Farmakokinetika se odnosi na procese apsorpcije, raspodjele, metabolizma i izlučivanja lijeka. Postoje značajne varijacije u farmakokinetici s obzirom na dob.
Apsorpcija
Na apsorpciju iz probavnog sustava utječe
-
lučenje želučane kiseline
-
stvaranje žučnih soli
-
vrijeme pražnjenja želuca
-
pokretljivost crijeva
-
duljina crijeva i učinkovita apsorpcijska površina
-
mikrobiološka flora
-
Bolesti
Svi ti čimbenici variraju s dobi (1).
Smanjeno izlučivanje želučane kiseline povećava biološku dostupnost lijekova koji su osjetljivi u kiselom okolišu (npr. penicilin), a smanjuje biološku dostupnost slabo kiselih lijekova (npr. fenobarbital).
Smanjeno stvaranje žučnih soli smanjuje biološku dostupnost lipofilnih lijekova (npr. diazepama).
Usporeno pražnjenje želuca i pokretljivost crijeva produljuju vrijeme potrebno za postizanje terapijskih koncentracija kad se lijekovi enteralnim putem primjenjuju kod djece < 3 mjeseca. Još jedan od uzroka smanjene apsorpcije lijekova su enzimi koji metaboliziraju lijekove u crijevima dojenčadi. Dojenčad s prirođenom atrezijom crijeva ili kirurškim putem odstranjenim dijelom crijeva, ili ona s cijevi za hranjenjem u jejunumu mogu imati specifične poremećaje apsorpcije, ovisno o duljini odstranjenog crijeva ili položaju odstranjenog/premoštenog dijela. Također treba razmotriti kako vrsta konzumirane hrane može utjecati na pražnjenje želuca.
Promjene u crijevnoj flori koje pomažu metabolizmu također mogu utjecati na apsorpciju u crijevima.
Apsorpcija ubrizganih lijekova je često neizvjesna zbog
-
varijabilnosti u njihovim kemijskim svojstvima
-
razlike u apsorpciji s obzirom na mjesto primjene (intramuskularno ili subkutano)
-
razlike u mišićnoj masi među djecom
-
bolest (npr. ugrožen cirkulatorni status)
-
varijabilnost u dubini uboda injekcije (preduboko ili preplitko)
U djece se općenito izbjegavaju intramuskularne injekcije zbog boli i mogućnosti oštećenja tkiva, ali kad postoji potreba za njihovom primjenom, najbolji su u vodi topljivi lijekovi jer ne precipitiraju na mjestu injekcije.
Transdermalna apsorpcija u novorođenčadi i u ranom dojenačkom razdoblju može biti pojačana jer je orožnjeli sloj kože tanak, i jer je omjer površine tijela i tjelesne težine puno veći nego u starije djece i odraslih. Kožne promjene (npr. ogrebotine, ekcemi, opekline) pojačavaju apsorpciju u djece bilo koje dobi.
Transrektalna primjena lijeka obično je prikladna samo za hitne slučajeve kad IV pristup nije dostupan (npr. rektalna primjena diazepama kod epileptičkog statusa). Samo mjesto postavljanja lijeka u stražnje crijevo može utjecati na apsorpciju zbog razlike u spletu vena i mjestu njihove drenaže. Mlađa dojenčad mogu izbaciti lijek i prije neke značajnije apsorpcije.
Apsorpcija inhaliranih lijekova iz pluća (npr. β–agonista kod astme, plućnog surfaktanta kod hijalinomembranske bolesti) može varirati s obzirom na fiziološke parametre, a više s obzirom na pouzdanost aparata kojim se primjenjuju i samu tehniku primjene od strane bolesnika ili osobe koja se za njega brine.
Referenca apsorpcije
-
1. van den Anker J, Reed MD, Allegaert K, Kearns GL: Developmental changes in pharmacokinetics and pharmacodynamics. J Clin Pharmacol 58 (supplement 10):S10–S25, 2018. doi: 10.1002/jcph.1284
Raspodjela
Volumen raspodjele lijeka mijenja se kod djece sa životnom dobi. Ovakve, o dobi ovisne promjene, posljedica su razlike u tjelesnom sastavu (osobito u vanstaničnom prostoru i ukupnom volumenu vode u organizmu) i vezivanju bjelančevina u plazmi.
Veće doze (po kilogramu tjelesne mase) vodotopljivih lijekova su preporućene u mlađe djece jer je veći postotak udjela vode u njihovom tijelu. ( link ). Nasuprot tome, kako dijete raste, smanjuje se postotak udjela vode u odnosu na tjelesnu težinu te su potrebne manje doze da bi se izbjegla toksičnost. Dodatno, djeca s pretilošću pokazalo se da imaju značajno veći postotak ukupne tjelesne vode, tjelesnog volumena, nemasne tjelesne mase i masne mase u usporedbi s djecom bez pretilosti (1).
Promjene u omjeru sastavnica tijela za vrijeme rasta i razvoja.
|
Adapted from Puig M: Body composition and growth. In Nutrition in Pediatrics, ed. 2, edited by WA Walker and JB Watkins. Hamilton, Ontario, BC Decker, 1996.
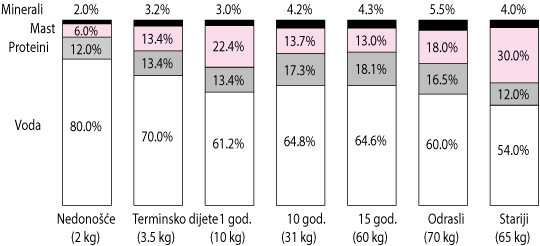 |
Mnogi se lijekovi vežu za bjelančevine (prvenstveno albumine, alfa 1 kisele glikoproteine i lipoproteine); vezivanje za bjelančevine ograničava raspodjelu slobodnog lijeka u cijelom tijelu. Koncentracije albumina i ukupnih bjelančevina su niže u novorođenčadi, ali od 10 do12 mjeseca približavaju se vrijednostima u odraslih. Smanjeno vezivanje za bjelančevine u novorođenčadi također je uzrokovano kvalitativnim razlikama u vezujućim bjelančevinama i kompetitivnom povezivanju molekula poput bilirubina i slobodnih masnih kiselina, koje u novorođenčadi i dojenčadi cirkuliraju u većim koncentracijama. Konačni ishod može biti povećana koncentracija slobodnog lijeka, veća dostupnost lijeka na receptorskim mjestima te postizanje farmakološkog učinka i veća učestalost neželjenih reakcija uz niže koncentracije lijeka.
Referenca distribucije
-
1. Vaughns JD, Conklin LS, Long Y, et al: Obesity and pediatric drug development. J Clin Pharmacol 58(5):650–661, 2018. doi: 10.1002/jcph.1054
Metabolizam i izlučivanje
Metabolizam i izlučivanje lijeka se razlikuju s obzirom na životnu dob i ovise o tvari ili lijeku, ali većina lijekova, a najbolji primjer su fenitoin, barbiturati, analgetici i kardioglikozidi, u novorođenčadi imaju 2 do 3 puta dulji poluživot nego u odraslih osoba.
Sustav enzima citokroma P–450 (CYP450) u tankom crijevu i jetri je najvažniji poznati sustav za metaboliziranje lijekova. Sustav enzima CYP450 inaktivira lijekove putem
-
oksidacije, redukcije i hidrolize ( I faza metabolizma)
-
hidroksilacije i konjugacije (II faza metabolizma)
Kod novorođenčadi faza I metabolizma je usporena, progresivno se ubrzava prvih 6 mjeseci života, za neke lijekove tijekom prvih nekoliko godina prelazi razine kod odraslih, a usporava se tijekom adolescencije te obično poprima razine kao kod odraslih do kasnog puberteta. Međutim, za neke lijekove se 2 do 4 tjedna nakon rođenja mogu doseći stope metabolizma odraslih (npr. barbiturati, fenitoin). Aktivnost CYP450 se također može potaknuti (što smanjuje koncentracije i učinak lijekova) ili inhibirati (povećavajući koncentracije i učinak) istodobnom primjenom nekih lijekova. Te interakcije lijekova mogu dovesti do toksičnosti lijeka kad je CYP450 aktivnost inhibirana ili premalene razine lijeka kad je inducirana CYP450 aktivnost. Prehrana također može utjecati na razvoj aktivnosti CYP450 u djece (1). Ulogu u metabolizmu nekih lijekova također imaju bubrezi, pluća i koža, kao i enzimi za metabolizam u crijevima novorođenčadi.
Druga faza metabolizam ponajprije ovisi o samoj tvari. Sazrijevanje enzima odgovornih za konjugaciju bilirubina i acetaminofena je produžena; enzimi odgovorni za konjugaciju morfija su potpuno sazrili već kod nedonoščadi.
Metaboliti lijekova izlučuju se ponajprije putem žuči ili bubrega. Bubrežna eliminacija ovisi o
Svi ovi čimbenici se mijenjaju tijekom prve 2 godine života. U vrijeme rođenja protok plazme kroz bubrege je mali (12 ml/minuti) i doseže razine kod odraslih od 140 ml/minuti do kraja 1. godine života. Slično tome, glomerularna filtracija u vrijeme rođenja iznosi 2 do 4 ml/minuti, za 2 do 3 dana se povećava na 8 do 20 ml/minuti i doseže razine kod odraslih od 120 ml/minuti s 3 do 5 mjeseci.
Metabolizam i izlučivanje reference
-
1. Blake JB, Abdel-Rahman SM, Pearce RE, et al: Effect of diet on the development of drug metabolism by cytochrome P-450 enzymes in healthy infants. Pediatr Res 60(6):717–723, 2006. doi: 10.1203/01.pdr.0000245909.74166.00
Doziranje lijeka
Zbog gore navedenih čimbenika, doziranje lijeka u djece <12 godina je često s obzirom na dob, tjelesnu težinu ili oboje. Ovakav je pristup praktičan, ali nije idealan. Čak i unutar populacije slične po dobi i težini, potrebe za lijekom mogu biti različite zbog razlika u metabolizmu i izlučivanju kao posljedice nejednake zrelosti samog organizma. Dakle, ako je moguće, doze lijeka bi se trebale prilagođavati koncentraciji lijeka u plazmi (međutim, koncentracija lijeka u plazmi možda ne odražava i koncentraciju lijeka u ciljnom organu). Na žalost, kod većine lijekova to nije moguće. Studije su napravaljene kao rezultat državnog zakonodavstva (Zakon o najboljim farmaceutskim proizvodima za djecu iz 2001 i Zakona o jednakosti pedijatrijskih istraživanja iz 2003, oba su vrijedeća od 2012—1; vidi također the U.S. Food and Drug Administration [FDA] status report) od sredine 2020 osigurane pedijatrijske informacije za 854 lijeka koja prethodno nisu imale kompletno označene informacije uključujući dozu, farmakokinetiku, a i sigurnosnu informaciju za korištenje kod djece.
Fiziološki utemeljeno farmakokinetičko modeliranje je matematička tehnika koja koristi poznate principe biokemije i fiziologije za predviđanje kako će se lijek apsorbirati, distribuirati, metabolizirati i izlučiti. Rezultati ovog modeliranja mogu pomoći u donošenju odluka o tome treba li, kada i kako provesti kliničko ispitivanje te mogu pomoći u poboljšanju sigurnosti i učinkovitosti pedijatrijskih kliničkih ispitivanja.
Literatura za doziranje lijekova
-
1. Connor EM, Smoyer WE, Davis JM, et al: Meeting the demand for pediatric clinical trials. Sci Transl Med 6 (227): 227fs11, 2014. doi: 10.1126/scitranslmed.3008043
Više informacija
Sljedeći je resurs na engleskom jeziku koji bi mogao biti koristan. Imajte na umu da THE MANUAL nije odgovoran za sadržaj ovog izvora.