Sindrom hipoplastičnog lijevog srca se sastoji od hipoplazije lijeve klijetke i uzlazne aorte, poremećenog razvoja aortalnih i mitralnih zalistaka (česta je atrezija aortne valvule), atrijskog septalnog defekta i prohodnog arterijskog duktusa. Ukoliko se normalno zatvaranje arterijskog duktusa ne spriječi infuzijom prostaglandina, dolazi do kardiogenog šoka i smrti. Obično se čuje glasni, jednostruki S2 i nespecifični sistolički šum. Dijagnoza se postavlja ultrazvukom srca. Konačno liječenje je kirurška korekcija u više faza ili presađivanje srca.
(Vidi također Pregled kongenitalne kardiovaskularne anomalije.)
Sindrom hipoplasičnog lijevog srca čini 2-4% prirođenih srčanih grešaka i druga je po učestalosti obstruktivna lezija lijeve strane srca. Budući su mitralna valvula, lijevi ventrikul i aortna valvula hipoplastični (česta je i aortna atrezija) oksigenirana krv dolazi u lijevi atrij i od tamo dio nje preko ovalnog otvora dolazi u desnu stranu srca, tamo se miješa s desaturiranom venskom krvi (pogledaj sliku Hipoplastično lijevo srce). Ova relativno desaturirana krv iz desne klijetke prolazi kroz plućnu arteriju u pluća, i od tamo arterijskim duktusom u sistemsku cirkulaciju. Sustavna protok krvi održava samo kroz desnu ulijevo duktalni shunt; tako neposredan opstanak ovisi o prohodnosti u duktusa arteriosus.
Sindrom hipoplastičnog lijevog srca
|
Lijeva klijetka, uzlazna aorta, i aortni i mitralni zalisci su hipoplastični; defekt atrijskog septuma i prohodan arterijski duktus su također prisutni.
AO = aorta; IVC = donja šuplja vena; LA =lijevi atrij; LV = lijeva klijetka; PA = plućna arterija; PDA = otvoren arterijski duktus; PV = plućna vena; RA = desni atrij; RV = desna klijetka; SVC = gornja šuplja vena.
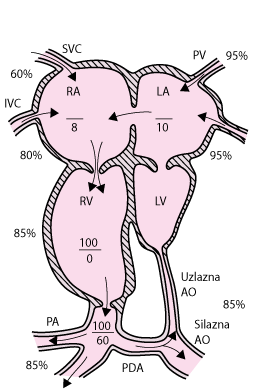
|
Simptomi i znakovi
Simptomi se pojavljuju kad se arterijski duktus počinje zatvarati, tijekom prvih 24 do 48 sati života. Kao posljedica, brzo se razvijaju simptomi kardiogenog šoka (tahipneja, dispneja, oslabljeni puls, bljedilo, cijanoza, hipotermija, metabolička acidoza, letargija, oligurija ili anurija). Kad je sistemska cirkulacija oslabljena, protok kroz moždane i koronarne arterije se smanjuje, dovodeći do simptoma ishemije mozga ili miokarda. Nedovolja je perfuzija bubrega, jetre i mezenterija, i česti su oligurija ili anurija. Ako se arterijski duktus ne otvori, ubrzo dolazi do smrti.
Pacijent se često prezentira s poteškoćama u hranjenju, otežanim disanjem, blijedom ili sivom bojom kože i letargijom. Fizikalni pregled pokazuje hiperaktivan prekordijem i odizanjem s lijeve strane prsne kosti, vrlo lošu perifernu prokrvljenost, hladne okrajine, plavo-sivu boje kože, i odsutne ili jedva opipljive pulseve. Drugi srčani ton (S2) je glasan i jednostruk. Nježni, nespecifični sistolički šum je često prisutan, kao i hepatomegalija. Teška metabolička acidoza je tipično prisutna i često se pogoršava primjenom kisika što je karakteristično za sindrom hipoplastičnog lijevog srca.
Dijagnoza
-
Rentgenska slika i EKG
-
Ultrazvuk srca
Sumnja na dijagnoza sindroma hipoplastičnog lijevog srca se postavlja na temelju kliničke slike, osobito u novorođenčadi s metaboličkom acidozom koja se pogoršava nakon primjene kisika; kisik smanjuje plućni vaskularni otpor i na taj način povećava udio krvi koji iz desne klijetke odlazi u pluća umjesto da kroz duktus ode u donje dijelove tijela. Dijagnoza se potvrđuje hitnim ultrazvukom srca.
Kateterizacija srca je rijetko indicirana za postavljanje dijagnoze.
Rendgenska slika pokazuje kardiomegaliju i kongestiju plućnih vena ili edem pluća. EKG pokazuje hipertrofiju desne klijetke i niske otklone u lijevim odvodima,premda to može biti i u granicama normale za novorođenčku dob.
Liječenje
-
Infuzija prostaglandina E1 (PGE1)
-
Kirurška korekcija u fazama
-
Ponekad transplantacija srca
Srećom, većina bolesnika sa sindromom hipoplastičnog lijevog srca se otkrije prenatalnim ultrazvukom ili fetalnim ultrazvukom srca, što omogućava primjenu prostaglandina E1 i druge odgovarajuće terapije odmah nakon rođenja, a prije nastanka hipoperfuzije organa.
Medikamentozno liječenje
Sva djeca sa sindromom hipoplastičnog lijevog srca trebala bi biti odmah stabilizirana u neonatalnoj intenzivnoj jedinici ili pedijatrijskoj kardiološkoj intenzivnoj njezi. Vaskularne pristup treba uspostaviti brzo postavljanjem umbilikalnog katetera i/ili perifernog venskog puta, ovisno što je brže. Daje se infuzija PGE1 (u početnoj dozi 0,05 do 0,1 mcg / kg / min IV) kako bi se spriječilo zatvaranje arterijskog duktusa ili otvorio kontrahirani duktus. Novorođenče, posebno ono koje je kritično loše kod prezentacije, potrebno je trahealno intubirati i mehanički ventilirati. Metabolička acidoza se korigira infuzijom natrijevog bikarbonata. Teško bolesnoj novorođenčadi u kardiogenom šoku su potrebni inotropni lijekovi (npr milrinon) i diuretici kako bi se poboljšao rad srca.
Od životne je važnosti održati plućnu vaskularnu rezistenciju visokom i sistemsku vaskularnu rezistenciju niskom kako bi se spriječila velika plućna recirkulacija na račun sistemske cirkulacije. Ovaj odnos plućne i sistemske rezistencije održava se izbjegavanjem hiperoksije, alkaloze i hipokapnije, a kojih svi mogu uzrokovati plućne vazodilataciju. Budući je kisik jedan od najmoćnijih plućnih vazodilatatora, djeca se ventiliraju sobnim zrakom ili čak smjesom kisika i CO2 kako bi se održala saturacija hemoglobina kisikom između 70 i 80%. Ukoliko je dijete mehanički ventilirano Pco2 se održava u rasponu između visoko normalnog ili lagano povišenog. Sistemska vaskularna rezistencija se održava izbjegavanjem ili minimalnom uporabom vazokonstriktivnih lijekova (npr adrenalin ili visoke doze dopamina). Milrinon može biti koristan jer dovodi do sistemske vazodilatacije.
Savjeti i zamke
-
Održavajte plućnu vaskularni rezistenciju relativno visoko i sistemsku rezistenciju krvnih žila nisko kako bi se izbjeglo povećanje plućne cirkulacije na račun sistemske perfuzije.
-
U tu svrhu izbjegavajte hiperoksiju, alkalozu i hiperkapniju (koji uzrokuju plućnu vazodilataciju) i minimizirajte uporabu vazokonstriktora.
|
Kirurško liječenje
Za preživljavanje je konačno potrebno kirurško liječenje sa slijedom operacija kojima se desna klijetka osposobljava da djeluje poput sistemske klijetke i da se osigura oksigenacija krvi u plućima.
Faza 1, napravi se tijekom prvog tjedna života, naziva se Norwood procedura. Stablo plućne arterije se odvoji od desne klijetke, distalni dio se zatvara zakrpom, a od proksimalnog dijela se s hipoplastičnom aortom formira neoaorta. Arterijski duktus se podveže. Protok krvi kroz pluća se ponovno uspostavlja umetanjem desnostranog modificiranog Blalock-Taussig spoja ili umetanjem provodnika između desne klijetke i plućne arterije (Sano modifikacija). Interatrijska komunikacija se proširi.
Alternativni hibridni postupak, zahtijeva združeni rad kardijalnog kirurga i intervencijskih kardiologa, a uključuje umetanje stenta u arterijski duktus (za održavanje sistemskog krvotoka) i podvezivanja (banding) obje grane plućne arterije (radi smanjenja plućnog protoka). U nekim centrima, hibridni postupak je rezerviran za visoko rizične pacijente (npr nedonoščad i one s multiorganskim zatajenjem).
Faza 2, radi se između 3 i 6 mjeseci starosti, sastoji se od postavljanja dvosmjernog Glenn_ili hemi-Fontan_a Ovi postupci spajaju gornju šuplju venu s desnom plućnom arterijom, što omogućuje krvi da zaobiđe desnu pretklijetku i ulijeva se izravno u pluća kako bi se oksigenirala. Za razliku od dvosmjernog Glenna, hemi-Fontan procedura ne odvaja potpuno gornju šuplju venu od desnog atrija.
Treća faza, radi se od 18 do 36 mjeseci života, je modificirana Fontanova procedura kojom se donja šuplja vena odvaja od desnog atrija i putem provodnika spaja u konfluens s gornjom šupljom venom i plućnom arterijom. Provodnik može biti intrakardijalno u obliku pregrade u atriju ili ekstrakardijalno u obliku tubularnog umetka.
Rizik od smrti za djecu sa sindromom hipoplastičnog lijevog srca je najviši u prvoj godini života (1). Oko 90% bolesnika koji prežive dojenačku dob doživjet će dob od 18 godina. Kao i kod druge djece sa složenim prirođenim srčanim greškama srca, preživjela djeca mogu imati neki stupanj neurorazvojnog poremećaja, što može biti posljedica već postojeće razvojne anomalije SŽS_a ili vidljive ili prikrivena hipoperfuzije SŽS_a ili tromboembolije nastale za vrijeme bilo koje faze kirurškog liječenja.
U neke dojenčadi sa sindromom hipoplastičnog lijevog srca koja imaju teži oblik disfunkcije trikuspidne valvule ili lijeve klijetke transplantacija srca je nužna metoda liječenja; međutim, PGE1 infuzija se mora nastaviti uz pažljivo održavanje idealnog plućnog i sistemskog vaskularnog otpora dok se ne nađe donator srca. Zbog vrlo ograničene dostupnosti donatora srca, oko 20% djece umre čekajući transplantaciju. Petogodišnje preživljavanje nakon transplantacije srca i nakon korekcije greške u više akata je slično. Nakon transplantacije srca potrebna je primjena imunosupresiva. Ovi lijekovi čine bolesnike osjetljivijima na infekcije i izazivaju patološke promjene na koronarnim arterijama presađenog srca u značajnom postotku tijekom petogodišnjeg razdoblja. Jedino poznato liječenje koronarne bolesti alogeničnog presatka je ponovno presađivanje.
Profilaksa endokarditisa
se preporuča tijekom najmanje 6 mjeseci nakon svake operacije i dokle god je pacijent cijanotičan ili ima ostatne defekte uz zakrpe ili ima ugrađen umjetni materijal.
Literatura
-
1. Siffel C, Riehle-Colarusso T, Oster ME, et al: Preživljavanje djece sa sindromom hipoplastičnog lijevog srca. Pediatrics 136 (4): e864-e870, 2015.
Ključne točke
-
Sindrom hipoplastičnog lijevog srca se sastoji od hipoplazije lijeve klijetke i uzlazne aorte, poremećenog razvoja aortalnih i mitralnih zalistaka; atrijski septalni defekt i prohodan arterijski duktus su neophodni za održavanja sistemne cirkulacije i preživljenje.
-
Simptomi kardiogenog šoka (npr tahipneja, dispneja, oslabljen puls, bljedilo, cijanoza, hipotermija, metabolička acidoza, letargija, oligurija ili anurija) se pojave kada se arterijski duktus počne zatvarati tijekom prvih 24 do 48 sati života, i postaju sve izraženiji okoliko se primjeni oksigenoterapija.
-
U početku se primjenjuje infuzija PGE1 kako bi se zadržao prohodan arterijski duktus, dati što je moguće manje kisika (kako bi se izbjeglo povećanje plućnog protoka na štetu sistemne cirkulacije), izbjegavati vazokonstriktore; dati natrij bikarbonat prema potrebi.
-
Za konačnu korekciju je potreban kirurški zahvat u više faza.