BOLESTI ŽLIJEZDA S UNUTRAŠNJIM IZLUČIVANJEM
Bolesti hipotalamusa
Bolesti adenohipofize
Bolesti neurohipofize
Bolesti štitne žlijezde
Bolesti doštitnih žlijezda
Bolesti kore nadbubrežnih žlijezda
Bolesti srži nadbubrežnih žlijezda
Multipli poremećaji žlijezda s unutrašnjim izlučivanjem
Uvod. Hipotalamus predstavlja središte neuroendokrine regulacije. Hipofiza kontrolira i upravlja radom ostalih žlijezda s unutrašnjim izlučivanjem. U ovome dijelu bit će opisane osnove fiziologije hipotalamusa, uzroci bolesti hipotalamusa te kliničke manifestacije bolesti hipotalamusa.
Fiziologija hipotalamičkih hormona. Hipotalamus putem hipofize utječe na rad svih ostalih žlijezda s unutrašnjim izlučivanjem. Funkcionalno i anatomski pripada međumozgu te spaja endokrini i živčani sustav. Skuplja i obrađuje informacije koje dolaze u središnji živčani sustav iz tijela te potiče ili koči rad hipofize, tj. lučenje hipofiznih hormona. Hipotalamus luči dvije vrste hormona kojima regulira lučenje hormona hipofize: hormoni oslobađanja (potiču lučenje hipofiznih hormona) i hormoni inhibiranja (koče lučenje hipofiznih hormona). Stvoreni hormoni se luče u tzv. portalni vaskularni sustav kojim se ostvaruje komunikacija između hipotalamusa i hipofize te djeluju na ciljne stanice adenohipofize. Hormoni hipotalamusa su hormon koji oslobađa tireotoropin, hormon koji oslobađa gonadotropin, hormon koji oslobađa kortikotropin, hormon koji oslobađa hormon rasta, hormon koji oslobađa prolaktin te hormon koji inhibira prolaktin (prikazano u Tablici 7.1.).
|
Tablica 7.1. Učinak hormona hipotalamusa
|
|
Oznaka
|
Engleski naziv
|
Hrvatski naziv
|
Djelovanje
|
|
TRH
|
Thyrotropin-releasing hormone
|
Hormon koji oslobađa tireotropin
|
Potiče lučenje TSH* i PRL*
|
|
GnRH
|
Gonadotropin- releasing hormone
|
Hormon koji oslobađa gonadotropin
|
Potiče lučenje LH* i FSH*
|
|
CRH
|
Corticotropin- releasing hormone
|
Hormon koji oslobađa kortikotropin
|
Potiče lučenje ACTH* i β-endorfina
|
|
GHRH
|
Growth hormone-releasing hormone
|
Hormon koji oslobađa hormon rasta
|
Potiče lučenje GH*
|
|
GHIH
|
Growth hormone-inhibiting hormone
|
Somatostatin
|
Inhibira lučenje GH*
|
|
PIF
|
Prolactin inhibitory factor
|
Faktor koji inhibira prolaktin
|
Inhibira lučenje PRL*
Glavni PIF u organizmu je dopamin
|
|
PRF
|
Prolactin releasing factor
|
Faktor koji oslobađa prolaktin
|
Potiče lučenje PRL
Glavni PRF u organizmu je VIP*
|
*TSH - tireotropni hormon, PRL - prolaktin, LH - luteinizacijski hormon, FSH - folikulostimulirajući hormon, ACTH - adrenokortikotropni hormon, GH - hormon rasta, VIP - vazoaktivni intestinalni peptid)
Definicija. Različite sistemske i lokalizirane bolesti središnjega živčanog sustava mogu zahvatiti i hipotalamus. Posljedično tomu dolazi do poremećaja neuroendokrine regulacije, pa se bolesti hipotalamusa, uz simptome i znakove osnovne bolesti, primarno očituju specifičnim endokrinološkim poremećajima. Endokrinološki poremećaji nastali uslijed poremećaja rada i funkcije hipotalamusa nazivaju se tercijarnim endokrinološkim poremećajima.
Etiopatogeneza. Poremećaji hipotalamusa mogu se naći u različitim bolestima i stanjima: 1) kongenitalni poremećaji (septooptička displazija, Riegerov sindrom, Kallmanov sindrom), 2) tumori (adenomi hipofize, kraniofaringeom, Rathkeova cista, hamartom, disgerminom), 3) upalne i infiltrativne bolesti (infekcije središnjega živčanog sustava, sarkoidoza, histiocitoza), 4) vaskularni poremećaji (inzult, aneurizma), 5) traumatske lezije, 6) zračenje te 7) kirurški zahvati.
Patofiziologija. Poremećaji hipotalamusa mogu dovesti do hiperfunkcije ili hipofunkcije hipofize s posljedičnim učinkom na druge žlijezde s unutrašnjim izlučivanjem što se manifestira specifičnim endokrinološkim poremećajem. Osim promjena u radu sustava žlijezda s unutrašnjim izlučivanjem, poremećaji hipotalamusa mogu biti povezani i s drugim neurometaboličkim poremećajima.
Neuroendokrina disfunkcija. Posljedično poremećaju rada hipofize kao posljedica mogu se razviti različiti endokrinološki poremećaji, a najčešći su hipotalamički nanizam, hipotalamički hipogonodizam, hipotalamička hiperprolaktinemija, hipotalamička hipotireoza, hipotalamička insuficijencija adrenokorteksa te centralni dijabetes insipidus.
Hipotalamički nanizam naziv je za stanje u kojemu nalazimo smanjeno lučenje GHRH-a, odnosno hormona koji oslobađa hormon rasta (GH), zbog čega kod djece dolazi do nastanka patuljastoga rasta (nanizam), dok se kod odraslih obično razvija klinička slika koja je posljedica smanjenja koštane i mišićne mase. Gubitak normalnoga lučenja hormona rasta jedna je od najčešćih posljedica strukturnih poremećaja hipotalamusa, a kod više od polovine djece s dokazanim manjkom hormona rasta nalazimo normalan odgovor na primjenu egzogenoga GHRH-a što ukazuje na poremećaj na razini hipotalamusa. Gen za GHRH još nije identificiran, ali je poznat gen za njegov receptor, iako mali postotak ovih bolesnika ima mutacije toga gena. Na izlučivanje GHRH-a utječu i psihološko stanje i prilike uslijed određenih poremećaja neurotransmitera.
Hipotalamički hipogonadizam nastaje kao posljedica smanjenoga stvaranja GnRH-a (hormon koji oslobađa gonadotropin) zbog čega se smanjuje lučenje FSH-a i LH-a s posljedičnim hipogonadizmom. Kod djece se taj poremećaj očituje zakašnjelim pubertetom, dok se kod odraslih osoba razvija klinička slika gubitka funkcije gonada (poremećaj dlakavosti, poremećaji menstruacijskoga ciklusa, erektilna disfunkcija, gubitak mišićne mase i dr.). Glavna klinička i diferencijalno-dijagnostička karakteristika ovoga poremećaja je oporavak kliničkih i laboratorijskih nalaza nakon egzogene primjene GnRH-a.
Hipotalamička hiperprolaktinemija nastaje kao posljedica smanjenoga stvaranja dopamina u hipotalamusu koji djeluje kao inhibitor lučenja prolaktina (PIF). Uslijed njegova manjka dolazi do prekomjernoga lučenja prolaktina i nastanka hiperprolaktinemije.
Hipotalamička hipotireoza posljedica je smanjenoga stvaranja TRH-a u hipotalamusu (hormon koji oslobađa tireotropin) zbog čega izostaje lučenje tireotropina iz adenohipofize, što dovodi do smanjenoga stvaranja hormona štitne žlijezde i kliničke slike hipotireoze.
Hipotalamička insuficijencija adrenokorteksa posljedica je smanjenoga stvaranja CRH-a u hipotalamusu (hormon koji oslobađa kortikotropin), zbog čega izostaje stvaranje kortikotropina iz adenohipofize i posljedično je smanjeno stvaranje hormona nadbubrežne žlijezde.
Dijabetes inspidus nastaje uslijed destrukcije supraoptičkih i paraventrikularnih jezgara hipotalamusa zbog čega dolazi do smanjenoga stvaranja antidiuretskoga hormona i kliničke slike u kojoj dominiraju iznimna poliurija i polidispija.
Neurometabolička disfunkcija. Osim poremećaja u radu žlijezda s unutrašnjim izlučivanjem, bolesti hipotalamusa mogu dovesti i do određenih metaboličkih poremećaja, a najčešći su hipotalamička pretilost, hipotalamička anoreksija te poremećaji tjelesne temperature.
Hipotalamička pretilost nastaje uslijed lezija mediobazalnoga dijela hipotalamusa, odnosno noradrenergičkih vlakana koja potječu iz paraventrikularnih jezgara, zbog čega dolazi do hiperfagije i debljanja.
Hipotalamička anoreksija nastaje uslijed lezija lateralnoga dijela hipotalamusa, odnosno nigrostrijatalnih dopaminergičkih niti koje prolaze tom regijom, a posljedica toga je hipofagija te mršavljenje.
Poremećaji termoregulacije nastaju uslijed lezije prednjega dijela hipotalamusa i preoptičke regije koje sadržavaju neurone osjetljive na toplinu koji odgovaraju na promjene unutrašnje temperature. Poremećaji se očituju nastankom hipo- ili hipertermije.
Klinička slika, dijagnostika i liječenje svakoga od navedenih poremećaja hipotalamusa opisano je u odgovarajućim dijelovima udžbenika.
Hipofiza se sastoji od dva režnja: prednjega (adenohipofiza) i stražnjega režnja (neurohipofiza). Adenohipofiza čini oko 75 % žlijezde. Građena je od kortikotropnih, somatotropnih, laktotropnih, tireotropnih i gonadotropnih stanica koje luče sljedeće hormone: kortikotropin, hormon rasta, prolaktin, tireotropin te gonadotropine.
Kortikotropin (ACTH) nastaje u kortikotropnim stanicama adenohipofize. Njegovo je lučenje regulirano na tri razine: negativna povratna sprega putem kortizola, središnji živčani sustav putem hipotalamusa i negativna povratna sprega putem samoga ACTH-a. Djeluje na stanice kore nadbubrežne žlijezde vezanjem na specifične receptore. Glavni učinak mu je poticanje lučenja glukokortikoida, mineralokortikoida te androgena.
Hormon rasta (HR) luče somatotropne stanice hipofize. Lučenje HR-a uvjetovano je dvama hipotalamičnim hormonima i dvama sustavima povratne sprege. Somatokrinin koji potiče oslobađanje i somatostatin koji inhibira lučenje HR-a. Različiti čimbenici utječu na oslobađanje tih hormona (neurogeni i metabolički). Dva su sustava povratne sprege koji kontroliraju lučenje HR-a: kratka zatvorena petlja (između hipofize i hipotalamusa) te duga zatvorena petlja (putem somatomedina C, a obuhvaća vezu hipotalamus-hipofiza-IGF-1). Povećana koncentracija HR-a ili IGF-1 koči sekreciju HR-a na razini hipotalamusa potičući oslobađanje somatostatina. Učinak HR-a vidi se na dva polja: 1) rast i 2) metabolizam. HR potiče rast svih tkiva u organizmu povećanjem njihove mase i broja stanica, a nužan je i za rast skeleta u visinu što se odigrava na epifiznim pločama indirektnim utjecajem preko IGF-1 (faktor sličan inzulinu). Djelovanje na metabolizam očituje se kroz povećanu sintezu proteina, mobilizaciju masnih kiselina iz masnoga tkiva te štednju ugljikohidrata (smanjeno iskorištavanje glukoze).
Prolaktin (PRL) luče laktotropne stanice hipofize. Zbog djelovanja estrogena, kocentracije ovoga hormona veće su kod žena nego kod muškaraca. Regulacija lučenja ostvaruje se putem hipotalamičkih čimbenika: PIF (faktor inhibiranja prolaktina) i PRF (faktor oslobađanja prolaktina). Hipotalamus u regulaciji lučenja PRL-a djeluje uglavnom inhibitorno, za razliku od drugih hormona, te kod lezija hipotalamusa uglavnom dolazi do smanjenja lučenja svih hormona hipofize, osim PRL-a čija se sekrecija pojačava. Regulacija lučenja ostvaruje se i putem kratke petlje negativne povratne sprege (hipofiza – hipotalamus). PRL utječe na laktaciju (odgovoran je za početak i održavanje laktacije) te reprodukciju (povećana koncentracija PRL-a koči funkciju spolnih žlijezda).
Tireotropin (TSH) izlučuju tireotropne stanice hipofize. Glavni regulatori njegove sekrecije su mehanizam povratne sprege hormonima štitne žlijezde te hipotalamička kontrola (TRH povećava lučenje, a somatostatin inhibira). Učinak ostvaruje vezanjem za specifične receptore na tireocitima što pokreće enzim adenil-ciklazu i potiče lučenje već stvorenih hormona štitne žlijezde (trijodtironin i tiroksin).
Gonadotropini obuhvaćaju dva hormona: FSH (folikulostimulirajući hormon) i LH (luteinizacijski hormon) koji stvaraju gonadotropne stanice adenohipofize. Lučenje gonadotropina je pulsno i pod utjecajem je GnRH-a iz hipotalamusa, ali je i pod regulacijom negativne povratne sprege putem spolnih hormona. Osim toga, na lučenje djeluje i hormon inhibin kojega luče Sertolijeve stanice u testisu (sudjeluje u proturegulaciji lučenja FSH-a kod muškaraca), a stvara se i u ovarijima, ali nema poznatoga fiziološkog učinka. FSH potiče rast folikula u ovariju, rast testisa i spermatogenezu dok LH utječe na ovulaciju, korpus luteum, stimulaciju Leydigovih stanica te steroidogenezu u ovarijima i testisima.
HIPOPITUITARIZAM
Definicija i podjela. Hipopituitarizam je naziv za stanje smanjene ili potpuno izostale sekrecije hormona adenohipofize. On nastaje kao posljedica destrukcije stanica normalne hipofize ili uslijed poremećaja same sinteze hormona što je obično posljedica genetskih defekata. Prema mjestu nastanka razlikujemo primarni hipopituitarizam (bolesti i poremećaji hipofize) te sekundarni hipopituitarizam (bolesti i poremećaji hipotalamusa). Prema deficitu hormona razlikujemo totalni hipopituitarizam (panhipopituitarizam) pri kojemu nalazimo deficit svih hormona adenohipofize, parcijalni hipopituitarizam karakteriziran deficitom dva ili više hormona te izolirani hipopituitarizam kod kojega se bilježi deficit samo jednoga hormona. Ovisno o brzini razvoja razlikujemo akutni i kronični hipopituitarizam. Općenito gledano, radi se o rijetkom endokrinom stanju.
Etiopatogeneza. Primarni hipopituitarizam nastaje kao posljedica bolesti i poremećaja same adenohipofize, a sekundarni kao posljedica bolesti i poremećaja hipotalamusa (gore opisano). Smanjeno stvaranje i lučenje hormona može biti povezano s destrukcijom samih stanica adenohipofize, što je obično stečeno stanje, ili s poremećajem sinteze hormona, što je obično genetski uvjetovano, pa govorimo o kongenitalnom hipopituitarizmu.
Kongenitalni hipopituitarizam posljedica je mutacije jednoga ili više gena koji sudjeluju u procesu sinteze i otpuštanja hormona adenohipofize. Može se pojaviti kao izoliran poremećaj (kongenitalni izolirani hipogonadotropni hipogonadizam) ili u sklopu različitih sindroma (Prader Willi sindrom, Kallmanov sindrom, sindrom septooptičke displazije). Ovi se poremećaji očituju već u djetinjstvu ili pubertetu te se opisuju u sklopu pedijatrije.
Stečeni hipopituitarizam može biti posljedica različitih bolesti i stanja: 1) traumatske ozljede (kirurška resekcija, iradijacijsko oštećenje, traume glave); 2) tumorski procesi (nefunkcionalni adenomi hipofize, Rathkeova cista, kraniofarigeom, meningeom, metastaze u hipofizi, limfomska ili leukemijska infiltracija, ostali paraselarni tumori); 3) infiltrativni procesi (limfocitni hipofizitis, hemokromatoza, sarkoidoza, histiocitoza Langerhansovih stanica); 4) vaskularni poremećaji (apopleksija hipofize, Sheehanov sindrom, anemija srpastih stanica, arteritis) te 5) infekcije (histoplazmoza, toksoplazmoza, tuberkuloza, Pneumocystis carinii infekcije).
U kliničkoj su praksi najčešći uzrok kliničkoga panhipopituitarizma nefunkcionalni adenom hipofize te tumori u području talamusa i sele turcike koji svojim rastom vrše kompresiju i destrukciju normalnih stanica adenohipofize. U nastavku teksta bit će opisani i neki posebni oblici panhipopituitarizma (apopleksija hipofize, Sheehanov postpartalni sindrom, limfocitni hipofizitis, sidrom prazne sele).
Klinička slika ovisi o tome radi li se o akutnom ili kroničnom hipopituitarizmu. Javljaju se dvije vrste simptoma: simptomi osnovne bolesti i simptomi deficita hormona. Simptomi osnovne bolesti ovise o samoj osnovnoj bolesti: kod tumorske etiologije javljaju se glavobolje, povraćanje, ispadi vida, neurološki ispadi i slično, kod upalne etiologije mogu se naći febrilna stanja te drugi opći i specifični znakovi infektivnoga stanja. Simptomi deficita hormona ovise o zahvaćenosti pojedinih stanica adenohipofize. Najčešće se razvija klinička slika panhipopituitarizma, rjeđe parcijalnoga ili izoliranog hipopituitarizma.
Deficijencija somatotropina (hormona rasta). Kongenitalni deficit hormona rasta očituje se hipoglikemijama u ranom djetinjstvu te usporenim rastom, što se naziva pituitarni nanizam. Stečeni deficit ovoga hormona čest je kod odraslih, a somatotropne stanice posebno su osjetljive na zračenje, kompresiju i traumu te se često u kliničkom tijeku prvo razvije deficit hormona rasta, a tek kasnije i deficit drugih hormona. Deficijencija hormona rasta prisutna je u više od 96 % slučajeva kada nalazimo i deficijenciju druga dva ili više hormona adenohipofize. Simptomi i znakovi variraju u svojoj izraženosti, a uključuju smanjenu toleranciju fizičkoga napora, brzo zamaranje, smanjenu sposobnost koncentracije te česte depresivne epizode, centralni tip pretilosti uz redukciju koštane i mišićne mase. Umjerena deficijencija hormona rasta često je fiziološki prisutna kod starijih muškaraca te pretilih osoba.
Deficijencija gonadotropina (LH, FSH) dovodi do razvoja hipogonadotropnoga hipogonadizma. Kongenitalni deficit očituje se u djetinjstvu, a karakterizira ga djelomičan ili potpun izostanak razvoja puberteta i sekundarnih spolnih osobina. Stečeni deficit gonadotropina očituje se gubitkom dlakavosti kod oba spola (kosa, brada, aksilarne i pubične dlake). Kod muškaraca se pojavljuju smanjen libido, erektilna disfunkcija, mišićna atrofija, hipogonadizam, infertilitet te osteopenija, dok se kod žena razvijaju oligomenoreja ili amenoreja, infertilitet, mišićna atrofija, atrofija sekundarnih spolnih osobina te osteoporoza.
Deficijencija tireotropina (TSH) dovodi do razvoja sekundarne hipotireoze s njezinim klasičnim očitovanjima s time da su simptomi obično blaže izraženi (umor, malaksalost, debljanje, depresija, konstipacija, hipotenzija). Primjena kemoterapeutika mitotana i beksarotena mogu dovesti do prolazne supresije lučenja TSH-a.
Deficijencija adrenokortikotropina (ACTH) dovodi do razvoja sekundarne adrenalne insuficijencije koja se očituje slabošću, malaksalošću, anoreksijom, mučninom i povraćanjem te povremenim hipoglikemijama. Za razliku od primarne adrenalne insuficijencije, ovaj oblik rijetko je udružen sa znacima deficijencije mineralokortikoida te hiperpigmentacijom. Dugo je očuvano lučenje ACTH-a, pa se ovi simptomi često javljaju u prilikama povećanih potreba za glukokortikoidima kao što su infekcija, stres ili kirurški zahvat.
Deficijencija prolaktina (PRL) očituje se kod žena u poslijeporođajnom periodu, a uključuje poremećaj laktacije (smanjena ili izostala).
Dijagnoza se postavlja na osnovi anamneze i kliničkoga nalaza, laboratorijske endokrinološke obrade (potvrda endokrinološkoga deficita) te slikovnih metoda kojima tražimo uzrok (najčešće magnetska rezonancija).
Laboratorijska dijagnostika deficijencije somatotropina (GH). Pulsno lučenje hormona rasta otežava laboratorijsku dijagnostiku s obzirom na to da su vrijednosti ovoga hormona kroz većinu dana nemjerljivo niske. Iako hormon rasta stimulira proizvodnju IGF-1, njegove vrijednosti u serumu nisu dovoljno niti specifične niti osjetljive za dijagnostiku deficijencije hormona rasta. Niske vrijednosti IGF-1 su indikativne za deficit hormona rasta, ali se mogu naći i u stanjima malnutricije, hipotireoze, loše regulirane šećerne bolesti, jetrenoga zatajenja, kao i uzimanja oralnih estrogena. Za potvrdu deficijencije hormona rasta koristi se stimulacijski test. On se provodi kod bolesnika sa sniženim vrijednostima IGF-1, kod bolesnika koji imaju deficijenciju drugih hormona adenohipofize te kod bolesnika koji imaju kliničke simptome koji ukazuju na deficit somatotropina uz pozitivnu anamnezu (tumori hipofize i okolne regije, trauma glave, operacije mozga, zračenje kranijuma, upale mozga i slično). Stimulacijski test podrazumijeva izazivanje hipoglikemije (tzv. hipoglikemijski test) inzulinom (češće) ili glukagonom (rjeđe) te mjerenjem koncentracije hormona rasta nakon toga. Nakon sniženja glikemije na oko 2,2 mmol/L kod više od 90 % zdravih osoba dolazi do porasta lučenja hormona rasta s vršnim makisimumom iznad 5 ug/L. Osobe prije testiranja moraju biti 8 do 10 sati natašte. Za izazivanje hipoglikemije danas se najčešće koristi inzulin (inzulinski test) u dozi od 0,15 jedinica kratkodjelujućega inzulina po kilogramu tjelesne mase te se tijekom dva do tri sata mjere vrijednosti hormona rasta i glukoze. Ako koncentracija hormona rasta ne prelazi 5,1 ug/L, potvrđuje se manjak hormona rasta. Primjena glukagona u svrhu izazivanja hipoglikemije za izvođenje ovoga testa danas se rjeđe primjenjuje (1,0 mg intramuskularno, tj. 1,5 mg ako su osobe teže od 90 kg).
Laboratorijska dijagnostika deficijencije gonadotropina. Hipogonadotropni hipogonadizam obilježen je sniženim vrijednostima spolnih hormona (testosteron kod muškaraca, estradiol kod žena) uz snižene ili uredne vrijednosti gonadotropina (LH, FSH). S obzirom na pulsatilno lučenje gonadotropina, preporuča se višekratno uzorkovanje i mjerenje koncentracije hormona. Stimulacijski GnRH test (ili LH-RH test) temelji se na intravenskoj primjeni 100 µg sintetskoga GnRH-a (gonadorelin) te očekivanom porastu lučenja LH-a i FSH-a. Mjerenje LH-a i FSH-a vrši se u 0., 30. i 60. minuti, a da bi test bio pozitivan, vrijednosti LH-a moraju porasti minimalno dvostruko u odnosu na početne, odnosno FSH za 50 % i više. Normalan gonadotropinski odgovor (pozitivan test) ukazuje na urednu funkciju adenohipofize i ukazuje na poremećaj na razini hipotalamusa. Ako izostane gonadotropinski odgovor (negativan test) pri ovom testu, ostaje nejasno radi li se o poremećaju na razini adenohipofize ili hipotalamusa.
Laboratorijska dijagnostika deficita tireotropina (TSH). Bolesnici sa sekundarnom hipotireozom imaju snižene vrijednosti tiroksina (FT4) i trijodtironina (FT3) uz snižene vrijednosti TSH-a. Ipak, postoje slučajevi u kojima je TSH urednih vrijednosti, iako je to rjeđe. Niske vrijednosti FT3 i FT4 uz visoke vrijednosti TSH-a ukazuju na primarnu hipotireozu. Stimulacijski test s hormonom koji oslobađa tireotropin (TRH) rijetko se provodi. Podrazumijeva intravensku primjenu TRH-a nakon čega se očekuje porast TSH-a. Kao i kod GnRH testa, uredan odgovor, tj. očekivani porast TSH-a, ukazuje na poremećaj na razini hipotalamusa.
Laboratorijska dijagnostika deficita adrenokortikotropina (ACTH). Klasičan laboratorijski nalaz koji ukazuje na sekundarnu adrenokortikalnu insuficijenciju je niska bazalna koncentracija kortizola u serumu (< 138 nmol/L) ili neodgovarajući porast kortizola u ACTH testu (ili rjeđe, hipoglikemijskim testom) uz nisku ili nisku normalnu koncentraciju ACTH-a u serumu. ACTH test predstavlja stimulacijski test u kojemu se primjenjuje sintetski ACTH (tetrakozaktid) s ciljem izazivanja lučenja kortizola. U dugom ACTH testu primjenjuje se 250 µg tetrakozaktida intravenski s mjerenjem kortizola u 0., 30. i 60. minuti, dok se u kratkom ACTH testu primjenjuje 1 µg s mjerenjem koritizola u 0., 20. i 30. minuti. Vrijednosti kortizola iznad 550 nmol/L u bilo kojem mjerenju isključuju adrenalnu insuficijenciju. U hipoglikemijskom testu najčešće koristimo kratkodjelujući inzulin (0,15 j/kg intravenski), a kao referentna vrijednost očekivanoga porasta kortizola također se uzima 550 nmol/L.
Slikovne metode. U obradi ovih bolesnika gotovo je uvijek potrebno napraviti magnetsku rezonanciju hipotalamusa i hipofize. MRI je posebno koristan u dijagnostici tumorskih tvorbi hipofize i hipotalamusa. On također može pokazati zadebljanje hipofiznoga drška koje može biti uzrokovano različitom patologijom povezanom s hipopituitarizmom (infiltrativne lezije, upale i sl.).
Diferencijalna dijagnoza. Reverzibilni hipogonadotropni hipogonadizam može se pojaviti uslijed težih i ozbiljnih oboljenja, malnutricije, anoreksije i morbidne pretilosti. Muškarci obično razvijaju djelomičan sekundarni hipogonadizam sa starenjem. Teški hipogonadotropni hipogonadizam može se razviti i kod muškaraca koji primaju GnRH analoge (leuprolide) zbog karcinoma prostate. Također, hipogonadotropni hipogonadizam može se razviti kod osoba koje uzimaju visoke doze oralnoga metadona. Sekundarna adrenalna insuficijencija javlja se i u sklopu primjene visokih doza kortikosteroida i može perzistirati do nekoliko mjeseci od prekida terapije. Supresiju TSH-a mogu uzrokovati teška oboljenja, hipertiroksemija te primjena trijodtironina ili beksarotena. Deficijencija hormona rasta javlja se fiziološki sa starenjem te kod pretilih osoba.
Liječenje. Osnovni cilj liječenja je ukloniti uzrok, a potom se ide, ako je potrebno, na supstitucijsku terapiju, ovisno o kliničkim manifestacijama i deficitu hormona.
Supstitucija kortikosteroida. Supstitucija glukokortikoida poboljšava većinu simptoma nastalih uslijed deficijencije ACTH-a, a supstitucija mineralokortikoida rijetko je potrebna. Preferira se peroralna primjena hidrokortizona, a potrebna dnevna doza iznosi od 15 do 35 mg/dan, podijeljeno obično u dvije doze (10 - 20 mg ujutro i 5 - 15 mg u kasno popodne). Osobama s bazalnim vrijednostima kortizola iznad 220 nmol/L (8 mg/dL) daju se manje doze i to oko 2 x 5 mg/dan. Nižim dozama pokušavaju se izbjeći kušingoidne nuspojave. Od ostalih lijekova mogu se davati prednizon (3 - 7,5 mg/dan) te metilprednizolon (4 - 6 mg/dan). Pri optimizaciji nadomjesne doze može pomoći praćenje broja leukocita i diferencijalne krvne slike te vrijednosti natrija, kalija, glukoze i krvnoga tlaka. Relativna neutrofilija i limfopenija mogu ukazivati na prekomjernu supstituciju i obrnuto. U stanjima stresa, kada su i inače povećane potrebe za ovim hormonima (infekcije, traume, kirurški zahvati), potrebno je pojačati supstituirajuću dozu (udvostručenje ili utrostručenje doze). Kod traume ili većih kirurških zahvata hidrokortizon se može davati svakih šest sati u dozi od 50 mg pareteralno (intravenski ili intramuskularno) i postupno snižavati kako se bolesnik oporavlja.
Supstitucija tireoidnih hormona. Nadoknada tireoidnih hormona provodi se tek nakon što se isključi potreba za nadoknadom kortikosteroida ili je njihova nadoknada već započela. Lijek izbora u supstituciji ovih hormona je levotiroksin. Potrebna supstitucijska doza levotiroksina široko varira (25 - 300 µg/dan) te se mora klinički i laboratorijski pratiti. Pratimo vrijednosti fT4 i eventualno TSH-a te se sukladno vrijednostima fT4 vrši promjena doze levotiroksina.
Supstitucija gonadotropina. Nadoknada testosterona kod muškaraca neophodna je da bi se postigao i održao normalan rast i razvoj, da bi se razvile sekundarne spolne osobine te da bi se očuvali androgeni anabolički efekti (mišićna i koštana masa). Testosteron se može primjenjivati u obliku intramuskularnih injekcija svakih 1 - 4 tjedna (npr. testosteron undekanoat 200 mg svaka dva tjedna ili 300 mg svaka tri tjedna, a danas postoje i depo preparati). Može se primjenjivati i u obliku dermalnih naljepaka (androderm 2 - 4 mg/dan) ili gela (androgel 50 mg). Kod muškaraca sa znacima infertiliteta (oligospermija) primjenjuje se humani korionski gonadotropin – hCG (ekvivalent LH) u dozi od 2000 do 3000 jedinica intramuskularno tri puta tjedno uz prekid primjene testosterona (uz prilagodbu doze vrijednostima testosterona). Ako se spermiogram ne poboljša za 6 do 12 mjeseci, može se nastaviti s injekcijama hCG-a uz dodatak beta filotropina (sintetski rekombinantni FSH). Terapija hCG-om bolje se podnosi od terapije testosteronom, ali je skuplja. Kod žena u premenopauzi preporuča se cikličko nadomjesno liječenje estrogenom i progesteronom s ciljem očuvanja sekundarnih spolnih osobina, normalne funkcije genitalnoga trakta te prevencije osteoporoze. Terapija gonadotropinima indicira se za indukciju ovulacije (FSH, hCG), a indikacija se može postići i primjenom klomifena.
Supstitucija somatotropina (hormona rasta). Nadomjesno liječenje hormonom rasta indicirano je kod odraslih simptomatskih osoba. Ono se vrši supkutanom primjenom rekombinantnoga humanog hormona rasta (rhGH), počinje se s dozom od 0,2 mg (ili 0,6 i.j.) tri puta tjedno te se doza povećava svaka 2 do 4 tjedna za 0,1 mg (ili 0,3 i.j.) sve dok se ne pojave nuspojave ili se normalizira vrijednost IGF-1 u serumu. Ako se željene učinke supstitucije (poboljšanje energije, povećanje mišićne mase, smanjenje visceralnoga adipoziteta) ne postigne kroz 3 do 6 mjeseci pri maksimalnoj dozi, rhGH terapija se prekida. Nuspojave uključuju periferne edeme, artralgije, mijalgije, sindrom karpalnoga kanala, ginekomastiju, hipotenziju, apneju u spavanju, glavobolju te pseudotumor cerebri. Visoke doze nekada mogu uzrokovati akromegaliju. Smanjenjem doze lijeka vrlo se brzo povlače i navedene nuspojave. Serumske vrijednosti IGF-1 treba održavati u referentnim vrijednostima. Primjenu rhGH-a treba prekinuti za vrijeme težih bolesti i stanja, s obzirom na to da visoke doze gnRH-a povećavaju smrtnost bolesnika u jedinicama intenzivnoga liječenja.
Prognoza. Prognoza primarno ovisi o uzročnoj bolesti. Većina bolesnika dobro podnosi nadomjesno liječenje ako se ono redovito prati i kontrolira. Također, u visokom se postotku ispravnim liječenjem vraća fertilnost i muškarcima i ženama s hipogonadotropnim hipogonadizmom.
POSEBNI OBLICI HIPOPITUITARIZMA
Apopleksija hipofize označava pojavu akutnoga intrapituitarnog krvarenja koje dovodi do oštećenja tkiva same pituitarne žlijezde i okolnoga tkiva. Apopleksija hipofize najčešće nastaje spontano kod bolesnika s adenomom hipofize. Predisponirajući faktori su trauma glave, hipertenzija, šećerna bolest, antikoagulantna terapija, anemija srpastih stanica te šok. Klinički, apopleksija hipofize očituje se naglom i teškom glavoboljom, poremećajem svijesti, poremećajima vida, oftalmoplegijom, vrlo brzo se razvijaju hipoglikemija i hipotenzija te bolesnici vrlo brzo umiru u slici kardiocirkulatornoga šoka ako se s liječenjem ne počne na vrijeme. Dijagnoza se potvrđuje na osnovi CT ili MR nalaza hipofize. Liječenje uključuje hitan neurokirurški zahvat, primjenu visokih doza glukokortikoida te primjenu ostalih potpornih mjera. Kod ovih se bolesnika kasnije razvija slika panhipopituitarizma.
Postpartalna nekroza hipofize (Sy Sheehan) je ishemijska nekroza hipofize koja se javlja kao posljedica prolongiranih i teških poroda praćenih oblinim intrauterinim krvarenjima. Krvarenje dovodi do hemoragijskoga šoka, a on do spazma arterola te tromboze, opstrukcije i nekroze hipofize koja je i onako krajem trudnoće masivnija i osjetljivija. Moguća podloga bolesti je i diseminirana intravaskularna koagulopatija (DIK). Često je prvi znak oslabljena ili odsutna laktacija. Menstruacijski ciklus se ne uspostavlja, bolesnice se žale na umor i malaksalost, moguća je i pojava hipotenzije, bradikardije, umora, malaksalosti, bezvoljnosti i sl. Dijagnoza se postavlja na osnovi anamnestičkih podataka, kliničkoga nalaza, laboratorijskih nalaza (niske vrijednosti hormona hipofize), a potvrđuje se testovima stimulacije. Liječenje obuhvaća suzbijanje šoka u toku poroda (infuzije, transfuzije, kisik, kortikosteroidi) te supstitucijsku terapiju ako se razvije ovaj sindrom.
Limfocitni hipofizitis je autoimuni poremećaj koji se obično javlja tijekom trudnoće i rano postpartalno. Karakteriziran je infiltracijom hipofize limfocitima, makrofagima i plazma stanicama. U 25 % slučajeva nalazimo i druga autoimuna oboljenja, najčešće sistemski eritematozni lupus. Ovo stanje često se opisuje nakon kemoterapije ipilimumabom. Bolesnici se prezentiraju glavoboljom, ispadima vida te simptomima hipopituitarizma (najčešće deficijencija ACTH-a). Poremećaj može biti prolazan ili trajan. U dijagnostičkom postupku nalazimo ubrzanu sedimentaciju eritrocita, a na MR hipofize promjene se prikazuju kao homogena selarna masa slična adenomu, pa ih je teško razlikovati. Na ovo treba posumjati ponajprije kod žena iza poroda s novodijagnosticiranom tumorskom masom u području hipofize. Liječenje uključuje primjenu glukokortikoida, a nekada i drugih imunosupresiva kroz nekoliko mjeseci. Kod nekih bolesnika bilježi se regresija tumorske mase i simptoma, a kod nekih zaostaje hipopituitarizam koji zahtijeva odgovarajuću supstitucijsku terapiju.
Sindrom prazne sele (engl. empty sella) često se slučajno otkrije tijekom MR snimanja mozga, a označava stanje u kojemu normalno tkivo hipofize nedostaje u svojem anatomskom ležištu (sella turcica) s intraselarnom hernijacijom likvora. Sindrom prazne sele može biti udružen s intrakranijskom hipertenzijom, ali se češće javlja idiopatski. Većina bolesnika je bez simptoma i funkcija hipofize je u potpunosti očuvana. Rjeđe se razvijaju znakovi hipopituitarizma.
TUMORI ADENOHIPOFIZE I SINDROMI HIPERPITUITARIZMA
Tumori hipofize čine 10 - 15 % svih intrakranijskih tumora. Oni mogu biti primarni i sekundarni (metastaze) te dobroćudni i zloćudni. Prema lučenju hormona, tj. biološkoj aktivnosti, dijele se na nefunkcionalne i funkcionalne, a obzirom na lokalizaciju mogu biti selarni i paraselarni. U kliničkoj su praksi najčešći tumori hipofize adenomi hipofize koje prema veličini svrstavamo u dvije skupine: mikroadenomi (< 10 mm) i makroadenomi (> 10 mm).
Etiologija nastanka primarnih tumora hipofize ostaje nejasna. To su tumori koji potječu od stanica adenohipofize, a točan mehanizam njihove tumorske transformacije još uvijek se istražuje. Postoji više teorija, a najčešće se spominju teorija hormonskoga poticanja (prekomjerna stimulacija lučenja hormona ili gubitak inhibicije lučenja hormona adenohipofize) te genska teorija (mutacije i poremećaji onkogena te tumor-supresorskih gena).
U daljnjem tekstu bit će opisan klinički pristup bolesniku s tumorom hipofizne regije, nefukcionalni tumori hipofize, funkcionalni tumori hipofize s njihovim najčešćim sindromima te osnovno o drugim, češćim tumorima hipofizne regije.
KLINIČKI PRISTUP BOLESNIKU S TUMOROM HIPOFIZNE REGIJE
Klinička slika. Kliničke manifestacije tumora hipofizne regije ovise o samoj lokalizaciji tumora, njegovoj veličini i invaziji i dekompresiji okolnih struktura. Glavobolja je najstalniji simptom tumora ove regije, čak i kada nisu veliki i ne pokazuju znakove supraselarne ekspanzije. Bol nastaje uslijed rastezanja tvrde moždane ovojnice. Težina glavobolje slabo korelira s veličinom i proširenošću tumorske mase. Ostali simptomi su posljedica daljnjega rasta i širenja tumorske mase: 1) supraselarno širenje tumora uzrokuje slabljenje vida pritiskom ili inavzijom optičke hijazme; 2) kompresija na pituitarni držak dovodi do pritiska na krvne žile i gubitak komunikacije između hipofize i hipotalamusa zbog čega se najprije razvija hiperprolaktinemija (smanji dotok dopamina), a kasnije i deficijencije drugih hormona adenohipofize (smanjen dotok hipotalamičkih hormona oslobađanja); 3) lateralni rast tumora može dovesti do invazije kavernoznoga sinusa i kompresije na njegove strukture (III., IV. i VI. moždani živac) pa se može javiti oftalmoplegija, ptoza vjeđa, diplopije, smanjen osjet iz područja kože lica; 4) rast tumora prema dolje uvjetuje invaziju kroz dno sele i ulazak u sfenoidni sinus rijetko kroz krov tvrdoga nepca uzrokujući infekcije, sekreciju likvora te nazofaringealnu opstrukciju.
Dijagnoza. Postavljanje dijagnoze temelji se na anamnestičkim podacima, kliničkom nalazu, slikovnim metodama, oftalamološkoj obradi te laboratorijskoj i patohistološkoj dijagnostici.
Magnetska rezonancija je glavna slikovna metoda u prikazu tumora ove regije. MRI prikaz hipofizne regije prije i poslije intravenske primjene gadolinija (kontrastno sredstvo) omogućuje precizan prikaz hipofize, hipotalamusa, hipofiznoga drška, okolnih selarnih struktura (kavernozni sinusi, sfenoidni sinus, optička hijazma).
Oftalmološka obrada. Kod svih bolesnika s tumorom ove regije treba učiniti potpun oftalmološki pregled zbog mogućih komplikacija vezanih uz pritisak i/ili invaziju optičke hijazme što može rezultirati poremećajima vida (bitemporalna hemianopija, homonimna hemianopsija, diplopija) te naposljetku gubitkom vida.
Laboratorijska obrada. Kod bolesnika s tumorom adenohipofize koji je potvrđen magnetskom rezonancijom hormonska obrada ovisi o veličini tumora i kliničkoj slici, a uključuje: 1) prolaktin (PRL); 2) inzulinu sličan hormon rasta (IGF-1); 3) ACTH, kortizol, slobodni kortizol u 24-satnom uzorku urina (UFC), prekonoćni supresijski test deksametazonom i ACTH test; 4) folikulostimulirajući hormon (FSH) i luteinzacijski hormon (LH), estradiol i testosteron te 5) TSH, FT3, FT4.
Liječenje. Ciljevi liječenja tumora adenohipofize i okolne regije su rješavanje lokalnoga učinka tumora na okolne strukture, kao i rješavanje endokrinoga problema koji može proizlaziti iz hipersekrecije hormona uslijed biološke prirode funkcionalnih tumora. Na raspolaganju su kirurško liječenje, radioterapija te medikamentno liječenje.
Kirurško liječenje je temelj liječenja. Preferira se kirurško uklanjanje tumora transsfenoidnalnim pristupom mikroendoskopskom tehnikom. To je najpoštedniji zahvat kojime se izbjegava oštećenje zdravih intrakranijalnih struktura. Na raspolaganju je više operativnih opcija: enukleacija tumora, hipofizektomija ili hemihipofizektomija, ovisno o patologiji. Za velike tumore s izraženom invazijom okolnih struktura operacija se vrši transkranijalno.
Radioterapija se može primjenivati kao primarna terapija za tumore hipofize i paraselarne regije, ili kao nadopuna kirurškom ili medikamentnom liječenju. Može se provoditi konvencionalnom radijacijskom metodom ili radiokirurškom metodom (engl. gamma-knife). Ovaj način liječenja udružen je s brojnim nuspojavama, kako akutnim (slabost, glavobolja, povraćanje), tako i kroničnim (simptomi hipopituitarizma, oštećenja okolnih moždanih živaca i sl).
NEFUNKCIONALNI TUMORI HIPOFIZE
Definicija. Nefunkcionalni tumori adenohipofize uključuju tumore adenohipofize koji ne luče hormone ili ih luče u količinama koje ne dovode do pojave karakterističnih, prepoznatljivih kliničkih očitovanja. Oni su među najčešćim tumorima adenohipofize (25 - 30 %).
Etiologija. Uzrok nastanka ovih tumora nije poznat. Imunohistokemijska istraživanja pokazuju da većina nefunkcionalnih tumora adenohipofize potječe od gonadotropnih stanica, stoga ti tumori proizvode male količine intaktnih gonadotropina (obično FSH) te njihovih slobodnih alfa i beta podjedinica. Posljedično se u serumu takvih bolesnika mogu naći povišene vrijednosti alfa i beta FSH podjedinica te rjeđe, beta LH podjedinica, ali uglavnom bez utjecaja na kliničku sliku.
Klinička slika. Bolest je dugo asimptomatska, a nekada se dijagnoza postavi kao slučajan nalaz tijekom magnetne rezonance koja se izvodi zbog neke druge indikacije (incidentalom). Simptomi uglavnom potječu od rasta tumorske mase (glavobolja i ostali specifični simptomi ovisno o rastu tumora). Kod nekih bolesnika uslijed kompresije i destrukcije ostatnog tkiva adenohipofize dolazi do razvoja simptoma hipopituitarizma. Rijetko se kod žena mogu javiti poremećaji menstruacijskoga ciklusa i znaci hiperstimulacije jajnika kao posljedica pojačanoga lučenja intaktnih hormona LH-a i FSH-a, što je povezano s velikom tumorskom masom.
Dijagnoza se postavlja na osnovi anamneze, fizikalnoga nalaza, laboratorijske endokrinološke obrade, oftalmološkoga pregleda te neuroradioloških pretraga (CT, MRI). Inicijalna pretraga kod simptoma i znakova intrakranijskoga tumora je magnetna rezonanca. Ako ona pokaže sumnju na tumor adenohipofize, bez obzira na klničku sliku potrebno je učiniti laboratorijsku endokrinološku obradu.
Laboratorijska endokrinološka obrada. Kod 10 do 15 % bolesnika s ovim tumorom nalazimo povišene razine slobodnih alfa podjednica FSH-a i LH-a, rjeđe se radi i o povišenju vrijednosti intaktnih hormona FSH-a i LH-a u bazalnim uvjetima. Preporuča se TRH test: primjenom TRH-a (hormon hipotalamusa koji oslobađa tireotropin) pojačava se lučenja slobodne beta podjednice LH-a, što ne nalazimo kod zdravih pojedinaca. Obično kod takvih bolesnika nalazimo i hiperprolaktinemiju koja je posljedica kompresije tumora na hipofizni držak i smanjen dotok dopamina (gubitak inhibicije lučenja prolaktina). Hiperprolaktinemiju uslijed prolaktinoma i onu kod nefunkcionalnog tumora hipofize možemo razlikovati nakon primjene agonista dopamina (kod nefunkcionalnoga tumora ne dolazi do pada vrijednosti prolaktina).
Liječenje. Terapijski pristup ponajprije ovisi o kliničkim manifestacijama i veličini tumora. Male, asimptomatske tumore nije potrebno liječiti nego samo redovno neuroradiološki i neurooftalmološki pratiti (pregledi oftalmologa, MRI hipofize). Veće tumore, a osobito uz oftalmološke i neurološke simptome, u pravilu treba kirurški odstraniti. Sve operirane bolesnike potrebno je nastaviti pratiti, prvi MR hipofize potrebno je učiniti već šest mjeseci nakon operacije, a zatim nastaviti jednom godišnje. Nakon pet godina bilježi se ponovni recidiv tumora kod oko 15 % bolesnika. Poslijeoperativno zračenje, osobito ako se tumor u potpunosti nije mogao odstraniti, smanjuje stopu recidiva. Nefunkcionani tumori hipofize imaju loš odgovor na medikamentno liječenje (agonisti dopamina, somatostatinski analozi) pa se ne primjenjuju u kliničkoj praksi. Selektivni GnRH analozi (Nal-Glu GnRH) suprimiraju sekreciju FSH-a, ali ne utječu na veličinu tumorske mase pa se mogu koristiti kao simptomatska terapija u nekim slučajevima.
FUNKCIONALNI TUMORI HIPOFIZE
Definicija. Funkcionalni tumori hipofize su tumori hipofize koji imaju sposobnost lučenja hormona i dovode do simptoma hiperpituitarizma. U kliničkoj praksi najčešće se radi o adenomima hipofize, a primarni adenokarcinomi s ekstrakranijalnim metastazama javljaju se izuzetno rijetko.
Etiopatogeneza. Adenomi hipofize su benigni tumori koji nastaju od normalnih stanica hipofize koje imaju sposobnost lučenja određenih hormona: laktotropne stanice (PRL), somatotropne stanice (STH), kortikotropne stanice (ACTH), tireotropne stanice (TSH) te gonadotropne stanice (FSH, LH). Prema tome razlikujemo nekoliko osnovnih vrsta adenoma hipofize: laktotropni adenom, somatotropni adenom, kortikotropni adenom, tireotropni adenom, gonadotropni adenom te plurihormonalni adenom koji ima sposobnost lučenja dva ili više hormona hipofize. Tumore hipofize karakterizira autonomnost, tj. lučenje hormona je neovisno o fiziološkim mehanizmima negativne povratne sprege, a veličina sekrecije ne mora biti povezana s veličinom tumora, tako da nekada i mali adenomi mogu uzrokovati znatnu sekreciju hormona i dovesti do jasnih kliničkih manifestacija. Točan uzrok i mehanizam njihova nastanka nije jasan. U svojoj osnovi adenomi hipofize su monoklonalni (što znači da potiču od jedne vrste stanica) što implicira genetsku etiologiju (jedna ili više somatskih mutacija) koja je kod nekih oblika jasno i dokazana. Također, kod nekih bolesnika s velikim i invazivnim makroadenomima nađene su različite kromosomske aberacije i gubitak kromosomske heterozigotnosti što može ukazivati na postojanje potencijalnih tumor-supresorskih gena u tim kromosomskim regijama i njihovu povezanost s nastankom ovih tumora (njihov gubitak uslijed kromosomske aberacije). Danas se sve više govori i o mogućoj povezanosti faktora rasta s nastankom adenoma hipofize, a s obzirom na to da se u hipofizi u većim količinama nalaze bazični faktor rasta fibroblasta (bFGF) koji stimulira proliferaciju hipofiznih stanica te epitelni faktor rasta (EGF) koji stimulira i proliferaciju i hormonsku sintezu i sekreciju.
Klinički entiteti koje mogu proizvesti ovi tumori su akromegalija, hiperprolaktinemija, Cushingova bolest te Nelsonov sindrom. Osim tumora, ove sindromi hiperpituitarizma mogu imati i neke druge uzroke.
AKROMEGALIJA
Definicija. Akromegalija je kliničko stanje koje nastaje uslijed hipersekrecije hormona rasta (ili hipotalamičkoga faktora oslobađanja hormona rasta – GhRH) u odrasloj životnoj dobi, kojemu je glavno obilježje povećanje okrajina (šake, stopala, uši i sl.). Incidencija akromegalije je niska te se dijagnosticira 5 do 6 slučajeva na 100 000 stanovnika. Najčešći uzrok akromegalije je somatotropni adenom hipofize.
Etiologija. Akromegalija može nastati uslijed hipersekrecije hormona rasta (GH) ili uslijed hipersekrecije hipotalamičkoga faktora oslobađanja hormona rasta (GhRH). Hipersekrecija hormona rasta može biti posljedica pojačanoga lučenja iz hipofize (somatotropni adenom, plurihormonalni adenom) ili izvan nje (adenomi ektopičnoga tkiva hipofize u sfenoidnom sinusu ili parafaringealno, paraneoplastični sindrom – tumori gušterače, limfoproliferativne bolesti). Hipersekrecija faktora oslobađanja hormona rasta (GhRH) može biti centralna (hamartom hipotalamusa, gangliocitom hipotalamusa) ili periferna (karcinoid, mikrocelularni karcinom pluća, adenom nadbubrežne žlijezde, feokromocitom). U više od 98 % slučajeva akromegalija je posljedica pituitarne hipersekrecije hormona rasta, najčešće iz somatotropnoga adenoma, nešto rjeđe iz plurihormonalnih adenoma (najčešće miješanoga somatotropnoga i laktotropnog adenoma). Patološki gledano, razlikujemo dva tipa somatotropnoga adenoma koja se međusobno razlikuju: gusto granulirani kojega karakterizira spor rast i mala invazija te slabo granulirani kojega karakterizira brz rast i velika invazija.
Klinička slika. Kliničke manifestacije akromegalije posljedica su pojačanoga djelovanja hormona rasta na periferna tkiva, a ponajprije se očituje rastom vezivnoga i koštanog tkiva, a kasnije i razvojem visceromegalije. Početni simptomi su blagi i neupadljivi, a za postupno očitovanje potreban je duži niz godina, tako da se bolest nekada dijagnosticira za deset i više godina.
Rast i bujanje vezivnoga tkiva najprije zahvaća meka tkiva šaka i stopala što vodi njihovom povećanju pa su nekada i prvi znaci potreba za nošenjem obuće većega broja ili potreba za većim rukavicama. Dolazi do zadebljanja usana i mekih dijelova nosa, a koža lica postaje grubo naborana, osobito na čelu.
Rast i bujanje koštanoga tkiva zahvaća određene koštane strukture tako da dolazi do karakterističnoga povećanja supraorbitalnih koštanih lukova te protruzije mandibule s karakterističnim razmacima između donjih zuba. Uslijed apozicijskoga rasta kostiju mogu nastati teže koštano-zglobne promjene (artropatija).
Generalizirana visceromegalija javlja se u kasnijim fazama bolesti, a očituje se kao kardiomegalija (akromegalična bolest srca), makroglosija, hipertrofija grkljana (dubok i promukao glas) te uvećanje štitne žlijezde (struma). Akromegalična bolest srca uključuje povećanu sklonost razvoju koronarne bolesti, hiperteforije lijeve klijetke, dijastoličke disfunkcije srca te povećanu pojavnost aritmija. Kod gotovo svih bolesnika razvija se arterijska hipertenzija.
Ostala klinička očitovanja su hiperhidroza, pojačana sekrecija lojnica i masna koža, sindrom karpalnoga kanala, proksimalna mišićna slabost te acantosis nigricans. Oštećena tolerancija glukoze ili manifestna šećerna bolest razvija se kod 25 % bolesnika s akromegalijom s obzirom na to da hormon rasta ima suprotan učinak od inzulina. Također, akromegalija je udružena s povećanim rizikom od razvoja kolorektalnih polipa, kao i povećanom smrtnošću od kolorektalnih malignoma.
Dijagnoza se postavlja na temelju anamneze, kliničkoga nalaza, laboratorijske endokrinološke obrade te neuroradiološke dijagnostike.
Laboratorijska endokrinološka obrada uključuje određivanje koncentracije hormona rasta i/ili inzulinu sličnoga faktora rasta 1 (IGF-1) te procjenu supresije lučenja hormona rasta tijekom testa opterećenja glukozom.
Određivanje hormona rasta u jednom slučajnom uzorku nije korisno u dijagnostici akromegalije s obzirom na pulsatilno lučenje hormona rasta te velike razlike u lučenju tijekom dana, tako da se razina hormona rasta može pokazati normalnom i u slučaju izražene akromegalije. Određivanje razine IGF-1 korisnija je pretraga u dijagnostici akromegalije s obzirom na to da njegove vrijednosti dobro koreliraju sa srednjom vrijednošću 24-satne koncentracije hormona rasta. Treba imati na umu da povišene vrijedosti IGF-1 fiziološki nalazimo u adolescenciji, pubertetu, trudnoći i pretilosti.
Dijagnoza akromegalije potvrđuje se izostankom supresije lučenja hormona rasta nakon oralnoga opterećenja glukozom. Test se izvodi ujutro, natašte, a sastoji se od uzorkovanja krvi i mjerenja koncentracije hormona rasta prije davanja glukoze te uzorkovanja i mjerenja koncentracije hormona rasta 120 minuta nakon oralnoga davanja 75 g glukoze. Normalan odgovor podrazumijeva sniženje razine hormona rasta na ispod 0,4 µg/L.
Ostale laboratorijske abnormalnosti koje možemo naći su: hiperfosfatemija, hiperkalcijemija, abnormalni testovi toleracije glukoze te hiperprolaktinemija (istodobna hipersekrecija ili uslijed pritiska tumora na držak hipofize). Kod većih tumora treba razmotriti obradu u smislu hipopituitarizma s obzirom na mogućnost pritiska i destrukcije tkiva hipofize samim tumorom.
Neuroradiološka dijagnostika. Magnetna rezonanca (MRI) koja je superiornija u odnosu na kompjuteriziranu tomografiju (CT) pokazuje kod više od 90 % bolesnika s akromegalijom tumor hipofize koji je obično ograničen na selu i sfenoidni sinus, a rijetko se radi o ektopičnim tumorima u području oko sfenoidne kosti.
Liječenje akromegalije ponajprije je usmjereno na kontrolu sekrecije hormona rasta i njegovih kliničkih posljedica uz očuvanje funkcije hipofize u što većoj mjeri. Terapijske opcije podrazumijevaju kirurško liječenje, medikamentno liječenje te radioterapiju.
Kirurško liječenje. Trassfenoidalno mikroendoskopsko uklanjanje tumora hipofize je metoda izbora u liječenju akromegalije uzrokovane adeonomom hipofize. Ovim se postupkom kod većine bolesnika postiže remisija bolesti, kao i očuvanje funkcije ostatnoga tkiva hipofize. Komplikacije su rijetke i nađu se kod svega 10 % bolesnika, a najčešće su infekcija, hipopituitarizam i curenje cerebrospinalnoga likvora. Postoperativno se kod manjega broja bolesnika mogu razviti poremećaji tekućine i elektrolita. Dijabetes insipidus može se pojaviti u roku od dva dana nakon operacije, a obično je blage naravi, spontano prolazi i ne zahtijeva specifično liječenje. Hiponatrijemija se može očekivati u prva dva tjedna nakon operacije i razvije se kod 21 % bolesnika. Očituje se glavoboljom, mučninom, povraćanjem, slabošću i malaksalošću, a liječenje se sastoji od restrikcije unosa tekućine. Pojačanim unosom soli nakon operacije, kao i laboratorijskim praćenjem vrijednosti natrija, može se prevenirati ova komplikacija.
Medikamentozno liječenje rezervirano je za bolesnike koji imaju nepotpunu biokemijsku remisiju bolesti nakon operativnoga zahvata, a primjenjuju se lijekovi koji djeluju kao antagonisti hormona rasta: agonisti dopamina (kabergolin), analozi somatostatina (oktreotid, lanreotid) te antagonisti receptora hormona rasta (pegvisomant). Analozi somatostatina i agonisti dopaminskih receptora smanjuju stvaranje hormona rasta, a antagonisti receptora za hormon rasta (pegvisomant) sprečavaju učinak već stvorenoga hormona rasta.
Analozi somatostatina smanjuju sekreciju hormona rasta djelujući preko specifičnih somatostatinskih receptora izraženih na površini tumora (SSTR2, SSTR5). Analozi somatostatina se razlikuju od nativnoga somatostatina po svojoj građi, a time se postiže dulji poluživot u plazimi i posljedično jači učinak. Kod više od 60 % bolesnika ovim lijekovima se postiže supresija lučenja GH-a i normalizacija IGF-1. U kliničkoj praksi primjenjuju se oktreotid te lanreotid i to u obliku depo preparata koji osiguravaju duže otpuštanje lijeka. Oktreotid se daje intramuskularno u dozi od 20 - 40 mg jednom mjesečno, a lanreotid supkutano u dozi od 60 - 120 mg jednom mjesečno. Manje je vjerojatno da će bolesnici s vrijednostima GH-a višima od 20 ng/mL prije početka liječenja pozitivno odreagirati na ovu terapiju. Nuspojave se razvijaju kod 1/3 bolesnika, a povezane su s supresijom motiliteta i sekrecije u probavnom sustavu (nelagoda u trbuhu, proljevi, flatulencija, mučnina, povraćanje). Uslijed hipokontraktilnosti žučnoga mjehura može doći do koncentriranja sadržaja i formiranja kamenaca (kolelitijaza).
Agonisti dopaminskih receptora smanjuju sekreciju hormona rasta, a najčešće se primjenjuju kabergolin te bromokriptin. Za postizanje terapeutskih učinaka potrebne su visoke doze ovih lijekova. U praksi se daje prednost kabergolinu, a dokazano je da je učinkovitiji u liječenju tumora koji luče i GH i PRL, ali može biti učinkovit i kod tumora s povišenim GH-om i normalnim PRL-om. Početna doza kabergolina je 0,25 mg dva puta tjedno per os, a postupno se povisuje do maksimalno 1 g dva puta tjedno per os (doza se temelji na vrijednostima IGF-1). Kod trećine bolesnika ova terapija će dovesti do smanjenja tumora za oko 50 %. Glavne nuspojave su umor, mučnina, konstipacija, bolovi u trbuhu te vrtoglavica.
Antagonisti receptora hormona rasta sprečavaju učinak već stvorenoga hormona rasta. U kliničkoj praksi primjenjuje se pegvisomant, mutirani oblik GH-a koji blokira stvaranje IGF-1 u jetri. Ovaj lijek utječe samo na smanjenje posljedica pojačane sekrecije GH-a, ali ne utječe na veličinu, tj. smanjenje samoga tumora, stoga se za vrijeme terapije mora stalno pratiti veličina tumora (oftalmološki pregledi, MRI). Pegvisomat postiže povlačanje simptoma i normalizaciju IGF-1 kod više od 90 % bolesnika. Početna doza je 10 mg supkutano jednom na dan, a ovisno o vrijednosti IGF-1, doza se može povećavati do maksimalno 40 mg/dan (povećavajući za 5 do 10 mg svakih 4 - 6 tjedana). Kod maloga broja bolesnika pegvisomant može uzrokovati hepatitis (osobito kod osoba s Gilbertovim sindromom) te se pri terapiji moraju pratiti jetreni enzimi. Ostale nuspojave uključuju mučninu, simptome nalik gripi, hipertenziju te lipohipertrofiju na mjestu aplikacije. Kod istodobne promjene peroralnih antidijabetika potrebno je smanjiti njihovu dozu kako bi se izbjegle hipoglikemije. Kombinacija pegvisomanta sa somatostatinskim analozima pokazuje dobre učinke kod bolesnika koji ne reagiraju na monoterapiju.
Radioterapija je indicirana za bolesnike kod kojih se nije postigla kompletna remisija bolesti kirurškim putem ili kombinacijom kirurškoga i medikamentoznog pristupa. Stereotaksijska radiokirurgija preferira se u odnosu na konvencionalne radioterapije, s obzirom na to da se na taj način izbjegava zračenje ostalih moždanih struktura. Najbolje rezultate daje „gamma knife“ radiokirurški pristup, a normalizacija IGF-1 postiže se kod više od 80 % bolesnika. Svim bolesnicima preporuča se doživotno uzimanje niskih doza acetilsalicilne kiseline zbog povećanoga rizika od moždanoga udara malih krvih žila zračenoga područja. Kod 30 - 60 % bolesnika se razvije hipopituitarizam u razdoblju od pet godina stoga je potrebno redovno endokrinološki kontrolirati bolesnika i nakon završenoga liječenja.
Prognoza. Bolesnici s akromegalijom imaju povećan rizik od obolijevanja od kardiovaskularnih bolesti. Pravilnim liječenjem i kontrolom bolesti (slučajni nalaz GH-a ispod 1,0 ng/mL ili supresija GH-a glukozom na ispod 0,4 ng/mL) taj se rizik uvelike smanjuje. Kao posljedica liječenja može se razviti hipopituitarizam.
HIPERPROLAKTINEMIJA
Definicija. Hiperprolaktinemija označava stanje pojačane sinteze i lučenja prolaktina, a ubraja se među najčešće hipersekrecijske sindrome adenohipofize i kod muškaraca i kod žena. Najčešći uzrok je adenom (prolaktinom) i on dovodi do lučenja PRL-a i to u vrijednostima višim od 200 µg/L, no hiperprolaktinemiju mogu uzrokovati i mnogi drugi faktori (obično je onda vrijedost PRL-a manja od 200 mcg/L).
Etiologija. Hiperprolaktinemija može biti fiziološka i patološka. Fiziološka prolaktinemija podrazumijeva povišene serumske razine prolaktina koje su uvjetovane fiziološkim promjenama i mehanizmima. Patološka hiperprolaktinemija nastaje uslijed različitih bolesti i stanja koja dovode do povećane vrijednosti serumskoga prolaktina i nisu povezani s fiziološkim mehanizmima te zahtijevaju specifično liječenje.
Fiziološka hiperprolaktinemija javlja se tijekom trudnoće, dojenja, spavanja (vrijedosti prolaktina se normaliziraju nakon sat vremena od buđenja) te u stanjima stresa i pri stimulaciji prsnoga koša uslijed refleksnoga mehanizma (kirurški zahvat, herpes zoster, stimulacija bradavica).
Patološka hiperprolaktinemija može biti uzrokovana različitim bolestima i stanjima: a) pituitarna hipersekrecija (prolaktinom, akromegalija); b) oštećenje hipotalamusa i hipofiznoga drška (tumori i ciste, granulomi, limfocitni hipofizitis, zračenje, trauma); c) sistemske bolesti (kronična renalna insuficijencija, hipotireoidizam, ciroza jetre, epilepsija, sistemski eritematozni lupus te d) lijekovi (antagonisti dopaminskih receptora, inhibitori sinteze dopamina, opijati, starija generacija blokatora histaminskih-2 receptora, inhibitori ponovne pohrane serotonina, estrogeni, blokatori kalcijskih kanala).
Prolaktiom. Prolaktinomi su tumori adenohipofize građeni od laktotropnih stanica, a predstavljaju najčešće hipofizne sekretorne adenome. Oni su ujedno i najčešći uzrok hiperprolaktinemije. Obično se pojavljuju sporadično, iako se mogu pojavljivati i obiteljski u sklopu sindroma multiple endokrine neoplazije (MEN), tip 1 i tip 4. Uglavnom se radi o mikroadenomima (manji od 1 cm) koji su daleko češći kod žena (20:1). Prolaktinomi veći od 1 cm su rjeđi, a odnos žene:muškarci je 1:1. Gigantski makroadenomi (veći od 3 cm u promjeru) mogu dovesti do destrukcije okolnih struktura. Muškarci imaju tendenciju dijagnostike makroprolaktinoma višu od žena, a to se pripisuje slabijim očitovanjem simptoma hipogonadizma pa se bolest kasnije i dijagnosticira. Patohistološki, razlikujemo tri oblika prolaktinoma te ih prema količini sekretornih granula u citoplazmi dijelimo u tri skupine: gusto granulirani, rijetko granulirani te miješani prolaktinomi. Rijetko granulirani prolaktinomi luče veće količine prolaktina od gusto granuliranih, ali i bolje reagiraju na terapiju antagonistima dopamina..
Patogeneza. Najčešći uzrok patološke hiperprolaktinemije je pituitarna hipersekrecija uslijed prolaktinoma, rjeđe uslijed plurihormonalnoga adenoma (obično se onda radi o pojačanoj sekreciji prolaktina i somatotropnoga hormona). Drugi čest uzrok hiperprolaktinemije je oštećenje hipotalamusa i hipofiznoga drška, s obzirom na to da je ona povezana sa smanjenim stvaranjem i sekrecijom hipotalamičkoga dopamina. Hipotalamički dopamin djeluje kao inhibitor lučenja prolaktina, luči se u hipotalamusu i portalnom cirkulacijom kroz hipofizni dršak dospijeva do laktotropnih stanica adenohipofize te vezajući se na specifične receptore na membrani koči lučenje prolaktina. Prema tome, pri njegovome manjku dolazi do razvoja hiperprolaktinemije. Hipotireoza također može biti uzrok hiperprolaktinemije jer povišene vrijednosti TSH-a i TRH-a dovode i do pojačane stimulacije lučenja prolaktina. Kronična renalna insuficijencija dovodi do hiperprolaktinemije uslijed smanjenoga perifernog klirensa hormona.
Patofiziologija. Povišene vrijednosti prolaktina smanjuju osjetljivost gonada (ovariji, testisi) na gonadotropine pa se razvija hipogonadizam što se očituje smanjenim vrijednostima testosterona kod muškaraca, kao i estrogena progesterona kod žena. Zbog toga u kliničkoj slici osim manifestacija vezanih uz pojačanu aktivnost prolaktina imamo i manifestacije hipogonadizma.
Klinička slika. Kliničke manifestacije mogu biti posljedica hiperprolaktinemije (galaktoreja), hipogonadizma te lokalnoga rasta tumora ako se radi o makroprolaktinomima.
Glavne kliničke manifestacije kod žena su oligomenoreja ili amenoreja, galaktoreja te infertilitet. Oligomenoreja predstavlja oskudnu i neredovitu mjesečnicu, dok amenoreja označava izostanak mjesečnice. Galaktoreja je prisutna u oko 50 do 80 % slučajeva, uglavnom se javlja spontano i bilateralno, iako može biti i unilateralna te oskudna (sadržaj se dobije tek na manualni pritisak bradavice). Uslijed smanjene koncentracije estrogena mogu se javiti i vazomotorne tegobe, smanjen libido, suhoća vaginalne sluznice i dispareunija (bolan spolni odnos), kao i poremećaji raspoloženja (depresija) te povećana incidencija osteoporoze. Kod manjega broja žena bilježe se povišene razine dihidroepiandrosterona što se prezentira umjerenim hirzutizmom, seborejom i aknama.
Glavne kliničke manifestacije kod muškaraca su vezane uz spolnu funkciju, tako da se javlja smanjen libido, erektilna disfunkcija te smanjen volumen ejakulata uz patološki nalaz spermiograma što vodi prema infertilitetu. Galaktoreja s ili bez ginekomastije moguća je pojava, ali daleko rjeđa nego kod žena. Obično su ove manifestacije srednje izražene i pripisuju se drugim uzrocima (starenje, stres) te se tako odgađa dijagnostika. Iz tog razloga tumori mogu rasti i dovesti do kliničkih manifestacija uslijed lokalnoga pritiska na okolne anatomske strukture.
Ostale kliničke manifestacije. Makroprolaktinomi svojim rastom mogu vršiti pritisak na okolne anatomske strukture te dovesti do karakterističnih obilježja (glavobolja, ispadni vidnoga polja, oftalmoplegija, diplopije, hipopituitarizam). U slučaju plurihormonalnih tumora kao uzroka hiperprolaktinemije javljaju se i druga klinička očitovanja (npr. istodobno pojačano lučenje hormona rasta dovodi do akromegalije). U rjeđim slučajevima kod nekih je žena prisutno lučenje abnormalne forme prolaktina za koju se smatra da može uzrokovati peripartalnu kardiomiopatiju koja dobro reagira na primjenu dopaminskih agonista.
Dijagnoza se postavlja na osnovi anamneze i kliničkoga pregleda, laboratorijske obrade te slikovnih metoda (neuroradiološka obrada). Uzimanje detaljne anamneze ključno je u procjeni hiperprolaktinemije: uzimanje lijekova, hipotireoza, operacija dojki ili neka druga bolest koja može dovesti do hiperprolaktinemije. Klinički pregled treba biti usmjeren na uočavanje i prepoznavanje znakova hipogonadizma, kao i na pregled dojki bez obzira na prisutnost galaktoreje.
Laboratorijska obrada. Ključna pretraga je određivanje prolaktina ujutro, natašte. Normalni nalaz je koncentracija prolaktina manja od 20 mcg/L. Zbog velike učestalosti lažno pozitivnih, kao i lažno negativnih, rezultata, kod visoke kliničke suspekcije preporuča se provjera u više navrata (osobito ako su vrijednosti neznatno povišene). Vrijednosti prolaktina više od 200 mcg/L nose visoku suspekciju na prolaktinom, dok manje vrijednosti mogu biti uzrokovane prolaktinomom, ali i drugim uzrocima. Kod muškaraca treba odrediti i ukupni i slobodni testosteron, LH i FSH, a kod žena estradiol, LH i FSH. Gonadotropini te testosteron (muškarci) i estardiol (žene) obično su sniženi.
Neuroradiološka obrada. Magnetna rezonancija (MRI) hipofize glavna je neuroradiološka pretraga kojom se potvrđuje prolaktinom. Makroprolaktinom se lako prikazuje i opisuje, dok se mikroprolaktinomi ne moraju uvijek prikazati. Osim toga, ova pretraga je nužna i kod bolesti selarne regije i hipotalamusa koje mogu dovesti do destrukcije i pritiska na hipofizni držak. Opcionalno u obzir dolazi i kompjuterizirana tomografija visoke rezolucije (HRCT) hipofize i selarne regije.
Liječenje može biti medikamentno, kirurško i radiacijsko, a u nekim slučajevima primjenjuje se i kemoterapija. Osnovu medikamentnoga liječenja čine agonisti dopamina koji imaju sposobnost vezanja na dopaminske (D2) receptore na membrani laktotropnih stanica te dovode do inhibicije lučenja prolaktina, ali i citolize što u konačnici dovodi do smanjenja tumorske mase.
Agonisti dopamina predstavljaju prvu liniju liječenja patološke hiperprolaktinemije. Tri su nam lijeka na raspolaganju: kabergolin, bromokriptin te kvinagolid. Kabergolin i bromokriptin su polusintetski ergot-alkaloidi s time da kabergolin pokazuje bolji afintet za D2 receptore na membrani laktotropnih stanica i bolje se podnosi od bromokriptina te ima dulje djelovanje i stoga mu se daje prednost. Kvinagolid je neergotski agonist dopamina s produljenim djelovanjem.
Liječenje kabergolinom započinje postupno (jedna do dvije doze na tjedan dana): prvi tjedan daje se 0,25 mg tbl jednom tjedno, drugi tjedan doza se povisuje na 0,25 mg dva puta na tjedan, a od trećega tjedna doza se povisuje na 0,5 mg dva puta tjedno. Dalje se doza povisuje s razmakom od mjesec dana, ovisno o vrijednostima prolaktina, a maksimalna doza je 1,5 mg dva puta tjedno. Bromokriptin se primjenjuje u širokom rasponu od 1,25 do 20 mg/dan tbl, obično 2,5 mg dva do tri puta dnevno. Inicijalna doza kvinagolida je 0,075 mg/dan tbl te se doza može postupno podizati do maksimalne doze od 0,6 mg/dan. Vrijednosti prolaktina kontroliraju se jednom mjesečno i prema nalazu se prilagođava doza lijeka. Liječenje može trajati i više godina bez posljedica.
Glavne nuspojave dopaminskih agonista su glavobolja, mučnina, nadutost, povraćanje i ortostatska hipotenzija. Nuspojave su najizraženije pri liječenju bromokriptinom. U slučaju jake mučnine nakon peroralnoga unosa kabergolina ili bromokriptina kod nekih žena pomaže vaginalna primjena lijeka (primjena lijeka duboko u vaginu), iako je moguć nadražaj sluznice vagine. Također, kako bi se umanjile nuspojave, preporuča se lijek uzimati navačer pred spavanje ako se radi o jednokratnoj dnevnoj dozi. Smanjenjem doze lijeka dolazi i do smanjenja izraženosti navedenih nuspojava.
Većina bolesnika liječenih dopaminskim agonistima postiže sniženje vrijednosti serumskoga prolaktina vrlo brzo te ih zadržava tijekom liječenja. Također rano po početku terapije primjećuje se i smanjenje tumorske mase s time da je taj učinak najizraženiji nakon godine dana liječenja. Brzo nakon primjene ovih lijekova uspostavlja se i normalna funkcija gonada te su moguće trudnoće, a kod ovih bolesnica nije zamjećena veća učestalost spontanih pobačaja ili teratogenoga učinka na plod.
Kirurško liječenje. Operativno liječenje indicirano je u liječenju makroprolaktinoma koji vrše kompresiju na okolne anatomske strukture te kod makroprolaktinoma koji ne vrše kompresiju na okolne strukture i mikroprolaktinoma koji ne reagiraju na terapiju dopaminskim agonistima ili ju bolesnici ne toleriraju. Kirurške komplikacije ovise o vještini neurokirurga kao i veličini prolaktinoma. U više od 95 % slučajeva funkcija adenohipofize ostaje uredna i nakon operacije. Stopa recidiva 10 godina nakon operacije kreće se oko 10 - 15 %. Moguće nuspojave kirurškoga liječenja su meningitis, cerebrovaskularni incident, gubitak vida, sinusitis, perforacija nosnog septuma, hiponatrijema i dijabetes insipidus.
Ostale terapijske mogućnosti. Radijacijsko liječenje danas je rijetko potrebno, s obzirom na dobar terapijski odgovor na agoniste dopamina i/ili kirurško liječenje. Ono je obično rezervirano za bolesnike s makroadenomima koji i dalje rastu unatoč liječenju dopaminskim agonistima, a nisu pogodni za operacijsko liječenje. Kemoterapija je također moguća metoda liječenja, a odnosi se na agresivne makroadenome ili karcinome kod bolesnika kod kojih operacijsko liječenje nije moguće, a tumor ne reagira na liječenje dopaminskim agonistima i radioterapiju. Najčešći citostatik koji se koristi za tu svrhu je temozolomid.
Prognoza. Općenito, prolaktinomi dobro reagiraju na medikamentnu terapiju dopaminskim agonistima. Kod bolesnika s makroadenomima teže se postiže izlječenje. U prosjeku, prognoza ovih bolesnika je vrlo dobra i samo mali broj bolesnika zahtijeva kirurško, radijacijsko ili kemoterapijsko liječenje.
CUSHINGOVA BOLEST
Definicija. Cushingova bolest naziv je za hiperkorticizam uzorkovan pojačanom produkcijom adrenokrotikotropnog hormona (ACTH) iz hipofize, najčešće iz hipofiznoga adrenokortikotropnoga adenoma. Cushingova bolest čini oko 70 % uzroka Cushingova sindroma, a on obuhvaća sve kliničke manifestacije uzrokovane hiperkorticizmom (pojačanim lučenjem kortizola) bez obzira na uzrok (tumori nadbubrega, ektopično lučenje kortizola, endogeni unos kortizola i sl.).
Adrenokortikotropni adenom čini oko 10 do 15 % svih tumora hipofize. S obzirom na brz razvoj kliničke slike koja nameće i relativno ranu dijagnostiku, većina ovih adenoma u trenu postavljanja dijagnoze su mikroadenomi. Ovi tumori su 5 do 10 puta češći kod žena nego kod muškaraca. Glavna patofiziološka značajka je nekontrolirana produkcija adrenokortikotropnoga hormona koji dovodi do hiperkortizolemije. Ipak, ovi tumori zadržavaju djelomičnu supresibilost produkcije adrenokortikotropnoga hormona u uvjetima visokih koncentracija glukokortikoida te je ova činjenica temelj dinamičkoga testa supresije lučenja adenokortikotropnoga hormoma primjenom visokih doza glukokortikoida (deksametazonski test) na temelju kojega se mogu razlikovati hipofizni od nehipofiznih uzroka Cushingova sindroma koji nemaju mogućnost supresibilnosti. Dugotrajno lučenje adrenokortikotropnoga hormona dovest će do hiperplazije kore nadbubrežne žlijezde te se osim pojačanoga stvaranja kortizola pojačano stvaraju i drugi hormoni zone retikularis adrenokorteksa, osobito androgeni (dihidroepiandrosteron, androstendion) koji se na periferiji pretvaraju u testosteron što će dovesti do supresije gonadotropina. Razine aldosterona su uredne.
Klinička slika i dijagnostički postupak opisani su u dijelu o bolestima nadbubrežne žlijezde (Cushingov sindrom).
Liječenje. Kirurško liječenje osnova je liječenja Cushingove bolesti, dok se radioterapija i medikamentno liječenje primjenjuje znatno rjeđe, uglavnom kod bolesnika kod kojih se ne postigne uspjeh kirurškim liječenjem.
Kirurško liječenje. Transsfenoidalna tumorska resekcija dovodi do remisije bolesti u 60 do 90 % slučajeva. Kod većine bolesnika nakon operativnoga zahvata hipofiza postupno oporavlja svoju normalnu funkciju. Lučenje adrenokortikotropnoga hormona nakon operacije normalizira se za 3 do 36 mjeseci te u tom periodu supresije bolesnici moraju dobivati hidrokortizon ili prednizon.
Radijacijsko liječenje rezervirano je za bolesnike kod kojih se nastavlja pojačana sekrecija adrenokortikotropnoga hormona i nakon kirurškoga liječenja. Prednost se daje sterotaksijskoj u odnosu na konvencionalnu radioterapiju.
Medikamentno liječenje nije uobičajena opcija za liječenje ovih bolesnika te se uglavnom primjenjuje kod bolesnika s perzistentnim ili rekurentnim oblikom Chusingove bolesti koji ne reagiraju na kirurško liječenje ili radioterapiju. Najčešći primjenjivani lijekovi su pasireotid i kabergolin.
Pasireotid je somatostatinski analog koji se primjenjuje supkutano, a ima sposobnost inhibicije sekrecije adrenokortikotropnoga hormona iz adenoma hipofize. Za razliku od ostalih analoga somatostatina, ima izraženiji afinitet prema somatostatinskim receptorima tipa 5 (SST5) koji su izraženiji na stanicama adenoma hipofize, za razliku od ostalih tipova somatostatinskih receptora. Terapijska doza iznosi 600 do 900 µg/dan. Većina bolesnika koji ne pokažu rani odgovor na primjenu ovog lijeka (smanjenje ACTH u plazmi, normalizacija slobodnog kortizola u 24-satom urinu) ne pokazuje učinak ni pri dužoj primjeni. Glavne nuspojave su hiperglikemija te razvoj šećerne bolesti (vjerojatno uslijed pankreasne supresije lučenja inzulina i inkretina), dok se od ostalih navode bolovi u trbuhu, mučnina, proljevi te pojačana učestalost žučnih kamenaca.
Kabergolin je dopaminski agonist za koji je otkriveno da smanjuje sekreciju kortizola u 25 do 50 % slučajeva bolesnika s Cushingovom bolesti. Također, kod određenoga broja bolesnika postignut je i efekt smanjenja adrenokortikotropnog adenoma hipofize. Učinak se povezuje s pronalaskom D2 receptora na površini stanica adrenokortikotropnoga adenoma. Primjenjuje se u dozi od 0,5 do 3,5 mg, peroralno, dva puta tjedno. Neke studije pokazuju pozitivan učinak kod oko 40 % bolesnika.
Ostali lijekovi koji se koriste u liječenju Chusingove bolesti (ketokonazol, mifepriston, mitotan i ostali) dijelom su simptomatskog liječenja i opisani su u dijelu o bolestima nadbubrežne žlijezde (Cushingov sindrom).
Prognoza. S obzirom na to da se većini bolesnika poremećaj dijagnosticira u fazi mikroadenoma te s obzirom na dobro razvijenu tehniku kirurškoga liječenja, većina bolesnika ulazi u remisiju i ima dobru prognozu (petogodišnje preživljenje iznosi oko 95 %, a desetogodišnje oko 90 %). Bolesnici kod kojih se dijagnosticira makroadenom imaju znatno lošije preživljenje.
Neurohipofiza predstavlja stražnji režanj hipofize koji je anatomski i funkcionalni sastavni dio hipotalamusa, a građen je od aksona koji potječu iz supraoptičkih i paraventrikularnih jezgara u hipotalamusu. Neurohipofiza luči dva hormona - antidiuretski hormon i oksitocin, koji se sintetiziraju u hipotalamusu te bivaju uskladišteni u u sekretornim granulama stražnjega režnja hipofize odakle dospijevaju u krvotok.
Antidiuretski hormon (ADH) ili vazopresin stvara se u ganglijskim stanicama supraoptičke i paraventrikularne jezgre te se zajedno s proteinskim nosačem prenosi duž aksona do neurohipofize gdje se pohranjuje u sekretornim granulama odakle se otpušta u krv zajedno s neurofizinom, svojim transportnim proteinom unutar aksona. Izlučivanje ADH-a povezano je s aktivnošću centra za žeđ koji regulira uzimanje tekućine. U stanjima deplecije vode i posljedičnoga povišenja osmolalnosti plazme, angiotenzin II povećava osjećaj žeđi i lučenje antidiuretskoga hormona koji djelujući na bubrežne tubule povećava reapsorpciju vode i smanjuje njezin gubitak putem bubrega. Obrnuto, povećani volumen plazme i smanjena osmolalnost koče lučenje ADH-a čime se pojačava diureza i vrši korekcija volemije. Promjene osmolalnosti plazme bilježe osmoreceptori, posebne neuronske strukture koje se nalaze u hipotalamusu. U bubrezima ADH djeluje preko vazopresinskoga receptora V2 koji se nalazi na kontraluminalnoj površini tubularnih stanica, a vezanjem za njih potiče migraciju akvaporinskih kanalića koji osiguravaju slobodno kretanje vode iz lumena tubula u tubularne stanice kroz staničnu membranu. Osim toga, ADH djeluje i na vazopresinske receptore V1 koji se nalaze na površini endotelnih stanica preko kojih ostvaruje svoj vazokonstriktivan učinak.
Oksitocin je hormon koji dovodi do kontrakcije mioepitelnih stanica izvodnih kanalića dojke i tako sudjeluje u procesu laktacije te stimulira kontrakcije maternice.
Dva najčešća poremećaja neurohipofize koji se susreću u kliničkoj praksi su dijabetes insipidus te sindrom neprimjerene sekrecije ADH-a (SIADH).
DIJABETES INSIPIDUS
Definicija. Dijabetes insipidus označava poremećaj kojega karakterizira smanjeno stvaranje i/ili smanjen učinak antidiuretskoga hormona zbog čega dolazi do gubitka velike količine tekućine, što se klinički očituje izraženom poliurijom i polidipsijom. Ovisno o etiologiji, razlikujemo centralni i nefrogeni dijabetes insipidus, a bolest se češće razvija kod osoba muškoga spola.
Etiopatogeneza. Ovisno o uzroku i mehanizmu nastanka, razlikujemo četiri oblika bolesti: centralni dijabetes inspidus, nefrogeni dijabetes insipidus, gestacijski dijabetes insipidus te primarna polidipsija.
Centralni dijabetes insipidus obilježen je smanjenim stvaranjem i/ili lučenjem antidiuretskoga hormona što nastaje kao posljedica bolesti i poremećaja hipotalamusa i hipofize. Najčešći uzroci su genetski (Wolfran/DIDMOAD sindrom), tumori (kraniofaringeom, hipotalamički tumori, metastatski tumori, limfomi, tumori hipofize), infekcije (tuberkuloza, meningitis, apscesi), infiltrativne bolesti (sarkoidoza, histiocitoza), vaskularni (aneurizma, ishemija, hemoragija), traume i kirurški zahvati. Vrijednosti antidiuretskoga hormona u plazmi su nemjerljive ili neprikladno niske u odnosu na osmolalnost plazme.
Nefrogeni dijabetes inspidus obilježen je urednim stvaranjem i lučenjem antidiuretskoga hormona, ali izostaje njegov fiziološki učinak što je posljedica poremećaja na razini samih tubula. On može nastati kao posljedica 1) genetskih poremećaja, odnosno mutacija koje zahvaćaju gen za vazopresinski receptor V2 ili akvaporinske kanale, 2) stečenih tubulointersticijskih bolesti bubrega ili 3) drugih poremećaja koji ometaju učinak antidiuretskoga hormona (hipokalijemija, hiperkalcijemija, lijekovi). Vrijednosti antidiuretskoga hormona u plazmi u ovom obliku bolesti su ili povišene ili unutar gornjih referentnih vrijednosti.
Gestacijski dijabetes insipidus rijedak je oblik ove bolesti koji je povezan s učinkom placentarne aminopeptid oksitocinaze koja razgradnjom oksitocina sprečava prijevremene kontrakcije gravidnoga uterusa. Osim oksitocina, ovaj enzim može dovesti i do razgradnje antidiuretskoga hormona zbog čega se on u trudnoći kompenzacijski pojačano sintetizira. U slučaju povećane ekspresije oksitocinaze ili izostanka kompenzatornoga povećanog lučenja anidiuretskoga hormona može se razviti slika dijabetesa insipidusa. Vrijednosti antidiuretskoga hormona i u ovom obliku bolesti su izrazito ili nemjerljivo niske.
Primarna polidipsija predstavlja poremećaj u kojemu dominira pojačan unos tekućine u organizam, što se obično susreće kod psihijatrijskih bolesnika ili uslijed poremećaja centra za žeđ. Pojačan unos tekućine dovodi do smanjenja osmolalnosti plazme što dovodi do smanjenoga stvaranja i lučenja antidiuretskoga hormona i posljedične poliurije. U ovome obliku bolesti vrijednosti antidiuretskoga hormona također su niske, ali su one u odnosu na druge oblike bolesti proporcionalno niske u odnosu na osmolalnost plazme.
Patofiziologija. Posljedično manjkavosti učinka antidiuretskoga hormona izostaje tubularna reapsorpcija tekućine zbog čega dolazi do prekomjernoga izlučivanja putem urina kojega odlikuje izuzetno niska osmolalnost. Dnevna diureza ovih bolesnika može iznositi i preko 20 litara. Posljedično povećanom gubitku tekućine dolazi do koncentriranja plazme i povišenja osmolanosti zbog čega se javlja osjet žeđi i bolesnici prekomjerno piju. Ako unos tekućine ne prati gubitak, kod bolesnika se mogu naći i povišene vrijednosti hematokrita te hipernatrijemija.
Klinička slika. Osnovna značajka ove bolesti je izražena poliurija koja može premašivati i 20 litara na dan. Bolesnici se obično javljaju liječniku kada dnevna diureza postane veća od 5 litara. Nastup bolesti je obično nagao te se poliurija razvije kroz nekoliko dana ili tjedana. Bolesnici posljedično pojačanom morenju imaju i pojačan osjet žeđi te uzimaju velike količine tekućine. Ako unos tekućine ne prati gubitak, razvija se klinička slika dehidracije i hipovolemije. Kod dijabetesa insipidusa koji se razvija sekundarno, uslijed bolesti središnjega živčanog sustava ili bubrega, u kliničkoj slici nalazimo i te simptome i znakove.
Dijagnoza. Svaka ekscesivna poliurija mora pobuditi sumnju na dijabetes insipidus. Dijagnostički postupak obuhvaća temeljitu anamnezu i fizikalni pregled, laboratorijsku dijagnostiku, endokrinološku obradu te dijagnostiku osnovne bolesti koja je dovela do tog stanja.
Laboratorijski nalazi. Osnovni laboratorijski nalazi koji ukazuju na dijabetes insipidus su smanjena osmolalnost mokraće (< 200 mOsm/L), povećana osmolalnost plazme (> 300 mOsm/kg) te umjerena hipernatrijemija. Određivanje koncentracije antidiuretskoga hormona u plazmi složen je postupak pa nije svugdje dostupan u rutinskoj obradi, stoga kod svih bolesnika sa sumnjom na ovaj poremećaj izvodimo test ustezanja vode, odnosno pokus koncentracije urina.
Test ustezanja vode ključan je endokrinološki test kod bolesnika sa sumnjom na dijabetes insipidus. Pretraga se izvodi u bolničkim uvjetima, a započinje ujutro mjerenjem tjelesne težine bolesnika, osmolanosti seruma i urina te mjerenjem koncentracije elektrolita. Bolesniku se uskraćuje uzimanje tekućine, a svaki sat se prikuplja izlučena mokraća u kojoj se određuje osmolanost (ili specifična težina) te se vrši vaganje bolesnika. Uskraćivanje vode provodi se sve dok bolesnik ne izgubi više od 5 % početne tjelesne težine ili se ne ustanovi kroz nekoliko mjerenja da se urin ne može koncentrirati za više od 30 mOsm/L ili se ne razvije teška dehidracija. Tada se ponovno provede uzorkovanje krvi i urina (osmolalnost, elektroliti) te se supkutano primjeni 5 i.j. vodene otopine antidiuretskoga hormona. Pretraga završava ponovnim uzorkovanjem i određivanjem osmlalnosti urina 60 minuta od aplikacije antidiuretskoga hormona. Normalan rezultat nakon dehidracije podrazumijeva stvaranje jako koncentrirane mokraće (>600 mOsm/L) čija osmolalnost premašuje plazmatsku osmolalnost i ne povećava se za više od 5 % nakon primjene anidiuretskoga hormona. Bolesnici s centralnim dijabetesom insipidusom ne mogu postići veću osmolalnost urina nego plazme, a nakon primjene antidiuretskoga hormona osmolalnost urina poraste za više od 50 % (bolesnici s parcijalnim centralnim dijabetesom insipidusom pokazuju odgovor u vidu porasta osmolalnosti urina nakon primjene antidiuretskoga hormona u rasponu od 10 do 50 %). Bolesnici s nefrogenim dijabetesom insipidusom također ne mogu postići veću osmolalnost urina u odnosu na plazmu te ne pokazuju dodatni odgovor na primjenu antidiuretskoga hormona (nema porasta osmolalnosti urina).
Dijagnostika osnovne bolesti. S obzirom na to da dijabetes insipidus obično razvija sekundarno, potrebno je provesti odgovarajuću dijagnostičku obradu ovisno o tome radi li se o centralnom ili nefrogenom obliku bolesti (npr. magnetna rezonanca mozga, ultrazvuk bubrega i sl.).
Diferencijalna dijagnoza. Kod bolesnika koji se javljaju s poliurijom treba isključiti druge, češće uzroke, kao što su hiperglikemija, primjena radioloških kontrastnih sredstava ili akutno bubrežno oštećenje.
Liječenje. Osnovu liječenja centralnoga dijabetesa insipidusa čini primjena dezmopresina, analoga antidiuretskoga hormona koji ima selektivni učinak na V1 receptore (ne izaziva vazokonstrikciju) te ima produljeno vrijeme djelovanja. Lijek je dostupan u više oblika za različite vrste primjena: topička (nazalna), parenteralna (supkutana, intravenska) te peroralna. Danas se najčešće lijek primjenjuje u obliku raspršivača za nazalnu primjenu. Doza lijeka koja je potrebna za postizanje odgovarajućega učinka je različita kod pojedinih osoba te se stoga treba postupno uvoditi (kod odraslih je to najčešće 10 - 20 µg za nazalnu primjenu). Ovisno o odgovoru, lijek se može primijeniti dva do tri pita na dan. Liječenje nefrogenoga dijabetes insipidusa sastoji se od osiguravanja odgovarajuće volumne nadoknade te primjene lijekova koji mogu biti učinkoviti u smanjenju poliurije, kao što su tiazidi (paradoksalni učinak smanjenjem dopreme vode do sabirnih kanalića), indometacin te amilorid. Uz navedene mjere potrebno je provesti i liječenje osnovne, uzročne bolesti koja je dovela do ovoga poremećaja.
Prognoza u prvom redu ovisi o uzročnoj bolesti, ali načelno gledano, dijabetes insipidus ima dobru prognozu, osobito centralni oblik. Posebnu pozornost treba usmjeriti na bolesnike koji ne mogu osigurati zadovoljavajući unos tekućine zbog mogućega razvoja teške dehidracije i hipovolemije.
SINDROM NEPRIMJERENE SEKRECIJE ADH-a
Definicija. Sindrom neprimjerene sekrecije ADH-a (SIADH, engl. syndrome of inappropriate antidiuretic hormone secretion) je kliničko stanje koje karakterizira nefiziološko, kontinuirano i neprikladno lučenje antidiuretskoga hormona zbog čega dolazi do povećane tubularne reapsorpcije vode s posljedičnom oligurijom, hipervolemijom i hiponatrijemijom.
Etiopatogeneza. Povećane koncentracije antidiuretskoga hormona u serumu mogu biti posljedica pojačanog stvaranja ADH-a u hipotalamusu i neurohipofizi ili može nastati kao rezultat ektopične proizvodnje što je karakteristično za različite tumore (paraneoplastični sindrom). Uzroke ovoga sindroma ugrubo možemo podijeliti u četiri skupine: bolesti i poremećaji središnjega živčanog sustava, tumori, plućne bolesti te lijekovima izazvani SIADH-i (Tablica 7.2.).
|
Tablica 7.2. Najčešći uzroci SIADH-a
|
|
Bolesti SŽS-a
|
Bolesti pluća
|
Tumori
|
Lijekovi
|
|
Meningoencefalitis, apscesi
Tumori SŽS-a
Cerebrovaskularni inzult
Vaskulitisi
Autoimune bolesti (SLE)
Traumatske lezije
Metaboličke encefalopatije
Hidrocefalus
|
Pneumonija
Tuberkuloza
Apscesi pluća
Empijem pleure
Astma, KOPB
Cistična fibroza
Sarkoidoza
|
Karcinom pluća
Mezoteliom pluća
Karcinomi probavne cijevi
Karcinom pankreasa
Adenokarcinom bubrega
Karcinom prostate
Karcinomi uterusa i jajnika
|
Stimulacija ADH sekrecije: acetilkolin, barbiturati, bromokriptin, haloperidol, histamin, opijati, tiopental
Potenciranje ADH učinka: metformin, teofilin, ADH analozi, griseofulvin
|
Patofiziologija. Pojačano djelovanje antidiuretskoga hormona očituje se povećanom tubularnom reapsorpcijom vode. Posljedično tome smanjuje se volumen izlučene mokraće pri čemu je ona hiperkoncentrirana (povećana osmolanost i specifična težina), dok reapsorbirana voda dovodi do povećanja cirkulirajućega volumena zbog čega se smanjuje osmolalnost plazme te nastaje dilucijska hiponatrijemija. Posljedično hipervolemiji pojačano se otpuštaju natriuretski peptidi koji dodatno dovode do gubitka natrija (pojačavaju natriurezu), a u nešto manjoj mjeri i kalija.
Klinička slika. Bolesnici sa SIADH-om obično su bez simptoma ili u kliničkoj slici dominiraju simptomi i znakovi osnovne bolesti. Simptomi SIADH-a prvenstveno su uzrokovani težinom i brzinom nastupa hiponatrijemije: glavobolja, gubitak teka, mučnina i povraćanje, paralitički ileus, mišićna slabost te stupnjeviti poremećaji svijesti (letargija, somnolencija, sopor, koma).
Dijagnoza se prvenstveno postavlja na osnovi laboratorijskih nalaza. Osnovni laboratorijski nalazi koji ukazuju na SIADH su snižena osmolalnost plazme (< 270 mOsm/kg), povećana osmolalnost urina u odnosu na plazmu, dilucijska hiponatrijemija te očuvana ekskrecija natrija putem urina (natrij u urinu je obično viši od 40 mmol/L). U dijagnostičkom postupku potrebno je isključiti druge moguće uzroke hiponatrijemije. Glavni kriteriji za postavljanje dijagnoze SIADH-a navedeni su u Tablici 7.3. Ovisno o indikaciji i simptomima, obradu treba usmjeriti i na otkrivanje uzročne bolesti ili stanja.
|
Tablica 7.3. Kriteriji za postavljanje dijagnoze SIADH-a
|
|
Osmolalnost seruma < 275 mOsm/kg;
Osmolalnost urina > 100 mOsm/kg;
Koncentracija Na u jednokratnom urinu > 30 mmol/l;
Odsutnost bolesti nadbubrežne žlijezde, štitnjače, hipofize i bubrežne insuficijencije;
Izostanak korekcije hiponatrijemije nakon primjene 0,9 %-tne NaCl infuzije;
Korekcija hiponatrijemije nakon restrikcije tekućine.
|
Liječenje. Osnovu liječenja SIADH-a čini restrikcija unosa tekućina. Ograničenjem unosa tekućine na 500 do 1000 ml/dan u većine bolesnika dolazi do normalizacije laboratorijskih nalaza. U slučaju da bolesnici ne reagiraju na restrikciju tekućine, u obzir dolazi primjena demeklociklina u dozi od 600 do 1200 mg/dan jer on ima sposobnost reverzibilne inhibicije učinka antidiuretskoga hormona na bubrege (izazivanje jatrogenoga dijabetes insipidusa). Ograničavajući faktor kod primjene ovoga lijeka je nastanak fotosenzitivnoga osipa. Antagonisti V2 receptora (tolvaptan, konivaptan) nisu u širokoj uporabi, a mogu se koristiti za parenteralnu primjenu u najtežim oblicima bolesti. Kod bolesnika koji su u izraženoj hipervolemiji može se primijeniti i furosemid. Osnovna preporuka u liječenju ovih bolesnika je praćenje oporavka vrijednosti natrija jer brzo ispravljanje hiponatrijemije može dovesti do teških neurološki komplikacija (opisano u liječenju hiponatrijemije).
Prognoza ponajprije ovisi o uzročnoj bolesti. Uz navedene preporuke za liječenje, SIADH se može dobro kontrolirati i održavati laboratorijske nalaze urednim.
U ovom dijelu udžbenika bit će predstavljene osnove fiziologije štitne žlijezde i njezinih hormona, kao i najčešće bolesti štitne žlijezde u kliničkoj praksi: struma ili guša, hipotireoza i miksedem, tireotoksikoza i hipertireoza te upale i tumori štitne žlijezde.
FIZIOLOGIJA ŠTITNE ŽLIJEZDE
Normalna funkcija štitne žlijezde usmjerena je na lučenje L-tiroksina (T4) i trijodtironina (T3), aktivnih hormona koji utječu na brojne metaboličke procese.
Sinteza hormona, sekrecija i metabolizam. Tireotropni hormon (TSH) predstavlja glavni regulatorni mehanizam koji regulira sintezu i lučenje hormona štitne žlijezde. Vezanjem TSH-a za receptore na površini tireocita potiče se unos joda te transport koloida u stanicu te sintezu i sekreciju T3 i T4.
Transport joda. Unos joda u štitnjaču odvija se protiv koncentracijskoga gradijenta i za takav transport potrebna je energija. Tu zadaću obavlja transporter jodida (ATP-ovisan Na/I kotransporter ili simporter), a nalazi se na bazolateralnoj membrani tireocita. Nakon ulaska, jod se organificira, tj. veže se za proteine.
Biosinteza hormona. Prvi korak u procesu biosinteze hormona štitnjače je oksidacija joda uz nazočnost vodikova peroksida, a reakciju katalizira tireoidna peroksidaza. Endoplazmatski retikulum i Golgijev aparat sintetiziraju molekulu tireoglobulina koja se sastoji od 70 molekula tirozina. Sljedeći korak podrazumijeva vezanje joda za tireoglobulin pri čemu se tirozin unutar tireoglobulina najprije jodira u monojodtirozin (MIT), a zatim u dijodtirozin (DIT) te dolazi do međusobnoga udruživanja tih molekula. Po završetku navedenoga procesa svaka molekula tireoglobulina sadrži i do 30 molekula tiroksina (T4) i nekoliko molekula trijodtironina (T3). U tom se obliku hormoni pohranjuju u folikulima u količinama koje su dostatne za opskrbu tijela hormonima tijekom dva do tri mjeseca.
Sekrecija hormona. Ovaj proces započinje endocitozom tireoglobulina i koloida u tireocite u kojima proteaze iz lizosoma vrše razgradnju tireoglobulina pri čemu se oslobađaju molekule MIT, DIT, trijodtironin (T3) i tiroksin (T4). Hormoni štitne žlijezde potom se luče u krv, a molekule MIT i DIT se dejodiniraju i dalje se upotrebljavaju za sintezu novoga tireoglobulina.
Transport hormona. T3 i T4 većinom se u cirkulaciji kreću vezani za proteine plazme (albumini, globulini), a samo se mali dio nalazi u slobodnom obliku. Zbog velikoga afiniteta proteina plazme za hormone štitne žlijezde ti se hormoni sporo otpuštaju u tkivne stanice. T4 se u krvi nalazi u znatno većim količinama nego T3.
Unutarstanični transport hormona i njihovo djelovanje. Hormoni štitne žlijezde u stanice ulaze procesom pasivne difuzije. Oni se vežu za unutarstanične receptore i ostvaruju svoj učinak poticanjem transkripcije različitih gena. Kako ti receptori imaju daleko veći afinitet za T3, većina T4 se unutar stanice pretvara u T3 uklanjanjem jedne molekule joda. U odsutnosti hormona štitne žlijezde na te se receptore vežu korepresori koji inhibiraju gensku ekspresiju.
Učinak hormona štitnjače. Hormoni štitnjače imaju učinak na unutarstaničnu metaboličku aktivnost, djeluju na rast te druge specifične mehanizme: 1) potiču staničnu metaboličku aktivnost (povećavaju broj mitohondrija, povećavaju aktivni transport kroz stanične membrane), 2) potiču muskuloskeletni rast djeteta te su potrebni za normalan razvoj mozga, 3) pospješuju metabolizam ugljikohidrata i masti te povećavaju intezitet bazalnoga metabolizma, 4) djeluju na krvožilni sustav (povisuju krvni tlak, srčani minutni volumen, frekvenciju i kontraktilnost), 5) pojačavaju disanje, 6) ubrzavaju crijevnu peristaltiku, 7) imaju podražajni učinak na središnji žičani sustav, 8) potiču mišićnu kontrakciju te 9) potiču lučenje hormona iz drugih endokrinih žlijezda.
Laboratorijska dijagnostika bolesti štitne žlijezde. Određivanje tireotropnoga hormona u serumu (TSH) osnovni je korak u otkrivanju poremećaja rada i funkcije štitne žlijezde te predstavlja najosjetljiviji test u dijagnostici hipotireoze i hipertireoze. Ako je TSH u granicama referentnih vrijednosti, bolesnik je eutireoidan i nije potrebno dalje određivati hormone štitne žlijezde. Povišene vrijednosti TSH-a upućuju na hipotireozu i tada je potrebno odrediti ukupni (T4) ili slobodni tiroksin (FT4) čime utvrđujemo radi li se o supkliničkom (uredne vrijednosti FT4) ili o kliničkom obliku bolesti (snižene vrijednosti FT4). Snižene vrijednosti TSH-a upućuju na hipertireozu te je tada potrebno odrediti vrijednosti T4 ili FT4, kao i ukupnoga trijodtironina (T3) i slobodnoga trijodtironina (FT3) jer u većini slučajeva hipertireoze povišenje FT3 prvi je znak bolesti. S obzirom na to da na ukupnu vrijednost utječu specifični proteinski nosači, danas se preporuča određivanje i mjerenje slobodnoga oblika hormona (FT3, FT4). Kod praćenja funkcije štitne žlijezde nakon početka liječenja hipertireoze tireostaticima ili radioaktivnim jodom određivanje FT4 pouzdaniji je pokazatelj učinka liječenja od TSH-a (FT4 se ranije normalizira u odnosu na TSH). Protutijela na tireoidnu peroksidazu (anti-TPO) i/ili protutijela na tireoglobulin (anti-TGA) su čest nalaz kod bolesnika s autoimunim poremećajem štitnjače, ali kod pojedinih bolesnika mogu biti i negativna. Protutijela na TSH receptor specifična su za Gravesovu bolest te mogu potvrditi etiologiju hipertireoze u klinički nejasnim slučajevima, ali određivanje TSH-receptor protutijela u praćenju medikamentnoga liječenja Gravesove bolesti nije potrebno.
GUŠA, struma
Definicija i podjela. Guša ili struma naziv je za povećanje štitnjače koje je neupalnoga i netumorskog porijekla. S obzirom na pojavnost, razlikujemo endemsku i sporadičnu strumu, s obzirom na sposobnost lučenja hormona i izazivanja simptoma hipertireoze, razlikujemo toksičnu i netoksičnu (eutiroidnu) strumu, a s obzirom na patohistološke promjene razlikujemo difuznu i multinodularnu strumu. Najčešće u kliničkoj praksi razlikujemo difuznu netoksičnu strumu, multinodularnu netoksičnu strumu i multinodularnu toksičnu strumu.
Epidemiologija. Endemska gušavost prisutna je kod stanovnika visokih gorja (Ande, Alpe, Pirineji, Himalaja). Povezana je s manjkom joda u prehrani, a on je nužan za normalnu sintezu hormona štitnjače. Jodiranje kuhinjske soli koje se danas provodi uvelike je smanjilo incidenciju strume. Pojava gušavosti je u načelu češća kod žena nego kod muškaraca, što se povezuje s većom učestalošću autoimunih bolesti kod žena, kao i povećanim potrebama za jodom tijekom trudnoće. Gledano na dob, struma se češće javlja kod starijih osoba.
Etiologija. Najčešći uzroci strume su: 1) manjak joda u prehrani, 2) izlaganje strumogenim tvarima te 3) prirođeni poremećaji sinteze hormona štitnjače. Zajednička patofiziološka osnova svih ovih uzroka je smanjena sinteza hormona štitnjače te kompenzatorno povećanje tkiva štitnjače kako bi se postiglo eutireoidno stanje. Ipak, kod određenoga broja bolesnika ne možemo dokazati uzrok strume.
Manjak joda. S obzirom na to da je jod nužan za normalnu sintezu hormona štitnjače, njegov deficit dovest će do smanjene sinteze hormona i posljedičnih kompenzacijskih promjena koje dovode do razvoja strume. Ovo susrećemo pri endemskoj gušavosti te u stanjima povećane potrebe za unosom joda (pubertet i trudnoća).
Izlaganje strumogenim tvarima, tj. tvarima koje potiču proliferaciju tkiva štitnjače, rjeđe se susreće u kliničkoj praksi. Najčešće se radi o lijekovima sa strumogenim učinkom te povrću koje u sebi sadrži tiocijanite. Lijekovi sa strumogenim učinkom su protutireoidni lijekovi, litijeve soli i sulfonilureja.
Prirođeni poremećaji sinteze hormona štitnjače najrjeđi su uzroci gušavosti, a dijelom se to pripisuje i činjenici da nisu dostupni rutinskoj dijagnostici. Poremećaji sinteze hormona mogu biti na bilo kojoj razini od transporta joda, preko biosinteze do same sekrecije.
Patogeneza. Kako je navedeno, zajedničko patogenetsko obilježje svih navedenih uzroka je neodgovarajuća i smanjena sinteza hormona štitnjače, a povećanje tkiva štitnjače samo je kompenzacijski odgovor kojim se pokušava povećati sintezu hormona i dovesti organizam u eutireoidno stanje. Mehanizmi kojima se postiže taj odgovor nisu do kraja razjašnjeni. Prijašnje teze da je povećanje tkiva štitnjače uzrokovano povećanim stvaranjem TSH-a koji se luči iz adenohipofize kao odgovor na sniženi trijodtironin i tiroksin danas i nisu najprihvatljivije s obzirom na to da kod velikoga broja bolesnika TSH ostaje uredan ili tek blago povišen. Sve više se govori o lokalnom učinku citokina i faktora rasta na hiperplaziju štitnjače. Razlog zbog kojega se kod nekih pojedinaca razvija difuzna hiperplazija, a kod nekih multinodularna, pokušava se objasniti razlikom u osjetljivosti pojedinih tireocita na hiperplastični učinak faktora rasta, citokina i TSH-a. Molekularna osnova gubitka autonomije pojedinih tireocita i sukladno tome, pojačanoga lučenja hormona štitnjače nije poznata, ali može biti posljedica genetskih promjena tijekom umnažanja tireocita koja dovodi do narušavanja normalnih unutarstaničnih puteva.
Klinička slika. Većina bolesnika prezentira se asimptomatskim povećanjem štitnjače. Ipak, daljnji rast i povećanje tkiva štitnjače može stvarati lokalne kompresivne simptome, a ukoliko se radi o toksičnoj gušavosti pojavljuju se i simptomi hipertireoze.
Povećanje štitnjače osnovni je znak. Uvećana struma često se može primijetiti i bez palpacije. Difuzna struma očituje se kao simetrično, obostrano uvećanje štitne žlijezde, dok kod multinodularne nalazimo čvorasto uvećanje. Bol nije karakteristična za gušavost. U Tablici 7.4. prikazana je stupnjevita podjela veličine gušavosti prema Svjetskoj zdravstvenoj organizaciji.
Simptomi kompresije uključuju otežano gutanje (pritisak na jednjak), otežano disanje i stridor (pritisak na traheju), promuklost (pritisak na laringeus rekurens) te vensku kongestiju vrata i lica (pritisak na jugularne vene). Pembertonov znak uključuje pojavu venske kongestije vrata i lica (pletora) kada bolesnik podigne ruke iznad glave, zbog kompresije na venu jugularis eksternu.
Znakovi hipertireoze. Toksična struma očituje se kao subklinička hipertireoza ili srednje izražena tireotoksikoza. Obično se radi o starijim bolesnicima koji se prezentraju novonastalom fibrilacijom atrija, tahikardijom, tremorom, gubitkom težine, poremećajem pažnje i sl. Često izlaganje jodu tijekom dijagnostičkih postupaka dovodi do pogoršanja kliničke slike.
|
Tablica 7.4. Stupnjevi uvećanja štitnjače prema Svjetskoj zdravstvenoj organizaciji
|
|
Stupanj
|
Karakteristike
|
|
0
|
Nema povećanja štitnjače
|
|
Ia
|
Povećanje se palpira, ali se ne vidi pri ekstenziji vrata
|
|
Ib
|
Povećanje se palpira i vidi se pri ekstenziji vrata
|
|
II
|
Povećanje se vidi i pri normalnom položaju vrata
|
|
III
|
Velika guša koja se primjeti iz daljine
|
Diferencijalna dijagnoza uključuje upale štitne žlijezde, tumore štitne žlijezde, autoimune bolesti te druge funkcionalne poremećaje štitne žlijezde. Dijagnoza strume uglavnom se postavlja isključivanjem prethodno navedenih dijagnoza.
Dijagnoza se postavlja na osnovi anamnestičkih podataka i kliničkoga pregleda, laboratorijskih nalaza i slikovnih metoda (ultrazvuk, scintigrafija, kompjuterizirana tomografija, magnetna rezonancija).
Klinički pregled. Prvi korak je razlikovanje gušavosti od drugih uzroka oteklina u području prednje strane vrata. Višak kože i povećana količina masnoga tkiva nekada može nalikovati na povećanje štitne žlijezde pa je potrebna pažljiva palpacija kako bi se razlikovali. Promatranje pomičnosti otekline tijekom gutanja također pomaže u razlikovanju strume od masnoga tkiva, s obzirom na to da pri gutanju dolazi i do pomaka štitne žlijezde.
Laboratorijski nalazi. Kod svih bolesnika treba odrediti vrijednosti hormona štitnjače. Kod netoksične strume TSH je normalan ili blago povišen, dok je fT4 snižen, a fT3 uredan, što se tumači pojačanom konverzijom fT4 u fT3. Kod toksične strume TSH je snižen, fT4 je normalan ili blago povišen dok je fT3 znatnije povišen. Određivanje TPO antitijela služi u diferencijalnoj dijagnozi prema imunotireopatijama, kod strume oni obično nisu povišeni.
Ultrazvuk vrata najbolja je metoda za definiranje karaktera i opsežnosti uvećane štitne žlijezde. On pomaže pri razlikovanju difuzne od multinodularne strume te daje podatke o eventualnoj kompresiji na druge anatomske strukture. Poreban je detaljan ultrazvučni pregled čvorova štitnjače te uočavanje eventualnih tumorskih promjena: nepravilni rubovi čvora, heterogena ehogenost, mikrokalcifikati, uočavanje vaskularnih struktura unutar čvora te dijametar čvora veći od 1 cm. Svaki suspektan čvor potrebno je bioptirati. Iglena biopsija (FNA, od engl. fine-needle aspiration biopsy) pod kontrolom ultrazvuka nužna je u dijagnostici suspektno tumorski promijenjenih čvorova štitnjače. Da bi se izbjegao rizik eventualne malignosti, preporuča se biopsija četiri najveća čvora u multinodularnim strumama.
CT i MRI. U slučaju jako povećane štitne žlijezde koja prominira prema straga, simptoma kompresije ili spuštanja strume u retrosternalni prostor indicirana je kompjuterizirana tomografija ili magnetna rezonancija.
Scintigrafija štitnjače indicirana je u multinodularnoj strumi s ciljem utvrđivanja postojanja tireoidne autonomije. Čvorovi koji nakupljaju primijenjen izotop nazivaju se toplim čvorovima i predstavljaju mjesta tireoidne autonomije, a čvorovi koji ne nakupljaju izotop su tzv. hladni čvorovi.
Liječenje strume treba započeti kada se isključi tumorska i upalna priroda bolesti. Asimptomatske bolesnike koji nemaju veće kozmetičke probleme potrebno je samo pratiti (klinički pregled, ultrazvuk, hormonski status). Pravo liječenje provodimo kod bolesnika s velikim strumama, kod razvijenih kompresivnih simptoma te kod bolesnika s toksičnom strumom. Metode liječenja strume su: terapija levotiroksinom, kirurško liječenje te liječenje radioaktivnim jodom.
TSH supresija levotiroksinom rijetko je učinkovita u smanjenju veličine same strume, a pored toga nosi opasnost od razvoja tireotoksikoze kod bolesnika s razvijenom supkliničkom hipertireozom. Ako se koristi, doze trebaju biti niže (50 µg/dan), a TSH se mora češće mjeriti kako bi se izbjegla pretjerana supresija. Terapija se temelji na činjenici da unos hormona štitnjače dovodi do supresije lučenja TSH-a iz adenohipofize i da se time smanjuje njegov proliferacijski učinak na štitnu žlijezdu. Ova terapija je indicirana kod bolesnika s povišenim vrijednostima serumskoga TSH-a te se ne preporuča kod bolesnika s kardijalnom anamnezom zbog povećanoga rizika od nastanka angine pektoris i fibrilacije atrija. Povećan je rizik i od nastanka osteoporoze, osobito kod postmenopauzalnih žena sa smanjenom koštanom gustoćom.
Kirurško liječenje (suptotalna tireoidektomija) indicirana je kod bolesnika kod kojih se razviju kompresivni simptomi i kod bolesnika kod kojih velike strume predstavljaju kozmetički problem. Kirurško liječenje indicirano je i kod postojanja suspektno malignoga čvora. Osim operativnoga rizika (na što treba misliti kod starijih osoba), kirurško liječenje nosi rizik i od nastanka hipotireoze koja će zahtijevati supstitucijsko liječenje.
Liječenje radioaktivnim jodom podrazumijeva primjenu radioaktivno obilježenoga joda koji se akumulira u štitnjači na mjestima tireoidne autonomije te tamo dovodi do lokalne destrukcije tkiva štitne žlijezde. Doza ovisi o veličini same strume, a liječenje se ponavlja višekratno. Kod većine bolesnika može se postići 40 do 50 %-tno smanjenje strume. Ranija zabrinutost od radijacijom induciranoga edema tkiva štitnjače i pritiska na traheju danas je manja jer su brojne studije pokazale izuzetnu rijetkost ove komplikacije. Hipotireoza se također rijetko pojavljuje kao posljedica ovoga liječenja. Terapija radioaktivnim jodom uglavnom je rezervirana za multinodularnu strumu kod starijih bolesnika koji imaju povećan operativni rizik.
Prognoza bolesnika sa strumom u načelu je dobra. Ako se zadovoljavajuće prate i liječe, rijetko se razvijaju teže komplikacije kao što su kompresije na anatomske strukture vrata ili tireotoksikoza.
HIPOTIREOZA I MIKSEDEM
Definicija. Hipotireoza je kliničko stanje koje nastaje kao posljedica smanjenoga stvaranja, lučenja i djelovanja hormona štitnjače. Ona može nastati kao posljedica poremećaja same štitne žlijezde (primarna hipotireoza), ali i kao posljedica poremećenoga lučenja tireotropnoga hormona (sekundarna, tercijarna hipotireoza). Kongenitalna hipotireoza prisutna je već kod rođenja i dovodi do razvojnih poremećaja, a potpuno razvijena klinička slika naziva se kretenizam. Termin miksedem i miksedemska koma podrazumijeva tešku hipotireozu koja zahtijeva hitno liječenje jer u protivnom može završiti letalnim ishodom.
Epidemiologija. Hipotireoza je česta bolest štitne žlijezde s prevalencijom od 1 % u općoj populaciji, no u starijoj životnoj dobi ona raste, tako da kod osoba iznad 60 godina iznosi oko 5 %. Češća je pojavnost kod žena.
Etiopatogeneza. Prema uzrocima razlikujemo tireoprivnu ili primarnu hipotireozu koja je posljedica poremećaja na razini same štitne žlijezde te supratireoidnu hipotireozu koja je posljedica poremećenoga lučenja tireotropnoga hormona, bilo uslijed poremećaja i bolesti adenohipofize (sekundarna hipotireoza), bilo hipotalamusa (tercijarna hipotireoza). Kongenitalna hipotireoza danas se prepoznaje već u rodilištu (neonatalni probir) te stoga ne dolazi do razvoja klasične kliničke slike. U kliničkoj praksi najčešći uzroci hipotireoze su autoimune bolesti štitnjače i ijatrogena hipotireoza.
Kongenitalna hipotireoza se javlja s učestalošću od 1 na 4000 novorođenčadi. Ona može biti prolazna ili trajna. Prolazna se javlja kod novorođenčadi majki koje su uzimale antitreocitne lijekove tijekom trudnoće ili imaju TSH-R blokirajuća antitijela koja mogu prijeći posteljicu. Trajna kongenitalna hipotireoza posljedica je disgeneze štitne žlijezde (80 - 85 %), poremećaja sinteze hormona štitne žlijezde (10 - 15 %) te je kod manjega broja novorođenčadi (oko 5 %) posredovana TSH-R antitijelima. S obzirom na visoku učestalost i kliničku težinu, danas se provodi neonatalni probir na kongenitalnu hipotireozu tako da se na vrijeme započinje sa suspstitucijskom terapijom i tako spriječi razvoj klasične kliničke slike te djeca imaju neometan daljnji rast i razvoj.
Autoimune bolesti štitnjače najčešći su uzrok hipotireoze u razvijenim zemljama. Najčešće se radi o Hashimotovom tireoiditisu kod kojega dolazi do T-stanično posredovanoga oštećenja tkiva štitne žlijezde. Glavna karakteristika Hashimotova tireoiditisa je kronična limfocitna infiltracija i razvoj fibroze (krajnja faza Hashimotovoga tireoiditisa – atrofični tireoiditis). Gravesova bolest, koja se inicijalno prezentira kao hipertireoza, u svojoj završnoj fazi dovodi do znatne destrukcije štitne žlijezde s posljedičnim razvojem hipotireoze. I Hashimotov tireoiditis i Gravesova bolest posebno su opisane. Kod takvih bolesnika češće su i druge autoimune bolesti (autoimuna adrenalna insuficijencija, šećerna bolest tip I, atrofični gastritis i perniciozna anemija , sistemska skleroza, vitiligo, celijakija).
Ijatrogena hipotireoza javlja se najčešće kao posljedica liječenja hipertireoze uslijed liječenja radioaktivnim jodom ili nakon tireoidektomije. U prva tri do četiri mjeseca liječenja radioaktivnim jodom razvija se gotovo kod svih bolesnika prolazna hipotireoza koja dobro reagira na niske doze levotiroksina i brzo se povlači. Kod primjene većih doza radioaktivnoga joda može doći i do trajnoga oštećenja štitne žlijezde i razvoja hipotireoze. Također, kod većine bolesnika se nakon suptotalne tireoidektomije razvija prolazna umjereno izražena hipotireoza koja često prolazi i bez liječenja. Totalna tireoidektomija zahtijeva doživotnu suspstituciju levotiroksinom.
Ostali uzroci hipotireoze. Neki maligni tumori (karcinom kolona, bazocelularni karcinom kože, gastrointestinalni stromalni tumor) mogu na svojoj površini izražavati enzim D3 koji može inaktivirati hormone štitne žlijezde te dovesti do tzv. potrošne hipotireoze. Određeni kemoterapeutici mogu uzrokovati tihi tireoiditis koji se najprije očituje hipertireozom (oslobađanje hormona uslijed destrukcije žlijezde) koja obično prolazi neprepoznato da bi se nakon toga postupno razvijala hipotireoza. Takvi kemoterapeutici su inhibitori tirozin kinaze, alfa interferon, talidomid, alemtuzumab, ipilimumab, interleukin 2 i još neki. Amiodaron je također čest uzrok simptomatske hipotireoze kod bolesnika s kroničnom srčanom bolesti (kasnije opisano). Hepatitis C je udružen s povećanim rizikom od nastanka autoimunoga tireoiditisa te razvojem hipotireoze.
Klinička slika hipotireoze ovisi o dobi kada se pojavljuje (mala djeca, starija djeca, odrasli). Pojava kongenitalne hipotireoze danas se odmah dijagnosticira u rodilištu testovima za probir, pa se kretenizam danas gotovo ni ne susreće. Kod odraslih su rani simptomi nespecifični i podmukloga su karaktera.
Klasične manifestacije hipotireoze su umor, malaksalost, psihomotorna usporenost, letargija, depresija, dobivanje na tjelesnoj težini unatoč smanjenom apetitu, slabo podnošenje napora i pojava dispneje pri naporu, artralgije i mijalgije, glavobolja, parestezije, mišićni grčevi, grublji glas, netolerancija hladnoće, pojava Raynaudova fenomena, stanjenje i opadanje kose. Kod žena se javljaju poremećaji menstruacijskoga ciklusa (uglavnom u smislu menometroragije, rjeđe se razvije amenoreja ili oskudne menstruacije). Galaktoreja kod žena je rijetka pojava.
Fizikalni nalaz. Kliničkim pregledom možemo naći bradikardiju, izoliranu dijastoličku hipertenziju, periferne edeme, otečenost lica i kapaka, suhu kožu te stanjene i ispucane nokte, a koža je blijeda ili žućkasta. Produžena je faza relaksacije dubokih tetivnih refleksa. Kod nekih bolesnika može se palpirati uvećana štitna žlijezda (struma), dok je kod nekih smanjena i nepalpabilna (destrukcija tkiva štitne žlijezde).
Miksedem predstavlja potpuno razvijenu, tešku kliničku sliku hipotireoze. S obzirom na to da se danas hipotireoza dijagnosticira u ranijoj fazi, danas je pojava miksedema i miksedemske kome izuzetno rijetka. Miksedem karakterizira tupo bezizražajno lice, prorijeđena kosa, periorbitalni otok, makroglosija, blijeda i hladna koža koja je gruba i gnjecava, a pacijenti postaju stuporozni. Često se razvija hipotermija kao i brojni izljevi u tjelesne šupljine (pleuralnu, perikardijalnu, peritonealnu). Ovo stanje može prijeći u miksedemsku komu, a nju precipitiraju izlaganje hladnoći, trauma, infekcija i primjena nekih lijekova.
Dijagnoza se postavlja na osnovi kliničke slike, laboratorijskih nalaza i slikovnih metoda. S obzirom na to da je hipotireoza relativno česta u općoj populaciji, svim bolesnicima s nejasnim i nespecifičnim simptomima treba odrediti hormone štitne žlijezde te sukladno nalazu vršiti daljnju obradu.
Laboratorijska obrada. Osnovna dijagnostička obrada kod sumnje na hipotireozu uključuje mjerenje serumskoga TSH-a i fT4. Kada je TSH povišen, a fT4 snižen, radi se o potpuno manifestnoj primarnoj hipotireozi. Ako je TSH povišen, a fT4 normalan, radi se o umjereno izraženoj ili supkliničkoj hipotireozi. Normalan ili snižen TSH u kombinaciji sa sniženim fT4 govori o supratireoidnoj hipotireozi (centralna hipotireoza). Interpretacija nalaza prikazana je na Slici 1. Referentne vrijednosti ultrasenzitivnoga TSH-a razlikuju se, ali generalno gledano iznose od 0,4 do 4,0 mU/L. One fiziološki variraju u odnosu na dob, tako da kod starijih bolesnika gotovo uvijek nalazimo blago povišenu razinu. Više od 95 % zdravih osoba ima vrijednosti TSH ispod 3,0 mU/L.
Ostali laboratorijski nalazi mogu uključivati hiponatrijemiju, hipoglikemiju, anemiju, hiperlipidemiju, povišene vrijednosti jetrenih transaminaza i kreatin kinaze. Kod hipotireoze autoimune etiologije mogu se naći pozitivna antitijela na tireoperoksidazu i tireoglobulin. Antinuklearna antitijela (ANCA) također mogu biti pozitivna, ali nisu indikativna za lupus. Kod nekih bolesnika može se naći hiperprolaktinemija.
Slikovne metode. Obično se kod svih bolesnika indicira ultrazvuk vrata i štitne žlijezde uz eventualnu citološku punkciju ili iglenu biopsiju zbog diferenciranja etiologije. U slučaju sumnje na centralnu hipotireozu potrebno je učiniti i MRI hipofize. I kod primarne hipotireoze može se naći lagano uvećana adenohipofiza kao posljedica reverzibilne hiperplazije TSH-sekretornih stanica. Na to treba misliti kod bolesnika s hiperprolaktinemijom kako bi se izbjegla kriva dijagnoza prolaktinoma.
Diferencijalna dijagnoza uključuje neurodegenerativne bolesti svojstvene starijoj životnoj dobi (Alzheimerova bolest, Parkinsonova bolest), psihičke poremećaje (depresivni sindrom), ali i klasične internističke bolesti kao što je uremija, kardijalna dekompenzacija i sl. Diferencijalna dijagnoza patoloških nalaza TSH i fT4 prikazana je u Tablici 7.5.
|
Tablica 7.5. Diferencijalna dijagnoza patoloških nalaza TSH-a i fT4
|
|
Povišen TSH
|
Laboratorijska greška; autoimune bolesti štitnjače; izražena tjelesna aktivnost; oporavak od netireoidnih bolesti; akutna psihijatrijska stanja; starija dob (žene)
|
|
Snižen fT4
|
Laboratorijska greška; akutne psihijatrijske bolesti; ciroza; nefrotski sindrom; teška oboljenja; lijekovi (androgeni, karbamazepin, kortikosteroidi, diklofenak, 5-fluorouracil, sertalin, naproksen)
|
Liječenje. Osnova liječenja je susptitucija hormona štitne žlijezde. U tu svrhu primjenjujemo sintetski levotiroksin. Prije odluke o početku nadomjesnoga liječenja levotiroksinom potrebna je klinička procjena bolesnika u smislu postojanja adrenalne insuficijencije i koronarne bolesti jer levotiroksin može dovesti do pogoršanja kliničkoga stanja tih bolesnika. Zato se prije početka terapije oni moraju ponajprije terapijski zbrinuti, a tek potom započeti liječenje levotiroksinom.
Sintetski levotiroksin je glavni oblik susptitucijskoga liječenja hipotireoze. Kod osoba mlade i srednje životne dobi započinje se liječenje levotiroksinom u dozi od 25 - 75 µg/dan i to manje doze kod slabije izraženih simptoma, a većim dozama treba započeti liječenje kod jače izražene simptomatologije. Doze levotirosina u trudnoći moraju biti više i kreću se oko 100 do 150 µg/dan. Doza se mora prilagođavati vrijednostima TSH-a koji bi trebao biti u vrijednostima između 0,4 mU/L i 2,0 mU/L. Tradicionalno, levotiroksin se uzimao s vodom ujutro prije doručka, no pokazalo se da uzimanje prije spavanja dovodi do bržega i većeg povećanja fT4 i sniženja TSH-a. Bez obzira kada se uzimao (ujutro ili navečer), to bi trebalo biti konzistentno. Nakon početka terapije signifikantan porast fT4 očekuje se za 1 do 2 tjedna s vrhuncem za 3 do 4 tjedna. Doza se povećava svakih 1 do 3 tjedna za 25 µg/dan ovisno o laboratorijskim nalazima (cilj je postizanje eutiroidnoga stanja). Kod starijih bolesnika i kod bolesnika s koronarnom bolesti dnevne doze levotiroksina ne bi trebale prelaziti 50 µg/dan. Koronarnim bolesnicima se preporuča postizanje zadovoljavajuće perfuzije miokarda prije početka terapije (koronarografija, perkutana koronarna intervencija ili premoštavanje).
Praćenje bolesnika i doziranje levotiroksina. Redovna klinička i laboratorijska evaluacija bolesnika nužna je za optimalizaciju doze levotiroksina. S obzirom na to da različiti pripravci levotiroksina mogu imati različitu bioraspoloživost (razlike i do 15 %), preporuča se da kada započnemo liječenje preparatom određenoga proizvođača nastavimo stalno istim kod pojedinoga bolesnika. U praćenju ovih bolesnika treba imati na umu da istodobna primjena drugih lijekova ili pojava drugih bolesti i stanja može dovesti do povećanih potreba za levotiroksinom ili će zahtijevati smanjenje doze levotiroksina. Razlog leži u njihovim specifičnim djelovanjima ili interferenciji s metabolizmom levotiroksina u jetri ili apsorpciji iz probavnoga sustava. Lijekovi i stanja koja utječu na doziranje levotiroksina prikazani su u Tablici 7.6.
|
Tablica 7.6. Lijekovi i stanja koja utječu na doziranje levotiroksina
|
|
Potreba za povišenjem doze
|
Lijekovi: karbamazepin, fenobarbital, fenitoin, rifampin, sertalin, amiodaron, preparati željeza, antacidi, orlistat, kalcij, magnezij, kolestiramin, inhibitori protonske pumpe
Bolesti i stanja: celijakija, idiopatska upalna bolest crijeva, intolerancija laktoze, gastritis, žene koje uzimaju oralne kontraceptive ili hormonsko nadomjesno liječenje, trudnoća
|
|
Potreba za snižavanjem doze
|
Lijekovi: teduglutid (terapija sindroma kratkog crijeva), kod bolesnika tijekom liječenja GnRH agonistima (hormon koji oslobađa gonadotropin)
Bolesti i stanja: kod žena u stanjima nagloga sniženja estrogena (postpartalno, nakon ovariektomije, nakon prekida hormonskoga liječenja
|
Povišene vrijednosti TSH-a sugeriraju povećanje doze levotiroksina. Ipak, prije nego se povisi doza levotiroksina treba obratiti pažnju na nekoliko stvari: uzima li bolesnik lijek prema uputama, uzima li bolesnik neki od lijekova koji utječe na apsorpciju ili metabolizam levotiroksina te ima li bolesnik neku od bolesti probavoga sustava koja ometa normalnu apsorpciju. Također, TSH može biti prolazno povišen kod akutnih psihijatrijskih poremećaja, uslijed primjene antipsihotika te u fazi oporavka od netireoidinih bolesti. Kod jako povišenoga TSH-a treba pomišljati i na tumor hipofize.
Normalne vrijednosti TSH-a mogu biti praćene povlačenjem simptoma kod bolesnika što onda označavamo kao eutiroidno stanje te kod bolesnika nastavljamo liječenje istom dozom levotiroksina. Neki bolesnici s normalnim vrijednostima TSH-a još uvijek mogu imati simptome hipotireoze, osobito ako su vrijednosti TSH-a na gornjoj granici referentnih vrijednosti ili je koncentracija fT3 još uvijek snižena. Kod ovih bolesnika može biti opravdano povećanje doze levotiroksina.
Niske vrijednosti TSH-a obuhvaćaju dva stanja: stanje sniženih vrijednosti TSH-a (0,04 - 0,4 mU/L) i stanje supresije TSH-a (≤ 0,03 mU/L). Kod bolesnika sa suprimiranim TSH-om potrebno je reducirati dozu levotiroksina i dalje klinički pratiti (kod ovih bolesnika zabilježena je velika učestalost atrijske fibrilacije i osteoporoze). Kod bolesnika sa sniženim TSH-om bez simptoma potrebna je klinička evaluacija u smislu procjene postojanja stanja ili uzimanja lijekova koji mogu dovesti do sniženja TSH-a (hipopituitarizam, netireoidna teža bolest, nesteroidni protuupalni lijekovi, opioidi, nifedipin, verapamil, visoke doze kortikosteroida). U slučaju nedostatka ovih stanja bolesnicima se može sniziti doza levotiroksina. U slučaju da se kod takvih bolesnika ponovno vrate simptomi hipotireoze, bit će porebno ponovno povisiti dozu levotiroksina. Kod bolesnika sa sniženim TSH-om koji još uvijek imaju simptome hipotireoze potrebno je odrediti fT3 te je opravdano je povisiti dozu levotiroksina ako je on snižen. Kod bolesnika sa sniženim TSH-om (0,04 - 0,4 mU/L) koji su asimptomatski i dobro se osjećaju nije potrebno mijenjati dozu levotiroksina.
Prognoza. Načelno gledano, uz medikamentnu supstitucijsku terapiju prognoza je vrlo dobra. Bolesnici sa srednje teško izraženom hipotireozom uzrokovanom Hashimotovim tireoiditisom imaju 11 %-tnu stopu remisije. Neliječeni bolesnici kod kojih se razvije miksedemska kriza imaju visoku stopu smrtnosti unatoč intenzivnom liječenju (20 - 50 %).
Supklinička hipotireoza definira se kao stanje povišenih vrijednosti TSH-a uz uredne vrijednosti fT4. Takvo stanje češće nalazimo kod osoba iznad 65 godina, kada se navodi da je prevalencija i do 13 %. Obično se radi o prolaznoj pojavi te se razina TSH-a normalizira unutar dvije godine. Normalizacija nalaza TSH-a češća je kod osoba koja nemaju antitireoidna antitijela. Kod takvih bolesnika ne nalazimo simptome, eventualno su blago izraženi u smislu umora, malaksalosti i psihomotorne usporenosti. Kod tih se bolesnika zamjećuje klinički oporavak kod supstitucije levotiroksinom. Asimptomatske bolesnike ne treba liječiti, nego samo laboratorijski pratiti.
Miksedemska kriza podrazumijeva najteži oblik kliničkoga očitovanja hipotireoze. Obično se razvija kod starijih žena koje su naglo prestale uzimati supstitucijsku terapiju levotiroksinom ili su razvile cerebrovaskularni inzult. Ostali predisponirajući faktori su teške infekcije, akutna kardiopulmonalna oboljenja te izlaganje jakoj hladnoći. Klinička prezentacija uključuje poremećaj svijesti od somnolencije do kome (miksedemska koma), hipotermiju, hipoventilaciju, hiponatrijemiju, hipoglikemiju, hipotenziju i rabdomiolizu. Bolesnici imaju tipična fenotipska obilježja hipotireoze. Dijagnoza se postavlja na osnovi anamnestičkih podataka, kliničkoga nalaza te laboratorijskih pretraga (najvažnije su vrijedosti TSH-a i fT4 uz ostale popratne patološke nalaze). Liječenje se provodi u jedinicama intenzivnoga liječenja, a uz simptomatsku terapiju najvažnije je započeti liječenje supstitucijom hormona. Supstitucijsko liječenje mora biti intenzivirano, levotiroksin se daje najprije u bolusu od 400 µg intravenski (doza zasićenja), a zatim se nastavlja 50 - 100 µg/dan intravenski dok bolesnik ne može uzimati peroralne preparate levotiroksina. Kod bolesnika s razvijenom miksedemskom komom daje se i liotironin (sintetski T3), i to u dozi od 5 - 10 µg svakih 8 sati kroz prvih 48 sati liječenja. Bolesnike s hipotermijom treba utopljavati postupno i s oprezom jer naglo utopljavanje može dovesti do razvoja kardiovaskularnoga kolapsa. Hipoventilacija i hiperkapnija zahtijevaju endotrahealnu intubaciju i mehaničku ventilaciju. Kod sumnje na infekcije potrebno je primjeniti odgovarajuće antibiotike. Ako sumnjamo da bolesnik ima i adrenalnu insuficijenciju, naprije moramo dati 100 mg hidrokortizona intravenski, a potom nastaviti 25 - 50 µg svakih 8 sati. Poseban problem su bolesnici s miksedemskom krizom i koegzistirajućom koronarnom bolesti kod kojih se mora započeti intenziviranu supstitucijsku terapiju uz velike mjere opreza.
TIREOTOKSIKOZA I HIPERTIREOZA
Definicija. Tireotoksikoza je naziv sa sve kliničke, fiziološke i biokemijske nalaze koji nastaju kao posljedica izloženosti i odgovora tkiva na prekomjernu količinu hormona štitnjače. Hipertireoza kao termin se treba upotrebljavati samo onda kada je tireotoksikoza posljedica pojačanoga stvaranja i izlučivanja hormona iz štitnjače jer tireotoksikozu mogu uzrokovati i druga stanja (npr. oslobađanje ranije stvorenih hormona iz štitnjače uslijed upale ili zbog lučenja horomona izvan štitnjače – metastatski tumori štitnjače, struma jajnika i sl.). Bolest se može javiti u svim dobnim skupinama, a češća je kod žena.
Etiopatogeneza. Najčešće tireotoksikoze kod nas su Gravesova bolest, toksični adenom i toksična multinodozna struma. Ostali, rjeđi uzroci su: lijekovi, akutni i subakutni tireoiditis (prolazna hipertireoza), metastaze diferenciranoga karcinoma štitnjače, tumori ovarija (struma ovarii), mola hidatidoza, koriokarcinom, tumor hipofize koji luči TSH te hipofizna rezistencija na hormone štitnjače.
Gravesova (Basedowljeva) bolest je autoimuna bolest štitne žlijezde koju karakterizira pojačana sinteza i otpuštanje hormona štitnjače. To je ujedno i najčešći uzrok tireotoksikoze u razvijenim zemljama. Bolest je češća kod žena nego kod muškaraca s odnosom 8:1, a najčešće se javlja u dobi između 20. i 40. godine. Osim poremećaja štitne žlijezde bolest karakteriziraju i infiltrativna oftalmopatija (egzoftalmus) te infiltrativna dermatopatija (pretibijalni edemi). Patogeneza hipertireoze povezena je s postojanjem autoantitijela koja imaju sposobnost vezanja na TSH receptore tireocita što ih potiče na stvaranje i lučenje hormona (TSH stimulirajuća antitijela – TSH-RSAb). Ovi bolesnici imaju povećan rizik za razvoj i drugih autoimunih bolesti. Više o bolesti opisano je u poglavlju o upalnim i autoimunim bolestima štitne žlijezde.
Autoimuno stvaranje hormona štitne žlijezde najčešće se susreće kod toksičnoga adenoma i toksične multinodozne strume. Toksični adenom je dobroćudni tumor štitnjače koji ima sposobnost autonomne sinteze i lučenja hormona te tako dovodi do hipertireoze. Toksična multinodozna struma je čvorasto povećanje štitnjače netumorskoga i neupalnoga porijekla praćeno pojačanom produkcijom hormona. Oba stanja karakterizira autonomnost u produkciji hormona štitnjače nevezano uz fiziološku hormonsku regulaciju.
Lijekovima inducirana tireotoksikoza manje je čest uzrok tireotoksikoze u kliničkoj praksi, ali može se susresti kod nekih bolesnika. Lijekovi koji se najčešće spominju u tom kontekstu su amiodaron i preparati joda, inhibitori tirozin kinaze te alemtuzumab. Amiodaron je jedan od najčešćih lijekova koji se povezuje s pojavom tireotoksikoze. Razlikujemo dva tipa amiodaronom uzrokovane tireotoksikoze: tip 1 (poticanje štitne žlijezde na aktivnu produkciju hormona, žlijezda je povećana i pojačano prokrvljena) te tip 2 (povećano otpuštanje hormona posljedica je upale same žlijezde i pasivnoga otpuštanja hormona). Obično se kroz prva tri mjeseca od početka terapije bilježi porast serumskoga TSH-a i fT4, no nakon toga dolazi do normalizacije TSH-a. Ako nakon toga fT4 ostane povišen uz snižen TSH, govorimo o amiodaronom induciranoj hipertireozi. Zbog toga je potrebno češće praćenje funkcije štitne žlijezde kod bolesnika na terapiji amiodaronom (preporučeno je svakih 6 mjeseci). Preparati joda također su česti uzročnici tireotoksikoze. Preporučeni dnevni unos joda kod odraslih osoba iznosi oko 150 µg/dan te unos većih količina joda može uzrokovati pojavu hipertireoze kod bolesnika koji imaju koegzistentnu asimptomatsku tiroidnu bolest (struma, adenom, autoimune bolesti), a rjeđe ju može izazvati i kod osoba bez koegzistentne tireoidne bolesti. Povećan unos joda najčešće je povezan s radiološkim kontrastnim pretragama gdje se jod koristi kao kontrastno sredstvo (Jod-Basedowljeva bolest).
Ostali, rjeđi uzroci tireotoksikoze. Upale štitne žlijezde dovodi do prolaznoga povišenja hormona zbog oštećenja tkiva i osobađanja hormona koji su ranije stvoreni i pohranjeni. Struma ovarii predstavlja teratom ovarija koji između ostaloga sadrži i tkivo štitnjače koje ima sposobnost stvaranja i lučenja hormona. Mola hidatidoza i koriokarcinom predstavljaju stanja u kojima dolazi do lučenja velike količine hCG-a koji može stimulirati štitnjaču na proizvodnju hormona. Tireotoksikoza može biti i posljedica pojačanog lučenja TSH-a iz hipofize (adenom).
Klinička slika tireotoksikoze uključuje klasične simptome i znakove koji su svojstveni za sve oblike tireotoksikoze bez obzira na etiologiju, a oni su često nespecifični u početku bolesti. Javljaju se i simptomi i znakovi koji su vezani uz uzročnu bolest/stanje koje je dovelo do tireotoksikoze što pomaže u diferencijaciji etiologije. Kardiopulmonalne manifestacije nalazimo kod gotovo svih bolesnika s razvijenom kliničkom slikom pa se često zasebno i opisuju.
Klasične kliničke manifestacije tireotoksikoze su nervoza, emocionalna labilnost, insomnija, tremor, proljevi, pretjerano znojenje i nepodnošenje vrućine. Bolesnici su dobroga ili pojačanog apetita, ali unatoč tome gube na težini. Žene u premenopauzi sklone su oligomenoreji i amenoreji. Kod starijih osoba javi se dispneja, pogoršanje srčane bolesti i sl. Česta pojava je i slabost proksimalne muskulature. Općenito, kod mlađih osoba dominiraju neurološki simptomi, dok kod starijih dominiraju kardiovaskularni i miopatski simptomi.
Fizikalni nalaz ovih bolesika dosta je specifičan. Koža je topla i vlažna, a često nalazimo palmarni eritem dlanova. Karakterističan nalaz je i odvajanje nokta od njegovoga ležišta (tzv. Plummerov nokat). Pregledom kardiovaskularnoga sustava možemo otkriti tahikardiju u mirovanju, sistoličku hipertenziju, periferno dobro punjen puls, a čest auksultacijski nalaz je sistolički šum nad prekordijem. U neurološkom pregledu zapažamo fini tremor ruku i jezika, slabost proksimalnih mišića te hiperrefleksiju.
Specifične manifestacije povezane s etiologijom. S obzirom na to da je Gravesova bolest najčešći uzrok tireotokisikoze, potrebno je poznavati i njezine druge kliničke manifestacije, kao što je infiltrativna oftalmopatija i dermatopatija. Oftalmopatiju nalazimo kod 20 - 40 % bolesnika s Gravesovom bolesti, a nešto rjeđe se može naći kod bolesnika s amiodaronom induciranom tireotoksikozom. Oftalmopatija se očituje konjuktivalnim edemom (kemoza), konjuktivitisom te različito izraženim stupnjem egzoftalmusa. Pritisak na optički živac dovodi do ispada osjeta vida (diplopije, slabljenje vida i sl.). Rijetko, promjene mogu biti unilateralne. Infiltrativnu dermatopatiju nalazimo kod 3 - 5 % bolesnika s Gravesovom bolesti, a očituje se kao otok pretibijalne regije uslijed akumulacije glikozaminoglikana. Zahvaćeno područje je ograničeno, izdignuto, zadebljano i ima izgled narančine kore.
Kardiopulmonalne manifestacije. Poremećaji srčanoga ritma česti su kod ovih bolesnika. Sinusna tahikardija, atrijska tahikardija i fibrilacija atrija mogu se naći kod oko 8 % bolesnika. Karakteristika fibrilacije atrija je otežana kontrola frekvencije ventrikula. Tireotoksikoza može biti precipitirajući faktor u razvoju srčanoga popuštanja, osobito ako se radi o već postojećim kardijalnim bolesnicima (tireotoksična kardiomiopatija). Ehokardiografski se kod 40 - 50 % bolesnika mogu pronaći indirektni znaci plućne hipertenzije. Hemodinamske abnormalnosti poput plućne hipertenzije reverzibilnoga su karaktera i poboljšavaju se nakon postizanja eutireoidnoga stanja.
Dijagnoza se postavlja na osnovi anamneze, kliničkoga nalaza te laboratorijskih nalaza i slikovnih metoda prikaza štitne žlijezde u svrhu diferenciranja etiologije. Kod svih bolesnika sa sumnjom na hipertireozu potrebno je odrediti TSH i fT4 u serumu kao prvi korak u dijagnostičkom postupku.
Određivanje hormona štitne žlijezde. Osnovni laboratorijski probir kod sumnje na tireotoksikozu podrazumijeva određivanje serumskoga TSH-a i fT4. Nalaz sniženoga TSH-a uz povišen fT4 govori o klasičnoj tiretoksikozi. Kombinacija sniženoga TSH-a uz normalan fT4 ukazuje na supkliničku hipertireozu, T3 tireotoksikozu ili netiroidnu bolest. Normalan ili povišen TSH uz povišen fT4 govori u prilog centralnoj hipertireozi te sindromu rezistencije na hormone štitnjače. Na Slici 2 prikazana je interpretacija nalaza hormona štitnjače. Problem kod interpretacije ovih nalaza predstavljaju bolesnici s akutnim psihijatrijskim poremećajima s obzirom na to da oko 30 % tih bolesnika ima povišenu razinu fT4 bez klinički jasne tireotoksikoze. Ipak, kod tih bolesnika TSH obično nije suprimiran. Kod njih se postupno i vrijednosti fT4 vraćaju u normalu.
Ostali laboratorijski nalazi. Ostali patološki nalazi mogu uključivati hiperkalcijemiju i/ili hiperkalciuriju, povišene vrijednosti alkalne fosfataze, anemiju, umjereno povišene vrijednosti jetrenih transaminaza, snižene vrijednosti lipida ili vrijednosti na donjoj granici referentnih vrijednosti. Povremeno se mogu registrirati i hipokalijemija i hipofosfatemija što može uzrokovati periodične paralize. Kod Gravesove bolesti detektibilna TSH-stimulirajuća protutijela (TSH-RSAb) nalazimo kod 65 % bolesnika. Mogu se naći pozitivna i antitireoglobulinska i antitireoperoksidazna antitijela, ali su nespecifična. Kod nekih bolesnika pozitivna su antinuklearna antitijela (ANCA), ali oni nemaju veze s lupusom ili nekom drugom autoimunom bolesti.
Slikovne dijagnostičke metode. Ultrazvuk štitne žlijezde koristan je za proučavanje morfologije štitne žlijezde i uočavanje mogućih uzroka hipertireoze (toksični adenom, multinodozna struma i dr.), a koristan je i za razlikovanju tipa amiodaronom inducirane tireotoksikoze (u tipu 1 štitnjača je povećana i dobro prokrvljena, dok je u tipu 2 prokrvljenost smanjena). Sumnjive čvorove treba citološki punktirati ili bioptirati. Scintigrafija radioaktivnim jodom koristi se za praćenje nakupljanja joda u tkivu štitne žlijezde. Povećano nakupljanje joda vidi se pri bolestima koje su praćene povećanim stvaranjem hormona (povećana proizvodnja), kao što je Gravesova bolest i toksična multinodozna struma, dok je smanjeno nakupljanje joda karakteristično za bolesti kod kojih nalazimo povećano otpuštanje uskladištenih hormona u samoj žlijezdi (tireoiditis).
Liječenje hipertireoze ponajprije ovisi o samom uzroku, ali načelno gledano podrazumijeva nekoliko oblika: medikamentno liječenje, liječenje radioaktivnim jodom te operativno liječenje. Medikamentno liječenje podrazumijeva simptomatsko liječenje neselektivnim beta blokatorima (propranolol), antitireoidnim lijekovima (metimazol, propiltiouracil) te preparatima joda.
Beta blokatori. S obzirom na to da hormoni štitne žlijezde povećavaju izražaj beta adrenergičkih receptora u mnogim tkivima i organima (srčani mišić, skeletni mišići, masno tkivo, limfociti), beta blokatori su lijekovi izbora za ublažavanje osnovnih simptoma tireotoksikoze (palpitacije, tremor, anksioznost i sl.). Kako se povećava izražaj i β1 i β2 receptora preporuča se primjena neselektivnih u odnosu na selektivne beta blokatore jer oni, osim što djeluju na srce (smanjenje frekevncije i kontraktilnosti), povoljno djeluju i na smanjenje metaboličkih zbivanja. Primjena beta blokatora, osobito neselektivnih, mora biti s posebnim oprezom kod bolesnika sa srčanim zatajenjem, kroničnom opstruktivnom plućnom bolesti te Raynaudovim fenomenom. Lijek izbora je neselektivni beta bloktor – propranolol. Uobičajena polazna doza propranolola je 20 do 40 mg svakih 8 sati te se može postupno povisivati svaka 2 do 3 dana ovisno o odgovoru bolesnika sve do najveće preporučene doze od 240 mg na dan. Početno više doze kasnije se mogu smanjivati kako postižemo bolju kontrolu bolesti. Propranolol osim svojih klasičnih antiadrenergičkih učinaka ima i djelomičan učinak na smanjenje ekstratireoidne konverzije T4 u T3 što daje dodatni učinak liječenju. U novijoj literaturi preporuča se i primjena dugodjelujućih oblika propranolola (propranolol ER 60 mg jednom ili dva puta na dan). Drugi, rjeđe korišteni beta blokatori pri ovoj indikaciji su atenolol i propranolol, a u težim slučajevima kada se zahtijeva učinkovitije i brže djelovanje ovih lijekova u obzir dolazi i intravenska primjena esmolola. Za bolesnike s prolaznim oblicima tireotoksikoze (subakutni tireoiditis, autoimuni tireoiditis, egzogeni unos hormona) terapija beta blokatorima može biti i jedini oblik liječenja koji će biti potreban.
Antitireoidni lijekovi koji se primjenjuju u liječenju tireotoksikoze su lijekovi iz skupine tionamida: metimazol i propiltiouracil. To su lijekovi koji ometaju fiziološke puteve biosinteze hormona štitnjače te tako ometaju njihovu prozvodnju i primjenjuju se kod tireotoksikoze uzrokovane pojačanom produkcijom tireoidnih hormona. Kod primjene ovih lijekova treba imati na umu da oni blokiraju sintezu novih hormona, a nemaju utjecaj na već stvorene i pohranjene hormone u samoj žlijezdi tako da do potpunoga učinka smanjenoga lučenja hormona nekada mora proći i do osam tjedana od početka liječenja. S obzirom na to da ovi lijekovi ne dovode do destrukcije same žlijezde, manja je pojava hipotireoze poslije liječenja, ali je zato prati visok postotak recidiva hipertireoze (i do 50 %) nakon prestanka uzimanja lijekova. Kod primjene ovih lijekova potrebna je kontrola hormona štitnjače svakih 3 do 12 tjedana, osobito u vrijeme titracije doze kako bi se izbjegla ijatrogena hipotireoza. Najčešće nuspojave su osip, svrbež, vrućica te artralgije, a pogađaju oko 5 % bolesnika. Osip i svrbež dobro reagiraju na antihistaminike. Teže, ali rjeđe nuspojave su agranulocitoza, pancitopenija te nekrotizirajući hepatitis. Pojava ovih komplikacija je nagla, iznenadna i nepredvidiva tako da ni učestala kontrola krvne slike i jetrenih transamniaza nije od veće kliničke koristi.
Metimazol je lijek izbora te mu se daje predost u liječenju tireotoksikoze u odnosu na propiltiouracil, osim u prvom tromjesečju trudnoće. Primjenjuje se peroralno i to u inicijalnim dozama od 30 do 60 mg jednom na dan. Kod bolesnika s umjerenom hipertireozom može se početi inicijalno s nižim dozama i to 10 do 20 mg na dan. Ako ga probavni sustav teže podnosi, potrebna količina može se podijeliti u dvije dnevne doze. Metimazol je češće povezan s fetalnim anomalijama u odnosu na propiltiouracil, ali može se primijeniti u slučaju nepodnošenja propiltiouracila, samo uz objašnjen rizik. Ako se primjenjuje tijekom trudnoće ili dojenja, doza ne smije biti veća od 20 mg na dan. Doza metimazola se smanjuje kada dođe do poboljšanja simptoma i normalizacije fT4 hormona. Ako se planira nastavak liječenja radioaktivnim jodom, metimazol treba isključiti četiri dana prije terapije te uključiti tri dana nakon terapije, sve kako bi se smanjio rizik od nastanka hipotireoze. Ako se nakon četiri tjedna od terapije radioaktivnim jodom postigne eutireoidno stanje, iz terapije se može izostaviti i metimazol.
Propiltiouracil ima veću prednost u primjeni u odnosu na metimazol za vrijeme trudnoće i dojenja jer je povezan s nižom stopom fetalnih anomalija i jer se slabije luči putem majčina mlijeka. Inače, inicijalne doze propiltiouracila su 300 do 600 mg na dan podijeljeno u četiri doze. Doza i učestalost primjene smanjuju se s poboljšanjem simptoma i normalizacijom fT4. Tijekom trudnoće doza ne bi trebala prelaziti 200 mg na dan.
Preparati joda (jodidi) mogu biti korisni kao privremena terapija teških oblika tireotoksikoze. Radi se o preparatima koji se uglavnom koriste kao kontrastna sredstva pri radiološkim pretragama. Njihov učinak temelji se na inhibiciji periferne konverzije T4 u T3. Primjenom ovih preparata razina T3 može pasti za više od 50 % unutar 24 sata. Unose se preoralno, 500 mg dva puta na dan tijekom tri dana, a potom se nastavlja s 500 mg jednom na dan. Koristi se u liječenju tireotoksične krize, a koristan je i u liječenju tireotoksikoze uzrokovane subakutnim tireoiditisom, amiodaronom inducirane tireotoksikoze te kod bolesnika kod kojih je terapija antitireoidnim lijekovima kontraindicirana. Duljina terapija u razdoblju dužem od 8 mjeseci je moguća, ali se učinkovitost terapije smanjuje s vremenskim odmakom.
Ostali lijekovi u liječenju tireotoksikoze. Zasićena otopina kalijeva jodida ili Lugolova otopina dovodi do prolazne inhibicije sinteze i otpuštanja tiroidnih hormona. Obično se koristi kao priprema bolesnika za tireoidektomiju te kao dodatak drugim lijekovima tijekom liječenja teške tireotoksikoze zbog postizanja boljega učinka. Litijev karbonat također može prolazno inhibirati oslobađanje tireoidnih hormona pa se i on može kombinirati s drugim lijekovima u liječenju teških oblika tireotoksikoze. Kolestiramin u crijevima može na sebe vezati tireoidne hormone i tako spriječiti enterohepatičko kruženje.
Liječenje radioaktivnim jodom dovodi do progresivne destrukcije tireocita te se može koristiti kao inicijalna terapija u liječenju tireotoksikoze ili kod nepostizanja željenih rezultata pri primjeni antitireoidnih lijekova. Mehanizam djelovanja uključuje unos radioaktivnoga joda u tireocite koji potom emitiraju gama zrake koje dovode do lokalne destrukcije tkiva štitne žlijezde. Dosadašnja istraživanja nisu pokazala veću incidenciju malignih oboljenja kod osoba koje su liječenje radioaktivnim jodom. Također, nije zapažena veća pojavnost kongenitalnih anomalija kod žena koje su prethodno liječene radioaktivnim jodom (preporuča se da se ova terapija ne primjenjuje barem tri mjeseca prije planiranoga začeća). Primjena metimazola i propiltiuracila povezana je s nešto lošijim ishodima liječenja radioaktivnim jodom. Ako su bolesnici tretirani tim lijekovima, oni se moraju izostaviti najmanje četiri dana prije početka liječenja radioaktivnim jodom kako bi se osigurao dostatan unos joda u tireocite. Relativna kontraindikacija za primjenu ovoga načina liječenja prisutnost je Gravesove oftalmopatije jer je zabilježeno njezino pogoršanje kod 15 do 20 % bolesnika, osobito pušača. Profilaktičkom primjenom prednizona u dozi 20 - 40 mg/dan u trajanju od dva mjeseca nakon terapije smanjuje se negativni učinak radioaktivnoga joda na pogoršanje oftalmopatije. Unutar dva mjeseca od početka liječenja radioaktivnim jodom dolazi do pada razine fT4, no nakon toga se ponovno bilježi porast što se ne smije tumačiti kao neuspjeh terapije jer to povišenje uzrokovano otpuštanjem pohranjenih hormona koje nastaje kao posljedica destrukcije tireocita. Kada se potroše rezerve hormona dolazi do ponovnoga pada razine hormona prema eutiroidnom ili hipotiroidnom stanju. Učestalost hipotireoze nakon liječenja radioaktivnim jodom je velika. Liječenje radioaktivnim jodom u nadležnosti je specijalista nuklearne medicine.
Operacijsko liječenje (tireoidektomija, lobektomija) kao metoda liječenja hipertireoze preporuča se kod toksičnoga adenoma, toksične multinodozne strume, osobito kod mlađih osoba. Također predstavlja izbor liječenja tireotoksikoze kod trudnica koje ne reagiraju na liječenje niskim dozama antitireoidnih lijekova. Operativno liječenje u slučaju Gravesove bolesti preporuča se samo ako je druga terapija kontraindicirana ili ne polučuje očekivani rezultat.
Liječenje posebnih stanja. Sinusna tahikardija koja se najčešće javlja kod ovih bolesnika dobro reagira na primjenu propranolola. Fibrilacija atrija s brzim odgovorom ventrikula predstavlja problem jer se teško održava kontrola frekvencije ventrikula. Elektrokonverzija ima malen uspjeh u postizanju sinusnoga ritma dok je pacijent u hipertireozi. Spontana konverzija u sinusni ritam dokumentira se kod 50 do 60 % bolesnika nakon postizanja eutireoze, ali kod gotovo polovice bolesnika dolazi do ponovnih paroksizama fibrilacije atrija. Kod takvih bolesnika može se pokušati elektivna kardioverzija nakon provedene antikogulacije. Ako se ne postiže sinusni ritam, potrebno je održavati kontrolu frekevncije ventrikula što se postiže primjenom beta blokatora, a ako se to ne dogodi, indicirana je i primjena digoksina. Peroralna antikoagulantna terapija indicirana je u sljedećim stanjima: uvećan lijevi atrij, globalna ventrikularna disfunkcija, srčano popuštanje, hipertenzija, rekurentna fibrilacija atrija te raniji tromboembolijski incidenti. Potrebne doze varfarina kod ovih bolesnika za postizanje ciljnoga PV-a obično su niže (uslijed ubrzanoga klirensa vitamina K) te se s oporavkom moraju povećavati kako bi se postigla optimalna antikoagulacija. Tireotoksična hipokalijemijska paraliza dobro reagira na primjenu propranolola (3 mg/kg peroralno), a poboljšanje je vidljivo već kroz nekoliko sati. Nadoknada kalija i fosfata nije pokazala uspjeha. Liječenje treba nastaviti s propranololom 60 - 80 mg svakih osam sati.
Terapijski pristup. Kod bolesnika s Gravesovom bolesti medikamentna treapija antitireoidnim lijekovima s ili bez radioaktivnoga joda predstavlja osnovu liječenja, dok se operacijsko liječenje primjenjuje u slučaju neuspjeha konzervativne terapije. Ako se sumnja na malignitet kod bolesnika s toksičnim adenomom, indicirana je operativna metoda liječenja, kao i kod bolesnka s toksičnim adenomom koji su mlađi od 40 godina ili stariji, ali dobroga općeg stanja. Kod starijih od 40 godina ili kod osoba lošijega zdravlja (postoji veći operacijski rizik) preporuča se liječenje radioaktivnim jodom. Liječenje toksične multinodozne strume slično je liječenju Gravesove bolesti s time da je operativni zahvat indiciran kod bolesnika s velikom strumom koja predstavlja i kozmetičke probleme, ali nosi i rizik od kompresije okolnih anatomskih struktura.
Tireoidna kriza ili oluja predstavlja rijedak, izrazito težak oblik tiretoksikoze koji je obično potaknut nekim stresnim događajem, najčešće nakon operacije štitne žlijezde ili primjene radioaktivnoga joda kada dođe do pojačanoga oslobađanja uskladištenih hormona iz destruirane žlijezde. Tireoidna kriza očituje se poremećajima svijesti, delirijem, teškom tahikardijom, povraćanjem, proljevom, dehiracijom i izraženom vrućicom. Liječenje se provodi u jedinicama intenzivnoga liječenja, a unatoč svim mjerama liječenja, stopa smrtnosti je visoka. Medikamentno liječenje uključuje sljedeće lijekove: propranolol (0,5 - 2 mg intravenski svaka 4 sata ili 20 - 120 mg peroralno svakih 6 sati); hidrokortizon (50 mg peroralno svakih 6 sati s redukcijom doze nakon stabilizacije stanja); metimazol (15 - 25 mg peroralno svakih 6 sati) ili propiltiouracil (150 - 250 mg peroralno svakih 6 sati). Dodatno se mogu primijeniti i pripravci joda (500 mg/dan) i Lugolova otopina (10 kapi tri puta na dan). Po stabilizaciji stanja potrebno je provesti liječenje radioaktivnim jodom (stariji bolesnici) ili operacijom (mlađi bolesnici).
UPALE ŠTITNE ŽLIJEZDE
Upala štitne žlijezde (tireoiditis) dijeli se u odnosu na klinički tijek na akutni, subakutni i kronični oblik kako je to navedeno u Tablici 7.7.
|
Tablica 7.7. Najčešći oblici upale štitnjače
|
|
Akutni tireoiditis
|
Subakutni tireoiditis
|
Kronični tireoiditis
|
|
Bakterijski akutni tireoiditis
Gljivični akutni tireoiditis
Postradijacijski akutni tireoiditis
|
Subakutni granulomatozni tireoiditis
Subakutni limfocitni tireoiditis
Lijekovima induciran tireoiditis
|
Kronični autoimuni tireoiditis
Kronični Riedelov tireoiditis
Parazitarni kronični tireoiditis
|
U daljnjemu tekstu bit će opisani najčešći oblici upale štitne žlijezde: akutni tireoiditis, subakutni granulomatozni tireoiditis, subakutni limfocitni tireoiditis te kronični autoimuni tireoiditis.
AKUTNI TIREOIDITIS
Definicija i etiologija. Akutni tireoiditis označava akutnu upalu štitne žlijezde koju najčešće uzrokuju bakterije (Staphylococcus, Streptococcus, Enterococcus) i gljivice (Aspergillus, Candida, Histoplasma), a može se javiti i nakon radijacije vratne regije (akutni postradijacijski tireoiditis). Najčešće se radi o širenju infektivnoga procesa iz okolnih struktura, a rjeđe se radi o hematogenoj diseminaciji ili prodoru uzročnika preko oštećenja kože.
Klinička slika. Klinički nalazimo opće infektivne simptome, otok, bolnost te hiperemiju kože vrata, a nekada se može razviti i apsces kojega karakterizira fenomen fluktuacije ili fistulacija pri čemu dolazi do pojave gnojne sekrecije u području otvora fistule na koži vrata. Ako nalazimo oštećenje većega dijela štitne žlijezde, moguća je i prolazna klinička slika hipertireoze uslijed pojačanoga otpuštanja hormona iz oštećenoga tkiva žlijezde.
Dijagnoza se postavlja na osnovi anamneze, kliničkoga nalaza (uvećana i bolna štitna žlijezda) te osnovnih laboratorijskih nalaza u kojima nalazimo leukocitozu s neutrofilijom, povišen C-reaktivni protein te ubrzanu sedimentaciju eritrocita. U početnoj fazi bolesti mogu se naći povišeni T3 i T4 uz tranzitorno snižen TSH.
Terapija se sastoji od općih mjera (antipireza, salicilati, analgetici), antimikrobne terapije (antibiotici širokoga spektra, antimikotici), a kod apscesa je nekada potrebna i kirurška intervencija (incizija i drenaža gnojne kolekcije).
SUBAKUTNI GRANULOMATOZNI TIREOIDITIS
Definicija. Subakutni granulomatozni tireoiditis (de Quervain tireoiditis) označava prolazni oblik upale štitne žlijezde koji se obično javlja neposredno nakon virusne infekcije gornjih dišnih puteva, a karakterizira ga granulomatozna reakcija s pojavom multinuklearnih divovskih stanica. Bolest se češće javlja kod žena i to u dobi između tridesete i pedesete godine života.
Etiopatogeneza. Točan etiopatogenetski mehanizam nastanka bolesti nije poznat, ali s obzirom na to da se gotovo isključivo javlja nakon virusnih infekcija koje uzrokuju različiti virusi (Coxsackie virusi, adenovirusi, virusi influenze, virus mumpsa) sugerira na njihovu značajnu ulogu u inicijaciji patološkoga procesa. Osim toga, češće se razvija kod osoba koje već imaju neku od autoimunih bolesti, a slično stanje mogu izazvati i neki lijekovi kao što su litij i interferon-α. Uslijed oštećenja tkiva štitne žlijezde početno dolazi do pojačanoga otpuštanja hormona u krv što traje do nekoliko tjedana kada dolazi do postupnoga smanjenja stvaranja hormona što traje sve dok se bolest ne povuče, a štitna žlijezda regenerira (i do nekoliko mjeseci).
Klinička slika. Osnovna klinička manifestacija subakutnoga granulomatoznog tireoiditisa je uvećana i bolna štitna žlijezda koja je udružena sa srednje izraženim sistemskim manifestacijama kao što su vrućica i slabost. Bolesnici obično opisuju bol u području prednje strane vrata koji se širi prema grlu, donjoj čeljusti te uhu, a pojačava se prilikom gutanja, kašljanja i pokreta vrata. Uz to, u prvoj fazi bolesti dominiraju znaci prolazne hipertireoze, nakon čega slijedi faza hipotireoze koja postupno spontano prolazi.
Dijagnoza. Anamneza daje podatke o prethodnoj virusnoj infekciji, autoimunom oboljenju ili uzimanju lijekova, dok fizikalnim pregledom nalazimo uvećanu i bolnu štitnu žlijezdu. U laboratorijskim nalazima nalazimo ubrzanu sedimentaciju eritrocita te povišene upalne parametre (leukociti, C-reaktivni protein). Početno, vrijednosti T3 i T4 su povišene pri čemu su vrijednosti T4 proporcionalno veće u odnosu na T3 (faza hipertireoze), dok kasnije u tijeku bolesti dolazi do pada vrijednosti T3 i T4 uz postupan porast TSH-a (faza hipotireoze). Scintigrafija štitnjače u početnim fazama bolesti pokazuje slabije nakupljanje radioaktivnoga joda. U nejasnim situacijama indiciran je ultrazvuk štitne žlijezde uz citološku punkciju ili biopsiju.
Liječenje. Osnovu liječenja čini primjena nesteroidnih protuupalnih lijekova, najčešće acetilsalicilne kiseline u visokim dozama (400 - 600 mg svakih 6 sati). Kod bolesnika koji ne reagiraju na ovu terapiju u obzir dolazi liječenje glukokortikoidima, obično prednizonom u dozi od 40 do 60 mg uz postupno snižavanje kroz sljedećih 6 do 8 tjedana. Kod bolesnika s razvijenom slikom hipertireoze korisna je primjena beta blokatora (antitireoidni lijekovi nemaju učinka), a kod hipotireoze opravdana je primjena levotiroksina. Bolesnicima je uputno pratiti vrijednosti TSH-a i T4 svaka 2 do 4 tjedna i prilagođavati liječenje ovisno o nalazima.
Prognoza. Kod većine bolesnika javlja se potpun oporavak funkcije štitne žlijezde, a trajna hipotireoza ostaje u 10 do 15 % slučajeva. Kod manjega broja bolesnika dolazi do produljenoga trajanja bolesti uz jedan ili više recidiva.
SUBAKUTNI LIMFOCITNI TIREOIDITIS
Definicija. Subakutni limfocitni tireoiditis (tihi, bezbolni ili postpartalni tireoiditis) oblik je subakutne upale štitne žlijezde nejasne etiologije koja se najčešće javlja kod žena unutar 3 do 6 mjeseci od poroda, a histološki ju karakterizira limfocitna infiltracija štitne žlijezde. Pojavnost kod žena nevezano uz trudnoću i porod, kao i kod muškaraca, iznimna je rijetkost.
Etiopatogeneza. S obzirom na prisutnost cirkulirajućih antitireoidnih protutijela (osobito protutijela na tireoidnu peroksidazu), kao i činjenicu da se bolest češće javlja kod osoba koje već imaju autoimuno oboljenje (obično šećernu bolest tip I), vjeruje se da je osnova nastanka bolesti imunološki uvjetovana. Bolest također prolazi tri faze: inicijalna faza hipertireoze, faza hipotireoze te faza oporavka.
Klinička slika. Karakteristično ovaj oblik tireoiditisa karakterizira odsutnost bola i sistemskih manifestacija (zbog čega se još i naziva tihi ili bezbolni tireoiditis). Štitna žlijezda je normalne veličine ili tek blago uvećana. Kliničkom slikom dominiraju simptomi hiper- ili hipotireoze ovisno o fazi bolesti.
Dijagnoza. Na dijagnozu subakutnoga limfocitnog tireoiditisa prvenstveno treba misliti kod žena s poremećajem rada štitne žlijezde koji se javlja unutar 3 do 6, a iznimno i do 12 mjeseci nakon poroda. Vrijednosti tireoidnih hormona ovise o fazi bolesti: početno povišen T3 i T4 (dominantno T4) uz snižen TSH, dok s razvojem bolesti dolazi do sniženja T3 i T4 uz porast TSH-a. Od subakutnoga granulomatoznog tireoiditisa razlikuje se prema nalazu povišenoga titra antitireoidinih antitijela i mirnoj sedimentaciji eritrocita, a od kroničnoga autoimunog tireoiditisa razlikuje se prema scintigrafskom nalazu smanjenoga nakupljanja radioaktivnoga joda. Svaka nejasnoća u dijagnostičkom postupku nalaže ultrazvuk i biopsiju štitne žlijezde.
Liječenje subakutnoga limfocitnog tireoiditisa ne zahtijeva primjenu nesteroidnih protuupalnih lijekova i/ili glukokortikoida, nego samo simptomatsko liječenje hipertireoze (beta-blokatori) ili primjenu levotiroksina u slučaju simptomatske hipotireoze.
Prognoza. Kod većine bolesnika prati se potpuni oporavak kroz nekoliko mjeseci, a samo manji broj bolesnika razvije klasični kronični autoimuni tireoiditis. Bolesnice koje su razvile ovaj tireoiditis nakon poroda imaju 70 %-tni rizik od razvoja istoga poremećaja i nakon sljedećih trudnoća.
KRONIČNI AUTOIMUNI (HASHIMOTOV) TIREOIDITIS
Definicija. Kronični autoimuni tireoiditis ili Hashimotov tireoiditis predstavlja jedan od najčešćih poremećaja štitne žlijezde kojega obilježava stanično i humoralno posredovano autoimuno oštećenje tkiva žlijezde i jedan je od najčešćih uzroka hipotireoze kod odraslih osoba. Procjenjuje se da se Hashimotov tireoiditis 10 do 15 puta češće javlja kod žena, i to najčešće u dobi između 30. i 50. godine života. I kod muškaraca i kod žena učestalost ove bolesti raste s životnom dobi.
Etiopatogeneza. Hashimotov tireoiditis nastaje kao posljedica autoimunoga oštećenja štitne žlijezde kombiniranim staničnim i humoralnim mehanizmima. Bolest karakterizira limfocitna infiltracija štitne žlijezde u kojoj nalazimo CD4+ i CD8+ T-limfocite, kao i B-limfocite. CD4+ i CD8+ T-limfociti dovode do direktnoga citotoksičnog učinka, dok se B-limfociti transformiraju u plazma stanice i produciraju različita antitireoidna protutijela od kojih su najznačajnija: anti-TPO (antitijela protiv tireoidne peroksidaze), anti-TG (antitijela na tireoglobulin), anti-TSHR (antitijela na TSH receptor) te različita sekundarna antitijela koja nastaju kao posljedica autoimunizacije na sadržaj razorenih folikula, ali ona nemaju značajniji utjecaj na razvoj bolesti. Početno uslijed destrukcije folikula dolazi do pojačanoga otpuštanja hormona u krv što se manifestira prolaznom fazom hipertireoze, ali kako bolest perzistira i progredira, dolazi do razvoja fibroze štitne žlijezde te bolesnici u konačnici razvijaju hipotireozu. Točan pokretač autoimunoga procesa nije poznat, ali se smatra da određenu ulogu imaju genetski, endogeni i egzogeni faktori (Tablica 7.8.). Kod bolesnika s Hashimotovim tireoiditisom nalazimo i veću učestalost drugih autoimunih oboljenja (šećerna bolest tip I, Sjögrenov sindrom, reumatoidni artritis, sistemski eritematozni lupus, mijastenija gravis, Addisonova bolest, perniciozna anemija, glutenska enteropatija).
|
Tablica 7.8. Etiologija kroničnoga autoimunog tireoiditisa
|
|
Genetski čimbenici
|
Endogeni čimbenici
|
Egzogeni čimbenici
|
|
HLA-DR3 haplotip
HLA-DR4 haplotip
HLA-DR5 haplotip
CTLA-4 polimorfizam
|
Niska porođajna težina
Estrogenski utjecaj
Kronično stanje stresa
|
Infekcije (virusne)
Pojačani unos joda
Pušenje
Lijekovi i toksini
|
Klinička slika. Glavna početna manifestacija kod većine je bolesnika povećanje štitne žlijezde (struma). Početno su bolesnici ili eutireoidini ili pokazuju znakove hipertireoze uslijed razaranja folikula. Kako bolest napreduje, tako se postupno razvija klinička slika hipotireoze koja je obično umjerenoga tipa.
Dijagnoza se postavlja na temelju anamneze, fizikalnoga nalaza, laboratorijskih pretraga, ultrazvuka i punkcije štitne žlijezde te scintigrafije. U laboratorijskim nalazima dominiraju povišena anti-TPO antitijela (povišena kod 90 % oboljelih), anti-TG antitijela (povišena kod 40 % oboljelih), dok nalazi hormona štitne žlijezde ovise o fazi bolesti (u razvijenoj bolesti nalazimo obrazac hipotireoze). Ultrazvuk pokazuje difuzni hipoehogeni denzitet tkiva štitne žlijezde uz mikronodulaciju, a pregled vaskularizacije (engl. color doppler flow) ne pokazuje pojačanu prokrvljenost tkiva kakvu nalazimo kod Gravesove bolesti. FNA (engl. fine needle aspiration) biopsija ukazuje na dominantnu limfocitnu infiltraciju (osjetljivost metode je i do 95 %). Scintigrafija štitne žlijezde u dijagnostici Hashimotova tireoiditisa danas ima manji značaj.
Liječenje. Specifičnoga liječenja Hashimotova tireoiditisa nema. Kod bolesnika s jasno razvijenim simptomima hipotireoze i povišenim TSH-om primjenjuje se trajna supstitucijska terapija levotiroksinom. Za bolesnike s uvećanom štitnom žlijezdom i povišenim TSH-om, bez evidentnih simptoma hipotireoze, također se može primjenjivati levotiroksin te pratiti njegov učinak na veličinu štitne žlijezde. Bolesnici s minimalno uvećanom štitnom žlijezdom i urednim TSH-om ne zahtijevaju supstitucijsko liječenje, nego samo redovne kontrole.
Prognoza. Kronični autoimuni tireoiditis (Hasihimotov tireoiditis) je kronična i progresivna bolest koja gotovo uvijek završi razvojem hipotireoze. U samo 5 % slučajeva zabilježi se spontana remisija. Bolesnici s razvijenom hipotireozom uz redovno uzimanje levotiroksina mogu dobro kontrolirati bolest i nemaju većih ograničenja. Ovi bolesnici imaju veću učestalost razvoja B-staničnoga limfoma u odnosu na opću populaciju.
KRONIČNI RIEDELOV TIREOIDITIS
Kronični Riedelov tireoiditis je bolest štitne žlijezde nepoznate etiologije, a karakterizira ju razvoj masivne fibroze i posljedične hipotireoze. Fibrozni proces je infiltrativnoga tipa, tako da zahvaća i okolne strukture vrata, a bolesnici pokazuju sklonost razvoju i fibroze medijastinuma, retroperitoneuma i orbite. Bolest se rijetko javlja, nešto učestalije kod žena. Klinička slika je obilježena početnim bezbolnim povećanjem štitne žlijezde nakon čega slijedi razvoj hipotireoze te lokalnih kompresivnih simptoma (stridor, promuklost, disfagija). Dijagnoza se potvrđuje patohistološkim pregledom tkiva štitne žlijezde, a potrebno je isključiti postojanje fibroze medijastinuma i retroperitoneuma. Osnovu liječenja čini operativni zahvat, a od pomoći može biti i primjena glukokortikoida i tamoksifena.
TUMORI ŠTITNE ŽLIJEZDE
Tumori štitnjače mogu biti primarni i sekundarni. Primarni mogu biti benigni (folikularni adenom, lipom, hemangiom, teratom) i maligni (karcinom, limfom, fibrosarkom). Sekundarni tumori, tj. metastaze, najčešće potječu od karcinoma bronha, dojke i bubrega.
FOLIKULARNI ADENOM
Definicija. Folikularni adenom je dobroćudni tumor štitne žlijezde građen od folikularnih stanica. Radi se o relativno čestom tumoru u općoj populaciji (5 - 10 %), iako stvarna učestalost nije poznata, s obzirom na to da su oni većinom asimptomatski, pa se i ne dijagnosticiraju. Češće se javlja u mlađoj životnoj dobi, pretežno kod žena.
Etiologija. Uzrok nastanka folikularnoga adenoma nije poznat, a rizični čimbenici koji bi pogodovali nastanku ovoga tumora do danas nisu identificirani.
Patologija. Folikularni adenomi štitne žlijezde najčešće se pojavljuju solitarno, no mogu se pojaviti i u multipnoj formi. Oni su inkapsulirani i svojim rastom vrše kompresiju na ostale strukture vrata. Patohistološki razlikujemo nekoliko oblika (normofolikularni, makrofolikularni, mikrofolikularni, trabekularni, adenom Hurthleovih stanica), no njihovo razlikovanje nema veće kliničko značenje. Prema sposobnosti lučenja hormona dijele se u dvije skupine: funkcionalni (imaju sposobnost autonomnoga lučenja hormona) te nefunkcionalni (nemaju sposobnost autonomnoga lučenja hormona).
Klinička slika. Tumori su dugo asimptomatski, a najčešća klinička manifestacije je palpatorni čvorić na vratu u području štitne žlijezde. Ako su prisutni multipli adenomi, uvećana štitna žlijezda nalikuje na multinodularnu strumu. Kod toksičnoga adenoma razvijaju se simptomi hipertireoze. Kod tumora većih dimenzija mogući su i lokalni kompresivni simptomi (stridor, promuklost, disfagija).
Dijagnoza se postavlja na temelju anamneze, fizikalnoga nalaza, nalaza hormona štitnjače (ovisi o biologiji tumora) te ultrazvučnoga nalaza i citološke punkcije suspektnoga čvora FNAB-om (engl. fine-needle aspiration biopsy).
Liječenje asimptomatskih bolesnika nije potrebno, dovoljno ih je redovno kontrolirati. Kirurško liječenje indicirano je za simptomatske bolesnike (hipertireoza, kompresija) te u slučaju sumnje na maligni proces.
KARCINOM ŠTITNE ŽLIJEZDE
Definicija. Karcinom štitnjače je zloćudni tumor štitne žlijezde koji potječe od folikularnih stanica ili parafolikularnih C-stanica te predstavlja najčešće maligno obljenje endokrinoga sustava. Razlikujemo četiri osnovne vrste karcinoma štitne žlijezde: papilarni karcinom, folikularni karcinom, anaplastični karcinom i medularni karcinom.
Epidemiologija. Ukupno gledano, učestalost karcinoma štitne žlijezde raste s dobi, a gledajući na spol, češći je kod žena s omjerom žene-muškarci 3:1. Karcinomi štitne žlijezde kod muškaraca povezani su s lošijim ishodima u odnosu na žene. Postoje određene epidemiološke karakteristike ovisno o tipu karcinoma štitne žlijezde, što je prikazano u Tablici 7.9.
|
Tablica 7.9. Epidemiološke karakteristike karcinoma štitne žlijezde
|
|
Karakteristika
|
Papilarni karcinom
|
Folikularni karcinom
|
Anaplastični karcinom
|
Medularni karcinom
|
|
Učestalost
|
70 - 80 %
|
15 %
|
5 %
|
2 %
|
|
Spolna pojavnost
|
Češće kod žena (3:1)
|
Češće kod žena (3:1)
|
Podjednaka pojavnost
|
Podjednaka pojavnost
|
|
Dobna pojavnost
|
25 - 45 godina
|
40 - 60 godina
|
> 50 godina
|
50 - 75 godina
|
|
Preživljenje/> 10 god
|
97 %
|
92 %
|
7,3 %
|
78 %
|
Etiopatogeneza. Točan uzrok i mehanizam nastanka karcinoma štitne žlijezde nisu poznati, no određenu ulogu mogu imati genetski čimbenici, ionizirajuće zračenje i radioaktivne tvari te manjak joda.
Genetika. U svojoj osnovi karcinom štitne žlijezde je monoklonalni tumor, što znači da potječe od jedne stanice u kojoj je došlo do određenoga poremećaja molekule DNA (mutacije) s posljedičnom hiperproliferacijom i gubitkom kontrole umnažanja. Genetska istraživanja pokazala su povećanu učestalost pojedinih mutacija u ovim tumorski promijenjenim stanicama, a radi se o mutacijama gena koji djeluju kao onkogeni ili kao tumor-supresorski geni. U Tablici 7.10. su navedene najčešće genetske mutacije u pojedinim vrstama karcinoma štitne žlijezde.
|
Tablica 7.10. Najčešće genetske promjene karcinoma štitne žlijezde
|
|
Papilarni karcinom
|
Folikularni karcinom
|
Anaplastični karcinom
|
Medularni karcinom
|
|
RAS (1p13.2)
MET (7q31)
|
RET/PTC (10q11.2)
BRAF (7q24)
RAS (1p13.2)
PTEN (10q23)
|
BRAF (7q24)
p53 (17q13)
APC (5q21-q22)
p21/WAF (6p21.2)
CTNNB1 (3p22)
|
RET (10q11.2)
|
Ionizirajuće zračenje i radioaktivne tvari. Zračenje regije glave i vrata u terapijske svrhe dokazano povećava učestalost pojavnosti karcinoma štitne žlijezde što je povezano s radijacijski uzrokovanim kromosomskim promjenama koje mogu rezultirati poremećajima onkogena ili tumor-supresorskih gena. Ovaj mehanizam izraženiji je kod djece nego kod odraslih. Izlaganje radioaktivnim tvarima kao što je radioaktivno obilježen jod minimalno povećava rizik od nastanka ovoga karcinoma.
Manjak joda. Povećana učestalost nastanka karcinoma štitne žlijezde bilježi se kod bolesnika sa razvijenom strumom u endemskim područjima gdje nalazimo manjak joda u vodi i zemljištu, dok se ista poveznica ne može povući s bolesnicima koji imaju strumu, a žive u neendemskim područjima. To ukazuje na moguću etiološku poveznicu manjka joda i pojave karcinoma štitne žlijezde.
Utjecaj tireotropnoga hormona (TSH). Danas se zna da u promociji i poticanju rasta karcinoma štitne žlijezde ulogu ima i tireotropni hormon, a tome u prilog govori i činjenica da većina stanica karcinoma štitne žlijezde sadrže receptor za TSH.
Patologija. Karcinomi štitne žlijezde dijele se na četiri osnovna tipa: papilarni karcinom, folikularni karcinom, anaplastični karcinom i medularni karcinom. Prva dva oblika predstavljaju dobro diferencirane karcinome, dok druga dva predstavljaju slabo diferencirane karcinome koji imaju znatno lošiju prognozu.
Papilarni karcinom građen je od razgranatih resica fibrovaskularne strome obloženih zloćudnim kubičnim ili cilindričnim epitelnim stanicama. Morfološki nalikuju na adenome. Najčešće se javlja kao solidna masa, a rjeđe poprima cističnu formaciju. Moguća su i višestruka žarišta te kod 30 % oboljelih zahvaća oba režnja štitne žlijezde. Rano metastazira u limfne čvorove. Od svih oblika karcinoma štitne žlijezde, papilarni karcinom odlikuje se najnižim stupnjem maligniteta, iako se njegova agresivnost pojačava u starijoj životnoj dobi.
Folikularni karcinom građen je od stanica koje nalikuju na stanice štitne žlijezde i oblikuju folikule. Razlikujemo dva tipa ovoga karcinoma: minimalno invazivni (oštro ograničen, jasni rubovi) te široko invazivni (neoštro ograničen, nejasni rubovi). Folikularni karcinom skloniji je davanju hematogenih metastaza (kosti, jetra, pluća) od limfogenih metastaza u regionalne i udaljene limfne čvorove. Iako pokazuje agresivnije ponašanje od papilarnoga krcinoma, folikularni karcinom zajedno s papilarnim ulazi u kategoriju dobro diferenciranih karcinoma. Posebna podvrsta ovoga karcinoma je i karcinom Hurthleovih stanica. Te stanice uglavnom nastaju tijekom upalnoga procesa, a karakterizira ih nakupljanje mitohondrija i obilna eozinofilna citoplazma.
Anaplastični karcinom predstavlja rijedak, iznimno agresivan karcinom građen od anaplastičnih stanica. Najčešće se razvija kod starijih osoba u podlozi multinodularne strume. Odlikuje ga brz rast, velika tumorska masa i lokalna kompresija okolnih struktura. Anaplastični karcinom vrlo rano daje limfogene i hematogene metastaze.
Medularni karcinom nastaje iz parafolikularnih C-stanica štitne žlijezde i karakterizira ga izražena biološka aktivnost (lučenje kalcitonina, prostaglandina, serotonina i nekih drugih peptida). Javlja se u dva oblika: sporadični (80 %) koji se obično javlja u starijoj životnoj dobi te obiteljski (20 %) koji se javlja u mlađoj životnoj dobi te je povezan s višestrukom endokrinom neoplazijom i mutacijama RET gena.
Klinička slika. Karcinom štitne žlijezde dugo je asimptomatska bolest, a prvo i najčešće očitovanje je bezbolan palpatorni čvor (ili čvorovi) na prednjoj strani vrata u području štitne žlijezde. Daljnji simptomi mogu biti posljedica rasta i lokalne kompresije (disfagija, stridor, promuklost), prisutnosti regionalnih limfnih metastaza (vratna limfadenopatija) ili udaljenih metastaza (mozak, jetra, pluća, kosti) te biološke aktivnosti samoga tumora što je posebno karakteristično za medularni karcinom (paraneoplastični sindrom).
Dijagnoza. Dijagnostički postupak kod sumnje na malignu bolest štitne žlijezde podrazumijeva detaljnu anamnezu i fizikalni pregled, laboratorijsku dijagnostiku, slikovne metode te biopsiju i patohistološku analizu.
Anamneza i fizikalni pregled. Podaci o ranijoj izloženosti zračenju regije glave i vrata (osobito u djetinjstvu) te prisutnosti karcinoma štitne žlijezde u obitelji važni su anamnestički podaci za ovu bolest. Fizikalni pregled zahtijeva posebnu pozornost pri pregledu vrata, a najčešći patološki nalazi su uvećana štitna žlijezda, nalaz patorezistencije (čvorova) na žlijezdi i regionalna limfadenopatija.
Laboratorijska dijagnostika. Nalazi hormona štitne žlijezde obično su uredni ako ne postoji pridruženi tireoiditis ili izražena tumorska destrukcija tkiva žlijezde. Folikularni karcinom može lučiti veće količine tiroksina i izazvati supresiju TSH-a. Serumski tireoglobulin može biti povišen kod metastatskoga papilarnoga i folikularnog karcinoma te se kod njih može koristiti kao tumorski marker u praćenju bolesti. Vrijednosti serumskoga kalcitonina povišene su kod medularnoga karcinoma, iako on može biti povišen i u drugim bolestima i stanjima (tireoiditis, trudnoća, kronična bubrežna bolest, neuroendokrini tumori). Povišene vrijednosti kalcitonina mogu zaostati kod jednoga dijela bolesnika, iako su oni u očiglednoj remisiji bolesti. Karcinoembrionalni antigen (CEA) također može biti povišen kod medularnoga karcinoma.
Slikovne metode. Ultrazvuk štitne žlijezde i vrata ishodišna je slikovna metoda u obradi ovih bolesnika. Ukazuje na veličinu i smještaj patorezistencije te omogućava ciljanu biopsiju. Također, ultrazvuk vrata bitan je u procjeni zahvaćenosti regionalnih limfnih čvorova. Scintigrafija se rjeđe izvodi i u pravilu ukazuje na biološko ponašanje čvora: pojačano nakupljanje radiofarmaka (topli čvor) ide u prilog benignim tvorbama, dok smanjeno nakupljanje radiofarmaka (hladni čvor) ide u prilog malignim tvorbama. U dijagnostici metastaza karcinoma štitne žlijezde koristimo se primjenom radioaktivnoga joda te scintigrafijom cijeloga tijela, primjenom pozitronske emisijske tomografije (PET) uz korištenje 18-fluorodeoksiglukoza (18FDG-PT) ili klasične kompjuterizirane tomografije.
FNAB (od engl. fine-needle aspiration biopsy) predstavlja zlatni standard u dijagnostici karcinoma štitne žlijezde, osobito kada se koristi uz ultrazvučno navođenje. Osim biopsije patorezistencije u samoj žlijezdi, može se koristiti i za biopsiju povećanih limfnih čvorova. Ako je i nakon ove pretrage pitanje o malignosti suspektnoga čvora otvoreno, preporuča se intraoperativna biopsija.
Liječenje dobro diferenciranih karcinoma štitne žlijezde podrazumijeva: 1) kirurško liječenje, 2) liječenje radioaktivnim jodom te 3) primjenu radioterapije i/ili kemoterapije u uznapredovaloj fazi bolesti. Nakon provedenoga onkološkog liječenja svi bolesnici moraju nastaviti s uzimanjem nadomjesne terapije levotiroksinom obično u dozi od 2,5 do 3,5 mcg/kg/dan kako bi se izvršila supresija lučenja TSH-a. Preporučeno je održavati vrijednosti TSH-a između 0,1 i 0,5 mIU/L.
Kirurško liječenje. U kirurškom liječenju dobro diferenciranih karcinoma štitne žlijezde koriste se sljedeće operacije: lobektomija s istmektomijom te subtotalna i totalna tireoidektomija. Lobektomija s istmektomijom u obzir dolazi kod bolesnika mlađih od 40 godina, koji imaju tumor manji od 1 cm u promjeru i imaju zdrav preostali režanj. Treba imati na umu da se kod ovih bolesnika u 10 % slučajeva razvije recidiv u kontralateralnom režnju. Subtotalna tireoidektomija podrazumijeva zahvat u kojemu se ostavlja nešto tkiva štitne žlijezde, a kao glavnu prednost nad totalnom tireoidektomijom navodi se manja stopa kirurških komplikacija, a provedene studije ne pokazuju da totalna tireoidektomija poboljšava dugoročnu prognozu. Totalna tireoidektomija s očuvanjem paratireoidnih žlijezda rezervirana je za sve bolesnike starije od 40 godina te sve bolesnike s bilateralnim oblikom bolesti. Prema NCCN-ovim preporukama (izv. National Comprehensive Cancer Network) totalna tireoidektomija preporučena je u sljedećim situacijama: 1) pozitivna anamneza na zračenje glave i vrata, 2) dokazane udaljene metastaze, 3) bilateralna pojavnost bolesti, 4) lokalna invazija tumora, 5) tumor veći od 4 cm u promjeru, 6) prisutne metastaze u vratnim limfnim čvorovima te 7) slabo diferenciran tumor. Ovisno o zahvaćenosti okolnih struktura i regionalnih limfnih čvorova, provodi se i disekcija vrata.
Terapija radioaktivnim jodom. Nakon provedenoga kirurškog liječenja bolesnicima se uvodi suspstitucijska terapija levotiroksinom kroz 4 do 6 tjedana, a potom se isključuje i bolesnici se uvode u stanje hipotireoze kako bi se isprovocirao porast serumskoga TSH-a. Kada se pacijent uvede u hipotireozu i kada poraste serumski TSH, bolesnicima se daje dijagnostička doza radioaktivno obilježenoga joda (131I ili 123I) te se obavi scintigrafija cijeloga tijela. Ukoliko se detektira nakupljanje radioaktivnoga joda u području same štitne žlijezde (ostatno tkivo) ili se otkriju metastaze, primjenjuje se radioaktivni jod u terapijskim dozama. Terapija se provodi sve dok apsorpcija radioaktivnoga joda izostane u potpunosti. Liječenje se temelji na destrukciji tkiva tumora putem radioaktivnosti. Glavne nuspojave ovoga liječenja su prolazna hipertireoza (ako su bolesnici podvrgnuti poštednim operacijama), sijaloadenitis (radioaktivni jod akumulira se u žlijezdama slinovnicama), mučnina i povraćanje, glavobolja, pojava plućne fibroze kod bolesnika s velikim metastazama na plućima, moždani edem kod bolesnika s metastazama na mozgu, povećan rizik od razvoja leukemije te karcinoma dojke i mokraćnoga mjehura. Također se zbog teratogenoga učinka radioaktivnoga joda ne preporuča planiranje trudnoće unutar godine dana od primijenjene terapije.
Liječenje uznapredovale faze bolesti. Kod velikih inoperabilnih tumora u obzir dolazi radioterapija s ciljem redukcije tumorske mase i smanjenja lokalnih simptoma. Kemoterapija cisplatinom ili doksorubicinom ima ograničenu djelotvornost.
Praćenje bolesnika. Kod ovih bolesnika preporučuje se scintigrafija radioaktivnim jodom 6 do 12 mjeseci od ablacije te se provodi svake dvije godine ako ne pokazuje znakove ostatne bolesti (nakupljanje joda). Prije scintigrafije potrebno je prekinuti terapiju levotiroksinom kroz 4 do 6 tjedana kako bi se postigla maksimalna TSH stimulacija.
Liječenje slabo diferenciranih karcinoma štitne žlijezde. Među slabo diferencirane karcinome štitne žlijezde ubrajamo anaplastični i medularni karcinom.
Liječenje anaplastičnoga karcinoma štitne žlijezde uglavnom je palijativno. Kirurško liječenje je opravdano ako se tumor može odstraniti u cijelosti te se obično kombinira s radioterapijom, s ciljem smanjenja tumorske mase i poboljšanja simptoma. Anaplastični karcinom rezistentan je na liječenje radioaktivnim jodom, kao i na većinu kemoterapeutika, te se eventualno može primijeniti cisplatina, doksorubicin i valproična kiselina.
Liječenje medularnoga karcinoma štitne žlijezde u prvom redu podrazumijeva ekstenzivni kirurški zahavat kojim se uklanja tumor s okolnim tkivom i zahvaćenim limfnim čvorovima. Kod bolesnika koji nisu kandidati za kirurško liječenje provodi se radioterapija. Medularni karcinom rezistentan je na terapiju radioaktivnim jodom i većinu kemoterapeutika, a kao mogući izbor navode se vandetanib, pazopanib, sorafenib ili sunitinib (većina lijekova je u kliničkim ispitivanjima).
Prognoza. Dobro diferencirani karcinomi štitne žlijezde (papilarni i folikularni karcinom) imaju dobru prognozu s desetogodišnjim preživljenjem preko 90 %. Slabo diferencirani karcinomi štitne žlijezde imaju lošiju prognozu te desetogodišnje preživljenje za medularni karcinom iznosi 78 %, a za anaplastični 7 %.
LIMFOM ŠTITNE ŽLIJEZDE
Limfomi štitne žlijezde su rijetki maligni tumori. Češće se javljaju u starijoj dobi, osobito kod žena. Najčešće se radi o B-staničnom limfomu, nešto rjeđe o MALT limfomu (engl. mucosa-associated lymphoma). Klinički ih karakterizira brz rast. Liječenje u prvom redu podrazumijeva primjenu kemoterapije.
EUTIREOIDNA BOLEST ŠTITNE ŽLIJEZDE
Definicija. Netireoidna (ili eutiroidna) bolest štitne žlijezde naziv je stanje u kojemu nalazimo patološke nalaze hormona FT3 i/ili FT4, u odsutnosti bolesti štitne žlijezde.
Etiologija. Ovo stanje može se susresti kao posljedica različitih akutnih ili kroničnih bolesti, a nastaje kao posljedica opće neuroendokrine reakcije čiji je rezultat slabljenje učinka hormona štitne žlijezde uz izostanak odgovora hipotalamusa i hipofize u vidu pojačanoga lučenja TSH-a. Najčešći uzroci su akutna životno-ugrožavajuća stanja (šok), maligne bolesti, opsežne traume, kronične bolesti jetre i bubrega, metabolički poremećaji, kronično gladovanje i dr.
Klinička slika. Bolesnici s eutiroidnom bolesti štitne žlijezde imaju razvijenu kliničku sliku osnovne bolesti, odnosno stanja koje je dovelo do poremećaja hormona štitne žlijezde. U težim oblicima mogu se razviti simptomi nalik na hipotireozu i miksedem (somnolencija, adinamija, edemi, hipotermija).
Dijagnoza počiva na interpretaciji laboratorijskih nalaza hormona štitne žlijezde. Početno se bilježe snižene vrijednosti FT3, a ako bolest traje dulje, snižava se i vrijednost FT4, dok su vrijednosti TSH-a najčešće uredne, a mogu biti i snižene ili vrlo rijetko blago povišene (ne u vrijednostima koje bi očekivali za hipotireozu). Snižene vrijednosti FT4 kod kritično oboljelih osoba loš su prognostički pokazatelj.
Liječenje se sastoji od liječenja osnovne bolesti. Davanje levotiroksina u ovim stanjima nije se pokazalo korisnim, štoviše - može usporiti tijek oporavka. Po stabilizaciji uzročne bolesti ili stanja dolazi i do normalizacije vrijednosti hormona štitne žlijezde.
PRISTUP BOLESNIKU S ČVOROM NA ŠTITNOJ ŽLIJEZDI
Palpabilan čvor na vratu koji pripada štitnoj žlijezdi nađe se kod oko 5 % odrasle populacije. Glavni diferencijalno dijagnostički izazov kod takvih bolesnika je prepoznati maligno oboljenje kako bi se na vrijeme i na odgovarajući način započelo liječenje. U nastavku teksta prikazan je algoritam obrade ovih bolesnika (Slika 7.1.).
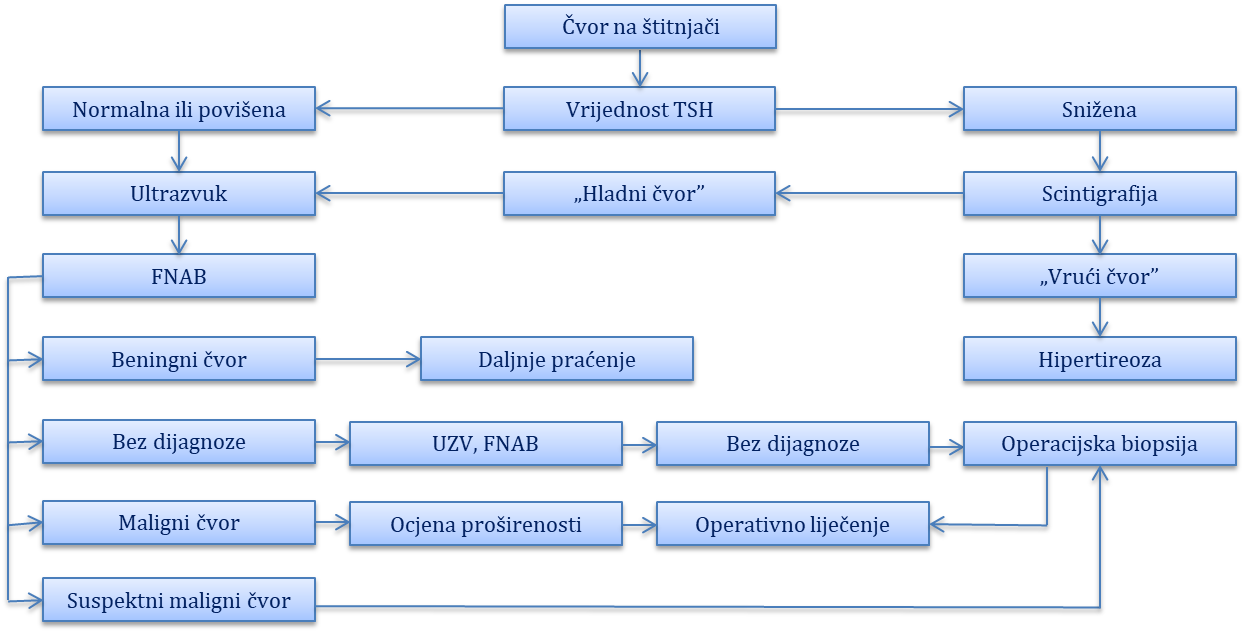
Slika 7.1. Opći pristup i obrada bolesnika s čvorom na štitnoj žlijezdi
BOLESTI DOŠTITNIH ŽLIJEZDA
Doštitne žlijezde predstavljaju četiri tjelešca smještena na stražnjoj strani štitne žlijezde koja stvaraju i luče paratireoidni hormon (PTH), jedan od glavnih regulatora koncentracije kalcija i fosfata u krvi. On se sintetizira u glavnim stanicama paratireoidne žlijezde, a poticaj za njegovo izlučivanje je snižena razina kalcija u krvi. Ima nekoliko značajnih učinaka: 1) potiče mobilizaciju kalcija iz kosti (aktivacija osteoklasta); 2) smanjuje gubitak kalcija putem bubrega povećavajući tubularnu reapsorpciju kalcija; 3) neizravno potiče apsorpciju kalcija iz crijeva stimulirajući nastanak aktivnoga oblika vitamina D (kalcitriol) te 4) potiče izlučivanje fosfata putem bubrega. Konačni rezultat djelovanja PTH-a je povećanje razine kalcija uz smanjenje razine fosfata. Povećane razine kalcija registriraju receptori na površini stanica paratireoidne žlijezde čime se koči lučenje PTH-a (mehanizam negativne povratne sprege).
HIPERPARATIREOIDIZAM
Hiperparatireoidizam je naziv za stanje koje karakterizira pojačano stvaranje i lučenje paratireoidnoga hormona posljedično čemu dolazi do poremećaja metabolizma kalcija i fosfata. Ovisno o etiopatogenezi, razlikujemo primarni, sekundarni i tercijarni hiperparatireoidizam.
PRIMARNI HIPERPARATIREOIDIZAM
Definicija. Primarni hiperparatireoidizam označava kliničko stanje u kojemu nalazimo pojačano stvaranje i lučenje paratireoidnoga hormona kao posljedicu bolesti i poremećaja samih doštinih žlijezda. Procijenjena učestalost ovoga poremećaja u razvijenim zemljama je oko 20 do 25 slučajeva na 100 000 stanovnika na godinu. Obično se javlja nakon petoga desetljeća s većom učestalošću kod žena (omjer 3:1).
Etiologija. Najčešći uzrok primarnoga hiperparatireoidizma je solitarni adenom u jednoj od doštitnih žlijezda koji čini 85 % ovih slučajeva. U preostalim slučajevima obično se radi o višestrukim adenomima ili hiperplaziji doštitnih žlijezda, dok se iznimno (manje od 1 %) radi o adenokarcinomu paratireoidnih žlijezda. Točan uzrok ovih promjena na doštitnim žlijezdama nije poznat te se može javiti sporadično ili u sklopu određenih genetskih poremećaja kao što je sindrom multiple endokrine neoplazije (MEN 1 i MEN 2a) te obiteljski izolirani hiperparatireoidizam. Treba imati na umu da doštitne žlijezde karakterizira široka varijabilnost u broju i lokalizaciji tako da se ovi patološki procesi mogu javiti i na ektopično smještenim žlijezdama, obično visoko u vratu, retroezofagealnom prostoru ili medijastinumu.
Adenom paratireoidne žlijezde označava benigni tumor građen pretežno od glavnih stanica koje pokazuju jasnu autonomnost u stvaranju i lučenju paratireoidnoga hormona. Obično se radi o solitarnom adenomu, iako se može javiti i u složenom obliku pri čemu zahvaća više doštitnih žlijezda. Najčešće su pogođene donje doštitne žlijezde. Tumor je jasno ograničen od svoje okoline, obične meke konzistencije s cističnim elementima, prosječne težine oko 10 grama. Kod 2 % bolesnika oni se mogu transformirati u adenokarcinom.
Hiperplazija paratireoidnih žlijezda označava difuzno uvećanje tkiva paratireoidnih žlijezda pri čemu su zahvaćene dvije ili više žlijezda. Kao i kod adenoma, i u ovom slučaju dolazi do gubitka normalne regulacije lučenja paratireoidnoga hormona i njegova pojačana lučenja.
Karcinom paratireoidnih žlijezda odgovoran je za manje od 1 % slučajeva primarnoga hiperparatireoidizma. Nastaje malignom transformacijom iz adenoma, a karakterizira ga manje agresivna priroda, iako može dati udaljene metastaze. Česti su lokalni recidivi nakon kirurške resekcije.
Patofiziologija. Glavni poremećaji u primarnom hiperparatireoidizmu posljedica su pojačanoga stvaranja i lučenja paratireoidnoga hormona uslijed čega se razvijaju hiperkalcijemija i hipofosfatemija. Hiperkalcijemija je posljedica pojačane mobilizacije kalcija iz kostiju, pojačane tubularne reapsorpcije kalcija te pojačane apsorpcije kalcija iz probavnoga sustava, dok je hipofosfatemija posljedica pojačanoga lučenja fosfata putem bubrega. Mobilizacija kalcija iz kostiju rezultat je pojačane aktivnosti osteoklasta zbog čega se razvija osteopenija te sklonost patološkim prijelomima (osteitis fibrosa cystica). Zbog hiperkalcijemije su ovi bolesnici skloni razvoju nefrolitijaze, pankreatitisa te ulkusne bolesti. Zbog hipofosfatemije je moguć i razvoj blaže metaboličke acidoze (fosfati djeluju kao acidobazni pufer).
Klinička slika. Danas se primarni hiperparatireoidizam uglavnom dijagnosticira u asimptomatskoj fazi pri obradi nađene hiperkalcijemije. Klinički simptomi i znakovi javljaju se kasnije, a posljedica su hiperkalcijemije što se može odraziti na različite organe i organske sustave: koštano-zglobni sustav (osteomalacija, osteopenija), bubrezi (nefrolitijaza), probavni sustav (mučnina, povraćanje, bol u trbuhu, konstipacija, ulkusna bolest, pankreatitis), mišićni sustav (slabost proksimalnih mišića, nestabilnost), psihički (depresija, kognitivne smetnje), kardiovaskularni sustav (hipertenzija, bradikardija).
Dijagnoza primarnoga hiperparatireoidizma postavlja se na osnovi laboratorijskih nalaza kojima se potvrđuje sam poremećaj, dok se slikovnim metodama nastoji utvrditi uzrok poremećaja.
Laboratorijski nalazi. Osnovni laboratorijski nalazi koji ukazuju na primarni hiperparatireoidizam su hiperkalcijemija i povišene vrijednosti paratireoidnoga hormona u serumu. Treba imati na umu da se u 10 do 20 % slučajeva vrijednosti paratireoidnoga hormona kreću u rasponu gornjih referentnih vrijednosti što ne treba tumačiti kao uredan nalaz s obzirom na to da se radi o neprimjerenoj vrijednosti u odnosu na hiperkalcijemiju (morao bi biti znatno niži). Ostali laboratorijski nalazi koji se mogu naći kod ovih bolesnika su: povišen pH urina, hiperkalciurija, hipofosfatemija ili normofosfatemija, hiperkloremija i hiperkloremična metabolička acidoza, omjer klorida i fosfata u serumu veći od 33 te povišene vrijednosti alkalne fosfataze kao odraz pojačane aktivnosti osteoklasta.
Slikovne metode. Ultrazvuk vrata prva je slikovna dijagnostička metoda koja se primjenjuje u obradi ovih bolesnika. Detaljno se pregleda cijela regija vrata, od mandibule do gornjega medijastinuma. Osim pri uočavanju povećanih paratireoidnih žlijezda, pomaže i pri izvođenju citološke punkcije suspektnih lezija. Scintigrafija i/ili jednofotonska emisijska kompjuterizirana tomografija (SPECT, od engl. single-photon emission computed tomography) s uporabom sestamibija predstavljaju najpreciznije dijagnostičke metode u obradi ovih bolesnika i dijagnostici adenoma paratireoidne žlijezde s obzirom na to da sestamibij pokazuje afinitet nakupljanja u adenomima paratireoidnih žlijezda. Lažno pozitivne nalaze možemo vidjeti kod bolesnika s čvorovima u štitnoj žlijezdi, tireoiditisom te cervikalnom limfadenopatijom. Konvencionalni CT i MRI rjeđe se koriste u dijagnostici ovih poremećaja. S obzirom na čest nalaz nefrolitijaze i koštanih poremećaja kod ovih bolesnika, preporuča se i CT abdomena (dijagnostika nefrolitijaze i nefrokalcinoze) te denzitometrija (ispitivanje gustoće kostiju).
Liječenje. Osnovu liječenja simptomatskih bolesnika čini operativno liječenje s ili bez medikamentne terapije, dok se većina asimptomatskih bolesnika redovno prati i kontrolira.
Kirurško liječenje čini osnovu liječenja primarnoga hiperparatireoidizma, a glavne indikacije su: 1) simptomatska hiperkalcijemija; 2) ukupna vrijednost serumskoga kalcija > 1 mg/dL iznad gornje granice normale; 3) kalciurija > 400 mg u 24-satnom urinu; 4) smanjena gustoća kostiju (T-score < -2,5); 5) dob < 50 godina i blaga hiperkalcijemija; 6) kalcijska nefrolitijaza ili nefrokalcinoza; 7) trudnoća i 8) nemogućnost dugotrajnoga praćenja. S obzirom na dobre rezultate operativnoga liječenja i relativno nisku stopu postoperativnih komplikacija, sve je više zagovornika paratireoidektomije kao oblika liječenja svih bolesnika s primarnim hiperparatireoidizmom.
Medikamentno liječenje. Lijekovi koji se mogu koristiti u liječenju primarnoga hiperparatireoidizma su sinakalcet, bisfosfonati, denosumab te vitamin D.
Sinakalcet je kalcimimetik koji djeluje na receptore za kalcij koji se nalaze na površini glavnih stanica paratireoidnih žlijezda dovodeći do smanjenoga stvaranja i lučenja paratireoidnoga hormona te smanjenja hiperkalcijemije kao krajnjega učinka. Može se koristiti kao inicijalna terapija ili kod bolesnika s neuspjelim operativnim liječenjem. Liječenje se obično započinje dozom od 15 do 30 mg/dan te se dalje doza usklađuje s nalazom kalcija (doza lijeka povećava se svaka dva tjedna sve dok se ne postigne uredna vrijednost kalcija). Maksimalna doza sinakalceta je 90 mg tri puta dnevno. Lijek se obično dobro podnosi, najčešće nuspojave su mučnina, povraćanje i hipokalcijemija (može se razviti i uz doze od 30 mg dnevno).
Bisfosfonati se koriste kod ovih bolesnika zbog svoga inhibitornog učinka na koštanu reapsorpciju pri čemu se minimalizira učinak paratireoidnoga hormona na osteoklaste, odnosno mobilizaciju kalcija iz kostiju te se smanjuje hiperkalcijemija. U ovoj indikaciji koriste se parenteralni oblici bisfosfonata: 30 - 90 mg pamidronata intravenski 2 – 4 x godišnje ili 5 mg zoledronata intravenski 1 x godišnje. Ovi se lijekovi obično koriste pri teškim oblicima hiperparatireoidizma u pripremi za operativni zahvat. Peroralni bisfosfonat alendronat nema veći utjecaj na hiperkalcijemiju, ali dokazano povećava koštanu gustoću.
Denosumab je humano monoklonalno protutijelo (IgG2) koje je usmjereno na RANKL za kojega se veže i onemogućava aktivaciju RANK receptora na površini osteoklasta. Sprečavajući RANKL/RANK interakciju inhibira nastanak i aktivnost osteoklasta te tako smanjuje koštanu reapsorpciju. Ovaj lijek daje se kod teških oblika hiperparatireoidizma u dozi od 120 mg/1 x mjesečno. Primjenjuje se supkutano.
Vitamin D ili njegovi analozi primjenjuju se samo u slučaju dokazanoga manjka 25-hidroksivitamina D kada ono dovodi do smanjenja lučenja paratireoidnoga hormona, bez pogoršanja hiperkalcijemije.
Pristup asimptomatskim bolesnicima uključuje redovne kontrole koje uključuju određivanje kalcija i albumina (ili ioniziranoga kalcija) dva puta godišnje, dok se procjena bubrežne funkcije i denzitometrija preporučuju jednom godišnje. Ove bolesnike treba poticati na redovnu tjelesnu aktivnost, izbjegavanje imobilizacije te izbjegavanje lijekova koji mogu pogoršati hiperkalcijemiju (tiazidi, vitamin A).
Prognoza. Kod bolesnika koji se ne liječe hiperkalcijemija i njezine komplikacije pogoršavaju ishod bolesti, a sama prognoza ovisi i o uzroku hiperparatoreoidizma (adenom, hiperplazija ili karcinom).
SEKUNDARNI HIPERPARATIREOIDIZAM
Definicija. Sekundarni hiperparatireoidizam označava stanje pojačanoga stvaranja i lučenja paratireoidnoga hormona koje nije posljedica autonomnoga lučenja hormona iz paratireoidnih žlijezda nego nastaje kao posljedica hipokalcijemije koja predstavlja snažan podražaj za lučenje paratireoidnoga hormona.
Etiopatogeneza. Najčešći uzrok sekundarnoga hiperparatireoidizma je kronična bubrežna bolest, dok su rjeđi uzroci malapsorpcija kalcija i vitamina D iz probavnoga sustava te rezistencija tkiva na vitamin D. Nastanak sekundarnoga hiperparatireoidizma kod bolesnika s kroničnom bubrežnom bolesti nastaje uslijed razvoja hiperfosfatemije i hipokalcijemije te uslijed smanjenoga stvaranja aktivnoga oblika vitamina D koji pomaže crijevnu apsorpciju kalcija (detaljan opis ovoga patofiziološkog mehanizma nalazi se u poglavlju nefrologije – komplikacije kronične bolesti bubrega). Uslijed produljene hipokalcijemije i pojačanoga stvaranja paratireoidnoga hormona dolazi do razvoja hiperplazije paratireoidnih žlijezda koja je patohistološki istovjetna primarnoj hiperplaziji koju nalazimo u primarnom hiperparatireoidizmu. Za razliku od primarne hiperplazije, ove promjene su reverzibilne prirode i ako se ukloni osnovni etiološki čimbenik (npr. transplantacija bubrega), dolazi do kliničkoga i laboratorijskog oporavka. Ipak, ako etiološki čimbenik djeluje duže vrijeme, promjene na paratireoidnim žlijezdama postaju ireverzibilne, odnosno razvija se autonomnost lučenja paratireoidnoga hormona što se onda naziva tercijarnim hiperparatireoidizmom.
Klinička slika. Kliničke manifestacije sekundarnoga hiperparatireoidizma prekrivene su kliničkom prezentacijom osnovne, odnosno uzročne bolesti, a najčešće je to kronična bubrežna bolest. Posljedično razvoju ovoga poremećaja kod kroničnih bubrežnih bolesnika dolazi do razvoja koštanih promjena i koštanih manifestacija (bolovi u kostima, sklonost patološkim prijelomima, metastatske kalcifikacije).
Dijagnoza se postavlja na temelju laboratorijskih nalaza koji uključuju povišene vrijednosti parathormona u krvi uz hipokalcijemiju, hiperfosfatemiju te snižene vrijednosti 25-hidroksivitamina D. Klasična radiografija i denzitometrija pokazuju promjene na koštanom tkivu što dodatno ukazuje na ovaj poremećaj. Ultrazvuk vrata i druge navedene slikovne metode u dijagnostici hiperparatireoidizma (gore opisane) ukazuju na difuzno povećanje svih paratireoidnih žlijezda.
Liječenje. Osnovu liječenja čini medikamentno liječenje, dok je kirurško liječenje indicirano samo u teškim oblicima koji slabo reagiraju na medikamentno liječenje. Medikamentno liječenje uključuje sljedeće: 1) restrikciju unosa fosfata u organizam putem hrane; 2) primjenu vitamina D (kalcitriol) i njegovih analoga (kalcifediol, parikalcitol, dokserkalciferol) te 3) primjenu kalcimimetika (sinakalcet, etelkalcetid). Liječenje se najprije temelji na smanjenom unosu fosfata te suplementaciji kalcija i vitamina D, a ako oni ne daju željeni terapijski odgovor (normalizacija laboratorijskih nalaza), indicirana je primjena kalcimimetika. Kirurško liječenje provodi se iznimno rijetko i to samo u teškim oblicima koji ne reagiraju na medikamentno liječenje.
Prognoza. Uz redovne kontrole, pridržavanja uputa o prehrani (smanjeni unos fosfata) te uzimanje lijekova, ovaj poremećaj u kroničnih bubrežnih bolesnika može se dobro držati pod kontrolom te se na taj način može izbjeći razvoj opisanih koštanih promjena.
TERCIJARNI HIPERPARATIREOIDIZAM
Tercijarni hiperparatireoidizam nastaje kao posljedica dugotrajnoga sekundarnog hiperparatireoidizima pri čemu nastala hiperplazija paratireoidnih žlijezda postaje ireverzibilna, a lučenje paratireoidnoga hormona autonomno i neovisno o stvarnom poticaju (hipokalcijemija, hiperfosfatemija). Kliničko-patofiziološke posljedice, kao i dijagnostički postupak istovjetni su onima kod sekundarnoga hiperparatireoidizma, ali temelj liječenja predstavlja operativno odstranjenje hiperplastičnih žlijezda.
HIPOPARATIREOIDIZAM
Definicija. Hipoparatireoidizam je klinički poremećaj kojega karakterizira smanjena sekrecija paratireoidnoga hormona uslijed poremećaja samih paratireoidnih žlijezda ili uslijed neosjetljivosti ciljnih organa na djelovanje paratireoidnoga hormona (pseudohipoparatireoidizam). Hipoparatireoidizam je značajno rjeđi poremećaj rada doštitnih žlijezda u odnosu na hiperparatireoidizam.
Etiopatogeneza. Ovisno o etiopatogenezi razlikujemo nekoliko oblika: ijatrogeni, idiopatski, kongenitalni i funkcionalni hipoparatireoidizam te pseudohipoparatireoidizam.
Ijatrogeni hipoparatireoidizam. Kirurška ablacija paratireoidnih žlijezda prilikom operativnih zahvata u regiji prednje strane vrata najčešći je uzrok hipoparatireoidizma. Rizik od ovoga događaja je utoliko veći, ukoliko je operativni zahvat opsežniji (totalna tireoidektomija, disekcija vratnih limfnih čvorova, velike strume), što je veća dob bolesnika te ukoliko je intraoperativno identificirano manje od dvije paratireoidne žlijezde. Radioterapija regije vrata također može biti uzrok ovoga poremećaja, iako se to rijetko viđa u svakodnevnoj kliničkoj praksi.
Idiopatski hipoparatireoidizam označava hipoparatireoidizam nepoznate etiologije, iako se danas smatra da nastaje kao posljedica autoimunoga procesa pa se sve više govori o autoimunom hipoparatireoidizmu. U prilog autoimunom procesu govori činjenica da se obično pojavljuje kod bolesnika koji boluju i od drugih autoimunih bolesti te se može javiti kao dio autoimunoga poliglandularnog sindroma.
Kongenitalni hipoparatireodizam nastaje uslijed izostanka razvoja paratireoidnih žlijezda, što se može pojaviti uslijed nekih genetskih sindroma (DiGeorgeov sindrom, Kearns-Sayreov sindrom, Barakat sindrom). S obzirom na to da se klinička slika razvija u djetinjstvu, predmet je izučavanja pedijatara.
Funkcionalni hipoparatireoidizam nastaje kao posljedica hipomagnezijemije koja je obično posljedica crijevne malapsorpcije ili kroničnoga alkoholizma. Značajno snižene vrijednosti magnezija djeluju inhibitorno na lučenje paratireoidnoga hormona. Nadoknadom magnezija dolazi i do oporavaka sekrecije paratireoidnoga hormona.
Pseudohipoparatireoidizam nastaje kao posljedica neosjetljivosti (rezistencije) ciljnih organa na djelovanje paratireoidnoga hormona čije je stvaranje i lučenje normalno očuvano. Radi se o genetski uvjetovanom poremećaju koji se dijeli u nekoliko podskupina.
Ostali uzroci hipoparatireoidizma uključuju oštećenja žlijezda nakupljanjem željeza (hemokromatoza), bakra (Wilsonova bolest), kao i granulomatozne bolesti te tumori i infekcije vratne regije.
Klinička slika. Kliničke manifestacije hipoparatireoidizma posljedica su poremećaja metabolizma kalcija i fosfata koji nastaju uslijed manjka učinka paratireoidnoga hormona – hipokalcijemija, hiperfosfatemija. Simptomi i znakovi ovise o stupnju hipokalcijemije, a mogu se podijeliti u dvije skupine: neurološke i neuromuskularne. Neurološke se manifestacije temelje na poremećaju raspoloženja, kognitivnim smetnjama, a neuromuskularne nastaju kao posljedica pojačane podražljivosti (parestezije, spazam proksimalnih mišića, laringealni spazam). Karakteristični su Chvostekov i Trousseauov znak (opisano u poglavlju o hipokalcijemiji).
Dijagnoza se temelji na laboratorijskim nalazima koji uključuju hipokalcijemiju, hiperfosfatemiju te snižene vrijednosti paratireoidnoga hormona (iako u pseudohipoparatireoidizmu on može biti uredan ili povišen). S obzirom na utjecaj magnezija na sekreciju paratireoidnoga hormona, preporuča se praćenje i njegovih vrijednosti. Slikovne metode imaju manji dijagnostički značaj. Elektrokardiogram kod hipokalcijemije pokazuje produljen QTc interval. Kod izraženih neuroloških manifestacija preporuča se neuroradiološka obrada.
Liječenje. Bolesnici s umjerenim hipoparatireoidizmom ne zahtijevaju odmah i liječenje, nego kontrole i praćenje. Liječenje se preporučuje kod simptomatskih bolesnika te kod bolesnika s vrijednostima kalcija nižim od 2 mmol/L (odnosno 8.0 mg/dL), a ono uključuje primjenu vitamina D i njegovih analoga, nadoknadu kalcija te primjenu rekombinantnoga humanoga paratireoidnog hormona. Početno liječenje uključuje primjenu vitamina D (kalcitriol 0,25 - 4 mg/dan; kolekalciferol 10,000 - 50,000 i.j./dan; ergokalciferol 25,000 - 150,000 i.j./dan) te preparata kalcija (800 - 1000 mg/dan). Ako se na taj način ne postigne zadovoljavajuća kontrola bolesti, opravdano je u terapiju uvesti rekombinantni humani paratireoidni hormon (rhPTH), iako to nije dio široke kliničke prakse. U slučaju hipomagnezijemije potrebna je supstitucija magnezija.
Prognoza. Ako se poremećaj prepozna na vrijeme te se započne s prikladnim liječenjem, prognoza ovih bolesnika je u načelu dobra i ne narušava značajnije kvalitetu života.
BOLESTI KORE NADBUBREŽNIH ŽLIJEZDAA
Uvod. Kora nadbubrežne žlijezde (adrenokorteks) luči hormone koje jednim imenom nazivamo kortikosteroidi, a to su mineralokortikoidi koji primarno djeluju na metabolizam elektrolita, glukokortikoidi koji primarno djeluju na intermedijarni metabolizam te androgeni hormoni.
Građa adrenokorteksa. Kora nadbubrežne žlijezde sastoji se od tri sloja (zona glomerulosa, zona fasciculata i zona reticularis) u kojima se zasebno odvijaju sinteze pojedinih skupina hormona. Zona glomerulosa leži ispod kapsule nadbubrežne žlijezde i čini oko 15 % korteksa, a odgovorna je za stvaranje i lučenje mineralokortikoida čiji je predstavnik aldosteron. Lučenje mineralokortikoida (aldosterona) potiču angiotenzin II te povišene vrijednosti kalija. Zona fasciculata čini oko 75 % korteksa, a odgovorna je za stvaranje i lučenje glukokortikoida čiji je glavni predstavnik kortizol. U manjoj se mjeri u ovoj zoni stvaraju i androgeni hormoni. Lučenje ovih hormona je pod utjecajem adrenokortikotropnoga hormona (ACTH) koji nastaje u adenohipofizi. Zona reticularis nalazi se uz samu srž nadbubrežne žlijezde, a odgovorna je za stvaranje u lučenje androgena (dihidroepiandrosteron, androstendion te manje količine estrogena), a lučenje ovih hormona također je pod utjecajem adrenokortikotropnoga hormona.
Kortikosteroidi. Svi hormoni kore nadbubrežne žlijezde po svojoj su kemijskoj građi steroidi, a nastaju složenim biokemijskim procesima iz kolesterola. Glavni predstavnici kortikosteroida su aldosteron i kortizol, ali ovim procesima nastaju i drugi kortikosteroidni hormoni. Neki od njih pokazuju i glukokortikoidni i mineralokortikoidni učinak. U Tablici 7.11. su prikazani glavni predstavnici hormona s mineralokortikoidnim i glukokortikoidnim učinkom.
|
Tablica 7.11. Učinci hormona kore nadbubrežne žlijezde
|
|
Mineralokortikoidni učinak
|
Aldosteron, deoksikortikosteron, kortikosteron, 9-α-fluorokortizol, kortizol, kortizon
|
|
Glukokortikoidini učinak
|
Kortizol, kortikosteron, kortizon, prednizon, metilprednizon, deksametazon
|
Fiziologija glukokortikoida. Glukokortikoidi su hormoni kore nadbubrežne žlijezde s dominantnim učinkom na intermedijarni metabolizam. Glavni glukokortikoid je kortizol (hidrokortizon). Djelovanje na intermedijarni metabolizam posredovano je glukokortikoidnim receptorima tipa II koji se nalaze na ciljnim tkivima. Osim učinka na metabolizam, glukokortikoidi imaju i snažni protuupalni i imunosupresivni učinak. Glukokortikoidi se nazivaju hormoni stresa zbog njihova pojačanoga lučenja kao odgovora na fizički stres (fizički napor, traume, operacije i sl), a i psihički stres također može dovesti do povišenja razine glukokortikoida. Zbog toga se vrijednosti glukokortikoida tijekom dana znatno mijenjaju.
Metabolički učinci glukokortikoida. Glavni metabolički učinci glukokortikoida su oni na metabolizam ugljikohidrata i proteina te u manjoj mjeri na lipide. Oni dovode do smanjenoga intracelularnog unosa i iskorištavanja glukoze (djeluju kao antagonisti inzulina) te potiču glukoneogenezu što vodi u hiperglikemiju. Reducira se sinteza i pojačava razgradnja proteina, posebno u mišićima. Ovi hormoni uzrokuju i aktivaciju lipaze pa tijekom duže izloženosti povećanim količinama glukokortikoida dolazi do karakteristične redistribucije masti u organizmu (vidi Cushingov sindrom).
Protuupalni i imunosupresivni učinci glukokortikoida. Za glukokortikoide karakteristični su imunosupresivni i protuupalni učinci zbog čega su često korišteni u terapijske svrhe. Te učinke ostvaruju izravnim djelovanjem na upalne stanice te medijatore upalnoga i imunološkog odgovora.
Ostali učinci glukokortikoida. Glukokortikoidi imaju i snažan učinak na druge stanice kao što su fibroblasti te koštane stanice. Oni smanjuju funkciju fibroblasta (otežano cijeljenje rana) kao i funkciju osteoblasta uz poticanje osteoklasta što vodi prema smanjenju koštane gustoće i nastanka osteoporoze.
Fiziologija mineralokortikoida. Mineralokortikoidi su hormoni kore nadbubrežne žlijezde s pretežnim učinkom na homeostazu elektrolita i ekstracelularne tekućine. Glavni predstavnik je aldosteron, a njegova dva najvažnija učinka su regulacija volumena ekstracelularne tekućine te uloga u metabolizmu natrija i kalija što je usko povezano. Aldosteron primarno djeluje na epitelne stanice bubrežnih kanalića gdje povećava reapsorpciju natrija uz istodobno povećanu sekreciju kalija. Na taj način aldosteron potiče zadržavanje natrija u ekstracelularnoj tekućini čime se povećava njezin volumen, kao i pojačano izlučivanje kalija putem mokraće. Uz ovaj učinak, aldosteron u umetnutim stanicama kortikalnih sabirnih cijevi potiče i sekreciju vodikovih iona u zamjenu za natrij čime se smanjuje koncentracija vodikovih iona u ekstracelularnoj tekućini te uzrokuje blažu alkalozu. Najsnažniji poticaji za lučenje aldosterona su povećana koncentracija kalijevih iona u ekstracelularnoj tekućini te povećana aktivnost renin-angiotenzin sustava (učinak angiotenzina II). Povećana razina natrija u ekstracelularnoj tekućini neznatno smanjuje lučenje aldosterona.
Fiziologija adrenalnih androgena. Kora nadbubrežne žlijezde u većim količinama luči muške spolne hormone (dihidroepiandrosteron, androstendion), dok je lučenje progesterona i estrogena znatno manje. Učinak ovih hormona u perifernim tkivima nastaje pretvorbom adrenokortikalnih androgena u testosteron.
Bolesti kore nadbubrežne žlijezde. Dvije su osnovne skupine bolesti kore nadbubrežne žlijezde: hiperfunkcija adrenokorteksa te hipofunkcija adrenokorteksa (prikazano u Tablici 7.12.).
|
Tablica 7.12. Bolesti kore nadbubrežne žlijezde
|
|
Hiperfunkcija adrenokorteksa
|
Hipofunkcija adrenokorteksa
|
|
Cushingov sindrom (sindrom viška glukokortikoida)
Hiperaldosteronizam (sindrom viška mineralokortikoida)
Hiperandrogenizam (sindrom viška androgena)
|
Primarna insuficijencija adrenokorteksa (Morbus Addison)
Sekundarna insuficijencija adrenokorteksa
Izolirani hipoaldosteronizam
|
CUSHINGOV SINDROM
Definicija. Cushingov sindrom je naziv za stanje koje nastaje kao posljedica prolongirane izloženosti tkiva povišenim vrijednostima glukokortikoida, bilo da se radi o endogeno nastalima (endogeni Cushingov sindrom), bilo o egzogeno unesenim glukokortikoidima (egzogeni ili jatrogeni Cushingov sindrom).
Epidemiologija. Stvarnu učestalost Cushingova sindroma teško je procijeniti s obzirom na širok raspon kliničkih manifestacija, kao i jačine njihove ekspresije te velik dio bolesnika ostaje neprepoznat. Neke studije pokazuju godišnju incidenciju od 1,2 do 1,7 oboljelih na milijun stanovnika. Ukupno gledano, bolest se češće javlja kod žena (omjer 5:1), ali Cushingov sindrom koji nastaje kao posljedica ektopičnoga lučenja ACTH-a češći je kod muškaraca (zbog veće učestalosti karcinoma pluća koji luči ACTH). Bolest se najčešće javlja kod osoba srednje životne dobi i to najčešće između 25. i 40. godine života.
Etiopatogeneza endogenoga Cushingovog sindroma. Endogeno nastali Cushingov sindrom posljedica je pojačanoga stvaranja i izlučivanja glukokortikoida iz kore nadbubrežne žlijezde. Ovisno o uzroku i mehanizmu nastanka dijeli se u dvije skupine: Cushingov sindrom neovisan o ACTH-u i Cushingov sindrom ovisan o ACTH-u.
Cushingov sindrom neovisan o ACTH-u nastaje kao posljedica autonomne sekrecije glukokortikoida koja se odvija bez stimulacije adrenokortikotropnim hormonom. Posljedično povišenim vrijednostima glukokortikoida dolazi do supresije lučenja ACTH-a iz adenohipofize (mehanizam negativne povratne sprege) te su njegove plazmatske vrijednosti snižene. Najčešći uzroci ovoga oblika Cushingova sindroma su: adrenokortikalni adenom, adrenokortikalni karcinom, adrenokortikalna mikronodularna hiperplazija te adrenokortikalna makronodularna hiperplazija.
Adrenokortikalni adenom predstavlja dobroćudni tumor kore nadbubrežne žlijezde koji sadržava autonomnu sposobnost stvaranja i izlučivanja glukokortikoida, poglavito kortizola. Radi se o najčešćem uzroku Cushingovoga sindroma neovisnoga o ACTH-u s godišnjom učestalošću od 0,6 oboljelih na milijun stanovnika.
Adrenokortikalni karcinom predstavlja zloćudni tumor kore nadbubrežne žlijezde koji sadržava autonomnu sposobnost stvaranja i izlučivanja glukokortikoida, a ponekad i androgena. Godišnja učestalost karcinoma adrenokorteksa procjenjuje se na oko 0,2 oboljelih na milijun stanovnika.
Adrenokortikalna mikronodularna hiperplazija označava bilateralno povećanje kore nadbubrežne žlijezde koje karakteriziraju noduli koji su u promjeru manji od 1 cm, a povezano je s povećanom produkcijom glukokortikoida. S obzirom na patohistološki nalaz, ona se dijeli u dvije skupine: pigmentirana mikronodularna hiperplazija s internodularnom atrofijom te nepigmentirana mikronodularna hiperplazija bez internodularne atrofije. Pigmentirani oblik može se javiti kao izolirani poremećaj ili u sklopu Carneyevoga sindroma (kožne hiperpigmentacije, miksom, endokrine neoplazije), a smatra se da nastaje uslijed genskoga defekta (mutacija PRKAR1A gena koji utječe na funkciju protein kinaze A). Genetska podloga nepigmentiranoga oblika mikronodularne hiperplazije je nepoznata.
Adrenokrortikalna makronodularna hiperplazija označava bilateralno povećanje kore nadbubrežne žlijezde koje karakteriziraju nepigmentirani noduli veći od 1 cm u promjeru, a također je povezano s hiperprodukcijom glukokortikoida. Mehanizam nastanka je nepoznat, a sumnja se da ulogu mogu imati genetske mutacije, parakrina sekrecija adrenokortikotropnoga hormona ili poremećaji njegova receptora na adrenokorteksu (nađeni su aberantni receptori koje mogu stimulirati i drugi hormoni poput serotonina, katekolamina, luteinizacijskoga hormona i dr.).
Cushingov sindrom ovisan o ACTH-u nastaje kao posljedica pojačane produkcije glukokortikoida kao posljedice hiperstimulacije adrenokortikotropnim hormonom. Ovaj oblik Chusingova sindroma najčešće nastaje na dva načina: sekretorni adenom hipofize te ektopično lučenje ACTH-a.
Sekretorni adenom hipofize (Cushingova bolest) je jedan od najčešćih uzroka Cushingova sindroma. Radi se o tumoru adenohipofize koji nastaje iz kortikotropnih stanica i ima očuvanu autonomnu sekreciju ACTH koji djeluje na nadbubrežne žlijezde i dovodi do njihove hiperplazije i hipersekrecije glukokortikoida.
Ektopično lučenje adrenokortikotropnoga hormona posljedica je sekrecije ACTH-a iz malignih tumora u sklopu paraneoplastičnoga sindroma, a najčešće se radi o mikrocelularnom karcinomu pluća, karcinomu gušterače te karcinoidu.
Etiopatogeneza egzogenoga Cushingovog sindroma. Ovaj oblik Cushingova sindroma naziva se i lijekovima izazvan Cushingov sindrom ili ijatrogeni Cushingov sindrom, s obzirom na to da se javlja kao posljedica prolongirane terapije glukokortikoidima. Težina poremećaja povezana je prvenstveno s primijenjenom dozom i duljinom trajanja liječenja. S obzirom na to da su glukokortikoidi osnovni lijekovi u liječenju cijeloga spektra imunološki posredovanih bolesti, i njegova incidencija je velika i čini najčešći uzrok Cushingova sindroma uopće.
Patofiziologija. Svi poremećaji koji nastaju kod ovih bolesnika posljedica su prolongirane izloženosti perifernih tkiva povišenim vrijednostima glukokortikoida (hiperkorticizam). Kortizol djeluje kao antagonist inzulinu i zato smanjuje iskorištavanje glukoze te simulira glukoneogenezu zbog čega se razvija hiperglikemija. Također, kortizol pojačava katabolizam i smanjuje anabolizam proteina što dovodi do negativne bilance dušika. Ovaj učinak je najizraženiji u skeletnim mišićima pa dolazi do smanjenja mišićne mase što je najizraženije na proksimalnim dijelovima udova. Zbog svoga specifičnog djelovanja na metabolizam masti, kortizol uzrokuje specifičnu redistribuciju masnoga tkiva (centralno nakupljanje masti). Također, kortizol smanjuje aktivnost osteoblasta te pojačava aktivnost osteoklasta pa dolazi do razvoja osteopenije i osteoporoze, a zbog svoga specifičnog utjecaja na imunološki sustav dovodi do nastanka imunosupresije. Shematski prikaz učinka hiperkorticizma prikazan je na Slici 7.2.

Slika 7.2. Shematski prikaz učinka hiperkorticizma
Klinička slika. Simptomi i znaci bolesti proizlaze iz poznatoga djelovanja glukokortikoida. Bolesnike s potpuno razvijenim Cushingovim sindromom lako je prepoznati zbog njihovog karakterističnog tzv. "kušingoidnog" izgleda. Dominantno do izražaja dolazi raspored masnoga tkiva pri čemu se on pojačava na nekim dijelovima tijela kao što je lice (izgled poput mjeseca, facies lunata), interskapularno područje (vratna grba) te mezenterij (tipična trupna debljina) uz gubitak mišićne mase proksimalnih skupina mišića pri čemu ekstemiteti djeluju izrazito mršavi i hipotrofični. Uočljive su i promjene na koži koje uključuju pojavu strija (osobito u području trbuha i leđa) te hematoma, kao posljedice pucanja kolagenih vlakana u dermisu. Bolesnici se žale na umor i malaksalost, gubitak mišićne snage, a često se razvija i anksiozno depresivni sindrom. Zbog razvoja osteoporoze češće su patološke frakture. Kod nekih bolesnika pojačano se luče i androgeni zbog čega bolesnici mogu imati akne, hirzutizam te poremećaj menstruacijskoga ciklusa (oligomenoreja/amenoreja). Kod gotovo svih bolesnika nalazimo izraženu arterijsku hipertenziju.
Dijagnoza se postavlja kroz dvije faze. Prvo je potrebno potvrditi postojanje samoga Cushingovog sindroma, a potom je potrebno usmjeriti dijagnostički postupak na otkrivanje uzroka poremećaja. Sumnju na ovaj poremećaj pobuđuje kušingoidni habitus bolesnika, poremećena tolerancija glukoze (hiperglikemija) te nalaz arterijske hipertenzije.
Osnovna dijagnostička obrada – probir bolesnika na Cushingov sindrom. Pri sumnji na ovu bolest postoji nekoliko testova koji su nam na raspolaganju: koncentracija slobodnoga kortizola u 24-satnom urinu, prekonoćni test supresije s 1 mg deksametazona, ponoćno određivanje vrijednosti koritizola u serumu te kasnovečernje određivanje vrijednosti kortizola u slini (danas gotovo napuštena metoda). Ovim se testovima potvrđuje ili isključuje Cushingov sindrom.
Određivanje koncentracije slobodnoga kortizola u 24-satnom urinu jedan je od najčešćih testova probira pri sumnji na Cushingov sindrom. Test ima osjetljivost veću od 95 % i specifičnost veću od 98 % ako bolesnici pravilno skupe urin (skupljanje počinje ujutro nakon prvoga jutarnjeg urina, a završava s prvim jutarnjim urinom sljedećega jutra). Normalne vrijednosti slobodnoga kortizola u 24-urinu iznose 80 - 120 µg/dan. Ako dobivena vrijednost tri puta premašuje gornju granicu, velika je vjerojatnost da se radi o Cushingovom sindromu, dok vrijednosti povišene u manjem rasponu zahtijevaju ponavljanje testa, odnosno dodatnu obradu.
Prekonoćni test supresije s 1 mg deksametazona (DST) ključni je test za potvrđivanje ovoga poremećaja. Osjetljivost je veća od 98 %, dok je specifičnost nešto niža i čini oko 75 %. Test se izvodi tako da se u 23 sata bolesnicima da 1 mg deksametazona per os te se sljedeći dan u 8 sati određuje vrijednost kortizola u plazmi. Kod zdravih osoba primjena deksametazona dovest će do supresije lučenja ACTH-a, što će dovesti do smanjenoga lučenja kortizola. Koncentracija kortizola < 50 nmol/l isključuje autonomno lučenje kortizola (isključen Cushingov sindrom), koncentracija kortizola 51 - 138 nmol/l upućuje na moguće autonomno lučenje kortizola, dok koncentracija kortizola >138 nmol/l upućuje na autonomno lučenje kortizola (potvrđen Cushingov sindrom). Kod tumačenja ovoga nalaza treba misliti na bolesti i stanja koja mogu također dovesti do hiperkortizolemije.
Ponoćno mjerenje serumskoga kortizola podrazumijeva uzorkovanje krvi između 23 i 24 sata kada su normalno vrijednosti kortizola najniže s obzirom na to da je i lučenje ACTH-a tijekom noći najniže. Test se provodi uzorkovanjem krvi dvije noći zaredom. Na Cushingov sindrom ukazuju vrijednosti kortizola veće od 210 nmol/L.
Kasnovečernje mjerenje kortizola u slini temelji se na činjenici da je količina kortizola u slini kod bolesnika s ovim poremećajem tijekom večernjih sati znatno viša u odnosu na zdravu populaciju. Uzorkovanje se preporuča učiniti kao i kod mjerenja serumskoga kortizola između 23 i 24 sata. Vrijednosti kortizola u slini više od 200 nmol/L suspektne su na ovaj poremećaj. Ovaj se test nije ušao u širu kliničku praksu.
Dodatna dijagnostička obrada – ispitivanje uzroka Cushingova sindroma. Svi bolesnici kojima je nekim od gore navedenih testova postavljena dijagnoza Cushingova sindroma moraju proći dodatnu obradu kako bi se otkrio uzrok te kako bi se moglo provesti daljnje liječenje. Prvi korak u ovom slučaju označava određivanje vrijednosti ACTH-a u plazmi kako bi se dobio uvid radi li se o ACTH-u ovisnom ili neovisnom poremećaju te se sukladno tome provode daljnje slikovne dijagnostičke metode. Povišene vrijednosti ACTH-a ukazuju na Cushingov sindrom ovisan o ACTH-u.
Kod sumnje na Cushingov sindrom neovisan o ACTH-u potreban je CT nadbubrežnih žlijezda kojim će se utvrditi postojanje poremećaja kao što su primarna hiperplazija, adenom ili karcinom nadbubrežnih žlijezda. Najčešće se radi o adenomima, rjeđe o adenokarcinomima. Kod svih radioloških nalaza suspektnih na maligni proces potrebna je žurnija kirurška reevaluacija. Ako CT ne pokaže patološke promjene, najvjerojatnije se radi o primarnoj pigmentiranoj mikronodularnoj bolesti adrenokorteksa.
Kod sumnje na Cushingov sindrom ovisan o ACTH-u potreban je MR hipofize kako bi se otkrilo radi li se o adenomu hipofize koji luči ACTH (Cushingova bolest). U 50 % slučajeva na ovaj se način dokaže funkcionalni adenom adenohipofize. Kod urednoga ili nesignifikantnog nalaza MR-a hipofize potrebna je invazivna pretraga kojom se uzorkuje venska krv iz donjega petroznog sinusa prije i nakon stimulacije hormonom koji oslobađa kortikotropin (CRH). Povišene vrijednosti ACTH-a prije kao i nakon primjene CRH-a govore u prilog mikroadenomu hipofize koji se ne može prikazati konvencionalnim radiološkim metodama. Ako su MRI hipofize kao i određivanje ACTH iz donjega petroznog sinusa uredni, potrebno je provesti dijagnostiku s ciljem traganja za ektopičnim lučenjem ACTH-a (mikrocelularni karcinom pluća, medularni karcinom štitne žlijezde, karcinom pankreasa).
Diferencijalna dijagnoza. Kod dijagnostičkoga pristupa bolesniku sa sumnjom na Cushingov sindrom tijekom obrade treba imati na umu da određena stanja i bolesti mogu imati sličan, „kušingoidni“ fenotip, kao i da vrijednosti kortizola (hiperkortizolemija) mogu biti povišene i kod nekih drugih bolesti i stanja (Tablica 7.13.).
|
Tablica 7.13. Diferencijalna dijagnoza Cushingova sindroma
|
|
Fenotipska sličnost (kušingoidni izgled)
|
Drugi uzroci hiperkortizolemije
|
|
Pretilost
Metabolički sindrom
Sindrom policističnih jajnika
Hiperreaktivost na glukokortikoide
Manjak hormona rasta (nanizam)
|
Stres (akutna bolest, operacija, fizički i psihički stres)
Kronični alkoholizam i apstinencijski sindrom
Psihička oboljenja (depresija, psihoza, bulimija, anoreksija)
Kronična bubrežna bolest
Nekontrolirana šećerna bolest
|
Liječenje. Osnovno liječenje Cushingova sindroma je kirurško liječenje, dok je medikamentno (primjena lijekova koji inhibiraju lučenje hormona nadbubrežne žlijezde) rezervirano za bolesnike koji se ne mogu kirurški liječiti ili je kirurško liječenje neuspjelo.
Kirurško liječenje ovisi o uzroku Cushingova sindroma, a podrazumijeva kirurško liječenje tumora hipofize, tumora koji ektopično luči ACTH ili tumora nadbubrežne žlijezde. Kod inoperabilnih tumora odgovorih za ektopično lučenje ACTH-a u obzir dolazi i laparoskopska bilateralna adrenalektomija ako se posljedice hiperkortizolizma ne mogu drugačije kontrolirati.
Medikamentno liječenje u pravilu je simptomatsko liječenje koje se primjenjuje kada se kirurško liječenje ne može provesti ili je ono neuspjelo. Ono je usmjereno na primjenu lijekova kojima se smanjuje sekrecija adrenkortikotropnoga hormona (opisano u poglavlju bolesti adenohipofize), lijekova koji inhibiraju adrenokortikalnu steroidogenezu (metirapon, ketokonazol, etomidat), lijekova koji djeluju kao antagonisti glukokotikoidnih receptora (mifepriston) ili lijekova koji djeluju adrenolitički (mitotan).
Ketokonazol je najčešće korišten lijek koji inhibira stvaranje hormona u kori nadbubrežne žlijezde te dovodi do tzv. kemijske adrenalektomije. On djeluje na više enzima uključenih u proces sinteze glukokortikoida. Dnevna doza od 600 do 800 mg dovoljna je za smanjenje dnevne produkcije kortizola. Glavne nuspojave su glavobolja, mučnina, povraćanje, impotencija, ginekomastija te jetrena lezija. Također, ketokonazol produžava QT-interval što može biti opasno kod srčanih bolesnika.
Mitotan je najčešće korišten lijek koji djeluje adrenolitički, odnosno izaziva strukturna i morfološka oštećenja tkiva nadbubrežne žlijezde. Djeluje na enzim 11-β-hidroksilazu te dovodi do destrukcije mitohondrija što sve vodi u nekrozu stanica zone fascikulate i retikularis. Dnevna doza ovoga lijeka iznosi 2 do 4 mg, a najčešće nuspojave su gastrointestinalne smetnje, neurološki ispadi, artralgije i neutropenija.
Mifepriston je predstavnik antagonista glukokortikoidnih receptora koji djeluje i kao antagonist progesteronskih receptora. Koristi se kod bolesnika s endogenim Cushingovim sindromom i razvijenom šećernom bolesti kod kojih je kirurško liječenje kontraindicirano ili nije polučilo uspjeh.
Prognoza ponajprije ovisi o uzroku Cushingova sindroma. Najbolju prognozu imaju bolesnici s dobroćudnim tumorom hipofize (Cushingova bolest) ili nadbubrežne žlijezde, dok je ona znatno lošija kod bolesnika s ektopičnim lučenjem ACTH-a ili karcinomom nadbubrežne žlijezde. Kod bolesnika uz odgovarajuće liječenje dolazi do regresije opisanih kliničkih promjena, iako često zaostaju kognitivne smetnje, mišićna slabost, kao i posljedice osteoporoze.
HIPERALDOSTERONIZAM
Hiperaldosteronizam označava kliničko stanje koje nastaje kao posljedica hipersekrecije mineralokortikoida, prvenstveno aldosterona, iz kore nadbubrežne žlijezde, što dovodi do poremećaja homeostaze elektrolita. Prema etiologiji i načinu nastanka razlikujemo primarni i sekundarni hiperaldosteronizam.
PRIMARNI HIPERALDOSTERONIZAM
Definicija. Primarni hiperaldosteronizam (Connova bolest) označava klinički sindrom koji nastaje kao posljedica pojačanoga autonomnog stvaranja i lučenja aldosterona iz kore nadbubrežne žlijezde. Smatra se da je primarni hiperaldosteronizam odgovoran za 8 do 10 % slučajeva sekundarne hipertenzije. Poremećaj se češće razvija kod žena nego kod muškaraca i to u omjeru 2:1 s vršnom incidencijom u dobi između 30. i 50. godine života.
Etiopatogeneza. U primarnom hiperaldosteronizmu pojačano stvaranje i lučenje aldosterona posljedica je poremećaja na razini same nadbubrežne žlijezde, odnosno radi se o autonomnom lučenju koje nije potaknuto niti inhibirano drugim čimbenicima. Najčešće se radi o adenomu, adenokarcinomu ili hiperplaziji glomerularne zone kore nadbubrežne žlijezde. Rjeđe, primarni hiperaldosteronizam može biti posljedica genetskih poremećaja (obiteljski hiperaldosteronizam) ili ektopičnoga lučenja aldosterona (paraneoplastički sindrom).
Idiopatska hiperplazija glomerularne zone kore nadbubrežne žlijezde te adenomi kore nadbubrežne žlijezde koji luče aldosteron danas se smatraju glavnim i najčešćim uzrokom primarnoga hiperaldosteronizma. Njihova etiologija nije poznata, a sve više se govori o proliferativnom odgovoru na neki autokrini ili parakrini faktor. Karcinom kore nadbubrežne žlijezde koji luči aldosteron rijedak je uzrok ovoga poremećaja.
Obiteljski hiperaldosteronizam dolazi u nekoliko oblika, a najznačajniji je obiteljski hiperaldosteronizam tip I u kojemu nalazimo genetski poremećaj koji uključuje rekombinaciju između gena za 11β-hidroksilazu (enzim koji je osjetljiv na ACTH stimulaciju) i gena za aldosteron-sintetazu koji se nalaze na 8. kromosomu, pri čemu nastaje hibridni genski produkt – aldosteron-sintetaza osjetljiva na ACTH stimulaciju. Zbog toga glomerularna zona postaje osjetljiva na djelovanje ACTH-a te dolazi do hipersekrecije aldosterona i razvoja sekundarne bilateralne hiperplazije. Karakteristika ovoga poremećaja je mogućnost supresije lučenja aldosterona primjenom glukokortikoida (glukokortikoidi suprimiraju produkciju ACTH-a).
Patofiziologija. Posljedično pojačanom učinku aldosterona na razini epitelnih stanica distalnoga tubula i sabirnih kanalića dolazi do pojačane reapsorpcije natrija i vode praćeno pojačanom sekrecijom kalija i vodika. Posljedično tim zbivanjima dolazi do povećanja volumena ekstracelularne tekućine, umjerene hiponatrijemije, hipokalijemije i blage metaboličke alkaloze. Povećan volumen ekstracelularne tekućine pogoduje razvoju arterijske hipertenzije. Kod većine ovih bolesnika razvija se i poremećaj tolerancije glukoze kao posljedica inhibitornoga učinka hipokalijemije na lučenje i djelovanje inzulina.
Klinička slika. Kliničke manifestacije u primarnom hiperaldosteronizmu prvenstveno su posljedica arterijske hipertenzije i hipokalijemije. Na ovaj poremećaj ukazuje refraktorna arterijska hipertenzija, pretežno dijastoličkoga tipa, koja se javlja kod osoba mlađe i srednje životne dobi, a dodatnu dozu sumnje unosi činjenica da se pri obradi otkrije i hipokalijemija. Bolesnici mogu imati standardna klinička očitovanja arterijske hipertenzije (okcipitalna glavobolja, epistakse, opresije u prsima i sl.), a ranije se razvijaju i njezine komplikacije. Edemi kao posljedica retencije natrija i vode nisu čest klinički nalaz ovih bolesnika. Hipokalijemija može biti uzrok mišićne slabosti, glavobolje, usporenoga crijevnog motiliteta i palpitacija.
Dijagnoza. Dijagnostički postupak započinje postavljanjem sumnje na primarni hiperadosteronizam. Kod svih bolesnika kod kojih postoji klinička sumnja indicirano je provođenje testova probira i testova potvrde ovog poremećaja, a potom se dijagnostički postupak usmjerava na otkrivanje uzroka primarnoga hiperaldosteronizma.
Sumnja na primarni hiperaldosteronizam. Na primarni hiperaldosteronizam treba pomišljati kod bolesnika (osobito mlađih) s arterijskom hipertenzijom koja slabo reagira na antihipertenzive uz nalaz hipokalijemije kojoj se ne nalazi uzrok (niske doze diuretika ili hipokalijemija bez diuretika). Također, treba imati na umu da u početnoj fazi bolesti ne mora biti jasno izražena hipokalijemija. Ostali laboratorijski nalazi koji se mogu naći kod ovih bolesnika su umjerena hipernatrijemija te umjerena metabolička alkaloza.
Probir bolesnika na primarni hiperaldosteronizam. Kod svih bolesnika kod kojih se sumnja na ovaj poremećaj potrebno je odrediti plazmatsku reninsku aktivnost (PRA) ili renin te aldosteron u serumu. U slučaju primarnoga aldosteronizma nalazimo snižene vrijednosti PRA-a (< 1 µg/L/h) te povišene vrijednosti aldosterona (> 416 pmol/L). Također, potrebno je odrediti omjer aldosterona i PRA pri čemu omjer veći od 30 govori u prilog primarnom hiperaldosteronizmu.
Potvrda primarnoga hiperaldosteronizma. Ako omjer aldosterona i PRA (ili aldosterona i renina) ukazuju na ovaj poremećaj i planira se operativni zahvat, potrebno je provesti test opterećenja solju. Nakon infuzije 2000 ml 0,9 %-tnoga natrijevog klorida tijekom 4 sata kontrolira se vrijednost aldosterona, a vrijednost viša od 277 pmol/L upućuje na primarni hiperaldosteronizam. Ako se planira operativni zahvat, radi se i kateterizacija nadbubrežnih vena s određivanjem aldosterona kako bi se sa sigurnošću utvrdila lokalizacija.
Dijagnostika uzroka primarnog hiperaldosteronizma. U verificiranju uzroka ovoga poremećaja koristimo se slikovnim metodama. U većini se slučajeva na temelju nalaza CT-a ili MR-a nadbubrežnih žlijezda može zaključiti radi li se o adenomu, karcinomu ili primarnoj hiperplaziji. Dodatno, ako se ne može verificirati uzrok, moguća je scintigrafija nadbubrega s NP-59 jodokolesterolom (jednostrana pojačana apsorpcija govori u prilog adenomu) ili se kateteriziraju lijeva i desna adrenalna vena te se vrši uzorkovanje s mjerenjem aldosterona.
Liječenje u osnovi ovisi o uzroku. Adenomi adrenokorteksa koji luče aldosteron primarno se rješavaju kirurškim putem (laparoskopska adrenalektomija). Liječenje bilateralne hiperplazije je medikamentno te podrazumijeva primjenu antagonista mineralokortikoida (spironolakton, eplerenon) te dobru kontrolu krvnoga tlaka (blokatori kalcijskih kanala, ACE inhibitori ili blokatori angiotenzinskih receptora). Iako rijedak u kliničkoj praksi, obiteljski hiperaldosteronizam tip I dobro reagira na primjenu niskih doza glukokortikoida. Adenokarcinomi adrenokorteksa zahtijevaju operativno liječenje s ili bez dodatne onkološke terapije.
Prognoza ovisi o uzroku. Kirurško liječenje adenoma osigurava potpun oporavak. Uz prikladno liječenje primarnoga hiperaldosteronizma bolesnika s bilateralnom hiperplazijom dobra kontrola krvnoga tlaka postiže se kod više od 2/3 bolesnika.
SEKUNDARNI HIPERALDOSTERONIZAM
Sekundarni hiperaldosteronizam nastaje kao posljedica pojačane aktivnosti renin-angiotenzinskog sustava (tzv. hiperreninemički hiperaldosteronizam) pri čemu angiotenzin II dovodi do snažne stimulacije adrenokorteksa na lučenje aldosterona. Aktivacija renin-angiotenzin sustava ponajprije je uzrokovana hipoperfuzijom bubrega što se susreće uslijed različitih bolesti i stanja (bolesti krvnih žila bubrega, kronično srčano popuštanje, dekompenzirana ciroza jetre, kronična bolest bubrega i nefrotski sindrom, tumori koji luče renini dr.). Kliničko-patofiziološke posljedice jednake su onima kod primarnoga hiperaldosteronizma. Glavna razlika između ta dva poremećaja leži u laboratorijskom nalazu plazmatske reninske aktivnosti (PRA) koja je povišena u ovim slučajevima. Liječenje počiva na zbrinjavanju i liječenju uzroka sekundarnoga hiperaldosteronizma.
HIPERANDROGENIZAM
Hiperandrogenizam ili sindrom suviška adrenalnih androgena označava stanje pojačanoga stvaranja i lučenja androgena iz kore nadbubrežne žlijezde s posljedičnim kliničkim promjenama koje nazivamo adrenogenitalni sindrom. Dva najznačajnija poremećaja iz ove skupine su kongenitalna adrenalna hiperplazija te adrenogenitalni sindrom kod odraslih.
KONGENITALNA ADRENALNA HIPERPLAZIJA
Definicija. Kongenitalna adrenalna hiperplazija (KAH) predstavlja skupinu nasljednih monogenetskih bolesti koje obilježava urođeni manjak jednoga od enzima koji sudjeluju u procesu nastanka kortizola u kori nadbubrežne žlijezde. Najčešće se radi o parcijalnom i potpunom defektu enzima 21-hidroksilaze, a rjeđe o defektu enzima 11-β-hidroksialze, 17-α-hidroksilaze ili 3-β-hidroksisteroid-dehidrogenaze.
Etiopatogeneza. Posljedično defektima enzima koji sudjeluju u procesu sinteze kortizola, dolazi do smanjenoga stvaranja i lučenja kortizola u krv zbog čega se razvija hipokortizolemija. Posljedično smanjenim vrijednostima kortizola u krvi pojačava se lučenje adrenokortikotropnoga hormona (ACTH) iz adenohipofize koji djeluje na koru nadbubrežne žlijezde i potiče stvaranje kortizola zbog čega u konačnici dolazi do razvoja hiperplazije adrenokorteksa. Hiperplazija u nekim slučajevima može kompenzatorno nadoknaditi smanjeno stvaranje kortizola, iako u težim oblicima i dalje zaostaje hipokortizolemija. S obzirom na to da ACTH ne stimulira samo proizvodnju kortizola, on stimulira i proizvodnju adrenalnih androgena zbog čega se oni pojačano stvaraju i otpuštaju u krv te dovode do nastanka adrenogenitalnoga sindroma. Neki od defekata enzima zahvaćaju i puteve sinteze mineralokortikoida pa se može javiti i deficit aldosterona (hipoaldosteronizam).
Klinička slika. Fenotipska obilježja, kao i druge kliničke manifestacije, ovise o vrsti i prirodi enzimatskoga deficita (parcijalni, potpuni). U kliničkoj praksi više od 90 % slučajeva kongenitalne adrenalne hiperplazije uzrokovano je mutacijom CIP21B gena koji se nalazi na 6. kromosomu te dovodi do deficita enzima 21-hidroksilaze koji može biti potpun i parcijalan. Potpun deficit 21-hidroksilaze očituje se ubrzo po rođenju razvojem teške insuficijencije kore nadbubrežne žlijezde što kod najvećega dijela djece ubrzo završava smrću, dok se parcijalni deficit 21-hidroksilaze očituje nešto kasnije u dječjoj dobi. Kod djevojčica nalazimo povećanje klitorisa, fuzije labija, preuranjenu pubična i aksilarna dlakavost, pojavu akni, dublji glas te ubrzan razvoj (maskulinizacija). Kod dječaka nalazimo tamnije pigmentirani skrotum, ubrzano povećanje penisa, skrotuma i testisa, pojavu dlakavosti, grubljega glasa te ubrzan rast i razvoj uz povećanje mišićne mase.
Dijagnoza se postavlja na temelju fizikalnoga nalaza (fenotipska obilježja), laboratorijske dijagnostike te slikovnih metoda. U laboratorijskim nalazima bolesnika s deficitom 21-hidroksilaze, osim poremećaja vrijednosti kortizola i adrenokortikotropnoga hormona, nalazimo i povišene vrijednosti 17-hidroksiprogesterona u serumu (glavni supstrat za enzim 21-hidroksilazu) te njegovoga metabolita pregnantriola u urunu. Ultrazvuk trbuha s naglaskom na genitalne organe i/ili CT ili MR daje uvid u morfološke promjene nadbubrežnih žlijezda (bilateralna hiperplazija), kao i unutarnjih spolnih organa (otkrivanje drugih anomalija ili tumora koji mogu također izazvati slična klinička obilježja).
Liječenje. Osnovu liječenja čini nadomjesna terapija glukokortikoidima čime se oni nadoknađuju te se postiže supresija lučenja ACTH-a iz adenohipofize što u konačnici dovodi i do smanjenoga lučenja androgena. U slučaju manjka mineralokortikoida potrebna je i njihova nadoknada. Ponekad su potrebne i kirurške rekonstrukcije vanjskih genitalija.
ADRENOGENITALNI SINDROM KOD ODRASLIH
Adrenogenitalni sindrom kod odraslih najčešće se javlja uslijed karcinoma adrenalne žlijezde. Kako su adrenalni androgeni slabije potentni od onih iz gonada, simptomi se jave tek kod velikih koncentracija. Često se zajedno s androgenima iz tumora nadbubrežne žlijezde luče i drugi hormoni (kortizol, aldosteron). Kod žena se javlja virilizam (hirzutizam, dubok glas, akne, povećanje klitorisa, amenoreja), dok se kod muškaraca ove kliničke manifestacije teže uočavaju. Osim tumora nadbubrega, adrenogenitalni sindrom mogu uzrokovati i drugi hormonski aktivni tumori (jajnici, testisi). U laboratorijskim nalazima ovih bolesnika susreću se povišena vrijednost dehidroepiandrosteron-sulfata (DHA-S) i androstendiona u krvi, dok je u urinu povišen 17-ketosteroid (17-KS). Slikovne dijagnostičke metode kao što su ultrazvuk, kompjuterizirana tomografija i magnetna rezonanca služe za otkrivanje promjena na nadbubrežnim žlijezdama. Liječenje je etiološko.
PRIMARNA INSUFICIJENCIJA ADRENOKORTEKSA (ADDISONOVA BOLEST)
Definicija. Primarna insuficijencija kore nadbubrežne žlijezde ili Addisonova bolest označava kliničko stanje smanjenoga stvaranja i izlučivanja glukokortikoida i/ili mineralokortikoida koje nastaje kao rezultat bolesti i oštećenja samih nadbubrežnih žlijezda. Procijenjena učestalost ovoga poremećaja u općoj populaciji iznosi 2 slučaja na 10 000 osoba.
Etiopatogeneza. Smanjeno stvaranje i izlučivanje kortikosteroidnih hormona posljedica je opsežne destrukcije ili propadanja tkiva nadbubrežne žlijezde, kliničke manifestacije javljaju se kada je uništeno više od 90 % tkiva. Najčešći uzroci su autoimuni adrenalitis, infektivni adrenalitis, infiltrativne bolesti koje zahvaćaju nadbubrežne žlijezde te rijetki genetski poremećaji (adrenoleukodistrofija, kongenitalna adrenalna insuficijencija).
Autoimuni adrenalitis odgovoran je za 60 do 70 % slučajeva Addisonove bolesti. Može se javiti sporadično ili u sklopu autoimunoga poliglandularnog sindroma (tip 1 i tip 2). Točan uzrok i mehanizam nastanka nisu poznati, ali se smatra da genetska predispozicija ima bitnu ulogu. Volumen žlijezda je smanjen, a histološkim nalazom dominiraju infiltrati limfocita i plazma stanica.
Infektivni adrenalitis danas je rjeđi uzrok ovoga poremećaja. Zahvaćenost i oštećenje tkiva nadbubrežne žlijezde može se naći kod različitih infekcija, kao što su meningokokna sepsa (Waterhouse-Friedricheov sindrom), tuberkuloza, kokcidiomikoza, histoplazmoza te citomegalovirusna infekcija. Tuberkuloza je u prošlosti bila najčešći uzrok Addisonove bolesti, no promjenom epidemiološke prilika, ona je danas iznimno rijedak uzrok ovoga poremećaja.
Infiltrativne bolesti. Tumorska infiltracija tkiva nadbubrežne žlijezde također predstavlja jedan od češćih uzroka Addisonove bolesti. Najčešće se radi o metastazama različitih karcinoma (pluća, kolon, dojka) te limfoproliferativnim bolestima. Svakako treba napomenuti da, iako su nadbubrežne žlijezde često sijelo metastatskih tumora, ovaj poremećaj se malokad razvija u njima (rijetko dovedu do opsežne destrukcije tkiva). Drugi, rjeđi uzorci su amiloidoza, hemokromatoza, te Wilsonova bolest.
Genetski poremećaji. Primarna insuficijencija adrenokorteksa može se naći i u nekim nasljednim bolestima, kao što su adrenoleukodistrofija te obiteljska deficijencija kortikosterioda. Adrenoleukodistrofija označava rijetku, X-vezanu nasljednu bolest koju karakterizira poremećaj β-oksidacije masnih kiselina pri čemu dolazi do akumulacije masnih kiselina dugih lanaca u adrenokorteksu, testisima, mozgu i kralješničnoj moždini. Obiteljska deficijencija kortikosteroida nastaje uslijed mutacije gena za ACTH receptor što se primarno očituje hipokorticizmom. Ovisno o genetskom poremećaju, i u kongenitalnoj adrenalnoj hiperplaziji možemo naći određeni stupanj manjka kortizola i/ili aldosterona.
Patofiziologija. Sve promjene koje se javljaju u ovom poremećaju posljedica su manjka adrenalnih hormona. Uslijed manjka aldosterona smanjena je reapsorpcija natrija te sekrecija kalija i vodika posljedično čemu se razvija hipovolemija, hiponatrijemija, hiperkalijemija te umjerena metabolička acidoza. Posljedično manjku kortizola bolesnici su skloni razviju hipoglikemija. Manjak androgena kod žena uzrokuje gubitak pubične i aksilarne dlakavosti, dok kod muškaraca ne dolazi do izražaja. Kao odgovor na smanjene vrijednosti kortizola u krvi pojačano se luči adrenokortikotropni hormon, a zajedno s njime i lipotropin zbog čega se javlja pojačana pigmentacija kože na određenim arealima kože.
Klinička slika. Ovisno o vremenu nastanka, razlikujemo akutni i kronični oblik bolesti. Akutna insuficijencija nadbubrežne žlijezde naziva se još i adisonskom krizom i zasebno je opisana dalje u tekstu. Kroničnu insuficijenciju nadbubrežne žlijezde karakteriziraju nespecifični simptomi i znakovi koji nastupaju postupno i dulje traju, a uključuju umor i malaksalost, gubitak snage, depresivno raspoloženje te smanjen tek i gubitak na tjelesnoj težini. Nešto specifičnije manifestacije su hiperpigmentacija kože i sluznica osobito u intertriginoznim područjima, ekstenzornim površinama udova, u područjima ožiljaka i bradavica te pojačana želja za slanim jelima i napicima (uslijed hiponatrijemije).
Dijagnoza se postavlja na temelju kliničke sumnje koja obuhvaća simptome i znakove bolesti uz osnovne laboratorijske nalaze, a potvrđuje se specifičnim endokrinološkim testovima (mjerenje bazalnih vrijednosti kortizola i adrenokortikotropnoga hormona te ACTH test). Slikovnim i ostalim metodama nastojimo otkriti uzrok nastanka Addisonove bolesti.
Osnovni laboratorijski nalazi kod bolesnika s primarnom insuficijencijom nadbubrežne žlijezde uključuju hiponatrijemiju, hiperkalijemiju, umjerenu metaboličku acidozu te normoglikemiju ili hipoglikemiju. U diferencijalnoj krvnoj slici često se otkrije eozinofilija i relativna limfocitoza.
Vrijednost kortizola. Ako klinička slika i snižena vrijednost kortizola (< 138 nmol/L) uzorkovane u bilo koje doba dana upućuju na adrenalnu insuficijenciju, nalaže se provođenje stimulacijskoga ACTH testa. Bazalna koncentracija kortizola iznad 500 nmol/L isključuje mogućnost ove bolesti i ne zahtijeva provođenje ACTH testa.
ACTH test. Kod bolesnika kod kojega postoji sumnja na Addisonovu bolest potreban je stimulacijski ACTH test kako je to opisano u poglavlju Bolesti adenohipofize. Ako tijekom testa u bilo kojoj točki poraste koncentracija kortizola na 550 nmol/l ili više, odgovor se smara urednim te se isključuje mogućnost ove dijagnoze. Ako koncentracija kortizola ne prelazi 138 nmol/L, test je patološki te ukazuje na prisutnost adrenalne insuficijencije.
Određivanje bazalne vrijednosti kortizola i ACTH test ukazuju na postojanje insuficijencije adrenokorteksa, ali ne i na kojoj se razini ona dogodila (primarna, sekundarna ili tercijarna). Da bi se to utvrdilo, potrebno je odrediti bazalnu vrijednost adrenokortikotropnoga hormona (ACTH).
Bazalna vrijednost adrenokortikotropnoga hormona (ACTH) dobiva se uzorkovanjem krvi u jutarnjim satima, kao i za vrijednosti kortizola (između 7 i 8 sati). Vrijednosti ACTH-a više od 100 pg/dL upućuju na poremećaj same nadbubrežne žlijezde (primarna insuficijencija adrenokorteksa), dok snižene vrijednosti ili vrijednosti na donjim granicama referentnoga raspona upućuju na sekundarnu i tercijarnu razinu ovoga poremećaja.
Slikovne metode. CT ili MRI nadbubrežnih žlijezda služe za otkrivanje morfoloških promjena kore nadbubrežne žlijezde (tumori, infiltracija, krvarenje) koje mogu biti uzrokom insuficijencije. Kod sumnje na sekundarnu i tercijarnu insuficijenciju adrenokorteksa potreban je MR mozga, odnosno hipofize.
Liječenje. Osnovu liječenja kronične insuficijencije adrenokorteksa čini supstitucijska primjena glukokortikoida, mineralokortikoida te androgena. Liječenje akutne insuficijencije posebno je opisano.
Supstitucija glukokortikoida predstavlja osnovu medikamentnoga liječenja insuficijencije nadbubrežne žlijezde. U tu se svrhu najčešće primjenjuje hidrokortizon i to ukupnoj dnevnoj dozi od 15 do 30 mg podijeljeno na dva ili tri puta. Danas nam na raspolaganju stoje i preparati hidrokortizona s prilagođenim oslobađanjem (tablete od 5 i 20 mg) koje se uzimaju kao jedna jutarnja doza. Doziranje glukokortikoida prvenstveno se bazira na kliničkoj slici i laboratorijskim nalazima, a teži se primjeni što nižih doza kako bi se izbjegle nuspojave. U stanjima stresa (teže bolesti, operacije, ozljede i sl.) povećavaju se potrebe za ovim hormonima zbog čega se i doza ovih lijekova povećava. U stanjima jačega stresa preporuča se parenteralna primjena hidrokortizona i to u inicijalnoj dozi od 50 do 100 mg intravenski ili intramuskularno te se nastavlja u dozi od 50 mg svakih šest sati dok traje izloženost stresu. Stanja manjega stresa zahtijevaju povećanje peroralnoga unosa glukokortikoida obično za 50 % uobičajene doze kroz nekoliko dana dok traje izloženost stresu (manje infekcije i sl.). Također, doza lijeka se mora udvostručiti i kod bolesnica u zadnjem tromjesečju trudnoće. U slučaju primjene drugih oblika glukokortikoida potrebno je dati odgovarajuću ekvivalentnu dozu, a kod izračuna ekvivalentne doze drugoga glukokortikoida uzima se okvirno da je 1 g hidrokortizona ekvivalent 1,6 mg kortizon acetata, 0,2 mg prednizolona, 0,25 mg prednizona te 0,025 mg deksametazona. Bolesnicima je potrebno napomenuti da se u slučaju kompromitiranosti peroralnoga unosa lijeka (mučnina, povraćanje) moraju javiti u zdravstvenu ustanovu zbog osiguravanja parenteralne primjene.
Supstitucija mineralokortikoida indicirana je kod svih bolesnika s primarnom insuficijencijom adrenokorteksa, dok se kod bolesnika sa sekundarnom i tercijarnom uvodi onda kada se kontrola bolesti ne postigne primjenom glukokortikoida. Osnovni lijek je fludrokortizon acetat, a primjenjuje se u dozi od 0,05 do 0,3 mg. Doza lijeka se povisuje u slučaju perzistiranja hipotenzije, hiponatrijemije ili hiperkalijemije. Povećanje doze lijeka u stanjima stresa nije potrebno, a povećava se kod viših temperatura okoline te pojačanoga znojenja. Kod bolesnika koji ne toleriraju lijek simptomatski se primjenjuju tablete natrijeva klorida.
Supstitucija androgena indicirana je kod bolesnika kojih se ne postiže klinički oporavak unatoč odgovarajućoj primjerni glukokortikoida i mineralokortikoida, osobito kod žena. Supstitucija se postiže peroralnom primjenom 25 - 50 mg dihidroepiandrosterona (DHEA).
Akutna adrenalna kriza (ili adisonska kriza) naziv je za akutno, životno ugrožavajuće kliničko stanje koje nastaje kao posljedica akutnoga manjka hormona kore nadbubrežne žlijezde. Ona se obično javlja kod osoba s neprepoznatom ili neliječenom adrenalnom insuficijencijom, u stanjima povećanih potreba za hormonima kore nadbubrežne žlijezde što se vidi u različitim stresnim situacijama (teška akutna bolest, kirurški zahvat, trauma i sl.). Kliničku sliku karakterizira nagao nastup simptoma koji uključuje opću anergiju, refraktornu hipotenziju te stupnjevit poremećaj stanja svijesti. U početku bolest nekada može nalikovati na akutno intraabdominalno zbivanje s obzirom na to da se javlja bol u trbuhu, mučnina, povraćanje te febrilno stanje. Ako se ne započne s liječenjem, kliničko stanje se rapidno pogoršava s razvojem hipovolemičnoga šoka i prijetećega kardiorespiratornog aresta. Na akutnu adrenalnu krizu treba pomišljati kod svih teško oboljelih bolesnika s refraktornom hipotenzijom te elektrolitnim disbalansom koji uključuje hiperkalijemiju, hiponatrijemiju te metaboličku acidozu i hipoglikemiju. Bolest se potvrđuje određivanjem vrijednosti kortizola iz slučajnoga uzorka krvi pri čemu su vrijednosti obično manje od 10 µg/dL. Osnovu liječenja čini promptna primjena intravenskoga hidrokortizona u ukupnoj dnevnoj dozi od 200 do 400 mg i to u obliku kontinuirane infuzije ili podijeljeno u četiri intravenske doze. Ako ne dođe do oporavka kliničkoga stanja, u terapiju se može uključiti i fludrokortizon per os u dozi od 50 µg/dan. Treba imati na umu da liječenje treba započeti i po samoj kliničkoj sumnji bez čekanja laboratorijskih nalaza. Uz supstitucijsko liječenje provode se i sve ostale simptomatske mjere (hidracija, liječenje elektrolitnoga disbalansa, hipoglikemije i sl.), kao i liječenje uzročnoga stanja. Liječenje se primjenjuje sve dok traje izloženost stresoru, a ukoliko ono traje dulje od 7 do 10 dana potrebno je postupno snižavati dozu danih lijekova u fazi oporavka. Nakon započinjanja s enteralnim unosom hrane, parentralna supstitucijska terapija zamjenjuje se peroralnom.
SUPRAPRIMARNA INSUFICIJENCIJA ADRENOKORTEKSA
Supraprimarna insuficijencija adrenokorteksa nastaje zbog bolesti adenohipofize (sekundarna insuficijencija) ili zbog poremećaja na razini hipotalamusa (tercijarna insuficijencija). Uzroci, dijagnostika i liječenje opisani su poglavlju o bolestima adenohipofize (hipopituitarizam).
BOLESTI SRŽI NADBUBREŽNIH ŽLIJEZDA
Srž nadbubrežne žlijezde predstavlja njezin središnji dio sačinjen od adrenomedularnih stanica koje se s obzirom na histološko bojanje nazivaju još i kromafine stanice. One stvaraju i luče hormone koje jednim imenom nazivamo katekolamini, a među njih ubrajamo adrenalin, noradrenalin i dopamin. Katekolamini preko svojih receptora ostvaruju različite kardiovaskularne i metaboličke učinke. Kardiovaskularni učinci podrazumijevaju stimulaciju adrenergičkih receptora na srcu (ubrzanje pulsa, jačanje kontraktilnosti, povećanje provodljivosti) te krvnim žilama (vazokonstrikcija i povišenje krvnoga tlaka). Poluvijek života katekolamina je kratak i traje svega 10 do 100 sekundi zbog čega njihove plazmatske koncentracije široko variraju. Katekolamini se dijelom iz cirkulacije uklanjaju ponovnom pohranom u završetke simpatičkih živaca, a dijelom se metaboliziraju do svojih krajnjih produkata koji se iz organizma luče putem urina (Slika 7.3.).
Slika 7.3. Metabolički putevi razgradnje katekolamina
(MAO-monoamino oksidaza; COMT-katekol-0-metiltransferaza)
Najznačajnije bolesti srži nadbubrežne žlijezde su novotvorine među kojima se ponajprije ističu feokromocitom i paragangliom.
FEOKROMOCITOM I PARAGANGLIOM
Definicija. Feokromocitom i paragangliom predstavljaju neuroendokrine tumore koji potječu od kromafinih stanica srži nadbubrežne žlijezde (feokromocitom) ili simpatičkih ganglija (paragangliom), a karakterizira ih izražena biološka aktivnost u vidu pojačanoga otpuštanja katekolamina.
Epidemiologija. Radi se o rijetkim tumorima s procijenjenom učestalošću od 2 do 8 oboljelih na milijun stanovnika. Smatra se da 0,1 % bolesnika oboljelih od arterijske hipertenzije ima feokromocitom ili paragangliom u podlozi (sekundarna hipertenzija). Javlja se podjednako kod oba spola, a najčešće u trećem i četvrtom desetljeću života.
Etiopatogeneza. Tumori se mogu javiti u sporadičnom (70 %) i obiteljskom (30 %) obliku. Obiteljska pojavnost susreće se pri nekim nasljednim sindromima kao što su MEN-2A i MEN-2B (mutacija RET protoonkogena), von Hippel-Lindauova bolest (gubitak funkcije VHL tumorskoga supresorskog gena) te neurofibromatoza tip I (mutacija NF-1 tumorskoga supresorskog gena). Osim ovih sindroma, pojavnost feokromocitioma i paraganglioma može biti povezana i s nekim drugim genskim mutacijama (SDHD, SDHC, SDHB, EGLN1/PHD2, KIF1B, SDHAF2, IDH1, TMEM127 i dr.). Sporadična pojavnost tumora (95 %) je nepoznate etiologije.
Patologija. U 90 % slučajeva ovi tumori su dobroćudni, a svega 10 % je zloćudno. S obzirom na to da maligni i benigni oblici daju istu histološku sliku, njihovo razlikovanje moguće je samo na temelju dokaza postojanja metastaza. U 90 % slučajeva radi se o feokromocitomu (srž nadbubrežne žlijezde), dok se u 10 % slučajeva radi o paragangliomima (simpatički gangliji smješteni u trbuhu, prsnom košu ili vratu). Glavno obilježje ovih tumora je biološka aktivnost koja se očituje pojačanim lučenjem katekolamina, bilo kontinuirano, bilo u valovima (pulsatilno).
Klinička slika. Kliničke manifestacije ovih tumora ponajprije se javljaju kao posljedica pojačanoga djelovanja katekolamina u organizmu, a najčešće se radi o trajnoj ili paroksizmalnoj arterijskoj hipertenziji koja se teško regulira klasičnom antihipertenzivnom terapijom. S obzirom na to da se katekolamini iz tumora luče uglavnom pulsatilno (npr. kod nagloga povećanja tlaka u trbuhu), tako se i u kliničkoj slici mogu paroksizmalno pojaviti simptomi i znakovi posljedične simpatičke hiperreaktivnosti: glavobolja, tjeskoba i uznemirenost, fini tremor i parestezije, palpitacije, stenokardične smetnje, napadaji crvenila praćeni osjećajem topline i profuznim znojenjem, iznenadna slabost i malaksalost, mučnina, bol u trbuhu i dr.
Dijagnoza. Kliničku sumnju na feokromocitom i paragangliom budi pojava tvrdokorne hipertenzije u mlađoj životnoj dobi koja se teško kontrolira antihipertenzivima, a osobito ako se kod bolesnika javljaju i znakovi simpatičke hiperreaktivnosti. Kod kliničke sumnje na ove tumore potrebno je provesti laboratorijsku obradu s ciljem otkrivanja povišenih vrijednosti katekolamina i njihovih metabolita te slikovnu dijagnostičku obradu kojima se nastoji lokalizirati tumorsku masu.
Laboratorijska dijagnostika (biokemijska dijagnoza) čini osnovu dijagnoze ovih tumora. Prije uzorkovanja krvi i urina za ove pretrage potrebno je izostaviti lijekove koji mogu dovesti do lažno pozitivnih rezultata (acetaminofen, lidokain, beta-agonisti, triciklički antidepresivi, antipsihotici, metoklopramid, efedrin, kaptopril, cimetidin). Pretrage koje se izvode u ovu svrhu su određivanje slobodnih metanefrina i normetanefrina u plazmi i u 24-satnom urinu čije povišene vrijednosti ukazuju na postojanje ovih tumora. Koncentracija metanefrina u plazmi povišena 2,5 puta i normetanefrina u plazmi povišena 4 puta, kao i koncentracija metanefrina i normetanefrina u 24 satnom urinu povišena 2 do 3 puta u odnosu na referentne vrijednosti, s velikom sigurnošću upućuju na feokromocitom. Mjerenje metanefrina u plazmi ima visoku osjetljivost (97 %), ali nema specifičnost (85 %) u odnosu na metanefrine u 24-satnom urinu (osjetljivost 90 %, specifičnost 98 %). Sukladno tome, mjerenje metanefrina u urinu daje manje lažno pozitivnih rezultata. Stoga se preporuča mjerenje metanefrina u plazmi kod visoko suspektnih bolesnika zbog svoje visoke osjetljivosti, dok se kod starijih bolesnika s arterijskom hipertenzijom bez drugih kliničkih simptoma preporuča mjerenje metanefrina u 24-satnom urinu zbog odgovarajuće osjetljivosti s nižom stopom lažno pozitivnih rezultata.
Slikovne metode (morfološka dijagnostika) omogućavaju vizualizaciju i određivanje lokalizacije tumora, a provodi se kod svih bolesnika s pozitivnom biokemijskom dijagnozom. Osnovne slikovne pretrage pri sumnji na ove tumore su CT ili MR abdomena i zdjelice s naglaskom na analizu nadbubrežnih žlijezda. Ako se ne otkrije suspektan tumor nadbubrežnih žlijezda ili simpatičkih ganglija, indiciran je CT ili MR vrata i prsnoga koša. Ako se navedenim pretragama ne otkrije lokalizacija tumora ili je ona dvojbena, na raspolaganju su nam i scintigrafija nadbubrežnih žlijezda s metajodobenzilgvanidin obilježenim radioaktivnim jodom (123-131J-MIBG) ili pozitronska emisijska tomografija (PET) s nespecifičnim (deoksiglukoza, 18FDG) ili specifičnim ligandom (dihidroksifenilalanin, 18FDOPA). Svi navedeni radiofarmaci imaj tendenciju nakupljanja u kromafinim stanicama i tako omogućavaju otkrivanje lokalizacije tumorske mase.
Liječenje. Osnovu liječenja čini operativno odstranjenje tumora. Prije samoga zahvata bolesnicima se moraju optimizirati vrijednosti krvnoga tlaka kao i kontrola aritmija, što se postiže primjenom alfa i beta blokatora adrenergičkih receptora (medikamentna terapija), a rjeđe i primjenom blokatora kalcijskih kanala. Bolesnici s urednim vrijednostima krvnoga tlaka ne zahtijevaju prijeoperacijsku pripremu lijekovima.
Medikamentno liječenje. Lijekovi izbora u kontroli arterijske hipertenzije kod ovih bolesnika (osobito u prijeoperacijskom periodu) su blokatori alfa adrenergičkih receptora (fenoksibenzamin 20 - 100 mg/dan, doksazosin 10 - 120 mg/dan) i/ili blokatori kalcijskih kanala (nifedipin ER 30 - 120 mg/dan). Ako se ne postigne željena regulacija krvnoga tlaka (< 160/90 mmHg), u terapiju se uvode i blokatori beta adrenergičkih receptora (metoprolol, atenolol). Osim regulacije krvnoga tlaka ovim lijekovima, potrebno je i osigurati kontrolu srčanoga ritma (smanjiti broj ventrikularnih ekstrasistola na manje od 1 u 5 minuta) te postići normalizaciju ST-T segmenta.
Operativno liječenje predstavlja metodu izbora u liječenju feokromocitoma i paraganglioma. Osnovno je pripremiti bolesnika za operativni zahvat, što se postiže opisanim medikamentnim liječenjem. 12 sati prije samoga operativnog zahvata preporuča se izostaviti primjenu navedenih lijekova zbog utjecaja na pojavnost poslijeoperacijske hipotenzije. Poslijeoperacijska hipotenzija i hipoglikemija kao najčešće rane komplikacije rješavaju se parenteralnom nadoknadom volumena i glukoze, rjeđe je potrebna primjena katekolamina (npr. noradrenalin).
Metastatski feokromocitom i paragangliom. S obzirom na to da se na temelju histološke slike benigne i maligne forme ovih tumora ne mogu jasno razlikovati, osnovna razlika temelji se na slikovnim metodama prije operacije kao i redovnom praćenju bolesnika nakon operacije, koje uključuje određivanje metanefrina u plazmi, najprije 4 do 6 tjedana nakon operacije, a potom svakih godinu dana tijekom 19 godina. Kod postavljanja dijagnoze metastaze se detektiraju kod 35 % bolesnika, dok se kod ostalih 65 % one pojave tijekom sljedećih pet godina. Terapija metastaza također se zasniva na operativnom liječenju, ako je ono moguće uz provođenje kemoterapije (kombinacija ciklofosfamida, vinkristina i dakarbazina) i/ili terapijske primjene 131I-MIBG. Koštane metastaze tretiraju se zračenjem (radioterapija).
Prognoza. Benigne forme ovih tumora načelno imaju dobru prognozu ako se na vrijeme operativno uklone, prije nego se razviju ozbiljne kardiovaskularne komplikacije. Arterijska hipertenzija se povlači kod većine bolesnika, dok samo kod njih oko 20 % trajno zaostaje i nakon operativnoga liječenja. Bolesnici s metastatskom bolesti imaju varijabilnu prognozu s obzirom na to da neke metastaze imaju izrazito indolentno ponašanje.
INCIDENTALOMI NADBUBREŽNIH ŽLIJEZDA
Definicija. Incidentalomi nadbubrežnih žlijezda predstavljaju tumore nadbubrežnih žlijezda koji se slučajno otkriju tijekom slikovnih dijagnostičkih metoda trbuha i zdjelice zbog različitih drugih kliničkih indikacija. Sve raširenija radiološka obrada bolesnika dovodi do sve većega boja nalaza incidentaloma pa je obrada ovih bolesnika postala izuzetno česta indikacija za endokrinološko testiranje.
Etiologija. U osnovi se može raditi o različitim funkcionalnim i nefunkcionalnim tumorima nadbubrežne žlijezde, kao i različitim sekundarizmima. Najčešće se radi o sljedećim tumorima: adenom, nodularna hiperplazija, adenokarcinom, feokromocitom, limfom, ganglioneuroblastom, ganglioneurom, hemangiom i dr.
Klinička slika. Bolesnici s incidentalomima su najčešće asimptomatski, iako se kod većine njih nađe supklinički Cushingov sindrom. Takvi bolesnici nemaju klasične znakove hiperkorticizma, ali se mogu pojaviti njegove dugoročne komplikacije kao što su inzulinska rezistencija i šećerna bolest, osteoporoza, arterijska hipertenzija i povećan ukupni kardiovaskularni mortalitet.
Dijagnoza. Kod svih bolesnika s incidentalomom potrebno je provesti endokrinološku obradu koja se sastoji od laboratorijske dijagnostike (hormonske analize) te radiološke obrade, s ciljem diferenciranja tumorske mase te zauzimanja stava o nastavku liječenja (hormonski aktivan ili hormonski neaktivan tumor).
Laboratorijska dijagnostika (endokrinološka obrada) u prvom je redu usmjerena na ispitivanje postojanja feokromocitoma, hiperkorticizma te hiperaldosteronizma. Ovo se provodi određivanjem vrijednosti slobodnih metanefrina u plazmi i urinu, određivanjem kortizola u prekonoćnom testu deksametazonske supresije te izračunavanjem omjera aldosterona i reninske aktivnosti plazme (ili renina) (opisano u odgovarajućim dijelovima teksta bolesti kore nadbubrežne žlijezde). Određivanje dihidroepiandrosteron-sulfata (DHEAS) indicira se samo kada u kliničkoj slici nalazimo znakove virilizacije, osobito kod žena.
Slikovne dijagnostičke metode. Osnovna pretraga uključuje CT ili MR abdomena i male zdjelice s naglaskom na nadbubrežne žlijezde. Veličina tumora, kao i njegove morfološke karakteristike, pomažu u diferencijaciji nađenih tumefakcija. Osnovne radiološke karakteristike benignih i malignih tumora prikazane su u Tablici 7.14. Scintigrafija ima ograničenu ulogu u dijagnostici i obradi ovih bolesnika (dostupnost, cijena, doza zračenja). Kod sumnje na tumore kore nadbubrežne žlijezde koristi se 131I-6-β-jodmetil-norkolesterol i 75Se-selenometil-19-norkolesterol kao radiofarmaci, a kod sumnje na tumore srži nadbubrežne žlijezde 131I-metajod-benzil gvanidin i 123I-metajod-benzil gvanidin. Biopsija tumora rijetko je indicirana kod ovih bolesnika s obzirom na ograničenost histološkoga razlikovanja određenih formi tumora, a kada se i odluči na to, potrebno je prethodno biokemijski isključiti postojanje feokromocitoma.
Liječenje ovih tumora ovisi o njihovoj vrsti, hormonskoj aktivnosti, kao i drugim karakteristikama (sumnja na malignitet, brzina rasta i dr.). Za sve funkcionalne tumore terapija izbora predstavlja kirurško liječenje (adrenalektomija), a ako je ono kontraindicirano, primjenjuje se medikamentna terapija koja uključuje primjenu inhibitora sinteze steroidnih hormona kore nadbubrežne žlijezde (hiperkorticizam) ili antagoniste aldosterona (hiperaldosteronizam). Liječenje nefunkcionalnih tumora ponajprije ovisi o veličini. Tumori veći od 6 cm predstavljaju jasnu indikaciju za operativno liječenje zbog velike suspekcije da se radi o karcinomu, dok se tumori manji od 4 cm promatraju i prate. Tumori veličine 4 do 6 cm predstavljaju izazov kod donošenja odluke o daljnjem liječenju, ali načelno se operacijsko liječenje savjetuje kada tumor pokazuje neke od sljedećih morfoloških karakteristika: nepravilan oblik, iregularni rubovi, mala količina lipida te znakovi nekroze i krvarenja unutar tumorske mase. Prema stavu hrvatskoga Referentnog centra za bolesti nadbubrežne žlijezde preporuča se operativno liječenje za sve tumore veće od 4 cm. Praćenje tumora manjih od 4 cm podrazumijeva kontrolni CT za 6 do 12 mjeseci, a potom nakon 2 godine. Ako u tom periodu nije došlo do porasta tumora, daljnje praćenje nije potrebno. Kontrolnu endokrinološku evaluaciju potrebno je napraviti 12 do 24 mjeseca od inicijalne evaluacije te još jednom unutar sljedeće dvije godine. Nakon 3 do 4 godine praćenja vrlo je mala mogućnost da nefunkcionalan tumor postane funkcionalan.
|
Tablica 7.14. Radiološke karakteristike incidentaloma (CT nalaz uz primjenu kontrasta)
|
|
Karakteristika
|
Benigni tumori
|
Maligni tumori
|
|
Veličina tumora
|
Obično manji od 4 cm
|
Obično veći od 6 cm
|
|
Morfologija tumora
|
Ovalni, pravilni rubovi
|
Nepravilni rubovi, infiltrativni rast
|
|
Apsorpcija rentgenskih zraka
|
Niska (manja od 10 HJ)
|
Visoka (viša od 10 HJ)
|
|
Ispiranje kontrasta
|
Više od 50 % nakon 10 - 15 minuta
|
Manje od 50 % nakon 10 - 15 minuta
|
MULTIPLI POREMEĆAJI ŽLIJEZDA S UNUTRAŠNJIM IZLUČIVANJEM
Tipični primjeri multiplih poremećaja žlijezda s unutrašnjim izlučivanjem su sindrom multiple endokrine neoplazije i autoimuni poliglandularni sindrom.
SINDROM MULTIPLE ENDOKRINE NEOPLAZIJE
Definicija. Sindrom multiple endokrine neoplazije podrazumijeva nekoliko kliničkih stanja koje karakterizira pojava tumora koji nastaju od specifičnih neuroendokrinih stanica, a pojavljuju se u dvije ili više žlijezda s unutrašnjim izlučivanjem. Ovisno o zahvaćenim žlijezdama i kliničkim karakteristikama razlikujemo četiri podtipa ovoga poremećaja: MEN 1, MEN 2, MEN 3 te MEN 4.
Sindrom multiple endokrine neoplazije tip 1 (MEN 1) nastaje kao posljedica mutacije MEN1 gena čiji produkt, protein menin sudjeluje u regulaciji staničnoga ciklusa tako što inhibira replikaciju DNA molekule i diobu stanice. Posljedično ovoj mutaciji stanice se počinju nekontrolirano umnažati i rasti, a to je posebno izraženo kod nekih neuroendokrinih stanica. Mutacija MEN1 gena može nastati de novo ili se može prenositi autosomno-dominantnim putem. Žlijezde najčešće zahvaćene ovim poremećajem su 1) paratireoidne žlijezde (hiperplazija, adenom), 2) pankreas i duodenum (gastrinom, inzulinom, glukagonom, vipom, somatostatinom) te 3) adenohipofiza (mikro- i makroadenomi). Rjeđe kod ovih bolesnika mogu nastati i karcinoidni tumor, feokromocitom te hiperplazija ili adenomi nadbubrežnih žlijezda. Dijagnoza se postavlja na temelju nalaza najmanje dva od tri specifična endokrina tumora kod bolesnika, a potvrđuje se genetskim testiranjem i nalazom mutacije MEN1 gena. Liječenje je simptomatsko i ovisi o zahvaćenim žlijezdama.
Sindrom multiple endokrine neoplazije tip 2 (MEN 2 ili MEN 2a) nastaje kao posljedica mutacije RET gena (onkogen) koji ima ulogu u staničnoj diobi i programiranoj staničnoj smrti (apoptoza). U slučaju mutacije RET gena stanice se počinju nekontrolirano dijeliti i rasti dovodeći do razvoja tumora. Najčešće zahvaćene žijezde su štitna žlijezda (medularni karcinom), doštitne žlijezde (adenom, hiperplazija) te nadbubrežne žlijezde (feokromocitom). Dijagnoza se postavlja na temelju pojavnosti specifičnih endokrinih tumora, a potvrđuje se genetskim testiranjem (mutacije RET gena). Liječenje je simptomatsko, ovisno o kliničkim manifestacijama.
Sindrom multiple endokrine neoplazije tip 3 (MEN 3 ili MEN 2b) također nastaje kao posljedica mutacije RET gena, a glavne kliničke manifestacije ovoga sindroma su mukozni neurinomi, marfanov habitus, feokromocitom te medularni karcinom štitne žlijezde. Česte su i intestinalne abnormalnosti (intestinalni ganglioneurinomi), abnormalnosti skeleta te zakašnjeli pubertet. Dijagnostika se zasniva na pridruženoj pojavnosti endokrinih tumora i nalazu genetskoga testiranja. Liječenje je simptomatsko i ovisi o kliničkom očitovanju.
Sindrom multiple endokrine neoplazije tip 4 (MEN 4) nastaje kao posljedica mutacije CDKN1B gena, a kliničke manifestacije gotovo su jednake onima koje susrećemo u MEN 1 tipu. Razlika između MEN1 i MEN 4 tipa sastoji se samo u genetskom testiranju, s obzirom na to da su zahvaćena dva različita gena.
AUTOIMUNI POLIGLANDULARNI SINDROM
Definicija. Autoimuni poliglandularni sindrom podrazumijeva disfunkciju dvije ili više žlijezda s unutrašnjim izlučivanjem uzrokovanih autoimunim mehanizmom. Ovisno o zahvaćenosti žlijezda i kliničkim karakteristikama, razlikujemo dva tipa ovoga poremećaja (osnovne karakteristike prikazane su u Tablici 7.15.).
Autoimuni poliglandularni sindrom tip 1 nasljeđuje se autosomno-recesivno, a klinički se manifestira već u djetinjstvu, obično do 15. godine života. Genetski se poremećaj sastoji od mutacije AIRE gena koji ima ulogu u održavanju imunotolerancije tijekom diferencijacije T-stanica u timusu, a do danas je poznato preko 60 vrsta mutacija. Glavne kliničke manifestacije su kronična mukokutana kandidijaza, hipoparatireoidizam te insuficijencija kore nadbubrežne žlijezde, iako ne moraju sve biti zastupljene (70 % oboljelih imaju samo kandidijazu i hipoparatireoidizam). S obzirom na slijed pojavnosti, obično se prvo manifestira mukokutana kandidijaza i to obično do 5. godine života, dok se hipoparatireoidizam javlja do 10. godine života, a insuficijencija adrenokorteksa do 15. godine života. Rjeđe kod ovih bolesnika možemo susresti šećernu bolest tipa 1 te autoimunu bolest štitne žlijezde. Dijagnostička potvrda ovoga sindroma zasniva se na genetskoj analizi i dokazivanju mutacija AIRE gena. Liječenje je simptomatsko (odgovarajuća supstitucijska terapija).
Autoimuni poliglandularni sindrom tip 2 nasljeđuje se autosomno-dominantno, a klinički se manifestira obično u mlađoj odrasloj dobi, najčešće u trećem i četvrtom desetljeću života. Bolest je češća kod osoba s HLA DR3, HLA DR4, HLA A1 i HLA B8 haplotipom. Glavne kliničke komponente ovoga sindroma su šećerna bolest tip 1, autoimuna tireoidna bolest te insuficijencija adrenokorteksa. U oko 50 % slučajeva insuficijencija adrenokorteksa prva je manifestacija bolesti, dok se u ostalima ona javlja nakon autoimune bolesti štitne žlijezde i šećerne bolesti tip 1. Rjeđe, ovi bolesnici mogu razviti i primarni hipogonadizam, mijasteniju gravis ili glutensku enteropatiju. S obzirom na to da ne postoji identificirani genetski poremećaj odgovoran za nastanak ovoga sindroma, dijagnoza se temelji na istodobnom ispoljavanju navedenih endokrinoloških poremećaja. Liječenje je simptomatsko (odgovarajuća supstitucijska terapija).
|
Tablica 7.15. Osnovne karakteristike autoimunoga poliglandularnog sindroma
|
|
Karakteristika
|
AIPGS tip 1
|
AIPGS tip 2
|
|
Učestalost
|
1:10 000
|
1:20 000
|
|
Odnos žene:muškarci
|
1:1
|
3:1
|
|
Tip nasljeđivanja
|
Autosomno-recesivno
|
Autosomno-dominantno
|
|
Vrijeme kliničke manifestacije
|
Djetinjstvo (do 15 godina)
|
Mlađa odrasla dob (30 - 40 godina)
|
|
Glavne kliničke značajke
|
Kronična mukokutana kandidijaza
Hipoparatireoidizam
Insuficijencija adenokorteksa
|
Insuficijencija adenkorteksa
Autoimuna bolest štitne žlijezde
Šećerna bolest tip 1
|
|
Sporedne kliničke značajke
|
Šećerna bolest tip 1
Alopecija areata
Autoimuna bolest štitne žlijezde
|
Vitiligo
Perniciozna anemija
Glutenska enteropatija (celijakija)
|
- Ananthakrishnan S. Diabetes insipidus during pregnancy. Best Pract Res Clin Endocrinol Metab. 2016 Mar;30(2):305–15.
- Angell TE, Vyas CM, Medici M, Wang Z, Barletta JA, Benson CB et al. Differential growth rates of benign vs. malignant thyroid nodules. J Clin Endocrinol Metab. 2017 Dec 1; 102(12):4642–7.
- Asuzu D, Chatain GP, Hayes C, Benzo S, McGlotten R, Keil M et al. Normalized early postoperative cortisol and ACTH values predict nonremission after surgery for Cushing disease. J Clin Endocrinol Metab. 2017 Jul;102(7):2179–87.
- Bartalena L, Baldeschi L, Boboridis K, Eckstein A, Kahaly GJ, Marcocci C et al. The 2016 European Thyroid Association/ European Group on Graves’ Orbitopathy guidelines for the management of Graves’ orbitopathy. Eur Thyroid J. 2016 Mar;5(1):9–26.
- Belančić A., Krpina M., Klobučar-Majanović S. Endokrina hipertenzija uslijed primarnog hiperparatireoidizma. Cardiologia Croatica 2017;12(3):59.
- Bensing S, Hulting AL, Husebye ES, Kämpe O, Lovas K. Managemnet of endocrine disease: Epidemiology, quality of life and complications of primary adrenal insufficiency: a review. Eur J Endocrinol. 2016 Sep;175(3):R107-16.
- US Preventive Services Task Force, Bibbins-Domingo K, Grossman DC, Curry SJ, Barry MJ, Davidson KW et al. Screening for thyroid cancer: US Preventive Services Task Force recommendation statement. JAMA. 2017 May 9;317(18):1882–7.
- Bilezikian JP, Brandi ML, Eastell R, Silverberg SJ, Udelsman R, Marcocci C et al. Guidelines for the management of asymptomatic primary hyperparathyroidism: summary statement from the Fourth International Workshop. J Clin Endocrinol Metab. 2014 Oct;99(10):3561–9.
- Brandi ML, Bilezikian JP, Shoback D, Bouillon R, Clarke BL, Thakker RV et al. Management of hypoparathyroidism: summary statement and guidelines. J Clin Endocrinol Metab. 2016 Jun;101(6):2273–83.
- Budoff MJ, Ellenberg SS, Lewis CE, Mohler ER 3rd, Wenger NK, Bhasin S et al. Testosterone treatment and coronary artery plaque volume in older men with low testosterone. JAMA. 2017 Feb 21;317(7):708–16.
- Capatina C, Wass JA. Hypopituitarism: growth hormone and corticotropin deficiency. Endocrinol Metab Clin North Am. 2015 Mar;44(1):127–41.
- Cappola AR, Shoback DM. Osteoporosis therapy in postmenopausal women with high risk of fracture. JAMA. 2016 Aug 16;316(7):715–6.
- Celemmons DR, Nieman LK. Approach to the patinet with endocrine disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1468-70.
- Cetani F, Pardi E, Marcocci C. Update on parathyroid carcinoma. J Endocrinol Invest. 2016 Jun;39(6):595–606.
- Čabrijan T., Altabas V. Bolesti neurohipofize. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 1193-6.
- Doggui R, El Atia J. Iodine deficiency: physiological, clinical and epidemiological features, and pre-analytical considerations. Ann Endocrinol (Paris). 2015 Feb;76(1):59–66.
- Fagin JA, Wells SA Jr. Biologic and clinical perspectives on thyroid cancer. N Engl J Med. 2016 Sep 15;375(11):1054–67.
- Funder JW, Carey RM, Mantero F, Murad MH, Reincke M, Shibata H et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2016 May;101(5):1889–916.
- Gordon MB, Levy RA, Gut R, Germak J. Trends in growth hormone stimulation testing and growth hormone dosing in adult growth hormone deficiency patients: results from the ANSWER program. Endocr Pract. 2016 Apr;22(4):396–405.
- Husebye ES, Allolio B, Arlt W, Badenhoop K, Bensing S, Betterle C et al. Consensus statement on the diagnosis, treatment and follow-up of patients with primary adrenal insufficiency. J Intern Med. 2014 Feb;275(2):104–15.
- Jonklaas J, Bianco AC, Bauer AJ, Burman KD, Cappola AR, Celi FS et al. Guidelines for the treatment of hypothyroidism: prepared by the American Thyroid Association Task Force on Thyroid Hormone Replacement. Thyroid. 2014 Dec;24(12):1670–751.
- Kastelan D, Dusek T, Aganović I, Štern-Padovan R, Kuzmanić D, Kaštelan Ž i sur“Dijagnostika i liječenje incidentaloma nadbubrežne žlijezde: preporuke Referentnog centra Ministarstva zdravstva za bolesti nadbubrežne žlijezde.” Lijec̆nic̆ki vjesnik 132 (2010):71-5.
- Kim M, Ladenson PW. Thyroid. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1500-14.
- Kline G, Holmes DT. Adrenal venous sampling for primary aldosteronism: laboratory medicine best practice. J Clin Pathol. 2017 Nov;70(11):911–6.
- Koršić M. Poremećaji multilih endokrinih žlijezda. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. 1240-3.
- Koršić M., Dumić M. Bolesti nadbubrežne žlijezde. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 1209-20.
- Koršić M., Vizner B. Fiziologija i patofiziologija endokrinog sustava. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 1159-77.
- Leder BZ, Tsai JN, Uihlein AV, Wallace PM, Lee H, Neer RM et al. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet. 2015 Sep;386(9999):1147–55.
- Lenders JW, Duh QY, Eisenhofer G, Gimenez-Roqueplo AP, Grebe SK et al. Pheochromocytoma and paraganglioma: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2014 Jun;99(6):1915–42.
- Luo Y, Kawashima A, Ishido Y, Yoshihara A, Oda K, Hiroi N et al. Iodine excess as an environmental risk factor for autoimmune thyroid disease. Int J Mol Sci. 2014 Jul 21; 15(7):12895–912.
- Mayo-Smith WW, Song JH, Boland GL, Francis IR, Israel GM, Mazzaglia PJ et al. Management of incidental adrenal masses: a white paper of the ACR incidental findings committee. J Am Coll Radiol. 2017 Aug;14(8):1038–44.
- Melmed S. New therapeutic agents for acromegaly. Nat Rev Endocrinol. 2016 Feb;12(2):90–8.
- Molitch ME. Anterior pituitary. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1480-94.
- Molitch ME. Diagnosis and treatment of pituitary adenomas: a review. JAMA. 2017 Feb 7;31 (5):516–24.
- Molitch ME. Neuroendocrinology and the neuroendocrine system. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1473-1579.
- Nieman LK et al. Treatment of Cushing’s syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2015 Aug;100(8):2807–31.
- Nieman LK. Adrenal cortex. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1514-21.
- Pallais JC, McInnis M, Saylor PJ, Wu RI. Case records of the Massachusetts General Hospital. Case 38-2015. A 21-year-old man with fatigue and weight loss. N Engl J Med. 2015 Dec;373(24):2358–69.
- Pawlowska M, Cusano NE. An overview of normocalcemic primary hyperparathyroidism. Curr Opin Endocrinol Diabetes Obes. 2015 Dec;22(6):413–21.
- Peterson SJ, McAninch EA, Bianco AC.. Is a normal TSH synonymous with “euthyroidism” in levothyroxine monotherapy? J Clin Endocrinol Metab. 2016 Dec;101(12):4964–73.
- Soltani A, Pourian M, Davani BM. Does this patient have pheochromocytoma? A systematic review of clinical signs and symptoms. J Diabetes Metab Disord. 2016 Mar 31;15:1–12.
- Quinkler M, Oelkers W, Remde H, Allolio B. Mineralocorticoid substitution and monitoring in primary adrenal insufficiency. Best Pract Clin Endocrinol Metab. 2015 Jan;29(1):17–24.
- Ranganath R, Shaha MA, Xu B, Migliacci J, Ghossein R, Shaha AR. de Quervain’s thyroiditis: a review of experience with surgery. Am J Otolaryngol. 2016 Nov–Dec;37(6):534–7.
- Riester A, Weismann D, Quinkler M, Lichtenauer UD, Sommerey S, Halbritter R. Life-threatening events in patients with pheochromocytoma. Eur J Endocrinol. 2015 Dec;173(6):757–64.
- Robertson GL. Diabetes insipidus: differential diagnosis and management. Best Pract Res Clin Endocrinol Metab. 2016 Mar;30(2):205–18.
- Ronević T, Željković-Vrkić T, Kos J, Fištrek M. Feokromocitom - dijagnostički i terapijski izazov koji traje. Medicus. 2007;16(2):205-10.
- Salomo LH, Laursen AH, Reiter N, Feldt-Rasmussen U. Myxoedema coma: an almost forgotten, yet still existing cause of multiorgan failure. BMJ Case Rep. 2014 Jan 30;2014:2013203223.
- Samson SL, Hamrahian AH, Ezzat S; AACE Neuroendocrine and Pituitary Scientific Committee; American College of Endocrinology (ACE).Clinical relevance of macroprolactin in the absence or presence of true hyperprolactinemia. Endocr Pract. 2015 Dec;21(12):1427–35.
- Smith TJ, Kahaly GJ, Ezra DG, Fleming JC, Dailey RA, Tang RA et al. Teprotumumab for thyroid-associated ophthalmopathy. N Engl J Med. 2017 May 4;376(1):174–61.
- Spiegel AM, Nieman LK. Polyglandular disorders. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1555-6.
- Spiegel AM. Principles of endocrinology. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1471-3.
- Straccia P, Rossi ED, Bizzarro T, Brunelli C, Cianfrini F, Damiani D et al. A meta-analytic review of the Bethesda System for Reporting Thyroid Cytopathology: has the rate of malignancy in indeterminate lesions been underestimated? Cancer Cytopathol. 2015 Dec;123(12):713–22.
- Strachan MWJ, Newell-Price JDC. Endocrinology. In: Davidsons Principles and Practice of Medicine, 23rd Edition. London: Elsevier; 2018. p. 630-89.
- Tabain I, Mate N, Kusić Z. Follicular adenoma of thyroid: retrospective review of the cytomorphologic characteristic in 104 cases. Acta clin Croat 2000; 39:221-225.
- Tafaj O, Jüppner H. Pseudohypoparathyroidism: one gene, several syndromes. J Endocrinol Invest. 2017 Apr;40(4):347–56.
- Taïeb D, Kebebew E, Castinetti F, Chen CC, Henry JF, Pacak K. Diagnosis and preoperative imaging of multiple endocrine neoplasia type 2: current status and future directions. Clin Endocrinol (Oxf). 2014 Sep;81(3):317–28.
- Thakker RV. Multiple endocrine neoplasia type 1 (MEN 1) and type 4 (MEN 4). Mol Cell Endocrinol. 2014 Apr 5;386(1–2):2–15.
- Verbalis JG. Posterior pituitary. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1494-500.
- Vizner B. Bolesti hipotalamusa i adenohipofize. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 1178-93.
- Wang S, Chen SS, Gao WC, Bai L, Luo L, Zheng XG et al. Prognostic factors of adrenocortical carcinoma: an analysis of the Surveillance Epidemiology and End Results (SEER) database. Asian Pac J Cancer Prev. 2017 Oct;18(10):2817–23.
- Wells SA Jr, Asa SL, Dralle H, Elisei R, Evans DB, Gagel RF et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015 Jun;25(6):567–610.
- Wong A, Eloy JA, Couldwell WT, Liu JK. Update on prolactinomas. Part 2: Treatment and management strategies. J Clin Neurosci. 2015 Oct;22(10):1568–74.
- Young WF. Adrenal medulla. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1521-7.
- Žmire J., Solter M. Bolesti štitnjače. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 1196-208.