BOLESTI ORGANA DIŠNOGA SUSTAVA
Klinički pristup bolesniku s bolestima dišnoga sustava
Dijagnostički postupci u pulmologiji
Kongenitalne bronhopulmonalne anomalije
Astma
Kronična opstruktivna plućna bolest
Plućne infekcije
Bronhiektazije
Intersticijske bolesti pluća
Difuzna alveolarna hemoragija
Plućni eozinofilni sindromi
Profesionalne bolesti pluća i bolesti pluća uzrokovane okolišem
Bolesti pleure i pleuralnoga prostora
Bolesti medijastinuma i dijafragme
Poremećaji ventilacije
Respiratorna insuficijencija
Tumori pluća
Ostale bolesti i stanja
Literatura
KLINIČKI PRISTUP BOLESNIKU S BOLESTIMA DIŠNOGA SUSTAVA
U kliničkom pristupu bolesniku s bolestima dišnoga sustava analiziramo osnovne simptome i znakove bolesti dišnoga sustava kao što su bol u prsima, dispneja, patološki oblici disanja, kašalj i iskašljavanje, cijanoza i akrocijanoza te hemoptoa i hemoptiza.
BOL U PRSIMA
Patofiziologija. Bol u prsima jedan je od najčešćih simptoma u kliničkoj praksi uopće i može biti uzrokovan različitim bolestima i stanjima. Može biti lokaliziran centralno (srce, aorta, jednjak, medijastinum) ili periferno (pluća, pleura, kosti i mišići, živci). S obzirom na to da plućni parenhim ne sadržava osjetne živce, bol u prsima koji nastaje zbog bolesti dišnih organa mora biti vezan uz pleuru koja ima osjetne živce (patološki proces pluća koji se širi na pleuru, bolesti same pleure). Zbog toga je bol periferan i dobro lokaliziran (pleuralni bol).
Karakteristike pleuralnoga bola. Na plućnu etiologiju bola u prsima (pleuralni bol) mogu ukazivati pridruženi simptomi (kašalj, iskašljavanje), bol ograničen na jednu stranu prsnoga koša, bol koji se pojačava prilikom disanja ili kašljanja te zauzimanje prisilnoga položaja (ležanje na oboljeloj strani kako bi se smanjile kretnje prsnoga koša i pleure, a time i bolnost).
Klinički pristup bolesniku s pleuralnim bolom temelji se na anamezi, fizikalnom pregledu, osnovnim laboratorijskim nalazima koji uključuju upalne parametre i plinske analize arterijske krvi te preglednom konvencionalnom radiološkom snimkom pluća. Preporuča se svim bolesnicima učiniti i elektrokardiografiju te u dvojbenim situacijama kardioselektivne enzime kako se ne bi previdio kardijalni uzrok. Daljnji postupak ovisi o rezultatima osnovnih pretraga i kliničkoj sumnji na etiologiju bola u prsima.
PULMONALNA DISPNEJA (ZADUHA)
Definicija. Dispneja je naziv za subjektivan osjećaj nestašice zraka prilikom čega bolesnik može imati različite vanjske manifestacije u vidu promjene dubine disanja (plitko, duboko) i/ili frekvencije disanja (tahipneja, bradipneja). Bolesnici dispneju obično opisuju kao gušenje ili osjećaj nedostatka zraka.
Patofiziologija. Dispneja se javlja u slučajevima prekomjernoga disajnog rada, tj. pojačane aktivnosti respiracijskih mišića. Različiti patološki mehanizmi dovode do smanjenja minutnoga volumena te respiracijski mišići pojačanim radom nastoje kompenzirati i održati minutni volumen dostatnim ili što većim. Sve te promjene dovode do aktivacije receptora i aferentnih živčanih vlakana koja potječu iz različitih intratorakalnih struktura (respiracijski mišići, stijenka prsnoga koša, dišni putevi, plućni parenhim) te uvjetuju prekomjernu i abnormalnu aktivnost respiracijskoga centra u produljenoj moždini.
Etiologija. Dispneja je jedan od najčešćih simptoma bolesti kardiocirkulacijskoga sustava. Uzroci kardijalne dispneje razmatrani su u poglavlju o kardiologiji. Pulmonalna dispneja može biti posljedica različitih bolesti i stanja: 1) bolesti gornjih dišnih puteva (aspiracija, strano tijelo, angioedem, upala, tumori), 2) bolesti plućnoga parenhima (pneumonija, tuberkuloza, karcinom, intersticijske bolesti); 3) bolesti dišnih puteva (bronhalna astma, kronična opstruktivna plućna bolest); 4) bolesti krvnih žila pluća (plućna hipertenzija, plućna embolija); 4) bolesti pleure (pleuritis, pleuralni izljev, pneumotoraks); 5) bolesti dijafragme (unilateralna ili bilateralna paraliza, velika hernija) te bolesti prsne stijenke (kifoskolioza, pektus ekskavatum). Osim uslijed poremećaja kardiocirkulacijskoga sustava, dispneja se može javljati i kod nekih drugih bolesti, kao što su metabolički poremećaji (metabolička acidoza), neurološki poremećaji (poremećaji stanja svijesti) ili psihički ispadi.
Klinička slika. Bolesnici s dispnejom žale se na osjećaj nestašice zraka i gušenje. Pri tome imaju manje ili više izražene vanjske manifestacije u vidu poremećaja frekvencije disanja (trahipneja, bradipneja), dubine disanja (plitko, duboko) te mogu imati vidljive znakove korištenja pomoćne respiratorne muskulature (uvlačenje juguluma i interkostalnih prostora, abdominalni tip disanja). Pri tome su bolesnici uznemireni, blijedi ili cijanotični, orošeni hladnim znojem. Jačina i brzina nastupa dispneje ovisi o uzročnoj bolesti. Za kronične plućne bolesti karakteristično je da se dispneja u početku javlja samo pri većim fizičkim naporima, a kasnije i pri manjim naporima te naposljetku i u mirovanju.
Posebni oblici dispneje. Dispneja, osim uz napor, može biti povezana i uz određene položaje tijela, tako da razlikujemo nekoliko oblika u odnosu na to: ortopneja (dispneja u ležećem položaju, nastaje zbog povećanja venskoga priljeva), platipneja (dispneja u uspravnom položaju, javlja se kod bolesnika sa slabošću trbušnih mišića i posljedičnim gubitkom dijafragmalne potpore uslijed anteriorne protruzije trbušnih organa) te trepopneja (dispneja pri ležanju na lijevom ili desnom boku). Paroksizmalna noćna dispneja naziv je za nagao nastup dispneje tijekom noći, obično pred jutro, koji bolesnike naglo probudi iz sna i izaziva osjećaj gušenja, nedostatka zraka praćenoga tjeskobom, a karakteristično se javlja u početnim fazama kardijalne dekompenzacije (povećanje cirkulirajućega volumena uslijed resorpcije perifernih edema u ležećem položaju).
Klinički pristup. S obzirom na to da je dispneja česta u kliničkoj praksi, predstavlja veliki diferencijalno-dijagnostički izazov, osobito u okvirima obrade bolesnika u hitnoj službi. Osnovni postupci s bolesnikom koji ima dispneju su: temeljno uzeta anamneza i fizikalni status, osnovna laboratorijska analiza koja uključuje plinske analize arterijske krvi, elektrokardiogram te klasični radiogram srca i pluća. Na temelju tih postupaka uglavnom se može razlikovati kardijalnu od pulmonalne dispneje. U zadnje vrijeme sve više se u svrhu diferenciranja kardijalne i pulmonalne dispneje koristi ultrazvuk pluća (plućnu kongestiju koja se javlja kod kardijalne dekompenzacije karakterizira obilje B-linija) te određivanje markera srčanoga popuštanja (nt-proBNP).
PATOLOŠKI OBLICI DISANJA
Cheyne-Stokesovo disanje patološki je oblik disanja karakteriziran apnejom trajanja od 10 - 15 sekundi nakon čega slijedi plitko disanje koje postaje sve dublje do određene točke, a zatim ponovno postaje sve pliće i završava apnoičnom pauzom. Najčešće se javlja kao znak intrakranijske patologije (osobito kod bolesnika koji su bez svijesti), a može se javiti i kao posljedica kronične hipoksije.
Biotovo disanje je patološki oblik disanja kod kojega nalazimo duge apnoične pauze koje bivaju isprekidane povremenim dubokim udasima. Javlja se u fazi agonije te kod nekih bolesti središnjega živčanog sustava (npr. meningitis).
KAŠALJ I ISKAŠLJAVANJE
Fiziologija. Kašalj je jedan od najčešćih znakova bolesti dišnoga sustava. Nastaje podraživanjem receptora za kašalj koji se nalaze u sluznici dišnih puteva (farinks, larinks, traheja, bronhi) te prijenosom živčanoga impulsa senzornim nitima parasimpatičkih živaca (n. vagus, n. glosofaringeus) do centra za kašalj koji se nalazi u produljenoj moždini. Prvenstveno, refleks kašlja predstavlja jedan od obrambenih mehanizama dišnoga sustava te pomaže pri odstranjivanju stranih čestica iz dišnih puteva. Najčešći podražaji koji dovode do refleksa kašlja su udisanje stranih čestica i drugih iritanasa te naglo izlaganje hladnom zraku ili nagloj promjeni temperature zraka.
Etiologija. Kašalj, osim navedenim podražajima, može biti izazvan i različitim bolestima i stanjima. Uzroci mogu biti različiti: farinks (postnazalna sekrecija); larinks (laringitis, tumor); traheja (traheitis); bronhi (akutni bronhitis, bronhalna astma, kronična opstruktivna plućna bolest, tumor); plućni parenhim (infekcije, fibroza, bronhiektazije, kongestija); ekstrapulmonalne bolesti (gastroezofagealni refluks) te lijekovi i druga stanja (ACE inhibitori, postinfektivni kašalj, aspiracija stranoga tijela).
Podjela. Prema vremenu trajanja, kašalj dijelimo na akutni koji traje do osam tjedana te kronični koji traje dulje od osam tjedana. Kašalj se također dijeli na neproduktivni (suhi), kada nije praćen iskašljavanjem, i produktivni - kada je praćen iskašljavanjem.
Iskašljaj ili sputum predstavlja sadržaj dišnih puteva koji biva izbačen kašljem. On se sastoji od vode, sluzi, elektrolita, deskvamiranih epitelnih stanica te drugih patoloških primjesa (bakterijske stanice, strana tijela i sl.). Osim makromorfološkim karakteristikama (boja, viskoznost), sputum predstavlja vrijedan materijal za različite laboratorijske pretrage (biokemijske, citološke, mikrobiološke).
Klinički pristup. Osnovni postupci kod bolesnika s kašljem uključuju dobro uzetu anamnezu (pušenje, uzimanje ACE inhibitora, gastrične smetnje, druge tegobe) i fizikalni pregled, kao i preglednu radiološku snimku pluća. Oni predstavljaju temelj na kojemu se bazira ostala dijagnostička obrada.
Liječenje se sastoji od liječenja osnovne bolesti u podlozi, a simptomatsko liječenje uključuje primjenu antitusika kod neproduktivnoga kašalja ili primjenu ekspektoranasa kod produktivnoga kašlja.
Neproduktivni kašalj liječi se primjenom antitusika. Na raspolaganju su sintetski antitusici kao butamirat (20 ili 50 mg tbl 2 do 3 x/dan) te opioidni antitusici kao folkodin (10 mg caps 2 do 3 x/dan), kodein (30 mg tbl maksimalno 4 x/dan) ili dekstrometorfan (15 mg sirupa maksimalno 4 x/dan).
Produktivni kašalj liječi se primjenom ekspektoranasa, iako je njihova prava farmakološka učinkovitost upitna. Na raspolaganju su različiti preparati: acetilcistein (200 mg 2 – 3 x/dan), bromheksin (8 ili 16 mg 2 do 3 x/dan) te karbocitsein (375 mg 2 do 3 x/dan).
CIJANOZA I AKROCIJANOZA
Definicija. Cijanoza je naziv za plavoljubičasto obojenje kože i sluznica što je posljedica povećane koncentracije deoksihemoglobina u krvi. Cijanoza se najčešće i najlakše uočava na periferiji i okrajinama (prsti, uške, nos), što se naziva akrocijanozom.
Patofiziologija. Plavo-ljubičasta boja kože posljedica je povećane koncentracije deoksihemoglobina što može biti posljedica povećane ekstrakcije kisika iz hemoglobina na periferiji (srčano popuštanje, venska opstrukcija) ili smanjene oksigenacije hemoglobina u plućima. Prema tome, razlikujemo perifernu i centralnu cijanozu. Cijanoza se može javiti i kao posljedica povećane koncentracije patoloških oblika hemoglobina (sulfhemoglobin, methemoglobin). Najčešći uzroci centralne i periferne cijanoze prikazani su u Tablici 2.1.
|
Tablica 2.1. Diferencijalna dijagnoza cijanoze
|
|
Centralna cijanoza
|
Periferna cijanoza
|
|
Hipoventilacijski sindromi
Bolesti alveokapilarne membrane
Bolesti plućnoga intersticija
Veno-arterijski šantevi
|
Srčano popuštanje
Izlaganje hladnoći
Venska opstrukcija
Arterijska opstrukcija
|
Klinička slika. Cijanoza je najbolje izražena na usnicama, uškama, prstima i obrazima. Kod tamnoputih bolesnika cijanozu najbolje uočavamo na sluznici usta i mrežnici oka. Ako cijanoza ne zahvaća usnice i sluznicu usne šupljine, radi se o perifernoj cijanozi. Nalaz batićastih prstiju ukazuje na to da cijanoza traje dulje vrijeme.
Klinički pristup. Osnovni je korak kod bolesnika s cijanozom odrediti radi li se o perifernoj ili centralnoj cijanozi. Na centralnu cijanozu ukazuju cijanoza usana i usne šupljine te prilikom masaže i laganoga zagrijavanja kože ne dolazi do povlačenja cijanoze. Kod svih bolesnika potrebno je učiniti plinske analize i acidobazni status, i odrediti patološke oblike hemoglobina ako za to postoji indikacija.
HEMOPTOA I HEMOPTIZE
Definicija. Hemoptoa je naziv za iskašljavanje krvi, a hemoptiza za primjese krvi u iskašljanom sadržaju. One ukazuju na krvarenje iz dišnoga sustava te mogu ukazivati na ozbiljna patološka stanja.
Etiologija. Glavne uzroke hemoptoe i hemoptize možemo podijeliti u tri skupine: upalni, tumorski i ostali uzroci. Upalna etiologija hemoptoe i hemoptize je najčešća, a uključuje akutni i kronični bronhitis, pneumoniju, tuberkulozu, bronhiektazije i plućne apsces te gljivične infekcije. Tumorska je etiologija također čest uzrok hemoptoe i hemoptize, a najčešće se radi o primarnom karcinomu pluća, dok je rijetko prisutna kod plućnih metastaza. Ostali uzroci su razni: plućna tromboembolija, srčano popuštanje, trauma prsnoga koša, bronhovaskularna fistula, hemoragijska dijateza te drugi uzroci difuzne alveolarne hemoragije.
Klinička slika. Hemoptou karakterizira iskašljavanje veće količine krvi iz dišnih puteva, a krv je obično svijetle boje i pjenušava te se pojavljuje uz kašalj. Od hemoptoe treba razlikovati hematemezu kod koje je krv tamnocrvene boje i povezana je s mučninom i povraćanjem. Bolesnici s hemoptoom obično su uplašeni i blijedi. Rijetko ta krvarenja mogu dovesti do hemoragijskoga šoka. Hemoptize su manje dramatične, a bolesnici se žale na primjese krvi u sadržaju sputuma.
Dijagnoza. Pristup bolesniku s hemoptoom i hemoptizom uključuje odgovarajuću pulmološku obradu. Osnovni pristup podrazumijeva detaljnu anamnezu i fizikalni pregled, osnovne laboratorijske pretrage s naglaskom na koagulogram te pregledni radiološki snimak pluća. Ostala dijagnostika ovisi o kliničkoj sumnji na etiologiju krvarenja.
Liječenje. Osnovno liječenje je etiološko. U simptomatske mjere ubrajamo mirovanje i stavljanje hladnih obloga na prsište, primjenu antitusika ako bolesnik ima nagon na kašalj. Potrebno je održavati koagulacijske parametre urednima primjenom odgovarajućih lijekova. Kod jakih krvarenja u obzir dolazi inhalacijska primjena antifibrinolitika (traneksamična kiselina) i iznimno rijetko aktiviranoga faktora VIIa. U obzir dolazi i bronhoskopsko interventno liječenje (primjena adrenalina, laserska koagulacija) te drugi oblici liječenja (embolizacija arterije, kirurško liječenje).
DIJAGNOSTIČKI POSTUPCI U PULMOLOGIJI
Osim laboratorijskih pretraga krvi, u dijagnostici bolesti dišnoga sustava koriste se različite slikovne dijagnostičke metode, invazivni postupci i testovi plućne funkcije.
SLIKOVNE DIJAGNOSTIČKE METODE
U slikovne dijagnostičke metode u pulmologiji ubrajamo klasični radiogram, ultrazvuk pluća i pleuralnoga prostora, kompjuteriziranu tomografiju, magnetsku rezonanciju, scintigrafiju te pozitronsku emisijsku tomografiju.
KLASIČNI RADIOGRAM PRSNOGA KOŠA
Uvod. Klasično radiološko snimanje organa prsnoga koša najčešće predstavlja ishodišnu dijagnostičku metodu u obradi bolesnika sa sumnjom na bolest pluća i općenito predstavlja najčešći radiološki pregled. Na preglednoj se snimci mogu analizirati koštane strukture torakalne stijenke, srce i velike krvne žile, plućni parenhim i plućna vaskulatura, pleura, dijafragma te medijastinum. Bolesti respiracijskoga i kardiocirkulatornog sustava predstavljaju najčešću indikaciju za izvođenje ove pretrage. Osim za postavljanje dijagnoze, ova se pretraga ponavlja jer ima ulogu i u praćenju razvoja bolesti ili terapijskoga učinka.
Tehnika snimanja. U svakodnevnoj se praksi klasični radiogram srca i pluća izvodi u dvije projekcije: postero-anteriorna (PA) i postranična ili profilna (L). Kod snimanja postero-anteriorne projekcije bolesnik stoji tako da prednji dio toraksa bude bliži filmu, a rendgenskim snopom biva usmjeren od straga prema naprijed. Na taj će način srce i velike krvne žile biti bliže filmu i dat će vjerniju veličinu. Postranična ili profilna projekcija izvodi se kao dopuna jer je trećina torakalnoga prostora prekrivena sjenom srca i velikih krvnih žila pa se iz toga razloga rutinski i radi lijevi profil, a desni uz kliničku indikaciju. Kod ležećih bolesnika koji se ne mogu vertikalizirati za izvođenje pretrage, snimanje se vrši u antero-posteriornoj projekciji (AP) - film se stavlja ispod leđa bolesnika, a rendgenski je snop usmjeren od naprijed prema straga. Kod takvoga se snimanja zbog promijenjenih fizikalnih uvjeta dobiva nerealnija slika srca i velikih krvnih žila, što sliku često čini neodgovarajućom za analizu. Također, pri izvođenju pretrage snimku bi trebalo snimiti pri dubokom inspiriju.
Uredan nalaz pluća na klasičnom radiogramu torakalnih organa uključuje centralno pozicioniranu traheju i glavne bronhe, obostrano simetričnu i homogenu prozračnost plućnoga parenhima, normalno položene ošite (desni u razini 5. ili. 6. međurebrenoga prostora, lijevi nešto niži za 2 do 3 cm), jasne i slobodne frenikokostalne sinuse te kardiotorakalni omjer manji od 50 %.
Najčešći patološki nalazi. Patološki nalazi pri interpretaciji snimke pluća uključuju patološka zasjenjenja, pojačanu prozračnost ili njihovu kombinaciju. Nekadašnja podjela patoloških nalaza pluća na alveolarni i intersticijski uzorak koji su se povezivali s patologijom alveola i intersticija danas se sve više napušta s obzirom na preklapanja i činjenicu da većina bolesti pluća na kraju rezultira patološkim promjenama i na intersticiju i na alveolama. U kliničkoj praksi najčešći patološki nalazi su: patološka zasjenjenja, plućna konsolidacija, atelektaza plućnoga parenhima te patološka prozračnost.
Patološka zasjenjenja najčešći su patološki nalaz kod interpretacije klasičnoga radiograma pluća. Ona prema obliku mogu biti plošna, okrugla te prugasta.
Plošna zasjenjenja zahvaćaju veći areal pluća, mogu biti homogena i nehomogena te podrazumijevaju različitu patologiju. Difuzna homogena zasjenjena tipična su za difuzno alveolarno oštećenje i nekardiogeni edem pluća (akutni respiratorni distres sindrom). Homogeno zasjenjenje jednoga režnja bez atelektaze tipično je za lobarnu pneumoniju, a zasjenjenje jednoga režnja s pratećom atelektazom obično je rezultat opstrukcije tumorom, stranim tijelom ili mukoznim čepom. Obostrana perihilarna zasjenjenja znak su plućne kongestije uslijed volumnoga preopterećenja.
Okrugla zasjenjenja označavaju postojanje jedne ili više okrugle sjene različite veličine na plućnom parenhimu. Ona se mogu vidjeti kod upala (multifokalna bronhopneumonija, apsces, paraziti, tuberkulom) te mogu ukazivati na primarne ili sekundarne tumore. Često se unutar takvih promjena vide i sekundarne kalcifikacije.
Prugasta zasjenjenja dolaze u dva oblika: linearan i retikularan (mrežolik). Linearan crtež podrazumijeva postojanje patoloških sjena u obliku pravilnih linija po plućnom parenhimu, a najčešće se govori o Kerleyevim A-linijama koje se protežu od perihilarne regije prema plućnoj periferiji i znak su plućne kongestije. Retikularan crtež označava nepravilna prugasta zasjenjenja plućnoga parenhima koja ostavljaju dojam mreže, pa se još naziva i mrežolikim crtežom. Njega primarno nalazimo kod bolesti plućnoga intersticija (intersticijski edem, atipične pneumonije, fibroza i sl.).
Plućna konsolidacija oblik je patološkoga zasjenjenja koje nastaje kada se alveolarni prostor ispuni tekućim ili drugim sadržajem, a susrećemo ga kod upalnoga procesa koji traje duže vrijeme. Radi se o homogenom zasjenjenju jasnih rubova koje zahvaća određeni plućni režanj. Unutar konsolidacije se mogu naći veći bronhi koji sadrže zrak i to nazivamo zračnim bronhogramom. Traheja i ostale medijastinalne strukture su bez patološkoga pomaka.
Atelektaza plućnoga parnehima oblik je patološkoga zasjenjenja koji nastaje kao posljedica smanjenja volumena bolesnoga parenhima (apsorpcija zraka i kolaps alveola), a obično je posljedica opstrukcije većega bronha tumorom, stranim tijelom ili mukoznim čepom. Prikazuje se kao plošno, homogeno, oštro ograničeno zasjenjenje, obično konkavnih rubova, koje prati pomak medijastinuma i traheje na bolesnu stranu.
Pojačana prozračnost plućnoga parenhima ukazuje na prisutnost veće i/ili patološke količine zraka intratorakalno. Ona može biti ograničena na manja područja pluća ili režnjeve (bule, ciste), na cijelo plućno krilo ili oba plućna krila (emfizem, hiperinflacija), pleuralni prostor (pneumotoraks) ili medijastinum (pneumomedijastinum). Posebna vrsta patološke prozračnosti je šupljina ili kavitacija unutar plućevine koja nastaje raspadom tkiva (upala, tumor). Ona obično ima svoju jasno vidljivu stijenku te sadržaj na dnu što stvara aerolikvidni nivo.
Interpretacija nalaza. Pri tumačenju radiološkoga nalaza glavna ishodišna točka je klinički upit ili sumnja. Ispravno postavljanje radiološke dijagnoze uključuje tumačenje nalaza u kontekstu kliničke slike bolesnika: lobarno plošno zasjenjenje bolesnika s anamnezom vrućice, kašlja i iskašljavanja može biti sasvim različito od onoga kod bolesnika s anamnezom dispneje i progresivnoga gubitka na tjelesnoj težini. Prilikom svakoga upućivanja bolesnika na radiološko snimanje pluća obvezno je radiologu napisati klinički upit ili kliničku sumnju.
ULTRAZVUK PLUĆA I PLEURALNOG PROSTORA
Uvod. Ultrazvuk pluća i pleuralnoga prostora danas ima sve veći značaj u dijagnostičkoj obradi bolesnika sa sumnjom na bolest dišnih organa, a osobito u okviru hitne službe i bolesnika smještenih u jedinicama intenzivnoga liječenja. Ultrazvuk se danas sve više koristi kao nadopuna kliničkom pregledu, a ima više prednosti: neškodljivost za bolesnika, brzo i jednostavno izvođenje, mogućnost opetovanoga izvođenja (praćenje dinamike bolesti) te izvođenje pretrage uz krevet bolesnika.
Tehnika izvođenja. Za ultrazvuk pluća koriste se sonde niže frekvencije (1.0 do 5.0 MHz) zbog bolje penetracije, ali se njima dobiva lošija rezolucija. Kod izvođenja pretrage sonda se stavlja na četiri karakteristične točke svakoga hemitoraksa: gornja prednja točka (2. - 3. interkostalni prostor u medioklavikularnoj liniji), donja prednja točka (4. - 5. interkostalni prostor u prednjoj aksilarnoj liniji), posterolateralna točka (4. - 5. interkostalni prostor u stražnjoj aksilarnoj liniji) te donja lateralna točka za prikaz frenikokostalnoga kuta.
Uredan nalaz ultrazvuka pluća u B-modu uključuje prikaz akustičnih sjena od rebara između kojih se uočavaju dva lista pleure koji međusobno kližu, a ispod kojih nalazimo više A-linija koje predstavljaju artefakte (reverberacije od pleure). Ovu sliku često opisujemo kao znak šišmiša. U M-modu imamo karakterističan nalaz koji se opisuje kao znak pješčane plaže zbog svoga izgleda (sitan, točkast uzorak).
Najčešći patološki nalazi su: plućna kongestija/plućni edem (intersticijski sindrom), pleuralna efuzija (pleuralni izljev), alveolarna konsolidacija (pleuropneumonija) te pneumotoraks. Plućnu kongestiju i edem karakteriziraju brojne okomite B-linije koje presijecaju A-linije te s disanjem karakteristično mijenjaju svoj položaj. Pleuralni se izljev očituje kao anehogena sjena u području frenikokostalnih kuteva, a s vremenom se mogu pojaviti fibrinske niti koje ukazuju na organizaciju izljeva. Alveolarna konsolidacija vidljiva je ako je patološki proces u doticaju s pleurom, a vidi se kao zgusnut parenhim (hepatizacija pluća) unutar kojega nalazimo zračni bronhogram. Pneumotoraks se u B-modu očituje odsustvom klizanja pleure, a u M-modu izostaje znak pješčane plaže.
Protokoli. Danas postoje dva protokola za brže i jednostavnije izvođenje ultrazvuka pluća. BLUE protokol koristi se u hitnoj službi pri evaluaciji bolesnika s dispnejom, a FALLS protokol za procjenu volumnoga opterećenja bolesnika (praćenje B-linija), što ima dijagnostički značaj, kao i terapijske implikacije (vrsta terapije, određivanje količine volumena koji se nadoknađuje).
KOMPJUTERIZIRANA TOMOGRAFIJA PRSNOGA KOŠA
Kompjuterizirana tomografija (CT) omogućava bolji prikaz morfoloških struktura i patoloških promjena intratorakalnih organa i često se nadovezuje na konvencionalno radiološko snimanje. CT omogućava detekciju patoloških promjena koje nisu detektibilne konvencionalnim snimanjem (lezije manje od 1 cm). U praksi se koristimo jednim od tri moda: konvencionalni CT (daje poprečne presjeke debljine 10 mm), CT visoke rezolucije (daje poprečne presjeke debljine 2 mm) te spiralni CT (omogućava prikaz cijeloga volumena prsnoga koša prilikom jednoga udaha koji traje do 8 sekundi). Glavni nedostatak CT-a visoka je doza zračenja kojoj je bolesnik izložen tijekom pretrage.
CT prsnoga koša obično se koristi kao druga linija u dijagnostici plućnih bolesti, kada se dijagnoza ne može postaviti na osnovi konvencionalne radiološke snimke. Najčešće indikacije su: infiltrati i patološka zasjenjenja pluća, pleure ili medijastinuma nejasne etiologije; sumnja na intersticijsku bolest pluća (pri toj indikaciji preporuča se CT visoke rezolucije); bolesnici s negativnim konvencionalnim radiološkim nalazom, ali s visokom sumnjom na intratorakalnu patologiju te procjena proširenosti (engl. staging) malignoga procesa.
Za razlikovanje vaskularnih od nevaskularnih struktura može se primijeniti intravenski kontrast te se tako omogućava bolje razlučivanje krvnih žila od ostalih tkiva. Također, obično se prilikom snimanja CT-a prsnoga koša u istome činu zahvati i gornji abdomen, što je bitno kod sumnje ili obrade malignoma pluća (detekcija sekundarizama u jetri ili nadbubrežnim žlijezdama).
CT angiografija plućnih arterija pretraga je izbora u dijagnostici plućne tromboembolije, a podrazumijeva primjenu kontrasta koji ispunjava plućne arterije i omogućava dijagnozu opstrukcije, odnosno embolizacije.
MAGNETNA REZONANCIJA
Magnetna rezonancija (MRI) pluća nema veću prednost nad CT-om u dijagnostici patomorfoloških promjena pluća i ima ograničenu ulogu. Prednost te pretrage, osim u činjenici da se bolesnika ne izlaže zračenju, leži u činjenici da se uz MRI mogu razlikovati krvne žile bez primjene kontrastnoga sredstva što može imati ulogu pri sumnji na plućnu emboliju, kada se ne može dati intravenski kontrast.
SCINTIGRAFIJA PLUĆA
Scintigrafija pluća je nuklearno-medicinska pretraga pri kojoj se koristi radiofarmak koji se primjenjuje intravenski (perfuzijska scintigrafija) ili inhalacijski (ventilacijska scintigrafija) poslije čega se posebnom kamerom detektiraju gama-zrake te se na taj način prati raspodjela radiofarmaka kroz pluća. Danas se pretraga izvodi gotovo samo pri jednoj indikaciji, a to je sumnja na plućnu tromboemboliju. Pri tome se izvodi i perfuzijska i ventilacijska scintigrafija te se na osnovi nesklada između ventilacije i perfuzije (postojanje ventiliranoga područja pluća bez perfuzije) postavlja indirektna sumnja na plućnu emboliju. Sama perfuzijska scintigrafija apsolutno je nepouzdana u postavljanju dijagnoze plućne embolije. Ventilacijska scintigrafija pluća može se koristiti i u prijeoperacijskoj procjeni učinka lobektomije ili pulmektomije na plućnu funkciju.
POZITRONSKA EMISIJSKA TOMOGRAFIJA (PET-CT)
PET-CT metoda služi pri obradi bolesnika sa sumnjom ili dokazanim malignim procesom pluća u svrhu stupnjevanja (engl. staging). Radi se o pretrazi koja se zasniva na primjeni radioaktivno označene glukoze (18-fluorodeoksiglukoza) s ciljem promatranja metaboličke aktivnosti tkiva, tj. suspektne mase ili limfnoga čvora. Maligni procesi metabolički su vrlo aktivni te im je potrebna veća količina glukoze, što dovodi do pojačane akumulacije radioaktivno označene glukoze, a to se onda detektira na učinjenim snimkama. Sličnu pojačanu metaboličku aktivnost mogu imati i inflamirana tkiva što treba imati na umu kod interpretacije nalaza (tuberkuloza, sarkoidoza, gljivične infekcije). Također, treba imati na umu i da tumori sporoga rasta, a time i slabije metaboličke aktivnosti, mogu dati lažno negativan nalaz. Najčešća indikacija za PET-CT je evaluacija intratorakalne raširenosti malignoga procesa pluća, osobito u procjeni medijastinuma i pripadajućih limfonoda.
INVAZIVNI POSTUPCI
Invazivni postupci u pulmologiji izvode se u dijagnostičke ili terapijske svrhe. To su postupci koji podrazumijevaju narušavanje integriteta kože ili sluznice, odnosno prodiranje u tkiva ili ulazak u tjelesne šupljine. Najčešći su: bronhoskopija, endoskopski ultrazvuk intratorakalnih limfnih čvorova; pleuralna punkcija i transtorakalna biopsija.
BRONHOSKOPIJA
Bronhoskopija je endoskopska metoda koja omogućava pregled nazofarinksa, larinksa, glasnica te proksimalnoga traheobronhalnog debla. Prema načinu izvođenja, razlikujemo fleksibilnu i rigidnu bronhoskopiju, a prema namjeni dijagnostičku i terapijsku.
Fiberbronhoskopija podrazumijeva pregled nazofarinksa, larinksa, traheje i bronha putem fleksibilnoga aparata koji se uvodi preko nosne šupljine. Aparat je tanji, fleksibilan i ima mogućnost navođenja i usmjeravanja od strane kliničara. Pretraga se izvodi ambulantno, uz prethodnu laganu sedaciju, lokalni anestetik (lidokain), a može se dati i atropin venski s ciljem smanjenja salivacije. Glavna je prednost mogućnost ulaska u segmentalne i subsegmentalne bronhe (do 7. generacije grananja) te izvođenje zahvata i postupaka uvođenjem instrumenata kroz radni kanal. Fiberendoskopija se kod intubiranih bolesnika izvodi kroz endotrahealni tubus, a kod bolesnika s traheostomom kroz kanilu.
Rigidna bronhoskopija podrazumijeva pregled larinksa, traheje i glavnoga bronha putem rigidne metalne cijevi koja se uvodi kroz usnu šupljinu pri čemu glava mora biti u izraženom položaju fleksije. Pretraga se rijetko izvodi, uglavnom u terapijske svrhe (vađenje stranoga tijela ili zbrinjavanje masivne plućne hemoragije). Također, zbog veličine i rigidnosti, pretrazi nisu dostupni segmentalni bronhi. Pretraga se izvodi pri općoj anesteziji.
Dijagnostička bronhoskopija. Izvođenje bronhoskopije u dijagnostičke svrhe podrazumijeva vizualni pregled organa te uzimanje dijagnostičkoga materijala. Vizualno se pregledaju nazofarinks, larinks, glasnice, traheja te bronhi koji su dostupni prolasku aparata. Pregledava se integritet i izgled sluznice, uočavaju se endobronhalne mase, ekstraluminalne kompresije, krvarenja i sl. Osim vizualnoga pregleda, tijekom bronhoskopije se mogu uzeti i različiti dijagnostički materijali uz pomoć instrumenata koji se uvode kroz radni kanal aparata: biopsija kliještima, bris četkicom, iglena aspiracija te bronhoalveolarni lavat (ispirak fiziološkom otopinom). Dobiveni uzorci mogu se mikrobiološki i citološki analizirati.
Terapijska bronhoskopija. Osim u dijagnostičke svrhe, bronhoskopija ima i značajne terapijske implikacije. Najčešći terapijski postupci su vađenje stranoga tijela, zaustavljanje krvarenja, toaleta dišnoga puta te pomoć pri otežanoj endotrahealnoj intubaciji. Osim toga, bronhoskopija ima sve veću ulogu u zbrinjavanju endobronhalnih lezija, kao što su tumorske mase i granulacijsko tkivo (YAG-laser, krioterapija, elektrokauterizacija), osobito onih koje dovode do opstrukcije i s njome povezanih komplikacija. Bronhoskopija može poslužiti i za postavljanje katetera za brahiterapiju karcinoma pluća, kao i za postavljanje endobronhalnih stentova u nekim slučajevima malignih tumora, traheoezofagealnih fistula te traheomalacije.
Kontraindikacije. Apsolutne kontraindikacije su srčane aritmije koje vode u hemodinamsku nestabilnost, nemogućnost odgovarajuće okisgenacije bolesnika za vrijeme pretrage te akutna respiratorna insuficijencija s hiperkapnijom (kod takvih bolesnika pretraga se može izvoditi samo ako ih se prethodno intubira i mehanički ventilira). Relativne kontraindikacije su akutni infarkt miokarda unutar mjesec dana, nekorigirana koagulopatija te nesuradljivost (nemir) bolesnika. Dodatan oprez potreban je kod bolesnika kojemu se radi transbronhalna punkcija, a ima sindrom gornje šuplje vene ili torakalnu aneurizmu.
Komplikacije. Bronhoskopija je u pravilu sigurna procedura, s niskom stopom komplikacija koje se kreću od 0,1 do 1,7 %. Komplikacije mogu biti uzrokovane samom pretragom (krvarenje, pneumotoraks, edem i povreda larinksa) ili premedikacijom (sedacija povezana sa supresijom centra za disanje, bronhospazam ili laringospazam izazvan lidokainom).
ENDOSKOPSKI ULTRAZVUK INTRATORAKALNIH LIMFNIH ČVOROVA
Intratorakalna limfadenopatija zahtijeva značajan klinički napor u evaluaciji svoga porijekla (upalno, tumorsko ili reaktivno). Osim toga, procjena proširenosti plućnoga malignog procesa (engl. staging) temelji se na procjeni zahvaćenosti regionalnih limfnih čvorova.
Procjena torakalne limfadenopatije zasniva se na neinvazivnim slikovnim metodama u čemu PET-CT ima glavnu ulogu. Ipak, za konačnu odluku potrebna je i citološka i/ili histološka verifikacija. Do sada je glavni standard pri tome bila cervikalna medijastinoskopija ili torakotomija s uzimanjem bioptata. Kako se radi o operativnim zahvatima koji nose visoke rizike, danas su na raspolaganju dvije manje invazivne pretrage: EUS-FNA (od engl. transoesophageal ultrasound-guided fine needle aspiration) te EBUS-TBNA (od engl. endobronchial ultrasound-guided transbronchial needle aspiration).
EUS-FNA je pretraga kod koje se ultrazvučna sonda uvodi transezofagealno te se na taj način prikazuje većina medijastinalnih limfnih čvorova koji se mogu punktirati iglom preko stijenke jednjaka. Intrapulmonalni i hilarni limfonodusi nisu dostupni ovoj pretrazi, što je ujedno njezin glavni nedostatak.
EBUS-TBNA je novija pretraga kod koje se ultrazvučna sonda uvodi transbronhalno te na taj način omogućava prikazivanje i uzimanje uzoraka. Za razliku od EUS-a, EBUS omogućava potpunu vizualizaciju i punkciju svih medijastinalnih, hilusnih i intrapulmonalnih limfnih čvorova.
Glavne indikacije za ove pretrage su citološka punkcija medijastinalne limfadenopatije nejasne etiologije te procjena proširenosti tumora pluća. Kontraindikacije i komplikacije jednake su kao i za klasičnu bronhoskopiju.
Zahvaljujući ovim metodama, medijastinoskopija ostaje „zlatni standard“ u dva slučaja: pri negativnom nalazu endoskopsko-ultrazvučne citološke punkcije PET-CT pozitivnih limfnih čvorova te kod bolesnika s centralnim primarnim tumorom prednjega medijastinuma.
PLEURALNA PUNKCIJA
Pleuralna punkcija ili torakocenteza je postupak uvođenja igle u pleuralni prostor s ciljem evakuacije pleuralne tekućine što može imati dvostruki značaj: dijagnostički (biokemijska, citološka i mikrobiološka analiza punktata) te terapijski (evakuacija tekućine olakšava disanje i smanjuje dispnoične tegobe).
Indikacije i kontraindikacije. Glavne indikacije za pleuralnu punkciju su analiza i utvrđivanje etiologije izljeva te olakšavanje disanja. Osnovne kontraindikacije za izvođenje pleuralne punkcije su relativne, a uključuju mali ili septirani pleuralni izljev, značajno izmijenjenu anatomiju torakalne stijenke, hemoragijsku dijatezu te nekontroliran kašalj.
Tehnika izvođenja. Postupak je najbolje izvoditi u sjedećem položaju, nagnut prema naprijed s rukama oslonjenim na čvrstu podlogu. Kod ležećih se bolesnika preporuča podizanje uzglavlja kreveta na što višu razinu. Mjesto punkcije određuje se na temelju fizikalnoga nalaza (odsutno disanje, mjesto najveće perkutorne mukline u stražnjoj aksilarnoj liniji) ili se označava na temelju ultrazvučnoga pregleda. Mjesto uboda se dezinficira, sterilno pokrije, a potom se vrši aplikacija lokalnoga anestetika (5 ml 2 % lidokain). Anestetik se aplicira uvođenjem igle uz gornji rub donjega rebra na predviđenome mjestu, postupno i polako s povremenim aspiracijama (da se izbjegne aplikacija anestetika u krvnu žilu). Kada se probije parijetalna pleura u šprici će se pojaviti prilikom aspiracije tekući sadržaj, a i sam proboj kroz torakalni zid osjeti se kao gubitak otpora uvođenju igle. Tada se vadi igla kojom smo anestezirali te se uvodi punkcijska igla po istom principu te se pomoću sustava za punkciju (šprica, trodijelni jednosmjerni ventil i spremnik) ili spajanjem na uređaj za sukciju vrši evakuacija preostale tekućine.
Posebne napomene. Bolesnik može osjetiti bol prilikom proboja kože ili parijetalne pleure iglom. Evakuacija mora biti polagana i ne smije se evakuirati više od 1000 do 1500 ml tekućine. Pri kraju evakuacije, kada dolazi do reekspanzije pluća, bolesnici počinju pomalo kašljati što je znak da se evakuacija završi. Također, evakuaciju treba prekinuti ako se bolesnik za vrijeme procedure počne tužiti na jak bol, izrazito otežano disanje, počne jako kašljati uz sukrvav iskašljaj, ako se dobije velika količina krvi kroz aspiracijsku iglu ili bolesnik razvije znakove šoka (hipotenzija, tahikardija, preznojavanje). Često nakon evakuacije pleuralnoga izljeva upalne etiologije bolesnici osjete pleuralnu bol te razviju pleuralno trenje. Preporuča se kontrolna radiološka snimka pluća nakon postupka (praćenje učinka punkcije, uočavanje pneumotoraksa).
Komplikacije. Kod pravilnoga izvođenja postupka, komplikacije su rijetke. Najčešće komplikacije su pneumotoraks koji ne diramo kada je manji i pustimo da se spontano apsorbira te subkutani emfizem. Ostale, rjeđe komplikacije su laceracije krvnih žila s posljedičnim hematotoraksom i/ili hemoptizama, pleuralni šok (hipotenzija udružena s punkcijom pleure), edem pluća (brza evakuacija veće količine tekućine koja je kroz duži period komprimirala plućni parenhim) te intratorakalna infekcija kod neodržavanja aseptičkih uvjeta rada.
Analiza pleuralnoga punktata. Dobiveni tekući sadržaj analizira se makroskopski (boja i izgled) te mikroskopski (biokemijski, citološki i mikrobiološki). Makroskopski gledano, dobiveni sadržaj može biti bistar - što ide u prilog transudatu, mutan - što ide u prilog eksudatu te hemoragičan. Mikroskopska analiza uključuje biokemijske pretrage (specifična gustoća, količina proteina, količina laktat dehidrogenaze), mikrobiološke pretrage te citološke pretrage (pretrage na maligne stanice). Na temelju izgleda i biokemijske analize razlikujemo dva tipa pleuralnoga izljeva: transudat i eksudat (Tablica 2.2.).
|
Tablica 2.2. Osnovne karakteristike transudata i eksudata
|
|
Vrsta izljeva
|
Specifična gustoća
|
Makroskopski izgled
|
Mikroskopski pregled
|
Koncentracija proteina
|
Koncentracija LDH-a
|
|
Transudat
|
Ispod 1010
|
Bistar i čist do blago žućkast
|
Nekoliko stanica
|
Ispod 3 g/dL
|
Manje od 2/3 urednih serumskih vrijednosti
|
|
Eksudat
|
Iznad 1010
|
Gust, zamućen, opalescentan
|
Mnoštvo stanica
|
Iznad 3 g/dL
|
Više od 2/3 urednih serumskih vrijednosti
|
Etiologija pleuralnoga izljeva može se temeljiti na navedenoj podjeli. Transudat se može javiti kao posljedica volumnoga opterećenja i visokoga hidrostatskog tlaka (srčana dekompenzacija, nefritički sindrom, energična nadoknada volumena) ili smanjenja koloidno-osmotskoga tlaka plazme (hipoproteinemija, nefrotski sindrom, hepatalna insuficijencija). Eksudat je obično upalne etiologije, bilo infektivne (bakterijska, virusna, gljivična), bilo neinfektivne (kolagenoze) te malignih procesa. Hemoragičan izljev može se naći uz maligne procese, traumatske ozljede, žestoke plućne infekcije ili u sklopu koagulopatija.
TRANSTORAKALNA BIOPSIJA
Transtorakalna biopsija pluća ili pleure postupak je uvođenja igle za biopsiju uz kontrolu ultrazvukom ili CT-om preko stijenke prsnoga koša do željene lezije koja je smještena u perifernim regijama. Najčešća indikacija je histološka potvrda malignoga procesa koji se nalazi na periferiji pluća i nije dostupan bronhoskopskoj biopsiji. Točnost transtorakalne iglene biopsije u dijagnostici malignih tumora je preko 95 %.
Postupak se vrši u aseptičnim uvjetima rada uz lokalnu anesteziju. Biopsijska igla uvodi se preko torakalne stijenke u željenu leziju pod kontrolom ultrazvuka ili CT-a dok bolesnik zadržava dah. Kada se potvrdi položaj igle u leziji, vrši se uzorkovanje (ovisno o vrsti igle, aspiracija sadržaja lezije za citološki pregled ili uzimanje cilindričnoga uzorka za histološki pregled).
Kontraindikacije uključuju značajno promijenjenu anatomiju zida prsnoga koša, nemogućnost točne lokalizacije procesa, nekontroliranu koagulopatiju, kontralateralnu pulmektomiju, suspektne vaskularne lezije te buloznu bolest pluća. Moguće komplikacije uključuju pneumotoraks, krvarenje, subkutani emfizem, zračnu emboliju i infekcije.
KLINIČKI TESTOVI PLUĆNE FUNKCIJE
Testovi plućne funkcije koriste se u svrhu procjene funkcionalnoga stanja dišnoga sustava, odnosno za otkrivanje patoloških promjena. Tu su testovi kojima se ispituje brzina protoka zraka kroz dišne puteve, plućni volumeni, difuzije plinova preko respiracijske membrane kao funkcija dišnih mišića. Oni sami nisu dovoljni za postavljanje dijagnoze, ali u sveobuhvatnom pristupu, koji obuhvaća kliničku sliku, laboratorijske i slikovne metode, imaju važnu ulogu. Osim u dijagnostici bolesti, koriste se i za procjenu težine bolesti, praćenje napredovanja bolesti, praćenje učinka liječenja, a često imaju i prognostičku važnost.
Testovi plućne funkcije koji se koriste u kliničkoj praksi su: spirometrija, bronhodilatacijski test, bronhoprovokacijski test, mjerenje vršnoga ekspiracijskog protoka, tjelesna pletizmografija, difuzijski kapacitet pluća (DLCO), mjerenje upale – FeNO test, plinske analize arterijske krvi u mirovanju, pulsna oksimetrija te testovi opterećenja (šestominutni test hoda i spiroergometrija).
Prije provođenja testova plućne funkcije treba isključiti bolesti i stanja koja mogu utjecati na rezultate ispitivanja i učiniti ih nevažećima. Najčešća i bolesti i stanja te potrebna pauza za izvođenje testova su: akutna upala dišnih puteva (4 do 6 tjedana), cijepljenje živom vakcinom (3 do 6 tjedana), neposredna inhalacija dišnih iritanasa (pauza do objektivnoga oporavka), aktivno ili pasivno pušenje (2 sata), terapija određenim lijekovima: bronhodilatatori kratkoga djelovanja (6 - 8 sati), bronhodilatatori dugoga djelovanja (12 - 24 sata), kromoni (24 sata), antihistaminici (3 do 7 dana), alfa-adrenergički blokatori (8 sati), beta-adrenergički blokatori (24 sata), kratkodjelujući teofilin (8 sati), dugodjelujući teofilin (24 sata), modifikatori leukotrijena (24 sata), inhalacijski ili sistemski kortikosteroidi (4 tjedna).
SPIROMETRIJA
Uvod. Spirometrija je najčešći test plućne funkcije u kliničkoj praksi. Ona omogućava dinamično mjerenje plućnih volumena te brzine protoka zraka kroz dišne puteve, što se može prikazati brojčanim rezultatom ili u obliku krivulje protok-volumen. Nalaz spirometrije pomaže pri razlikovanju opstruktivnih od restriktivnih smetnji disanja.
Tehnika izvođenja spirometrije. Osnovna pretpostavka za valjanu interpretaciju nalaza je suradljivost bolesnika i poznavanje tehnike izvođenja spirometrije. Bolesnik najprije normalno diše, a potom učini maksimalan udah nakon kojega slijedi brz i jak izdah dokle god je to moguće (do kraja). Izdah mora trajati najmanje 6 sekundi ii ne smije biti isprekidan kašljanjem i sl. Pri tome bolesnik usnicama čvrsto stisne usnik spirometra, a na nos se postave nosne štipaljke. Na taj način uređaj (spirometar) mjeri i računalno analizira protoke i volumene koji se naknadno ispisuju. Prije samoga izvođenja testiranja u spirometar se unose osnovi bolesnikovi parametri (spol, dob, tjelesna masa i visina) jer su oni nužni kako bi se izmjerene vrijednosti pojedinih parametara usporedile s individualnim standardom (tzv. očekivane vrijednosti za spol, dob, tjelesnu visinu i masu ispitanika).
Parametri spirometrije. Spirometrijom mjerimo sljedeće parametre: FVC (forsirani vitalni kapacitet), FEV1 (forsirani ekspiratorni volumen u prvoj sekundi), FEV1/FVC (omjer forsiranoga ekspiratornog volumena u prvoj sekundi i forsiranoga vitalnog kapaciteta, tzv. Tiffeneauov indeks), PEF (vršni ekspiracijski protok), te FEF25, FEF50 i FEF75 (forsirani ekspiracijski protok pri 25 %, 50 % i 75 % forsiranoga vitalnog kapaciteta). Parametri spirimetrije prikazani su u Tablici 2.3.
|
Tablica 2.3. Parametri spirometrije
|
|
Naziv
|
Pokazatelj
|
Klinička primjena
|
|
FVC
|
Maksimalna količina zraka koju bolesnik može izdahnuti nakon maksimalnoga udaha.
|
Snižene vrijednosti FVC-a ukazuju na restriktivan poremećaj disanja.
|
|
FEV1
|
Volumen zraka koji se izdahne u prvoj sekundi i normalno iznosi 75 % FVC-a.
|
Pokazatelj protoka, koristan u dijagnostici i praćenju opstruktivnih smetnji disanja.
|
|
FEV1/FVC
|
Postotak FEV1 od FVC-a (dio FVC-a koji čini FEV1).
|
Osjetljiviji pokazatelj opstruktivnih smetnji disanja od FEV1.
|
|
PEF
|
Maksimalna brzina izdaha, tj. vrši protok zraka u početnom dijelu ekspirija.
|
Praćenje respiratorne funkcije i kontrole bolesnika s bronhalnom astmom.
|
|
FEF25,50,75
|
Maksimalna brzina izdaha pri 25 %, 50 % i 75 % FVC-a. Negdje se označava kao MEF.
|
Osjetljiviji pokazatelj opstrukcije malih dišnih puteva od FEV1.
|
Interpretacija nalaza spirometrije. Nalaz spirometrije može se prikazati na dva načina: a) brojčanim vrijednostima i b) krivuljom protok-volumen. Prije interpretacije treba provjeriti jesu li zadovoljeni uvjeti same tehnike izvođenja pretrage: maksimalan udah, brz i snažan izdah bez kašljanja koji traje minimalno 6 sekundi. To se može provjeriti i ponovljenim mjerenjem, a rezultate smatramo prihvatljivima ako je odstupanje manje od 5 % ili 100 ml.
Brojčana interpretacija. Referentne (normativne, uredne) vrijednosti navedenih parametara nisu iste za sve osobe, nego one ovise o spolu, visini, težini te dobi. Stoga se kod ispisa rezultata spirometrije, osim ispisa vrijednosti koju je ispitanik postigao tijekom ispitivanja, ispisuje i postotak koji predstavlja postignutu vrijednost u odnosu na očekivanu vrijednost za toga ispitanika: više od 100 % (izvrstan nalaz), 100 % (uredan nalaz), 100 – 80 % (tolerirano smanjenje), manje od 80 % (patološki nalaz). Omjer FEV1/FVC (Tiffeneauov indeks) normalno iznosi 70 % (0.7). Interpretacija nalaza spirometrije prikazana je u Tablici 2.4.
|
Tablica 2.4. Interpretacija nalaza spirometrije
|
|
Normalan nalaz
|
Opstruktivne smetnje disanja
|
Restriktivne smetnje disanja
|
|
FEV1 > 80 %
FVC > 80 %
FEV1/FVC > 0.7
|
FEV1 < 80 %
FVC < 80 %
FEV1/FVC < 0.7
|
FEV1 < 80 %
FVC < 80 %
FEV1/FVC > 0.7
|
Krivulja protok-volumen omogućava istovremeni prikaz mjerenja protoka i volumena i njihovoga međusobnog odnosa. Krivulja na osi X prikazuje volumen zraka (izražen u litrama), a na Y osi prikazuje protok zraka (izražen u litrama u sekundi). Dobivena krivulja ima svoj ekspiratorni dio (iznad X osi) te inspiratorni dio (ispod X osi). Ekspiratorni dio krivlje pokazuje ukupni volumen zraka izdisan tijekom testa (forsirani vitalni kapacitet, FVC) i na njoj možemo mjeriti vršni ekspiracijski protok (PEF) te forsirani ekspiracijski protok pri 75 %, 50 % i 25 % FVC-a (FEF75, FEF50, FEF25). Inspiratorni dio krivulje prikazuje volumen zraka koji se forsirano udahne tijekom testa, a na njemu se mjere identični parametri: vršni inspiracijski protok (PIF) te forsirani inspiracijski protok pri 25 %, 50 % i 75 % inspiriranoga vitalnog kapaciteta (FIF25, FIF50, FIF75). Analiza ove krivulje temelji se na zapažanju da krivulja karakteristično mijenja svoj izgled ovisno o vrsti poremećaja disanja (opstruktivne, restriktivne) u odnosu na zdrave osobe.
BRONHODILATACIJSKI TEST
Bronhodilatacijski test izvodi se s ciljem utvrđivanja reverzibilnosti bronhoopstrukcije, a temelji se na odgovoru dišnih puteva nakon primjene bronhodilatatora: inhalacijske primjene 400 mcg salbutamola ili 160 mg ipratropija. Bolesnike treba upozoriti da ne uzimaju bronhodilatatore kratkoga djelovanja šest sati prije testiranja, a dugoga djelovanja dvanaest sati. Test se sastoji od izvođenja spirometrije prije primjene bronhodilatatora i 20 minuta nakon primjene salbutamola, odnosno 45 minuta nakon ipratropija. Porast spirometrijske vrijednosti FEV1 za 12 % (ili 200 ml) znači da je test pozitivan, odnosno da je bronhoopstrukcija reverzibilna.
Ovaj test koristan je u diferencijalnoj dijagnozi opstruktivnih poremećaja disanja: bolesnici s astmom pokazuju reverzibilnu opstrukciju, dok bolesnici s kroničnom opstruktivnom plućnom bolesti pokazuju ireverzibilnu bronhoopstrukciju, iako postoje slučajevi koji mogu pokazivati i određeni stupanj reverzibilnosti.
Ako je bronhodilatacijski test salbutamolom ili ipratropijem negativan, može se pokušati četverotjedni pokus reverzibilnosti inhalacijskim kortikosteroidima. To uključuje inicijalno spirometrijsko testiranje, primjenu inhalacijskih kortikosteroida tijekom četiri tjedna te ponovno spirometrijsko testiranje. Test je pozitivan ako su ispunjeni prethodno navedeni uvjeti (poboljšanje FEV1 za 12 % i 200 mL).
BRONHOPROVOKACIJSKI TEST
Bronhoprovokacijski test izvodi se s ciljem izazivanja bronhoopstrukcije nespecifičnim stimulansima (nespecifična bronhoprovokacija) ili specifičnim alergenima (specifična bronhoprovokacija). Radi se o testu kojime se mjeri bronhalna hiperreakivnost.
Nespecifična bronhoprovokacija najčešće se izvodi kod bolesnika sa sumnjom na bronhalnu astmu, čiji je nalaz spirometrije uredan. Kod tih bolesnika pokušava se inhalacijskom primjenom metakolina ili histamina izazvati bronhospazam. Test se sastoji od izvođenja spirometrije prije i nakon bronhoprovokacije, a pozitivnim se smatra kada dođe do pada vrijednosti FEV1 za više od 20 % u odnosu na početnu vrijednost (najčešće se primjenjuje metakolin u rastućim dozama do maksimalne doze od 16 mg/mL). Pozitivan bronhoprovokacijski test podržava dijagnozu bronhalne astme.
Specifična bronhoprovokacija označava izazivanje bronhospazma specifičnim alergenima (grinje kućne prašine, pelud, lijekovi). Zbog jednostavnosti drugih metoda, ova se metoda rijetko provodi, najčešće pri dijagnostici profesionalne astme. Negativan nalaz ovoga testa za bolesnika znači da može nastaviti izlaganje određenome alergenu, a pozitivan nalaz da ga mora izbjegavati. Kontraindikacija za izvođenje ovoga testa spirometrijski je dokazana opstrukcija s FEV1 < 65 – 70 % očekivanih vrijednosti.
Kontraindikacije. Apsolutne kontraindikacije za provođenje ovih testova su teška opstrukcija (FEV1 < 50 %), akutni infarkt miokarda ili cerebrovaskularni incident u posljednjih mjesec dana, aneurizme aorte ili cerebralnih arterija te neregulirana arterijska hipertenzija. Relativne kontraindikacije su umjerena opstrukcija (FEV1 60 – 50 %), infekcije dišnih puteva u posljednjih mjesec dana, terapija inhibitorima kolinesteraze, trudnoća i dojenje.
MJERENJE VRŠNOGA EKSPIRACIJSKOG PROTOKA (PEF)
Mjerenje vršnoga ekspiracijskog protoka (PEF) korisno je u brzoj evaluaciji respiratorne funkcije kod bolesnika s opstruktivnim smetanja disanja u kućnim uvjetima ili uvjetima hitne medicine, zbog jednostavnosti izvođenja i niske cijene.
PEF predstavlja najveći postignuti protok tijekom forsiranoga ekspirija nakon maksimalnoga inspirija. Uređaj koji mjeri PEF malen je i jednostavan za rukovanje te se preporuča njegova primjena i samim bolesnicima u kućnim uvjetima. U standardnoj primjeni bilježi se najviša postignuta vrijednosti PEF-a dobivena trima uzastopnim mjerenjima. Glavno ograničenje u interpretaciji nalaza PEF-a trud je bolesnika te se kod izvođenja postupka bolesnik mora pridržavati uputa (maksimalni udah, forsirani, snažni i brzi izdah).
Dnevna varijabilnost PEF-a može imati značaj u postavljanju dijagnoze bronhalne astme: dijagnostički značaj ima večernji PEF koji je za 10 % viši od jutarnjega (ili 20 % ako je bolesnik na bronhodilatatorima). U izračunavanju dnevne varijabilnosti PEF-a primjenjuje se amplituda (razlika između najviše i najniže vrijednosti) izražena kao postotak srednje dnevne vrijednosti.
Osim toga, PEF se koristi kao parametar praćenja odgovora na terapiju, a može se koristiti i pri procjeni reverzibilnosti bronhoopstrukcije (kriterij za reverzibilnost povećanje je PEF-a za 20 % ili 60 L/min nakon primjene bronhodilatatora).
TJELESNA PLETIZMOGRAFIJA
Tjelesna pletizmografija funkcionalna je pretraga pluća kojom se vrše mjerenja statičkih plućnih volumena i otpora u dišnim putevima. Ta metoda omogućava najobjektivnije mjerenje plućne hiperinflacije, kao i otpora dišnih puteva. Njome se mjere sljedeći parametri: FRC – funkcionalni rezidualni kapacitet, TLC – totalni plućni kapacitet, RV – rezidualni volumen te otpor u dišnim putevima (Raw).
Pretraga se obavlja uz pomoć pneumotahografa spojenoga s računalom u posebnoj, hermetički zatvorenoj kabini u kojoj bolesnik diše. Metoda se temelji na Boyle-Mariottovom zakonu prema kojemu je umnožak volumena i tlaka plina konstantan pri konstantnoj temperaturi. Rezultati se dobivaju matematičkim (računalnim) izračunom iz postojećih, mjerenih varijabli.
Glavna karakteristika opstruktivnih smetnji disanja povišeni su plućni volumeni kao rezultat hiperinflacije te povećan otpor u dišnim putevima, dok je kod restriktivnih smetnji disanja plućni volumen smanjen .
DIFUZIJSKI KAPACITET PLUĆA (DLCO)
Mjerenje difuzijskoga kapaciteta pluća služi za ocjenu difuzije plinova preko respiracijske membrane i daje uvid u njezino funkcionalno stanje. Poremećaji difuzijskoga kapaciteta pluća primarno ukazuju na bolesti koje pogađaju alveokapilarnu membranu, no na njegove vrijednosti utječu i druge bolesti i stanja (anemija, pušenje).
U kliničkoj praksi najčešće se ispituje difuzijski kapacitet za ugljikov monoksid i to metodom jednoga udaha (engl. single breath, SB DLCO). Mjerenje se vrši uz pomoć aparata koji ima sposobnost detekcije ugljičnoga monoksida. Bolesnik mora najprije maksimalno izdahnuti, potom maksimalno udahnuti mješavinu plinova koja sadrži ugljikov monoksid i inertni plin helij, zadržati dah deset sekundi, a potom maksimalno izdahnuti. Difuzijski kapacitet izračunava se iz poznate koncentracije ugljičnoga monoksida u smjesi zraka koja se udiše te koncentracije u smjesi zraka koja se izdiše, a za odgovarajuću interpretaciju mora se prilagoditi alveolarnom volumenu (koji se računa iz razrijeđenoga helija) te bolesnikovom hematokritu. DLCO se izražava u ml/min/mmHg te kao postotak od očekivane vrijednosti.
Ako je funkcija alveokapliarne membrane očuvana, dolazi do difuzije ugljičnoga monoksida te u izdahnutom zraku koncentracije moraju biti niske.
Smanjen DLCO nalazimo pri različitim bolestima: bolestima koje pogađaju ili smanjuju alveokapilarnu membranu (emfizem pluća, plućna fibroza, resekcija pluća, upalne bolesti intersticija), bolestima koje pogađaju plućnu vaskularnu mrežu (plućna hipertenzija, plućna embolija, vaskulitisi) te bolesti koje utječu na vezanje plinova na eritrocite (anemija, pušenje).
Povećan DLCO nalazimo pri različitim stanjima u kojima se CO pojačano veže za hemoglobin: srčano popuštanje (plućna kongestija i angažiranje dodatne plućne mikrocirkulacije), policitemija (eritrocitoza), intraalveolarna hemoragija (vezanje CO za eritrocite u alveolarnom prostoru) te kod astmatičara (nepoznat je mehanizam, vjerojatno uslijed aktivacije dodatne mikrovaskulature).
MJERENJE UPALE – FeNO TEST
Mjerenje upalne aktivnosti u dišnim putevima ima visok dijagnostički značaj, osobito u dijagnostici astme, s obzirom na to da je kronična upala dišnih puteva glavno patofiziološko zbivanje u astmi. Mjerenje koncentracije dušičnoga oksida u izdahnutome zraku (engl. fraction of exaled nitric oxide measurements, FeNO) najčešće je korištena metoda za procjenu upalne aktivnosti dišnih puteva. S obzirom na to da se pri upali stvara dušični oksid, njegove povećane koncentracije u izdahnutome zraku ukazuju na prisutnost upale i njezin intenzitet. Normalne vrijednosti FeNO testa niže su od 25 ppb, srednje povišene vrijednosti su 25 - 50 ppb, a visoke vrijednosti iznad 50 ppb.
PLINSKE ANALIZE ARTERIJSKE KRVI
Određivanje parcijalnih tlakova kisika i ugljičnoga dioksida u arterijskoj krvi (PaO2, PaCO2), saturacije hemoglobina kisikom (SpO2) te acidobaznoga statusa arterijske krvi (pH, bikarbonati, manjak baza) ima ključnu ulogu za procjenu respiracijske funkcije. Glavni pokazatelji respiratorne insuficijencije su hipoksemija i/ili hiperkapnija.
Poremećaji PaO2. Hipoksemija nastaje kao rezultat poremećene difuzije plinova preko respiracijske membrane i javlja se uslijed bolesti koje zahvaćaju respiracijsku membranu (edem pluća, pneumonija, plućna hemoragija, fibroza i dr.). Hiperoksija je stanje koje se može susresti prilikom hiperventilacije ili jatrogeno tijekom provođenja oksigenoterapije.
Poremećaji PaCO2. Hipokapnija se javlja kod ubrzane eliminacije ugljičnoga dioksida iz pluća, što se javlja u sklopu hiperventilacije. Nasuprot tome, hiperkapnija se razvija uslijed hipoventilacije i smanjenoga protoka zraka kroz dišne puteve (opstruktivne bolesti pluća, slabost respiracijskih mišića i sl.).
Poremećaji pH. S obzirom na to da pluća i proces disanja imaju važnu ulogu u održavanju pH krvi, smanjena ventilacija rezultirat će smanjenom eliminacijom ugljičnoga dioksida koji se nakuplja u krvi te s vodom stvara ugljikovodičnu kiselinu koja može disocirati i davati vodikove ione što rezultira smanjenjem pH, a to onda nazivamo respiracijskom acidozom. Pri kroničnim plućnim bolestima bubreg pokušava to kompenzirati pojačanim stvaranjem i reapsorpcijom bikarbonata (koncentracija bikarbonata raste za oko 1 mmol/l za svaki porast CO2 od 10 mmHg ili 1,3 kPa). Suprotno tome, tijekom hiperventilacije dolazi do pojačane eliminacije ugljičnoga dioksida i posljedične hipokapnije što vodi prema sniženju koncentracije vodikovih iona i respiracijskoj alkalozi. Navedene reakcije i uloga pluća u regulaciji pH prikazani su formulom:
H+ + HCO3- ↔ H2CO3 ↔ CO2 + H2O
Pri interpretaciji nalaza ABS-a bolesnika s kroničnom plućnom bolesti uvijek se potrebno voditi kliničkim stanjem bolesnika. Ponekad i vrlo teški poremećaji, u smislu teške hipoksemije (PaO2 ispod 7) i hiperkapnije (PaCO2 oko 10), mogu biti dobro klinički podnošljivi i bolesnici neće imati veće smetnje. Tome u prilog govori i povišena vrijednost bikarbonata kao odgovor koji sprečava razvoj acidoze.
PULSNA OKSIMETRIJA
Pulsna oksimetrija predstavlja neinvazivnu metodu praćenja saturacije hemoglobina kisikom u krvi te ima praktičnu primjenu u kliničkoj praksi. Radi se o spektrofotometrijskoj metodi koja omogućava mjerenje saturacije hemoglobina iz krvi na periferiji (prsti, uška). Rezultat počiva na apsorpciji svjetlosti emitirane iz dioda ugrađenih u oksimetar koji se postavlja na distalnu falangu prsta ili ušku. Normalnom vrijednošću smatra se saturacija hemoglobina kisikom iznad 90 %.
Glavno ograničenje pulsne oksimetrije proizlazi iz činjenice da se tom metodom ne mogu razlikovati karboksihemoglobin i methemoglobin od oksihemoglobina, na što treba misliti u nekim kliničkim situacijama (npr. pri trovanju ugljičnim monoksidom pulsna oksimetrija može pokazivati vrijednost saturacije od 100 %). Također, na vrijednost utječu i stanje periferne cirkulacije i krvnoga tlaka, anemija te druga ograničenja (npr. lak za nokte, pigmentirana koža).
TESTOVI OPTEREĆNJA
Šestominutni test slobodnoga hoda određuje udaljenost koju bolesnik može prijeći normalnim hodom tijekom šest minuta. Tim se testom ispituje, između ostaloga, funkcionalni kapacitet i stanje plućnoga sustava jer osobe s težim bolestima pluća zbog ograničene respiratorne funkcije imaju slabiju toleranciju napora zbog brze pojave dispneje. Osim stanja plućnoga sustava, na rezultat utječu i stanja drugih organskih sustava (npr. kardiovaskularni, mišićno-koštani i sl.).
Spiroergometrija je metoda kojom se nastoji procijeniti respiratornu funkciju pri fizičkom opterećenju (vožnja sobnoga bicikla ili hodanje po pokretnoj traci). Koristi se u dijagnostici tako da se organizam izlaže opterećenju koje može izazvati poremećaje koji se ne mogu otkriti u fazi mirovanja ili se koristi za procjenu podnošenja opterećenja.
KONGENITALNE BRONHOPULMONALNE ANOMALIJE
Kongenitalne anomalije pluća i bronha predstavljaju strukturni i/ili funkcionalni poremećaj koji nastaje kao posljedica poremećaja intrauterinoga razvoja, a prisutan je od samoga rođenja. Većina kongenitalnih anomalija pluća klinički se očituju i dijagnosticiraju već pri rođenju ili ranoj životnoj dobi, a samo manji dio ostaje neprepoznat do odrasle dobi. Kongenitalne anomalije pluća nastaju djelovanjem različitih etioloških čimbenika u vrijeme organogeneze (virusi, lijekovi, toksini, zračenje i dr.), a sam uzrok često ostane neotkriven.
Najčešće kongenitalne bronhopulonalne anomalije su: nedostatna razvijenost pluća (ageneza, aplazija i hipoplazija pluća), bronhogene ciste, kongenitalna cistična adenomatozna malformacija, bronhopulmonalna sekvestracija, kongenitalni lobarni emfizem, Scimitar sindrom te vaskularne anomalije (arterio-venska fistula).
NEDOSTATNA RAZVIJENOST PLUĆA
Definicija. Ovisno o stupnju nerazvijenosti pluća, razlikujemo tri anomalije: ageneza, aplazija i hipoplazija. Ageneza pluća označava razvoju anomaliju koju karakterizira potpuni izostanak bronha, plućnoga parenhima i krvnih žila pluća. Aplazija pluća označava razvojnu anomaliju pri kojoj postoji rudimentarni glavni bronh, ali plućni parenhim te krvne žile nisu razvijene. Hipoplazija je najblaži oblik nedostatne razvijenosti pluća u kojemu postoje sve tri komponente (bronhalno stablo, parenhim pluća, krvne žile), ali su sve nedostatno razvijene uz brojne cistične promjene.
Etiopatogeneza. Poremećaj razvoja pluća posljedica je djelovanja teratogenoga čimbenika za vrijeme embriogeneze (ageneza pluća) ili organogeneze (aplazija i hipoplazija). Jedan od najčešćih uzroka je smanjenje intratorakalnoga prostora što onemogućava normalan razvoj pluća (npr. kongenitalna dijafragmalna hernija, oligohidramion i sl.). Te su anomalije obično udružene i s anomalijama drugih organa i organskih sustava. Prema opsegu, anomalije mogu biti bilateralne, unilateralne i lobarne. Bilateralne anomalije su nespojive sa životom (bilateralna ageneza ili hipoplazija) ili se očituju vrlo brzo po rođenju (bilateralna hipoplazija). Unilateralne anomalije su najčešće, one zahvaćaju jedno plućno krilo, dok je drugo normalne strukture, no vrlo brzo razvija kompenzatornu hipertrofiju te hiperinflaciju. Lobarne anomalije ograničene su na samo jedan režanj pluća te obično ostaju neprepoznate do odrasle dobi, s obzirom na to da ne uzrokuju veći funkcionalni poremećaj. Najčešće je zahvaćen lijevi gornji režanj.
Klinička slika. Kliničke manifestacije ponajprije ovise o opsegu plućne nerazvijenosti. Što je viši stupanj nerazvijenosti, to se bolest prije i prezentira te dijagnosticira (obično u pedijatrijskoj dobi). Niži stupanj plućne nerazvijenosti može imati asimptomatski tijek ili se može prezentirati u kasnijoj životnoj dobi opetovanim plućnim infekcijama ili simptomima smanjenje respiratorne funkcije (dispneja, cijanoza).
Dijagnoza. Klinička obrada započinje preglednom radiološkom snimkom pluća koja ovisno o stupnju nerazvijenosti pokazuje smanjenu prozračnost jednoga hemitoraksa s hiperinflacijom kontralateralno, podignutim ošitom te pomakom medijastinalnih struktura na stranu anomalije. Za konačnu dijagnozu potrebna je diferencijalna dijagnostička obrada koja uključuje CT ili MRI pluća i drugih intratorakalnih struktura s angiografijom te bronhoskopija. Testovima plućne funkcije ocjenjuje se utjecaj anomalije na normalnu funkciju pluća.
Liječenje je simptomatsko (prevencija i liječenje infekcija, vježbe disanja), a kirurška intervencija u obzir dolazi kod rekurentnih infekcija ili pojave drugih komplikacija (krvarenje, pneumotoraks).
BRONHOGENE CISTE
Definicija. Bronhogene ciste su kongenitalne cistične formacije različite lokalizacije, a nastaju kao posljedica poremećaja u razvoju traheobronhalnoga stabla. Stvarna učestalost ove anomalije je nepoznata s obzirom na to da veliki broj bronhogenih cista ostaje asimptomatski kroz cijeli životni vijek.
Etiopatogeneza. Bronhogene ciste nastaju odvajanjem (separacijom) razvojnoga pupoljka traheobronhalnoga stabla te njegovim zaostajanjem na različitim lokalizacijama gdje nastaju cistične formacije. Najčešća lokalizacija je medijastinum (paratrahealno, parahilarno, parakarinalno), ali se mogu pojaviti i intrapulmonalno (najčešće u donjim režnjevima) te u donjem vratnom dijelu. Bronhogene ciste imaju vlastitu stijenku koja je iznutra prekrivena cilindričnim ili kubičnim epitelom te sadrži druge elemente bronhalne stijenke (glatki mišići, hrskavice, mukozne žlijezde). Ciste su obično solitarne (rjeđe multiple), unilokularne te primarno ne komuniciraju s traheobronhalnim stablom (osim intrapulmonalno smještenih cista koje mogu imati i primarnu komunikaciju). Komunikacija između bronhogene ciste i traheobronhalnoga stabala može nastati kasnije, sekundarno kao posljedica infekcije (postinfektivna fistulacija). Unutrašnjost ciste ispunjena je mukoznim sterilnim materijalom, a u slučaju komunikacije s traheobronhalnim stablom nastaje djelomično dreniranje, pojava aerolikvidnoga nivoa, a moguća je i bakterijska invazija s posljedičnom infekcijom.
Klinička slika. Kliničke manifestacije ponajprije ovise o lokalizaciji i veličini bronhogene ciste. Manje ciste koje ne komuniciraju s traheobronhalnim stablom uglavnom ostaju asimptomatske kroz cijeli životni vijek, ne utječu na plućnu funkciju i mogu se usputno otkriti tijekom radiološke obrade pluća zbog neke druge indikacije. Simptomi koji se javljaju najčešće su posljedica kompresije traheobronhalnoga stabla (stridor, piskanje, kašalj, dispneja) te posljedično tome rekurentnih infekcija.
Dijagnoza. Klinička obrada započinje klasičnim radiološkim snimanjem pluća (cistična formacija, tankih i pravilnih rubova, ispunjena tekućinom ili zrakom ili je prisutan aerolikvidni nivo), a potvrđuje distinktivnijom pretragom kao što je CT prsnoga koša kojim se može jasnije prikazati cističnu strukturu, njezinu lokalizaciju, odnos prema drugim strukturama, kao i narav njezinoga sadržaja.
Liječenje uglavnom nije potrebno ili je simptomatsko. Velike ciste koje ugrožavaju respiracijsku funkciju ili one koje dovode do rekurentnih infekcija mogu se kirurški odstraniti.
KONGENITALNA CISTIČNA ADENOMATOZNA MALFORMACIJA
Definicija. Kongenitalna cistična adenomatozna malformacija pluća predstavlja multicističnu masu unutar plućnoga parenhima koja nastaje abnormalnom proliferacijom bronhijalnih struktura. U osnovi nalazimo prekomjeran rast i razvoj terminalnih bronhiola koje gotovo u potpunosti suprimiraju razvoj alveola. Ova anomalija čini 25 % svih kongenitalnih plućnih anomalija.
Klasifikacija. Prema patomorfološkom izgledu, kongenitalne cistične adenomatozne malformacije dijele se na tri tipa. Tip I predstavlja policističnu masu koja se sastoji od cista različitih veličina (2 - 10 cm) s jednom dominantnom cistom, a to je ujedno i najčešći tip (75 %). Tip II predstavlja policističnu masu koju čine male, uniformne ciste čiji je promjer manji od 2 cm i čini 10 – 15 % slučajeva. Tip III je najrjeđi oblik, a čini ga solidna masa koju sačinjavaju brojne bronhoalveolarne mikrociste.
Klinika. Kongenitalna cistična adenomatozna malformacija najčešće se dijagnosticira već u ranom djetinjstvu, najčešće unutar prve dvije godine života. Samo manji broj bolesnika ostaje asimptomatski do odrasle dobi. Najčešća klinička manifestacija uključuje rekurentne plućne infekcije. Dijagnostički postupak obuhvaća klasični radiogram pluća, CT dijagnostiku te bronhoskopiju. Liječenje je simptomatsko, a u slučaju opetovanih infekcija može se pribjeći i kirurškom liječenju.
KONGENITALNI LOBARNI EMFIZEM
Definicija. Kongenitalni lobarni emfizem predstavlja hiperinflaciju jednoga (ili više) plućnih režnjeva koji nastaju kao posljedica poremećaja u razvoju stijenke bronha. Anomalija je češća kod muškoga spola u odnosu na ženski .
Etiopatogeneza. Hiperinflacija je posljedica poremećaja u razvoju stijenke bronha pri čemu nalazimo promjene u smislu bronhomalacije ili stenoze što dovodi do pojave fenomena jednosmjernoga ventila pri čemu zrak normalno prolazi kroz bronh u inspiriju u plućni režanj, no pri ekspiriju nailazi na otpor što dovodi do zadržavanja zraka i hperinflacije. Alveolarna stijenka ostaje intaktna i nije destruirana. Najčešće su zahvaćeni lijevi gornji režanj i srednji desni režanj.
Klinika. Prema kliničkom tijeku razlikuju se tri tipa kongenitalnoga lobarnog emfizema: tip I (simptomi se razvijaju rano u djetinjstvu), tip II (simptomi se razvijaju kasno u djetinjstvu) i tip III (asimptomatski bolesnici kod kojih se anomalija usputno dijagnosticira). Kod odraslih su glavne kliničke manifestacije dispneja i opetovane infekcije. Dijagnoza se postavlja na osnovi radiološke dijagnostike (klasični rendgenogram, CT). Liječenje je simptomatsko, eventualno kod opetovanih infekcija u obzir dolazi kirurško liječenje.
BRONHOPULMONALNA SEKVESTRACIJA
Definicija. Bronhopulmonalni sekvestar predstavlja kongenitalnu malformaciju u kojoj postoji razvijeno aberantno plućno tkivo koje nije povezano s traheobronhalnim stablom i plućnim funkcionalnim krvotokom. Prema lokalizaciji razlikujemo intralobarni i ekstralobarni plućni sekvestar. Sekvestar se sastoji od cistično promijenjenoga plućnog tkiva s nepotpuno razvijenim alveolarnim i bronhalnim elementima. Moguće su mikroskopske komunikacije s okolnim tkivom, osobito kod intralobarnoga sekvestra što omogućava ulazak zraka i bakterijsku invaziju pa su moguće rekurentne infekcije.
Intralobarni plućni sekvestar češće se susreće, a podrazumijeva postajanje aberantnoga plućnog tkiva unutar plućnoga parenhima. Najčešća lokalizacija je posterobazalni segment donjega režnja s podjednakom pojavnošću i u lijevom i u desnom plućnom krilu. Arterijska opskrba vrši se aberantnom arterijom iz aorte, a venska drenaža osigurava se preko pulmonalnih vena. Anomalija se gotovo uvijek javlja izolirano, bez drugih malformacija.
Ekstralobarni sekvestar nalazi se izvan normalnoga plućnog parenhima koji je najčešće smješten u donjem stražnjem dijelu prsne šupljine ili u gornjem dijelu abdomena. Arterijska opskrba vrši se aberantnom arterijom iz aorte ili plućne arterije, a venska drenaža putem vene azigis ili hemiazigos. U 90 % slučajeva sekvestar se nalazi s lijeve strane i češće se javlja kod muškaraca nego kod žena. Često su prisutne i druge anomalije, kao što su dijafragmalna hernija, kongenitalne srčane mane ili kongenitalna cistična adenomatozna malformacija.
Klinika. Bolest može kroz duži period ostati asimptomatska. Osnovni simptomi su kašalj, dispneja te hemoptize koje ponekad mogu biti masivne. Rekurentne infekcije pluća istoga sijela također su česta pojava. Također, unutar sekvestra veća je učestalost pojave malignoga procesa. Dijagnostički postupak obuhvaća klasični radiogram pluća (homogena sjena neoštrih rubova sa znacima cističnih promjena), CT prsnoga koša s CT angiografijom, bronhografiju te bronhoskopiju. U svim slučajevima bronhopulmonalne sekvestracije preporuča se kirurško liječenje.
SCIMITAR SINDROM
Definicija. Scimitar sindrom predstavlja rijetku kombiniranu anomaliju koja se sastoji od hipoplazije desnoga plućnog krila s karakterističnim abnormalnostima arterijske opskrbe i venske drenaže (hipoplazija desne plućne arterije, drenaža desne plućne vene u donju šuplju venu, arterijska opskrba hipoplastičnoga plućnoga krila putem direktnih ogranaka iz aorte), a često je prisutna i dekstropozicija srca. Naziv anomalije potječe od karakterističnoga radiološkog nalaza anomalne drenaže hipoplastičnoga plućnoga krila u donju šuplju venu koja izgleda poput zavijene sablje (scimitar).
Patogeneza. S obzirom na to da se radi o lijevo-desnom spoju (krv iz aorte preko aberantne arterije dovodi krv u hipoplastično plućno krilo, a zatim se venska krv drenira u donju šuplju venu), sindrom može duže vrijeme ostati asimptomatski i ne praviti značajnije tegobe. Također, lijevo plućno krilo razvija kompenzatornu hipertrofiju i hiperinflaciju.
Klinika. Simptomi poput brzoga umaranja, dispneje, kašlja i učestalih respiratornih infekcija javljaju se najčešće u drugom i trećem desteljeću života. Dijagnoza se temelji na klasičnoj radiološkoj snimci pluća koja se nadopunjuje diferentnijim pretragama kao što CT ili MR s angiografskim prikazom krvnih žila. Kirurška korekcija indicirana je kod simptomatskih bolesnika.
ARTERIOVENSKA FISTULA PLUĆA
Arteriovenska fistula pluća predstavlja razvojnu anomaliju krvožilnoga sustava pluća pri čemu nalazimo patološki spoj između plućne arterije i vene što stvara funkcionalni desno-lijevi spoj s posljedično smanjenom saturacijom kisika arterijske krvi sistemskoga krvotoka. Može se naći jedan ili više spojeva o čemu i ovisi stupanj oksigenacije arterijske krvi i kliničke manifestacije. Dijagnoza se postavlja plućnom angiografijom. Kirurško liječenje indicirano je kod klinički manifestnih bolesnika. Bolest se obično prezentira i liječi u pedijatrijskoj dobi.
Definicija. Astma predstavlja heterogenu bolest koju obilježavaju kronična upala i preosjetljivost dišnih puteva koja dovodi do reverzibilnoga ograničenja protoka zraka (bronhoopstrukcija), koji varira u svom intenzitetu i vremenu pojavnosti.
Epidemiologija. Astma je jedna od najčešćih kroničnih bolesti u općoj populaciji s većom učestalošću u djetinjstvu i mlađoj životnoj dobi nego u zreloj i starijoj životnoj dobi. Incidencija astme varira u različitim zemljama svijeta između 1 i 18 %, a u Hrvatskoj iznosi oko 3 %. Procjenjuje se da u svijetu ima oko 300 milijuna oboljelih od astme svih dobnih skupina te da prevalencija raste u zemljama u razvoju. Kod više od polovine bolesnika astma se javlja prije 10. godine života. Do puberteta se bolest češće javlja kod osoba muškoga spola, dok nakon puberteta bolest postaje učestalija kod ženskoga spola.
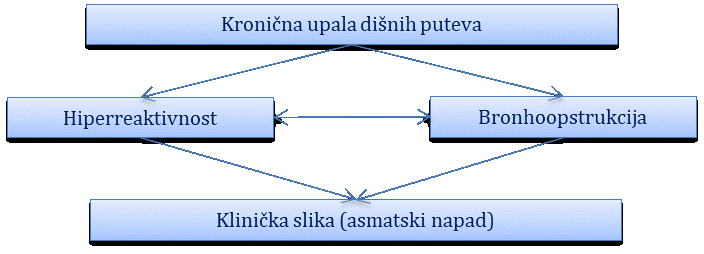
Etiologija. Astma je, etiološki gledano, heterogena bolest na čiju pojavnost utječe velik broj čimbenika koji se međusobno isprepliću (Slika 2.1.). Glavno etiopatološko obilježje astme kronična je upala dišnih puteva koja dovodi do njihove hiperreaktivnosti (preosjetljivosti) što se očituje kroz povremene i reverzibilne bronhoopstrukcije i dovodi do karakterističnoga kliničkog očitovanja – astmatskoga napada. Ulogu u tim mehanizmima imaju genetska predispozicija, okolišni čimbenici, kao i provocirajući čimbenici.
Slika 2.1. Shematski prikaz etiopatogeneze astme
Genetska predispozicija. Obiteljska pojavnost bronhalne astme, kao i velika učestalost bronhalne astme kod identičnih blizanaca govori u prilog genetskoj predispoziciji za nastanak bolesti. Točan „gen za astmu“ nije identificiran, već se radi o brojnim polimorfizmima različitih gena koji mogu pridonijeti razvoju bolesti. Bolest se najčešće povezuje s polimorfizmima gena na 5. kromosomu (5q31-33) gdje se nalaze geni koji kodiraju različite interleukine koji imaju ulogu u alergijskim reakcijama (IL-3, IL-4, IL-5, IL-9, IL-13). Polimorfizam tih gena povezan je s nastankom atopije uopće (sklonost alergijskim oboljenjima). Novija istraživanja povezuju s nastankom astme i polimorfizme drugih gena, kao što su ADAM-33 na 20. kromosomu čija je pojačana ekspresija udružena s povećanom hiperreaktivnošću dišnih puteva i tkivnom remodelacijom, SETDB2 i RCBTB1 na 2. kromosomu koji sudjeluju u sintezi IgE, i drugih (DPP-10, ORMDL-3).
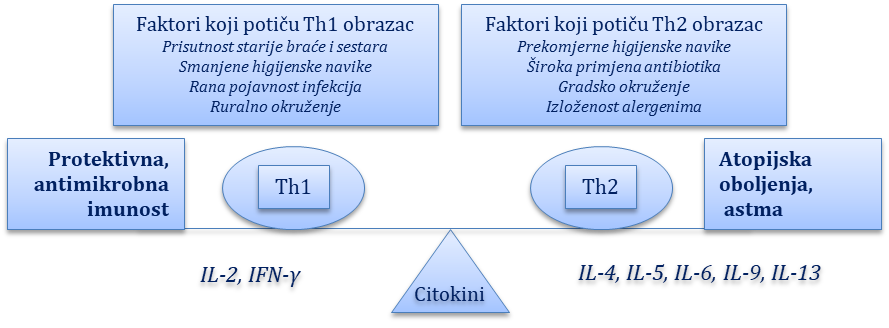
Okolišni čimbenici. Kao glavni okolišni čimbenici za razvoj astme navode se prekomjerno izlaganje alergenima, cigaretnom dimu i drugim onečišćivačima zraka u ranom djetinjstvu. Pod njihovim učinkom dolazi do aktivacije upalnih i strukturnih stanica koje podržavaju upalnu reakciju, tj. upalni odgovor. Time se i objašnjava češća pojavnost astme kod djece roditelja pušača, u gradskim sredinama (veća zagađenost zraka sumporovim dioksidom, česticama dizelskih goriva i ozonom), kao i pri snažnijoj izloženosti kućnoj prašini te dlakama kućnih ljubimaca uz slabu ventilaciju prostora. Također se kao bitan okolišni čimbenik za razvoj astme navodi i povoljan učinak respiratornih infekcija na njezinu pojavnost. Izlaganjem bakterijskim, virusnim i gljivičnim produktima u ranom djetinjstvu stimuliraju se TLR receptori (engl. toll-like receptors) eksprimirani na površini raznih imunih i epitelnih stanica, posljedično čemu se usmjerava imunološki odgovor s Th2 obrasca, koji je odgovoran za razvoj alergijskih reakcija, na Th1 obrazac, koji sudjeluje u obrani organizma od mikroba. Time se i objašnjava tzv. higijenska hipoteza, prema kojoj djeca koja se odgajaju u „sterilnim“ uvjetima i kod kojih se češće primjenjuju antibiotici imaju veću predispoziciju za nastanak atopijskih oboljenja, pa tako i astme, a sve zbog jačanja Th2 obrasca imunološkoga odgovora u nedostatku poticaja razvoja Th1 obrasca (Slika 2.2.). Pojavnost astme povezuje se i s prehrambenim navikama i pretilosti. Neke opservacijske studije pokazuju povezanost između povećane učestalosti astme i prehrane s niskim unosom antioksidanasa (vitamin C, vitamin A, magnezij, selenij) i/ili povećanim unosom omega-6-polizasićenih kiselina. Također, debljina se opisuje kao nezavisni čimbenik u nastanku astme, osobito kod žena, a tu se vezu pokušava objasniti učinkom proupalnih adipokina koje luči masno tkivo.
Slika 2.2. Shematski prikaz Th1 i Th2 odgovora
Patogeneza. Osnovni i središnji događaj u bronhalnoj astmi kronična je upala dišnih puteva. Ona nastaje interakcijom genetske predispozicije i okolišnih čimbenika, a zahvaća sluznicu dišnih puteva od traheje do terminalnih bronhiola. Dobro je poznato da je intenzitet upale povezan s traheobronhalnom hiperreaktivnosti što se očituje bronhospazmom i opstruktivnim smetnjama disanja. Kronična upala osim što je odgovorna za razvoj reverzibilnog bronhospazma dovodi i do procesa remodelacije dišnih puteva što u poodmakloj fazi bolesti može biti uzrokom razvoja ireverzibilne bronhoopstrukcije.
Kronična upala dišnih puteva. Glavnu ulogu u kroničnoj upali dišnih puteva imaju upalne stanice koje nakon što se aktiviraju luče tzv. medijatore upale koji dovode do različitih učinaka odgovornih za patološke i kliničke manifestacije. Najznačajnije su makrofagi i dendritičke stanice (antigen prezentirajuće stanice), limfociti, mastociti, eozinofili te neutrofili. Upalne stanice infiltriraju stijenku bronha, a u najvećoj koncentraciji nalaze se u samoj sluznici. Makrofagi i dendritičke stanice sudjeluju u preradi i prezentaciji antigena limfocitima kao i u lokalnom oštećenju tkiva. Th2 limfociti dominiraju u blagoj i umjerenoj astmi, dok u teškoj astmi dominiraju Th1 limfociti. Limfociti produciraju medijatore koji su zaslužni za migraciju drugih upalnih stanica kao što su mastociti (IL-3, IL-4, IL-9, IL-13), eozinofili (IL-3, IL-5, GM-CSF) i neutrofili (TNF-α). Oni su pak odgovorni za otpuštanje različitih medijatora kao što su histamin, triptaza, prostaglandini i leukotrijeni koji djeluju na razne efektorske stanice (epitelne stanice, glatkomišićne stanice, mukozne stanice, živčane stanice) što u konačnici i dovodi do bronhospazma, bronhalne hipersekecije, oštećenja endotelne barijere, poremećaja inervacije (pojačana aktivnost kolinergičkog sustava, smanjena aktivnost simpatičkog sustava) i sl. Posebnu ulogu imaju eozinofili čija povećana koncentracija u sputumu, perifernoj krvi i brisu nosa ima dijagnostičko značenje (tzv. eozinofilna astma) kao i u predviđanju terapijskog odgovora. Osim upalnih stanica, izvor medijatora upale mogu biti i aktivirane strukturne stanice dišnih puteva, osobito endotelne stanice.
Remodelacija dišnih puteva. Kroničnu astmu karakteriziraju strukturne promjene dišnih puteva koje nastaju kao posljedica kroničnog upalnog procesa. Promjene epitela uključuju gubitak cilijarnih stanica zbog čega on postaje vulnerabilniji i podložniji infekcijama i drugim iritansima. Aktivacija endotelnih stanica praćena je pojačanom ekspresijom inducibilne NO sintetaze zbog čega se bilježi pojačana produkcija dušičnog oksida (NO) što ima dijagnostički značaj u procjeni aktivnosti upale dišnih puteva u astmi. Karakteristična je i pojačana proizvodnja te nakupljanje kolegenskih vlakana i proteoglikana u području bazalne membrane zbog čega ona postaje zadebljana kao i hiperplazija glatko-mišićnih stanica dišnih puteva. Ove pojave uvjetuju trajni opstruktivni poremećaj protoku zraka te su odgovorne za pojavu ireverzibilnosti bronhoopstrukcije u ovih bolesnika. Živčani završeci postaju hipersenzitivni, osobito u odgovoru na stimulaciju bradikininom i neurokininom što rezultira pojačanom kolinergičkom aktivnosti (pojačano otpuštanje acetilkolina) koja je odgovorna za pojačanu kontrakciju glatko-mišićnog sloja.
Provocirajući čimbenici. Različiti endogeni ili egzogeni čimbenici mogu biti odgovorni za razvoj bronhoopstrukcije kod bolesnika s astmom. Taj mehanizam može biti alergološki posredovan tj. ovisan o IgE protutijelima (tzv. alergijska astma) ili neovisan o IgE protutijelima (tzv. nealergijska astma). Najčešće se radi o inhalacijskim alergenima, alergenima iz radne okoline (tzv. profesionalna astma), virusnim infekcijama, lijekovima te drugim nespecifičnim čimbenicima.
Inhalacijski alergeni najčešći su pokretači bronhospazma. Obično se radi o alergenima grinja kućne prašine (Dermatophagoides pteronissinus), peludu biljaka (trava, korov, stabla) te alergenima dlaka, perija i epitelnih otpadaka domaćih životinja i plijesni. Bronhospazam posljedica je reakcije preosjetljivosti tipa I (alergijsko-anafilaktički tip) i ovisan je o IgE protutijelima.
Alergeni iz radne okoline odgovorni su za oko 15 do 20% uzroka astme u odrasloj populaciji. Može se raditi o molekulama niske molekularne težine (izocijanati, anhidridi, teški metali) koji mogu dovesti do bronhospzama alergijskom reakcijom (kada se ponašaju kao hapteni) ili nealergijskim mehanizmom (izravna aktivacija upalnih i epitelnih stanica) te o molekulama velike molekulske težine (alergeni životinja i kukaca, lateks, lijekovi i sl.) koji dovode do bronhospazma isključivo alergijskom reakcijom. Ovi alergeni se susreću u radnom okruženju bolesniku i mogu biti odgovorni za nastanak cjelogodišnje astme te često zahtijevaju promjenu radnog okruženja ili radnog mjesta bolesnika.
Virusne infekcije gornjih dišnih puteva (rinovirusi, respiratorni sincicijski virusi, koronavirusi) mogu biti uzrokom bronhospazma, a stoga je i učestalost astmatskih napadaja češća u viroznih bolesnika. Bronhospazam nastaje uslijed djelovanja brojnih proupalnih citokina koji nastaju tijekom infekcije.
Lijekovi također mogu provocirati bronhospazam, a najčešće povezivani su beta blokatori (dolazi do prevlasti kolinergičke bronhokostriktivne aktivnosti), ACE inhibitori (inhibicija razgradnje kinina koji djeluju bronhokonstrikcijski) te acetilsalicilna kiselina (tzv. aspirinska astma, uslijed poremećaja prostagladina).
Tjelesna aktivnost čest je uzrok bronhospazma u djece, rjeđe u odraslih. Bronhospzama počinje neposredno nakon aktivnosti te prolazi spontano u roku od 30 minuta. Do bronhospazma dolazi zbog hiperventilacije koja može dovesti do mehaničke aktivacije prouplnih stanica. Sličnim mehanizmom do bronhospazma dovodi i udisanje hladnog zraka i hiperventilacija.
Patofiziologija. Glavno patofiziološko zbivanje u bronhalnoj astmi je brohospazam te razvoj opstruktivnih smetnji disanja. Bronhospazam je u prvom redu posljedica kontrakcije glatko-mišićnog sloja bronha, no otežanom protoku zraka pridonose kongestija i edem sluznice te bronhalna hipersekrecija. Inspirij je održan zbog aktivacije pomoćne dišne muskulture, dok je ekspirij pasivan te kao takav je otežan i produljen što vodi prema zadržavanju zraka u plućima i nastanka hiperinfalcije. Uslijed navedenih promjena dolazi i do smanjene ventilacije alveola što uz pojačani protok krvi koji je posljedica lokalnih upalnih zbivanja dovodi do neskalda između ventilacije i perfuzije (smanjena ventilacija, pojačana perfuzija) što uvjetuje nastanak arteriovenskog šanta. Početno, ove su promjene reverzibilnog karaktera, no s vremenom i trajanjem kronične upale i posljedične remodelacije dišnih puteva njihov stupanj reverzibilnosti opada te u najtežim obilicima nalazimo trajnu bronhoopstrukciju što nekada stvara otežanu diferencijaciju naspram kronične opstruktivne plućne bolesti.
Klinička slika. Klinički, astma je bolest promjenjive prirode s obzirom na njezinu pojavnost, učestalost i intenzitet simptoma. Bolest karakteriziraju faze remisije (vrijeme u kojemu bolesnici nemaju simptoma) te egzacerbacije (astmatski napadaj, astmatski status). U ovisnosti na težinu i pojavnost simtoma astmu dijelimo u dvije kategorije: povremena i trajna astma koja opet može biti blaga, umjerena i teška (kasnije opisano). Ovisno o etiologiji, astma može biti cjelogodišnja (alergeni grinja i pljesni), sezonska (alergeni peludi trava) ili kombinirana. Glavne kliničke manifestacije astme su astmatski napadaj i status astmatikus.
Astmatski napadaj je osnovna manifestacija bronhalne astme. On može biti različite težine, od blagog do teškog oblika. Astmatski napadaji se najčešće javljaju noću ili pred jutro, najčešće između 4 i 6 sati kada se i bilježi najveći mortalitet od astme. Vjeruje se da ovome pridonosi značajan pad kortizola tijekom noći te povišeni tonus parasimpatikusa koji pogoduje bronhokostrkciji. Napad počinje naglo, a manifestira se kašaljem, piskanjem, pritiskom u prsima i dispnejom. Nekada se prije napada javi jaki svrbež prednje strane vrata. Za vrijeme napada prisutna je tahipneja zbog koje je govor bolesnika otežan i isprekidan. Bolesnik sjedi sagnut prema naprijed i vide se znaci aktivacije pomoćne dišne muskulature (uvlačenje juguluma i interkostaelnih prostora). Perkusija prsnog koša otkriva hipersonoran zvuk, a auskultatorno se čuje produžen i otežan ekspirij s asinkronim polimorfnim visokofrekventnim piskovima koji su prisutni i u insipiriju i u ekspiriju. U teških astmatskih napada zbog sve užih dišnih puteva zvučni fenomeni mogu biti sve tiši (nekada je disanje u potpunosti nečujno, tzv. „silent lung“), a bolesnici postaju cijanotični, tahikardični i smeteni.
Astmatski status podrazumijeva oblik astmatskog napadaja kojeg karakterizira izostanak odgovora na inicijalnu bronhodilatacijsku terapiju, a koji vodi prema značajnoj hipoksemiji, retenciji ugljičnog dioksida te respiratornoj insuficijenciji koja zahtijeva bolničke mjere liječenja (obično u jedniciama intezivne skrbi).
Cough astma. U nekih bolesnika astma se manifestira samo suhim i nadražajnim kašljem, tzv. „cough astma“. U tom slučaju kašalj je diferencijalno dijagnostički potrebno razlučiti od kašlja koji je posljedica kroničnih bolesti gornjih dišnih puteva, gastoezofagealnog refluksa ili nuspojave lijekova (ACE inhibitori).
Procjena težine i kontrole astme. Težina astme procjenjuje se retrogradno prema intenzitetu liječenja potrebnog za postizanje kontrolu simptoma i prevenciju egzacerbacija astme stoga se ona može procjenjivati tek nakon započetog stupnjevitog liječenja (liječenje se provodi u 5 stupnjeva ili koraka koji odgovaraju stupnjevima težine bolesti – teži oblici bolesti zahtijevaju veći stupanj liječenja). Kontrola simptoma astme podrazumijeva izostanak dnevnih i noćnih simptoma, normalnu tjelesnu aktivnost i nepostojanje potrebe za simptomatskim lijekom u cilju otklanjanje simptoma. Ako se potpuna kontrola bolesti postigne u koraku liječenja 1 ili 2 radi se o blagoj astmi, u koraku 3 ili 4 o umjerenoj astmi, a u koraku 4 ili 5 o teškoj astmi. Kako je slobodna procjena „kontrole astme“ kako od strane bolesnika tako i od strane liječnika obično bolja nego što stvarno je, u svakodnevnoj kliničkoj praksi preporučuje se uporaba upitnika za procjenu kontrole astme. U Hrvatskoj se koristi ACT upitnik (Astma Control Test) kojim se kontrola simptoma boduje od 5 do 25 (što je zbroj veći kontrola simptoma je bolja). Tešku astmu potrebno je razlikovati od nekontrolirane astme čiji su simptomi posljedica neredovite ili nepravilne uporabe lijekova, izloženosti okidačima astme (provocirajući čimbenici) odnosno uslijed nekontroliranih čimbenika okoliša, pogrešne dijagnoze astme ili simptoma pridruženih bolesti. Težina astme ne predstavlja trajno stanje nego se ona može mijenjati tijekom mjeseci i godina.
Diferencijalna dijagnoza. Najčešće bolesti koje diferencijalno dijagnostički treba razlikovati od astme u ranijoj životnoj dobi su sindrom kašlja gornjih dišnih puteva, inhalirano strano tijelo, bronhiektazije, primarna cilijarna diskinezija, bronhopulmonalna displazija, kongenitalna bolest srca te cistična fibroza, dok su to u starijoj, odnosno odrasloj dobi, disfunkcija glasnica, disfunkcionalno disanje, hiperventilacija, KOPB, opstrukcija velikih dišnih puteva, kolaps dišnih puteva, bolesti plućnog parenhima, popuštanje lijevoga srca, plućna embolija (mikroembolizacije) te plućna hipertenzija. Astma kod sportaša često oponaša druga stanja čija je posljedica otežano disanje ili je udružena s njima (disfunkcionalno disanje, laringalni poremećaji, kardijalni poremećaji ili iscrpljenost), stoga mora biti dokazana bronhoprovokacijskim testovima. Astmu je kod pušača ponekad problem razlučiti od KOPB-a, a često se radi i o sindromu preklapanja. Astma je česta kod pretilih osoba, ali treba imati na umu da i sama debljina može imitirati simptome astme. U kliničkoj praksi kod 25 do 30 % bolesnika dijagnoza astme nije definitivno potvrđena jer bolesnici prije potvrde započnu uzimati protuupalnu terapiju.
Dijagnoza astme postavlja se na temelju anamneze, fizikalnoga pregleda, testova plućne funkcije (spirometrija s bronhodilatacijskim testom, bronhoprovokacijski testovi, dnevna varijabilnost vršnoga protoka), procjene aktivnosti upale dišnih puteva (FeNO test), alergijskoga testiranja te drugih pretraga s ciljem diferenciranja dijagnoze.
Anamneza i fizikalni pregled. Anamnestički podaci o početku pojave simptoma prije dvadesete godine života, varijabilnost tegoba, povezanost tegoba s ekspozicijom određenim alergenima (sezonska pojavnost), kao i pojavnost drugih atopijskih oboljenja upućuje na dijagnozu bronhalne astme. Prisutnost astme kod bližih srodnika također podupire dijagnozu astme. Prilikom fizikalnoga pregleda auskultacijski nalaz nad plućima često je uredan. Temeljni auskultacijski nalaz kod ovih su bolesnika bronhalni šumovi (engl. „wheezing“), a oni se migu čuti i uslijed drugih bolesti i stanja kao što su egzacerbacija KOPB-a, akutni bronhitis, traheomalacija i kolaps dišnih puteva, prisutnost stranoga tijela, plućna embolija te popuštanje lijevoga srca. Pri teškoj egzacerbaciji astme bronhalni šumovi mogu izostati zbog snažnoga bronhospazma i značajno smanjenoga protoka zraka kroz dišne puteve. U tom slučaju treba prepoznati druge kliničke znakove koji upućuju na poremećaj disanja i dispneju. Kliničkim se pregledom kod jednoga dijela bolesnika s astmom mogu otkriti i znaci rinitisa te nosne polipoze.
Spirometrija s bronhodilatacijskim testom zlatni je standard u postavljaju dijagnoze astme, a klasični nalaz upućuje na reverzibilne opstruktivne smetnje disanja: FEV1 < 80 % očekivanih vrijednosti, FVC < 80 % očekivanih vrijednosti te omjer FEV1/FVC (Tiffeneauov indeks) < 70 % (ili 0.7) očekivanih vrijednosti. Na reverzibilnost smetnji, koje čine glavnu razliku naspram KOPB-a, ukazuje pozitivan bronhodilatacijski test: porast spirometrijske vrijednosti FEV1 za 12 % (ili 200 ml) 20 minuta nakon inhalacijske primjene 400 mcg salbutamola ili 160 mg ipratropija. Krivulja protok-volumen također ima svoj specifičan izgled: inspiratorni dio krivulje ima oblik kao i kod normalnoga disanja samo što su protoci manji (pa je i manja površina ispod krivulje), dok ekspiratorni dio krivulje pokazuje konveksan pad krivulje idući do PEF prema FEF25, a protoci su također znatno sniženi. Uredan spirometrijski nalaz ne isključuje dijagnozu astme te je potrebno provesti ostalu dijagnostiku i na drugi način potvrditi hiperreaktivnost dišnih puteva.
Bronhoprovokacijski testovi koriste se u dijagnostici astme kod bolesnika kod kojih postoji osnovana sumnja na astmu, a inicijalnom spirometrijom nije otkriveno ograničenje protoka zraka kroz dišne puteve, kao ni bronhoreverzibilnost. Bronhoprovokacijski testovi mogu biti nespecifični i specifični, a izvode se u fazi remisije bolesti kod bolesnika s dobrom plućnom funkcijom. Od nespecifičnih se najčešće izvodi metakolinski test, a rjeđe drugi kao što su udisanje histamina, acetilkolina, manitola ili suhoga i hladnog zraka. Specifični testovi s pojedinim alergenima koriste se kako bi se otkrio pojedinačni alergen kao uzrok simptoma. Također, odgovarajući bronhoprovokacijski testovi koriste se u dijagnostici astme uzrokovane naporom, aspirinske astme i profesionalne astme. Negativan bronhoprovokacijski test isključuje astmu.
Mjerenje vršnoga ekspiracijskog protoka (PEF) korisna je metoda za praćenje respiratorne funkcije (praćenje bolesti, ocjena težine bolesti, praćenje terapijskoga odgovora) bolesnika u kućnim ili ambulantnim uvjetima, s obzirom na to da je jednostavna za izvođenje i ne zahtijeva posebnu opremu. Izračunava se iz dva dnevna mjerenja tijekom duljega vremenskog razdoblja (najmanje dva tjedna) kao dnevna amplituda od prosječne vrijednosti. Dnevna varijabilnost PEF-a ima značaj pri postavljanju dijagnoze bronhalne astme: dijagnostički značaj ima večernji PEF koji je za 10 % viši u odnosu na jutarnji (ili 20 % ako je bolesnik na bronhodilatatorima). Također, velika varijabilnost dnevnih vrijednosti PEF-a ukazuje na lošu kontrolu bolesti.
FeNO test je metoda koja omogućava mjerenje koncentracije dušičnoga oksida u izdahnutom zraku (engl. fraction of exaled nitric oxide measurements), a ima ulogu u određivanju aktivnosti upale (u uvjetima kronične upale pojačano se stvara dušični oksid što povećava njegovu prisutnost u izdahnutom zraku). Normalne vrijednosti FeNO testa niže su od 25 ppb, srednje povišene vrijednosti su 25 - 50 ppb, a visoke su vrijednosti iznad 50 ppb.
Alergijskim testiranjem potvrđuje se postojanje atopije na uobičajene inhalacijske alergene iz okoliša. Kod bolesnika koji imaju simptome astme dokaz atopije povećava vjerojatnost postojanja astme. Dokaz atopije ne znači nužno da alergen odmah uzrokuje i simptome astme te stoga tu povezanost treba potvrditi bronhoprovokacijskim testom. Atopija se dokazuje određivanjem ukupnoga i specifičnog IgE protutijela u serumu, određivanjem eozinofila u perifernoj krvi i dišnim putevima (iskašljaj, obrisak nosa) ili kožnim „prick“ testom. Oko polovica astmatičara ima fenotip alergijske ili eozinofilne astme (ili oba) te ih svrstavamo u skupinu „T2 high“ bolesnika kod kojih je i učinak liječenja kortikosteroidima značajno bolji. Bolesnici koji nemaju dokazanu atopiju ili eozinofile spadaju u skupinu „T2 low“ bolesnika (nekada tzv. nealergijska astma) te je kod njih odgovor na liječenje kortikosteroidima značajno lošiji.
Radiološka dijagnostika. Klasični rendgenogram pluća bolesnika s astmom uglavnom je uredan, osobito na početku bolesti. Kod bolesnika s težim astmatskim napadajem može se registrirati hiperinflacija, potisnut i zaravnjen ošit te segmentalne atelektaze uslijed bronhoopstrukcije sluznim čepom. Pneumotoraks i/ili pneumomedijastinum rijetke su komplikacije astmatskoga napadaja koje se mogu rendgenski detektirati.
Opća načela liječenja. Osnovni ciljevi liječenja astme su postizanje kontrole simptoma i sprečavanje loših ishoda bolesti kao što su smrtni ishod, životno ugrožavajući astmatski napad, egzacerbacija astme te trajno oštećenje plućne funkcije uz što niži intenzitet liječenja. Liječenje astme uključuje opće mjere, farmakoterapiju te druge, specifične nefarmakološke metode. Opće mjere uključuju izbjegavanje okolnosti i/ili alergena koji dovode do pojave napadaja (ako je poznat). Pacijenti trebaju izbjegavati i uzimanje preparata acetil-salicilata jer oni mogu uzrokovati napadaj. Prema potrebi je nužno provesti druge mjere kao što su promjena radne ili životne sredine i sl.
Farmakoterapija predstavlja temelj liječenja astme. Lijekovi za liječenje astme dijele se u dvije glavne kategorije: osnovni ili protuupalni lijekovi te simptomatski lijekovi. Osnovni ili protuupalni lijekovi (tzv. kontroleri) namijenjeni su za redovitu i svakodnevnu uporabu, a dovode do smanjenja upale te uspostavljaju dugoročnu kontrolu nad simptomima bolesti te smanjuju buduće rizike kao što su egzacerbacije i pogoršanje plućne funkcije. Simptomatski lijekovi (engl. „reliever“ ili „rescue“ medications) primjenjuju se s ciljem uklanjanja trenutačnih simptoma bolesti te dovode do trenutačnoga olakšanja, ali ne utječu na tijek i ishode bolesti. Najčešće skupine lijekova koje koristimo u liječenju astme su: bronhodilatatori (β2-agonisti, antikolinergici, teofilin), inhalacijski i sistemski koritikosteroidi, antileukotrijeni te kromoni. Biološki lijekovi koriste se pri strogim indikacijama kod bolesnika s teškom astmom.
β2-agonisti su skupina lijekova koji uzrokuju bronhodilataciju vezujući se za β2-adrenergičke receptore koji se u velikom broju nalaze u dišnim putevima. Njihova stimulacija dovodi do aktivacije adenil ciklaze i pojačane produkcije intracelularnoga cikličkog adenozin-monofosfata (cAMP) koji dovodi do relaksacije glatko-mišićnih stanica te tako posreduje bronhodilataciju. Osim toga, dokazano je da β2-agonisti imaju učinak i na mastocite smanjujući njihovo otpuštanje medijatora upale. U kliničkoj praksi razlikujemo β2-agoniste kratkoga i dugog djelovanja. S obzirom na to da se primjenjuju poglavito inhalacijski, imaju slabije izražene nuspojave, a najčešće su mišićni tremor, palpitacije i umjerena hipokalijemija (β2-agonisti potiču ulazak kalija u skeletne mišiće). Najčešći β2-agonisti prikazani su u Tablici 2.5.
β2-agonisti kratkoga djelovanja (SABA) posreduju brz i kratkotrajni učinak (3 - 6 sati). Oni se koriste za prekid astmatskog napadaja, a njihova česta upotreba sugerira na lošu kontrolu bolesti. Može se koristiti i u preventivne svrhe prije izlaganja potencijalnom pokretaču astmatskoga napadaja (najčešće prije fizičke aktivnosti). Kod nas je najčešći lijek iz ove skupine salbutamol, a inače se koriste i albuterol, levalbuterol, bitolterol i dr.
β2-agonisti dugoga djelovanja (LABA) posreduju sporiji, ali dugotrajniji učinak (12 - 24 sati) te se primjenjuju u jednoj ili dvije dnevne doze. Oni su indicirani kada se ne može postići kontrola simptoma kod bolesnika koji su na terapiji inhalacijskim kortikosteroidima i β2-agonistima kratkoga djelovanja. Primjena LABA bez inhalacijskih kortikosteroida se ne preporuča. Danas postoje brojne fiksne kombinacije LABA i inhalacijskih kortikosteroida što poboljšava terapijsku ustrajnost kod bolesnika. Najčešći lijekovi iz ove skupine su salmeterol i formoterol koji imaju 12-satni učinak i indakaterol koji ima 24-satni učinak.
|
Tablica 2.5. Najčešći β2-agonisti
|
|
Lijek
|
Oblik lijeka
|
Preporučena dnevna doza
|
Maksimalna dnevna doza
|
|
Salbutamol
|
MDI 100 mcg
|
1 - 2 udaha pp
|
8 udaha (800 mcg)
|
|
DPI 200 mcg
|
1 x 1 udah (200 mcg)
|
4 x 1 udah (800 mcg)
|
|
Nebulizacija 5mg/1ml
|
0,5 - 1 ml pp
|
4 ml (20 mg)
|
|
Salmeterol
|
MDI 25 mcg
|
2 x 2 udaha
|
2 x 4 udaha (200 mcg)
|
|
DPI 50 mcg
|
2 x 1 udah
|
2 x 2 udaha (200 mcg)
|
|
Formoterol
|
MDI 12 mcg
|
2 x 1 udah
|
2 x 2 udaha (48 mcg)
|
|
DPI 12 mcg
|
2 x 1 udah
|
2 x 2 udaha (48 mcg)
|
|
DPI 6 mcg
|
2 x 1 - 2 udaha
|
2 x 4 udaha (48 mcg)
|
|
Indakaterol
|
DPI 150 mcg
|
1 x 1 udah
|
1 x 2 udaha (300 mcg)
|
|
DPI 300 mcg
|
1 x 1 udah
|
1 x 1 udah (300 mcg)
|
Antikolinergici svoj učinak ostvaruju inhibicijom kolinergičkoga (parasimpatičkoga) živčanog učinka na dišne puteve tj. inhibiraju bronhokonstrikciju i smanjuju mukoznu sekreciju. Manje su učinkoviti od β2-agonista i koriste se kao dopunska terapija kada se ne postiže kontrola bolesti uz primjenu ICS i LABA. Najčešći lijekovi iz ove skupine su ipratropij-bromid (kratkodjelujući preparat) i tiotropij-bromid (dugodjelujući preparat, tzv. LAMA, od engl. long acting muscarinic antagonists). Nuspojave su rijetke, a uključuju suhoću usta, retenciju urina te pogoršanje glaukoma. Najčešći antikolinergici prikazani su u Tablici 2.6.
|
Tablica 2.6. Najčešći antikolinergici
|
|
Lijek
|
Oblik lijeka
|
Preporučena dnevna doza
|
Maksimalna dnevna doza
|
|
Ipratropij-bromid
|
MDI 20 mcg
|
4 x 1 - 2 udaha
|
4 x 3 udaha (240 mcg)
|
|
Nebulizacija 0,25 mg/1 ml
|
3 – 4 x 2 ml
|
3 – 4 x 2 ml (2 mg)
|
|
Tiotropij-bromid
|
MDI 2,5 mcg
|
1 x 2 udaha
|
1 x 2 udaha (5 mcg)
|
|
DPI 10 mcg
|
1 x 1 udah
|
1 x 1 udah (10 mcg)
|
|
DPI 18 mcg
|
1 x 1 udah
|
1 x 1 udah (18 mcg)
|
Teofilin je bronhodilatator koji svoj učinak ostvaruje inhibicijom enzima fosfodiesteraze u glatko-mišićnim stanicama dišnih puteva što rezultira porastom cikličkoga adenozin-monofosfata (cAMP) koji dovodi do bronhodilatacije. Dokazano je da teofilin u niskim dozama ima i protuupalni učinak. Teofilin dolazi u obliku sporo-otpuštajućih preparata za peroralnu uporabu (u kroničnoj terapiji) te u obliku aminofilina namijenjenoga za intravensku uporabu u akutnim situacijama. Nuspojave se javljaju pri višim koncentracijama lijeka u krvi (> 10 mg/L), a najčešće su mučnina, povraćanje i glavobolje, dok se rjeđe mogu naći i palpitacije, tahiaritmije i epileptički napadaji. S obzirom na to da se teofilin u jetri metabolizira putem enzima CYP450, uporaba drugih lijekova s učinkom na isti enzim može dovesti do poremećaja koncentracije teofilina u krvi. Povećani klirens teofilina nalazimo kod primjene lijekova i tvari koji induciraju CYP450 (rifamicin, fenobarbiton, etanol, nikotin), a smanjen klirens kod primjene lijekova koji inhibiraju enzim CYP 450 (cimetidin, eritromicin, ciprofloksacin, alopurinol, zafirlukast), ali i kod nekih bolesti i stanja (srčano popuštanje, jetrena lezija, pneumonija, starost). Moguće je i laboratorijsko određivanje koncentracije lijeka u plazmi.
Inhalacijski kortikosteroidi (ICS) su najučinkovitiji lijekovi u kontroli simptoma bolesnika s bronhalnom astmom. Učinak im se temelji na modifikaciji genske ekspresije u smislu inhibicije gena koji kodiraju produkciju proupalnih molekula (citokini, adhezijske molekule i sl.) te aktivacije protuupalnih gena kao što je protein koji aktivira mitogen i dr. Osim što dovode do brzoga poboljšanja kontrole simptoma, ICS-i poboljšavaju i plućnu funkciju na što upućuje poboljšanje nalaza spirometrije. ICS se primjenjuje dva puta dnevno, a u lakšim je slučajevima dovoljna i jedna dnevna doza. Predstavnici ove skupine su beklometazon, budezonid, flutikazon i ciklezonid. Glavne nuspojave su lokalnoga karaktera i uključuju gljivične infekcije usne šupljine te disfoniju. ICS-i imaju minimalan sistemski učinak, stoga ni ne izazivaju druge nuspojave. Najčešći inhalacijski kortikosteroidi dani su u Tablici 2.7.
|
Tablica 2.7. Najčešći inhalacijski kortikosteroidi
|
|
Lijek
|
Niske doze
|
Srednje doze
|
Visoke doze
|
|
Beklometazon HFA*
|
100 - 200 mcg
|
200 - 400 mcg
|
> 400 mcg
|
|
Budezonid DPI**
|
200 - 400 mcg
|
400 - 800 mcg
|
> 800 mcg
|
|
Ciklezonid HFA*
|
80 - 160 mcg
|
160 - 320 mcg
|
> 320 mcg
|
|
Flutikazon furoat DPI**
|
100 mcg
|
---
|
> 200 mcg
|
|
Flutikazon propionat DPI**
|
100 - 250 mcg
|
250 - 500 mcg
|
> 500 mcg
|
|
Flutikasone propionat HFA*
|
100 - 250 mcg
|
250 - 500 mcg
|
> 500 mcg
|
|
Mometazon furoat
|
110 - 220 mcg
|
220 - 440 mcg
|
> 440 mcg
|
|
Triamcinolon acetonid
|
400 - 1000 mcg
|
1000 - 2000 mcg
|
> 2000 mcg
|
* hidrofluoroalkanski potisni plin
** inhaler suhoga praha
S obzirom na to da se u liječenju astme obično koristi više od jedne skupine lijekova, i to najčešće u inhalacijskom obliku, danas postoje tvornički pripravljene fiksne kombinacije koje olakšavaju primjenu lijekova i poboljšavaju bolesnikovu ustrajnost i suradljivost. U Tablici 2.8. navedene su najčešće kombinacije inhalacijskih lijekova.
|
Tablica 2.8. Primjeri fiksnih kombinacija inhalacijskih lijekova u liječenju astme
|
|
Lijek
|
Oblik lijeka
|
Preporučena dnevna doza
|
Maksimalna dnevna doza
|
|
Salmeterol+ flutikazon
|
MDI 25/125 mcg
|
2 x 2 udaha
|
2 x 2 udaha
|
|
MDI 25/250 mcg
|
2 x 2 udaha
|
2 x 2 udaha
|
|
DPI 50/500 mcg
|
2 x 1 udah
|
2 x 1 udah
|
|
DPI 50/250 mcg
|
2 x 1 udah
|
2 x 1 udah
|
|
Budesonid+formoterol
|
MDI 160/4,5 mcg
|
2 x 2 udaha
|
2 x 2 udaha
|
|
DPI 160/4,5 mcg
|
2 x 1 - 2 udaha
|
2 x 4 udaha
|
|
DPI 320/9 mcg
|
2 x 1 udah
|
2 x 2 udaha
|
|
DPI 80/4,5 mcg
|
2 x 1 - 2 udaha
|
2 x 4 udaha
|
|
Formoterol+beklometazon
|
MDI 100/6 mcg
|
2 x 1 - 2 udaha
|
2 x 2 udaha
|
|
DPI 100/6 mcg
|
2 x 1 - 2 udaha
|
2 x 2 udaha
|
|
Ipratropij+salbutamol
|
Nebulizacija 0,5/2,5 mg
|
2 x 2,5 ml
|
4 x 2,5 ml
|
|
Indakaterol+glikopironij
|
DPI 85/43 mcg
|
1 x 1 udah
|
1 x 1 udah
|
Sistemski kortikosteroidi koriste se u liječenju egzacerbacije bronhalne astme. Mogu se primjenjivati intravenski (hidrokortizon, metilprednizolon) ili peroralno – oralni kortikosteroidi ili OCS (prednizon, prednizolon). Primjena se preporuča kroz pet do deset dana dok traju akutni simptomi, a samo manje od 1 % bolesnika zahtijevat će dužu primjenu. Sistemski učinci (nuspojave) uključuju debljanje, razvoj hiperglikemije i hipertenzije, veći rizik od razvoja osteoporoze, gastričnih ulceracija, proksimalne miopatije, depresije i katarakte. Triamkinolon je poseban depo preparat koji se daje intramuskularno i osigurava dugotrajniji učinak što je pogodno za nesuradljive bolesnike, ali primijećena je veća učestalost razvoja proksimalne miopatije te se danas njegova primjena izbjegava i ne preporuča.
Antileukotrijeni su lijekovi koji inhibiraju učinak leukotrijena, a to se može postići na dva načina: smanjivanjem stvaranja leukotrijena putem blokade enzima 5-lipooksigenaze (zileuton) ili blokadom leukotrijenskih receptora – LTRA (montelukast, zafirlukast). Ovi su lijekovi manje učinkoviti u odnosu na ICS, ali se dobar učinak postiže u kombinaciji s ICS-om kod bolesnika kod kojih se teže postiže kontrola bolesti uz sam ICS. Primjenjuju se jednom ili dva puta na dan i dobro se podnose. Primjena zileutona može biti povezana s prolaznim porastom aminotransferaza, a primjena montelukasta i zafirlukasta s pojavom eozinofilne granulomatoze s poliangiitisom (Churg-Straussov sindrom). Njihova je učinkovitost posebno zapažena kod bolesnika s aspirinskom astmom, astmom uzrokovanom naporom i kod bolesnika koji uz astmu imaju pridruženi alergijski rinitis.
Kromoni su lijekovi koji se koriste u kontroli astme, ali pokazuju značajno manju učinkovitost u odnosu na ICS ili antileukotrijene te se toga vrlo rijetko koriste. Svoj učinak ostvaruju poglavito inhibicijom aktivnosti mastocita. Predstavnici su kromolin i nedokromil. Imaju kratko djelovanje te se moraju uzimati četiri puta na dan. Obično se koriste u liječenju astme u djece.
Biološka terapija astme. Biološki lijekovi danas se koriste u liječenju teške alergijske i teške eozinofilne astme, i to kod bolesnika koji su imali četiri umjerene ili teške egzacerbacije koje su liječene kortikosteroidima ili su na dugotrajnom liječenju oralnim kortikosteroidima s ciljem održavanja kontrole bolesti. U teškoj alergijskoj astmi koristi se anti IgE liječenje monoklonskim protutijelom omalizumabom koje predstavlja DNA-rekombinantno humanizirano monoklonsko protutijelo koje se selektivno veže na IgE te sprečava njegovo vezanje na IgE receptore na površini bazofila i mastocita. U liječenju teške eozinofilne astme koriste se anti IL-5 lijekovi kao što su mepolizumab, reslizumab i benralizumab. Oni svoj učinak postižu vezanjem za IL-5 te ometanjem njegova vezanja za ciljne stanice.
GINA smjernice za liječenje astme. Trenutne važeće smjernice za liječenje bolesnika s astmom su GINA smjernice (engl. Global Initiative for Asthma) koje zagovaraju tzv. stupnjevito liječenje astme. Princip stupnjevitoga načina liječenja temelji se na smanjivanju ili povećavanju intenziteta liječenja ovisno o procjeni kontrole bolesti. Ako bolest nije dobro kontrolirana, pojačava se intenzitet liječenja, odnosno prelazi se na viši stupanj liječenja, tzv. „step up“. Ako je bolest potpuno kontrolirana tijekom više mjeseci, smanjuje se intenzitet liječenja, odnosno vraća se na niži stupanj liječenja, tzv. „step down“. Liječenje se provodi kroz pet stupnjeva ili koraka koji odgovaraju stupnjevima težine bolesti, a uključuju primjenu osnovnih i simptomatskih lijekova. Navedeno liječenje prikazano je u Tablici 2.9.
|
Tablica 2.9. Preporučeno stupnjevito liječenje astme temeljeno na GINA smjernicama iz 2019. godine
|
|
Korak u liječenju
|
Osnovni lijek (engl. controller)
|
Simptomatski lijek (engl. reliever)
|
|
Terapija izbora
|
Ostale opcije
|
Terapija izbora
|
Ostale opcije
|
|
Prvi korak
|
Niske doze ICS-formoterol po potrebi
|
Niske doze ICS zajedno kada se uzima i SABA
|
Niske doze ICS-formoterol po potrebi
|
SABA po potrebi
|
|
Drugi korak
|
Svakodnevno niske doze ICS ili niske doze ICS-formoterol po potrebi
|
LTRA ili niske doze ICS zajedno kada se uzima i SABA
|
Niske doze ICS-formoterol po potrebi
|
SABA po potrebi
|
|
Treći korak
|
Niske doze ICS-LABA
|
Srednje doze ICS ili niske doze ICS+LTRA
|
Niske doze ICS-formoterol po potrebi
|
SABA po potrebi
|
|
Četvrti korak
|
Srednje doze ICS-LABA
|
Visoke doze ICS uz LAMA ili LTRA
|
Niske doze ICS-formoterol po potrebi
|
SABA po potrebi
|
|
Peti korak
|
Visoke doze ICS-LABA; razmotriti dodavanje LAMA ili biološke terapije ovisno o fenotipu
|
Dodati niske doze OCS (misliti na nuspojave)
|
Niske doze ICS-formoterol po potrebi
|
SABA po potrebi
|
Drugi oblici liječenja astme. Imunoterapija je izbor liječenja za one bolesnike s astmom i alergijskim rinitisom kod kojih prominentnu ulogu ima alergija. Ona podrazumijeva provođenje hiposenzibilizacije primjenom specifičnih antigena. S obzirom na način injiciranja antigena, razlikujemo dva oblika imunoterapije: subkutana imunoterapija (SCIT) i sublingvalna imunoterapija (SLIT). Bronhalna termoplastika predstavlja mogućnost liječenja za bolesnike s teškom nealergijskom astmom (tzv. „T2 low“ bolesnici), kod kojih se ne postiže kontrola simptoma i egzacerbacija usprkos liječenju u petom koraku. Postupak se temelji na bronhoskopskoj proceduri pri kojoj se primjenjuje radiofrekvencijska energija koja smanjuje masu glatkih mišića te time smanjuje i samu bronhokonstrikciju. Postupak se provodi se u rijetkim specijaliziranim centrima u Europi i drugim dijelovima svijeta. Nekoliko studija pokazalo je da je niska razina serumskoga D vitamina povezana s oštećenom plućnom funkcijom, većom frekvencijom egzacerbacija astme, kao i sa smanjenim odgovorom na primjenu kortikosteroida što sugerira mogućnost primjene vitamina D u svrhu poboljšanja kontrole astme i sprečavanja egzacerbacija, iako za to ne postoje čvrsti dokazi. Druge nefarmakološke mjere liječenja podrazumijevaju prestanak pušenja, regulaciju tjelesne težine, tjelesnu aktivnost, vježbe disanja, kontrolu emocionalnoga stresa te izbjegavanje lijekova koji mogu pogoršati astmu (beta blokatori, nesteroidni antireaumatici). S obzirom na to da gripa može doprinijeti teškim egzacerbacijama astme, preporučuje se redovno cijepljenje protiv gripe bolesnika s umjerenom i teškom astmom (iako kod ovih bolesnika postoji rizik od pneumokokne infekcije nema konzistentnih preporuka oko cijepljenja protiv pneumokoka).
Edukacija bolesnika. Za postizanje očekivanoga uspjeha liječenja astme potreban je složen i sveobuhvatan pristup liječenju. Osobito je važno da bolesnici budu dobro educirani i steknu vještine potrebne za uspješno liječenje astme. Jedna od najvažnijih osobitosti liječenja astme inhalacijska je primjena lijekova. Bolesnici lijekove moraju uzimati redovito i pravilno jer je to najčešći razlog nepostizanja učinka liječenja što rezultira nekontroliranom bolesti. Bolesnici moraju svladati pravilnu tehniku inhaliranja lijeka koja se treba periodički provjeravati, osobito ako izostane očekivani učinak liječenja. Idealno je da se bolesnici s astmom educiraju u tzv. astma-školi te imaju pisani plan liječenja astme i steknu vještine samopomoći.
Astma u posebnim populacijama i stanjima. U nekim populacijama bolesnika ili pri nekim stanjima uobičajene mjere liječenja treba prilagoditi. Osobito osjetljiva populacija su adolescenti. Često ne prihvaćaju uzimanje lijekova, a skloni su rizičnim ponašanjima kao što je pušenje. U toj dobi astma se može povući, ali i pogoršati. Kod 20 % žena astma se može pogoršati pred menstruaciju. Obično imaju dismenoreju i premenstrualni sindom, viši indeks tjelesne mase te pogoršanje astme kod uzimanja aspirina. Kontrola astme u trudnoći često se mijenja. Kod otprilike jedne trećine žena astma se u trudnoći pogorša, kod jedne trećine poboljša, a kod jedne trećine ostane nepromijenjena. Egzacerbacije su najčešće u drugom tromjesečju trudnoće. Loša kontrola astme u trudnoći može biti posljedica hormonalnih promjena, prestanka ili smanjenja uzimanja lijekova za astmu i/ili virusnih infekcije kojima su trudnice sklone. Tijekom trudnoće dobra kontrola astme smanjuje rizik od neželjenih događaja ili komplikacija te se stoga smatra opravdanom uporaba inhalacijskih lijekova potrebnih za kontrolu simptoma i prevenciju egzacerbacija, kako osnovnih protuupalnih, tako i simptomatskih. Kod bolesnika s astmom čest je podražaj za bronhospazam i simptome astme i tjelesna aktivnost, a manifestira se najčešće po prestanku tjelesne aktivnosti. Astma izazvana naporom, obično bez drugih simptoma astme, česta je pojava kod vrhunskih sportaša. Astmu kod sportaša treba znati razlikovati od drugih, također čestih poremećaja disanja kod sportaša, kao što su disfunkcija glasnica, kronični kašalj ili disfunkcionalno disanje. Kod bolesnika senzibiliziranih na alergene radnoga okoliša kontinuirano izlaganje može rezultirati stalno prisutnim simptomima, egzacerbacijama i ireverzibilnim ograničenjem protoka zraka kroz dišne puteve. Aspirinska astma poseban je oblik obično teške kronične astme udružene s nosnom polipozom i kroničnim rinosinuitisom. Nakon uzimanja aspirina ili drugih lijekova iz skupine nesteroidnih antireumatika (NSAR) razvija se akutni napad astme nakon nekoliko minuta do 1 - 2 sata. Nekada su napadi iznimno teški, praćeni šokom, gubitkom svijesti i respiratornim arestom te zahtijevaju liječenje u jedinicama intenzivnoga liječenja i mehaničku ventilaciju. Aspirinska astma prisutna je kod 7 % ukupne populacije astmatičara i kod 15 % u skupini bolesnika s teškom astmom.
Akutna egzacerbacija ili akutna astma. Egzacerbacije astme epizode su pogoršanja simptoma i plućne funkcije u odnosu na uobičajeno stabilno stanje i zahtijevaju intervencije i promjenu u liječenju. U kliničkoj praksi nazivaju se akutna astma ili akutni napadi astme. Egzacerbacije astme najčešće nastaju zbog neodgovarajućega protuupalnoga liječenja, odnosno nekontrolirane bolesti, te izlaganja nekom vanjskom podražaju (alergenima, onečišćenju, virusnim infekcijama). Teške egzacerbacije mogu se dogoditi bolesnicima s blagom i umjerenom astmom, dok bolesnici s teškom astmom mogu biti stabilni. Rijetki bolesnici ne osjećaju pogoršanje simptoma i mogu doživjeti teško pogoršanje plućne funkcije koje nije praćeno simptomima. Liječenje egzacerbacije astme temelji se na jačini egzacerbacije, tako da razlikujemo blagu, umjerenu i tešku egzacerbaciju astme. Inicijalno zbrinjavanje u hitnoj službi temelji se na osnovnoj procjeni i određivanju stupnja egzacerbacije astme, a što uključuje mjerenje FEV1 ili PEF. U dijagramu u nastavku opisan je slijed postupaka i zbrinjavanje bolesnika s egzacerbacijom astme.
Osnovna terapija astmatskoga napadaja uključuje inhalcijsku primjenu β2-agonista i antikolinergika, primjenu kisika te kortikosteroida. Kod blažih napadaja dostatna je primjena samo β2-agonista, dok je kod težih indicirana i primjena antikolinetika. U bolničkim uvjetima i uvjetima hitne službe preferira se nebulizacija: salbutamol 1 ml (5 mg) + ipratropij bromid 2 ml (0,5 mg) + fiziološka otopina 2 ml koja se može ponavljati do četiri puta s razmakom od pola sata. Kisik se primjenjuje kroz nosni kateter ili masku da bi se održavala saturacija arterijske krvi iznad 94 %. Kod ovih bolesnika preporuča se i primjena kortikosteroida, bilo intravenski (40 - 80 mg metilprednizolon), bilo peroralno (40 - 80 mg prednizon). Ako se ne postiže zadovoljavajući terapijski odgovor, indicirana je i intravenska primjena aminofilina u dozi od 2 mg/kg/TT polako tijekom 10 do 20 minuta.
Terapija refraktornoga astmatskog napadaja uključuje primjenu nekoga od sljedećih lijekova: adrenalin, magnezij te ketamin. Adrenalin se primjenjuje u nerazrijeđenom obliku (1mg/1ml) u dozi od 0,5 ml subkutano ili intramuskularno. Magnezij se daje u obliku 50 %-tnoga magnezijeva-sulfata i to u dozi od 2,5 do 5 ml kao spori intravenski bolus kroz 20 minuta. Ketamin se daje rijetko, u dozi od 0,5 mg/kg/TT (obično oko 30 mg) u obliku spore intravenske injekcije. Ako se ne postiže odgovor niti primjenom ovih lijekova, indicirana je endotrahealna intubacija te mehanička ventilacija uz sedaciju bolesnika inhalacijskim anestetikom (sevofuran, izofluran). Sve ove intervencije zahtijevaju pažljiv nadzor bolesnika i obično smještaj u jedinicu intenzivnoga liječenja.
Inhalacijska primjena lijekova u pulmologiji. Inhalacijska primjena lijeka u dišne puteve i pluća osigurava izravan lokalni učinak uz minimalno sistemsko djelovanje što smanjuje učestalost neželjenih pojava. Načini aplikacije koji osiguravaju točno doziranje lijeka ovise o vrsti aplikatora. Tri su glavna uređaja za inhalacijsku primjenu lijeka: raspršivač fiksnih doza, raspršivač suhoga praha i nebulizator.
Raspršivači fiksnih doza ili pumpice (MDI, od engl. metered dose inhaler) osiguravaju inhalacijsku primjenu lijeka u obliku suspenzije ili otopine. Sastoje se od metalnih komora u kojima se lijek nalazi u obliku suspenzije ili otopine, uz surfaktant te potisni plin, a smješteni su unutar plastičnih držača s usnikom preko kojega se isporučuje doza lijeka. Kao potisni plin danas se obično koristi hidrofloralkan (HFA) s obzirom na to da ne dovodi do oštećenja ozonskoga omotača u odnosu na ranije korišten kloroflorkarbon (CFC). Osim toga, HFA stvara aerosol s manjom veličinom čestica što osigurava bolji prijenos do malih dišnih puteva. Glavni nedostaci raspršiavača fiksnih doza su potreba za dobrom suradljivošću i educiranošću bolesnika o načinu primjene lijeka te nakupljanje lijeka u orofarinksu. Lakšu primjenu lijeka iz MDI uređaja osiguravaju dodaci kao što su spremnici (engl. spacers) u kojima se lijek pretvara u oblik pare ili magle pa se tako lakše inhalira te komore (engl. holding chembers) koje omogućavaju zadržavanje lijeka te tako pomažu kod neodgovarajuće koordinacije potiska i udaha.
Raspršivači suhoga praha (DPI, od engl. dry powder inhalers) su uređaji koji osiguravaju inhalacijsku primjenu lijeka u obliku praha sadržanoga u kapsuli ili blisteru. Isporuka lijeka osigurava se udahom (nema potisnoga plina) zbog čega ovi uređaji nisu prikladni za liječenje akutnih napadaja astme kada se ne može proizvesti dovoljno jak udah da bi se lijek dostavio u male dišne puteve. Ovisno o načinu na koji se oslobađa lijek iz kapsule ili blistera, razlikujemo nekoliko oblika DPI uređaja: Diskus, Aerolizer, HandiHaler, Twisthaler te Flexhaler. Glavni preduvjet za primjenu lijeka putem DPI uređaja je suradljivost bolesnika i odgovarajući inspiratorni protok kako bi se osigurala zadovoljavajuća dostava lijeka
Nebulizatori su uređaji koji omogućavaju pretvaranje lijekova u obliku suspenzije ili otopine u oblik aerosola koji se potom lakše inhalira i ima bolju raspodjelu unutar pluća. Ovisno o načinu rada, razlikujemo pneumatske i ultrazvučne nebulizatore. Sastoje se od komorice u koju se stavlja otopina lijeka, samoga uređaja te maske za nos i usta u koju bolesnik diše i tako unosi lijek u pluća. Glavna prednost nebulizacije kao oblika inhalacijske primjene lijeka je ta što ne zahtijeva suradljivost bolesnika (teže oboljeli, djeca, nesuradljivi bolesnici).
TEŠKA ASTMA
Definicija i epidemiologija. Teška astma definira se kao astma kod bolesnika koji imaju perzistentne simptome unatoč optimalnoj medikamentnoj terapiji koja uključuje višestruku ili kontinuiranu primjenu oralnih sistemskih kortikosteroida. Teška astma javlja se kod 5 do 10 % bolesnika s astmom.
Patogenetska obilježja. Osnovne karakteristike teške astme su trajna i ireverzibilna bronhoopstrukcija, hiperreaktivnost traheobronhalnoga stabla i posljedična hiperinflacija. Navedene promjene posljedica su sklonosti ovih bolesnika procesu remodelacije koja proizlazi iz kronične upale. Najčešće se radi o neutrofilnoj upali dišnih puteva, iako kod jednoga dijela bolesnika mogu i izostati izražene upalne promjene. Broj eozinofila u uzorcima dišnih puteva (obrisak nosa, sputum) nije konzistentan. Određeni radovi i spoznaje upućuju i na ulogu različitih bakterija, virusa i gljivica u nastanku teške astme.
Klinička obilježja. Osnovno kliničko obilježje teške astme perzistencija je simptoma astme unatoč odgovarajućem liječenju koje podrazumijeva i primjenu sistemskih kortikosteroida. Postoje različiti klinički fenotipovi kod kojih susrećemo tešku astmu. Najčešće se radi o nealergijskoj astmi kod žena, dok su ostali fenotipovi kod kojih možemo češće susresti tešku astmu aspirinska astma, astma kasne pojavnosti (engl. late onset asthma) te nestabilna astma (engl. brittle asthma). Astma kasne pojavnosti je ona kod koje se simptomi razvijaju u kasnijoj životnoj dobi, dok nestabilnu astmu karakterizira izražena dnevna varijabilnost vršnoga izdisajnog protoka (PEF varijabilnost viša od 40 %). Bolesnici s teškom astmom pokazuju i izraženiju sklonost razvoju respiratornih infekcija.
Dijagnostički postupak. Dijagnoza teške astme postavlja se na osnovi kliničke opservacije bolesnika. Ako se radi o bolesnicima koji imaju uporne simptome i bolest se ne može staviti pod kontrolu unatoč pridržavanja i ustrajnosti u uzimanju lijekova (a to uključuje i primjenu sistemskih kortikosteroida – peti korak prema GINA smjernicama), možemo reći da bolesnik ima tešku astmu. Pri tome je potrebno provesti klasičnu dijagnostičku obradu kako bi se odredio fenotip astme (alergijska, eozinofilna, aspirinska i dr.). Svakako je jedan od ključnih koraka u postavljanju dijagnoze isključivanje loše suradljivosti bolesnika u procesu liječenja tj. potrebno je provjeriti uzima li bolesnik redovno svoju terapiju, zna li pravilno primijeniti inhalacijsku terapiju te pridržava li se općih mjera liječenja (izbjegavanje provocirajućih čimbenika, prestanak pušenja i dr.).
Liječenje teške astme predstavlja klinički izazov i ono se provodi samo u specijaliziranim ustanovama koje imaju iskustava u liječenju ovih bolesnika. U tome pogledu primjenjuje se standardna, imunomodulatorna i biološka terapija kao i drugi, specifični oblici liječenja.
Standardna terapija teške astme podrazumijeva klasično liječenje koje podrazumijeva primjenu visokih doza inhalacijskih kortikostroida (ICS) i dugodjelujućih beta agonista (LABA) uz dodatak antileukotrijena i/ili teofilina i antikolinergika dugoga djelovanja (LAMA) uz dodatak peroralnih glukokortikoida (OCS). Liječenje podrazumijeva primjenu 0,5 do 1 mg prednizolona po kilogramu tjelesne mase kroz najmanje dva tjedna kada se naglo snižava doza na 20 mg prednizolona dnevno tijekom sljedeća dva tjedna. Nakon mjesec dana liječenja potrebno je provesti reevaluaciju simptoma te, ako je postignuta odgovarajuća kontrola, nastaviti s njihovom primjenom u najmanjoj mogućoj dozi (trebala bi biti manja od 5 mg/dan). Jedan dio bolesnika ne pokazuje dobar klinički odgovor na primjenu kortikosteroida, vjerovatno uslijed razvoja rezistencije na glukokortikoide, a to se najčešće viđa u pušača što se povezuje s oksidacijskim stresom.
Imunomodulatorna terapija kod bolesnika s teškom astmom provodi se kod bolesnika koji ne reagiraju na glukortikoide kao i kod bolesnika koji zahtijevaju dugoročnu primjenu glukokortikoida s ciljem postizanja kontrole bolesti. Imunomodulatorni lijekovi pokazuju manju učestalost nuspojava u odnosu na glukortikoide pa su prihvatljiviji u pogledu dugoročnoga liječenja. Oni se uvode paralelno s glukokortikoidima i ako kroz period od 24 do 36 tjedana ne dovedu do smanjenja potrebe za glukokortikoidima mogu se isključiti iz terapije. Najčešće korišteni lijekovi iz ove skupine su makrolidi (dugotrajna primjena azitromicina ili klaritromicina, pokazuju tendenciju snižavanja vrijednosti određenih interleukina), azatioprin (2 - 5 mg/kg), ciklosopirin (5 - 8,5 mg/kg) te metotreksat (5 - 25 mg/tjedan).
Biološka terapija predstavlja novi oblik liječenja teške astme. Indicirana je kod bolesnika koji ne reagiraju na liječenje glukokortikoidima ili kod bolesnika koji zahtijevaju dugotrajnu primjenu glukokortikoida za postizanje kontrole bolesti, što nosi rizik od razvoja raznih komplikacija. Pri teškoj alergijskoj astmi koristi se anti IgE liječenje monoklonskim protutijelom omalizumabom koje predstavlja DNA-rekombinantno humanizirano monoklonsko protutijelo koje se selektivno veže na IgE te sprečava njegovo vezanje na IgE receptore na površini bazofila i mastocita. U liječenju teške eozinofilne astme koriste se različiti anticitokinski lijekovi kao što su mepolizumab, reslizumab i benralizumab koji ometaju učinak IL-5 na ciljne stanice.
Bronhalna termoplastika predstavlja mogućnost liječenja za bolesnike s teškom nealergijskom astmom (tzv „T2 low“ bolesnici), kod kojih se ne postiže kontrola simptoma i egzacerbacija usprkos liječenju u petom koraku. Postupak se temelji na bronhoskopskoj proceduri pri kojoj se primjenjuje radiofrekvencijska energija koja smanjuje masu glatkih mišića te time smanjuje i samu bronhokonstrikciju.
Prognoza. Unatoč farmakološkom napretku liječenja bolesnika s teškom astmom, njihova prognoza je i dalje znatno lošija u odnosu na druge bolesnike s astmom i nosi znatno viši rizik od nastanka trajno narušene plućne funkcije i narušene kvalitete života.
KRONIČNA OPSTRUKTIVNA PLUĆNA BOLEST (KOPB)
Definicija. Prema Globalnoj inicijativi za kroničnu opsruktivnu plućnu bolest (GLOD, od engl. Global Initiative for Chronic Obstructive Lung Disease) koja potječe od Svjetske zdravstvene organizacije (WHO) te Američkoga instituta za srce, pluća i krvi (NHLBI), kronična opstruktivna plućna bolest (KOPB) definira se kao česta bolest koju se može spriječiti i liječiti, a karakterizirana je trajnim respiratornim simptomima te ograničenjem protoka zraka kroz dišne puteve i/ili alveolarnim poremećajima koji nastaju kao posljedica dugotrajne izloženosti štetnim česticama i plinovima. Podlogu bolesti čini kronična upala koja dovodi do poremećaja na razini dišnih puteva (kronični bronhitis/bronhiolitis) te plućnoga parenhima (emfizem pluća). Prikaz zbivanja u KOPB-u prikazan je shematski (Slika 2.3.). Nekada su se kronični bronhitis i emfizem pluća opisivali kao zasebni kliničko-patološki entiteti, ali danas se zna da se radi o različitim fenotipovima iste bolesti.
Kronični bronhitis definiran je kliničko-epidemiološki, prema tomu o kroničnom bronhitisu govorimo kada osoba kašlje, obično produktivno, velik broj dana, ukupno najmanje unutar tri mjeseca u godini tijekom najmanje dvije uzastopne godine, a da se pri tome kašalj ne može povezati s drugim uzrocima.
Emfizem pluća definiran je patološko-anatomskim karakteristikama prema kojima emfizem pluća predstavlja stanje pri kojemu dolazi do širenja zračnih prostora distalno od terminalnih bronhiola uslijed razaranja interalveolarnih septi i potpornoga tkiva pluća.
Slika 2.3. Shematski prikaz zbivanja u KOPB-u
Epidemiologija. KOPB je općenito jedna od najčešćih kroničnih bolesti i zauzima četvrto mjesto među najčešćim uzrocima smrtnosti u razvijenim zemljama uz tendenciju porasta broja oboljelih osoba. Pojavnost bolesti povezuje se ponajprije s dugotrajnim pušačkim stažom, starijom životnom dobi te lošijim socioekonomskim prilikama. Onečišćenje zraka otvorenih i zatvorenih prostora, kao i profesionalna onečišćenja zraka, također predstavljaju sve češći rizični čimbenik za razvoj KOPB-a. Bolest se češće javlja kod muškaraca nego kod žena, premda se i kod žena bilježi sve veći porast (vjerojatno povezano s povećanjem navike pušenja). Bolest predstavlja i rastući socioekonomski problem s obzirom na njezinu sve veću učestalost u skupini radno aktivnih osoba (učestala bolovanja, ranije umirovljenje), kao i visoke troškove liječenja.
Etiologija. Osnovni etiopatogenetski mehanizam podrazumijeva upalni odgovor dišnih puteva i plućnoga parenhima kao odgovor na dugotrajnu izloženost štetnim tvarima. On nastaje kao rezultat složene interakcije između dugotrajnoga kumulativnog udisanja štetnih čestica i plinova i brojnih endogenih čimbenika što su kao genetska predispozicija, postojanje hiperreaktivnosti dišnih puteva i/ili smetnji u razvoju pluća tijekom djetinjstva.
Pušenje je glavni rizični čimbenik za razvoj KOPB-a i više od 90 % bolesnika s KOPB-om su pušači. Cigaretni dim u dišnim putevima izaziva oksidativni stres koji pokreće upalni odgovor. Pušači koji su pušili više od 30 cigareta na dan imaju dvadeset puta veći rizik od smrti uzrokovane KOPB-om i njezinih posljedica u odnosu na nepušače. Osim aktivnoga pušenja, danas se zna da i pasivno pušenje također predstavlja rizični čimbenik za razvoj KOPB-a. Incidencija KOPB-a prati incidenciju pušenja s odmakom od oko 20 godina što predstavlja razdoblje potrebno da kod pušača sklonih razvoju KOPB-a dođe do razvoja bolesti.
Genetska predispozicija. Iako se zna da je pušenje glavni rizični čimbenik za razvoj KOPB-a, činjenica je da se on razvije kod samo 20 % pušača što ukazuje na postojanje individualne, genetski uvjetovane sklonosti za razvoj ove bolesti. Tome pridonosi i činjenica češće pojavnosti KOPB-a u nekim obiteljima. U tome smislu, najčešće se spominje deficijencija α-1 antitrispina, dok su drugi genetski poremećaji slabije istraženi. Deficijencija α-1 antitripsina genetski je uvjetovano stanje karakterizirano sniženom razinom α-1 antitripsina koji se stvara u jetri, a djeluje kao inhibitor proteinaza (poglavito elastaze) te tako smanjuje razgradnju proteina. S obzirom na to da je razgradnja proteina plućnoga parenhima jedno od glavnih događaja u patogenezi KOPB-a, manjak ovoga inhibitora povezan je s bržim razvojem ove bolesti. Danas je poznato više od 75 alela za gen α-1 antitripsina, a tri najčešća fenotipa su: MM (normalni fenotip), MZ (heterozigotni fenotip) te ZZ (homozigotni fenotip).
Izloženost drugim štetnim tvarima. Osim cigaretnoga dima, i drugi štetni čimbenici mogu doprinijeti razvoju KOPB-a, kao što su dim koji nastaje sagorijevanjem bioloških goriva, profesionalna izloženost različitim plinovima i prašini (mineralna ili pamučna prašina), izloženost kemijskim tvarima (kadmij) te zagađenost zraka.
Poremećaj razvoja pluća. Smanjena maksimalno dosegnuta razvijenost plućne funkcije uslijed prijevremenoga poroda, smanjene porođajne težine ili uslijed utjecaja drugih čimbenika na razvoj pluća (pušenje majke za vrijeme trudnoće, rana izloženost djece cigaretnom dimu i drugim zagađivačima) predstavlja rizični čimbenik za razvoj KOPB-a u kasnijoj životnoj dobi.
Astma i hiperreaktivnost dišnih puteva također predstavljaju rizični čimbenik za razvoj KOPB-a. Osobe koje boluju od astme i puše (kao i osobe s dokazanom hiperreaktivnošću dišnih puteva bez simptoma astme) imaju znatno viši rizik od razvoja KOPB-a u odnosu na osobe koje nemaju astmu i puše.
Patogeneza. Upala u dišnim putevima i plućnom parenhimu kod bolesnika s KOPB-om predstavlja modificiran i pojačan normalni upalni odgovor na kronične iritanse poput pušenja. Mehanizam takvoga pojačanoga upalnog odgovora još uvijek nije sasvim jasan, ali smatra se da je genetski uvjetovan. Pušenje, kao i dugotrajna inhalacija drugih štetnih tvari, dovodi do oksidativnoga stresa u dišnim putevima i plućnom parenhimu te biomarkeri oksidativnoga stresa kao što su vodikov peroksid i 8-isoprostan mogu kod ovih bolesnika biti povišeni u sputumu, izdahnutom zraku i cirkulaciji, osobito u fazama egzacerbacije. Posljedično oksidativnom stresu dolazi do intracelularnih promjena (acetiliranje histona) koje uvjetuju pojačanu ekspresiju proupalnih gena i povećano stvaranje proupalnih citokina (LTB4, IL-8, TNF-α, IL-1ß, IL-6, TGF-ß i drugi). Oni izazivaju lokalne promjene te kemotaksiju upalnih stanica (makrofagi, neutrofili, eozinofili). Aktivirane upalne stanice dovode do nastanka kronične upale (kronični bronhitis) što uvjetuje promjene na epitelu dišnih puteva, u prvom redu hipersekreciju sluzi (što je i glavna karakteristika kroničnoga bronhitisa), a nastaje i edem te poremećaj mukocilijarnoga aparata. Nakupljanje i zadržavanje sluzi u dišnim putevima pogoduje razvoju sekundarne infekcije što dodatno pogoršava stanje bolesti (egzacerbacija). Osim toga, aktivirane upalne stanice luče i proteinaze (neutrofili luče neutrofilne elastaze, a makrofagi matriks metaloproteinaze) koje nadmašuju aktivnost antiproteinaza što dovodi do razgradnje elastina i drugih elemenata potpornoga tkiva pluća te razaranja alveolarnih septi pa dolazi do širenja distalnih zračnih prostora i nastanka emfizema pluća (tzv. hipoteza proteinaza i antiproteinaza). Osim toga, oksidativni stres dovodi i do promjena na malim dišnim putevima (manji od 2 mm, tzv. respiratorni bronhi) te se i na njima zapaža razvoj upale i njezinih posljedica (hipertrofija i fibroza) te posljedično suženje lumena (tzv. bolest malih dišnih puteva). S obzirom na to da se radi o upalnoj bolesti, nastali proupalni citokini, osim što imaju lokalni učinak u dišnom sustavu, krvlju se prenose i na druga tkiva i organe te se zapažaju i neki sistemski učinci kao što su kaheksija i atrofija skeletnih mišića.
Patologija. Patološke promjene kod bolesnika s KOPB-om zahvaćaju sve strukture pluća: dišne puteve, plućni parenhim i krvne žile. Strukturne promjene posljedica su opetovanih procesa upale i cijeljenja, a jednom potaknut proces ostaje i pogoršava se, čak i nakon prestanka pušenja. Makroskopski, pluća bolesnika s KOPB-om izgledaju napuhano uslijed hiperinflacije, a dišni putevi, osobito manji, suženi su sa zadebljanom stijenkom i ispunjeni gustim mukoznim sadržajem koji mjestimično formira čepove. Mikroskopski nalaz uključuje infiltraciju stijenke bronha i bronhiola upalnim stanicama (poglavito neutrofilima i CD8+ limfocitima, a kod nekih bolesnika i s eozinofilima), proliferaciju i hiperplaziju mukoznih žlijezda i stanica te mjestimičnu skvamoznu metaplaziju koja se javlja kao odgovor na kronični podražaj (zamjena višerednoga cilindričnog epitela s trepetiljkama otpornijim pločastim stanicama). U kasnijim fazama dolazi do razvoja fibroze i gubitka kapilarne mreže. Emfizem karakterizira širenje zračnih prostora plućnih acinusa, a prema izgledu razlikujemo centroacinarni, distalno acinarni, panacinarni i iregularni.
Patofiziologija. Navedeni procesi dovode do različitih posljedica kao što su poremećaji plućne funkcije (bronhoopstrukcija i hiperinflacija, poremećaj izmjene respiratornih plinova), plućna hipertenzija i plućno srce te posljedice sistemske upale.
Bronhoopstrukcija i hiperinflacija. Osnovni patofiziološki poremećaj u KOPB-u opstrukcija je dišnih puteva koja nastaje kao posljedica mukozne hipersekrecije, remodelacije dišnih puteva te emfizematoznih promjena, a dovodi do otežanoga ekspirija i posljedičnoga zarobljavanja zraka i hiperinflacije (inspirij dugo ostaje uredan jer on predstavlja aktivnu fazu disanja pri čemu napor pri protoku zraka savladava snaga dišnih mišića, dok to izostaje u pasivnom ekspiriju). Opsežnost upale, fibroze i sekreta u lumenu dišnih puteva korelira sa stupnjem opstrukcije, odnosno smanjenjem spirometrijskih pokazatelja opstruktivnih smetnji ventilacije: forsiranoga volumena u prvoj sekundi (FEV1) te njegovoga omjera s vitalnim kapacitetom (FEV1/FVC). Ove promjene povezane su i s ubrzanim padom FEV1, što je glavna karakteristika bolesti. Progresivno zarobljavanje zraka i hiperinflacija pluća odgovorni su i za smanjenje inspiratornoga kapaciteta (IC) te nemogućnost udaha, što je presudno za simptom otežanoga disanja i nepodnošenje tjelesnoga napora (hiperinflacija se smatra glavnim mehanizmom nastanka dispneje kod ovih bolesnika). Primjena bronhodilatatora koji utječu na periferne dišne puteve smanjuje zarobljavanje zraka, a tako i rezidualne volumene i kapacitete (RV, FRC) te na taj način poboljšava simptome i kapacitet vježbanja, odnosno toleranciju napora zbog čega se smatraju jednima od ključnih lijekova u liječenju ovih bolesnika.
Poremećaj izmjene respiratornih plinova. S napredovanjem bolesti razvija se respiratorna insuficijencija koju karakterizira poremećaj ventilacijsko-perfuzijskoga odnosa (VA/Q), posljedično čemu dolazi do hipoksemije i hiperkapnije. Nekoliko je mehanizama koji uvjetuju razvoj ove respiratorne insuficijencije. Razvojem emfizema pluća smanjuje se površina alveokapilarne membrane, što za posljedicu ima smanjenje ukupne respiratorne površine, a time i smanjenje difuzijskoga kapaciteta za respiratorne plinove (kisik, ugljični dioksid). Također, kao posljedica ranije opisane opstrukcije dišnih puteva, neravnomjerno raspoređene u plućima, dolazi do neravnomjerne ventilacije pluća pri čemu dolazi do hipoventilacije zahvaćenih područja i povećanja mrtvoga prostora. Nastali poremećaji dovode do aktivacije komepenzacijskih mehanizama u vidu povećanja dišnoga rada (tahipneja, korištenje pomoćne dišne muskulature) čime se nastoji ispraviti nastalu hipoksemiju i hiperkapniju. Kada dođe do iscrpljenja kompenzatornih mehanizama, nastupa hipoventilacija, retencija ugljičnoga dioksida (hiperkapnija) te respiratorna acidoza. Kod bolesnika s globalnom respiratornom insuficijencijom, a osobito u slučaju respiratorne acidoze, treba imati na umu da umjerena hipoksemija daje poticaj za disanje centru za disanje (stimulacijski učinak) te treba biti oprezan s primjenom kisika jer njegova primjena u visokim protocima i postocima za ove bolesnike može biti pogubna. Kod ovih bolesnika kao kompenzatorni odgovor na kroničnu hipoksemiju možemo naći i sekundarnu eritrocitozu (policitemija) što dovodi do cijanoze i pletore.
Plućna hipertenzija i plućno srce. U teškoj uznapredovaloj bolesti razvija se plućna hipertenzija, prvenstveno kao posljedica hipoksične vazokonstrikcije malih plućnih arterija. Tijekom vremena u arterijama nastaju strukturne promjene koje uključuju hiperplaziju intime, a kasnije i hiperplaziju i/ili hipertrofiju glatkomišićnih stanica. Čak i u blagim oblicima KOPB-a ili kod pušača koji nemaju KOPB, a skloni su razvoju emfizema, mogu se vidjeti značajne abnormalnosti u protoku kroz plućnu mikrocirkulaciju koje se pogoršavaju s progresijom bolesti. Slično kao i u dišnim putevima, u plućnim krvnim žilama prisutan je perzistentni upalni odgovor povezan s endotelnom disfunkcijom koja pogoduje nastanku vazokonstrikcije i povećanju tlaka plućnoga krvožilja. Gubitak plućnih kapilara u emfizemu doprinosi povećanom tlaku u plućnom krvotoku. Progresivna plućna hipertenzija može dovesti do hipertrofije desnoga ventrikula i popuštanja desnoga srca što se naziva kronično plućno srce. Novija istraživanja pokazala su da je promjer plućnih žila povezan s rizikom od egzacerbacija KOPB-a te da promjene na njima, koje su obično neprepoznate, od velike važnosti na utjecaj težine simptoma i nastanak egzacerbacija.
Sustavni učinci. Mnogi bolesnici s KOPB-om često istovremeno imaju i druge pridružene bolesti koje su povezane s istim rizičnim čimbenicima kao i KOPB, kao što su pušenje, starost i inaktivnost. Pridružene bolesti u velikoj mjeri pogoršavaju zdravstveno stanje i preživljenje bolesnika s KOPB-om. Ograničenje protoka zraka, a posebno hiperinflacija, utječu na funkciju srca i izmjenu respiratornih plinova. Upalni medijatori u cirkulaciji mogu doprinijeti gubitku skeletnih mišića i kaheksiji te mogu potaknuti ili pogoršati pridružene bolesti, kao što su ishemična bolest srca, popuštanje srca, osteoporoza, anemija, šećerna bolest i metabolički sindrom.
Klinička slika. KOPB postaje klinički manifestan obično u petom ili šestom desetljeću života, a iznimno se rijetko javlja i ranije. Osnovni simptomi su produktivan kašalj i dispneja. Samu bolest karakterizira spora progresija s povremenim iznenadnim pogoršanjima (egzacerbacija). U prošlosti je često bolest dijeljenja u dvije kategorije ovisno o patološkom entitetu koji prevladava (kronični bronhitis ili emfizem pluća), pa se tako opisivao tip A (ružičasti puhač; dominacija emfizema) te tip B (plavi napuhanko; dominacija kroničnoga bronhitisa). U heterogenoj masi bolesnika s KOPB-om ove bolesnike i dalje prepoznajemo kao fenotip bolesnika s emfizemom, odnosno fenotip bolesnika s kroničnim bronhitisom, ali većinu se bolesnika ipak ne može jednostavno svrstati u jedan od ova dva tipa. Dvije osnovne kliničke manifestacije KOPB-a su kašalj koji je obično praćen iskašljavanjem te dispneja i netolerancija napora. Kod svih bolesnika s takvim manifestacijama koji imaju pozitivnu anamnezu na neki rizični čimbenik (npr. pušenje) treba pomišljati na KOPB.
Kronični kašalj prisutan je kod više od 30 % bolesnika s KOPB-om. Obično je praćen iskašljavanjem, iako se može raditi i o neproduktivnom kašlju (rjeđe). Može biti intermitentan ili prisutan tijekom cijeloga dana te može biti različitoga intenziteta. Obično predstavlja prvi znak koji može mjesecima i godinama prethoditi nastanku KOPB-a. Kašalj je najizraženiji u jutarnjim satima te pri tjelesnoj aktivnosti. Iskašljaj može biti serozan ili mukozan, no najčešće se radi o mukopurulentnom iskašljaju žućkasto-zelenkaste boje uslijed infekcije ili kontaminacije. Kao i kašalj, i iskašljavanje može biti povremeno ili trajno te može varirati u obimu, odnosno volumenu iskašljanoga sadržaja.
Dispneja. Najkarakterističniji i najozbiljniji simptom KOPB-a progresivna je dispneja koja nastaje kao posljedica zarobljavanja zraka i hiperinflacije. U početku je prisutna samo pri tjelesnom naporu, a u kasnijim fazama javlja se i u mirovanju. Bolesnici dispneju najčešće opisuju kao otežano disanje, pritisak ili stezanje u prsima, glad za zrakom ili ostajanje bez zraka.
Wheesing i stezanje u prsima. Engl. wheesing označava visokofrekventne polifone bronhalne šumove koje bolesnici obično opisuju kao cičanje ili sviranje u prsima. Oni se mogu čuti u inspiriju i ekspiriju, često i bez auskultacije. Stezanje u prsima obično se javlja pri tjelesnom naporu te se smatra se nastaje uslijed izometričnoga stezanja interkostalnih mišića.
Fizikalni nalaz. Klinički nalaz bolesnika s KOPB-om u početnim fazama bolesti može biti uredan, a karakteristični znaci javljaju se s progresijom bolesti. Uslijed hiperinflacije i emfizema, bolesnici s KOPB-om imaju karakterističan bačvasti prsni koš. Šum disanja obično je u većoj ili manjoj mjeri oslabljen, a ekspirij produljen i otežan, praćen bronhalnim šumovima i/ili i hropcima. Perkusijom prsnoga koša dobiva se hipersonoran zvuk koji je posljedica hiperinflacije. S razvojem i progresijom bolesti dolazi do nastanka specifičnih komplikacija, kao što su respiratorna insuficijencija, kronično plućno srce i popuštanje desne strane srca te ostale te ostale sistemske komplikacije koje nose svoje kliničke znakove (periferni edemi, distendirane vratne vene i sl.). Bolesnici u uznapredovaloj fazi bolesti obično su cijanotični. U fazama egzacerbacije često je prisutna tahipneja, bolesnici koriste pomoćne prsne i trbušne respiracijske mišiće (uvlačenje međurebrenih prostora i juguluma u inspiriju) te zauzimaju položaj u kojemu su lagano nagnuti naprijed te dišu kroz stisnute usnice kako bi povećali otpor pri izdahu i time pospješili izlazak „zarobljenoga zraka“.
Komplikacije. S razvojem i progresijom bolesti dolazi do nastanka specifičnih komplikacija kao što su egzacerbacije, respiratorna insuficijencija, kronično plućno srce te ostale sistemske komplikacije.
Egzacerbacije KOPB-a. Egzacerbacije KOPB-a najčešće su potaknute respiratornim infekcijama, najčešće bakterijskim, rjeđe virusnim ili kombiniranim. U jednoj trećini slučajeva egzacerbacije KOPB-a obilježava eozinofilija, što je osobito važno za liječenje ovih bolesnika, dok se u 14 % slučajeva radi o tzv. pauci-inflamatornim egzacerbacijama. Dio bolesnika posebno podložan nastanku egzacerbacija i bolesnici s učestalim egzacerbacijama čine tzv. fenotip čestih egzacerbatora. Novije studije ukazuju da se u pozadini učestalih egzacerbacija nalazi genetski polimorfizam. Tijekom egzacerbacije pogoršava se zarobljavanje zraka i hiperinflacija te je dodatno smanjen ekspiratorni protok što sve doprinosi pogoršanju dispneje. Također, u egzacerbaciji se pogoršava i ventilacijsko-perfuzijski omjer (VA/Q) što može rezultirati nastankom ili pogoršanjem hipoksemije. Treba imati na umu da i druga stanja, kao što su pneumonije, plućna embolija ili akutna dekompenzacija srca, mogu „oponašati“ egzacerbaciju KOPB-a ili je mogu pogoršati.
Respiratorna insuficijencija neizbježan je događaj u uznapredovalim fazama KOPB-a. O njoj pričamo kada parcijalni tlak kisika padne ispod 8 kPa (60 mmHg), a parcijalni tlak ugljičnoga dioksida poraste iznad 7 kPa (55 mmHg) te tada govorimo o globalnoj respiratornoj insuficijenciji (hipoksemijsko-hiperkapnički tip). S daljnjom progresijom bolesti dolazi i do daljnje progresije respiratorne insuficijencije koja postaje sve refrakternija na klasične oblike liječenja, uključujući i mehaničku potporu disanju te vodi bolesnika prema letalnom ishodu.
Kronično plućno srce (lat. cor pulmonale) uključuje promjene desne strane srca koje su posljedica dugotrajne plućne bolesti i promjena na plućnim krvnim žilama. Promjene nastaju kao posljedica tlačnoga opterećenja desnoga srca zbog razvijene plućne hipertenzije, a uključuju hipertrofiju desnoga ventrikula te insuficijenciju pulmonalne i/ili trikuspidalne valvule. Klinički se kronično plućno srce očituje kao desnostrano srčano popuštanje: distendirane vratne vene, ascites, pozitivan hepatojugularni refleks te periferni edemi.
Sistemske i ostale komplikacije. Dugotrajna bolest dovodi i do nekih sistemskih komplikacija i očitovanja koja mogu biti posljedica same naravi bolesti (učinak proupalnih citokina, povećan rad dišnih mišića, ograničenje aktivnosti i sl.), ali i lijekova koje bolesnici doživotno uzimaju. Bolesnici s uznapredovalim KOPB-om postaju iscrpljeni, gube na mišićnoj masi, razvijaju depresivno raspoloženje, skloniji su hipertenziji, osteoporozi i šećernoj bolesti. Također, ovi su bolesnici skloniji infekcijama kao što su akutni bronhitis i pneumonija, nastanku spontanoga pneumotoraksa, a imaju i viši rizik od razvoja karcinoma pluća (kod svih bolesnika s KOPB-om promjena intenziteta kašlja treba sugerirati na razvoj karcinoma pluća).
Dijagnoza KOPB-a postavlja se na temelju anamneze i fizikalnoga nalaza, laboratorijskih nalaza, testova plućne funkcije te slikovnih dijagnostičkih metoda. U obradi ovih bolesnika, osobito u kasnijim fazama bolesti, preporuča se i kardiološka evaluacija (elektrokardiografija, ehokardiografija).
Anamneza i fizikalni nalaz. Podaci o pušenju ili izloženosti nekom drugom rizičnom čimbeniku, uz prisutnost kroničnoga kašlja, dispneje i nepodnošenja napora visoko su suspektni za postavljanje sumnje na dijagnozu KOPB-a. U slučaju negativne anamneze na pušenje, a osobito kod mlađih osoba, treba pomišljati na mogućnost postojanja deficijencije α1-antitripsina.
Laboratorijski nalazi. Osnovni laboratorijski nalazi u lakše i srednje teškim slučajevima mogu biti uredni. Eritrocitoza i povišen hemoglobin mogu biti posljedica sekundarne policitemije koju nalazimo u kasnijim fazama bolesti. Plinske analize i acidobazni status u početku bolesti, kao i u mirovanju, mogu biti uredni. Kasnije nalazimo hipoksemiju, hiperkapniju i kompenziranu respiracijsku acidozu (pH uredan, povišeni bikarbonati). Nerijetko bolesnici s teškim KOPB-om dobro toleriraju i teško poremećene nalaze plinskih analiza (PaO2 ispod 6 kPa, PaCO2 iznad 9 kPa) što treba imati na umu kod određivanja načina liječenja (ne zahtijevaju mehaničku ventilaciju!). Saturacija arterijske krvi kisikom određivane metodom pulsne oksimetrije često pokazuje snižene vrijednosti (80 – 90 %). Nalaz eozinofilije u perifernoj krvi dokazano povećava rizik od egzacerbacija.
Ispitivanje plućne funkcije ključno je u postavljanju dijagnoze KOPB-a. Najznačajnija ventilacijska funkcionalna pretraga plućne funkcije je spirometrija, a difuzijska DLCO (difuzijski kapacitet pluća za ugljični monoksid).
Spirometrija je najčešća metoda ispitivanja plućne funkcije i predstavlja zlatni standard za postavljanje dijagnoze KOPB-a. Dijagnozu KOPB-a potvrđuje nalaz trajne, odnosno ireverzibilne opstrukcije dišnih puteva nakon primjene bronhodilatatora (četiri udaha ili 400 µg salbutamola), a podrazumijeva omjer FEV1/FVC (Tiffeneaunov indeks) manji od 70 %. Ovisno o vrijednosti FEV1, određuje se stupanj opstrukcije, ali sama vrijednost FEV1 nema veću važnost pri postavljanju dijagnoze. Bolesnici s KOPB-om mogu imati normalne ili snižene vrijednosti FVC-a. Bronhodilatacijski test kod ovih bolesnika obično je negativan što ima ulogu u razlikovanju od astme, iako kod bolesnika s izraženom bronhalnom hiperreaktivnošću taj test može biti i pozitivan. Ako se početni nalaz opstrukcije na spirometriji na temelju kojega je postavljena dijagnoza KOPB-a normalizira, dijagnoza KOPB-a mora se korigirati jer izostanak trajne opstrukcije ili uredan nalaz plućne funkcije isključuju dijagnozu KOPB-a. U tim slučajevima potrebno je učiniti reevaluaciju nalaza i dijagnostiku u cilju nalaženja drugih mogućih uzroka opstruktivnih smetnji ventilacije, u prvom redu astme. Krivulje protok-volumen i protok-vrijeme u KOPB-u pokazuju karakterističan nalaz za opstruktivne smetnje ventilacije.
Difuzijski kapacitet pluća za ugljični monoksid (DLCO) ukazuje na stanje difuzije respiracijskih plinova preko alveolokapilarne membrane. Test se izvodi tako da bolesnik udiše malu količinu ugljikovoga monoksida (CO), zadrži dah kroz 10 sekundi i potom izdiše u aparat koji ima sposobnost mjerenja koncentracije CO. Kod osoba sa zdravim plućima (tj. alveolokapilarnom membranom) udahnuti CO brzo se apsorbira te ga gotovo nema u izdahnutom zraku. S obzirom na to da pri emfizemu pluća dolazi do smanjenja respiratorne površine, nalazimo smanjen DLCO. Test nije specifičan za KOPB, ali ukazuje na postojanje emfizema pluća.
Radiološka dijagnostika. Klasični radiogram pluća početno ne pokazuje specifične promjene, no kasnije se mogu pojaviti klasični znakovi hiperinflacije pluća s nisko položenom i zaravnjenom dijafragmom te se ponekad mogu registrirati bule. Uloga klasičnoga radiograma pluća leži i u pomoći pri diferencijalnoj dijagnozi drugih bolesti spram KOPB-a. Kompjuterizirana tomografija visoke rezolucije (HRCT) nema veću ulogu u dijagnostici KOPB-a, osim u pogledu procjene distribucije emfizema ili pogledu planiranja kirurškoga liječenja (bulektomija, smanjenje volumena pluća).
Kardiološka dijagnostika. S obzirom na to da kod bolesnika s KOPB-om često dolazi i do razvoja srčane patologije, potrebno je provesti kardiološku evaluaciju bolesnika, a pri tome se misli na elektrokardiogram i ehokardiografiju. Na EKG-u bolesnika s KOPB-om mogu se naći znaci opterećenja desnoga srca: desna električna os, blok desne grane, znaci dilatacije desnoga atrija (P-pulmonale) te znaci hipertrofije desnoga ventrikula. Ehokardiografija omogućava morfološku analizu desne strane srca, kao i funkcionalnost pulmonalne i trikuspidalne valvule jer njihova insuficijencija može ukazivati na plućnu hipertneziju i cor pulmonale.
Dijagnostika deficijencije α1-antitripsina podrazumijeva određivanje vrijednosti α1-antitripsina u krvi, kao i genotipa (MM, MZ ili ZZ), a indicirana je kod bolesnika kod kojih se bolest javi u ranijoj životnoj dobi, osobito ako se radi o nepušačima i osobama bez drugih sumnjivih rizičnih čimbenika.
Procjena težine KOPB-a na temelju spirometrije. Prema GOLD inicijativi, težinu KOPB-a procjenjujemo na osnovi postbronhodilatacijske vrijednosti FEV1. Prema vrijednosti FEV1 razlikujemo četiri stupnja bolesti: blagi, umjereni, teški i vrlo teški. Klasifikacija je prikazana u Tablici 2.10.
|
Tablica 2.10. Klasifikacija KOPB-a prema težini bolesti
|
|
Stupanj
|
Težina
|
Vrijednosti FEV1
|
|
GOLD I
|
Blagi
|
FEV1 ≥ 80 %
|
|
GOLD II
|
Umjereni
|
50 % ≤ FEV1 < 80 %
|
|
GOLD III
|
Teški
|
30 % ≤ FEV1 < 50 %
|
|
GOLD IV
|
Vrlo teški
|
FEV1 < 30 %
|
Procjena težine KOPB-a na temelju simptoma. Simptomi bolesnika s KOPB-om također su presudni za procjenu težine same bolesti, kao i za procjenu rizika od budućih egzacerbacija i drugih nepovoljnih ishoda bolesti, uključujući i smrtni ishod. U procjeni simptoma preporučuju se pojednostavljeni standardizirani upitnici. S obzirom na to da je KOPB bolest koju najbolje karakterizira dispneja, preporučuje se uporaba mMRC skale (engl. modified Medical research concil) koja dispneju kategorizira u pet stupnjeva (0 – 4). Međutim, kako nemaju svi bolesnici dispneju, smatra se da simptome KOPB-a bolje odražavaju upitnici koji uzimaju u obzir i druge simptome. Najpoznatiji takav upitnik je SGRQ upitnik koji je dosta složen te se koristi samo za potrebe kliničkih istraživanja. U svakodnevnoj praksi primjenjiv je njegov pojednostavljen oblik CAT upitnik (engl. COPD assesement test) koji ima osam jednostavnih pitanja kojima se rangira intenzitet simptoma od 0 do 5, a vrlo dobro korelira s SGRQ upitnikom. Pored procjene samih simptoma, vrlo je važna i procjena rizika od egzacerbacija s obzirom na to da su one važan prognostički čimbenik. Smatra se da je najbolji pokazatelj budućih egzacerbacija broj egzacerbacija u proteklih 12 mjeseci tako da dvije ili više egzacerbacije u proteklih 12 mjeseci upućuju na povećan rizik od egzacerbacija. Rizik egzacerbacija povećava se i sa stupnjem opstrukcije prema spirometrijskom nalazu, kao i pogoršanjem ograničenja protoka kroz dišne puteve.
Kombinirana procjena težine KOPB-a. Nakon postavljanje dijagnoze KOPB-a potrebna je cjelovita procjena težine KOPB-a koja uključuje procjenu ograničenja protoka zraka kroz dišne puteve (na temelju postbronhodilatacijskoga FEV1) te procjene simptoma i rizika od egzacerbacija (na temelju upitnika) kako je shematski (Slika 2.4.). To predstavlja ključni korak prije početka liječenja s obzirom na to da se temelji na ABCD pristupu (GOLD smjernice).
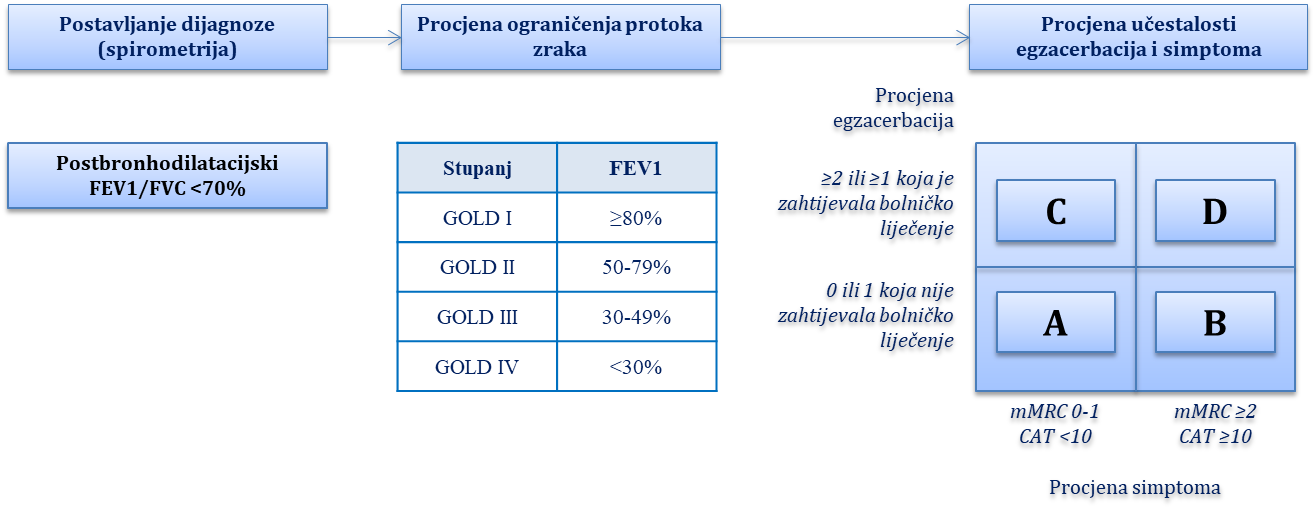
Slika 2.4. Kombinirana procjena težine KOPB-a i pristup bolesniku
Diferencijalna dijagnoza. Diferencijalna dijagnoza dispnoičnoga bolesnika i bolesnika s produktivnim kašljem poprilično je široka. Najčešće diferencijalne dijagnoze koje dolaze u obzir kod ovih bolesnika su astma, kardijalna dekompenzacija i karcinom pluća, a treba misliti i na bronhiektazije, tuberkulozu i cističnu fibrozu. KOPB karakterizira pojava simptoma u srednjoj životnoj dobi, spora progresija simptoma, dispneja pri naporu te ireverzibilna bronhoopstrukcija. Astmu karakterizira pojava prvih simptoma još u djetinjstvu, varijabilnost simptoma (jače izraženi noću i ujutro), konkomitentna pojava rinokonjuktivitisa, pozitivna obiteljska anamneza te reverzibilna bronhoopstrukcija. Kardijalnu dekompenzaciju karakterizira auskultacijski nalaz na plućima (diskretne krepitacije i vlažni hropci bazalno obostrano), uvećana srčana sjena i znakovi zastoja na radiografskoj snimci pluća te restriktivni poremećaj plućne funkcije.
Liječenje. Terapijski pristup bolesniku s KOPB-om ovisi o samoj težini bolesti i učestalosti egzacerbacija. Stabilne bolesnike liječimo ambulantno, dok bolesnike s egzacerbacijom liječimo uglavnom hospitalno. Osnovi principi liječenja su: prestanak pušenja, medikamentozna terapija (bronhodiltatori, kortikosteroidi, roflumilast, antibiotici, ostala medikamentozna terapija), oksigenoterapija, plućna rehabilitacija te kirurško liječenje.
Prestanak pušenja osnovni je korak u liječenju bolesnika s KOPB-om. Prestanak pušenja čak i u uznapredovalim fazama bolesti može imati pozitivan učinak na kontrolu simptoma i učestalost egzacerbacija. Rijetki su bolesnici koji samostalno uspiju prestati pušiti i ustraju u tome (svega oko 5 %). Ostalima na raspolaganju stoje bihevioralni psihoterapijski pristup, kao i medikamentna potpora u vidu supstitucije nikotina (transdermalni naljepci, žvake, nazalni sprej) s ili bez primjene specifičnih lijekova kao što je vareniklin (agonist nikotinskih acetilkolinskih receptora) ili bupropion (antidepresiv, selektivni inhibitor ponovne pohrane katekolamina). Uloga elektronskih cigareta u postupku odvikavanja od pušenja ili kao zamjene za pušenje nije klinički ispitana.
Bronhodilatatori su glavni lijekovi za liječenje KOPB-a. Dokazano poboljšavaju kontrolu simptoma te povećavaju toleranciju napora kod bolesnika s KOPB-om, no nemaju utjecaj na sam tijek bolesti i oporavak plućne funkcije. Oni povećavaju FEV1 te poboljšavaju i olakšavaju ekspirij čime smanjuju hiperinflaciju pluća. Doza i učestalost primjene ovise o stanju bolesnika i uznapredovalosti bolesti te se sukladno tome koriste bronhodilatatori kratkoga i dugoga djelovanja. To su lijekovi iz skupine β2 agonista i antikolinergika, a mogu se primjenjivati samostalno ili u kombinaciji (danas većinom postoje tvorničke kombinacije ovih lijekova što olakšava njihovu primjenu). U bronhodilatatore ubrajamo i teofilin te aminofilin koji se danas sve rjeđe koriste kod ovih bolesnika.
Najčešće korišteni bronhodilatatori kratkoga djelovanja su β2 agonisti – SABA (salbutamol) te antikolinergici – SAMA (ipratropij bromid). Načelno se preferira primjena ipratropij bromida kod ovih bolesnika zbog duljega terapijskog učinka te zbog toga što ne izaziva simpatomimetičke nuspojave, kao što su tahikardija, tremor i hipokalijemija. Doze lijekova za kroničnu terapiju navedene su u Tablici 2.11.
Bronhodilatatori dugoga djelovanja preferiraju se kod bolesnika s teškim i vrlo teškim oblikom KOPB-a, odnosno kada se kontrola simptoma ne može postići primjenom kratkodjelujućih bronhodilatatora. Na raspolaganju su preparati β2 agonista – LABA (formoterol, salmeterol, indakaterol, arformoterol, vilanterol) te antikolinergika – LAMA (tiotropij, glikopiron, aklidin, umeklidin). Primjena LAMA-a pokazuje bolji učinak u pogledu redukcije egzacerbacija u odnosu na LABA-u, a kombinacijska primjena LABA/LAMA pokazuje bolji učinak od monoterapije.
|
Tablica 2.11. Najčešće korišteni bronhodilatatori u liječenju KOPB-a
|
|
Bronhodilatatori kratkoga djelovanja
|
|
Salbutamol
|
Ventolin®
|
1 inhalacija (200 mcg) do 4 x dnevno
|
|
Ipratropij
|
Atrovent®
|
1 - 2 inhalacije (20 do 40 mcg) 3 do 4 x dnevno
|
|
Bronhodilatatori dugoga djelovanja
|
|
Salmeterol
|
Serevent®
|
1 inhalacija (50 mcg) 2 x dnevno
|
|
Formoterol
|
Atimos®, Fortulin®
|
1 inhalacija (12 mcg) 2 x dnevno
|
|
Indakaterol
|
Hirobriz®, Onbre®z, Oslif®
|
1 inhalacija (150 mcg) 1 x dnevno
|
|
Tiotropij
|
Spiriva®, Braltus®
|
1 inhalacija (10 mcg) 1 x dnevno
|
|
Aklidin
|
|
1 inhalacija (322 mcg) 2 x dnevno
|
|
Umeklidin
|
Incruse®, Rolufta®
|
1 inhalacija (55 mcg) 1 x dnevno
|
|
Glikopiron
|
Enurev®, Seebri®, Tovanor®
|
1 inhalacija (44 mcg) 1 x dnevno
|
|
Najčešće kombinacije antikolinergika i β2 agonista
|
|
Ipratropij/salbutamol
|
Cipla inhalacije®
|
1 inhalacija (0,5 mg/2,5 mg) 3 do 4 x dnevno
|
|
Indakaterol/glikopiron
|
Ultibro®, Ulunar®, Xoterna®
|
1 inhalacija (85 mcg/43 mcg) 1 x dnevno
|
|
Formoterol/aklidin
|
Brimica®, Duaklir®
|
1 inhalacija (340 mcg/12 mcg) 2 x dnevno
|
Glavne nuspojave β2 agonista su tremor, tahikardija i umjerena hipokalijemija, a antikolinergika midrijaza, zamagljen vid i suhoća usta.
Teofilin (metilksantin) je slabi sistemski simpatomimetik koji se uvodi kao dodatni lijek kada se kontrola simptoma ne može postići primjenom β2 agonista, antikolinergika i inhalacijskih kortikosteroida. Primjenjuje se u obliku tableta, peroralno. Dokazano je da primjena teofilina poboljšava saturaciju hemoglobina kisikom tijekom noći te je koristan kod bolesnika s pretežno noćnim simptomima. Osim bronhodilatacijskoga učinka, teofilin ima i protuupalni učinak. Primjenu teofilina karakterizira uzak terapijski prozor i mogući toksični učinak stoga je potrebno povremeno provjeravati koncentraciju lijeka u serumu: terapijske vrijednosti su 8 do 12 mcg/mL, a toksični učinak nastaje kod vrijednosti iznad 20 mcg/mL (supraventrikulske i ventrikulske aritmije, konvulzije). Liječenje se započinje s dozom od 2 x 150 mg te se postupno može povećavati do doze od 2 x 300 mg.
Kortikosteroidi. Inhalacijski kortikosteroidi (ICS), kao i bronhodilatatori, pokazuju pozitivan učinak kod ovih bolesnika u vidu smanjenja simptoma te učestalosti egzacerbacija, iako ne utječu na tijek bolesti i plućnu funkciju. Također, učinak je znatno slabije izražen nego kod bolesnika s astmom, a zabilježena je i veća učestalost pneumonija. Primjena ICS-a kao monoterapije danas se ne preporuča, već se oni uglavnom kombiniraju s bronhodilatatorima dugoga djelovanja. Kod bolesnika s teškim KOPB-om i učestalim egzacerbacijama kombinirana primjena ICS-a i LABA-e znatno je učinkovitija u pogledu poboljšanja plućne funkcije, zdravstvenoga statusa i smanjenja broja egzacerbacija u odnosu na njihovu samostalnu primjenu. Također, danas se sve više koristi i trostruka terapija koja uključuje ICS, LAMA i LABA. Najčešće se primjenjuju flutikazon u dozi od 500 do 1000 mcg/dan te beklometazon u dozi od 400 do 2000 mcg/dan. Najčešće nuspojave inhalacijskih ICS lijekova su gljivične infekcije usne šupljine i gornjih dišnih puteva što često dovodi do promuklosti (zbog toga se nakon inhalacije lijeka preporuča isprati usnu šupljinu vodom). Sistemska primjena kortikosteroida (intravenski, peroralno) indicirana je samo u slučajevima egzacerbacije KOPB-a (opisano kasnije). Iako to nije dokazano, dugotrajna primjena ICS-a kod ovih bolesnika može biti povezana s nuspojavama kao što su osteoporoza i katarakta. U predviđanju odgovora bolesnika na ICS danas se vodimo vrijednostima eozinofila u perifernoj krvi. Za bolesnike koji imaju manje od 100 eozinofila/µL smatramo da će imati lošiji odgovor na ICS u odnosu na bolesnike koje imaju više od 300 eozinofila/µL. Indikacije i preporuke za primjenu ICS-a kod ovih bolesnika prikazane su u Tablici 2.12.
|
Tablica 2.12. Primjena ICS-a kod bolesnika s KOPB-om
|
|
Primjena ICS-a je opravdana
|
Primjenu ICS-a treba razmotriti
|
Primjena ICS-a se ne preporuča
|
|
Anamneza hospitalnoga liječenja egzacerbacije KOPB-a;
≥ 2 umjerene egzacerbacije KOPB-a tijekom jedne godine;
> 300 eozinofila/µL u perifernoj krvi;
Astma u osobnoj anamnezi.
|
1 umjerena egzacerbacija KOPB-a tijekom jedne godine;
100 - 300 eozinofila/µL u perifernoj krvi.
|
Učestale pneumonije;
< 100 eozinofila/µL u perifernoj krvi;
Anamneza infekcije mikobakterijama.
|
Roflumilast pripada skupini nesteroidnih protuupalnih lijekova, a djeluje kao inhibitor PDE4, enzima koji je prisutan u strukturnim i upalnim stanicama važnima za patogenezu KOPB-a. Njegovom inhibicijom smanjuje se upalni odgovor bez utjecaja na bronhodilataciju. Indiciran je u terapiji održavanja teških oblika KOPB-a (postbronhodilatacijski FEV1 manji od 50 %, dominacija kroničnoga bronhitisa u kliničkoj slici, učestale egzacerbacije u anamnezi). Koristi se kao dodatak bronhodilatacijskoj terapiji. Preporučena doza je 1 x 500 mcg/dan. Najčešće nuspojave su mučnina, proljev i povraćanje, a dugotrajna primjena lijeka može dovesti i do smanjenja tjelesne težine.
Antibiotici. Recentne studije pokazuju da redovita primjena nekih antibiotika može dovesti do smanjenja učestalosti egzacerbacija KOPB-a. U tom pogledu najviše se ističe primjena makrolida, i to azitromicina (250 mg dnevno ili 500 mg tri puta tjedno) i eritromicina (500 mg dva puta na dan) tijekom perioda od jedne godine. Primjena tih antibiotika povezana je s povećanjem bakterijske rezistencije na makrolide, prolongacijom QT-intervala te oštećenjem sluha. Aktivni pušači imaju manju korist od opisane primjene ovih antibiotika u odnosu na ostale bolesnike.
Ostala medikamentozna terapija. S obzirom na povećanu produkciju sluzni i otežanoga iskašljavanja, bolesnicima se preporuča uzimanje ekspektoranasa (mukolitik) te odgovarajuća hidracija. Kod edematoznih bolesnika preporuča se primjena diuretika. Nema dokaza o povoljnom učinku primjene vitamina D na klinički tijek i učestalost egzacerbacija u ovih bolesnika.
Oksigenoterapija. Primjena kisika je jedina terapijska mjera kod bolesnika s KOPB-om koja je pokazala pozitivan utjecaj na sam tijek bolesti, tj. poboljšanje ishoda u smislu duljeg preživljenja, smanjenoga broja hospitalizacija i poboljšane kvalitete života. Preživljenje je u direktnom suodnosu s brojem sati provedenih na oksigenoterapiji, tako da se najbolji rezultati bilježe kod konstantne 24-satne primjene kisika (preživljenje nakon 36 mjeseci iznosi 65 % u odnosu na 45 % kod bolesnika koji su kisik primali samo noću). Za zadovoljavajući učinak preporuča se primjena kisika kroz najmanje 19 sati tijekom dana i to u protoku između 1 i 3 L/min preko nosnoga katetera. Glavne indikacije za oksigenoterapiju su: a) PaO2 manji od 7,3 kPa (55 mmHg) na sobnom zraku (preporuča se opetovano mjerenje s razmakom od tri tjedna i uz odgovarajuću medikamentnu terapiju), b) PaO2 između 7,3 i 8 kPa kod bolesnika s policitemijom, noćnom hipoksemijom, perifernim edemima ili plućnom hipertenzijom te c) koncentracija karboksihemoglobina manja od 3 % (kod bolesnika koji su prestali pušiti). Također, oksigenoterapiju se može provoditi i kod bolesnika koji imaju uredne vrijednosti PaO2 ili neznatno snižene vrijednosti u mirovanju, ali koji postaju značajno hipoksemični u naporu. Kod njih se oksigenoterapija primjenjuje za vrijeme napora što rezultira povećanjem tolerancije napora, kao i bržim oporavkom nakon njega. Oksigenoterapija se može provoditi i u kućnim uvjetima uz odgovarajuću opremu (koncentratori kisika, sistemi tekućega kisika, boce s komprimiranim plinom, pulsni oksimetar).
Plućna rehabilitacija poželjna je kod svih bolesnika s KOPB-om i danas postoje posebno educirani fizioterapeuti koji ju provode. Aerobne vježbe (hodanje ili biciklizam minimalno kroz 20 minuta tri puta tjedno) pomažu bolesnicima u održavaju tjelesne kondicije. Vježbe disanja i poticanje iskašljavanja (drenažni položaji, perkusija prsnoga koša i sl.) pomažu u kontroli i olakšavanju simptoma. Intenzitet mjera plućne rehabilitacije mora se prilagođavati težini bolesti i bolesnikovoj kondicijskoj spremnosti.
Kirurško liječenje KOPB-a rijetko je indicirano i nije često u kliničkoj praksi, a na raspolaganju su bulektomija, redukcija plućnoga volumena te transplantacija pluća. Osim toga, danas su na raspolaganju i različiti endoskopski (bronhoskopski) zahvati kojima se nastoji reducirati hiperinflacija kod bolesnika s teškim efizemom (engl. endobronchial valve placement, lung coil, vapor ablation).
Bulektomija je indicirana kod bolesnika s teškim buloznim emfizemom uz uvjet da bolesnik ima veliku bulu koja zauzima 30 do 50 % hemitoraksa. Kirurško uklanjanje takve bule može dovesti do simptomatskoga poboljšanja, ali ne utječe na konačni ishod (palijativni postupak).
Redukcija plućnoga volumena (redukcijska pneumoplastika) indicira se kod bolesnika s teškim buloznim emfizemom i dokazanom hiperinflacijom. Zahvat se sastoji od bilateralne resekcije koja zahvaća 20 - 30 % plućnoga krila, a dokazano pokazuje prolazno poboljšanje plućne funkcije, smanjenje simptoma te bolju toleranciju napora. Mortalitet vezan uz sam zahvat kreće se između 5 i 10 % u centrima koji imaju iskustva u takvim zahvatima. Kod oba gore navedena zahvata smanjenjem plućnoga volumena smanjuje se i intratorakalni prostor što omogućava bolji položaj dijafragme i tako neizravno potpomaže rad disanja.
Transplantacija pluća indicira se u rijetkim slučajevima, a za to mora biti zadovoljeno više uvjeta: bolest u vrlo teškom stadiju, značajna limitiranost dnevnih aktivnosti, iscrpljene metode medikamentnoga liječenja, limitirano trajanje života bez transplantacije, odgovarajuća funkcija ostalih organskih sustava te dobar socijalni status i mogućnost daljnje skrbi za bolesnika. Zahvati se izvode u posebnim medicinskim centrima. Dvogodišnje preživljenje nakon transplantacije pluća u ovih bolesnika iznosi 75 %, a najčešće komplikacije su odbacivanje transplantata, oportunističke infekcije i obliterirajući bronhiolitis.
Ostale terapijske mogućnosti i napomene. Kod svih bolesnika s KOPB-om preporučeno je redovno godišnje cijepljenje protiv gripe te primjena polivalentnoga pneumokoknog cjepiva. Liječenje KOPB-a kod bolesnika s deficijencijom α1-antiripsina provodi se primjenom humanoga α1-antitripsina i to u dozi od 60 mg/kg intravenski jednom tjedno, indicirano je kod bolesnika koji imaju vrijednosti α1-antitripsina manje od 310 mg/L i patološki nalaz plućne funkcije. Kod bolesnika sa sekundarnom policitemijom i visokim hematokritom preporuča se venepunkcija. Bolesnicima s teškom dispnejom, unatoč optimalnoj medikamentnoj terapiji, mogu se dati opioidi (5 - 10 mg morfija ili 5 - 10 mg oksikodona svakih 4 do 6 sati ili morfij u SR formulaciji 10 mg 1 x dnevno). U nekim se slučajevima može pokušati s primjenom neinvazivne mehaničke ventilacije u kućnim uvjetima (NIV-CPAP). Kod bolesnika koji planiraju na put zrakoplovom preporuča se provesti test disanjem sa zrakom koji sadrži 15 % kisika te se preporuča oprez pri letenju ako se registrira saturacija manja od 85 % unutar 15 minuta od početka testa, tj. preporuča se primjena kisika tijekom leta.
Noćna hipoksija kod bolesnika s KOPB-om. Fiziološki, u REM fazi spavanja dolazi do pada saturacije i PaO2 što kod bolesnika s KOPB-om s od ranije postojećom hipoksemijom dovodi do negativnih ishoda. Kod tih bolesnika tijekom noći PaO2 može pasti i na 2,5 kPa. Razlozi za takvu noćnu desaturaciju su višestruki i povezani su za događaje vezane uz REM fazu spavanja i njezin utjecaj na disanje (inhibicija respiracijskih mišića, plitko disanje, gubitak mišićnoga tonusa i povećan otpor u dišnim putevima). Pojava takvih, značajnih hipoksemija za vrijeme spavanja povezana je s povećanom plućnom vazokonstrikcijom, pogoršanjem plućne hipertenzije te posljedično većim srčanim naprezanjem što može uzrokovati maligne poremećaje ritma s letalnim završetkom. Takve je bolesnike ključno prepoznati jer pravovremeno uključivanje noćne oksigenoterapije ili primjena neinvazivne ventilacije (CPAP) za vrijeme spavanja mogu biti ključni za prevenciju iznenadne smrti.
Liječenje KOPB-a temeljeno na GOLD smjernicama. Globalna inicijativa za kroničnu plućnu bolest ili GOLD (engl. Global initiative for chronic obstructive lung disease) predstavlja organizaciju unutar Svjetske zdravstvene organizacije koja izrađuje smjernice za dijagnostiku i liječenje KOPB-a. Daljnji tekst je utemeljen na smjernicama objavljenima 2020. godine.
Temeljni ciljevi liječenja bolesnika s KOPB-om su smanjenje simptoma, poboljšanje tolerancije tjelesnoga napora, poboljšanje općega zdravstvenog stanja te prevencija progresija bolesti, smanjivanje broja egzacerbacija te u konačnici smanjivanje ukupne smrtnosti ovih bolesnika. Osnovni koncept liječenja prikazan je shematski (Slika 2.5.).

Slika 2.5. Shematski prikaz liječenja bolesnika s KOPB-om
Inicijalno liječenje. Inicijalno liječenje temelji se na osnovi tzv. ABCD kategorizacije bolesnika. To podrazumijeva da sve bolesnike s KOPB-om na temelju njihovih simptoma i učestalosti egzacerbacija svrstavamo u četiri skupine koje označavamo slovima A, B, C i D. ABCD kategorizacija bolesnika s KOPB-om temelji se na dva osnovna parametra: procjeni simptoma te na osnovi učestalosti egzacerbacija, kako je to opisano prethodno u tekstu. Inicijalno liječenje bolesnika s KOPB-om prikazano je shamtski (Slika 2.6.).

Slika 2.6. Inicijalna farmakoterapija bolesnika s KOPB-om
Daljnje liječenje i prilagodba farmakoterapije. Nakon uvođenja inicijalne farmakoterapije prema ABCD pristupu, kako je prethodno opisano, i primjene ostalih metoda i mjera liječenja daljnja se farmakoterapija prilagođava simptomima i egzacerbacijama nevezano uz ABCD pristup. Revizija i promjena načina liječenja može nastupiti jako rano, čim se procijeni da inicijalna terapija ne daje rezultate i nema uspjeha. Navedena procjena temelji se na prisutnosti i dominaciji dispneje ili egzacerbacija. Ako se kod istoga bolesnika pojavljuju i dispneja i egzacerbacije, prednost se daje algoritmu liječenja egzacerbacija. Navedeni algoritmi prikazani su shematski (Slika 2.7.).
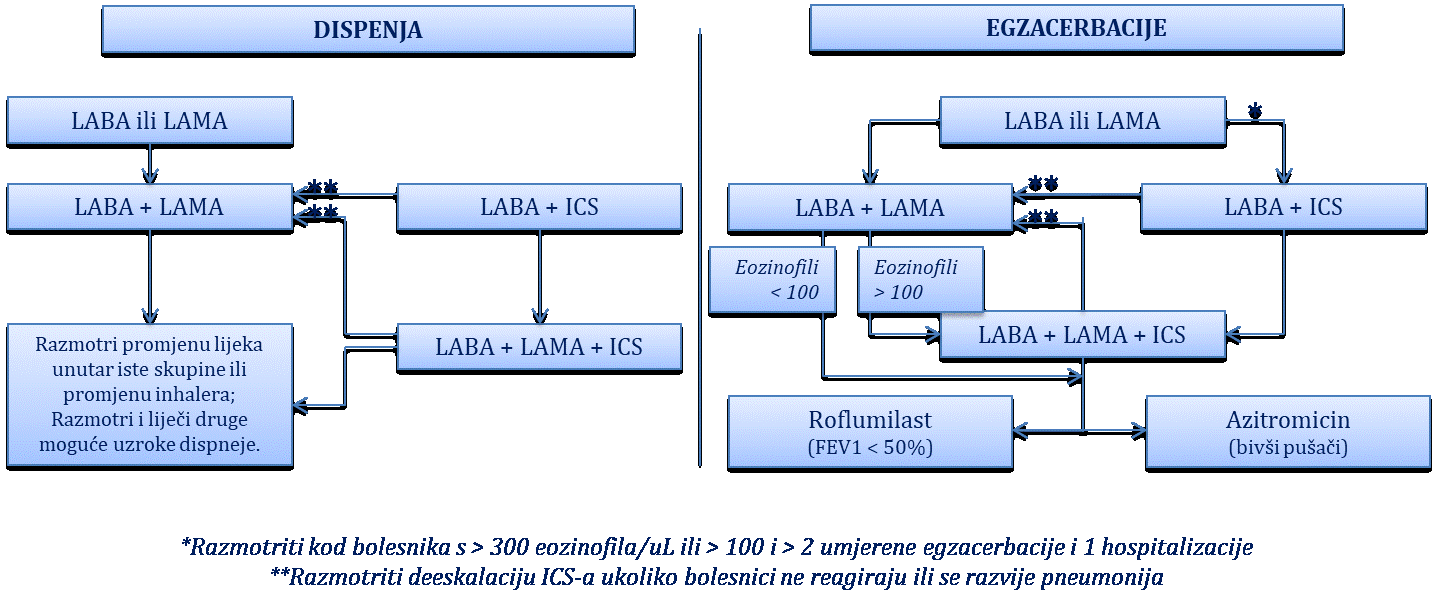
Slika 2.7. Shematski prikaz daljnjega liječenja i prilagodbe farmakoterapije
Prognoza. KOPB je kronična progresivna bolest s lošim ishodom. Bolesnici koji imaju FEV1 manji od 1 L imaju medijan četverogodišnjega preživljenja oko četiri godine. Prestanak pušenja i oksigenoterapija su jedini postupci koji mogu utjecati na produljenje života, dok odgovarajuća bronhodilatacijska terapija s ili bez kortikosteroida utječe samo na kontrolu simptoma i poboljšanje kvalitete života. Terminalna faza ovih bolesnika predstavlja velik stres i za obitelj i samoga bolesnika te zahtijeva posebnu pozornost i palijativnu skrb.
SINDROM PREKLAPANJA ASTME I KRONIČNE OPSTRUKTIVNE BOLESTI PLUĆA
Definicija i epidemiologija. Sindrom preklapanja astme i kronične opstruktivne bolesti pluća (ACOS, engl. Asthma-COPD overlap syndrome) predstavlja opstruktivnu bolest pluća koju karakterizira varijabilna, nepotpuna i reverzibilna bronhoopstrukcija. U tu skupinu bolesnika pripadaju bolesnici koji imaju astmu s djelomično ireverzibilnom opstrukcijom te bolesnici s KOPB-om koji pokazuju određeni stupanj reverzibilne opstrukcije. Najčešće se radi o pušaču koji ima postavljenu dijagnozu astme prije 40. godine života, a u starijoj dobi ispunjava kriterije za postavljanje dijagnoze KOPB-a. Kako su i astma i KOPB bolesti čija se incidencija i prevalencija stalno povećavaju, smatra se da je i učestalost ovoga sindroma sve veća, iako još nema konkretnih podataka. Prosječna dob postavljanja dijagnoze ACOS-a je unutar petoga desetljeća (nešto viša nego kod astmatičara, a niža nego kod bolesnika s KOPB-om).
Etiopatogeneza. Do sada nije jasno predstavlja li ACOS jedinstvenu bolest ili se radi o različitoj ekspresiji astme, odnosno KOPB-a. Glavni rizični čimbenici za razvoj ACOS-a su nedostatan intrauterini razvoj pluća i razvoj pluća u ranom djetinjstvu (genetska predispozicija, izloženost duhanskom dimu, nedostatak nutrijenata i antioksidansa, niska porođajna težina) te utjecaj okolišnih čimbenika (pušenje, izloženost okolišnim zagađivačima i alergenima, virusne infekcije i infekcije atipičnim bakterijama). Ti čimbenici mogu djelovati neovisno, ali vjerojatniji je njihov međusobni singeristički učinak. Konačni ishod njihova djelovanja nastanak je kronične upale dišnih puteva i posljedična remodelacija dišnih puteva s nastankom manjega ili većeg stupnja reverzibilnosti bronhoopstrukcije.
Kliničke karakteristike i dijagnoza. Simptomi bolesti istovjetni su onima koje nalazimo i pri astmi i pri KOPB-u, a to su kašalj, iskašljavanje, otežano disanje, pritisak u prsima te nepodnošenje napora. Jedno od karakterističnijih obilježja je i dispneja koja se pogoršava pri naporu i smiruje pri mirovanju. Za postavljanje dijagnoze nužni su temeljito uzeta anamneza i klinički pregled bolesnika, kao i procjena plućne funkcije (spirometrija s brohodilatacijskim testom) te druge specifične pretrage (FeNO test, DLCO, alergijsko testiranje). ACOS obilježava jedan od dva fenotipa: 1) bolesnik s astmom i nepotpuno reverzibilnom opstrukcijom, s ili bez emfizema i reduciranoga DLCO-a te 2) bolesnik s KOPB-om i emfizemom uz djelomično reverzibilnu opstrukciju s ili bez prisutnih alergija i reduciranoga DLCO-a. Kriteriji za postavljanje dijagnoze ACOS-a prikazani su u Tablici 2.13.
|
Tablica 2.13. Kriteriji za postavljanje dijagnoze ACOS-a*
|
|
Veliki kriteriji
|
Mali kriteriji
|
|
1) Vrlo pozitivan bronhodilatacijski test salbutamolom: porast FEV1 minimalno 15 % i 400 ml u odnosu na bazične vrijednosti;
2) Astma u anamnezi prije 40. godine života;
3) Eozinofilija u sputumu.
|
1) Vrijednosti ukupoga IgE veće od 100 IU;
2) Sklonost atopiji;
3) Pozitivan bronhodilatacijski test salbutamolom: porast FEV1 > 12 % i 200 ml u dva odvojena mjerenja;
4) Eozinofili u serumu veći od 5 %.
|
* ACOS je vjerojatan ako su prisutna dva velika i jedan mali kriterij ili jedan veliki i dva mala kriterija.
Osobitosti liječenja ACOS-a. Trenutno ne postoje opće prihvaćene smjernice za liječenje ovih bolesnika. Kod svih treba provoditi opće mjere kao što je izbjegavanje provocirajućih čimbenika, prestanak pušenja, provođenje plućne rehabilitacije te redovno cijepljenje protiv gripe i pneumokoka. Temelj liječenja ovih bolesnika, slično kao i kod astme, čine inhalacijski kortikosteroidi uz dugodjelujuće beta agnostike (LABA). Kod svakoga bolesnika sa sumnjom na ACOS treba započeti liječenje prema smjernicama za astmu. Odabir lijekova i njihova doza ovisi o postignutoj kontroli bolesti, nalazima plućne funkcije, kao i o vrijednosti eozinofila u sputumu (povišene vrijednosti eozinofila u sputumu prediktor su dobroga odgovora na inhalacijske kortikosteroide).
Među plućne infekcije ubrajamo akutni traheobronhitis, akutne upale pluća, plućni apsces, tuberkulozu pluća, infekcije pluća drugim mikobakterijama te gljivične infekcije pluća.
AKUTNI TRAHEOBRONHITIS
Definicija i epidemiologija. Akutni traheobronhitis predstavlja akutnu, kratkotrajnu upalu sluznice traheje i/ili bronha koja je često udružena s akutnim infekcijama gornjih dišnih puteva. Bolest se češće javlja tijekom hladnih mjeseci čemu pridonosi boravak i zadržavanje osoba u zatvorenim prostorima što olakšava kapljični put prijenosa uzročnika.
Etiologija. Najčešći uzročnici akutnoga traheobronhitisa su virusi i to adenovirusi, respiratorni sincicijski virusi te virusi parainfluenze. Bakterije (Streptococcus pneumoniae, Haemophylus influenzae) znatno rjeđe uzrokuju traheobronhitis, najčešće kao superponirana infekcija na prethodnu virusnu ili kod ugroženih osoba (pušači, kronična opstruktivna plućna bolest, imunokompromitiranost). Rijetko, traheobronhitis može biti uzrokovan inhalacijom iritantnih plinova (amonijak, sumporov dioksid, bojni otrovi).
Patogeneza. Uzročnici svojim direktnim ili indirektnim učinkom dovode do klasične upalne reakcije s posljedičnim edemom, hipersekrecijom te hiperemijom sluznice. Ako je jače izražen, edem može dovesti i do prolaznih opstruktivnih smetnji disanja. Gnojna eksudacija iznimno je rijetka. Bolest uglavnom spontano prolazi uz potpuni oporavak. Kod bolesnika s KOPB-om može se razviti egzacerbacija bolesti.
Klinička slika. Kod virusne etiologije u kliničkoj slici najprije dominiraju kataralni simptomi (subfebrilnost, grlobolja, rinoreja, podražaj konjuktiva) na što se obično nadovezuje kašalj koji je u prvim danima suh i neproduktivan, da bi kroz nekoliko dana postao produktivan s žućkasto-zelenkastim iskašljajem. Bolesnici se mogu žaliti na nelagodu pri disanju te piskanje prilikom ekspirija. Bakterijska etiologija praćena je visokom temperaturom i pogoršanjem osnovnih simptoma. Bolest obično spontano prolazi kroz nekoliko dana.
Dijagnoza se prvenstveno postavlja na osnovi kliničke slike i fizikalnoga pregleda (pooštreno disanje, produljen ekspirij, bronhalni zvižduci u inspiriju). U laboratorijskim nalazima može se naći umjerena leukocitoza i umjereno povišeni C-reaktivni protein. Radiološka snimka pluća je uredna. Mikrobiološka dijagnostika (obrada sputuma) indicirana je samo kod visoke sumnje na bakterijsku infekciju.
Liječenje je prvenstveno simptomatsko (mirovanje, obilna hidracija, ekspektorancije). Kod sumnje na bakterijsku infekciju te kod rizičnih osoba indicirana je antimikrobna terapija, a antibiotik izbora je amoksicilin 250 mg 3 x/dan.
AKUTNE UPALE PLUĆA
Uvod. Pneumonija je naziv za upalu pluća koja može biti uzrokovana bakterijama, virusima ili gljivicama. Radi se o učestaloj bolesti u općoj populaciji koju zbog svojih epidemioloških, ali i kliničkih posebnosti dijelimo u dvije skupine: domicilne pneumonije i nozokomijalne (hospitalne) pneumonije. Posebnu skupinu čine pneumonije imunokompromitiranih osoba te aspiracijska pneumonija.
Patogeneza. U normalnim uvjetima, alveole i donji dišnu putevi su sterilni unatoč velikoj izloženosti različitim mikrobima. Tome pridonose fiziološki obrambeni mehanizmi kao što su kašalj i kihanje, aktivnost mukocilijarnoga aparata, djelovanje alveolarnih makrofaga te lučenje sekretornoga IgA protutijela. Prema tome, da bi infekcija nastala, mora biti zadovoljeno nekoliko kriterija: unos patogena u pluća, oslabljenost ili gubitak obrambenih mehanizama te izloženost virulentnim mikroorganizmima.
Unos patogena u pluća. Najčešći put unosa mikroba u dišni put aspiracija je mikroorganizmima koji koloniziraju orofarinks, a ostali, rjeđi putevi su direktna inhalacija uzročnika u dišni put, hematogena diseminacija iz drugih sijela (bakterijemija) te arteficijalni unos patogena u pluća (endotrahealna intubacija, traume prsnoga koša i sl.).
Oslabljeni obrambeni mehanizmi. Određenja stanja i bolesti dovode do smanjenja jednoga ili više obrambenih mehanizama dišnih puteva što stvara predispoziciju za razvoj infekcije. Takve bolesti i stanja su: starija životna dob (> 65 godina), alkoholizam, pušenje, pothranjenost, poremećaji stanja svijesti, kronične nezarazne bolesti (srčano popuštanje, šećerna bolest, maligne bolesti, kronično bubrežno zatajenje i dr.) te postojeće plućne bolesti (kronična opstruktivna plućna bolest, bronhiektazije, cistična fibroza, karcinom pluća, mehanička opstrukcija).
Virulencija patogena. Razvoj infekcije ovisi i o samome uzročniku, tj. njegovoj sposobnosti da izazove infekciju. Različiti patogeni mogu imati različite mehanizme koje ih čine virulentnijima: npr. lučenje toksina koji oštećuju i smanjuju aktivnost mukocilijarnoga aparata, mogućnost cijepanja IgA protutijela, inhibicija aktivnosti alveolarnih makrofaga, oštećenje epitelne barijere i sl.
Nakon dospijevanja patogena u alveole, alveolarni makrofagi ih fagocitiraju. Oni potom prezentiraju njihove antigene na svojoj površini te luče citokine koji dovode to kemotaksije drugih upalnih stanica (limfociti, neutrofili) te dolazi do nastanka upalne reakcije.
Patologija. Patološki gledano, razlikuju se dva oblika upalnoga procesa na plućima: alveolarni i intersticijski. Alveolarnu pneumoniju karakterizira upalni proces koji se dominantno odvija u samim alveolama, a uzrokuju ga klasične bakterije koje mogu opstati samostalno izvan stanica domaćina. Dolazi do stvaranja upalnoga eksudata koji se sastoji od upalnih stanica (alveolarni makrofagi, neutrofili, limfociti), bakterija, deskvamiranih epitelnih stanica, eritrocita, fibrina i drugih molekula. Eksudat ispunjava alveole, smanjuje respiratornu površinu i može dovesti do konsolidacije. Nasuprot tome, intersticijske pneumonije uzrokuju patogeni koji su isključivo intracelularni organizmi, tj. mogu opstati samo unutar stanica domaćina stoga inficiraju stanice intersticija pluća te je upalni proces dominantno ograničen na sam intersticij (edem, hiperemija). Takvi patogeni su atipične bakterije (mikoplazme, klamidije, legionele, rikecije) te virusi.
DOMICILNE (IZVANBOLNIČKE) PNEUMONIJE
Definicija. Domicilne ili izvanbolničke pneumonije su one koje nastaju u domicilnim (kućnim) uvjetima kod imunokompetentnih osoba, nisu stečene u bolničkim ili sličnim ustanovama. Među domicilne pneumonije ubrajamo i one pneumonije koje se razviju u bolnici, ali unutar 48 sati od prijema na hospitalno liječenje.
Epidemiologija. Radi se o relativno čestoj bolesti u općoj populaciji. Incidencija u Republici Hrvatskoj iznosi 1,1 do 1,4 % (stvarni broj vjerojatno je veći jer se dio pneumonija, osobito onih s lakšom kliničkom slikom niti ne dijagnosticira). Učestalost raste i u starijoj životnoj dobi te kod ostalih rizičnih skupina (kod kojih su prisutni alkoholizam, pušenje, kronične nezarazne bolesti, postojeće bolesti pluća i sl.). Također, smrtnost od pneumonije i njezinih komplikacija veća je u rizičnim skupinama.
Etiologija. Najčešći uzročnici domicilnih pneumonija su gram-pozitivne bakterije (Strepotococcus pneumoniae, Haemofilus influenzae, Staphylococcus aureus), gram-negativne bakterije (Proteus mirabilis, Klebsiella pneumoniae, Enterobacter species, Escherichia coli), atipične bakterije (Mycoplasma pneumoniae, Legionella pneumophila, Chlamydia pneumoniae, Coxiella burnetii) te virusi (virus influenze A i B, virusi parainfluenze, adenovirusi, respiratorni sincicijski virusi, koronavirusi). Istraživanja i studije pokazali su da je najčešći uzročnik domicilnih pneumonija među prethodno navedenima pneumokok, odnosno Streptococcus pneumoniae.
Klinička slika. U osnovi se klinička slika razlikuje između alveolarnih i intersticijskih pneumonija te se one u literaturi opisuju kao tipična i atipična pneumonija. Tipična klinička slika razvija se kod alveolarnih pneumonija i uzrokovana je klasičnim bakterijama, dok se atipična klinička slika razvija kod intersticijskih pneumonija i uzorkovana je atipičnim bakterijama i virusima.
Tipična klinička slika (tipična pneumonija). Početak bolesti je brz i nagao, razvija se visoko febrilno stanje uz tresavicu, zimicu i druge opće infektivne simptome (umor, algični simptomi, gubitak teka, herpes labialis i sl.). Bolesnici se tuže na bol u prsima i to na strani gdje se nalazi upala, a bol se pojačava pri dubokom udahu. Ovisno o težini upale razvija se i dispneja uz svoje vanjske manifestacije. Kašalj je početno neproduktivan, no kroz nekoliko dana postaje produktivan, a iskašljaj je gust, žuto-zelenkast. Kod teških pneumonija moguće su i hemoptize. Poremećaj stanja svijesti viđa se pri teškim pneumonijama s izraženom hipoksemijom.
Atipična klinička slika (atipična pneumonija). Početak bolesti je polagan, a simptomi nisu jako izraženi. Temperature su obično subfebrilne, a prisutan je neproduktivan, suhi kašalj. Bol u prsima često nije prisutna ili je prisutna, ali manje izražena. Dispneja je blaga i nema klasičnih vanjskih manifestacija.
Unatoč iznesenim opisima, u kliničkoj je praksi često nemoguće razlikovati alveolarnu od intersticijske pneumonije samo na osnovi kliničke slike, osobito kod starijih osoba. Kod starijih osoba treba imati na umu da se pneumonija ponekad može očitovati nesepcifičnim simptomima i znacima kao što su slabost, malaksalost te poremećaj funkcionalnoga i mentalnoga statusa.
Dijagnoza. Dijagnoza pneumonija počiva na anamnezi, fizikalnom pregledu, laboratorijskoj dijagnostici, radiološkoj dijagnostici te mikrobiološkoj dijagnostici.
Anamneza. Anamnezom obuhvaćamo podatke o sadašnjim tegobama bolesnika, dosadašnjim bolestima te funkcijama i navikama (otkrivanje i uočavanje rizičnih skupina bolesnika) te epidemiološkim prilikama (kontakt sa životinjama, slična oboljenja u okruženju i sl.).
Fizikalni pregled. Inspekcijski se često uočava zauzimanje prisilnoga položaja – bolesnici obično leže na strani pneumonije kako bi ograničili kretnje pri disanju, a time i bol. Auskultacijski nalaz kod alveolarne pneumonije je patološki (nečujno disanje, krepitacije, hropci), dok je kod intersticijskih obično normalan. Iznad područja nečujnoga disanja perkutorno se čuje muklina ili izrazito skraćen plućni zvuk.
Laboratorijska dijagnostika. U dijagnostici pneumonija fokus leži na određivanju upalnih parametara: leukocita i diferencijalne krvne slike, C-reaktivnoga proteina (CRP) i prokalcitonina (PCT). U krvnoj slici se kod bolesnika s alveolarnom pneumonijom obično nalazi leukocitoza s neutrofilijom i skretanjem ulijevo (pojava nezrelih oblika leukocita), rjeđe se susreće leukopenija. Kod intersticijskih pneumonija leukociti su obično uredni ili blago povišeni, a neutrofili su uredni ili sniženi. Iako je načelno CRP povišen kod akutnih pneumonija (i alveolarne i intersticijske), ipak ima ograničenu kliničku implikaciju i treba ga interpretirati u kontekstu kliničkoga stanja. Vrijednosti CRP-a veće su kod bakterijske etiologije pneumonije. Rezultati provedenih studija su prijeporni u smislu vrijednosti CRP-a kao pokazatelja pneumonije uopće, i kao pokazatelja etiologije pneumonije (bakterijska ili virusna). Prokalcitonin (PCT) je perkusor kalcitonina koji se oslobađa iz parenhimskih stanica kao odgovor na bakterijske toksine, a koristan je u određivanju etiologije pneumonije (povišene vrijednosti kod bakterijskih, a snižene kod virusnih). Osim toga, PCT je koristan u praćenju terapijskoga odgovora na uvedenu antibiotsku terapiju (očekuje se pad vrijednosti) kao i prognostički čimbenik (perzistentno visoke vrijednosti ukazuju na lošiju prognozu bolesti).
Radiološka dijagnostika. Klasični radiogram srca i pluća (poželjno u dvije projekcije – postero-anteriorno i lateralno, tj. profilno) osnovna je dijagnostička metoda u dijagnostici pneumonija (Slika 2.8.). Osnovna promjena je novonastali infiltrat, no ponekad se kod dehidriranih bolesnika (volumna deplecija) inicijalno infiltrati ne uočavaju, ali pojavljuju se na snimkama ponovljenim nakon rehidracije. Ako je klinički suspektna pneumonija, a radiološki nalaz je negativan, potrebno je ponoviti snimanje za 24 do 48 sati. Načelno, radiološka potvrda pneumonije indicirana je u sljedećim situacijama: akutni razvoj respiratorne simptomatologije uz jedan od navedenih znakova: tjelesna temperatura iznad 37,8 C, srčana frekvencija iznad 100/min, respiratorna frekvencija veća od 20/min ili patološki auskultacijski nalaz. Najčešće radiološke slike alveolarnih pneumonija su lobarna pneumonija i bronhopneumonija. Lobarna pneumonija očituje se kao homogena lezija koja zahvaća određeni režanj te polazi od periferije prema središtu plućnoga parenhima sa zračnim bronhogramom ili bez njega. Bronhopneumonija se očituje kroz konfluentna mrljasta žarišta, neoštro ograničena, koja se protežu uz dišne puteve, ograničena na jedan režanj. Intersticijska pneumonija se prikazuje kao obostrani, difuzni, nježni, mrežoliki i neoštro ograničeni infiltrati (tzv. ground glass fenomen). Za intersticijske pneumonije karakterističan je nesrazmjer između kliničke slike i auskultacijskoga nalaza (blagi) u odnosu na radiološku snimku (izražena). Kompjuterizirana tomografija rijetko je indicirana u dijagnostici pneumonija, obično se radi samo u slučaju kliničkih nejasnoća i nedoumica.
Slika 2.8. Radiološki nalaz bronhopneumonije (lijevo) i intersticijske pneumonije (desno)
Mikrobiološka dijagnostika. Iako se dijagnoza pneumonija s velikom sigurnošću može postaviti na temelju kliničkoga, laboratorijskoga i radiološkog nalaza, mikrobiološka dijagnostika služi za identifikaciju uzročnika, što može utjecati na samu terapiju. Unatoč rezultatima studija koje pokazuju da su patogeni uzročnici mikrobiološki dokazani kod 35 do 45 % bolesnika s klinički i radiološki potvrđenim pneumonijama, mikrobiološku dijagnostiku treba provoditi, osobito kod bolesnika koji zahtijevaju hospitalno liječenje. Kod bolesnika koji se liječe i kontroliraju ambulantno mikrobiološka dijagnostika nije nužna, tj. prepušta se procjeni samoga liječnika. Kod hospitalnih bolesnika, osobito kod bolesnika u intenzivnoj jedinici, kao i kod onih kod kojih se očekuje specifičan uzročnik, preporuča se učiniti kulturu sputuma (iskašljaj ili bronhoskopski ispirak), hemokultura, urinarni antigenski test na pneumokok i legionelu te molekularne pretrage.
Kultura iskašljaja. Iskašljaj je najčešći i najdostupniji uzorak za mikrobiološku dijagnostiku dišnih puteva. Treba imati na umu da pri uzimanju iskašljaja lako dolazi do kolonizacije te se zato prije obrade uzorka procjenjuje njegova kvaliteta utvrđivanjem prisutnosti stanica pločastoga epitela – ako se nađe više od 25 stanica pločastoga epitela u vidnom polju (povećanje 100 x) uzorak se smatra kontaminiranim te neprikladan za mikrobiološku dijagnostiku. Uzorak se mora uzeti najkasnije 6 do 12 sati od početka antimikrobnoga liječenja. Osim uzgoja određenoga patogena, bitan je i njihov broj te se klinički značajnom smatra koncentracija patogena viša od 106/ml (odnosno 104/ml kod bronhoskopskoga ispirka). Malo je patogena kod koji imaju klinički značaj bez obzira na broj, tj. koncentraciju (M. tuberculosis, Legionella).
Hemokultura. Uzimanje hemokulture preporuča se za sve bolničke bolesnike u teškom općem stanju te one koji pripadaju nekoj od rizičnih skupina. Prije primjene antimikrobnoga liječenja hemokulture kod bolesnika s domicilnim pneumonijama pozitivne su kod 10 - 15 % bolesnika, a najčešći izolat je S. pneumoniae (25 % pneumokoknih pneumonija praćeno je bakterijemijom).
Urinarni antigenski testovi. Otkrivanje antigena uzročnika u urinu metodom imunokromatografije osigurava jednostavnu i brzu dijagnostiku uzročnika, a na raspolaganju su testovi na pneumokok i legionelu. Antigen pneumokoka koji se detektira u urinu je C-polisaharid i ima visoku specifičnost (oko 90 %), iako treba misliti na moguće lažno pozitivne nalaze (nakon pneumokoknoga cjepiva, prethodna infektivna epizoda s pneumokokom, osobito kod bolesnika s KOPB-om te kolonizacija streptokokom koji ima sličan antigen). Antigen pneumokoka u urinu se sadržava i može se detektirati u razdoblju od nekoliko tjedana do šest mjeseci. Osim na pneumokok, danas se primjenjuju urinarni antigenski testovi na legionelu i to najčešće antigen serogrupe I koja je i najčešći uzročnik. Također, antigen legionele može perzistirati duže vrijeme u urinu. Primjena antibiotika ne utječe na pozitivnost ovih nalaza što im daje dodatnu kliničku prednost.
Molekularni testovi. Molekularna dijagnostika uzročnika pneumonija podrazumijeva otkrivanje nukleinskih kiselina (DNA ili RNA) uzročnika u različitim uzorcima (sputum, obrisak ždrijela, urin, serum). Rezultat ne ovisi o vijabilnosti uzročnika, što im daje prednost u dijagnostici nakon uvođenja antimikrobne terapije. Za molekularne testove koristi se PCR metoda. Druga prednost je brzina dobivanja rezultata (rezultat u roku od jednoga dana).
Liječenje. Kod procjene liječenja bolesnika s pneumonijom osnovni je korak procjena težine bolesti. Na temelju te procjene može se razdvojiti bolesnike koje treba liječiti hospitalno od onih koje se može liječiti ambulantno. Temelj liječenja je primjena antibiotika uz ostalu simptomatsku terapiju.
Procjena težine bolesti. U svakodnevnoj praksi najčešći bodovni sustav za procjenu težine pneumonije je CURB-65. Parametri za njegov izračun su: novonastala konfuzija (C, engl. confusion), serumska razina ureje > 7 mmol/L (U, engl. urea), broj respiracija > 30/min (engl. respiratory rate), sistolički tlak < 90 mmHg i dijastolički < 60 mmHg (B, engl. blood pressure) te dob od 65 godina života i više. Svaki parametar nosi jedan bod te se na osnovi njihovoga zbroja ocjenjuje težina bolesti i modalitet liječenja. Bolesnici sa zbrojem od 0 i 1 liječe se ambulantno (hospitalno samo iz socijalnih razloga), sa zbrojem 2 bolesnici se hospitalno liječe na odjelima, a zbroj 3 ili više nalaže hospitalno liječenje u jedinici intenzivnoga liječenja. Postoje i drugi bodovni sustavi kao što je PSI indeks (engl. pneumonia severity index), ali je on kompliciraniji i zahtjevniji za rutinski rad.
Antimikrobno liječenje. Pravodobna i pravovaljana primjena antibiotika osnovni je terapijski cilj. Preporučeno vrijeme početka antimikrobne terapije su prva četiri do šest sati od postavljanja dijagnoze. Izbor antibiotika ovisi o više čimbenika, a temelji se na mogućem očekivanom uzročniku, individualnim čimbenicima rizika, prethodnoj uporabi antibiotika, alergijama te prevalenciji patogena i njihovoj rezistenciji (lokalna epidemiološka slika). Empirijski izbor antimikrobnih lijekova u liječenju domicilinih pneumonija prikazan je u Tablici 2.14. Način primjene antibiotika ovisi o težini bolesti, tako da ambulantno liječeni bolesnici obično primaju peroralno antibiotike (iznimno parenteralno putem dnevne bolnice), dok kod hospitalno liječenih bolesnika početak liječenja uključuje parenteralnu primjenu. Prelazak s parenteralne primjene na peroralnu indiciran je nakon inicijalne kliničke stabilizacije, pada temperature te stabilizacije vitalnih znakova uz odgovarajuću funkciju probavnoga sustava i mogućnost peroralnoga unosa lijeka. Duljina liječenja je individualna i temelji se na kliničkoj procjeni (simptomi, laboratorijski nalazi). Svakako prije prekida liječenja bolesnici moraju biti barem 48 - 72 sata afebrilni i klinički bez značajnijih tegoba.
|
Tablica 2.14. Izbor antimikrobne terapije
|
|
Kategorija bolesnika
|
Preporučena antimikrobna terapija
|
|
Ambulantni bolesnici bez komorbiditeta i rizika
|
Beta laktam ili makrolid ili tetraciklin/doksiciklin
|
|
Ambulantni bolesnici s komorbiditetima i rizicima*
|
Beta laktam + makrolid ili levofloksacin/moksifloksacin
|
|
Hospitalno liječenje na bolničkim odjelima
|
Beta laktam + makrolid ili levofloksacin/moksifloksacin
|
|
Hospitalno liječenje u JIL-u, bez rizika od P. aeruginosa
|
Cefalosporin III. generacije + makrolid (azitromicin) ili levofloksacin/moksifloksacin
|
|
Hospitalno liječenje u JIL-u, rizik od P. aeruginosa
|
Antipseudomonasni beta laktam + fluorokinolon ili aminoglikozid i makrolid
|
|
Bolesnici s rizikom od CA-MRSA**
|
Vankomicin, alternativa je linezolid i teikoplanin
|
*Komorbiditeti i rizici: bolesnici koji su antimikrobno liječeni u protekla tri mjeseca, osobe starije od 65 godina, prethodno hospitalizirani bolesnici, imunosuprimirani bolesnici, bolesnici s postojećim plućnim i/ili drugim nezaraznim bolestima (šećerna bolest, kronične bolesti srca i bubrega, alkoholizam, pothranjenost i dr.).
** CA-MRSA: Community-acquired methicillin-resistant Staphylococcus aureus
Simptomatsko liječenje. Osim antibiotske terapije, ovisno o bolesnikom stanju i težini bolesti potrebno je provoditi i druge potporne i simptomatske mjere: volumna nadoknada i dostatna hidracija, korekcija elektrolitnoga disbalansa, nutritivna nadopuna, liječenje respiratorne insuficijencije i hipoksije, profilaksa duboke venske tromboze i plućne embolije, gastroprotekcija, korekcija anemije, liječenje hiperglikemije i drugo.
HOSPITALNE (BOLNIČKE) PNEUMONIJE
Definicija. Pojam hospitalna (bolnička, nozokomijalna) pneumonija obuhvaća tri klinička entiteta: bolnička pneumonija u užem smislu (engl. Hospital-acquired pneumonia, HAP), pneumonija povezana s respiratorom (engl. Ventilator-associated pneumonia, VAP) te pneumonija povezana sa zdravstvenom skrbi (engl. Healthcare-associated pneumonia, HCAP). HAP predstavlja upalu pluća koja nastaje nakon 48 sati od prijema u bolnici i nije bila u inkubaciji prilikom prijema. VAP označava upalu pluća koja se razvija kod intubiranoga bolesnika nakon 48 sati od započete mehaničke ventilacije. HCAP označava upalu pluća koja nastaje u izvanbolničkim uvjetima, ali su bolesnici izloženi zdravstvenoj skrbi/postupcima (boravak u ustanovama kroničnoga tipa, bolesnici na kemoterapiji, bolesnici koji su boravili na bolničkom liječenju koje je trajalo duže od dva dana u zadnja tri mjeseca, bolesnici koji su na kroničnoj hemodijalizi).
Epidemiologija. Hospitalne pneumonije predstavljaju povećavaju morbiditet i mortalitet bolesnika na bolničkom liječenju, osobito u jedinicama intenzivne skrbi. Incidencija VAP-a pojavljuje se kod 15 do 25 % mehanički ventiliranih bolesnika. HAP je najčešći uzrok smrtnosti među bolničkim infekcijama. Rizik od infekcije multirezistentnim uzročnicima nose sljedeći bolesnici: primjena antibiotika u posljednjih 90 dana; aktualna hospitalizacija koja traje duže od pet dana; hospitalizacija u posljednjih 90 dana koja je trajala duže od dva dana; dokazana bolnička rezistencija uzročnika na antibiotike; imunosupresijska bolest ili liječenje; težina bolesti (šok) i loš funkcionalni status bolesnika.
Etiologija. Uzročnici hospitalnih pneumonija obično su različiti bolnički sojevi koji su često (multi)rezistentni na klasične antibiotike. Najčešći uzročnici su gram-negativne bakterije i Staphylococcus aureus. Od gram-negativnih bakterija obično se radi o sljedećima: Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Acinetobacter species te Enterobacter species. Od gram-pozitivnih bakterija najčešće su Streptococcus species te Staphylococcus aureus, uključujući meticilin rezistentni soj (MRSA). Kod imunokompromitiranih osoba česte su gljivične infekcije pluća.
Klinička slika. Simptomi i znakovi bolničke pneumonije neintubiranih bolesnika jednaki su kao i kod bolesnika s domicilinim pneumonijama. Znakovi koji upućuju na nastanak pneumonije kod intubiranih bolesnika su: pojava febrilnoga stanja; tahipneja; tahikardija; pojačana potreba za sukcijom dišnih puteva pri čemu se dobiva gust, žućkasto-zelenkasti sekret; pogoršanje hipoksemije uz stalnu potrebu za pojačanjem respiratorne potpore (podizanje parcijalnoga tlaka inspiriranoga kisika – FiO2, povećanje tlakova i sl.), a nekada razvoj pneumonije kod kritično oboljelih rezultira razvojem poremećaja svijesti.
Dijagnoza. Kod pojave kliničke sumnje na razvoj hospitalne pneumonije indicirana je dodatna laboratorijska obrada, radiološko snimanje pluća te mikrobiološka dijagnostika. U laboratoriju se obično bilježi porast upalnih parametara (leukociti, C-reaktivni protetin, prokalcitonin). Rendgenogram srca i pluća mora se napraviti kod svih bolesnika sa sumnjom na pneumoniju, a tipični nalaz ukazuje na alveolarnu komnsolidaciju i zračni bronhogram. Osim toga, radiološki snimak ukazuje i na težinu pneumonije (lobarna, multilobarna, bilateralna) i mogućih komplikacija (atelektaza, pleuralni izljev). Također, kod svih bolesnika treba provesti mikrobiološko uzorkovanje koje uključuje kulturu sputuma ili bronhoskopski uzet bronhoalveolarni lavat ili obrisak zaštićenom četkicom kod neintubiranih bolesnika ili kod intubiranih bolesnika aspirat traheje ili bronhoskopski uzeti uzorci (lavat, bris zaštićenom četkicom). Studije su pokazale bolju pouzdanost u mikrobiološkoj identifikaciji uzročnika bronhoskopski uzetih uzorka za razliku od nebronhoskopskih uzoraka, iako to nije imalo utjecaja na prognozu bolesti. Teži se da se uzorci uzmu prije početka antibiotske terapije ili prije njezine promjene (zamjene). Svi se uzorci bojaju po Gramu (prikaz morfologije bakterija i neutrofila) te se nasađuju na podloge (kultura), a prag za razlikovanje bakterijske infekcije od kolonizacije iz materijala aspirata traheje ili sputuma je 106 Cfu/ml, za bronhoskopski lavat 104 Cfu/ml, a za bris zaštićenom četkicom 103 Cfu/ml.
Klinički pokazatelj plućne infekcije (engl. Clinical Pulmonary Infection Score, CPIS) predstavlja indeks koji pomaže u dijagnostici hospitalne pneumonije (Tablica 2.15.). Inicijalno bodovanje uključuje prvih pet parametara, a 2. ili 3. dan procjenjuju se posljednja dva. Ukupni zbroj bodova veći od 6 ukazuje na postojanje hospitalne pneumonije.
|
Tablica 2.15. Clinical Pulmonary Infection Score, CPIS
|
- Temperatura: 36,5 do 38,4 (0 bodova); 38,5 do 38,9 (1 bod), viša od 39 i niža od 36 (2 boda);
- Leukociti: između 4.000 i 11.000 (0 bodova); manje od 4.000 ili više od 11.000 (1 bod);
- Trahealna sekrecija: nema je (0 bodova); nepurulentna (1 bod); purulentna (2 boda);
- Oksigenacija (PaO2/FiO2): više od 240 (0 bodova); manje od 240 (2 boda);
- RTG pluća: bez infiltrata (0 bodova); difuzni infiltrati (1 bod); lokalizirani infiltrati (2 boda);
- Progresija RTG infiltrata: bez progresije (0 bodova); postoji progresija (2 boda);
- Rast patogena u kulturi: nikakav (0 bodova); postoji (1 bod).
|
Liječenje. Osnova liječenja je antimikrobna terapija. Liječenje počinje empirijskom primjenom antibiotika, a izbor, odnosno kombinacija antibiotika ovisi o tome postoje li kod bolesnika čimbenici multirezistentne infekcije (prethodno navedeni). Kod bolesnika kod kojih ne postoje čimbenici multirezistentne infekcije primjenjuje se antibiotska monoterapija, a kod onih kod kojih postoje čimbenici rizika najčešće se liječe trojnom antibiotskom terapijom. Po prispijeću nalaza mikriobiološke kulture široku empirijsku antimikrobnu terapiju treba prilagoditi nalazu antibiograma (prekrajanje ili deeskalacija terapije). Duljina terapije treba biti utemeljena na kliničkoj situaciji (klinička slika, pad vrijednosti prokalcitonina, regresija infiltrata). Studije nisu pokazale prednost produljenoga liječenja (15 dana) u odnosu na kraće liječenje (sedam dana) hospitalnih pneumonija, osim u slučaju pseudomonasne infekcija kada je kraći period liječenja povezan s većim rizikom od reinfekcije.
Izbor antimikrobnih lijekova. Preporučeni antibiotici za empirijsko liječenje hospitalnih pneumonija prikazane su u Tablici 2.16. i poglavito ovise o prisutnosti čimbenika za multirezistentnu infekciju pluća. Pri izboru treba imati na umu da se za bolesnike koji su bili na nekom antibiotiku odabere antibiotik iz druge grupe.
|
Tablica 2.16. Izbor antimikrobne terapije za liječenje bolničke pneumonije
|
|
Ako nema rizika od multirezistentne infekcije pluća ili je on nizak, liječenje započinje izborom jednoga od sljedećih antimikrobnih lijekova:
- Moksifloksacin 1 x 400 mg iv ili levofloksacin 1 x 500 mg iv
- Ceftriakson 1 x 2 g iv
- Ampicilin-sulbaktam 4 x 3 gr iv
- Ertapenem 1 x 1 g iv
U slučaju sumnje na pseudomonasnu infekciju:
- Piperacilin-tazobaktam 3 x 4,5 g iv
- Cefepim 3 x 2 g iv ili ceftazidim 3 x 2 gr iv
- Imipenem 4 x 500 - 1000 mg iv ili meropenem 3 x 1 - 2 g iv
|
|
Ako postoji rizik od multirezistentne infekcije pluća, liječenje započinje trojnom antibiotskom terapijom odabirom jednoga lijeka iz navedene tri grupe:
- Primarni antipseudomonasni antimikrobni lijek
- Piperacilin-tazobaktam 3 x 4,5 g iv
- Cefepim 3 x 2 g iv ili ceftazidim 3 x 2 g iv
- Imipenem 4 x 500 - 1000 mg iv ili meropenem 3 x 1 - 2 g iv
- Sekundarni antipseudomonasni lijek
- Ciprofloksacin 2 x 400 mg iv ili levofloksacin 1 x 500 mg iv
- Gentamicin 1 x 7 mg/kg iv ili amikacin 1 x 20 mg/kg iv
- Kolistin 3 x 3 mil ij iv (s ili bez inhalacijske primjene)
- Pokrivanje MRSA infekcije
- Linezolid 2 x 600 mg iv ili vankomicin 2 x 1 g iv
|
Simptomatsko liječenje uključuje standardne mjere: liječenje hipoksemije (oksigenoterapija, mehanička ventilacija), nutritivna potpora, volumna nadoknada, gastroprotekcija, tromboprofilaksa i dr.
Prognoza. Bolesnici kod kojih se razvije hospitalna pneumonija imaju lošiju prognozu jer ona dodatno pogoršava osnovnu bolest. Prema nekim studijama stopa smrtnosti od hospitalnih pneumonija je 35 do 50 %.
ASPIRACIJSKA PNEUMONIJA
Definicija. Aspiracijska pneumonija nastaje kao rezultat aspiracije sadržaja iz usta i ždrijela u donje dišne puteve pri čemu, ovisno o naravi aspiriranoga sadržaja, može nastati kemijski pneumonitis (aspiracija želučane kiseline i sličnih toksičnih tvari) ili anaerobna pneumonija (aspiracija anaerobnih bakterija iz usne šupljine i ždrijela).
Etiopatogeneza. Aspiracija sadržaja iz usta i gornjih dišnih puteva u plućima može izazvati anaerobnu pneumoniju i kemijski pneumonitis što ovisi o sadržaju aspiriranoga sadržaja.
Nastanak anaerobne pneumonije. Anaerobna pneumonija nastaje aspiracijom sadržaja (slina, sekreti) kontaminiranih anaerobnim bakterijama koje se nalaze u usnoj šupljini i ždrijelu. Iako se tijekom noći normalno aspirira sadržaj iz usta i gornjih dišnih puteva, kod normalnih, zdravih osoba takva pojava ne izaziva bolest zahvaljujući djelovanju obrambenih mehanizama u donjim dišnim putevima (mukocilijarni aparat, sekretroni IgA, alveolarni makrofagi i sl.). Aspiracijska pneumonija posljedica je ili oslabljenih obrambenih mehanizama (bolesti pluća) ili stanja koja pridonose većem riziku od aspiracije (poremećaj stanja svijesti, bolesti središnjega živčanoga sustava, poremećaji gutanja, prisutnost stranih tijela kao što je endotrahealni tubus ili nazogastrična sonda, kronični alkoholizam i sl.). S obzirom na to da se u usnoj šupljini i ždrijelu nalaze anaerobne bakterije (osobito kod bolesnika s lošom higijenom usne šupljine te kod onih s nesaniranim zubalom i bolestima gingive), aspiracija sadržaja iz njih dovodi do razvoja anaerobnih infekcija koje se mogu očitovati kao nekrotizirajuća pneumonija, plućni apsces te empijem pleure. Najčešći uzročnici su Bacteroides species, Fusobacterium species, Peptostreptococcus te Prevotella melaninogenica.
Nastanak kemijskoga pneumonitisa. Kemijski pneumonitis posljedica je aspiracije raznih tvari koje mogu djelovati toksično na plućni parenhim, tj. izazvati abakterijsku upalu i oštećenje. U prvom se redu ovdje podrazumijeva aspiracija želučane kiseline, tj. želučanoga sadržaja, iako se aspirirati mogu i druge tvari (naftni derivati i sl.). Oštećenje je posljedica izravnoga fizikalno-kemijskoga učinka aspiriranoga sadržaja, a jačina ovisi o količini aspiriranoga sadržaja. Želučana kiselina izaziva kemijsku opeklinu koja dovodi do edema, intraalveolarne hemoragije, atelektaze i bronhokostrikcije. Poseban oblik kemijskoga pneumonitisa je Mendelsov sindrom.
Klinička slika. Simptomi i znakovi anaerobne pneumonije nisu dramatični i razvijaju se postupno. Bolesnici imaju vrućicu ili su afebrilni, imaju blago do umjereno izraženu dispneju te produktivan kašalj, a javljaju se i opći simptomi kao što su umor i malaksalost te mršavljenje. Klinička slika kemijskoga penumonitisa je dramatičnija, osobito nakon aspiracije veće količine sadržaja i javlja se brzo nakon aspiracije: akutna dispneja s kašljem, sukrvavi pjenušavi iskašljaj, tahipneja, tahikardija, wheezing, a bolesnici su blijedi, zaplašeni i orošeni hladnim znojem.
Dijagnoza. Pri postavljanju dijagnoze važnu ulogu imaju anamnestički podaci koji pobuđuju sumnju na aspiracijsku pneumoniju (klinička slika, čimbenici rizika za aspiraciju, podatak o povraćanju i aspiraciji i sl.), a radiološki snimak pluća potvrđuje dijagnozu. Radiološki znakovi anaerobne pneumonije ovise o njezinom patološkom očitovanju: plućni apsces (solitarna šupljina okružena konsolidacijom i ograđena tankim zidom unutar koje obično nalazimo jasnu granicu zrak-tekućina), nekrotizirajuća pneumonija (višestruke kavitacije unutar područja plućne konsolidacije) te empijem pleure (znakovi prisutnosti tekućine u pleuralnom prostoru – zasjenjenje koje obuhvaća pomak laterouzlazne granice pluća prema medijalno i zaobljeni frenikokostalni sinusni). Radiološki znakovi kemijskoga pneumonitisa uključuju nastanak višestrukih infiltrata uz nastankom konsolidacije i kavitacije te intersticijskoga crteža. Kod nejasnih radioloških nalaza preporuča se kompjuterizirana tomografija. Na aspiracijsku pneumoniju mogu ukazivati i povišeni upalni parametri (leukociti, C-reaktivni protein). Kod bolesnika se preporuča i mikrobiološko uzorkovanje (sputum ili bronhoskopski materijali – lavat ili bris zaštićenom četkicom).
Liječenje. Kod svih bolesnika potrebno je provoditi potporne mjere, u prvom redu liječenje hipoksemije (oksigenoterapija, mehanička ventilacija). Antibiotici su indicirani kod anaerobne pneumonije i kemijskoga pneumonitisa kod kojega se sumnja na moguću superinfekciju. Antibiotik izbora je klindamicin (3 x 600 mg iv do poboljšanja, a potom 4 x 300 mg peroralno). Alternativno se može primijeniti kombinacija amoksicilin-klavulonska kiselina (3 x 1,2 g iv ili 2 x 1 g peroralno) uz metronidazol (3 x 400 mg iv ili 3 x 500 mg peroralno). Antimikrobna terapija se preporuča sve dok ne dođe do regresije radioloških promjena što može potrajati mjesecima. Veće apscese i empijem pleure potrebno je kirurški drenirati, a u težim slučajevima preporuča se i torakotomija i operativno zbrinjavanje. U liječenju kemijskoga pneumonitisa mogu se u akutnoj fazi primjenjivati i kortikosteroidi (metilprednizol), a može se primijeniti i bronhoskopska toaleta (ispiranje fiziološkom otopinom).
Mendelsonov sindrom označava kliničko stanje aspiracije veće količine želučanoga sadržaja što dovodi do teškoga kemijskog pneumonitisa koji se razvija kroz nekoliko sati i ima visoku stopu smrtnosti. Često je udružen s povraćanjem kod bolesnika koji su poremećenoga stanja svijesti i ne mogu održavati dišni put, a susreće se i kod medicinskih intervencija (hitna endotrahealna intubacija, lavaža želuca uz nezaštićen dišni put). Ubrzo nakon aspiracije razvijaju se dispneja, tahipneja te hipoksemijska respiratorna insuficijencija. U krvi je prisutna izražena hipoksemija uz postupni razvoj acidoze, a na rendgenogramu se nalaze opsežni bilateralni infiltrati. Kod takvih bolesnika indicirani su endotrahealna intubacija i mehanička ventilacija, postavljanje nazogastrične sonde te bronhoskopska toaleta donjih dišnih puteva. Liječenje se provodi u jedinicama intenzivnoga liječenja. Primjena kortikosteroida (metilprednizon) primjenjuje se, iako studije pokazuju oprečne rezultate. Profilaktički se uključuju antibiotici (klindamicin). Unatoč svim mjerama kod ovih bolesnika često dolazi do pogoršanja stanja i smrtnoga ishoda. Kao moguću metodu za kupovinu vremena do oporavka pluća predstavlja i postupak veno-venske ekstrakorporalne membranske oksigenacije.
KOMPLIKACIJE PNEUMONIJA
Najčešće komplikacije pneumonija su pleuralni izljev, empijem pleure, bronhogena diseminacija i plućni apsces, masivno krvarenje (masivna hemoptoa), sepsa te akutni respiratorni distres sindrom. Pojedine komplikacije opisane su u odgovarajućim dijelovima udžbenika.
PNEUMONIJE KOD IMUNOKOMPROMITIRANIH BOLESNIKA
Definicija. Imunokompromitirani bolesnici posjeduju rizik od razvoja pneumonija, ne samo uzrokovanih klasičnim mikroorganizmima, nego i oportunistima, što je i glavna karakteristika te patologije. U ovu skupinu bolesnika ubrajamo bolesnike s urođenim poremećajima humoralne ili celularne imunosti, bolesnike na imunosupresivnoj terapiji, neutropenične bolesnike te HIV-pozitivne bolesnike.
Etiologija. Pneumonije u ovoj skupini bolesnika najčešće uzrokuju oportunistički mikroorganizmi koji inače kod zdravih, imunokompententnih bolesnika ne izazivaju bolest. To mogu biti bakterije, virusi i gljivice. Na etiologiju utječe vrsta imunološkoga deficita, a možemo se voditi i prema vremenskoj pojavnosti bolesti.
Uzročnici prema vrsti imunološkoga deficita. Defekti humoralne imunosti obično su povezani s nastankom bakterijskih infekcija, dok su defekti celularne imunosti povezani s nastankom virusnih i gljivičnih infekcija te infekcija protozoama i mikobakterijama. Bolesnici s neutropenijom ili poremećenom funkcijom granulocita skloni su infekcijama koje uzrokuju S. aureus, Aspergillus, gram-negativne bakterije te gljivičnim infekcijama (Candida).
Uzročnici prema vremenskoj pojavnosti bolesti. Pneumonije koje naglo nastaju i imaju fulminantan tijek obično su bakterijske etiologije, dok poodmakao i postupan početak bolesti nalazimo kod virusnih, gljivičnih te infekcija mikobakterijama i protozoama. Pneumonija koja nastaje 2 do 4 tjedna od transplantacije obično je bakterijske etiologije, dok su one koje nastaju mjesecima kasnije obično virusne (citomegalovirus) i gljivične etiologije (Aspergillus).
Klinička slika. Uobičajeno je kod ovih bolesnika klinička slika istovjetna kao i kod imunokompententnih bolesnika, ali je manje karakteristična i upečatljivija. Bolest često prolazi bez povišene temperature, a respiratorni simptomi su manje izraženi te je manje vjerojatno da će pojaviti gnojni iskašljaj ako je bolesnik u neutropeniji.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, fizikalnoga pregleda te laboratorijske, radiološke i mikrobiološke dijagnostike. Na pneumoniju treba pomišljati kod svih imunokompromitiranih bolesnika koji razviju respiratorne simptome ili postanu febrilni te imaju patološki auskultacijski nalaz na plućima. Kod svih njih potrebno je učiniti rendgenogram pluća koja može pokazivati lokaliziranu konsolidaciju kod tipičnih pneumonija ili difuzni intersticijski nalaz kod atipičnih pneumonija. Laboratorijski nalazi ovise o osnovnom poremećaju, ali se u pravilu pojavljuje porast upalnih parametara, osobito C-reaktivnoga proteina i prokalcitonina. Za dokaz uzročnika potrebno je provesti mikrobiološku dijagnostiku, najprije pregled sputuma (bakterije, gljivice, mikobakterije, Legionella, P. jirovecii) ili bronhoskopski dobivenoga materijala ako je nalaz sputuma negativan.
Liječenje se temelji na etiologiji i nalazu antibiograma, a ako nije izoliran niti jedan uzročnik, na empirijskoj primjeni antimikrobnih lijekova. Izbor antibiotika jednak je kao opisanome za bolničke pneumonije uz dodatak antimikotika ako postoji sumnja i na infekciju gljivama.
Pneumocystis jirovecii pneumonija najčešća je oportunitička infekcija pluća u kliničkoj praksi. Radi se o ubikvitarnom mikroorganizmu koji u dišni sustav ulazi putem aerosola te kod imunokompetentnih osoba ne izaziva bolest. Infekcija kod imunokompromitiranih osoba nastaje reinfekcijom ili reaktivacijom organizma koji je ranije dospio u pluća. Glavni simptomi su povišena temperatura, otežano disanje i kašalj. Na radiološkoj snimci pluća prikazuje se kao difuzan, bilateralni retikulinski crtež, a kod 20 do 30 % bolesnika radiološki nalaz može biti uredan. Konačna dijagnoza postavlja se dokazom trofozoita ili cista u uzorku suptuma, aspirata traheje ili nekoga drugog (bioptat, bris četkicom). Liječenje treba početi što ranije, a antibiotik izbora je sulfametoksazol/trimetoprim (5 mg/kg 3 x/dan). Svi HIV pozitivni bolesnici koji su imali tu infekciju i koji imaju broj CD4+ limfocita manje od 200/µL trebaju profilaktički dobivati sulfametoksazol/trimetoprim. Alternativni lijekovi su pentamidin, dapson i atovakvon.
PLUĆNI APSCES I NEKROTIZIRAJUĆA PNEUMONIJA
Definicija. Plućni apsces je naziv za nekrozu plućnoga tkiva koja stvara kavitacije unutar plućevine okružene fibroznom opnom, a uzrokovana je mikrobiološkim agensima. Nakupinu više manjih plućnih apscesa (do 2 cm) nazivamo nekrotizirajuća pneumonija. Plućni apsces je češći kod starijih osoba, kod osoba s rizičnim čimbenicima za razvoj aspiracijske pneumonije (poremećaj stanja svijesti, kronični alkoholizam) te imunosuprimiranih osoba.
Etiopatogeneza. Plućni apsces može nastati primarno, uzrokovan mikrobiološkim agensom na do tada zdravim plućima, ili sekundarno, kao komplikacija ranije bolesti pluća (npr. opstrukcija dišnih puteva, bronhiektazije i sl.). Može nastati na jedan od tri načina: 1) komplikacija bakterijske pneumonije, 2) aspiracija patogena iz orofarinksa i usne šupljine te 3) septičke embolizacije u tijeku bakterijemije ili endokarditisa trikuspidalne valvule. Apsces je praćen kolikvacijskom nekrozom plućnoga tkiva uz stvaranjem fibrozne opne kojom organizam pokušava ograničiti infekciju. Pri tome apsces može perforirati u bronhe i drenirati se u njih što je praćeno obilnim iskašljavanjem gnojnoga sadržaja, a može i perforirati u pleuralni prostor, pri čemu nastaje empijem pleure.
Mikrobiologija. Najčešći uzročnici plućnoga apscesa su patogeni koje možemo naći u usnoj šupljini i orofarinksu: Peptostreptococcus species, Bacteroides species te Fusobacterium species. Ostali, rjeđi uzročnici su Staphylococcus aureus, Sreptococcus pyogenes, Streptococcus pneumoniae, Klebsiella pneumoniae te Hemophilus influenzae. Kod imunokompromitiranih osoba plućni apsces mogu uzrokovati i gljivice (Aspergillus, Cryptococcus, Histoplasma, Blastomyces), paraziti (Entamoeba species, Paragonimus species) te mikobakterije (Mycobacterium species).
Klinička slika. Simptomi i znakovi plućnoga apscesa ponajprije ovise o uzročniku. Anaerobni uzročnici obično se prezentiraju indolentnim kliničkim tijekom. Bolesnici su umorni i malaksali, mršave, imaju noćna preznojavanja i subfebrilne temperature uz uporni kašalj i iskašljavanje te različiti stupanj dispneje. Sličan klinički tijek nalazimo i kod gljivičnih i parazitranih uzročnika. Plućni apscesi koji nastaju kao komplikacija bakterijske pneumonije imaju burniju kliničku sliku praćenu povišenom temperaturom, kašljem i iskašljavanjem te progresivnom dispnejom. Treba imati na umu da kod nekih bolesnika, osobito starijih, klinička slika ne mora biti upečatljiva, a nije rijedak ni potpuni asimptomatski tijek.
Komplikacije. Plućni apsces može rupturirati u bronhe uz stvaranje obilnoga purulentnog iskašljaja ili u pleuralni prostor s nastankom empijema pleure. Također, moguće komplikacije su i plućna fibroza te nastanak bronhopleuralne i pleurokutane fistule.
Diferencijalna dijagnoza je raznolika: kavitirajući karcinom pluća, kavitirajući infarkt pluća, kavitirajuća pneumokonioza, kavitirajuća sarkoidoza, Wegenerova granulomatoza, kongenitalna bronhogena cista, tuberkulozna kaverna, lokalizirani empijem, aktinomikoza i dr.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, laboratorijskih i mikrobioloških pretraga, slikovnih metoda te eventualno drugih invazivnih postupaka (bronhoskopija, punkcija).
Laboratorijski nalazi su nespecifični, ponajprije ovise o aktivnosti bolesti. U akutnoj fazi su to ubrzana sedimentacija i povišeni upalni parametri, dok su u kroničnoj fazi upalni parametri ili blaže povišeni ili mirni. Također, u kroničnim fazama može se naći anemija kronične bolesti.
Slikovne metode. Radiološko snimanje pluća osnovna je pretraga kod sumnje na plućni infekt i plućni apsces. Apscesne šupljine prikazuju se kao okrugle šupljine okružene zonom konsolidacije, a obično su djelomično ispunjene tekućim sadržajem što daje jasno vidljivu granicu tekućina-zrak (aerolikvidni nivo). Nekrotizirajuća pneumonija vidi se kao veće područje plućne konsolidacije koje sadrži višestruke kavitirajuće lezije s ili bez aerolikvidnih nivoa. Kompjuterizirana tomografija indicirana je samo u nejasnim situacijama i pri sumnji na tumorski proces ili strano tijelo.
Mikrobiološke pretrage. Kod svake sumnje na plućni apsces indicirana je mikrobiološka obrada sputuma (osobito ako je prisutna gnojna ekspektorancija), bronhoskopski uzetoga materijala (lavaža, aspirat, bris četkicom) ili rjeđe, sadržaja apscesa dobivenoga transtorakalnom punkcijom pod kontrolom CT-a ili UZV-a. U febrilnim stanjima potrebno je uzeti i hemokulture (bakterijemija).
Bronhoskopija nema veći dijagnostički značaj, a obično se izvodi kod suspektnoga malignoga procesa ili stranoga tijela te nam ponekad služi u svrhu uzorkovanja za mikrobiološku dijagnostiku.
Liječenje plućnoga apscesa uključuje etiološko liječenje, simptomatsko liječenje te ponekad perkutanu drenažu ili kirurško liječenje.
Etiološko liječenje. S obzirom na to da su bakterije najčešći uzrok plućnoga apscesa, temelj liječenja je antibiotska terapija. Antibiotik izbora je klindamicin, početno 600 mg intravenski svakih osam sati, a nakon poboljšanja 300 mg peroralno svakih šest sati. Alternativno liječenje čini amoksicilin/klavulonska kiselina u dozi (3 x 1,2 gr intravenski ili 2 x 1 gr peroralno) uz metronidazol (500 mg intravenski ili peroralno svakih osam sati). Optimalno trajanje liječenja je individualno, a treba se provoditi sve do regresije radiološkoga nalaza, što može trajati i mjesecima. Kod drugih uzročnika treba primjenjivati odgovarajuće lijekove (npr. antimikotici).
Simptomatsko liječenje podrazumijeva kondicijsku potporu (hidracija, nutricija) te potpomaganje iskašljavanja. Pulmološka fizikalna terapija i posturalna drenaža ne preporučuju se u akutnoj fazi zbog mogućnosti rasapa infektivnoga sadržaja po plućima.
Perkutana drenaža plućnoga apscesa rijetko je indicirana i rezervirana je za slučajeve kod kojih se ne postiže odgovarajuća regresija uz odgovarajuću medikamentoznu terapiju. Izvodi se samo u slučajevima optimalne anatomske lokalizacije uz kontrolu UZV-a ili CT-a. Glavna opasnost je mogući rasap infektivnoga sadržaja, osobito u pleuralni prostor. Samo oko 10 % slučajeva zahtijeva perkutanu drenažu.
Kirurško liječenje indicirano je u rijetkim slučajevima apscesa koji ne reagiraju na medikamentno liječenje i perkutanu drenažu. Ovisno o lokalizaciji i opsegu, vrše se segmentektomija ili lobektomija. Pulmektomija se vrši kod velikih i multiplih apscesa koji zahvaćaju cijelo plućno krilo i to stanju kada bolesnik to može podnijeti.
TUBERKULOZA PLUĆA
Definicija. Tuberkuloza je kronična zarazna bolest koju uzrokuje Myobacterium tuberculosis. Primarno pogađa pluća, iako može zahvatiti i druge organe i tkiva te predstavlja jednu od najraširenijih zaraznih bolesti diljem svijeta.
Epidemiologija. Danas se smatra da je tim uzročnikom inficirana jedna trećina ukupne svjetske populacije. Tijekom 2013. godine registrirano je 9 milijuna novih slučajeva tuberkuloze, a 1,5 milijun osoba umrlo je od njezinih posljedica. Prema podacima iz 2010. godine, tuberkuloza je bila među prvih deset uzroka smrti u svijetu. Stopa incidencije široko varira, od 10/100 000 (razvijene europske zemlje) do 100/100 000 (zemlje afričke regije). Prema incidenciji, Republika Hrvatska pripada zemljama sa srednje visokom incidencijom (oko 25/100 000). Od 2010. incidencija tuberkuloze u Hrvatskoj je ispod 20/100 000 stanovnika, a prema novijim podacima ona iznosi manje od 12/100 000 stanovnika. Cilj je da incidencija tuberkuloze u Hrvatskoj bude ispod 10/100 000. Bacilom tuberkuloze zaražena je trećina svjetske populacije, međutim, od ukupnoga broja inficiranih aktivnu bolest razvije samo 5 - 10 % osoba, a to ovisi o veličini infektivne doze te o obrambenim mehanizmima inficirane osobe. Kod ostalih je prisutna tzv. latentna infekcija. Sukladno tome, obolijevanje od tuberkuloze u starijoj populaciji ovisi dijelom i o izloženosti tuberkulozi u mlađoj životnoj dobi, a ne samo aktualnoj epidemiološkoj situaciji.
Rizični čimbenici. Rizične čimbenike koji pogoduju pojavnosti i širenju tuberkuloze možemo podijeliti u tri skupine: 1) kontakt s visokorizičnim skupinama (boravak i zadržavanje u područjima s visokom incidencijom, preko 40/100 000), 2) bolesti i stanja koja narušavaju funkciju imunološkoga sustava (imunosupresivna terapija, kemoterapija, malnutricija, HIV infekcija te kronične nezarazne bolesti kao što su šećerna bolest i kronično bubrežno zatajenje) te 3) životni stil (ovisnost o alkoholu, drogama i lijekovima, život u većim zajednicama – domovi, zatvori i sl.). Tradicionalno je pojavnost tuberkuloze bila vezana ponajprije uz loše socio-ekonomske i zdravstveno-higijenske prilike, no u današnje vrijeme, s obzirom na velik broj imunokompromitirajućih bolesti, kao i načina liječenja (imunosupresija) tuberkuloza dobiva sasvim novo značenje. Danas se sve više ukazuje na HIV-infekciju kao bitan rizični čimbenik, s obzirom na to da ona narušava stanično-posredovanu imunost koja je ključna u obrani organizma od bacila tuberkuloze. Osim što HIV-pozitivne osobe imaju veću stopu incidencije bolesti, kod njih se bilježi i viša stopa smrtnosti, kao i učestalost multirezistentnih sojeva, što otežava liječenje.
Etiologija. Tuberkulozu mogu uzrokovati četiri bacila iz porodice mikobakterija (Mycobacterium tuberculosis complex), a to su Mycobacterium tuberculosis, Mycobacterium bovis, Mycobacterium africanum te Mycobacterium microti. Radi se o obligatno aerobnim i fakultativno intracelularnim organizmima koji u organizmu obitavaju unutar makrofaga i inficiraju ga. Imaju karakterističnu strukturu stanične stijenke koju karakterizira debeli lipidni sloj i mikolne kiseline što je čini otpornom i slabo propusnom i pridonosi duljem preživljavanju unutar makrofaga, kao i otpornosti na antimikrobne lijekove.
Mycobacterium tuberculosis danas je gotovo jedini i isključivi uzročnik tuberkuloze u našim krajevima. Izvor zaraze je osoba s aktivnom bolesti čiji sputum sadrži značajan broj bacila (tipično dovoljan da razmaz bude pozitivan). Put prijenosa je kapljični, odnosno uzročnik se prenosi s osobe na osobu inhalacijom aerosola koji sadrži dovoljnu količinu bacila. To se obično događa prilikom napinjanja dišnoga sustava (kašljanje, kihanje, pjevanje), rijetko tijekom normalnoga disanja i govora. Kapljice koje sadrže bacil mogu još satima lebdjeti na sobnom zraku što povećava mogućnost inficiranja. Prenapučenost i boravak u zatvorenim prostorima pogoduje lakšem širenju uzročnika. Neživi predmeti (odjeća, posteljina, posuđe i sl.) ne pridonose širenju bolesti.
Mycobacterium bovis danas je iskorijenjen kao uzročnik tuberkuloze, a radi se o uzročniku koji se prenosio ingestijom zaraženoga kravljeg mlijeka te je ponajprije bio uzročnik gastrointestinalne tuberkuloze. Danas je taj oblik prijenosa iskorijenjen preventivnim mjerama (veterinarske mjere, obrada mlijeka i dr.).
U kliničkoj praksi sve je više infekcija uzrokovanih tzv. multirezistentnim sojevima bacila tuberkuloze, a to su sojevi koji pokazuju rezistenciju najmanje na rimfampicin i/ili izoniazid te njihove kombinacije s drugim antituberkuloticima. Takva tuberkuloza naziva se rezistentnom, a može biti stečena (razvoj rezistencije tijekom kliničkoga tijeka bolesti i liječenja) ili se može raditi o infekciji primarno rezistentnim sojem. Ovisno o lijekovima na koje su sojevi stvorili rezistenciju, razlikujemo monorezistentne (rimfampicin ili izoniazid), multirezistentne (rimfampicin i izoniazid), ekstenzivno rezistentne (rimfapicin, izoniazid i još jedan antituberkulotik) i totalno rezistentne sojeve (rezistentni na sve lijekove). Rezistentna tuberkuloza posljedica je nepridržavanja mjera liječenja, kombinirane i standardizirane terapije bilo uslijed greške liječnika, nestašice lijekova, nesuradnje bolesnika bilo uslijed nepostojanja odgovarajućih nacionalnih programa. Prevalencija rezistentne tuberkuloze u svijetu najveća je u Aziji, a u Europi u zemljama bivšeg Sovjetskoga saveza. U Hrvatskoj je malen broj bolesnika s multirezistentnom tuberkulozom, a slučajevi proširene rezistentne tuberkuloze nisu zabilježeni.
Patogeneza. U patogenezi tuberkulozne infekcije razlikujemo dva stadija: primarna i postprimarna tuberkuloza (Slika 2.9.). Primarna tuberkuloza označava primoinfekciju bacilom tuberkuloze, a postprimarna označava sve oblike tuberkuloze koji se mogu razviti nakon primoinfekcije, a to obuhvaća latentnu tuberkulozu, primarnu progresivnu tuberkulozu te reaktivaciju tuberkuloze. Primarna i latentna tuberkuloza predstavljaju klinički asimptomatske oblike bolesti, dok primarna progresivna tuberkuloza i reaktivacija tuberkuloze predstavljaju manifestne oblike pa se nazivaju aktivnom bolešću.
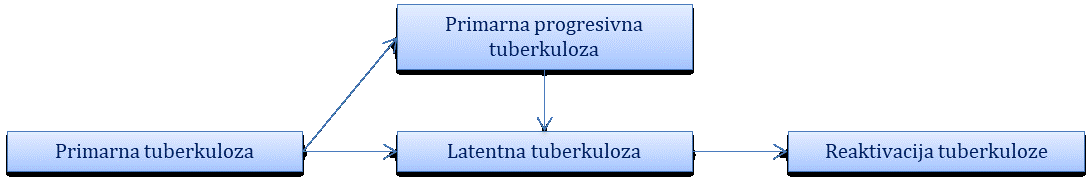
Slika 2.9. Patogenetski tijek tuberkuloze
Primarna tuberkuloza označava prvi kontakt organizma s uzročnikom (primoinfekcija). Nakon inhalacije bacili tuberkuloze dospijevaju u alveole gdje ih fagocitiraju alveolarni makrofagi. Uspješnost fagocitoze ovisi o baktericidnoj aktivnosti makrofaga, kao i o virulenciji bacila. Rijetko makrofagi u potpunosti unište bacile (lučenje proteolitičkih enzima). Češće otporni bacili nastavljaju razmnožavanje unutar alveolarnih makrofaga, a veliki dio je liziran od strane uzročnika. Aktivirani makrofagi luče razne citokine (IL-1, TNF-α) koji vrše kemotaksiju drugih upalnih stanica te prezentiraju antigene bacila na svojoj površini T-limfocitima. Tako započinje stanično-posredovani imunološki odgovor organizma na bacile tuberkuloze. Antigen-specifični T-limfociti proliferiraju i nakupljaju se oko makrofaga te tako nastaju specifični granulomi koji ograničavaju širenje infekcije. Središte granuloma koje čine makrofagi i bacili tuberkuloze djelomično nekrotizira (kazeozna nekroza), a okruženo je T-limfocitima te specifičnim epiteloidnim i Langerhansovim stanicama s više jezgara koje nastaju iz makrofaga. Unutar kazeozne nekroze bacil tuberkuloze može ostati godinama i preživjeti u svom latentnom obliku. Aktivirani T-limfociti luče razne citokine koji pojačavaju imunološki odgovor, a najvažnijim se smatra interferon gama (INF-γ) kojim se makrofage potiče na baktericidnu aktivnost. Takvo primarno žarište infekcije naziva se Ghonov fokus. Ako se infekt izdrenira u regionalne limfne čvorove, isti proces nastat će i u njima pa se onda to naziva Ghonov kompleks (Ghonov fokus + regionalna limfadenopatija). Opisani proces traje nekoliko tjedana, a klinički prolazi asimptomtaski ili ima blage simptome nalik prehladi. Otpornost organizma određuje daljnji tijek bolesti (primarna progresivna tuberkuloza ili latentna tuberkuloza s ili bez kasnije reaktivacije).
Latentna tuberkuloza označava fazu bolesti koja se javlja iza primoinfekcije, a može se definirati kao stanje trajnoga imunološkog odgovora bez kliničkih znakova bolesti. Tako organizam ograničava infekciju na primarno žarište i spriječi daljnje širenje. To podrazumijeva formiranje granuloma u čijim središtima mogu zaostati uspavani bacili tuberkuloze (tzv. perzisteri). U toj fazi bolesnici nisu infektivni i ne mogu uzročnika prenositi na druge osobe. U ovom obliku infekcija može ostati doživotno ili se u jednom trenutku (imunosupresija) može reaktivirati i uzrokovati aktivnu bolest.
Reaktivacija tuberkuloze zbiva se kod 5 do 10 % osoba s latentnom tuberkulozom. Polovica tih slučajeva zbiva se unutar dvije godine od primoinfekcije, no moguća je reaktivacija i desetljećima kasnije. Čimbenici koji pogoduju reaktivaciji tuberkuloze su: imunosupresivna terapija, koinfekcija HIV-virusom, starenje (fiziološko smanjenje imunološkoga odgovora), malnutricija te razvoj kroničnih nezaraznih bolesti, kao što je šećerna bolest i kronično bubrežno zatajenje u terminalnoj fazi. Reaktivacija označava razvoj aktivne bolesti koja je najčešće ograničena na pluća, no može uslijediti i hematogeni rasap uzročnika te razvoj izvanplućnih žarišta (koža, kosti i zglobovi, genitourinarni sustav, gastrointestinalni sustav, središnji živčani sustav i dr.).
Primarna progresivna tuberkuloza razvija se u manje od 5 % slučajeva kada imunološki odgovor nije sposoban ograničiti primoinfekciju te se razvija aktivna bolest sa svim svojim plućnim i izvanplućnim manifestacijama kako je to opisano. Klinički je nemoguće razlikovati primarnu progresivnu tuberkulozu od reaktivacije tuberkuloze, ali smatra se da je više od 90 % aktivne tuberkuloze u odrasloj dobi posljedica reaktivacije latentne tuberkuloze. Ovo razlikovanje ima samo akademski značaj, s obzirom na to da su klinička manifestacija, dijagnostički postupak te liječenje istovjetni za sve aktivne oblike tuberkuloze.
Mehanizam oštećenja tkiva. Oštećenje tkiva (plućnoga ili izvanplućnog) posljedica je formiranja karakterističnih granuloma sa središnjom kazeoznom nekrozom ili bez nje. Takve formacije remete normalnu strukturu tkiva i organa. Širenjem granuloma i aktivacijom bolesti u plućima nastaju kavitacije (šupljine) koje mogu rupturirati u bronhe, uz bronhalnu diseminaciju, ili u pleuru, što je praćeno nastankom tuberkuloznoga empijema i pleuritisa. Isti proces odigrava se i u drugim tkivima u koja dospije uzročnik.
Klinička slika. Primarna i latentna tuberkuloza klinički su asimptomatske faze bolesti. U nekim slučajevima primoinfekcija može biti praćena nespecifičnim simptomima nalik prehladi na što bolesnici često niti ne obraćaju pozornost. Aktivna bolest (primarna progresivna tuberkuloza ili reaktivacija tuberkuloze) u 90 % slučajeva se manifestira kao plućna tuberkuloza. Izvanplućni oblici tuberkuloze su mnogo rjeđi (10 - 20 %) i javljaju se obično kod bolesnika inficiranih HIV-virusom te uslijed ostalih imunokompromitirajućih stanja. Od izvanplućnih manifestacija najčešći su tuberkulozni pleuritis i tuberkulozni limfadenitis, a mogu biti zahvaćeni i koža, kosti, zglobovi, genitourinarni i gastrointestinlani sustav te mozak.
Plućna tuberkuloza obilježena je općim i respiratornim simptomima. Bolesnici se žale na brzo umaranje, gubitak na tjelesnoj težini, preznojavanje (koje je tipično izraženo u popodnevnim satima i noću) te subfebrilne temperature. Javlja se kroničan produktivni kašalj, često praćen hemoptizama, a u težim slučajevima moguće su i hemoptoe. Dispneja i pleuralna bol javljaju se kasnije.
Tuberkulozni pleuritis s izljevom nastaje prolaskom uzročnika u pleuralni prostor iz subpleuralnih žarišta, rjeđe hematogenom ili limfogenom diseminacijom, a može biti posredovan i imunološkom reakcijom (odgođena hipersenzitivna reakcija u sklopu primarne infekcije). Karakteristično se javlja kod mlađih osoba i obično je bez simptoma ili je praćen laganom dispnejom i probadanjem u prsištu. Moguć je i podražajni kašalj. Klasični znakovi plućne tuberkuloze obično izostaju. Izljev je obično jednostran. Neliječeni oblici često spontano prolaze, ali u dvije trećine se u roku od dvije godine razvija klasična plućna tuberkuloza.
Tuberkulozni limfadenitis također je češće sijelo tuberkulozne infekcije. Nastaje limfnim širenjem uzročnika iz primarnoga žarišta i regionalnih limfnih čvorova. Najčešće su zahvaćeni cervikalni i supraklavikularni limfonodusi. Klinički se uz opće simptome pojavljuju uvećani i bolni limfni čvorovi, čija palpatorna konzistencija ovisi o stupnju kazeozne nekroze. Koža iznad čvora je indurirana, a često postoji i limfokutana fistula kroz koju secernira gnojni sadržaj. Karakteristično, koža nije hiperemična i topla (tzv. hladni apsces).
Laringealna i bronhalna tuberkuloza nastaje kontaminacijom površine sluznice bacilom tuberkuloze koje nastaje tijekom iskašljavanja. Tipično se razvijaju karakteristični granulomi i ulceracije sluznice. Simptomi koji mogu ukazivati na takvu zahvaćenost su promuklost, stridor (zahvaćenost larinksa) ili wheezing (zahvaćenost traheje i bronha). Ovi su bolesnici vrlo zarazni zbog izbacivanja velike količine bacila.
Milijarna tuberkuloza rijedak je oblik tuberkuloze karakteriziran hematogenim rasapom uzročnika po cijelom organizmu stvaranjem sitnih granuloma veličine zrna prosa. Kliničkom slikom dominiraju izraženi opći simptomi (umor, gubitak teka, mršavljenje, febrilno stanje), respiratorni i gastrointestinalni simptomi, limfadenopatija, hepatosplenomegalija. U 20 do 30 % slučajeva zahvaćen je i središnji živčani sustav (glavobolja, neurološki deficiti, poremećaj stanja svijesti, kočenje vrata).
Dijagnoza tuberkuloze postavlja se na temelju anamnestičkih podataka i fizikalnoga nalaza, laboratorijskih pretraga, slikovnih dijagnostičkih metoda, mikrobiološkoga dokaza uzročnika te drugih specifičnih pretraga (tuberkulinski test, quantiferon test).
Anamneza i fizikalni pregled. Na tuberkulozu treba uvijek pomišljati u osoba koje se prezentiraju kroničnim općim i respiratornim simptomima (pa i akutnih) u prisutnosti klasičnih čimbenika rizika (prethodno navedeno). Fizikalni nalaz je nespecifičan, bolesnici su obično kahektični, a auskultacijski nalaz različit (nečujno disanje, hropci i sl.).
Laboratorijske pretrage. Laboratorijski nalazi u tuberkulozi su nespecifični, mogu pokazivati ubrzanu sedimentaciju eritrocita, povišene upalne parametre, a često je prisutna i anemija kronična bolesti.
Slikovne dijagnostičke metode. Klasični radiogram pluća glavna je dijagnostička metoda pri sumnji na tuberkulozu pluća (Slika 2.10.). Kod latentne infekcije radiološki nalaz može biti uredan ili se mogu uočiti Ghonova žarišta koja su obično smještena apikalno i imaju karakteristične kalcifikacije. Aktivnu bolest mogu karakterizirati manja ili veća područja konsolidacije s ili bez kavitacija, prošireni medijastinum uslijed hilarne ili paratrahealne limfadenopatije te pleuralni izljev. Kompjuterizirana tomografija obično se izvodi kod sumnje na milijarnu tuberkulozu. Radiološka dijagnostika, osim što je nužna u dijagnostici, bitna je i u praćenju liječenja, tj. utvrđivanju regresije ili progresije bolesti.
Slika 2.10. Radiološki nalaz milijarne tuberkuloze
Mikrobiološka dijagnostika ostaje zlatni standard u potvrdi dijagnoze tuberkuloze pluća. U kliničkoj praksi dostupne su tri mikrobiološke metode: direktna mikroskopija uzorka, klasične mikrobiološke kulture te molekularni testovi. Najčešći uzorak koji se koristi u dijagnostici je sputum koji se dobiva spontanim putem ili nakon provokacije udisanjem aerosola hipertonične fiziološke otopine. Ostali uzorci uključuju bronhoskopski dobiveni materijal (aspirat traheje, bronhoalveolarni lavat ili minilavat, transbronhalni bioptat), uzorak pleuralne tekućine te iznimno rijetko ispirak želuca (obično kod djece).
Direktna mikroskopija uzorka podrazumijeva specifično bojanje i mikroskopski pregled preparata u kojemu se može detektirati uzročnik. Glavna prednost ove metode je brzo dobivanje rezultata (isti dan), ali se preliminarna dijagnoza mora potvrditi specifičnijim metodama. Danas se preferira bojanje uzoraka fluorescentnom bojom auraminom te analiza flourescentnim mikroskopom (prikaz žuto-narančastih bacila na zelenoj podlozi) u odnosu na klasično bojanje po Ziehl-Neelsenu i klasičnu mikroskopiju gdje se bacili prikazuju kao acidorezistentni ljubičasti štapići. Za pozitivan nalaz potrebno je više od 104 bacila u 1 ml uzorka te se analizira tri jutarnja uzorka (iskašljaja). Ukupna senzitivnost pretrage za sva tri uzorka iznosi oko 70 %. Isti nalaz direktne mikroskopije imaju i druge netuberkulozne mikobakterije što treba imati na umu pri interpretaciji nalaza.
Mikrobiološke kulture predstavljaju klasični način uzgoja i izolacije uzročnika uz mogućnost testiranja osjetljivosti na antibiotike. Pri tome se koriste tekuće (na bazi bujona) ili krute podloge (na bazi agra ili jaja). Uzgoj na tekućim podlogama je brži, rezultati se dobivaju kroz jedan do tri tjedna, u odnosu na krute podloge kada se rezultati dobivaju kroz tri do osam tjedana. Testiranje osjetljivosti uzročnika na antibiotike dodatno produljuje proces za jedan do tri tjedna. Pretrage imaju visoku specifičnost i osjetljivost.
Molekularni testovi u dijagnostici tuberkuloze imaju sve veći značaj s obzirom na brzo i pouzdano dobivanje rezultata (unutar jednoga dana). Testovi se temelje na PCR metodi kojom se detektiraju specifične nukleinske kiseline uzročnika u danom uzorku. Danas postoje molekularni testovi kojima se potvrđuje sama prisutnost uzročnika u uzorku (dokaz specifične nukleinske kiseline u uzorku), ali i testovi kojima se može otkriti prisutnost uzročnika s genskom mutacijom koja je povezana s otpornošću na neki antituberkulotik (rimfampicin, izoniazid), što ima velike implikacije u započinjanju liječenja. To je posebno korisno kod bolesnika koji su već ranije primali antituberkulotike, koji su rođeni ili su živjeli duže od jedne godine u zemljama s visokom stopom multirezistentnih izolata, koji su bili u kontaktu s osobom kod koje je izoliran multirezistentni soj te kod HIV-pozitivnih osoba. Ova se metoda obično primjenjuje u slučajevima kada je potrebna brzo postaviti dijagnozu, kod bolesnika kod kojih je negativna direktna mikroskopija, obično kod djece, trudnica i imunokompromitiranih bolesnika. U Hrvatskoj se od 2005. godine na nacionalnoj razini provodi studija genotipizacije svih novoizoliranih sojeva bacila tuberkuloze na temelju čega se može razlikovati endogenu reaktivaciju tuberkuloze od superinfekcije.
Tuberkulinsko testiranje predstavlja kožni test kojim se provjerava stanično-posredovana imunost prema uzročniku tuberkuloze. Izvodi se kod sumnje na infekciju M. tuberculosis te može ukazivati na nju, ali ne i na aktivnu bolest. Test se sastoji od iniciranja 0,1 ml pročišćenoga proteinskog derivata (PPD) koji sadrži 5 tuberkulinskih jedinica intrakutano na volarnu stranu podlaktice. Očitanje testa vrši nakon 48 do 72 sata, a sastoji se od mjerenja transverzalnoga promjera nastaloga indurata. Negativan nalaz je infiltracija manja od 5 mm, pozitivan nalaz je infiltracija od 5 do 14 mm dok jaka reakcija ima infiltraciju veću od 15 mm, a vrlo jaka reakcija veću od 20 mm. Infiltracija veća od 15 mm kod prethodno cijepljenih osoba, odnosno veća od 5 mm kod necijepljenih osoba suspektna je na infekciju M. tuberculosis. Anergija je naziv za odsutnost kožne reakcije kod osoba zaraženih M. tuberculosis. Lažno negativni rezultati mogu se javiti kod bolesnika u aktivnoj infekciji (uključujući i fulminantnu tuberkulozu), imunodeficijentnih bolesnika (imunosupresivna terapija, kronična oboljenja) te ostalih anergičnih stanja (malnutricija, uznapredovala dob, stres i sl.). Lažno pozitivni rezultati mogu se javiti kod infekcija netuberkulinskim mikobakterijama kao posljedica križne reaktivnosti. Pozitivan tuberkulinski test ukazuje na infekciju M. tuberculosis, ali ne i na aktivnu bolest.
IGRA testovi (engl. Interferon Gamma Release Assays) temelje se na sposobnosti mjerenja otpuštanja gama interferona iz senzibiliziranih CD4+ limfocita u hepariniziranoj krvi nakon izlaganja specifičnim antigenima M. tuberculosis. U Hrvatskoj se u kliničkoj praksi najčešće primjenjuje QuantiFERON test. Antigeni koji se upotrebljavaju kod ovoga testa (ESAT-6 i CFP-10) nisu prisutni niti u jednom BCG-cijepnom soju kao ni u većini netuberkuloznih mikobakterija što daje prednost u ispitivanju infekcije M. tuberculosis kod bolesnika koji su cijepljeni, kao i pri razlikovanju od infekcija drugim netuberkulinskim mikobakterijama. Kao i tuberkulinski test, QuantiFERON test služi za dijagnostiku infekcije M. tuberculosis i nema ulogu u procjeni aktivnosti.
Liječenje. Osnovni cilj liječenja tuberkuloze eliminacija je bacila tuberkuloza iz zaražene osobe, a to se postiže primjenom antituberkulotika. Liječenje treba voditi pulmolog koji se bavi liječenjem takvih bolesnika i ima iskustva u tome. Liječenje se može provoditi ambulantno ili hospitalno. Ambulantno se mogu liječiti lakši slučajevi kada su bolesnici suradljivi (osobito u pogledu uzimanja terapije) i kada se pridržavaju uputa o mjerama sprječavanja širenja tuberkuloze (boravak u kući, izbjegavanje posjeta, prikrivanje lica i usta za vrijeme kašljanja ili kihanja i sl.). Hospitalno liječenje indicira se za nesuradljive bolesnike, bolesnike s težim oblikom bolesti i komorbiditetima te bolesnike kojima je potrebna dodatna dijagnostička obrada. Hospitalizirane bolesnike treba smjestiti u izolaciju, preporuča se soba s negativnim tlakom.
Neposredno promatranje liječenja (engl. directly observed therapy, DOT). Loša suradljivost bolesnika i neredovito uzimanje lijekova najčešći su uzroci terapijskoga neuspjeha, nastavka širenja tuberkuloze te razvoja rezistencije na antituberkulotike. Neposredno promatranje liječenja (DOT) podrazumijeva da medicinsko osoblje nadzire uzimanje svake doze lijeka, čime se povećava vjerojatnost da će se terapijski režim u potpunosti provesti. Glavni kriteriji za uvođenje DOT pristupa liječenju su: bolesnici za koje se očekuje da će biti nesuradljivi (npr. anamneza mentalnoga poremećaja, anamneza nesuradljivosti u liječenju tuberkuloze u prošlosti), bolesnici kod kojih su izolirani multirezistentni sojevi te bolesnici s lošim socioekonomskim prilikama (npr. beskućnici).
Antituberkulotici su antimikrobni lijekovi koje koristimo u liječenju tuberkuloze (eradikaciji M. tuberculosis) i predstavljaju okosnicu liječenja tuberkuloze. Najznačajniji antituberkulotici su: izonijazid (H), rifampicin (R), pirazinamid (Z) i etambutol, (E) te streptomicin (S). Liječenje se vrši primjenom više antituberkulotika kroz dulje vrijeme, a osnovni režimi liječenja opisani su u nastavku.
Izonijazid (H) je najpotentniji antituberkulotik i mora biti uključen u svaki režim liječenja, osim u slučaju rezistencije i nepodnošenja. Učinak ostvaruje inhibicijom sinteze mikolne kiseline koja je sastavni dio stanične stijenke mikobakterija. Glavna mu je nuspojava polineuropatija (utječe na metabolizam vitamina B6), a nju se prevenira istodobnom primjenom piridoksina u dozi od 10 mg/dan. Ostale nuspojave su kožni osipi i vrućica (alergijske reakcije) te se kod manje od 1 % može razviti hepatitis koji može imati fatalan ishod ako se nastavi s primjenom lijeka. Tijekom liječenja se preporuča provoditi redovne neurološke preglede te određivati jetrene markere (AST, ALT, ALP, GGT).
Rifampicin (R) je također jedan od najjačih antituberkulotika koji svoj učinak temelji na blokadi bakterijske ribonukleinske polimeraze te tako utječe na sintezu nukleinskih kiselina. Najčešća nuspojava je hepatotoksičnost koja se očituje tranzitornim povišenjem jetrenih enzima. Prekid primjene lijeka indiciran je samo ako dođe do porasta bilirubina ili su vrijednosti jetrenih enzima trostruko više od normalnih. Ostale nuspojave su trombocitopenija, vrućica, kožni osipi te gastrointestinalne tegobe. Karakteristično, sekreti bolesnika dobivaju narančastu boju, osobito urin. Tijekom liječenja potrebno je češće kontrolirati krvnu sliku uključujući trombocite te jetrene enzime. Rimfampicin može imati brojne interakcije s drugim lijekovima, a najčešće su inhibicija učinka oralnih kontraceptiva, kortikosteroida, varfarina, metadona, oralnih antidijabetika te digoksina.
Pirazinamid (Z) je derivat nikotinske kiseline koji je sličan izonijazidu po uskom spektru djelovanja ograničenom samo na M. tuberculosis. Glavne nuspojave su hiperuricemija, hepatotoksičnost kožni osipi te probavne smetnje. Tijekom liječenja preporuča se praćenje jetrenih enzima i urata. Interakcije su rijetke.
Etambutol (E) pokazuje manju djelotvornost u odnosu na ostale antituberkulotike te pokazuje samo bakteriostatski učinak. Glavna i karakteristična nuspojava je optički neuritis koji može dovesti do smanjenja vidne oštrine, pojave skotoma i sljepoće za zelenu i crvenu boju. Po prekidu uzimanja lijeka oporavak je potpun. Tijekom liječenja su preporučeni češći oftalmološki pregledi.
Streptomicin (S) je aminoglikozid koji se rjeđe primjenjuje zbog toksičnih učinaka i intramuskularne primjene. Učinak ostvaruje inhibicijom sinteze proteina i oštećenjem ribosoma. Glavne nuspojave su neurotiksičnost (oštećenje vestibularnoga živca) i nefrotoksičnost. Oštećenje vestibularnoga živca uglavnom je ireverzibilno. Također, češće su i alergijske reakcije u odnosu na antituberkulotike prvoga reda. Iz tih razloga ovaj se lijek koristi u drugoj liniji liječenja.
Standardni režimi liječenja. Tuberkuloza se liječi kombinacijom više antituberkulotika kroz dulji period, prema standardnim terapijskim algoritmima. Istodobnom primjenom više antituberkulotika nastoji se uništiti što veći broja uzročnika te umanjiti mogućnost nastanka rezistencije. Terapijski režimi jednaki su za pulmonalnu i ekstrapulmonalnu tuberkulozu. Svi algoritmi sastoje se iz dvije faze: inicijalna faza koja kod novooboljelih traje 2 mjeseca i stabilizacijska faza koja kod novooboljelih traje 4 mjeseca. U određenim situacijama obje faze liječenja mogu trajati dulje. Lijekovi se mogu primjenjivati svakodnevno ili se nakon prva dva tjedna svakodnevnoga uzimanja mogu uzimati tri puta tjedno, ali u ukupnoj jednakoj dozi. Produženi algoritam preporuča se bolesnicima koji imaju pozitivan razmaz ili kulturu nakon inicijalne faze liječenja, bolesnicima s HIV-koinfekcijom te bolesnicima s inicijalno težom kliničkom slikom. U nastavku će biti opisani osnovni terapijski režim (liječenje novooboljelih bolesnika, liječenje recidiva), liječenje tuberkuloze u slučaju zahvaćenosti središnjega živčanoga sustava, liječenje latentne tuberkuloze, liječenje rezistentne tuberkuloze te liječenje tuberkuloze kod bolesnika s jetrenom i bubrežnom insuficijencijom.
Osnovni terapijski režim. Standardni režim liječenja svih novooboljelih od plućne i izvanplućne tuberkuloze vrijedi za bolesnike koji nisu nikada prije liječeni, a podrazumijeva dvofazni režim u trajanju od šest mjeseci primjenom četiri antituberkulotika u inicijalnoj fazi tijekom dva mjeseca, a potom dva antituberkulotika u fazi održavanja tijekom četiri mjeseca (2HRZE/4HR). Kod bolesnika koji su prethodno liječeni primjenjuje se standardni režim ponovljenoga liječenja s pet antituberkulotika tijekom produljene inicijalne faze od tri mjeseca i s tri antituberkulotika tijekom produljene faze održavanja tijekom pet mjeseci (3HREZS/5HRE).
Liječenje tuberkuloze sa zahvaćenim CNS-om. Inicijalna faza liječenja s četiri antituberkulotika u trajanju od dva mjeseca istovjetna je prethodno opisanom, a nakon toga slijedi stabilizacijska faza koja traje deset mjeseci, a primjenjuju se izonizaid i rimfampicin tako da ukupno liječenje traje dvanaest mjeseci. Indicirana je i primjena kortikosteroida (prednizolona) s ciljem prevencije dugoročnih komplikacija.
Liječenje latentne tuberkuloze (kemoprofilaksa). Svrha i cilj liječenja latentne tuberkuloze je sprečavanje reaktivacije i pojave aktivne bolesti, a samim time i sprečavanje širenja bolesti na druge osobe. Iz tih razloga provodi se testiranje na tuberkulozu u vidu tuberkulinskoga ili IGRA testa. Liječenje latentne tuberkuloze indicirano je u sljedećim slučajevima: 1) osobe mlađe od 35 godina s pozitivnim tuberkulinskim ili IGRA testom; 2) zdravstveni djelatnici s pozitivnim tuberkulinskim ili IGRA testom; 3) osobe koje će započeti biološku terapiju i imaju pozitivan IGRA test; 4) HIV-pozitivni bolesnici s pozitivnim IGRA testom te 5) bolesnici s radiološkim znacima preboljene tuberkuloze. Na raspolaganju nam stoje tri terapijska algoritma: 1) primjena izonizida kroz devet mjeseci; 2) primjena rimfampicina i pirazinamida kroz dva mjeseca ili 3) primjena rimfampicina kroz četiri mjeseca.
Liječenje rezistentne tuberkuloze. Rezistencija na antituberkulotike predstavlja sve veći javnozdravstveni problem. Čimbenici koji su povezani s pojavom rezistencije su: 1) ranije liječenje antituberkuloticima, 2) koinfekcija HIV-virusom, 3) infekcija stečena u područjima s visokom učestalosti rezistencije, 4) kontakt s oboljelom osobom koja ima rezistentni soj te 5) terapijski neuspjeh unatoč dokumentiranoj adherenciji bolesnika u uzimanju terapije. Najčešće se susrećemo s monorezistentnim i multirezistentnim sojevima, dok su ostali izuzetno rijetki. Kod monorezistencije na izoniazid (što je najčešći oblik rezistencije) bolesnici se mogu uspješno liječiti primjenom rimfampicina, pirazinamida te etambutola ili streptomicina kroz šest mjeseci ili primjenom rimfamicina i etambutola kroz 12 mjeseci. Liječenje bolesnika s ostalim rezistentnim oblicima M. tuberculosis treba provoditi u specijaliziranim ustanovama, a liječenje se treba bazirati na nalazu testa osjetljivosti te može trajati i do 24 mjeseca. U liječenju multirezistentne tuberkuloze koriste se terapijski režimi, odnosno kombinacije lijekova iz skupine antituberkulotika drugoga reda u koje ubrajamo aminoglikozide (amikacin, kanamicin, cikloserin), flurokinolone (ciproflosacin, ofloksacin, mofloksacin), rifampicine (rifabutin, rifapentin) te tioamide (etionamid, protionamid).
Liječenje tuberkuloze kod trudnica i za vrijeme dojenja. Opće prihvaćen algoritam kod trudnica i dojilja obuhvaća primjenu izonizaida, rimfampicina i etambutola kroz dva mjeseca nakon čega slijedi stabilizacijska faza u kojoj se primjenjuje izoniazid i rimfampicin. Etambutol se može isključiti iz terapije nakon mjesec dana ako je potvrđena osjetljivost uzročnika na izonizaid i rimfampicin. Pirazinamid nema jasno definiran rizik od teratogenosti, koristi se samo ako je dokazana rezistencija na druge lijekove, a potvrđena je osjetljivost na pirazinamid. Streptomicin je kontraindiciran.
Liječenje tuberkuloze kod bolesnika s jetrenom i bubrežnom insuficijencijom. Osobitu pozornost treba obratiti kod bolesnika s oštećenom funkcijom jetre i bubrega. S obzirom na to da su mnogi anituberkulotici hepatotoksični, potrebna je rutinska kontrola jetrenih nalaza i sukladno nalazima liječenje treba privremeno prekidati do oporavka funkcije jetre. Bolesnici s jetrenom insuficijncijom mogu uzimati jedan ili čak dva hepatotoksična lijeka, ali tri nikako. Ponuđene su sheme liječenja s jednim, dva ili nijednim hepatotoksičnim lijekom koji traju bitno dulje od standardnih shema liječenja (2HES/10HE ili 2HRSE/6HR ili 18 - 24 SE+kinolon). Kod blage i umjerene bubrežne insuficijencije daju se uobičajene doze izoniazida, rimfampicina i pirazinamida, aminoglikozide treba izbjegavati, dok se etambutol može primijeniti samo iznimno. Kod teške bubrežne insuficijencije treba smanjiti i dozu izonizaida i pirazinamida. Ako je bolesnik na hemodijalizi, lijekovi se daju nakon dijalize.
Prevencija tuberkuloze započinje primjenom cjepiva (BCG cjepivo) u rodilištu te docjepljivanjem nereaktora u dječjoj dobi (nakon provjere tuberkulinskim testom). Na taj je način znatno smanjena učestalost bolesti u dječjoj i adolescentnoj dobi. U Republici Hrvatskoj BCG cijepljenje propisano je Pravilnikom i mora se provoditi kod sve djece koja nemaju kontraindikacija. Otkrivanje inficiranih bolesnika u latentnoj fazi bolesti kako bi se provelo liječenje (kemoprofilaksa) i spriječilo napredovanje prema aktivnoj bolesti, kada je bolesnik zapravo kontagiozan te može širiti bolest, preporuča se u sljedećim situacijama: osobe koje su bile u uskom kontaktu s novooboljelim bolesnikom, imunokompromitirane osobe (prije početka biološke terapije, bolesnici s HIV-koinfekcijom, bolesnici s malignom hematološkom bolesti, bolesnici koji idu na transplantaciju solidnih organa) te u određenim socijalnim okolnostima (useljenici iz zemalja s visokom incidencijom tuberkuloze, beskućnici i sl.). Testovi koji se izvode u tu svrhu su tuberkulinski test i IGRA testovi (QuantiFERON).
Prognoza je načelno dobra i kod svih imunokompetentnih bolesnika koji su pravilno uzimali lijekove postiže se eradikacija uzročnika, odnosno izlječenje. Stopa relapsa bolesti je manja od 5 %. Najčešći uzrok relapsa je bolesnikova neadherencija po pitanju uzimanja terapije.
INFEKCIJE PLUĆA NETUBERKULOZNIM (ATIPIČNIM) MIKOBAKTERIJAMA
Definicija i čimbenici rizika. Infekciju pluća mogu uzrokovati i druge mikobakterije osim M. tuberculosis, a nazivamo ih netuberkulozne ili atipične mikobakterije. S obzirom na to da se radi o manje virulentnim mikrobima, infekcija pluća tim uzročnicima puno je rjeđa i obično je povezana s postojećim rizičnim čimbenicima, kao što je strukturna bolest pluća (kronična opstruktivna plućna bolest, bronhiektazije), HIV-infekcija ili genetski defekti stvaranja gama interferona ili interleukina 12.
Etiopatogeneza. Atipične mikobakterije rasprostranjene su u tlu i vodi te s obzirom na slabu virulenciju kod većine izlaganja ovim uzročnicima ne dolazi do razvoja bolesti nego samo do kolonizacije. Razvoju bolesti pogoduju navedeni rizični čimbenici. Najčešće atipične mikobakterije koje uzrokuju bolest kod ljudi su Mycobacterium avium complex (M. avium, M. intracellularae), Mycobacterium kansasii, Mycobacterium abscessus te Mycobacterium xenopi. Interpersonalni prijenos i zaraza ovim uzročnicima je rijetka. Infekcija pluća ovim uzročnicima patološki se može prezentirati na jedan od sljedeća tri oblika: 1) kavitirajuća lezija u gornjim režnjevima koja oponaša tuberkulozu, 2) bronhiektazije koje zahvaćaju srednje režnjeve pluća ili 3) hipersenzitivni pneumonitis.
Klinička slika. U kliničkoj slici dominiraju kroničan kašalj i iskašljavanje, dok su drugi respiratorni simptomi (dispneja, hemoptize), kao i sistemski (vrućica, malaksalost, mršavljenje), slabije izraženi. Bolest može imati progresivan tijek ili može mirovati kroz duže vrijeme.
Dijagnoza se postavlja na temelju anamneze, radiološkoga nalaza i mikrobioloških pretraga. Anamnestički podatak o ranijim plućnim bolestima ključan je za postavljanje sumnju na ovu infekciju s obzirom na to da se ona ne razvija na zdravim plućima kod imunokompetentnih osoba. Radiološki nalaz sličan je onome kod tuberkuloze što uključuje kavitirajuće lezije čije su stijenke tanje, a i pleuralni izljev je rijetka pojava. U nejasnim situacijama indicirana je i kompjuterizirana tomografija. Konačna dijagnoza počiva na mikrobiološkom nalazu uzročnika (kultura sputuma ili drugoga uzorka), iako nalaz treba interpretirati u kontekstu kliničke slike i radiološkoga nalaza s obzirom na to da ovi uzročnici mogu kolonizirati dišne puteve bez da uzrokuju bolest.
Liječenje. Osnovno liječenje je antimikrobno i ovisi o izoliranoj mikobakteriji. Osnovni terapijsku algoritam u slučaju izolacije M. avium complex uključuje primjenu klaritromicina ili azitromicina, rimfampicina i etambutola kroz 12 mjeseci. Kod bolesnika s izraženim fibrokavitirajućim lezijama u prva dva mjeseca liječenja terapiji se može dodati i streptomicin ili amikacin. Kirurška resekcija indicirana je samo u slučajevima dobro ograničenih lezija i to kod mladih osoba dobre konstitucije. Kod izolacije M. kansasii preporuča se primjena rifampicina, izoniazida i etambutola kroz osamnaest mjeseci s minimalno dvanaest mjeseci od negativizacije sputuma.
Prognoza je načelno dobra i kod bolesnika koji se pridržavaju terapijskoga algoritma postiže se uspješna eradikacija uzročnika (izlječenje).
GLJIVIČNE INFEKCIJE PLUĆA
Definicija. Gljivične infekcije pluća ili plućne mikoze su bolesti pluća koje nastaju kolonizacijom i invazijom endogenim ili egzogenim gljivicama u dišnom sustavu. U pravilu se radi o infekcijama kod osoba s poremećenim imunološkim obrambenim mehanizmima jer u protivnom obrambeni mehanizmi i imunološki sustav unište većinu gljivica.
Etiopatogeneza. Gljivične infekcija pluća mogu nastati na dva načina pa razlikujemo egzogene (primarne) i endogene (sekundarne) plućne mikoze.
Egzogene plućne mikoze nastaju unosom gljivica iz vanjskoga svijeta u organizam. Gljivice su ubikvitarni organizmi i nalaze se posvuda oko nas i samim time veliki broj njih unosi se u dišni sustav tijekom disanja. Ipak, očuvani obrambeni mehanizmi kao što je funkcionalan mukocilijarni epitel i alveolarni makrofagi odmah ih uništavaju i eliminiraju prije nego one izazovu patološku reakciju. Prema tome, oštećenje tih mehanizama povezano je s većom učestalošću razvoja gljivičnih infekcija pluća.
Endogene plućne mikoze uzrokovane su gljivicama koje normalno nalazimo kao saprofite u ljudskoj mikrobnoj flori. Njihovom umnažanju i invaziji pogoduju stanja u kojima dolazi do slabljenja imunološkoga sustava kao što su antibiotska terapija, imunosupresivna terapija, maligna oboljenja, kronične plućne bolesti, kronične nezarazne bolesti kao što je šećerna bolest, kronično bubrežno zatajenje i sl.
Najčešće gljivične infekcija pluća su kandidijaza i aspergiloza, a mogu se naći i kriptokokoza, mukormikoza te u endemičnim krajevima histoplazmoza, blastomikoza i kokcidiomikoza.
PLUĆNA KANDIDIJAZA
Etiopatogeneza. Gljivice iz roda Candida spp. (C. albicans, C. glabrata, C. krusei, C. parapsilosis) dio su normalne flore usne šupljine, organa probavne cijevi, kože i genitalnoga sustava kod žena. Infekcija pluća posljedica je razvoja invazivne kandidijaze koja podrazumijeva invaziju gljivica u krvotok (kandidemija) s posljedičnim naseljavanjem drugih organa i tkiva (meningitis, visceralna i pulmonalna kandidijaza, endoftalmitis, osteomijelitis). Glavni rizični čimbenici za razvoj invazivne kandidijaze su prolongirana neutropenija, nedavna abdominalna operacija, terapija antibioticima širokoga spektra, kronična bubrežna bolest te intrvaskularni kateteri (osobito centralni za potrebe parenteralne nutricije).
Klinička slika. Plućna kandidijaza daje sliku žarišnih pneumonija (dispneja, kašalj, iskašljavanje, hemoptize), a često su prisutni i drugi znakovi sistemske kandidijaze (vrućica, hepatosplenomegalija, mukokutane lezije, abdominalna bol, razvoj septičkoga šoka). Kod neprepoznatih i neliječenih bolesnika razvija se progresivna respiratorna insuficijencija.
Dijagnoza se postavlja na osnovi anamnestičkih podataka (otkrivanje rizičnih čimbenika), laboratorijskih nalaza (povišeni upalni parametri), radiološke snimke pluća (plućni žarišni upalni infiltrat) te mikrobioloških pretraga (kultura sputuma, hemokultura). Hemokulture su pozitivne kod samo 50 % bolesnika.
Liječenje se temelji na primjeni antimikotika, najprije empirijski, a kasniju terapiju prema potrebi treba prilagoditi nalazu testa osjetljivosti. Preporučeni izbor antibiotika temelji se na najčešće izoliranom uzročniku (C. albicans) i stanju bolesnika.
Izbor antimikotika. Početni izbor antimikotika ovisi o stanju bolesnika. Stabilnim bolesnicima s umjerenom bolesti preporuča se započeti liječenje flukonazolom (prva doza 800 mg iv, nakon čega se nastavlja 400 mg iv/dan), dok se teže oboljelim bolesnicima i onima koji su nedavno uzimali derivate triazola preporuča primjena lijekova iz skupine ehinokandina: kaspofugin (prva doza 70 mg iv, nastaviti 50 mg iv/dan), mikafungin (100 mg iv/dan) ili anidulafungin (prva doza 200 mg iv, nastaviti 100 mg iv/dan). Glavna prednost ehinokandina je ta što pokrivaju i drugi najčešće izoliran uzročnik – C. glabrata.
Trajanje liječenja. Liječenje treba trajati sve dok ne dođe do potpune rezolucije bolesti i simptoma, a najmanje dva tjedna od zadnje pozitivne mikrobiološke kulture. Kada dođe do stabilizacije bolesnika i kliničkoga poboljšanja, može se prijeći s parenteralne na peroralnu terapiju (flukonazol 200 - 800 mg u jednoj ili dvije dnevne doze).
Ostale napomene. C. glabrata i C. krusei rezistentni su na triazole te njihovo liječenje treba provoditi ehinokandinima, eventualno vorikonazolom, ako je osjetljivost dokazana testom osjetljivosti. C. parapsilosis dobor reagira na liječenje flukonazolom.
PLUĆNA ASPERGILOZA
Etiopatogeneza. Aspergiloza je naziv za skupinu bolesti koje uzrokuje gljivica iz roda Aspergillus. Najčešće izolirana je A. fumigatus, dok se rjeđe mogu izolirati i A. flavus te A. niger. Te gljivice u prirodi najčešće nalazimo na lišću i drveću u fazi truljenja, a čovjek se zarazi inhalacijom spora. Aspergiloza ima tri kliničke forme: aspergilom, alergijska bronhopulmonalna aspergiloza te invazivna aspergiloza.
Aspergilom predstavlja najčešći oblik gljivične infekcije pluća. Radi se o konglomeratu gljivičnih hifa, fibrina i staničnoga detritusa koji nastaje kolonizacijom i neinvazivnim rastom uzročnika u patološkim šupljinama pluća (posttuberkulozne kaverne, bronhiektazije). Tipično, hife aspergilusa formiraju micelij koji nepotpuno ispunjava konglomerat tako da u njemu uvijek ostaje sloj zraka poput polumjeseca koji se jasno uočava na radiološkim snimkama (karakteristično se kod promjene položaja tijela mijenja i položaj micelija – Mondov znak). Bolest je uglavnom asimptomatska, no rastom konglomerata može doći do hemoptiza i hemoptoe. Dijagnoza se postavlja na osnovi anamnestičkih podataka (ranije kavitirajuće plućne lezije), tipičnoga radiološkog nalaza – najbolje kompjuterizirana tomografija (konglomerat s zrakom u obliku polumjeseca) te mikrobiološke potvrde uzročnika u uzorcima (najčešće aspirat bronha). Liječenje simptomatskih bolesnika (hemoptoa, hemoptize) poglavito je kirurška. Kod inoperabilnosti u obzir dolazi embolizacija bronhalne arterije. Primjena sistemskih antimikotika nije se pokazala kao najučinkovitija, a antimikotik izbora je vorikonazol.
Alergijska bronhopulmonalna aspergiloza označava stanje u kojemu dolazi do kolonizacije dišnih puteva ovim mikroorganizmom kod bolesnika s alergijskom astmom. Kod njih to može izazvati pogoršanje bolesti lučenjem toksina te izaziva izraženu eozinofiliju. Ta je bolest opisana u poglavlju plućne eozinfilije.
Invazivna aspergiloza je rijetka klinička manifestacija aspergiloze, a javlja se kod imunokompromitiranih pojedinaca (osobito bolesnika s neutropenijom i HIV-pozitivnih bolesnika). Invazivna aspergiloza obično se razvija iz plućnoga aspergiloma te je obilježena zahvaćanjem krvnih žila, njihovom mikroembolizacijom i nekrozom plućnoga tkiva (nekrotizirajuća plućna aspergiloza) uz mogućnost hematogene diseminacije (koža, središnji živčani sustav, drugi organi). Klinički se to stanje prezentira teškim plućnim simptomima, razvojem respiratorne insuficijencije te znacima zahvaćenosti drugih organa. Na diseminiranu invazivnu aspergilozu treba pomišljati kod svih imunokomprimitiranih bolesnika sa septičnim stanjem te znakovima plućne aspergiloze (radiološki nalaz, mikrobiološki nalaz). Potvrdu bolesti dobivamo izolacijom uzročnika iz hemokulture (često negativni rezultati) te brzim molekularnim PCR Aspergillus DNA testom ili određivanjem galaktomanana (sastojak stanične stijenke aspergilusa) u serumu ili bronhoalveolarnom lavatu (ELISA test). Lijek izbora je vorikonazol (6 mg/kg iv dva puta tijekom prvoga dana, a zatim 4 mg/kg svakih 12 sati). Po stabilizaciji bolesnika prelazi se na peroralno liječenje vorikonazolom (4 mg/kg 2 x/dan). Alternativni lijekovi su lipidna formulacija amfotericina B (3 - 5 mg/kg/dan) ili kaspofugin (prva doza 70 mg iv, nastaviti 50 mg iv/dan). Kod kritično oboljelih osoba koje ne reagiraju na monoterapiju može se pokušati s kombinacijom vorikonazol/kaspofugin ili amfotericin B te razmisliti o kirurškoj intervenciji. Smrtnost je i dalje visoka, oko 50 %.
KRIPTOKOKOZA
Etiopatogeneza. Kriptokokoza je infekcija koju uzrokuje gljivica Cryptococcus neoformans koju se može naći kao saprofit kože i crijevne sluznice, a u većim se količinama može naći i u ekskretima ptica. Stoga, infekcija njome može nastati endogenim ili egzogenim putem. S obzirom na to da je ulazno mjesto dišni sustav, najčešće očitovanje je plućna infekcija, iako uzročnik ima sklonost i prema meningeama. Kod imunokompetnetnih osoba infekcija je ubrzo svladana i prolazi asimptomatski. Progresija i klinički manifestna bolest uglavnom je povezana s stanjima imunodeficijencije (oportunistička infekcija). Najčešće kliničke manifestacije su kriptokokna penumonija i kriptokokni menigitis, a moguća je i sistemska hematogena diseminacija. Zahvaćena tkiva sadrže cistične tvorbe koje imaju želatinozan izgled zbog nakupljenoga kriptokokonoga kapsuliranog polisaharida.
Klinička slika. Simptomi plućne kriptokokoze su opća slabost, umor i malaksalost uz subfebrilne temperature i dugotrajan, uglavnom neproduktivan kašalj. U teškim slučajevima razvija se teška progresivna pneumonija i akutni respiratorni distres sindrom. Kripotokokni meningitis može prolaziti asimptomatski ili imati minimalne simptome, a kasnije se razvija slika moždanoga edema (glavobolja, smetenost, poremećeni vid, poremećaj svijesti). Diseminirana bolest obilježena je febrilnim stanjem, mukokutanim lezijama, hepatosplenomegalijom, akutnom bubrežnom ozljedom i sl.
Dijagnoza se postavlja na osnovi anamneze koja uključe podatke o ranijim bolestima i predisponirajućim čimbenicima, radiološke snimke pluća (nodularne lezije u donjim segmentima pluća, rjeđe se nađu veće zone upalnoga infiltrata ili milijarni rasap) te mikrobiološkoga dokaza uzročnika u različitim uzorcima (sputum, urin, krv, cerebrospinalni likvor). Kod sumnje na meningitis indicirana je lumbalna punkcija te MRI snimanje mozga koje je osjetljiviji nego CT u detekciji sitnih kriptokoknih lezija. Biokemijska analiza cerebrospinalnoga likvora pokazuje povećanu koncentraciju proteina, pleocitozu s dominacijom mononukleara te sniženu glukozu. Na raspolaganju je latekst test na kapsularni kriptokokni antigen u likvoru ili serumu.
Liječenje. Ako se radi o asimptomatskoj, ograničenoj plućnoj leziji kod imunokompetentnih osoba, liječenje nije potrebno, iako neki autori preporučuju liječenje flukonazolom. Pri razvijenoj bolesti i kod bolesnika s imunodeficijencijom preporuča se provesti punu shemu liječenja koja uključuje liposomalni amfotericin B u dozi od 3 - 4 mg/kg/dan intravenski kroz četrnaest dana nakon čega slijedi peroralna primjena flukonazola u dozi do 400 mg/dan kroz sljedećih osam tjedana. Kod meningitisa i bolesnika u teškom stanju, uz ovu se terapijsku shemu može dodati flucitozin (25 mg svakih 6 sati) kroz šest do deset tjedana. Zbog mogućnosti relapsa bolesti neki autori preporučuju profilaktičnu primjenu flukonazola u dozi od 200 mg/dan kroz sljedećih deset mjeseci, a kod HIV-pozitivnih osoba doživotno.
MUKORMIKOZA
Etiopatogeneza. Mukormikoza je naziv za infekcije uzrokovane različitim gljivicama kao što su Mucor, Rhizopus, Lichtheimia te Cunninghamella. Radi se o gljivicama koje se nalaze na trulim biljkama i tlu te se u organizam unose inhalacijom spora. Infekcija nastaje kod imunodeficijentnih bolesnika, a to su obično bolesnici na imunosupresivnoj terapiji, bolesnici s malignom bolesti, nekontroliranim dijabetesom ili kroničnim bubrežnim zatajenjem. Radi se o oportunističkoj infekciji.
Klinička slika. Bolest se ponajprije razvija i zahvaća nos, sinuse i orbite, a glavna manifestacija su nekrotične ulceracije sluznice. Nekrotizirajući sinusitis može biti kompliciran razvijem tromboze kavernoznoga sinusa. Moguća je i zahvaćenost pluća kada se očituje kao nekrotizirajuća pneumonija te prodorom u krvne žile praćenim hematogenom diseminacijom.
Dijagnoza se postavlja teško, s obzirom na to da je klinička slika nespecifična, a mikrobiološki nalazi nepouzdani (većinom su razmazi i kulture negativni). Konačnu dijagnozu u pravilu daje biopsija lezije u kojoj se nalaze hife gljivica.
Liječenje uključuje kombinaciju kirurškoga debridmana te antifungalne terapije. Započinje se intravenskom promjenom liposomalnoga amfotericina B (5 mg/kg/dan), a nakon stabilizacije terapija se nastavlja peroralnom primjenom posakonazola u dozi od 300 mg/dan. Stopa mortaliteta je visoka i iznosi i do 40 %.
HISTOPLAZMOZA
Etiopatogeneza. Histoplazmoza je infekcija koju uzrokuje gljivica Histoplasma capsulatum. Ona se nalazi na tlu kontaminiranome izmetom ptica i šišmiša, a čovjek se zarazi inhalacijom spora. Bolest je endemična za područje Amerike, Azije i Afrike.
Klinička slika. Klinički se može očitovati u tri oblika: akutna plućna histoplazmoza, progresivna diseminirana histoplazmoza i kronična plućna histoplazmoza. Akutna plućna histoplazmoza može imati različito kliničko očitovanje, od simptoma nalik gripi do teške pneumonije, traje od jednoga do šest tjedana i obično dobro završava. Simptomi uključuju opće infektivne simptome, dispneju i kašalj. Progresivna diseminirana histoplazmoza obično se nadovezuje na akutnu plućnu histoplazmozu kod imunodeficijentnih bolesnika, a uz vrućicu se razvijaju i drugi znakovi bolesti, ovisno o zahvaćenosti organa i organskih sustava. Kronična plućna histoplazmoza obično se susreće kod starijih bolesnika koji već imaju postojeću kroničnu bolest pluća. Karakterizirana je asimptomatskim prisustvom kavitirajućih lezija i infiltrata, obično u apeksima pluća.
Dijagnoza i liječenje. Dijagnoza se postavlja na osnovi anamnestičkih (osobito epidemioloških) podataka, radiološkoga nalaza na plućima te mikrobiološke potvrde iz različitih uzoraka (pozitivna kultura i/ili pozitivan antigen test). Liječenje se provodi itrakonazolom (200 - 400 mg/dan), a u težim slučajevima intravenskom primjenom liposomalnoga amfotericina B (3 mg/kg/dan). Liječenje može trajati i do nekoliko mjeseci.
BLASTOMIKOZA
Blastomikoza je infekcija koju uzrokuje gljivica Blastomyces dermetiditis. Bolest je endemična u dijelovima Sjeverne Amerike i Kanade. Uzročnik se nalazi ubikvitarno u prirodi i čovjek se zarazi udisanjem spora. Najčešća klinička manifestacije je plućna blastomikoza koju karakteriziraju umjerena vrućica, dispneja, pleuralna bol te kašalj koji je najprije neproduktivan, a kasnije postaje purulentan. U težim oblicima bolesnici postaju prostrirani te je moguća hematogena diseminacija, najčešće u kožu. Dijagnoza se postavlja na osnovi anamnestičkih podataka, radiološke snimke pluća (nespecifični upalni infiltrati) te mikrobiološkoga dokaza uzročnika (kulture, biopsija, antigen test). Liječenje se provodi primjenom itrakonazola (200 - 400 mg/dan), a u težim slučajevima intravenskom primjenom liposomalnoga amfotericina B (0,5 - 1 mg/kg/dan). Liječenje može trajati i do nekoliko mjeseci.
KOKCIDIOMIKOZA
Kokcidiomikoza označava infekciju koju uzrokuje gljivica Coccidioides immitins, koja se nalazi kao saprofit u tlu te se čovjek zarazi inhalacijom spora. Bolest se pojavljuje u jugoistočnim dijelovima SAD-a i Meksiku. Inkubacija traje oko deset dana, a očituje se akutnim plućnim simptomima kao što su umjerena dispneja, kašalj i iskašljavanje uz opće infektivne simptome. Uz to, mogu se naći i eritema nodozum, konjuktivitis i pleuralni izljevi. Uglavnom je oporavak potpun, a samo se kod manjega broja bolesnika razvijaju plućne kavitacije s hemoptizama i hematogeni rasap uzročnika (meningitis, osteomijelitis, hepatosplenomegalija). Dijagnoza se postavlja na osnovi anamneze, radiološkoga nalaza pluća (nespecifični upalni infiltrati) te seroloških pretraga (IgM, IgG protutijela). Identifikacija uzročnika na kulturama moguća je u specijaliziranim laboratorijima. Bolest je najčešće samoizlječiva, a kod teških plućnih i diseminiranih oblika primjenjuje se itrakonazol ili flukonazol. Amfotericin B rezerviran je za najteže oblike bolesti.
Definicija. Bronhiektazije predstavljaju stalno, abnormalno proširenje bronha i bronhiola udruženo s propadanjem bronhalne stijenke. One nastaju sekundarno kao posljedica brojnih poremećaja i stanja povezanih s kroničnom nekrotizirajućom upalom bronhalne stijenke.
Epidemiologija. Bronhiektazije se danas rjeđe susreću, osobito u odrasloj dobi. Razlog tome leži u prevenciji, ranom prepoznavanju i/ili pravovaljanom liječenju plućnih infekcija koje se najčešće povezuju s pojavom bronhiektazija, a u prvom se redu tu misli na tuberkulozu. U razvijenim su zemljama bronhiektazije danas najčešće povezane s cističnom fibrozom.
Etiopatogeneza. U svojoj su osnovi bronhiektazije posljedica kronične nekrotizirajuće upale stijenke bronha, koja se može razviti primarno ili sekundarno, uslijed bronhoopstrukcije ili poremećaja imunološkoga sustava. Kronična nekrotizirajuća upala stijenke bronha dovodi do strukturnih poremećaja same stijenke (gubitak elastičnih i mišićnih vlakana), kao i okolnoga intersticija i alveola, a sve to pogoduje patološkom proširenju bronha. Takvi prošireni bronhi ispunjeni mukoznim sekretom čine idealnu podlogu za naseljavanje bakterija i nastanak superponiranih infekcija te stoga glavnu kliničku manifestaciju čine opetovane bakterijske infekcije. Takve infekcije dodatno pridonose širenju bronhiektazija i nastaje začarani krug. Kod oko jedne trećine bolesnika točan uzrok ostaje nepoznat. Načelno, bronhiektazije dijelimo na kongenitalne i stečene.
Kongenitalne bronhiektazije posljedica su prirođenih bolesti ili stanja koja pogoduju razvoju kronične nekrotizirajuće upale bronhalne stijenke. Najčešća stanja su: cistična fibroza, Kartagenerov sindrom te stanja prirođene imunodeficijencije.
Cistična fibroza je najčešći kongenitalni uzrok bronhiektazija. One nastaju kao posljedica poremećene egzokrine sekrecije uslijed čega nalazimo pojačano zadržavanje viskozne sluzi unutar bronha i bronhiola posljedično čemu se javljaju opstrukcije te sekundarne infekcije. Bronhiektazije povezane s cističnom fibrozom su opsežne, lokalizirane su difuzno i bilateralno te postaju klinički manifestne već u djetinjstvu.
Kartagenerov sindrom rjeđi je uzrok kongenitalnih bronhiektazija, a u njegovoj osnovi nalazimo poremećaj funkcije cilija zbog čega se javlja pojačano zadržavanje sekreta unutar lumena bronha i tako stvara sklonost razvoju sekundarnih infekcija. U svom punom kliničkom očitovanju Kartagenerov sindrom čini trijas: bronhiektazije, sinusitis i situs viscerum inversus.
Stanja prirođene imunodeficijencije, kao što su primarna hipogamaglobulinemija te prirođeni poremećaji funkcije neutrofila, stvaraju povećanu sklonost respiratornim infekcijama koje mogu dovesti do nekrotizirajuće upale stijenke bronha i nastanka bronhiektazija.
Stečene bronhiektazije najčešće nastaju kao posljedica plućne infekcije ili bronhoopstrukcije, no postoje i drugi, rjeđi mogući etiološki čimbenici.
Plućne infekcije. Danas se smatra je jedna trećina slučajeva bronhiektazija uzrokovana plućnim infekcijama, i to godinama prije pojave same bolesti. Virusne i bakterijske infekcije u djetinjstvu mogu uzrokovati izravno permanentno oštećenje stijenke bronha što će rezultirati pojavom bronhiektazija godinama nakon inicijalne infekcije. Infekcije mikobakterijama danas se najčešće povezuju sa sekundarnom pojavom bronhiektazija.
Bronhoopstrukcija. Benigna stenoza bronha, endobronhalni tumor, strano tijelo, mukoidna impakcija ili ekstraluminalna kompresija mogu dovesti do opstrukcije bronha i otežanoga ili nemogućeg odstranjenja sekreta što rezultira njegovim nakupljanjem u distalnom dijelu čime nastaje pogodan medij za naseljavanje bakterija i superponirane infekcije koja može dovesti do bronhiektazija.
Ostali etiološki čimbenici. Češća pojava bronhiektazija može se vidjeti i kod bolesnika sa sistemskim autoimunim bolestima vezivnoga tkiva (reumatoidni artritis, Sjögrenov sindrom, sistemski lupus), ezofagealnom disfunkcijom (regurgitacija kiseloga želučanog sadržaja i kronična upala bronha) te kod bolesnika s idiopatskim upalnim bolestima crijeva. Točni patogenetski mehanizmi kod takvih bolesnika nisu jasni.
Mikrobiologija. Opetovane bakterijske infekcije jedna su od temeljnih kliničkih karakteristika bronhiektazija. Prošireni bronhi, otežano odstranjenje te posljedično nakupljanje sekreta u njima čine glavne pretpostavke za naseljavanje bakterija i nastanak superponiranih infekcija. Najčešći uzročnici su: Haemophilus influenzae (35 %), Pseudomonas aeruginosa (31 %), Moraxella catarrhalis (20 %), Staphylococcus aureus (14 %) i Streptococcus pneumoniae (13 %).
Patologija. Bronhiektazije najčešće zahvaćaju srednje velike bronhe (4. do 9. generacija grananja) što je posljedica građe stijenke (sadrže manje hrskavice). Promjene mogu biti lokalizirane ili difuzne. Lokalizacija bronhiektazija može biti povezana s etiologijom, tako da bronhiektazije nakon tuberkuloze najčešće nastaju u gornjim režnjevima, a nakon bakterijskih i virusnih infekcija u donjim režnjevima. Inače su bazalne lokalizacije češće jer srednji i gornji režnjevi imaju prirodno bolju drenažu sekreta. Stijenke bronhiektazija prožete su upalnim infiltratom kojeg poglavito čine neutrofili, a mišićno-vezivni sloj zamijenjen je vezivnim tkivom. Okolno tkivo (intersticij, alveole) također je destruirano, sadrži dosta granulacijskoga i vezivnoga tkiva.
Klinička slika. Kliničke manifestacije ponajprije ovise o veličini i lokalizaciji bronhiektazija. Manje bronhiektazije mogu biti u potpunosti asimptomatske. Osnovni simptomi su kašalj, gnojni iskašljaj te pojava dispneje. Simptomi su početno blagi, no s vremenom postaju sve izraženiji. Takav tijek bolesti povremeno prekidaju rekurentne superinfekcije koje se očituju vrućicom, intenziviranjem kašlja i iskašljavanja, dispnejom i hemoptizama. Karakteristično je da se rekurentne pneumonije javljaju na istom mjestu i slabije reagiraju na klasičnu antibiotsku terapiju. S progresijom bolesti bolesnici gube na tjelesnoj težini, razvijaju batićaste prste te imaju karakterističan gnojni zadah iz usta (halitoza).
Komplikacije. Glavne komplikacije uključuju razvoj plućne hipertenzije s opterećenjem desnoga srca i razvojem kroničnoga plućnog srca, bakterijemije s nastankom sekundarnih apscesa te amiloidoza.
Dijagnoza se temelji na osnovi anamneze i fizikalnoga pregleda, laboratorijskih pretraga, radiološke dijagnostike, bronhoskopije i mirkobiološke dijagnostike, a indicirana je i evaluacija plućne i srčane funkcije.
Anamneza i fizikalni pregled. Anamnestički podaci o progresiji respiratornih simptoma i rekurentnim plućnim infekcijama mogu ukazivati na bronhiektazije. Fizikalni nalaz je nespecifičan i može uključivati asteničnu konstituciju, auskultacijski nalaz bronhalnih hropaca, pojavu batićastih prstiju i dr.
Laboratorijska dijagnostika. Ne postoje specifični laboratorijski nalazi koji su karakteristični za bronhiektazije. Kod većine bolesnika može se naći anemija kronične bolesti te ubrzana sedimentacija. Kod superponirane infekcije povišeni su upalni parametri (leukociti, C-reaktivni protein, prokalcitonin). Plinske analize arterijske krvi početno su uredne, no mogu pokazivati određeni stupanj hipoksemije pri egzacerbacijama, a kasnije i u mirovanju.
Radiološka dijagnostika. Konvencionalni radiogram pluća ishodišna je slikovna metoda u obradi ovih bolesnika, a prošireni bronhi očituju se prstenastim ili trakastim sjenama. Zlatni standard za postavljanje dijagnoze bronhiektazije je CT visoke rezolucije (HRCT) koji daje detaljan opis morfologije i lokalizacije bronhiektazija, kao i okolnoga plućnog tkiva. Svaka sumnja na bronhiektazije koja se temelji na anamnestičkim podacima i klasičnom radiološkom nalazu zahtijeva upućivanje bolesnika na HRCT.
Bronhoskopija je indicirana kod svih bolesnika s dokazanim bronhiektazijama. Ona pomaže u otkrivanju uzroka bronhiektazija (endobronhalni tumor, ekstraluminalna kompresija) te služi za uzimanje uzorka za patološku, mikrobiološku ili citološku dijagnostiku.
Mikrobiološka dijagnostika. Mikrobiološka obrada sputuma, aspirata traheje ili bronhoalveolarnoga lavata ima veliko značenje u otkrivanju uzročnika rekurentnih plućnih infekcija te određivanja njihove osjetljivosti na antibiotike. Izolacija Pseudomans aeruginosa bakterije povezana je s lošijim ishodima i prognozom.
Testovi plućne funkcije. Kod manjih bronhiektazija i u ranijim fazama bolesti nalazi testova plućne funkcije su uredni. Spirometrija može ukazivati na opstruktivne smetnje disanja ili kombinaciju opstruktivno-restriktivnih smetnji disanja. Difuzijski kapacitet pluća također je u kasnijim fazama bolesti snižen.
Elektrokardiografija i ultrazvuk srca služe u evaluaciji srčane funkcije i otkrivanju desnostranoga srčanog popuštanja (kronično plućno srce). Na EKG-u mogu se vidjeti desna električna os, P-pulmonale i znakovi hipertrofije desnoga srca. Na ehokardiografiji se može vidjeti hipertrofirani desni ventrikul, dilatirani lijevi atrij te određeni stupanj insuficijencije pulmonalnoga i/ili trikuspidalnoga zaliska.
Ostala dijagnostika. Kod sumnje na kongenitalne bronbhiektazije preporuča se odrediti koncentraciju klorida i natrija u znoju (cistična fibroza), serumsku koncentraciju α1-antitripsina (deficijencija α1-antitripsina) te serumskih imunoglobulina (hipogamaglobulinemija).
Liječenje. Osnovi ciljevi liječenja su kontrola simptoma, redukcija egzacerbacija te poboljšanje kvalitete života. Temelj liječenja je konzervativno liječenje, no kod nekih bolesnika indicirano je i kirurško liječenje. Liječenje stabilne bolesti je ambulantno, dok egzacerbacije uglavnom zahtijevaju hospitalizaciju. U svim slučajevima kada je to poznato potrebno je provoditi etiološko liječenje.
Opće mjere i prevencija infekcija najbitniji su koraci u kontrolni simptoma te smanjenju broja egzacerbacija. Svim bolesnicima se savjetuje prestanak pušenja i provođenje fizikalnih metoda liječenja s ciljem odgovarajuće drenaže sadržaja traheobronhalnoga stabla (vježbe disanja, vježbe iskašljavanja, posturalna drenaža, perkusija prsnoga koša). Također, svim se bolesnicima preporuča godišnje cijepljenje protiv gripe, primjena pneumokoknoga cjepiva svakih pet godina, kao i druge mjere prevencije infekcija (izbjegavanje zatvorenih prostora s mnogo ljudi i sl.).
Antimikrobno liječenje temelj je konzervativnoga liječenja bronhiektazija, a treba se temeljiti na antibiogramu izolata iz sputuma. Ono se provodi kod svih bolesnika s dokazanom infekcijom, ali i kod bolesnika s visokom kliničkom sumnjom na infekciju. Kod empirijske primjene antibiotika preporuča se primjena sljedećih antibiotika: amoksicilin/klavulonska kiselina (875/125 mg svakih 12 sati), sulfametoksazol/trimetoprim (160/800 mg svakih 12 sati) ili ciprofloksacin (500 mg svakih 12 sati). Kod bolesnika s učestalim egzacerbacijama preporuča se prolongirana terapija makrolidima po shemi azitromicin 500 mg 3 x/tjedan kroz 6 mjeseci ili 250 mg 1 x/dan kroz 12 mjeseci. Ta prolongirana primjena makrolida dokazano smanjuje učestalost egzacerbacija u odnosu na placebo skupinu. Bolesnicima s cističnom fibrozom preporuča se inhalacijska primjena aminoglikozoda jer dokazano smanjuje učestalost kolonizacije s P. aeruginosa, poboljšava FEV1 te reducira broj hospitalizacija.
Ostale konzervativne metode liječenja. Primjena mukolitika i ekspektoranasa je kontroverzna (acetilcistein može uzrokovati bronhokonstrikciju) i u tu svrhu preporuča se obilna hidracija. Bolesnicima koji imaju spirometrijom dokazane opstruktivne smetnje disanja i imaju pozitivan bronhodilatacijski test preporuča se primjena β2 agonista. Kod bolesnika s kroničnom hipoksemijom indicirano je liječenje kisikom (oksigenoterapija).
Kirurško liječenje u obzir dolazi ako je ispunjeno nekoliko temeljnih uvjeta: lokalizirana bolest, zdrav preostali dio pluća, nemogućnost kontrole simptoma konzervativnim mjerama liječenja te rekurentne infekcije i/ili obilne hemoptize. Izbor kirurškoga zahvata ovisi o operateru, a najčešće se pribjegava lobektomiji. Transplantacija pluća se izvodi pri ovoj indikaciji, ali su rezultati nedovoljno istraženi. Drži se da su klinički ishodi transplantiranih bolesnika s bronhiektazijama u terminalnoj fazi, koji nisu uzrokovani cističnom fibrozom, usporedivi s ishodima transplantiranih bolesnika s drugom plućnom patologijom.
Liječenje egzacerbacija. Pojam egzacerbacije podrazumijeva superponiranu bakterijsku infekciju koja dodatno pogoršava postojeće simptome i respiratornu insuficijenciju. Većina egzacerbacija zahtijeva hospitalno liječenje, parenteralnu antibiotsku terapiju te ostalu potpornu terapiju (oksigenoterapija, nutritivna potpora, optimalna hidracija). Liječenje se provodi prema načelima opisanim u poglavlju o akutnoj upali pluća.
Prognoza bolesti ponajprije ovisi o proširenosti bolesti i očuvanosti plućne funkcije. Bolesnici koji imaju očuvanu plućnu funkciju, što se očituje na nalazima plućne funkcije, imaju u pravilu dobru prognozu, a takvih je oko 80 % bolesnika. Prediktori lošijih ishoda i prognoze su: difuzna bilateralna bolest, patološki nalazi testova plućne funkcije, kronična pseudomonasna infekcija te razvoj kroničnoga plućnog srca.
INTERSTICIJSKE BOLESTI PLUĆA
Definicija. Intersticijske bolesti pluća (ili difuzne bolesti plućnoga parenhima) heterogena su skupina bolesti koja uključuje preko dvije stotine različitih kliničkih entiteta, a zajednička im je karakteristika patološka infiltracija plućnoga parenhima, prvenstveno upalnim i/ili fibrozirajućim procesom te dijele slične kliničko-radiološke karakteristike.
Plućni intersticij podrazumijeva dio alveolarne stijenke koje se nalazi između alveolarnoga epitela i endotela krvnih žila. Sastoji se od mezenhimalnih stanica (fibroblasti), molekula ekstracelularnoga matriksa (kolagen, elastin, proteoglikani) te tkivnih leukocita, limfocita i mastocita. Sam termin bolesti plućnoga intersticija i nije u potpunosti ispravan jer u većini slučajeva patološki proces ne ostaje ograničen isključivo na njega nego se širi i zahvaća okolne strukture (zračne prostore, krvne žile). U normalnim se okolnostima plućni intersticij zdravih osoba ne može vidjeti na slikovnim radiološkim prikazima (konvencionalni radiogram, HRCT), već postaje vidljiv nakon što se zadeblja uslijed patoloških procesa (edem, upala, ožiljkavanje).
Epidemiologija. Bolesti plućnoga intersticija čine oko 15 % ukupne plućne patologije od čega su dvije trećine bolesti nepoznatoga uzroka, dok jedna trećina ima poznatog uzrok. Dva najčešća klinička entiteta iz ove skupine bolesti koja se susreću u kliničkoj praksi su idiopatska plućna fibroza i sarkoidoza. Te su bolesti češće kod muškaraca nego kod žena, a incidencija se povećava i sa starenjem.
Klasifikacija. Podjela bolesti plućnoga intersticija je kompleksna i promjenjiva, a danas je u kliničkoj praksi najčešće u upotrebi ona Američkoga torakalnog društva i Europskoga respiratornog društva (ATS/ERS) iz 2013. godine. Ona sve bolesti plućnoga intersticija dijeli na četiri skupine: 1) intersticijske bolesti pluća poznatoga uzroka, 2) idiopatske intersticijske pneumonije, 3) granulomatozne intersticijske bolesti pluća te 4) intersticijske bolesti pluća zasebne kategorije. U novije vrijeme se kao posebna kategorije izdvaja skupina intersticijskih pneumonija s autoimunim obilježjima (IPAF). Podjela intersticijskih bolesti pluća prikazana je shematski (Slika 2.11.).
Intersticijske bolesti pluća poznatoga uzroka kategorija su kod koje pojavu bolesti možemo povezati s etiološkim čimbenikom. U tu skupinu ubrajamo interisticijske bolesti pluća koje nastaju kao posljedica izloženosti organskim prašinama (hipersenzitivni pneumonitis), anorganskim prašinama (pneumokonioze), lijekovima (amiodaron, nitrofurantion, bleomicin) i drugim štetnim čimbenicima (plinovi, pare, zračenje) te one koje nastaju u sklopu sistemskih bolesti vezivnoga tkiva (tzv. kolagenoze – reumatoidni artritis, sklerodermija, sistemski eritematozni lupus). Pojedini klinički entiteti iz ove skupine opisani su u drugim, odgovarajućim dijelovima.
Idiopatske intersticijske pneumonije kategorija su bolesti karakteriziranih upalnim procesom intersticija kojima ne znamo uzrok te se rjeđe mogu povezati s nekim uzročnim ili rizičnim čimbenikom. Dijele se u tri podskupine: 1) glavne idiopatske intersticijske pneumonije, 2) rijetke idiopatske intersticijske pneumonije i 3) neklasificirane idiopatske intersticijske pneumonije. Njihova detaljnija podjela i karakteristike opisani su u nastavku teksta.
Granulomatozne intersticijske bolesti pluća su one čija je glavna karakteristika stvaranje granuloma. Najčešća bolest u toj skupini je sarkoidoza, a u tu se skupinu ubrajaju i infekcije plućnoga parenhima uzrokovane mikobakterijama i gljivicama, granulomatozni plućni vaskulitisi kao i neke druge rjeđe bolesti.
Intersticijske bolesti pluća zasebne kategorije čine bolesti koje se svojim karakteristikama ne uklapaju u prethodne kategorije, nego formiraju zasebnu skupinu. Najznačajnije su akutna i kronična eozinofilna pneumonija, plućna alveolarna proteinoza, limfangioleiomiomatoza te histiocitoza Langerhansovih stanica.
U novije vrijeme opisuje se nova skupina – intersticijska pneumonija s autoimunim obilježjima (IPAF – engl. interstitial pneumonia with autoimmune features) u koju se uvrštavaju bolesti koje uz intersticijsku plućnu patologiju imaju nespecifične kliničke i serološke karakteristike autoimunih bolesti nedovoljne za postavljanje dijagnoze sustavne bolesti. U ovu se skupinu mogu ubrojiti i bolesnici kod kojih se intersticijska bolest pluća dijagnosticira prije pojave izvanplućnih manifestacija sustavne bolesti.
Slika 2.11. Shematski prikaz podjele intersticijskih bolesti pluća
Patogeneza. Opći obrazac početka i razvoja bolesti sličan je za sve intersticijske bolesti. Nekoliko je ključnih događaja koji mogu rezultirati upalnim i fibroznim odgovorom plućnoga tkiva. Upalni i fibrozni proces javljaju se kao posljedica vaskularnoga i/ili alveolarnoga oštećenja.
Vaskularno oštećenje. Izravno vaskularno oštećenje obilježeno je aktivacijom endotelnih stanica posljedica čega je povećana permeabilnost vaskularne stijenke s posljedičnom pojačanom transudacijom plazmatskih proteina u ekstravaskularni intersticijski prostor. Također, aktivacija endotelnih stanica povezana je i s razvojem tromboze.
Alveolarno oštećenje. Oštećenje alveolarnih epitelnih stanica dovodi do gubitka integriteta fiziološke barijere, a aktivirane alveolarne epitelne stanice kao odgovor na oštećenje luče brojne proupalne medijatore koji potiču i podržavaju upalnu reakciju.
Infiltracija i aktivacija leukocita. Kao odgovor na vaskularno i alveolarno oštećenje i lučenje proupalnih citokina, dolazi do pojačane adherencije leukocita za aktivirani endotel, kao i njihova migracija u intersticij. Aktivirani leukociti luče brojne enzime koji pogoduju oštećenju tkiva, kao i druge citokine koji dalje podržavaju upalni proces. Smjer razvoja upalnoga odgovora ponajprije određuje i vrstu intersticijske bolesti pluća (npr. limfocitna intersticijska pneumonija, granulomatozne intersticijske bolesti pluća i sl.).
Remodelacija i fibroza. Kao odgovor na oštećenje i inflamaciju, aktiviraju se i pojedine skupine intersticijskih stanica (proliferacija fibroblasta) koje dovode do pojačane produkcije sastavnica ekstracelularnoga matriksa što vodi prema remodelaciji matriksa te konačnom razvoju fibroze.
Opisani patogeni mehanizam uopćen je zbog lakšega razumijevanja naravi bolesti, iako svaki klinički entitet ima svoje značajke i karakteristike, što će biti posebno opisano.
Patofiziologija. S obzirom na slična patogenetska zbivanja i patološki ishod, ove bolesti dijele i slične patofiziološke značajke: smanjenu plućnu elastičnost i plućni volumeni, gubitak plućne kapilarne mreže i poremećenu izmjena plinova te razvoj plućne hipertenzije.
Smanjena plućna elastičnost i plućni volumeni. Infiltracija plućnoga intersticija smanjuje plućnu elastičnost i otežava ekspanziju pluća prilikom ekspirija što dovodi do povećanoga napora pri disanju pri čemu glavnu ulogu nose pomoćni dišni mišići. Posljedično smanjenoj plućnoj elastičnosti, smanjeni su i plućni volumeni (totalni plućni kapacitet, funkcionalni rezidualni kapacitet, rezidualni volumen). Alveolarna ventilacija uredna je na račun povećane respiratorne frekvencije.
Gubitak plućne kapilarne mreže i poremećaj u izmjeni plinova. Oštećenje, tj. gubitak plućne kapilarne mreže uslijed vaskularnoga oštećenja kao i infiltracije intersticija otežava izmjenu plinova što se može klinički dokazati kao smanjen difuzijski kapacitet za ugljični monoksid (DLCO). Prvi je znak razvoj hipoksemije dok se parcijalni tlak ugljičnoga dioksida duže ostaje uredan na račun pojačane alveolarne ventilacije, no naposljetku dolazi i do retencije ugljičnoga dioksida i razvoja hiperkapnije, a to je ujedno i znak uznapredovale bolesti.
Plućna hipertenzija. Smanjena kapilarna površina, povećana plućna vaskularna rezistencija te plućna vazokonstrikcija izazvana hipoksijom dovodi do povišenja tlaka u plućnim krvnim žilama i plućne hipertenzije što može imati posljedice za desno srce i razvoj kroničnoga plućnog srca.
Klinička slika. Klinička manifestacija ponajprije ovisi o tipu intersticijske bolesti pluća. Manji broj bolesti ima asimptomatski tijek i slučajno ih se otkrije prilikom radiološkoga snimanja pluća iz drugih razloga ili tijekom sistematskoga pregleda. Neke bolesti karakterizira postupan i progresivan razvoj simptoma, dok neke imaju nagao početak s brzim i akutnim očitovanjem. Najčešći simptomi su dispneja i kašalj, dok su pleuralna bol i hemoptize rjeđi. Također, kod nekih bolesnika mogu dominirati opći simptomi te simptomi zahvaćenosti drugih organa ako se radi o sistemskoj bolesti.
Dispneja je osnovni simptom intersticijskih bolesti pluća. U većini se bolesti ona početno javlja pri naporu te se bolesnici žale na slabu toleranciju fizičkih aktivnosti, a kako bolest napreduje, tako se i dispneja javlja pri sve manjim naporima, a u uznapredovalim fazama prisutna je i u mirovanju. Dispneja se kod nekih bolesnika javlja karakteristično u epizodama (npr. hipersenzitivni pneumonitis). Subjektivan doživljaj dispneje ne mora uvijek pratiti radiološki nalaz te tako postoje situacije u kojima bolesnici imaju izražen radiološki nalaz uz umjerenu dispneju (sarkoidoza) ili slabo izražen radiološki nalaz uz jako izraženu dispneju (vaskulitisi).
Kašalj je također čest simptom ovih bolesti. Njegove karakteristike su da je neproduktivan te da slabo reagira na primjenu antitusika, čak i centralnih (kodein). Nagla promjena karakteristike kašlja u smislu pojačanja inteziteta ili pojave iskašljaja treba pobuditi sumnju na superponiranu patologiju (upala, tumor).
Pleuralna bol i stezanje u prsima rjeđi su simptomi intersticijskih bolesti pluća te sugeriraju na širenje patološkoga procesa na pleuru. Rijetko, stezanje u prsima može biti prvi znak bolesti intersticija.
Hemoptize nisu karakteristične za bolesti intersticija, a njihova pojavnost treba sugerirati superponiranu patologiju (tumor, upala, tromboembolija).
Opći i izvanplućni simptomi. Kako su intersticijske bolesti pluća često dio sistemskih bolesti, moguće su i druge manifestacije osim plućnih. Bolesnici se mogu žaliti na umor, malaksalost, gubitak teka i mršavljenje, a česte su i subfebrilne temperature. Od ostalih, najčešće se javljaju kožna, zglobna i očna klinička očitovanja.
Dijagnoza. Dijagnostički postupak temelji se na anamnezi, fizikalnom pregledu, radiološkim slikovnim metodama, funkcionalnim plućnim testovima te citološkoj i/ili patohistološkoj potvrdi bolesti. U nastavku je opisan opći dijagnostički postupak, a pojedine karakteristike uz pojedine bolesti bit će opisane kasnije.
Anamneza je prvi i ključni korak. Bolesnika se temeljito ispituje o simptomima koje ima (plućni, izvanplućni), njihovoj vremenskoj pojavnosti i intenzitetu. Bitni su i anamnestički podaci o mogućoj izloženosti štetnim tvarima iz okoliša ili radnoga okruženja, uzimanju lijekova te navikama kao što je pušenje ili konzumiranje droga (kokain, heroin, marihuana). Bitna je i obiteljska anamneza, tj. pojavnost sličnih simptoma kod bližih srodnika.
Fizikalni pregled. Intersticijske bolesti pluća nemaju karakteristične znakove pri kliničkom pregledu bolesnika. Najvažniji je auskultacijski nalaz pluća. Disanje može biti vezikularno ili pooštreno. Prvi zvučni fenomeni koji se javljaju su kasnoinspirijski hropci, a s razvojem bolesti moguća je pojava inspiratornih i ekspiratornih zvižduka. Kod zahvaćene pleure može se čuti pleuralno trenje. Batićasti prsti i cijanoza javljaju se u poodmaklim fazama bolesti. Ako se radi o sistemskim bolestima, moguća je pojava i drugih znakova kao što su kožne lezije, očne promjene, zglobne promjene te hepatosplenomegalija.
Radiološke slikovne metode. Osnovna dijagnostička metoda je konvencionalna radiološka snimka pluća. Na njemu se intersticijska patologija prikazuje kao retikularni, nodularni ili mješoviti retikulonodularni intersticijski uzorak. S vremenom se razvijaju konfluentne, homogene sjene tipa zrnastoga stakla, a u terminalnim fazama opisuju se saćasta pluća. Osim toga, na snimci se mogu uočiti i druge pridružene pojave kao što su limfadenopatija, pleuralni plakovi i sl. Kod svih bolesnika sa sumnjom na intersticijsku bolest pluća indiciran je CT pluća visoke rezolucije (HRCT) koji omogućava detaljniju analizu plućnoga parenhima (Slika 2.12.). Patološki nalazi na HRCT-u koji ukazuju na patologiju intersticija su zadebljanje interlobularnih septa, retikularni (mrežasti) uzorak, uzorak zrnatoga stakla (smanjena prozračnost uz očuvan prikaz krvnih žila) te mozaičnost perfuzije i zarobljavanje zraka. Patološki nalazi plućnoga intesticija na HRCT-u pluća mogu biti visoko specifični te s velikom vjerojatnošću mogu ukazivati na pojedine bolesti plućnoga intersticija, kao što su UIP, NSIP, COP, RB-ILD, DIL te LIP. U nekim slučajevima nalaz sigurnoga i jasnoga uzorka intersticijske pneumonije na HRCT-u u sklopu kliničke slike može biti dovoljan za postavljanje definitivne dijagnoze bolesti.
Slika 2.12. HRCT nalaz patologije plućnoga intersticija (akutna eozinofilna pneumonija)
Citološka i patohistološka dijagnostika. Potvrdu bolesti obično čini citološki ili patohistološki nalaz. Uzorci se uglavnom dobivaju tijekom bronhoskopije: bronhoalveolarna lavaža, transbronhalna biopsija pluća ili limfnih čvorova. U tu svrhu može poslužiti endoskopski ultrazvuk (EBUS-TBNA). Uzorak pluća za patohistološku dijagnostiku može se dobiti i putem video-asistirane torakoskopske biopsije pluća (VATB) te otvorene biopsije pluća.
Testovi plućne funkcije u najvećoj mjeri služe za dobivanje uvida u funkcionalne stanje pluća i stupanj bolesti. U tu svrhu se preporuča siprometrija, DLCO i plinske analize arterijske krvi. Početno ti nalazi mogu biti uredni te se nekada preporuča izvođenje pri naporu. Spirometrija ukazuje na obrazac restriktivnih smetnji disanja (smanjenje forsiranoga vitalnoga kapaciteta, FVC i vitalnoga kapaciteta, VC). Osim toga, ti testovi pomažu i u praćenju razvoja bolesti i odgovora na terapiju.
Opća načela liječenja. S obzirom na to da su dva osnovna patofiziološka mehanizma koja dominiraju u bolesti inflamacija i fibroza, liječenje je usmjereno na njihovu supresiju. Teži se što ranijem prepoznavanju bolesti kada dominira faza upale jer se protuupalnim liječenjem ona suprimira i tako priječi njezino napredovanje u fibrozu. U toj fazi bolesti ključnu ulogu imaju kortikosteroidi. Ostale imunosupresivne lijekove, kao što su azatioprin i metotreksat, a i citostatike (ciklofosfamid), koristimo u uznapredovalim fazama bolesti kada dominira fibrozirajući proces. Transplantacija pluća može imati terapijsku ulogu kod nekih kliničkih entiteta.
IDIOPATSKE INTERSTICIJSKE PNEUMONIJE
Definicija i podjela. Idiopatske intersticijske pneumonije (IIP) čine velik dio bolesti plućnoga intersticija. Nastaju uslijed oštećenja plućnoga parnehima nepoznatoga uzroka, a rezultiraju upalom i fibrozom. Današnja podjela idiopatske intersticijske pneumonije dijeli u tri skupine: glavne, rijetke i neklasificirane.
Glavne idiopatske intersticijske pneumonije dijele se u tri skupine: 1) kronične fibrozirajuće IIP (obična intersticijska pneumonija - UIP, nespecifična intersticijska pneumonija - NSIP); 2) IIP povezane s pušenjem (respiratorni bronhiolitis s intersticijskom pneumonijom - RB-ILD, deskvamativna intersticijska pneumonija - DIP) te 3) subakutne/akutne IIP (kriptogena organizirajuća pneumonija - COP, akutna intersticijska pneumonija - AIP).
Rijetke idiopatske intersticijske pneumonije obuhvaćaju limfocitnu intersticijsku pneumoniju (LIP) te idiopatsku pleuroparenhimsku fibroelastozu (PPFE).
Neklasificirane idiopatske intersticijske pneumonije. U skupinu IPP-a koje se ne mogu klasificirati pripadaju entiteti kod kojih postoje značajna neslaganja između kliničkog, radiološkoga i patohistološkoga nalaza, entiteti s višestrukim radiološkim ili patohistološkim uzorcima, entiteti kod kojih je prethodna terapija dovela do promjene u radiološkom i patohistološkom nalazu te novi ili drugi neuobičajeni entiteti koji se ne uklapaju u postojeće klasifikacije prema smjernicama ATS/ERS.
U daljnjem tekstu biti će prikazani osnovni entiteti koje ubrajamo u skupinu idiopatskih intersticijskih pneumonija.
OBIČNA INTERSTICIJSKA PNEUMONIJA I IDIOPATSKA PLUĆNA FIBROZA
Obična intersticijska pneumonija (UIP, engl. usual interstitial pneumonia) najčešća je IIP koja čini oko 55 % svih IIP-a. Ona predstavlja radiološki i patohistološki entitet idiopatske plućne fibroze (IPF) iako UIP nije sinonim za IPF. UIP se uvijek nalazi u podlozi IPF-a, ali se može naći i u podlozi druge intersticijske patologije (nuspojave lijekova, azbestoza, hipersenzitivni pneumonitis, zahvaćenost intersticija u sklopu sustavnih bolesti vezivnoga tkiva) te na njih treba uvijek diferencijalno-dijagnostički misliti kod bolesnika sa sumnjom na IPF. Idiopatska plućna fibroza (IPF) kao najvažnija klinička slika UIP-a detaljno je prikazana u nastavku.
Idiopatska plućna fibroza (IPF) jedna je od najčešćih bolesti plućnoga intersticija te ujedno i najčešći oblik kroničnih fibrozirajućih idiopatskih intersticijskih pneumonija. Radi se o sporoprogresivnoj bolesti nepoznate etiologije koja zahvaća isključivo pluća, a karakterizira je difuzna fibroza plućnoga parenhima (bolest ubrzanoga starenja pluća). Patohistološkim i radiološkim uzorkom u podlozi IPF-a nalazimo UIP. Bolest se najčešće javlja u petom i šestom desetljeću života, češće kod muškaraca (omjer 2:1).
Etiopatogeneza. Točan etiopatogenetski mehanizam razvoja IPF-a nije razjašnjen, ali se smatra da je razvoj bolesti posljedica opetovanoga oštećenja alveolarnoga epitela nepoznatim čimbenikom, koji aktivira mehanizme upale i fibroze kao odgovor na oštećenje. Glavno je obilježje IPF-a proliferacija fibroblasta s posljedičnom povećanom proizvodnjom komponenata ekstracelularnoga matriksa (kolagen) uz manje izražen upalni odgovor. To narušava normalnu strukturu intersticija s posljedičnim smanjenjem elastičnosti pluća i poremećajem izmjene plinova na respiracijskoj membrani. Kao mogući uzročnici alveolarnoga oštećenja i pokretači opisanoga odgovora navode se različiti inhalacijski stimulansi (pušenje, izlaganje prašini iz okoline), virusne i druge respiratorne infekcije (Epstein-Barr, Herpes virus), lijekovi (metotreksat, nitrofurantion) te kronični gastroezofagealni refluks (prisutan kod 90 % bolesnika oboljelih od IPF-a). Sve više se govori i o genetskoj predispoziciji i povezanosti IPF-a i polimorfizma MUC5B gena.
Patologija. Glavni patohistološki nalaz uključuje subpleuralnu fibrozu s poljima proliferacije fibroblasta i gustoga ožiljkavanja koja se smjenjuju s poljima normalnoga plućnoga parenhima (heterogenost nalaza). Upalna komponenta slabije je izražena, a u upalnom infiltratu dominiraju limfociti. S vremenom se razvija cistična dilatacija perifernih alveola (saćasta pluća) koja se pogoršavaju s progresijom bolesti.
Klinička slika. Glavno je kliničko očitovanje progresivna dispneja praćena suhim, podražajnim kašljem i stezanjem u prsima. Opći simptomi (umor, mršavljenje, artralgije, mialgije) slabije su izraženi. Postupno se razvija respiratorna insuficijencija. Cijanoza i batićasti prsti javljaju se u uznapredovaloj fazi bolesti. Bolesnici su skloni sekundarnim infekcijama, pneumotoraksu i tromboemboliji pluća. Klasični auskultacijski znak čine fini, suhi pukoti u inspiriju koji su u početku najčujniji pri bazama pluća, a kasnije nad cijelim plućnim krilom, tzv. velcro krepitacije (poput odvajanje „čičak“ trake).
Dijagnoza se postavlja na osnovi kliničke slike i anamnestičkih podataka, laboratorijske dijagnostike, radiološke dijagnostike, testova plućne funkcije te eventualno patohistološke dijagnostike.
Laboratorijski nalazi su nespecifični. Često se nađe ubrzana sedimentacija eritrocita i hipergamaglobulinemija. Također, u serumu možemo naći povišena antinuklearna antitijela (ANA) i reumatoidni faktor (RF), no u manjim titrovima. Veći titar (> 1:160) ANA-e i RF-a sugerira na plućnu manifestaciju difuzne bolesti vezivnoga tkiva.
Radiološka dijagnostika. Konvencionalni radiogram pluća pokazuje obostrane retikularne uzorke koji su u početku izraženiji u području plućnih baza. Kasnije se mogu naći i zone manjih cističnih promjena (saćasta pluća). Negativan radiološki nalaz ne isključuje IPF, osobito ako se radi o početnoj fazi bolesti. Svaki suspektan nalaz na konvencionalnom radiogramu pluća treba potvrditi HRCT-om koji predstavlja metodu izbora u dijagnostici IPF-a. Na njemu se bolest prikazuje difuznim, grubim, subpleuralnim retikulinskim sjenama s nepravilno zadebljanim interlobarnim septama, zonama cističnih formacija (saćasta pluća) te trakcijskim bronhiektazijama (radiološki nalaz UIP-a). Opisani nalaz HRCT-a uz anamnestičke podatke uglavnom je dovoljan za postavljanje dijagnoze IPF-a.
Invazivni dijagnostički postupci. Bronhoalveolarna lavaža ima veću ulogu u diferenciranju dijagnoze i isključivanju IPF-a. Nalaz malignih stanica sugerira na neoplazmu, limfocitoza na hipersenzitivni penumonitis i sl. Patohistološka potvrda bolesti potrebna je u nejasnim situacijama, a uzorak se može dobiti na više načina (transbronhalna biopsija, videoasistirana torakoskopska biopsija, otvorena biopsija pluća).
Testovi plućne funkcije pokazuju restriktivne smetnje disanja (smanjen TLC, VC, FVC) te smanjenu difuziju (smanjeni DLCO). U početnim fazama bolesti spirometrija može biti i uredna, osobito kod bolesnika s emfizemom, dok je difuzijski kapacitet mnogo osjetljiviji u tom smislu te mnogo ranije pokazuje oštećenje. Poremećaj izmjene plinova dovodi do pada oksigenacije i to najprije pri tjelesnom naporu, a kasnije i u mirovanju. 6-minutni test opterećenja dobar je pokazatelj kapaciteta vježbanja i omogućuje praćenje tijeka i progresije bolesti.
Liječenje. Temelj liječenja IPF-a čine kortikosteroidi i citostatici (ciklofosfamid, azatiprin) te u novije vrijeme antifibrotici. U liječenju stabilne bolesti koriste se preoralni preparati (prednizon uz ciklofosmafid ili azatioprin), no pri pogoršanju bolesti preporuča se intravenska primjena prednizolona. Noviji terapijski pristupi uključuju primjenu antifibrotika (pirfenidon, nintedanib) čemu su pridonijele kliničke studije iz 2014. godine koje su pokazale njihov klinički doprinos. Uz navedenu terapiju primjenjuju se i simptomatske mjere liječenja (prevencija i liječenje infekcija, oksigenoterapija, drenažni položaji i sl.). Kao zadnja opcija liječenja ostaje transplantacija pluća koja je pokazala uspjeh kod bolesnika mlađih od 55 godina.
Prognoza bolesti u načelu je loša, a tijek bolesti nepredvidiv. Prosječno preživljenje od postavljanja dijagnoze iznosi dvije do pet godina.
NESPECIFIČNA INTERSTICIJSKA PNEUMONIJA
Nespecifična intersticijska pneumonija (NSIP) druga je po učestalosti idiopatska intersticijska pneumonija u kliničkoj praksi s učestalosti od oko 25 %. Najčešće se javlja u četvrtom i petom desetljeću života, češće kod žena, a više od 70 % oboljelih su nepušači. Klinička prezentacija je slična kao i kod IPF-a, iako pokazuje indolentniji i polaganiji tijek. Patohistološki se otkriva uniformni upalni infiltrat s ili bez žarišta fibroze te prema tome razlikujemo celularni i fibrotični oblik koji ima lošiju prognozu. RTG pluća pokazuje zasjenjenje poput mliječnoga stakla i retikularne promjene, a HRCT nalaz pokazuje periferne, subpleuralne sjene tipa mliječnoga stakla, a saćasta pluća manje su izražena nego kod UIP-a. Prema literarnim podacima, točna dijagnoza NSIP-a na temelju HRCT-a može se postaviti u čak 66 do 88 % slučajeva. Osim kao samostalni entitet, NSIP je također najčešće zastupljen tip IIP-a u sistemskim bolestima vezivnoga tkiva, a može se naći i kod hipersenzitivnoga pneumonitisa, AIDS-a te promjena na plućima uzrokovanih lijekovima. Liječenje se provodi kortikosteroidima na koje bolesnici uglavnom dobro odgovaraju pa su imunosupresivi (ciklofosfamid, azatiprin) rezervirani za teže oblike bolesti. Prognoza je bolja nego kod IPF-a, petogodišnji mortalitet niži je od 5 %.
RESPIRATORNI BRONHIOLITIS S INTERSTICIJSKOM PNEUMONIJOM
Respiratorni bronhiolitis s intersticijskom pneumonijom (RB-ILD) idiopatska je intersticijska pneumonija koja pokazuje snažnu etiološku povezanost s pušenjem, a karakterizira ju subklinička upala malih dišnih puteva (bronhiolitis) uz intersticijsku patologiju. Bolest se češće javlja kod muškaraca kasnih srednjih godina. Glavne kliničke karakteristike su dispneja i kašalj koji traju tjednima i mjesecima. Na radiološkim snimkama (RTG, HRCT) vide se zadebljale stijenke bronha te zasjenjenja tipa mliječnoga stakla. Histološki nalaz karakteriziraju pigmentirani makrofagi u lumenu respiratornih bronhiola uz rijetka fibroblastna žarišta i malo fibroze. Osnovna terapijska mjera je prestanak pušenja. Kortikosteroidi se primjenjuju, ali nema studija koje jasno pokazuju njihovu kliničku učinkovitost. Kod oko 20 % bolesnika bilježi se spontana regresija bolesti. Prognoza je načelno dobra, stopa smrtnosti je mala.
DESKVAMATIVNA INTERSTICIJSKA PNEUMONIJA
Deskvamativna intersticijska pneumonija (DIP) oblik je idiopatske intersticijske pneumonije koju obilježava infiltracija dišnih puteva mononuklearnim stanicama i prisutnost pigmentiranih makrofaga unutar distalnih bronha (koji su početno shvaćeni kao deskvamirani pneumociti, odakle i potječe ime bolesti). Bolest se javlja uglavnom kod pušača srednjih godina, češće kod muškaraca. Klinički tijek je polagan, obilježen dispnejom i kašljem. Radiološki se prikazuju centrolobularni noduli i opacifikacija poput mliječnoga stakla. Histološki je obilježen alveolarnim prostorima ispunjenima pigmentiranim makrofagima. Liječenje se temelji na prestanku pušenja, a u težim oblicima daju se kortikosteroidi s ili bez imunosupresiva. Prognoza je dobra, petogodišnji mortalitet je ispod 5 %.
KRIPTOGENA ORGANIZIRAJUĆA PNEUMONIJA
Kriptogena organizirajuća pneumonija (COP) naziva se još i bronhiolitis obliterans s organiziranom pneumonijom (BOOP), a predstavlja oblik idiopatske intersticijske pneumonije koju karakterizira prisutnost granulacijskoga tkiva unutar bronhiola i alveolarnih duktusa koje dovodi do njihove opstrukcije. Javlja se podjednako kod oba spola, obično u petom i šestom desetljeću života. Može se javiti primarno, kao idiopatsko oboljenje, ili sekundarno, povezano uz autoimune bolesti, kolagenoze ili uzimanje nekih lijekova (imunosupresivi). Velik dio bolesnika prije početka bolesti ima prodromalne simptome nalik gripi nakon čega slijedi tipično očitovanje u vidu progresivne dispneje i kašlja. Kod manjega se broja bolesnika može javiti i produktivan kašalj, bolovi u prsištu, noćna znojenja, artralgije, mialgije. Radiološki nalaz uključuje obostrane mrljaste, multifokalne konsolidacije, često sa zračnim bronhogramom, koje su smješteni subpleuralno i u donjim režnjevima. Tipičan nalaz prisutan je u oko 40 - 70 % slučajeva. Višestruki alveolarni infiltrati mogu spontano nestati i mogu se pojavljivati novi infiltrati na drugim mjestima (migrirajući infiltrati). Konačnu dijagnozu daje histološki nalaz granulacijskoga tkiva unutar bronhiola. Liječenje se temelji na primjeni kortikosteroida na koje bolesnici postižu dobar klinički odgovor, ali su recidivi česti.
AKUTNA INTERSTICIJSKA PNEUMONIJA
Akutna intersticijska pnuemonija (AIP) ili Hamman-Richov sindrom akutna je i brzoprogresivna idiopatska intersticijska pneumonija koja pogađa mlađe, prethodno zdrave osobe. Podjednako se javlja kod oba spola. Klinički je karakterizira dispneja za kojom slijedi brz razvoj akutnoga respiratornog distres sindroma. Kod velikoga broja bolesnika bolesti prethodi prodromalna faza kojom dominiraju simptomi nalik gripi. Radiološki nalaz uključuje difuzne bilateralne konsolidacije s područjima opacifikacija tipa mliječnoga stakla (najbolje vidljivo na HRCT-u). Histološki nalazimo difuzno alveolarno oštećenje. Liječenje često zahtijeva mjere intenzivnoga nadzora i mehaničku ventilaciju. Primjenjuje se pulsna intravenska kortikosteroidna terapija kroz tri dana nakon čega se nastavlja s peroralnim kortikosteroidima. U liječenje se mogu uvesti i imunosupresivi. Bolest prati visoka stopa mortaliteta koja iznosi 50 do 80 %.
LIMFOCITNA INTERSTICIJSKA PNEUMONIJA
Limfocitna intersticijska pneumonija (LIP) rijetka je idiopatska intersticijska pneumonija koju karakteriziraju nakupine zrelih limfocita difuzno raspoređene po plućnom intersticiju. Obično se javlja u srednjoj životnoj dobi, češće kod žena. Može biti primarna, idiopatska ili sekundarna. Idiopatski LIP čini oko 20 % svih slučajeva LIP-a, a ostatak se javlja sekundarno u sklopu autoimunih bolesti (Sjögrenov sindrom, reumatoidni artritis, sistemski eritematozni lupus, miastenija gravis, preniciozna anemija) te stečenih i prirođenih imunodeficijencija. Klinički tijek je kroničan (dispneja, kašalj, opći simptomi). Standardni radiogram pokazuje bazalne retikularne lezije ili nodularni uzorak, a s napredovanjem bolesti miješani uzorak zrnatoga stakla i konsolidata te zračne bronhograme u većim konsolidatima. HRCT toraksa karakterizira nalaz zrnatoga stakla, centrilobularnih nodusa i zadebljanje intersticija s predominacijom u donjim režnjevima. Ciste su prisutne u 68 - 82 % slučajeva i po tome se razlikuje od NSIP-a. Histološki nalaz karakteriziraju difuzne nakupine limfocita, makofaga i plazma stanica. Liječenje se temelji na primjeni kortikosteroida na koje se uglavnom postiže dobar odgovor. Prognoza nije jasno definirana.
IDIOPATSKA PLEUROPARENHIMSKA FIBROELASTOZA
Idiopatska pleuroparenhimska fibroelastoza rijedak je oblik idiopatske intersticijske pneumonije koju karakterizira subleuralna fibroelastoza pretežno gornjih plućnih režnjeva s pratećim fibroznim zadebljanjem visceralne pleure. Većina slučajeva je idiopatska, no može se i povezivati s nekim bolestima i stanjima (radijacija, kemoterapija, azbestoza, autoimune bolesti). Klinički tijek je kroničan, a uključuje dispneju i kroničan kašalj. Dijagnoza se temelji na radiološkoj dijagnostici (zadebljana pleura, zahvaćenost gornjih režnjeva, intersticijski uzorak) te patohistološkoj potvrdi. U liječenju se primjenjuju kortikosteroidi koji imaju slab učinak na tijek bolesti te imunosupresivi. Tijek bolesti je sporoprogresivan, neke studije su pokazale da za potpuni razvoj teške respiratorne insuficijencije treba i 10 do 20 godina.
GRANULOMATOZNE INTERSTICIJSKE BOLESTI PLUĆA
Uvod. Granulomatozne intersticijske bolesti pluća su posebna skupina bolesti koju karakterizira stvaranje granuloma u plućnom parenhimu, što se javlja kao posljedica granulomatozne upale. Granulomatozna upala specifičan je tip kronične imunološke reakcije koju karakterizira nakupljanje transformiranih makrofaga (divovske, multinuklearne epiteloidne stanice) u nodularnu formu (granulom), što mogu potaknuti različiti infektivni i neinfektivni agensi. Načelno, razlikujemo dva tipa granuloma: granulomi stranoga tijela i imuni granulomi. Granulomi stranoga tijela formiraju se oko inertnih i neprobavljivih stranih tijela u organizmu, a imuni granulomi nastaju aktivacijom specifičnih T-limfocita. Aktivirani T-limfociti luče γ-interferon za koji se smatra da je najodgovorniji za transformaciju makrofaga u epiteloidne stanice.
Klasifikacija. Granulomatozne intersticijske bolesti pluća mogu se podijeliti u dvije skupine: infektivne i neinfektivne. Infektivne granulomatozne bolesti pluća mogu izazvati mikobakterije (M. tuberculosis, netuberkulozne mikobakterije), gljivice (Histoplasma, Cryptococcus, Blastomyces, Aspergillus) te paraziti (Dirofilaria). Neinfektivne granulomatozne bolesti pluća uključuju širok spektar kliničkih manifestacija: sarkoidoza, hipersenzitivni pneumonitis, granulomatoza s poliangiitisom (Wegenerova granulomatoza), eozinofilna granulomatoza s poliangiitisom (Churg-Straussov sindrom), bronhocentrična i limfomatoidna granulomatoza, talk granulomatoza i druge. U ovome dijelu bit će opisane najčešće granulomatozne intersticijske bolesti pluća.
SARKOIDOZA
Definicija. Sarkoidoza je kronična multisistemska bolest nepoznate etiologije obilježena nakupljanjem CD4+ T-limfocita što rezultira Th-1 imunosnim odgovorom u zahvaćenom organu i stvaranjem nekazeoznih granuloma u različitim organima i tkivima. U više od 90 % slučajeva zahvaćeni su pluća i intratorakalni limfni čvorovi, ali bolest može zahvatiti i druga tkiva i organe (koža, oči, središnji živčani sustav).
Epidemiologija. Bolest se obično razvija u srednjoj životnoj dobi (između 20 i 40 godina) s nešto većom učestalosti kod žena u odnosu na muškarce. Iako se bolest javlja u čitavom svijetu, ipak pokazuje određenu geografsku sklonost, tako da je najveća incidencija na području zemalja sjeverne Europe, dok je najniža u Japanu. Prevalencija sarkoidoze u Republici Hrvatskoj iznosi 4,1 na 100 000 stanovnika.
Etiopatogeneza. Bolest nastaje kao posljedica specifičnoga granulomatoznoga upalnog odgovora na neki nepoznat antigen (reakcija preosjetljivosti tipa IV). Iako se navode različiti antigeni kao mogući pokretači imunološke reakcije, ni jedan nije sa sigurnošću dokazan. Najčešće spominjani su: infektivni (atipične mikobakterije, B. burgdorferi, gljivični antigeni, Epstein-Barrov virus, herpesvirusi) te inhalacija anorganskih (aluminij, cink, tlak) i organskih tvari (pelud). Također, kao rizični čimbenici navode se i genetska predispozicija (češća pojavnost kod bliskih srodnika) te socijalni čimbenici (češća pojavnost u ruralnim sredinama).
Patogeneza. Nepoznat antigen započinje specifični imunološki odgovor koji podrazumijeva akumulaciju i aktivaciju T-limfocita koji luče različite medijatore među kojima je najbitniji γ-interferon, posljedica čega je transformacija makrofaga u epitelioidne stanice koje formiraju granulome, a oni dovode do narušavanja normalne strukture tkiva i organa. Karakteristično je da granulomi u sarkoidozi pokazuju i određenu metaboličku aktivnost. Epiteloidne stanice imaju mogućnost aktivacije vitamina D što je povezano s povećanom apsorpcijom kalcija iz probavnoga sustava, hiperkalcijemijom i hiperkalciurijom. Također, granulomi imaju sposobnost i lučenja ACE enzima što ima i dijagnostičku važnost.
Patologija. Osnovni su patološki supstrati u sarkoidozi nekazeozni granulomi sačinjeni od epiteloidnih stanica koje se mjestimično spajaju u multinuklearne orijaške stanice, okružene limfocitima, mastocitima, fibroblastima i kolagenom. Osnovo sijelo bolesti su pluća i limfni sustav (prvenstveno intratorakalna limfadenopatija), ali bolest može zahvatiti i druge organe. Granulomi u plućima nalaze se u alveolarnim pregradama, stijenkama bronhiola i bronha te uzrokuju difuznu bolest pluća. Ekstratorakalna sarkoidoza zahvaća jetru u 50 - 80 %, slezenu u 40 %, kožu u 30 %, zglobove u 25 %, oči u 25 %, periferne limfne čvorove u 10 %, mozak u 5 do 10 %, kosti i mišiće u 5 %, srce u 5 %, žlijezde slinovnice u 3 - 5 % slučajeva, dok ostale lokalizacije zahvaća znatno rjeđe.
Klinička slika sarkoidoze je različita i uključuje sve aspekte od potpuno asimptomatske bolesti koja se slučajno dijagnosticira do brzoprogresivnoga oblika s fatalnim završetkom, koji se rijetko susreće (1 - 5 %). Bolest se može prezentirati općim simptomima te plućnim i izvanplućnim manifestacijama. Sarkoidoza se najčešće klinički manifestira kao asimptomatska ili umjereno simptomatska bolest s karakterističnom bilateralnom hilarnom limfadenopatijom s ili bez zahvaćanja plućnoga parenhima. Zahvaćenost plućnoga parenhima predstavlja lošiju prognozu s obzirom na to da kod 20 % bolesnika progredira u plućnu fibrozu.
Opća simptomatologija prisutna je kod gotovo svih bolesnika, ali je slabije izražena. Bolesnici se najčešće žale na umor, malaksalost, gubitak teka i mršavljenje te pojavu subfebrilnih temperatura.
Plućne manifestacije glavna su klinička karakteristika sarkoidoze, s obzirom na to da su pluća zahvaćena u više od 90 % slučajeva. Bolesnici se mogu žaliti na dispneju, kašalj te stezanje u prsima. Auskultacijski nalaz može biti uredan ili se čuju kasnoinspiratorni pukoti što je glavna karakteristika intersticijske patologije.
Izvanplućne manifestacije su različite: kožne lezije (eritema nodozom, eritematozno-skvamozne promjene nosa, obraza i uški), očne lezije (prednji i stražnji uveitis koji se očituju bolom i crvenilom oka te gubitkom vida), retikuloendotelne manifestacije (periferna limfadenopatija, splenomegalija), metaboličke manifestacije (hiperkalcijemija, hiperkalciurija), neurološke manifestacije (kognitivna disfunkcija, glavobolja, periferna neuropatija), hepatalne manifestacije (hepatomegalija, poremećaj funkcije jetre), koštano-zglobne manifestacije (artralgija, koštane ciste) te kardijalne manifestacije (poremećaji srčanoga ritma, srčano popuštanje).
Akutna prezentacija bolesti. Najčešći oblik akutne sarkoidoze poznat je pod nazivom Löfgrenov sindrom. Javlja se kod osoba mlađih od 30 godina, a obilježen je vrućicom, nodoznim eritemom (crvenim i bolnim nodoznim kožnim promjenama na potkoljenicama), hilarnom i medijastinalnom limfadenopetijom, artralgijama te je često popraćen akutnim konjunktivitisom i iridociklitisom. Manje čest oblik akutne sarkoidoze poznat je pod nazivom Heerfordtov sindrom. Obilježen je povišenom temperaturom, povećanim paratireoidnim žlijezdama, parezom ličnoga živca (n. facialis) te anteriornim uveitisom. Prognoza akutne sarkoidoze je dobra, a samoizliječenje često (u oko 60 % slučajeva).
Kronična prezentacija bolesti. Sarkoidoza s primarno kroničnim tijekom javlja se obično u osoba starijih od 40 godina, a karakterizira je postupan početak i progresivan tijek. Manifestira se respiratornim simptomima kao što je kronični suhi kašalj koji se pogoršava pri izlaganju iritansima i hladnom zraku te otežanim disanjem pri naporu. Od općih simptoma najčešće su subfebrilne temperature, slabost, umor te gubitak apetita i gubitak na tjelesnoj težini. Česta je kronična upala oka (keratokonjunktivitis, kronični uveitis) i kože. Prognoza bolesti je lošija nego kod akutne sarkoidoze, a spontane remisije su rjeđe (oko 40 % slučajeva).
Dijagnoza se postavlja na osnovi kliničke slike, laboratorijskih pretraga, radiološke dijagnostike te patohistološke potvrde bolesti. Težina bolesti procjenjuje se testovima plućne funkcije.
Laboratorijska dijagnostika. Kod većine bolesnika nalazimo anemiju kronične bolesti (normokromna, normocitna), ubrzanu sedimentaciju eritrocita te hiperkalcijemiju i hiperkalciuriju (hiperkalciurija nekada može ići i uz uredne vrijednosti kalcija u serumu). Ostali nalazi ovise o raširenosti bolesti (npr. povišeni jetreni enzimi kod afekcije jetre i sl.). Specifičnija pretraga je određivanje ACE enzima koji je povišen kod više od 60 % bolesnika s akutnom i 20 % s kroničnom sarkoidozom, a povišen može biti i kod limfoma, tuberkuloze, hipertireoze te azbestoze i silikoze. Praćenje vrijednosti ACE enzima ima značaj i u praćenju bolesti, tj. odgovoru na terapiju. Također, kod većine bolesnika povišena je i hitotriozidaza, enzim iz skupine hitinaza, a predstavlja biomarker visoke osjetljivosti i specifičnosti kod bolesnika sa sarkoidozom.
Radiološka dijagnostika. Osnovna pretraga je konvencionalni radiogram pluća na kojemu se tipično opisuje bilateralna hilarna limfadenopatija te plućni infiltrati, a kod nejasnih situacija indiciran je i HRCT. Ovisno o raspodjeli patologije na radiološkoj snimci, sarkoidozu dijelimo u četiri stadija: prvi stadij uključuje bilateralnu hilarnu limfadenopatiju bez plućnih infiltrata, drugi stadij uključuje bilateralnu hilarnu limfadenopatiju i plućne infiltrate, treći stadij uključuje pulmonalne infiltrate bez limfadenopatije te četvrti stadij koji uključuje fibrozu. HRCT toraksa na plućnom parenhimu u ranom stadiju pokazuje peribronhovaskularne i perilimfatičke noduse, milijarne noduse, žarišne konsolidate, a u kasnom stadiju retikularni uzorak, konsolidate te znakove fibroze (zadebljanje bronhalnoga zida, distorzija, trakcijske bronhiektazije). Pleura je rijetko zahvaćena (3 %), a u tim slučajevima izljevi su obično obostrani.
Patohistološka dijagnostika. Konačnu potvrdu dijagnoze daje patohistološka analiza specifičnoga uzorka u kojemu nalazimo nekazeozne granulome. Vrsta i način dobivanja uzoraka ovise o distribuciji sarkoidoze. Kako se najčešće radi o plućnoj patologiji, uzorak se može dobiti transbronhalnom biopsijom (najosjetljivija metoda, nalaz je pozitivan u više od 90 % slučajeva), rjeđe se indicira videoasistirana torakoskopska biopsija ili otvorena biopsija pluća. Ovisno o zahvaćenosti mogu se uzeti i drugi bioptički uzorci (biopsija kože, perifernih limfnih čvorova, jetre i dr.).
Testovi plućne funkcije služe za procjenu težine bolesti. Kod većine bolesnika s izoliranom hilarnom limfadenopatijom ili ekstrapulmonalnom distribucijom funkcionalni testovi pluća su uredni. Tipično se kod zahvaćenosti pluća nalaze restriktivne smetnje disanja, a kod razvoja fibroze DLCO je snižen.
Ostale dijagnostičke metode. Bronhoalveolarna lavaža pokazuje tipičan nalaz limfocitoze (više od 10 % limfocita) s povećanim omjerom CD4:CD8 stanica (omjer veći od 3,5). Kod sumnje na sarkoidozu središnjeg živčanoga sustava može se određivati koncentracija ACE enzima u cerebrospinalnom likvoru. U nejasnim situacijama moguća je i scintigrafija cijeloga tijela galijem koji se nakuplja u tumorski i upalnim tkivima). Simetrični pojačano nakupljanje galija u hilusima pluća i medijastinuma (lambda znak) te u žlijezdama slinovnicama (panda znak) visoko su sugestivni za sarkoidozu.
Diferencijalna dijagnoza. Kod interpretacije radiološkoga nalaza u obzir dolazi limfom, plućna tuberkuloza, bronhogeni karcinom, idiopatska fibroza i hipersenzitivni pneumonitis.
Liječenje. S obzirom na to da je bolest kod velikoga broja ljudi asimptomatska i sklona spontanoj remisiji, liječenje je indicirano pri sljedećim indikacijama: izražena plućna simptomatologija, prisutnost hiperkalcijemije, izvnaplućna zahvaćenost značajnijih organa (mozak, srce, oči, poremećaji funkcije jetre i bubrega, izražene kožne promjene) te kod asimptomatskih bolesnika kod kojih se na kontrolnim pregledima prati progresija radiološkoga nalaza. Liječenje čini primjena kortikosteroida te imunosupresiva kod onih koji ne reagiraju na kortikosteroide, a u najtežim oblicima u obzir dolazi i transplantacija pluća.
Osnovna shema liječenja. Osnovu liječenja čine kortikosteroidi i to po shemi prednizolon (ili ekvivalent) 0,5 mg/kg peroralno kroz četiri do šest tjedana, nakon čega se doza smanjuje do doze održavanja (obično 5 - 10 mg svaki drugi dan) koja se primjenjuje kroz dvanaest mjeseci. Liječenje se prekida nakon nestanka svih znakova aktivnosti. Po završenom liječenju bolesnici se prate učestalo tijekom dvije godine.
Liječenje bolesnika koji ne reagiraju na osnovnu shemu liječenja. Kod bolesnika koji ne reagiraju na navedeni terapijski režim u obzir dolazi liječenje imunosupresivnim lijekovima (metotreksat, azatiopin, ciklofosfamid i leflunomid), imunomodulatornim lijekovima (infliksimab) ili antimalaricima (klorokin, hidroksiklorokin). Lijek izbora kod bolesnika koji ne reagiraju na osnovu shemu liječenja najčešće je metotreksat, a liječenje treba započeti dozom od 2,5 mg 1 x tjedno i postupno povećavati svaki tjedan za 2,5 mg do doze od 10 - 25 mg 1 x tjedno. Prvih osam tjedana uz metotreksat treba davati i kortikosteroide, a onda ih postupno ukidati, s obzirom na to da metotreksat svoj pravi učinak ostvaruje između šestoga i dvanaestog tjedna liječenja. Tijekom terapije metotreksatom potrebno je češće kontrolirati krvnu sliku i jetrene enzime te se preporuča primjena folne kiseline (1 mg/dan).
Transplantacija pluća u obzir dolazi kao metoda liječenja za stabilne bolesnike koji se nalaze u četvrtom stadiju bolesti (fibroza) i imaju razvijenu respiratornu insuficijenciju.
Prognoza. Na lošiju prognozu bolesti ukazuju drugi i treći stadij bolesti (zahvaćanje plućnoga parenhima), dob bolesnika nakon četrdesete godine, hiperkalcemija, splenomegalija te kronični uveitis. Vrućica, poliartritis, nodozni eritem i bihilarna limfadenopatija u akutnom stadiju ukazuju na dobru prognozu i veću vjerojatnost remisije. Prirodni tijek bolesti je nepredvidiv, iako kod najvećega broja bolesnika dođe do regresije, spontano ili uz primjenu lijekova, a tek manji broj završava fibrozom i teškom respiratornom insuficijencijom. Kod bolesnika koji su postigli remisiju česti su relapsi. Načelno gledano, izlječenje ili dobra kontrola bolesti postižu se kod oko 90 % bolesnika.
GRANULOMATOZA S POLIANGIITISOM (WEGENEROVA GRANULOMATOZA)
Definicija. Granulomatoza s poliangiitisom (Wegenerova granuomatoza) predstavlja kroničnu autoimunu bolest nepoznate etiologije koju karakterizira granulomatozna upala gornjih dišnih puteva i pluća te nekrotizirajući vaskulitis malih i srednje velikih krvnih žila koji u najvećem postotku zahvaća bubrege.
Epidemiologija. Bolest se najčešće se javlja kod osoba srednje životne dobi s nešto većom učestalošću kod muškaraca. Prosječna učestalost bolesti iznosi 10 do 12 slučajeva na milijun stanovnika.
Etiopatogeneza. Glavnu ulogu u nastanku bolesti imaju imunološki mehanizmi, iako do danas nisu poznati uzročnici koji ih pokreću. U središte patogeneze bolesti stavljaju se antineutrofilna citoplazmatska protutijela (c-ANCA) usmjerena protiv proteinaze-3 (PR-3) koja je sastavni dio neutrofila (neki autori PR-3 nazivaju Wegenerov autoantigen). c-ANCA protutijela nalazimo kod više od 95 % bolesnika s generaliziranim oblikom bolesti, dok su pozitivna kod manje od 50 % bolesnika u ranoj fazi bolesti ograničenoj samo na respiratorni sustav. To upućuje na činjenicu da c-ANCA ima glavnu ulogu u nastanku nekrotizirajućega vaskulitisa, što je i dokazano brojnim in vivo i in vitro pokusima koji pokazuju da interakcija između c-ANCA i PR-3 na površini neutrofila dovodi do njihove prerane aktivacije i posljedičnoga endotelnoga oštećenja (vaskulitis). Ipak, ostaje nejasna povezanost između c-ANCA i nastanka granulomatozne upale dišnoga sustava. Većina autora danas smatra da Wegenerova granulomatoza počinje kao tipična granulomatozna bolest dišnoga sustava (granulomatozni odgovor na neki inhalacijom uneseni antigen), a da se kasnije iz nje razvija nekrotizirajući vaskulitis povezan s c-ANCA-om (tzv. Fienbergova hipoteza) te se zbog toga sve više upotrebljava naziv granulomatoza s poliangiitisom umjesto Wegenerova granulomatoza. Danas se kao mogući pokretači cijeloga procesa najčešće spominju bakterija Staphylococcus aureus, lijekovi (antitireoidni lijekovi) te anorganske prašine (silicij, hidrokarboni).
Patologija. Osnovna obilježja granulomatoze s poliangiitsom su nekrotizirajući granulomi koji se tipično nalaze u gornjim dišnim putevima (nos, grlo, sinusi) i plućima te nekrotizirajući vaskulitis koji zahvaća male i srednje velike krvne žile (dišni sustav, bubrezi, koža, oči, središnji živčani sustav). Učestalost zahvaćanja pojedinih organa je sljedeća: pluća (95 %), sinusi (90 %), bubreg (85 %), zglobovi (65 %), nos, nazofarinks i uho (60 %), oko (55 %), živčani sustav (20 %) i srce (10 %).
Klinička slika. Početak bolesti obično je postupan i potpuna klinička manifestacija se razvija kroz šest do dvanaest mjeseci. Rijetko bolest može imati i akutan, brzoprogresivni tijek. Kliničku sliku Wegenerove granulomatoze mogu činiti opći simptomi, simptomi gornjih i donjih dišnih puteva, bubrežni simptomi te ostali simptomi koji ponajprije ovise o proširenosti bolesti, tj. vaskulitisa.
Opći simptomi često prethode drugim očitovanjima, a uključuju umor, malaksalost, gubitak teka i mršavljenje, nespecifične algične sindrome (artralgije, mialgije) te povišenu tjelesnu temperaturu.
Simptomi gornjih dišnih puteva prisutni su u više od 90 % slučajeva bolesti. Tipična očitovanja su kronični sinusitis s gnojnom i/ili sukrvavom sekrecijom, nazalna kongestija te ulceracije usne i nosne šupljine. Rjeđe, bolesnici mogu razviti upalu srednjega uha (bol, šum, nagluhost) ili stridor uzrokovan subglotičnom granulomatoznom stenozom.
Simptomi donjih dišnih puteva prisutni su kod više od 70 % bolesnika, a glavne kliničke manifestacije su dispneja, kašalj s iskašljavanjem, stezanje u prsima i hemoptize.
Bubrežni simptomi rijetko su prisutni u početnoj fazi bolesti, ali s vremenom više od 85 % bolesnika razvije bubrežne kliničke manifestacije, najprije u vidu asimptomatskih patoloških nalaza urina i azotemije, a kasnije simptomatskoga bubrežnog zatajenja.
Ostali simptomi uključuju migratorni oligoartritis koji zahvaća poglavito velike zglobove, okularne lezije (episkleritis, prednji uveitis, unilateralna proptoza uslijed granulomske mase retroorbitalno), kožne lezije u vidu purpure, perifernu neuropatiju s dominacijom ispada osjeta i dr. Također, ovi bolesnici pokazuju izraženu sklonost razvoju duboke venske tromboze.
Dijagnoza se postavlja na osnovi kliničke slike, laboratorijskih nalaza s određivanjem ANCA protutijela, slikovnih metoda te patohistološkom potvrdom iz uzetih uzoraka zahvaćenoga tkiva (biopsija).
Laboratorijske pretrage ukazuju na blagu anemiju, umjerenu leukocitozu, ubrzanu sedimentaciju eritrocita i povišeni C-reaktivni protein. Kod zahvaćenosti bubrega nalazimo i patološki nalaz sedimenta urina (proteinurija, eritrociturija, eritrocitni cilindri) te povišene metabolite dušika u kasniji fazama (ureja, kreatinin).
ANCA protutijela. Najveću dijagnostičku vrijednost ima određivanje antineutrofilinih citoplazmatskih autoantitijela (ANCA). Standardno se određuju dvije vrste: c-ANCA (usmjerena na PR-3) i p-ANCA (usmjerena na mijeloperoksidazu). Veći značaj imamo od c-ANCA protutijela, budući da su ona pozitivna u više od 95 % slučajeva kod bolesnika s razvijenom bolesti, dok svega 10 do 20 % bolesnika ima pozitivna p-ANCA protutijela. Bitno je napomenuti da vrijednosti, tj. titar ANCA antitijela ne korelira s aktivnošću bolesti pa promjene u njihovoj vrijednosti ne bi trebale utjecati na korekciju terapije bez jasnih kliničkih pokazatelja.
Slikovne dijagnostičke metode uključuju radiološko snimanje pluća (konvencionalni radiogram, HRCT) koje u većini slučajeva pokazuje patologiju u vidu infiltrata, nodula ili kavitacija. Hilarna limfadenopatija se rijetko susreće kod ovih bolesnika te ukazuje na mogućnost druge patologije (infekcija, sarkoidoza, tumor). Ostale slikovne metode ovise o zahvaćenosti: CT sinusa, ultrazvuk bubrega, MR mozga i sl.
Patohistološka dijagnostika ključna je za postavljanje konačne dijagnoze. Kao uzorak za patohistološku dijagnozu mogu se uzeti lezije gornjih dišnih puteva, pluća, bubrega ili druge dostupne lezije. Najpouzdaniji uzorak predstavlja bioptat pluća (transbronhalna biopsija, VAST biopsija, otvorena biopsija), s obzirom na to da se na njemu najčešće vide obje komponente bolesti: granulomatozna upala te nekrotizirajući vaskulitis. U uzorcima gornjih dišnih puteva najčešće se vidi samo obrazac kronične upale, bez granuloma i vaskulitisa. Bioptat bubrega uglavnom pokazuje segmentalni nekrotizirajući glomerulonefritis karakteriziran odsustvom ili tek manjom zastupljenošću imunokompleksa u uzorcima.
Zaključno, dijagnoza Wegenerove granulomatoze definitivno se potvrđuje histološkim nalazom granulomatoznoga nekrotizirajućeg vaskulitisa kod bolesnika s dišnim simptomima i znacima glomerulonefritisa.
Diferencijalna dijagnoza uključuje druge sistemske vaskulitise (Churg-Straussov sindrom, mikroskopski poliangiitis, poliarteritis nodosa), druge sistemske bolesti vezivnoga tkiva (npr. sistemski lupus, reumatoidni artritis), Goodpastureov sidnrom, septička stanja te bolesti pluća (karcinom).
Liječenje. Što ranije prepoznavanje i početak liječenja ključni su u prevenciji napredovanja bolesti i uzrokovanja višeorganskoga oštećenja. Liječenje je podijeljeno u dvije faze: faza indukcije i faza održavanja.
Faza indukcije. U početnom liječenju postoje dvije opcije: klasična - koja uključuje kombinaciju ciklofosfamida i kortikosteroida, ili u novije vrijeme - kombinacija rituksimaba i kortikosteroida. U klasičnoj opciji primjenjuje se ciklofosfamid u dozi od 2 mg/kg/dan peroralno (redukcija doze preporuča se kod značajnijega renalnoga oštećenja te bolesnika iznad 70 godina) uz prednizon u dozi od 1 mg/kg/dan. Remisija se tim režimom postiže kod više od 90 % bolesnika. Preporuča se liječenje u trajanju od tri do šest mjeseci. Za vrijeme terapije ciklofosfamidom indicirano je profilaktičko uzimanje sulfametoksazola s trimetoprimom zbog prevencije infekcije P. jirovecii te dobra hidracija zbog prevencije hemoragijskoga cistitisa i karcinoma mokraćnoga mjehura. Doza kortikosteroida se snižava nakon četiri tjedna, a ako bolesnici to toleriraju i potpuno se ukida. U novije vrijeme koristi se i kombinacija rituksimaba s kortikosteroidima kao inicijalna terapija, što su ad hoc analize pokazale čak i učinkovitijim pristupom, ali prisutnost većega rizika od oportunističkih infekcija i nedostatak dugoročnijih studija ograničava primjenu ovoga terapijskog režima.
Faza održavanja. Po kliničkoj stabilizaciji koja obično uslijedi nakon tri do šest mjeseci nastavlja se s terapijom održavanja, a na raspolaganju su tri opcije: azatioprin (1 - 2 mg/kg/dan per os), metotreksat (20 - 25 mg/tjedno per os ili intramsukularno) te rituksimab (500 mg intravenski početno, a potom ponoviti dozu za četrnaest dana, a zatim svakih šest mjeseci). Obično se preferira metotreksat u fazi održavanja, ali treba imati na umu da se metotreksat treba izbjegavati kod bolesnika s bubrežnim oštećenjem.
Prognoza. Rana dijagnoza i rana terapija osiguravaju dobru prognozu: postizanje visoke stope remisije te smanjenje ili uklanjanje bubrežnoga oštećenja. Neliječeni bolesnici imaju progresivan tijek s lošim ishodima.
EOZINOFILNA GRANULOMATOZA S POLIANGIITISOM (CHURG-STRAUSSOV SINDROM)
Definicija. Eozinofilna granulomatoza s poliangiitisom ili Churg-Straussov sindrom predstavlja rijetku, imunološki posredovanu sistemsku bolest koju karakterizira nekrotizirajući vaskulitis te stvaranje granuloma u različitim tkivima i organima (najčešće u plućnom intersticiju), obično kod bolesnika s astmom i perifernom eozinofilijom.
Epidemiologija. Učestalost ove bolesti iznosi oko 3 oboljela na milijun stanovnika. Podjednako se javlja kod oba spola, obično u četvrtom i petom desetljeću života. Kako je već navedeno, primijećena je snažna povezanost s težim oblicima bronhalne astme i eozinofilijom.
Etiopatogenza je nepoznata, a smatra se da je za nastanak bolesti odgovoran (auto)imunološki proces na što upućuje nalaz brojnih imunoloških biljega: povišen imunoglobulin E, povišen eozinofilni kationski protein (ECP), pozitivna antineutrofilna citoplazmatska antitijela (pretežno p-ANCA, dok je c-ANCA uglavnom negativna) te reumatoidni faktor (RF). U novije vrijeme pojavnost bolesti povezuje se i s uzimanjem antileukotrijena te naglim prestankom uzimanja oralnih kortikosteroida kod bolesnika s astmom.
Patologija. Glavne patološke karakteristike su vaskulitis malih i srednje velikih krvnih žila te formiranje granuloma uz eozinofilne infiltrate koji mogu zahvatiti različite organe i tkiva (pluća, koža, bubrezi, srce, probavni trakt, periferni živci).
Klinička slika. U početnoj fazi bolesti dominiraju opći simptomi (temperatura, umor, glavobolja, preznojavanje, mršavljenje) uz simptome astme. Postupno se razvijaju plućni simptomi u vidu progresivne dispneje, kašlja, hemoptiza te stezanja u prsima. Moguća su i klinička očitovanja uslijed zahvaćenosti drugih organa i tkiva: koža (purpura, hemoragične bule, subkutani noduli), probavni sustav (bol u trbuhu, krvarenje), srce (akutni infarkt miokarda, srčano popuštanje), periferna neuropatija i dr.
Dijagnoza se postavlja na osnovi kliničke slike, anamnestičkih podataka (astma), laboratorijskih, radioloških i histoloških metoda. U laboratorijskim nalazima obično se prati ubrzana sedimentacija eritrocita, povišeni upalni parametri, eozinofilija, a pozitivni mogu biti i drugi imunološki markeri (IgE, p-ANCA, RF). Na radiološkim snimkama pluća opisuju se obostrani infiltrati pretežno u gornjim i srednjim plućnim poljima. Bolest se potvrđuje nalazom eozinofilnoga granulomatoznoga nekrotizirajućeg vaskulitisa u bioptičkim uzorcima (pluća, koža i dr.).
Dijagnostički kriteriji za Churg-Straussov sindrom uključuju sljedeće parametre: astma, eozinfolija, plućni infiltrati, periferna neuropatija i tipičan histološki nalaz. Za postavljanje dijagnoze dovoljno je da su zadovoljena četiri od šest kriterija.
Liječenje ponajprije obuhvaća primjenu kortikosteroida, obično prednizolon uz dozu od 1 mg/kg/dan uz postupno smanjenje doze po kliničkoj stabilizaciji te uz dugoročnu primjenu, nekada i trajnu, u svrhu sprečavanja relapsa bolesti. Kod težih bolesnika i onih koji ne reagiraju na liječenje u terapiju se može uključiti i ciklofosfamid.
Prognoza. Petogodišnje preživljenje bolesnika koji su odgovarajuće liječeni iznosi 60 do 80 %, dok je to kod neliječenih bolesnika oko 25 %.
BRONHOCENTRIČNA GRANULOMATOZA
Uvod. Bronhocentrična granulomatoza predstavlja rijetku, destruktivnu granulomatoznu leziju bronha i bronhiola za koju se vjeruje da nastaje kao nespecifični odgovor na različite oblike oštećenja dišnih puteva. U polovici slučajeva bolest je povezana s astmom i alergičnom bronhopulmonalnom aspergilozom, iako se bolest može povezati i s nekim drugim bolestima i stanjima (gljivične infekcija pluća, reumatoidni artritis, ankilozantni spondilitis, glomerulonefritis, aplazija crvene loze te influenza).
Klinika. Bolest se klinički očituje općim simptoma, simptomima osnovne bolesti (astma) te priduženim plućnim simptomima koji uključuju dispneju, kašalj, iskašljavanje, hemoptize i stezanje u prsima. Radiološki nalaz može biti varijabilan (solitarni ili multipli noduli, infiltrati, atelektaza). Konačnu dijagnozu daje patohistološka analiza bronhoskopski dobivenoga uzorka. Liječenje se temelji na primjeni glukokortikoida, iako kod velikoga broja bolesnika bolest može imati i spontanu regresiju.
LIMFOMATOIDNA GRANULOMATOZA
Uvod. Plućna limfomatoidna granulomatoza predstavlja rijedak oblik limfoproliferativne bolesti koju karakteriziraju višestruki plućni nodularni infiltrati (granulomi) s invazijom limfocita u stijenku krvnih žila. Prema klasifikaciji SZO-a, radi se o limfoproliferativnoj bolesti B-staničnoga porijekla nepoznatoga malignog potencijala. Bolest se javlja u bilo kojoj životnoj dobi, ali najčešće između trećeg i petoga desetljeća s nešto višom učestalošću kod muškaraca. Etiološki, bolest se najčešće povezuje s EBV infekcijom, iako je točan mehanizam nepoznat. Osim pluća, bolest može zahvatiti i druga tkiva i organe (živčani sustav, bubrezi).
Klinika. Bolesnici se prezentiraju općim simptomima (umor, malaksalost, mršavljenje, temperature), plućnim simptomima (kašalj, dispneja, hemoptize) te izvanplućnim simptomima, ovisno o zahvaćenosti. Osim pluća, bolest može zahvatiti i druga tkiva i organe (živčani sustav, koža, bubrezi). Radiološki se može prezentirati solitarnim ili višestrukim nodulima ili masama u donjim i perifernim plućnim poljima (80 - 100 %) koji mogu biti migrirajući. Drugi mogući radiološki nalaz su pleuralni izljevi (33 %), pneumonitis ili velike lezije u obliku mase (30 %), kavitacije nodula (30 %) i pneumotoraks (5 %). Konačna dijagnoza se postavlja patohistološkom analizom bioptata plućne promjene. Liječenje uključuje primjenu kortikosteroida, a u težim slučajevima i citostatika.
INTERSTICIJSKE BOLESTI PLUĆA ZASEBNE KATEGORIJE
Iz ove skupine intersticijskih bolesti bit će prikazane plućna alveolarna proteinoza, histiocitoza Langerhansovih stanica te limfangioleiomiomatoza. Ostale su opisane u drugim dijelovima (plućne eozinofilije, plućni hemoragijski sindromi i dr.).
PLUĆNA ALVEOLARNA PROTEINOZA
Definicija i epidemiologija. Plućna alveolarna proteinoza rijetka je bolest koju karakterizira nakupljanje lipoproteinskoga materijala u alveolama, poglavito proteina surfaktanta. Obično se javlja kod mlađih, do tada zdravih osoba s dva do tri puta većom učestalošću kod muškaraca.
Etiopatogeneza. Nakupljanje lipoproteinskoga sadržaja unutar alveola posljedica je pojačane produkcije lipoproteinskoga materijala i/ili oslabljene funkcije alveolarnih makrofaga koji imaju sposobnost njihovoga uklanjanja. Bolest dolazi u tri oblika: kongenitalni, stečeni i idiopatski. Kongenitalni oblik povezan je s poremećajima proizvodnje proteina, poglavito surfaktanta, zbog čega se on pojačano nakuplja unutar alveola, a sama bolest postaje klinički manifestna još u dječjoj dobi. Stečeni oblik povezan je s bolestima i stanjima koja smanjuju funkciju alveolarnih makrofaga zbog čega ne mogu na odgovarajući način eliminirati lipoproteinski materijal te se on pojačano nakuplja (hematološke maligne bolesti, farmakološka supresija, prekomjerna inhalacija anorganskih prašina ili toksičnih plinova). Idiopatski oblik plućne alveolarne proteinoze ostaje nepoznate etiologije.
Klinička slika se razvija postupno, a dominira progresivna dispneja, podražajni kašalj s oskudnim iskašljavanjem, hemoptize i stezanje u prsima. S vremenom se razvija respiratorna insuficijencija s cijanozom i batićastim prstima.
Dijagnoza se postavlja na osnovi kliničke slike, laboratorijskih nalaza, radiološke dijagnostike, bronhoalveolarne lavaže i u nekim slučajevima patohistološke potvrde bolesti. U laboratorijskim nalazima nalazimo policitemiju, hipergamaglobulnijemiju i povišen LDH. Najčešći radiološki nalaz na konvencionalnom radiogramu pluća ukazuje na bihilarne infiltrate poput leptirovih krila koje nalazimo i kod plućnoga edema. HRCT daje bolje podatke i ukazuje na promjene intersticija (zadebljanje interlobularnih septa, uzorak mliječnoga stakla). Bronhoalveolarna lavaža ima ključnu ulogu u postavljanju dijagnoze. Uzorak izgleda zamućeno, mliječnoga je izgleda, a biokemijskom analizom vide se PAS-pozitivna acelularna ovalna tjelešca i pjenušavi makrofagi. U nejasnim slučajevima indicirana je biopsija pluća i patohistološki pregled koji ukazuje na karakteristično nakupljanje proteinskoga i fosfolipidnoga sadržaja unutar alveola.
Liječenje uključuje terapijsko ispiranje pluća. Ono se izvodi pod općom anestezijom nakon intubacije endotrahealnim tubusom s dva lumena. Dok vršimo lavažu pluća fiziološkom otopinom u velikim količinama (10 do 15 puta s po 1 do 2 litre) kroz jedan lumen, kroz drugi se vrši ventilacija bolesnika. Kod 50 % bolesnika dovoljna je jedna lavaža pluća, dok se kod drugih postupak mora ponavljati svakih šest do dvanaest mjeseci. Medikamentozna terapija nema veću ulogu.
Prognoza. Kod 10 % bolesnika bolest spontano prolazi. Uz redovne kontrole i lavažu pluća, petogodišnje preživljenje iznosi i do 80 %. Na preživljenje utječu česte sekundarne infekcije pluća.
PLUĆNA HISTIOCITOZA LANGERHANSOVIH STANICA
Definicija. Histocitoza Langerhansovih stanica (histiocitoza X) rijetka je granulomatozna bolest koju karakteriziraju infiltracija i proliferacija Langerhansovih stanica u plućnom intersticiju i zračnim prostorima. Osim pluća, mogu biti zahvaćeni i drugi organi i tkiva (koža, kosti, limfatično tkivo, hipofiza).
Epidemiologija. Bolest se obično javlja u srednjoj životnoj dobi, podjednako kod oba spola. Karakteristično je da se bolest javlja gotovo isključivo u pušača.
Etiopatogeneza. Točan uzrok bolesti nije poznat. S obzirom na snažnu povezanost s pušenjem, njezina pojavnost pokušava se objasniti aktivacijom alveolarnih makrofaga kao posljedice izloženosti duhanskom dimom. Posljedično tome, dolazi do pojačanoga lučenja citokina i faktora rasta koji su odgovorni za kemotaksiju, infiltraciju i proliferaciju Langerhansovih stanica u plućnom intersticiju. Izolirana zahvaćenost pluća prisutna je u oko 80 % slučajeva, a glavne patološke odrednice su formiranje mikronodusa i cističnih promjena koji zahvaćaju obično gornje plućne režnjeve. Cistične formacije mogu rupturirati u pleuralni prostor s posljedičnim nastankom pneumotoraksa. Infiltracija hipofize prezentira se kao dijabetes insipidus, a moguće su i koštane i kožne lezije.
Klinička slika. Bolest obično počinje blagim simptomima kao što su dispneja, kašalj i stezanje u prsima. S vremenom dolazi do progresije, pogoršanja dispneje, produktivnoga kašalja i hemoptiza. Nastanak pneumotoraksa dodatno naglo pogoršava dispneju i bol u prsima. Ostale manifestacije uključuju poliuriju (dijabetes insipidus), bol u kostima, kožne osipe i limfadenopatiju.
Dijagnoza se postavlja na osnovi kliničke slike, anamnestičkih podataka (pušenje) radiološke dijagnostičke obrade i patohistološke potvrde bolesti. Radiološki nalaz (konvencionalni radiogram, HRCT) pokazuju zadebljani intersticij s mikronodularnim promjenama i formiranje cističnih formacija. Patohistološka potvrda bolesti uključuje biopsiju pluća (transbronhalna, torakoskopska, otvorena) i nalaz proliferiranih Langerhansovih stanica u preparatu (prikaz Birbeckovih granula elektronskom mikroskopijom, prikaz površinskih antigena CD1 monoklonalnim antitijelima). Ako se u bronhoalveolarnom lavatu nađe više od 5 % Langerhansovih stanica uz odgovarajuću anamnezu i radiološki nalaz, biopsija pluća nije nužna za potvrđivanje dijagnoze. Testovi plućne funkcije mogu biti normalni ili pokazivati restriktivne smetnje disanja, no ako se radi o pušačima kod kojih se razvila kronična opstruktivna plućna bolest, smetnje disanja bit će mješovitoga opstruktivno-restriktivnoga tipa.
Liječenje uključuje prestanak pušenja, što kod nekih bolesnika može dovesti od kliničkoga poboljšanja, a nekada i radiološke regresije bolesti. Mogu se primjenjivati i kortikosteroidi s ili bez citostatika, ali uspjeh nije zadovoljavajući. Odabrani bolesnici mogu biti kandidati za transplantaciju pluća.
Prognoza. Priroda bolesti je nepredvidiva što uključuje ishode od spontane regresije do napredovanja do stadija fibroze i respiratorne insuficijencije. Moguća je i progresija prema limfomu. Petogodišnje preživljenje iznosi oko 55 do 60 %.
PLUĆNA LIMFANGIOLEIOMIOMATOZA
Definicija i epidemiologija. Plućna limfangioleiomiomatoza rijedak je poremećaj kojega karakterizira hamartomatozna infiltracija pluća glatko-mišićnim stanicama, a isključivo se javlja kod premenopauzalnih žena s učestalošću manjom od 1 na milijun žena.
Etiopatogeneza. Točan uzrok bolesti se ne zna, a 15 % bolesnica s ovom dijagnozom ima i tuberoznu sklerozu. Uloga spolnih hormona u patogenezi nije poznata (s obzirom na pojavljivanje samo kod žena). Proliferacija atipičnih glatko-mišićnih stanica zahvaća plućni parenhim, plućne krvne i limfne žile te pleuru. Posebno čest nalaz kod ovih bolesnica je poremećena limfna drenaža s razvojem hilotoraksa. Postupno dolazi do narušavanja normalne plućne arhitekture s razvojem emfizema i propadanjem plućne funkcije. Kod ovih je bolesnika češća i učestalost bubrežnih angiomiolipoma.
Klinička slika uključuje početne simptome kao što su dispneja, podražajni kašalj koji kasnije postaje produktivan uz povremene hemoptize i stezanje u prsima. Česti su pneumotoraksi i hilozni pleuralni izljevi koji dodatno pogoršavaju dispneju.
Dijagnoza se postavlja na temelju kliničke slike, radiološke dijagnostike i biopsije pluća. Na radiološkim snimkama (konvencionalni radiogram, HRCT) nalazimo klasične intersticijske promjene s normalnim ili povećanim plućnim volumenima (uslijed emfizema) te mogući pleuralni izljev. Na HRCT-u se mogu uočiti višestruke i difuzno raspoređene ciste. Konačnu dijagnozu postavljamo patohistološkom analizom bioptata pluća kojom se prikazuje proliferacija glatko-mišićnih stanica uz cistične formacije.
Liječenje. U pokušajima liječenja navedeni su ovariektomija, progesteronska terapija te primjena tamoksifena, no unatoč tome, bolest ima svoj progresivni tijek i završava respiratornom insuficijencijom i smrću. Transplantacija pluća može dovesti do kratkoročnoga poboljšanja, ali se bolest vraća i na transplantatu. Srednje preživljenje od postavljanja dijagnoze iznosi oko osam godina.
DIFUZNA ALVEOLARNA HEMORAGIJA
Definicija. Difuzna alveolarna hemoragija (DAH) predstavlja klinički sindrom koji nastaje uslijed masovne ekstravazacije eritrocita u alveolarni prostor, što se klinički očituje rekurentnim hemoptizama, bilateralnim plućnim infiltratima te padom u crvenoj krvnoj slici. Kod jedne trećine bolesnika s ovim sindromom hemoptize ne moraju biti prisutne, a pad u crvenoj krvnoj slici ne mora biti izražen. DAH je najčešće posljedica plućnih vaskulitisa i idiopatske plućne hemosideroze, no velik broj bolesti i stanja može se prezentirati kao DAH što rezultira velikim diferencijalno-dijagnostičkim izazovom.
Etiologija. Uzroke difuzne alveolarne hemoragije možemo podijeliti u dvije skupine, a to su skupina koja je povezana s vaskulitisom i ona koja nije povezana s vaskulitisom. Najčešći uzroci difuzne alveolarne hemoragije su plućni vaskulitisi te idiopatska plućna hemosideroza što će biti i posebno opisano.
Bolesti i stanja povezana s vaskulitisom. U ovu skupinu ubrajamo primarne i sekundarne vaskulitise. Primarni vaskulitisi dijele se u dvije skupine: vaskulitisi povezani s ANCA-om i vaskulitisi posredovani imunokompleksima. Sekundarne vaskulitise nalazimo u sklopu različitih sistemskih autoimunih bolesti, esencijalne krioglubulinemije, Behcetove bolesti, stanja nakon transplantacije pluća i koštane srži te uzrokovanu lijekovima (vaskulitis induciran lijekovima). Detaljnija podjela primarnih i sekundarnih vaskulitisa koji uzrokuju DAH opisana je kasnije (plućni vaskulitisi).
Bolesti i stanja koja nisu povezana s vaskulitisom („slijepa hemoragija“). U ovu skupinu ubrajamo idiopatsku plućnu hemosiderozu, koagulopatije, mitralnu stenozu, inhalacijska oštećenja pluća, hemoragiju induciranu lijekovima, kao i neke sistemske bolesti (Goodpastureov sindrom, sistemski eritematozni lupus).
Patogeneza. Glavni patogenetski događaj u DAH-u je diseminirano oštećenje plućnih kapilara što je praćeno disrupcijom alveolarne i kapilarne bazalne membrane s posljedičnom ekstravazacijom eritrocita u alveolarni prostor. S obzirom na to da je alveolarni prostor ispod dosega mukocilijarnoga aparata te receptora za kašalj, velika količina krvi zaostaje u plućima prije nego se to klinički očituje (hemoptize). Tako nastaju alveolarni infiltrati koji narušavaju normalnu funkciju pluća i dovode do razvoja respiratorne insuficijencije.
Klinička slika. Kliničko očitovanje DAH-a je široko te obuhvaća spektar od asimptomatskoga patološkoga radiološkog nalaza pa sve do teške, po život opasne respiratorne insuficijencije. Bolesnici se najčešće prezentiraju znacima krvarenja iz dišnoga sustava (hemoptize, hemoptoa), iako kod jedne trećine bolesnika to može izostati. Ostali simptomi i znakovi uključuju progresivnu dispneju, kašalj, stezanje u prsima te vrućicu. Kliničko stanje može se pogoršavati i komplicirati razvojem respiratorne insuficijencije koja zahtijeva mehaničku potporu disanju. Ovisno o uzroku, bolesnici mogu ispoljavati i druge kliničke manifestacije kao što su kožni osipi, znaci zahvaćenosti gornjih dišnih puteva, sinusa i očiju, neurološke manifestacije, nespecifični artritisi i mišićna slabost, znaci oštećene bubrežne funkcije i dr.
Dijagnoza. Postavljanje dijagnoze DAH-a relativno je klinički lako, a počiva na kliničkoj slici, laboratorijskim nalazima (pad u crvenoj krvnoj slici) te na prisutnosti radioloških infiltrata, no razumijevanje uzroka i diferencijalna dijagnoza kod ovih su bolesnika je teški i opsežni. Dijagnostički postupak započinje temeljitom anamnezom i fizikalnim pregledom, osnovnom laboratorijskom i radiološkom obradom, a na osnovi toga dalje se provode specifične dijagnostičke metode.
Anamneza i fizikalni pregled. Temeljito uzeta anamneza (opseg i razvoj simptoma, prethodne bolesti, izlaganje štetnim tvarima, lijekovi) kod ovih bolesnika može biti ključna za daljnje usmjeravanje dijagnostičkoga postupka. Zajedno s fizikalnim pregledom, anamneza može ukazivati da se ne radi samo o plućnoj patologiji, nego o zahvaćenosti više organskih sustava, što je glavna karakteristika vaskulitisa koji su najčešći uzrok DAH-a.
Osnovni laboratorijski nalazi ukazuju na anemiju i pad hemoglobina, a ako je bolest duže prisutna nalazimo i znakove sideropenije, a ovisno o uzročnoj bolesti i njezinoj rasprostranjenosti mogu se naći i otkloni u diferencijalnoj krvnoj slici (eozinofilija), povišeni metaboliti dušika (azotemija), patološki nalaz urina (proteinurija, eritrociturija, eritrocitni cilindri) i dr.
Radiološka dijagnostika. Kod bolesnika s kliničkom sumnjom na DAH (hemoptize, anemija) i prisutnih plućnih infiltrata na konvencionalnoj radiološkoj snimci indicirana je kompjuterizirana tomografija visoke rezolucije (HRCT). Klasični nalazi uključuju intersticijski uzorak (engl. ground glass opacifikacije) udružen s područjima alveolarne konsolidacije. Nakon prestanka hemoragije dolazi i do relativno brzoga povlačenja infiltrata (nekoliko dana do nekoliko tjedana). U fazi regresije glavni nalaz predstavljaju zadebljane interlobularne septe. Ovisno o uzročnoj bolesti mogu se naći i drugi, specifični nalazi (granulomi, kavitacije, itd.).
Specifični laboratorijski nalazi izvode s ciljem diferenciranja uzroka DAH-a. Preporuča se ANCA testiranje (c-ANCA, p-ANCA), određivanje antitijela na glomerularnu bazalnu membranu (anti-GBM), antinuklearnih antitijela (ANA), anticitrulinskih protutijela (anti-CCP), reumatoidnoga faktora (RF) te antifosfolipidnih antitijela. Kod sumnje na lijekove kao uzrok DAH-a može se napraviti i toksikološka analiza urina na lijekove.
Difuzijski kapacitet pluća za ugljični monoksid (DLCO) može biti koristan u postavljanju dijagnoze DAH-a, a karakteristično je da kod ovih bolesnika nalazimo prolazno, reverzibilno povećanje DLCO-a kao posljedice vezanja ugljičnoga monoksida za intraalveolarni hemoglobin. Ipak, ovaj test se ne koristi rutinski u praksi.
Bronhoskopija i bronhoalveolarna lavaža. Bronhoskopija ima svoje mjesto u isključivanju izvora krvarenja u velikim i srednje velikim dišnim putevima te drugih patologija (tumori, infekcije i sl.). Bronhoalveolarna lavaža služi za potvrdu intraalveolarne hemoragije, a ključni nalaz je prisutnost više od 20 % hemosiderinom krcatih makrofaga (HLM, od engl. hemosiderin laden macrophages), iako ono može biti prisutno i u drugim oblicima difuzne alveolarne lezije, stoga se treba tumačiti u kontekstu ostalih kliničko-radioloških parametara.
Patohistološka dijagnostika dobivenih uzoraka tkiva pluća (transbronhalna, kirurška) i/ili drugih tkiva ovisno o proširenosti bolesti ključna je za slaganje mozaika diferencijalne dijagnoze DAH-a.
Liječenje. Liječenje difuzne alveolarne hemoragije u prvom redu ovisi o uzročnoj bolesti, stoga je potrebno što ranije provesti širok dijagnostički postupak s ciljem postavljanja prave dijagnoze. Specifična, etiološka terapija opisana je u zasebnim dijelovima u kojima se i opisuje etiološki entitet. Ovdje će biti navedena akutna simptomatska terapija liječenja DAH-a dok još nije poznat etiološki entitet. Akutno liječenje DAH-a uključuje odgovarajuću ventilacijsku potporu, kontrolu koagulacijskoga sustava, primjenu glukokortikoida te u posebnim stanjima primjenu rekombinantnoga faktora VIIa te primjenu antifibrinolitika.
Ventilacijska potpora. Stupanj potpore disanju ovisi ponajprije o stanju bolesnika i može uključivati sve oblike: oksigenoterapija, neinvazivna mehanička ventilacija, invazivna mehanička ventilacija te u najtežim oblicima ekstrakorporalna membranska oksigenacija (VV-ECMO).
Kontrola koagulacijskih parametara. Glavne preporuke kod ovih bolesnika uključuju kontrolu broja trombocita iznad 50.000/µL te PV-INR ispod 1.5. Ove parametre postižemo transfuzijama trombocita, primjenom vitamina K te eventualno primjenom svježe smrznute plazme.
Primjena glukokortikoida. S obzirom na to da je najčešći uzrok DAH-a imunološki posredovana bolest, opravdana je primjena ovih lijekova i bez potvrđene dijagnoze. Preporuča se parenteralna primjena metilprednizolona u visokim dozama. Kod primjene glukokortikoida treba imati na umu da se uzmu dijagnostički uzorci prije početka terapija te da se bolesnici na odgovarajući način pokriju antimikrobnim lijekovima.
Ako se uz primjenu navedenih metoda liječenja ne uspijeva postići odgovarajuća kontrola bolesti, u obzir dolazi primjena rekombinantnoga faktora VIIa ili antifibrilnotika, sve s ciljem pokušaja zaustavljanja intraalveolarne hemoragije bez obzira na nepoznat uzrok DAH-a.
Primjena rekombinantnoga faktora VIIa (rVIIa) može predstavljati terapijski izbor kod refraktornih, životno ugroženih bolesnika. Primjena se temelji na manjim studijama i pojedinačnim prikazima slučajeva koji su pokazali određenu kliničku korist. Može se primijeniti sistemsko (i.v.) ili lokalno (bronhoskopski). Kod sistemske primjene lijek se daje intravenski u dozi od 90 - 180 mcg/kg kao jedna doza ili se po potrebi može ponavljati svaka dva do četiri sata. Ako se primjenjuje lokalno tijekom bronhoskopije, primjenjuje se tako da se 50 mcg lijeka pomiješa s 50 ml fiziološke otopine te da se aplicira 25 ml dobivene otopine u svaki glavni bronh. Primjenu ovoga lijeka mogu pratiti tromboembolijski incidenti što treba imati na umu. Primjena rVIIa u ovoj indikaciji je off label, ali u kritičnim situacijama može biti opravdana.
Primjena antifibrinolitika također je terapijska opcija koja je na raspolaganju u refraktornim i životno ugrožavajućim situacijama. Može se primijeniti inhibitor aminokaproične kiseline (stariji antifibrinolitik) ili traneksamična kiselina (noviji antifibrinolitik). Također je moguća sistemska (intravenska) ili lokalna (bronhoskopska) primjena.
PLUĆNI VASKULITISI
Definicija. Vaskulitis je naziv za heterogenu skupinu bolesti koju karakterizira upalni proces stijenke krvnih žila, a mogu se javiti primarno, kao samostalna bolest, ili sekundarno, u sklopu različitih sistemskih bolesti. Radi se o bolestima koje mogu zahvatiti bilo koje krvne žile u tijelu te mogu imati višeorgansko očitovanje. Pluća, odnosno plućno krvožilje, često je sijelo i primarnih i sekundarnih vaskulitisa.
Klasifikacija. Klasično se vaskulitisi dijele prema veličini krvnih žila koje napadaju, pa tako razlikujemo vaskulitise malih, srednje velikih i velikih krvnih žila (detaljno opisano u dijelu o reumatologiji, imunologiji i alergologiji). Radi lakšega razumijevanja, za potrebe ovoga poglavlja, vaskulitise koji zahvaćaju pluća dijelimo u tri skupine: 1) primarni idiopatski vaskulitisi malih krvnih žila povezani s ANCA-om (granulomatozni poliangiitis ili Wegenerova granulomatoza, eozinofilni granulomatozni poliangiitis ili Churg-Straussov sindrom, mikroskopski poliangiitis te izolirani pauci-imuni plućni kapilaritis), 2) primarni vaskulitisi posredovani imunokompleksima (Goodpastureov sindrom) te 3) sekundarni vaskulitisi (kronične sistemske autoimune bolesti, esencijalna krioglobulinemija, Behcetova bolest, transplantacija pluća i koštane srži te vaskulitis induciran lijekovima).
Glavne značajke plućnih vaskulitisa. Glavne značajke vaskulitisa koji pogađaju plućno krvožilje bit će opisane u ovom dijelu udžbenika, dok se detaljniji podaci o tim bolestima nalaze u drugim, odgovarajućim dijelovima.
Granulomatozni poliangiitis (granulomatoza s poliangiitisom, Wegenerova granulomatoza) najčešći je vaskulitis povezan s ANCA-om karakteriziran granulomatoznom upalom gornjih dišnih puteva i pluća te nekrotizirajućim vaskulitisom malih i srednje velikih krvnih. Dominanta klinička očitovanja dišnoga sustava povezana su s granulomima u gornjim dišnim putevima (sinusitis, rinoreja, epistakse, subglotična stenoza) te plućima (dispneja, kašalj, stezanje u prsima, hemoptize). Bolest se može prezentirati i općim simptomima te simptomima i znakovima zahvaćenosti drugih organa i tkiva: bubrežna insuficijencija, koža (purpura, ulceracije, papulonodularni osipi), mišićnokoštani sustav (artritis i artralgije, mialgije), oči (konjuktivitis, uveitis, proptoza), živčani sustav (glavobolje, periferne neuropatije) i dr. Glavni serološki marker je c-ANCA protutijelo koje je pozitivno kod 85 do 95 % bolesnika s aktivnom bolešću. Histološki nalaz karakterizira nekrotizirajući vaskulitis malih i srednje velikih krvnih žila, granulomatozna upala s formiranjem granuloma te parenhimalna nekroza zahvaćenoga tkiva.
Eozinofilni granulomatozni poliangiitis (eozinofilna granulomatoza s poliangiitisom, Churg-Straussov sindrom) također se ubraja u skupinu vaskulitisa povezanih s ANCA-om, a karakterizira ga trijada: astma, eozinofilija te sistemski nekrotizirajući vaskulitis uz stvaranje granuloma, najčešće u plućnom intersticiju. Klinički, bolest prolazi kroz tri faze: 1) prodromalna faza u kojoj dominiraju opći simptomi i koja može trajati godinama, 2) eozinofilna faza koju karakterizira periferna eozinofilija i eozinofilni infiltrati te 3) faza vaskulitisa koja može imati i fatalni završetak. Klinički je značajna zahvaćenost probavnoga sustava (gastrointestinalna krvarenja) te srca (zahvaćenost srca odgovorna je polovinu smrti ovih bolesnika). p-ANCA je pozitivna kod 35 do 75 %, a c-ANCA kod 5 do 10 % bolesnika. Glavna histološka obilježja su nekrotizirajući vaskulitis malih krvnih žila te eozinofilni infiltrati s nekrotizirajućim granulomima.
Mikroskopski poliangiitis (MPA) negranulomatozni je nekrotizirajući vaskulitis koji zahvaća male krvne žile. Zbog sličnosti u etiopatogenezi, MPA se smatra varijantom poliarteritisa nodosa vaskulitisa (PAN) koji inače pogađa srednje velike krvne žile. Glavne razlike su u tome što pluća i bubrezi obično nisu zahvaćeni u PAN-u, a MPA obično nije povezan s prethodnom hepatitis B ili C infekcijom, što je često u PAN-u. Bolest se obično javlja u petom desetljeću života, podjednako kod oba spola. Najčešće su pogođeni bubrezi i pluća pa kod gotovo svih bolesnika nalazimo brzoprogresivan glomerulonefritis (90 - 100 %), dok difuznu alveolarnu hemoragiju nalazimo kod 30 do 50 % bolesnika (dispneja s ili bez hemoptiza, pad hemoglobina, alveolarni infiltrati). Pored toga, mogu se javiti i opći simptomi te simptomi zahvaćenosti drugih organa i tkiva (kožne lezije, periferna neuropatija, gastrointestinalna krvarenja, artralgije i dr.). Većina bolesnika (50 do 75 %) ima pozitivan biljeg p-ANCA, dok je c-ANCA pozitivan kod 10 do 15 % bolesnika. Histološki nalaz uključuje fokalni, segmentirajući vaskulitis s upalnim mješovitim infiltratima bez formiranja granuloma.
Izolirani pauci-imuni plućni vaskulitis rijedak je oblik vaskulitisa koji kliničko-patološki karakterizira izoliran plućni kapilaritis bez seroloških ili kliničkih znakova sistemskih bolesti vezivnoga tkiva uz pozitivne ANCA serološke biljege. Bolest se obično javlja kod osoba srednje životne dobi, podjednako kod oba spola. Glavno kliničko obilježje je difuzna alveolarna hemoragija. Neki bolesnici mogu pokazivati simptome gornjih dišnih puteva, ali ne ispunjavaju sve kriterije za granulomatozni, a kod jednoga dijela nalazimo astmu, ali bez eozinofilije, što isključuje CSS. Histološki nalaz uključuje nespecifični kapilaritis i difuznu alveolarnu hemoragiju.
Goodpastureov sindrom (GS) je autoimuna bolest koju karakterizira postojanje cirkulirajućih antitijela na glomerularnu bazalnu membranu (anti-GBM), plućna hemoragija te brzoprogresivni glomerulonefritis. Anti-GBM antitijela usmjerena su na određene dijelove kolagena tipa IV, koji se u najvećoj mjeri nalaze u sastavu bazalne membrane bubrežnih i plućnih kapilara. Anti-GBM antitijela nastaju kod genetskih predisponiranih osoba, a sama bolest je potaknuta vanjskim čimbenikom (pušenje, virusna infekcija, toksini) koji oštećuje endotel i omogućava pristup autoantitijelima na bazalnu membranu gdje se oni vežu te uzrokuju stanično posredovani imuni odgovor koji vodi oštećenju tkiva. Bolest je češća u mlađoj i srednjoj životnoj dobi, češće kod muškaraca. Glavne kliničke manifestacije su dispneja, kašalj, stezanje u prsima te plućna hemoragija koja može imati raspon od rijetkih hemoptiza do klinički značajnoga krvarenja. Bubrežne manifestacije uključuju raspon od asimptomatskih patoloških nalaza (azotemija, patološki sediment urina) do klinički manifestnoga bubrežnog zatajenja. Glavni serološki pokazatelj GS-a je dokaz anti-GBM autoantitijela, a jedan dio bolesnika može imati pozitivna i ANCA antitijela. Ključni dijagnostički postupak je patohistološka analiza bioptata pluća ili bubrega gdje se imunofluoroscentnim metodama dokazuju linearni depoziti autoantitijela duž bazalne membrane.
Behcetova bolest je rijedak kronični oblik sistemskoga vaskulitisa karakteriziran trijasom: 1) uveitis, 2) ulceracije usne šupljine i genitalija te 3) simptomi i znakovi zahvaćenih drugih organa i tkiva. Plućno krvožilje je zahvaćeno kod 10 % bolesnika. Obično su zahvaćene srednje velike plućne arterije, a najprije se razvija vaskulitis vasa vasoruma koji dovodi do destrukcije elastičnih vlakana te se posljedično razvijaju aneurizme. Glavna klinička manifestacija je krvarenje koje može ići od blagih hemoptiza do hemoptoa opasnih po život. CT angiografija ili MRI pluća karakteristično pokazuju aneurizmatska proširenja plućnih arterija.
Dijagnoza. S obzirom na to da je plućna hemoragija najčešće očitovanje plućnih vaskulitisa, svaka hemoptiza ili hemoptoa treba pobuditi sumnju na ovu skupinu bolesti. Konačna dijagnoza se postavlja na temelju kliničkih pokazatelja, seroloških biljega te patohistološkoga nalaza. Potpuni dijagnostički postupak opisan je u sklopu difuzne alveolarne hemoragije, a ovdje je prikazana tablica najčešćih vaskulitisa i njihovih karakteristika (Tablica 2.17.).
|
Tablica 2.17. Glavna dijagnostička obilježja plućnih vaskulitisa
|
|
Plućni vaskulitis
|
Klinička obilježja
|
Serološka obilježja
|
Histopatološka obilježja
|
|
Granulomatozni poliangiitis
|
Granulomi dišnoga sustava
Sistemski vaskulitis
Fokalni glomerulonefritis
|
c-ANCA (85 - 95 %)
p-ANCA (10 - 15 %)
|
Nekrotizirajući vaskulitis
Granulomatozna upala
|
|
Eozinofilni granulomatozni poliangiitis
|
Bronhalna astma Hipereozinofilija
Sistemski vaskulitis
|
p-ANCA (35 - 75 %)
c-ANCA (5 - 10 %)
|
Nekrotizirajući vaskulitis
Granulomatozna upala
Eozinofilni infiltrati
|
|
Mikroskopski poliangiitis
|
Glomerulonefritis (95 %)
Plućna hemoragija (50 %)
Ostali znaci vaskulitisa
|
p-ANCA (50 - 75 %)
c-ANCA (10 - 15 %)
|
Nekrotizirajući vaskulitis
Mješoviti upalni infiltrat
Nema stvaranja granuloma
|
|
Izolirani pauci-imuni plućni vaskulitis
|
Plućna hemoragija bez znakova zahvaćenosti drugih organa i tkiva
|
ANCA negativan
Anti-GBM negativan
|
Nespecifični plućni kapilaritis
|
|
Goodpastureov sindrom
|
Plućna hemoragija
Glomerulonefritis
Povezanost s pušenjem
|
Anti-GBM (95 %)
|
Imunofluorescentni dokaz depozita protutijela duž bazalne membrane
|
Terapija. S obzirom na sličan imunološki patogenetski mehanizam, liječenje plućnih vaskulitisa je u načelu jednako. Glavni ciljevi liječenja su postizanje kontrole i remisije bolesti i održavanje remisije uz smanjenje komplikacija vezanih uz samu terapiju. Liječenje se može podijeliti u dvije faze: inicijalna faza kojom se postiže remisija te faza održavanja kojom se postignuta remisija nastoji održati što dulje. Inicijalna faza liječenja traje obično tri do šest mjeseci, dok faza održavanja traje 18 do 24 mjeseca. Detaljnije je o liječenju pojedinih entiteta pisano u odgovarajućim dijelovima udžbenika.
Inicijalna faza liječenja. Početak i način liječenja plućnih vaskulitisa ponajprije ovisi o težini bolesti. Europska grupa za vaskulitise (EUVAS, engl. European vasculitis study group) ovisno o težini, bolesti dijeli u pet kategorija: 1) ograničena bolest, 2) rana generalizirana bolest, 3) aktivna generalizirana bolest, 4) teška bolest i 5) refraktorna bolest.
Ograničena bolest podrazumijeva grupu bolesnika sa simptomima vezanim uz dišni sustav, ali koji ne pokazuju znakove zahvaćenosti drugih organa (bubrežna funkcija je očuvana) i nemaju općih simptoma. Kod ovih bolesnika liječenje uključuje monoterapiju nekim od navedenih lijekova: glukokortikoidi, azatioprin ili metotreksat.
Rana generalizirana bolest podrazumijeva grupu bolesnika koji imaju lokalne simptome dišnoga sustava te opće simptome, ali ne pokazuju znakove zahvaćenosti drugih organa (bubrežna funkcija je očuvana). Kod ovih bolesnika liječenje treba započeti dvojnom terapijom koja najčešće uključuje ciklofosfamid i glukokortikoid. U obzir dolazi i primjena metotreksata umjesto ciklofosfamida, iako se kod razvijene slike DAH-a ne preporuča njegova primjena.
Aktivna generalizirana bolest podrazumijeva bolesnike s razvijenim lokalnim simptomima dišnoga sustava, općim simptomima, kao i znakovima zahvaćenosti drugih organa (narušena bubrežna funkcija, ali kreatinin je niži od 500 µmol/L). Početno liječenje ovih bolesnika također se temelji na dvojnoj terapiji ciklofosfamid plus glukokortikoid. Sadašnje studije ukazuju na to da pulsna intravenska terapija ciklofosfamida ima jednaku učinkovitost kao i peroralna uz manju učestalost nuspojava, iako to još nije u potpunosti dokazano.
Teška bolest podrazumijeva pojavu teških kliničkih manifestacija kao što je teško bubrežno oštećenje (kreatinin veći od 500 µmol/L), difuzna alveolarna hemoragija ili neko drugo životno ugrožavajuće stanje. U inicijalnoj terapiji ovih bolesnika uz primjenu ciklofosfamida i glukokortikoida preporuča se i primjena plazmafereze (svakodnevna primjena kroz 10 do 14 dana). U slučaju teške difuzne alveolarne hemoragije treba primjenjivati i prethodno opisane mjere liječenja.
Refraktorna bolest podrazumijeva grupu bolesnika koji ne reagiraju na citotoksične lijekove (ciklofosfamid, azatioprin), visoke doze kortikosteroida i plazmaferezu. Kod ovih bolesnika može se pokušati s primjenom humanoga imunoglobulina ili primjenom biološke terapije (rituksimab, infliksimab).
Liječenje glukortikoidima obuhvaća inicijalno visoke intravenske doze metilprednizolona (1000 mg/dan kroz tri do pet dana), a zatim se nastavlja s prednizonom 1 mg/kg/dan (maksimalno 80 mg) peroralno te se postupno snamnjuje i ukida kroz četiri do šest mjeseci. Ciklofosfamid se tradicionalno primjenjuje peroralno u dozi od 2 mg/kg/dan (prilagodba doze je potrebna kod starijih osoba i osoba s bubrežnim zatajenjem). Najčešće nuspojave ciklofosfamida su leukopenija i neutropenija kao posljedica mijelosupresije, oportunističke infekcije, te hemoragijski cistitis, karcinom mokraćnoga mjehura, infertilnost i hematološki maligniteti.
Faza održavanja. Cilj ove faze je sprečavanje relapsa bolesti nakon inicijalne faze liječenja. Danas su dva najčešće korištena lijeka u tu svrhu azatioprin u dozi od 2mg/kg/dan ili metotreksat u dozi 25 mg/tjedno kroz 18 mjeseci. Mikofenolat mofetil je inferiorniji u odnosu na ova dva lijeka i koristi se kao druga linija kod bolesnika kod kojih je kontraindicirana primjena azatioprina ili metotreksata ili nemaju odgovor na njihovu primjenu. Provode se i studije koje ispituju učinak intermitentne primjene rituksimaba u terapiji održavanja.
Ostale napomene. Kod bolesnika koji primaju visoke doze glukokortikoida i ostale citotoksične lijekove preporuča se profilaktička primjena sulfametoksazol/trimetoprima kao prevencije pneumocistitis pneumonije. Također, kod dugotrajne primjene kortikosteroida potrebna je profilaksa osteoporoze i češća kontrola glikemije. Bolesnicima koji su na terapiji metotreksatom potreban je dodatak folne kiseline.
Prognoza. Bez liječenja, plućni vaskulitisi imaju visoku stopu mortaliteta koja se kreće do 75 %. Primjenom imunosupresivnih lijekova koji su danas na raspolaganju remisija se postiže kod većine bolesnika te je petogodišnji mortalitet manji od 10 %. Unatoč svim mjerama liječenja, ukupno gledano, životni vijek ovih bolesnika kraći je u odnosu na opću populaciju.
IDIOPATSKA PLUĆNA HEMOSIDEROZA
Definicija. Idiopatska plućna hemosideroza (IPH) je rijedak poremećaj nepoznate etiologije kojega karakterizira rekurentna difuzna alveolarna hemoragija. Bolest se češće susreće u dječjoj i adolescentnoj dobi, a kod odraslih je iznimno rijetka.
Etiopatogeneza. Etiologija bolesti je nepoznata. Glavni patofiziološki događaj je rekurentno intraalveolarno krvarenje te posljedična akumulacija željeza iz hemosiderina unutar alveolarnih makrofaga. Aktivirani makrofagi i ponavljana krvarenja mogu dovesti do intersticijske fibroze. Glavni histološki nalaz je stanjivanje endotela i bazalne membrane plućnih kapilara bez depozita.
Klinička slika. Simptomi i znakovi javljaju se epizodično. Glavna obilježja su dispneja, kašalj i krvarenje iz pluća što se može očitovati od slabih hemoptiza do obilnih, po život opasnih hemoptoa. Kod slabije izraženoga krvarenja hemoptize mogu i izostati, dok sputum postaje smećkaste boje zbog prisutnosti hemosiderina. Posljedično razvoju anemije javljaju se umor, malaksalost, palpitacije i drugi simptomi. Kod nekih bolesnika prisutni su i drugi opći simptomi. Bolest je progresivnoga tijeka.
Dijagnoza IPH uglavnom se postavlja isključivanjem ostalih uzroka difuzne alveolarne hemoragije (dijagnostički postupak je prethodno opisan). U laboratorijskim nalazima nalazimo hipokromnu i mikocitnu anemiju uz znakove sideropenije, a često su povišeni IgA i ruma faktor (RF). Na radiološkim snimkama pluća početno se nalazi alveolarni uzorak, a s napredovanjem bolesti javljaju se i znaci intersticijske fibroze. S napredovanjem bolesti razvija se i fibroza što će se prezentirati sniženim difuzijskim kapacitetom (snižen DLCO). Bronhoskopija igra ulogu u isključenju drugih uzroka krvarenja. Konačna se dijagnoza postavlja patohistološkim pregledom bioptata pluća (oštećenje plućnih kapilara uz izostanak drugih obilježja specifičnih za vaskulitise uz određeni stupanj fibroze).
Liječenje. S obzirom na nepoznat uzrok, liječenje IPH-a je ograničeno. Terapijski pristup ovim bolesnicima praktički je jednak kao i kod ostalih plućnih vaskulitisa (ciklofosfamid, glukortikoidi, plazmafereza). Potrebna je i korekcija anemije. Prognoza je načelno loša.
OSTALA STANJA POVEZANA S DAH-om I PLUĆNIM VASKULITISOM
Primarni antifosfolipidni sindrom. DAH se u sklopu antifosfolipidnoga sindroma javlja rijetko. Patogenetski mehanizam podrazumijeva vezanje antifosfolipidnih protutijela na endotelne stanice plućnih kapilara što dovodi do njihove aktivacije, pojačane ekspresije adhezivnih molekula, kemotaksije neutrofila te posljedičnoga oštećenja praćenoga ekstravazacijom eritrocita u alveolarni prostor. Dijagnoza se postavlja isključenjem drugih uzroka DAH-a, anamnestičkih podataka koji idu u prilog antifosfolipidnom sindromu te nalazu antifosfolipidnih antitijela u serumu. Liječenje uključuje primjenu visokih doza glukokortikoida u kombinaciji s ciklofosfamidom ili azatioprinom te primjenu humanoga imunoglobulina G s ili bez plazmafereze. Terapija se često komplicira razvojem tromboembolijskih incidenata.
Transplantacija hematopoetskih matičnih stanica. DAH može se javiti i kao posljedica alogene ili autologne transplantacije matičnih hematopoetskih stanica. Učestalost je mala (manje od 2 %), ali je praćena visokom stopom mortaliteta (više od 50 %). Točan patogenetski mehanizam nije poznat, ali se smatra da se radi o imunološki posredovanom poremećaju. Klinički se DAH očituje vrlo brzo nakon transplantacije, a pojava nakon više od 30 dana povezana je s lošijom prognozom. Dijagnoza se postavlja na osnovi anamnestičkih podataka, kliničke manifestacije (hemoptize, kašalj, dispneja), radiološke i bronhoskopske obrade. Liječenje počiva na potpornim mjerama i visokim dozama kortikosteroida.
PLUĆNI EOZINOFILNI SINDROMI
Definicija. Plućni eozinofilni sindromi (plućne eozinofilije, plućni infiltrati s eozinofilijom) heterogena su skupina bolesti koje karakterizira infiltracija plućnoga parenhima i/ili dišnih puteva eozinofilima s ili bez eozinofilije u perifernoj krvi.
Etiološka podjela. Plućne eozinofilne sindrome ovisno o etiologiji dijelimo u dvije skupine: primarni (nepoznata etiologija) i sekundarni (poznata etiologija).
Primarni ili idiopatski plućni eozinofilni sindromi nepoznate su etiologije, a toj skupini pripadaju akutna eozinofilna pneumonija, kronična eozinofilna pneumonija, hipereozinofilni sindrom te ranije opisivan Churg-Straussov sindrom (eozinofilna granulomatoza s poliangiitisom).
Sekundarni ili ekstrizični plućni eozinofilni sindromi poznate su etiologije, a uzrokovani su različitim vanjskim čimbenicima. U tu skupinu pripadaju alergijska bronhopulmonalna aspergiloza te plućne eozinofilije koje se javljaju kao posljedica infestacije parazitima (Lofflerov sindrom), unosa lijekova ili kao posljedica zračenja i malignih oboljenja.
Umjereno povećan broj eozinofila u bronhoalveolarnom lavatu može se naći i uslijed nekih drugih bolesti i stanja, ali se oni ne ubrajaju među plućne eozinofilne sindrome (hipersenzitivni pneumonitis, histicitoza Langerhansovih stanica, sarkoidoza, idiopatske intersticijske pneumonije).
Fiziologija i patofiziologija eozinofila. Eozinofili su krvne stanice koje imaju ključnu ulogu u alergijskim reakcijama. Nastaju u koštanoj srži iz matične hematopoetske stanice u procesu koji se naziva eozinofilopoeza. Glavni poticaj za stvaranje eozinofila daje interleukin 5 (IL-5) kojega luče TH-2 limfociti, a utjecaj ima i interleukin 3 (IL-3) te stimulirajući faktor rasta granulocita i makrofaga (GM-CSF). Posljedično povećanoj produkciji eozinofila razvija se eozinofilija (> 500/mm3) i/ili tkivna eozinofilna infiltracija. Eozinofilija u perifernoj krvi može biti prolazna, periodična ili trajna. Razlikujemo blagu eozinofiliju ( 500 - 1500/mm3), značajnu eozinofilija (> 1500/mm3) te izrazitu eozinofiliju (> 5000/mm3). Dugotrajna ili kronična eozinofilija u perifernoj krvi često uzrokuje tkivnu eozinofiliju s potencijalnim oštećenjem organa. Aktivirani eozinofili imaju sposobnost stvaranja i otpuštanja proupalnih citokina, slobodnih kisikovih radikala i kationskih proteina (glavni bazični protein, eozinofilni kationski protein) koji imaju glavnu ulogu u oštećenju tkiva. Također, eozinofili imaju sposobnost lučenja leukotrijena i trombocitnoga aktivirajućeg faktora koji mogu uzrokovati kontrakciju glatke muskulature (bronhospazam).
AKUTNA EOZINOFILNA PNEUMONIJA
Definicija. Akutna eozinofilna pneumonija (AEP) je plućna eozinofilija nepoznate etiologije koju klinički karakterizira nagao početak i brza progresija koja vodi prema akutnoj respiratornoj insuficijenciji.
Epidemiologija. Radi se o rijetkoj bolesti koja zahvaća osobe u dobi između drugoga i četvrtoga desteljeća života s većom učestalošću kod muškaraca u odnosu na žene. Dosadašnja iskustva govore da se uglavnom radi o pušačima i osobama koje nemaju astmu u osobnoj anamnezi.
Etiopatogeneza. Točan uzrok AEP-a nije poznat, ali se drži da se radi o akutnoj hipersenzitivnoj reakciji na neki inhalacijski antigen. S obzirom na to da se gotovo isključivo javlja kod pušača, smatra se da bi pušenje moglo biti pokretač cijele reakcije. Karakteristično se uglavnom radi o pušačima koji su tek počeli pušiti s kratkim pušačkim stažom. Kao mogući pokretač hipersenzitivne reakcije spominju se i neki drugi inhalacijski toksini, uglavnom vanjski zagađivači zraka. Oštećenje plućnoga parenhima posljedica je infiltracije i aktivacije eozinofila, a nastala oštećenja su reverzibilna i plućna funkcija se može u potpunosti oporaviti nakon početka liječenja.
Patologija. Glavni patohistološki nalaz uključuje obilan eozinofilni infiltrat u intersticiju, bez eksudata u alveolama, bez granuloma i perivaskularne infiltracije eozinofilima. Dodatno se mogu naći hijaline membrane i začepljeni mali bronhi.
Klinička slika. Bolest karakterizira nagao početak i brz razvoj simptoma, obično unutar mjesec dana. Bolesnici imaju izražene opće simptome (umor, vrućica, noćno preznojavanje, algični sindromi) uz progresiju dišnih simptoma (dispneja, kašalj, pleuralna bol). Pogoršanje se može razvijati vrlo brzo te bolesnici mogu razviti tešku akutnu respiratornu insuficijenciju.
Dijagnoza se postavlja na osnovi kliničke slike, anamnestičkih podataka, laboratorijskih nalaza, radiološke dijagnostike te bronhoskopije s bronhoalveolarnom lavažom i ponekad transbronhalnom biopsijom.
Anamneza. Bitan anamnestički podatak odnosi se na pušenje, osobito ako je bolesnik kraćega pušačkog staža. Također, karakteristično je da bolesnici nemaju astmu ili povezane tegobe.
Laboratorijski nalazi. Kod bolesnika nalazimo ubrzanu sedimentaciju eritrocita, povišeni C-reaktivni protein i povišeni IgE, ali su to nespecifični nalazi. Periferna eozinofilija može izostati, osobito u početnom dijelu bolesti, što je također karakteristično za AEP.
Radiološka dijagnostika. Na radiološkim snimkama pluća (konvencionalni rendgenogram, HRCT) opisuju se bilateralni difuzni infiltrati ili retikulinski uzorak bez intratorakalne limfadenopatije. Dvije trećine bolesnika ima i manje, obostrane pleuralne izljeve.
Testovi plućne funkcije. Spirometrija može biti uredna ili otkriva umjerene opstruktivne smetnje disanja, dok mjerenje difuzijskoga kapaciteta pluća za ugljični monoksid (DLCO) pokazuje smanjene vrijednosti.
Invazivna dijagnostika. Ključna pretraga u postavljanju dijagnoze AEP-a je bronhoalveolarna lavaža, a nalaz više od 25 % eozinofila u dobivenom uzorku ukazuje na plućnu eozinofiliju. Biopsija pluća izvodi se samo kod nejasnih bolesnika, a patohistološki nalaz ukazuje na difuzno alveolarno oštećenje te intersticijsku infiltraciju eozinofilima. Može se analizirati i pleuralni punktat koji ima karakteristično visok pH te se citološki može dokazati obilje eozinofila u njemu.
Dijagnostički kriteriji za AEP uključuju sljedeće: 1) akutna febrilna bolest udružena s respiratornim simptomima koja traje manje od mjesec dana; 2) razvijena hipoksemijska respiratorna insuficijencija; 3) radiološki nalaz difuznih alveolarnih ili alveo-intersticijskih infiltrata; 4) prisutnost više od 25 % eozinofila u bronhoalveolarnom lavatu i/ili karakterističan patohistološki nalaz; 5) odsustvo gljivične ili parazitarne infekcije; 6) odsutnost utjecaja lijekova povezanih s plućnom eozinofilijom; 7) brz i potpun oporavak uz terapiju kortikosteroidima i 8) izostanak recidiva nakon prekida liječenja kortikosteroidima.
Liječenje se sastoji od provođenja potpornih mjera respiratorne funkcije (oksigenoterapija, mehanička ventilacija) te primjene kortikosteroida. Početno liječenje uglavnom uključuje više doze metilprednizolona (80 - 125 mg 3 - 4 puta na dan), a po stabilizaciji se doza postupno snižava te se nastavlja s peroralnim prednizonom u dozi od 40 do 60 mg kroz osam do deset tjedana.
Prognoza bolesti je izvrsna. Gotovo kod svih bolesnika vrlo brzo po uvođenju kortikosteroidne terapije dolazi do kliničkoga i radiološkog oporavka, a nastala oštećenja pluća su reverzibilna.
KRONIČNA EOZINOFILNA PNEUMONIJA
Definicija. Kronična eozinofilna pneumonija (KEP) plućna je eozinofilija nepoznata uzroka, a karakterizira ju eozinofilna infiltracija plućnoga parenhima praćena kroničnim, indolentnim kliničkim tijekom.
Epidemiologija. Kao i ostale plućne eozinofilije, KEP je rijetka bolest u općoj populaciji i obično pogađa osobe u kasnijoj srednjoj životnoj dobi (prosjek pojavnosti je 45 godina) s nešto većom učestalošću kod žena. Obično se javlja kod nepušača, a više od 50 % oboljelih ima astmu ili druge atopijske bolesti.
Etiopatogeneza. Točan uzrok i mehanizam eozinofilne infiltracije plućnoga parenhima je nepoznat. Oštećenja koja nastaju posljedica su aktivacije eozinofila praćene lučenjem brojnih proupalnih citokina i proteaza. Progresija bolesti prema fibrozi je moguća, ali rijetka kada se pravilno liječi.
Patologija. Patohistološki nalaz uključuje konsolidaciju plućnoga parenhima u kojemu nalazimo alveole ispunjene eksudatom uz obilje eozinofila unutar alveola i intersticija, a mogu se naći i nekazeozni granulomi te perivaskularni eozinofilni infiltrati bez nekroze stijenke krvnih žila.
Klinička slika. Klinički tijek KEP-a je sporoprogresivan te se klinička slika može razvijati mjesecima. Glavni respiratorni simptomi su kašalj, progresivna dispneja, pleuralna bol te rijetko hemoptize. Većina bolesnika ima opće simptome koji uključuju subfebrilne temperature, umor, gubitak teka i gubitak na težini, noćna preznojavanja i sl.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, laboratorijskih nalaza, radiološke dijagnostike, testova plućne funkcije te invazivnih pretraga (bronhoalveolarna lavaža, biopsija).
Anamneza. Anamnestički podaci daju podatke o kliničkoj slici i kliničkom tijeku bolesti (indolentan) te o drugim korisnim podacima bitnim za dijagnozu (nepušači, pozitivna anamneza na atopijske bolesti).
Laboratorijski nalazi. Više od 90 % bolesnika ima perifernu eozinofiliju i kod većine bolesnika eozinofili čine više od 30 % ukupnih leukocita. Ostali, nespecifični nalazi uključuju ubrzanu sedimentaciju, povišeni C-reaktivni protein, umjerenu trombocitozu te povišeni IgE.
Radiološka dijagnostika. Karakteristični radiološki nalaz uključuje bilateralne, periferne ili subpleuralne infiltrate, obično u gornjim i srednjim plućnim poljima koji se često opisuju kao fotografski negativ plućnoga edema. Mogući dodatni nalazi su atelektaza, kavitacije, nodularni infiltrati, pleuralni izljevi te limfadenopatija. HRCT je puno osjetljiviji u dokazivanju ovih promjena od konvencionalnoga radiograma.
Testovi plućne funkcije. Spirometrija pokazuje najčešće kombinirane opstruktivno-restriktivne smetnje disanja uz sniženi difuzijski kapacitet (DLCO).
Invazivna dijagnostika. U uzroku bronhoalveolarnoga lavata nalazimo eozinofiliju, a zastupljenost eozinofila može biti i do 60 %. U nejasnim situacijama indicirana je biopsija pluća, a patohistološki nalaz je gore opisan.
Liječenje KEP-a temelji se na primjeni kortikosteroida. Početak liječenja uključuje peroralnu primjenu prednizona u dozi od 1 mg/kg/dan kroz jedan do dva tjedna nakon čega se doza postupno snižava kroz nekoliko mjeseci. S obzirom na čestu pojavu recidiva, kod nekih bolesnika se indicira primjena prednizona u dozi od 10 - 15 mg/dan kroz nekoliko godina. Neki autori zagovaraju inhalacijsku primjenu kortikosteroida u svrhu prevencije recidiva (flutikazon ili beklometazon u dozi od 500 do 700 mcg 2 x/dan).
Prognoza. Kao i kod AEP-a, odgovor na kortikosteroidnu terapiju je odličan te se vrlo brzo, kroz nekoliko dana, prati kliničko-radiološka regresija bolesti. Bolest za razliku od AEP-a prati visoka stopa recidiva stoga će neki bolesnici zahtijevati dugoročnu kortikosteroidnu profilaksu. Razvoj fibroze i kronične respiratorne insuficijencije je rijedak.
HIPEREOZINOFILNI SINDROM
Definicija i epidemiologija. Hipereozinofilni sindrom (HES) je kronična leukoproliferativna bolest koju obilježava prekomjerno stvaranje eozinofila u koštanoj srži s posljedičnom eozinofilijom te eozinofilnom infiltracijom različitih tkiva i organa. HES se obično javlja kod osoba srednje životne dobi, češće kod muškaraca. Pluća i drugi dišni organi zahvaćeni su kod 50 % bolesnika. Više o samoj bolesti pisano je u poglavlju o hematologiji.
Etiopatogeneza. HES je bolest nepoznate etiologije. Razlikuju se dvije varijante ovoga sindroma: mijeloproliferativna i limfocitna. Mijeloproliferativna varijanta podrazumijeva hematološku bolest koja pripada skupini leukemija i nastaje kao posljedica poremećaja na razini matične hematopoetske stanice i eozinofilopoeze. Limfocitna varijanta podrazumijeva nastanak eozinofilije kao posljedice proliferacije limfocita Th-2 koji luče IL-5, Il-3 i GM-CSF koji stimuliraju eozinofilopoezu, što je povezano s alergijskim oboljenjima. Karakteristično, kod mijeloproliferativne varijante tipično je zahvaćen miokard, dok kod limfocitne varijante dominira zahvaćenost pluća, probavnoga sustava i kože.
Klinička slika. S obzirom na to da se radi o sistemskoj bolesti, kliničke manifestacije ovise o opsegu i vrsti organa koji su zahvaćeni tim poremećajem. Svi bolesnici imaju izražene opće simptome kao što su subfebrilnost, umor, malaskalost, preznojavanje, mršavljenje i sl. Na zahvaćenost pluća upućuju klasični simptomi kao što su dispneja, kašalj, iskašljavanje te stezanje u prsima. Ostali organi koji mogu biti zahvaćeni su organi probavne cijevi, jetra, slezena, bubrezi, mozak i živci, zglobi i koža. Posebno je karakteristična infiltracija miokarda s posljedičnom restriktivnom kardiomiopatijom.
Dijagnoza se postavlja na temelju široke obrade, a glavni nalazi koji sugeriraju na HES su izražena leukocitoza i eozinofilija u diferencijalnoj krvnoj slici te punkcija koštane srži koja ukazuje na povećan broj prekursora zrelih eozinofila. Na plućnu zahvaćenost upućuju radiološki infiltrati često praćeni pleuralnim izljevima te nalaz povećanoga broja eozinofila u bronhoalveolarnom lavatu. Ostale pretrage ovise o zahvaćenim organima.
Diferencijalna dijagnoza. Kod postavljanja dijagnoze HES-a potrebno je sa sigurnošću isključiti druge moguće uzroke, ponajprije alergije, parazitarne i gljivične bolesti te druge hematološke bolesti.
Liječenje se temelji na kortikosteroidnoj terapiji (prednizon 1 mg/kg/dan), a u težim slučajevima mogu se davati i drugi, specifični lijekovi (hidroksiureja, ciklosporin, interferon). Anti-IL-5 agensi (mepolizumab) trenutno je u kliničkim ispitivanjima. Prognoza je načelno dobra ako nije zahvaćen miokard.
ALERGIJSKA BRONHOPULMONALNA ASPERGILOZA
Definicija. Alergijska bronhopulmonalna aspergiloza (ABPA) ubraja se u skupinu plućnih eozinofilnih sindroma, a razvija se kao posljedica kolonizacije dišnih puteva gljivicom Aspergillus spec., tj. imunološke reakcije organizma na njezine antigene.
Epidemiologija. Karakteristično se bolest gotovo isključivo javlja kod bolesnika s postojećom astmom ili rjeđe, cističnom fibrozom. 25 % bolesnika s bronhalnom astmom ima pozitivan kožni test na Aspergillus, a samo manje od 5 % tih bolesnika zadovoljava kriterije za ABPA-u. Razlog zašto se ABPA razvija samo kod nekih astmatičara i bolesnika s cističnom fibrozom nije poznat.
Etiopatogeneza. Gljivica Aspergillus spec. nalazi se kao ubikvitaran organizam u tlu u obliku spora. Kada se spore inhaliraju u dišne puteve dolazi do njihove transformacije u hife. Većina alergena hifa zapravo su proteolitički enzimi koji dovode do oštećenja epitela i omogućavaju njihovu ekspoziciju limfatičnom tkivu što dovodi do imunološkoga odgovora u smislu aktivacije Th-2 limfocita s posljedičnom pojačanom produkcijom specifičnih IgE i IgG protutijela te kemotaksijom i aktivacijom eozinofila. Navedene reakcije dovode do oštećenja tkiva, a IgE posredovana degranulacija mastocita te aktivirani eozinofili dovode do patofizioloških mehanizama tipičnih za alergijsku astmu. Pojačana bronhosekrecija zajedno s hifama aspergilusa pogoduje stvaranju mukoznih čepova koji mogu dovesti do bronhoopstrukcije i pogoduju nastanku proksimalnih bronhiektazija. Oštećenja plućnoga tkiva mogu voditi prema razvoju fibroze i respiratorne insuficijencije. Bitno je naglasiti da u ABPA gljivica Aspergillus stvara samo kolonizaciju dišnih puteva i ne dovodi do invazije u tkiva (za razliku od ostalih kliničkih oblika plućne aspergiloze).
Klinička slika. Kliničke manifestacije ABPA-e uključuju egzacerbaciju ranijih simptoma bronhalne astme uz karakteristično iskašljavanje prljavo-zelenkastoga i smećkastoga sadržaja ponekad u hemoptizi. Kod težih bolesnika zamjećuju se i opći simptomi poput vrućice, umora i malaksalosti, gubitka teka i gubitka na tjelesnoj težini. Fizikalni nalaz ovih bolesnika istovjetan je kao kod astme. Bolest prate česti recidivi, uz mogućnost razvija kronične respiratorne insuficijencije kao posljedice fibroze.
Klinički stadiji. ABPA prolazi kroz pet kliničkih stadija: prvi ili akutni stadij (postoje svi dijagnostički kriteriji za ABPA); drugi stadij ili remisija bolesti (povlačenje svih simptoma na dulje od šest mjeseci); treći stadij ili recidiv bolesti (povrat jednoga ili više dijagnostičkih kriterija); četvrti stadij ili refraktorna bolest (ovisnost o kortikosteroidima ili bez odgovora na njih) te peti stadij ili stadij fibroze (prisutna difuzna fibroza i bronhiektazije).
Dijagnoza se postavlja na osnovi anamnestičkih podataka (pogoršanje postojećih simptoma), laboratorijskih pretraga, radiološke dijagnostike te specifičnih testova za dokazivanje gljivične kolonizacije (kultura sputuma, intradermalni test, precipitirajuća antitijela). Na ABPA-u treba posumnjati kod svih bolesnika s pogoršanjem postojećih simptoma bronhalne astme, perifernom eozinofilijom te postojanjem radioloških plućnih infiltrata.
Laboratorijski nalazi. Klasični laboratorijski nalazi kod ABPA-e uključuju perifernu eozinofiliju te povišen ukupni IgE (> 1000 ng/ml) i povišen specifični IgE i IgG na Aspergillus.
Radiološka dijagnostika. Konvencionalni rendgenogram pluća pokazuje stacionarne ili migrirajuće infiltrate, prstolike sjene mukoznih čepova te edem bronhalne stijenke. HRCT daje bolji uvid u morfološke promjene te je koristan u detekciji proksimalnih bronhiektazija koje su visoko specifične za ABPA-u.
Specifični testovi. Kod gotovo svih bolesnika nalazimo pozitivnu kulturu sputuma na Aspergillus. Intradermalni test specifičnim antigenom aspergilusa daje neposrednu burnu papuloznu ili vezikuloznu reakciju (ovaj test se može naći kod 25 % bolesnika s astmom, ali nemaju svi ABPA-u). Kod većine bolesnika u serumu se može naći specifično precipitirajuće antitijelo na Aspergillus. Biopsija pluća rijetko je potrebna.
Dijagnostički kriteriji za ABPA-u uključuju sljedeće: 1) pozitivna anamneza na astmu ili cističnu fibrozu; 2) povišena IgE i IgG antitijela na Aspergillus; 3) značajno povišen ukupni IgE; 4) nalaz proksimalnih bronhiektazija; 5) pozitivan intradermalni test na Aspergillus; 6) eozinofilija periferne krvi; 7) pozitivan serumski precipitirajući antigen na Aspergillus i 8) prolazni ili trajni radiološki plućni infiltrati.
Liječenje. Osnovu liječenja čini primjena kortikosteroida. Početno liječenje uključuje primjenu visokih doza prednizona (0.5 - 1 mg/kg/dan) kroz dva do četiri tjedna kada se, ako to dozvoljava kliničko stanje, počinje postupno snižavati primjenjivana doza (preporučeno 0,5 mg svaki drugi dan). Doziranje ponajprije ovisi o kliničkom stanju i razini specifičnih IgE protutijela (preporuča se određivati svaka tri mjeseca do remisije). U slučaju relapsa bolesti, kao i kod početnoga liječenja koje ne reagira na kortikosteroide, preporuča se primijeniti i antimikotik (itrakonazol, 3 x 200 mg prva tri dana te nastaviti 2 x 200 mg sljedećih šesnaest tjedana). Simptomatska primjena bronhodilatatora je opravdana.
LOFFLEROV SINDROM
Definicija. Lofflerov sindrom je plućna eozinofilija uzrokovana prolaskom larvi nekih helminta kroz pluća što je dio njihova životna ciklusa, a očituje se perifernom eozinofilijom, migrirajućim plućnim infiltratom s ili bez plućnih simptoma.
Etiopatogeneza. Najčešći uzročnici ovoga sindroma su Ascaris lumbricoides, Toxocara canis te Strongiloides sterocoralis. Oni u pluća dospijevaju krvlju, prelaze u alveole te putem dišnih puteva per continuitatem se kreću prema jednjaku i crijevima. Migracija larvi kroz pluća praćena je eozinofilnim upalnim odgovorom. Patološki proces je samoograničavajući i završava nakon prolaska larvi.
Klinička slika. Glavne kliničke značajke Lofflerovoga sindroma su suh podražajni kašalj, stezanje i nelagoda u prsima te subfebrilne temperature. Bolesnici mogu imati lagano izražen bronhospazam praćen piskanjem i wheezingom. Simptomi prolaze spontano nakon pet do deset dana.
Dijagnoza i liječenje. Dijagnoza se postavlja na temelju anamnestičkih podataka, laboratorijskih nalaza (periferna eozinofilija, povišeni ukupni i specifični IgE) te radiološkoga nalaza migrirajućih plućnih infiltrata. Infiltrati obično nestaju nakon tjedan do dva tjedna. Bolest se potvrđuje nalazom larvi u bronhalnom ili želučanom aspiratu. Za pozitivan nalaz jajašaca u stolici potreban je duži period pa to nema veći dijagnostički značaj u trenu postojanja respiratornih smetnji. Liječenje se provodi antihelminticima.
PLUĆNA EOZINOFILIJA IZAZVANA LIJEKOVIMA
Plućnu eozinofiliju može izazvati velik broj lijekova koji se primjenjuju u svakodnevnoj kliničkoj praksi, a očituje se kao akutna ili kronična eozinofilna pneumonija. Radi se o rijetkom stanju koje, kada se pojavi, predstavlja izazov za dijagnosticiranje. Kliničko očitovanje može se javiti odmah nakon početka uzimanja lijeka, ali i nakon dužega perioda uzimanja. Klasično se očituje općim i respiratornim simptomima, a često su udruženi i s urtikarijom i drugim oblicima kožnih osipa. Laboratorijski nalazi uključuju eozinofiliju, ubrzanu sedimentaciju eritrocita te povišeni IgE. Radiološki nalaz karakteriziraju difuzni periferni, subpleuralni infiltrati. U sputumu i bronhoalveolarnom lavatu je broj eozinofila povišen. Biopsija pluća rijetko je potrebna, a pokazuje obilnu eozinofilnu infiltraciju alveolarnih prostora i intersticija, bez granuloma i vaskulitisa. Katkada se vidi i blaga intersticijska fibroza. Liječenje se sastoji od ukidanja lijeka za koji se smatra da je odgovoran za takvo stanje, a u težim i nejasnim slučajevima primjenjuju se glukokortikoidi. Prognoza je dobra.
Lijekovi koji mogu dovesti do plućne eozinofilije su: antibiotici (ampicilin, cefotaksim, ciprofloksacin, etambutol, metronidazol, penicilini, tetraciklini, sulfonamidi), nesteroidni protuupalni lijekovi (diklofenak, acetilsalicilna kiselina, naproksen, ibuprofen, piroksikam), kemoterapeutici (metotreksat, belomicin), kao i mnogi drugi lijekovi.
PROFESIONALNE BOLESTI PLUĆA I BOLESTI PLUĆA UVJETOVANE OKOLIŠEM
U skupinu bolesti pluća uvjetovanih okolišem ubrajamo sve patološke promjene na plućima koje nastaju kao posljedica izlaganja (udisanja) štetnim čimbenicima iz okoliša, a kako je to često vezano uz radno mjesto, takve se bolesti često nazivaju i profesionalnim bolestima pluća. Oštećenje može nastati direktnim učinkom štetnih tvari na dišni sustav ili indirektno, izazivanjem upale ili reakcije preosjetljivosti.
U ovu skupinu bolesti ubrajamo profesionalnu astmu (najčešći oblik profesionalne bolesti pluća), bolesti i stanja koja nastaju uslijed udisanja biološki aktivnih prašina (bisinoza), organskih prašina (hipersenzitivni pneumonitis), anorganskih prašina (pneumokonioze) te ozljede pluća nastale utjecajem zračenja (radijacijske ozljede pluća).
PROFESIONALNA ASTMA
Definicija i epidemiologija. Profesionalna astma (PA) je opstruktivna plućna bolest karakterizirana upalom dišnih puteva, bronhalnom hiperreaktivnošću i varijabilnim smetnjama u protoku zraka kroz dišne puteve uzrokovana udisanjem štetnih čimbenika na radnom mjestu. U mnogim industrijski razvijenim zemljama zapadne Europe gdje je upotreba azbesta odavno zabranjena profesionalna astma je najčešća profesionalna bolest dišnoga sustava. Smatra se da od svih slučajeva astme 2 do 5 % čini profesionalna astma. Najveću učestalost PA-e nalazimo u tekstilnoj industriji (prerada pamuka), a zatim u drvnoj industriji i pekarstvu.
Etiopatogeneza. U etiopatogenezi PA-e glavnu ulogu ima kronična izloženost (inhalacija) štetnim čimbenicima, ali ne može se zanemariti niti utjecaj pušenja i atopije. Bez obzira na pokretač, patogenetski mehanizam astme je jedinstven.
Izloženost štetnim čimbenicima. Inhalirani štetni čimbenici mogu se ponašati kao alergeni ili hapteni. Alergeni su spojevi velike molekulske mase (peptidi, proteini, polisaharidi) te u organizmu mogu izravno pokrenuti alergijsko-anafilaktički tip reakcije posredovan IgE protutijelima. Hapteni su spojevi male molekulske mase (nemetali i soli metala: izocijanidi, nikal, krom, platina) koji se, da bi izazvali ovakav oblik reakcije, najprije moraju spojiti s nekom molekulom/proteinom u organizmu jer tek tada postaju alergogeni. Brzina razvoja i težina bolesti izravno je povezana s razinom i vremenskim trajanjem izloženosti osobe utjecaju ovih čimbenika. Nealergijski mehanizmi temelj su pojave iritativne astme.
Ostali čimbenici. Kao i kod klasične astme, pušenje povećava sklonost razvoju PA-e. Također, bolesnici s atopijom brže će razviti PA od osoba koji nemaju atopiju i kod njih je potreban puno dulji period i veća razina izloženosti da bi se razvila PA.
Klinička slika. Simptomi PA-e javljaju se tijekom nekoliko mjeseci ili godina nakon senzibilizacije na alergene s kojima bolesnik dolazi u dodir na radnom mjestu. Najčešći simptomi uključuju napadaje suhoga kašlja ili samo suhoga kašljucanja, osjećaj nedostatka zraka s ponekad čujnim disajnim fenomenom piskanja, osjećaj pritiska i stezanja u prsnom košu te noćno ili ranojutarnje buđenje zbog osjećaja nedostatka zraka ili suhoga kašlja. Jednoje od glavnih obilježja PA-e smanjenje ili potpun izostanak simptoma tijekom godišnjega odmora ili bolovanja, dok se nakon ponovne ekspozicije na radnom mjestu oni vraćaju te se pogoršavaju prema kraju radnoga tjedna. Ovisno o odgovoru organizma, tri su moguća vremenska intervala do pojave simptoma nakon ekspozicije (udisanja) specifičnoga astmogena na radnom mjestu. Prvi je rani odgovor koji se javlja unutar 30 minuta od ekspozicije, drugi odgovor je dvostruk i zbiva se najprije unutar prvih 30 minuta te ponovo nakon 4 do 8 sati nakon ekspozicije, a treći je izoliran kasni odgovor koji se javlja nakon četiri do osam sati bez ranijega upozoravajućega brzog odgovora. Zbog razvoja kasne alergijske reakcije, često se simptomi javljaju znatno kasnije od ekspozicije (npr. isti dan u večernjim ili noćnim satima) što ponekada otežava povezivanje simptoma s nastankom PA-e.
Dijagnoza. Dijagnostički postupci jednaki su kao i za klasičnu astmu. Specifičnosti u dijagnostici PA-e su dobro uzeta radna anamneza (bolesnici prije zaposlenja nisu imali simptome astme), mjerenje vršnoga ekspiracijskoga protoka (PEF) na radnom mjestu i kućnim uvjetima, usporedba dobivenih vrijednosti te po potrebi provođenje specifičnoga bronhoprovokacijskog testa. U dijagnostički postupak i evaluaciju ovih bolesnika uključuje se i specijalist medicine rada.
Liječenje i prognoza. Osnovni korak u liječenju je prekid izloženosti čimbeniku koji dovodi do PA-e, a to nekada može uključivati i prekvalifikaciju i promjenu radnoga mjesta. Ostala medikamentozna terapija jednaka je kao i za klasičnu astmu. Prognoza ovisi ponajprije o vremenu prestanka ekspoziciji, što je ekspozicija dulje trajala, manja je šansa za oporavak nakon prekida ekspozicije zbog razvijenih ireverzibilnih promjena na plućima. U svakom slučaju, prekid ekspozicije bitno smanjuje kliničke tegobe.
Prevencija. Ključ u sprečavanju PA-e je prevencija kroz izdavanje liječničke potvrde prilikom upisivanja u određene strukovne srednje škole te zaposlenja na rizična radna mjesta.
BISINOZA
Definicija. Bisinoza je naziv za sindrom sličan profesionalnoj astmi (engl. asthma-like syndome), povezan s udisanjem biološki aktivne prašine, što se najčešće susreće kod osoba izloženih udisanju sirovoga i neobrađenog pamuka, lana ili konoplje.
Etiopatogeneza. Točan patogenetski mehanizam ovoga poremećaja ostaje nerazjašnjen, a činjenica da se javlja samo kod osoba koje su u kontaktu sa sirovim i neobrađenim biljkama sugerira na njihovu kontaminaciju nekim specifičnim bakterijskim endotoksinima. Bolest se može javiti kod prve ekspozicije, ali najčešće se javlja nakon duljega razdoblja izloženosti.
Klinička slika. Osnovni simptomi i znakovi su pritisak u prsima i dispneja uz piskanje i sviranje pri disanju (posljedica bronhospazma). Tipično, simptomi su najizraženiji prvoga radnog dana nakon vikenda (ili duljega izbivanja s posla), a onda se postupno smanjuju prema kraju radnoga tjedna (stari naziv bolesti je „groznica ponedjeljka“). Ovaj tipičan obrazac pojave simptoma bitan je u razlikovanju bisinoze od PA-e.
Dijagnoza. Dijagnostički postupak jednak je kao i kod PA-e, s time da anamnestički podaci o radnom mjestu i ekspoziciji te tipičan obrazac pojave simptoma imaju glavnu diferencijalno-dijagnostičku ulogu.
Liječenje se temelji na izbjegavanju ekspozicije (nošenje maski ili promjena radnoga mjesta) te primjeni antihistaminika.
HIPERSENZITIVNI PNEUMONITIS
Definicija. Hipersenzitivni pneumonitis (HP) ili ekstrinzičan alergijski alveolitis predstavlja oštećenje pluća posredovano reakcijom preosjetljivosti na organske čestice koje su disanjem unesene u dišne puteve i alveole. Do danas je poznato više od 300 antigena koji imaju sposobnost izazivanja HP-a, a najčešći su navedeni u Tablici 2.18.
Epidemiologija. Radi se o rijetkoj skupini bolesti koje su uglavnom vezane za radno mjesto ili boravište. Najugroženiji su radnici u poljoprivrednoj, drvnoj i prehrambenoj industriji. Samo 5 - 10 % izloženih osoba razvije kliničku sliku. Prevalencija i incidencija HP-a varira te ovisi o intenzitetu izloženosti antigenu, sezoni, geografskim uvjetima (kišovitost, vlažnost, industrija određenoga područja) i genetskoj predispoziciji. Oko 80 - 90 % oboljelih su nepušači, a bolest se češće javlja kod muškaraca srednje životne dobi. U Hrvatskoj incidencija oboljelih osoba od HP-a iznosi oko 0.6/100, 000 stanovnika.
Etiopatogeneza. HP je uzrokovan inhalacijom aerosola finih organskih čestica: bakterija, spora različitih gljivica, ameba, proteina životinjskoga porijekla, mineralnoga ulja, lijekova ili različitih organskih kemijskih supstanci. Osnovi događaj u patogenezi je fagocitoza unesenoga antigena putem alveolarnih makrofaga koji djeluju kao antigen-prezentirajuće stanice i tako omogućavaju pokretanje reakcije preosjetljivosti. Oštećenje plućnoga parenhima nastaje kao posljedica reakcije preosjetljivosti tipa III (preosjetljivost prouzročena imuno-kompleksima) te tipa IV (preosjetljivost posredovana stanicama) – Slika 2.13. Otkriveno je da u nastanku bolesti važnost ima i genetska predispozicija (HLA-DRB1*1305; HLA-DQB1*0501).
Reakciju preosjetljivosti tipa III karakterizira stvaranje imunokompleksa (kompleks antigen-antitijelo) na mjestu odlaganja antigena (alveole) što rezultira aktivacijom sustava komplementa koji izaziva oštećenje plućnoga tkiva.
Reakciju tipa IV karakterizira senzibilizacija limfocita prilikom prvoga kontakta što se događa kao posljedica prezentacije antigena putem antigen-prezentirajućih stanica (alveolarni makrofagi) naivnim CD4+ limfocitima koji se pretvaraju u specifične Th-1 limfocite i ostaju u cirkulaciji. Prilikom drugoga kontakta s antigenom dolazi do promptne aktivacije već postojećih Th-1 limfocita što se očituje lučenjem brojnih medijatora, među kojima je najbitniji INF-γ koji je odgovoran za nastanak granuloma i fibroze.

Slika 2.13. Shematski prikaz patogeneze hipersenzitivnoga pneumonitisa
Patologija. Glavne patohistološke promjene uključuju zadebljanje alveolarne stijenke, obilan upalni infiltrat kojega čine poglavito limfociti te stvaranje nekazeoznih granuloma. Ako se ekspozicija nastavi, proces se širi i na intersticij uz mogućnost razvoja fibroze. Ako se ekspozicija prekine u ranijem stadiju, dolazi do potpune rezolucije plućne patologije.
Klinička slika. Osnovni simptomi HP-a su dispneja, kašalj, stezanje i nelagoda u prsima uz različit stupanj općih simptoma (umor, malaksalost, gubitak teka i sl.). Ovisno o kliničkom tijeku, razlikujemo tri oblika bolesti: akutni, subakutni i kronični.
Akutni klinički tijek karakterizira brz razvoj simptoma, u roku od četiri do šest sati nakon ekspozicije tvari na koju postoji razvijena preosjetljivost. Bolesnici imaju obično povišenu temperaturu i uglavnom se to tumači kao plućni infekt. Ako se prekine ekspozicija, klinički simptomi povlače se u roku 24 do 48 sati.
Kronični klinički tijek karakterizira stalna ekspozicija maloj koncentraciji antigena. Simptomi nisu jako izraženi, ali su stalno prisutni te imaju tendenciju progresije. Simptomi kao što su kašalj, dispneja, umor, gubitak na težini, anoreksija i slabost slabije su izraženi nego pri akutnom i subakutnom obliku bolesti, ali su stalno prisutni. Mogu se razvijati mjesecima i godinama te imaju tendenciju pogoršanja. Kod ove skupine bolesnika moguć je nastanak plućne fibroze i razvoj kronične respiratorne insuficijencije. Kronični oblik HP-a razvije se kod oko 5 % bolesnika.
Subakutni klinički tijek teško se razdvaja od akutnoga i kroničnog, a javlja se kod bolesnika koji su intermitentno eksponirani antigenu (farmerska pluća, golubovi, papige). Simptomi su srednje izraženi, a traju mjesecima nakon prekida ekspozicije. Mogući je i prelazak subakutnoga u kronični oblik HP-a.
Dijagnoza HP-a je teška, s obzirom na širok dijapazon bolesti koje ulaze u diferencijalnu dijagnozu te se obično postavlja metodom isključivanja. Osnovu dijagnoze čini dobro uzeta anamneza kojom se povezuje mogući antigen i bolest, na što može upućivati radno mjesto bolesnika (ali i podaci o prostoru stanovanja uključujući kontakt s domaćim životinjama, hobije i putovanja). Klasičan dijagnostički postupak uključuje radiološku dijagnostičku obradu, provođenje testova plućne funkcije te bronhoskopiju s bronhoalveolarnom lavažom i/ili transbronhalnom biopsijom pluća.
Radiološka dijagnostika. Konvencionalni rendgenogram pluća nije ni specifičan niti senzitivan za HP, a često kod akutnih i subakutnih kliničkih oblika može biti uredan, a kada se očituje, daje sliku difuznih retikulo-nodularnih opacifikacija. HRCT je osjetljivija radiološka metoda i predstavlja standard u obradi bolesnika s bilo kojom sumnjom na bolest intersticija. Najtipičniji nalaz HP-a na HRCT-u uključuje opsežne, neoštroograničene centrolobularne mikronodule, dok nekada mogu postojati samo opacifikacije nalik mliječnome staklu. Medijastinalna limfadenopatija je rijetka. U kasnijim fazama nalazimo promjene tipične za intersticijsku fibrozu.
Testovi plućne funkcije korisni su u procjeni težine bolesti i same funkcije pluća te nemaju veći dijagnostički značaj. Spirometrija početno može pokazivati kombinirane opstruktivno-restriktivne smetnje disanja, dok s odmakom dominira restriktivni poremećaj disanja. Smanjen je difuzijski kapacitet pluća (DLCO), a kasnije se može razviti i hipoksemija.
Bronhoalveolarna lavaža sastavni je dio dijagnostičke obrade i može ukazivati na limfocitozu s niskim CD4:CD8 omjerom (omjer manji od 1.0), što ukazuje na to da se radi o sarkoidozi. U akutnom je obliku u razdoblju između 48 do 72 sata tipičan rani neutrofilni alveolitis, a nakon 72 sata limfocitni. Kronični oblik pokazuje limfocitni ili neutrofilni alveolitis. Također se u uzroku može naći i povećan broj mastocita (> 1 %).
Nalaz precipitirajućih antitijela. Nalaz cirkulirajućih precipitirajućih antitijela u serumu (specifična antitijela na sumnjivi antigen) može ukazivati na dijagnozu, ali ona nisu niti specifična niti osjetljiva pa su praktički beskorisna. Ovaj postupak podrazumijeva najprije identifikaciju potencijalnoga antigena što zahtijeva aerobiološko i mikrobiološko ispitivanje radnoga mjesta u suradnji s specijalistima medicine rada koji obično provjeravaju poznate izvore mogućih antigena. U kliničkoj praksi ova metoda se ne primjenjuje.
Biopsija pluća indicirana je krajnjoj situaciji kada se ne može sa sigurnosti postaviti dijagnoza HP-a (transbronhalna biopsija pluća, TBBP). Glavni histološki nalaz uključuje limfocitni alveolitis s nekazeoznim granulomima te nalazom intersticijske fibroze u uznapredovalim fazama.
Dijagnostički kriteriji. Najvažniji dijagnostički kriteriji za postavljanje dijagnoze HP-a su: 1. poznata izloženost antigenu; 2. pozitivna precipitirajuća antitijela na određeni antigen; 3. karakteristični simptomi koji se javljaju četiri do osam sati nakon izloženosti; 4. pogoršanje simptoma nakon ponovne izloženosti; 5. auskultacijski nalaz krepitacija u inspiriju te 6. gubitak na tjelesnoj težini. Dijagnoza HP-a procjenjuje se kao definitivna, vjerojatna ili subklinička, ovisno o zastupljenosti pojedinih kriterija prema dijagnostičkom algoritmu.
Diferencijalna dijagnoza. Diferencijalno dijagnostički u akutnom obliku treba isključiti toksični sindrom nakon udisanja organske prašine, plućnu emboliju/infarkt, aspiracijski pneumonitis te difuzno alveolarno oštećenje (DAD). U subakutnom diferencijalno dijagnostički HP treba razlikovati od profesionalne astme, idiopatskih intersticijskih pneumonija povezanih s pušenjem (RB-ILD, DIP), mikobakterijske i gljivične infekcije, a u kroničnom od idiopatske plućne fibroze (IPF), nespecifične intersticijske pneumonije (NSIP), kronične sarkoidoze, plućnih manifestacija bolesti vezivnoga tkiva te pneumokonioza.
Liječenje. Osnovu liječenja čini prekid izloženosti čime se u nekim slučajevima akutnih i subakutnih oblika bolesti može postići potpuna remisija bolesti. Kod većine bolesnika indicirana je primjena kortikosteroida, i to prednizolona u početnoj dozi od 0.5 - 1 mg/kg/dan (najviše 60 mg/dan) kroz dva tjedna kod akutnoga i četiri tjedna kod subakutnoga i kroničnoga HP-a, nakon čega se doza smanjuje do doze održavanja od 10 mg/dan. Alternativno liječenje predstavljaju imunosupresivni lijekovi (azatioprin, ciklosporin, ciklofosfamid), niske doze makrolidnih antibiotika, monoklonalna antitijela (anti-CD20, rituximab) te u slučajevima razvoja plućne fibroze transplantacija pluća. Oboljelima je potrebna promjena radnoga mjesta, a u preventivne mjere ubrajamo redukciju mikroorganizma u okolini (sušenje sijena prije pohrane), nošenje kvalitetnih maski te odgovarajuću ventilaciju poljoprivrednih prostora.
|
Tablica 2.18. Primjeri hipersenzitivnih pneumonitisa
|
|
Klinički entitet
|
Antigen
|
Izvor antigena
|
|
Farmerska pluća
|
Termofilne aktinomicete
|
Pljesnivo sijeno i žito, silaža
|
|
Pluća berača gljiva
|
Termofilne aktinomicete
|
Pljesnivi kompost
|
|
Bolest orezivača drveta
|
Rhizopus spp., Mucor spp.
|
Kontaminirane grane hrasta i javora
|
|
Pluća perača sira
|
Penicillium casei
|
Pljesnivi oblog sira
|
|
Vinogradarska pluća
|
Botrytis cincrea
|
Trulo grožđe
|
|
Pluća uzgajivača duhana
|
Aspergillus spp.
|
Lišće i stabljike biljke duhana
|
PNEUMOKONIOZE
Definicija. Pneumokonioze podrazumijevaju plućne bolesti koje nastaju kao posljedica dugotrajnoga udisanja anorganskih čestica koje se talože u plućima te dovode do upalnoga odgovora i plućne fibroze. S obzirom na to da su ove bolesti najčešće povezane s radnim mjestom, ubrajaju se u kategoriju profesionalnih plućnih bolesti.
Etiologija i klasifikacija. Najčešće pneumokonioze u kliničkoj praksi su silikoza koja nastaje udisanjem čestica silicijevog-dioksida, azbestoza nastala udisanjem azbestnih čestica, berilioza koja nastaje udisanjem para ili prašina berilija te pneumokonioza ugljenokopača koja nastaje udisanjem čestica ugljene prašine.
Opća patogeneza. Pneumokonioza nastaje kao posljedica inhalacije anorganskih čestica, tj. reakcije imunološkoga sustava na njih. Jačina i brzina razvoja imunološke reakcije uvjetovana je karakteristikama samih čestica kao što su veličina (manje čestice lakše dospijevaju u distalne dišne puteve) i fibroaktivnost (silicij, azbest i berilij pokazuju znatno veću fibroaktivnost u odnosu na ugljenu prašinu), kao i koncentracijom i dužinom ekspozicije navedenim česticama. Znatan dio inhaliranih čestica odstranjen je klasičnim mehanizmima (kašalj, mukocilijarni aparat), tako da samo manji dio njih dospijeva u distalne dišne puteve. Tamo ih fagocitiraju alveolarni makrofagi koji se pri tome aktiviraju i luče brojne medijatore koji potiču upalu i stimuliraju fibroblastni rast (slobodni kisikovi radikali, proteaze, leukotrijen B4, interleukin 8, faktor tumorske nekroze α, γ interferon). Navedeni patološki proces rezultira restriktivnim smetnjama disanja, smanjenom difuzijom i razvojem kronične respiratorne insuficijencije. Karakteristično, kod bolesnika s razvijenim pneumokoniozama češće susrećemo reumatološka oboljenja, osobito reumatoidni artritis (Caplanov sindrom).
U daljnjem tekstu bit će prikazane najčešće pneumokonioze te njihove karakteristike: silikoza, azbestoza, berilioza te pneumokonioza ugljenokopača.
SILIKOZA
Definicija. Silikoza je najčešća pneumokonioza koja nastaje uslijed dugotrajne izloženosti, tj. udisanja silicijeva dioksida. On u prirodi dolazi u dva oblika: kristalni i amorfni, s time da kristalni ima daleko veću biološku aktivnost. Najčešći kristalni oblici silicijeva oksida su kvarc, kristobalit i tridimit.
Epidemiologija. Silikozi su najviše skloni radnici koji rade na bušenju i preradi kamena i pijeska (kamenolomi, klesarstvo) te radnici koji u svome poslu koriste abrazivna sredstva koja sadrže silicijev-dioksid (proizvodnja stakla, keramička industrija, ljevaonice).
Etiopatogeneza. Patološki proces započinje fagocitozom i aktivacijom alveolarnih makrofaga koji luče medijatore zaslužne za oštećenje plućnoga tkiva (kisikovi radikali, proteaze), kemotaksiju drugih upalnih stanica (limfociti, mastociti) koje dovode do granulomatozne upale te potiču pojačanu aktivnost fibroblasta i razvoj fibroze. Karakteristično, alveolarni makrofagi koji fagocitiraju silicijev-dioksid vrlo brzo se raspadaju i odumiru zbog čega se smanjuje njihov broj, a time i obrana organizma od mikroba te je kod ovih bolesnika pojačana učestalost infekcija tuberkuloznim i netuberkuloznim mikobakterijama, kao i gljivicama.
Patologija. Makromorfološki bolest karakteriziraju sićušni čvorići (granulomi), od bjelkastih do sivkastih, koji su obično lokalizirani u gornjim dijelovima pluća. S vremenom se čvorići mogu spajati u veće konglomerate i tvoriti ožiljke. Granulomi se stvaraju u medijastinalnim limfnim čvorovima s karakterističnim odlaganjem kalcija što daje sliku ljuske od jaja („eggshell“ kalcifikacije). S napredovanjem bolesti navedene promjene konfluiraju te zajedno s fibroznim tkivom tvore sliku klasične plućne fibroze. Histološki, čvoraste lezije karakterizira hijalizirani kolagen posložen u koncentrične krugove unutar kojih se primjenom polariziranoga mikroskopa mogu uočiti dvolomne (polarizirajuće) silicijeve čestice.
Klinička slika. Prosječno vrijeme ekspozicije do pojave simptoma bolesti iznosi 15 do 20 godina, a kod 10 % bolesnika to vrijeme može biti i znatno kraće (pet godina). Ovisno o kliničkom tijeku, razlikujemo nekoliko oblika bolesti: akutna silikoza, ubrzana silikoza te kronična silikoza.
Akutna silikoza je rjeđi oblik bolesti koji nastaje unutar pet godina ekspozicije, obično velikim količinama sitnih čestica silicijeva dioksida. Bolest počinje naglo, izraženim općim simptomima (vrućica, slabost, algični sindromi) uz dispneju, kašalj i stezanje u prsima. Praktički kod svih ovih bolesnika razvija se superinfekcija tipičnim ili atipičnim mikobakterijama.
Ubrzana silikoza je oblik bolesti koji se obično razvija unutar pet do deset godina ekspozicije silicijevom dioksidu. Opći i dišni simptomi su slabije izraženi, a karakteristična je za ovaj oblik bolesti povezanost s brojnim sistemskim bolestima (reumatoidni artritis, sistemska skleroza, sistemski lupus). Kod oko 25 % bolesnika nalazimo infekciju mikobakterijama.
Kronična silikoza je najčešći oblik silikoze koji se javlja nakon 15 i više godina ekspozicije silicijevom dioksidu. Karakteriziraju ga sporoprogresivni dišni simptomi (dispneja, kašalj) koji prelaze u kroničnu respiratornu insuficijenciju. I kod ovih bolesnika bilježi se sklonost infekcijama mikobakterijama, kao i veća učestalost karcinoma u odnosu na opću populaciju.
Dijagnoza se postavlja na osnovi anamneze, radiološke dijagnostičke obrade, laboratorijske obrade, testova plućne funkcije te patohistološke potvrde bolesti.
Radiološka dijagnostika uključuje konvencionalni radiogram pluća te HRCT koji je daleko osjetljiviji i specifičniji. Početni radiološki nalaz uključuje multiple male nodule koji su često udruženi s medijastinalnom limfadenopatijom što može oponašati sarkoidozu. S vremenom noduli konfluiraju te se razvija masivna plućna fibroza, osobito u gornjim dijelovima pluća s kompenzatornom hiperinflacijom u donjim dijelovima. Karakteristično, medijastinalna limfadenopatija pokazuje tzv. eggshell kalcifikacije.
Laboratorijska dijagnostika ima svoje mjesto u diferencijalnoj dijagnozi (enzim koji konvertira angiotenzin, reuma faktor, antinuklearna antitijela i drugi serološki biljezi). Mogu se naći nespecifični nalazi, kao što su anemija kronične bolesti, ubrzana sedimentacija i povišeni C-reaktivni protein.
Testovi plućne funkcije nemaju dijagnostički značaj, ali koriste se u praćenju bolesti. Spirometrijom se dokazuju restriktivne smetnje disanja, a difuzijski kapacitet pluća (DLCO) je snižen.
Bronhoskopija s transbronhalnom biopsijom je ključna za postavljanje konačne dijagnoze. Histološki nalaz uključuje područja intersticijske fibroze s granulomima u kojima se pod faznim mikroskopom mogu detektirati polarizacijski kristali silicijeva dioksida. S obzirom na čestu superinfekciju mikobakterijama, dijagnostiku treba provesti i u tom smjeru.
Liječenje. Specifično liječenje silikoze ne postoji. Kao osnovna mjera nameće se prekid ekspozicije, iako se najčešće ona klinički manifestira kada su bolesnici već u mirovini, s obzirom na to da se javlja nakon petnaest i više godine izloženosti. Pri akutnoj silikozi moguća je bronhoalveolarna lavaža koja dovodi do kratkotrajnoga simptomatskog poboljšanja. Može se pokušati i s primjenom kortikosteroida (preoralni prednizolon), a učinak ima kod akutne i ubrzane silikoze, slabije kod kronične. Treba provoditi kućnu oksigenoterapiju i plućnu rehabilitaciju, a kao metoda liječenje nameće se i transplantacija pluća za mlađe bolesnike bez značajnijih komorbiditeta. Ako bolesnici imaju potvrđenu infekciju miokobakterijama, onda je potrebno i nju liječiti prema opisanim načelima kao i kod drugih bolesnika.
Prognoza. Silikoza je kronična progresivna bolest koja završava teškom respiratornom insuficijencijom i smrtnim ishodom. Kod svih bolesnika koji su izloženi siliciju potrebni su redoviti sistematski liječnički pregledi, kao i provođenje mjera zaštite na radu.
AZBESTOZA I PRIDRUŽENE BOLESTI IZAZVANE AZBESTOM
Definicija. Azbestoza i pridružene bolesti izazvane azbestom nastaju kao posljedica dugotrajne izloženosti, odnosno dugotrajnoga udisanja azbesta (magnezij-aluminijev silikat). Kronična izloženost azbestu najčešće dovodi do plućne intersticijske fibroze (plućna azbestoza) i promjena na pleuri (pleuralni izljev, pleuralna zadebljanja te mezoteliom pleure), a može biti povezana i s češćom pojavnošću nekih drugih malignih oboljenja, kao što su karcinom pluća i larinksa.
Epidemiologija. Primarno su azbestu izloženi radnici koji su s njime u neposrednom kontaktu, na primjer, u brodogradnji i u građevinskoj industriji, dok je sekundarna izloženost moguća kod članova obitelji tih radnika, kao i kod osoba koje žive u neposrednoj blizini rudnika azbesta.
Etiopatogeneza. Razvoj bolesti jednak je kao i kod drugih pneumokonioza. Osnovni događaj je aktivacija alveolarnih makrofaga koji fagocitiraju azbestne čestice koji se potom aktiviraju i luče brojne medijatore koji dovode do razvija upale i fibroze. Zbog svojih bioloških karakteristika, čestice azbesta lako dospijevaju u cijela pluća te se tako razvija difuzna plućna fibroza.
Patologija. Azbestoza je obilježena difuznom intersticijskom fibrozom plućnoga parenhima u kojemu se mogu detektirati azbestne čestice (zlatno-smeđi, vretenasti ili zaobljeni štapići). Promjene karakterizira difuzna distribucija u oba plućna krila.
Klinička slika. Kliničke manifestacije obično se javljaju nakon dugotrajne ekspozicije azbestu (dvadeset i više godina). Simptomi i znakovi postupno se razvijaju i imaju progresivan karakter. Dominira dispneja, neproduktivan podražajni kašalj te stezanje i nelagoda u prsima. Postupno se razvija klasična slika plućne fibroze (hipoksemijska respiratorna insuficijencija, plućna hipertenzija, kronično plućno srce). Kod velikoga dijela bolesnika nakon prekida ekspozicije simptomi se smiruju, no u 10 do 15 % slučajeva i dalje progrediraju.
Dijagnoza. Dijagnostički postupak je klasičan kao i za ostale pneumokonioze. Temeljito uzeta anamneza je ključna u samom procesu dijagnoze. Početni radiološki nalaz uključuje deformiran retikulinski crtež s rijetkim mikronodularnim sjenama te često, promjenama na pleuri (izljev, plakovi). Kasnije se razvija klasična slika difuzne intersticijske fibroze. Testovi plućne funkcije koriste se u praćenju bolesnika, a uključuju restriktivne smetnje disanja i smanjen difuzijski kapacitet pluća. Konačna dijagnoza postavlja se na temelju bronhoskopije i transbronhalne biopsije pluća (klasični histološki nalaz intersticijske fibroze s nalazom azbestnih čestica). U bronhoalveolarnom lavatu mogu se naći azbestne čestice, iako se one mogu naći i kod osoba bez azbestoze.
Liječenje. Specifične terapije za azbestozu nema. Savjetuje se prekid ekspozicije te provođenje mjera plućne rehabilitacije. Kad se razvije fibroza, liječenje je simptomatsko (oksigenoterapija, liječenje kroničnoga plućnog srca i dr.). U obzir dolazi i transplantacija pluća.
Azbestoza pleure naziv je za skupinu bolesti i stanja koje se etiopatogenetski povezuju s izloženošću azbestu. To su stvaranje pleuralnih plakova i kalcifikacija, pleuralnih adhezija, pleuralnih izljeva te razvoj mezotelioma. Mezoteliom pleure posebno je opisan u dijelu o bolestima pleure. Ostale promjene su obično benigne naravi, uzrokuju oskudne simptome te se mogu javljati samostalno ili u sklopu već opisane plućne azbestoze. Dijagnoza počiva na anamnezi i radiološkoj obradi, a sve sumnjive lezije na pleuri treba bioptirati, a izljeve punktirati da se ne previdi maligno oboljenje. Liječenje je simptomatsko.
BERILIOZA
Definicija i epidemiologija. Berilioza je naziv za plućnu bolest koja nastaje kao posljedica izloženosti (udisanja) plinovima i česticama koji sadrže berilij. Beriliju su izloženi radnici u rudnicima berilija te radnici u avioindustriji i nuklearnoj industriji. Može se javiti u dva oblika, kao akutna i kronična berilioza.
Etiopatogeneza. Akutna berilioza je posljedica jake, obično kratkotrajne izloženosti visokoj koncentraciji berilija koja dovodi do nadražaja i nespecifičnoga akutnog pneumonitisa koji dovodi do difuznoga alveolarnog edema i pojačane eksudacije. Kronična berilioza je posljedica dugotrajne izloženosti manjim koncentracijama berilija. Specifično, etiopatogenetski proces se razlikuje od drugih pneumokonioza. U kroničnoj beriliozi promjene na plućima nastaju kao rezultat reakcije preosjetljivosti tipa IV, odnosno stanično-posredovanoga oštećenja. Pri tome se čestice berilija ponašaju kao hapteni te nakon vezanja za alveolarne proteine djeluju kao pravi antigeni na koje se stvara specifična reakcija koja rezultira formiranjem granuloma. Činjenica da se ova bolest razvija kod samo 2 do 5 % osoba izloženih beriliju sugerira i postojanje genetske predispozicije bolesti.
Klinička slika. Akutna berilioza je rijetka, a očituje se naglo nastalom dispnejom, kašljem i naglim razvojem akutne respiratorne insuficijencije koja može progredirati u akutni respiratorni distres sindrom. Kronična beriolioza ima indolentniji, ali progresivan tijek. Nastup simptoma se može javiti i trideset i više godina od izloženosti beriliju. U kliničkoj slici nalazimo opće simptome (subfebrilne temperature, mršavljenje, slabost) te progresivnu dispneju i kašalj uz nelagodu i stezanje u prsima. Postupno se razvija kronična respiratorna insuficijencija, iako neki bolesnici mogu imati ograničenu bolest bez progresije.
Dijagnoza se postavlja na temelju anamnestičkih podataka (profesionalna ekspozicija beriliju), radiološkoga nalaza (u akutnoj formi difuzni alveolarni infiltrati, u kroničnoj granulomatozne promjene često s medijastinalnom limfadenopatijom pa može nalikovati na sarkoidozu) te transbronhalne biopsije u kojoj nalazimo nekazeozne granulome. Presudan test u dijagnostici je test berilijske limfocitne proliferacije (BeLPT) – dokaz proliferacije specifičnih T-limfocita nakon izlaganju beriliju u in vitro uvjetima.
Liječenje. Liječenje akutne berilioze provodi se u jedinicama intenzivnoga liječenja, s obzirom na to da obično zahtijeva mjere asistirane ventilacije, a primjenjuju se i kortikosteroidi. Liječenje kronične berilioze indicirano je kod bolesnika s razvijenim simptomima, a uključuje primjenu kortikosteroida (prednizolon) ili u težim slučajevima kombinirana primjena metotreksata s prednizolonom. Kod nekih bolesnika s uznapredovalom bolesti u obzir dolazi i transplantacija pluća.
Prognoza. Akutna berilioza može imati fatalan završetak, ali uz dobre simptomatske mjere i prekid ekspozicije dobar dio bolesnika doživi oporavak. Neki oblici akutne berilioze mogu prijeći u kronični oblik. Kronična berilioza ima polagan tijek i samo trećina bolesnika završi s teškom respiratornom insuficijencijom.
PNEUMOKONIOZA UGLJENOKOPAČA
Definicija. Pneumokonioza ugljenokopača (PU) naziv je za promjene na plućima koje nastaju kod osoba izloženih dugotrajnom udisanju čestica ugljene prašine, a mogu se razviti u jedan od tri oblika: plućna antrakoza, jednostavna PU te komplicirana PU.
Etiopatogeneza. Patogeneza razvoja PU najvjerojatnije je ovisna o količini ugljene prašine kojima je osoba bila izložena, pa se tako i razlikuju tri oblika PU. Osnovna koncepcija razvoja bolesti istovjetna je drugim pneumokoniozama te stavlja alveolarne makrofage u središte događaja (fagocitoza, aktivacija, fibroza).
Plućna antrakoza je najjednostavniji i najbezazleniji oblik PU. Nastaje fagocitozom ugljene prašine od strane alveolarnih makrofaga koji se nakupljaju u plućnom tkivu duž limfnih puteva i ne izazivaju niti upalni odgovor niti fibrozu. Na obdukciji se mogu naći tamne linearne linije po plućnom parenhimu.
Jednostavna PU označava nakupljanje ugljene prašine u makrofagima, ali oni se aktiviraju i luče proupalne medijatore koji dovode do nastanka tzv. ugljenih čvorova koje čine makrofagi krcati ugljenom prašinom i kolagena vlakna koja ih povezuju.
Komplicirana PU ima sve značajke jednostavne PU iz koje proizlazi uz stimulaciju fibroblasta i nastanak plućne fibroze. U samo 1 - 3 % slučajeva jednostavna PU prelazi u komplicirani oblik.
Klinička slika. PU je dugo asimptomatska bolest. Početni simptomi uključuju dispneju pri naporu koja se pogoršava te kasnije može biti prisutna i u mirovanju, kronični kašalj s karakterističnim crnim iskašljajem (melanoptiza). Kod razvoja komplicirane PU prisutni su svi klinički znakovi kronične respiratorne insuficijencije, plućne hipertenzije i kroničnoga plućnog srca.
Dijagnoza se postavlja na temelju anamnestičkih podataka, radiološke dijagnostike (početno difuzno raspoređene nodularne sjene, a kasnije slika plućne fibroze), testova plućne funkcije kojima se prati bolest i ocjenjuje uznapredovalost (restriktivne smetnje disanja, smanjena difuzija) te transbronhalnom biopsijom pluća.
Liječenje i prognoza. Liječenje PU-e je nespecifično i uključuje prekid ekspozicije ili smanjenje ekspozicije (maske za nos i usta) te ostale simptomatske mjere (plućna rehabilitacija, oksigenoterapija, prevencija respiratornih infekcija). U obzir dolazi i transplantacija pluća. Prognoza ponajprije ovisi o stadiju bolesti.
RADIJACIJSKE OZLJEDE PLUĆA
Uvod. Radijacijske ozljede pluća podrazumijevaju sva oštećenja plućnoga parenhima koja nastaju djelovanjem rendgenskih zraka na pluća, a najčešće se radi o oštećenjima koja nastaju za vrijeme radioterapije malignih procesa torakalne regije. Opseg oštećenja ovisi o jakosti rendgenskih zraka, vremenu ekspozicije te veličini površine koja se ozračuje. Učestalost radijacijskih ozljeda pluća nakon radioterapije karcinoma dojke, pluća ili limfoma kreće se između 10 i 35 %. Radijacijska ozljeda pluća može imati dvije faze: akutna faza ili radijacijski pneumonitis i kronična faza ili postradijacijska fibroza.
Akutna faza (radijacijski pneumonitis). Akutni radijacijski pneumonitis najčešće se razvija unutar dva do tri mjeseca od provedene radioterapije, iako raspon može biti od jednoga do šest mjeseci. Mehanizam nastanka nije jasan, ali se vjeruje da se radi o imunološki posredovanom mehanizmu čemu u prilog ide i činjenica da bolest dobro reagira na primjenu kortikosteroida. Glavni histološki nalaz uključuje upalnu infiltraciju intersticija i alveola s dominantnim nalazom limfocita uz eksudaciju u alveolama. Klinički se bolest očituje postupnim razvijanjem dispneje, suhoga i podražajnoga kašlja te stezanjem u prsima. Kod nekih je bolesnika moguć i razvoj akutnoga respiratornog distres sindroma. Na dijagnozu treba pomišljati kod svih bolesnika s dišnim simptomima koji su prošli radioterapiju torakalne regije unutar posljednjih godinu dana. U laboratorijskim nalazima dominiraju leukocitoza i ubrzana sedimentacija eritrocita. Radiološki nalaz slabo korelira s kliničkom slikom i daje sliku alveolarnoga infiltrata u području pluća izloženoga zračenju. Testovi plućne funkcije ukazuju na restriktivne smetnje disanja i snižen difuzijski kapacitet pluća (DLCO). Liječenje se sastoji od primjene prednizona u dozi od 1 mg/kg/dan kroz tjedan dana, a potom s 20 - 40 mg/dan kroz dva do tri tjedna te potom postupno smanjivanje i isključivanje iz terapije.
Kronična faza (postradijacijska fibroza). Postradijacijska fibroza pluća može se razviti kod bolesnika koji su prošli radioterapijsko zračenje s ili bez prethodnoga radijacijskog pneumonitisa. Kliničko očitovanje ponajprije ovisi o veličini zračenoga područja. Fibroza koja dovodi do značajne respiratorne insuficijencije i kroničnoga plućnog srca rijetka je. Bolest se najčešće prezentira kao sporoprogresivna dispneja. Dijagnostički postupak je jednak kao i kod drugih oblika plućne fibroze, a najbitniji dijagnostički podatak je provedeno zračenje unutar posljednjih godinu dana te dokazan radiološki infiltrat u području zračene regije. Primjena kortikosteroida ne dovodi do poboljšanja. S obzirom na sporu progresiju, bolesnici uglavnom ni ne zahtijevaju specifično liječenje jer uglavnom umru od osnovne bolesti.
BOLESTI PLEURE I PLEURALNOGA PROSTORA
Među bolesti pleure i pleuralnoga prostora ubrajamo upalu pleure (pleuritis), pleuralni izljev, pneumotoraks, tumore pleure te ostale, rjeđe bolesti (fibroza, fistule).
UPALA PLEURE – PLEURITIS
Definicija i etiologija. Pleuritis je naziv za upalu pleure koja se može javiti kao primarna ili sekundarna bolest. Primarni pleuritis je rijedak i uglavnom je virusne etiologije (najčešći uzročnik je Coxackie B virus), a češće se javlja sekundarno u sklopu pneumonije (pleuropneumonija). Virusni pleuritis najčešće se javlja kod mlađih osoba tijekom ljetnih mjeseci. Pleuritis neinfektivne etiologije je rijedak (obično u sklopu autoimunih bolesti ili uremije). Pleuritis je često praćen stvaranjem pleuralnoga izljeva.
Klinička slika. Glavna klinička manifestacija je pleuralni bol (pleurodinija) koja je praćen manje ili više izraženim općim simptomima, ovisno o etiologiji te suhim, podražajnim kašljem. Pleuralni bol je dobro lokalizirani, oštar i probadajuć, a karakteristično se pogoršava s dubokim udahom i prilikom kašljanja. Ako je nadražena i dijafragma (pleuritis bazalnih dijelova), moguća je pojava bola u istostranom ramenu (nadražaj freničnoga živca).
Dijagnoza se postavlja na osnovi kliničke slike i kliničkoga nalaza (auskultacijski nalaz pleuralnoga trenja), laboratorijskih nalaza (kod virusnih upala obično nespecifični u vidu umjerene leukocitoze ili leukopenije s umjereno povišenim C-reaktivnim proteinom) te radiološkom snimkom pluća s ciljem isključenja postojanja pleuralnoga izljeva.
Liječenje je simptomatsko. Primjenjuju se analgetici i nesteroidni protuupalni lijekovi (indometacin 25 mg 3 x/dan). Kod izraženoga podražajnog kašlja koji pogoršava bol kratkotrajno se može primijeniti kodein (30 - 60 mg 3 - 4 x/dan). Prognoza je povoljna.
PLEURALNI IZLJEVI
Fiziologija. Fiziološki u pleuralnom prostoru uvijek nalazimo malu količinu tekućine (5 do 15 ml) koja olakšava međusobno klizanje dva lista pleure tijekom disanja. Ona nastaje kao rezultat ravnoteže između stvaranja tekućine u pleuralnom prostoru s jedne strane te limfne drenaže kojom se apsorbira stvorena tekućina s druge strane. Tri su načina nastanka tekućine u pleuralnom prostoru: 1) transudacija tekućine iz kapilara u parijetalnoj pleuri (0,01 ml/kg/h), 2) transudacija tekućine iz plućnoga intersticija preko visceralne pleure te 3) iz peritinealne šupljine kroz sitne otvore dijafragme. Na veličinu transudacije tekućine iz kapilara utječe hidrostatski tlak na arterijskom dijelu kapilarne mreže (tjera tekućinu iz kapilara) te koloidno-osmotski tlak na venskom dijelu kapilarne mreže (povlači tekućinu nazad u kapilare). Prema tome, povišenje hidrostatskoga tlaka ili pad koloidno-osmotskoga tlaka pogoduje pojačanom transudacijom tekućine u pleuralni prostor. Kapacitet limfne drenaže ima kapacitet da apsorbira dvadeset puta veću količinu tekućine nego što se ona normalno stvara.
Definicija. Pleuralni izljev definira se kao kliničko stanje koje karakterizira abnormalno nakupljanje tekućine u pleuralnom prostoru koje nastaje ili zbog pojačanoga stvaranja tekućine ili zbog otežane apsorpcije tekućine, što može dovesti do kompromitiranja funkcije disanja.
Etiopatogeneza. Pleuralni izljev može nastati na jedan od pet načina: 1) pojačana transudacija iz kapilara uslijed povećanoga hidrostatskog i/ili sniženoga koloidno-osmotskog tlaka; 2) pojačana transudacija iz kapilara uslijed povećane permeabilnosti stijenke kapilara; 3) smanjena limfna drenaža pleuralnoga prostora; 4) infekcija pleuralnoga prostora i 5) krvarenje uz pleuralni prostor.
Biokemijska podjela pleuralnoga izlijeva. Na osnovi biokemijskoga stava pleuralne tekućine, pleuralne izljeve dijelimo u dvije osnovne grupe: transudate i eksudate. To je klinički bitna podjela jer ukazuje na moguću etiologiju pleuralnoga izljeva kao je prikazano u Tablici 2.19.
Transudat je pleuralni izljev koji nastaje kao posljedica pojačane transudacije tekućine iz kapilara uslijed povišenoga hidrostatskog tlaka ili sniženoga koloidno-osmotskog tlaka plazme uz normalno očuvanu strukturu kapilara. Tako nastaje izljev koji je po svom sastavu sličan plazmi (filtrat plazme) uz značajno sniženu koncentraciju proteina. U kliničkoj su praksi najčešći uzroci ovakvoga izljeva srčano popuštanje (povećan hidrostatski tlak) te stanja povezana s hipoalbuminemijom, kao što su ciroza jetre i nefrotski sindrom (sniženi koloidno-osmotski tlak).
Eksudat je pleuralni izljev koji nastaje kao posljedica pojačane transudacije tekućine iz kapilara uslijed strukturnih poremećaja kapilara zbog lokalne upale i/ili nemogućnosti uklanjanja proteina limfom. Tako nastaje izljev koji je bogat proteinima, a najčešći uzroci ovoga izljeva u kliničkoj praksi su infekcije, tumori i autoimune bolesti.
|
Tablica 2.19. Diferencijalna dijagnoza pleuralnoga izljeva
|
|
Vrsta pleuralnoga izljeva
|
Diferencijalna dijagnoza
|
|
Transudat
|
Srčano popuštanje, ciroza jetre, nefrotski sindrom, peritonealna dijaliza, miksedem, opstrukcija gornje šuplje vene, plućna tromboembolija , akutna atelektaza
|
|
Eksudat
|
Pneumonija i ostale plućne infekcije (tuberkuloza, gljivične i parazitarne infekcije), maligna oboljenja (karcinom, limfom, mezoteliom, metastaze), bolesti vezivnoga tkiva
|
Razlikovanje transudata i eksudata. Diferenciranje transudata i eksudata moguće je nakon uzorkovanja izljeva pleuralnom punkcijom, a za analizu je dovoljno dvadesetak mililitara (Tablica 2.20.).
|
Tablica 2.20. Karakteristike pleuralnoga izljeva
|
|
Karakteristika izljeva
|
Transudat
|
Eksudat
|
|
Makroskopski izgled
|
Bistar, ružičasto-žut
|
Mutan, hemoragičan
|
|
Specifična gustoća
|
< 1,015
|
> 1,015
|
|
Koncentracija proteina (g/L)
|
< 2,5
|
> 2,5
|
|
Koncentracija LDH (UI)
|
< 200
|
> 200
|
|
Omjer koncentracije proteina izljev/serum
|
< 0,5
|
> 0,5
|
|
Omjer koncentracije LDH izljev/serum
|
< 0,6
|
> 0,6
|
Klinička slika. Manji pleuralni izljevi (manje od 500 mL) ne uzrokuju kliničke tegobe i teško ih je dokazati na temelju fizikalnoga pregleda bolesnika. U kliničkoj slici dominiraju simptomi i znakovi osnove bolesti, a sam pleuralni izljev dovodi do razvoja ili pogoršanja od ranije postojeće dispneje, kašlja i bola ili nelagode u prsima povezane s disanjem. Glavni nalazi kod kliničkoga pregleda bolesnika su nečujan šum disanja i perkutorna muklina iznad područja izljeva (kod pregleda bolesnika postaviti u sjedeći položaj). Kod velikih, obostranih izljeva vide se znakovi korištenja pomoćne respiratorne muskulature s ili bez cijanoze.
Dijagnoza se postavlja na osnovi kliničke slike, kliničkoga pregleda te slikovnih dijagnostičkih metoda (rendgenogram pluća, ultrazvuk pluća). Kod većine bolesnika indicirana je i pleuralna punkcija. Osim dijagnostike postojanja samoga izljeva, još bitnija je i dijagnostika etiologije izljeva.
Rendgenogram pluća osnovna je dijagnostička metoda pri sumnji na pleuralni izljev, a tom se metodom može detektirati kada u pleuralnom prostoru ima više od 250 ml tekućine (Slika 2.14.). Klasični nalaz uključuje zaobljene freniko-kostalne sinuse te pomak laterouzlazne granice prema medijalno. Kod jako velikih izljeva moguć je i pomak medijastinalnih struktura kontralateralno. Dodatni nalazi mogu ukazivati na etiologiju izljeva (kardiomegalija i redistribucija plućnoga krvotoka na srčanu dekompenzaciju, atelektaza na tumorsku patologiju i sl.).
Slika 2.14. Radiološki nalaz pleuralnoga izljeva desno
Ultrazvuk pluća danas je sve češća pretraga u otkrivanju pleuralnih izljeva. Direktnim interkostalnim pristupom (prikaz desnoga i lijevoga freniko-kostalnog sinusa s lateralnih strana trupa) može detektirati i minimalne količine izljeva. Tekućina se prikazuje anehogena zona u kojoj nalazimo obično flotirajuće kolabirano plućno krilo poput jezička. Dodatna prednost je mogućnost mjerenja veličine izljeva, uočavanje fibroznih septi (kod starijih izljeva) te određivanje (markacija) mjesta pluralne punkcije.
Pleuralna punkcija u dijagnostičke svrhe izvodi se onda kada se ne može sa sigurnošću odrediti etiologija izljeva. Opis postupka opisan je u poglavlju Invazivni postupci u pulmologiji. Dobiveni uzorak se pregleda makroskopski (izgled) te mikroskopski (biokemijska, mikrobiološka i citološka analiza). Osnovni parametri koji se gledaju pri biokemijskoj analizi su specifična gustoća te koncentracija proteina i laktat-dehidrogenaze, a može se proširiti i analiziranjem drugim parametrima (glukoza i sl.). Mikrobiološka analiza ključna je pri sumnji na infektivnu etiologiju, a uzimaju se dva odvojena uzorka, jedan za analizu na mikobakterije, a jedan na klasične bakterije. Citološka analiza omogućava dobivanje podataka o vrsti i dominaciji pojedinih stanica u izljevu (npr. nalaz malignih stanica).
Liječenje pleuralnoga izljeva zasniva se na liječenju osnovne bolesti. Terapijska pleuralna punkcija u obzir dolazi kod bolesnika kod kojih veličina izljeva dodatno ugrožava disanje i pogoršava dispneju. Postupak izvođenja opisan je u poglavlju Invazivni postupci u pulmologiji.
KLINIČKI OBLICI PLEURALNIH IZLJEVA
Pleuralni izljev u sklopu srčanoga popuštanja. Popuštanje lijevoga ventrikula je najčešći uzrok nastanka pleuralnoga izljeva tipa transudata. Nastaje kao posljedica porasta hidrostatskoga tlaka u plućnim kapilarama i posljedične transudacije tekućine kroz intersticij i visceralnu pleuru. Izljevi su obično bilateralni i jednaki veličinom (jednostrani su rijetki, a zahvaćaju desnu stranu). Dijagnoza se postavlja na osnovi kliničke slike i nalaza te rendgenograma ili ultrazvuka pluća. Dijagnostička pleuralna punkcija indicirana je samo u nejasnim slučajevima (jednostrani izljev, nejednakost u veličini, febrilno stanje, pleurodinija). Terapijska punkcija indicirana je samo kod bolesnika kod kojih diuretska terapija ne dovodi do simptomatskoga olakšanja.
Parapneumonični pleuralni izljev. Radi se o pleuralnom izljevu koji se javlja u sklopu plućnih infekcija, najčešće bakterijskih pneumonija, a može se javiti u dva oblika, kao komplicirani i nekomplicirani parapneumonični izljev, a međusobno ih razlikujemo na temelju biokemijske i mikrobiološke analize. Komplicirani parapneumonični izljev s obiljem leukocita i dedritusa nazivamo empijem pleure (gnojni izljev).
Nekomplicirani parapneumonični izljev ima sljedeće karakteristike: pH viši od 7,20, koncentraciju glukoze veću od 3,3 mmol/L (30 mg/dL), mikrobiološki je sterilan, a unutar izljeva ne nalazimo fibrovezivne niti i tekućina se slobodno kreće unutar pleuralnoga prostora. Liječenje se sastoji od primjene antibiotika nakon čega se vrlo brzo uočava regresija izljeva i bez pleuralne punkcije.
Komplicirani parapneumonični izljev ima sljedeće karakteristike: pH niži od 7,20, koncentracija glukoze je niža od 3,3 mmol/L (30 mg/dL), mikrobiološka kultura je pozitivna, a unutar izljeva nalazimo fibrovezivne niti koje septiraju izljev i zarobljavaju tekućinu u džepove, a kasnije formiraju adhezije koje otežavaju respiratorne kretnje pluća. Ovakvi izljevi teže reagiraju na antibiotsku terapiju, a ne mogu se ni u potpunosti evakuirati pleuralnom punkcijom te se kod njih indicira postavljanje torakalnoga drena. Kod opsežnoga septiranog izljeva i brojnih intrapleuralnih adhezija povezanih s otežanim disanjem u obzir dolazi aplikacija fibrinolitika i deoksiribonukleaze putem postavljenoga torakalnog drena (potpomažu razgradnju fibroznih niti), a u obzir dolazi i torakoskopija.
Maligni pleuralni izljev javlja se kao sekundarna pojava kod nekih malignih oboljenja, najčešće karcinoma pluća, dojke i limfoma te plućnih i pleuralnih metastaza. Posljedica je destrukcije krvnih žila i/ili opstrukcije limfne drenaže. Iako se najčešće radi o eksudatima, nekada maligni pleuralni izljev može imati karakteristike transudata. Pojava ove vrste izljeva označava i lošu prognozu. Dijagnoza se u 60 % slučajeva postavlja nalazom malignih stanica citološkim pregledom izljeva dobivenoga u prvoj punkciji, a u 80 % slučajeva analizom uzorka ponovljene punkcije. Ako se ne dokažu maligne stanice na temelju dvije pleuralne punkcije, a postoji visoka sumnja, u obzir dolazi transtorakalna punkcija zadebljane pleure pod kontrolom ultrazvuka ili biopsija pleure tijekom kirurške torakoskopije. Asimptomatske izljeve ne treba liječiti. Simptomatski izljevi zahtijevaju pleuralnu punkciju i evakuaciju sadržaja. Kod recidivnih izljeva u obzir dolazi pleurodeza ili postavljanje drenažnoga katetera kojega bolesnici mogu prazniti i u ambulantnim uvjetima.
Pleurodeza ili kronična drenaža označava postupak kod kojega se na kraju pleuralne punkcije u intrapleuralni prostor aplicira sklerozirajuće sredstvo koje će izazvati nespecifičan upalni podražaj listova pleure koji će dovesti do stvaranja adhezija i njihova sljepljivanja. Najčešća sredstva koja se koriste u tu svrhu su sterilni talk, doksiciklin i belomicin. Postupak je kontraindiciran kod karcinoma pluća centralne lokalizacije i atalektraze pluća, kod ipsilateralnoga pomaka medijastinuma i kod izostanka reekspanzije pluća nakon punkcije.
Tuberkulozni pleuralni izljev javlja se kod oko 30 % bolesnika s tuberkulozom pluća, a nastaje uslijed povećane propusnosti kapilara izazvane hipersenzitivnom reakcijom na mikobakterijske proteine. Glavne karakteristike izljeva su limfocitna dominacija te koncentracija adenozin-deaminaze veća od 50 U/L. Mikobakterije se rijetko nalaze u izljevu pa su mikrobiološke kulture i mikroskopija uglavnom negativni.
Hilotoraks je naziv za nakupljanje limfe u pleuralnom prostoru koje nastaje kao posljedica disrupcije torakalnoga limfatičkog voda, a dva najčešća uzroka su trauma prsnoga koša (obično poslijeoperacijski) ili malignom medijastinuma. Hilotoraks karakterizira mliječna boja izljeva uz povišene vrijednosti triglicerida (> 110 mg/dL). Izljevi su obično veliki i zahtijevaju torakalnu drenažu. Produljena torakalna drenaža može dovesti do malnutricije i imunodeficijencije zbog gubitka lipida, proteina i limfocita. U težim slučajevima indicira se i kirurška intervencija (ligacija torakalnoga limfatičkog voda).
Hematotoraks je naziv za prisutnost krvi u pleuralnom izljevu, a dokazuje se određivanjem hematokrita u izljevu koji mora biti veći od polovine vrijednosti hematokrita u krvi. Manji hematotoraksi se ne moraju liječiti nego je potrebna klinička opservacija. Veći izljevi zahtijevaju torakalnu drenažu i to iz više razloga: simptomatsko olakšanje, mogućnost kontrole krvarenja i prevencija organizacije i razvoja fibrotoraksa. Ako je krvarenje na dren veće od 200 mL/h, indicirana je kirurška intervencija.
Pleuralni izljev u sklopu sistemskih bolesti. Pleuralni izljev može se vidjeti i kod bolesnika sa sistemskim bolestima vezivnoga tkiva kao što su reumatoidni artritis (RA), sistemski eritematozni lupus (SLE), Sjögrenov sindrom i dr. Kod 15 % bolesnika s aktivnim RA-om može se naći pleuralni izljev kojeg karakteriziraju prisutnost reumatoidnoga faktora i niske vrijednosti glukoze. Učestalost pleuralnoga izljeva kod bolesnika sa SLE-om iznosi 15 do 50 %, a karakteriziraju ga lupusne eritematozne stanice i niske vrijednosti komplementa (C3 i C4). Liječenje podrazumijeva tretiranje osnovne bolesti, terapijska punkcija rijetko je indicirana.
Ostali oblici pleuralnih izljeva. Akutni pankreatitis može pratiti lijevostrani pleuralni izljev karakteriziran povećanom koncentracijom amilaza. Meigsov sindrom karakterizira trijada koju čine tumor ovarija, ascites i veliki desnostrani pleuralni izljev koji nastaje uslijed prolaska ascitesa kroz male defekte dijafragme u desno prsište. Dresslerov sindrom koji se javlja tri do trideset dana nakon infarkta miokarda ili operacije na srcu također može biti praćen manjim lijevostranim pleuralnim izljevom.
PNEUMOTORAKS
Definicija. Pneumotoraks je naziv za prisutnost zraka u pleuralnom prostoru, a može nastati spontano ili uslijed traume prsnoga koša, tako da razlikujemo spontani i traumatski pneumotoraks.
Etiologija i podjela. Podjela pneumotoraksā temelji se na etiologiji: traumatski pneumotoraks, spontani pneumotoraks (primarni i sekundarni) te jatrogeni pneumotoraks.
Traumatski pneumotoraks nastaje kao posljedica penetrantne ili nepentrantne ozljede prsnoga koša. S obzirom na to da se radi o jačim ozljedama, često je udružen i s krvarenjem pa se takvo stanje naziva pneumohematotoraks i predstavlja predmet izučavanja kirurških struka.
Primarni spontani pneumotoraks nastaje kao posljedica rupture subpleuralnih bula ili cista, uz odsutnost primarne bolesti pluća. Radi se o kongenitalnim bulama i cistama koje su nastale kao posljedica poremećaja u razvoju pluća. Obično se radi o mlađim osobama, pretežno muškarcima (omjer muškarci: žene iznosi 6:1), mršavim i visokim koji imaju pozitivnu anamnezu na pušenje. Ovi oblici pneumotoraksa skloni su recidivima.
Sekundarni spontani pneumotoraks nastaje u podlozi primarne bolesti pluća kao što je kronična opstruktivna plućna bolest, bronhalna astma, karcinom pluća, plućni apsces i druge.
Jatrogeni pneumotoraks nastaje kao komplikacija medicinskih zahvata kao što su postavljanje središnjega venskoga katetera u unutarnju jugularnu venu ili venu subklaviju, pleuralna punkcija, punkcija ili drenaža plućnih lezija ili pleure, bronhoskopija i druge.
Patofiziologija. Prodor zraka u pleuralni prostor uzrokuje povišenje intrapleuralnoga tlaka koji nadmašuje tlak u alveolama što dovodi do kolapsa pluća i gubitka respiracijske površine. Ako se unutar pleuralnoga prostora nalaze adhezije, nastaje lokalizirani (parcijalni) pneumotoraks, a kada nema adhezija, zrak se nesmetano širi duž pleuralnoga prostora i nastaje generalizirani (kompletni) pneumotoraks. Ako se radi o opsežnom pneumotoraksu, povišeni intrapleuralni tlak osim kolapsa pluća uzrokuje i kontralateralni pomak traheje i medijastinalnih struktura te komprimira venske strukture što smanjuje venski priljev srcu što opet vodi prema smanjenju minutnoga volumena i hemodinamskoj ugroženosti.
Klinička slika. Simptomi ovise ponajprije o veličini pneumotoraksa i pridruženim plućnim bolestima (veći opseg pneumotoraksa i pridružene plućne bolesti prije se očituju i simptomi su izraženiji). Glavni simptom je bol na strani nastanka pneumotoraksa, otežano disanje te podražajni kašalj. Pri fizikalnom pregledu na strani pneumotoraksa disanje je jedva čujno ili odsutno, a perkutorno se dobiva hipersonoran zvuk. Uglavnom je prisutna tahikardija, a kod većih i hipotenzija. Inspekcijski se uočava odsutnost respiracijskih pokreta prsnoga koša na zahvaćenoj strani te znakovi korištenja pomoćne dišne muskulature.
Dijagnoza pneumotoraksa se postavlja na osnovi kliničke slike, anamnestičkih podataka, fizikalnoga pregleda te potvrđuje radiološkom snimkom pluća ili ultrazvučnim pregledom. Plinske analize arterijske krvi ukazuju na stupanj težine bolesti, a nalaz uključuje akutnu hipoksemijsku respiratornu insuficijenciju.
Radiološka snimka pluća ukazuje na potpun ili djelomično kolabiran plućni parenhim s vidljivom linijom visceralne pleure te gubitkom plućnoga vaskularnog crteža lateralno od te linije (Slika 2.15.). Kod većih pneumotoraksā vidi se i kontralateralni pomak traheje i medijastinuma. Na osnovi radiološkoga nalaza pneumotorakse dijelimo u tri skupine: mali pneumotoraks (zahvaćeno manje od 20 % plućnoga volumena), srednje veliki pneumotoraks (zahvaćeno 20 do 50 % plućnoga volumena) te veliki pneumotoraks (zahvaćeno više od 50 % plućnoga volumena).
Slika 2.15. Radiološki nalaz opsežnoga desnostranog pneumotoraksa
Ultrazvuk pluća postaje sve češća metoda u dijagnostici pneumotoraksa. U B-modu izostaje karakteritično klizanje pleure, dok u M-modu izostaje znak pješčane plaže i vidi se znak barkoda. Pažljivim pregledom jasno se uočava granica između ta dva znaka i ona se označava kao „lung point“ i ukazuje na veličinu pneumotoraksa.
Liječenje pneumotoraksa temelji se na njegovoj veličini i simptomatologiji. Mali, asimptomatski pneumotoraksi ne zahtijevaju liječenje nego samo opservaciju i kontrolno snimanje za dva do tri tjedna. Srednje veliki i veliki pneumotoraksi zahtijevaju jednostavan postupak aspiracije zraka te postproceduralnu kontrolu. Ako se nakon postupka pluća ekspandiraju i simptomi se povuku, bolesnici se opserviraju i kontrolna snimka se radi za dva do tri tjedna. Ako se nakon postupka pluća nisu ekspandirala ili se pneumotoraks ponovno javi, indicirana je torakalna drenaža. Ako se pneumotoraks ne može riješiti navedenim postupcima, indicirano je kirurško liječenje. U simptomatsku terapiju ulaze oksigenoterapija i analgezija.
Postupak jednostavne aspiracije pneumotoraksa sastoji se od nekoliko koraka: 1) aplikacija lokalnoga anestetika (2 % lidokain) u područje punkcije – drugi interkostalni prostor u medioklavikularnoj liniji; 2) uvede se kanila veličine 16 gaugea na dubinu od 3 do 4 cm; 3) kanila se spoji preko trokrakoga ventila na 50 kubičnu špricu; 4) aspirira se do 2.5 L zraka ili dok se ne osjeti otpor prilikom aspiracije; 5) postproceduralno učiniti novu radiološku snimku.
Tenzijski pneumotoraks je naziv za poseban oblik pneumotoraksa kod kojega nastaje valvularni mehanizam koji omogućava ulazak zraka u pleuralni prostor prilikom udaha, a onemogućava izlazak prilikom izdisaja. To dovodi do brzoga širenja pneumotoraksa, kolapsa pluća, pomaka medijastinuma te smanjenja venskoga priljeva i razvoja hemodinamskoga urušaja. Klinička slika je dramatična i zahtijeva hitnu punkciju pneumotoraksa te postavljanje torakalnoga drena.
MALIGNI MEZOTELIOM PLEURE
Definicija. Maligni pleuralni mezoteliom je rijedak primarni maligni tumor pleure koji potječe od mezotelnih stanica parijetalne ili visceralne pleure i karakterizira ga visok stupanj agresivnosti te loša prognoza.
Epidemiologija. Ovaj malignom se najčešće javlja kod starijih muškaraca, a prosječna dob u trenu postavljanja dijagnoze je 74 godine. Učestalost kod žena je četverostruko manja. Pojavnost je veća kod osoba koje su profesionalno bile izložene udisanju azbestnih čestica (brodogradnja, građevinarstvo) ili su živjele u neposrednoj blizini izvora azbestnih čestica, a primijećena je i veća učestalost kod članova obitelji osoba koje su bile profesionalno izložene azbestu. Mezoteliom se razvija i kod 20 % osoba koje nisu bile izložene azbestu.
Etiologija. Dva osnovna čimbenika rizika koja se povezuju s nastankom mezotelioma pleure su izloženost azbestu i ionizirajućem zračenju, a sve više se govori i o genetskoj predispoziciji te infekciji virusom SV40 (simian virus 40), iako se ta infekcija drži kontroverznom u ulozi nastanka mezotelioma. Pušenje ne povećava rizik od pojave ovoga malignoma.
Izloženost azbestu glavni je čimbenik rizika koji se povezuje s nastankom ovoga malignoma i prisutan je kod 80 % bolesnika. Period od ekspozicije do razvoja bolesti je različitoga trajanja i može se kretati od 20 do 50 godina, a to ponajprije ovisi o dužini ekspozicije i količini inhaliranoga azbesta.
Izloženost ionizirajućem zračenju također je utvrđeni čimbenik rizika, bilo da se radi o posljedicama vanjskoga, bilo terapijskoga zračenja (radioterapija medijastinalne regije). Karakteristično je da mezoteliomi pleure s tim rizičnim čimbenikom imaju bolju prognozu i preživljenje od onih koji su povezani s izloženošću azbestu.
Genetska predispozicija. S obzirom na to da u 20 % slučajeva mezoteliom pleure nije povezan s azbestom te da samo neke osobe koje su bile izložene azbestu razviju ovaj malignom pretpostalvja se genetska predispozicija bolesti. U tom se pogledu danas najviše spominje mutacija BAP1 tumor supresorskoga gena koju nalazimo kod velikoga broja oboljelih (57 do 63 %).
Patogeneza. Mezoteliomi pleure nastaju na lokaliziranom prostoru parijetalne ili visceralne pleure, a imaju tendenciju širenja duž pleure sa stvaranjem izljeva. S rastom tumora dolazi i do mjestimične obliteracije pleuralnoga prostora. Karakterizira ga lokalna invazija tako da zahvaća torakalnu stijenku, subpleuralno plućno tkivo, kao i ostale intratorakalne strukture. Iako većina tumora ostaje ograničena na prsni koš, moguća je hematogena diseminacija u udaljena tkiva i organe, najčešće u jetru.
Patologija. Makroskopski se mezoteliom prezentira kao žućkasto-bjelkasta čvrsta vezivna ploča koja u manjem ili većem opsegu oplakuje pluća i obliterira pleuralni prostor. Tumor obično zahvaća desno plućno krilo, a u oko 5 % slučajeva javlja se obostrano. Histološki razlikujemo tri tipa: 1) epiteloidni (50 - 70 %); sarkomatoidni (10 - 20 %) i miješani tip (10 %). Epiteliodni je najčešći i ima nešto bolju prognozu od ostalih oblika. Ponekad histološko razlučivanje mezotelioma od karcinoma i drugih benignih tumora pleure može biti otežano te se tada koriste imunohistokemijske metode.
Klinička slika. Bolest je dugo asimptomatska i ima podmukao početak. Kod više od 60 % bolesnika bolest se u svojoj razvijenoj formi očituje trijadom: dispneja, pleuralna bol te pleuralni izljev. U trenu kada mezoteliom postane simptomatski uglavnom se već radi o proširenoj bolesti. S vremenom se razvijaju i simptomi kao posljedica lokalne invazije tumora (sindrom gornje šuplje vene, srčana tamponada, kompresija kralješnične moždine, paraliza freničnoga ili povratnoga laringealnog živca, disfagija i sl.) te opći simptomi (mršavljenje, malaksalost) i simptomi udaljenih, hematogenih metastaza.
Dijagnoza se postavlja na osnovi anamneze, kliničkoga nalaza, radiološke dijagnostičke obrade te invazivnih postupaka (pluralna punkcija, biopsija i patohistološka analiza tumorske mase). U novije vrijeme spominju se i biokemijski markeri koji bi mogli sugerirati na pojavnost ovoga malignoma čak i u pretkliničkom stadiju.
Radiološka dijagnostička obrada. Klasična radiološka značajka mezotelioma je nepravilno, nodularno, unilateralno zadebljanje pleure s pratećim pleuralnim izljevom. Sve sumnjive nalaze klasičnoga rendgenograma treba nadopuniti kompjuteriziranom tomografijom koja daje bolji uvid u opseg i proširenost tumorskoga procesa (infiltracija torakalne stijenke, dijafragme, perikarda, medijastinalnih limfnih čvorova i dr.). Pretragom treba zahvatiti i gornji abdomen (jetra, limfni čvorovi i nadbububrežne žlijezde) kako bi se uočili sekundarizmi.
Pleuralna punkcija nema veći dijagnostički značaj, ali ima svoje mjesto u diferencijalnoj dijagnozi. Izljev je obično tipa eksudata, blago hemoragičan. Citološka analiza je uglavnom negativna, a ako se i nađu atipične maligne stanice, teško ih je razlikovati od metastatskoga adenokarcinoma ili atopije stanica drugih uzroka.
Biopsija i patohistološka analiza je zlatni standard za postavljanje dijagnoze malignoga mezotelioma. Najčešće se radi o analizi uzorka dobivenoga transtorakalnom punkcijom pleure s tumorskom masom uz kontrolu ultrazvuka ili CT-a, a nekada se indicira i video-asistirana torakoskopija. U postupku razlikovanja mezotelioma od drugih tumora primjenjuju se različite imunohistokemijske metode.
Biokemijski markeri. Iako nisu još u rutinskoj kliničkoj primjeni, postoje dva biokemijska markera čije povišene vrijednosti sugeriraju na postojanje ovoga malignoma, čak i u pretkliničkoj fazi, što daje implikaciju u praćenju bolesnika izloženih azbestu. To su mezotelin (SMRP, od engl. serum mesothelin-related protein) te fibulin-3.
Klinički stadiji bolesti. Na temelju dijagnostičke evaluacije bolesnika kod kojih je histološki potvrđena bolest, bolesnike možemo svrstati u jedan od četiri stadija prema preporukama IMIG skupine (engl. International mesothelioma interest group), na temelju TMN klasifikaciju. TNM klasifikacija i klinički stadiji bolesti prikazani su u Tablici 2.21. i 2.22.
Terapija. Liječenje ponajprije ovisi o proširenosti bolesti (lokalizirana i proširena bolest), a terapijski modaliteti uključuju kirurško liječenje, radioterapiju, kemoterapiju te palijativne postupke.
Liječenje temeljeno na proširenosti bolesti. Lokalizirana bolest podrazumijeva klinički stadij I i II te je kod njih indicirano multimodalno liječenje koje uključuje kirurški zahvat, adjuvantnu radioterapiju te neodjuvantnu i/ili adjuvantnu kemoterapiju. Proširena bolest podrazumijeva klinički stadij III i IV te je kod njih indicirana palijativna kemoterapija.
Kirurško liječenje indicirano je kod lokalizirane bolesti (stadij I i II). Izbor kirurškoga postupka ovisi o više čimbenika, a na raspolaganju su manje radikalan zahvat koji uključuje pleurektomiju i dekortikaciju te radikalna kompletna pulmekotomija. Studije koje su uspoređivale kliničke ishode ovih zahvata su došle do oprečnih rezultata.
Kemoterapija. Primjena cisplatine i pemetrekseda čini prvu liniju citostatskoga liječenja ovoga malignoma koja kod 30 - 40 % bolesnika dovodi do simptomatskoga poboljšanja i produljenja preživljenja. Alternativni citostatici su gemcitabin, antraciklini te vinorelbin.
Palijativno liječenje uključuje punkciju pleuralnoga izljeva, drenažu pleuralnoga prostora, pleurodezu te u nekim slučajevima palijativnu radioterapiju ili kiruršku resekciju.
Prognoza je načelno loša. Medijan preživljenja od postavljanja dijagnoze kreće se u rasponu od 7 do 17 mjeseci. Petogodišnje preživljenje bilježi se kod samo 5 do 10 % bolesnika. Loši prognostički čimbenici su loše opće stanje bolesnika, neepiteloidna histologija mezotelioma te muški spol. Većina bolesnika umire od respiratorne insuficijencije ili komplikacija vezanih uz lokalnu invaziju tumorske mase.
OSTALI TUMORI PLEURE
Solitarni fibrozni tumori pleure su izuzetno rijetki dobroćudni tumori pleure građeni od fibroznih elemenata. Etiologija je nepoznata, a obično se javljaju kod osoba srednje životne dobi, podjednako kod oba spola. Tumori su inkapsulirani i dobro ograničeni od ostaloga tkiva s histološki jasnom diferencijacijom stanica. Uglavnom su asimptomatski, a simptomi se javljaju uslijed progresije rasta tumora (dispneja, bol, kašalj). Dijagnoza se potvrđuje radiološkim metodama (konvencionalni rendgenogram, kompjuterizirana tomografija) te biopsijom i patohistološkom analizom. Liječenje je kirurško, a recidivi su rijetki.
Metastatski tumori pleure česta su pojava u kliničkoj praksi i uzrok su više od 50 % svih pleuralnih izljeva. Pleuralne metastaze najčešće su posljedica karcinoma pluća, dojke te genitourinarnoga trakta, ali i drugih tumora. Klinički se pleuralne metastaze očituju kao maligni pleuralni izljev koji ima odlike eksudata i obično je hemoragičan. Dispneja i kašalj dominiraju kliničkom slikom. Dijagnoza se potvrđuje radiološkim pretragama te citološkom analizom pleuralnoga punktata. Liječenje je simptomatsko i sastoji se od liječenja osnovne bolesti, a u obzir dolaze pleuralne punkcije, pleurodeza ili postavljanje pleuralnoga katetera. Prognoza je loša.
|
Tablica 2.21. TNM klasifikcija malignoga mezotelioma pleure
|
|
T0
|
Nema evidentnoga primarnog tumora
|
|
T1
|
Jednostrana zahvaćenost parijetalne pleure s ili bez infiltracije visceralne pleure
|
|
T1a
|
Jednostrana zahvaćenost parijetalne pleure bez infiltracije visceralne pleure
|
|
T1b
|
Jednostrana zahvaćenost parijetalne pleure s infiltracijom visceralne pleure
|
|
T2
|
Jednostrana zahvaćenost parijetalne pleure s jednom od sljedećih karakteristika: difuzna infiltracija visceralne pleure, infiltracija plućnoga parenhima, infiltracija dijafragme
|
|
T3
|
Jednostrana zahvaćenost parijetalne pleure s jednom od sljedećih karakteristika: infiltracija endotorakalne fascije, infiltracija medijastinalnoga masnog tkiva, netransmuralna infiltracija perikarda
|
|
T4
|
Jednostrana zahvaćenost parijetalne pleure s difuznom ili multifokalnom infiltracijom masnoga tkiva torakalne stijenke, rebara, peritoneuma, kontralateralne pleure, kralješnice, perikarda, miokarda, brahijalnoga pleksusa te nalaz malignih stanica u perikardijalnom izljevu
|
|
N0
|
Bez metastaza u limfne čvorove
|
|
N1
|
Metastaze u jednom ili više intrapulmonalnih i/ili hilarnih limfnih čvorova
|
|
N2
|
Metastaze u subkarinalnim i/ili ipsilateralnim medijastinalnim parasternalnim limfnim čvorovima
|
|
N3
|
Metastaze u kontralateralne medijastinalne limfne čvorove te ipsilateralne ili kontralateralne supraklavikularne ili skalenske limfne čvorove
|
|
M1
|
Bez udaljenih metastaza
|
|
M2
|
Potvrđene udaljene metastaze
|
|
Tablica 2.22. Klinički stadiji malignoga mezotelioma
|
|
Klinički stadij
|
T parametar
|
N parametar
|
M parametar
|
|
I
|
T1
|
N0
|
M0
|
|
IA
|
T1a
|
N0
|
M0
|
|
IB
|
T1b
|
N0
|
M0
|
|
II
|
T2
|
N0
|
M0
|
|
III
|
T1, T2
|
N1
|
M0
|
|
T1, T2
|
N2
|
M0
|
|
T3
|
N0, N1, N2
|
M0
|
|
IV
|
T4
|
Bilo koji N
|
M0
|
|
Bilo koji T
|
N3
|
M0
|
|
Bilo koji T
|
Bilo koji N
|
M1
|
BOLESTI MEDIJASTINUMA I DIJAFRAGME
Medijastinum ili sredoprsje naziv je za prostor smješten između plućnih krila s lijeve i desne strane, dijafragme s donje strane i velikih krvnih žila s gornje strane. Klasično se dijeli u tri dijela: prednji, srednji i stražnji. Prednji medijastinum sadrži timus, krvne žile, perikard i limfne čvorove. Srednji medijastinum sadržava srce, velike krvne žile, traheju i glavne bronhe, limfne čvorove te frenični i vagalni živac. Stražnji medijastinum sadržava kralješke, silaznu aortu, jednjak, prsni limfni vod, venu azigos i hemiazigos, simpatički lanac, donji dio vagusa i limfne čvorove.
Najčešće bolesti medijastinuma su upale (akutni medijastinitis, granulomatozni medijastinistis), tumori medijastinuma te pneumomedijastinum. Osnova liječenja ovih bolesti je kirurška, stoga se ove bolesti i smatraju kirurškim bolestima i više se izučavaju u kirurškoj literaturi.
AKUTNI MEDIJASTINITIS
Definicija. Akutni medijastinitis je naziv akutnu upalu vezivnoga tkiva medijastinuma koja, ako se ne prepozna i ne liječi na vrijeme, ima visok stupanj smrtnosti.
Etiopatogeneza. Najčešće se akutni medijastinitis javlja kao komplikacija nakon kardiokirurškoga zahvata s učestalošću od 1 do 2 %. Rizični čimbenici za razvoj postoperativnoga akutnog medijastinitisa su hitni zahvat, debljina, prolongirano vrijeme zahvata, reanimacija tijekom zahvata, rana reoperacija te sternalna dehiscencija. Ostali uzroci akutnoga medijastinitisa su: progresija upalnoga procesa iz orofaringealne regije, perforacija jednjaka (spontana, traumatska, jatrogena), traheobronhalna perforacija (traumatska, jatrogena), progresija intrapulmonalnoga upalnog procesa, trauma prsnoga koša i sl. Akutni medijastinitis karakteriziraju lokalne promjene koje uključuju nekrozu tkiva sa stvaranjem gnojnoga sadržaja i mogućim krvarenjem te nastankom sepse i sistemskoga upalnog odgovora.
Mikrobiologija. Najčešći uzročnici akutnoga medijastinitisa su gram-pozitivni koki (Staphylococcus aureus, Staphylococcus epidermidis) s učestalošću od oko 60 do 80 %. U 20 % do 40 % slučajeva radi se o miješanoj infekciji gram-pozitivnim i gram-negativnim bakterijama, a izolirana infekcija gram-negativnim uzročnikom izuzetno je rijetka.
Klinička slika. Tijek bolesti je akutan i progresivan. Bolest počinje visokom temperaturom te općim lošim stanjem, a vrlo brzo se javljaju dispneja, bol u prsima i razvoj septičkoga šoka (tahikardija, tahipneja, hipotenzija). Uz navedene simptome bolesnici imaju i simptome svoje osnovne bolesti. Pri fizikalnom pregledu može se naći pozitivan Hammanov znak (krckanje tijekom sistole).
Komplikacije. Komplikacije koje mogu pratiti akutni medijastinitis su sepsa i septički šok, respiratorna insuficijencija, pneumotoraks, empijem pleure te krvarenje iz velikih krvnih žila.
Dijagnoza. Sumnja na akutni medijastinitis postavlja se na osnovi kliničke slike i anamnestičkih podataka, laboratorijskih nalaza (povišeni upalni parametri) te radiograma prsnoga koša (proširena sjena medijastinuma uz zračne linije). Potvrda dijagnoze se postiže pomoću kompjuterizirane tomografije kojom se bolje vizualizira opseg patološkoga procesa te može ukazivati na etiologiju. Kod sumnje na sepsu potrebno je uzorkovanje krvi u više navrata i s više mjesta (hemokultura).
Liječenje. S obzirom na to da se u osnovi bolesti nalazi gnojna upala, osnovno liječenje je kirurško (drenaža, operativna eksploracija i debridaman) uz parenteralnu primjenu antibiotika širokoga spektra ili ciljano prema antibiogramu. Preporučena kombinacija uključuje piperacilin-tazobaktam plus vankomicin ili vankomicin plus fluorokinolon i klindamicin. Da bi se pokrili i gram-negativni uzročnici, može se dodati i aminoglikozid. Uz to je potrebno provoditi simptomatske mjere: analgezija, oksigenoterapija, mehanička ventilacija, parenteralna prehrana i sl.
Prognoza. Smrtnost od akutnoga medijastinitisa je visoka i kreće se u rasponu od 40 do 50 %. Ranija dijagnostika i početak liječenja osiguravaju bolju prognozu.
KRONIČNI MEDIJASTINITIS
Definicija. Kronični medijastinitis je naziv za kroničnu upalu medijastinuma koju karakterizira razvoj fibroze, pa se i naziva kroničnim fibrozirajućim medijastinitisom.
Etiologija. Kronični fibrozirajući medijastinitis najčešće nastaje kao komplikacija granulomatoznih plućnih infekcija, najčešće uzrokovanih gljivicom Hystoplasma capsulatum te bakterijom Mycobacterium tuberculosis. Ostali, rjeđi uzroci su neoplazma, radioterapija te lijekovi (metisergid).
Klinička slika. Bolesnici su dugo asimptomatski, a sam klinički tijek je indolentan i sporoprogresivan. Simptomi nastaju kada fibroza dovede do kompresije ostalih intratorakalnih struktura i organa (dispneja, disfagija, sindrom gornje šuplje vene, Hornerov sindrom, promuklost i sl.).
Dijagnoza se postavlja na temelju kliničke slike, radioloških nalaza (preporuča se kompjuterizirana tomografija) te kirurške biopsije i histološke analize.
Liječenje. Osnovno liječenje uključuje liječenje osnovne bolesti te u kasnijim fazama bolesti eventualno kiruršku intervenciju (kod simptomatskih bolesnika).
PNEUMOMEDIJASTINUM
Definicija i etiologija. Pneumomedijastinum je naziv za prisutnost zraka u medijastinalnom prostoru. Može nastati na jedan od tri načina: 1) ruptura alveola; 2) ruptura ili perforacija jednjaka ili traheobronhalnoga stabla te 3) prodor zraka iz vrata ili peritonealne šupljine.
Klinička slika. Glavne kliničke manifestacije su pojava subkutanoga emfizema (80 % bolesnika) te bola u prsima s ili bez širenja u vrat i lopatice (40 % bolesnika). Bolesnici bol opisuju kao pritisak iza prsne kosti, a pojačava se s dubokim udisajima. Dispneja je rjeđe prisutna. Ostali simptomi uključuju disfoniju, difagiju, bol u grlu i dr. U kliničkom pregledu dominira Hammanov znak (škripanje nad prekordijem tijekom sistole).
Dijagnoza se postavlja na temelju kliničke slike te radioloških metoda koje prikazuju radiolucentne pruge koje predstavljaju zrak između anatomskih struktura medijastinuma. CT prsnoga koša je osjetljiviji u dijagnostici u odnosu na klasični radiogram i kod svake sumnje na pneumomedijastinum potrebno je snimiti CT prsnoga koša.
Liječenje je usmjereno na liječenje osnovne bolesti, a često je potrebna i kirurška intervencija te ostale potporne mjere (oksigenoterapija, mehanička ventilacija i sl.).
CISTE I TUMORI MEDIJASTINUMA
Uvod. Tumori medijastinuma mogu biti primarni (rijetko) te sekundarni (češće). Najčešći primarni tumori medijastinuma su timomi, neurogeni tumori, limfomi i ciste. S obzirom na to da u medijastinumu nalazimo obilje limfnih čvorova, oni su često sijelo metastaza (karcinom pluća, jednjaka, dojke, želuca i bubrega).
Podjela. Budući da se u medijastinumu nalaze različita tkiva, tumori medijastinuma mogu biti različiti. Zbog svoje povezanosti s lokalizacijom, tumore medijastinuma dijelimo u tri skupine: tumori prednjega, srednjega i stražnjeg medijastinuma. Osim tumora, sličnu radiološku sliku mogu davati i druge patorezistencije što ima velik diferencijalno-dijagnostički značaj što je prikazano u Tablici 2.23.
|
Tablica 2.23. Patološke rezistencije u medijastinumu
|
|
Prednji medijastinum
|
Srednji medijastinum
|
Stražnji medijastinum
|
|
Teratom
Timom
Tireoidni tumor
Guša
Aneurizma
Limfom
Paratireoidni tumor
Lipom
|
Perikardijalna cista
Limfoidna hiperplazija
Bronhogeni tumor
Bronhogena cista
Aneurizma
Limfom
|
Neurogeni tumor
Tumor jednjaka
Bronhogeni tumor
Bronhogena cista
Aneurizma
Limfom
Enterična cista
Dijafragmalna hernija
|
Klinička slika tumora medijastinuma najviše ovisi o njihovoj lokalizaciji jer svojim rastom mogu izazvati različite kompresivne simndrome. Tumori medijastiuma su dugo asimptomatski, često se dijagnosticiraju slučajno prilikom radiološke obrade prsnoga koša iz drugih razloga. Simptomi su najčešće posljedica rasta i kompresije i/ili infiltracije okolnih tkiva i struktura. Simptomi traheobronhalne opstrukcije prezentiraju se kao suh i podražajni kašalj, stridor te osjećaj gušenja, a veća je i pojavnost infekcija. Simptomi opstrukcije gornje šuplje vene uključuju nabrekle vene na vratu, proširen izgled lica, naglašene kolaterale na prednjoj strani toraksa, a u slučaju izostanka kolaterala nalazimo hiperemiju, cijanozu te edem glave i vrata. Simptomi kompresije jednjaka očituju se kao disfagija i odinofagija različitoga intenziteta. Simptomi kompresije živaca. Pritisak na nervus frenikus dovodi do paradoksalnoga gibanja ošita, a pritisak nervusa rekurensa do promuklosti i gubitka glasa. Infiltracija i kompresija aferentnih niti donjega cervikalnog i gornjega torakalnog segmenta uzrokuju pojavu jakih retrosternalnih bolova. Simptomi kompresije simpatikusa očituju se kao Hornerov sindrom kojeg karakteriziraju istostrana anhidroza, mioza, ptoza i endoftalmus.
Dijagnoza se postavlja prvenstveno na temelju radiološke dijagostike (konvencionalni radiogram prsnoga koša, kompjuterizirana tomografija) te patohistološkom potvrdom uzoraka dobivenih na različite načine (trasbronhalna biopsija, trasezofagealna biopsija, perkutana transtorakalna biopsija, videotorakoskopija, otvorena biopsija).
Liječenje ponajprije ovisi o vrsti i naravi tumora. Kao mogućnost ostaje operativno liječenje s ciljem uklanjanja lokalnih simptoma.
BOLESTI DIJAFRAGME (OŠITA)
Uvod. Dijafragma (ošit) je glavni respiratorni mišić koji odjeljuje torakalnu od abdominalne šupljine. Disfunkcija dijafragme uvijek dovodi do poremećaja ventilacije, unatoč postojanju kompenzacijskih mehanizama (aktivacija pomoćne dišne muskulature). Bolesti dijafragme mogu se podijeliti u dvije skupine: poremećaji inervacije i anatomski poremećaji.
Poremećaji inervacije dijafragme. Inervacija dijafragme se odvija preko freničnoga živca (n. phernicus) koji nastaje spajanjem prednjih grana C3-C5 u području vrata te se spušta duž vrata i prsne stijenke do dijafragme po kojoj se distribuira s njezine donje strane. Oštećenje freničnoga živca rezultirat će jednostranom ili obostranom slabosti ili paralizom dijafragme što narušava normalnu mehaniku disanja. Najčešći uzroci prikazani su u Tablici 2.24.
|
Tablica 2.24. Uzroci oštećenja freničnoga živca i posljedične paralize dijafragme
|
|
Unilateralna paraliza dijafragme
|
Bilateralna paraliza dijafragme
|
|
Jatrogena lezija frenikusa (opracija, punkcija subklavije)
Invazija frenikusa karcinomom pluća
Neurološke bolesti (poliomijelitis, herpes zoster)
Traumatsko oštećenje frenikusa
|
Bolesti donjeg i gornjeg motoneurona
Multipla skleroza
Guillain-Barreov sindrom
Posttraumatska kvadriplegija
|
Poremećaji anatomije dijafragme. U anatomske poremećaje dijafragme ubrajamo kongenitalne i stečene dijafragmalne hernije te rupturu dijafragme. Prirođene dijafragmalne hernije uglavnom se otkrivaju u dječjoj dobi i predmet su bavljenja pedijatrije i dječje kirurgije. Najčešće stečene hernije dijafragme su hijatalna hernija, posterolateralna (Bochdalekova) hernija te prednja (Morgangnijeva) hernija. Hijatalna hernija povezana je s protruzijom želuca u intratorakalni prostor i može biti povezana s nastankom gastroezofagealne refluksne bolesti. Kliničke manifestacije dijafragmalnih hernija ponajprije ovise o njihovoj veličini, manje ostaju asimptomatske, dok veće mogu stvarati probleme pri disanju i kod probave zbog patoloških pomaka struktura trbuha unutar prsnoga koša. Ruptura dijafragme nastaje kao rezultat djelovanja tupe ili penetrantne ozljede s posljedičnim prolabiranjem trbušnih organa u prsnu šupljinu što može dovesti do kompresije na pluća te do opstrukcije probavnoga sustava. Te su bolesti prvenstveno predmet izučavanja kirurgije.
Klinička slika ovisi o uzročnoj bolesti. Glavni simptomi disfunkcije dijafragme su plućni, a ovise o opsegu poremećaja (unilateralni, bilateralni). Bolesnici se mogu žaliti na dispneju, umor pri disanju, kratkoću daha, nemogućnost dubokoga udaha te nelagodu u prsima. Auskultacijski se obično nađe oslabljen šum disanja, a kod protruzije organa u prsište nekada se može čuti crijevna peristaltika.
Dijagnoza. Dijagnostički postupci koji mogu ukazivati na bolest dijafragme su klasični rendgenogram pluća (visok stav ošita), rendgenska dijaskopija (paradoksalno gibanje dijafragme) te CT prsnoga koša koji ima presudnu ulogu kod sumnje na dijafragmalnu herniju. Ovisno o uzročnoj bolesti potrebno je provesti i druge, specifične dijagnostičke metode. S pulmološke strane indicirano je provesti ispitivanje funkcije pluća. Spirometrijski nalaz ukazuje na utjecaj bolesti dijafragme na plućnu funkciju i potrebitosti liječenja.
Liječenje. Odluka o potrebitosti liječenja ovisi o nalazima testova plućne funkcije. Ako su bolesnici asimptomatski i imaju uredne ili prihvatljive nalaze plućne funkcije, nije potrebno provoditi liječenje. Kod ostalih je bolesnika liječenje usmjereno na osnovnu bolest (kirurška reparacija hernije, liječenje neuroloških bolesti i sl.). Simptomatsko liječenje može uključivati neke oblike mehaničke potpore disanju ili elektrostimulaciju freničnoga živca i dijafragme.
Glavnu ulogu u kontroli ventilacije ima centar za disanje koji se nalazi u području moždanoga debla te periferno i centralno smješteni kemoreceptori osjetljivi na promjene parcijalnih tlakova kisika i ugljičnoga dioksida, kao i na promjene pH arterijske krvi. Centralni kemoreceptori nalaze se u području centra za disanje i osnovni je podražaj za njihovu aktivaciju povećanje parcijalnoga tlaka ugljičnoga dioksida i/ili porast koncentracije vodikovih iona (acidoza). Odgovor na njihovu stimulaciju je produbljeno i ubrzano disanje kojime se nastoji odstraniti što više ugljičnoga dioksida, a time i ispraviti acidozu. Periferni kemoreceptori smješteni su u karotidnim i aortalnim tjelešcima i primarno su osjetljivi na sniženje parcijalnoga tlaka kisika te u uvjetima akutne hipoksemije oni predstavljaju snažni stimulans za pojačanje disanja. Također, ovi periferni receptori bitan su poticaj disanju bolesicima s kroničnom opstruktivnom plućnom bolesti koji imaju stalno povišen parcijalni tlak ugljičnoga dioksida što dovodi do smanjene osjetljivosti centralnih kemoreceptora.
Osnovna podjela poremećaja ventilacije uključuje hiperventilacijski sindrom, hipoventilacijski sindrom te pridruženi poremećaj disanja za vrijeme spavanja (sindrom apneje u spavanju).
HIPERVENTILACIJSKI SINDROM
Definicija. Hiperventilacijski sindrom definira se kao stanje u kojemu minutna ventilacija nadilazi metaboličke potrebe organizma, što rezultira smanjenjem parcijalnoga tlaka ugljičnoga dioksida u krvi (hipokapnija) te posljedičnim biokemijskim promjenama. Javlja se u akutnom i kroničnom obliku.
Epidemiologija. Hiperventilacijski sindrom prisutan je kod oko 5 % opće populacije. Obično se javlja u dobi između 15 i 55 godina sa znatno višom učestalošću kod žena kod odnosu na muškarce (omjer 7:1). Također je zamjećeno da se hiperventilacijski sindrom češće javlja kod bolesnika s bronhalnom astmom.
Etiopatogenza. Točan uzrok ovoga sindroma nije poznat, ali smatra se da se radi o bolesnicima s abnormalnim respiratornim odgovorom na stres i emocionalne okidače, kao i na neke kemijske podražaje (natrij, laktati, ugljični dioksid) ili lijekove (izoprotrenolol, kofein). Iako je učestalost ovoga sindroma češća među krvnim srodnicima u prvom koljenu, genetska podloga nije dokazana. Izlaganje navedenim okidačima kod ovih bolesnika rezultira abnormalnim respiratornim odgovorom koji se manifestira kao ubrzano i duboko disanje koje ubrzo dovodi do hiperinflacije pluća i porasta rezidualnoga plućnog volumena. Visok rezidualni volumen i prekomjerna ekspanzija pluća ograničavaju volumen zraka pri sljedećim udisajima te se kod bolesnika razvija osjećaj nedostatka zraka i nemogućnosti potpunoga udaha što izaziva anksioznost koja također sama po sebi potiče duboko disanje i sve to vodi u začarani krug u kojemu bolesnici imaju sve izraženije simptome (Slika 2.16.).
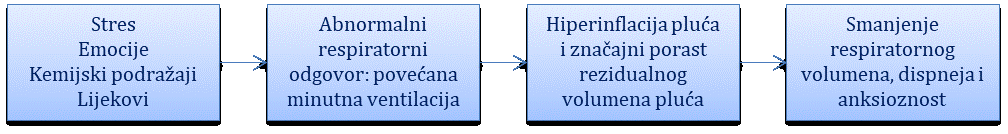
Slika 2.16. Etiopatogeneza hiperventilacijskoga sindroma
Patofiziologija. Prekomjeran respiracijski rad dovodi prvenstveno do promjena u parcijalnim tlakovima kisika i ugljičnoga dioksida u arterijskoj krvi pri čemu se kisik povisuje (hiperoksemija), a ugljični dioksid smanjuje (hipokapnija). Uslijed pojačane eliminacije ugljičnoga dioksida dolazi i do pojačanoga uklanjanja vodikovih iona što rezultira porastom pH arterijske krvi (respiratorna alkaloza). Ove su pak promjene odgovorne za pomak elektrolita u unutarstanični prostor zbog čega nastaju hipokalcijemija, hipokalijemija, hipofosfatemija i posljedična mišićna slabost, tremor ili karpopedalni spazmi. Hipokapnija dovodi do cerebralne vazokonstrikcije što za posljedicu ima smanjenu perfuziju mozga pa bolesnici mogu imati glavobolje, presinkope i sinkope.
Klinička slika. Simptomi i znakovi hiperventilacijskoga sindroma posljedica su same hiperventilacije (duboko i šumno disanje, uznemirenost, tahikardija, preznojavanje), kao i njezinih metaboličkih posljedica (najčešće neurološke manifestacije kao što su mišićna slabost, parestezije, presinkope).
Akutni hiperventilacijski sindrom oblježava naglo nastala, jasno izražena hiperventilacija (duboko i šumno disanje) pri čemu se bolesnici žale na slabost, dispnoične tegobe, stezanje u prsima, vrtoglavicu, palpitacije, parestezije u rukama i nogama, a često su prisutni i karpopedalni spazmi, fascikulacije i midrijaza (hipokalcijemija). Simptomi nastupaju naglo, jako su izraženi, kraće traju i često se jasno mogu povezati s okidačem (najčešće nakon stresne situacije).
Kronični hiperventilacijski sindrom ima manje dramatične simptome i znakove, a naglasak je na simptomima koji nastaju kao posljedica metaboličkih promjena, dok je sama hiperventilacija manje izražena i uočljiva, što otežava dijagnozu. Ti se bolesnici obično prezentiraju neurološkim simptomima (umor, glavobolja, presinkope, parestezije, mišićna slabost), ali se mogu žaliti i na dispneju te pritisak u prsima. Ti bolesnici su skloniji depresivnom raspoloženju, žale se na suhoću usta i sl.
Diferencijalna dijagnoza je široka i može uključivati različite bolesti i stanja: plućne bolesti (astmatski napadaj, plućna embolija, pneumotoraks), srčane bolesti (akutni koronarni sindrom, tahiaritmije), neurološke bolesti (centralne i periferne bolesti živčanoga sustava), metaboličke bolesti (dijabetička ketoacidoza, metabolička acidoza, hipertireoza, trovanje) te psihičke bolesti (panika, opsesivno-kopulzivni poremećaj, apstinencijski sindrom) i dr. U svakodnevnom kliničkom radu kod sumnje na hiperventilacijski sindrom mora se isključiti akutni koronarni sindrom i plućna tromboembolija.
Dijagnoza. Standardni dijagnostički postupak uključuje anamnezu i fizikalni pregled, elektokardiografiju, laboratorijske pretrage te rendgenogram srca i pluća. Dijagnoza hiperventilacijskoga sindroma zapravo počiva na anamnestičkim podacima, karakterističnim laboratorijskim promjenama te isključenju drugih bolesti i stanja, u prvom redu akutnoga koronarnog sindroma i plućne embolije.
Anamaneza i fizikalni pregled su ključni kod ovih bolesnika. Iznenadan početak simptoma, naglasak na somatizaciji psiholoških tegoba (osjećaji trenjenja, mravinjanja, suhoća usta) te povezivanje s određenim okidačem ključni su elementi za postavljanje dijagnoze hiperventilacijskoga sindroma. Kod akutnoga oblika je to puno jasnije i lakše, dok kod kroničnoga oblika to ne mora biti tako jasno. Kod takvih bolesnika sumnju trebaju pobuditi nejasna neurološka ili kardiorespiratorna simptomatologija u prisutnosti hipokapnije i kompenzirane alkaloze.
Elektokardiogram prvenstveno služi za isključivanje akutnoga koronarnog sindroma i plućne embolije. Kod izraženih promjena u plazmatskim vrijednostima elektrolita moguće su i promjene u elektrokardiogramu: inverzija T-vala, produljeni QT-interval, sinusna tahikardija, promjene ST-segmenta i dr.
Laboratorijski nalazi. Plinske analize i acidobazni status arterijske krvi ključni su u dijagnostici. U akutnom obliku nalazimo hiperoksemiju, hipokapniju te nekompenziranu respiracijsku alkalozu (bikarbonati su uredni), dok u kroničnom obliku nalazimo slabije izraženu hiperoksemiju, hipokapniju te kompenziranu respiracijsku alkalozu (bikarbonati su sniženi). Također, u akutnom napadaju nalazimo i hipokalcijemiju, hipokalijemiju te hipofosfatemiju. U svrhu isključenja akutnoga koronarnog sindroma i plućne embolije mogu se određivati i kardioselektivni enzimi te D-dimeri (opravdano samo pri jasnoj kliničkoj sumnji).
Klasični radiogram srca i pluća nema veći značaj, a kod izražene kliničke slike može ukazivati na hiperinflaciju. Veći značaj ima u isključivanju drugih bolesti koje mogu imati sličnu kliničku prezentaciju.
Dodatni testovi. Ispitivanje disanja u ležećem i stojećem položaju može imati određen dijagnostički značaj. Kod normalnih osoba prilikom promjene položaja iz ležećega u stojeći dolazi i do pojačanja respiracije, a kod ovih bolesnika je to naglašenije, a može se i objektivizirati mjerenjem izdahnutoga ugljičnog dioksida (etCO2).
Liječenje hiperventilacijskoga sindroma zasniva se na primjeni različitih tenhnika disanja te eventualno primjeni medikamenata. Disanje u papiratu vrećicu kako bi se zaustavila hiperventilacija uglavnom se ne preporuča jer su registrirani smrtni slučajevi kod bolesnika koji su bili krivo dijagnosticirani (akutni infarkt, plućna embolija). Tijekom hiperventilacije bolesnike treba poticati da dišu trbuhom i da se koncentriraju na trbušno disanje što obično dovodi do usporavanja disanja. Kod bolesnika kod kojih se ne može postići kontrola simptoma na navedeni način indicirano je davanje benzodiazepina ili inhibitora ponovne pohrane serotonina. Bolesnici koji imaju česte napade hiperventilacije mogu uzimati te lijekove i kao trajnu terapiju.
Prognoza bolesti je dobra, osim što učestali napadi akutne hiperventilacije i kronični hiperventilacijski sindrom mogu narušavati kvalitetu života.
HIPOVENTILACIJSKI SIDROM
Definicija. Hipoventilacijski sindrom definira se kao stanje smanjene i nedostatne minutne ventilacije što se očituje sniženim vrijednostima parcijalnoga tlaka kisika (hipoksemija) te porastom parcijalnoga tlaka ugljičnoga dioksida (hiperkapnija). Prema kliničkom nastupu i karakteristikama razlikujemo akutni i kronični hipoventilacijski sindrom.
Epidemiologija. Ukupno gledano, s obzirom na učestalost pretilosti i kronične opstruktivne plućne bolesti u općoj populaciji kao glavnih uzroka hipoventilacijskoga sindroma, i sama učestalost ovoga sindroma relativno je česta. Obično se javlja kod osoba starije životne dobi s češćom pojavnošću kod muškaraca u odnosu na žene.
Etiopatogeneza. Hipoventilacijski sindrom može se razviti uslijed različitih bolesti i stanja, među kojima su poremećaji središnjeg živčanoga sustava (centralna alveolarna hipoventilacija), pretilost (Pickwick sindrom), anomalije prsne stijenke, neuromišićne bolesti te kronična opstruktivna plućna bolest.
Centralna alveolarna hipoventilacija posljedica je poremećaja središnjega živčanog sustava, a razlikujemo kongenitalni i stečeni centralni hipoventilacijski sindrom. Kongenitalni centralni hipoventilacijski sindrom posljedica je mutacije PHOX2B gena, uslijed čega dolazi do poremećaja autonomne kontrole disanja te ovi bolesnici pokazuju slab ili nikakav odgovor centra za disanje u stanjima hipoksije ili hiperkapnije. Homozigoti imaju kliničko očitovanje rano u djetinjstvu, dok heterozigoti mogu imati blaže kliničke manifestacije te mogu ostati neprepoznati do odrasle dobi. Stečeni centralni hipoventilacijski sindrom posljedica je patoloških promjena koje zahvaćaju centar za disanje (cerebrovaskularni inzult, tumori, traume).
Hipoventilacija uduružena s pretilošću (Pickwickov sindrom) definira se kao stanje u kojemu nalazimo kombinaciju pretilosti (indeks tjelesne mase veći od 30 kg/m2) te kronične hiperkapnije u budnom stanju (PaCO2 > 6 kPa) u odsutnosti drugih uzroka hipoventilacijskoga sindroma. Točan mehanizam razvoja hipoventilacije kod ovih bolesnika nije jasan i ne uključuje samo fizički zamor dišnih mišića (debljina smanjuje elastičnost stijenke prsnoga koša) nego su u to uključeni i drugi mehanizmi (centralni poremećaj, poremećaj metabolizma leptina), a na to ukazuje i sama činjenica da se ne razvije kod svih pretilih osoba ujedno i hipoventilacijski sindrom. Većina ovih bolesnika ima i opstruktivu apneju za vrijeme spavanja.
Anomalije stijenke prsnoga koša. Kod bolesnika s anomalijama prsne stijenke hipoventilacijski sindrom razvija se sekunadarno uslijed poremećaja mehanike disanja (smanjena elastičnost stijenke, nedostatno širenje prsnoga koša i sl.) te posljedično smanjenih plućnih volumena. Najčešća anomalija stijenke prsnoga koša povezana s ovim sindromom je kifoskolioza i to u svojim izraženim oblicima.
Neuromišićne bolesti kao što su mijastenija gravis, amiotrofična lateralna skleroza, mišićna distrofija ili Guillain-Barreov sindrom dovode do mišićne slabosti koja zahvaća respiratorne mišiće posljedično čemu dolazi do smanjenja alveolare ventilacije i nastanka hipoventilacijskoga sindroma.
Kroniča opstruktivna plućna bolest čest je uzrok hipoventilacijskoga sindroma, osobito kod bolesnika koji imaju FEV1 manji od 1 L ili od 30 % očekivanih vrijednosti. S obzirom na to da bolesnici s kroničnom opstruktivnom plućnom bolesti pokazuju različiti stupanj hipoventilacije, na njezinu pojavnost, osim samih promjena na plućima, vjerojatno utječu i neki drugi čimbenici (npr. genetski uvjetovana smanjena osjetljivost kemoreceptora na hipoksiju i/ili hiperkapiju).
Patofiziologija. Smanjena alveolarna ventilacija dovodi do smanjenja oksigenacije arterijske krvi te smanjenja eliminacije ugljičnoga dioksida što rezultira hipoksemijom i hiperkapnijom. Uslijed hiperkapnije dolazi do nakupljanja vodikovih iona i razvoja respiratorne acidoze. Ako se radi o akutnoj hipoventilaciji, acidoza se brže razvija jer nije kompenzirana, dok pri kroničnoj hipoventilaciji dolazi do razvoja kompenzatornoga odgovora bubrega u obliku pojačanoga stvaranja i zadržavanja bikarbonata tako da u kroničnom hipoventilacijskom sindromu uz hipoksemiju i hiperkapniju susrećemo kompenziranu respiracijsku acidozu (pH uredan, bikarbonati povišeni). Hiperkapnija može biti povezana i s cerebralnom vazodilatacijom koja može dovesti do edema.
Klinička slika. Nastup i progresija simptoma i znakova hipoventilacije ovise o kliničkim karakteristikama uzročne bolesti/stanja. Obično se početno oni ne uočavaju ili su slabije izraženi, a s napredovanjem bolesti napreduje i stupanj hipoventilacije, što dovodi do jasnih kliničkih očitovanja. Početni simptomi su dispneja pri naporu, umor i pospanost. S vremenom se dispneja javlja pri sve manjim naporima, a kasnije i u mirovanju. Bolesnici s značajnom hipoksemijom postaju cijanotični. U kasnim fazama hipoventilaciju karakterizira poremećaj svijesti, od letargije ili agitiranosti preko somnolencije i sopora do kome. Takvi bolesnici skloniji su i razvoju plućnih infekcija.
Dijagnoza. Za postavljanje dijagnoze hipoventilacijskoga sindroma dovoljna je klinička slika i laboratorijski nalazi (plinske analize i acidobazni status arterijske krvi), dok je za diferenciranje uzroka potrebno provesti širu dijagostičku obradu koja uključuje radiološku dijagnostiku (konvencionalni radiogram, kompjuterizirana tomografija), testove plućne funkcije te druge specifične pretrage (mjerenje transdijafragmalnoga tlaka, elektromioneurografija, polisomografija i dr.).
Plinske analize i acidobazni status arterijske krvi kod pvih bolesnika su karakteristični. U nalazu dominiraju hipoksemija i hiperkapnija uz nekompenziranu respiracijsku acidozu (akutna hipoventilacija) ili kompenziranu respiracijsku acidozu (kronična hipoventilacija).
Liječenje hipoventilacijskoga sindroma prvenstveno je usmjereno na liječenje i otklanjanje primarnoga uzroka. U simptomatsko liječenje hipoventilacijskoga sindroma ubrajamo opće preporuke, oksigenoterapiju, primjenu respiratornih stimulanasa te specifičnih metoda kao što je stimulacija dijafragme.
Opće preporuke uključuju primjenu prestanka pušenja, izbjegavanje alkohola i lijekova koji dodatno vrše depresiju centra za disanje, provođenje vježbi disanja te regulacija tjelesne mase (redukcijska dijeta). Sve te mjere pozitivno i stimulacijski djeluju na centar za disanje.
Oksigenoterapija. Da bi se izbjegle neželjene posljedice hipoksemije kod simptomatskih bolesnika s hipoventilacijskim sindrom, preporuča se primjena kisika. On se može primjenjivati kratkotrajno u fazama pogoršanja simptoma, a kod nekih bolesnika indicirana je i trajna oksigenoterapija. Kod primjene kisika kod ovih bolesnika potreban je dodatan oprez kako bi se izbjegla retencija ugljičnoga dioksida. Zbog toga se prije uvođenja kisika u terapiju vrši test kisikom (opisano kod kronične opstruktivne plućne bolesti). Preporuča se titrirati kisik kako bi se PaO2 održao između 60 i 65 mmHg (8 i 8,5 kPa). Kod bolesnika koji ostaju simptomatski unatoč oksigenoterapiji i koji imaju pogoršanje simptoma tijekom noći može se preporučiti i primjena neinvazivne mehaničke ventilacije (NIV-CPAP, BiPAP i dr.).
Respiratorni stimulansi. Primjena lijekova koji svojim učinkom mogu teoretski poticati disanje ostaje kao zadnja opcija i nije pokazala značajne rezultate. Na raspolaganju stoji nekoliko lijekova: medroksiprogesteron (izravan učinak na centar za disanje), acetazolamid (povećava eksekreciju bikarbonata te tako pogoršava metaboličku acidozu koja poticajno djeluje na centar za disanje) te teofilin (višestruki učinci: bronhodilatacija, centralni učinak, povećava elastičnost respiracijskih mišića).
Stimulacija dijafragme također je jedna od metoda liječenja hipoventilacije koja nije našla široku primjenu. Koncept podrazumijeva stimulaciju freničnoga živca kirurški postavljenim elektrodama koje su povezane s generatorom koji se stavlja pod kožu. Kao rezultat stimulacije freničnoga živca javlja se kontrakcija dijafragme. Na generatoru se može podesiti brzina odašiljanja impulsa i ostale karakteristike. Glavni nedostatak je oštećenje freničnoga živca koje se javlja kroz određeno vrijeme.
Prognoza bolesnika s hipoventilacijskim sindromom je varijabilna i ponajprije ovisi o primarnoj, uzročnoj bolesti koja se nalazi u podlozi.
POREMEĆAJI DISANJA ZA VRIJEME SPAVANJA
Poremećaji disanja za vrijeme spavanja relativno su česti u općoj populaciji, iako se na njih kao na klinički problem slabije obraća pozornost. Klasični poremećaji disanja za vrijeme spavanja su opstruktivna apneja u snu (engl. obstructive sleep apnea – OSA) te centralna apneja u snu (engl. central sleep apnea – CSA), iako se danas ovaj poremećaj sve više širi te poprima dodatne pojmove i sve ih objedinjuje u takozvani kontinuum poremećaja disanja za vrijeme spavanja (Slika 2.17.). Taj kontinuum čine obično hrkanje, sindrom povećane rezistencije gornjih dišnih puteva (engl. upper airway resistance syndrom – UARS) te sindrom apneje u snu kao krajnji oblik bolesti.
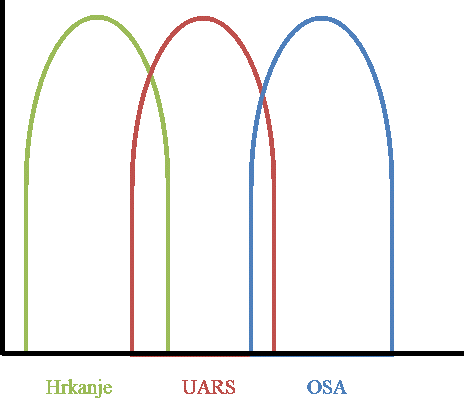
Slika 2.17. Kontinuum poremećaja disanja za vrijeme spavanja
Ovaj kontinuum započinje običnim hrkanjem koji zapravo predstavlja prvi simptom poremećaja disanja za vrijeme spavanja te ono može napredovati prema ozbiljnijim poremećajima, osobito kod pretilih osoba. Ove osobe još nemaju razvijene druge, objektivne manifestacije. Sljedeći poremećaj u ovom kontinuumu je sindrom povećane rezistencije gornjih dišnih puteva kojega karakterizira postojanje respiracijskoga napora tijekom spavanja kako bi se ventilacija održala urednom te ovi bolesnici već razvijaju poremećaje u vidu čestih buđenja, loše kvalitete sna te pospanosti tijekom dana. S vremenom se razvija konačni oblik poremećaja disanja za vrijeme spavanja – sindrom apneje u snu.
U daljnjem tekstu bit će opisana dva najčešća poremećaja disanja za vrijeme spavanja: opstruktivna apneja u snu i centralna apneja u snu.
OPSTRUKTIVNA APNEJA U SNU
Definicija. Opstruktivna apneja u snu (engl. obstructive sleep apnea – OSA) definira se kao poremećaj karakteriziran prestankom disanja za vrijeme spavanja u trajanju dužem od deset sekundi uslijed potpune ili djelomične opstrukcije gornjih dišnih puteva, što je praćeno povećanim respiracijskim naporom kako bi se razriješila opstrukcija i održalo disanje. OSA je najčešći poremećaj disanja za vrijeme spavanja.
Epidemiologija. Prevalencija OSA-e u općoj se populaciji prema podacima iz literaure kreće između 2 do 4 %, iako je stvarni postotak znatno viši jer velik dio bolesnika nije dijagnosticiran. Boolest se češće javlja kod muškaraca u odnosu na žene (omjer 3:1) te je učestalost veća u starijoj životnoj dobi (iznad 65 godina).
Etiopatogeneza. Glavni uzrok ovoga sindroma je djelomična ili potpuna opstrukcija gornjih dišnih puteva koja limitira protok zraka do pluća, što je praćeno kompenzacijskim pojačanim respiracijskim naporom kako bi se nadvladala opstrukcija i osigurao protok zraka. Prema tome, dvije ključne točke etiopatogeneze ovoga sindroma su opstrukcija gornjih dišnih puteva te pojačan respiracijski napor.
Opstrukcija gornjih dišnih puteva u ovome sindrom zbiva se na razini orofarinksa, a posljedica je primicanja (zapadanja) baze jezika i drugih mekotkivnih struktura prema stražnjem zidu orofarinksa, što se u određenoj mjeri događa u svih osoba s obzirom na smanjen tonus mišića farinksa tijekom spavanja. Dodatni čimbenici koji pridonose toj opstrukciji mogu se podjeliti u dvije skupine: strukturalni i nestrukturalni (Tablica 2.25.).
|
Tablica 2.25. Rizični čimbenici za OSA-u
|
|
Strukturalni čimbenici
|
Nestrukturalni čimbenici
|
|
Prirođenje anatomske varijacije
Retrognatija, mikrognatija
Mandibularna hipoplazija
Adenotonzilarna hipertrofija
Spušteno meko nepce
|
Muški spol, starija životna dob
Debljina, povećan opseg vrata
Konzumacija alkohola
Djelovanje sedativa
Pušenje
|
Pojačani respiracijski napor. Uslijed razvoja djelomične ili potpune opstrukcije razvija se smanjen protok zraka prema plućima što uzrokuje prestanak disanja (apneja) pri čemu dolazi do hipoksemije i hiperkapnije. Hipoksemija i hiperkapnija putem odgovarajućih kemoreceptora vrše podražaj na centar za disanje koji potom eferentnim živčanim vlaknima šalje impulse dišnim mišićima i mišićima farinksa i larinksa koji uvjetuju njihov pojačani rad i nadvladavanje opstrukcije, što je praćeno zvučnim fenomenima (izraženo hrkanje).
Genetska podloga. S obzirom na to da je otkriveno da je u nekim obiteljima ovaj poremećaj učestaliji nego u drugima, i da rođaci u prvom koljenu imaju dva do tri puta veći rizik od razvoja ovoga sindroma sugerira na moguću ulogu genetskih čimbenika. Iako je rađeno više studija s ciljem otkrivanja potencijalnih gena koji se povezuju s ovim poremećajem, do sada nije pronađena jasna poveznica između ispitivanih gena i ovoga poremećaja, ali najviše se povezuje s genima koji kontoliraju oksidativni stres i upalu.
Patofiziologija. Osim reperuksije na oksigenaciju, opstruktivna apneja u snu može imati i druge posljedice, osobito na kardiocirkulacijski sustav. Tijekom opstrukcije dolazi do snižavanja intratorakalnoga tlaka što povećava venski priljev i opterećenje desnoga srca, a to se dodatno komplicira vazokonstrikcijom plućnih arterija kao odgovora na hipoksemiju. Ovo opterećenje zajedno s pojačanim učinkom simpatikusa koji se aktivira u takvom stanju potiče potrošnju kisika u miokardu te može dovesti do značajne ishemije koja može rezultirati poremećajima srčanoga ritma ili koronarnim incidentom. U pogledu kroniciteta postupno se može razviti plućna hipertenzija i kronično plućno srce. Poznata je i izražena povezanost opstruktivne apneje u snu i arterijske hipertenzije, osobito kod pretilih osoba.
Klinička slika. Osnovni simptomi vezani su uz spavanje. Bolesnici tijekom spavanja imaju kraće ili duže apnoične faze nakon kojih slijedi glasno hrkanje koje ponekad bolesnika budi iz sna. Zbog toga je spavanje isprekidano, a bolesnici su umorni i neispavani. Učestalost epizoda apneje tijekom spavanja je različita, ali može dosezati i nekoliko stotina. Posljedično tome, česte su jutarnje glavobolje, razdražljivost te smanjena koncetracija i depresivno raspoloženje tijekom dana. S vremenom se kod bolesnika mogu razviti arterijska hipertenzija, poremećaji srčanoga ritma te srčano popuštanje.
Dijagnoza opstruktivne apneje u snu počiva na dobro uzetoj anamenzi koja mora sadržavati i hetero-anamnestičke podatke o kvaliteti spavanja i sna bolesnika. Pri fizikalnom pregledu treba obratiti pozornost na pretilost (indeks tjelesne mase veći od 30 kg/m2), arterijsku hipertenziju, debljinu vrata (suspektan je onaj koji je većeg opsega od 42 cm kod muškaraca i 40 cm kod žena) te anomalije nosa, usta i gornjih dišnih puteva. Konačna dijagnoza postavlja se putem polisomnografije.
Polisomnografija je pretraga koja se izvodi tijekom spavanja bolesnika u kontroliranim uvjetima. Tijekom spavanja se kod bolesnika prati nekoliko parametara: 1) san i stadij sna (elektroencefalografija, elektrookulografija); 2) srčani ritam (elektrokardiografija); 3) disanje: saturacija arterijske krvi (pulsna oksimetrija), protok zraka (preko senzora protoka u nosu i ustima) te mišići rad (pletizmografija); 4) tonus mišića brade i jezika (elektromiografija). Interpretacijom ovih nalaza dobiva se apneja-hipopneja indeks (AHI) koji se definira kao ukupan broj epizoda zaduhe po satu spavanja. AHI veći od 5 upućuje na OSA-u. AHI veći od 15 karakterističan je za umjereni oblik OSA-e, a veći od 30 na teški oblik OSA-e.
Liječenje OSA-e uključuje opće mjere, a kod težih oblika (AHI indeks veći od 15) u obzir dolaze i druge metode liječenja: primjena neinvazivne mehaničke ventilacije tijekom spavanja, primjena oralnih pomagala/proteza tijekom spavanja te kirurško liječenje.
Opće mjere uključuju smanjenje tjelesne težine; izbjegavanje alkohola, sedativa i nikotina pred spavanje te izbjegavanje bočnoga položaja pri spavaju.
Primjena oralnih pomagala/proteza osiguravaju učvršćivanje mandibule i sprečavaju retropoziciju tijekom spavanja, a time i zapadanje jezika prema ždrijelu.
Primjena neinvazivne mehaničke ventilacije tijekom spavanja danas je sve češća metoda liječenja OSA-e. Prijenosni respirator osigurava održavanje PEEP-a i tlačne inspiratorne potpore putem posebnih aplikatora (nazalna maska, oronazalna maska i dr.).
Kirurško liječenje uključuje rješavanje strukturalnih uzroka OSA-e ako zakažu konzervativne metode. U te se svrhe mogu izvoditi različiti zahvati: uvulopalatofaringoplastika, laserska uvuloplastika, glosektomija i dr. Taj dio liječenja obavljaju kirurzi glave i vrata.
Prognoza. Uz pravodobnu dijagnostiku i liječenje kratkoročna prognoza ovih bolesnika je dobra i kod većine se povlače simptomi bolesti, dok je dugoročna progoza nepoznata, s obzirom na to da nisu rađene odgovarajuće studije. Neliječeni bolesnici posjeduju rizike od razvoj kardiocirkulatornih incidenata, ali i drugih opasnosti (npr. povećan rizik od prometnih nesreća i sl.).
CENTRALNA APNEJA U SNU
Definicija. Centralna apneja u snu (engl. central sleep apnea – CSA) definira se kao poremećaj kojega karakterizira prestanak disanja tijekom spavanja uz očuvan dišni put i bez opstruktivnih smetnji disanja. U ovome slučaju radi se o poremećaju centralne kontrole ventilacije.
Etiopatogeneza. Prema etiopatogenezi, CSA dijelimo u dvije kategorije: a) CSA povezana s hiperventilacijom i b) CSA povezana s hipoventilacijom.
CSA povezana s hiperventilacijom najčešći je oblik CSA (Slika 2.18.). Hiperventilacija tijekom spavanja dovodi do pada vrijednosti parcijalnoga tlaka ugljičnoga dioksida koje je u fazi non-REM spavanja glavni stimulans za održavanje zadovoljavajuće respiracije. Slijed događaja započinje hipoksijom koja stimulira hiperpneju koja dovodi do hipokapnije i centralne apneje. Centralna apneja pak dovodi do ponovnoga porasta parcijalnoga tlaka ugljičnoga dioksida što dovodi do ponovne uspostave ventilacije i hiperpneje koja ponovno dovodi do hipokapnije i centralne apneje. Takav karakteristični obrazac disanja naziva se Cheyne-Stokesovo disanje. Ovaj obrazac centralne apneje najčešće se vidi kod bolesnika s popuštanjem srca koje inducira hipoksemiju za vrijeme spavanja.
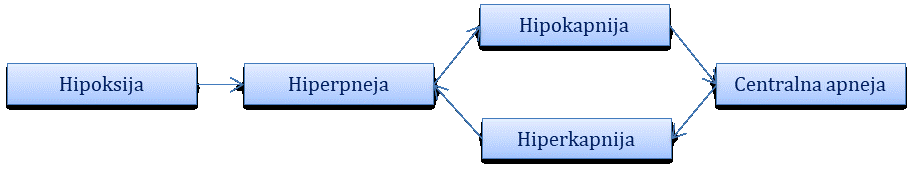
Slika 2.18. Patogeneza CSA povezane s hiperventilacijom (Cheyne-Stokesov tip)
CSA povezana s hipoventilacijom je rjeđi oblik CSA. Pojavljuje se kod bolesnika koji imaju sekundarno uvjetovanu alveolarnu hipoventilaciju (centralne lezije, neuromišićne bolesti, deformacije prsnoga koša) koja se tijekom budnoga stanja kompenzira voljnim stimulansima za disanje što izostaje tijekom spavanja pa bolesnici ulaze u apnoične faze.
Klinička slika. Simptomi i znakovi slični su onima uzrokovanima opstruktivnom apnejom u snu. Dominiraju isprekidano spavanje, dnevna pospanost, glavobolje i gubitak koncentracije uz sniženo, depresivno raspoloženje. Kao i kod opstruktivne apneje u snu, i ovim bolesnicima prijete dugoročne posljedice, kao što su razvoj plućne hipertenzije, kroničnoga plućnog srca te kardiovaskularni incidenti.
Dijagnoza se postavlja na osnovi anamnestičkih podataka te polisomografije. U ovom slučaju registira se apnoična faza tijekom spavanja, ali koja nije praćena odgovarajućim pojačanim respiracijskim naporom.
Liječenje se sastoji od liječenja primarne bolesti, općih mjera (izbjegavanje depresora središnjega živčanog sustava), primjene neinvazivne mehaničke ventilacije, a kod nekih bolesnika u obzir dolazi i elektrostimulacija freničnoga živca tijekom spavanja.
RESPIRATORNA INSUFICIJENCIJA
Definicija. Respiratorna insuficijencija definira se kao stanje nedovoljne i neodgovarajuće minutne ventilacije potrebne da bi se zadovoljila odgovarajuća oksigenacija tkiva i organa te kako bi se eliminirao ugljični dioksid stvoren u procesu metabolizma. Prema nastupu, kliničkim karakteristikama te načinu liječenja razlikujemo akutnu i kroničnu respiratornu insuficijenciju.
Opća patofiziologija. Respiratorna insuficijencija može nastati na jedan od navedenih pet načina: alveolarna hipoventilacija, nesklad ventilacije i perfuzije, postojanje intrapulmonalnoga desno-lijevog spoja (šant), smanjena difuzija plinova ili udisanje zraka sa smanjenim postotkom kisika.
Alveolarna hipoventilacija označava stanje nedovoljnoga disanja pri čemu je minutna ventilacija značajno snižena te dovodi do smanjenja PaO2 (hipoksemija) te povišenja PaCO2 (hiperkapnija) u arterijskoj krvi. Ona može biti posljedica uzroka na više razina: bolesti središnjega živčanog sustava koje zahvaćaju centar za disanje (upale, tumori, traume), bolesti kralješnične moždine (trauma, bolesti motoneurona), bolesti ekspiracijskih mišića (mijastenija gravis, mišićna distrofija, miopatije), bolesti stijenke prsnoga koša (kifoskolioza, ankilozirajući spondilitis) te bolesti dišnih puteva (kronična opstruktivna plućna bolest, bronhalna astma, stenoze).
Nesklad ventilacije i perfuzije označava nesrazmjer između protoka krvi kroz kapilarnu mrežu alveola te njihove ventilacije. Poremećaj se može očitovati u dva oblika: a) ventilacija smanjena u odnosu na perfuziju (smanjen protok zraka kroz dišne puteve – bronhalna astma, kronični bronhitis) te b) ventilacija povećana u odnosu na perfuziju (plućna embolija, emfizem pluća). Posljedica ovih poremećaja je hipoksemija koja aktivira i potiče centar za disanje što rezultira pojačanom minutnom ventilacijom pa je PaCO2 uredan ili snižen.
Intrapulmonalni desno-lijevi spoj (šant) označava situaciju u kojoj dolazi do miješanja neoksigenirane s oksigeniranom krvlju. Nastaje kao posljedica očuvanoga protoka krvi kroz kapilare alveola koje nisu ventilirane (atelektaza, opsežna pneumonija). Ako je patološkim procesom zahvaćeno do 50 % pluća javlja se samo hipoksemija, a ako je zahvaćeno više od 50 %, uz hipoksemiju se javlja i hiperkapnija.
Smanjena perfuzija plinova (kisik, ugljični dioksid) rezultat je poremećaja na razini alveolokapilarne membrane što se javlja u bolestima plućnoga intersticija.
Smanjena koncentracija kisika u udahnutome zraku može biti uzrok hipoksemije, ali se ona u kliničkoj praksi rijetko susreće. Obično se radi o boravku na velikim nadmorskim visinama ili udisanju toksičnih plinova (ugljični monoksid).
KRONIČNA RESPIRATORNA INSUFICIJENCIJA
Definicija. Kronična respiratorna insuficijencija (KRI) definira se kao postupno, progresivno pogoršanje respiratorne funkcije koje se manifestira izoliranom hipoksemijom ili kombinacijom hipoksemije i hiperkapnije, a posljedica je kroničnih bolesti i stanja koja pogađaju organe koji sudjeluju u procesu disanja.
Etiologija. Najčešći uzroci kronične respiratorne insuficijencije su: 1) opstruktivne plućne bolesti (kronična opstruktivna plućna bolest, bronhalna astma, bronhiektazije), 2) restriktivne plućne bolesti i poremećaji difuzije (neuromuskularne bolesti, anomalije prsnoga koša, bolesti plućnoga intersticija) te 3) bolesti plućne cirkulacije (plućna hipertenzija, kronična plućna embolija). U kliničkoj je praksi najčešći uzrok kronične respiratorne insuficijencije kronična opstruktivna plućna bolest.
Klasifikacija. Kronična respiratorna insuficijencija može biti latentna, koja se očituje hipoksemijom pri naporu, dok su nalazi plinova u arterijskoj krvi u mirovanju uredni, te manifestna, koja je prisutna i u mirovanju. Nadalje, manifestna KRI može biti parcijalna – očituje se hipoksemijom, dok je PaCO2 uredan ili snižen; te globalna pri kojoj nalazimo hipoksemiju i hiperkapniju. Globalna KRI može biti kompenzirana (uredan pH zbog bubrega koji kompenziraju poremećaj pojačanom reasorpcijom bikarbonata zbog čega su oni povišeni) te dekompenzirana kod koje nalazimo respiracijsku acidozu, a obično je posljedica akutizacije kronične respiratorne insuficijencije.
Klinička slika. Glavna karakteristika kronične respiratorne insuficijencije je postupan početak i pogoršanje tijekom dužega vremenskog intervala. Početno dominiraju simptomi i znakovi uzročne bolesti. Prvotno su simptomi prisutni samo pri naporu (latentna KRI), a kasnije i u mirovanju (manifestna KRI).
Osnovni simptomi KRI-a su dispneja koja može biti praćena i drugim respiratornim simptomima, ovisno o etiologiji (kašalj, iskašljavanje, hemoptoze, bol), te posljedična neuropsihijatrijska i kardiocirkulacijska očitovanja.
Neuropsihijatrijske manifestacije KRI-a su umor, glavobolja, manjak koncentracije i intelektualnih sposobnosti, letargija, depresivno raspoloženje i sl. Bolesnici kod jake hipoksije razvijaju najprije kvalitativne poremećaje svijesti (npr. agitiranost, suženo stanje svijesti), a kasnije i kvantitativne (somnolencija, sopor, koma).
Kardiocirkulacijske mainfestacije KRI-a uključuju tahiaritmije, poremećaje krvnoga tlaka te simptome i znakove kroničnoga plućnog srca (nabrekle vene vrata, hepatomegalija, ascites, periferni edemi).
Dijagnoza kronične respiratorne insuficijencije postavlja se na osnovi anamnestičkih podataka, kliničkoga pregleda (auskultacija i perkusija, pluća, akrocijanoza, batićasti prsti, bačvasti prsni koš i dr.) te analize plinskih analiza arterijske krvi i acidobaznoga statusa (Tablica 2.26.). Ostala dijagnostika (radiološka, invazivna, testovi plućne funkcije) ovisi o uzročnoj bolesti.
|
Tablica 2.26. Najčešći nalazi ABS-a kod KRI-a
|
|
Oblik KRI –a
|
PaO2
|
PaCO2
|
pH
|
HCO3
|
|
Latentna KRI
|
↓ (napor)
|
Uredan
|
Uredan
|
Uredan
|
|
Manifestna KRI – parcijalna
|
↓
|
Uredan ili ↓
|
Uredan
|
Uredan
|
|
Manifestna KRI – globalna, kompenzirana
|
↓
|
↑
|
Uredan
|
↑
|
|
Manifestna KRI – globalna, dekompenzirana
|
↓
|
↑
|
↓
|
↓
|
Liječenje se temelji na uzroku (etiološko liječenje). Simptomatsko liječenje kronične respiratorne insuficijencije je ograničenoga dosega, a uključuje respiracijsku fizioterapiju, oksigenoterapiju, oblike mehaničke ventilacije te primjenu farmakoloških stimulanasa respiracije (doksapram 1,5 - 4 mg/min kontinuirano intrevsnki).
Prognoza bolesnika s kroničnom respiratornom insuficijencijom je loša, s obzirom na to da se radi o progresivnoj bolesti. Medijan preživljenja bolesnika s manifestnom kroničnom respiratornom insuficijencijom i znacima kroničnoga plućnog srca iznosi oko četiri do pet godina.
AKUTNA RESPIRATORNA INSUFICIJENCIJA
Definicija. Akutna respiratorna insuficijencija predstavlja naglo nastao poremećaj respiratorne funkcije koji može nastati uslijed različitih bolesti i stanja, a klasično se prema etiopatogenezi dijeli na akutnu respiratornu insuficijenciju tipa I (hipoksemični tip) te akutnu respiratornu insuficijenciju tipa II (hiperkapnijski tip) kako je prikazano u Tablici 2.27.
Akutna respiratorna insuficijencija tipa I (hipoksemički tip) nastaje uslijed poremećaja na razini alveokapilarne membrane zbog čega dolazi do poremećaja oksigenacije što se u prvom redu očituje razvojem hipoksemije koja se definira sniženjem parcijalnoga tlaka ugljičnoga dioksida u arterijskoj krvi na vrijednosti manje od 8 kPa. Razlog zbog kojega se pri bolesti alveokapilarne membrane primarno razvija hipoksemija, a ne i hiperkapnija, leži u činjenici da je kisik slabije topljiv. Kao takav, on teže difundira kroz zadebljalu i edematoznu, patološki promijenjenu membranu, za razliku od ugljičnoga dioksida kojeg karakterizira bolja topljivost pa je njegova difuzija očuvana i u uvjetima patološki promijenjene alveokapilarne membrane te se hiperkapnija neće razviti sve dok i ventilacija ne bude ugrožena, što se javlja kasnije u tijeku bolesti kao posljedica zamora pri disanju i pojačanoga dišnog rada.
Akutna respiratorna insuficijencija tipa II (hiperkapnijski tip) nastaje kao posljedica poremećaja na razini protoka zraka kroz dišne puteve, bilo zbog bolesti samih dišnih puteva, bilo zbog bolesti koje pogađaju mehaniku disanja, kao što su poremećaji stijenke prsnoga koša, neuromišićne bolesti te bolesti i poremećaji središnjega živčanog sustava. Temeljno kliničko očitovanje ovoga tipa respiratorne insuficijencije je hiperkapnija, dok hipoksemija može biti prisutna u kasnijem tijeku bolesti. Razlog pojavi hiperkapnije u odsutnosti hipoksemije kod ovih bolesnika leži u koncentracijskom gradijentu kisika. Naime, uslijed hipoventilacije dolazi do nakupljanja ugljičnoga dioksida u alveolama (slabije se eliminira iz njih) što uvjetuje smanjenje koncentracijskoga gradijenta između ugljičnoga dioksida u alveolama i ugljičnoga dioksida u kapilarama, pa je time oslabljena i njegova difuzija te se on posljedično nakuplja u krvi i dolazi do razvoja hipoksemije. S obzirom na udio kisika u atmosferskom zraku, njegova koncentracija u alveolama ostaje dostatna i u uvjetima hipoventilacije što osigurava dostatan koncentracijskih gradijent da bi difuzija kisika ostala zadovoljavajuća i u tim uvjetima.
|
Tablica 2.27. Etiologija akutne respiratorne insuficijencije
|
|
Akutna respiratorna insuficijencija tipa I
|
Akutna respiratorna insuficijencija tipa II
|
|
Kardiogeni edem pluća
Pneumonija
Difuzna alveolarna hemoragija
Plućna fibroza
|
Kronična opstruktivna plućna bolest
Teška astma
Akutna neuromišićna slabost
Sedacija i ozljede središnjeg živčanoga sustava
|
Klinička slika i dijagnoza. Kod bolesnika dominiraju simptomi i znakovi osnovne bolesti uz razvoj dispneje i njezinih vanjskih mainfestacija (tahipneja, cijanoza, disanje pomoćnom muskulaturom). Osim toga, bolesnici postaju agitirani i konfuzni, a kasnije mogu razviti i teži poremećaj stanja svijesti. Također, prisutna je i tahikardija (kompenzacijski mehanizam) te arterijska hipotenzija. Osnovu dijagnoze čine klinički pregled, plinska analiza arterijske krvi te pregledni radiogram srca i pluća. Daljnji dijagnostički postupak usmjeren je ovisno o bolesti ili stanju na koje se sumnja i koje se nalazi u pozadini.
Liječenje akutne respiratorne insuficijencije u prvom je redu usmjereno na liječenje uzročne bolesti. Stabilizacija respiratorne funkcije ovisno o njezinoj težini postiže se primjenom kisika (oksigenoterapija), neinvazivnom mehaničkom ventilacijom ili u najtežim slučajevima intubacijom i invazivnom mehaničkom ventilacijom.
Tumori pluća mogu biti primarni (benigni ili maligni) te sekundarni (metastaze). Najčešći primarni tumor pluća je karcinom pluća, a ostali rjeđi primarni tumori su karcinoid, adenoid-cistični karcinom, mukoepidermoidni karcinom te hamartom.
KARCINOM PLUĆA
Definicija. Karcinom pluća naziv je za zloćudni tumor nastao malignom transformacijom i proliferacijom epitelnih stanica dišnih puteva (bronhi, bronhioli, alveole). Odlikuje ga polagan i podmukao rast, kasna dijagnostika te loša prognoza.
Epidemiologija. U Republici Hrvatskoj karcinom pluća nalazi se na prvom mjestu po učestalosti kod muškaraca, dok je kod žena na trećem mjestu. Karcinom pluća odlikuje najveća stopa smrtnosti u odnosu na ostale karcinome. Pojavnost ovoga tumora rijetka je prije 40. godine, a zatim raste do 80. godine kada se bilježi ponovni pad učestalosti. Najčešća dob za pojavu ovoga karcinoma je između 60. i 65. godine. S obzirom na spol, karcinom pluća češći je kod muškaraca nego kod žena s omjerom 5:1. Učestalost karcinoma pluća prati trend pušenja, pa se u zemljama sa stopom pušenja u padu primjećuje i pad učestalosti toga karcinoma, dok se u zemljama u kojima je trend pušenja povećan javlja i porast učestalosti karcinoma pluća. Godišnje se u Republici Hrvatskoj dijagnosticira više od 2900 novih slučajeva karcinoma pluća, dok od njega umre oko 2800 bolesnika. Prema stopi smrtnosti, od karcinoma pluća umre više ljudi nego od karcinoma debeloga crijeva, dojke, prostate i gušterače zajedno. Temeljni razlog tome je ograničena rana dijagnostika (ne postoje odgovarajući testovi za rano otkrivanje bolesti), pa se često dijagnosticira u uznapredovalim fazama bolesti (samo kod 5 do 15 % bolesnika bolest se otkrije u asimptomatskoj fazi).
Etiopatogeneza. Karcinom pluća nastaje interakcijom genetske predispozicije i vanjskih (egzogenih) čimbenika, iako točan i jasan etiopatogenetski mehanizam nije poznat. Pušenje predstavlja glavni rizični čimbenik za nastanak karcinoma pluća i preko 90 % slučajeva povezano je s pušenjem.
Genetska predispozicija. Danas se zna da presudnu ulogu u malignoj transformaciji i proliferaciji stanica imaju genetske promjene koje uključuju aktivaciju onkogena (geni koji stimuliraju proliferaciju i tumorsku transformaciju, npr. MYC, RAS, BLC) i/ili inaktivaciju tumor-supresorskih gena (geni čiji gubitak funkcije uvjetuje nastanak tumora, npr. p53, RB). Te su genetske promjene dijelom nasljedno uvjetovane, a dijelom su rezultat djelovanja egzogenih čimbenika (kancerogena). U prilog tezi da su neke genetske promjene nasljedno uvjetovane govori činjenica da rođaci osobe oboljele od karcinoma pluća u prvom koljenu imaju dva ili tri puta viši rizik za oboljenje od njega, čak i ako se radi o nepušačima. S obzirom na to da ove genetske promjene rezultiraju malignom transformacijom, kao i daljnjom proliferacijom stanica, nazivaju se pogonskim mutacijama (engl. driver mutations). Do danas je poznato više takvih mutacija, a najpoznatije su EGFR (10 - 35 %), KRAS (15 - 25 %), ALK (3 - 7 %), HER2 (2 - 4 %), BRAF (1 - 3 %), ROS 1 (1 - 3 %) i drugi (Tablica 2.28.). Poznavanje i određivanje ovih mutacija danas ima ulogu i u samom procesu liječenja (primjena tzv. pametnih lijekova), kao i u predviđanju prognoze bolesti.
|
Tablica 2.28. Statistički značajne genetske mutacije koje se pojavljuju u pojedinim vrstama karcinoma pluća
|
|
Adenokarcinom
|
Planocelularni karcinom
|
Mikrocelularni karcinom
|
|
TP53, KRAS, KEAP1, STK11, EGFR, NF1, BRAF, SETD2, RBM10, MGA, MET, ARID1A, PIK3CA, SMARCA4, RB1, CDKN2A, U2AF1, RIT1
|
TP53, CDKN2A, PTEN, PIK3CA, KEAP1, MLL2, HLA-A, NFE2L2, NOTCH1, RB1, PDYN
|
SOX2, RLF-MYCL1, CREBBP, EP300, MLL
|
Pušenje. Nepušačem se smatra osoba koja je u životu popušila manje od 100 cigareta, dok svi ostali ulaze u kategoriju pušača. Cigaretni dim sadržava nekoliko tisuća kemijskih sastojaka od kojih neki imaju jasno dokazan kancerogeni učinak (nikotin, ugljični monoksid, spojevi katrana). Pušenje je odgovorno za preko 90 % slučajeva karcinoma pluća kod muškaraca i 80 % slučajeva kod žena. Pušači imaju dokazano deseterostruko veći rizik za obolijevanje od karcinoma pluća u odnosu na nepušače. Rizik je direktno povezan s dnevnim brojem popušenih cigareta, duljinom pušačkoga staža te količinom katrana i nikotina u cigaretama. U razvoju karcinoma pluća veću ulogu ima duljina pušačkoga staža u odnosu na dnevni broj popušenih cigareta. Rizik od razvoja karcinoma pluća ostaje i do petnaest do dvadeset godina od prestanka pušenja. Također, postoji i spolna razlika u osjetljivosti na kancerogene iz duhanskoga dima tako da žene pokazuju veću osjetljivost te time imaju i veći rizik (smatra se da je to posljedica razlike u mehanizmima popravka molekule DNA). Pasivno pušenje („okolinski duhanski dim“) također predstavlja rizični čimbenik za razvoj karcinom pluća te se smatra da je 25 % karcinoma pluća povezano s pasivnim pušenjem (pasivni pušači imaju 1,5 puta veći rizik za nastanak karcinoma pluća u odnosu na nepušače).
Izloženost okolišnim čimbenicima. Osim pušenja, kronična izloženost drugim inhalacijskim čimbenicima također može biti rizični čimbenik za razvoj karcinoma pluća. Najznačajniji su azbest, arsen, nikal, krom, formaldehid, vinil-klorid, radon te policiklički ugljikovodici. Izloženost navedenim spojevima danas je većinom povezana uz određena radna mjesta, no njihova povećana koncentracija bilježi se i u ispušnim plinovima automobila, tvornica i sl. Time se i tumači veća učestalost karcinoma pluća na područjima s većom stopom zagađenosti zraka.
Prijašnje plućne bolesti. Neke kronične nemaligne bolesti pluća kao što su kronična opstruktivna plućna bolest, idiopatska plućna fibroza, tuberkuloza i sl. povezane su s većom učestalošću pojavnosti karcinoma pluća. Kod tih stanja bilježi se razvoj karcinoma u području ožiljaka.
Ostali rizični čimbenici. Prehrana siromašna prirodnim antioksidansima (voće, povrće) te bogata zasićenim masnim kiselinama pogoduje razvoju karcinoma pluća. Veća učestalost karcinoma primjećena je i kod HIV-pozitivnih bolesnika. Izloženost radijacijskom zračenju također povećava rizik.
Patogeneza. Osnovni događaj u nastanku karcinoma pluća je maligna transformacija normalne stanice. Ona je posljedica genetskih promjena koje dovode do gubitka normalnih mehanizama koji kontroliraju rast i razmnožavanje stanice. Genetske promjene mogu biti nasljedne i/ili potaknute vanjskim čimbenicima. S obzirom na to da molekula DNA ima vlastite reparacijske mehanizme, nastanak mutacije nastaje kada štetni utjecaji nadjačaju njezinu reparacijsku sposobnost. Genetske promjene uključuju aktivaciju protoonkogena koji postaju onkogeni ili inaktivaciju tumor-supresorskih gena. Tako nastala maligna stanica počinje se nekontrolirano dijeliti i umnažati stvarajući nove klonove koji su također skloni genetskim promjenama i progresiji. Konačno nastaje tumorska masa koja ima sposobnost invazije okolnoga tkiva, neoangiogeneze te metastaziranja.
Patologija. Prema lokalizaciji razlikujemo tri tipa karcinoma pluća, centralni koji nastaje iz glavnih bronha, periferni koji nastaje iz bronhiola te difuzno-infiltrativni koji nastaje iz alveola i širi se njihovom površinom. Histološki razlikujemo četiri osnovna tipa: karcinom malih stanica, adenokarcinom, planocelularni karcinom te karcinom velikih stanica. Njihovo međusobno razlikovanje temelji se na histološkom pregledu svjetlosnim mikroskopom te dodatnim imunohistokemijskim metodama.
Adenokarcinom čini 35 do 40 % svih karcinoma pluća, a nastaje iz žljezdanih stanica bronhalne stijenke te ima očuvanu sposobnost lučenja sluzi. To je ujedno najčešći tip karcinoma pluća kod nepušača. Najčešće je periferne lokalizacije i kao takav je često povezan s nastankom malignih pleuralnih izljeva. Histološki ga karakterizira acinarna ili tubularna struktura te produkcija sluzi. Prema novoj klasifikaciji Svjetske zdravstvene organizacije iz 2015. godine, adenokarcinomi se dijele u tri podskupine: adenokarcinom in situ (promjer tumora manji od 3 cm, bez invazije), minimalno invazivni adenokarcinom (promjer tumora manji od 3 cm, ali s invazijom do 5 mm) te invazivni adenokarcinom (promjer tumora veći od 3 cm i invazija veća od 5 mm). Invazivni karcinom ima nekoliko podvrsta na temelju histoloških karakteristika: lepidični, papilarni, acinarni, mikropapilarni te solidni tip. Adeonarcinom in situ i minimalno invazivni adenokarcinom imaju gotovo 100 %-tno petogodišnje preživljenje kada se kirurški odstrane, dok invazivni adenokarcinom ima lošiju prognozu, ali među njima lepidični tip ima najbolju prognozu, acinarni i papilarni srednje dobru prognozu, a mikropapilarni i solidni lošu prognozu. Prema toj istoj klasifikaciji ranije upotrebljavan termin kao podvrsta adenokarcinoma - bronhoalveolarni karcinom se napušta.
Planocelularni karcinom čini 25 do 35 % svih karcinoma pluća, a nastaje iz epitelnih stanica velikih bronha pa ima karakterističnu centralnu lokalizaciju. Makroskopski se opisuje kao velika tumorska masa, neoštro ograničena od okolnoga tkiva s centralnom nekrozom i kavitacijama. Glavne histološke karakteristike su mu keratinizacija te intracelularna premoštavanja. S obzirom na to da tumor sporije raste u odnosu na ostale karcinome pluća, ima najnižu stopu metastaziranja u trenu postavljanja dijagnoze. Prema novoj se klasifikaciji planocelularni karcinom dijeli u četiri podskupine: planocelularni karcinom in situ, keratinizirajući, nekeratinizirajući te bazaloidni planocelularni karcinom.
Karcinom velikih stanica ili krupnostanični karcinom čini 10 do 15 % svih plućnih karcinoma, a također je epitelnoga porijekla. Makroskopski se prezentira kao periferno smještena tumorska masa, a histološki ga karakteriziraju velike, atipične stanice bez keratinizacije (što je karakteristično za planocelularni karcinom) ili žljezdane strukture (što je tipično za adenokarcinom).
Karcinom malih stanica ili mikrocelularni karcinom čini 15 % svih karcinoma pluća i ima snažnu povezanost s pušenjem, a potječe od plućnih neuroendokrinih stanica (APDU stanice) te zadržava sposobnost lučenja različitih polipeptida koji su zaslužni za različite paraneoplastične sindrome. Obično je centralne lokalizacije (perihilarno) i karakteriziraju ga brz rast i brzo metastaziranje. Histološki je tumor izgrađen od malih stanica s oskudnom citoplazmom i nepravilnim rubovima, fino granuliranim kromatinom te visokim stupnjem mitotičke aktivnosti.
U kliničkoj praksi karcinome pluća dijelimo u dvije skupine s obzirom na njihovo biološko ponašanje i liječenje: karcinom malih stanica (15 % svih karcinoma pluća) koji je izrazito agresivan i loše reagira na liječenje; karcinom nemalih stanica koji obuhvaća adenokarcinom, planocelularni karcinom i karcinom velikih stanica (85 % svih karcinoma pluća), koji imaju nešto bolji odgovor na onkološko liječenje.
Klinička slika. Karcinom pluća karakterizira dug asimptomatski period i kod pojave prvih simptoma bolest je obično u uznapredovaloj fazi. U kliničkoj slici dominiraju nespecifični simptomi, specifični simptomi i znakovi vezani uz destrukciju plućnoga parenhima (kašalj, bol, krvarenja, dispneja) ili okolnih intratorakalnih struktura (tzv. intratorakalni simptomi) te simptomi i znakovi udaljenih metastaza ili paraneoplastičkoga zbivanja.
Nespecifični simptomi kao što su umor, malaksalost, anoreksija i gubitak na težini, febrilnost i slabost prisutni su kod oko 30 % bolesnika s karcinomom pluća. Oni se obično javljaju u kasnijoj fazi bolesti i nisu specifični.
Specifični, plućni simptomi su kašalj, hemoptoa i hemoptiza, učestale dišne infekcije, dispneja i bol. Kašalj se javi kod 75 % bolesnika, uporan je i traje duže od mjesec dana. Na karcinom pluća treba posumnjati ako se javi kašalj koji traje duže od mjesec dana bez jasne etiologije ili kod promjena intenziteta kašlja kod bolesnika s KOPB-om. Hemoptize ili hemoptoa također su česti i zahtijevaju hitnu obradu, osobito ako su udruženi s drugim alarmantnim simptomima (kašalj, gubitak na težini i sl.). Učestale dišne infekcije nastaju uslijed sužavanja lumena bronha, nakupljanja sekreta i kolonizacije bakterija, a pogoduju i oslabljeni mehanizmi obrane. Dispneja se početno javlja samo pri naporu, a kasnije i u mirovanju. Bol se kod centralno smještenoga tumora javlja kasnije i mukloga je karaktera, a nastaje širenjem tumorske mase u medijastinum, dok se kod perifernih tumora javlja ranije zbog ranijega zahvaćanja pleure i torakalne stijenke, a karakterizira ga pojačanje u inspiriju (pleuralna bol). Karcinomi centralne lokalizacije obično imaju izraženije respiracijske sindrome. Također, na karcinom pluća može ukazivati i opetovana pojava upale pluća iste lokalizacije.
Intratorakalni simptomi. Pancoastov sindrom javlja se kod apikalno smještenih tumora, a dovodi do razaranja rebara i torakalnih kralješaka, a zahvaća i brahijalni pleksus pa nastaje jak i intenzivan bol koji se širi u ruku. Hornerov sindrom nastaje uslijed zahvaćenosti simpatičkoga lanca, a očituje se kao istostrana mioza, ptoza i endoftalmus. Česti su i kompresivni sindromi: sindrom gornje šuplje vene (edem i cijanoza glave i vrata), kompresija traheje (kašalj, zaduha, stridor), kompresija jednjaka (disfagija, odinofagija te mogući nastanak fistula), kompresija n. laringeusa rekurensa (promuklost), kompresija n. frenikusa (paraliza dijafragme i posljedično otežano disanje). Mogu se javiti i pleuralni te perikadijalni izljev s odgovarajućim kliničkim očitovanjima.
Metastatski simptomi. Metastaze u jetri očituju se kao hepatomegalija, bolnost ispod desnim rebrenim lukom, ikterus te ascites. Zahvaćenost nadbubrežnih žlijezda očituje se kao slabost, hipotenzija i hiperpigmentacija kože. Koštane metastaze dovode do jake bolnosti, patoloških fraktura, a u laboratorijskim nalazima nalazimo povišenje alkalne fosfataze i kalcija. Moždane metastaze uzrokuju glavobolje, mučninu, povraćanje, gubitak vida, epileptičke napadaje te poremećaj svijesti.
Paraneoplastični sindromi su različiti. Koštano-mišićni su osteomalacija, miopatija te hipertrofična osteoartropatija. Kožni su pruritis i hiperpigmentacija. Česti su endokrini paraneoplastički sindromi kao što je Cushingov sindrom, hiperkalcijemija, ginekomastija i galaktoreja. U živčanom sustavu mogu se javiti periferna neuropatija, encefalopatija i psihoza. Ostali su flebotromboza (Trosseauov sindrom), kaheksija, nefrotski sindrom i drugi.
Dijagnoza. Dijagnostički postupak kod bolesnika s karcinomom pluća sastoji se od dva dijela: dokazivanja samoga karcinoma i određivanja njegova histološkoga tipa te od procjene proširenosti samoga tumora, ako je on dokazan. Dijagnoza karcinoma pluća potvrđuje se na osnovi patohistološkoga i/ili citološkoga (alternativno) nalaza. Uzorak za patohistološku analizu dobiva se biopsijom tumorskoga tkiva bronhoskopskim ili transtorakalnim putem (pod kontrolom CT-a ili UZV-a), dok se citološka analiza može provoditi na temelju više uzoraka (iskašljaj, bronhoskopski uzorci - ispirak, otisak, obrisak četkicom, transtorakalna punkcija, analiza pleuralnoga izljeva i sl.). Standardna obrada bolesnika kod sumnje na karcinom pluća uključuje dobro uzetu anamnezu, osnovne laboratorijske nalaze, radiološku dijagnostiku, citološku analizu sputuma, određivanje tumorskih markera te invazivnu dijagnostičku obradu s ciljem prikaza i uzimanja tkiva za histološku analizu (bronhoskopija, transtorakalna biopsija). Kada se dokaže karcinom i odredi njegov histološki tip, potrebna je dijagnostička obrada s ciljem procjene proširenosti bolesti (engl. staging). U tu se svrhu koriste endoskopski ultrazvuk i punkcija intratorakalnih limfnih čvorova, PET-CT, UZV i/ili CT abdomena, CT mozga, scintigrafija kosti i druge pretrage ovisno o indikaciji. S obzirom na razvoj novih lijekova za liječenje karcinoma pluća za određene histološke tipove (karcinomi nemalih stanica), potrebno je provesti molekularnu dijagnostiku na specifične genetske promjene i proteine (EGFR, ALK, PD-L1). Popis pretraga kod dijagnostičke obrade bolesnika s karcinomom pluća navedne su u Tablici 2.29.
|
Tablica 2.29. Popis pretraga kod dijagnostičke obrade bolesnika s karcinomom pluća
|
|
Dijagnostičke metode za dokazivanje karcinoma pluća
|
Dijagnostičke metode za procjenu proširenosti karcinoma pluća
|
Dodatne dijagnostičke metode kod karcinoma pluća
|
|
Klasični RTG srca i pluća
Citološki pregled sputuma
Tumorski markeri
CT/MRI prsnoga koša
Bronhoskopija s biopsijom
Transtorakalna biopsija pluća
|
CT ili UZV abdomena
CT ili MRI mozga
Scintigrafija kosti
PET-CT
Punkcija uvećanih limfnih čvorova
Punkcija pleuralnoga izljeva
|
Molekularna dijagnostika mutacija
Spirometrija
|
Anamneza i fizikalni pregled. Uporan kašalj koji traje duže vrijeme, a koji se ne može povezati s drugim uzrocima, kao i promjena intenziteta kašlja kod bolesnika s kroničnom opstruktivnom bolesti, zajedno s podatkom o pogoršanju općeg stanja, naglom mršavljenju te anamnezom pozitivnom na pušenje trebaju pobuditi sumnju na moguću neoplazmu pluća. Fizikalni nalaz je nespecifičan i ovisi o stadiju bolesti. U kasnijim fazama bolesnici su kahektični, imaju oslabljen ili odsutan šum disanja (osobito kod pleuralnih izljeva) i sl.
Laboratorijski nalazi. Osnovni laboratorijski nalazi mogu biti uredni, a najčešće se zapaža anemija kronične bolesti, anemija uslijed manjka željeza ili pancitopenija. Ostali patološki nalazi koji se javljaju posljedica su ili metastatskoga procesa ili paraneoplastične aktivnosti, a najčešći su hiperkalcijemija, hiponatrijemija te povišeni jetreni enzimi.
Radiološka dijagnostika. Konvencionalni rendgenogram pluća osnovna je dijagnostička pretraga kod sumnje na neoplazmu pluća. Radiološki nalazi koji mogu upućivati na karcinom pluća su plućni nodus, masa ili infiltrat, proširena sjena medijastinuma, atelektaza, uvećanje plućnih hilusa te pleuralni izljevi (Tablica 2.30., Slika 2.19.). Svaka sumnja na karcinom pluća zahtijeva kompjuteriziranu tomografiju. CT, osim za svrhu dijagnostike samoga tumora, ima ulogu i u određivanju proširenosti bolesti. Često se već na osnovi CT nalaza može utvrditi razlika između karcinoma malih i nemalih stanica (perihilarni infiltrat uz masivnu medijastinalnu limfadenopatiju i znakovi invazije medijastinuma karakteristični su nalaz za karcinom malih stanica). Kod izvođenja CT prsnoga koša obično se skenira i gornji dio trbuha tako da se prikažu jetra i nadbubrežne žlijezde, s obzirom na to da su one najčešće sijelo metastatskih promjena.
|
Tablica 2.30. Radiološki znakovi karcinoma pluća
|
|
Radiološki znakovi cetralne lokalizacije
|
Radiološki znakovi periferne lokalizacije
|
|
Jednostrano uvećanje hilusa
Paradoksalno malen plućni hilus
Atelektaza
Pneumonija
Hiperinflacija
Spotani pneumotoraks
|
Okrugle sjene i infiltrati
Segmentalne i subsegmentalne atalektaze
Infiltrativne sjene
Infiltrati s destrukcijama
Hilarna limfadenopatija
|
Slika 2.19. Radiološki nalaz tumorske tvorbe suprahilarno desno
Citološka analiza sputuma je jednostavna i jeftina pretraga koja se izvodi kod sumnje na karcinom pluća, ali njezin nalaz treba tumačiti s oprezom. Pozitivan nalaz na maligne stanice obično se otkrije kod bolesnika s velikim, centralno smještenim tumorskim masama (planocelularni karcinom, mikrocelularni karcinom), dok je kod ostalih oblika uglavnom negativan. Dakle, takav negativan nalaz ne isključuje dijagnozu karcinoma pluća. Kod izvođenja ove pretrage uvijek se analiziraju bar tri uzorka iskašljaja (obično prvi jutarnji sputum kroz tri dana). Osim sputuma, citološki se mogu analizirati i drugi uzorci, kao što su pleuralni punktat ili uzorci dobiveni bronhoskopijom (bris čestkicom, aspirat) ili nekom drugom punkcijom.
Tumorski markeri. U dijagnostici, ali i terapijskom praćenju bolesnika dostupno je nekoliko tumorskih markera: CEA (karcinoembrijski antigen) može upućivati na adenokarcinom, CYFRA 21-1 i SSC (engl. squamos cell carcinoma antigen) na planocelularni karcinom te NSE (neuron specifična enolaza) na mikrocelularni karcinom. Porast tih markera možemo naći i u nekim drugim malignim (neuroblastom, pankreas) i nemalignim bolestima (bolesti jetre, zatajenje bubrega), što treba imati na umu kod tumačenja ovih nalaza. Također, negativne vrijednosti ne isključuju dijagnozu karcinoma pluća. Izrazito povišene vrijednosti ovih markera mogu dobro korelirati s napredovanjem bolesti.
Bronhoskopija je metoda izbora u dijagnostici centralno smještenih tumora. Ona omogućava vizualizaciju bronha te uočavanje endobronhalne tumorske mase ili ekstrabronhalnih kompresija, kao i dobivanje različitih uzoraka za citološku i/ili histološku dijagnostiku (izravna biopsija kliještima, transbronhalna iglena biopsija, bris četkicom, ispirak i sl.). Tumori koji se vizualiziraju unutar 2 cm od karine, tj. ulaska u glavni bronh su u startu inoperabilni jer se ne može postići odgovarajući resekcijski rub. Proširena i zaravnjena karina ukazuje na supkarinalnu limfadenopatiju te se preporuča transbronhalna iglena biopsija „na slijepo“. Iako bronhoskopija s biopsijom ima visoku osjetljivost za dijagostiku centralnih tumora (oko 90 %), negativan histološki ili citološki nalaz ne mora ujedno značiti i isključivanje dijagoze karcinoma te se preporuča ponoviti pretragu i uzorkovanje.
Transtorakalna biopsija pluća preferira se u dijagnostici periferno smještenih tumora koji nisu dostupni bronhoskopskom pregledu i uzorkovanju. Izvodi se uz pomoć igle pod kontrolom ultrazvuka ili CT-a. Dobiveni uzorci mogu se citološki i histološki analizirati. Glavno ograničenje za izvođenje pretrage je anatomska lokalizacija tumora, kao i moguće komplikacije (pneumotoraks, krvarenje). Učestalost lažno negativnih rezultata kreće se oko 30 %.
Pleuralna punkcija indicira se kod svih bolesnika s pleuralnim izljevom. Punktat je obično lagano hemoragičan, prema biokemijskom sastavu pripada skupini eksudata, a citološki se nalaze atipične maligne stanice. Citološki nalaz negativan na maligne stanice ne isključuje dijagnozu karcinoma.
Endoskopski ultrazvuk ima ulogu u procjeni intratorakalne proširenosti bolesti. Najčešće se provodi s ciljem ispitivanja medijastinalnih masa i limfnih čvorova. U tu se svrhu izvode EUS-FNA (engl. transoesophageal ultrasound-guided fine needle aspiration) i EBUS-TBNA (engl. endobronchial ultrasound-guided transbronchial needle aspiration).
Ostale invazivne dijagnostičke metode uključuju video-asistiranu torakoskopiju, otovorenu biopsiju pluća te perkutanu biopsiju ili punkciju periferno dostupnih limfnih čvorova (npr. supraklavikularni).
Molekularna dijagnostika danas je bitna nadopuna histološkoj dijagnostici, s obzirom na to da se u prisutnosti nekih mutacija provodi ciljana terapija (tzv. pametni lijekovi). Kod svih bolesnika s dokazanim karcinomom nemalih stanica preporuča se molekularno testiranje na EGFR mutaciju te ALK i ROS1 translokaciju. Primjena EGFR, ALK i ROS1 inhibitora dokazano poboljšava kliničke ishode kod ovih bolesnika. Mutacije se mogu dokazati iz same tumorske mase, plazme (rijetko) ili pleuralnoga punktata ako postoji dovoljan broj stanica (u određenim količinama tumorsku DNA možemo naći i izvan same tumorske stanice). EGFR , ALK i ROS1 status određuje se svim bolesnicima s neskvamoznim karcinomom nemalih stanica ili miješanim tumorom, kao i kod bolesnika sa skvamoznim karcinomom ako se radi o nepušačima (ili bivši pušači koji su manje pušili - manje od 15 kutija godišnje) i/ili mlađoj životnoj dobi (< 50 godina). Također, određivanje PD-L1 statusa (ligand 1 programirane stanične smrti) danas je bitno u planiranju terapijskom pristupa, tj. procjene opravdanosti imunoterapije.
Ostala dijagnostika. Kod bolesnika s dokazanim karcinomom pluća potrebna je dodatna dijagnostička obrada s ciljem utvrđivanja metastaza, tj. raširenosti bolesti. U tu svrhu izvode se CT ili MRI mozga (moždane metastaze), UZV ili CT abdomena (metastaze jetre, nadbubrežnih žlijezda), scintigrafija kostiju (koštane metastaze) ili PET-CT koji je koristan u dijagnostici mikrometastaza (uočavanje pojačane metaboličke aktivnosti stanica, a najveću vrijednost ima u procjeni metastaza u limfnim čvorovima i koštanom tkivu). CT mozga kao dio obrade indiciran je kod svih bolesnika s karcinomom malih stanica, kao i kod bolesnika s karcinomom nemalih stanica ako se radi o adenokarcinomu (kod ostalih bolesnika se on izvodi samo u slučaju kliničke indikacije, odnosno simptoma). PET-CT je koristan za procjenu statusa limfnih čvorova medijastinuma, kao i za verificiranje metastaza u limfne čvorove i kosti.
Određivanje proširenosti ili „staging“ bolesti. S ciljem usklađivanja terapijskoga pristupa i određivanja prognoze bolesnika s karcinomom pluća, razvijeni su posebni sustavi za proširenost bolesti. Određivanje stadija bolesti kod bolesnika s karcinomom nemalih stanica temelji se na TNM klasifikaciji, kako je to navedeno u Tablici 2.31.
|
Tablica 2.31. Stadiji i TNM klasifikacija karcinoma pluća
|
|
Stadij
|
T
|
N
|
M
|
Tx: primarni tumor se ne može procijeniti ili je tumor dokazan prisutnošću malignih stanica u sputumu ili ispirku, ali se ne vizualizira bronhoskopski ili slikovnim metodama;
T0: bez dokaza postojanja primarnoga tumora;
Tis: karcinom in situ, skvamozni karcinom in situ (SCIS); adenokarcinom in situ (AIS): adenokarcinom s čistom lepidičnom histologijom, ≤ 3 cm u najvećem promjeru;
T1: tumor ≤ 3 cm u najvećem promjeru, okružen plućnim tkivom ili visceralnom pleurom bez bronhoskopski jasnoga širenja proksimalno od lobarnoga bronha, T1mi (minimalno invazivan adenokarcinom - adenokarcinom ≤ 3 cm u najvećem promjeru s dominacijom lepidične histologije i ≤ 5 mm invazije u najvećem promjeru), T1a (tumor ≤ 1 cm u najvećem promjeru), T1b (tumor > 1 cm, ali ≤ 2 cm u najvećem promjeru), T1c (tumor > 2 cm, ali ≤ 3 cm u najvećem promjeru);
T2: tumor > 3 cm, ali ≤ 5 cm ili tumor bilo koje veličine koji zahvaća visceralnu pleuru ili je udružen s atelektazom/opstruktivnim pneumonitisom (ne zahvaćaju cijelo plućno krilo) ili zahvaća glavni bronh bez obzira na udaljenost od karine, ali ne zahvaća karinu, T2a (tumor > 4 cm, ali ≤ 5 cm u najvećem promjeru), T2b (tumor > 4 cm, ali ≤ 5 cm u najvećem promjeru);
T3: tumor > 5 cm, ali ≤ 7 cm u najvećem promjeru ili tumor koji izravno infiltrira neku od navedenih struktura: parijatelnu pleuru (PL3), torakalnu stijenku, frenični živac, parijetalni perikard ili odvojeni primarni tumorski nodusi u istom režnju.
T3: tumor > 7 cm ili tumor bilo koje veličine koji invadira dijafragmu, medijastinum, srce, velike krvne žile, traheju, povratni laringealni živac, jednjak, tijelo kralješka ili karinu ili odvojeni tumorski nodusi u ipsilateralnom režnju koji se razlikuju od primarnih nodusa.
NX: regionalni limfni čvorovi ne mogu se procijeniti;
N0: bez metastaza u regionalnim limfnim čvorovima;
N1: metastaze u ipsilateralne peribronhalne i/ili hilarne limfne čvorove te intrapulmonalne limfne čvorove;
N2: metastaze u ipsilateralne limfne čvorove medijastinuma ili subkarinalne limfne čvorove;
N3: metastaze u kontralateralnim medijastinalnim ili hilarnim limfnim čvorovima ili ipsilateralnim ili kontralateralnim skalenskim i li supraklavikularnim limfnim čvorovima
M0: nema udaljenih metastaza
M1: prisutne udaljene metastaze; M1a (odvojeni tumorski nodus u kontralateralnom režnju, pleuri ili perikardu s izljevima); M1b (solitarna ekstratorakalna metastaza u jednom organu koja ima jedan nodus), M1c (multiple ekstratorakalne metastaze u jedan ili više organa).
|
|
0
|
Tis
|
N0
|
M0
|
|
IA1
|
T1mi
|
N0
|
M0
|
|
T1a
|
N0
|
M0
|
|
IA2
|
T1b
|
N0
|
M0
|
|
IA3
|
T1c
|
N0
|
M0
|
|
IB
|
T2a
|
N0
|
M0
|
|
IIA
|
T2b
|
N0
|
M0
|
|
IIB
|
T1a
|
N1
|
M0
|
|
T1b
|
N1
|
M0
|
|
T1c
|
N1
|
M0
|
|
T2a
|
N1
|
M0
|
|
T2b
|
N1
|
M0
|
|
T3
|
N0
|
M0
|
|
IIIA
|
T1a
|
N2
|
M0
|
|
T1b
|
N2
|
M0
|
|
T1c
|
N2
|
M0
|
|
T2a
|
N2
|
M0
|
|
T2b
|
N2
|
M0
|
|
T3
|
N1
|
M0
|
|
T4
|
N0
|
M0
|
|
T4
|
N1
|
M0
|
|
IIIB
|
T1a
|
N3
|
M0
|
|
T1b
|
N3
|
M0
|
|
T1c
|
N3
|
M0
|
|
T2a
|
N3
|
M0
|
|
T2b
|
N3
|
M0
|
|
T3
|
N2
|
M0
|
|
T4
|
N2
|
M0
|
|
IIIC
|
T3
|
N3
|
M0
|
|
T4
|
N3
|
M0
|
|
IVA
|
T (svi)
|
N (svi)
|
M1a
|
|
T (svi)
|
N (svi)
|
M1b
|
|
IVB
|
T (svi)
|
N (svi)
|
M1c
|
| |
|
|
|
|
|
Opća načela liječenja. U liječenju karcinoma pluća na raspolaganju je kirurško liječenje, kemoterapija, radioterapija, ciljana terapija te ostali specifični lijekovi (inhibitori angiogeneze, imunoterapija). Uz navedene mjere liječenja treba provoditi i simptomatske i palijativne mjere (odgovarajuća analgezija, odgovarajući nutritivna potpora i sl.). Inicijalni cilj u liječenju karcinoma pluća je što više smanjiti tumorsku masu, a potom učvrstiti postignuti terapijski učinak te potom što duže zadržati fazu remisije. Općenito, uz liječenje petogodišnje preživljenje za karcinom pluća (za sve podtipove) iznosi oko 13 %. Dva najbitnija prognostička čimbenika su opće stanje bolesnika te stadij bolesti. Karcinom nemalih stanica karakterizira slabija osjetljivost na kemoterapiju i radioterapiju pa je kirurški zahvat osnovni preduvjet za liječenje toga tipa karcinoma uz kombinaciju adjuvantne ili neoadjuvantne kemoradioterapije. Glavne karakteristike karcinoma malih stanica su brz rast i progresija te brzo metastaziranje, što ga čini nepogodnim za operativno liječenje, ali pokazuje bolju osjetljivost na kemoterapiju.
Kirurško liječenje. Osnova svakoga onkološkog tretmana je kirurška resekcija tumora. Kod bolesnika s karcinomom pluća kirurško liječenje uglavnom je rezervirano za bolesnike s karcinomom nemalih stanica i to u stadijima I, II, kao i nekih bolesnika sa stadijem III, dok je kod bolesnika s karcinomom malih stanica rijetko provedivo (kod svega 5 % bolesnika s ograničenom bolesti). Kirurško liječenje je načelno kontraindicirano u sljedećim slučajevima: dokazane ekstratorakalne metastaze, postojanje malignoga pleuralnog izljeva, tumorska invazija u medijastinum i okolne strukture (srce, velike krvne žile, jednjak, traheja, živci) te zahvaćenost kontralateralnih medijastinalnih limfnih čvorova. Kod bolesnika koji su kandidati za operativno liječenje indicirano je provesti prijeoperacijsku evaluaciju koja uključuje određivanje FEV1 i DLCO. FEV1 manji od 40 % očekivanih vrijednosti i DLCO manji od 40 % značajno povećavaju perioperativni mortalitet. Također, te su vrijednosti bitne operaterima i pri izboru zahvata: za pulmektomiju FEV1 mora biti veći od 2.0 L i DLCO veći od 60 %, a za lobektomiju FEV1 veći od 1,5 L i DLCO veći od 50 %. Klinaste resekcije i segmentektomije rjeđe se izvode zbog veće učestalosti recidiva tumora. Rizik od recidiva kod bolesnika s potpunom resekcijom tumora je po godini 2 - 3 %, a većina recidivira unutar 2 - 3 godine.
Klasična kemoterapija. Citostatici se mogu primijeniti prije kirurškoga zahvata (neoadjuvantno) ili nakon njega (adjuvantno), a kada se radi o inoperabilnom tumoru, oni su glavni modalitet liječenja. Kod bolesnika s karcinomom nemalih stanica kemoterapija se bazira na primjeni platine (cisplatina ili karboplatina) uz dodatak citostatika treće generacije (gemcitabin, paklitaksel, docetaksel, pemetreksed, vinorelbin). Danas se preferira liječenje cisplatinom s obzirom na dokazano bolju učinkovitost, osim kod bolesnika s renalnom insuficijencijom, neuropatijom ili nagluhošću, kod kojih se terapija temelji na karboplatini s obzirom na manje toksičan efekt. Karboplatina uzrokuje naglašeniju trombocitopeniju od cisplatine. Izbor dodatnoga citostatika ovisi o hiostološkom tipu tumora, kao i o nuspojavama pa se uglavnom temelji na individualnoj osnovi. Promjena citostatika tijekom liječenja indicirana je u slučaju razvoja toksičnih efekata ili ako se nakon reevaulacije primijeti da je tumorska masa narasla ili pak nije došlo do njezinoga smanjenja. Glavni citostatici u liječenju karcinoma malih stanica su platina i etopozid. Primjena kemoterapeutika izvodi se prema posebnim standardima, a zahtijeva stalan nadzor liječnika te odgovarajuću premedikaciju. Također, prilikom uvođenja kemoterapije vodi se računa i o općem stanju bolesnika i mogućnosti da izdrži primjenu citostatika pri čemu se vodimo posebnim protokolima (engl. ECOG performance status – Tablica 2.32.). Ugrubo rečeno, kemoterapija je indicirana kod pacijenata dobroga općeg stanja, ECOG 0 ili 1 i tada razmišljamo o takozvanoj „doublet“ kemoterapiji, baziranoj na platini. Ako pacijent uz to ima i adenokarcinom te pozitivnu mutaciju, odmah dodajemo i ciljanu terapiju.
|
Tablica 2.32. ECOG performance status*
|
|
Opis
|
Status
|
|
Normalna aktivnost
Prisutnost simptoma, bolesnik pokretan
U krevetu manje od 50 % vremena
U krevetu više od 50 % vremena
100 % vezan uz krevet
|
0
1
2
3
4
|
* ECGO – Eastern Cooperative Oncology Group
Radioterapija. Liječenje zračenjem ima sve manju ulogu u liječenju karcinoma pluća i obično se koristi u slučajevima kada je tumor inoperabilan ili kod izraženih lokalnih simptoma uslijed rasta tumora. Razlikujemo dva režima primjene kemoterapije: istovremeno (istodobna primjena kemoterapije i radioterapije, tj. terapija citostaticima započinje istoga dana kada se započinje i sa zračenjem) te sekvencionalno (zračenje započinje nakon dva do četiri ciklusa kemoterapije). Studije pokazuju da su klinički ishodi bolji kod provođenja istovremene kemoradioterapije, no ona nosi veći rizik od neželjenih nuspojava (mučnina i povraćanje, ezofagitis, neutropenija). Apsolutne kontraindikacije za radioterapiju su velika tumorska masa, velik pleuralni izljev, srčana dekompenzacija te teži ispad respiratorne funkcije. Samo liječenje zračenjem provode onkolozi-radioterapeuti.
Ciljana terapija. Bolesnici s dokazanim molekularnim promjenama, kao što su EGFR mutacija te ALK i ROS1 translokacija, imaju dokazanu korist od liječenja takozvanim „pametnim“ lijekovima. EGFR gen kodira receptor za epidermalni faktor rasta čija mutacija može rezultirati nekontroliranom staničnom diobom, stoga takvi bolesnici imaju korist od primjene inhibitora tirozin kinaze (erlotinib, afatinib, gefitinib). Slično tome, promjene ALK gena također rezultiraju pojačanim staničnim diobama na što može utjecati primjena ALK inhibitora (cirzotinib, certinib, alectinib). Primjena određenih pametnih lijekova, kao što je crizotinib, ima ulogu i u ROS1 inhibiciji što ih čini pogodnima za liječenje bolesnika s ROS1 translokacijom. 50 do 60 % pacijenata rezistentnih na EGFR ima dodatnu T 790 M mutaciju, te se kod njih liječenje može nastaviti osimertinibom.
Inhibitori angiogenze imaju svoje mjesto u liječenju karcinoma pluća. Svoj učinak ostvaruju sprečavanjem rasta novih krvnih žila što smanjuje vijabilnost tumorske mase. U tu se svrhu primjenjuje bevacizumab, monoklonalno antitijelo koje djeluje kao antagonist VEGF-a (vaskularni endotelni faktor rasta) te tako ostvaruje svoj antiangiogeni učinak. Koristi se u liječenju karcinoma pluća nemalih stanica.
Imunoterapija ima sve veću ulogu u liječenju karcinoma pluća, a temelji se na jačanju imunološkoga sustava u borbi protiv malignih stanica. Glavni farmakološki cilj je modulacija staničnih mehaizama kojima se tumorska stanica brani od imunološkoga sustava kako bi se na taj način olakšala destrukcija tumorskih stanica od strane imunološkoga sustava. U kliničkoj praksi koriste se antitijela usmjerena na PD-L1 (pembrolizumab, nivolumab, atezolizumab) zbog čega je bitna prethodna molekularna dijagnostika kojom se dokazuje prisutnost toga proteina, kao i postotak njegove ekspresije (liječenje je indicirano kod svih bolesnika koji imaju PD-L1 ekspresiju veću od 50 %). Konačni učinak ovih lijekova utemeljen je na složenim unutrastaničnim mehanizmima koji rezultiraju smanjenjem inhibitornoga djelovanja tumorske stanice na citotoksične T-limfocite.
Liječenje karcinoma nemalih stanica. U terapijskom pristupu ovim bolesnicima na raspolaganju nam stoje kirurško liječenje, kemoterapija i radioterapija, a terapijski pristup u prvom redu ovisi o stadiju bolesti: rani stadij (stadij I-II), lokalno uznapredovala bolest (stadij III) te metastatska bolest (stadij IV).
Stadij I i II. Kirurško je liječenje u ovim stadijima osnovna metoda liječenja. Lobektomija ili pulmektomija preporučuju se prije nego segmentektomija ili klinasta resekcija, uz odgovarajuću resekciju limfnih čvorova medijastinuma. Za bolesnike koji to odbijaju ili je operacijski zahvat kontraindiciran iz nekoga drugog razloga, može se provesti klasična radioterapija ili stereotaksijska radioterapija (SRT) za stadij I. Za sve bolesnike u stadiju IIA i IIB preporuča se nakon kirurškoga liječenja provesti adjuvantnu kemoterapiju, kao i za bolesnike sa stadijem IB ako imaju tumor veći od 4 cm, dok se za stadij IA ona ne preporuča. Kod ovih bolesnika primjenjuje se „doublet“ kemoterapija temeljena na platini.
Stadij IIIA – potencijalno operabilan tumor. Kod bolesnika u III stadiju bolesti, kod kojih se smatra da je moguće provesti kirurško liječenje preporuča se najprije provesti neoadjuvantnu kemoterapiju (2 do 4 ciklusa „doublet“ kemoterapije temeljene na platini uz imunoterapiju ako je PD-L1 ekspresija > 50 % ) s ili bez zračenja, a zatim pristupiti kirurškom liječenju.
Stadij IIIB – inoperabilan tumor. Kod bolesnika u III stadiju bolesti kod kojih je tumor inoperabilan preporuča se liječenje konkomitantnom kemoradioterapijom, odnosno kod starijih i bolesnika s značajnim komorbiditetima sekvencijskom kemoterapijom, a potom radioterapijom.
Postoperativna radioterapija kod ovih bolesnika indicirana je kod neradikalno operiranih bolesnika s N0, N1 i N2, kod kojih nije moguće provesti reoperaciju (tada se preporuča konkomitantna kemoradioterapija) te radikalno operiranih bolesnika s N2 (provesti radioterapiju sekvencijski s kemoterapijom).
Stadij IV – prva linija liječenja. Aktivno liječenje indicirano je kod bolesnika dobroga općeg stanja (ECOG 0 i 1) te kod odabranih bolesnika s ECOG 2, dok se kod bolesnika s ECOG 3 i 4 indicira palijativno liječenje. U ovom stadiju ciljevi su smanjenje tumorske mase, usporavanje rasta tumora te ublažavanje simptoma. Kod bolesnika u IV stadiju bolesti osnovu liječenja u prvoj liniji čini kombinirana kemoterapija s dva citostatika čiji izbor ovisi o histološkom tipu (obično platina plus citostatik – gemcitabin, paklitaksel, docetaksel, pemetreksed, vinorelbin) kroz četiri do šest ciklusa s ili bez primjene bevacizumaba. Bevacizumab (inhibitor angiogeneze) dokazano poboljšava kliničke ishode, ali se ne smije davati bolesnicima s planocelularnim karcinomom jer se pokazalo da kod njih može uzrokovati ozbiljna krvarenja. Ako bolesnici ne mogu primati terapiju temeljenu na platini, preporuča se kombinacija dva citostatika bez platine. Kod bolesnika koji su EGFR/ALK/ROS pozitivni ili imaju ekspresiju PD-L1 veću od 50 %, liječenje se sastoji od kombinirane primjene ciljne terapije ili imunoterapije zajedno s klasičnom kemoterapijom. Ako su bolesnici lošijega općeg stanja, a imaju ekpresiju PD-L1 veću od 50 %, liječenje se temelji samo na imunoterapiji. Kod bolesnika kod kojih se ne postigne željeni klinički odgovor prelazi se na drugu ili treću liniju liječenja.
Stadij IV – druga linija liječenja. Kod bolesnika koji nemaju aktivacijske mutacije (EGFR, ALK, ROS1) drugu liniju liječenja najčešće čini monoterapija docetakselom ili pemetreksedom. Kod bolesnika s adenokarcinomom uz docetaksel se primjenjuje i nintedanib (tirozin-kinazni inhibitor). Praćenje bolesnika vrši se nakon svaka dva ciklusa, a lijekovi se mogu primjenjivati sve do progresije bolesti ili neprihvatljive toksičnosti. Kod bolesnika koji su EGFR pozitivni, a nisu specifično liječeni primjenjuje se erlotinib, genfitinib ili afatinib, odnosno ako su prije specifično liječeni, potrebna je rebiopsija tumora te se, ako se u njoj dokaže rezistentna mutacija EGFR (T790M), primjenjuje osimertinib. Kod ALK/ROS pozitivnih bolesnika koji nisu specifično liječeni primjenjuje se krizotinib, odnosno ceritinib ili alektinib ako su ranije liječeni krizotinibom.
Stadij IV – treća linija liječenja. Treća linija liječenja primjenjuje se kod bolesnika kod kojih nastupi progresija bolesti tijekom ili nakon druge linije liječenja. Bolesnicima koji su EGFR/ALK/ROS pozitivni pristupa se kako je to opisano u drugoj liniji liječenja. Kod bolesnika s adenokarcinomom pluća i nepoznatim EGFR statusom u obzir dolazi primjena erlotiniba. Odabir citotoksičnih lijekova u ovoj liniji liječenja nema opisane smjernice (nema dovoljno dokaza).
Palijativno liječenje. Palijativna radioterapija kod bolesnika u IV. stadiju bolesti indicirana je u slučaju moždanih metastaza, koštanih metastaza te u slučaju razvoja sindroma gornje šuplje vene. Bronhoskopske metode (terapija laserom, stent, krioterapija) mogu biti korisne u rješavanju tumorske opstrukcije bronha. Također, kod bolesnika sa sindromom gornje šuplje vene moguća je interventna procedura (postavljanje stenta). Kod recidivnih malignih izljeva indicirana je pleurodeza.
Liječenje karcinoma malih stanica. U liječenju karcinoma malih stanica vodimo se podjelom na ograničenu i proširenu bolest (VALSG klasifikacija, engl. Veterans Administration Lung Study Group) kako je prikazano u Tablici 2.33. Cilj određivanja stadija je identificirati pacijente s limitiranom bolešću kako bi proveli definitivnu terapiju. Osnovu liječenja ovih bolesnika čini kemoterapija, dok je kirurško liječenje rijetko indicirano.
|
Tablica 2.33. Stadiji karcinoma malih stanica
|
|
Ograničena bolest
|
Tumor ograničen samo na ipsiltateralni hemitoraks
|
|
Proširena bolest
|
Tumor proširen na kontralateralni hemitoraks, udaljene metastaze
|
Ograničena bolest. Liječenje ovih bolesnika temelji se na kemoterapiji i radioterapiji. Kirurško liječenje indicirano je za manje od 5 % bolesnika, a to su oni sa solitarnim perifernim tumorom kod kojih se ne mogu dokazati metastaze, odnosno zahvaćenost medijastinalnih limfnih čvorova (T1-2, N0). Kod tih se bolesnika nakon operacije, ako nisu dokazane metastaze u medijastinalnim limfnim čvorovima, provodi adjuvantna kemoterapija (cisplatin + etoposid), a ako su metastaze dokazane, indicirano je provođenje i dodatne radioterapije. Kod ostale većine bolesnika koji nisu kandidati za operativno liječenje glavni terapijski pristup je istovremena kemoradioterapija koja pokazuje bolje rezultate od sekvencionalne kemoradioterapije ili radioterapije same. Prvu liniju liječenja čini cisplatina ili karboplatina plus etopozoid ili irinotekan, dok drugu (alternativnu) liniju čine topotekan, irinotekan, taksani, ciklofosfamid, doksorubicin i vinkristin. Kod bolesnika kod kojih se tom terapijom postigne klinički odgovor, a uz to im je ECOG 0 - 2 preporuča se provesti i profilaktičko kranijalno zračenje (tri do pet tjedana od posljednjega ciklusa kemoterapije) s ciljem smanjenja rizika od moždanih metastaza.
Proširena bolest. Bolesnici s proširenom bolešću karcinoma malih stanica imaju najgoru prognozu i najuži terapijski izbor. Osnovu liječenja čini kemoterapija (platina plus etopozid). Kod bolesnika s dobrim odgovorom preporuča se provesti profilaktičko kranijalno zračenje, kao i provođenje konsolidacijske terapije. U drugoj liniji liječenja mogu se koristiti topotekan i irinotekan. U drugoj liniji nikako nisu indicirani taksani, gemcitabin niti vinorelbin. Radioterapija se primjenjuje iznimno (izraženi lokalni simptomi uvjetovani veličinom tumorske mase).
Palijativni intervencijski zahvati. Kod bolesnika s inoperabilnim tumorom koji dovodi do suženja bronha (intraluminalni rast ili ekstraluminalna kompresija) mogu nastati različite komplikacije, kao što su učestale upale, krvarenja ili izražena dispneja. Kod tih bolesnika na raspolaganju su neke od bronhoskopskih intervencija, kao što je laserska vaporizacija tumora (neodymium-Yag laser), endobronhalna radijacija (brahiterapija) ili postavljanje endobronhalnoga stenta. Navedenim zahvatima može se potići odgovarajuća rekanilizacija bronha što olakšava bolesnikove simptome i poboljšava kvalitetu života.
Prognoza. Ishodi liječenja bolesnika s karcinom pluća načelno su loši, s obzirom na to da više od 40 % bolesnika u trenu postavljanja dijagnoze ima završne stadije bolesti. Praćenje bolesnika sastoji se od redovnih pregleda i CT-a svakih 6 do 12 mjeseci prve dvije godine, a potom jednom godišnje.
KARCINOIDNI TUMOR PLUĆA
Definicija i epidemiologija. Karcinoid pluća je neuroendokrini tumor koji nastaje iz matičnih stanica bronhalnoga epitela koje se nazivaju Kulchitskyjeve stanice. Oni čine oko 10 % svih neuroendokrinih tumora i oko 1 - 2 % svih tumora pluća. Pojavljuju se podjednako kod oba spola, a prosječna dob prilikom postavljanja dijagnoze je između petoga i šestog desetljeća života.
Etiopatogeneza. Karcinoid pluća je nepoznate etiologije i do sada nisu identificirani potencijalni uzroci maligne transformacije Kulchitskyjevih stanica. Pušenje nije povezano s nastankom ovoga tumora. Patofiziološki gledano, tumori mogu dovesti do lokalnih i sistemskih posljedica. Lokalne posljedice proizlaze iz samoga rasta tumora koji može dovesti do bronhalne opstrukcije s klasičnim posljedicama kao što su atelektaza, recidivirajuće upale ili hiperinflacija. Sistemske posljedice nastaju kao posljedica lučenja različitih biološki aktivnih tvari iz tumora, kao što su serotonin, adenokortikotropni hormon, antidiuretski hormon, melanocitno stimulacijski hormon, hormon rasta i drugi. Oni mogu dovesti do karakterističnoga kliničkog očitovanja koje se naziva karcinoidni sindrom, iako on nije toliko prisutan kao kod karcinoida drugih lokalizacija.
Patologija. Ovisno o patobiološkim karakteristikama, razlikujemo dva oblika plućnoga karcinoida: tipičan i atipičan. Tipičan karcinoid ima benignu biološku narav, raste sporije, ne daje metastaze, a histološki nalaz uključuje jasno diferencirane stanice s malo mitoza. Atipični karcinoid (10 % slučajeva) malignoga je karaktera, raste brže i agresivnije, a stanice pokazuju veću diobenu aktivnost, pleomorfizam, hiperkromaziju i atipiju. Unatoč tome, ponekad je teško razlikovati ova dva tipa tumora samo na temelju histoloških karakteristika. Atipični karcinoidi daju udaljene metastaze. Najčešća lokalizacija tumora je lobarna ili segmentalna (60 %), glavni bronh (20 %), periferna (20 %) te rijetko karinalna ili trahealna lokalizacija.
Klinička slika. 25 % bolesnika u trenutku postavljanja dijagnoze je asimptomatsko. Simptomi mogu biti posljedica bronhalne opstrukcije, lučenja bioloških aktivnih tvari (karcinoidni sindrom) ili posljedica metastatskih promjena. Simptomi bronhalne opstrukcije su kašalj, iskašljavanje, dispneja, hemoptize te recidivirajuće pneumonije iste lokalizacije. Karcinoidni sindrom je rijetka klinička manifestacija kod bolesnika s karcinoidom pluća (javlja se kod oko 10 % bolesnika), a uključuje napade crvenila, bronhospazme, tahikardije, proljev i dr. Kod bolesnika s metastatskom bolesti javljaju se i opći simptomi kao što su slabost, gubitak na težini i drugi specifični simptomi ovisno o lokalizaciji.
Dijagnoza plućnoga karcinoida temelji se na anamnestičkim podacima, laboratorijskim nalazima, slikovnim dijagnostičkim metodama te invazivnim procedurama koje za cilj imaju uzorkovanje i patohistološku analizu tumorskoga tkiva.
Laboratorijski nalazi. Kod sumnje na karcinoidni tumor pluća određuje se 5-hidroksiindoloctena kiselina (5-HIAA) koja nastaje kao nusprodukt metabolizma serotonina i njezine povišene vrijednosti mogu ukazivati na karcinoid. Određivanje adrenokortikotropnoga hormona (ACTH), hormona rasta (GH) ili melanocitno stimulacijskoga hormona (MSH) indicirano je samo kada postoji klinička sumnja na ektopičnu produkciju tih hormona.
Slikovne metode. Klasični radiogram pluća (RTG) kod 75 % ovih bolesnika ukazuje na patološki proces koji uključuje prikaz same tumorske infiltracije ili prikaz posljedica bronhoopstrukcije (atelektaza, hiperinflacija, upalna konsolidacija). Kompjuterizirana tomografija (CT) otkriva detaljnije morfološke karakteristike tumora, smještaj i povezanost s ostalim strukturama, njegovu proširenost te otkriva tumor manjih veličina koji se ne bi otkrio klasičnim snimanjem. Primjenom intravenskoga kontrasta može se razlikovati benigna od maligne lezije, s obzirom na to da maligne lezije pokazuju veću prokrvljenost, iako na umu treba imati da su svi karcinoidni tumori dobro prokrvljeni. Magnetska rezonancija (MRI) ne pokazuje značajnije prednosti u odnosu na kompjuteriziranu tomografiju. Primjena pozitron-emisijske tomografije (PET-CT) nema veću ulogu u razlikovanju benignih od malignih karcinoida, s obzirom na to da karcinoidni tumori unatoč dobroj prokrvljenosti ne pokazuju povećanu metaboličku aktivnost pa se mogu krivo tumačiti kao benigne lezije. Scintigrafija somatostatinskim analogom pokazuje povećanu aktivnost u stanicama primarnoga i metastatskoga karcinoida, iako na umu treba imati da se somatostatinski analozi mogu nakupljati i u nekim tkivima kao što su jetra, štitnjača, bubrezi i slezena i u odsutnosti tumora.
Invazivna dijagnostika. Zlatni standard za postavljanje dijagnoze je biopsija i histološka analiza uzorkovanoga tkiva. Ovisno o lokalizaciji tumora, na raspolaganju su endobronhalna biopsija, transbronhalna biopsija te perkutana transtorakalna biopsija. S obzirom na dobru prokrvljenost, moguća komplikacija je opsežnije krvarenje.
Određivanje proširenosti ili „staging“ bolesti. Procjena proširenosti tumora istovjetna je kao i za karcinom pluća, kako je to prethodno opisano. Osim toga, karcinoidne tumore pluća histološki dijelimo u tri skupine: 1) tumori niskoga stupnja malignosti (manje od dvije mitoze/vidno polje, bez nekroze), 2) tumori srednjega stupnja malignosti (2 - 10 mitoza/vidno polje s ili bez fokusa nekroze) te 3) tumori visokoga stupnja malignosti (više od 10 mitoza/vidno polje).
Liječenje. Sve karcinoidne tumora pluća terapijski treba shvatiti kao maligna oboljenja. Kirurško liječenje osnovni je oblik liječenja ako nema dokazanih udaljenih metastaza, a kemoterapija ili radioterapija služe kao dopuna liječenju ili u slučaju da se kirurško liječenje ne može provesti (Tablica 2.34.).
Kirurško liječenje. Cjelovita resekcija tumorske mase uz prateću medijastinalnu limfadenektomiju osnovni je preduvjet uspješnoga liječenja. U tom pogledu preferira se pulmekotomija ili lobektomija, iako i poštednije procedure (segmentektomija, klinasta resekcija) imaju dobre rezultate. Kod odabranih bolesnika moguća je i resekcija metastatske promjene ako je ograničena i dobro lokalizirana.
Kemoterapija. Osnovu kemoterapije karcinoidnoga tumora čini kombinacija cisplatine i etopozida, a u svrhu simptomatskoga olašanja bolesnicima se može dati i octreoitid. Kod inoperabilnih, lokalno proširenih ili metastatskih karcinoida pluća odnedavno se može se primijeniti i everolimus koji pokazuje relativno dobre rezultate (50 % smanjenje rizika od progresije bolesti i smrtnoga ishoda).
Radioterapija se primjenjuje kao modalitet lokalnoga liječenja kod bolesnika kod kojih je operativno liječenje kontraindicirano i onih koji imaju razvijene lokalne komplikacije uslijed veličine samoga tumora (npr. sindrom gornje šuplje vene i sl.).
Palijativno liječenje. Kod inoperabilnih tumora koji dovode do klinički značajnijih lokalnih komplikacija, kao što je bronhoopstrukcija, moguće je provesti bronhoskopske intervencije s ciljem rekanalizacije bronha (laserska terapija, endobronhalno stentiranje).
|
Tablica 2.34. Liječenje karcinoidnoga tumora pluća
|
|
Stadij bolesti
|
Opcija liječenja
|
|
I, II, IIIA
|
Pulmektomija/lobektomija + medijastinalna limfadenektomija
|
|
IIIA niski stupanj, inoperabilni
|
Radijacijska terapija
|
|
IIIA srednji stupanj, inoperabilni
|
Cisplatina/etopozid + radijacijska terapija
|
|
IIIB
|
Cisplatina/etopozid s ili bez radioterapije
|
|
IIIB (metastaza), IV
|
Cisplatina/etopozid s ili bez everolimus i/ili octeroid
|
Prognoza. Karcinoidni tumor pluća načelno ima bolju prognozu u odnosu na ostale plućne malignome. Petogodišnje preživljenje iznosi 80 - 95 %, a desetogodišnje 80 - 90 %. Tipični karcinoid ima bolju prognozu od atipičnoga.
ADENOIDNI CISTIČNI KARCINOM PLUĆA
Definicija i epidemiologija. Adenoidni cistični karcinom pluća rijetki je maligni tumor pluća koji nastaje iz bronhalnih žlijezda te čini manje od 0,5 % primarnih tumora pluća. Obično se razvija kod osoba srednje i starije životne dobe (prosječna dob u trenutku postavljanja dijagnoze je 55 godina), s nešto češćom pojavnosti kod žena nego kod muškaraca (omjer žene:muškarci je 3:2).
Etiopatogeneza. Etiologija ovoga tumora je nepoznata, ali se u znatnom broju slučajeva može naći genetska abnormalnost u vidu postojanja fuzijskoga gena MYB-NFUB koji nastaje kao posljedica translokacije kromosoma 6 i 9. Dosadašnja ispitivanja nisu povezala pušenje s pojavnošću ovoga tumora. Tumor obično nastaje iz malih žlijezda traheje ili velikih bronha. Karakterizira ga polagan rast i širenje unutar submukoze, dok sluznica uglavnom ostaje intaktna (teško ga je uočiti tijekom endoskopije), a sklon je širenju i zahvaćanju okolnih živaca (perineuralno širenje). Generalno gledano, metastaze su rijetke i ove tumore svrstavamo u grupu tumora niskoga stupnja malignosti, ali zbog svoga karakterističnog rasta teško je pogodan za odgovarajuću kiruršku resekciju i česte su rezidue tumora i lokalni recidivi.
Klinička slika. Tumori su dugo asimptomatski. Najčešći simptomi uključuju podražajni kašalj, nelagodu u prsima, a zbog sklonosti invaziji živaca moguća je i jača bolnost. Kod trahealne lokalizacije česti simptom je inspiratorni stridor. Hemoptize i dispneja su rjeđe prisutni. Kod tumora koji dosegnu veće veličine mogući su lokalni kompresivni sindromi.
Diferencijalna dijagnoza. Diferencijalno-dijagnostički u obzir dolazi karcinom pluća, granulomatoza pluća, hamartom, metastatski tumor pluća, planocelularni karcinom traheje i dr.
Dijagnoza se postavlja na temelju radioloških slikovnih metoda te uzorkovanjem i patohistološkim nalazom tumorske mase. Na klasičnom radiogramu pluća možemo naći plućni nodus, masu, infiltrat ili atelektazu s ili bez medijastinalne limfadenopatije, ali nalaz je nespecifičan. Bolji uvod u patomorfologiju omogućava kompjuterizirana tomografija kojom se detaljnije može prikazati karakteristično submukozno širenje tumora. Za konačnu dijagnozu potrebno je uzorkovanje tumorske mase. S obzirom na to da je većina tumora centralne lokalizacije, metoda izbora je bronhoskopija, a za one rjeđe, periferne, može se pokušati transtorakalna biopsija pluća. Nakon postavljene dijagnoze potrebno je provesti dodatnu dijagnostičku obradu s ciljem otkrivanja udaljenih metastaza (procedura kao i kod ostalih karcinoma pluća).
Liječenje. Osnovno liječenje uključuje kiruršku resekciju tumora ako je ona izvediva. Kod inoperabilnih tumora i potvrđenih metastaza liječenje predstavlja kombinaciju kemoterapije, radioterapije i invazivnih endoskopskih procedura s ciljem rekanalizacije traheje ili bronha i redukcije tumorske mase. Kod bolesnika s pozitivnom KIT ekspresijom u obzir dolazi liječenje imatinibom.
Prognoza je kod ovih bolesnika nepredvidiva i prvenstveno ovisi o lokalnoj proširenosti bolesti i mogućnosti resekcije, kao i o postojanju udaljenih metastaza.
METASTATSKI TUMORI PLUĆA
Definicija. Metastatski tumori pluća su maligni tumori pluća koji nastaju širenjem primarnoga tumora (direktna invazija, hematogeno, limfogeno), koji se može nalaziti unutar pluća ili izvan njega (kolon, dojka, prostata, mokraćni mjehur i dr.).
Etiopatogeneza. Iako gotovo svaki maligni tumor može metastazirati u pluća, najčešća primarna sijela plućnih metastaza su melanom, karcinom štitnjače, karcinom dojke, kolorektalni karcinom, karcinom glave i vrata, karcinom bubrega, karcinom testisa, karcinom prostate, osteosarkom, koriokarcinom, rabdomiosarkom i drugi. Najčešći patofiziološki mehanizmi širenja primarnoga tumora i nastanaka metastaza su direktno širenje te širenje hematogenim i limfogenim putem. Jatrogena implantacija (npr. tijekom operacije) rijedak je, ali moguć način nastanka metastaze.
Klinička slika. Većina metastatskih tumora pluća dugo je asimptomatska. U vrijeme kada se jave plućni simptomi kod bolesnika je uglavnom već klinički razvijena faza uznapredovale maligne bolesti. Glavni simptom je kašalj, a mogu se javiti i dispneja, hemoptize i hemoptoa te osjećaj stezanja i bolova u prsima. Kada su metastaze praćene nastankom pleuralnih izljeva, respiratorna funkcija može biti znatno narušena te se bolesnici žale na nemogućnost disanja i osjećaj gušenja.
Dijagnoza se postavlja na osnovi radiološke i invazivne dijagnostičke obrade. Najčešći radiološki znaci metastatskih tumora pluća su solitarni ili višestruki noduli, intersticijski infiltrat ili endobronhalna lezija s ili bez distalne atelektaze. Veličina radioloških lezija može biti različita, od nekoliko milimetara do velikih masa. Iako je klasični radiogram pluća ishodišna metoda u dijagnostičkom postupku zbog svoje relativno male specifičnosti i osjetljivosti, pri sumnji na sekundarizme pluća preporuča se kompjuterizirana tomografija, s obzirom na to da omogućava bolji uvid u morfologiju lezije, kao i uočavanje manjih lezija (ispod 1 cm) što se ne može detektirati klasičnom snimkom. Invazivna pulmološka obrada ima za cilj uzimanje uzorka tumorskoga tkiva za patohistološu dijagnostiku, a ovisno o lokalizaciji i pristupu na raspolaganju su bronhoskopija i transbronhalna biopsija ili perkutana transtorakalna biospija. Osim potvrde malignoga procesa na plućima, histološka analiza s ili bez dodatnih imunohistokemijskih metoda omogućava utvrđivanje porijekla metastaza, tj. primarnoga sijela.
Diferencijalna dijagnoza. Postavljanje dijagnoze plućnih metastaza je relativno lako ako se od ranije zna za malignu bolest jer svaka novonastala radiološka lezija na plućima može ukazivati na sekundarizam. Kod bolesnika kod kojih se plućna metastaza otkrije kao prvi znak maligne bolesti treba tragati za primarnim sijelom, a u tome mogu pomoći specifični tumorski markeri, kao i histološka i imunohistokemijska analiza bioptata. Kod intrepretacije radiološkoga nalaza slične slike mogu davati i arteriovenske malformacije, apsces, granulomatozna lezija, reumatoidni čvor, tuberkulozna kaverna i dr.
Liječenje. Osnovno liječenje ovih bolesnika usmjereno je na liječenje osnovne bolesti, tj. malignoga procesa primarnoga sijela prema ustaljenim načelima. Kao opcija u liječenju dolazi kirurška resekcija metastaze (tzv. metastazektomija) u određenih bolesnika. Kandidati za ovaj oblik liječenja su bolesnici koji imaju primarni tumor koji je pod kontrolom, kod kojih je kirurški rizik prihvatljiv, kod kojih je moguća resekcija procesa u cijelosti te kod bolesnika koji nemaju dokumentiranu niti jednu drugu ekstratorakalnu metastazu. Bolesnici koji imaju ove karakteristike, ali kod njih nije moguće izvesti kirurški zahvat mogu biti kandidati za druge oblike liječenja, kao što su sterotaksijska radioterapija ili krioterapija.
Prognoza. Prema podacima Registra za plućne metastaze, prosječno petogodišnje preživljenje nakon kirurške resekcije plućnih metastaza iznosi 36 %, a desteogodišnje preživljenje 26 %.
BENIGNI TUMORI PLUĆA
Benigni tumori pluća predstavljaju dobroćudne lezije koje mogu biti smještene endobronhalno ili parenhimatozno. Većinom se radi o solitarnim, rjeđe multiplim lezijama. Prema ishodištu se dijele u nekoliko skupina: epitelni tumori (papilomi, polipi), mezodermalni tumori (fibromi, lipomi, leiomiomi, hemangiomi) te nepoznatoga izvora (hamartomi, teratomi, ksantomi).
Klinički su obično asimptomatski, a dijagnostički i terapijski pristup jednak je onome koji je opisan kod solitarnoga plućnog nodusa. U kliničkoj su praksi najčešći benigni tumori pluća hamartomi, bronhialni adenomi te hemangiomi.
Hamartomi su najčešći dobroćudni plućni tumori. Uglavnom se pojavljuju kod odraslih, rijetko kod djece. Periferno su lokalizirani i makroskopski ih karakterizira dobra ograničenost te čvrsta i glatka konzistencija. Histološki se sastoje pretežno od epitelnoga tkiva u kojemu nalazimo i različito zastupljena druga tkiva (masno i hrskavično tkivo). Kirurški se lako uklanjaju.
Bronhalni adenomi također su česti dobroćudni tumori pluća koji nastaju iz žljezdanih struktura bronha, a zbog svoje sklonosti formiranju cista nazivaju se i cistadenomima. Opasnost ovih tumora leži u tendenciji progresije u maligni tumor.
Hemangiomi su rjeđi dobroćudni plućni tumori koji nastaju od pneumocita, a karakteriziraju ih skleroza i formiranje prostora ispunjenih krvlju. Obično se javljaju kod žena srednjih godina.
SOLITARNI PLUĆNI NODUS
Definicija. Solitarni plućni nodus ili čvor definira se kao diskretna, zaobljena, oštroograničena radiološka sjena čiji dijametar ne prelazi 3 centimetra, koja je okružena plućnim parenhimom i nije u kontaktu s hilusom ili medijastinumom te nije povezana s intratorakalnom limfadenopatijom. Solitarni plućni nodus predstavlja izazov za kliničku praksu i nameće temeljno pitanje radi li se o benignoj ili malignoj leziji. Solitarni plućni nodus ne uzrokuje nikakve simptome i znakove, bolesnici su asimptomatski. Detektira ih se prilikom radiološke obrade prsnoga koša iz nekoga drugog razloga. Rijetko možemo naći opetovane pneumonije, atelektazu ili hemoptize.
Etiologija. Solitarni plućni nodus ima široku diferencijalnu dijagnozu koja uključuje tumorsku etiologiju, upalnu infektivnu etiologiju, upalnu neinfektivnu etiologiju, kongenitalnu etiologiju te druge, rjeđe uzroke. Mogući uzroci prikazani su u Tablici (2.35.).
|
Tablica. 2.35. Etiologija solitarnoga plućnog nodusa
|
|
Tumorska etiologija
|
Upalna (infektivna) etiologija
|
Upalna (neinfektivna) etiologija
|
Kongenitalna etiologija
|
Drugi, rjeđi uzroci
|
|
Primarni karcinom
Metastaza
Limfom
Karcinoid
Hamartom
Benigni tumori
|
Tuberkuloza
Plućne mikoze
Plućni apsces
Pneumonija
Hidatidna cista
|
Reumatoidni nodus
Sarkoidoza
Wegenerova granulomatoza
|
AV malformacija
Plućna sekvestracija
Bronhogena cista
|
Plućni infarkt
Kuglasta atelektaza
Mukoidna impakcija
Zona fibroze
|
Dijagnostički postupak. Sve bolesnike s otkrivenim solitarnim plućnim nodusom treba dijagnostički obraditi kako bi se razjasnila etiologija. Dijagnostički postupak uključuje anamnezu i klinički pregled bolesnika, laboratorijske pretrage, kompjuteriziranu tomografiju, pozitron emisijsku tomografiju te bronhoskopsku ili trastorakalnu biopsiju.
Anamneza i fizikalni pregled. Anamnezom možemo dobiti bitne podatke koji mogu ukazivati na mogući uzrok: prijašnja maligna oboljenja, navika pušenja, izloženost rizičnim čimbenicima (azbest, radon, nikal, krom), preboljena tuberkuloza, kontakt s oboljelima od tuberkuloze, putovanja u područja s visokom prevalencijom tuberkuloze ili nekih mikoza i dr. Fizikalni pregled uglavnom je uredan, ali neki nalazi također mogu upućivati na etiologiju (npr. astenična konstitucija, patološki auskultacijski nalaz).
Laboratorijske pretrage. Laboratorijski nalazi imaju ograničenu ulogu kod ovih bolesnika. Anemiju kronične bolesti možemo naći kod bolesnika s kroničnim oboljenjima (tumor, tuberkuloza). Preporuča se učiniti panel tumorskih markera s naglaskom na plućne (NSE, CYFRA 21-1, CEA).
Kompjuterizirana tomografija (CT) zbog svoje bolje rezolucije ima daleko veću prednost u procjeni solitarnoga plućnog nodusa u odnosu na kovencionalni radiogram pluća. CT-om se mogu detektirati i analizirati nodusi veličine od 3 - 4 mm pa na više. Na temelju CT analize veličine i brzine rasta nodusa te karakteristika kalcifikacija, rubova i unutrašnjosti nodusa u većini se slučajeva može procijeniti radi li se o malignoj ili benignoj leziji.
Pozitron emisijska tomografija (PET-CT) može biti korisna u razlikovanju malignih od benignih lezija na temelju spoznaje da maligne stanice zbog svoje veće metaboličke aktivnosti akumuliraju veću količinu intravenski apliciranoga FDG analoga (18-F-2 fluorodeoksiglukoza) što se potom bilježi posebnim kamerama. Osim toga, ovom pretragom otkrivaju se i metastaze u medijastinumu. Treba imati na umu i da neki metabolički aktivni nodusi mogu biti netumorske etiologije (upalni nodusi) te da neki tumori imaju nižu metaboličku aktivnost, a time i manje nakupljanje FDG-a (karcinoid, lepidični adenokarcinom).
Invazivna dijagnostika. Dobivanje uzorka plućnoga nodusa bronhoskopskim tehnikama ili transtorakalnom biopsijom pluća predstavlja najpouzdaniji način razlikovanja maligne od benigne lezije, tj. otkrivanja etiologije.
Postupak s bolesnikom. 2017. godine donešene su smjernice (Fleischner Society) za liječenje i praćenje bolesnika s solitarnim plućnim nodusom i one se odnose na bolesnike iznad 35 godina, imunokompententne i bez dokazanih malignih oboljenja (Tablica 2.36.).
|
Tablica 2.36. Preporuke Fleischner Society iz 2017. godine za praćenje bolesnike s plućnim nodusima
|
|
Karakteristike nodusa
|
Kliničke preporuke
|
|
Solitarni, solidni, nekalcificirani nodus
|
> Manji od 6 mm: nema potrebe za rutinskim praćenjem, kod osoba s visokim rizikom snimiti CT unutar 12 mjeseci
> 6 - 8 mm: CT unutar 6 - 12 mjeseci te razmotriti ponavljanje CT-a za 18 - 24 mjeseci
> 8 mm i više: razmotriti CT, PET-CT ili biopsiju unutar 3 mjeseca
|
|
Multipli, solidni, nekalcificirani nodusi
|
> Odrediti najsuspektniji čvor i dalje ga pratiti
> Manji od 6 mm: nema potrebe za rutinskim praćenjem, kod osoba s visokim rizikom CT unutar 12 mjeseci
> 6 mm i više: CT unutar 3 - 6 mjeseci te razmotriti ponavljanje CT-a za 18 - 24 mjeseci
|
|
Solitarni ground-glass nodul
|
> Manji od 6 mm: bez potrebe za daljnjim praćenjem
> 6 mm i više: CT unutar 6 - 12 mjeseci te ako i dalje perzistira ponavljati CT svake 2 godine unutar 5 godina
|
|
Solitarni, djelomično solidni nodul
|
> Manji od 6 mm: bez potrebe za daljnjim praćenjem
> 6 mm i više: CT unutar 3 - 6 mjeseci, ako nodus i dalje perzistira i ima solidnu komponentu manju od 6 mm ponavljati CT jednom godišnje kroz 5 godina, a ako ima solidnu komponentu 6 mm i više preporuča se PET-CT, biopsija ili kirurška resekcija
|
|
Multipli subsolidni (djelomično solidni, ground glass) noduli
|
> Odrediti najsuspektniji čvor i dalje ga pratiti
> Manji od 6 mm: CT unutar 3 - 6 mjeseci i ako ostanu stabilni - CT svake 2 - 4 godine
> 6 mm i više: CT unutar 3 - 6 mjeseci i dalje postupati ovisno o nalazu najsuspektnijega čvora
|
U visoko rizičnu skupinu ubrajamo bolesnike sa sljedećim karakteristikama: dob iznad 40 godina, ženski spol, obiteljska anamneza na karcinom pluća, lokacija na gornjim režnjevima, radiografski nalaz emfizema, prisutnost plućne fibroze, pušenje te izloženost azbestu, radonu i ostalim kancerogenima.
Kirurška resekcija nodusa indicirana je kod sumnje na malignitet te kod simptomatskih bolesnika (pnuemonija, atelektaza, hemoptize). Kod bolesnika kod kojih je kirurška procedura kontraindicirana ili se ne može izvesti iz bilo kojega drugog razloga u obzir dolaze i drugi modaliteti liječenja, kao što je sterotaksijska radiofrekvencijska ablacija ili endoskopska resekcija tumora kod endobronhalnih lezija. Izbor operacijskoga postupka leži na operateru i temelji se na anatomskim značajkama nodusa te kondicijskome stanja bolesnika.
U ovome dijelu bit će opisane najznačajnije nuspojave lijekova na plućima, plućne manifestacije u sistemskim bolestima te atelektaza.
NUSPOJAVE LIJEKOVA NA PLUĆIMA
Uvod. Do sada je poznato više od 600 lijekova koji mogu imati različite štetne nuspojave za pluća. Prepoznavanje tih nuspojava predstavlja velik klinički izazov, s obzirom na nespecifične kliničke, laboratorijske i radiološke nalaze pa se većinom dijagnoza i postavlja na temelju isključivanja drugih bolesti i stanja, a često ove nuspojave ostaju i neprepozate i krivo tumačene.
Etiopatogeneza. Različiti su mehanizmi kojima lijekovima mogu izazvati oštećenja pluća i pridruženih struktura, kao što su direktan toksični učinak, oštećenje posredovano imunološkim reakcijama, oštećenje posredovano oksidativnim stresom i dr. Dodatni rizični čimbenici koji pojačavaju štetan učinak lijeka na pluća su uznapredovala životna dob, kumulativna doza, istodobna oksigenoterapija, radijacijska terapija, od ranije postojeća plućna bolest u podlozi te genetska predispozicija. Lijekovi mogu izazvati oštećenja gotovo svih plućnih struktura: dišnih puteva (bronhospazam), plućnoga parenhima (plućne eozinofilije, plućna fibroza), plućnoga krvožilja (tromboembolija, plućna hipertenzija, plućni vaskulitisi), kao i pridruženih struktura (pleuralni izljevi, medijastinalna limfadenopatija). Najčešće nuspojave lijekova na plućima, njihovi mehanizmi i lijekovi koji ih uzrokuju prikazani su u Tablici 2.37.
|
Tablica 2.37. Najčešće nuspojave lijekova na plućima
|
|
Nuspojava
|
Mehanizam
|
Lijek
|
|
Bronhospazam
|
Alergijsko-anafilaktička reakcija
|
Penicilinski preparati
|
|
Direktno oslobađanje medijatora
|
Na-sukcinat, jodni kontrasti
|
|
Poremećaj sinteze medijatora
|
ASK i drugi NSAIL-i
|
|
Inhibicija razgradnje medijatora
|
ACE inhibitori (kašalj)
|
|
Antagonizam β receptora
|
Neselektivni beta blokatori
|
|
Plućne eozinofilije
|
Hipersenzitivna reakcija na lijek
|
Nitrofirantion, peniclin, tetraciklini, metotrekast, belomicin, NSAIL
|
|
Plućna fibroza
|
Direktan toksični učinak na pluća
|
Amiodaron, belomicin, busulfan, anakinra, terapija kisikom
|
|
Plućna trombeombolija
|
Povećana adhezivnost trombocita
|
Hormonska oralna terapija temeljena poglavito na estrogenima
|
|
Plućna hipertenzija
|
Oštećenje endotela kapilara
|
Amfetamin, fenfulramin, deksfenfulramin
|
|
Plućni vaskulitisi
|
Imunološki posredovano oštećenje
|
Nitrofurantion, sulfonamidi, penicilini, fenitoin, propiltiouracil
|
|
Nekardiogeni plućni edem
|
Oštećenje endotela kapilara
|
ASK, adenalin, kodein, indometacin, metadon, slabutamol, ritodrin
|
|
Pleuralni izljev/fibroza
|
Direktan toksični učinak
|
Bromokriptin, metizergid, amiodaron, metotreksat, danterolin
|
Klinička slika. Simptomi i znakovi ponajprije ovise o vrsti nuspojave koja nastaje (brohospazam, plućna eozinofilija, plućna fibroza, plućna embolija, plućni vaskulitis, nekardiogeni edem pluća, pleuralni izljev), što je opisano u odgovarajućim dijelovima teksta. Na povezivanje utjecaja lijeka s nastalom plućnom patologijom trebala bi ukazivati vremenska povezanost simptoma i administracije lijeka, kao i podatak o povlačenju simptoma nakon prekida uzimanja lijeka, no u kliničkoj prkasi to nije jednostavno.
Dijagnoza. Postavljanje dijagnoze ostaje na metodi eliminacije, s obzirom na to da nema patognomoničnih kliničkih, laboratorijskih niti radioloških nalaza i oni ponajprije ovise o vrsti nuspojave. Dodatno dijagnozu komplicira velik broj lijekova koji mogu izazvati jednu ili više različitih nuspojava na plućima pa vrlo često nuspojave lijekova na plućima ostaju neprepoznate ili se vode pod drugim dijagnozama.
Liječenje. Kada se identificira lijek koji je izazvao određenu nuspojavu na plućima temeljni postupak je prekid njegovoga uzimanja. Uz to se provode sve ostale metode liječenja, ovisno o vrsti nuspojave, što je opisano na odgovarajućim mjestima u tekstu.
PLUĆNE MANIFESTACIJE SISTEMSKIH BOLESTI
Uvod. Plućne komplikacije sistemskih autoimunih bolesti su relativno česte, a najčešće se radi o reumatoidnom artritisu, sistemskom eritematoznom lupusu te sistemskoj sklerozi. Najčešće plućne komplikacije sistemskih autoimunih bolesti prikazane su u Tablici 2.38. Više o kliničkoj slici, dijagnostici i liječenju pisano je u odgovarajućim dijelovima udžbenika.
|
Tablica 2.38. Najčešće plućne manifestacije sistemskih autoimunih bolesti
|
|
Bolest
|
Dišni putevi
|
Plućni parenhim
|
Pleura
|
Ošit i prsna stijenka
|
|
Reumatoidni artritis
|
Obliterirajući bronhiolitis
|
Plućna fibroza, reumatoidni čvorići
|
Pleuritis, pleuralni izljevi, pneumotoraks
|
---
|
|
Sistemski eritematozni lupus
|
---
|
Plućna fibroza, plućni infarkt
|
Pleuritis, pleuralni izljevi
|
Slabost ošita
|
|
Sistemska skleroza
|
Bronhiektazije
|
Plućna fibroza, aspiracijski sindrom
|
---
|
Rigidnost prsnoga koša
|
|
Dermatomiozitis/ polimiozitis
|
Karcinom pluća
|
Plućna fibroza
|
---
|
Miopatija dišnih mišića
|
|
Reumatska vrućica
|
---
|
Pneumonija
|
Pleuritis, pleuralni izljev
|
---
|
Reumatoidni artritis. Pluća su često zahvaćena pri reumatoidnom artritisu i odgovorna su za 10 - 20 % uzroka smrti vezano uz ovu bolest. Iako se plućne manifestacije javljaju obično unutar 5 godina od postavljanja dijagnoze, u 10 do 20 % slučajeva one čak mogu prethoditi zglobnim manifestacijama. Najčešće se radi o plućnoj fibrozi, no mogu se pojaviti i pleuralni izljevi, reumatoidni čvorići te rjeđe bronhitis i bronhiektazije.
Plućna fibroza je najčešća i najteža plućna komplikacija reumatoidnoga artritisa. Patološki, klinički i radiološki ima iste značajke kao i idiopatska plućna fibroza, osim što je karakterizira kroničniji tijek. Primjena metotreksata često implicira etiološku genezu, pa se nekada ne može sa sigurnošću odrediti je li plućna fibroza posljedica same bolesti ili se javlja kao nuspojava na metotreksat.
Pleuralni izljevi također mogu biti česti kod ovih bolesnika. Izljevi su obično mali i unilateralni, rijetko veći i bilateralni. Radi se o eksudatu kojega karakteriziraju niske vrijednosti glukoze i povišene vrijednosti laktat dehidrogenaze. Većina izljeva se resorbira i povlači spontano.
Reumatoidni čvorići su uglavnom asimptomatski i otkriju se pri radiološkoj obradi pluća iz nekoga drugog razloga. Obično su multipli i smješteni subpleuralno, često s kavitacijama. Ovaj radiološki nalaz može oponašati karcinom pluća, metastaze te tuberkulozno žarište.
Obliterirajući bronhiolitis je rijetka, ali teška plućna manifestacija reumatoidnoga artritisa. Karakterizira ga razvoj upale bronhiola s posljedičnim koncentričnim suženjem koje limitira protok zraka prilikom disanja. Ovu komplikaciju katrakterizira i slab odgovor na kortikosteroidnu terapiju.
Sistemski eritematozni lupus. Više od dvije trećine bolesnika s SLE-om tijekom bolesti imaju bar jednu epizodu plućnih komplikacija. Najčešće se radi o pleuritisu koji može i ne mora biti praćen stvaranjem izljeva. Izljevi su obično obostrani i mogu zahvatiti i perikard (panserozitis). Rjeđe, ali ozbiljnije plućne komplikacije SLE-a su akutni alveolitis udružen s difuznom alveolarnom hemoragijom te plućna fibroza čija je pojavnost znatno rjeđa nego kod reumatoidnoga artritisa.
Sistemska skleroza može dovesti do razvoja plućne fibroze koja značajno narušava kvalitetu života i pogoršava prognozu bolesti. Medijan preživljenja bolesnika s plućnom fibrozom u podlozi sistemske skleroze iznosi oko četiri godine.
ATELEKTAZA
Definicija. Atelekataza označava stanje nedovoljno ekspandiranih alveola, tj. smanjenoga plućnog volumena i predstavlja jedan od najčešćih radioloških nalaza koji može ukazivati na različita patološka stanja koja mogu dovesti do atelektaze.
Etiopatogeneza. S obzirom na etiologiju, tj. mehanizam nastanka, atelektaze dijelimo u dvije skupine: opstruktivna atelektaza i neopstruktivna atelektaza. Kao poseban oblik atelektaze izdvaja se sindrom srednjega režnja.
Opstruktivna atelektaza je najčešći tip atelektaze koji nastaje uslijed opstrukcije bronha ili bronhiola s posljedičnom distalnom resorpcijom zraka i kolapsom alveola. Najčešći uzroci su tumori, strana tijela i mukozne impakcije (bronhalna astma, kronični bronhitis). Veličina atalektaze ponajprije ovisi o lokalizaciji opstrukcije (bronhioli, segmentalni bronhi, lobarni bronhi, glavni bronhi).
Neopstruktivna atelektaza je rjeđi tip atelektaze, a nastaje uslijed kompresije na alveole izvana (pneumotoraks, pleuralni izljev, intratorakalni tumori, limfadenopatija, ožiljci) ili uslijed manjka surfaktanta koji održava površinsku napetost alveola i priječi kolaps (npr. kod akutnoga respiratornog distres sindroma).
Sindrom srednjega režnja definira se kao perzistentna ili rekurentna atelektaza srednjega režnja desnoga plućnog krila kao posljedične ekastraluminalne kompresije ili intraluminalne opstrukcije, a nekada se javlja i bez dokazivoga uzroka. Posljedično se razvijaju bronhiektazije i rekurentne infekcije.
Patofiziologija. Atelektaza dovodi do nastanka intrapulmonalnoga desno-lijevog spoja (šanta) te dolazi do miješanja neoksigenirane s oksigeniranom krvi prolaskom kroz kapilare neventiliranih i kolabiranih alveola. Utjecaj toga spoja na respiratornu funkciju ponajprije ovisi o veličini područja atelektaze. Veća područja atelektaze mogu dovesti do respiratorne insuficijencije.
Klinička slika. Manje atelektaze i one koje se sporije razvijaju mogu biti asimptomatske i ne stvarati veće poteškoće. Velike atelektaze mogu se prezentirati dispnejom, slabom tolerancijom napora, kašljem i nelagodom u prsima. Naglo nastale atelektaze prati akutna klinička slika: naglo nastala dispneja, cijanoza, tahipneja, tahikardija, hipotenzija i drugi znaci šoka. Auskultacijski je karakterističan nalaz odsutnoga disanja.
Dijagnoza se postavlja na osnovi kliničkoga nalaza te klasičnoga radiograma pluća. U svrhu diferencijalne dijagnoze mogu se napraviti kompjuterizirana tomografija i brohoskopija.
Liječenje. Osnovni terapijski pristup podrazumijeva uklanjanje uzroka atelektaze. Kod perzistentmih atelektaza preporuča se primjena antibiotika širokoga spektra zbog visoke učestalosti superinfekcija. Bitne su i mjere fizikalne medicine (vježbe disanja i iskašljavanja, drenažni položaji i sl.).
- Accurso FJ. Cystic fibrosis. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. 2016. p. 562-565.
- Alzahrani YA, Becker EA. Asthma control assessment tools. Respir Care. 2016 Jan;61(1):106–16.
- Basner RC. Obstructive sleep apnea. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 638-41.
- Baughman RP, Grutters JC. New treatment strategies for pulmonary sarcoidosis: antimetabolites, biological drugs, and other treatment approaches. Lancet Respir Med. 2015 Oct;3(10):813–22.
- Boras Z, Marunica E, Trkeš V. Liječenje izvanbolničkih pneumonija. Medicus. 2016;25(1):39-45.
- Bulat Kardum Lj. Izvanbolničke pneumonije. Medicus. 2016;25,(1):31-38
- Chen XY, Sun JM, Huang XJ. Idiopathic pulmonary hemosiderosis in adults: review of cases reported in the latest 15 years. Clin Respir J. 2017 Nov;11(6):677–81.
- Chesnutt AN, Chesnutt MS, Prendergast NT. Pulonary Disorders. In: Papadakis MA, McPhee SJ. Current Medical Diagnosis & Treatment. 58. Edition. New York: McGraw Hill Education; 2019. p.334-450.
- Christiani DC. Physical and chemical injuries of the lung. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 595-602.
- Chung KF. Clinical management of severe therapy-resistant asthma. Expert Rev Respir Med. 2017 May;11(5):395-402.
- Drazen JM. Asthma. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 549-55.
- Đaković Rode O. Etiološka dijagnostika pneumonija. Medicus. 2005;14(1):45-53.
- Elicker BM, Jones KD, Henry TS, Collard HR. Multidisciplinary approach to hypersensitivity pneumonitis. J Thorac Imaging. 2016 Mar;31(2):92–103.
- Finkas LK, Martin R. Role of Small Airways in Asthma. Immunol Allergy Clin North Am. 2016 Aug;36(3):473-82.
- Fortin M, Tremblay A.. Pleural controversies: indwelling pleural catheter vs. pleurodesis for malignant pleural effusions. J Thorac Dis. 2015 Jun;7(6):1052–7.
- Frew AJ, Doffman SR, Hurt K, Buxton-Thomas R. Respiratory disease. In: Kumar P, Clark M. Kumar & Clark`s Medicine. 9. edition. London: Elsevier; 2017. p. 1057-1113.
- Getahun H, Matteelli A, Chaisson RE, Raviglione M. Latent Mycobacterium tuberculosis infection. N Engl J Med. 2015 May 28;372(22):2127–35.
- Ginter E, Simko V. Deficiency of Vitamin D and Vitamin C in the Pathogenesis of Bronchial Asthma. Bratisl Lek Listy. 2016;117(6):305-7.
- Grbac I, Bašić-Grbac M, Ostojić J. Rak pluća. Medicus. 2001Nov;10(2):179-90.
- Grbac I, Martinac S, Šokčević M, Rončević S, Petric V, Stančić, V. The Pathogenesis of Bronchial Hyperreactivity in Patients with Allergic Rhinitis. Acta clinica Croatica. 2003;42(1):69-74.
- Iannuzzi M. Sarcoidosis. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 603-607.
- Israel E, Reddel HK. Severe and difficult-to-treat asthma in adults. N Engl J Med. 2017 Sep 7;377(10):965–76.
- Jones TL, Neville DM, Chauhan AJ.Diagnosis and treatment of severe asthma: a phenotype-based approach. Clin Med (Lond). 2018 Apr 1;18(2):s36-s40.
- Jun JC, Chopra S, Schwartz AR. Sleep apnoea. Eur Respir Rev. 2016 Mar;25(139): 12–8.
- Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016 Sept 1; 63(5):e61–111.
- Khuri FR. Lung cancer and other pulmonary neoplasms. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1303-12.
- Kraft M. Approach to the patient with respiratory disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 526-31.
- Kukulj S, Serdarević M. Liječenje teške astme. Liječnički vjesnik. 2013; 135( 9-10):268-73
- Kuzman I, Rakušić N, Čivljak R, Puljiz I, Kutleša M, Topić A i sur. Smjernice za liječenje pneumnija iz opće populacije. Liječnički vjesnik. 2017 ;139:177–191.
- Kuzman I. Liječenje pneumonija: koliko su važne smjernice? Medicus. 2005;(1):71-82.
- Lally L, Spiera RF.. Pulmonary vasculitis. Rheum Dis Clin North Am. 2015 May;41(2):315–31.
- Lee JS, Giesler DL, Gellad WF, Fine MJ. Antibiotic therapy for adults hospitalized with community-acquired pneumonia: a systematic review. JAMA. 2016 Feb 9;315(6):593–602.
- Levine SM. Alveolar filling disorders. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 571-4.
- MacMahon H, Naidich DP, Goo JM, Lee KS, Leung ANC, Mayo JR et al. Guidelines for management of incidental pulmonary nodules detected on CT images: from the Fleischner Society 2017. Radiology. 2017 Jul;284(1):228–43.
- Malhotra A, Powell F. Disorders of ventilatory control. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 545-8.
- Mareković I, Baričević D, Firis N. Mikrobiološka dijagnostika izvanbolničkih pneumonija. Medicus. 2016Nov 13;25(1):15-20.
- Maričić L, Višević R, Včeva A, Včev A, Labor S. Procjena rizika za sindrom apneje u spavanju i prekomjerne dnevne pospanosti u bolesnika oboljelih od kronične opstruktivne plućne bolesti. Acta medica Croatica. 2013;67( 3):219-24.
- Markotić A. Imunopatogeneza pneumonija. Medicus. 2016;25(1):7-14.
- Mažuranić I. Radiološka dijagnostika pneumonija. Medicus. 2016;25(1): 16-21.
- Mccool FD. Diseases of diaphragm, chest wall, pleura and mediastinum. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 627-36.
- McCracken JL, Veeranki SP, Ameredes BT, Calhoun WJ. Diagnosis and management of asthma in adults: a review. JAMA. 2017 Jul 18;318(3):279–90.
- Miculinć N, Čučević B. Bolesti pleure, medijastinuma i ošita. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb:Ljevak; 2008. str. 694-9.
- Mims JW. Asthma: definitions and pathophysiology. Int Forum Allergy Rhinol. 2015 Sep;5(1):S2-6.
- Murgu SD, Egressy K, Laxmanan B, Doblare G, Ortiz-Comino R, Hogarth DK. Central airway obstruction: benign strictures, tracheobronchomalacia, and malignancy-related obstruction. Chest. 2016;150(2):426–41.
- Musher DM. Overview of pneumonia. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 610-9.
- Niewoehner DE. Chronic obstructive disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 555-561.
- O`Donnell AE. Bronchiectasis, atelectasis, cysts and localized lung disorders. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 566-70.
- Pavelić Lj, Samaržija M. Akutne upale pluća. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008., str. 666-72.
- Pavičić F, Popović Grle S. Poremećaji ventilacije. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008., str. 699-700.
- Pavičić F, Tudorić N. Kronična opstruktivna plućna bolest. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008., str. 662-6.
- Pavliša G, Alfirević-Ungarov T, Kasap E. Neinvazivna mehanička ventilacija u bolesnika s kroničnom opstruktivnom plućnom bolešću. Medica Jadertina.2011 Nov13; 41(3-4):135-41.
- Pelicarić D, Popović-Grle S. Fenotipovi KOPB-a, Medicus 2016; 25(1):81-89.
- Peroš-Golubičić T, Tekavec-Trkanjec J. Bolesti plućnog intersticija. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb:Ljevak; 2008. str. 680-7.
- Peroš-Golubičić T, Tekavec-Trkanjec J. Plućne mikoze. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B., urednici. Interna medicina. 4. izdanje. Zagreb:Ljevak; 2008. str. 678-80.
- Petrović A, Šola AM, Šemnički . Plućna rehabilitacija u bolesnika s KOPB. Fizikalna i rehabilitacijska medicina. 2018 Nov13;31(1-2):60-1.
- Pierce AM, Brown LK.. Obesity hypoventilation syndrome: current theories of pathogenesis. Curr Opin Pulm Med. 2015 Nov; 21(6):557–62.
- Popović Grle S. Epidemiologija i značenje astme. Medicus. 2013;22(1):7-12.
- Popović Grle S. Profesionalne plućne bolesti. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb:Ljevak; 2008. str. 690-4.
- Popović-Grle S. Teška astma. Medicus. 2011;20(2):169-73.
- Puretić H, Žuljević E, Jakopović M. Bolničke pneumonije. Medicus. 2016 ;25(1):47-55.
- Raghu G. Interstitial lung disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 575-87.
- Rakušić N. Anomalije razvoja dišnih organa i prsnog koša. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb:Ljevak; 2008. str. 651-4.
- Rakušić N. Bronhiektazije. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb, 2008. str. 673-6.
- Reid PT, Innes JA. Respiratory medicine. In: Davidsons Principles and Practice of Medicine, 23rd Edition. London: Elsevier; 2018. p. 546-627.
- Samaržija M, Jakopović M, Boban M, Bošković L, Belac Lovasić I, Juretić A i sur. Smjernice za dijagnozu, liječenje i praćenje bolesnika oboljelih od raka pluća malih stanica. Liječnički vjesnik. 2017;139 (11-12):0-0.
- Samaržija M, Jakopović M. Tumori traheje, bronha i pluća. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb:Ljevak; 2008., str. 704-14.
- Samaržija M. Respiracijska insuficijencija. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb:Ljevak; 2008., str. 701-4.
- Scanlon PD. Respiratory function: mechanisms and testing. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 539-45.
- Sever B, Samaržija M. Poremećaji disanja u spavanju. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb:Ljevak; str. 704-6.
- Shah A, Panjabi C. Allergic bronchopulmonary aspergillosis: a perplexing clinical entity. Allergy Asthma Immunol Res. 2016 Jul;8(4): 282–97.
- Stark P. Imaging in pulmonary disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. . Philadelphia: Elsevier Saunders; 2016. p. 531-9.
- Suzuki T, Trapnell BC.. Pulmonary alveolar proteinosis syndrome. Clin Chest Med. 2016 Sep;37(3):431–40.
- Škrinjarić Cincar S. Važnost procjene kvalitete života u bolesnika s kroničnom opstruktivnom plućnom bolešću. Medicus. 2016;25(1):91-8.
- Tarlo SM. Occupational lung disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders;2016. p. 588-94.
- Tudorić N, Pavičić F. Astma. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 655-61.
- Tudorić N. Dijagnostičke pretrage u pulmologiji. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008., str. 645-50.
- Tudorić N. Nuspojave lijekova na plućima. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008., str. 715-7.
- Tudorić N. Plućne eozinofilije. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008., str. 687-90.
- Tudorić N. Plućni apsces. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008., str. 677-8.
- Vogelmeier CF, Criner GJ, Martinez FJ, Anzueto A, Barnes PJ, Bourbeau J. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD executive summary. Am J Respir Crit Care Med. 2017 Mar 1;195(5):557–82.
- Vukić Dugac A, Barišić B. Osobitosti pneumonija u bolesnika s kroničnom opstruktivnom plućnom bolesti (KOPB-om). Medicus. 2016;25(1):73-9.
- Wedzicha JA, Calverley PMA, Albert RK, Anzueto A, Criner GJ et al. Prevention of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J. 2017 Sep 9;50(3):1602265.
- Wenzel RP. Acute bronchitis and tracheitis. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition.Philadephia: Elsevier Saunders; 2016. p. 608-9.
- Wunderink RG, Waterer GW. Clinical practice. Community-acquired pneumonia. N Engl J Med. 2014 Feb 6;370(6):543-51.