BOLESTI SRCA I KRVNIH ŽILA
Osnovni simptomi i znakovi bolesti srca i krvih žila
Elektrokardiografija
Slikovne dijagnostičke metode u kardiologiji
Invazivne dijagnostičke metode u kardiologiji
Kronično srčano popuštanje
Akutno srčano popuštanje i kardiogeni edem pluća
Izolirano desnostrano srčano popuštanje
Transplantacija srca
Osnove elektrofiziologije i etiopatogeneze srčanih aritmija
Klinički pristup bolesniku s aritmijama
Farmakološko i nefarmakološko liječenje aritmija
Sinusne aritmije i poremećaji sinusnoga čvora
Supraventrikularna paroksizmalna tahikardija
Sindrom preekscitacije
Fibrilacija i undulacija atrija
Ventrikularna tahikardija, fibrilacija i iznenadna srčana smrt
Atrioventrikularni i intraventrikularni poremećaji provođenja
Ekstrasistole i drugi poremećaji srčanoga ritma
Ateroskleroza
Definicija, terminologija i klinička podjela koronarne bolesti
Stabilna koronarna bolest (stabilna angina pektoris)
Akutni koronarni sindrom bez elevacije ST-segmenta (nestabilna angina pektoris i NSTEMI infarkt)
Akutni koronarni sindrom s elevacijom ST-segmenta (STEMI infarkt)
Komplikacije akutnoga infarkta miokarda
Ostali oblici koronarne bolesti
Neopstruktivna koronarna bolest
Prevencija kardiovaskularnih bolesti
Akutna reumatska vrućica
Infektivni endokarditis
Miokarditis
Akutni perikarditis i druge bolesti perikarda
Kardiomiopatije
Bolesti aortnoga zaliska
Bolesti mitralnoga zaliska
Bolesti zaliska plućne arterije
Bolesti trikuspidalnoga zaliska
Umjetni srčani zalisci
Prirođene srčane greške
Fiziologija krvnoga tlaka
Primarna (esencijalna) arterijska hipertenzija
Sekundarna arterijska hipertenzija
Hipertenzivna kriza
Aneurizme aorte
Disekcija aorte i drugi oblici akutnoga aortalnog sindroma
Aortitisi i druge bolesti aorte
Periferna arterijska bolest
Ostale bolesti perifernih arterija
Duboka venska tromboza
Ostale bolesti vena
Plućna hipertenzija
Plućna embolija
Tumori srca
Bolesti srca i krvnih žila u trudnoći
Literatura
OSNOVNI SIMPTOMI I ZNAKOVI BOLESTI SRCA I KRVIH ŽILA
Najčešći simptomi i znakovi koji se susreću u bolesnika s bolestima srca i krvnih žila su bol u prsištu, otežano disanje (dispneja), palpitacije, presinkopa, sinkopa te periferni edemi i cijanoza.
BOL U PRSIMA
Bol u prsima predstavlja jedan od najvećih kliničkih izazova u pogledu diferencijacije s obzirom na širok spektar bolesti i stanja koja se mogu prezentirati bolovima u prsištu, od kojih su neka potencijalno životno ugrožavajuća (akutni koronarni sindrom, akutni aortni sindrom, plućna tromboembolija, tenzijski pneumotoraks). Bol u prsima predstavlja i jedan od najčešćih razloga za posjet bolesnika hitnoj službi. Klasično se dijeli u dvije velike skupine: bol u prsima srčanoga porijekla i bol u prsima koji nije srčanoga porijekla. Najčešći oblici bolova u prsištu srčanoga porijekla su stenokardija, perikardijalna te aortna bol.
Stenokardija je naziv za bol u prsima koji nastaje uslijed ishemije miokarda, a javlja se kao glavna manifestacija koronarne bolesti (stabilna angina pektoris, akutni koronarni sindrom). Najčešće se opisuje kao osjećaj pritiska, stezanja ili težine u prsima, što je obično praćeno tjeskobom i strahom. Rjeđe se opisuje kao žarenje, pečenje ili kao neodređena nelagoda u prsima. Tegobe su lokalizirane u sredoprsju, retrosternalno, a česta je i pojava širenja i to najčešće prema lijevoj strani vrata, ramena i ruke, dok je širenje prema desnoj strani, vratu i donjoj čeljusti ili prema epigastriju nešto rjeđa pojava. Stenokardija je najčešće provocirana fizičkim naporom, emocionalnim stresom, izlaganjem hladnoći ili obilnijem obroku. U stabilnoj su koronarnoj bolesti stenokardije u mirovanju rijetka pojava, ako se pojave - to je najčešće u okviru Prinzmentalove angine, a gotovo su redovita pojava u bolesnika s akutnim koronarnim sindromom. Pojava stenokardije u mirovanju ili tijekom noći kod ovih bolesnika ukazuje na prijelaz stabilne u nestabilnu koronarnu bolest, odnosno na rizik od razvoja akutnoga koronarnog sindroma. Tegobe pri stabilnoj angini pektoris traju kratko (obično do 10 minuta) i smiruju se prekidom provokacijskoga čimbenika, odnosno odmorom ili primjenom nitroglicerina, što je tipično kod takvih bolesnika. Bol koji traje dulje od 20 minuta, ne popušta uslijed mirovanja ili opetovane primjene nitroglicerina upućuje na akutni koronarni sindrom (nestabilnu anginu pektoris, akutni infarkt miokarda).
Perikardijalni bol glavni je simptom perikarditisa. Bol je oštar i probadajući, a bolesnici ga često opisuju kao žarenje ili pečenje, najintenzivnije uz lijevi rub sternuma. Karakteristično je da bolesnici zauzimaju prisilan položaj u kojemu se smanjuje osjet bola, a to je sjedeći položaj s trupom lagano nagnutim prema naprijed. Također, bol se može pojačavati kod dubokoga udaha, pokreta lijevoga ramenog zgloba ili kašljanja. Za razliku od stenokardije, perikardijalni bol nije povezan s tjelesnim naporom, ne prolazi mirovanjem ili primjenom nitroglicerina te traje kroz duži vremenski period nepromijenjenim intenzitetom. Sumnju na perikarditis, uz navedeni opis bola, nadopunjuje i auskultacijski nalaz perikardijalnoga trenja.
Aortni bol predstavlja snažan, naglo nastao bol u sredoprsju sa širenjem u leđa između lopatica, koji nastaje uslijed akutnoga aortnog sindroma, odnosno akutne disekcije aorte. S obzirom na njegovu brzu progresiju i potencijalno fatalan završetak, bitno je rano u kliničkom pristupu posumnjati na to stanje te pravodobno usmjeriti dijagnostički tijek. Na akutni aortni sindrom upućuje naglo nastao bol probadajućega karaktera koji obično započinje u sredoprsju uz brzo širenje prema leđima (interskapularno) te kasnije prema abdomenu i preponama. Bol je obično isprovociran težim fizičkim naporom ili izrazitim porastom vrijednosti krvnoga tlaka. Jedna od glavnih karakteristika fizikalnoga pregleda razlika je u kvaliteti pulsa i vrijednosti krvnoga tlaka na lijevoj i desnoj ruci, što je posljedica širenja disekcije u ogranke za lijevu ili desnu ruku (brahiocefalično deblo ili lijeva potključna arterija).
Ostali uzroci srčanoga bola u prsima. Plućna embolija kao jedna od bolesti s različitim oblicima kliničkih očitovanja (od asimptomatskoga tijeka do fatalnoga završetka) može biti praćena i bolovima u prsima. Ona može biti posljedica plućnoga infarkta i nadražaja pleure, pri čemu su prisutne karakteristike pleuralnoga bola (bolovi u jednom hemitoraksu s jasnim pojačanjem prilikom dubokoga udaha te smanjenjem intenziteta pri ležanju na oboljeloj strani) ili posljedica ishemije desnoga ventrikula uslijed naglo nastaloga tlačnog opterećenja i razvoja akutnoga plućnog srca. Osim toga, nespecifični bolovi srčanoga porijekla u prsima prisutni su kod bolesnika s miokarditisom, kardiomiopatijama, bolestima srčanih zalistaka i dr.
DISPNEJA
Dispneja je naziv za bolesnikov subjektivan osjećaj nestašice zraka i gušenja, na što nam mogu ukazivati i različiti fizikalni znakovi kao što su tahipneja, cijanoza, korištenje pomoćne dišne muskulature pri disanju (uvlačenje juguluma i međurebrenih prostora, trbušni tip disanja) te otežan i isprekidan govor. Dispneja se može očitovati kod različitih bolesti i stanja, a najčešće je posljedica srčanih i plućnih oboljenja. U pogledu kardiovaskularnih bolesti, najčešće se javlja kao posljedica srčanoga popuštanja te plućne tromboembolije i drugih bolesti plućnih krvnih žila (plućna hipertenzija).
Srčano popuštanje najčešći je kardijalni razlog nastanka dispneje. Ona je posljedica plućne kongestije uslijed popuštanja lijeve strane srce i posljedičnoga porasta hidrostatskoga tlaka unutar plućnih krvnih žila. Ovisno o uzročnoj bolesti, nastup kardijalne dispneje može biti polagan i progresivan ili akutan i nagao, što se prezentira slikom akutnoga kardiogenog plućnog edema. Posebni oblici dispneje kod ovih su bolesnika paroksizmalna noćna dispneja, karakterizirana naglom pojavom dispnoičnih smetnji kod bolesnika tijekom spavanja, obično u ranim jutarnjim satima, koja ih budi iz sna i zahtijeva zauzimanje povišenog položaja ili ustajanja kako bi se disanje olakšalo. Ta se pojava tumači povećanim venskim priljevom i posljedično tome srčanim opterećenjem koje se javlja u ležećem položaju uslijed preraspodjele tekućine djelovanjem sile teže. Ortopneja je naziv za otežano disanje u ležećem položaju, zbog čega bolesnici karakteristično sjede u Fowlerovom (polusjedećem) položaju jer tako dolazi do volumnoga rasterećenja srca (intravaskularni volumen prenesen je pritom djelovanjem sile teže i potisnut u vene trbuha i donjih udova).
Plućna tromboembolija također je jedan od čestih uzroka dispnoičnih tegoba, a često je praćena bolom u prsima (obično pleuralnoga karaktera) te hemoptizama. Bitan je anamnestički podatak kod takvih bolesnika onaj o mogućim rizičnim čimbenicima, kao što su nedavna operacija, imobilizacija, dugotrajno mirovanje i sl.
PALPITACIJE
Palpitacije predstavljaju neugodan osjećaj lupanja, preskakanja ili nepravilnoga rada srca. Najčešće su posljedica poremećaja srčanoga ritma, ali mogu se javiti i nevezano uz patološka stanja, obično kod osoba s neurotičnim psihičkim poremećajima. Palpitacije se mogu javiti uz bezazlene poremećaje srčanoga ritma kao što su ekstrasistole, ali mogu biti i znak ozbiljnijih poremećaja, kao što je nepostojana ventrikularna tahikardija zbog čega je indicirana dijagnostička evaluacija svih takvih bolesnika (24-satna ili 48-satna elektrokardiografija, ehokardiografija).
PRESINKOPA I SINKOPA
Sinkopa je naziv za kratkotrajan, iznenadan gubitak svijesti kojemu obično prethodi period vrtoglavice i omaglice - presinkopa. Uzroci sinkope i presinkope su mnogobrojni, a najčešći uzroci kardiovaskularnoga porijekla prikazani su u Tablici 1.1.
|
Tablica 1.1. Najčešći uzroci presinkope i sinkope
|
|
Vaskularna sinkopa
|
Opstruktivna sinkopa
|
Aritmogena sinkopa
|
|
Vazovagalna sinkopa
Posturalna sinkopa
Hipersenzitivni karotidni sinus
Mikcijska sinkopa
|
Aortna stenoza
Hipertrofijska kardiomiopatija
Pulmonalna stenoza
Plućna tromboembolija
Miksom/tromb atrija
|
Tahiaritmije
Bradiaritmije
Signifikantne pauze
Afunkcija elektrostimulatora
|
Vazovagalna sinkopa najčešći je oblik sinkope u kliničkoj praksi. Nastaje uslijed prolaznoga poremećaja autonomnoga živčanog sustava čiji je rezultat periferna vazodilatacija koja uvjetuje nagao pad krvnoga tlaka, što uz izostanak refleksne tahikardije dovodi do prolazne hipoperfuzije mozga i gubitka svijesti. Gubitku svijesti obično prethode simptomi kao što su slabost, mučnina, poremećaji vida i zujanje u ušima. Potpuni oporavak svijesti očekuje se kroz nekoliko minuta, obično nakon polijeganja i podizanja nogu u povišen položaj (položaj autotransfuzije). Vazovagalnu sinkopu obično mogu isprovocirati različite emocionalne situacije, kao što su uzbuđenje ili strah.
Posturalna (ortostatska) hipotenzija nastaje kao posljedica ortostatske hipotenzije koja se definira padom vrijednosti krvnoga tlaka u stojećem položaju za više od 20 mmHg. Može nastati uslijed hipovolemije (dehidracija, krvarenje), preraspodjele krvi iz centralnih u periferne vene (dugotrajno stajanje), kao nuspojava lijekova (metildopa, beta blokatori, kalcijski blokatori), a može biti i neurogeno uvjetovana (poremećaji autonomnoga živčanog sustava).
Opstruktivna sinkopa nastaje kao posljedica poremećaja (redukcija, prekid) protoka krvi kroz srce i pluća, što u konačnici rezultira smanjenjem udarnoga volumena i perfuzije mozga, uslijed čega dolazi do gubitka svijesti.
Aritmogena sinkopa naziv je za sinkopu koja nastaje uslijed poremećaja srčanoga ritma. I bradikardni i tahikardni poremećaji srčanoga ritma mogu biti uzrokom smanjenja udarnoga, a time i minutnoga volumena, što dovodi do smanjene perfuzije mozga i nastanka sinkope.
PERIFERNI EDEMI, ASCITES I ANASARKA
Kod bolesnika s desnostranim ili obostranim srčanim popuštanjem dolazi do razvoja slike sistemske ili generalizirane kongestije koja se očituje perifernim edemima, ascitesom te u najtežim slučajevima anasarkom. Periferni edemi često su prvi znak srčanoga popuštanja, a nastaju kao posljedica povećanja hidrostatskoga tlaka u krvožilju donjih ekstemiteta uslijed usporene cirkulacije te povećanoga intravaskularnog volumena. Kardijalni edemi su simetrični, hladni i tjestasti. Kako napreduje srčano popuštanje, tako dolazi i do razvoja hepatomegalije, splenomegalije i ascitesa, što je posljedica neodgovarajuće drenaže krvi iz sustava donje šuplje vene u desno srce. Na kraju dolazi do generaliziranoga edema cijeloga tijela koji se naziva anasarka te označava terminalnu fazu srčanoga popuštanja.
CIJANOZA
Cijanoza je naziv za plavičasto obojenje kože i sluznice. Nastaje kao posljedica povećane koncentracije neoksigeniranoga hemoglobina u krvi koji ima spektometrijski maksimum apsorpcije za plavocrvenu boju. Osim vrijednosti neoksigeniranoga hemoglobina, na pojavu cijanoze utječu i drugi čimbenici, kao što su anemija (slabije izražena cijanoza zbog manjka hemoglobina), policitemija (izraženija cijanoza zbog povećane koncentracije hemoglobina), prisutnost patoloških oblika hemoglobina (methemoglobin, sulfhemoglobin) te prirodna boja kože (kod bolesnika tamnije puti cijanoza se teže uočava). U odnosu na mehanizam nastanka razlikuju se centralna i periferna cijanoza.
Centralna cijanoza nastaje kao posljedica narušene arterijske oksigenacije u plućima, bilo zbog bolesti pluća (bolesti dišnih puteva, bolesti alvelokapilarne membrane, arterio-venski spojevi), bilo zbog bolesti srca (prirođeni ili stečeni desno-lijevi spojevi), što se očituje smanjenjem vrijednosti oksihemoglobina i porastom vrijednosti deoksihemoglobina. Cijanoza je prisutna na periferiji (prsti, uške, nos), ali i u području usnica i usne šupljine (jezik), što je ujedno klinički razlikuje od periferne cijanoze.
Periferna cijanoza nastaje isključivo kao posljedica srčane slabosti koja dovodi do otežane i usporene perfuzije perifernih tkiva, zbog čega dolazi do pojačane ekstrakcije kisika iz oksihemoglobina i posljedičnoga nakupljanja deoksihemoglobina. Klinički, cijanoza je prisutna samo na periferiji okrajina (akrocijanoza).
Elektrokardiografija (EKG) predstavlja temeljnu dijagnostičku metodu u kardiologiji i izvodi se prilikom gotovo svakoga pregleda bolesnika. U nastavku teksta bit će opisane osnove elektrofiziologije i snimanja elektrokardiografije, kao i osnove očitavanja te prikaz najčešćih elektrokardiografskih patoloških nalaza.
OSNOVE ELEKTROFIZIOLOGIJE I SNIMANJA ELEKTROKARDIOGRAFIJE
Elektrokardiografija je postupak snimanja električne aktivnosti srca, tako da se ona bilježi na papiru ili se prikazuje na monitoru u obliku krivulje s pozitivnim i negativnim otklonima. Uređaj kojime se vrši taj postupak naziva se elektrokardiograf, a grafički ispis naziva se elektrokardiogram.
Elektrofiziologija. U mirnome su stanju srčane stanice polarizirane, pri čemu je unutrašnjost stanice negativno nabijena u odnosu na izvanstanični prostor. Kada se stanicu podraži, dolazi do njezine depolarizacije koja je obilježena ulaskom pozitivnih iona natrija, tako da unutrašnjost stanice postaje pozitivna, što je preduvjet za njezinu kontrakciju. Nakon procesa depolarizacije slijedi proces repolarizacije, obilježen aktivnim izbacivanjem iona natrija, zbog čega se srčana stanica vraća u svoje prvobitno stanje negativnoga električnog naboja. Podražaj stanica miokarda stvara električni impuls koji nastaje u posebnim stanicama sa sposobnošću stvaranja srčanoga impulsa, a dio srčanoga mišića koji osigurava stvaranje i provođenje električnog impulsa kroz miokard naziva se provodnim sustavom.
Provodni sustav srca i elektrokardiogram. Provodni sustav srca osigurava usklađenost srčanoga ciklusa (sistola i dijastola), što se na elektrokardiogramu bilježi kroz tri osnovne komponente: P-val, QRS-kompleks te T-val. P-val označava depolarizaciju atrija koja prethodi kontrakciji atrija, QRS-kompleks označava depolarizaciju ventrikula koja prethodi kontrakciji ventrikula, a T-val označava repolarizaciju ventrikula koja prethodi relaksaciji ventrikula. Repolarizacija atrija ne vidi se na elektrokardiogramu jer se događa u vrijeme kontrakcije ventrikula, zbog čega je prekrivena QRS-kompleksom. Provodni sustav srca započinje strukturom koja se naziva sinusnim čvorom, smještenim u stražnjem zidu desnoga atrija. Tu započinje stvaranje srčanoga impulsa u obliku električnoga potencijala koji se nastavlja širiti dalje duž atrija prema sljedećoj strukturi, a to je atrio-ventrikularni čvor (AV-čvor). Sinusni čvor predvodnik je stvaranja srčanoga impulsa zbog čega se naziva prirodnim pacemakerom. Val depolarizacije koncentrično se širi u svim smjerovima od sinusnoga čvora kroz oba atrija uzrokujući njegovu kontrakciju. Širenje depolarizacijskog vala kroz atrije na EKG-u se bilježi kao P-val. Nakon atrija depolarizacijski val ulazi u AV-čvor, smješten u gornjem dijelu interventrikularnoga septuma, a zatim paralelno u desnu i lijevu granu, te prednji i stražnji Hisov snop (lat. fascicul) lijeve grane. U tome se dijelu depolarizacijski val sporije širi, što omogućava da krv iz atrija uđe u ventrikule, a na EKG-u se bilježi ravna izoelektrična linija koju nazivamo PQ-segmentom. Daljnje širenje impulsa ide kroz Purkinjeova vlakna do stanica srčanoga mišića i na EKG-u se bilježi kao QRS-kompleks. QRS-kompleks predstavlja električnu aktivnost ventrikula i sastoji se od početnoga silaznog otklona koji se naziva Q-zubcem, nakon kojega slijedi pozitivni otklon ili R-zubac iza kojega bilježimo ponovni negativni otklon, odnosno S-zubac. Nakon QRS-kompleksa slijedi ravna izoelektrična linija do pojave T-vala, koju označavamo kao ST-segment. T-val se javlja na kraju srčanoga ciklusa i predstavlja repolarizaciju ventrikula, pri čemu se srčane stanice vraćaju u početno, negativno stanje u odnosu na izvanstanični prostor. Karakteristike pojedinih komponenata elektrokardiograma predstavljene su u Tablici 1.2.
|
Tablica 1.2. Karakteristike normalnoga elektrokardiograma
|
|
EKG parametar
|
Definicija
|
Trajanje (sekunde)
|
Visina (milimetar)
|
|
P-val
|
Depolarizacija atrija
|
0,05 do 0,10
|
1 do
|
|
PQ (PR) interval
|
Atrioventrikularno provođenje
|
0,12 do 0,20*
|
--
|
|
QRS-kompleks
|
Depolarizacija ventrikula
|
0,06 do 0,12
|
Q ¼ R, R 2 - 20; S 0 - 20
|
|
ST-segment
|
Vrijeme u kojemu je ventrikul depolariziran
|
--
|
-0,5 do +1
|
|
T-val
|
Repolarizacija ventrikula
|
do 0,20
|
2 do 6
|
|
QT-interval
|
Ukupno vrijeme električne aktivnosti ventrikula
|
0,23 - 0,47*
|
--
|
*PQ i QT-intervali ovise o srčanoj frekvenciji, navedene vrijednosti odnose se na eukardno stanje
Elektrokardiogram predstavlja grafički ispis elektrokardiografske krivulje. Ispisuje se na milimetarskom papiru gdje je jedan kvadrat dugačak i visok jedan milimetar (tzv. mali kvadrat) s posebno istaknutim debljim linijama između kojih nalazimo pet malih kvadrata (tzv. veliki kvadrat). Visina i dubina vala (pozitivan i negativan otklon od izoelektrične linije) mjere se u milimetrima i predstavljaju mjeru za voltažu, dok horizontalna linija predstavlja vrijeme. Vrijeme između dvaju debelih linija iznosi 0,2 sekunde, a svaki mali kvadratić predstavlja 0,04 sekunde. Na temelju toga se može mjeriti dužina trajanja svakoga srčanog ciklusa ili njegovoga dijela. Vodoravne kalibracijske crte predstavljaju napon, a postavljene su tako da deset malih podjela predočava 1 mV. Uobičajena brzina snimanja je 25 mm/s, ali može se podesiti i na brže (50 mm/s) ili sporije snimanje (10 mm/s).
Odvodi i elektrode. Standardni elektrokardiogram sastoji se od dvanaest odvoda koji omogućavaju analizu električne aktivnosti srca iz dvanaest različitih projekcija, čime se omogućava bolja analiza i lokalizacija patoloških promjena. Odvode se dobiva postavljanjem elektroda na ekstremitete i prsni koš, a razlikuje se šest perifernih i šest prekordijalnih odvoda. Postavljanje elektroda na bolesnika ima svoja pravila koja je potrebno strogo poštivati kako bi se dobilo ispravan elektrokardiogram. Elektrode koje se postavljaju na ekstremitete obilježene su bojama i dogovorno se postavljaju na sljedeći način: crvena elektroda – desna ruka, žuta elektroda – lijeva ruka, zelena elektroda – lijeva noga, crna elektroda – desna noga. Prekordijalne elektrode koje se postavljaju na prsni koš označene su slovima i brojevima, od V1 do V6, a postavlja ih se sljedećim redom:
- V1 u četvrti interkostalni prostor uz desni rub sternuma;
- V2 u četvrti interkostalni prostor uz lijevi rub sternuma;
- V3 u sredinu između V2 i V4;
- V4 u peti interkostalni prostor u lijevoj srednjoj klavikularnoj liniji;
- V5 u istu horizontalnu ravninu kao i V4, ali u prednjoj aksilarnoj liniji te
- V6 u istu horizontalnu ravninu kao V4 i V5,samo u srednjoj aksilarnoj liniji.
Periferni odvodi. Postavljanjem elektroda na desnu i lijevu ruku te lijevu nogu dobivaju se periferni odvodi, a tako postavljene elektrode formiraju tzv. Einthovenov trokut, dok crna elektroda na desnoj nozi služi kao uzemljenje. Svaku stranu toga trokuta čini jedna elektroda, a kombinacijom dvije elektrode od kojih je jedna pozitivna, a druga negativna, dobivamo jedan odvod. Tako razlikujemo tri osnovna odvoda koje obilježavamo rimskim brojevima: I - odvod koji čine negativna elektroda na desnoj ruci i pozitivna elektroda na lijevoj ruci, II - odvod koji čine negativna elektroda na desnoj ruci i pozitivna elektroda na lijevoj nozi te III - odvod koji čine negativna elektroda na lijevoj ruci i pozitivna elektroda na lijevoj nozi. Tim načinom potencijali s obje elektrode utječu na konačni izgled krivulje (bipolarni odvodi). Osim ta tri standardna odvoda, postavljanjem elektroda na ekstremitete dobivaju se i tri pojačana, unipolarna odvoda, a to su aVR, aVL i aVF. Njihovo nastajanje posljedica je drugačijega povezivanja elektroda - jedna elektroda na ekstremitetu je dominantna, tzv. eksplorativna, a druge dvije čine spoj čiji električni potencijal odgovara nuli, zbog čega se ovi odvodi nazivaju unipolarnim. U aVR-odvodu dominantna elektroda je ona na desnoj ruci, u dovodu aVL na lijevoj ruci, a kod aVF-a na lijevoj nozi, prema tome aVR-odvodom dominiraju potencijali s desnog ramena, aVL-om s lijevog ramena, a aVF-om s lijeve noge. Periferni odvodi snimaju električna događanja srca koja se zbivaju u frontalnoj ravnini.
Prekordijalni odvodi snimaju električnu srčanu aktivnost u horizontalnoj ravnini s površine prsnoga koša. Radi se o šest elektroda koje se postavlja na karakteristična mjesta i to daje šest unipolarnih odvoda (V1 - V6). S obzirom na to da svaki odvod snima električnu aktivnost iz druge projekcije, normalno je da QRS-kompleks nije jednak u svim odvodima, pa je pretežno negativan u V1 odvodu, dok je u V6 odvodu pretežno pozitivan. Odvodi V1 i V2 postavljeni su iznad desne strane srca i zovu se desnim perkordijalnim odvodima, odvodi V5 i V6 iznad lijeve strane srca i nazivaju se lijevim perkordijalnim odvodima, dok su odvodi V3 i V4 postavljeni iznad septuma te se nazivaju septalnim odvodima.
Dodatni odvodi. Određene bolesti i stanja mogu zahtijevati postavljanje dodatnih odvoda, kao što su to desni i stražnji (posteriorni) odvodi. Desni odvodi podrazumijevaju postavljanje prekordijalnih elektroda na desnu stranu prsnog koša, simetrično istim redom kao i na lijevoj strani, a označavaju se slovima i brojevima od V1R do V6R. Desni se odvodi snimaju kod bolesnika s dekstrokardijom ili kod sumnje na infarkt desnoga ventrikula. Stražnji odvodi postavljaju se na leđa bolesnika po sljedećim obilježjima i lokaciji: V7 (peti interkostalni prostor lijevo na stražnjoj aksilarnoj liniji), V8 (peti interkostalni prostor lijevo na skapularnoj liniji), V9 (peti interkostalni prostor lijevo na paravertebralnoj liniji), V7R (peti interkostalni prostor desno na stražnjoj aksilarnoj liniji), V8R (peti interkostalni prostor desno na skapularnoj liniji) te V9R (peti interkostalni prostor desno na paravertebralnoj liniji). Snimanje stražnjih odvoda indicirano je kod bolesnika sa sumnjom na infarkt stražnje strane srca.
OSNOVE ANALIZE ELEKTROKARDIOGRAMA
Pri svakoj analizi elektrokardiograma potrebno je prepoznati srčani ritam, odrediti srčanu frekvenciju i električnu os te uočiti najčešće patološke promjene, kao što su hipertrofija lijevoga ventrikula, ishemija miokarda i sl. Često se za to koristi kratica FROHI (frekvencija, ritam, osovina, hipertrofija, ishemija). U nastavku teksta bit će opisani analiza električne osovine, frekvencije i ritma te najčešće patološke promjene elektrokardiograma.
ANALIZA SRČANOGA RITMA
Normalni ili regularni ritam. U normalnim uvjetima srčani ritam predvodi SA-čvor u kojemu nastaje impuls koji se potom prenosi preko atrija, AV-čvora i His-Purkinjeova sustava na ventrikule i dovodi do ujednačene kontrakcije atrija i ventrikula. Takav se ritam naziva sinusnim ritmom, a karakteriziran je pojavom urednih P-valova iza kojih dolazi QRS-kompleks. P-valovi su jednake morfologije, atrijska i ventrikularna frekvencija su iste, a PP i PR-intervali jednaki.
Patološki ritmovi. Postoji velik broj patoloških ritmova koji se ugrubo dijele na poremećaje stvaranja i poremećaje provođenja. Ovisno o mjestu u kojemu nastaju, razlikujemo sinusne ritmove, atrijske ritmove, atrioventrikularne ritmove te ventrikularne ritmove. Najčešći patološki ritmovi prikazani su Tablici 1.3.
|
Tablica 1.3. Najčešći patološki srčani ritmovi
|
|
Sinusni ritmovi
|
Atrijski ritmovi
|
Atrioventrikularni ritmovi
|
Ventrikularni ritmovi
|
|
Sinusna bradikardija
Sinusna tahikardija
Sinusna aritmija
Sinusni arest
Sinusni blok
|
Atrijske ekstrasistole
Lutanje centra vodiča
Atrijska tahikardija
Undulacija atrija
Fibrilacija atrija
|
Nodalni ritam
Atrioventrikularni blok
Nodalni kružni ritam
|
Ventrikularna tahikardija
Idioventrikularni ritam
Fibrilacija ventrikula
|
Detaljna podjela i elektrokardiografski opisi pojedinih poremećaja srčanoga ritma nalaze se u poglavlju o poremećajima srčanoga ritma.
ANALIZA SRČANE FREKVENCIJE
Srčana frekvencija podrazumijeva broj srčanih otkucaja tijekom jedne minute i njezino određivanje predstavlja jedan od osnovnih koraka pri očitavanju elektrokardiograma. Raspon normalne srčane frekvencije je od 60 do 100 otkucaja u minuti. Frekvencija veća od 100/min naziva se tahikardijom, a manja od 60/min bradikardijom. Iako većina uređaja danas automatski analizira i ispisuje srčanu frekvenciju, potrebno je poznavati osnovna pravila i načine određivanja srčane frekvencije pri interpretaciji elektrokardiograma: pravilo 300, pravilo 10 sekundi, pravilo 6 sekundi (ili 15 cm) te pravilo 3 sekunde.
Pravilo 300. Pri određivanju srčane frekvencije ovom metodom potrebno je pronaći karakteristični R-zubac koji pada točno na debelu crnu liniju milimetarskog papira, a princip se sastoji od uočavanja debelih crnih linija do sljedećeg R-zupca pri čemu svaka debela linija označava određenu frekvenciju. Prva debela linija koja slijedi označava frekvenciju 300, druga frekvenciju 150, treća frekvenciju 100, četvrta frekvenciju 75, peta frekvenciju 60 i šesta frekvenciju 50. Frekvencija se određuje tamo gdje pada sljedeći R-zubac (npr. ako sljedeći R-zubac pada na četvrtu debelu liniju onda je frekvencija 75/min). Ovo vrijedi samo za regularne (pravilne) ritmove, tj. ritmove s ujednačenim RR-intervalima.
Pravilo 10 sekundi. Većina elektrokardiografskih zapisa snima deset sekundi po stranici. Princip ovoga pravila sastoji se od toga da se izbroje svi QRS-kompleksi jednoga reda te se dobiveni broj pomnoži sa šest, a rezultat predstavlja srčanu frekvenciju. Ova je metoda dobra za određivanje frekvencije kod nepravilnih ritmova, npr. fibrilacije atrija.
Pravilo 6 sekundi (ili 15 cm). Kod procjene srčane frekvencije ovom metodom služimo se malim oznakama na gornjem rubu elektrokardiograma koje obilježavaju intervale od tri sekunde, a te oznake mogu postojati kao vertikalne linije ili kao crne točke. Princip metode podrazumijeva prebrojavanje QRS-kompleksa u dva intervala od tri sekunde te se dobiveni broj pomnoži s deset i tako dobije srčana frekvencija.
Pravilo tri sekunde. Ovo je pravilo slično prethodno opisanome pravilu 6 sekundi, a sastoji se od toga da se prebroje QRS-kompleksi u jednom intervalu od tri sekunde te se dobiveni broj pomnoži s 20. Ova se metoda preporuča samo kod iznimno pravilnih ritmova.
ANALIZA SRČANE ELEKTRIČNE OSI
Električna os predstavlja pravac depolarizacije koji se širi kroz ventrikule i izaziva kontrakciju srca, odnosno predstavlja smjer aktivacije srca. Taj se pravac depolarizacije naziva vektorom, i on pokazuje ukupni pravac kretanja električnoga podražaja (depolarizacije) kroz srce. Ako svaki QRS-kompleks predstavlja pojedinačni električni podražaj, a time i vektor, onda se njihovim zbrajanjem dobije veliki QRS-vektor koji predstavlja opći pravac ventrikularne depolarizacije. Početak srednjega QRS-vektora uvijek je u AV-čvoru. Kako se ventrikuli fiziološki nalaze pomaknuti više u lijevo i dolje u odnosu na AV-čvor, tako je i normalni smjer srednjega QRS-vektora usmjeren prema dolje i lijevo, što predstavlja fiziološku električnu os srca. Točan položaj električne osi obilježava se stupnjevima u krugu. Centar toga kruga je u AV-čvoru. Električna os normalno je okrenuta prema dolje i lijevo, i prema tome su normalne vrijednosti od -30º do +90º. Ako se iz nekog razloga srce pomakne, pomiče se i vektor. Ako se srce pomakne na desno, električna os će se također pomaknuti na desno, a isto tako, ako se srce pomakne u lijevo, i električna će se os pomaknuti u lijevo.
Klinička važnost određivanja električne osi. Abnormalnosti električne osi mogu ukazivati na proširenje (hipertrofiju) ventrikula, blokove u provođenju impulsa (npr. uzrokovane ožiljkom nakon infarkta), rotaciju srca u longitudinalnoj osi i sl. Abnormalna električna os može biti lijeva (-30º do +90º) ili desna (+90º do +180º). Hipertrofirani ventrikul pokazuje veću električnu aktivnost na svojoj strani te se automatski električna os pomiče prema toj strani. Kod hipertrofije lijevoga ventrikula nalazit ćemo lijevu električnu os, a kod hipertrofije desnoga ventrikula desnu električnu os. Isto tako, nakon infarkta miokarda, kada dođe do odumiranja jednoga dijela miokarda i stvaranja ožiljka u kojemu nema električne aktivnosti, električna će os biti pomaknuta na suprotnu stranu, kao npr. kod infarkta desnoga ventrikula, gdje nalazimo lijevu električnu os.
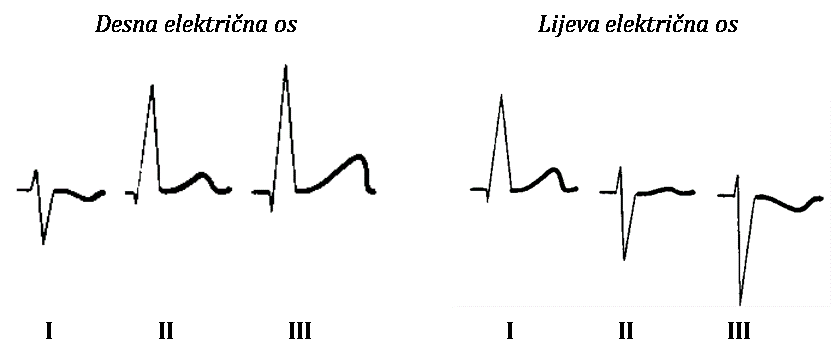
Određivanje električne osi. Električnu je os najlakše odrediti metodom kvadranta pri kojoj se frontalna ravnina srca horizontalnom i vertikalnom linijom koje prolaze kroz AV-čvor podijeli na četiri kvadranta: gornji lijevi, donji lijevi, gornji desni i donji desni. Električna os smještena u donjem lijevom kvadrantu je fiziološka, dok su ostale patološke. Princip određivanja električne osi ovom metodom podrazumijeva određivanje kretnje električne osi udesno i ulijevo, što dobivamo promatranjem prvoga (I) odvoda te određivanjem kretanja fiziološke osi prema dolje ili gore, što dobivamo promatranjem aVF-odvoda kako je to u nastavku opisano. EKG osobine desne i lijeve električne osi prikazane su na Slici 1.1.
Prvi (I) odvod pokazuje smjer kretanja električne osi udesno ili ulijevo. Ako je QRS-kompleks u ovom odvodu pretežno negativan, to znači da se električna os kreće udesno, a ako je pretežno pozitivan, znači da se električna kreće ulijevo. Objašnjenje: u I. odvodu lijeva ruka je pozitivna, a desna ruka negativna, prema tome ako je QRS u tom odvodu pozitivan, to znači da se depolarizacija kreće prema pozitivnoj elektrodi koja je u ovom odvodu na lijevoj ruci.
aVF-odvod pokazuje smjer kretanja električne osi prema gore ili dolje. Ako je QRS u aVF-odvodu uglavnom pozitivan, električna os pokazuje smjer kretanja prema dolje, a ako je QRS u aVF-odvodu uglavnom negativan, električna os pokazuje smjer kretanja prema gore. Objašnjenje: kod aVF-odvoda uzima se da je pozitivna elektroda u lijevoj nozi, pa prema tome ako QRS pokazuje pozitivan otklon, to znači da se depolarizacija kreće prema pozitivnoj elektrodi koja je u ovom odvodu u lijevoj nozi.
Ako smjer kretnje električne osi ide prema lijevo i dolje, radi se o fiziološkoj električnoj osi; ako je smjer lijevo i gore, radi se o lijevoj električnoj osi; ako je desno i dolje, radi se o desnoj električnoj osi te ako je desno i gore, radi se o ekstremnoj desnoj električnoj osi.
Najčešći uzroci patološke lijeve električne osi su podignuta dijafragma (trudnoća, ascites, tumor abdomena), hipertrofija lijeve klijetke, poremećaji srčanoga provođenja (prednji lijevi fascikularni blok, blok lijeve grane), infarkt miokarda inferiorne lokalizacije, emfizem, preekscitacijski sindromi, prirođene srčane bolesti (atrijski septalni defekt, defekt endokardnih jastučića) i dr.
Najčešći uzroci patološke desne električne osi su opterećenje desnoga srca (plućna embolija, kronična opstruktivna plućna bolest, teška astma, plućna hipertenzija), infarkt miokarda lateralne lokalizacije, poremećaji srčanoga provođenja (lijevi stražnji fascikularni blok, blok desne grane), prirođene srčane greške (stenoza plućne arterije, dekstrokardija), duboki inspirij i dr.
Slika 1.1. EKG osobine desne i lijeve električne osi
NAJČEŠĆE PATOLOŠKE ELEKTROKARDIOGRAFSKE PROMJENE
Pri interpretaciji elektrokardiograma potrebno je prepoznati najznačajnije patološke elektrokardiografske promjene koje se mogu naći u određenim bolestima i stanjima, a to su: hipertrofija atrija i ventrikula, kompletni i nekompletni blokovi grana, ishemijske elektrokardiografske promjene te elektrokardiografske promjene zbog drugih bolesti i stanja (plućna embolija, perikarditis, elektrolitni disbalans).
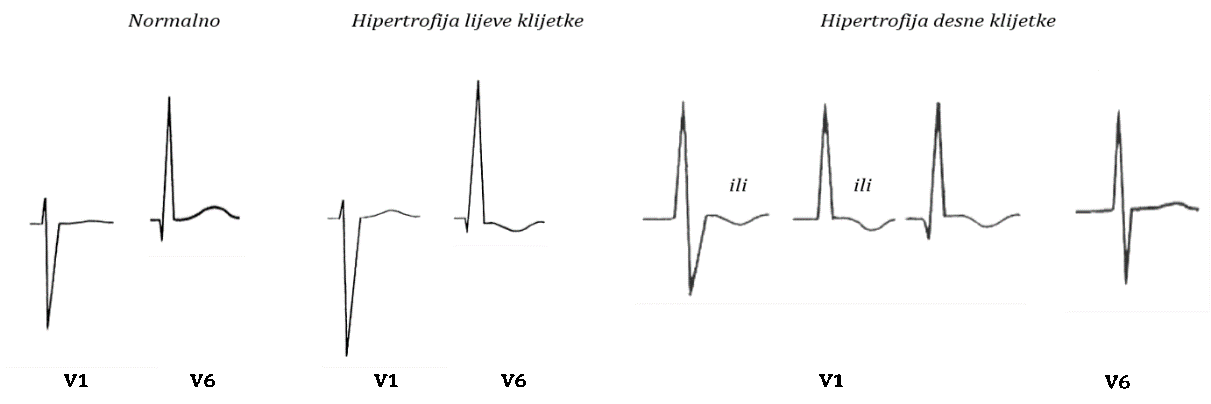
Hipertrofija ventrikula označava patološko zadebljanje stijenke desnoga ili lijevog ventrikula, a u različitim bolestima i stanjima prisutna može biti i biventrikularna hipertrofija. Općenite karakteristike hipertrofije ventrikula su povećana amplituda R-zupca nad zahvaćenom stranom (u desnim ili lijevim prekordijalnim odvodima), produljeno trajanje QRS-kompleksa te skretanje električne osi prema zahvaćenoj strani (patološka lijeva ili desna električna os). EKG osobine hipertrofije lijeve i desne klijetke prikazane su na Slici 1.2.
Slika 1. 2. EKG osobine hipertrofije lijeve i desne klijetke
Hipertrofija lijevoga ventrikula (HLK) karakterizirana je visokim R-zupcima (≥ 25 mm) u lijevim prekordijalnim odvodima (V5, V6) i dubokim S-zupcima (≥ 25 mm) u desnim prekordijalnim odvodima (V1, V2), pri čemu je zbroj amplituda R-zubaca u odvodima V5 ili V6 i S-zupca u V1 veći od 35 mm (Sokolow-Lyon kriteriji HLK-a). Obično se u odvodima s visokim R-zupcima nalazi silazna depresija ST-segmenta uz asimetričan i negativan T-val. Širina QRS-kompleksa duža je od 0,09 s (90 ms) uz patološku lijevu električnu os. Često nalazimo i pridružene znakove hipertrofije (dilatacije) lijevoga atrija. Hipertrofiju lijevoga ventrikula koja nastaje uslijed tlačnoga (sistoličkog) opterećenja karakteriziraju visoki, neprošireni R-zupci uz smanjene Q-zupce i izražene negativne T-valove, dok hipertrofiju lijevoga ventrikula koja nastaje uslijed volumnoga (dijastoličkog) opterećenja karakteriziraju visoki R-zupci s kasnom prekretnicom, dublji Q-zupci i pozitivni T-valovi.
Hipertrofija desnoga ventrikula (HDK) karakterizirana je naglašenim R-zupcem u V1 odvodu (≥ 7 mm), koji idući prema V6 odvodu postaje sve manji, dok S-zubac postaje sve dublji. Zbroj R-zupca u V1 i S-zupca u V5 ili V6 veći je od 10,5 mm. Također, u desnim odvodima s izraženim R-zupcem nalazimo spuštanje ST-segmenta s negativnim i asimetričnim T-valom. Prisutna je desna električna os. Često nalazimo i pridružene znakove hipertrofije (dilatacije) desnoga atrija.
Biventrikularna hipertrofija manifestira se kombinacijom elemenata hipertrofije lijevoga i desnog ventrikula, a obični je udružena s kongenitalnim srčanim greškama.
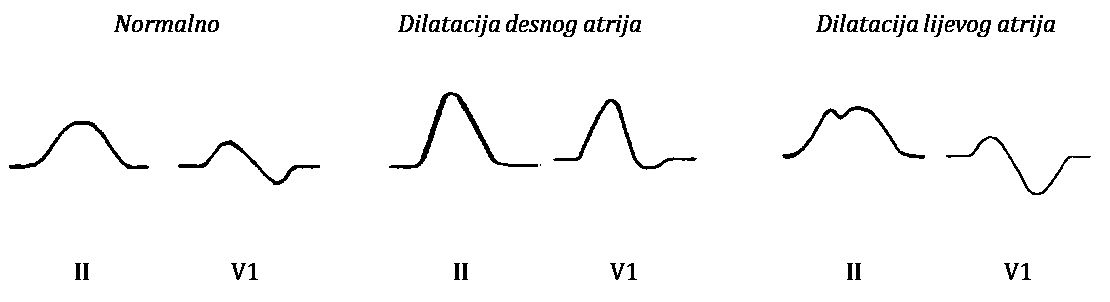
Hipertrofija (dilatacija) atrija može odražavati patološke procese koji pogađaju atrije, pri čemu se oni prilagođavaju širenjem i/ili povećanjem mišićne mase. Hipertrofiju desnoga ili lijevog atrija uočava se promatranjem karakteristika P-valova u drugom (II) i V1-odvodu, kako je dolje opisano. EKG osobine hipertrofije (dilatacije) desnog i lijevog atrija prikazane su na Slici 1.3.
Hipertrofija (dilatacija) desnoga atrija obilježena je visokim i šiljastim P-valom u II i III odvodu, dok je u odvodima V1 i V2 bifazičan, pri čemu je prvi dio (desnoatrijska komponenta) pozitivan i šiljat, što se naziva P-pulmonalne ili P-dextrocardiale.
Hipertrofija (dilatacija) lijevoga atrija obilježena je dvogrbim i proširenim P-valom u II odvodu, dok je u odvodima V1 i V2 bifazičan, pri čemu je naglašen drugi, duboki i negativni dio (lijevoatrijska komponenta) što se naziva P-mitrale ili P-sinistrocardiale.
Hipertrofija (dilatacija) oba atrija karakterizirana je proširenim (> 0,10 s), visokim (> 0,25 mV) i dvogrbim P-valom u drugom (II) odvodu.
Slika 1.3. EKG osobine hipertrofije (dilatacije) desnoga i lijevog atrija
Blokovi grana označavaju intraventrikularne poremećaje provođenja impulsa, pri čemu se impuls koji dolazi zajedničkom granom Hisova snopa ne može prenijeti kroz desnu ili lijevu granu (blok desne ili lijeve grane) ili njihove ogranke (prednji lijevi fascikularni blok, stražnji lijevi fascikularni blok). Prema izraženosti razlikujemo kompletne i nekompletne blokove grane. Blokovi grana najčešće su posljedica strukturalnih i/ili degenerativnih bolesti miokarda (kardiomiopatija, koronarna bolest, miokarditis i sl.).
Kompletni blok desne grane karakteriziran je potpunim prekidom provođenja impulsa preko desne grane Hisova snopa u desni ventrikul, uslijed čega se on depolarizira kasnije, zaobilazno iz lijevoga ventrikula, pri čemu nastaje disinkronija kontrakcija lijevoga i desnog ventrikula (najprije se kontrahira lijevi, a potom desni ventrikul). Osnovni znakovi bloka desne grane su prošireni QRS-kompleks (> 0,12 s) te nalaz jasno procijepanoga R-zupca u desnim prekordijalnim odvodima, pri čemu je sekundarni R-zubac viši od primarnoga (rsR', rsr', rSR' ili M oblik). T-val u V1 većinom je negativan ili bifazičan, a S-zubac u V5, V6, I. i II. odvodu, proširen na više od 40 ms.
Kompletni blok lijeve grane karakteriziran je potpunim prekidom provođenja impulsa kroz lijevu granu Hisova snopa u lijevi ventrikul, pri čemu se on depolarizira kasnije, zaobilazno iz desnoga ventrikula uslijed čega nastaje disinkronija kontrakcija lijevoga i desnog ventrikula (najprije se kontrahira desni, a potom lijevi ventrikul). Najznačajniji je znak bloka lijeve grane proširen QRS-kompleks (> 0,12 s) te pojava širokog i pri vrhu usječenog R-zupca u lijevim prekordijalnim odvodima (V5, V6) te odvodima I i aVL. U većine bolesnika prisutne su i sekundarne promjene ST-spojnice i T-vala u odvodima I, aVL te V4 do V6.
Nekompletni blok lijeve ili desne grane ima gotovo identična obilježja kao i kompletni blok. Osnovnu razliku čini trajanje QRS-kompleksa. Trajanje QRS-kompleksa kod nekompletnoga bloka desne ili lijeve grane iznosi 0,10 do 0,11 s.
Fascikularni blokovi lijeve grane označavaju poremećaje provođenja na infranodalnoj razini, bilo da se radi o bloku prednjega ogranka lijeve grane Hisova snopa, tj. prednjega lijevog fascikularnog bloka, ili stražnjega ogranka lijeve grane Hisova snopa, tj. stražnjega lijevog fascikularnog bloka. Prednji lijevi fascikularni blok daleko je češći, a karakteriziraju ga lijeva električna os, trajanje QRS-kompleksa kraće od 0,12 s uz mali R i duboki S-zubac u II, III i aVF-odvodu te mali Q u I i aVL-odvodu. Stražnji lijevi fascikularni blok je rjeđi, a karakteriziraju ga desna električna os, trajanje QRS-kompleksa kraće od 0,12 s te mali R i duboki S-zubac u I i aVL-odvodima te mali Q-zubac u II, III i aVF (Tablica 1.4.).
|
Tablica 1.4. Elektrokardiografski kriteriji fascikularnih blokova
|
|
Prednji lijevi fascikularni blok
|
Stražnji lijevi fascikularni blok
|
|
Lijeva električna os
II, III, aVF – mali R, duboki S
I, aVL – mali Q
|
Desna električna os
I, aVL – mali R, duboki S
II, III, aVF –mali Q
|
Bifascikularni blok označava kombinaciju kompletnoga bloka desne grane s prednjim ili stražnjim lijevim fascikularnim blokom, dok trifascikularni blok predstavlja kombinaciju bifascikularnoga bloka s AV-prolongacijom.
Ishemijske elektrokardiografske promjene uključuju promjene ST-segmenta, T-vala i Q-zupca koje ovise o tome radi li se o ishemiji, leziji ili nekrozi miokarda. Karakteristično je da se ovisno o odvodima u kojima se nalaze promjene može procijeniti lokalizacija srca pogođena ishemijom kako je to navedeno u Tablici 1.5.
Ishemija miokarda. Glavna EKG oznaka ishemije miokarda je pojava negativnih T-valova u odvodima u kojima su oni normalno pozitivni. Negativni T-valovi mogu se pojaviti samostalno ili u sklopu drugih elektrokardiografskih promjena koje ukazuju na koronarnu bolest.
Lezija miokarda prikazuje se u EKG-u elevacijom ST-segmenta u odvodima koji odgovaraju pogođenoj regiji miokarda, odnosno začepljenju određene koronarne arteriji koja vaskularizira i opskrbljuje određeno područje miokarda. Detaljne karakteristike elevacije ST-segmenta kod akutnog infarkta opisane su u poglavlju o akutnome koronarnom sindromu s elevacijom ST-segmenta. Kod nalaza elevacije ST-segmenta na elektrokardiogramu diferencijalno dijagnostički treba, osim na infarkt, misliti i na druge bolesti, kao što su Prinzmetalova angina, aneurizma lijevoga ventrikula, akutni perikarditis, Brugada sindrom, sindrom rane repolarizacije i drugo.
Nekroza. Točnu dijagnozu infarkta (nekroza miokarda) postavljamo na osnovi postojanja patološkog Q-zupca, a on se definira jednim od sljedeća dva kriterija: širina veća od 0.04 s (1 mali kvadrat) ili veličina (dubina) veća od 1/3 pripadajućeg QRS-kompleksa. Q-zubac može biti naznačen u nekim odvodima bez da označava patološko zbivanje, a to su I, II, V4 i V5.
|
Tablica 1.5. Procjena lokalizacije i opskrbnoga područja ishemije miokarda na temelju EKG-a
|
|
Lokalizacija ishemije
|
Opskrbno područje
|
EKG-odvodi
|
Zrcalna simetrija
|
|
Septalno područje
|
Lijeva koronarna arterija
|
V1, V2
|
Nema
|
|
Anteriorno područje
|
Lijeva koronarna arterija
|
V3, V4
|
Nema
|
|
Anteroseptalno područje
|
Lijeva koronarna arterija
|
V1 - V4
|
Nema
|
|
Lateralno područje
|
Arterija cirkumfleksa ili njezin marginalni ogranak/ dijagonalni ogranak lijeve koronarne arterije
|
V5, V6, I, aVL
|
II, III, aVF
|
|
Visoko lateralno područje
|
Arterija cirkumfleksa
|
I, aVL
|
II, III, aVF
|
|
Anterolateralno područje
|
Arterija cirkumfleksa
|
V3 - V6, I, aVL
|
II, III, aVF
|
|
Prednje prošireno područje
|
Lijeva koronarna arterija
|
V1 - V6, I, aVL
|
II, III, aVF
|
|
Inferiorno područje
|
Desna koronarna arterija/ distalna arterija cirkumefleksa
|
II, III, aVF
|
I, aVL
|
|
Posteriorno područje
|
Arterija cirkumfleksa/desna koronarna arterija
|
V7 - V9
|
Spuštanje ST-segmenta i visoke R valove treba tražiti na anteriornim odvodima, osobito na odvodu V1.
|
Elektrokardiografske promjene pri akutnom infarktu miokarda mogu se podijeliti u tri kategorije s obzirom na vremenski slijed. Akutne promjene koje traju nekoliko sati ili kraće uključuju pojavu hiperakutnih T-valova te elevaciju ST-segmenta s denivelacijom u zrcalnim odvodima. Subakutne promjene odnose se na promjene koje nalazimo kroz nekoliko dana do nekoliko tjedana, a uključuju spuštanje ST-segmenta, pojavu Q-zupca, redukciju R-zupca te negativizaciju T-valova (Slika 1.4.). Kronične promjene u prvom redu obilježava patološki Q-zubac.

Slika 1.4. EKG osobine ishemije miokarda
Elektrokardiografske promjene pri drugim značajnijim bolestima i stanjima uključuju promjene pri plućnoj emboliji, perikarditisu te poremećajima vrijednosti kalija i kalcija.
Plućna embolija. Promjene u elektrokardiogramu koje mogu upućivati na plućnu emboliju su sinusna ili atrijska tahikardija ili brza fibrilacija atrija, pojava S1Q3T3 obrasca (duboki S u I odvodu te patološki Q i negativni T-val u III odvodu), kompletni ili nekompletni blok desne grane te desna električna os.
Perikarditis. Promjene u EKG-u koje prate perikarditis dijele se u četiri faze: 1. elevacija ST-segmenta, 2. vraćanje ST-segmenta u izoelektričnu liniju, 3. aplanacija i negativizacija T-valova te 4. normalizacija T-valova. Detaljan slijed promjena opisan je u poglavlju o akutnome perikarditisu.
Elektrolitni disbalans. Hiperkalijemiju obilježavaju visoki i šiljasti (šatorasti) T-valovi uz širenje QRS-kompleksa i smetnje atrioventrikularnoga provođenja. Hipokalijemiju karakterizira snižen T-val, produljenje QT-intervala te spuštanje ST-segmenta. Kod hipokalcijemije je prisutno produljenje QT-intervala uz pozitivan T-val, dok kod hiperkalcijemije nalazimo skraćenje T-vala koji se odvaja od R-zupca.
Artefakti pri očitavanju elektrokardiograma. Jedan od najčešćih artefakata pri interpretaciji EKG-a u kliničkoj praksi nastaje uslijed zamjene elektroda na gornjim ekstremitetima, što se manifestira pojavom negativnoga P-vala, QRS-kompleksa i T-vala u I odvodu, dok će u aVL-odvodu biti pozitivni. Ako se ne radi o zamjeni elektroda, treba posumnjati na dekstrokardiju. Čest je nalaz i pozicijski Q-zubac u III odvodu koji nas može krivo navesti na sumnju o preboljenom infarktu. Ako se otkrije izoliran patološki Q-zubac u III odvodu, potrebno je ponoviti snimanje u dubokom inspiriju kada on mora nestati.
SLIKOVNE DIJAGNOSTIČKE METODE U KARDIOLOGIJI
Slikovne dijagnostičke metode u ehokardiografiji uključuju ehokardiografiju, klasični rendgenogram srca i pluća, kompjuteriziranu tomografiju srca, magnetnu rezonancu srca te različite nuklearno-medicinske slikovne metode.
EHOKARDIOGRAFIJA
Uvod. Ehokardiografija ili ultrazvuk srca predstavlja temeljnu dijagnostičku slikovnu metodu u kardiologiji. Osim što pruža informacije o morfološkim karakteristikama srca, omogućava i njegovu funkcionalnu procjenu, zbog čega predstavlja nezaobilazan dio svake dijagnostičke obrade pri sumnji na srčano oboljenje. Danas razlikujemo nekoliko metoda (vrsta) ehokardiografije: dvodimenzionalna i trodimenzionalna transtorakalna ehokardiografija, dvodimenzionalna i trodimenzionalna tranezofagusna ehokardiografija, strain ehokardiografija te kontrastna i stres-ehokardiografija.
EHOKARDIOGRAFSKE METODE
Ehokardiografske metode koje se rutinski primjenjuju prilikom pregleda srca su jednodimenzionalni prikaz ili M-prikaz (M-mode), dvodimenzionalni prikaz (2D-mode) te doplerske metode (kontinuirani dopler, pulsni dopler, obojeni i tkivni dopler).
Jednodimenzionalni prikaz ili M-prikaz (engl. M-mode) predstavlja jedan od najstarijih načina ehokardiografskoga prikaza srčanih struktura. Slika nastaje usmjeravanjem ultrazvučnoga snopa na željenu srčanu strukturu koja se giba te se ultrazvučni val od nje reflektira nazad u sondu i prikazuje na monitoru u linijskom obliku u vremenskom slijedu. Na taj se način omogućava praćenje gibanja srčanih struktura tijekom srčanoga ciklusa u vremenskom intervalu (npr. otvaranje i zatvaranje srčanih zalistaka). Osim toga, tim su prikazom omogućena i precizna mjerenja srčanih šupljina i stijenke miokarda.
Dvodimenzionalni prikaz ili 2D-prikaz (engl. 2D-mode) označava ehokardiografski način prikazivanja slike pri kojoj se veličina amplitude reflektiranoga vala pretvara u točku određenoga intenziteta koja se prikazuje na ekranu (što je intenzitet veći, to je točka svjetlija). Tim se načinom stvara dvodimenzionalna slika promatranih struktura u realnom vremenu, pri čemu dobivamo anatomske presjeke srca u jednoj ravnini što omogućuje jasniju i vjerniju analizu anatomskih oblika i odnosa.
Kontinuirani dopler je metoda koja se koristi za mjerenje brzine protoka u određenoj regiji, a temelji se na paralelnom kontinuiranom odašiljanju i primanju ultrazvučnoga snopa, pri čemu se kretanja unutar toga snopa prikazuju na ekranu kao doplerski spektar brzina izražen u m/s. Tom se metodom mogu mjeriti velike brzine protoka, ali ne može se odrediti točno mjesto gdje su izmjerene brzine duž ultrazvučnoga snopa.
Pulsni dopler je metoda koja se koristi za mjerenje brzine protoka, ali za razliku od kontinuiranoga doplera, omogućava mjerenje brzine na točno određenom mjestu koje obilježimo na dvodimenzionalnom prikazu. Metoda se sastoji od povremenoga (pulsnog) odašiljanja ultrazvučnoga vala koji se potom reflektira i bilježi, a ne u kontinuiranom odašiljanju i primanju vala. Pulsni dopler koristi se za mjerenje manjih brzina protoka.
Obojeni dopler (engl. Color Doppler) omogućava prikaz protoka u zadanome području pomoću dvije boje: crvena (protok krvi u smjeru pretvarača) te plava (protok krvi suprotno od smjera pretvarača). Također, više se brzine prikazuju svjetlijim bojama, a niže tamnijim bojama. Na temelju obojanoga doplera dobiva se orijentacijski uvid u brzinu na temelju promjene boja na mjestu veće brzine.
Trodimenzionalna ehokardiografija omogućava prikaz srca u tri prostorne ravnine, što pruža adekvatniju analizu kompleksnih anatomskih odnosa, kao i specifičnih srčanih abnormalnosti u odnosu na dvodimenzionalni ultrazvuk. Ova je metoda posebno korisna za mjerenje volumena i mase srčanih šupljina, procjenu kontraktilnosti, kao i za realniji prikaz srčanih zalistaka. Češće se koristi kod transezofagealnoga pristupa u odnosu na transtorakalni, a može se koristiti kao nadopuna dvodimenzionalnoj ehokardiografiji, prvenstveno pri analizi valvularnog aparata ili za kompletan pregled srčanih struktura iz svih standardnih projekcija.
Kontrastna ehokardiografija podrazumijeva klasični ehokardiografski pregled koji podrazumijeva intravensku primjenu posebnoga kontrastnog sredstva koji inače nevidljivu krv čini vidljivom prilikom ultrazvučnoga pregleda. To se obično koristi u svrhu pronalaženja intrakardijalnih patoloških spojeva na razini srčanih šupljina ili ekstrakardijalnih spojeva (npr. perzistentni ductus arteriosus) velikih krvnih žila te za procjenu perfuzije miokarda. Kontrastna sredstva sadrže sitne mikromjehuriće plina (4 - 5 µm) koji mogu prolaziti kroz plućnu kapilarnu mrežu, a lako ih je primijetiti prilikom ultrazvučnoga pregleda. Sredstva prve generacije koja su se koristila bili su mjehurići zraka stablizirani inkapsulacijom ili prijanjenjem mikročestica. Drugu generaciju kontrastnih sredstava čine plinovi fluorougljkovodika male topljivosti, dok će sredstva treće generacije (koja još nisu dostupna u svakodnevnoj praksi) koristiti i polimernu ljusku kako bi se mogla proizvesti reproduktivnija zvučna svojstva. Kod srčanih spojeva s desno-lijevim spojem nakon davanja kontrasta na perifernu venu jasno se može uočiti pojava kontrasta u lijevim srčanim šupljinama kroz prisutni spoj, dok se kod lijevo-desnog spoja na njegovom mjestu uočava ispiranje kontrasta uslijed dotoka krvi iz lijeve strane srca (iz arterijskoga dijela), koja ne sadrži kontrast (tzv. negativni kontrast). Pri procjeni perfuzije miokarda miokard s dobrom perfuzijom prikazuje se kao hiperehogena zona (dobar koronarni protok osigurava dotok veće količine kontrasta), dok se miokard s lošom perfuzijom prikazuje kao hipoehogena zona (u njega dolazi manja količina kontrasta).
Stres-ehokardiografija ili ehokardiografija u opterećenju podrazumijeva klasični ehokardiografski pregled koji se izvodi u mirovanju te neposredno nakon fizičkoga ili farmakološkog opterećenja (dobutamin, dipridamol). Pretraga se najčešće izvodi kod bolesnika sa sumnjom na koronarnu bolest, kod kojih je kontraktilnost miokarda u mirovanju uredna. Izlaganje opterećenju može dovesti do smanjenja perfuzije određenih dijelova miokarda, što će rezultirati regionalnim ispadom kontraktilnosti. Osjetljivost-test može se povećati primjenom kontrastnoga sredstva (ranije opisano). Funkcionalni odgovor na stres, osim u slučaju obrade ishemijske bolesti miokarda, važan je i u procjeni subkliničke disfunkcije lijeve klijetke (npr. antraciklinska toksičnost) te ispitivanju kontraktilne disfunkcije kod bolesnika s volumnim opterećenjem lijeve komore uzrokovanima regurgitirajućim valvularnim greškama. Osim navedenoga, stres-ehokardiografija ima ulogu u procjeni kontraktilne sposobnosti lijeve klijetke kod teške aortalne stenoze s niskim gradijentom, kao i u slučaju indirektne procjene tlaka u plućnoj arteriji na osnovi brzine trikuspidalne regurgitacije, npr. u slučaju umjerene mitralne stenoze.
Tkivni dopler podrazumijeva mjerenje brzine gibanja srčanih stijenki, za razliku od klasičnoga doplera kojim se mjeri brzina gibanja krvi. Tkivnim doplerom omogućava se analiza gibanja tkiva miokarda lijevoga ventrikula po pojedinim segmentima uzduž duge i kratke osi, čime se omogućava objektivna kvantifikacija regionalne i globalne funkcije lijevoga ventrikula te uočavanje njegove sistoličke ili dijastoličke disfunkcije u najranijim, subkliničkim fazama. Također, tkivni dopler može se koristiti i za mjerenje gibanja mitralnoga prstena, u svrhu procjene tlaka punjenja lijevoga ventrikula, u prognozi i praćenju ishemijske koronarne bolesti (osobito uz istovremenu primjenu stres-ehokardiografije), utvrđivanju subkliničkih znakova disfunkcije miokarda kod valvularnih grešaka, procjeni srčanoga zatajenja s očuvanom sistoličkom funkcijom, razlikovanju restriktivne kardiomiopatije od konstriktivnoga perikarditisa te u procjeni sistoličke funkcije desnoga ventrikula.
Strain-ehokardiografija koristi se, slično kao i tkivni dopler, za mjerenje napregnutosti i stupanj deformacije miokarda, što ima veliku ulogu u procjeni globalne i regionalne sistoličke i dijastoličke disfunkcije lijevoga ventrikula, osobito u subkliničkim fazama. Spektar potencijalnih kliničkih primjena vrlo je širok zbog njegove sposobnosti razlikovanja aktivnih i pasivnih kretanji miokardnih segmenata, kvantificiranja intraventrikularne disinkronije i procjene komponenata miokardne funkcije, poput longitudinalnoga skraćenja miokarda, koje se vizualno ne može procijeniti. Uloga strain-ehokardiografije posebno se ističe u otkrivanju disfunkcije miokarda različitih etiologija, ranoga otkrivanja akutnoga odbacivanja alografta nakon transplantacije srca te mjerenju brzine napregnutosti i deformacije što pomaže u odabiru primjene različitih terapija (srčane resinhronizacijske terapije, koronarne revaskularizacije, transplantacije). Osim u inidikaciji za navedeni zahvat, strain-ehokardiografija ima ulogu i u prognostičkom praćenju njegova učinka.
TRANSTORAKALNA EHOKARDIOGRAFIJA
Transtorakalna ehokardiografija (TTE) označava ultrazvučni prikaz srčanih struktura preko stijenke prsnoga koša kroz četiri osnovna ehokardiografska prozora: parasternalni prozor (treći ili četvrti interkostalni prostor uz lijevi rub sternuma), apikalni prozor (predio palpatorno određenoga vrška srca), subkostalni prozor (ispod lijevoga rebrenog luka i vrha prsne kosti) te suprasternalni prozor (iznad prsne kosti).
Osnovni ehokardiografski pregled sastoji se od mjerenja dimenzija lijevoga atrija i lijevoga ventrikula, aortnoga korijena, desnoga ventrikula i donje šuplje vene, debljine stijenki miokarda i procjene njihove kontraktilnosti, određivanja globalne sistoličke funkcije lijevoga i desnoga ventrikula te morfološke i funkcionalne procjene pojedinih srčanih zalistaka.
Tehnika pregleda. Za vrijeme pregleda bolesnik leži na lijevom boku s lijevom rukom savijenom pod glavom i trupom uzdignutim za oko 30 stupnjeva u odnosu na donji dio tijela. Prije pregleda na prsni koš bolesnika postavljaju se elektrode koje se povezuju sa samim ultrazvučnim uređajem, što omogućava istovremeni prikaz elektrokardiografske krivulje zajedno s ultrazvučnom slikom. Pregled se standardno obavlja prikazom srčanih struktura u 2D i M-prikazu iz duge i kratke parasternalne osi te iz apikalnoga, subkostalnoga i suprasternalnog presjeka uz standardiziranu doplersku analizu.
Protokol pregleda. U nastavku teksta bit će opisan klasičan protokol transtorakalnoga ehokardiografskog pregleda u karakterističnim prikazima (duga parasternalna os, kratka parasternalna os, apikalni prozor, subkostalni prozor, suprasternalni prozor).
Duga parasternalna os. Pregled započinje prikazom struktura iz duge parasternalne osi u 2D-prikazu, a sam prikaz osigurava se postavljanjem sonde u treći ili četvrti međurebreni prostor uz lijevi rub sternuma uz usmjeravanje pokazivača sonde prema desnome ramenu. U ovome prozoru možemo prikazati sljedeće strukture (idući od gore prema dolje, odnosno anteriorno prema posteriorno): početno manji prostor bez odjeka koji odgovara masnom tkivu prsnoga koša, prednju stijenku desnoga ventrikula, šupljinu desnoga ventrikula, interventrikularni septum i šupljinu lijevoga ventrikula te, najdistalnije, stražnju stijenku lijevoga ventrikula s anterolateralnim papilarnim mišićem. Također se jasno uočava izlazni trakt lijevoga ventrikula, aortni zalistak, korijen i početni dio uzlazne aorte te niže od njih mitralni zalistak i lijevi atrij (Slika 1.5.).
U istom se pregledu u M-prikazu obave mjerenja korijena aorte (na kraju dijastole), separacije aortnih kuspisa, anteroposteriorne dimenzije lijevoga atrija (na kraju sistole) te lijevoga ventrikula (i na kraju sistole i na kraju dijastole) (Slika 1.6.). Za potrebe mjerenja dimenzija lijevoga ventrikula potrebno je osigurati da linija M-prikaza prolazi kroz bazalni segment lijeve komore između mitralnoga zaliska i papilarnoga mišića, a da je pri tome okomita na zidove lijevoga ventrikula. Mjerenje lijevoga ventrikula podrazumijeva mjerenje interventrikularnoga septuma, stražnjega (posterolateralnog) zida lijevoga ventrikula te mjerenje samih dimenzija lijevoga ventrikula za vrijeme sistole i dijastole. Na temelju procijenjenih dimenzija lijevoga ventrikula izračunavaju se istisna frakcija i frakcija skraćenja lijevoga ventrikula. Mjerenje u M-prikazu iz ovoga aspekta podrazumijeva i mjerenje desnoga ventrikula (njegov uzlazni dio). U istom se prikazu potom prikaže protok krvi kroz trikuspidalni, mitralni i aortni zalistak pomoću obojenog doplera kao i trikuspidalni zalistak iz projekcije ulaznoga trakta desnoga ventrikula (Slika 1.7.).
|
Slika 1.5 Duga parasternalna os, 2D-prikaz
|
|
Slika 1.6. Duga parasternalna os, M-prikaz
|
|
Slika 1.7. Duga parasternalna os, obojeni dopler
|
Kratka parasternalna os. Pregled se nastavlja prikazom struktura iz kratke parasternalne osi u 2D-prikazu što se postiže rotacijom sonde u smjeru kazaljke na satu iz pozicije duge parasternalne osi usmjeravajući pokazivač sonde prema lijevom ramenu. Ovaj prozor omogućava nekoliko prikaza: prikaz na razini aortnoga zaliska, prikaz na razini mitralnoga zaliska, prikaz na razini papilarnih mišića te prikaz na razini apeksa, što se postiže nježnim rotacijskim usmjeravanjem sonde.
Prikaz na razini aortnoga zaliska u 2D-prikazu omogućava prikaz morfologije aortnih kuspisa (normalno se trolisna aorta prikazuje znakom mercedesa), interatrijskoga septuma (vizualizacija eventualnoga patološkog spoja), trikuspidalnoga zaliska, izgonskoga trakta desnoga ventrikula te zaliska plućne arterije i zajedničke plućne arterije (Slika 1.8., Slika 1.9.). Pulsnim doplerom procjenjuju se transpulmonalne brzine protoka (kod većih brzina, npr. plućna stenoza, koristi se kontinuirani dopler – Slika 1.10.).
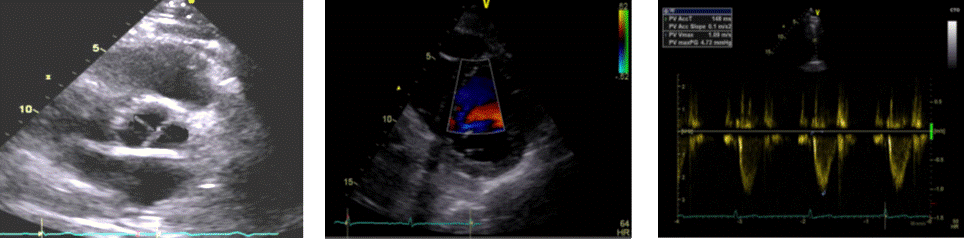
|
Slika 1.8. Kratka parasternalna os, prikaz na razini aortnoga zaliska (znak merecedesa)
|
|
Slika 1.9. Kratka parasternalna os, obojeni dopler
|
|
Slika 1.10. Kratka parasternalna os, pulsni dopler, transpulmonalni protok
|
Prikaz na razini mitralnoga zaliska uglavnom se koristi za procjenu morfologije i funkcije mitralnoga zaliska (opseg mitralne prstenaste kalcifikacije, veličinu mitralne aree u mitralnoj stenozi, etiologija mitralne regurgitacije). Kretanje mitralnoga zaliska u parasternalnoj kratkoj osi u 2D-prikazu nalikuje na riblja usta (Slika 1.11.).
2D-prikaz na razini papilarnih mišića idealan je za pregled značajki lijevoga ventrikula, kao što su globalna i regionalna kontraktilnost, kao i za procjenu njegove veličine i dimenzija (hipertrofija). Iz tog je prikaza moguće vizualizirati i bazalni dio desnoga ventrikula (Slika 1.12.). Također, iz ovog je prostora moguće M-prikazom izmjeriti dimenzije lijevoga ventrikula u sistoli i dijastoli, kao i debljine njegovih stijenki (Slika 1.13).
2D-prikaz na razini apeksa nije standardan, ali može biti koristan u procjeni funkcije apikalnoga dijela lijevoga ventrikula (ispadi kontraktilnosti) ili za prikaz trombotskoga sadržaja.
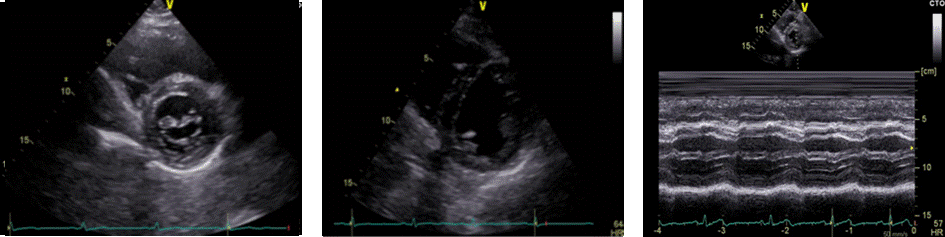
|
Slika 1.11. Kratka parasternalna os, 2D-prikaz na razini mitralnog zaliska (riblja usta)
|
|
Slika 1.12. Kratka parasternalna os, 2D-prikaz na razini papilarnih mišića
|
|
Slika 1.13. Kratka parasternalna os, M-prikaz na razini papilarnih mišića
|
Apikalni prozor. Pregled se nastavlja u apikalnom prozoru koji se najčešće nalazi u petom međurebrenom prostoru, ali za njegovo točno određivanje obično je potrebna palpatorna procjena projekcije srčanoga vrška. U tom je prozoru moguć prikaz u nekoliko presjeka: presjek četiri šupljine, presjek pet šupljina, presjek dvije šupljine te presjek tri šupljine.
Apikalni 2D-prikaz četiri šupljine omogućava prikaz sve četiri srčane šupljine, što je pogodno za procjenu kontraktilne funkcije desnoga i lijevog ventrikula (Slika 1.14.). Najčešće se na temelju te projekcije procjenjuje segmentalna i globalna kontraktilna (sistolička) funkcija lijevoga ventrikula. Globalna sistolička funkcija ispituje se Simpsonovom metodom (Simpson BP, biplane) koja podrazumijeva ocrtavanje unutrašnjosti lijevoga ventrikula, čime se automatski izračunava njegova površina, i to u vrijeme sistole i dijastole (Slika 1.15.). Uspoređivanjem površine lijevoga ventrikula za vrijeme sistole i dijastole dobiva se postotak istisnute krvi pri jednoj kontrakciji, što se naziva istisnom frakcijom. U ovom prikazu moguće je i odrediti segmentalnu kontraktilnost lateralnoga, septalnoga i apikalnog dijela miokarda lijevoga ventrikula.
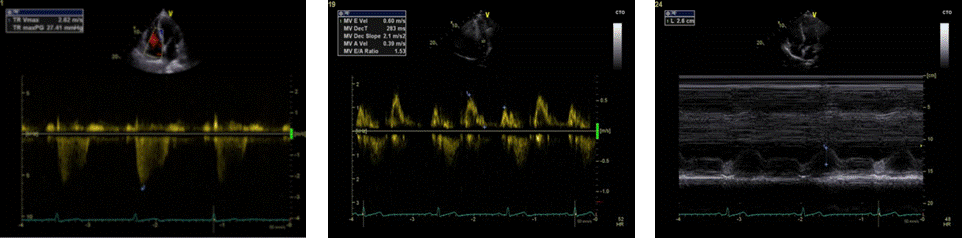
Jednako je tako iz ovoga prikaza moguće odrediti i dimenzije lijevoga i desnog atrija, kao i promatrati morfologiju interatrijskoga septuma. Obojenim doplerom omogućena je analiza protoka krvi kroz trikuspidalni, aortni i mitralni zalistak (Slika 1.16.), dok kontinuirani i pulsni dopler omogućavaju procjenu brzina protoka krvi kroz mitralni i trikuspidalni zalistak (Slika 1.17. i 1.18.).
Na temelju jednako usmjerenoga M-prikaza moguća je procjena kontraktilnosti desnoga ventrikula metodom TAPSE (od engl. tricuspidal annular plane systolic excursion), kao i lijevoga ventrikula metodom MAPSE (od engl. mitral annular plane systolic excursion). TAPSE predstavlja amplitudu sistoličke pokretljivosti trikuspidalnoga prstena (Slika 1.19.). Kod normalne je sistoličke funkcije desnoga ventrikula ta amplituda veća od 18 mm, dok je kod sistoličke disfunkcije desnoga ventrikula manja od 15 mm. Isto vrijedi i za mitralni prsten kod procjene MAPSE-om, a dobivene vrijednosti manje od 10 mm ukazuju na sistoličku disfunkciju lijevoga ventrikula.
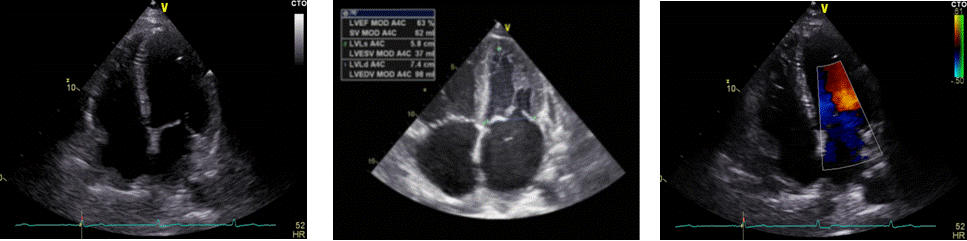
|
Slika 1.14. Apikalni prikaz četiri šupljine, 2D-prikaz
|
|
Slika 1.15. Apikalni prikaz četiri šupljine, 2D-prikaz – Simpson metoda (označivanje)
|
|
Slika 1.16. Apikalni prikaz četiri šupljine, obojeni dopler
|
|
Slika 1.17. Apikalni prikaz četiri šupljine,kontinuirani dopler, trikuspidalni zalistak
|
|
Slika 1.18. Apikalni prikaz četiri šupljine, pulsni dopler, mitralni zalistak
|
|
Slika 1.19. Apikalni prikaz četiri šupljine, M-prikaz, TASPE
|
Apikalni 2D-prikaz pet šupljina dobiva se usmjeravanjem ultrazvučnoga snopa anteriorno, tako da snop bude usmjereniji površnije, što omogućava prikaz i pete šupljine koja predstavlja izlazni trakt lijevoga ventrikula. Iz ove pozicije procjenjujemo njegovu morfologiju (hipertrofija, membrane), kao i morfologiju aortnoga zaliska (Slika 1.20.). U ovom prikazu kontinuiranim doplerom određujemo brzine protoka kroz aortni zalistak, a pulsnim doplerom brzinu protoka kroz izlazni trakt lijevoga ventrikula (Slika 1.21. i 1.22.).
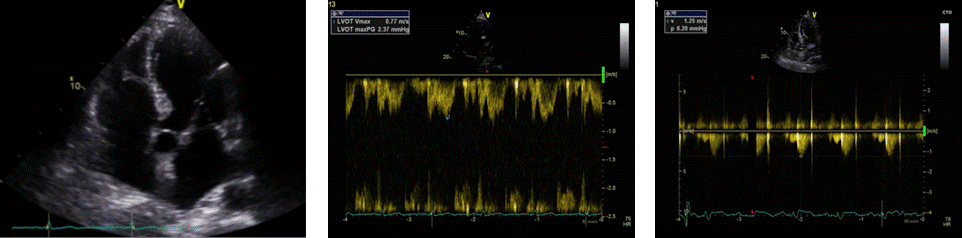
|
Slika 1.20. Apikalni prikaz pet šupljina, 2D-prikaz
|
|
Slika 1.21. Apikalni prikaz pet šupljina, pulsni dopler, mjerenje brzine LVOT
|
|
Slika 1.22. Apikalni prikaz pet šupljina, kontinuirani dopler, mjerenje brzine aortalnog zaliska
|
Apikalni 2D-prikaz dvije šupljine postiže se rotacijom ultrazvučne sonde za oko 45 stupnjeva iz projekcije apikalnoga presjeka četiri šupljine suprotno od smjera kazaljke na satu. Ovim prikazom promatraju se lijevi ventrikul i lijevi atrij, dok se interventrikularni septum u ovom prikazu ne treba vidjeti (Slika 1.23.). Ovaj presjek koristimo za procjenu kontraktilnosti inferiorne i anteriorne stijenke lijevoga ventrikula te procjenu sistoličke funkcije opisanom Simpsonovom metodom (Simpson SP, singleplane) (Slika 1.24.). Ovaj prikaz omogućava i morfološku procjenu mitralnog zaliska, kao i promatranje protoka obojenim doplerom.
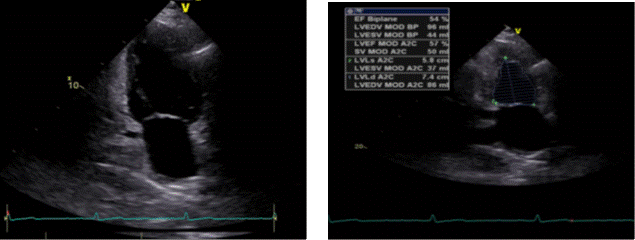
|
Slika 1.23. Apikalni prikaz dvije šupljine, 2D-prikaz
|
|
Slika 1.24. Apikalni prikaz dvije šupljine, Simpson SP
|
Apikalni prikaz tri šupljine ili apikalni prikaz duge osi podrazumijeva nastavak rotacije ultrazvučne sonde za još 45 stupnjeva suprotno od smjera kazaljke na satu u odnosu na prethodnu poziciju (apikalni prikaz dvije šupljine), pri čemu se dobiva prikaz sličan parasternalnoj dugoj osi (samo s pogledom srca iz pozicije apeksa). Ovaj se presjek najčešće koristi za promatranje kontraktilnosti posterolateralne stijenke lijevoga ventrikula te interventrikularnoga septuma.
Subkostalni prozor. Pregled srca iz ove projekcije omogućen je kod bolesnika u ležećem položaju na leđima (u slučaju napetosti trbušne stijenke potrebno je saviti noge u koljenima). Sonda se polaže ispod ksifoidnoga nastavka s pokazivačem na sondi usmjerenim ulijevo tako da je ultrazvučni snop usmjeren prema gore u smjeru lijevoga ramena. Na ovaj se način u 2D-prikazu prikazuje srce u presjeku četiri šupljine, pri čemu se analizira morfologija srčanih šupljina (npr. uvećanje desnoga srca kod tlačnoga opterećenja), kao i interatrijskoga i interventrikularnoga septuma (Slika 1.25.). Ovaj je prikaz bitan i u procjeni perikardijalnoga izljeva i njegovoga utjecaja na hemodinamiku (kompresija na srce). Pregled u ovome prozoru završava procjenom veličine i kolapsibilnosti donje šuplje vene u M-prikazu na mjestu udaljenom 3 cm od utoka u desni atrij (prikaz donje šuplje vene postiže se rotacijom sonde za 90 stupnjeva iz pozicije subkostalnoga prikaza četiri šupljine – Slika 1.26. i 1.27.).
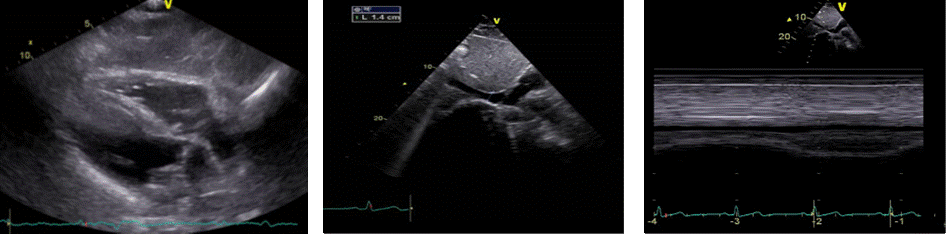
|
Slika 1.25. Supkostalni 2D-prikaz
|
|
Slika 1.26. Supkostalni 2D-prikaz, vena kava inferior
|
|
Slika 1.27. Supkostalni M-prikaz, vena kava inferior (kolapsibilnost)
|
Suprasternalni prozor. Prikaz srca iz ove projekcije postiže se kod bolesnika koji leži na leđima s vratom u ekstenziji i glavom okrenutom u lijevu stranu. Ultrazvučna sonda postavlja se u jugulum, pri čemu je ultrazvučni snop usmjeren prema dolje i ukoso. 2D-prikazom se prikazuje uzlazna aorta, luk aorte s brahiocefaličnom arterijom, lijeva zajednička karotidna arterija, lijeva arterija subklavija te kranijalni segment silazne aorte (Slika 1.28.). U poprečnom se presjeku prikazuje i desna plućna arterija u dijelu koji prolazi ispod aortnoga luka. Ovaj se presjek koristi prvenstveno za određivanje dimenzija luka aorte, ponekad i u dijagnostici disekcije ili koarktacije aorte.
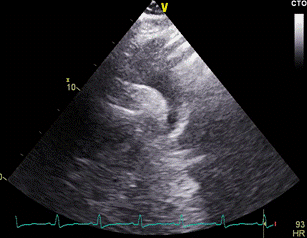
|
Slika 1.28. Suprasternalni 2D-prikaz
|
Ehokardiografska mjerenja. Standardna ehokardiografska mjerenja aorte i srčanih šupljina izvode se u dugoj parasternalnoj osi u M-prikazu takozvanom edge to edge metodom (mjerenje od jednoga do drugog unutarnjeg ruba šupljine) na odgovarajućim pozicijama. Mjerenje korijena aorte i desnoga ventrikula vrše se u dijastoli, a mjerenje lijevoga ventrikula i u sistoli i u dijastoli. Osim toga, mjere se i debljina interventrikularnoga septuma i stražnjega zida lijevoga ventrikula u dijastoli. Anteroposteriorni promjer lijevoga atrija mjeri se na kraju sistole. Najčešća ehokardiografska mjerenja dana su u Tablici 1.6.
|
Tablica 1.6. Najčešća ehokardiografska mjerenja
|
|
Kratica
|
Značenje
|
Referentna vrijednost
|
|
LVIDd (PLAX)
|
Unutarnji promjer lijevoga ventrikula u dijastoli
|
35 do 56 mm
|
|
LVIDs (PLAX)
|
Unutarnji promjer lijevoga ventrikula u sistoli
|
21 do 40 mm
|
|
RV (PLAX)
|
Unutarnji promjer desnoga ventrikula u dijastoli
|
7 do 26 mm
|
|
LA (PLAX)
|
Unutarnji promjer lijevoga atrija u sistoli
|
19 do 40 mm
|
|
Ao (PLAX)
|
Unutarnji promjer aortnoga korijena
|
20 do 37 mm
|
|
ACS (PLAX)
|
Separacija aortnih kuspisa
|
15 do 26 mm
|
|
IVSd (PLAX)
|
Debljina interventrikularnoga septuma u dijastoli
|
7 do 12 mm
|
|
LVPW (PLAX)
|
Debljina stražnje stijenke lijevoga ventrikula
|
7 do 12 mm
|
|
VCI (subkostalno)
|
Donja šuplja vena
|
11 do 23 mm
|
Doplerska mjerenja omogućavaju mjerenja brzine protoka krvi kroz određena područja, a najčešće su to srčani zalisci i izlazni trakt lijevoga ventrikula. Kontinuirani dopler koristimo za mjerenje protoka kroz aortni zalistak te za mjerenje regurgitacija na trikuspidalnom i mitralnom zalisku, dok pulsni dopler koristimo za mjerenje protoka u izlaznom traktu lijevoga ventrikula te protoka kroz mitralni, pulmonalni i trikuspidalni zalistak. Pri tome se uobičajeno mjere tri parametra: maksimalna brzina protoka (Vmax), maksimalni gradijent tlaka (PG) te srednji gradijent tlaka (MG). Više je o doplerskim mjerenjima vezano uz pojedine valvularne greške rečeno u odgovarajućim poglavljima o bolestima srčanih zalistaka.
Procjena sistoličke funkcije. Procjena sistoličke funkcije lijevoga ventrikula podrazumijeva određivanje istisne ili ejekcijske frakcije lijevoga ventrikula i/ili određivanjem frakcije skraćenja. Istisna ili ejekcijska frakcija (EF) označava postotak krvi izbačene iz lijevoga ventrikula u jednoj sistoli, a normalno iznosi 50 do 70 %. Najčešće metode mjerenja istisne frakcije su prethodno opisana Simpsonova biplanarna metoda te manje pouzdana Teichholzova metoda koja se određuje mjerenjima dimenzija lijevoga ventrikula u M-prikazu. Frakcija skraćenja (FS) je druga mjera sistoličke funkcije lijevoga ventrikula, a označava frakcijsko skraćenje unutarnjih dimenzija lijevoga ventrikula koje se dobiva mjerenjem unutarnjega promjera lijevoga ventrikula na kraju sistole i na kraju dijastole, a normalne vrijednosti su one iznad 25 %. Procjena sistoličke funkcije desnoga ventrikula vrši se na temelju TAPSE metode (engl. tricuspidal annular plane systolic excursion) te FAC metode (engl. fractional area change) koja se temelji na promjeni površine desnoga ventrikula na kraju sistole i kraju dijastole. Normalne FAC vrijednosti iznose 31 do 60 %.
Procjena dijastoličke disfunkcije vrši se mjerenjem protoka kroz mitralni zalistak pomoću pulsnoga doplera, pri čemu se analiziraju brzine E i A-vala mitralnoga protoka tj. njihovi omjeri (E/A), vrijeme decelaracije E-vala (DtE) te vrijeme izovolumne relaksacije (IVRT) (Slika 1.29.). E-val predstavlja protok tijekom ranoga dijastoličkog punjenja koje nastaje kao posljedica tlačnoga gradijenta između lijevoga atrija i lijevoga ventrikula, dok A-val predstavlja protok krvi u kasnoj dijastoli koji je posljedica atrijske kontrakcije. Vrijeme deceleracije E-vala mjeri se od vrha E-vala do bazalne linije vanjskim rubom spektra. Na temelju ovih vrijednosti razlikujemo pet stupnjeva dijastoličke disfunkcije (Tablica 1.7.).
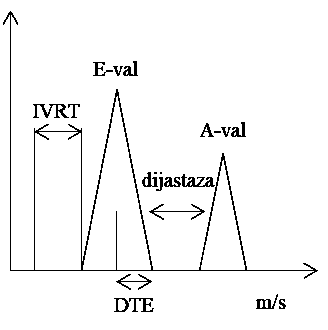
Slika 1.29. Transmitralni protok
|
Tablica 1.7. Stupnjevi dijastoličke disfunkcije prema ehokardiografskim parametrima
|
|
Oblici dijastoličke disfunkcije
|
Uredan nalaz
|
DD I. stupnja
|
DD II. stupnja
|
DD III. stupnja
|
DD IV. stupnja
|
|
Produljena relaksacija
|
Pseudonormalni tip
|
Reverzibilni restriktivni tip
|
Ireverzibilni restriktivni tip
|
|
IVRT (m/s)
|
60 - 90
|
> 105
|
60 - 105
|
< 60
|
< 60
|
|
E/A
|
0,75 - 1,5
|
< 0,75
|
0,75 - 1,5
|
> 1,5
|
> 1,5
|
|
DTE (m/s)
|
140 - 220
|
> 240
|
140 - 220
|
< 140
|
< 140
|
TRANSEZOFAGEALNA EHOKARDIOGRAFIJA
Transezofagealna ehokardiografija podrazumijeva ultrazvučni pregled srčanih struktura sondom plasiranom u jednjak, preko kojega se i vrši pregled. Njezina se primjena posebno ističe u analizi stražnjih srčanih šupljina koje nisu lako dostupne transtorakalnim pregledom, kao što su aurikula lijevoga atrija te interatrijski septum, kao i u procjeni uzlazne aorte te srčanih zalistaka (nativni ili umjetni). Koristi se i za intraoperativnu i postoperativnu evaluaciju valvularnih kardiokirurških zahvata.
KLASIČNI RENDGENOGRAM SRCA I PLUĆA
Rendgenska snimka srca i pluća u dvije projekcije (postero-anteriorna i latero-lateralna) kod većine bolesnika predstavlja ishodišnu slikovnu metodu u evaluaciji srčanoga oboljenja, a omogućava analizu položaja, veličine i oblika srca i velikih krvnih žila te analizu plućne cirkulacije. Ukupna analiza obuhvaća i opis plućnoga parenhima, pleure i ošita, što može imati veliko diferencijalno dijagnostičko značenje.
Položaj srca. Srce je u postero-anteriornoj projekciji normalno položeno većim dijelom ulijevo od medijalne linije, a glavninu lijeve konture čini lijevi ventrikul. Na položaj srca osim prirođenih anomalija mogu utjecati i druge bolesti i stanja: deformacije prsnoga koša i kralježnice te bolesti pleure i plućnoga parnehima. Kod osoba s asteničnom konstitucijom srčana je sjena obično mala i uspravno položena, dok se kod adipoznih ljudi srčana sjena doima uvećanom i poprečno položenom. Na položaj srca utječe i stav ošita, pa je kod visokoga stava ošita on potisnut prema gore, pri čemu srčana sjena djeluje prošireno.
Veličina srca. Standardno se za procjenu veličine srca koristi kardiotorakalni omjer, odnosno poprečni promjer srca podijeljen s poprečnim promjerom prsnoga koša. Normalno, promjer srca obično iznosi oko jedne trećine promjera prsnoga koša. Da bi se mogle okvirno analizirati veličine pojedinih šupljina srca u PA-projekciji, analiziraju se zasebno lijeva i desna kontura srca koje se pri tome podijele na segmente. Pri analizi lijeve konture srca razlikujemo četiri segmenta: prvi segment (luk aorte), drugi segment (glavno stablo arterije pulmonalis), treći segment (aurikula lijevoga atrija) i četvrti segment (lijevi ventrikul), dok pri analizi desne konture srca razlikujemo tri segmenta: prvi segment (gornja šuplja vena), drugi segment (uzlazni dio aorte) i treći segment (desni atrij).
Plućna cirkulacija. Plućni crtež čini glavno stablo plućne arterije koja se nakon kratkoga toka od 3 do 4 cm dijeli na desnu i lijevu pulmonalnu arteriju koje se dalje postupno granaju i sužavaju prema periferiji. Čine ga i plućne vene, ali u normalnim hemodinamskim prilikama one se ne razlikuju veličinom od odgovarajućih arterija. Plućni vaskularni crtež najbogatiji je u bazalnim dijelovima (jača prokrvljenost zbog djelovanja gravitacije i povećan volumen parenhima u bazama pluća). Najčešći patološki nalazi plućne cirkulacije su smanjen plućni protok koji je karakteriziran nježnim i neupadljivim izgledom hilarnih i perifernih ogranaka plućne arterije, povećan protok - karakteriziran proširenom sjenom hilarnih i perifernih ogranaka uz reduciranu sjenu perifernoga žilnog crteža uz dilatirane i krupne hilarne i perihilarne vaskularne strukture, što nalazimo kod plućne hipertenzije, te znakovi plućne venske kongestije (Kerleyeve B linije, uvećani i vaskularni hilusi, kranijalna redistribucija krvotoka te znakovi pleuralnoga izljeva). Kerleyeve B linije označavaju nakupljanje tekućine u septalnim limfatičkim prostorima, što se vidi u obliku nježnih i vlasastih linija u kostofreničnom kutu horizontalnoga toka, paralelno s ošitom. Plućni edem karakteriziraju bilateralna, mrljasta i zamagljena zasjenjenja.
KOMPJUTERIZIRANA TOMOGRAFIJA
Kompjuterizirana tomografija (CT) danas se sve češće koristi u kardiovaskularnoj dijagnostici, osobito u dijagnostici koronarne bolesti (koronarografija kompjuteriziranom tomografijom, kalcijski score koronarnih arterija), a može se koristiti i u druge svrhe. Za optimalno snimanje srca potrebno je postići eukardno stanje (srčana frekvencija oko 60/min), a snimanje se vrši u dubokom inspiriju. Brzi i nepravilni srčani ritmovi, kao što je fibrilacija atrija, umanjuju kvalitetu snimke.
Koronarografija kompjuteriziranom tomografijom (CCTA) ili CT koronarografija omogućava prikazivanje koronarnih arterija u visokoj rezoluciji s ciljem dokazivanja i utvrđivanja veličine i mjesta značajne stenoze, kao i karakteristika samoga plaka (stabilan, nestabilan). Pri izvođenju pretrage klasično se koristi jodni kontrast. Pretragu se preporuča izvoditi s ciljem isključivanja koronarne bolesti kod bolesnika kod kojih se sumnja nju (klinička slika, ehokardiografski nalaz i sl.), dok se ne preporuča u svrhu probira. Ova metoda ima važno mjesto i u dijagnostici prirođenih anomalija koronarnih arterija, kao i u procjeni prohodnosti premosnica u stanjima nakon kardiokirurške revaskularizacije miokarda. Velika količina kalcifikata u koronarnim arterijama smanjuje njezinu specifičnost.
Kalcijski score koronarnih arterija označava kvantifikaciju kalcifikacija koronarnih arterija pomoću nativne kompjuterizirane tomografije. On se izražava kao Agatstonov broj, koji se temelji na volumenu i gustoći kalcifikata i kao takav predstavlja prediktor rizičnoga kardiovaskularnog događaja. Visoke vrijednosti kalcijskoga skora (> 300) povezane su s većim rizikom od neželjenih kardiovaskularnih događaja. Osim toga, ova je metoda korisna i u procjeni planiranja intervencijskoga ili kardiokirurškog liječenja (anatomska raspodjela kalcifikacija), a koristi se i kao selekcijski kriterij prije izvođenja CT angiografije (velika količina kalcifikata smanjuje specifičnost CT koronarografije u prikazu signifikantne stenoze).
Ostale primjene kardiovaskularne kompjuterizirane tomografije uključuju mjerenje volumena lijevog ventrikula, istisne frakcije, zadebljanja miokarda, debljinu i kalcifikacije perikarda i sl.
MAGNETNA REZONANCA SRCA
Magnetna rezonanca srca (MR) predstavlja neinvazivnu slikovnu dijagnostičku metodu koja bolesnike ne izlaže štetnom ionizirajućem zračenju, a omogućava uvid u morfologiju i funkciju srca u visokoj rezoluciji s ili bez primjene kontrastnoga sredstva (gadolinij). Najčešće indikacije za MR srca su bolesti miokarda (miokarditis i kardiomiopatije), koronarna bolest, kongenitalne srčane mane, tumori srca te bolesti perikarda. S obzirom na fizikalnu osnovu pretrage (stvaranje magnetskoga polja), ona se ne smije raditi na bolesnicima s ugrađenim metalnim protezama, kao ni na bolesnicima sa srčanim elektrostimulatorom (uređaji novije generacije mogu biti kompatibilni s izvođenjem pretrage, ali se to mora provjeriti prije same pretrage), dok prisutnost umjetnih valvula i intrakoronarnih stentova ne predstavlja kontraindikaciju za izvođenje pretrage. Kod primjene gadolinija kao kontrastnoga sredstva treba imati na umu da se on ne smije primjenjivati kod bolesnika s glomerularnom filtracijom manjom od 30 mL/min te bolesnika koji su na programu kronične hemodijalize (rizik od nastanka nefrogene sistemske skleroze).
Najčešća hitna indikacija za izvođenje MR-a srca sumnja je na miokarditis koji je karakteriziran edemom te ranom i/ili kasnom postkontrastnom imbibicijom subepikardne distribucije. MR srca uz primjenu gadolnija omogućava i razlikovanje ishemijskih od neishemijskih ožiljaka, što ima veliku ulogu u obradi bolesnika s dilatacijskom kardiomiopatijom, a bitnu ulogu ima i u dijagnostici infiltrativnih bolesti miokarda (amiloidoza, sarkoidoza). Također, MR srca omogućava i klasični prikaz morfologije i veličine srčanih komora, što ima veliku ulogu u dijagnostici prirođenih srčanih grešaka, kao i u određivanju stupnja valvularne greške.
NUKLEARNO-MEDICINSKA DIJAGNOSTIKA SRCA
Nuklearno-medicinska dijagnostika srca podrazumijeva primjenu farmaka obilježenih radioaktivnim izotopom. Oni se nakupljaju u miokardu (ili unutar srčanih šupljina) i emitiraju zračenje koje se potom detektira gama ili pozitronskom kamerom, a sve s ciljem procjene perfuzije miokarda (perfuzijska scintigrafija miokarda) ili procjene funkcije lijevoga ventrikula (radionuklidna ventrikulografija). Najčešće nuklearno-medicinske pretrage koje se koriste u ove svrhe su planarna scintigrafija te pozitron-emisijska tomografija (PET) i jednofotonska pozitron-emisijska kompjuterizirana tomografija (SPECT).
Perfuzijska scintigrafija miokarda (planarna, PET, SPECT) izravni je pokazatelj koronarne perfuzije miokarda s obzirom na to da doprema radiofarmaka u kardiomiocite ovisi o njezinoj suficijentnosti. Pretraga se izvodi u fazi mirovanja i nakon opterećenja te se dobiveni rezultati uspoređuju. U slučaju koronarne insuficijencije dolazi do nastanka ispada u nakupljanju radiofarmaka u irigiranom području miokarda. Prisutnost defekta punjenja u opterećenju uz uredan nalaz u mirovanju sugerira na ireverzibilan proces, dok defekt punjenja i u mirovanju i u opterećenju sugerira na ireverzibilnost (ožiljak). Perfuzijska scintigrafija najčešće se primjenjuje u dijagnozi koronarne bolesti s ciljem otkrivanja i opsega ishemije te razlikovanja vijabilnog od ožiljno promijenjenoga miokarda, a posebno je pogodan za procjenu uspješnosti revaskularizacije.
Radionuklidna ventrikulografija izvodi se uz pomoć radioaktivnih obilježenih eritrocita ili albumina koji se primjenjuju intravenski te omogućavaju prikaz položaja, oblika i veličine lijevoga ventrikula, kao i procjenu njegove kontraktilnosti. Razvojem drugih dijagnostičkih metoda (osobito ehokardiografskih koje ne izlažu bolesnika zračenju) radionuklidna ventrikulografija danas se rijetko izvodi.
INVAZIVNE DIJAGNOSTIČKE METODE U KARDIOLOGIJI
Uvod. Kateterizacija srca predstavlja invazivnu dijagnostičku metodu koja podrazumijeva uvođenje katetera putem periferne vene ili arterije u srce s ciljem mjerenja hemodinamskih parametara, uzorkovanja krvi, kontrastnoga prikaza krvnih žila i/ili srčanih šupljina, elektrofiziološkoga ispitivanja, izvođenja intravaskularnoga ultrazvuka ili u svrhu endomiokardijalne biopsije. Osim u dijagnostičke svrhe, kateterizacija srca se sve više primjenjuje i u terapijske svrhe, kao što su perkutana koronarna intervencija ili elektrofiziološke ablacijske metode. U ovome će dijelu teksta biti prikazane najčešće izvođene invazivne dijagnostičke i terapijske procedure u kardiologiji, a detaljnije su njihovo izvođenje i indikacije raspravljeni u pojedinim dijelovima udžbenika.
Koronarografija predstavlja jednu od neizostavnih metoda u dijagnostici koronarne bolesti koja se izvodi naizmjeničnim ubrizgavanjem kontrastnoga sredstva u lijevu i desnu koronarnu arteriju čime se prikazuju njihove glavne grane i ogranci. Promatranje koronarnih arterija nakon aplikacije kontrastnoga sredstva vrši se iz više projekcija kako bi se dobio odgovarajući i bolji uvid u prohodnost koronarnih arterija. Pretraga omogućava prikaz aterosklerotskih promjena koronarnih arterija, njihov opseg i lokalizaciju, kao i procjenu njihova hemodinamskoga značaja. Na temelju nalaza koronarografije donosi se odluka o potrebi i načinu revaskularizacije miokarda.
Lijevostrana ventrikulografija izvodi se tijekom kateterizacije lijevoga srca, a podrazumijeva primjenu kontrastnoga sredstva u lijevom ventrikulu čime se može dobiti uvid u globalnu i segmentalnu kontraktilnost lijevoga ventrikula, njegov volumen i morfologiju, kao i moguću prisutnost mitralne regurgitacije.
Aortografija predstavlja kontrastni prikaz aorte i njezinih ogranaka prilikom kateterizacije lijevoga srca, a može biti korisna u dijagnostici aneurizme, aortne regurgitacije te prikaza nefizioloških spojeva, kao što je perzistentni duktus Botalli.
Kateterizacija lijevoga srca izvodi se uvođenjem katetera putem perifernih arterija (femoralna, brahijalna, radijalna) u aortu, a zatim kroz aortni zalistak u lijevi ventrikul i/ili atrij. Kateterizaciju lijevoga srca moguće je izvesti i transseptalnom perforacijom prilikom kateterizacije desnoga srca. Ona se danas najčešće izvodi s ciljem mjerenja tlakova u aorti, lijevom atriju i lijevom ventrikulu te u svrhu elektrofiziološkoga ispitivanja, a rjeđe u svrhu kontrastnoga prikaza lijevih srčanih komora (lijeva ventrikulografija). Normalne vrijednosti tlakova u aorti i lijevim srčanim šupljinama prikazane su u Tablici 1.8.
|
Tablica 1.8. Hemodinamska mjerenja pri kateterizaciji lijevoga ventrikula
|
|
Hemodinamsko mjerenje
|
Srednja vrijednost
|
Raspon
|
|
Lijevi atrij
|
Enddijastolički tlak lijevoga atrija
|
10 mmHg
|
4 – 16 mmHg
|
|
Kasnosistolički tlak lijevoga atrija
|
12 mmHg
|
6 – 21 mmHg
|
|
Srednji tlak lijevoga atrija
|
8 mmHg
|
2 – 12 mmHg
|
|
Lijevi ventrikul
|
Maksimalni sistolički tlak lijevoga ventrikula
|
130 mmHg
|
90 – 140 mmHg
|
|
Enddijastolički tlak lijevoga ventrikula
|
8 mmHg
|
5 – 12 mmHg
|
|
Aorta
|
Maksimalni sistolički tlak aorte
|
130 mmHg
|
90 – 140 mmHg
|
|
Enddijastolički tlak aorte
|
70 mmHg
|
60 – 90 mmHg
|
|
Srednji tlak aorte
|
90 mmHg
|
70 – 105 mmHg
|
Kateterizacija desnoga srca izvodi se uvođenjem katetera putem femoralne vene i donje šuplje vene u desni atrij, desni ventrikul te plućnu arteriju. Kao i kateterizacija lijevoga srca, najčešće se izvodi s ciljem specifičnih hemodinamskih mjerenja (tlak u desnom atriju, desnom ventrikulu te plućnim arterijama) te elektrofiziološkoga ispitivanja. Osim toga, kateterizacija desnoga srca omogućava i neka druga specifična mjerenja, kao što je mjerenje minutnoga i udarnog volumena (termodilucijska metoda, Fickova jednadžba). Normalne vrijednosti tlakova u desnim srčanim šupljinama i plućnoj arteriji prikazane su u Tablici 1.9.
|
Tablica 1.9. Hemodinamska mjerenja pri kateterizaciji desnoga ventrikula
|
|
Hemodinamsko mjerenje
|
Srednja vrijednost
|
Raspon
|
|
Desni atrij
|
Enddijastolički tlak desnog atrija
|
6 mmHg
|
2 – 7 mmHg
|
|
Kasnosistolički tlak desnog atrija
|
5 mmHg
|
2 – 7 mmHg
|
|
Srednji tlak desnog atrija
|
3 mmHg
|
1 – 5 mmHg
|
|
Desni ventrikul
|
Maksimalni sistolički tlak desnog ventrikula
|
25 mmHg
|
15 – 30 mmHg
|
|
Enddijastolički tlak desnog ventrikula
|
6 mmHg
|
1 – 7 mmHg
|
|
Plućna arterija
|
Maksimalni sistolički tlak plućne arterije
|
25 mmHg
|
15 – 30 mmHg
|
|
Enddijastolički tlak plućne arterije
|
9 mmHg
|
4 – 12 mmHg
|
|
Srednji tlak plućne arterije
|
15 mmHg
|
9 – 19 mmHg
|
|
Srednji okluzvni tlak plućne arterije
|
9 mmHg
|
4 – 12 mmHg
|
Hemodinamske srčane varijable. Na temelju mjerenja tlakova u srčanim šupljinama, aorti i plućnoj arteriji, kao i mjerenja minutnoga volumena različitim matematičkim izračunima (formulama), dobivamo specifične varijable koje služe za dijagnostiku i praćenje bolesnika (srčani indeks, sistemski vaskularni otpor, plućni vaskularni otpor, udarni volumen, udarni indeks te radni indeks desnoga i lijevog ventrikula). Najznačajnije hemodinamske srčane varijable prikazane su u Tablici 1.10.
|
Tablica 1.10. Hemodinamske srčane varijable
|
|
Varijabla
|
Formula
|
Vrijednost
|
Jedinica
|
|
Srčani indeks (CI)
|
|
2,2 - 4,2
|
L/min/m2
|
|
Sistemski vaskularni otpor (SVR)
|
|
1200 - 1500
|
dynes-s/cm5
|
|
Plućni vaskularni otpor (PVR)
|
|
100 - 300
|
dynes-s/cm5
|
|
Udarni volumen (SV)
|
|
60 - 90
|
ml/otkucaj
|
|
Udarni indeks (SI)
|
|
20 - 65
|
ml/otkucaj
|
Kontraindikacije za izvođenje kateterizacije srca mogu biti apsolutne i relativne. Najčešće su kontraindikacije teška nekontrolirana hipertenzija, ventrikularne tahiaritmije, svježi cerebrovaskularni incident, teška anemija, aktivno gastrointestinalno krvarenje, alergija na kontrastno sredstvo, akutno bubrežno oštećenje, teško srčano popuštanje, teška infekcija ili vrućica nepoznata porijekla, poremećaji elektrolita, koagulacijski poremećaji, trudnoća te uznapredovala životna dob komplicirana teškim komorbiditetima.
Komplikacije. Najčešće komplikacije koje prate navedene procedure su smrtni ishod (0,01 %), akutni infarkt miokarda (0,05 %), cerebrovaskularni incident (0,07 %) te maligni poremećaj srčanoga ritma (0,6 %). Ostale komplikacije koje se mogu susresti kod ovih bolesnika su disekcija aorte, perforacija srca, tamponada, srčano popuštanje, alergijska reakcija na kontrastno sredstvo, nefrotoksičnost, blaži poremećaji srčanoga ritma, krvarenje ubodnoga mjesta, infekcija te druge vaskularne komplikacije (tromboza, pseudoaneurizma i sl.).
Intravaskularni ultrazvuk danas se sve češće koristi u dijagnostici ateroskleroze, koronarne bolesti, putem posebnih ultrazvučnih sondi koje se tijekom koronarografije uvode u koronarne krvne žile. Pretraga omogućava procjenu dubine invazije i karakteristike aterosklerotskoga plaka.
Endomiokardna biopsija izvodi se putem posebnoga katetera uvedenog u desni ventrikul putem femoralne ili unutarnje jugularne vene pri čemu se uzima 4 do 6 cilindričnih uzoraka endomiokardnoga tkiva. Osnovne indikacije za biopsiju endomiokarda su praćenje odbacivanja srčanoga transplantata te utvrđivanje kardiotoksičnoga učinka antraciklina, dok se može koristiti i u dijagnostici miokarditisa i kardiomiopatija, iako je napretkom neinvazivnih slikovnih metoda korištenje ove metode za te indikacije znatno rjeđe.
Elektrofiziološko ispitivanje i elektrofiziološke ablacijske metode detaljnije su opisane u poglavlju o poremećajima srčanoga ritma i provođenja.
KRONIČNO SRČANO POPUŠTANJE
Definicija. Srčano popuštanje ili srčano zatajenje podrazumijeva klinički sindrom koji nastaje uslijed strukturnoga i/ili funkcionalnoga poremećaja srca koji dovodi do ispada u njegovoj funkciji sa smanjenjem minutnoga volumena i/ili povišenja intrakardijalnih tlakova i ima za posljedicu tkivnu hipoperfuziju te plućnu i/ili sistemsku kongestiju (Slika 1.30.). Sama definicija podrazumijeva prisutnost simptoma i znakova srčanoga popuštanja, no i prije njih mogu postojati asimptomatski strukturni i funkcionalni poremećaji koji predstavljaju prekursore srčanoga popuštanja (sistolička i dijastolička disfunkcija).
Slika 1.30. Shematski prikaz razvoja sindroma srčanoga popuštanja
Epidemiologija. Srčano popuštanje predstavlja rastući zdravstveni problem te se procjenjuje da pogađa više od 25 milijuna bolesnika diljem svijeta. Ukupna prevalencija u razvijenim zemljama iznosi oko 2% godišnje. Incidencija i prevalencija srčanoga popuštanja u stalnom su porastu, osobito u starijoj životnoj dobi (bolest starije životne dobi). Prevalencija srčanoga zatajenja raste od oko 1 % kod osoba mlađih od 60 godina sve do više od 10 % kod osoba starijih od 80 godina. Više od 75 % postojećih i novodijagnosticiranih slučajeva srčanoga popuštanja zabilježeno je kod oboljelih u dobi iznad 65 godina. Srčano popuštanje jedan je od najčešćih uzroka hospitalizacija bolesnika starije životne dobi, a česte su i rehospitalizacije, što predstavlja i veliko ekonomsko opterećenje.
Klasifikacija. Iako su ranije opisivane različite podjele srčanoga popuštanja, danas najčešće govorimo o tri klinička entiteta: srčano popuštanje s očuvanom istisnom frakcijom (HFpEF), srčano popuštanje s umjereno sniženom istisnom frakcijom (HFmrEF) te srčano popuštanje sa sniženom istisnom frakcijom (HFrEF). Osnovne razlike i kriteriji za ova tri klinička entiteta prikazani su u Tablici 1.11. Navedena klasifikacija nije samo od akademskoga značaja, nego ima i jasne kliničke implikacije vezane uz sam tijek bolesti i, što je bitnije, za sam terapijski pristup. Prema nastupu kliničke slike i brzini razvoja, razlikujemo akutno i kronično srčano popuštanje, a prema dominaciji kliničkih simptoma i znakova razlikujemo zatajivanje desne strane srca (dominiraju znaci sustavne kongestije), zatajivanje lijeve strane srca (dominiraju znaci plućne kongestije i smanjenoga minutnog volumena) te globalno ili obostrano srčano zatajenje.
|
Tablica 1.11. Klasifikacija kroničnoga srčanog popuštanja
|
|
Oblici kroničnog srčanog popuštanja
|
Srčano popuštanje uz sniženje EF
(HFrEF)
|
Srčano popuštanje uz umjereno snižavanje EF (HFmrEF)
|
Srčano popuštanje uz očuvanje EF
(HFpEF)
|
|
Klinička slika
|
Simptomi +/- znakovi
|
Simptomi +/- znakovi
|
Simptomi +/- znakovi
|
|
Ehokardiografija
|
EF ≤ 40%
|
EF 40 – 49 %
|
EF ≥ 50 %
|
|
Dodatni kriteriji
|
Nema
|
Povišeni NT-proBNP + jedan od dva kriterija: relevantna strukturna bolest srca ili dijastolička disfunkcija srca
|
Povišeni NT-proBNP + jedan od dva kriterija: relevantna strukturna bolest srca ili dijastolička disfunkcija srca
|
Etiologija. Svako stanje koje znatnije dovodi do promjene u funkciji ili strukturi miokarda može biti uzrok srčanoga popuštanja. Iako se u nekim pogledima etiologija srčanoga popuštanja s očuvanom i srčanoga popuštanja sa smanjenom istisnom frakcijom razlikuju, ipak postoji znatnije preklapanje između njih. U razvijenim je zemljama koronarna bolest najčešći uzrok srčanoga popuštanja i kod žena i kod muškaraca te se smatra da je ishemijska kardiomiopatija odgovorna za 60 do 75 % svih slučajeva srčanoga popuštanja. Hipertenzija je također značajan etiološki faktor, bilo u kombinaciji s koronarnom bolesti, bilo kao izolirana bolest. Sve više se govori i o dilatacijskim kardiomiopatijama koje se razvijaju kao posljedica određenih genetskih defekata, a pogađaju citoskeletne proteine (dezmin, miozin, vinkulin) i nuklearne membranske proteine (laminin). Kod 20 do 30 % bolesnika točna etiološka osnova srčanoga popuštanja ostaje nepoznata. Također, postoje i različiti precipitirajući čimbenici koji mogu dovesti do samoga nastupa ili do pogoršanja ranije razvijenoga srčanog popuštanja.
Najčešći uzroci srčanoga popuštanja sa srednje sniženom i sniženom istisnom frakcijom su: 1) koronarna bolest (infarkt miokarda, ishemijska kardiomiopatija); 2) kronično tlačno opterećenje (dugotrajna nekorigirana hipertenzija, opstruktivna valvularna bolest, najčešće aortalna stenoza); 3) kronično volumno opterećenje (regurgitirajuća valvularna bolest, intrakardijalni i ekstrakardijalni lijevo-desni šant); 4) kronične plućne bolesti (plućna hipertenzija, kronična opstruktivna plućna bolest, bolesti intersticija); 5) neishemijska dilatacijska kardiomiopatija (genetski poremećaji, infiltrativne bolesti); 6) lezija miokarda izazvana lijekovima ili toksinima (virusne infekcije, metabolički poremećaji, kemoterapija) te 7) poremećaji srčanoga ritma (kronične bradiaritmije i kronične tahiaritmije).
Najčešći uzroci srčanoga popuštanja s očuvanom istisnom frakcijom su: 1) patološka hipertrofija lijevoga ventrikula (primarna hipertrofijska kardiomiopatija, sekundarna hipertrofija uslijed hipertenzije); 2) restriktivna kardiomiopatija (infiltrative bolesti – amiloidoza, sarkoidoza; bolesti odlaganja – hemokromatoza); 3) endomiokardna fibroza te 4) starenje.
Precipitirajući čimbenici. Prethodno navedene uzroke često podržavaju i različiti precipitirajući čimbenici koji pridonose nastanku ili pogoršanju srčanoga popuštanja. Takvi su: ishemija miokarda, poremećaji srčanoga ritma, plućna embolija, vrućica i infekcije, anemija, poremećaji rada štitne žlijezde (tireotoksikoza), terapijska nesuradljivost (neredovito uzimanje lijekova), nepridržavanje dijetnoga režima (prekomjeran unos soli), prekomjeran unos alkohola, neprimjerena fizička aktivnost, jatrogeno volumno opterećenje (infuzije, transfuzije) i trudnoća.
Patofiziologija. Srčano popuštanje progresivni je poremećaj započet inicijalnim događajem koji dovodi do narušavanja strukture i/ili funkcije miokarda. Inicijalni događaj može nastupiti naglo (npr. opsežni akutni infarkt miokarda) ili postupno (npr. arterijska hipertenzija, valvularna bolest). Kod nagloga nastupa inicijalnoga događaja klinička slika srčanoga popuštanja razvija se vrlo brzo, dok kod postupnoga nastupa bolesnici dugo vremena ostaju asimptomatski ili blago simptomatski, a razlog tome leži u mogućnosti miokarda da odgovori na inicijalni događaj kompenzacijskim mehanizmima kojima se nastoji održati dostatan srčani minutni volumen. U daljnjemu će tekstu biti prikazani osnovni kompenzacijski mehanizmi kojima se nastoji očuvati srčani minutni volumen, kao i osnovne molekularne promjene u slučaju srčanoga popuštanja s očuvanom istisnom frakcijom i sa smanjenom istisnom frakcijom.
Kompenzatorni mehanizmi predstavljaju fiziološki odgovor na inicijalnu noksu koja dovodi do narušavanja strukture i/ili funkcije miokarda, s ciljem očuvanja srčanoga minutnog volumena urednim. Glavni pokretač kompenzacijskih mehanizama je pad srčanoga minutnog volumena koji nastaje djelovanjem inicijalnoga događaja na miokard. U osnovi kompenzatorni mehanizmi uključuju: 1) aktivaciju simpatičkoga živčanog sustava; 2) aktivaciju sustava renin-angiotenzin te 3) aktivaciju drugih neurohumoralnih molekula i citokina. U konačnici, sve će te promjene dovesti i do strukturalnih promjena na samom miokardu, a taj se proces naziva remodulacijom miokarda.
Pojačana aktivacija simpatičkoga živčanog sustava jedan je od prvih kompenzacijskih mehanizama koji se javlja kod nastupa srčanoga popuštanja. Posljedica je pada tlaka u arterijama uslijed slabljenja kontraktilne snage miokarda uzrokovanog inicijalnim događajem te posljedične aktivacije arterijskih baroreceptora. Kod takvih su bolesnika dokazane povišene razine noradrenalina, kao i povećana aktivnost simpatičkih živčanih vlakana. Simpatikus jača srčanu kontrakciju, ubrzava frekvenciju te uzrokuje vazokonstrikciju, a sve to dovodi do povećanja srčanoga minutnog volumena. S vremenskim odmakom dolazi do gubitka receptora za noradrenalin (proces desenzitacije), pa i učinak toga kompenzacijskog mehanizma slabi. Povišene koncentracije noradrenalina povezane su s lošijim ishodom. Utjecaj ostalih katekolamina nije do kraja istražen.
Sustav renin-angiotenzin aktivira se relativno rano pri srčanom zatajenju. Osnovni inicijatori aktivacije toga sustava su renalna hipoperfuzija, beta-adrenergična stimulacija te hiponatrijemija. Angiotenzin II dovodi do vazokonstrikcije i posljedičnoga povišenja tlaka, a poboljšava i glomerularnu filtraciju povećanjem protoka krvi kroz bubrege. Aldosteron uzrokuje retenciju natrija i vode, što u konačnici povećava intravaskularni volumen. Početno ti mehanizmi povećavaju minutni volumen, no dugoročno pogoršavaju funkciju miokarda volumnim i tlačnim opterećenjem. Neka su istraživanja pokazala i da angiotenzin II i aldosteron mogu imati i direktne štetne učinke na miokard (vaskularna hipertrofija, miokardna fibroza).
Natriuretski peptidi (BNP, ANP) redovito su povišeni pri srčanom popuštanju kao odgovor na volumno opterećenje, a djelujući na bubrege pojačavaju natriurezu i izlučivanje volumena te tako predstavljaju protutežu sustavu renin-angiotenzin. Također, pri srčanom su popuštanju prisutne i povišene razine vazodilatacijskih prostaglandina (PGE2, PGI2) kojima se nastoji poboljšati renalna hemodinamika. Kod nekih se bolesnika pojavljuje i povišenje cirkulirajućega endotelina i vazopresina (djeluju vazokonstriktorno te smanjuju diurezu). U srčanom se popuštanju bilježe i povećane koncentracije proupalnih citokina (TNF-α, IL-1β, IL-6) koji mogu pridonijeti kontraktilnoj disfunkciji, fibrozi miokarda, a smatra se da imaju i posrednu ulogu pri štetnom djelovanju katekolamina i angiotenzina II na miokard.
Remodeliranje miokarda. Navedeni neurohumoralni mehanizmi, tj. njihova prekomjerna aktivacija, dovest će do strukturnih promjena samoga miokarda što jednim imenom nazivamo remodeliranje (pregradnja). Promjene uključuju sljedeće: 1) hipertrofiju miocita; 2) promjene kontraktilnih svojstava miocita; 3) progresivni gubitak miocita (nekroza, apoptoza); 4) beta-adrenergičku desenzibilizaciju (gubitak beta-adrenergičkih receptora) te 5) reorganizaciju izvanstaničnoga matriksa (promjena organizacije kolagenskih vlakana). Biološki stimulansi koji provociraju navedene promjene su mehaničko rastezanje miocita, cirkulirajući neurohormoni (noradrenalin, angiotenzin II), proupalni citokini (TNF-α, IL-1β, IL-6) te ostali peptidi i faktori (endotelin). Makromorfološki, proces remodelacije miokarda dovodi do promjena u masi, volumenu i obliku lijevoga ventrikula. Lijeva klijetka postupno se dilatira i mijenja svoj oblik od fiziološkoga elipsoidnog oblika prema sferoidnoj formi. Istodobno dolazi i do intersticijskih promjena u smislu fibroze, a sve to vodi prema nekoordiniranoj i manje učinkovitoj kontrakciji. Sam proces remodeliranja negativno utječe na funkciju miokarda i vodi u pogoršanje srčane funkcije, stoga se farmakološkim utjecajem na navedene neurohumoralne mehanizme nastoji usporiti proces remodeliranja miokarda.
Patofiziologija srčanoga popuštanja sa sniženom istisnom frakcijom. Osnova ovoga oblika srčanoga zatajenja smanjena je kontraktilna sposobnost miokarda, tj. sistolička disfunkcija. Osnovna molekularna zbivanja potaknuta su mehaničkim opterećenjem (volumno, tlačno), kao i aktiviranim neurohumoralnim mehanizmima. Oni dovode do promjene genske ekspresije kontraktilnih proteina, kao i miocitolize te kidanja citoskeletnih veza. Sve ove promjene u konačnici dovode do slabljenja kontraktilne snagne pojedinih miocita, a onda i miokarda u cjelini.
Patofiziologija srčanoga popuštanja s umjereno sniženom i očuvanom istisnom frakcijom. Razumijevanje patofiziologije ovih oblika srčanoga popuštanja nije do kraja razjašnjeno, ali se temelji na dijastoličkoj disfunkciji miokarda. Dijastolička disfunkcija u prvom je redu uzrokovana strukturnim promjenama miokarda i/ili poremećajem prometa kalcija koji ometaju normalnu relaksaciju i popustljivost. Kako je relaksacija miokarda povezana s izbacivanjem kalcija putem kalcijskih pumpi koje su ovisne o ATP-u, njegov nedostatak (npr. u ishemiji) dovest će do produljene i neodgovarajuće relaksacije miokarda, što ometa normalno dijastoličko punjenje ventrikula. Strukturne promjene, kao što je intersticijska fibroza, također mogu ometati normalnu relaksaciju miokarda. Dijastoličku disfunkciju pogoršavaju i tahiaritmije zbog skraćenja vremena dijastole te smanjenja protoka kroz koronarne arterije s obzirom na to da se protok kroz koronarne arterije odvija samo u dijastoli. Sve te promjene dovode do povišenja tlaka lijevoga ventrikula na kraju dijastole (engl. LVEDP – left ventricular end-diastolic pressure), što se retrogradno prenosi i na plućnu cirkulaciju. U odnosu na uznapredovalost, razlikujemo četiri stupnja dijastoličke disfunkcije: I stupanj (produljena relaksacija miokarda lijeve klijetke), II stupanj (pseudonormalni tip), III stupanj (reverzibilni restriktivni tip) te IV stupanj (ireverzibilni restriktivni tip).
Klinička slika - simptomi zatajivanja srca. Najizraženiji simptomi u bolesnika sa zatajenjem srčane funkcije su dispneja, ortopneja, paroksizmalna noćna dispneja, Cheyne-Stokesovo disanje, osjećaj umora i slabosti, nikturija i cerebralni simptomi.
Dispneja je subjektivan osjećaj nestašice zaraka. U ranoj se fazi pojavljuje tek pri težem fizičkom naporu, a u uznapredovalome se stanju javlja i u mirovanju. Patofiziološki, dispneja je multifaktorijalne prirode, ali središnji je događaj plućna kongestija i intersticijski edem koji dovodi do aktivacije jukstakapilarnih J receptora koji stimuliraju ubrzano i plitko disanje. S obzirom na to da pluća postaju kruća, potrebno je uložiti dodatan napor pri disanju što dodatno pogoršava dispneju.
Ortopneja je oblik dispneje koji se javlja kod bolesnika u ležećem položaju, a nastaje zbog preraspodjele tekućine iz splanhičnih vena i vena donjih udova u prsni koš te dovodi do porasta plućnoga kapilarnog tlaka i opterećenja srca. Takvi bolesnici često u krevetu zauzimaju povišeni položaj (Fowlerov položaj) ili spavaju s puno jastuka ne bi li uspravljanjem olakšali disanje.
Paroksizmalna noćna dispneja nagla je pojava dispneje koja je praćena jakim kašljem te budi bolesnika iz sna, a obično se javlja dva do tri sata nakon usnivanja. Za razliku od ortopneje, bolesnicima zauzimanje povišenoga položaja ne donosi olakšanje. Patofiziologija uključuje preraspodjelu tekućine u ležećem položaju, ali i usporavanje aktivnosti respiracijskoga centra. Često se kod ovih bolesnika pojavljuje i bronhospazam, kao posljedica prepunjenosti bronhijalnih vena koje vrše pritisak na same bronhe (tzv. kardijalna astma).
Umor i slabost posljedica su opće tkivne hipoperfuzije. Dijelom su odraz poremećaja vazodilatacije, a dijelom anaerobnoga metabolizma.
Cheyne-Stokesovo disanje tip je disanja koji se javlja kod smanjene osjetljivosti respiracijskoga centra. Ciklički se smjenjuju faze intenzivnoga, forsiranog i oslabljenog disanja. Tijekom oslabljenoga disanja ili faze apneje dolazi do pada PaO2 te porasta PaCO2, što dovodi do pojačane stimulacije centra za disanje. Ovaj obrazac disanja prisutan je kod oko 40% bolesnika s uznapredovalim srčanim popuštanjem i obično je povezan s niskim minutnim volumenom.
Nikturija ili pojačano mokrenje noću javlja se već u ranim fazama zatajivanja srca. Tijekom dana bolesnici manje mokre zbog smanjenoga minutnog volumena i redistribucije krvotoka zbog fizičke aktivnosti. Oligurija (smanjeno mokrenje) javlja se u kasnijoj fazi kao posljedica smanjenoga minutnog volumena.
Cerebralni simptomi nastaju zbog hipoperfuzije mozga, a to su: smetenost, zaboravljivost, nesanica, glavobolja, poremećaji orijentacije i dr.
Klinička slika – znakovi zatajivanja srca. Od glavnih znakova zatajenja srca opisat ćemo stanje uhranjenosti, znakove povećane simpatičke adrenergičke aktivnosti, auskultacijski nalaz srca i pluća te znakove nakupljanja tekućine (sustavna kongestija).
Stanje uhranjenosti. Akutni su bolesnici obično dobro uhranjeni, dok kronični pokazuju znakove slabije uhranjenosti sve do kaheksije (tzv. kardijalna kaheksija). Razvoj kaheksije povezuje se s edemom sluznice probavne cijevi kao posljedice sustavne kongestije zbog čega se javljaju mučnina, povraćanje i anoreksija. Također, zbog toga je otežana i apsorpcija hranjivih tvari iz crijeva. Sve se više govori i o ulozi citokina u razvoju kardijalne kaheksije.
Znakovi pojačane adrenergičke aktivnosti (tj. periferne vazokonstrikcije) su: bljedilo kože, osjećaj hladnih udova, cijanoza okrajina (akrocijanoza), prekomjerno znojenje i proširene periferne vene. Uslijed pojačane stimulacije simpatikusa javlja se ubrzan srčani rad (tahikardija). Krvni tlak početno može biti normalan ili povišen, ali s napredovanjem srčanoga popuštanja razvija se hipotenzija.
Fizikalni nalaz srca. Kod prisutne kardiomegalije vršak srca (iktus) uobičajeno je pomaknut ispod petoga interkostalnog prostora i/ili lateralno u odnosu na medioklavikularnu liniju. Protodijastolički galop (S3) osnovni je auskultacijski znak srčane insuficijencije. Taj ton nastaje u ranoj dijastoli, a odgovara fazi brzoga dijastoličkog punjenja zbog smanjene rastezljivosti ili proširenja ventrikula. Kod plućne hipertenzije koja prati zatajivanje lijevoga ventrikula čuje se glasna plućna komponenta drugoga tona, a nekada i sistolički šum relativne trikuspidalne ili mitralne regurgitacije. Srčana akcija je ubrzana.
Fizikalni nalaz pluća. Najkarakterističniji znak plućnoga zastoja su hropci koji se u blažim oblicima čuju obostrano bazalno, dok se kod plućnoga edema čuju difuzno. Rjeđe hropce čujemo samo na jednoj strani, a onda je to najčešće na desnoj strani. Uslijed zastoja i edema bronhalne sluznice možemo naći i auskultacijske znakove bronhospazma (produljen i otežan ekspirij, engl. wheezing). U slučaju pleuralnih izljeva iznad tih polja disanje se ne čuje, a perkutorno se registrira muklina.
Znakovi nakupljanja tekućine. Zbog sistemskoga venskog zastoja vratne vene su distendirane i jetra je povećana (hepatomegalija). U slučaju trikuspidalne insuficijencije može se izazvati hepatojugularni refleks (pritiskom na jetru povećavaju se vratne vene). Ascites nastaje kao posljedica povećanoga tlaka u veni porti i perifernim venama. Edemi nogu znak su perifernoga zastoja, javljaju se simetrično, tjestasti su, hladni, i noću se ne smanjuju.
NYHA klasifikacija. U kliničkoj se praksi za procjenu težine bolesti najčešće primjenjuje NYHA klasifikacija (engl. New York heart association). Prema njoj bolesnike svrstavamo u četiri stupnja. U prvome stupnju bolesnici imaju dispneju samo pri većim naporima, dok uobičajene aktivnosti ne dovode do simptoma. Drugi stupanj uključuje manje ograničenje aktivnosti, a dispneja se javlja pri uobičajenim naporima. U trećem stupnju nalazimo značajnu redukciju tjelesne aktivnosti, a dispneja je prisutna i pri malim naporima, ali je odsutna u mirovanju. Četvrti stupanj uključuje bolesnike koji imaju dispneju i druge kliničke manifestacije i u mirovanju.
Dijagnoza se postavlja na temelju anamneze, fizikalnoga nalaza, laboratorijskih nalaza - uključujući biokemijske markere srčanoga popuštanja, elektrokardiografije, rendgenske snimke srca i pluća, ehokardiografije i drugih slikovnih metoda te u rjeđim slučajevima, invazivnim dijagnostičkim postupcima (kateterizacija srca, endomiokardna biopsija). S obzirom na to da je koronarna bolest jedan od najčešćih uzroka srčanoga popuštanja, potrebno je procijeniti i provesti dijagnostičku obradu u tom pogledu. Inicijalni dijagnostički postupak kod bolesnika sa sumnjom na srčano popuštanje prikazan je shematski (Slika 1.31.).
Slika 1.31. Inicijalni dijagnostički algoritam kod bolesnika sa sumnjom na srčano popuštanje
Laboratorijski nalazi. U crvenoj krvnoj slici možemo naći anemiju ili policitemiju. Povišeni kreatinin i ureja upućuju na bubrežnu disfunkciju (kardiorenalni sindrom). Često su prisutne i proteinurija i povećana specifična težina mokraće. Vrijednosti elektrolita su uredne u početnim fazama zatajivanja srca. Bolesnici koji primaju diuretike mogu biti skloni hipokalemiji. U uznapredovaloj bolesti nalazimo hiperkalemiju (smanjena glomerularna filtracija) i dilucijsku hiponatrijemiju. Hepatalna kongestija uzrokuje povišenje bilirubina, AST-a, ALT-a i LDH-a. U obradi je potrebno ispitati i hormone štitnjače. Također, kod svih je bolesnika potrebno odrediti lipidogram te HbA1c hemoglobin u slučaju patoloških vrijednosti glukoze u plazmi natašte (šećerna bolest, oštećena tolerancija glukoze).
Biokemijski markeri srčanoga popuštanja. Vrijednosti natriuretskih peptida (BNP i NT-proBNP) mogu biti korisne u dijagnostici srčanoga popuštanja. Njihove povišene vrijednosti posljedica su pojačanoga otpuštanja iz opterećenoga srčanog mišića. Osjetljivije su u dijagnostici srčanoga popuštanja sa smanjenom istisnom frakcijom nego kod srčanoga popuštanja s očuvanom istisnom frakcijom. Određivanje natriuretskih peptida preporuča se samo u svrhu isključenja srčanoga popuštanja, ali ne i za postavljanje dijagnoze. Treba imati na umu da vrijednosti natriuretskih peptida rastu s dobi, kod oštećene bubrežne funkcije, te su više kod žena. Lažno niske vrijednosti mogu se naći u pretilih bolesnika sa srčanim popuštanjem. Također, manju osjetljivost testa bilježimo i kod bolesnika s KOPB-om. U hitnim stanjima, određivanje BNP-a ili NT-proBNP markera može biti korisno pri razlikovanju dispneje kardiogenoga i nekardiogenog porijekla. Povišenje troponina, osobito visoko-osjetljivoga troponina (engl. high-sensitivity troponin), nalazimo kod akutnoga i kod kroničnoga srčanog popuštanja te se smatra negativnim prognostičkim znakom.
Elektrokardiografija pokazuje patološka odstupanja, ali odstupanja nisu specifična za zatajivanje srca i ovise o osnovnoj bolesti koja je u podlozi. Najčešći patološki EKG nalazi kod srčanoga popuštanja su smetnje repolarizacije, poremećaji intraventrikularnoga provođenja, znakovi hipertrofija ventrikula te niska voltaža. Elektrokardiografija nam služi za praćenje srčanoga ritma, uočavanje znakova hipertrofije lijevoga ventrikula, kao i za otkrivanje ranijih infarkata miokarda što upućuje na postojanje ishemijske kardiomiopatije.
Rendgenska snimka srca i pluća. Jedan od najčešćih radioloških znakova srčanoga popuštanja je povećanje srčane sjene ili kardiomegalija. Ona se može izraziti omjerom poprečnoga promjera srca i poprečnoga unutrašnjeg promjera toraksa, tzv. kardiotorakalni indeks koji je normalno manji od 0,5. Treba imati na umu da više od jedne trećine bolesnika sa srčanim popuštanjem ima normalan kardiotorakalni indeks. Ipak, kardiomegalija nije ni osjetljiv ni specifičan pokazatelj sistoličke disfunkcije lijevoga ventrikula. Uvijek treba pregledati i stanje plućnoga vaskularnog crteža i uočiti znakove plućne kongestije. U početnoj su fazi krvne žile podjednako široke i u donjim i u gornjim dijelovima pluća, ali s napredovanjem bolesti, tj. povišenjem tlaka u plućnim venama, crtež u donjim dijelovima postaje oskudniji. Na snimci se može uočiti i plućni edem, karakteriziran mrljastim promjenama, često konfluentnim u srednjim plućnim poljima, nalik krilima leptira. U kroničnom zatajivanju lijevoga ventrikula progresijom plućne venske kongestije tekućina zaostaje u septalnim limfatičnim prostorima, što se opisuje kao Kerleyjeve B linije (sitne trakaste sjene koje teku usporedno s ošitom). U danjem tijeku bolesti nalazimo mrežoliko pojačanje intersticijskoga crteža. Nekada se otkrije i pleuralni izljev, a on je češći i veći na desnoj strani (desno plućno krilo ima veću pleuralnu površinu). Radiološka snimka srca i pluća korisna je i u otkrivanju respiratornih oboljenja koja mogu oponašati kliničku sliku srčanoga popuštanja (diferencijalno-dijagnostički značaj).
Ehokardiografija je pouzdana, neinvazivna metoda kojom možemo dobiti rijetke podatke o strukturi i funkciji srca, pa postaje neophodna u dijagostici zatajenja srca. Predstavlja dijagnostičku metodu izbora u dijagnostici srčanoga popuštanja. Ehokardiografijom se dokazuje prisutnost i opseg sistoličke i/ili dijastoličke funkcije, a na temelju procjene vrijednosti istisne frakcije srca, bolesnike svrstavamo u prethodno navedene tri skupine (HFpEF, HFmrEF, HFrEF). Također, ehokardiografija pruža i dodatne korisne informacije, kao što su procjena morfologije srčanih šupljina (dilatacija, hipertrofija), procjena kontraktilnosti stijenki (hipokineza i akineza kao posljedica ishemije i nekroze) te procjena morfologije i funkcije srčanih zalistaka. Osim toga, pruža mogućnost otkrivanja postojanja plućne hipertenzije na temelju indirektnih znakova i kriterija. Postoje i stanja kod kojih je teže napraviti dobar pregled ultrazvukom, kao što su emfizem, prekomjerna tjelesna masa, fibrilacija atrija i sl.
Magnetska rezonanca srca (MRI) predstavlja slikovnu metodu izbora za procjenu srčanih struktura i funkcije kod bolesnika s lošim akustičnim eho prozorom (tehnički loša ehokardiografija), kao i kod bolesnika koji imaju kompleksne nasljedne bolesti srca. Magnet srca posebno je koristan u dijagnostici srčanoga popuštanja pri sumnji na specifične oblike kardiomiopatija (amiloidoza, hemokromatoza), kao i u procjeni etiologije dilatacijske kardiomiopatije (primjenom gadolinija moguće je razlikovati ishemijsko od neishemijskoga tkiva).
Desnostrana srčana kateterizacija u samoj dijagnostičkoj obradi srčanoga popuštanja danas se rijetko izvodi zbog dobro razvijenih neinvazivnih dijagnostičkih metoda koje daju pouzdane podatke kakvi bi se dobili i kateterizacijom srca. Kateterizacija desnoga srca s kateterom plućne arterije preporuča se kod bolesnika s teškim srčanim popuštanjem u pripremi za transplantaciju srca i mehaničku cirkulacijsku potporu, a može se razmotriti i kod bolesnika s vjerojatnom plućnom hipertenzijom otkrivenom ehokardiografijom, s ciljem procjene reverzibilnosti prije pristupa korekciji valvularne bolesti te kod simptomatskih bolesnika s nejasnom etiologijom i hemodinamskim statusom srčanoga popuštanja. Tijekom kateterizacije srca može se izvršiti i endomiokardna biopsija s ciljem patohistološkoga pregleda uzorka u svrhu otkrivanja etiologije (bolesti odlaganja, infiltrativne bolesti), a obično se indicira kod bolesnika s nejasnom, brzonapredujućom srčanom bolesti.
Dijagnostika koronarne bolesti. Kod svih bolesnika s rizičnim čimbenicima za koronarnu bolest, kod bolesnika sa simptomima koronarne bolesti te kod bolesnika s neizravnim dokazima postojanja koronarne bolesti (pozitivna ergometrija, ehokardiografski ispadi kontraktilnosti, elektrokardiografski znaci preboljenoga infarkta) potrebno je obaviti koronarografiju (ili CT angiografiju koronarnih arterija), kako bi se to i potvrdilo. Među svim tim bolesnicima potrebno je identificirati one koji su kandidati za revaskularizaciju jer je dokazano da sama revaskularizacija poboljšava ishod kod bolesnika sa srčanim popuštanjem.
Liječenje srčanoga popuštanja sa sniženom istisnom frakcijom. Ciljevi liječenja su: 1) simptomatsko olakšanje kod bolesnika; 2) poboljšanje funkcionalnog stanja te 3) prevencija učestalih hospitalizacija i smrti bolesnika. Osnovni terapijski postupci uključuju liječenje reverzibilnih uzroka srčanoga popuštanja te farmakološke i nefarmakološke metode liječenja. Opće mjere liječenja podrazumijevaju provođenje određenoga režima prehrane da bi se reducirala tjelesna masa ako se radi o pretilom bolesniku, smanjenje unosa soli i tekućine, prestanak pušenja, prestanak konzumacije alkoholnih pića te je poželjna umjerena tjelesna aktivnost, ovisno o stanju bolesnika (dinamičke vježbe, šetnja). U NYHA IV. nije poželjna tjelesna aktivnost. Shematski prikaz terapijskoga pristupa bolesniku s HFrEF-om prikazan je na Slici 1.32.
Liječenje reverzibilnih uzroka srčanoga popuštanja ima najveći značaj u liječenju ovih bolesnika jer smanjenjem ili uklanjanjem tih uzroka značajno utječemo na usporenje napredovanja srčanoga popuštanja. Mjere podrazumijevaju prikladno liječenje koronarne bolesti, medikamentnu kontrolu hipertenzije, liječenje valvularnih srčanih grešaka i koegzistentnih aritmija. Također, potrebno je smanjiti ili ukloniti negativni utjecaj različitih lijekova i alkohola na srčano popuštanje (blokatori kalcijskih kanala, nesteroidni protuupalni lijekovi).
Farmakološke mjere liječenja uključuju primjenu lijekova koji utječu na samu bolest, bilo u smislu olakšanja simptoma, bilo u smislu usporavanja progresije (diuretici, lijekovi s učinkom na renin-angiotenzinski sustav, beta blokatori, angiotenzin receptor-neprilisin inhibitor, ivabradin, glikozidi digitalisa, vazodilatatori) te ostalih potrebnih farmakoloških mjera (antikoagulacijska terapija, antiaritmička terapija, primjena statina).
Diuretici su najmoćniji lijekovi u simptomatskoj terapiji srčanoga popuštanja s obzirom na to da se povećanom diurezom smanjuju simptomi izazvani plućnom i sistemskom kongestijom, a smanjuje se i volumno srčano opterećenje. Treba imati na umu da pretjerana diureza može dovesti do značajnijega elektrolitskog disbalansa, kao i pojačane neurohormonske aktivacije, što može pogoršati stanje, stoga primjena diuretika kod ovih bolesnika mora biti strogo dozirana i redovno praćena. U liječenju se koriste tiazidski diuretici, diuretici Henleove petlje te diuretici koji štede kalij. Moguća je i učinkovita njihova kombinacija.
Tiazidski diuretici lijekovi su izbora u liječenju srednje teških oblika srčanoga popuštanja i obično su diuretici s kojima započinjemo liječenje. Najčešće se primjenjuju hidroklortiazid (25 – 100 mg/dan), metolazon (2,5 – 5 mg/dan) te klortalidon (25 – 50 mg/dan). Tiazidi postaju neučinkoviti kada glomerularna filtracija padne ispod 30 - 40 mL/min, osim metolazona koji zadržava učinkovitost i do glomerularne filtracije od 20 - 30 mL/min. Nuspojave su hipokalijemija, deplecija intravaskularnoga volumena (hipotenzija, prerenalna azotemija), neutropenija i trombocitopenija, hiperglikemija, hiperurikemija te povišenje jetrenih transaminaza.
Diuretici Henleove petlje koriste se kod težih oblika srčanoga popuštanja, odnosno kada se kontrola simptoma ne može održati tiazidskim diureticima. Najčešće se primjenjuju furosemid (20 - 320 mg/dan), torsemid (20 - 200 mg/dan) te bumetanid (1 - 8 mg/dan). Karakterizira ih brzi početak i kratko vrijeme djelovanja. Zbog toga se u bolesnika s očuvanom bubrežnom funkcijom preferiraju dvije ili više dnevnih doza u odnosu na jednu veću dozu. Diuretici Henleove petlje primjenjuju se peroralno, osim u akutnim situacijama i situacijama kada je apsorpcija lijeka otežana (edem sluznice crijeva), kada se primjenjuju intravenski. Torsemid može pokazati bolju učinkovitost kada je furosemid nedjelotvoran, a to se povezuje s njegovom boljom apsorpcijom i dužim poluvijekom života. Kod oštećene bubrežne funkcije mogu biti potrebne visoke doze diuretika (i do 500 mg furosemida ili ekvivalenta). Glavne su nuspojave deplecija intravaskularnoga volumena (hipotenzija, prerenalna azotemija) te hipokalijemija (osobito kod bolesnika koji uzimaju i digitalis). Manje česte nuspojave su osipi, gastrointestinalne smetnje te ototoksičnost.
Diuretici koji štede kalij imaju veći značaj u liječenju zbog čuvanja kalija i smanjenja mogućnosti nastanka hipokalijemije, nego zbog samog diuretskog učinka. Stoga se ti lijekovi kombiniraju s tiazidima ili diureticima Henleove petlje. Triamteren (37,5 – 75 mg/dan) te amilorid (5 – 10 mg/dan) djeluju na distalni tubul gdje smanjuju sekreciju kalija, a diuretski učinak je zanemariv. Najčešće su nuspojave hiperkalijemija, gastrointestinalni simptomi te bubrežna disfunkcija. Spirinolakton (12,5 – 100 mg/dan) i eplerenon (25 – 100 mg/dan) djeluju kao antagonisti aldosterona te, osim što štede kalij, imaju i povoljan utjecaj na tijek srčanoga popuštanja (kasnije opisano). Osim hiperkalijemije (koja je osobito izražena ako bolesnici dobivaju još i ACE inhibitore), česta nuspojava spirinolaktona je ginekomastija.
Kombinacije diuretika. Osim već spomenute kombinacije tiazidskih diuretika ili diuretika Henleove petlje s diureticima koji štede kalij u svrhu prevencije hipokalijemije, kombinacija diuretika Henleove petlje s tiazidima može biti korisna kod bolesnika s refrakternim edemima. Najpogodniji tiazid za tu kombinaciju je metolazon zbog dostatne učinkovitosti i kod nižih vrijednosti glomerularne filtracije, što je često prisutno kod takvih bolesnika. Obično se daje 2,5 mg metolazona uz diuretik Henleove petlje. U početku je to dovoljno dva do tri puta tjedno, no u nekim se slučajevima zadovoljavajuća diureza izazove tek s dodatkom 10 mg metolazona na dnevnoj bazi. Ova kombinacija mora biti strogo praćena jer može izazvati ekscesivnu diurezu i elektrolitni disbalans.
Lijekovi s učinkom na renin-angiotenzin-aldosteronski sustav. Kako je već opisano, aktivacija neurohumoralnih mehanizama u kojima ovaj sustav ima vodeću ulogu vodi prema remodelaciji miokarda i time progresiji srčanog popuštanja. Blokiranjem ovoga sustava smanjuje se njegova prekomjerna aktivnost, a time se smanjuje i proces remodelacije te se usporava srčana progresija. U ovu skupinu lijekova ubrajamo ACE inhibitore, blokatore angiotenzin-II receptora te antagoniste aldosterona (spirinolakton, eplerenon).
ACE inhibitori (inhibitori enzima angiotenzin konvertaze) su lijekovi koji dokazano imaju višestruku pozitivnu ulogu u bolesnika s srčanim popuštanjem: smanjuju smrtnost, smanjuju broj hospitalizacija zbog pogoršanja srčanoga popuštanja, povećavaju toleranciju fizičkoga napora te reduciraju simptome srčanoga popuštanja. Zbog navedenoga, ACE inhibitori (zajedno s diureticima) predstavljaju prvu liniju liječenja srčanoga popuštanja, bilo simptomatskih, bilo asimptomatskih bolesnika (bolesnici s EF-om manjim od 40 %, bez simptoma). ACE inhibitore bi u terapiju trebalo uvoditi s oprezom, zbog toga što mogu dovesti do značajne hipotenzije, osobito nakon prvih doza lijeka. To je obično izraženije kod bolesnika koji imaju niže vrijednosti tlaka od ranije, bolesnika s hipovolemijom i/ili prerenalnom azotemijom te hiponatrijemijom (indikator aktivacije renin-angiotenzin-aldosteronskog sustava). Kod tih bolesnika treba započeti nižim dozama lijeka te ih postupno tijekom nekoliko tjedana povećavati do klinički učinkovitih doza koje su potvrđene kliničkim studijama: enalapril 10 mg dvaput dnevno; ramipril 10 mg jednom dnevno ili lizinopril 20 mg jednom dnevno. Asimptomatska hipotenzija nije kontraindikacija za povišenje doze lijeka. Kod nekih bolesnika bilježimo i porast serumskoga kreatinina i kalija, ali ako su te razine stabilne, nije potrebno isključivati lijek iz terapije, čak ni pri većim vrijednostima kalija (do 5,5 mmol/L). Ovo se češće susreće u starijih bolesnika, dijabetičara i bolesnika s nižim vrijednostima sistoličkoga arterijskog tlaka. Najčešće su nuspojave vrtoglavica (koja ne korelira s vrijednostima krvnoga tlaka) i kašalj (povezano s interferencijom s metabolizmom bradikinina). Angioedem je rijetka, ali potencijalno ozbiljna nsupojava koja također nastaje uslijed interferencije s metabolizmom bradikinina. S obzirom na to da ovi lijekovi suprimiraju i aktivnost enzima kinaze II, dolazi do porasta koncentracije bradikinina.
Blokatori angiotenzinskih II receptora lijekovi su koji ostvaraju sličan učinak kao i ACE inhibitori, no drugim mehanizmom. Oni ne sprečavaju nastanak angiotenzina II, nego sprečavaju učinak već stvorenoga angiotenzina II blokiranjem njegovih receptora (AT1 receptori). Smatra se da su ovi lijekovi u potpunosti ekvivalentni ACE inhibitorima što se tiče učinka na srčano popuštanje, iako rezultati provedenih studija nemaju jasno dosljedne zaključke te se primjenjuju samo kao alternativa kod kontraindikacija ili lošega podnošenja ACE inhibitora. S obzirom na to da ne interferiraju s metabolizmom bradikinina, ovi se lijekovi bolje podnose ako bolesnik razvije neki oblik nuspojave na ACE inhibitore (najčešće kašalj). Kod nas se najčešće primjenjuje valsartan u dozi 160 mg dvaput dnevno, s time da se počinje s nižim dozama (40 – 80 mg dvaput dnevno) i postupno ih se povisuje te losartan (početna doza 1 x 50 mg/dan, ciljna doza 1 x 150 mg/dan) i kandesartan (početna doza 1 x 4 – 8 mg/dan, ciljna doza 32 mg/dan). Kao i kod ACE inhibitora, kod bolesnika se mogu očekivati hipotenzija, hiperkalijemija i aztemija kao nuspojave.
Antagonisti mineralokortikoidnih receptora (MRA) također su korisni u liječenju srčanoga popuštanja, i to kao lijekovi koji preveniraju nastanak hipokalijemije kod bolesnika na diuretskoj terapiji te kao lijekovi koji utječu na usporavanje remodeliranja miokarda. Kako je već navedeno, primjenjuju se spirinolakton i eplerenon. Zbog mogućnosti nastanka hiperkalijemije, potrebna su češća mjerenja kalija (nakon jednoga tjedna i nakon četiri tjedna terapije), osobito kod bolesnika s oštećenom bubrežnom funkcijom te bolesnika koji istodobno uzimaju i ACE inhibitore.
Beta blokatori su lijekovi kojima je također dokazano da imaju povoljan utjecaj na smanjenje progresije srčanoga popuštanja te na poboljšanje ishoda same bolesti (smanjena smrtnost, manji broj hospitalizacija i sl.). Mehanizam takve koristi temelji se na smanjenju učinka katekolamina na miokard (povišene razine katekolamina i pojačana simpatička stimulacija dovode do progresivnoga oštećenja miokarda te pogoršanja funkcije lijevoga ventrikula). Beta blokatori koji se koriste pri ovoj indikaciji su: 1) karvediol (neselektivni β-1 i β-2 antagonist), 2) metoprolol-sukcinat ili metoporol s produljenim oslobađanjem (selektivni β-1 antagonist), 3) bisoprolol (selektivni β-1 antagonist) te nebivolol (selektivni β-1 antagonist s vazodilatacijskim učinkom preko endotelnog L-arginina putem dušikova oksida). Metoprolol-tartarat ili kratkodjelujući metoprolol nije učinkovit u srčanom popuštanju. Danas se preporučuje uvesti jedan od ovih lijekova svim bolesnicima sa srčanim popuštanjem koji nemaju znakove pogoršanja simptoma ili volumnoga opterećenja te ako nemaju nekardijalnih kontraindikacija (npr. izraženu plućnu bolest). S obzirom na to da uvođenje ove terapije može dovesti do pogoršanja srčanoga popuštanja zbog nagloga učinka na kompenzacijske mehanizme, doziranje mora biti postupno i pažljivo. Početna doza karvediola iznosi 3,125 mg dvaput dnevno te se postupno povećava na 6,25, 12,5 i 25 mg dvaput dnevno u vremenskim intervalima od oko dva tjedna. Uvođenje metoprolola s produljenim oslobađanjem započinje s 12,5 ili 25 mg jednom dnevno te se doza udvostručuje svaka dva tjedna do ciljne doze od 200 mg jednom dnevno. Početna doza bisoprolola je 1,25 mg jednom dnevno te se ona udvostručuje svakih 1 do 4 tjedna do doze od 10 mg jednom dnevno. Prije povećanja doze beta blokatora potrebno je ocijeniti djelovanje ranijih doza. Ako je došlo do pogoršanja simptoma, što se obično očituje zadržavanjem tekućine (pogoršanje edema, dispneje), treba odgoditi povišenje doze, ili u težim slučajevima čak i smanjiti dozu beta blokatora, a korisno može biti i povećati dozu diuretika.
Angiotenzin receptor-neprilisin inhibitor (ARNI) predstavlja novi lijek koji se koristi u liječenju srčanoga popuštanja, a radi se o kombinaciji sakubitrila i valsartana. Sakubitril je inhibitor neprilizina, enzima koji razgrađuje natriuretske peptide čime osigurava njihove pozitivne učinke, kao što su vazodilatacija, smanjenje vrijednosti arterijskoga tlaka, smanjenje simpatičkoga tonusa, pojačanje natriureze/diureze, smanjenje lučenja vazopresina i aldosterona dok valsartan (blokator angiotenzinskih receptora) djeluje blokirajući sustav renin-angiotenzin-aldosteron i tako smanjuje njegov negativan učinak na tijek srčanoga popuštanja. Sakubitril/valsartan koristi se u liječenju bolesnika sa srčanim popuštanjem sa smanjenom istisnom frakcijom koji ostaju simptomatski, unatoč odgovarajućim dozama ACE inhibitora ili blokatora angiotenzinskih receptora, beta blokatora i inhibitora mineralokortikoida. Istodobna primjena sakubitril/valsartana i drugih ACE inhibitora kontraindicirana je zbog potencijalnoga rizika od angioedema, zbog čega se ovaj lijek može uvesti u terapiju najmanje 36 sati od prekida terapije ACE inhibitorima. Liječenje se ne smije započeti kod bolesnika s razinom kalija većom od 5,4 mmol/L te kod onih s vrijednostima sistoličkoga krvnog tlaka ispod 100 mmHg. Početna doza lijeka je 49/51 mg dva puta na dan, a doza se udvostručuje od 2. do 4. tjedna do ciljne doze od 97/103 mg dva puta na dan, ako je bolesnik podnosi. Kod bolesnika koji su bili na nižim dozama ACE inhibitora ili ARB-ova ili nisu uopće uzimali te lijekove, početna doza treba iznositi 24/26 mg dva puta na dan. Nije potrebna korekcija doze lijeka kod bolesnika s oštećenom funkcijom bubrega ili jetre.
Ivabradin je lijek novije generacije koji djeluje na sinusni čvor, na tzv. pacemaker stanice gdje selektivnom i specifičnom inhibicijom If kanala smanjuje srčanu frekvenciju bez da ima učinak na atrioventrikularno ili intraventrikularno provođenje, kao ni na srčanu kontraktilnost. Primjena ivabradina preporuča se kod bolesnika sa sinusnim ritmom i frekvencijom većom od 70/min, uz EF niži od 35 % i prisutne simptome, unatoč odgovarajućim dozama beta blokatora, ACE inhibitora (ili ARB-ova) te antagonista aldosterona. Ivabradin se preporuča kod bolesnika kod kojih je kontraindicirana primjena beta blokatora ili ih teško podnose. Početna doza je 5 mg dvaput dnevno, a može se povisiti na 7,5 mg dvaput dnevno ili smanjiti na 2,5 mg dvaput dnevno (ovisno o postizanju srčane frekvencije, potrebno je održavati frekvenciju između 50 i 60/min).
Glikozidi digitalisa nekada su bili lijek izbora u terapiji srčanoga popuštanja, dok su danas namijenjeni samo određenim situacijama. Oni blokiraju Na/K crpku i povećavaju unutarstaničnu razinu natrija, što pridnosi povećanom utoku kalcija u stanice i povećanom oslobađanju kalcija iz sarkoplazmatskoga retikuluma te tako potiče interakciju između miozina i aktina. Osim toga, digitalis produžuje refraktorno razdoblje u AV-čvoru i usporava provedbu podražaja stimulacijom vagusa. Uvođenje digitalisa u terapiju srčanoga popuštanja može se razmatrati kod bolesnika koji ostaju simptomatski, unatoč optimalnoj terapiji ACE inhibitorima, diureticima i beta blokatorima te bolesnika sa srčanim popuštanjem koji imaju fibrilaciju atrija s brzim odgovorom ventrikula, kod kojih se ne postiže kontrola frekvencije ventrikula drugim lijekovima. Potrebne doze digitalisa se razlikuju, tako da se kreću od 0,125 mg do 0,5 mg jednom dnevno. Manje doze potrebne su kod bolesnika s oštećenom bubrežnom funkcijom, starijih bolesnika te kod mršavih bolesnika. Oblici digitalisa su digoksin i metildigoksin. U oba slučaja liječenje započinje početnom dozom zasićenja, tzv. digitalizacijom, a zatim se nastavlja dozom održavanja. Digitalizacija metildigoksinom postiže se oralnom primjenom 0,2 mg triput dnevno tijekom dva do četiri dana, a zatim se nastavlja dozom održavanja koja iznosi 0,05 do 0,3 mg u jednoj ili više dnevnih doza. Mjerenje koncentracije digitalisa u serumu vrši se sedam do četrnaest dana od početka terapije (mjerenje bi trebalo biti najmanje šest sati nakon uzimanja posljednje doze). Optimalna doza digitalisa u serumu iznosi 0,7 do 1,2 ng/mL, a toksični učinak obično se bilježi tek kad koncentracija poraste iznad 1,8 ng/mL. Amiodaron, propafenon i verapamil mogu u značajnijoj mjeri povisiti serumsku razinu digitalisa. Glavne nuspojave digitalisa su ventrikularne tahiaritmije, osobito u prisutnosti hipokalijemije ili ishemije miokarda. Jednom kada se postigne odgovarajuće doziranje digitalisa, nije potrebna česta provjera njegove koncentracije u serumu, osim ako ne dođe do promjene u bubrežnoj funkciji ili bolesnik počne uzimati lijekove koji povećavaju njegovu koncentraciju.
Vazodilatatori. Učinak vazodilatatora pri srčanom popuštanju je skroman i oni se koriste u iznimnim situacijama. Preporuke za primjenu vazodilatatora (nitrata, hidralazina) nose nisku razinu preporuke i to za bolesnike sa srčanim pupuštanjem koji imaju snižen EF, i u slučaju da ne podnose ACE inhibitore ili ARB-ove, ili ako su simptomi i dalje prisutni, unatoč optimalnom liječenju ACE inhibitorima, beta blokatorima te diureticima. Intravenski vazodilatatori (nitroglicerin, natrij-nitroprusid) indicirani su u liječenju akutnoga srčanog popuštanja (kasnije opisano). U ovoj indikaciji najprikladniji peroralni vazodilatator je izosorbit-dinitrat u dozi od 20 do 80 mg dva do tri puta dnevno. Pomaže smanjenju simptoma srčanoga popuštanja, ali nema utjecaja na progresiju same bolesti. Glavne nuspojave su hipotenzija i glavobolja. Dugotrajna primjena ovih lijekova može dovesti do razvoja tolerancije. Oralna primjena hidralazina pokazuje samo povoljne učinke kada se primjenjuje s nitratima. Ipak, zbog potrebe relativno visokih doza (200 – 400 mg/dan) ovoga lijeka za klinički učinak, većina bolesnika ih loše podnosi. Glavne nuspojave su hipotenzija, tahikardija te glavobolja.
SLGT2 inhibitori. U budućnosti će važnu ulogu u liječenju srčanog zatajenja s reduciranom sistoličkom funkcijom sigurno imati i SLGT2 inhibitori (inhibitori kotranspotera glukoze i natrija 2). Trenutno jedino službeno odobrenje od strane FDA (The Food and Drug Administration) ima dapagliflozin koji je pokazao 25 %-tno smanjenje rizika od smrtnosti kardiovaskularnog uzroka, kao i hospitalizacija zbog zatajenja srca kod bolesnika sa smanjenim EF-om, uključujući one s i bez šećerne bolesti. Primarni mehanizam djelovanja temelji se na regulaciji razine glukoze u plazmi inhibiranjem resorpcije glukoze i natrija u proksimalnim tubulama bubrega (povećavaju natriurezu i glukozuriju), a kardioprotektivni učinak imaju i sekundarni učinci kao što su smanjenje ukupne mase tjelesne masti (uključujući visceralno masno tkivo) te smanjenje razine albuminurije i mokraćne kiseline u serumu. Lijekovi nose nizak intrizični rizik od hipoglikemije.
Lijekovi koje treba izbjegavati pri srčanom popuštanju sa sniženim EF-om su: glitazoni (peroralni antidijabetici), većina blokatora kalcijskih kanala (s iznimkom amlodipina i felodipina), nesteroidni protuupalni lijekovi (mogu dovesti do retencije tekućine i utjecati na bubrežnu funkciju), a također treba izbjegavati istodobnu kombinaciju ACE inhibitora i ARB-ova zbog velikoga rizika od nastanka hiperkalijemije.
Antikoagulacijsko liječenje. Srčano popuštanje sa sniženim EF-om ima ponešto povećan rizik nastanka intrakardijalnoga tromba i sustavne embolizacije. Taj je rizik veći kod bolesnika s fibrilacijom atrija, kod bolesnika s prethodnim tromboembolijskim incidentima te kod bolesnika koji su imali prednji infarkt miokarda veće lokalizacije. Kod takvih je bolesnika opravdana peroralna antikoagulacijska terapija (kod bolesnika s preboljenim prednjim infarktom do tri mjeseca nakon infarkta), a kod ostalih i doživotno. Ostali bolesnici sa srčanim popuštanjem imaju stopu nastanka tromboembolijskoga incidenta od 2 na 100 bolesnika što odgovara stopi razvoja ozbiljnijega krvarenja i rutinsku primjenu antikoagulantnih lijekova kod ovih bolesnika ne čini opravdanom.
Antiaritmijsko liječenje. Bolesnici sa srčanim popuštanjem imaju veću incidenciju razvoja bilo simptomatskih, bilo asimptomatskih aritmija. Ambulantno nadziranje srčanoga ritma kroz 24 sata kod ovih bolesnika pokazuje visoku učestalost asimptomatskih aritmija (kod više od 70 % bolesnika). Iznenadna pojava ventrikularnih poremećaja ritma uzrok je nagle srčane smrti velikoga broja takvih bolesnika. Primjena beta blokatora ima povoljan učinak na prevenciju srčanih aritmija, stoga i u ovom segmentu pokazuje svoju opravdanost kao jedan od osnovnih lijekova za srčano popuštanje. Rutinska primjena amiodarona ili ostalih antiaritmika nije opravdana i ne poboljšava ishode bolesnika. Studije su pokazale da kod bolesnika s fibrilacijom atrija nema razlike u ishodu kod bolesnika kojima se nastojala održati kontrola ritma u odnosu na one kojima se nastojalo održati kontrolu frekvencije, stoga se ne inzistira na održavanju sinusnog ritma ako je to otežano.
Nefarmakološke metode liječenja srčanoga popuštanja sa sniženim EF-om uključuju implantaciju kardioverter defibrilatora (ICD), resinhronizacijsku biventrikularnu elektrostimulaciju (CRT), koronarnu revaskularizaciju, transplantaciju srca te neke oblike mehaničke srčane potpore.
Ugradnja ICD-a (engl. implantable cardioverter defibrilator) indicirana je kod nekih bolesnika sa srčanim popuštanjem. Njegova je uloga da prepozna ventrikularni maligni poremećaj ritma te isporuči elektrošok i prekine smrtonosnu aritmiju i tako spriječi iznenadnu smrt. Svi bolesnici koji su preživjeli epizodu VF/VT bez pulsa kandidati su za ugradnju ICD-a i kod njih je očekivano preživljenje duže od jedne godine (sekundarna prevencija). Primarna prevencija (bolesnici koji nisu imali malignu ventrikularnu aritmiju) još uvijek je predmet široke rasprave. Svi bolesnici sa srčanim popuštanjem NYHA II i III i EF manjim od 35 %, unatoč optimalnoj medikamentnoj terapiji kroz tri mjeseca, kod kojih se također očekuje preživljenje duže od jedne godine, bez obzira na etiologiju srčanoga popuštanja, kandidati su za ugradnju ICD-a. Ugradnja ICD-a bolesnicima u stadiju NYHA IV preporuča se samo ako su kandidati za CRT, LVAD ili transplantaciju srca. Osobita korist pokazala se kod ugradnje ICD-a bolesnicima koji su preboljeli infarkt miokarda i imaju ishemijsku kardiomiopatiju. MADIT II studija pokazala je 31 % manju smrtnost u skupini bolesnika koji su imali implantirani ICD.
Biventrikularna elektrostimulacija (engl. CRT – cardiac resynchronisation therapy). Mnogi bolesnici sa srčanim popuštanjem imaju poremećaje intraventrikularnoga provođenja koji se očituju produljenjem QRS-kompleksa ili razvojem potpunoga bloka lijeve grane. To dovodi do disinhronije i pogoršanja sistoličke disfunkcije. Biventrikularna elektrostimulacija podrazumijeva istodobnu elektrostimulaciju putem dvije elektrode, a to su: stimulacija desnoga ventrikula od apeksa te stimulacija lijevoga ventrikula od lateralne stijenke preko koronarnoga sinusa. Ovisno o mogućnosti defibrilacije elektrode koja se nalazi u lijevom ventrikulu, razlikujemo dva oblika CRT-a: CRT-p (bez mogućnosti defibrilacije) i CRT-d (s mogućnosti defibrilacije). To poboljšava sinkronizaciju kontrakcije oba ventrikula i u konačnici poboljšava sistoličku funkciju. Studije su pokazale da ovakav način liječenja dovodi do porasta EF-a, poboljšanja simptoma, bolje tolerancije napora te smanjuje broj hospitalizacija i smrtnih ishoda. CRT se preporučuje kod bolesnika koji su u sinusnom ritmu, a može se primijeniti i kod bolesnika s fibrilacijom atrija koji imaju morfologiju bloka lijeve grane uz QRS > 150 ms te EF < 35 %, unatoč optimalnoj medikamentnoj terapiji, a može se razmotriti i kod bolesnika s QRS-om u trajanju od 130 do 149 ms (kontraindiciran je kod bolesnika s QRS-om u trajanju kraćem od 130 ms). CRT se može implantirati i bolesnicima koji već imaju konvencionalni elektrostimulator ili ICD. Bolesnici s ishemijskom kardiopatijom pokazuju minimalno poboljšanje u funkciji lijeve klijetke posljedično razvijenim ožiljnim promjenama. Bolji odgovor nakon ugradnje CRT-a pokazuju žene u odnosu na muškarce (manja površina tijela, veličina srca).
Revaskularizacija miokarda metoda je liječenja koronarne bolesti koja je najčešći uzrok srčanoga popuštanja. Svim bolesnicima kod kojih se ustanovi postojanje koronarne bolesti i koji su kandidati bilo za intervencijsku revaskularizaciju (PCI), bilo za kiruršku revaskularizaciju (CABG) potrebno je to učiniti što ranije. Sama revaskularizacija može dovesti do usporenja progresije srčanoga popuštanja, a u nekim slučajevima i do poboljšanja samoga kliničkog stanja.
Kirurško liječenje srčanoga popuštanja. Ako srčano popuštanje uzrokuju kirurški rješivi uzroci, kao što su srčane greške, kasno otkrivene srčane anomalije i sl., bolesnika treba podvrgnuti operaciji, i to kada nema drugih kontraindikacija. Transplantacija srca također je metoda liječenja srčanoga popuštanja kod nekih bolesnika. U novije se vrijeme izvode i operacije remodeliranja ventrikula (engl. SVR – surgical ventricular restoration), iako studije još ne pokazaju značajnije prednosti zahvata.
Mehaničko srce - LVAD (engl. left venticular assist devices) metoda je liječenja koja se koristi u najtežim oblicima srčanoga popuštanja kod bolesnika kod kojih se kontrola bolesti ne može postići lijekovima i drugim metodama, kao što je premoštenje pa sve do transplantacije srca. Rjeđe se koriste kod bolesnika kod kojih transplantacija neće biti izvršena, kao metoda koja donosi produljenje života. Postupak kompliciraju učestale infekcije, tromboze ili mogućnost krvarenja uslijed antikoagulacije.
Slika 1.32. Shematski prikaz terapijskoga pristupa bolesniku s HFrEF-om
Liječenje srčanoga popuštanja s umjereno sniženom i očuvanom istisnom frakcijom. Gotovo polovica bolesnika sa srčanim popuštanjem ima očuvan EF > 40 – 50 %. Kod njih nijedna terapija do sada nije pokazala poboljšanje preživljenja i usporavanja progresije dijastoličke disfunkcije. Također, primjena nefarmakoloških metoda liječenja nije pokazali značajniju terapijsku korist kod takvih bolesnika. Poznavanje čimbenika koji pogoršavaju srčano popuštanje s očuvanim EF-om bitno je zbog razumijevanja terapijskoga pristupa. Sistemska hipertenzija uzrokuje hemodinamsko opterećenje lijevoga ventrikula i pogoršava relaksaciju miokarda u dijastoli. Tahikardija dovodi do skraćenja dijastole, tj. vremena punjenja ventrikula, što dodatno pogoršava dijastoličku disfunkciju. Ovi bolesnici teže podnose i atrijsku fibrilaciju jer im to zbog gubitka atrijske kontrakcije pogoršava dijastoličku funkciju. Ishemija miokarda također pogoršava relaksaciju miokarda i može postati uzrok dijastoličke disfunkcije. Prema tome, glavni su terapijski ciljevi kod takvih bolesnika: 1) dobra kontrola arterijske hipertenzije; 2) kontrola frekvencije ventrikula kod atrijske fibrilacije ili postizanje i održavanje sinusnoga ritma; 3) kontrola plućne i sistemske kongestije primjenom diuretika i nitrata te 4) koronarna revaskularizacija kod bolesnika s koronarnom bolesti.
Korekcija reverzibilnih uzorka srčanoga popuštanja. Hipertenzija, bolesti perikarda i atrijske tahiaritmije potencijalno su reverzibilni uzroci te njihovo liječenje može dovesti do poboljšanja kliničkih ishoda kod ovih bolesnika. S obzirom na to da tahikardije dovode do skraćenja dijastole, tj. skraćenja vremena punjenja ventrikula, njihova kontrola može poboljšati dijastoličku disfunkciju.
Farmakološko liječenje. Diuretska terapija osnovna je simptomatska terapija kod ovih bolesnika, a sve navedeno o diuretskoj terapiji kod bolesnika sa sniženim EF-om odnosi se i na ove bolesnike. Primjena niti jednog od standardnih lijekova koji se koriste kod srčanoga zatajenja nije pokazala utjecaj na poboljšanje konačnoga ishoda (produljenje života, smanjen broj hospitalizacija i sl.). Primjena kalcijskih blokatora kod ovih bolesnika može biti opravdana u nekim situacijama, s obzirom na to da se kočenjem utoka kalcija produljuje vrijeme relaksacije i poboljšava dijastolička disfunkcija. Neke su studije pokazale prednosti kod primjene kandesartana (ARB) u smislu smanjenja broja hospitalizacija, ali ne i ukupne smrtnosti ovih bolesnika. U zadnje se vrijeme provode studije koje uključuju primjenu sildenafila (inhibitor fosfodiesteraze-5), iako dosadašnji rezultati ne pokazuju značajniju kliničku korist.
Prognoza. Kada jednom srčano popuštanje postane klinički manifestno, prognoza je unatoč poboljšanoj terapiji loša. Petogodišnje preživljenje ovih bolesnika od postavljanja dijagnoze iznosi 50 %. Godišnja stopa smrtnosti iznosi 5 % za asimptomatske bolesnike ili bolesnike s umjereno izraženim simptomima, a raste do 30 % kod bolesnika s jasno razvijenom kliničkom slikom. Lošija prognoza povezana je sa starijom životnom dobi, nižom istisnom frakcijom, kroničnom renalnom insuficijencijom te dijabetesom. Ipak, u zadnjih je desetak godina prognoza nešto bolja u odnosu na ranije i to zbog široke primjene ACE inhibitora i beta blokatora koji dokazano poboljšavaju kliničke ishode kod bolesnika sa srčanim puštanjem i sniženim EF-om.
AKUTNO SRČANO POPUŠTANJE I KARDIOGENI EDEM PLUĆA
Definicija. Akutno srčano popuštanje definira se kao brz i progresivan nastanak simptoma i znakova srčanoga popuštanja koji zahtijevaju brzu dijagnostiku i hitno liječenje. Klasično, pojam „akutno srčano popuštanje“ opisuje dva klinička stanja, a to su akutni kardiogeni edem pluća i kardiogeni šok, koji se opisuju odvojeno zbog razlika u terapijskom pristupu. Također, u literaturi se često spominje i klasifikacija akutnoga srčanog popuštanja na temelju fizikalnoga nalaza bolesnika, ovisno o izraženosti simptoma i znakova kongestije i periferne hipoperfuzije (Slika 1.33.). U daljnjem tekstu bit će opisan akutni kardiogeni edem pluća, dok je kardiogeni šok opisan u poglavlju o intenzivnoj medicini.
Slika1.33. Shematski prikaz podjele akutnoga srčanog popuštanja na temelju fizikalnoga nalaza.
Etiopatogeneza. Kardiogeni edem pluća može se javiti naglo, iznenada, bez prijašnjih simptoma i znakova srčanoga popuštanja (de novo) ili se može javiti kao egzacerbacija ranije prisutnoga kroničnoga srčanog popuštanja. Najčešći uzroci akutnoga plućnog edema su: 1) akutni infarkt miokarda ili teška ishemija, 2) egzacerbacija kroničnoga srčanog popuštanja, 3) akutna teška hipertenzija (hipertenzivna kriza), 4) akutno oštećenje bubrega (volumno preopterećenje) te 5) akutna valvularna greška (akutne regurgitacije kao posljedica mehaničke komplikacije akutnoga infarkta). Egzacerbacija kroničnoga srčanog popuštanja najčešće je uzrokovana prekidom uzimanja lijekova (loša suradljivost bolesnika), pojačanim unosom soli u prehrani, pojavom tahiaritmija (najčešće fibrilacija atrija s brzim odgovorom ventrikula), interkurentnom infekcijom ili ishemijom miokarda. Već ovisno o uzroku dolazi do volumnoga i/ili tlačnog opterećenja lijevoga ventrikula, što dovodi do porasta tlaka punjenja i retrogradnoga širenja prema plućnim kapilarama. Povećanje hidrostatskoga tlaka u plućnim kapilarama iznad 30 mmHg dovodi do transudacije tekućine iz kapilara u plućni intersticij i alveole te se u konačnici razvija edem pluća (najprije intersticijski, a potom i alveolarni). U konačnici alveole postaju ispunjene tekućinom, a zadebljala, edematozna alveokapilarna membrana otežava izmjenu plinova zbog čega se razvija teška hipoksemija.
Klinička slika. Kliničkom slikom dominiraju teška dispneja i tahipenija (bolesnici dišu plitko i ubrzano). Javlja se kašalj i pjenušavi iskašljaj - obično bijele boje, no može sadržavati i manje količine krvi. Koža je blijeda, orošena hladnim i ljepljivim znojem uz naznačenu akrocijanozu. Glasno se čuju hropci pri disanju, a prisutni su i znaci korištenja pomoćne respiratorne muskulature (disanje trbuhom, uvlačenje juguluma i interkostalnih prostora). Bolesnici su zaplašeni i imaju osjećaj skoro nadolazeće smrti. Glavni nalaz pri fizikalnom pregledu su krupni i vlažni hropci koji se čuju pri auskultaciji oba plućna krila. Oni su najprije prisutni u inspiriju i pri bazama pluća, no kasnije se čuju i u ekspiriju i nad čitavim plućnim poljima. Nekada može biti naznačen i wheezing zbog edema bronhalne sluznice i bronhoopstrukcije (kardijalna astma). Plućni izljev karakterizira nečujno disanje i perkutorna muklina iznad izljeva.
Dijagnoza. Glavni dijagnostički postupci su anamneza, fizikalni pregled, elektrokardiografija te ultrazvučni ili radiografski pregled pluća. Sumnja na plućni edem mora se postaviti već pri samom kliničkom pregledu jer daljnji dijagnostički postupak mora teći paralelno s terapijskim postupkom. Elektrokardiografija nije specifična, ali može ukazivati na uzrok plućnoga edema (ishemija, tahiaritmija). Rendgen srca i pluća još uvijek je nezaobilazan dio dijagnostičkoga postupka kod sumnje na plućni edem, a nalazi koji idu u prilog toj dijagnozi su kardiomegalija, pleuralni izljev, Kerleyeve B linije (ukazuju na edem intersticija), perihilarna zasjenjenja (znak leptira, znak alveolarnoga edema) te redistribucija krvotoka (kranijalna vazodilatacija). U novije se vrijeme sve više koristi ultrazvuk u dijagnostici plućnoga edema. Karakterističan nalaz ultrazvuka pluća kod plućnoga edema uključuje pojavu tzv. B linija, a to su duge, ravne crte koje prekidaju A linije te se premještaju s klizanjem pleure. Normalno se mogu naći do dvije B linije u jednom interkostalnom prostoru, no nalaz tri ili više ukazuje na plućni edem. Određivanje natriuretskih peptida (BNP i NTpro-BNP) može pomoći u diferencijaciji kardiogenoga od nekardiogenog edema pluća. Blaže povišene troponine možemo naći u sklopu akutnoga popuštanja bez ishemije, dok su njihove vrijednosti značajnije povišene u prisustvu ishemije miokarda. Ehokardiografiju treba napraviti kod svih hemodinamski nestabilnih bolesnika odmah po dolasku u bolnicu, a kada su hemodinamski stabilni, pregled treba obaviti unutar 48 sati od prijema, osobito kod bolesnika s nepoznatom srčanom funkcijom.
Liječenje. Glavni ciljevi liječenja plućnoga edema su: olakšavanje simptoma, smanjenje objektivnih kliničkih znakova, povećanje diureze te poboljšanje oksigenacije. Bolesnika je potrebno postaviti u odgovarajući sjedeći položaj sa spuštenim nogama, procijeniti i osigurati dišni put, osigurati venski pristup (jedan ili više perifernih puteva, centralni venski put), uvesti urinarni kateter te nadzirati bolesnika. Neinvazivni nadzor (engl. monitoring) uključuje elektrokardiografiju, učestalo mjerenje krvnoga tlaka te pulsnu oksimetriju, dok invazivni nadzor uključuje intraarterijsko mjerenje krvnoga tlaka, mjerenje središnjega venskog tlaka te prema potrebi mjerenje tlaka u plućnoj arteriji. Glavne terapijske opcije u liječenju edema pluća su: oksigenoterapija, diuretska terapija, vazodilatacijska terapija, primjena morfija te primjena vazoaktivnih lijekova (inotropi i vazopresori).
Oksigenoterapija i respiratorna resuscitacija. Cilj oksigenoterapije održavanje je saturacije kisikom iznad 90 %. Osnovni postupak je primjena kisika na masku u visokim protocima (FiO2 1.0; 6 – 10 L/min). Ako se tim načinom ne može održati saturacija, sljedeći je korak primjena neinvazivne mehaničke ventilacije - NIV (FiO2 0.5 - 1.0 PEEP 5 - 10 mbar), a ako se ni tim postupkom ne može održati zadovoljavajuća saturacija, bolesnici se moraju endotrahealno intubirati i strojno ventilirati.
Intenzivirana diuretska terapija. Intravenska primjena diuretika osigurava brz početak djelovanja lijeka, a glavni učinci su vazodilatacija i pojačana diureza. Venodilatacija je raniji učinak koji se javlja pri intravenskoj aplikaciji diuretika, a učinak uključuje smanjenje volumnoga opterećenja srca („pospremanje krvi u splanhični bazen”) te smanjenje plućne kongestije. Sam učinak posredovan je prostaglandinima, a javlja se prije učinka pojačane diureze. Pojačana diureza je kasniji efekt, a uključuje smanjenje intravaskularnoga volumena, smanjenje tlačnoga opterećenja desnoga srca te smanjenje plućne kongestije. Bolesnicima koji nisu prethodno bili na diuretskoj terapiji daje se furosemid u dozi od 20 do 40 mg kao intravenski bolus (ili 10 – 20 mg torsemida ili 1 mg bumetanida), a kod slaboga odgovora dozu se može udvostručiti nakon dva sata. Bolesnicima koji su prethodno bili na diuretskoj terapiji daje se furosemid u dozi dvostrukoj većoj od one koju su uzimali u kroničnoj terapiji (a najmanje u istoj dozi), također kao intravenski bolus. Preporuča se nastaviti primjenu diuretika kroz dva ili više bolusa tijekom dana. Kontinuirana intravenska primjena diuretika opravdana je samo kod bolesnika koji ne reagiraju na bolusnu primjenu lijeka, a daje se furosemid u dozi od 5 mg/h kod uredne funkcije bubrega, a kod oštećene funkcije bubrega i do 15 mg/h. Nakon primjene diuretika, pojačana diureza očekuje se već kroz 20 do 30 minuta, a najveća diureza bilježi se unutar jednog do dva sata od intravenske promjene. Za vrijeme intenzivirane diuretske terapije potrebno je kontinuirano kliničko praćenje bolesnika (procjena težine simptoma, praćenje diureze, praćenje tjelesne težine), laboratorijsko praćanje elektrolita (kalij, magnezij), ureje i kreatinina te po potrebi radiološka evaluacija (radiogram, ultrazvuk). Poseban oprez potreban je kod kardiogenoga plućnog edema bez signifikantnoga volumnog preopterećenja (hipertenzivna kriza, akutna aortna ili mitralna insuficijencija) te kod bolesnika u hipotenziji (sistolički krvni tlak ispod 90 mmHg), kada treba smanjiti dozu diuretika ili ih kombinirati s primjenom inotropa i/ili vazopresora.
Vazodilatacijska terapija. Glavni učinci vazodilatatora su smanjenje povišenoga tlaka punjenja i/ili tlačnoga opterećenja lijevoga ventrikula. Smanjenjem volumnoga i tlačnog opterećenja srca smanjuju se intrakardijalni tlakovi. Vazodilatatori su indicirani za sve bolesnike s plućnim edemom i održanim tlakom (sistolički tlak iznad 90 mmHg). Najčešće primjenjivani vazodilatatori su nitroglicerin, nitroprusid i nesiritid. Nitroglicerin smanjuje tlak punjenja lijevoga ventrikula. Daje se kontinuirano intravenski u dozi od 5 – 10 mcg/min, a prema potrebi se doza može povisiti za 5 – 10 mcg/min svakih 3 – 5 min do maksimalne doze od 100 – 200 mcg/min. Moguća je pojava tolerancije, osobito kod viših doza. Glavne nuspojave su glavobolja i hipotenzija. Nitroprusid dovodi do uravotežene arterijske i venske dilatacije. Daje se u dozi od 5 do 10 mcg/min (moguća titracija svakih pet minuta do maksimalne doze 200 – 400 mcg/min). Lijek se može metabolizirati do cijanida i tiocijanata te može biti toksičan. Česta nuspojava je refleksna tahikardija. Nesiritid je rekombinantni oblik humanog BNP-a i predstavlja terapijsku alternativu nitroglicerinu i nitroprusidu. Daje se u početnom bolusu od 2 mcg/kg, a zatim se nastavlja kontinuirano u dozi od 0.01 mcg/kg/min.
Primjena morfija. Morfij je dugo vremena bio osnovna terapija za plućni edem. Danas je njegova primjena indicirana kod jake dispneje praćene nemirom bolesnika. Djeluje kao sistemski venodilatator i koronarni dilatator, a dobar je analgetik i anksiolitik. Daje se u dozi 2 – 4 mg intravenski bolusno, a prema potrebi se dozu može povećavati za 2 mg. Glavne nuspojave su hipotenzija, povraćanje i respiratorna sedacija. Kod davanja morfija preporuča se profilaktička primjena antiemetika (metoklopramid) te imati na raspolaganju antidot (nalokson) u slučaju prestanka disanja.
Primjena vazoaktivnih lijekova. Primjena ovih lijekova opravdana je samo kod bolesnika koji se prezentiraju plućnim edemom i hipotenzijom, što je ujedno i najlošija kombinacija, s obzirom na to da svi terapijski postupci kod plućnoga edema dovode do snižavanja krvnoga tlaka. Idealno, u takvim bi se slučajevima trebalo rastumačiti radi li se o plućnom edemu uslijed akutnoga srčanog popuštanja uz sniženu ili uz očuvanu istisnu frakciju jer izbor vazoaktivnih lijekova ponajprije ovisi o tome. Do toga se podataka može doći brzom ultrazvučnom procjenom srčane funkcije, tj. ocjenom kontraktilnosti i mjerenjem istisne frakcije, što bi trebalo biti standardna klinička praksa. Kod bolesnika sa sniženom istisnom frakcijom lijekovi izbora su inotropi, a vazopresori su sekundarni izbor, dok kod bolesnika s očuvanom istisnom frakcijom inotropi mogu pogoršati stanje i kontraindicirani su, a primjenuju se samo vazopresori.
Primjena inotropa. Inotropi se primjenjuju kod bolesnika sa sistoličkom disfunkcijom koja dovodi do sniženja istisne frakcije. Služe kao kratkoročno rješenje do definitivne terapije i oporavka srčane funkcije. Primjena inotropa nije indicirana kod bolesnika s dijastoličkom disfunkcijom i općenito zahtijeva kontinuirano nadgledanje srčanoga ritma i krvnoga tlaka (invazivno mjerenje). Najčešći lijekovi koji se primjenjuju u tu svrhu su milrinon, dobutamin, dopamin te levosimendan. Milrinon je inhibitor fosfodiesteraze, a inotropni učinak na miokard ostvaruje inhibicijom razgradnje cAMP-a. Također, smanjuje i plućni i periferni vaskularni otpor (rezistenciju). Početna doza je 50 mcg/kg tijekom deset minuta, a potom je treba titrirati od 0,375 do 0,750 mcg/kg/min. Dobutamin primarno djeluje na β-1 receptore, a ima i mali učinak na β-2 i α-1 receptore. Glavni je učinak pojačanje kontraktilne snage miokarda uz zanemariv učinak na frekvenciju. Pri primjeni može dovesti do nepredvidivih hipotenzija. Početna doza je 2,5 mcg/kg/min i može se titrirati do 20 mcg/kg/min. Dopamin u niskim dozama (1 – 3 mcg/kg/min) djeluje primarno na D-1 receptore i dovodi do dilatacije renalnih i mezenteričkih krvnih žila, u srednjim dozama (1 – 10 mcg/kg/min) djeluje poglavito na β-1 receptore i pojačava kontraktilnost s varijabilnim učinkom na srčanu frekvenciju (često izaziva tahiaritmije), dok u visokim dozama (> 10 mcg/kg/min) djeluje na α-1 receptore i dovodi do vazokonstrikcije (djeluje kao vazopresor). Prema tome, dopamin kao inotrop koristimo u srednjim terapijskim dozama. Levosimendan povećava osjetljivost kardijalnih miofibrila za kalcij bez povećanja intracelularne koncentracije kalcija (pojačava kontraktilnost). Zbog relaksacijskoga učinka na glatku muskulaturu dovodi i do vazodilatacije. Povećava kontraktilnost, a smanjuje preload te afterload. Primjenjuje se početno u dozi 6 – 12 mcg/kg kao intravenski bolus, a potom se nastavlja kontinuirana primjena u dozi od 0.05 do 0.2 mcg/kg/min.
Primjena vazopresora. Vazopresori su lijekovi koji djelujući na α-1 receptore dovode do vazokonstrikcije što dovodi do povećanja tlaka i poboljšanja centralne perfuzije. Ipak, to dovodi do tlačnoga opterećenja lijevoga ventrikula, što pogoršava kardijalni status. Primjena vazopresora indicirana je samo za bolesnike s tvrdokornom hipotenzijom i hipoperfuzijom vitalnih organa unatoč primjeni standardne terapije. Najčešći vazopresor u kliničkoj upotrebi je noradrenalin koji se primjenjuje u dozi od 0.2 do 1.5 mcg/kg/min.
Pristup bolesniku s neprimjerenim odgovorom na diuretike. U slučaju izostanka povoljnoga odgovora na intenziviranu diuretsku terapiju kako je opisano, dvije su moguće opcije: 1) modulacija diuretske terapije te 2) primjena metode ultrafiltracije. Modulacija diuretske terapije podrazumijeva udvostručenje doze danoga diuretika (diuretik Henleove petlje) do postizanja zadovoljavajuće diureze ili maksimalne preporučene doze ili dodavanje drugoga diuretika (klorotiazid, metolazon, spirinolakton). Klorotiazid je jedini tiazidski diuretik koji se može davati intravenski (500 do 1000 mg/dan), a ima ograničenu dostupnost. Peroralne alternative su hidroklortiazid (25 do 50 mg 2x/dan) te metolazon (5 do 10 mg 1x/dan). Metolazon se sugerira bolesnicima s oštećenom bubrežnom funkcijom (GF < 20 ml/min), iako nema jasnih studija u prilog tome. Dodavanje antagonista aldosterona preferira se kod bolesnika sa sniženom istisnom frakcijom. Oni poboljšavaju diurezu te smanjuju gubitak kalija. Imaju prednost u dodavanju nad tiazidima kod bolesnika koji su na visokim dozama diuretika Henleove petlje, a imaju niže vrijednosti kalija. U akutnim stanjima dnevna doza može ići preko 100 mg/dan. Ultrafiltracija je mehanička metoda uklanjanja viška tekućine iz organizma, bez utjecaja na elektrolitni status. Primjenjuje se kod bolesnika koji su volumno preopterećeni, a ne reagiraju na standardnu terapiju. Najčešća metoda ultrafiltracije je CVVH (kontinuirana veno-venska hemofiltracija).
Najčešći algoritam zbrinjavanja akutnoga kardiogenog plućnog edema u hitnoj službi: 1) oksigenacija putem maske ili NIV (saturacija izand 90 %); 2) primjena diuretika u pojedinačnim intravenskim bolusima, a kod slaboga odgovora nastavak kontinuirano intravenski; 3) vazodilatator (prvo pojedinačna sublingvalna doza, a onda po potrebi parenteralna kontinuirana primjena); 4) preferirati kombinaciju vazodilatatora i diuretika; 5) morfij kod izrazito dispnoičnih i nemirnih bolesnika (ne kao lijek izbora pri plućnom edemu) te 6) u slučaju hipotenzije uključiti vazoaktivnu terapiju.
IZOLIRANO DESNOSTRANO SRČANO POPUŠTANJE
Definicija. Izolirano desnostrano srčano popuštanje odnosi se na srčano popuštanje u kojemu dominiraju simptomi i znakovi popuštanja desne strane srca (sistemska kongestija), što se može javiti primarno, kao posljedica različitih bolesti i stanja koje pogađaju desnu stranu srca, ili sekundarno, uslijed plućne patologije ili poremećaja funkcije lijeve strane srca.
Etiopatogeneza. Desnostrano srčano popuštanje može nastati kao posljedica volumnoga ili tlačnog opterećenja te smanjenja kontraktilnosti desnoga ventrikula (ili njihove kombinacije), a ovisno o brzini razvoja i prirodi uzročne bolesti razlikujemo akutno i kronično desnostrano srčano popuštanje. Desnostrano srčano popuštanje koje se javlja kao posljedica bolesti i poremećaja pluća i plućne cirkulacije tradicionalno nazivamo akutno ili kronično plućno srce (cor pulmonale).
Tlačno opterećenje desnoga ventrikula jedno je od najčešćih uzroka popuštanja desne strane srca. Ono može nastati na više razina: 1) bolesti pulmonalne valvule (pulmonalna stenoza), 2) bolesti plućne cirkulacije (plućna embolija, plućna hipertenzija), 3) poremećaji i bolesti lijeve strane srca te 4) ostali uzroci (kongenitalne anomalije, mehanička ventilacija pozitivnim tlakom, akutni respiratorni distres sindrom i sl.).
Volumno opterećenje desnoga ventrikula najčešće se javlja u sklopu pulmonalne i trikuspidalne regurgitacije, a može se javiti i uslijed kongenitalnih anomalija (Ebsteinova anomalija, transpozicija velikih krvnih žila) ili ekscesivne primjene infuzijskih otopina i krvnih pripravaka.
Smanjena kontraktilnost desnoga ventrikula razvija se uslijed poremećaja samoga miokarda koji dovode do njegove slabosti, a najčešće se to viđa pri infarktu desnoga ventrikula, miokarditisu i kardiomiopatijama koje zahvaćaju desni ventrikul (npr. aritmogena displazija desnoga ventrikula).
Patofiziologija. Akutno desnostrano srčano popuštanje nastaje kao posljedica naglo nastalih poremećaja koji uvjetuju tlačno ili volumno opterećenje ili smanjenu kontraktilnost desnoga ventrikula, što za posljedicu ima naglo nastalu dilataciju desnih srčanih šupljina koja dodatno može vršiti pritisak na desni koronarni sinus i dovesti do smanjenoga protoka krvi kroz desnu koronarnu arteriju. Kronično desnostrano srčano popuštanje razvija se polagano, zbog čega je omogućen razvoj hipertrofije miokarda desnoga ventrikula kao odgovora na pojačane zahtjeve, a to kasnije vodi u remodelaciju koja završava fibrozom i gubitkom kontraktilne snage. I akutno i kronično popuštanje desne strane srca dovode do smanjenoga udarnog volumena desnoga ventrikula što uvjetuje slabije punjenje lijevoga srca, čime se ograničava udarni volumen i pridonosi sistemskoj hipoperfuziji. Istodobno, povišeni tlakovi u desnom srcu ograničavaju utok krvi slijeva iz gornje i donje šuplje vene što rezultira razvojem sistemske kongestije kao dominantnoga znaka popuštanja desne strane srca (uvećane jugularne vene, hepatomegalija, ascites, periferni edemi).
Klinička slika. Kako je navedeno, ovisno o brzini razvoja poremećaja razlikujemo akutno i kronično desnostrano srčano popuštanje. U kliničkoj slici nalazimo simptome i znakove osnovne, etiološke bolesti uz koju se razvijaju znakovi sistemske kongestije koji predstavljaju osnovno obilježje popuštanja desne strane srca.
Akutno popuštanje desne strane srca karakterizira nagli nastanak i brzi razvoj simptoma. Kod bolesnika dominantno nalazimo znakove hipoperfuzije (hipotenzija, tahikardija, hladne okrajine, bljedoća, akrocijanoza) te umjereno izražene znakove sistemske kongestije (dominiraju nabrekle vene vrata). Karakteristično je da kod takvih bolesnika izostaje klasičan auskultacijski nalaz plućne kongestije.
Kronično popuštanje desne strane srca razvija se polagano te u njemu dominiraju znakovi sistemske kongestije kao što su nabrekle vene vrata, hepatomegalija, hepatojugularni refleks, ascites i periferni edemi. Također, kod ovih se bolesnika razvijaju i kronični kardiorenalni sindrom, kongestivna hepatopatija te kardijalna kaheksija (edem sluznice crijeva dovodi do malapsorpcije).
Dijagnoza. Osnovna dijagnostička obrada kod bolesnika sa sumnjom na desnostrano srčano zatajenje uključuje anamnezu i fizikalni pregled, elektrokardiografiju, laboratorijsku dijagnostiku, rendgenogram srca i pluća te ehokardiografiju. U slučaju da se navedenim pretragama ne otkrije uzrok, provode se i druge, specifične dijagnostičke metode kojima se nastoji utvrditi etiologija popuštanja desne strane srca.
Elektrokardiogram ovih bolesnika može ukazivati na postojanje desne električne osi te dilatacije ili hipertrofije desnoga ventrikula. Osim toga, može se detektirati i postojanje aritmija koje mogu utjecati na samu bolest, kao i znakovi ishemije ili preboljenoga infarkta.
Laboratorijski nalazi ovih bolesnika nisu specifični, a često su prisutne povišene vrijednosti jetrenih transaminaza i bilirubina kao odraz kongestivne hepatopatije (kod akutnoga su popuštanja transaminaze znatno više povišene nego kod kroničnoga popuštanja kada su uredne ili blago povišene). Određivanje natriuretskih peptida (NT-proBNP) također ima dijagnostički značaj kod ovih bolesnika.
Rendgenogram srca i pluća može upućivati na uvećanje desne strane srca (pomak srčane sjene u desno, gubitak retrosternalnoga zračnog prostora na lateralnoj projekciji, distenzija gornje šuplje vene, proširenje trunkusa plućne arterije), kao i na postojanje pleuralnoga izljeva, osobito u težim oblicima bolesti (češće na desnoj strani).
Ehokardiografija predstavlja osnovnu dijagnostičku metodu kod ovih bolesnika. Ona omogućava morfološku i funkcionalnu analizu struktura desne strane srca, kao i procjenu postojanja plućne hipertenzije na temelju neizravnih znakova i kriterija. Na temelju ultrazvučnoga nalaza moguće je precizno odrediti veličinu i hipertrofiju desnoga ventrikula. Promjer desnoga ventrikula veći od 4,2 cm (apikalni prikaz) ukazuje na proširenje desnoga ventrikula, kao i debljina zida miokarda desnoga ventrikula viša od 5 mm (mjerena na kraju dijastole) na hipertrofiju. Procjenu funkcije desnoga ventrikula omogućava mjerenje TAPSE (engl. tricuspid annular plane systolic excursion) koje ukazuje na longitudinalno skraćenje desnoga ventrikula, a normalno iznosi ≥ 1,8 cm dok je kod ovih bolesnika skraćeno i ukazuje na smanjenje kontraktilnosti desnoga ventrikula. Također, ultrazvučni pregled omogućava i analizu valvularnoga aparata, odnosno uočavanje patologije pulmonalne i triksupidalne valvule. Ultrazvučni kriteriji za plućnu hipertenziju opisani su u poglavlju o plućnoj hipertenziji. Dodatni ultrazvučni znakovi koji ukazuju na desnostrano srčano popuštanje su dilatirana donja šuplja vena koja ne kolabira tijekom inspirija te proširene hepatalne vene. Ehokardiografski prikaz dilatacije desnih srčanih šupljina (lijevo) i posljedične teške trikuspidalne regurgitacije (desno) prikazan je na Slici 1.34.
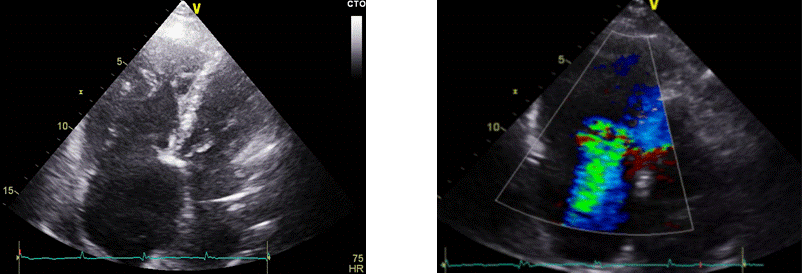
Slika 1.34. Ehokardiografski prikaz dilatacije desnih srčanih šupljina (lijevo) i posljedične teške trikuspidalne regurgitacije (desno)
Ostale dijagnostičke metode. Za otkrivanje uzroka desnostranoga srčanog popuštanja na raspolaganju su i brojne druge dijagnostičke metode: koronarografija (ishemija), magnetna rezonanca srca (miokarditis, kardiomiopatije), kateterizacija desnog srca i kateter plućne arterije (plućna hipertenzija), CT angiografija plućnih arterija (akutna plućna embolija, kronična tromboembolijska bolest), HRCT pluća (bolesti plućnoga intersticija) i sl.
Liječenje akutnoga desnostranoga srčanog popuštanja. Osnovu liječenja čini zbrinjavanje i liječenje etiološkoga stanja koje je dovelo do desnostranoga srčanog popuštanja. Simptomatsko liječenje podrazumijeva volumno rasterećenje bolesnika te prema potrebi provođenje vazoaktivne terapije. Volumno rasterećenje bolesnika podrazumijeva primjenu diuretika kako je to opisano za slučajeve kroničnoga srčanog popuštanja ili kod najtežih oblika kontinuiranu veno-vensku hemofiltraciju (CVVH). Kod izraženih pleuralnih izljeva i ascitesa koji kompromitiraju disanje indicira se i pleuralna, odnosno abdominalna punkcija. Vazoaktivno liječenje podrazumijeva tlačno rasterećenje desnoga ventrikula primjenom neselektivnih (nitroglicerin, nitroprusid) ili selektivnih plućnih vazodilatatora (inhalacijski i paraneteralni epoprostenol ili peroralni inhibitori fosfodiesteraze) te pojačanje kontraktilne snage desnoga ventrikula (dobutamin, milrinon).
Liječenje kroničnoga desnostranog srčanog popuštanja osim liječenja osnovne bolesti podrazumijeva primjenu lijekova jednako kako je to opisano u poglavlju o kroničnom srčanom popuštanju (diuretici, lijekovi s učinkom na renin-angiotenzinski sustav, beta blokatori, vazodilatatori). Kronična primjena selektivnih plućnih vazodilatatora (analozi prostaciklina, antagonisti receptora za endotelin, inhibitori fosfodiesteraze) opravdana je kod bolesnika s primarnom plućnom hipertenzijom i bolesnika s kroničnom tromboembolijskom bolesti pluća, dok je kod drugih bolesnika sa sekundarnim oblicima plućne hipertenzije (npr. sekundarna hipertenzija uslijed poremećaja funkcije lijeve strane srca) neopravdana. Specifičnosti primjene ovih lijekova opisane su u poglavlju plućne hipertenzije.
Ostale metode liječenja ovih bolesnika, onih koji su u potpunosti refrakterni na standardnu terapiju, uključuju mehaničku cirkulatornu potporu (RVAD, engl. right ventricular assist device; LVAD, engl. left vetricular assist device; BiVAD, engl. biventricular assist device) i transplantaciju srca.
Prognoza ovih bolesnika ponajprije ovisi o uzročnoj bolesti koja je dovela do desnostranoga srčanog popuštanja, kao i o bolesnikovoj suradnji u pogledu liječenja.
Uvod. Transplantacija srca kirurški je zahvat kojim se bolesno srce bolesnika zamjenjuje zdravim srcem odgovarajućega donora, a predstavlja jedinu terapijsku metodu koja može dovesti do produljenja života, kao i poboljšanja kvalitete življenja bolesnika koji se nalaze u terminalnom stadiju srčanoga popuštanja. Transplantacija srca provodi se tek kada su iscrpljene sve druge metode konzervativnoga i interventnoga kardiološkog liječenja. Činjenica da su danas sve bolji dugoročni rezultati transplantiranih bolesnika (jednogodišnje preživljenje je oko 90 %, a petogodišnje oko 70 %) dovodi do toga da se sve više bolesnika upućuje na transplantaciju. Prva transplantacija srca u Hrvatskoj izvedena je 1988. godine u Kliničkom bolničkom centru Zagreb, a glavni operater bio je prof. Josip Sokolić. U svijetu se godišnje obavi u prosjeku od 4000 do 5000 transplantacija srca.
Odabir bolesnika. Procjena opravdanosti i korisnosti transplantacije srca temelji se poznavanju indikacija te kontraindikacija za ovaj postupak. U načelu su svi bolesnici u terminalnom stadiju srčanoga popuštanja kandidati za transplantaciju srca, ako nemaju kontraindikacija.
Indikacije. Najčešće su indikacije za transplantaciju srca uznapredovalo srčano popuštanje u sklopu ishemijske i dilatacijske kardiomiopatije, a mogući su i drugi uzroci (hipertenzivna bolest srca, neliječena valvularna bolest, miokarditis i toksična kardiomiopatija te nasljedne i prirođene srčane greške). Rjeđe indikacije su IV. stupanj angine pektoris prema Kanadskom kardiovaskularnom društvu, maligni poremećaji srčanoga ritma koji ne reagiraju na standardnu terapiju te srčani tumori. Osim same indikacije, pri odluci o transplantaciji bitna je i procjena funkcijske sposobnosti bolesnika, a ona se najčešće vrši na temelju spiroergometrije, ergometrije ili šestominutnoga testa hoda. Transplantacija je indicirana kod bolesnika koji imaju vrijednosti maksimalne potrošnje kisika (VO2) manje od 10 mL/kg/min, dok se kod bolesnika s vrijednostima između 10 i 14 mL/kg/min ona može razmotriti uzimajući u obzir i druge pokazatelje i stanje bolesnika.
Apsolutne kontraindikacije. Osnovne apsolutne kontraindikacije za transplantaciju srca su: 1) sistemske bolesti koje limitiraju životni vijek, kao što su aktivna maligna oboljenja, teška opstruktivna plućna bolest s FEV1 < 1 L/min te aktivne multisistemske bolesti, i 2) fiksna plućna hipertenzija sa srednjim transpulmonalnim gradijentom tlaka većim od 5 mmHg ili plućnim vaskularnim otporom većim od 6 Woodovih jedinica, bez mogućnosti korekcije klasičnim metodama liječenja.
Relativne kontraindikacije za transplantaciju srca su brojne: starija životna dob (> 72 godine), aktivna infekcija, aktivna ulkusna bolest, šećerna bolest s uznapredovalim komplikacijama (neuropatija, nefropatija, retinopatija), teška periferna vaskularna i cerebrovaskularna bolest, morbidna pretilost (BMI > 35) ili izražena kaheksija (BMI < 18), teško oštećenje funkcije bubrega (CrCl < 25 mL/min), teško oštećena funkcija jetre (bilirubin > 2,5 mg/dL, transaminaze povišene trostruko u odnosu na normalne razine, INR > 1.5), teško plućno oboljenje s FEV < 40 %, ireverzibilni neurološki ili neuromuskularni poremećaj, signifikantna koagulopatija te zlouporaba nikotina, lijekova ili alkohola (transplantacija zahtijeva apstinenciju koja mora biti dulja od šest mjeseci).
Pretransplantacijska obrada. Nakon postavljanja same indikacije za transplantaciju srca bolesnik mora proći široku internističku i kardiološku obradu s ciljem utvrđivanja njegova stanja i sposobnosti za navedeni zahvat, kao i pronalazak kontraindikacija zbog kojih se bolesnik privremeno ili trajno ne može podvrgnuti zahvatu. Osim standardnih dijagnostičkih pretraga koje se vrše s ciljem postavljanja same dijagnoze bolesti, bolesnicima se izvode i druge, specifične pretrage kao što su: 1) test opterećenja kojim se mjeri maksimalna potrošnja kisika pri naporu (procjena funkcijske sposobnosti bolesnika); 2) kateterizacija desnoga srca s kateterom plućne arterije (procjena plućne hipertenzije na temelju određivanja plućne vaskularne rezistencije i transpulmonalnoga gradijenta); 3) serološke pretrage na najčešće viruse (citomegalovirus, Epstein-Barrov virus, varicella zoster virus, herpes simplex virus, Echoviridae, Coxsackie, HIV, virusni hepatitis) te Quantiferon test (tuberkuloza), 4) probir na tumorska oboljenja (mamografija, PAPA test) te druga specifična dijagnostika ovisno o indikaciji. Ako se kod bolesnika s indikacijom za transplantaciju srca ne utvrde kontraindikacije, bolesnika se stavlja na transplantacijsku listu, što podrazumijeva provođenje imunološke predtransplantacijske obrade koja se temelji na HLA tipizaciji primatelja i davatelja, određivanju HLA protutijela u serumu primatelja te testu križne reakcije (engl. cross match) prije same transplantacije. Navedena predtransplantacijska obrada opisana je u poglavlju o transplantaciji bubrega, a vrijednost PRA (engl. panel reactive antibodies) manja od 10 % smatra se prihvatljivom za stavljanje bolesnika na transplantacijsku listu.
Transplantacijska lista. Nakon što je bolesnik uvršten na transplantacijsku listu mora biti pod strogim nadzorom, s obzirom na dinamiku bolesti i višemjesečno čekanje na odgovarajući organ. Bolesnicima se svakih šest mjeseci prate vrijednosti plućne vaskularne rezistencije i određuje PRA ako su primali transfuzije (često se radi o bolesnicima s mehaničkom cirkulacijskom potporom koja često dovodi do simptomatskih makroangiopatskih hemolitičkih anemija). Svaka infekcija i drugi komorbiditeti koji se razviju tijekom čekanja na transplantaciju moraju se prijaviti transplantacijskom centru koji vrši reevaluaciju indikacije i opravdanosti transplantacije. Prednost pri transplantaciji imaju bolesnici s razvijenom težom kliničkom slikom, odnosno vitalno ugroženi bolesnici (ovisnost o inotropnoj potpori, sniženi srčani indeks, povišeni plućni okluzivni tlak, snižena venska saturacija hemoglobinom), bolesnici s komplikacijama mehaničke cirkulacijske potpore te bolesnici koji imaju akutno popuštanje već transplantiranoga srca.
Odabir donora. Kod odabira potencijalnoga donora i srca koje će biti transplantirano, osim navedene imunološke obrade, ključnu ulogu imaju i ABO krvna kompatibilnost te veličina srca, odnosno tijela donora. Prihvatljivim se smatra srce donora čija je težina približna težini primatelja (dozvoljena su odstupanja od oko 25 %). Nakon isključenja općih kontraindikacija za uzimanje organa od potencijalnoga donora (aktivna infekcija, maligna bolest s izuzetkom maligne bolesti središnjeg živčanog sustava i sl.), vrši se procjena stanja srca koje se planira transplantirati. Kod muškaraca mlađih od 40 godina i žena mlađih od 45 godina dovoljna je ehokardiografska obrada, dok je kod starijih kandidata osim ehokardiografije nužna i koronarografija. Na temelju navedenih pretraga donosi se odluka o tome hoće li se srce transplantirati iz donora ili ne.
Operacijski zahvat. Postupak transplantacije podrazumijeva eksplantaciju srca iz donora koje se potom skladišti i transportira u hipotermijskim uvjetima, a preporučeno vrijeme do implantacije ne bi smjelo biti duže od 4 do 6 sati (vrijeme hladne ishemije). Gotovo simultano vrši se priprema primatelja koji se priključuje na stroj za ekstrakorporalnu cirkulaciju te se vrši uklanjanje srca ostavljajući stražnju stijenku desnog i lijevog atrija, a potom se vrši implantacija donorskoga srca (grafta) uz izvođenje odgovarajućih anastomoza (biatrijska ili bikavalna anastomoza, anastomoza pulmonalne arterije i aorte).
Poslijetransplantacijska imunosupresija. U većine transplantacijskih centara danas se nakon transplantacije provodi trostruka imunosupresijska terapija koja uključuje inhibitor kalcineurina (ciklosporin ili takrolimus), antiproliferativni lijek (mikofenolat) te kortikosteroide. Rjeđe se imunosupresija provodi samo inhibitorom kalcineurina. Iako nije dokazana prednost takrolimusa u odnosu na ciklosoprin u pogledu ukupnoga preživljenja, ipak se preferira njegova primjena zbog bolje podnošljivosti i manje izraženih nuspojava (arterijska hipertenzija, hiperlipidemija, hirzutizam i sl.). Također, u velikom broju centara provodi se i indukcijska imunosupresivna terapija u perioperativnom razdoblju koja uključuje primjenu baziliksimaba (antiinterleukin IL-2), iako je ona praćena povećanom učestalošću oportunističkih infekcija.
Specifične komplikacije koje prate bolesnike nakon transplantacije srca su odbacivanje i vaskulopatija transplantata, infekcije te maligniteti.
Odbacivanje transplantata može biti posredovano protutijelima ili stanično, a najčešće se razvija unutar prvih šest mjeseci od transplantacije. Stanično posredovano odbacivanje je češće, karakterizirano je perivaskularnim infiltratima limfocita te nekrozom miokarda i ima nešto bolju prognozu u odnosu na odbacivanje posredovano protutijelima (humoralno odbacivanje) koje je fatalnije, a karakterizira ga stvaranje imunodepozita u miokardu. Klinički se ovo stanje očituje smanjenjem funkcije presatka, odnosno razvojem srčanoga popuštanja. Odbacivanje transplantata dokazuje se endomiokardijalnom biopsijom, a ona se rutinski izvodi transjugularnim pristupom jednom tjedno tijekom prvoga mjeseca, potom svaka dva tjedna tijekom drugoga mjeseca, a zatim svakih jedan do dva mjeseca tijekom prve godine. Na temelju histološke slike može se odrediti radi li se o odbacivanju posredovanom stanicama ili protutijelima te se može kategorizirati u jednu od četiri kategorije, ovisno o težini (Tablica 1.12.). Većinu epizoda staničnog odbacivanja liječi se visokim dozama peroralnih ili parenteralnih kortikosteroida, a pri težim oblicima indicirana je i primjena timoglobulina. Liječenje odbacivanja posredovanog protutijelima vrši se primjenom intravenskih imunoglobulina, timoglobina, visokim dozama kortikosteroida te primjenom specifičnih monoklonalnih B-staničnih protutijela (rituksimab), a u obzir dolazi i plazmafereza.
|
Tablica 1.12. Histološka klasifikacija odbacivanja srčanoga transplantata.
|
|
Stanično posredovano odbacivanje
|
Odbacivanje posredovano protutijelima
|
|
Stupanj 0
|
Bez odbacivanja
|
Stupanj 0
|
Bez odbacivanja
|
|
Stupanj 1
|
Intersticijski i/ili perivaskularni infiltrati s 1 fokusom lezije miokarda
|
Stupanj 1
|
Dva podtipa: H+ (histolopatološke promjene vez imunopatološkog nalaza) te H- (imunopatološki nalaz bez histopatoloških promjena)
|
|
Stupanj 2
|
Dva ili više fokusa lezije miokarda
|
Stupanj 2
|
Prisutnost histopatoloških promjena uz imunopatološki nalaz (depoziti)
|
|
Stupanj 3
|
Difuzni infiltrati s multifokalnim lezijama, edemom, hemoragijom i vaskulitisom
|
Stupanj 3
|
Opsežan patohistološki nalaz (intersticijska hemoragija, upalni infiltrat, zone nekroze, kapilarna fragmentacija)
|
Vaskulopatija transplantata predstavlja kronični oblik odbacivanja i jedan je od vodećih uzroka smrti transplantiranih bolesnika nakon prve godine. Radi se o imunološki posredovanim promjenama na koronarnim arterijama koje uključuju subendotelnu infiltraciju T-limfocitima, proliferaciju glatkomišićne muskulature te perivaskularnu fibrozu, što sve vodi neprimjerenoj perfuziji miokarda i razvoju ishemije. Rizični čimbenici za razvoj vaskulopatije transplantata su: HLA nepodudarnost, učestale epizode akutnoga odbacivanja, starija dob donora, prijašnja infekcija citomegalovirusom te ostali, klasični rizični čimbenici koji pogoduju razvoju ateroskleroze (hiperlipidemija, hipertenzija, hiperglikemija). Prilikom praćenja takvih bolesnika preporuča se koronarografija s intravaskularnim ultrazvukom jednom godišnje, a zadebljanje intime (> 0.5 mm) pouzdan je pokazatelj razvoja ove komplikacije. Pri angiografskom prikazu zahvaćene koronarne arterije koncentrično su sužene, za razliku od aterosklerotske koronarne bolesti gdje se vidi asimetrično izbočenje plaka. Liječenje je uglavnom usmjereno na prevenciju, a primjena visokih doza statina pokazala je uspjeh u usporenju progresije vaskulopatije. U terapiji se spominju i sirolimus i everolimus, a kada se radi o fokalnoj promjeni, u obzir dolazi i balonska dilatacija te postavljanje stenta. Krajnja metoda liječenja je retransplantacija.
Infekcije koje se javljaju uslijed imunosupresije čine oko 20 % smrtnih slučajeva transplantiranih bolesnika tijekom prve godine, a zauzimaju veliki značaj i dalje, gotovo tijekom cijeloga života. U svrhu prevencije infekcija preporuča se prije transplantacije obaviti cijepljenja protiv pneumokoka, hepatitisa B, herpes zostera te u mlađih žena humanog papiloma virusa, a također u svih primatelja koji su CMV pozitivni ili su CMV negativni, a primaju organ CMV pozitivnoga donora preporuča se profilaktička primjena ganciklovira ili valganciklovira. Svako febrilno stanje kod ovih bolesnika zahtijeva hospitalizaciju, izolaciju, mikrobiološko uzorkovanje i odgovarajuće antimikrobno liječenje.
Maligna oboljenja. Uslijed dugotrajne imunosupresije u ovih se bolesnika češće razvijaju maligna oboljenja u odnosu na drugu populaciju. To se ponajprije odnosi na limfoproliferativne bolesti i kožne karcinome, dok maligna oboljenja solidnih organa u pravilu imaju istu incidenciju kao i u općoj populaciji.
Prognoza. U prvoj godini nakon transplantacije najčešći uzroci smrti su akutno odbacivanje transplantata te infekcije, a nakon godine dana vaskulopatija transplantata i limfoproliferativne bolesti. Prosječno preživljenje nakon transplantacije srca je jedanaest godina, iako mnogi požive i duže. Većina se bolesnika nakon transplantacije vraća u normalan životni ritam uz određena ograničenja. Kod žena s transplantiranim srcem moguća je trudnoća, ali je potrebno provesti odgovarajuću prekoncepcijsku obradu i skrb.
OSNOVE ELEKTROFIZIOLOGIJE I ETIOPATOGENEZE SRČANIH ARITMIJA
Aritmija označava svaki poremećaj u frekvenciji, ritmu, mjestu nastanka ili provođenju srčanoga podražaja. Vrlo su učestale u općoj populaciji. Poremećaje ritma srca možemo podijeliti na nekoliko načina. Prema mehanizmu nastanka dijele se na poremećaje stvaranja i poremećaje provođenja impulsa, prema frekvenciji na tahiaritmije i bradiaritmije, prema izvorištu na ventrikularne i supraventrikularne te prema značenju na asimptomatske, simptomatske, hemodinamski značajne i prognostički važne aritmije.
Elektrofiziologija. Za razumijevanje nastanka artimija i djelovanje antiaritmika potrebno je poznavati mehanizam nastanka srčanoga impulsa te njegovo širenje kroz srčani mišić. Srce ritmičnim kontrakcijama stijenke tjera krv kroz krvne žile. Kako bi se osigurao uredan protok krvi kroz srce, njegova kontrakcija mora biti usklađena. Najprije se moraju kontrahirati atriji, a potom ventrikuli. Takvu usklađenost osigurava provodni sustav srca koji stvara i provodi živčani impuls kroz miokard na odgovarajući način.
Provodni sustav srca započinje strukturom koja se naziva sinusni čvor ili SA-čvor. On je smješten u stražnjem zidu desnoga atrija, gdje započinje stvaranje električnoga impulsa koji se širi na ostale srčane strukture, najprije provodnoga sustava, a zatim stanice radne muskulature atrija i ventrikula. SA-čvor je predvodnik i nazivamo ga i prirodnim pacemakerom. Val depolarizacije se od SA-čvora koncentrično širi u svim pravcima i podražuje najprije oba atrija te uzrokuje njihovu kontrakciju. To širenje depolarizacijskoga vala kroz atrije na EKG-u se očituje kao P-val. Nakon depolarizacije atrija depolarizacijski val dolazi u atrioventrikularni čvor i zatim se širi duž desne i lijeve grane Hisova snopa. U tim je strukturama brzina širenja depolarizacijskoga vala usporena u trajanju 1/10 sekunde, što omogućava odgovarajuće punjenje ventrikula. Taj prolaz kroz AV-čvor na EKG-u pratimo kao izoelektrične linije, odnosno PQ-segment. Nakon toga kroz mrežu Purkinjeovih vlakana depolarizacijski val dolazi do radne muskulature ventrikula koja je na EKG-u oslikana kao QRS-kompleks. Nakon depolarizacije i sistoličke kontrakcije koja slijedi događa se repolarizacija, odnosno vraćanje u električki ishodišno stanje polarizacije svih srčanih struktura. Repolarizacija atrija prekrivena je QRS-kompleksom i obično je zbog slabih potencijala atrija prekrivena jačim potencijalima ventrikula, odnosno prekrivena je QRS-kompleksom, dok se repolarizacija ventrikula na EKG-u oslikava kao T-val. Time završava jedan srčani ciklus i započinje novi, fazom spontane dijastoličke depolarizacije do postizanja potencijala paljenja u centru vodiču, odnosno sinusnom čvoru.
Akcijski potencijal predstavlja depolarizacijski val koji se širi miokardom i izaziva kontrakciju miokarda. Njegov nastanak opisuje se kroz nekoliko faza (faza 0, 1, 2, 3 i 4). Akcijski potencijal kardiomiocita započinje naglim i masivnim ulaskom natrijevih iona u srčanu stanicu, što potencijal stanice gotovo trenutačno podiže s -85 mV na oko +30 mV. To se zove depolarizacija stanice i predstavlja nultu fazu (faza 0). Nakon toga slijedi faza 1 koju karakterizira zatvaranje natrijevih kanala te otvaranje kalijevih kanala kroz koje kalij počinje izlaziti iz stanice pa električni potencijal počinje padati čime započinje repolarizacija. U fazi 2 nastaje tzv. "plato" koji je posljedica utoka kalcijskih kanala koji povisuju električki potencijal srčane stanice, što uravnotežuje električki učinak izlaska kalijevih iona. U fazi 3 utok kalcija prestaje te prevladava izlazak kalija što uzrokuje daljnje padanje potencija i repolarizaciju na -85 mv što predstavlja fazu mirovanja, tj. fazu 4. Nastanak akcijskoga potencijala u stanicama predvodnicima razlikuje se od opisanoga kod kardiomiocita. U predvodničkim stanicama nedostaju brzi natrijski kanali, stoga je sam depolarizacijski val u fazi 0 sporiji nego je to kod kardiomiocita te ga nose ioni kalcija koji sporije ulaze u stanice. Također, faza 4 je uzlaznoga oblika (na čemu i počiva svojstvo automatizma), a predstavlja spontanu dijastoličku depolarizaciju, koju karakterizira izlazak kalija, i ulazak natrija i kalcija. Kada potencijal s najniže točke koja u tim stanicama iznosi -60 do -70 mV dođe do -40 ili -50 mV, tj. vrijednost okidanja, stanica se naglo depolarizira i podraži susjedne stanice. Najbrži dijastolički uspon bilježimo u stanicama SA-čvora, zbog čega je on i predvodnik, a zatim AV-čvora i tek na kraju His-Purkinjeova sustava. Oblik akcijskoga potencijala ima ulogu i pri prijenosu impulsa, što je faza 0 strmija, to se podražaj brže i lakše prevodi na susjedne stanice. Zbog toga se impuls brzo provodi stanicama atrija i ventrikula gdje je potrebna skladna kontrakcija, a sporije provodi stanicama provodnoga sustava, što je nužno da bi se osigurao vremenski interval između kontrakcije atrija i ventrikula.
Autodepolarizacija. Spontana depolarizacija normalna je karakteristika stanica sinusnoga čvora, atrio-ventrikularnoga čvora i His-Purkinjeovih stanica. One mogu inicirati nastanak srčanoga impulsa koji se dalje širi. Spontana depolarizacija fiziološki je regulirana tonusom autonomnoga živčanog sustava, tj. parasimpatikusom i simpatikusom. Parasimpatikus ima negativan kronotropni učinak (usporava stvaranje impulsa), putem acetilkolina koji se veže za muskarinske receptore i preko G proteina aktivira kalijske kanale, što dovodi do povećanoga utoka kalija u stanice i posljedičnoga sniženja električnoga potencijala što smanjuje prag podražljivosti. Simpatikus ima suprotan učinak (pozitivan kronotropni učinak), a ostvaruje ga otpuštanjem katekolamina koji aktiviraju α i β adrenergičke receptore. Kao posljedica aktivacije β1 receptora, povećava se utok kalcija u stanice što povećava električni potencijal i tako smanjuje prag podražljivosti. Taj učinak je najdominantniji na stanicama sinusnoga čvora.
Etiologija. Poremećaji stvaranja i/ili provođenja srčanoga impulsa najčešće nastaju u podlozi strukturno ili funkcionalno promijenjen miokard, iako mogu nastati i u uvjetima zdravoga srca uslijed različitih vanjskih, ekstrakardijalnih utjecaja, kao što su poremećaji acidobazne ravnoteže i elektrolitni poremećaji (Tablica 1.13.).
|
Tablica 1.13. Najčešći kardijalni i ekstrakardijalni uzroci srčanih aritmija.
|
|
Kardijalni uzroci
|
Ekstrakardijalni uzroci
|
|
Koronarna bolest srca
Kardiomiopatije
Upalne srčane bolesti
Bolesti srčanih zalistaka
Srčano popuštanje
Prirođene srčane greške
Genetski poremećaji ionskih kanala
|
Plućne bolesti
Poremećaji elektrolita
Poremećaji acidobaznog stanja
Hipertireoza
Hipotireoza
Autonomna disfunkcija
Proaritmogeni utjecaj lijekova
|
Mehanizmi nastanka aritmija. Aritmije mogu nastati iz dva osnovna razloga, a to su poremećaj stvaranja impulsa i/ili poremećaj širenja impulsa. Niz čimbenika može poremetiti elektrofiziološke i metaboličke osobine miokarda te uzrokovati navedene smetnje, a najčešće su to acidobazni i elektrolitni poremećaji, ishemija, promjene autonomnoga živčanog sustava, koncentracija katekolamina, lijekovi i sl. (Tablica 1.14.).
|
Tablica 1.14. Mehanizmi nastanka srčanih aritmija
|
|
Poremećaji stvaranja impulsa
|
Poremećaji provođenja impulsa
|
|
Poremećaj automatizma
Pojačana okidačka aktivnost (trigerirana aktivnost)
|
Re-entry (povratni, kružni) mehanizam
Blok provođenja (mehaničke zapreke)
|
Mehanizmi nastanka tahikardija. Tri su osnovna mehanizma kojima nastaju tahiaritmije: 1) povećan automatizam; 2) trigerirana aktivnost te 3) kružni (engl. re-entry) mehanizam.
Povećan automatizam podrazumijeva povećano stvaranje srčanoga impulsa, bilo u predvodničkim stanicama, ubrzanjem normalnoga automatizma, bilo u stanicama koje nisu predvodničkoga tipa, tzv. patološkim automatizmom. Glavno elektrofiziološko obilježje čini ubrzana tj. skraćena faza 4 akcijskoga potencijala, pa novi akcijski potencijal nastaje tek što je prethodni završio. Različite okolnosti mogu dovesti do skraćenja faze 4 akcijskoga potencijala i promjene praga podražljivosti predvodničkih stanica ili omogućiti autodepolarizaciju stanica nepredvodničkoga tipa koja se potom proširi i aktivira cijelo srce (podražaj katekolaminima, poremećaji koncentracije elektrolita, ishemija, primjena lijekova).
Trigerirana aktivnost nastaje na bazi ranih ili kasnih naknadnih potencijala koji, ako dosegnu prag, izazivaju okidanje tj. izazivaju preuranjenu kontrakciju. Za razliku od povećanoga automatizma kod kojega novi akcijski potencijal nastaje tek kada je prethodni završio, akcijski potencijal u trigeriranoj aktivnosti nastaje na osnovi prethodnoga akcijskog potencijala, tj. novi nastaje prije nego je prethodni završio. To se događa uslijed produljenja repolarizacije, što je najčešće posljedica reaktivacije natrijskih ili kalcijskih kanala. Ako spontana depolarizacija nastaje za vrijeme faze 3 akcijskoga potencijala, govorimo o ranim naknadnim potencijalima (engl. EAD – early afterdepolarisations), a ako nastaje tijekom faze 4, govorimo o kasnim naknadnim potencijalima (engl. DAD – late afterdepolarisations). Naknadni potencijali koji se stvaraju tijekom faze 3 ili 4 akcijskoga potencijala, ako su dovoljno visoki, uzrokuju novu kontrakciju ili niz kontrakcija tj. tahikardiju.
Kružni ili povratni (engl. re-entry) mehanizam jedan je od najčešćih mehanizama tahikardija. Glavna značajka ovoga mehanizma je vraćanje srčanoga impulsa na prvobitni put gdje uzrokuje ponovnu depolarizaciju i kontrakciju, ili više kontrakcija ako se kruženje ponavlja. Pri tome impuls može kružiti po većem području (engl. macro re-entry) ili po manjem području (engl. micro re-entry). Osnovni preduvjet za nastanak ovoga mehanizma je postojanje dvije ili više regija s različitim obilježjima električne provodljivosti, kao npr. marginalna zona srčanoga infarkta ili akcesorni atriovetrikularni put. Električni impuls normalno putuje te dolazi do podijeljene regije te dalje nastavlja podijeljeno, sporim i brzim putem. Mjesto gdje se ta dva puta iznova ujedinjuju blokirano je za impuls koji ide sporim putem jer je taj dio refraktoran uslijed depolarizacije koju je uzrokovao impuls koji je išao bržim putem te se impuls vraća na prvobitni put i uzrokuje ponovnu repolarizaciju.
Mehanizmi nastanka bradiaritmija. Bradiaritmije nastaju na temelju dva osnovna mehanizma: usporeni automatizam sinusnoga čvora te uslijed zapreke provođenja električnoga impulsa.
Usporeni automatizam sinusnoga čvora može rezultirati smanjenom srčanom frekvencijom ili pauzama. U slučaju potpunoga prekida rada sinusnoga čvora kao predvodnika, ulogu predvodnika preuzima sljedeći, niži centar u provodnom sustavu srca, a to je atrioventrikularni čvor s nižom aktivnosti i manjom frekvencijom. Fiziološki, pojačan tonus parasimpatikusa dovodi do usporenja rada sinusnoga čvora (npr. spavanje), ali i mnogi drugi čimbenici utječu na njegov rad (masaža karotidnoga sinusa, beta blokatori, blokatori kalcijskih kanala, degenerativne promjene).
Zapreke provođenju električnoga impulsa često su uzrok nastanka bradiaritmija, odnosno srčanih blokova. Prethodni infarkt i posljedično stvaranje ožiljaka ili degenerativne promjene miokarda mogu zahvatiti puteve kojima se srčani impuls normalno širi te uzrokovati njegovo usporeno kretanje, zapinjanje ili potpunu zapreku prolasku.
KLINIČKI PRISTUP BOLESNIKU S ARITMIJAMA
Dijagnoza aritmija postavlja se na osnovi anamnestičkih podataka, fizikalnoga pregleda i EKG-a kao osnovnih dijagnostičkih postupaka, a u daljnjoj obradi mogu se primijeniti i drugi dijagnostički postupci kao što su 24-satni Holter EKG, trajno praćenje srčanoga ritma, test opterećenja, test na nagibnom stolu te elektrofiziološko ispitivanje.
Anamnestički podaci. Simptomi bradiaritmije mogu biti vrlo različiti prema pojavnosti i ozbiljnosti - od slučajno zapaženoga usporenog pulsa, omaglica i nesigurnosti u hodu pa sve do gubitka svijesti. Tahiaritmije se obično očituju osjećajem ubrzanoga rada srca, što obično stvara nelagodu i strah. Upravo je ta anksioznost najčešći razlog zbog kojega bolesnik dolazi liječniku. Tegobe će biti izrazitije ako su pridruženi znakovi smanjene perfuzije organa: bol u prsima, vrtoglavica, omaglica i gubitak svijesti. U razgovoru s bolesnikom treba saznati na koji se način aritmija pojavljuje i u kakvim okolnostima i (iznenada ili postupno, u naporu ili u mirovanju), kakve su karakteristike simptomima (osjećaj drukčijega rada srca, omaglica, gubitak svijesti, pritisak ili bol u prsima), koji su čimbenici mogli potaknuti nastanak simptoma (lijekovi, toksični učinci) te postoje li poznati komorbiditeti. kako kardijalni, tako i ekstrakardijalni, koji su mogli utjecati na aritmiju (hipertireoza, anemija). Često već na osnovi anamnestičkih podataka orijentacijski možemo odrediti radi li se o tahiaritmijama ili bradiaritmijama. Kliničke manifestacije srčanih aritmija prikazane su u Tablici 1.15.
|
Tablica 1.15. Kliničke manifestacije srčanih aritmija
|
|
Baradiaritmije
|
Tahiaritmije
|
Nepovoljni znakovi
|
|
Umor, slabost
Omaglice
Presinkope i sinkope
Srčano popuštanje
|
Palpitacije
Omaglice
Presinkope i sinkope
Dispneja
Bol u prsima
|
Ekstremne frekvencije
Popuštanje srca
Ishemija miokarda
Znakovi šoka
Poremećaji svijesti
|
Fizikalni pregled. Pri fizikalnom pregledu bolesnika za vrijeme trajanja aritmije treba obratiti pozornost na postojanje znakova hemodinamske nestabilnosti (vrijednosti krvnoga tlaka, frekvencije srca, procjene vitalnih znakova i perfuziju vitalnih organa). Palpacijom pulsa, auskultacijom srca i praćenjem jugularnoga venskog pulsa može se i bez EKG-a utvrditi radi li se o bradi- ili tahiaritmiji.
EKG je prva metoda u dijagnostici aritmija. Problem nastaje kada su aritmije paroksizmalne i kada nisu prisutne u trenutku izvođenja pretrage, i tada je indiciran 24-satni Holter EKG.
24-satni Holter EKG podrazumijeva snimanje i pohranjivanje EKG nalaza kroz 24 sata (nekada i 48 sati). Provodi se uz pomoć malih uređaja koji se postavljaju oko struka bolesnika. Oni pomoću samoljepljivih elektroda postavljenih na prsni koš bilježe električnu srčanu aktivnost. Uređaji sadrže posebnu memoriju koja pamti taj zapis te omogućava naknadnu interpretaciju uz pomoć računala. Tom se pretragom analiziraju sljedeći podaci: 1) ukupan broj srčanih otkucaja; 2) najniža i najviša srčana frekvencije tijekom snimanja; 3) ukupan broj ekstrasistola (ventrikularnih, supraventrikularnih); 4) epizode aritmija ako su zabilježene; 5) najdulji RR-interval; 6) postojanje i duljina eventualnih srčanih pauza te 7) promjene ST-segmenta koje ukazuju na koronarnu bolest. Najčešće indikacije za Holter EKG su: 1) simptomi koji su s velikom vjerojatnošću povezani s aritmijom (palpitacije, omaglice, sinkopa); 2) stanja koja su povezana s opasnim aritmijama (npr. hipertrofijska kardiomiopatija, oštećenje funkcije lijeve klijetke nakon akutnoga infarkta miokarda) te 3) potreba za procjenom učinka antiaritmijske profilakse ili terapije.
Dugotrajno praćenje srčanoga ritma podrazumijeva snimanje i pohranjivanje EKG-a kroz dulji vremenski period (i do godine dana), a omogućava detekciju srčanih aritmija kod bolesnika kod kojih se one javljaju rijetko i teško ih se može detektirati pomoću 24-satnog Holter EKG-a, čak i kada se opetovano izvodi. U tu se svrhu danas najčešće primjenjuju posebni uređaji koji se nazivaju implantabilni loop recorderi. Oni se kirurškim putem ugrađuju pod kožu prsnoga koša i mogu snimati i pohranjivati električnu srčanu aktivnost kroz dulji vremenski period (i do nekoliko godina), bez dodatnih elektroda i žica, što bolesnika ne ometa u svakodnevnim aktivnostima. Uređaj se programira tako da se pohranjuju ritmovi najbrže i najsporije frekvencije, a bolesnici dodatno mogu i sami aktivirati pohranu elektrokardiograma u memoriju uređaja pomoću posebnoga aktivatora koji nose poput privjeska za ključeve. U slučaju pojave određenih simptoma, nelagode, palpitacija, bolesnici mogu aktivirati snimanje tako da EKG zapis u određenom vremenskom periodu prije i nakon pritiska na aktivator ostaje pohranjen. Podaci s loop recordera se pomoću elektromagneta i elektromagnetskih valova prenose na računalo te se naknadno mogu analizirati.
Test opterećenjem u ovom se kontekstu može provoditi iz dva osnovna razloga: 1) provociranje nepoznate aritmije kod bolesnika koji se tuže na tegobe koje se dominantno javljaju pri naporu te 2) ispitivanje ponašanja već detektiranih aritmija tijekom napora, što se obično radi kod bolesnika s dokazanim bradiaritmijama. Najveći prijepori vezani su uz ispitivanje pojavnosti ventrikularnih tahiaritmija pri opterećenju, s obzirom na to da se ventrikularni poremećaji srčanoga ritma mogu zabilježiti u gotovo jedne trećine zdravih osoba izloženih određenom naporu. Takvi „benigni“ poremećaji nastaju uslijed pojave ektopijske ventrikularne aktivnosti izazvane naporom, a prezentiraju se monomorfnim, rijetkim i izoliranim ekstrasistolama te se pojavljuju uz brže srčane frekvencije i nisu reproducibilne u ponovljenim testovima. Nasuprot tome, „maligni“ poremećaji karakterizirani su učestalim i polimorfnim ekstrasistolama (> 10/min), ekstrasistolama u paru ili pojavom ventrikularne tahikardije, što se može vidjeti i pri manjim frekvencijama (< 130/min) i može ih se izazvati i u ponavljanim testovima, odnosno reproducibilni su. Ipak, zbog navedenih ograničenja, tumačenje ovih nalaza treba uzeti s rezervom.
Test na nagibnom stolu (engl. head-up tilt-table test) koristi se u obradi bolesnika s recidivirajućom sinkopom nerazjašnjene etiologije, a pozitivan test ukazuje na to da se radi o vazovagalnoj sinkopi. Test se izvodi tako da bolesnik najprije leži mirno na ravnom stolu tijekom desetak minuta, a zatim se stol uspravi do kosine od 60 ili 70° radi postizanja pasivnoga uspravnog položaja i u tom položaju bolesnik ostaje naslonjen tijekom 45 minuta. Za vrijeme pretrage kontinuirano se prati EKG i neinvazivno mjeri arterijski krvni tlak. Pozitivan rezultat testa je izazvana sinkopa bilo zbog: 1) izrazitoga sniženja arterijskoga tlaka (vazodepresorni mehanizam), ili 2) izrazitoga usporenja srčane frekvencije bez ili s asistoličkom pauzom (kardioinhibitorni mehanizam), ili 3) zbog kombinacije navedena dva mehanizma. Test je indiciran kod bolesnika s recidivirajućim sinkopama ili nakon sinkope pri kojoj se bolesnik ozlijedi, koja se dogodila prigodom vožnje automobila ili u nekom rizičnom zanimanju, a sumnja se da je vazovagalne geneze.
Elektrofiziološko ispitivanje srca. Radi se o invazivnoj metodi koja zahtijeva složenu kateterizaciju srca u posebno opremljenom laboratoriju, i pruža najegzaktnije podatke o vrsti, mehanizmu i prognozi aritmija te omogućava procjenu odgovora na liječenje. Ona je ponajprije indicirana kod bolesnika kod kojih se prethodno opisanim metodama ne može postaviti točna dijagnoza poremećaja srčanoga ritma ili kod kojih se planira provođenje ablacijskih tehnika liječenja aritmija. Pretraga se sastoji od istovremenoga snimanja površinskoga EKG-a te mjerenja intrakardijalnih električnih potencijala uz programiranu stimulaciju atrija i ventrikula. Za izvođenje ovoga ispitivanja potrebno je postaviti elektrode u odgovarajuće dijelove srca. One omogućavaju bilježenje intrakardijalnih električnih potencijala te, prema potrebi, stimulaciju određenih dijelova srca. Elektrode se obično uvode kroz femoralne vene i postavljaju u desni ventrikul (ispitivanje potencijala i stimulacija desnoga ventrikula), u područje triksupidalne valvule (praćenje potencijala Hisova snopa) te dvije elektrode u desni atrij (područje gornjega septuma za stimulaciju i područje lateralnoga zida za praćenje potencijala), a dodatno se kod sumnje na supraventrikularne tahikardije uvodi elektroda u područje koronarnoga sinusa (ispitivanje potencijala i stimulacije lijevoga atrija) ili kod sumnje na ventrikularne tahikardije u lijevi ventrikul putem femoralne arterije. Ispitivanje se sastoji od izazivanja odgovarajuće stimulacije i mjerenja osnovnih intervala provođenja intrakardijalnih potencijala, a s obzirom na to da svaki poremećaj srčanoga ritma ima karakterističan redoslijed pojavljivanja tih potencijala, može se s velikom sigurnošću odrediti točan mehanizam, lokalizacija i dijagnoza aritmije. Atrijskom se stimulacijom procjenjuje funkcija sinusnoga čvora, atrioventrikularnoga čvora te His-Purkinjeova sustava, dok se ventrikularnom stimulacijom procjenjuje retrogradno provođenje te pojava ventrikularnih poremećaja srčanoga ritma. Na elektrofiziološko ispitivanje obično se upućuju bolesnici s nerazjašnjenim tahikardnim poremećajima srčanoga ritma (supraventrikularne tahiaritmije, ventrikularne tahiaritmije, sindrom preekscitacije), kao i bolesnici koji su kandidati za neki od oblika elektrofiziološkoga liječenja. Pojedine indikacije za ovu pretragu navedene su u opisima pojedinih aritmija. Najčešće komplikacije koje prate ovu proceduru su lokalne naravi (krvarenje i infekcije punkcijskih mjesta na periferiji), dok su komplikacije kao što su mehaničko oštećenje srca ili tromboembolijski incident izuzetno rijetke.
FARMAKOLOŠKO I NEFARMAKOLOŠKO LIJEČENJE ARITMIJA
U liječenju aritmija razlikujemo farmakološke i nefarmakološke mjere. Farmakološko liječenje, tj. lijekovi, čine osnovu liječenja aritmija, ali značajno mjesto zauzimaju i nefarmakološke mjere koje uključuju različite elektroterapijske metode liječenja, kao što su defibrilacija i elektrokonverzija, srčana elektrostimulacija, primjena implantibilnoga kardioverter defibrilatora te ablacijske tehnike.
ANTIARITMICI
Antiaritmike, lijekove koji se koriste u liječenju aritmija, ovisno o njihovom mehanizmu djelovanja dijelimo u četiri skupine prema Vaughan-Williamsovoj klasifikaciji: I. skupina (blokatori natrijskih kanala), II. skupina (beta blokatori), III. skupina (blokatori kalijskih kanala) te IV. skupina (blokatori kalcijskih kanala).
Osim te klasifikacije, u upotrebi je i druga klasifikacija koja se naziva sicilijanski gambit, i s obzirom na svoju formu ne predstavlja pravu klasifikaciju, nego kategorizaciju antiaritmičnih lijekova u odnosu na temeljne mehanizme djelovanje. Radi se o tablici u kojoj su navedeni lijekovi u vodoravnim recima, dok su u okomitim stupcima nabrojani kanali, receptori i pumpe na koje lijekovi mogu djelovati te klinički učinci koji se postižu primjenom tih lijekova.
Antiaritmici I. skupine su blokatori natrijskih kanala, koji blokiraju brze natrijske kanale te usporavaju provođenje impulsa kroz kardiomiocite, ali ne i kroz stanice provodnoga sustava srca, s obzirom na to da one nemaju brze natrijske kanale. Ovisno o kinetici učinka (duljina djelovanja na natrijske kanale), dijele se u tri podskupine, a to određuje srčanu frekvenciju pri kojoj se uočavaju učinci lijekova. Lijekovi skupine I a imaju kinetiku srednje brzine (djeluju na natrijske kanale u trajanju od 1 do 10 sekundi), lijekovi skupine I b brzu kinetiku (djeluju na natrijske kanale manje od 1 sekunde), a lijekovi skupine I c sporu kinetiku (djeluju na natrijske kanale dulje od 10 sekundi). Prema tome, lijekovi iz skupine I a djeluju pri sporijim frekvencijama, I b pri brzim srčanim frekvencijama a učinak lijekova iz skupine Ic prisutan je pri svim srčanim frekvencijama. Predstavnici I a skupine su dizopiramid, prokainamid, kinidin, I b skupine lidokain i meksiletin te I c skupine flekainid i propafenon (Tablica 1.16.). Ti se lijekovi mogu koristiti u liječenju supraventrikularnih (Ia i Ic) i ventrikularnih tahikardija (Ia, Ib, Ic). Glavna nuspojava može biti proaritmogeni učinak, a nastala aritmija uglavnom je teža i opasnija od one koja se liječi. S obzirom na to da je ovaj proaritmogeni učinak izražen pri strukturnim bolestima srca, ti se lijekovi daju samo bolesnicima sa strukturno zdravim srcem.
|
Tablica 1.16. Antiaritmici prve skupine
|
|
Lijek
|
Intravenska primjena
|
Oralna primjena
|
Nuspojave
|
|
Dizopiramid
|
1,5 mg/kg kao bolus kroz 5 min, nastaviti u infuziji 0,4 mg/kg/h
|
100 - 200 mg svakih 6 do 8 sati
|
Retencija urina, suhoća usta, hipoglikemija, VT, torsades
|
|
Prokainamid
|
10 - 15 mg/kg u bolusu, nastaviti infuziju 1 - 4 mg/min
|
50 mg/kg/dan u podjeljenim dozama svaka 3 do 4 sata
|
Hipotenzija, indukcija SLE, agranulocitoza, VT, torsades
|
|
Lidokain
|
100 mg kao bolus kroz 2 min, nastaviti infuziju 4 mg/min
|
----
|
Tremor, epi napad, pospanost, delirij, parestezije
|
|
Propafenon
|
2 mg/kg kao bolus, pp nastaviti infuziju 2 mg/min
|
Inicijalno 150 mg 3 x/dan, pp povećati na 300 mg 3 x/dan
|
Bronhospazam, probavne smetnje
|
|
Indikacije: Ia : supresija atrijskih i ventrikularnih ekstrasistola, VT, SVT, FA ili UA te FV; Ib : supresija ventrikularnih aritmija – VES, VT, FV; Ic : supresija SVES, VES, SVT, VT, FA, FV.
|
Propafenon je lijek izbora u prekidanju supraventrikularne tahikardije uskog QRS-kompleksa u odsutnosti strukturne bolesti srca. Primjenjuje se kao spori intravenski bolus u dozi od 2 mg/kg. U stalnoj terapiji primjenjuje se peroralno u dozi oko 150 mg triput na dan. Kontraindiciran je u prisutnosti težih strukturnih bolesti srca. Najčešće nuspojave su omaglice, poremećaji srčanoga provođenja te palpitacije.
Antiaritmici II. skupine su lijekovi koji blokiraju beta-adrenergičke receptore, tzv. beta blokatori (Tablica 1.17.). Oni blokiraju učinak simpatikusa i njihov je učinak usporavanje stvaranja i provođenja električnih impulsa te produljenje perioda refraktornosti, posebno stanica sa sporim kanalima, tj. stanica provodnoga sustava. Klinički se to odražava usporavanjem srčane frekvencije, produljenjem PR-intervala te smanjenim prijenosom impulsa kroz AV-čvor. Ti su lijekovi često korišteni, primarno u liječenju supraventrikularnih tahikardija. U praksi se najčešće koriste peroralno za kontrolu frekvencije ventrikula kod fibrilacije atrija. Intravenska primjena ograničena je zbog slabije dostupnosti samoga lijeka, a koristi se za pravilne tahikardije uskog QRS-kompleksa kada se vagalni postupci i adenozin pokažu bezuspješnima. Imaju povoljne učinke i na prevenciju ventrikularnih poremećaja ritma, osobito fibrilacije ventrikula, podizanjem praga za njezin nastanak. Kontraindikacije za primjenu beta blokatora su srčani blok II. ili III. stupnja, hipotenzija, teško simptomatsko srčano popuštanje te nekontrolirana plućna bolest. Načelno se dobro podnose, ali treba biti oprezan kod bolesnika s bronhalnom astmom i kroničnom opstruktivnom plućnom bolesti. Glavne nuspojave su bradikardija i hipotenzija te bronhospazam.
|
Tablica 1.17. Antiaritmici druge skupine
|
|
Lijek
|
Intravenska primjena
|
Oralna primjena
|
Nuspojave
|
|
Esmolol
|
500 mcg/kg tijekom 1 - 2 min, pp nastaviti 25 - 200 mcg/kg/min
|
---
|
Bronhospazam, pogoršanje sistoličke funkcije
|
|
Propranolol
|
1 - 5 mg bolusno, pp jednom ponoviti za 5 min
|
10 - 30 mg u 3 - 4 x/dan
|
Bradikardija, AV blok, bronhospazam
|
|
Metoprolol
|
2,5 - 5 mg svakih 5 min do ukupne doze od 15 mg
|
50 - 100 mg 2 x/dan
|
Bradikardija, AV blok, bronhospazam
|
|
Bisoprolol
|
---
|
5 mg 1 x/dan
|
Bronhospazam, pogoršanje sistoličke funkcije, GI smetnje
|
|
Indikacije: supraventrikularne tahikardije (SVES, ST, SVT, FA, UA); ventrikularne aritmije (potporna uloga)
|
Antiaritmici III. skupine su blokatori kalijskih kanala koji dovode do produljenja trajanja akcijskoga potencijala i refraktornosti stanica čime smanjuju kapacitet prenošenja električnog impulsa te smanjuju automatizam (Tablica 1.18.). Podjednako djeluju na stanice sa sporim i brzim kanalima te se načelno mogu primijeniti kod svake tahiaritmije, osim kod torsadesa. Predstavnici ove skupine su amiodaron, dronedaron, sotalol, dofetilid te ibutilid.
|
Tablica 1.18. Antiaritmici treće skupine
|
|
Lijek
|
Intravenska primjena
|
Oralna primjena
|
Nuspojave
|
|
Amiodaron
|
150 - 300 mg bolusno, nastaviti infuziju 900 mg/24h
|
600 - 1200 mg/dan kroz 7 dana, potom 100 - 400 mg/dan
|
Plućna fibroza, hipo i hiper-tireoza, hepatitis, neuropatija
|
|
Dronedaron
|
---
|
400 mg 2 x/dan
|
QT-prolongacija, srčano popuštanje (kontraindikacija)
|
|
Sotalol
|
10 mg kroz 1 - 2 min
|
80 - 160 mg svakih 12 sati
|
Bradikardija, pogoršanje sistoličke funkcije, VT
|
|
Dofetilid
|
---
|
125 - 500 mcg svakih 12 sati
|
Torsades, reducirati kod bubrežnog zatajenja
|
|
Indikacije: amiodaron (refraktorna VF, SVPT, prevencija VT, AF, VF); dofetilid (AF i UA); sotalol (VT, AF)
|
Amiodaron je lijek izbora u liječenju supraventrikularnih i ventrikularnih tahiaritmija ako se radi o strukturno bolesnom srcu. Smatra se jednim od sigurnijih antiaritmika za primjenu u hitnoj službi. Najčešće indikacije za primjenu amiodarona su: 1) liječenje ventrikularne fibrilacije ili ventrikularne tahikardije bez pulsa nakon bezuspješne defibrilacije; 2) liječenje ventrikularne tahikardije kod hemodinamski nestabilnoga bolesnika nakon bezuspješne elektrokardioverzije; 3) liječenje ventrikularne tahikardije kod bolesnika sa strukturnom bolesti srca; 4) konverzija fibrilacije atrija u sinusni ritam te 5) prevencija novih ventrikularnih aritmija u poslijereanimacijskom periodu. Kod parenteralne primjene amiodaron se daje početno kao intravenski bolus u dozi 150 do 300 mg (preporuča se pomiješati ga s 250 ml 5 %-tne glukoze te aplicirati kroz 20 do 30 minuta), a nakon toga se može nastaviti u obliku kontinuirane infuzije (maksimalna dnevna doza iznosi 1200 mg). Zbog sklonosti izazivanju tromboflebitisa treba ga davati ili kroz veću perifernu venu ili putem središnjega venskog katetera ako se primjenjuje u dužem periodu. Glavne nuspojave su hipotenzija i bradikardija.
Dronedaron je pokazao dobre kliničke učinke u liječenju bolesnika s paroksizmalnom fibrilacijom atrija bez prisutnih znakova srčanoga popuštanja, no novije studije (PALLAS trail) pokazale su povećanje kardiovaskularnih incidenata kod bolesnika s permanentnom fibrilacijom atrija.
Antiaritmici IV. skupine su blokatori kalcijskih kanala (Tablica 1.19.). To su nedihidropiridinski blokatori kalcijskih kanala koji smanjuju automatizam i provođenje kroz AV-čvor. Te lijekove primarno koristimo za liječenje supraventrikulaskih tahiaritmija, a predstavnici su verapamil i diltiazem.
|
Tablica 1.19. Antiaritmici četvrte skupine
|
|
Lijek
|
Intravenska primjena
|
Oralna primjena
|
Nuspojave
|
|
Verapamil
|
2,5 mg bolus, pp ponoviti 2,5 - 5 mg za 5 min do max 15 mg
|
80 - 120 mg 3 x/dan ili 240 - 360 mg 1 x/dan (SR oblik tablete)
|
Hipotenzija, konstipacija, pogoršanje sistoličke funkcije
|
|
Dilatiazem
|
0,25 mg/kg kroz 2 min, pp nastaviti infuziju 5 - 12 mg/h
|
120 - 360 mg 1 x/dan (SR oblik tablete)
|
Hipotenzija, pogoršanje sistoličke funckije
|
|
Indikacije: prekidanje SVT i usporavanje brze FA ili UA
|
Verapamil se najčešće koristi za liječenje stabilne, pravilne tahikardije uskih QRS-kompleksa, kao i za kontrolu frekvencije ventrikula kod bolesnika s fibrilacijom atrija. Ne smije se primjenjivati kod sindroma preekscitacije, niti kod ventrikularnih aritmija. Također je opasan i za bolesnike s težom disfunkcijom lijevoga ventrikula. U hitnim stanjima daje se u obliku intravenskoga bolusa od 2,5 do 5 mg, a može se ponavljati kroz nekoliko minuta do maksimalne doze od 15 – 20 mg.
Ostali antiarimitici. Ostali antiaritmici koji se koriste u kliničkoj praksi, a nisu obuhvaćeni ovom podjelom su adenozin, digoksin i atropin.
Adenozin je purinski nukleotid koji blokira provođenje impulsa kroz AV-čvor, dok nema utjecaja na druge stanice provodne i radne muskulature miokarda. Ima kratko vrijeme poluživota od 10 do 15 sekundi, zbog čega se daje brzo intravenski kroz veću venu, a nakon aplikacije se potiskuje fiziološkom otopinom. Prije davanja lijeka bolesnike treba upozoriti da mogu osjetiti kratkotrajne opresije u prsima, mučninu i crvenilo. Kontraindicirani su kod bolesnika s bronhalnom astmom. Glavnu indikaciju za primjenu adenozina predstavlja paroksizmalna supraventrikularna tahikardija i lijek je izbora kod tih bolesnika ako su vagalni manevari neučinkoviti (masaža karotidnoga sinusa, Valsalvin manevar). Lijek se daje kao brzi intravenski bolus od 6 mg, a prema potrebi se može ponoviti još jednom ili dva puta u dozi od 12 mg u razmaku od nekoliko minuta. Tijekom primjene lijeka bolesnik mora biti pod nadzorom.
Digoksin je lijek koji se danas slabije koristi, a glavna indikacija je kontrola frekvencije ventrikula kod bolesnika s fibrilacijom atrija i srčanim popuštanjem, kod kojih se to ne postiže drugim lijekovima. U hitnim stanjima daje se u dozi od 0,5 mg kao intravenski bolus, dok se peroralna digitalizacija postiže sporije (1 - 1,5 mg tijekom prva 24 do 36 sata podijeljeno u tri ili četiri dnevne doze, a zatim se nastavlja s 0,125 do 0,5 mg kao jedna dnevna doza). Kod dugotrajne primjene digoksina preporuča se povremeno određivanje koncentracije lijeka u serumu kako bi se izbjegle nuspojave vezane uz predoziranje s obzirom na uzak terapijski prozor lijeka.
Atropin je lijek koji preko učinaka acetilkolina poništava učinak parasimpatikusa na srce i tako povećava sinusni automatizam i provođenje kroz AV-čvor. Najčešće nuspojave su antikolinergični simptomi kao što su retencija urina, zamagljen vid te suhoća usta. Glavna indikacija za primjenu atropina je simptomatska bradikardija ili atrioventrikularni blok. Atropin ima smisla davati pri bradikardijama s uskim QRS-kompleksima jer kod bradikardija s širokim QRS-kompleksima neće postići učinak. Davanje u asistoliji i električnoj aktivnosti srca bez pulsa nije opravdano jer asistolija u tim uvjetima nije uzrokovana prekomjernim tonusom vagusa, nego patološkim promjenama na miokardu. Atropin se daje intravenski u dozi od 0,5 mg te se može ponavljati svakih nekoliko minuta do ukupne doze od 3 mg.
Magnezij se kao antiaritmik primjenjuje u dvije indikacije: 1) liječenje VT-a po tipu torsades de pointes te 2) aritmije uzrokovane intoksikacijom digitalisom. Magnezij ostvaruje učinak poboljšanjem neurokemijskoga prijenosa, smanjuje otpuštanje acetilkolina te osjetljivost završne motoričke ploče. Daje se u dozi od 2 g putem periferne vene tijekom deset minuta, a prema potrebi može se ponoviti još jednom.
DEFIBRILACIJA I ELEKTROKARDOVERZIJA
Defibrilacija označava postupak prekidanja malignih poremećaja srčanoga ritma primjenom kratkotrajnoga električnog udara. Primjenjuje se samo u slučajevima ventrikularne fibrilacije i ventrikularne tahikardije bez pulsa, u sklopu kardiopulmonalne reanimacije. Temeljni mehanizam defibrilacije podrazumijeva prolazak istosmjerne struje kroz miokard, dovoljne jakosti da dovede do depolarizacije kritične mase miokarda i omogući predvodniku da preuzme kontrolu. Uspjeh defibrilacije ovisi o jakosti struje koja se dovodi u miokard, a na umu treba imati da se velika količina struje koja se isporuči prilikom defibrilacije preusmjerava duž drugih puteva u prsištu izvan srca što dovodi do toga da tek 4 % isporučene energije dolazi do srca. Na to utječu dva glavna čimbenika: otpor prsnoga koša i položaj elektroda. Na otpor prsnoga koša koji kod odraslih uobičajeno iznosi oko 70 - 80 ohma utječe kontakt elektroda i prsnoga koša (dlakavost smanjuje kontakt, primjena gela povećava kontakt), veličina elektroda (površina elektrode treba biti najmanje 150 cm2) te stadij disanja (najmanji otpor je na kraju ekspirija). Položaj elektroda pri defibrilaciji može biti različit, ali elektrode moraju biti postavljene tako da se srce nalazi u električnom polju između dviju elektroda. Standardno se jedna elektroda stavlja ispod desne ključne kosti, a druga u područje srednje aksilarne linije na sredini prsnoga koša. Alternativni položaji su anteroposteriorni (jedna elektroda na sredini lijevoga prekordija, a druga straga iza srca ispod lijeve lopatice), posterolateralni (jedna elektroda u srednjoj aksilarnoj liniji na sredini prsnoga koša, a druga straga preko desne lopatice) te biaksilarni položaj (jedna elektroda na lijevoj lateralnoj stijenci prsnoga koša, a druga nasuprot na desnoj lateralnoj stijenci). Kod bolesnika koji imaju elektrostimulator ili sličnu napravu, elektroda mora biti udaljena od uređaja minimalno 10 cm. Više o samoj defibrilaciji napisano je u poglavlju o intenzivnoj medicini u dijelu o naprednom održavanju života.
Elektrokardioverzija podrazumijeva postupak primjene kratkotrajnoga električnog udara s ciljem konverzije supraventrikularnih i ventrikularnih tahiaritmija u sinusni ritam, i to kod bolesnika s jasno izraženim nepovoljnim znakovima (znakovi šoka, ishemije miokarda ili srčanoga popuštanja ili poremećaj stanja svijesti) ili kod bolesnika koji ne reagiraju na standardnu medikamentnu terapiju. Glavna razlika u odnosu na defibrilaciju leži u činjenici da isporuka električne energije mora biti sinkronizirana s R-zupcem na EKG-u kako bi se izbjegla primjena električne energije u vulnerabilnoj fazi repolarizacije pri vrhu T-vala, jer bi to moglo dovesti do još opasnije aritmije, tj. ventrikularne fibrilacije. Današnji uređaji programirani su tako da se isporuka energije vrši 0,02 sekunde nakon R-vala. Zbog nelagode samoga postupka bolesnici tijekom izvođenja zahvata moraju biti analgosedirani. Položaj elektroda istovjetan je onome opisanom za defibrilaciju. Kod tahiaritmija širokog QRS-kompleksa i fibrilacije atrija koristi se električna energija jakosti 120 - 150 J ako se radi o bifaznim uređajima ili 200 J ako se radi o monofaznim. Kod tahiaritmija uskih QRS-kompleksa i undulacije atrija koristi se električna energija jakosti 70 - 120 J ako se radi o bifaznim uređajima ili 100 J ako se radi o monofaznim.
SRČANA ELEKTROSTIMULACIJA
Uvod. Elektrostimulacija je oblik liječenja koji nadomješta oslabljenu ili manjkavu kronotropnu funkciju srca te je primarno namijenjena liječenju bradiaritmija. Uz pomoć generatora i elektroda proizvodi se električni impuls koji izaziva stvaranje i širenje depolarizacijskoga vala kroz miokard, što u konačnici dovodi do odgovarajuće srčane kontrakcije. Prvi srčani elektrostimulator ugrađen je 1958. godine u Švedskoj, a prvi pacijent kojemu je ugrađen elektrostimulator dočekao je duboku starost, iako mu je 26 puta implantiran novi model. Prvi elektrostimulator u Hrvatskoj implantiran je 1964. godine, samo šest godina od prve svjetske implantacije.
Generator elektrostimulatora. Srčani elektrostimulator sastoji se od dva osnovna dijela. To su generator impulsa te jedna ili više elektroda koje se uvode u srčane šupljine i omogućavaju prijenos električnoga impulsa iz generatora do miokarda. Prema tome, glavna funkcija generatora je generiranje električnoga impulsa i održavanje odgovarajuće srčane frekvencije. On se sastoji od baterije koja osigurava izbor električne energije te elektroničnih sklopova koji predstavljaju mikroračunala s određenim zadanim programima. Kućište generatora građeno je od neutralnoga, biološki inertnog materijala, najčešće titanija. Energija koju isporučuje generator određena je unaprijed zadanim naponom u voltima (V) te širinom pulsa u milisekundama (ms). Generatori suvremenih elektrostimulatora, osim što služe za stvaranje impulsa (engl. pacing), imaju i funkciju zamjećivanja vlastitih impulsa (engl. sensing), što osigurava stimulaciju samo kada je ona potrebna, odnosno kada vlastita srčana aktivnost padne ispod programirane minimalne frekvencije elektrostimulatora. Takva elektrostimulacija zove se elektrostimulacija na zahtjev (franc. on demand) i danas predstavlja osnovni način elektrostimulacije.
Baterija elektrostimulatora. Danas se u praksi najčešće koriste litij-jod baterije koje generatoru osiguravaju životni vijek od pet do deset godina. Te su baterije građene od litija koji predstavlja anodu i joda koji predstavlja katodu, a između njih je elektrolit litij-jodid koji služi kao medij za kretanje iona. Kako se baterija s vremenom troši, tako se povećava i debljina elektrolita između litija i joda čime se povećava otpor baterije. U početku taj otpor iznosi 50 do 100 ohma, dok na kraju on iznosi 20000 do 30000 ohma. Osim porasta otpora, indikator pražnjenja baterije je i pad napona baterije. Početno, napon baterije iznosi oko 2,8 V, a trošenjem on linearno opada do 90 % iskorištenosti i tada ima napon oko 2,4 V. Baterije u prosjeku rade šest do osam godina, a nakon što se istroše mijenja se samo generator, dok se elektrode ne diraju.
Elektrode elektrostimulatora. Elektroda predstavlja električni vodič koji izlazi iz generatora, čiji se vrh uvodi u srčane šupljine gdje se vršak elektrode fiksira za miokard i time se osigurava prijenos stvorenoga impulsa. Ovisno o načinu fiksacije elektrode za miokard, razlikujemo aktivne i pasivne elektrode. Aktivne elektrode imaju na svome vrhu spiralni zavoj žice koji se poput vijka uvije u miokard, dok pasivne elektrode imaju vršak u obliku sidra koji se zaplete u trabekule, i kasnije priraste vezivnim tkivom. Također, razlikujemo unipolarne i bipolarne elektrode. Unipolarne elektrode imaju katodu u vršku elektrode, a anoda je samo kućište elektrostimulatora, dok su bipolarne elektrode praktičnije jer na vršku imaju i anodu i katodu pa se tako izbjegava stimulacija okolne muskulature prsnoga zida ili neželjeno zamjećivanje električnoga impulsa okolnih skeletnih mišića koji bi mogli blokirati isporučivanje električnih impulsa iz generatora. Postoje i tzv. steroidne elektrode koje na svom kraju imaju rezervoar iz kojega se postupno otpuštaju kortikosteroidi koji smanjuju lokalnu upalnu reakciju na mjestu kontakta elektrode s miokardom. Osim opisanih transvenskih elektroda, postoje i posebno dizajnirane epikardne elektrode koje se izvana ušivaju na srce tijekom kardiokirurških zahvata i uglavnom nisu namijenjene trajnoj elektrostimulaciji.
Princip rada elektrostimulatora. Glavni je cilj elektrostimulatora probuditi električni potencijal kardiomiocita koji će se proširiti miokardom i proizvesti kontrakciju. Impuls koji stvara generator određen je s dva parametra, a to su amplituda ili napon koji se mjeri u voltima (V) te trajanje impulsa koje se mjeri u milisekundama (ms). Izlazna energija impulsa proporcionalna je voltaži i trajanju impulsa te se mora individualno prilagoditi svakom bolesniku zbog različitoga praga podražljivosti. Prag podražaja je najniža energija impulsa koja će dovesti do podražaja miokarda, a razlikuje se od osobe do osobe. Prilikom namještanja amplitude napona, ona se uvijek namjesti na vrijednost dva do tri puta višu od praga podražaja zbog sigurnosti stimulacije. Da bi elektrostimulator počeo stimulirati srce, vlastita frekvencija mora pasti ispod vrijednosti frekvencije na koju je generator elektrostimulatora postavljen. Ako je uključena histereza elektrostimulacije na bazičnoj frekvenciji, stimulacija počinje kad se postigne pad vlastite frekvencije na vrijednost zadane histereze, koja je niža od osnovne frekvencije. Na primjer, ako je osnovna frekvencija elektrostimulatora podešena na 60/min i uključena je histereza na 50/min, elektrostimulator započinje sa stimulacijom od 60/min tek kada vlastita srčana frekvencija padne ispod 50/min.
Vrste i označavanje elektrostimulatora. Ovisno o vrsti i broju komora koje elektrostimulator stimulira, razlikujemo jednokomorne (desni atrij ili ventrikul), dvokomorne (desni atrij i ventrikul) i trokomorne elektrostimulatore (desni atrij, desni i lijevi ventrikul). Također, postoje elektrostimulatori s programom koji prepoznaje potrebe za fiziološkim povećanjem srčane frekvencije putem različitih senzora za prepoznavanje vibracija i akceleracija tijela pri pokretu, promjene temperature krvi, frekvencije disanja te sukladno time automatski, primjereno intenzitetu promjena, povećavaju i frekvenciju elektrostimulacije. Takva mogućnost naziva se frekventnom adaptabilnošću (engl. rate responsive) označena je slovom R, četvrtim slovom po redu koji se nalazi u međunarodnom kodu koji karakterizira način i mogućnosti rada svakoga pojedinog elektrostimulatora (Tablica 1.20.).
|
Tablica 1.20. Međunarodno označavanje elektrostimulatora
|
|
Oznaka
|
Značenje
|
Opis
|
|
Prvo slovo
|
Komora koja se stimulira
|
O - ništa; A - atrij; V - ventrikul; D - oboje (A+V)
|
|
Drugo slovo
|
Mjesto otkrivanja impulsa („sensing“)
|
O - ništa; A - atrij; V - ventrikul; D - oboje (A+V)
|
|
Treće slovo
|
Način reagiranja na otkriveni impuls
|
O - bez otkrivanja; I - inhibicija; T - trigeriranje; D - oboje (I+T)
|
|
Četvrto slovo
|
Mogućnost modulacije frekvencije
|
O - bez mogućnosti; R - rate responsive
|
|
Peto slovo
|
Antitahikardna funkcija
|
O - ništa; P - antitahikardni pacing; S - shock; D - oboje (P+S)
|
Jednokomorna elektrostimulacija oblik je elektrostimulacije kod koje se postavlja jedna elektroda u desni atrij ili desni ventrikul. Ako se elektroda postavlja u desni ventrikul, radi se o VVI načinu stimulacije, a ako se postavlja u desni atrij, radi se o AAI načinu stimulacije što predstavlja stimulaciju atrija ili ventrikula zadanom, programiranom frekvencijom, u odsutnosti vlastite srčane aktivnosti, a ako se ona ipak pojavi - dolazi do inhibicije rada elektrostimulatora. Ako elektrostimulator ima i mogućnost frekventne adaptabilnosti (engl. rate responsive) elektrostimulacije, govorimo o VVIR ili AAIR načinu rada. Jednokomorna elektrostimulacija moguća je i u AAT ili VVT načinu rada kod kojega se u slučaju pojave vlastite aktivnosti atriji ili ventrikuli dodatno stimuliraju sinkrono s P-valom u AAT načinu rada ili s R-valom u VVT načinu rada. Ti se načini primjenjuju samo privremeno, u slučajevima kada bi vanjski elektromagnetski impulsi mogli dovesti do interferencije s radom elektrostimulatora zbog npr. primjena elektrokautera pri operacijama. Također, u tim se slučajevima jednokomorna elektrostimulacija može alternativno programirati i u AOO ili VOO načinu rada, kao stimulacija atrija ili ventrikula zadanom frekvencijom - bez obzira na vlastitu aktivnost ili vanjske elektromagnetske impulse.
Dvokomorna elektrostimulacija podrazumijeva postavljanje dvije elektrode, jedne u desni atrij, a druge u desni ventrikul, pri čemu obje elektrode imaju sposobnost prepoznavanja vlastitoga električnog impulsa srca (engl. sensing) i stimuliranja (engl. pacing). Najčešći oblik ove elektrostimulacije je DDD način rada, pri čemu se u odsutnosti vlastite srčane aktivnosti stimuliraju i atriji i ventrikuli, i to uz dva zadana parametra: frekvencija i AV-interval. Atrij se stimulira samo u odsutnosti vlastite aktivnosti, a ventrikul se stimulira samo ako nakon isteka zadanoga AV-intervala izostane kontrakcija ventrikula. Postoje i drugi načini dvokomorne stimulacije, ali se oni rjeđe koriste, to su DOO, DDI i DDT.
Trokomorna elektrostimulacija (CRT - engl. cardiac resynchronisation therapy) podrazumijeva postavljanje tri elektrode, jedne u desni atrij, jedne u desni ventrikul i jedne u koronarni sinus za stimulaciju lijevoga ventrikula s epikardijalne strane. Ona se primjenjuje u slučaju potrebe za sinkronizacijom kontrakcije lijevoga i desnog ventrikula kod kroničnoga srčanog popuštanja s niskom istisnom frakcijom.
Indikacije za elektrostimulaciju su različite, a uključuju poremećaje atrioventrikularnoga provođenja (AV-blok drugoga stupnja, totalni AV-blok), bolest sinusnoga čvora i druge specifične indikacije.
Tehnička izvedba elektrostimulacije. Zahvat pri kojemu se bolesniku postavlja elektrostimulator s elektrodama obavlja se u aseptičnim uvjetima uz mogućnost radiološke kontrole, tj. dijaskopije. Elektrode se uvode nakon incizije kože u prepektoralnoj regiji preko vene cefalike ili vene subklavije u odgovarajući dio srca, dok se generator elektrostimulatora postavlja u unaprijed kirurški kreirano ležište u prepektoralnoj loži s desne ili lijeve strane prsnoga koša.
Kontrola bolesnika. Svi bolesnici s ugrađenim elektrostimulatorom srca moraju se redovito kontrolirati u ambulantama za elektrostimulaciju srca gdje se pomoću posebnih uređaja – programera, telemetrijski provjerava rad elektrostimulatora, eventualno vrši reprogramiranje tj. podešavanje elektrostimulacijskih parametara i procjenjuje istrošenost baterije, odnosno preostalo trajanje elektrostimulatora radi planiranja optimalnoga vremena za zamjenu baterije.
IMPLANTABILNI KARDIOVERTER DEFIBRILATOR - ICD
Implantabilni kardioverter defibrilator (ICD – engl. implantable cardioverter defibrilator) predstavlja električni uređaj sličan srčanom elektrostimulatoru koji ima sposobnost prepoznavanja malignih poremećaja srčanoga ritma, kao što su ventrikularna tahikardija ili ventrikularna fibrilacija, te promptnoga odgovora nekom od terapijskih mogućnosti (antitahikardni program, kardioverzija, defibrilacija). Ugradnja ICD-a slična je ugradnji standardnoga elektrostimulatora te se on također sastoji od generatora koji se implantira pod kožu prsnoga koša (ili rjeđe trbuha) i jedne ili više elektroda koje se uvode u srčane šupljine (jednokomorni ICD, dvokomorni ICD). Rizici i komplikacije ugradnje ICD uređaja jednaki su kao i kod standardnoga elektrostimulatora. ICD ima razvijen računalni program koji omogućava prepoznavanje i analizu nastaloga poremećaja srčanoga ritma te algoritam koji omogućava odgovarajući odgovor: antitahikardni program (pretjecanje ili „overdrive“, isporuka kratkih ciklusa elektrostimulacije), kardioverzija (isporuka električne energije koja se poklapa s vrhom R-vala) ili defibrilacija (isporuka električne energije nevezano uz srčani ciklus). Pri aktivaciji ICD-a isporučuje se električna energija manje količine, obično 10 do 20 J. Osim toga, ICD se može koristiti i kao standardni elektrostimulator, pa se može koristiti i u liječenju bradiaritmija ako se one pojave.
Indikacije. ICD uređaji u prvom su redu namijenjeni liječenju malignih poremećaja srčanoga ritma i prevenciji nagle srčane smrti, bilo u sklopu sekundarne prevencije (bolesnici koji su preživjeli epizodu malignoga poremećaja ritma), bilo u sklopu primarne prevencije (bolesnici koji posjeduju rizik od nastanka malignoga poremećaja ritma), što je prikazano u Tablici 1.21. Primjena ICD uređaja u prevenciji nagle srčane smrti uzrokovane malignim poremećajem ritma pokazala se 27 % uspješnijom u odnosu na klasične antiaritmike.
|
Tablica 1.21. Indikacije za ugradnju ICD-a
|
|
Primarna prevencija
|
Sekundarna prevencija
|
|
1) Bolesnici sa sistoličkom disfunkcijom (EF < 35 %), kratkotrajnim ventrikularnim tahikardijama i izazvanim tahiaritmijama pri elektrofiziološkom ispitivanju;
2) Bolesnici s visokim rizikom od maligne aritmije uslijed teških oboljenja kao što su hipertrofijska kardiomiopatija, aritmogena displazija desnog ventrikula, produljeni QT-interval, Brugada sindrom.
|
1)Bolesnici nakon reanimacije zbog srčanoga aresta uzrokovanog ventrikularnom tahikardijom bez pulsa ili fibrilacijom ventrikula;
2) Bolesnici s ventrikularnom tahikardijom koja dovodi do hemodinamske nestabilnosti;
3) Bolesnici s ventrikularnom tahikardijom koja ne dovodi do hemodinamske nestabilnosti, a koji imaju EF < 35 %.
|
Kontraindikacije. Ugradnja ICD-a ne preporučuje se bolesnicima ako je razlog maligne aritmije poznat i reverzibilan (akutni infarkt miokarda, elektrolitski disbalans), kod bolesnika s preekscitacijskim sindromima (npr. WPW-sindrom) te kod bolesnika sa srčanim popuštanjem u stadiju NYHA IV, koji nisu kandidati za transplantaciju srca ili im je očekivano trajanje života kraće od šest mjeseci. Teški psihijatrijski poremećaj također može predstavljati relativnu kontraindikaciju za ugradnju ICD-a.
Opće napomene. Bolesnicima je potrebno napomenuti i upozoriti ih da se aktivacija ICD uređaja može osjetiti kao neugodan udar te se nakon toga trebaju javiti u hitnu službu. Bolesnici koji izgube svijest neugodnu aktivaciju ne zamijete. Potrebno je pacijentima objasniti da moraju izbjegavati mogućnost elektromagnetske interferencije (držati mobitel na suprotnoj strani od uređaja, ne zadržavati se dulje u područjima elektromagnetskih sigurnosnih sustava). Nakon ugradnje ICD-a potrebne su redovne liječničke kontrole u periodu od šest mjeseci do godine dana. Na kontrolnim pregledima moguće je provjeriti kako uređaj radi, koliko se aktivirao i provjeriti preostalo trajanje baterije.
ABLACIJSKE TEHNIKE
Napretku u liječenju aritmija značajno su doprinijela intrakardijalna elektrofiziološka ispitivanja koja mogu kod velikoga broja bolesnika otkriti izvorište aritmije. Terapijski učinak se ostvaruje ablacijom (uništenjem) samoga izvorišta, što se postiže uz pomoć nekoliko metoda: radiofrekventna ablacija (toplinsko djelovanje radiofrekventne energije), mikrovalna ablacija, laserska ablacija i krioablacija. Najčešće indikacije za katetersku ablaciju su: 1) AV nodalna kružna tahiakrdija, AV kružna tahikardija, undulacija atrija, atrijska tahikardija, fibrilacija atrija te ventrikularna tahikardija. Detalji ovih procedura i indikacijama opisani su u poglavljima o pojedinim aritmijama.
SINUSNE ARITMIJE I POREMEĆAJI SINUSNOGA ČVORA
Među sinusne aritmije i druge poremećaje sinusnoga čvora ubrajamo sinusnu bradikardiju i tahikardiju, sinusnu aritmiju, bolest sinusnoga čvora (engl. sick-sinus syndrome) te sinoatrijske poremećaje provođenja (sinoatrijski blok).
SINUSNA BRADIKARDIJA
Definicija. Sinusna bradikardija naziv je za poremećaj srčanoga ritma karakteriziran usporenim stvaranjem srčanoga impulsa u sinusnom čvoru s frekvencijom manjom od 50/min.
Etiologija. Sinusna bradikardija može se javiti u dvije forme, fiziološkoj i patološkoj. Fiziološku bradikardiju možemo naći kod sportaša i teških fizičkih radnika. Oni mogu imati uvećano srce koje uvjetuje veći udarni volumen, zbog čega je potrebna manja frekvencija da bi se osigurao dostatni minutni volumen u mirovanju, a može biti prisutna i za vrijeme spavanja. Patološka sinusna bradikardija može nastati kao posljedica različitih intrinzičnih ili ekstrinzičnih čimbenika koji mogu biti akutni i reverzibilni ili kronični i ireverzibilni. Najčešći intrinzični čimbenici su akutna ishemija ili infarkt miokarda u području sinusnoga čvora te kronične degenerativne promjene, kao što je fibroza. Najčešći ekstrinzični čimbenici su primjena lijekova s negativnim kronotropnim djelovanjem kao što su npr. beta blokatori, amiodaron, blokatori kalcijskih kanala, propafenon, klonidin, litij, zatim pojačani tonus parasimpatikusa (vazovagalna stanja, mučnina i povraćanje, hipersenzitivni karotidni sinus, inferiorni akutni infarkt srca), hipotermija, hipotireoza, elektrolitni poremećaji, povišen intrakranijski tlak te druge bolesti i stanja, kao što su kolestatska žutica i infiltrativne bolesti srca.
Klinička slika. Većina bolesnika sa sinusnom bradikardijom je asimptomatska. Glavne tegobe koje se mogu javiti kod ovih bolesnika posljedica su smanjenoga minutnog volumena: umor i malaksalost, pospanost i poremećaj kognitivnih funkcija, a pri težim se oblicima javlja osjećaj mračenja pred očima, omaglice te gubitak svijesti.
Dijagnoza se postavlja na osnovi anamnestičkih podataka (simptomi bolesti, lijekovi koje bolesnik uzima), fizikalnoga pregleda (palpacija pulsa, auskultacija srca) te nalaza EKG-a koji pokazuje normalan sinusni ritam (prije svakog QRS-kompleksa nalazimo uredan P-val) s jednakim RR-intervalima, ali sa sporom frekvencijom (< 50/min) – Slika 1.35.
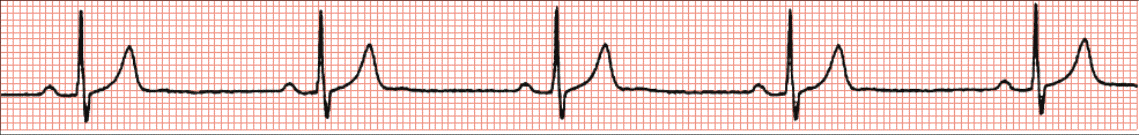
Slika 1.35. EKG nalaz – sinusna bradikardija
Liječenje. Osnovu liječenja čini uklanjanje uzročnoga čimbenika, npr. smanjenje doze lijeka ili njegovo uklanjanje ili ispravak elektrolitnoga poremećaja. Kod asimptomatskih bolesnika nije potrebna primjena lijekova za ubrzavanje srčane frekvencije. U slučaju simptomatske bradikardije pri hitnim stanjima moguća je primjena lijekova ili privremena elektrostimulacija. Lijek izbora je atropin (0,5 - 1 mg iv, po potrebi ponavljati svakih 3 do 5 minuta do ukupne doze od 3 mg), a mogu se primijeniti i dopamin (2,5 - 10 mcg/kg/min) ili izoprenalin (1 - 10 mcg/min iv). U slučaju sinusne bradikardije uzrokovane predoziranjem beta blokatorima ili blokatorima kalcijskih kanala primjenjuje se glukagon kao antidot (0,05 - 0,15 mg/kg/h). Ako se korigiraju etiološki čimbenici, a sinusna bradikardija se i dalje nastavi (RR-interval > 2,5 s) uz izražene simptome, indicirana je i privremena ili trajna elektrostimulacija.
SINUSNA TAHIKARDIJA
Definicija. Sinusna tahikardija naziv je za poremećaj srčanoga ritma karakteriziran ubrzanim stvaranjem srčanoga impulsa u sinusnom čvoru s frekvencijom višom od 100 u minuti.
Etiologija. Sinusna tahikardija posljedica je ubrzanoga stvaranja srčanoga električnog impulsa u sinusnom čvoru, i može se javiti u tri oblika: fiziološkom, kompenzacijskom i patološkom (Tablica 1.22.). Fiziološka sinusna tahikardija nastaje u uvjetima povećanje koncentracije katekolamina u krvi, što se normalno susreće kod osoba izloženih pojačanom fizičkom ili psihičkom naporu. Kompenzacijska tahikardija predstavlja mehanizam kojim organizam nastoji osigurati dostatnu dostavu kisika stanicama na periferiji u uvjetima kada je ona narušena iz nekoga razloga, kao što su srčano popuštanje, teška anemija ili hipovolemija. Vrućica je čest uzrok pojave sinusne tahikardije, što je odraz povećanih metaboličkih potreba te se kod svakoga povišenja tjelesne temperature od 1℃ povećava srčana frekvencija za oko 10 otkucaja u minuti. Patološka tahikardija nastaje u različitim uvjetima koji djeluju izravno na sinusni čvor, što se može vidjeti kod hipertireoze, feokromocitoma ili uslijed utjecaja lijekova (teofilin, aminofilin, levotiroksin, efedrin, stimulativne droge). Ovisno o okolnostima u kojima nastaje sinusna tahikardija (odnosno u kojoj je mjeri i je li izražena), može se govoriti o prikladnoj i neprikladnoj sinusnoj tahikardiji.
|
Tablica 1.22. Etiologija sinusne tahikardije
|
|
Fiziološka sinusna tahikardija
|
Kompenzacijska sinusna tahikardija
|
Patološka sinusna tahikardija
|
|
Pojačan fizički napor
Pojačan psihički napor
Vrućica
|
Srčano popuštanje
Teška anemija
Hipovolemija
|
Hipertireoza
Feokromocitom
Utjecaj lijekova
|
Klinička slika. Bolesnici sa sinusnom tahikardijom primarno se žale na neugodan osjećaj glasnoga i jakog lupanja srca (palpitacije) i često su pri tome nemirni i zaplašeni. Intenzitet simptoma ovisi o jačini tahikardije, ali i o psihičkoj nadogradnji bolesnika. Sinusna tahikardija može kod koronarnih bolesnika biti uzrok pojave anginoznih i/ili dispnoičnih smetnji.
Dijagnoza se postavlja na osnovi kliničke slike i kliničkoga pregleda (palpacija pulsa, auskultacija srca) te nalaza EKG-a. Na EKG-u nalazimo sinusni ritam kojega obilježava postojanje P-vala ispred svakoga QRS-kompleksa, skraćeni i jednaki RR interval te povećanje srčane frekvencije iznad 100/min (Slika 1.36.).
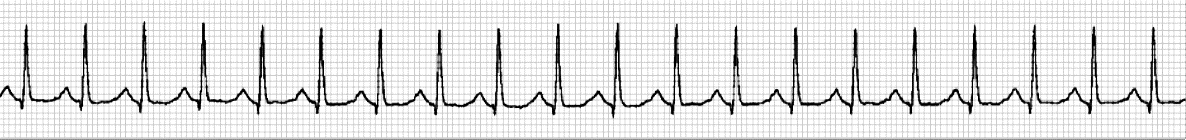
Slika 1.36. EKG nalaz – sinusna tahikardija
Liječenje se u prvom redu sastoji od uklanjanja etiološkoga čimbenika, s obzirom na to da je sinusna tahikardija najčešće sekundarne prirode. Kod potrebe za usporavanjem srčane frekvencije pri sinusnoj tahikardiji koriste se beta blokatori (bisoprolol 2,5 – 5 mg/dan, propranolol 3 x 10 – 30 mg/dan), blokatori kalcijskih kanala (verapamil 3 x 80 – 120 mg/dan, diltiazem 1 x 120 – 360 mg SR) ili ivabradin (2 x 5 - 7,5 mg/dan).
SINUSNA ARITMIJA
Sinusna aritmija predstavlja promjenjiv nepravilan ritam koji se javlja uslijed bolesti sinusnoga čvora (engl. sinus sick syndrome), ali i nekih drugih stanja. Električni impulsi nastaju u sinusnom čvoru i svi P-valovi su identični, ali je aktivnost samoga čvora nepravilna i impulsi nastaju u različitim intervalima. Sinusna se aritmija javlja u dva oblika: respiratorna i nerespiratorna sinusna aritmija.
Respiratorna sinusna aritmija uzrokovana je refleksnom inhibicijom vagusa (parasimpatikusa) uvjetovanim respiracijskim fazama te se manifestira ubrzanjem srčane frekvencije u inspiriju te usporenjem u ekspiriju (Slika 1.37.). Radi se o čestoj pojavi u djece i mladih i ne predstavlja patološko stanje.
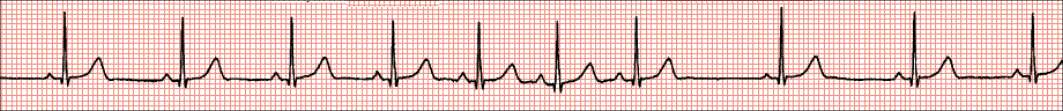
Slika 1.37. EKG nalaz – sinusna aritmija
Nerespiratorna sinusna aritmija predstavlja patološki oblik sinusne aritmije. Može biti uzrokovana različitim etiološkim čimbenicima: autonomna neuropatija, pojava uz dijafragmalni infarkt, miokarditis, trovanje digitalisom ili u sklopu bolesti sinusnoga čvora.
Klinički pristup. Ova vrsta aritmije je asimptomatska, a dijagnosticira se na osnovi nalaza EKG-a u kojem dominiraju uredni P-valovi koji se nalaze ispred svakog QRS-kompleksa, ali uz nepravilan RR-interval. Liječenje ove aritmije nije potrebno.
SINUSNI BLOK (SA-BLOK)
Definicija i etiologija. Sinusni blok označava poremećaj provođenja impulsa sa sinusnoga čvora na atrijski miokard. Uzroci toga poremećaja mogu biti ekstrinzični i intrinzični.
Ekstrinzični ili ekstrakardijalni uzroci podrazumijevaju poremećaj autonomnoga živčanog sustava (hipersenzitivni karotidni sinus), primjenu lijekova (beta blokatori, blokatori kalcijskih kanala, digoksin), hipertireozu, hipoksiju, hiponatrijemiju te povišen intrakranijski tlak.
Intrinzični ili kardijalni uzroci podrazumijevaju bolest sinusnoga čvora, koronarnu bolest, infiltrativne bolesti srca, miokarditis i kardiomiopatije te jatrogene uzroke (postoperativno, radijacijska terapija).
Podjela i mehanizam. Razlikujemo tri stupnja sinusnoga bloka. Sinusni blok prvoga stupnja obilježen je produljenom aktivacijom sinusnoga čvora i on se ne registrira na standardnom EKG-u. Sinusni blok drugoga stupnja obilježen je blokadom pojedinih impulsa u perinodalnom tkivu, a prema obilježjima i EKG nalazu razlikujemo dva podtipa: Mobitz I (uz skraćenje PP-intervala) i Mobitz II (bez skraćenja PP-intervala). Sinusni blok trećega stupnja nastaje potpunim blokiranjem prijenosa podražaja iz sinusnoga čvora na atrijski miokard, a ako je ta pauza duža, hijerarhijski niži centri preuzimaju ulogu centra vodiča (nodalni ritam, idioventrikularni ritam).
Klinička slika i dijagnoza. Klinički, sinusni blok može biti asimptomatski ili može dovesti do pojave presinkope i sinkope ili simptoma neodgovarajućega minutnog volumena. Dijagnoza se postavlja na osnovi EKG nalaza. Sinusni blok prvoga stupnja ne može se registrirati standardnim EKG-om. Sinusni blok drugoga stupnja ima dva podtipa: Mobitz I - karakteriziran skraćenjem PP-intervala do PP-stanke veće od dvostruke vrijednosti najkraćega PP-intervala (Slika 1.38.), te Mobitz II - karakteriziran jednakim PP-intervalima do stanke koja je jednaka dvostrukom PP-intervalu. Kod sinusnoga bloka trećega stupnja javljaju se doknadni ritmovi iz nižih centara (nodalni ritam, idioventrikularni ritam) ili asistolija.
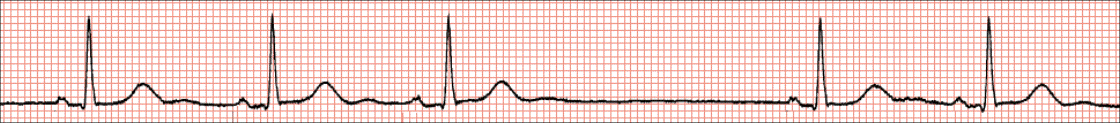
Slika 1.38. EKG nalaz – sinusni blok Mobitz I
Liječenje. Osnovu liječenja čini korekcija i liječenje potencijalno reverzibilnih uzroka koji mogu dovesti do ovog poremećaja. Asimptomatski bolesnici u pravilu ne zahtijevaju nikakvo liječenje, dok je kod simptomatskih bolesnika indicirana ugradnja trajnoga srčanog elektrostimulatora.
BOLEST SINUSNOGA ČVORA
Definicija. Bolest sinusnoga čvora (engl. sinus sick syndrome) označava skupinu poremećaja stvaranja i provođenja impulsa iz sinusnoga čvora, koja nastaje uslijed njegove strukturno ili funkcionalno uzrokovane disfunkcije. Bolest sinusnoga čvora može se manifestirati sinusnom bradikardijom, sinusnim pauzama te sinusnim blokom. Kod više od 50 % bolesnika bilježi se i rekurentna pojava supraventrikularnih poremećaja ritma, najčešće u vidu fibrilacije atrija, kod kojih se zbog brzoga frekventnoga odgovora ventrikula mogu izmjenjivati periodi brzoga i sporog ritma, što karakterizira tzv. tahi-bradi sindrom. Bolest sinusnoga čvora obično se susreće kod starijih osoba, obično nakon 65. godine života, s podjednakom zastupljenošću kod oba spola.
Etiologija. Bolest sinusnoga čvora može nastati kao posljedica različitih intrinzičih i ekstrinzičnih čimbenika. Najčešći intrinzični čimbenici koji se povezuju s ovom pojavom su kronične degenerativne i strukturne promjene miokarda u području sinusnoga čvora, što može biti posljedica fibroze u sklopu starenja, ishemijskih lezija ili remodeliranja desnoga srca (kronična fibrilacija atrija, desnostrano srčano popuštanje), a današnja saznanja uspućuju i na poremećaj ionskih kanala kao značajan etiološki čimbenik razvoja ove bolesti. Ekstrinzični čimbenici koji pogoduju razvoju bolesti sinusnoga čvora su disfunkcija autonomnoga živčanog sustava (hipersenzitivni karotidni sinus, vazovagalni poremećaji), metabolički poremećaji (hipoksija, hipotireoza, poremećaji kocentracije kalija i kalcija), pojačan tonus parasimpatikusa (spavanje), kao i utjecaj različitih lijekova (beta blokatori, blokatori kalcijskih kanala, digoksin, litij).
Klinička slika. Bolest sinusnoga čvora klinički je progresivna bolest. Početno su bolesnici asimptomatski, ali s razvojem bolesti dolaze do izražaja simptomi koji su u prvom redu posljedica cerebralne hipoperfuzije koja se javlja u vrijeme bradiaritmija. Bolesnici se žale na umor, pospanost, gubitak koncentracije, omaglice, a moguće su i sinkope. Pojava ovih aritmija može postati i uzrok pogoršanja osnovne srčane bolesti (stenokardične smetnje, pogoršanje simptoma srčanoga popuštanja). Bolesnici koji imaju tahi-bradi sindrom u vrijeme paroksizma tahiaritmije mogu se žaliti na palpitacije i uznemirenost s popratnom anksioznošću.
Dijagnoza se postavlja na temelju anamnestičkih podataka, kliničkoga pregleda i nalaza EKG-a. Standardni EKG nalazi uključuju sinus bradikardiju, sinusnu pauzu koja traje više sekundi, sinusni blok ili sinusni arest (Slika 1.39.). Kod više od 50 % oboljelih mogu se pojaviti i paroksizmi supraventrikularnih tahiaritmijskih poremećaja (fibrilacija ili undulacija atrija, atrijska tahikardija, paroksizmalna supraventrikularna tahikardija). Često se pri jednokratnom snimanju 12-kanalnog EKG-a ne otkriju karakteristični poremećaji ritma pa je indicirano snimanje 24-satnog Holter EKG-a.

Slika 1.39. EKG nalaz – sinusna pauza kod bolesnika s bolešću sinusnoga čvora
Liječenje se sastoji od djelovanja na osnovni etiološki faktor, a u nekim je slučajevima indicirana i ugradnja srčanoga elektrostimulatora. Ugradnja srčanoga elektrostimulatora apsolutno je indicirana kod svih bolesnika s dokumentiranom bradiaritmijom koja dovodi do kliničkih manifestacija (presinkopa, sinkopa), a kod kojih bolest sinusnoga čvora nije posljedica korektibilnih ekstrinzičnih faktora. Kod bolesnika koji imaju bolest sinusnoga čvora bez poremećaja atrioventrikularnoga provođenja moguća je ugradnja jednokomornoga ili dvokomornog elektrostimulatora, dok se kod prisutnosti i atioventrikularnoga poremećaja provođenja, uključujući blok grana i bifascikularni blok, ugrađuje dvokomorni elektrostimulator.
SUPRAVENTRIKULARNA PAROKSIZMALNA TAHIKARDIJA
Definicija. Supraventrikularna paroksizmalna tahikardija (SVPT) uopćeni je naziv za naglu i rekurirajuću pojavu tahikardije čije je ishodište u atrijima ili atrioventrikularnom čvoru. Osnovne karakteristike SVPT-a su iznenadna i nagla pojava, obično kraći period trajanja - od nekoliko minuta do nekoliko sati, rijetko i duže, te sklonost recidiviranju. SVPT se obično javlja kod mlađih osoba, na strukturno zdravom srcu. Ovisno o izvoru i samom mehanizmu, razlikujemo tri vrste SVPT-a, a to su: atrioventrikularna nodalna kružna tahikardija, atrioventrikularna kružna tahikardija i atrijska tahikardija. Među supraventrikularne tahikardije ubrajaju se i sinusna tahikardija te fibrilacija i undulacija atrija, ali su zbog svojih specifičnosti izdvojene i posebno opisane. Najčešći mehanizam nastanka SVPT-a povratni je ili kružni mehanizam (engl. reentry) koji može biti potaknut ili prekinut slučajnom ekstrasistolom ili se radi o pojačanom automatizmu.
Atrioventrikularna nodalna kružna tahikardija (AVNRT – engl. atrioventricular nodal reentrant tachycardia) češće se javlja u mlađoj populaciji, osobito kod žena i to na srukturno zdravom srcu. Radi se o aritmiji koja nastaje kao posljedica kružnoga mehanizma unutar samoga AV-čvora (engl. micro-reentry) u kojemu razlikujemo dva snopa (brzi i spori) koji provode električni impuls prema ventrikulima. Brzi snop karakterizira duži period oporavka (refrakternosti), dok spori snop karakterizira kraći period oporavka, što predstavlja ključ za razumijevanje nastanka ove aritmije. U normalnim okolnostima impuls koji dolazi iz atrija na ulazu u AV-čvor započinje svoj put i brzim i sporim snopom, ali se prenese samo onaj koji ide brzim snopom, s obzirom na to da onaj koji ide sporim snopom nestaje kada dođe na kraj svog puta u AV-čvoru jer pada u vrijeme refrekternosti uzrokovane prolaskom impulsa kroz brzi snop i ne može se dalje širiti. AVNRT nastaje kao posljedica atrijske ekstrasistole koja proizvede električni impuls u vremenu oporavka brzoga snopa te se zbog toga on samo anterogradno prenosi putem sporoga snopa. Dok električni impuls stigne na suprotni kraj AV-čvora, dolazi i do oporavka brzog puta što omogućava njegovu ponovnu stimulaciju i retrogradno kretanje impulsa prema atrijima te tako nastaje kruženje impulsa unutar AV-čvora, pri čemu se impulsi prenose i na ventrikule i atrije koji se gotovo istodobno kontrahiraju. Ovo se naziva tzv. tipičnom ili "sporo-brzom" vrstom AVNRT-a, za razliku od atipične ili "brzo-spore" vrste AVNRT-a u kojoj brzi snop služi kao anterogradna grana, a spori kao retrogradna (brzi snop vodi impuls prema ventrikulu, a spori prema atriju).
EKG nalaz kod AVNRT-a ukazuje na pravilnu tahikardiju uskih QRS-kompleksa (osim ako se nađe poremećaj provođenja električnoga impulsa, npr. blok desne ili lijeve grane) čija se frekvencija obično kreće između 160 i 250 otkucaja u minuti. Kod ovih se bolesnika može zapaziti i denivelacija ST-segmenta povezana s tahiaritmijom (skraćena dijastola dovodi do hipoperfuzije, s obzirom na to da se protok kroz koronarne arterije odvija samo u dijastoli). P-val se može vidjeti tek kod nižih frekvencija, kod tipične AVNRT retrogradni P'-val kraćega je trajanja i javlja se tijekom ili prije QRS-kompleksa (P'R-interval kraći je od 0,07 s) – Slika 1.40., dok se kod atipične AVNRT P'-val javlja uvijek prije QRS-kompleksa, a P'R interval dulji je od 0,07 s.
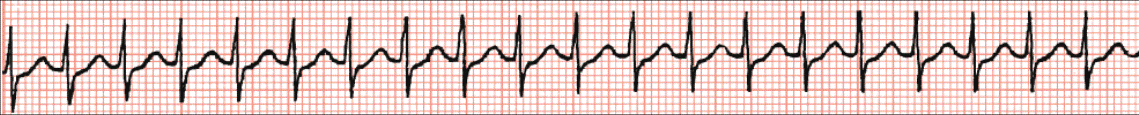
Slika 1.40. EKG nalaz – SVPT (AVNRT)
Atrioventrikularna kružna tahikardija (AVRT – engl. atrioventricular reentrant tachycardia) nešto je rjeđi oblik SVPT-a, a nastaje kao posljedica kružnoga (engl. reentry) mehanizma koji je posljedica postojanja akcesornih puteva koji omogućavaju prijenos električnoga impulsa iz atrija u ventrikule (i obrnuto) mimo atrioventrikularnoga čvora. Akcesorni putevi građeni su od atrijskoga miokarda i javljaju se kao izolirani prirođeni defekti koji su rijetko povezani s drugim anomalijama. Prema mehanizmu nastanka, razlikujemo dva oblika AVR-tahikardije: ortodromna AVRT i antidromna AVRT. U slučaju ortodromne AVRT električni impuls se normalno anterogradno provodi iz atrija preko AV-čvora i Hisova snopa u ventrikule te potom brzo retrogradno vraća akcesornim putem nazad u atrije pri čemu nastaje kružno kretanje impulsa po velikoj površini miokarda (engl. macro-reentry). Antidromna AVRT nastaje suprotnim načinom, odnosno električni impuls se anterogradno provodi iz atrija na ventrikule akcesornim putem, dok njegovo retrogradno kretanje iz ventrikula u atrije ide putem Hisova snopa i AV-čvora. Ortodromna AVRT obilježena je QRS-kompleksima normalnoga trajanja, dok su kod antidromne AVRT QRS-kompleksi prošireni.
EKG nalaz kod AVRT-tahikardije ukazuje na pravilnu tahikardiju frekvencije između 160 i 250 otkucaja u minuti s uskim i pravilnim QRS-kompleksima ako se radi o ortodromnoj AVRT (Slika 1.41.) ili širokim QRS-kompleksima ako se radi o antidromnoj AVRT.
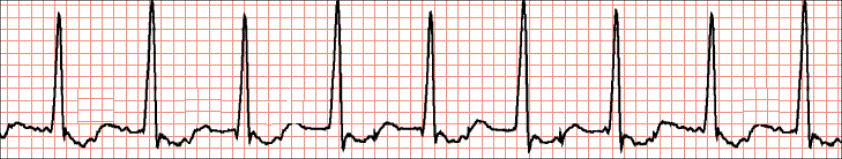
Slika 1.41. EKG nalaz – SVPT (ortodromna AVRT)
Atrijska tahikardija najrjeđi je oblik SVPT-a, obično je povezana sa strukturnom bolesti srca (kongenitalne anomalije, stanje nakon kardiokirurških intervencija) i javlja se u starijoj populaciji. Ishodište, tj. žarište ili fokus ove aritmije leži u zonama atrija s najmanjom međusobnom povezanošću između stanica miokarda, kao što su ušća plućnih vena, krista terminalis ili područje uz atrioventrikularni čvor, a iz njih se električni impuls dalje širi centrifugalnim putem kroz atrije i preko AV-čvora prenosi u ventrikule. Ovisno o broju fokusa iz kojih nastaje aritmija, razlikujemo fokusnu (ektopičnu) atrijsku tahikardiju koja nastaje iz samo jednog fokusa te multifokalnu (kaotičnu) atrijsku tahikardiju koja nastaje iz više fokusa. Najčešći mehanizam nastanka ove aritmije je pojačani automatizam, ali može se raditi i o trigeriranoj aktivnosti ili kružnom, povratnom mehanizmu. Frekvencija kod atrijske tahikardije rijetko prelazi 200 otkucaja u minuti s pravilnim ritmom (pravilni RR-intervali) kod fokusne atrijske tahikardije i nepravilnim ritmom (nepravilni RR-intervali) kod multifokalne atrijske tahikardije. Atrijske tahikardije kraćega trajanja mogu biti povod ulaska u fibrilaciju atrija, a one dužega trajanja mogu postati uzrok razvoja kardiomiopatije.
EKG nalaz kod fokalne atrijske tahikardije ukazuje na pravilnu tahikardiju uskih QRS-kompleksa čija se frekvencija kreće između 100 i 250 otkucaja u minuti. Budući da ektopični električni impuls u fokalnoj atrijskoj tahikardiji ima pravilan ritam, na EKG-u se kod nižih frekvencija uočavaju jasni P-valovi jednake morfologije koji se razlikuju od P-valova sinusnoga ritma. Na fokus prisutan u desnom atriju ukazuje prisutnost pozitivnoga ili bifazičnog P-vala u aVL-u te negativan ili bifazičan P-val u V1, dok na fokus izbijanja u lijevom atriju ukazuje nalaz negativnoga P-vala u I i aVL-u te pozitivnoga P-vala u V1 (Slika 1.42.).
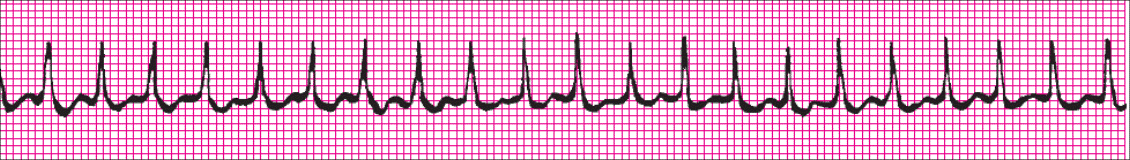
Slika 1.42. EKG nalaz –SVPT ( fokalna atrijska tahikardija)
EKG nalaz kod multifokalne atrijske tahikardije ukazuje na nepravilnu tahikardiju uskih QRS-kompleksa kod koje se pri nižim frekvencijama uočavaju tri ili više različitih morfologija P-valova (Slika 1.43.). Često se miješa s fibrilacijom atrija od koje se razlikuje po izolelektričnim segmentima između pojedinih P-valova i ne toliko brzim ritmom.
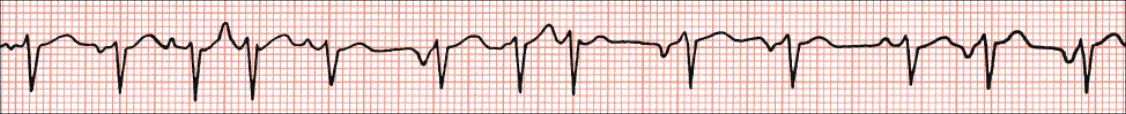
Slika 1.43. EKG nalaz – SVPT (multifokalna atrijska tahikardija)
Klinička slika. SVPT je obilježen iznenadnom i naglom pojavom simptoma u vidu osjećaja glasnoga lupanja srca (palpitacije), uznemirenosti, uplašenosti, tremora i preznojavanja. Pojava sinkope je rijetka. SVPT se može javiti spontano ili nakon nekoga podražaja, kao što je promjena položaja tijela. Često se javlja i nakon emocionalnoga stresa, prekomjerne konzumacije kofeina, teina ili alkohola. Trajanje simptoma je različito, može završiti spontano ili zahtijevati medicinske intervencije (vagalni manevri, medikamenti). Kod bolesnika s postojećom koronarnom bolesti SVPT može uzrokovati stenokardične tegobe, a kod bolesnika s oštećenom sistoličkom funkcijom hipotenziju i srčano popuštanje.
Dijagnoza se postavlja na osnovi kliničke slike i EKG-a. Razlikovanje pojedinih vrsta SVPT-a na temelju 12-kanalnoga Holter EKG-a ponekad je teško i zahtijeva puno iskustva, posebno kada se radi o AVNRT-u i AVRT-u. Osnovna je karakteristika EKG-a pri SVPT-u pravilna tahikardija frekvencije između 160 i 250 otkucaja u minuti uskih QRS-kompleksa (osim u slučaju postojanja poremećenoga provođenja, kao što je blok desne ili lijeve grane kada je QRS-kompleks proširen iznad 120 ms). P-valovi su obično nevidljivi jer su inkorporirani tj. prekriveni QRS-kompleksom ili se javljaju neposredno iza njega kao pseudo S ili pseudo R'-zubac. Elektrofiziološka obrada rezervirana je za bolesnike koji imaju učestale simptomatske SVPT-e i kod kojih se planira kateterska ablacija s ciljem definitivnoga liječenja.
Liječenje supraventrikularnih tahiakrdija u načelu je jednako, bez obzira na vrstu aritmije, a sastoji se od mjera prekidanja napada SVPT-a (vagalni manevri, farmakološka, elektrokonverzija, ablacija) te prevencije ponovnih napada.
Prekid napada SVPT-a. Nakon inicijalne obrade bolesnika (fizikalni pregled, EKG), ako se zaključi da se radi o bolesniku koji ima SVPT i nepovoljne znakove (znakovi šoka, poremećaj svijesti, srčano popuštanje, ishemija miokarda), indicirana je hitna elektrokardioverzija primjenom sinkroniziranoga elektrošoka jakosti 70-120 J ako se radi o bifaznim ili 100 J ako se radi o monofaznim defibrilatorima. Kod ostalih, hemodinamski stabilnih bolesnika, prekid SVPT-a primarno se postiže vagalnim manevrima ili farmakološkim mjerama, a tek se kod rezistentnih bolesnika pristupa elektrokardioverziji.
Vagalni manevri podrazumijevaju mehaničke radnje koje dovode do povećanja tonusa parasimpatikusa koji djeluje negativno kronotropno na srce, tj. usporavaju stvaranje i provođenje srčanoga električnog impulsa. Oni predstavljaju prvu medicinsku intervenciju kod ovih bolesnika, i često ih bolesnici sami primjenjuju kako bi vratili normalan sinusni ritam i olakšali simptome. Najčešće se u tu svrhu primjenjuju kašljanje, Valsavin manevar, masaža karotidnoga sinusa te, rjeđe, uranjanje lica u hladnu vodu ili gutanje ledene vode.
Masaža karotidnoga sinusa izvodi se najprije na desnoj strani vrata u trajanju od 10 do 20 sekundi, a u slučaju izostanka učinka prelazi se na lijevu stranu (zabranjeno je istovremeno masirati obje strane). Ta se metoda izbjegava kod starijih osoba, osoba s anamnezom recidivirajućih cerebovaskularnih incidenata te kod bolesnika s auskultacijski potvrđenim šumom nad karotidnom arterijom.
Valsalvin manevar temelji se na povećanju intratorakalnoga tlaka što se osigurava jakom kontrakcijom abdominalnih mišića. To osigurava porast intraabdominalnoga tlaka koji se preko ošita prenosi i na prsni koš. Postupak se izvodi kod bolesnika u polusjedećem položaju na način da se bolesniku da šprica od 10 mL u koju puše svom snagom pokušavajući potisnuti klip ili se rukom prekriju nos i usta te se bolesniku savjetuje da tiska kao da će imati stolicu. Postupak treba trajati oko 15 sekundi, a potom se bolesnik poliježe te mu se pasivno podignu noge kroz još 15 sekundi što povećava uspjeh postupka.
Farmakološka konverzija SVPT-a u sinusni ritam indicirana je kod bolesnika kod kojih nisu uspjele mehaničke metode stimulacije parasimpatikusa (vagalni manevri), a lijekovi izbora su adenozin i blokatori kalcijskih kanala, a mogu se primijeniti i propafenon, amiodaron, beta blokatori.
Intravenska primjena adenozina danas se navodi kao metoda izbora za prekidanje SVPT-a, zbog kratkoga vremena učinka i minimalno negativnoga inotropnog djelovanja. Adenozin dovodi do bloka provođenja električnoga impulsa kroz AV-čvor te tako dovodi do prekida kružnoga mehanizma AVRT-a i AVNRT-a, što se događa u više od 90 % slučajeva SVPT-a. Zbog svoga kratkog vremena poluživota od svega 10 sekundi, lijek se mora davati kao brzi intravenski bolus (kroz 1 do 2 sekunde) i dodatno se potiskuje s 10 do 20 ml fiziološke otopine. Inicijalna doza adenozina je 6 mg, a po potrebi se može ponoviti još dva puta u dozi od 12 mg. Glavne nuspojave na koje bolesnike treba upozoriti su kratkotrajne opresije u prsima, mučnina, preznojavanje, tremor i glavobolja. Zbog moguće ekscitacije atrijskoga i ventrikularnog miokarda kod otprilike 10 % bolesnika nakon primjene adenozina može se pojaviti fibrilacija atrija, a rjeđe i ventrikularni poremećaji ritma, zbog čega je potreban nadzor za vrijeme primjene lijeka. Također, adenozin može uzrokovati i bronhospazam te se ne preporuča njegova primjena kod bolesnika s astmom i kroničnom opstruktivnom plućnom bolesti.
Intravenska primjena blokatora kalcijskih kanala, kao što su verapamil i diltiazem, indicirana je kod bolesnika koji ne reagiraju na adenozin ili je on kontraindiciran. Njihov učinak ostvaruje se smanjenjem provodljivošću AV-čvora, što je uvjetovano inhibicijom sporih kalcijskih kanala i smanjenjem utoka kalcija u stanice provodnoga sustava. Za razliku od adenozina, ovi lijekovi imaju dulji poluvijek života i jače izražen negativan inotropni učinak, zbog čega može doći do hipotenzije koja može potrajati još neko vrijeme nakon postignute konverzije u sinusni ritam. U Hrvatskoj se najčešće primjenjuje verapamil koji se daje u dozi od 5 do 10 mg kao spori intravenski bolus kroz 5 do 10 minuta. Verapamil se ne smije davati kod bolesnika s izraženim srčanim popuštanjem kao niti kod bolesnika s ranije dokumentiranim preekscitacijskim sindromom (WPW ili LGL-sindrom), s obzirom na to da može uzrokovati pojavu teških ventrikularnih aritmija. Također se izbjegava i kombinirana primjena blokatora kalcijskih kanala s beta blokatorima i ivabradinom.
Intravenska primjena propafenona također je opravdana kod bolesnika sa SVPT-om, s obzirom na to da i on dovodi do smanjenja provodljivosti kroz AV-čvor smanjujući brz utok natrija u stanice provodnoga sustava. Prednost u odnosu na blokatore kalcijskih kanala stoji u činjenici da se može davati i kod bolesnika s preekscitacijskim sindromom, ali se ne preporuča kod bolesnika sa značajnom strukturnom bolesti srca. Lijek se primjenjuje u dozi od 1 do 2 mg/kg kao spori intravenski bolus uz stalno praćenje srčanoga ritma za vrijeme primjene lijeka. Najčešće nuspojave koje prate intravensku primjenu propafenona su omaglica, palpitacije i hipotenzija.
Amiodaron se također može primjenjivati kod bolesnika sa SVPT-om i predstavlja jedan od najsigurnijih lijekova (najmanji proaritmogeni potencijal, najmanja ograničenja za primjenu), ali ima nešto skromnije rezultate u konverziji SVPT-a u sinusni ritam. Standardna preporučena doza amiodarona iznosi 5 mg/kg otopljeno u 250 ili 500 ml 5 %-tne glukoze primijenjeno kao spora intravenska infuzija kroz dvadeset minuta do tri sata. Doza se može ponavljati do maksimalne dnevne doze od 1200 mg tijekom 24 sata. Najznačajnija nuspojava primjene amiodarona je hipotenzija.
Prevencija ponovnoga napada SVPT-a. Medikamentnu prevenciju ponovnoga napada SVPT-a čini primjena lijekova koji produljuju vrijeme refrakternosti AV-čvora, a to su u prvom redu nedihidropiridinski blokatori kalcijskih kanala (diltiazem ili verapamil) te beta blokatori. Bolesnici koji slabo reagiraju na ove lijekove i imaju učestale recidive SVPT-a mogu se liječiti propafenonom ako se radi o strukturno zdravom srcu, ili amiodaronom ako se radi o bolesnicima sa značajnijim strukturnim bolestima srca. Kod bolesnika koji imaju učestale i opetovane epizode SVPT-a, kao i kod mlađih osoba kod kojih želimo izbjeći dugotrajnu primjenu antiaritmika, preporuča se elektrofiziološko ispitivanje te kateterska ablacija sporoga puta u slučaju AVNRT-a ili akcesornog puta u slučaju AVRT-a. Uspješnost kateterske ablacije u trajnom rješavanju SVPT-a kreće se i preko 95 %.
Uvod. Sindromi preekscitacije predstavljaju posebnu skupinu aritmija koje karakterizira patološka povezanost atrijskoga i ventrikularnog miokarda putem akcesornih puteva koji omogućavaju anterogradni ili retrogradni prijenos električnoga impulsa mimo atrioventrikularnoga čvora što uzrokuje prijevremenu stimulaciju i kontrakciju ventrikula (preekscitacija) i/ili može biti uzrokom nastanka supraventrikularnih ili ventrikularnih tahiaritmija (WPW sindrom). Klinički značajni akcesorni putevi prikazani su u Tablici 1.23.
|
Tablica 1.23. Klinički značajni akcesorni putevi i sindromi preekscitacije
|
|
Akcesorni put
|
Anatomska konekcija
|
Sindrom preekscitacije
|
|
Kentov snop
|
Atrijski i ventrikularni miokard
|
Wolff-Parkinson-Whiteov sindrom
|
|
Jamesov snop
|
Atrijski miokard i AV-čvor ili Hisov snop
|
Lown–Ganong–Levineov sindrom
|
|
Mahaimska vlakna
|
Atrijski miokard i desna grana Hisova snopa
|
Tahiaritmije uzrokovane Mahaim vlaknima
|
WOLFF-PARKINSON-WHITEOV OBRAZAC I SINDROM
Definicija i epidemiologija. Wolff-Parkinson-Whiteov (WPW) obrazac obilježen je postojanjem akcesornoga puta koji izravno povezuje miokard atrija i ventrikula, što omogućava anterogradni prijenos srčanoga impulsa mimo atrioventrikularnoga čvora i uzrokuje pojavu preuranjene stimulacije i kontrakcije ventrikula (preekscitacija), dok se termin WPW-sindrom koristi kada na EKG-u uz WPW-obrazac, koji ukazuje na postojanje akcesornoga puta i preekscitacije ventrikula, postoje povezane tahiaritmije. Akcesorni snop koji izravno povezuje atrije s ventrikulima (Kentov snop) može biti smješten bilo gdje duž atrioventrikularne brazde ili u septumu, a najčešće lokalizacije su u području lijeve lateralne strane brazde (50 %), u stražnjem (30 %) i prednjem (10 %) dijelu septuma te u području desne lateralne strane brazde (10 %). Učestalost EKG nalaza WPW-obrasca u općoj populaciji iznosi 0,1 do 0,3 %, dok je učestalost WPW-sindroma nešto rjeđa.
Patofiziologija. Akcesorni put koji spaja miokard atrija i ventrikula (Kentov snop) nastaje kao posljedica poremećaja u embrionalnom razvoju kada dolazi do njihove separacije kako bi se osigurala električna izoliranost atrija i ventrikula koji ostaju povezani jedino preko atrioventrikularnoga čvora i Hisova snopa. To osigurava prijenos srčanoga impulsa iz atrija u ventrikule samo putem AV-čvora, što osigurava kordiniranu kontrakciju atrija i ventrikula, potrebnu za odgovarajuće pražnjenje atrija i dijastoličko punjenje ventrikula. Najprije se kontrahiraju atriji koji potiskuju krv prema ventrikulima (sistola atrija), a nakon toga s kašnjenjem koje odgovara vremenu prolaza električnog impulsa kroz AV-čvor i ventrikuli (sistola ventrikula). Postojanje akcesornoga puta koji izravno povezuje miokard atrija i ventrikula omogućava prijenos srčanoga električnog impulsa mimo atrioventrikularnoga čvora i Hisova snopa, koji sporije provodi električni impuls, što uvjetuje preuranjenu ili prijevremenu stimulaciju i kontrakciju ventrikula, odnosno preekscitaciju. To je pojava koja ne uzrokuje nikakve simptome i može ju se uočiti samo putem karakterističnoga EKG nalaza (WPW-obrazac). Akcesorni put, osim što može biti uzrok preekscitacije ventrikula, može biti i uzrok tahiaritmija i tada govorimo o WPW-sindromu. Akcesorni put može poslužiti kao mjesto koje omogućava anterogradni ili retrogradni prijenos srčanoga električnog impulsa koji dovodi do nastanka atrioventrikularne kružne tahikardije (AVRT) koja može imati dva oblika. Ortodromna AVRT nastaje anterogradnim prijenosom srčanoga električnog impulsa iz atrija u ventrikule putem AV-čvora i Hisova snopa te retrogradnim vraćanjem akcesornim putem pri čemu nastaje tahikardija uskih QRS-kompleksa (ako nema intraventrikularnoga poremećaja provođenja). Antidromna AVRT nastaje anterogradnim prijenosom srčanoga impulsa iz atrija u ventrikule preko akcesornoga puta te retrogradnim vraćanjem u atrije putem Hisova snopa i AV-čvora što uvjetuje nastanak tahikardije širokog QRS-kompleksa, pa se ona često interpretira kao VT. Nastanak ventrikularnih poremećaja srčanoga ritma kod bolesnika s WPW-obrascem moguć je kod bolesnika kod kojih se razvije fibrilacija ili undulacija atrija kada se neki od brojnih električnih impulsa koji nastaju i prolaze miokardom atrija prenose na ventrikule uzrokovajući njihov podražaj i nastanak ventrikularne tahikardije ili, rjeđe, i ventrikularne fibrilacije.
Klinička slika. Osobe s WPW-obrascem nemaju kliničkih simptoma i otkriju se rutinskom analizom EKG-a. Manji dio bolesnika s WPW-obrascem prezentira se WPW-sindromom kojega karakterizira pojava AVRT-a koja se prezentira tipičnim simptomima kao što su palpitacije, omaglice, nesvjestica, sinkopa te uznemirenost i uplašenost. Vrlo rijedak oblik kliničke manifestacije WPW-sindroma razvoj je malignoga ventrikularnog poremećaja srčanoga ritma ili kardijalnoga aresta. Kod bolesnika s WPW-obrascem češća je i pojavnost fibrilacije i undulacije atrija u odnosu na opću populaciju.
Dijagnoza. Osnovu dijagnoze WPW-obrasca i sindroma čini EKG nalaz (Slika 1.44.). WPW-obrazac karakterizira skraćen PR-interval (< 0,12 s), QRS-kompleks koji traje duže od 120 ms te se na njemu raspoznaje karakteristični delta-val (polagani uspon QRS-kompleksa). Dijagnoza WPW-sindroma postavlja se kod bolesnika koji imaju već od ranije poznat EKG nalaz WPW-obrasca i koji razviju neku od tahiaritmija koje u svom mehanizmu uključuju akcesorni put (najčešće AVRT). Karakterističan EKG obrazac neće se uvijek jasno vidjeti, osobito ako se radi o atipičnim lokalizacijama akcesornoga puta. Ergometrijom se može provesti stratifikacija rizika. Ako se pri opterećenju i povećanoj srčanoj frekvenciji izgubi WPW-obrazac (delta – val u EKG-u) smatra se da je akcesorni put ograničene anterogradne provodljivosti i takve se bolesnike svrstava u skupinu bolesnika s niskim rizikom od nastanka malignoga ventrikularnog poremećaja ritma i nagle srčane smrti. Kod svih bolesnika s nalazom EKG-a s WPW-obrascem, posebno kod učestalih simptomatskih tahikardija (WPW-sindrom), treba obaviti elektrofiziološko ispitivanje radi lokalizacije akcesornoga puta i kateterske ablacije. Nalazi elektrofiziološkoga ispitivanja koji upućuju na visok rizik od nagle srčane smrti kod takvih su bolesnika: nalaz multiplih akcesornih puteva, inducibilna AVRT ili fibrilacija atrija tijekom ispitivanja, RR-interval skraćen na manje od 250 ms te nalaz refrakternoga perioda akcesornoga puta manji od 240 ms.
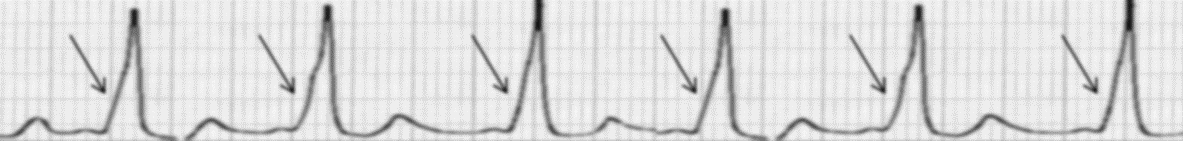
Slika 1.44. EKG nalaz – WPW-sindrom (delta val prikazan strelicom)
Stratifikacija rizika od nagle srčane smrti kod ovih se bolesnika temelji na EKG-u, ergometriji (EKG u opterećenju) te elektrofiziološkom ispitivanju. U kategoriju bolesnika s povećanim rizikom od nastanka nagle srčane smrti ubrajaju se bolesnici s perzistentnim nalazom WPW-obrasca u EKG-u koji se ne povlači pri opterećenju te bolesnici s prethodno navedenim nalazima elektrofiziološkoga ispitivanja. Osim toga, povećan rizik imaju i mlađe osobe, osobe muškoga spola te bolesnici s kongenitalnim ili stečenim strukturnim srčanim poremećajima.
Liječenje. Bolesnika s WPW-obrascem i WPW-sindromom liječi se ablacijom akcesornoga puta, a ona je indicirana kod svih bolesnika s rekurentnim simptomatskim tahiaritmijama, kao i kod asimptomatskih bolesnika s povećanim rizikom od nastanka nagle srčane smrti. Farmakološko liječenje indicirano je za prekid nastale tahiaritmije ili za prevenciju nove tahiaritmije kod bolesnika koji nisu kandidati za katetersku ablaciju. Kod svih bolesnika koji se prezentiraju tahiaritmijskim poremećajem srčanoga ritma i imaju izražene nepovoljne znakove indicirana je hitna elektrokardioverzija.
Akutno farmakološko liječenje (prekid tahiaritmije). Ako se radi o pravilnoj tahiaritmiji uskih QRS-kompleksa (ortodromna AVRT), farmakološki pristup jednak je kao i kod ostalih formi SVPT-a, a uključuje primjenu adenozina ili verapamila ako se ne postigne konverzija u sinusni ritam primjenom vagalnih manevara. Ako se radi o tahiaritmiji s proširenim QRS-kompleksima, što ukazuje na antidromni oblik AVRT-a ili fibrilaciju atrija s anterogradnim prevođenjem impulsa preko akcesornoga puta, primjena lijekova koji smanjuju provodljivost atrioventrikularnoga čvora, kao što su blokatori kalcijskih kanala ili beta blokatori, dodatno će povećati provođenje impulsa putem akcesornoga puta s atrija na ventrikule, što može dovesti do pojave ventrikularne tahikardije ili fibrilacije, stoga se ti lijekovi strogo izbjegavaju. U tim se slučajevima postizanje konverzije preporuča primjenom propafenona ili amiodarona.
Kronično farmakološko liječenje (prevencija tahiaritmije) provodi se samo kod bolesnika koji iz nekoga razloga nisu kandidati za katetersku ablaciju akcesornoga snopa. U tu se svrhu najčešće koriste propafenon kod bolesnika sa strukturno zdravim srcem ili amiodaron kod bolesnika sa značajnom strukturnom bolesti srca. Primjenu beta blokatora i blokatora kalcijskih kanala treba izbjegavati kod ovih bolesnika.
OSTALI OBLICI SINDROMA PREEKSCITACIJE
Lown–Ganong–Levineov sindrom ili LGL-sindrom predstavlja preekscitacijski sindrom koji nastaje kao posljedica postojanja akcesornoga puta koji povezuje atrijski miokard s donjim dijelom atrioventrikularnoga čvora ili s Hisovim snopom (tzv. Jamesov snop). Brzo provođenje impulsa iz atrija preko Jamesova snopa u Hisov snop dovodi do skraćenoga PR-intervala (normalno se impuls koji putuje atrioventrikularnim čvorom provodi sporije) i preekscitacije ventrikula koja se očituje urednim QRS-kompleksom. Postojanje Jamesova snopa stvara rizik od nastanka kružnih aritmija kao što su AVNRT ili ortodromna AVR-tahikardija koja uključuje anterogradno provođenje impulsa preko AV-čvora do ventrikula i njegovo retrogradno vraćanje putem Jamesova snopa nazad u atrije. Povećan je i rizik od nastanka atrijske fibrilacije i undulacije te ventrikularne tahikardije. LGL-obrazac uključuje tipičan EKG nalaz (skraćeni PR-interval, uredan QRS-kompleks), a o LGL-sindromu govorimo kada se pojavi neka od navedenih tahiaritmija. Dijagnoza se postavlja na temelju EKG nalaza i potvrđuje elektrofiziološkim ispitivanjem. Kod bolesnika s opetovanim simptomatskim tahiaritmijama u podlozi LGL-sindroma indicirana je kateterska ablacija akcesornoga snopa. Učinkovitost pojedinih antiaritmika u liječenju ovoga sindroma slabo je ispitana, pa se i liječenje ponajprije temelji na kliničkom iskustvu.
Tahiaritmije uzrokovane Mahaimovim vlaknima predstavljaju rijedak oblik sindroma preekscitacije kojega obilježava prisutnost patološke komunikacije između atrijskoga i ventrikularnog miokarda putem vlakana koja najčešće potječu od prednjega zida desnoga atrija i dopiru do desnoga ventrikula u području desne grane Hisova snopa. Postojanje tih vlakana najčešće se viđa kod bolesnika koji imaju i druge prirođene strukturne bolesti, kao što su Ebsteinova anomalija ili atrezija triksupidalne valvule. EKG ovih bolesnika u mirovanju je uredan, s obzirom na to da se provođenje impulsa dominantno odvija preko atrioventrikularnoga čvora. Mahaimova vlakna omogućavaju samo anterogradno provođenje impulsa, što povećava rizik od nastanka antidromne AVR-tahikardije (impuls se anterogradno provodi s atrija na vetrikule putem Mahaimovih vlakana, dok se retrogradno vraća u atrije putem Hisova snopa i AV-čvora). Elektrofiziološko ispitivanje i kateterska ablacija akcesornih puteva čine osnovni dijagnostičko-terapijski pristup kod ovih bolesnika.
FIBRILACIJA I UNDULACIJA ATRIJA
FIBRILACIJA ATRIJA
Definicija. Fibrilacija atrija (FA) predstavlja najčešću postojanu aritmiju u kliničkoj praksi. Obilježava ju kaotično kruženje mnoštva depolarizacijskih valova kroz atrijski miokard što dovodi do njegova treperenja i gubitka odgovarajuće kontrakcije. Temeljno razlikujemo kliničku i subkliničku FA. Klinička FA može biti simptomatska ili asimptomatska uz dokazani elektrokardiografski zapis (12-kanalni ili ritam traka u trajanju od najmanje 30 sekundi). Subklinička FA potvrđena je zapisom FA putem uređaja s mogućnošću duljega (ili trajnog) praćenja srčanoga ritma (srčani elektrostimulator ili loop recorder) u trajanju od pet minuta ili duže.
Epidemiologija. Fibrilaciju atrija ima oko 1 do 1,5 % opće populacije diljem svijeta, a učestalost je osobito visoka kod bolesnika starije životne dobi (70 % bolesnika s FA-om su u životnoj dobi između 65 i 85 godina). Povećanje učestalosti (prevalencije) FA-a, osobito u razvijenim zemljama, tumači se općim trendom starenja stanovništva, s obzirom na to da učestalost FA-a raste s dobi, većom prisutnošću arterijske hipertenzije i drugih kardiovaskularnih čimbenika rizika koji povećavaju učestalost FA-a, kao i dostupnijom i naprednijom dijagnostikom. Iako je incidencija FA-a nešto niža kod žena u odnosu na muškarce, žene s FA-om imaju veći rizik od smrtnoga ishoda u odnosu na muškarce, što se tumači generalno višim rizikom od nastanka moždanoga udara. Fibrilacija atrija značajno povećava ukupni morbiditet i mortalitet, a znatno utječe i na kvalitetu života.
Etiopatogeneza. Fibrilacija atrija javlja se na podlozi strukturno promijenjenoga srca, a koronarna i hipertenzivna bolest srca danas predstavljaju glavne rizične čimbenike za njezinu pojavnost (Tablica 1.24.). Osim toga, nastanku FA-a pogoduju i druge strukture bolesti srca, kao što su bolest mitralnoga zaliska, dilatacijska i druge kardiomiopatije, kronični konstriktivni perikarditis te kongenitalne anomalije. Osim strukturnih bolesti srca, FA se može naći i u sklopu nekih drugih, ekstrakardijalnih bolesti i stanja, kao što su hipertireoza te kronične plućne bolesti (kronična opstruktivna plućna bolest, opstruktivna apneja u spavanju, plućna hipertenzija, tromboembolijska bolest pluća). Ostali rizični čimbenici koji pogoduju razvoju FA-a su, pored već navedenih muškoga spola i starije životne dobi, i: metabolički sindrom, prekomjerna konzumacija alkohola, prekomjerna konzumacija vitamina D i niacina te intenzivna fizička aktivnost. Svi navedeni čimbenici koji pogoduju razvoju FA-a dovode do različitih strukturnih poremećaja na samom miokardu atrija, što stvara predispoziciju za nastanak poremećaja automatizma i provođenja električnih impulsa.
|
Tablica 1.24. Etiološki čimbenici u nastanku fibrilacije atrija
|
|
Kardijalne bolesti i stanja
|
Ekstrakardijalne bolesti i stanja
|
Ostali rizični čimbenici
|
|
Koronarna bolest srca
Hipertenzivna bolest srca
Bolest mitralnoga zaliska
Dilatacijska kardiomiopatija
Kongenitalne i druge srčane bolesti
|
Hipertireoza
Kronična opstruktivna pluća bolest
Kronična plućna hipertenzija
Akutna i kronična plućna embolija
Opstruktivna apneja u spavanju
|
Povećana dob, muški spol
Metabolički sindrom
Prekomjeran unos alkohola
Prekomjeran unos vitamina D i niacina
Intenzivirana fizička aktivnost
|
Fibrilacija atrija iznimno se javlja i na strukturno zdravom srcu. Takvu FA nazivamo izolirana fibrilacija atrija (engl. lone atrial fibrillation) i odgovorna je za 20 do 25 % slučajeva fibrilacije atrija kod mlađih osoba. Tumači se poremećajem odnosa autonomnoga živčanog sustava, tj. naglašenim tonusom vagusa (parasimpatikusa) tijekom noći i simpatikusa tijekom dana. Fibrilacija atrija može se javiti i u uvjetima povećanoga unosa alkohola (engl. holiday heart syndrome).
Patofiziologija. Patofiziologiju FA-a možemo razmatrati na nekoliko razina: na razini samoga zbivanja unutar atrijskoga miokarda kojim započinje fibrilacija atrija, na razini odgovora ventrikula na nastali poremećaj te u konačnici na razini reperkusije same fibrilacije atrija na ukupnu hemodinamiku.
Patofiziološki mehanizmi kojima navedeni uzročni čimbenici dovode do proaritmogenoga učinka koji rezultira nastankom FA-a različiti su i uključuju djelovanje na više razina: 1) promjene u ekstracelularnom matriksu (fibroza, upalna i masna infiltracija, odlaganje amiloida); 2) promjene na razini miocita (remodeliranje ionskih kanala, hipertrofija, apoptoza i nekroza); 3) endotelne i vaskularne promjene te promjene autonomnoga živčanog sustava. U konačnici se stvara okruženje u kojemu se javlja povećana sklonost ektopičnoj električnoj aktivnosti te poremećaj provođenja impulsa, što se ostvaruje kroz promjene u trajanju i karakteristikama samoga akcijskog potencijala unutar atrijskoga miokarda. Žarišta atrijskoga miokarda koja pokazuju povećani automatizam brzo se depolariziraju i stvaraju električnu aktivnost fibrilacijskoga tipa, a poremećaj provođenja u vidu nastanka više kružnih mehanizama uzrokovan promjenama u strukturi samoga atrija propagira i održava fibrilaciju. Dominantno mjesto u kojemu dolazi do izbijanja i nastanka fibrilacijske električne aktivnosti je lijevi atrij, i to njegovo područje oko utoka plućnih vena, što je posebno naznačeno kod bolesnika s paroksizmalnom fibrilacijom atrija.
Odgovor ventrikula. Iako se u atriju stvara mnoštvo električnih podražaja, tek se poneki prevedu u ventrikule i dovedu do njegove kontrakcije, što je posljedica refrakternosti AV-čvora. To provođenje električnoga impulsa kroz AV-čvor ne prati nikakav slijed, zbog čega se u konačnici razvija apsolutna aritmija ventrikula. Frekvencija ventrikula kod FA-a široko varira kod pojedinih bolesnika (100 – 160/min), što se tumači individualnim razlikama u duljini trajanja refrakternoga perioda AV-čvora. Fibrilaciju atrija koju prati ubrzana frekvencija ventrikula opisujemo kao FA s brzim odgovorom ventrikula. Kako na provođenje električnoga impulsa kroz AV-čvor utječu i involutivne promjene samoga čvora, kod starijih osoba obično susrećemo nešto sporiji odgovor ventrikula nego kod mlađih.
Utjecaj na hemodinamiku. Opisani mehanizam dovodi do toga da se atrijski miokard u konačnici ne kontrahira u cijelosti, nego njegovi miociti lagano osciliraju dovodeći do treperenja oba atrija. Izostanak kontrakcije atrija kod zdravih osoba ne dovodi do značajnijih hemodinamskih poremećaja, s obzirom na to da je punjenje ventrikula u najvećem dijelu spontani proces koji se odvija na račun tlačnoga gradijenta između atrija i ventrikula tijekom dijastole (na ovaj način oko 80 % krvi pređe iz atrija u ventrikule, a tek 20 % bude potisnuto atrijskom sistolom, odnosno kontrakcijom atrija), pa ono i nema reperkusije na srčani minutni volumen. Ipak, gubitak atrijske sistole kod bolesnika sa značajnije izraženim strukturnim poremećajem koji dovodi do određenog stupnja sistoličke i/ili dijastoličke disfunkcije može biti uzrok pada srčanoga minutnog volumena i posljedičnih kliničkih manifestacija (srčano popuštanje). Porast frekvencije ventrikula kod bolesnika s FA-om također može uvjetovati određene hemodinamske učinke. U stanjima povećane frekvencije ventrikula skraćuje se dijastoličko punjenje ventrikula što dodatno smanjuje udarni, a time i minutni volumen. Osim toga, porast frekvencije ventrikula dovodi i do povećane potrebe za krvlju i kisikom, što uz skraćenu dijastolu može rezultirati razvojem hipoperfuzije i ishemije (protok kroz koronarne arterije odvija se samo u vrijeme dijastole), a to posebno do izražaja dolazi kod bolesnika s od ranije poznatom koronarnom bolesti.
Ostale patofiziološke posljedice fibrilacije atrija. U uvjetima FA pri kojima izostaje odgovarajuća kontrakcija atrija nalazimo povećani rizik od nastanka ugruška, osobito u području aurikle lijevoga atrija, što može postati izvor tromboembolijskih incidenata, zbog čega se FA smatra jednim od najznačajnijih rizičnih čimbenika za nastanak ishemijskoga moždanog udara i smatra se da uzrokuje 20 do 30 % svih moždanih udara.
Klinička slika. S obzirom na prisutnost kliničkih manifestacija, razlikujemo asimptomatsku i simptomatsku FA. Gotovo jedna trećina bolesnika koji imaju FA nema kliničkih simptoma i ona se slučajno otkrije prilikom EKG snimanja. Kod ostalih bolesnika težina kliničke slike FA-a može biti različita. Bolesnici se uglavnom žale na osjećaj glasnoga i nepravilnog rada srca (palpitacije) te su pri tome često zaplašeni i uznemireni. Rjeđe su prisutne presinkope i sinkope, i to uglavnom kod bolesnika s FA sa sporim ventrikularnim odgovorom, zbog pretjerane medikamentne blokade AV-čvora ili prilikom pauza koje nastaju prilikom konverzije FA u normalni sinusni ritam. Kod bolesnika s izraženim strukturnim bolestima srca koje su dovele do određenoga stupnja sistoličke i/ili dijastoličke disfunkcije razvoj FA s brzim odgovorom ventrikula može biti uzrok pogoršanja simptoma i znakova srčanoga popuštanja, kao i anginoznih tegoba (pritisak i bolovi u prsima) ili njezinih ekvivalenata (dispneja), osobito kod koronarnih bolesnika. Ponekad je moždani udar ili drugi oblik sistemskog tromboembolizacijskog incidenta prvi znak FA-a. Izraženost simptoma FA-a i opterećenje bolesnika procjenjuje se na temelju modificirane EHRA skale (engl. European Heart Rhythm Association) koja procjenjuje težinu simptoma (bez simptoma, blagi, umjereni, teški, onesposobljavajući) na temelju njihovih utjecaja na svakodnevne aktivnosti (Tablica 1.25.).
|
Tablica 1.25. Modificirana EHRA skala za procjenu težine simptoma fibrilacije atrija.
|
|
EHRA score
|
Simptomi
|
Utjecaj na svakodnevne aktivnosti
|
|
I
|
Bez simptoma
|
Bolesnici nemaju simptoma.
|
|
IIa
|
Blagi
|
Bez utjecaja na svakodnevne aktivnosti, ne opterećuju bolesnika.
|
|
IIb
|
Umjereni
|
Bez utjecaja na svakodnevne aktivnosti, ali opterećuju bolesnika.
|
|
III
|
Teški
|
Značajan utjecaj na svakodnevne aktivnosti.
|
|
IV
|
Onesposobljavajući
|
Svakodnevne aktivnosti u potpunosti su prekinute.
|
Klasifikacija FA-a temelji se na njezinoj postojanosti, a nekoliko je pojmova kojima se ona opisuje: novootkrivena, paroksizmalna, perzistentna , dugotrajno perzistentna te permanentna FA.
Novootkrivena fibrilacija atrija naziv je za svaku FA koja se otkrije prvi puta i nije ranije bila dijagnosticirana, bez obzira na duljinu trajanja ili eventualnu prisutnost simptoma koji se mogu povezati s FA-om.
Paroksizmalna fibrilacija atrija karakterizirana je samoograničavajućim epizodama koje traju do sedam dana s napomenom kliničke važnosti perioda od prvih 48 sati od pojave FA-a nakon kojega se smanjuje vjerojatnost spontane konverzije u sinusni ritam.
Perzistentna fibrilacija atrija održiva je FA koja traje dulje od sedam dana i obično zahtijeva prekid (konverziju u sinusni ritam) lijekovima ili elektrokardioverzijom. Taj oblik FA-a uglavnom se javlja kod bolesnika koji su već imali paroksizme FA-a.
Dugotrajna perzistentna fibrilacija atrija održiva je FA koja traje godinu dana ili dulje, dok se još pokušava postići kontrola ritma, odnosno konverzija u sinusni ritam.
Permanentna fibrilacija atrija označava FA koja traje dulje od godine dana i kod koje se odustaje od pokušaja konverzije u sinusni ritam te se kao osnovni terapijski ciljevi postavljaju kontrola frekvencije ventrikula i tromboprofilaksa.
Dijagnoza FA-a postavlja se na temelju kliničke slike i nalaza EKG-a. Fibrilacija atrija ima karakterističan EKG nalaz koji podrazumijeva odsutnost P-valova, umjesto kojih nalazimo tzv. fibrilacijske valove (f-valovi) promjenjive amplitude, oblika i vremena pojavnosti, te apsolutnu aritmiju ventrikula što se prezentira pojavnošću QRS-kompleksa različitih RR-intervala (Slika 1.45.). U slučaju normalnoga EKG nalaza sa sinusnim ritmom uz kliničke znakove koji upućuju na postojanje ovoga poremećaja ritma, indiciran je 24-satni ili 48-satni Holter EKG kojime se povećava mogućnost registriranja pojavnost FA-a ako ona nije stalna. Kod bolesnika kod kojih se postavi dijagnoza FA-a obvezna je i ehokardiografija s ciljem otkrivanja postojanja strukturne bolesti srca i procjene sistoličke i dijastoličke funkcije, ali i s ciljem otkrivanja prisutnosti intramuralnoga tromba, što je osobito važno prilikom odluke o konverziji FA-a u sinusni ritam. U tome pogledu, sama transtorakalna ehokardiografija nije dovoljna, s obzirom na to da se njome ne može prikazati eventualni tromb u aurikuli lijevoga atrija, pa se kod takvih bolesnika mora obaviti transezofagealna ehokardiografija. Svi bolesnici moraju proći i standardnu laboratorijsku obradu, uključujući i određivanje hormona štitnjače, te ostale pretrage ovisno o sumnji na bolest u podlozi FA-a.
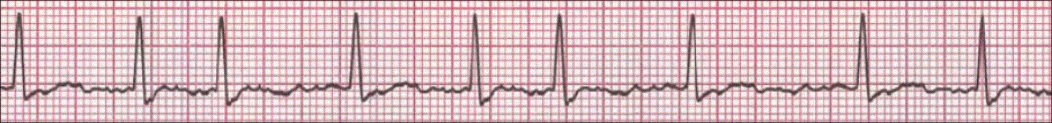
Slika 1.45. EKG nalaz – fibrilacija atrija
Liječenje. Osnovna načela liječenja FA-a podrazumijevaju: 1) terapiju kontrole ritma, 2) terapiju kontrole frekvencije, 3) antikoagulacijsko liječenje te 4) liječenje čimbenika rizika i pratećih kardiovaskularnih oboljenja. Inicijalni pristup bolesniku s novootkrivenom FA-om ovisi ponajprije o njegovom kliničkom stanju, tj. hemodinamskoj stabilnosti. Prisutnost/odsutnost znakova hemodinamske nestabilnosti diktira daljnje terapijsko postupanje.
Terapija kontrole ritma u liječenju FA-a podrazumijeva uspostavljanje i održavanje sinusnoga ritma, a terapijski modaliteti ovise o tome radi li se o akutnoj ili dugoročnoj kontroli ritma.
Akutna kontrola ritma označava akutno uspostavljanje sinusnoga ritma kod bolesnika s novootkrivenom FA-om. Kod pristupa takvim bolesnicima osnovni je korak procijeniti opće stanje bolesnika, tj. procijeniti postoje li znakovi hemodinamske nestabilnosti, kao što su izražena hipotenzija ili poremećaj stanja svijesti. Kod bolesnika s izraženim znakovima hemodinamske nestabilnosti, kao i kod svih drugih hemodinamski nestabilnih tahiaritmija, osnovni postupak podrazumijeva hitnu elektrokardioverziju (sinkronizirana isporuka elektrošoka jakosti 120 - 150 J ako se radi o bifaznim uređajima ili 200 J ako se radi o monofaznim) uz primjerenu prethodnu analgosedaciju. Kod hemodinamski stabilnih bolesnika potrebno je napraviti izbor bolesnika kod kojih će se učiniti rana ili odgođena konverzija te način na koji će se ona postići: farmakološki ili elektrokardioverzijom.
Rana konverzija moguća je kod bolesnika kod kojih se može sa sigurnošću utvrditi da novootkrivena FA ne traje dulje od 48 sati ili kod bolesnika kod kojih se na temelju transezofagealne ehokardiografije isključi prisutnost tromba u lijevom atriju (neovisno o vremenskom trajanju FA-a). Njezina je glavna prednost brzo olakšanje simptoma.
Odgođena konverzija izvodi se kod bolesnika kod kojih FA traje dulje od 48 sati ili se ne može sa sigurnošću utvrditi traje li manje od 48 sati, odnosno kod bolesnika kod kojih prisutnost tromba u lijevom atriju nije isključena na temelju transezofagealne ehokardiografije. Kod takvih se bolesnika konverzija može provesti nakon primjene oralnih antikoagulantnih lijekova (varfarin ili direktni oralni antikoagulantni lijekovi, DOAC) u trajanju od najmanje tri tjedna prije konverzije, uz nastavak njihove primjene tijekom sljedeća četiri tjedna nakon provedene konverzije, a kod bolesnika s povećanim tromboembolijskim rizikom oni se primjenjuju i doživotno. Također, ako se bolesnicima na temelju transezofagealne ehokardiografije otkrije intramuralni tromb, potrebno je provesti trotjednu antikoagulaciju, a prije same konverzije preporuča se ponoviti pretragu kako bi se potvrdila rezolucija tromba.
Elektrokardioverzija označava postupak transtorakalne primjene istosmjerne struje koja je sinkronizirana s QRS-kompleksom, a dovodi do depolarizacije kritične mase atrijskoga miokarda što omogućava sinusnom čvoru da preuzme kontrolu ritma. Zbog nelagode i bolova tijekom isporuke električne struje, postupak se izvodi u analgosedaciji (midazolam i/ili propofol) uz odgovarajući nadzor (EKG, arterijski krvni tlak, saturacija). Elektrode za isporuku električne struje postavljaju se u anterolateralni ili anteroposteriorni položaj, a većina autora preporučuje anteroposteriorni položaj kao prikladniji, s obzirom na to da se oba atrija uključuju u polje isporučene električne energije te se bilježi veći postotak uspješne konverzije. Da bi se izbjegla kožna oštećenja (opekline), na elektrode je potrebno nanijeti sloj gela, čime se ujedno osigurava i bolja provodljivost električne energije. Za sam postupak elektrokardioverzije danas se koriste bifazični defibrilatori koji omogućavaju isti učinak s isporukom električne struje manje jakosti (pri elektrokonverziji FA-a koristi se električna struja jakosti 120 do 150 J). Neuspjeh elektrokardioverzije definira se kao perzistencija FA-a i nakon isporuke električne energije ili vrlo brzi povrat nakon kratkotrajnoga sinusnog ritma, što nalaže isporuku novoga šoka veće energije, a i prethodna infuzija ibutilida povećava učinkovitost sljedećega šoka. Komplikacije elektrokardioverzije mogu biti vezane uz sam postupak analgosedacije (hipoventilacija, hipotenzija), a mogu se javiti i srčani arest (obično kod bolesnika s ranije prisutnom disfunkcijom sinusnoga čvora) i tromboembolijski incidenti.
Farmakološka konverzija označava postupak uspostave sinusnoga ritma primjenom lijekova, a obično se provodi kod bolesnika s čestim recidivima FA-a ili kod bolesnika kod kojih je analgosedacija rizična, pa se elektrokonverzija ne preporuča. Ako se radi o bolesnicima bez značajne strukturne bolesti srca, lijekovi izbora u farmakološkoj konverziji su propafenon, flekainid i vernakalant, dok se pri prisutnosti strukturne bolesti srca preporuča primjena amiodarona (Tablica 1.26.). Učinak farmakološke konverzije najizraženiji je kod FA-a koja traje do 48 sati, a sve dulje od toga smanjuje vjerojatnost postizanja normalnoga sinusnog ritma. Kod bolesnika sa strukturno zdravim srcem i rijetkim epizodama FA-a moguća je i strategija „pilula u džepu (engl. "pill in the pocket") kada se bolesnicima daje da sami uzmu antiaritmik prilikom pojave simptoma. Obično se u tu svrhu daje flekainid koji se uzima u jednoj peroralnoj dozi od 200 do 300 mg ili propafenon koji se uzima u jednokratnoj peroralnoj dozi od 450 do 650 mg kada se osjete simptomi.
|
Tablica 1.26. Lijekovi u farmakološkoj konverziji fibrilacije atrija.
|
|
Lijek
|
Inicijalna doza
|
Doza održavanja
|
Rizici/nuspojave
|
|
Propafenon
|
1,5 - 2 mg/kg tijekom 10 min
|
---
|
Hipotenzija, undulacija atrija, blaga QRS prolongacija.
|
|
Amiodaron
|
5 - 7 mg/kg tijekom 1 do 2 sata
|
50 mg/sat do ukupno 1,2 g u 24 sata
|
Hipotenzija, flebitis, bradikardija, odložena konverzija (8 - 12 sati)
|
|
Vernakalant
|
3 mg/kg tijekom 10 min
|
2 mg/kg tijekom 10 min
|
Hipotenzija, QRS i QT prolongacija, izbjegavati kod teže strukturne bolesti srca
|
|
Flekainid
|
1,5 - 2 mg/kg tijekom 10 min
|
---
|
Hipotenzija, undulacija atrija, blaga QRS prolongacija
|
Dugoročna kontrola ritma podrazumijeva terapijsku strategiju dugoročnoga održavanja sinusnoga ritma, a treba biti prioritet kod bolesnika mlađe životne dobi, kao i kod bolesnika koji imaju izražene simptome unatoč odgovarajućoj kontroli frekvencije. Dugoročna kontrola ritma može se postići primjenom lijekova (farmakološka kontrola ritma), kateterskom ablacijom ili operativnim liječenjem. Inicijalne opcije za dugoročnu kontrolu ritma kod takvih bolesnika prikazane su shematski (Slika 1.46.).
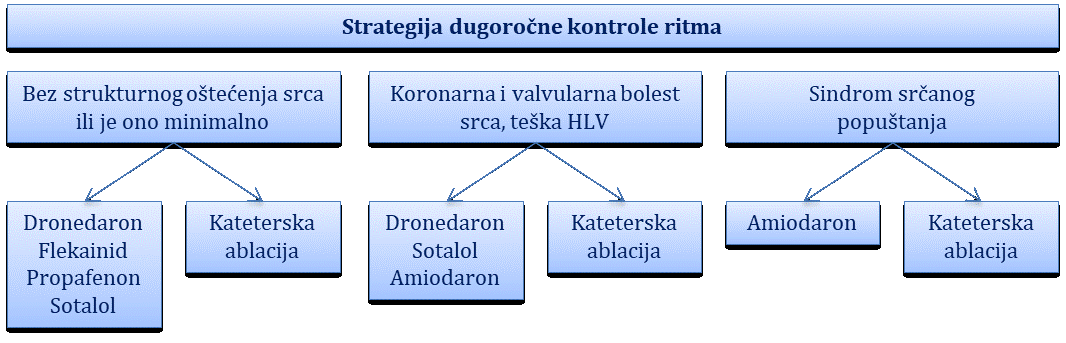
Slika 1.46. Shematski prikaz inicijalne terapijske strategije dugoročne kontrole ritma.
Farmakološka kontrola temelji se na primjeni antiaritmika. Izbor antiaritmika za dugoročnu kontrolu ritma u bolesnika s FA-om temelji se na postojećim komorbiditetima, kardiovaskularnim rizicima, kao i mogućnostima proaritmogenoga učinka te drugih nuspojava. Nakon uvođenja antiaritmika potrebne su češće EKG kontrole kako bi se pratio ritam, frekvencija, ali i moguće produljenje QT-intervala, QRS-kompleksa ili razvoj AV-bloka. Kod bolesnika s produljenim QT-intervalom i znacima bolesti sinusnoga čvora primjena ovih antiaritmika nije preporučena. Kako je prethodno navedeno, izbor lijekova za dugoročnu kontrolu ritma prvenstveno ovisi o postojećim komorbiditetima. Kod bolesnika sa strukturno zdravim srcem mogu se primjenivati dronedaron, flekainid, propafenon ili sotalol, kod bolesnika sa strukturnom bolesti srca u obzir dolaze dronedaron, sotalol i amiodaron, dok se kod bolesnika s razvijenim znacima srčanog popuštanja preporuča primjena amiodarona. Doze i osnovne karakteristike najznačajnijih lijekova prikazane su u Tablici 1.27.
|
Tablica 1.27. Lijekovi za dugoročnu kontrolu ritma.
|
|
Lijek
|
Doza
|
Kontraindikacije i napomene
|
|
Amiodaron
|
3 x 200 mg tbl/prva 4 tj, 2 x 200 mg tbl/druga 4 tj, potom 1 x 200 mg/dan
|
Oprez kod davanja s lijekovima koji produljuju QT-interval.
Oprez kod bolesnika s bolešću jetre i štitne žlijezde.
|
|
Dronedaron
|
2 x 400 mg tbl/dan
|
Ne davati kod srčanog popuštanja u stadiju NYHA III ili IV.
Oprez kod primjene digitalisa i beta blokatora
|
|
Sotalol
|
2 x 80 - 160 mg tbl/dan
|
Ne davati kod teške hipertrofije lijevog ventrikula, astme i srčanoga popuštanja.
|
|
Propafenon
|
3 x 150 - 300 mg tbl/dan
2 x 225 - 425 mg SR tbl/dan
|
Ne davati kod bolesnika sa strukturnom bolesti srca.
Povećava koncentraciju digitalisa i varfarina.
|
Kateterska ablacija podrazumijeva provođenje elektrofiziološkoga ispitivanja kojime se mapiraju ektopična izvorišta FA-a i potom uništavaju primjenom radiofrekventne ili krioablacije. Taj se terapijski postupak pokazao učinkovitijim u dugoročnoj kontroli ritma u odnosu na primjenu lijekova. Kateterska ablacija indicirana je kao druga linija liječenja bolesnika sa simptomatskom FA-om, koji su refraktorni na medikamentnu terapiju. Također, može se uzeti u obzir i kao prva linija liječenja kod odabranih bolesnika koji ne žele dugoročno uzimati antiaritmike ili su oni kontraindicirani i postoji rizik od ozbiljnih nuspojava. Zbog smanjenja rizika od tromboembolijskih incidenata i kod tih se bolesnika provodi antikoagulacijsko liječenje: kod bolesnika kod kojih FA traje dulje od 48 sati ili imaju dokumentirani intramuralni tromb u lijevom atriju indicirana je trotjedna peroralna antikoagulacijska terapija prije samoga zahvata, a nastavlja se i nakon njega u trajanju od najmanje osam tjedana, kod bolesnika s visokim rizikom i dulje. Ponovna pojava FA-a unutar prva tri mjeseca od ablacije ne znači odmah i neuspjeh metode, a liječi se farmakološki ili elektrokardioverzijom. Pojava FA-a nakon tri mjeseca od zahvata označava ablaciju neuspješnom i tek tada se zahvat može ponoviti. Najčešće komplikacije kateterske ablacije su mehaničke prirode (perikardijalni izljev, srčana tamponada, periproceduralni moždani udar, stenoza plućne vene).
Za bolesnike kod kojih prva linija dugoročne kontrole ritma nije uspjela moguće su različite mogućnosti: 1) kod bolesnika s neuspjehom u primjeni dronedarona, flekainida, propafenona ili sotalola u obzir dolazi primjena amiodarona, nekog drugog od navedenih antiaritmika ili kateterska ablacija; 2) kod bolesnika s neuspjehom u primjeni amiodarona u obzir dolazi kateterska ablacija ili kombinacija antiaritmika te 3) kod bolesnika s neuspjehom kateterske ablacije u obzir dolazi kombinirana primjena antiaritmika ili ponovna ablacija.
Terapija kontrole frekvencije predstavlja osnovnu terapijsku mjeru u liječenju FA-a, a osobito kod bolesnika kod kojih se ne može postići sinusni ritam. Preporučena frekvencija ventrikula kod bolesnika s FA-om iznosi 60 do 110/minuti. Lijekovi koji se koriste u kontroli frekvencije prikazani su u Tablici 1.28.
|
Tablica 1.28. Lijekovi u terapiji kontrole frekvencije ventrikula
|
|
Skupina
|
Predstavnik
|
Akutna kontrola
|
Kronična kontrola
|
|
Beta blokatori
|
Bisoprolol
|
2,5 - 5 mg tbl po
|
1,25 - 10 mg tbl po
|
|
Nebivolol
|
2,5 - 5 mg tbl po
|
2,5 - 10 mg tbl po
|
|
Metoprolol
|
2,5 - 10 mg iv (bolus)
|
100 - 200 mg tbl/dan
|
|
Blokatori kalcijskih kanala
|
Diltiazem
|
15 - 25 mg iv (bolus)
|
3 x 60 mg tbl/dan
|
|
Verapamil
|
2,5 - 5 mg iv (bolus)
|
3 x 40 - 120 mg tbl/dan
|
|
Digitalis
|
Digoksin
|
0,5 mg iv (bolus)
maksimalno 1,5 mg/24 sata
|
1 x 0,0625 - 0,25 mg tbl/dan
|
|
Antiaritmik
|
Amiodaron
|
300 mg iv + 250 ml 5 % glukoze kroz 30 - 60 min
|
1 x 200 mg tbl/dan
|
Akutna kontrola frekvencije ventrikula najčešće se postiže primjenom beta blokatora, blokatora kalcijskih kanala ili digitalisom, a izbor lijeka ponajprije ovisi o prisutnosti srčanoga popuštanja i sistoličkoj funkciji lijevoga ventrikula. Kod bolesnika koji nemaju simptome srčanoga popuštanja i/ili imaju istisnu frakciju iznad 40 %, kontrolu frekvencije postižemo blokatorima kalcijskih kanala ili beta blokatorima (njihova istodobna primjena se ne preporuča), dok se kod bolesnika sa simptomima srčanoga popuštanja i/ili istisnom frakcijom ispod 40 % primjenjuju beta blokatori u najmanjoj dozi potrebnoj za postizanje ciljne frekvencije (110/min) ili amiodaron. Kada bolesnici ne reagiraju na opisanu prvu liniju liječenja, kao drugi izbor daje se digitalis (digoksin). Primjenu beta blokatora i blokatora kalcijskih kanala treba izbjegavati kod hemodinamski nestabilnih bolesnika s obzirom na to da oba lijeka mogu dovesti do dodatnoga sniženja vrijednosti krvnog tlaka te negativnoga inotropnog učinka na miokard, zbog čega se kod tih bolesnika preporuča primjena amiodarona.
Dugoročna kontrola frekvencije ventrikula također se u prvoj liniji liječenja temelji na primjeni beta blokatora ili blokatora kalcijskih kanala. Blokatori kalcijskih kanala izbjegavaju se kod bolesnika sa srčanim popuštanjem sa sniženom istisnom frkacijom (HFrEF) zbog izraženoga negativnoga inotropnog učinka. Kod bolesnika kod kojih se ne može postići ciljna kontrola frekvencije ventrikula uz ove lijekove primjenjuje se digitalis. Ablacija AV-čvora i ugradnja trajnoga elektrostimulatora predstavlja zadnju opciju u postizanju dugoročne kontrole frekvencije ventrikula, i to kod bolesnika koji su visoko simptomatski i koji su refraktorni na medikamentnu terapiju.
Antikoagulantno liječenje i prevencija tromboembolijskih incidenata. Kako je već opisano, FA je povezana s povećanim rizikom od nastanaka tromboembolijskih incidenata, osobito moždanoga udara. U tu se svrhu bolesnicima sa svim oblicima FA-a (osim kod bolesnika s izoliranom FA-om koji su mlađi od 65 godina) i kliničkim čimbenicima rizika za tromboembolijski incident preporuča primjena antikoagualntnih lijekova, dok se primjena antitrombocitnih lijekova pokazala inferiornijom, pa se ne preporuča pri ovoj indikaciji. Odluka o uvođenju antikoagulantne terapije temelji se na procjeni rizičnih čimbenika za pojavu tromboembolijskih incidenata, kao i rizika od mogućega krvarenja kao njihove posljedice, što se izračunava prema odgovarajućim bodovnim sustavima tzv. skorovima. Kod ambulantnih se bolesnika provodi peroralna antikoagulacijska terapija, bilo varfarinom, bilo direktnim oralnim antikoagulantnim lijekovima (DOAC). U daljnjem tekstu bit će opisani glavni postulati antikoagulantne terapije kod bolesnika s FA-om.
Procjena rizičnih čimbenika za tromboembolijski incident temelji se na izračunu CHA2DS2-VASc bodovnoga sustava (Tablica 1.29.) koji kvantificira kombinirani utjecaj glavnih rizičnih čimbenika (dob, spol i pridružene bolesti). Prema važećim smjernicama uvođenje antikoagulacijske terapije treba razmotriti kod muškaraca s jednim te kod žena s dva boda te je apsolutno indicirana kod muškaraca s dva ili više bodova te žena s tri ili više bodova.
|
Tablica 1.29. CHA2DS2-VASc bodovni sustav
|
|
Rizični čimbenici
|
Broj bodova
|
Interpretacija
|
|
Dob
|
≤ 64
|
0
|
Uvođenje antikoagulacijske terapije treba razmotriti kod muškaraca s 1 bodom i žena s 2 boda.
Uvođenje antikoagulacijske terapije apsolutno je indicirano kod muškaraca s ≥ 2 boda i žena s ≥ 3 boda.
|
|
65 - 74
|
1
|
|
≥ 75
|
2
|
|
Spol
|
Muški
|
0
|
|
Ženski
|
1
|
|
Pridružene bolesti
|
Kongestivno srčano popuštanje
|
1
|
|
Arterijska hipertenzija
|
1
|
|
Šećerna bolest
|
1
|
|
Moždani udar/TIA/tromboembolija
|
1
|
|
Infarkt miokarda, periferna arterijska bolest
|
1
|
Procjena rizika od krvarenja također je bitna u procjeni opravdanosti uvođenja antikoagulacijske terapije, s obzirom na to da ona nosi značajan rizik od njezine pojavnosti. Rizični čimbenici koji pogoduju nastanku krvarenja mogu se podijeliti u tri skupine: nepromjenjivi, potencijalno promjenjivi i promjenjivi. Nepromjenjivi čimbenici rizika su dob iznad 65 ili 75 godina (ovisno o bodovnom sustavu), prethodno veliko krvarenje, prethodni moždani udar, kronična hemodijaliza, ciroza jetre, malignitet te genetski čimbenici. Potencijalno promjenjivi rizici su anemija, umjereno oštećena funkcija bubrega i jetre te smanjeni broj ili funkcija trombocita. Promjenjivi čimbenici rizika su hipertenzija (> 160 mmHg), teško održiv INR (bolesnik koji se nalazi manje od 60 % vremena u terapijskom rasponu), primjena lijekova koji predisponiraju krvarenje te prekomjerno uzimanje alkohola (više od osam pića tjedno). U Hrvatskoj se za procjenu rizika od krvarenja kod takvih bolesnika najčešće primjenjuje HAS-BLED bodovni sustav koji bolesnike kategorizira u tri skupine: 1) bolesnici s malim rizikom od pojave krvarenja (0 bodova), 2) bolesnici s umjerenim rizikom od pojave krvarenja (1 - 2 boda) te 3) bolesnici s visokim rizikom od pojave krvarenja (≥ 3 boda). Sam sustav bodovanja upućuje na rizik i potrebu za češćim kontrolama, ali ga samoga po sebi ne bi trebalo koristiti za odluku o ukidanju antikoagulacijske terapije. Ovi sustavi omogućavaju bolju identifikaciju te korekciju promjenjivih i potencijalno promjenjivih rizičnih čimbenika.
Izbor peroralne antikoagulacijske terapije. Za antikoagulacijsko liječenje ovih bolesnika danas su na raspolaganju dvije skupine lijekova: antagonisti vitamina K (varfarin) te direktni antikoagulantni lijekovi (DOAC). Oni su jednako učinkoviti u prevenciji tromboembolijskih incidenata, a pri izboru se treba voditi preporučenim načelima te bolesnikovoj sklonosti. Za bolesnike koji imaju mehaničku srčanu valvulu ili imaju umjerenu ili tešku mitralnu stenozu, peroralno antikoagulacijsko liječenje temelji se isključivo na primjeni varfarina, dok se kod ostalih bolesnika može primijeniti varfarin ili novi antikoagulantni lijekovi, što ovisi o preferenciji kliničara i bolesnika. Ipak, današnje preporuke prednost daju primjeni direktnih antikoagulantnih lijekova (DOAC) u odnosu na varfarin kod tih bolesnika (tzv. nevalvularna fibrilacija atrija). Za bolesnike s uznapredovalom bubrežnom bolešću, odnosno terminalnom fazom bolesti, u antikoagulacijskom liječenju prednost ima primjena niskomolekularnoga heparina. U daljnjem tekstu prikazani su najznačajniji antikoagulantni lijekovi.
Varfarin je predstavnik antagonista vitamina K koji djeluju kao inhibitori enzima karboksilaze ovisne o vitaminu K koji sudjeluje u procesu sinteze faktora zgrušavanja vanjskoga puta (II, VII, IX i X) te proteina C i S. Uslijed navedene inhibicije, stvaraju se faktori zgrušavanja koji na svojoj površini nemaju karboksilnu skupinu nužnu za njihovu aktivaciju. Antikoagulacijski učinak varfarina ponajprije ovisi o smanjenju razine funkcionalnih faktora II i X, a s obzirom na to da oni imaju poluvijek života od 24 do 72 sata. Potrebno je nekoliko dana da bi varfarin ostvario svoj terapijski učinak, tj. da bi novonastali faktori bez karboksilne skupine zamijenili postojeće faktore s karboksilnom skupinom. Varfarin dolazi kao mješavina R i S izomera, brzo se apsorbira iz probavnoga sustava i postiže vršne koncentracije u krvi već 90 minuta nakon primjene. Poluvijek života u plazmi iznosi 36 do 42 sata, a većina varfarina (97 %) cirkulira vezana za albumine i samo preostali, slobodni dio lijeka je aktivan. Varfarin se nakuplja u jetri gdje se metabolizira, a na metabolizam lijeka u velikoj mjeri utječe genetska predispozicija - polimorfizmi CYP2C9 i VKORC1, što utječe na raznolikost u antikoagulacijskom učinku lijeka unutar opće populacije. Osim genetskih čimbenika, na antikoagulantni učinak utječu i prehrana, lijekovi te druge bolesti i stanja te je stoga potreban redovan koagulacijski nadzor. U praćenju odgovora na varfarin koristi se određivanje protrombinskog vremena (PV), odnosno INR-a, a kod ovih je bolesnika njegova ciljna vrijednost između 2 i 3, osim kod bolesnika koji imaju mehanički zalistak gdje je preporučeni raspon između 2,5 i 3,5. Zbog uskoga terapijskog prozora i individualnoga odgovora bolesnika, praćenje INR-a mora biti učestalo, a čak je i kod bolesnika sa stabilnim nalazima INR-a potrebna minimalno jedna mjesečna kontrola. Početna doza varfarina iznosi 5 do 10 mg (najčešće dvije tablete od 3 mg kroz dva dana) te se potom doza titrira ovisno o vrijednosti INR-a. Najčešće nuspojave primjene varfarina su krvarenje i kumarinska nekroza kože. U slučaju koagulacijskoga poremećaja uzrokovanog primjenom varfarina koji obilježava produljenje PV-a (odnosno INR-a) primjenjuje se njegov antidot - vitamin K u dozi od 5 do 10 mg intravenski, a njegov učinak vidljiv je već kroz nekoliko sati. Ispravak ovoga otklona mora biti izveden posebno pažljivo kod bolesnika koji imaju mehanički zalistak (INR ne smije pasti ispod 2,5) te se kod njih zajedno s primjenom vitamina K daje i niskomolekularni heparin kako bi se izbjegla eventualna tromboza mehaničke valvule. U težim se oblicima krvarenja primjenjuje i svježe smrznuta plazma.
Direktni oralni antikoagulantni lijekovi (DOAC) svoje antikoagulacijske učinke ostvaruju direktnim djelovanjem ili na trombin (dabigatran) ili na faktor Xa (rivaroxaban, apixaban, edoxaban), i to reverzibilnim vezanjem na njihovo aktivno mjesto čime izazivaju njihovu inaktivaciju. Svi ti lijekovi imaju brz početak djelovanja (za razliku od varfarina kojemu treba nekoliko dana), ali i nešto kraći poluvijek života u plazmi, pa se dio njih mora uzimati dva puta na dan. S obzirom na to da njihova primjena ne zahtijeva praćenje antikoagulacijskoga učinka, ovi lijekovi se više koriste. Glavno ograničenje u njihovoj primjeni prisutno je kod oštećenja bubrežne funkcije koje zahtijeva prilagođavanje doze lijeka, a kod uznapredovaloga bubrežnog oštećenja njihova je upotreba kontraindicirana. Laboratorijsko praćenje učinka ovih lijekova nema veće značenje u kliničkoj praksi. Određivanje aPTV-a može se iskoristiti u procjeni učinka dabigatrana, kao i protrombina kod rivaroksabana, ali ne postoji stroga korelacija kao što je to slučaj izmeđue varfarina i INR-a. Za točnije praćenje učinka rivaroskamaba i apiksabana može se određivati aktivnost i koncentracija faktora Xa, što nije dostupno u široj kliničkoj praksi. U liječenju krvarenja kod bolesnika koji su na direktnim antikoagulantnim lijekovima, osim standardnih mjera liječenja krvarenja (mehaničko liječenje, primjena krvnih pripravaka), primjenjuju se i neke specifične metode. Ako je od unosa zadnje doze lijeka prošlo manje od četiri sata, preporuča se primjena aktivnoga ugljena s ciljem smanjenja apsorpcije. Kod bolesnika s životno ugrožavajućim krvarenjem, koji su na terapiji inhibitorima faktora Xa, indicirana je primjena humanoga protrombinskog kompleksa, dok je kod bolesnika koji su na terapiji dabigatranom opravdana primjena idracizumaba, monoklonalnoga protutijela koje predstavlja antidot dabigatranu. S obzirom na relativno kratak poluvijek života (10 do 12 sati), primjena krvnih derivata uz mehaničke metode hemostaze često je dovoljna da se prebrodi kritični period. Osnovne karakteristike i doziranje ovih lijekova prikazane su u Tablici 1.30.
|
Tablica 1.30. Doziranje i kliničke karakteristike direktnih antikoagulantnih lijekova
|
|
Lijek
|
Dabigatran
|
Rivaroksaban
|
Apiksaban
|
Edoksaban
|
|
Mehanizam
|
Inhibitor antitrombina
|
Inhibitor faktora Xa
|
Inhibitor faktora Xa
|
Inhibitor faktora Xa
|
|
Poluvijek života
|
12 - 17 sati
|
7 - 11 sati
|
12 sati
|
9 - 11 sati
|
|
Doziranje
|
2 x 150 mg tbl (< 79 g)
2 x 110 mg tbl (≥ 80 g)
|
1 x 20 mg tbl (lijek uzeti uz jelo)
|
2 x 5 mg tbl
|
1 x 60 mg tbl
|
|
Prilagodba doze
|
2 x 75 mg tbl (klirens kreatina 30 - 50 mL/min)
|
1 x 15 mg tbl (klirens kreatinina < 50 mL/min)
|
2 x 2,5 mg tbl (dob > 80 god, TT < 60 kg, kreatinin < 130 µmol/L)
|
1 x 30 mg tbl (klirens kreatinina < 50 mL/min)
|
|
Rizik od krvarenja
|
↓ intrakranijsko
↑ gastrointestinalno
|
↓ intrakranijsko
↑ gastrointestinalno
|
↓ intrakranijsko
↓ gastrointestinalno
|
↓ intrakranijsko
↓ gastrointestinalno
|
Krvarenje kod bolesnika na antikoagulacijskoj terapiji. Kako bi se spriječilo krvarenje vezano uz kirurške zahvate i intervencije, preporuča se prekid uzimanja varfarina tri do pet dana prije zahvata, a direktnih antikoagulantnih lijekova za dva poluvijeka života ako se radi o manjim zahvatima, ili pet poluvremena života ako se radi o većim zahvatima. Također, kao mjera prevencije krvarenja kod ovih bolesnika, navodi se i izbjegavanje istovremene primjene antitrombocitnih lijekova, osim ako to nije posebno indicirano (vidi kasnije). Zbrinjavanje krvarenja koje nastaje kod bolesnika na antikoagulantnim lijekovima detaljno je opisano prethodno u tekstu, a sumarno su prikazani i u shemi u nastavku (Slika 1.47.).
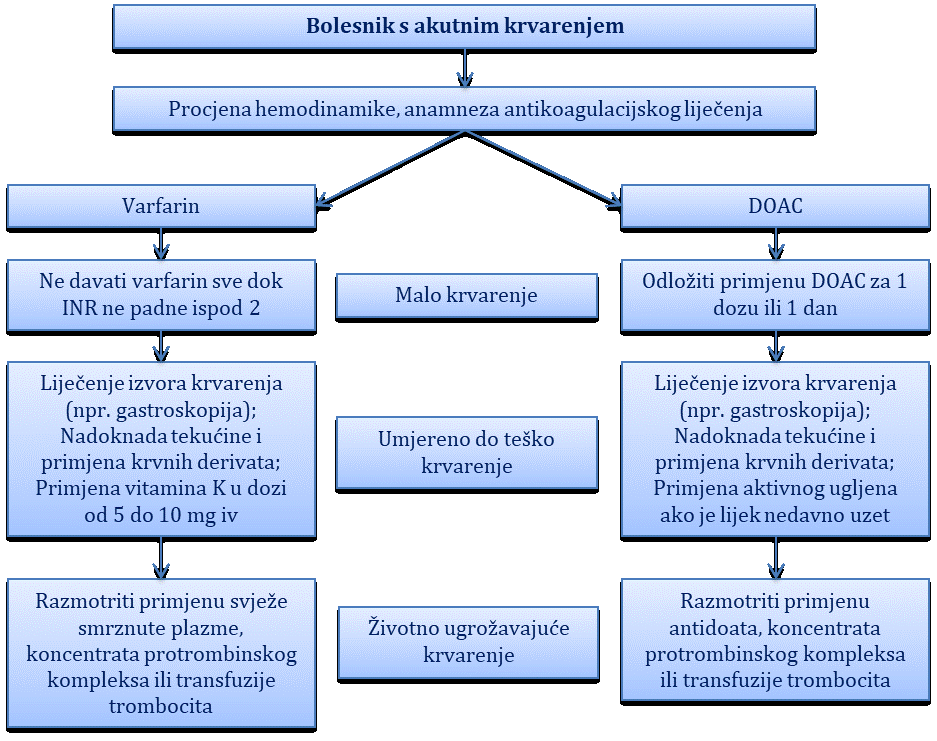
Slika 1.47. Shematski postupnik s bolesnikom na antikoagulacijskoj terapiji s akutnim krvarenjem.
(DOAC-direktni antikoagulantni lijekovi)
Istodobna primjena antikoagulantnih i antitrombocitnih lijekova povećava apsolutni rizik od velikoga krvarenja. Kada se radi o bolesnicima koji imaju stabilnu koronarnu bolest i fibrilaciju atrija, opravdana je primjena samo peroralnih antikoagulantnih lijekova. Kombinacija antitrombocitnih i antikoagulantnih lijekova opravdana je samo kod bolesnika nakon akutnoga koronarnog sindroma i nakon elektivne PCI s ugrađenim stentom, prema dolje navedenoj shemi. Pri ovoj kombiniranoj terapiji od antitrombocitnih lijekova primjenjuju se samo acetilsalicilna kiselina (aspirin) i klopidogrel.
Pri kombiniranoj terapiji antikoagulantnim i antitrombocitnim lijekovima kod bolesnika nakon akutnoga koronarnog sindroma koristimo se sljedećom shemom: 1) kod bolesnika koji imaju nizak rizik od krvarenja (u usporedbi s rizikom od akutnoga koronarnog sindroma ili in stent tromboze) trojna terapija (oralni antikoagulans, acetilsalicilna kiselina, klopidogrel) primjenjuje se tijekom prvih šest mjeseci, potom dvojna terapija (oralni antikoagulans uz acetilsalicilnu kiselinu ili klopidogrel) tijekom sljedećih šest mjeseci, a nakon toga monoterapija oralnim antikoagulansom doživotno; 2) kod bolesnika koji imaju visok rizik od krvarenja (u usporedbi s rizikom od akutnoga koronarnog sindroma ili in stent tromboze) trojna terapija (oralni antikoagulans, acetlilsalicilna kiselina, klopidogrel) primjenjuje se samo tijekom prvog mjeseca, potom dvojna terapija (oralni antikoagulans uz acetilsalicilnu kiselinu ili klopidogrel) do kraja prve godine, a nakon toga monoterapija oralnim antikoagulansom doživotno.
Pri kombiniranoj terapiji antikoagulantnim i antitrombocitnim lijekovima kod bolesnika nakon elektivne perkutane koronarne intervencije s implantacijom stenta koristimo se sljedećom shemom: 1) kod bolesnika s niskim rizikom krvarenja (u usporedbi s rizikom od akutnoga koronarnog sindroma ili in stent tromboze) trojna terapija (oralni antikoagulans, acetilsalicilna kiselina, klopidogrel) primjenjuje se tijekom prvog mjeseca, potom dvojna dvojna terapija (oralni antikoagulans uz acetilsalicilnu kiselinu ili klopidogrel) do kraja prve godine, a nakon toga monoterapija oralnim antikoagulansom doživotno; 1) kod bolesnika s visokim rizikom krvarenja (u usporedbi s rizikom od akutnoga koronarnog sindroma ili in stent tromboze) trojna terapija (oralni antikoagulans, acetilsalicilna kiselina, klopidogrel) primjenjuje se tijekom prvoga mjeseca, potom dvojna terapija (oralni antikoagulans uz acetilsalicilnu kiselinu ili klopidogrel) do navršenih šest mjeseci, a potom monoterapija oralnim antikoagulansom doživotno.
Antikoagulacijsko liječenje kod bolesnika nakon cerebrovaskularnoga inzulta. Početak ili nastavak liječenja oralnim antikoagulansima kod bolesnika nakon ishemijskoga moždanog udara koji imaju fibrilaciju atrija ovisi ponajprije o težini moždanoga udara prema NIHSS bodovnom sustavu. Vrijeme uključivanja oralnih antikoagulansa kod tih se bolesnika provodi prema sljedećoj shemi: 1) kod tranzitorne ishemijske atake drugi dan od akutnoga događaja; 2) kod blagoga moždanog udara (NIHSS < 8) treći dan od akutnoga događaja; 3) kod srednje teškoga moždanog udara (NIHSS 8 - 15) šesti dan od akutnoga događaja (uz prethodnu procjenu sekundarne hemoragizacije na temelju CT-a ili MR-a) te 4) kod teškoga moždanog udara (NIHSS ≥ 16) dvanaesti dan od akutnoga događaja (uz prethodnu procjenu sekundarne hemoragizacije na temelju CT-a ili MR-a). Ako se radi o razvoju hemoragijskoga cerebrovaskularnog inzulta kod bolesnika koji su na oralnoj antikoagulacijskoj terapiji, potrebno je razmotriti čimbenike koji podržavaju i ne podržavaju daljnje antikoagulacijsko liječenje (Tablica 1.31.). Kada se odluči nastaviti s primjenom oralnih antikoagulantnih lijekova, ono se nastavlja četiri do osam tjedana od akutnog događaja, a prednost se daje lijekovima sa smanjenim rizikom od intrakranijskoga krvarenja.
|
Tablica 1.31. Čimbenici pri odlučivanju o nastavku antikoagulacije nakon intrakranijskoga krvarenja
|
|
Čimbenici koji ne podržavaju uporabu antikoagulanasa
|
Čimbenici koji podržavaju uporabu antikoagulanasa
|
|
Krvarenje koje se dogodilo uz odgovarajuću dozu DOAC-a ili kada je liječenje prekinuto ili je smanjena doza;
Starija životna dob;
Loše regulirana hipertenzija;
Krvarenje u korteksu;
Teško intrakranijsko krvarenje;
Kronična zlouporaba alkohola;
Potrebna dvojna terapija nakon perkutane intervencije.
|
Krvarenje koje se dogodilo tijekom liječenja varfarinom ili u slučaju predoziranja;
Traumatski uzrok krvarenja;
Mlađa životna dob;
Dobro regulirana hipertenzija;
Krvarenje u području bazalnih ganglija;
Subarahnoidalno krvarenje;
Visok rizik od nastanka ishemijskog moždanog udara.
|
Osim opisanoga antikoagulacijskog liječenja, u tromboprofilaksi bolesnika s fibrilacijom atrija u obzir dolazi i kirurška metoda liječenja – zatvaranje i ekscizija aurikule lijevoga atrija. Nju se može razmatrati kod bolesnika s potrebom za dugoročnom antikoagulacijskom terapijom koji imaju kontraindikacije.
Liječenje čimbenika rizika i pratećih kardiovaskularnih oboljenja posljednja je terapijska odrednica u liječenju bolesnika s fibrilacijom atrija, a podrazumijeva provođenje klasičnih mjera liječenja i prevencije kardiovaskularnih rizika i oboljenja kako je to opisano u odgovarajućim dijelovima (srčano popuštanje, arterijska hipertenzija, valvularna srčana bolest, šećerna bolest, pretilost, kronične plućne bolesti, kronična bolest bubrega).
UNDULACIJA ATRIJA
Definicija i etiologija. Undulacija atrija (UA) predstavlja tahiaritmiju atrija koju karakterizira specifično kruženje depolarizacijskoga vala u velikom krugu po desnom atriju, pri čemu on dovodi do tzv. lepršanja uz izostanak odgovarajuće kontrakcije stvarajući praktično iste hemodinamske posljedice kao i fibrilacija atrija. Iako se može javiti na strukturno zdravom srcu, UA je obično povezana s različitim strukturnim bolestima srca ili kroničnim plućnim oboljenjima, slično kao i fibrilacija atrija.
Klinička slika i dijagnoza. Undulacija atrija prema trajanju može biti paroksizmalna ili perzistentna. Češće se javlja kod muškaraca. Perzistentna UA obično prelazi u fibrilaciju atrija. Sustavne tromboembolije su rjeđe u odnosu na fibrilaciju atrija. Undulaciju atrija karakterizira frekvencija atrija između 250 i 350 u minuti uz atrioventrikularni blok provođenja 2:1 ili 3:1, zbog čega frekvencija ventrikula obično iznosi 100 do 150 u minuti. Dijagnoza se postavlja na osnovi karakterističnog EKG nalaza na kojemu se prepoznaju valovi undulacije (f-valovi) nalik pravilnim zupcima pile, obično najbolje vidljivi u inferiornim odvodima (Slika 1.48.). Nakon postavljanja dijagnoze UA potrebno je provesti daljnju dijagnostičku obradu jednaku onoj kakva se provodi i kod fibrilacije atrija.
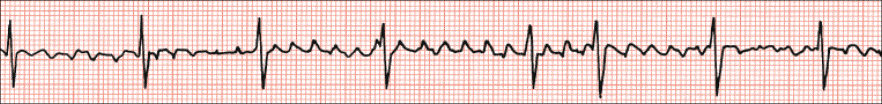
Slika 1.48. EKG nalaz – undulacija atrija
Liječenje UA provodi se na isti način kao i liječenje fibrilacije atrija, uz napomenu da je farmakološko liječenje manje uspješno u kontroli frekvencije u odnosu na fibrilaciju atrija. Kod pojave recidivirajućih epizoda UA preporuča se elektrofiziološko ispitivanje i linijska ablacija na razini kavotrikuspidalnoga istmusa, najpogodnijega i najužeg mjesta za prekidanje kružnoga mehanizma odgovornog za održavanje UA.
VENTRIKULARNA TAHIKARDIJA, FIBRILACIJA I IZNENADNA SRČANA SMRT
Ventrikularna tahikardija (VT) i ventrikularna fibrilacija (VF) ubrajaju se u skupinu najozbiljnijih poremećaja srčanoga ritma, s obzirom na to da se radi o aritmijama povezanim s nastankom iznenadne srčane smrti.
VENTRIKULARNA TAHIKARDIJA
Definicija. Ventrikularna tahikardija (VT) označava tahiaritmiju čije je izvorište u ventrikularnom miokardu ili infrahisnim dijelovima provodnoga sustava srca (Purkinjeove niti), a prezentira se s tri ili više uzastopnih ventrikularnih ekstrasistola pri čemu je ukupni broj otkucaja jednak ili veći od 100 u minuti. Pojavnost VT-a povezana je s rizikom prijelaza u fibrilaciju ventrikula i nastupom iznenadne srčane smrti.
Etiopatogeneza. Pojavnost VT-a uglavnom je povezana s različitim strukturnim bolestima srca, a rijetko se javlja na strukturno nepromijenjenom miokardu. Može nastati kao posljedica povećanoga automatizma, kruženja ili potaknute (trigerirane) aktivnosti ventrikularnoga miokarda. Kod jednoga dijela bolesnika pojava VT-a ne može se povezati niti s jednim poznatim uzorkom ili mehanizmom, pa govorimo o idiopatskoj VT. Najčešći uzroci VT-a prikazani su u Tablici 1.32.
|
Tablica 1.32. Etiologija ventrikularne tahikardije
|
|
VT sa strukturnom bolesti srca
|
VT uz odsutnost strukturne bolesti srca
|
|
Koronarna bolest srca
Kardiomiopatije
Upalne bolesti srca
Srčano popuštanje
Bolesti nakupljanja (infiltrativne bolesti)
|
Stečene kanalopatije (farmakološki uzrokovane)
Nasljedne kanalopatije (LQTS, Brugada sindrom)
Aritmogena displazija desnoga ventrikula
Elektrolitni i metabolički poremećaji
Intoksikacija digitalisom
|
Oblici ventrikularne tahikardije. S obzirom na trajanje, VT dijelimo na nepostojanu, kratkotrajnu (engl. non sustained VT) koja traje manje od 30 sekundi te postojanu, dugotrajnu (engl. sustained VT) koja traje dulje od 30 sekundi. Prema izgledu QRS-kompleksa razlikujemo monomorfnu VT koju čine jednaki QRS-kompleksi (jedno izvorište aritmije) te polimorfnu VT koju čine različiti oblici QRS-kompleksa (više izvorišta aritmija). Prema hemodinamskom učinku razlikujemo VT s ili bez hemodinamskog urušaja. Posebni oblici VT-a su torsades de pointes te ubrzan idioventrikularni ritam. Torsades de pointes predstavljaju oblik VT-a karakteriziran polimorfnim QRS-kompleksima koji mijenjaju amplitudu i širinu, vretenastoga su oblika i kao da osciliraju oko izoelektrične linije, i povezuje se sa sindromom produljenoga QT-intervala. Ubrzan idioventrikularni ritam naziva se još i polaganom ili sporom VT s frekvencijom u rasponu od 60 do 120/min, i obično se susreće tijekom akutnoga infarkta miokarda i to nakon reperfuzije, a vidi se i nakon operacija na srcu, kod reumatskoga endokarditisa i intoksikacije digitalisom.
Klinička slika VT-a ovisi o samom trajanju aritmije, frekvenciji ventrikula te o postojanju i težini osnovne bolesti. Nepostojane i kratke VT mogu proći bez simptoma ili se mogu prezentirati kratkim, nespecifičnim simptomima kao što su omaglice i osjećaj nelagode u prsima. Postojane VT najčešće se očituju palpitacijama te presinkopom ili sinkopom (posljedica cerebralne hipoperfuzije). Kod bolesnika s izraženim strukturnim srčanim poremećajima VT može dovesti do razvoja srčanoga popuštanja i plućnoga edema, a kod koronarnih bolesnika može biti uzrok anginoznih smetnji i/ili dispnoičnih tegoba. Pri napadu VT-a bolesnici su zaplašeni i uznemireni. Kod hemodinamskih značajnih VT-a razvijaju se znakovi šoka, kao što su poremećaj svijesti, hipotenzija i oligurija.
Dijagnoza. Kod bolesnika sa sumnjom na VT nužna je dijagnostička obrada koja obuhvaća neinvazivne i invazivne dijagnostičke pretrage. Osnovne dijagnostičke pretrage kod takvih bolesnika čine EKG, test opterećenja, Holter EKG te ehokardiografija, a dodatno se prema potrebi izvode i druge slikovne dijagnostičke metode, koronarnografija te elektrofiziološko ispitivanje.
EKG predstavlja ishodišnu dijagnostičku metodu. Ventrikularna tahikardija se očituje brzim slijedom širokih i bizarnih QRS-kompleksa (iste ili različite morfologije), obično s frekvencijom 100 - 250/min (Slika 1.49, 1.50 i 1.51.). Kod bolesnika koji u trenutku snimanja EKG-a nemaju VT mogu se naći patološki znakovi koji je predisponiraju (učestale VES, sindrom dugoga QT-intervala, Brugada sindrom,) ili strukturne bolesti srca (hipertrofija lijevoga ventrikula, blokovi atrioventrikularnoga provođenja, znakovi ishemije).
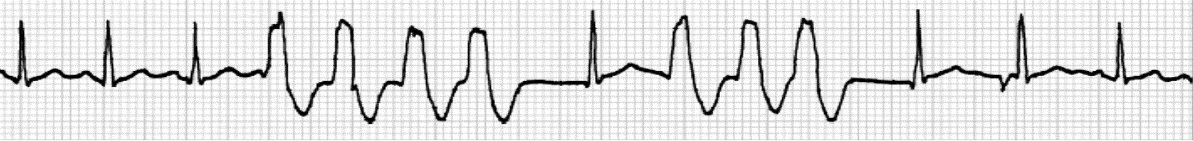
Slika 1.49. EKG nalaz – kratkotrajna, nepostojana VT
Slika 1.50. EKG nalaz – monomorfna VT
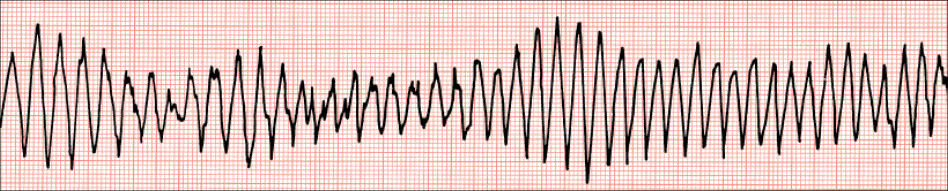
Slika 1.51. EKG nalaz - torsades de pointes
Holter-EKG indiciran je kod svih bolesnika sa sumnjom na VT kod kojih ona nije zabilježena na EKG-u. Snimanje se kod nekih bolesnika može produljiti na 48 sati i dulje, a na raspolaganju je i ugradnja implantibilnoga loop recordera koji omogućava dugotrajno snimanje EKG-a (do godine dana). U interpretaciji nalaza najčešće probleme stvaraju artefakti koji mogu nastati prilikom bolesnikova kretanja.
Ergometrija može otkriti VT povezane s opterećenjem i ishemijom miokarda. Ergometrijom se otkriva do 4 % nepostojanih VT-a kod odraslih osoba srednje životne dobi.
Ehokardiografija i druge slikovne metode. Ehokardiografija je potrebna kod svih bolesnika s registriranom VT, kao i kod onih kod kojih se sumnja na njezino postojanje. Njome se procjenjuju sistolička i dijastolička srčana funkcija, kao i moguće strukturne srčane promjene povezane s nastankom ove aritmije. U tu se svrhu mogu koristiti i druge slikovne dijagnostičke metode, kao što je magnetna rezonanca srca (osobito kod sumnje na miokarditis i kardiomiopatije). Mogućnost karakterizacije miokardnoga, masnoga i fibroznog tkiva na temelju ove pretrage pokazala se dobrim prediktorom mogućega nastanka VT-a i nagle srčane smrti. Nuklearno-medicinske dijagnostičke metode kao što su SPECT i PET-CT imaju značajnu ulogu u procjeni perfuzije miokarda, kao i značajki simpatičke inervacije miokarda, što može biti povezano s nastankom VT-a.
Invazivna dijagnostička obrada. Koronarografija je metoda kojom potvrđujemo ili isključujemo koronarnu bolest, kao najčešći uzrok ventrikularnih poremećaja srčanoga ritma, na koju nam ukazuju već i neinvazivne dijagnostičke metode (EKG znaci ishemije, ehokardiografski dokazani ispadi kontraktilnosti). Elektrofiziološko ispitivanje indicirano je kod bolesnika kod kojih prethodno navedenim pretragama nije dobiveno dovoljno podataka o etiologiji ventrikularnoga poremećaja ritma. Tom se metodom dokazuje postojanje aritmije, otkriva njezin mehanizam i lokalizacija te procjenjuje njezin hemodinamski učinak. Istovremeno se može obaviti ablaciju izvorišta i definitivno riješiti problem.
Diferencijalna dijagnoza. Razlikovanje VT-a od supraventikularne tahikardije s aberantnim provođenjem predstavlja problem u kliničkoj praksi s obzirom na to da se i jedna i druga manifestiraju pravilnom tahikardijom širokih QRS-kompleksa. Određeni EKG znakovi mogu ukazivati na ventrikularno ili supraventrikularno izvorište aritmije (vidi dalje).
EKG znakovi koji ukazuju na ventrikularni izvor tahikardije su: 1) AV disocijacija; 2) trajanje QRS-a dulje od 140 ms; 3) prisutnost capture ili fusion kontrakcija; 4) morfologija lijeve električne osi i bloka grane; 5) prisutnost monofaznih (R) ili bifaznih (qR, QR, RS) kompleksa u V1 te 6) prisutnost qR ili QS kompleksa u V6.
EKG znakovi koji ukazuju na supraventrikularni izvor tahikardije su: 1) prisutnost trifazičnoga QRS-kompleksa, osobito u I i V6 odvodu; 2) ventrikularna frekvencija veća od 170/minuti; 3) trajanje QRS-kompleksa između 120 i 140 ms te 4) prisutnost znakova preekscitacije.
Ako se ne može točno procijeniti o kojoj se aritmiji radi, daljnje se terapijsko postupanje provodi kao da se radi o ventrikularnom poremećaju srčanoga ritma.
Inicijalno liječenje. Osnovni terapijski pristup bolesniku s VT-om ovisi o prisutnosti tzv. nepovoljnih znakova, tj. znakova šoka (poremećaj stanja svijesti, hipotenzija), akutnoga srčanog popuštanja ili ishemije miokarda.
Ventrikularna tahikardija uz prisutne nepovoljne znakove nalaže hitnu elektrokardioverziju koja podrazumijeva isporuku sinkroniziranoga električnog šoka (istosmjerna struja) u jakosti od 100 do 360 J. Ako su bolesnici pri svijesti, zahvat se mora izvesti uz prethodnu analgosedaciju. Ako se VT ponovno vrati nakon inicijalne konverzije ili i dalje perzistira, indicirana je i intravenska primjena amiodarona, najprije kao intravenski bolus od 150 mg nakon čega slijedi kontinuirana infuzija od 1 mg/min tijekom šest sati, a potom 0,5 mg/min tijekom 18 sati uz daljnje pokušaje elektrokardioverzije. Intravenska primjena amiodarona može dovesti do razvoja značajne hipotenzije.
Ventrikularna tahikardija bez prisutnih nepovoljnih znakova inicijalno se liječi farmakološkom konverzijom, a pri tome se najčešće koriste amiodaron i lidokain. Elektrokardioverzija se kod ovih bolesnika indicira ako se ne postigne farmakološki učinak ili nastupi pogoršanje kliničke slike. Amiodaron se početno primjenjuje kao brza intravenska infuzija u dozi od 300 mg kroz dvadeset minuta nakon čega se prema potrebi nastavlja s kontinuiranom, sporom infuzijom tijekom 24 sata (maksimalna doza amiodarona kroz 24 sata iznosi 1200 mg). Lidokain se primjenjuje kao intravenski bolus od 100 mg kroz dvije minute, a potom se nastavlja infuzijom u dozi od 4 mg/min. Empirijska intravenska primjena magnezija u dozi od 1 do 2 mg opravdana je u slučajevima polimorfne VT. Magnezij je i antiaritmik izbora u liječenju torsades de pointes. Liječenje ubrzanoga idioventrikularnog ritma provodi se primjenom atropina s ciljem ubrzanja sinusne frekvencije kako bi se pretekla frekvencija ventrikula.
Istovremeno s navedenim mjerama liječenja potrebno je liječiti i potencijalne rizične čimbenike koji pogoduju nastanku VT-a (akutna ishemija, elektrolitni poremećaj, proaritmogeni učinak lijekova).
Dugoročno liječenje. Bolesnici s epizodom VT-a uz odsutnost potencijalno reverzibilnih precipitirajućih čimbenika imaju visok rizik od ponovnoga recidiva te se kod njih preporuča dugoročno liječenje koje može uključivati primjenu lijekova ili neku od invazivnih metoda (ugradnja ICD, kateterska ablacija).
Medikamentno liječenje. Beta blokatori su među najčešće korištenim lijekovima u prevenciji ventrikularnih poremećaja srčanoga ritma, osobito kod bolesnika sa strukturnom bolesti srca. Kod intolerancije ili nepodnošljivosti beta blokatora mogu se primjenjivati i blokatori kalcijskih kanala.
Implantibilni kardioverter-defibrilator (ICD). Kod svih bolesnika koji su imali epizodu hemodinamski nestabilne VT, u odsutnosti reverzibilnih uzroka ili u periodu od 48 sati nakon akutnoga infarkta miokarda uz očekivano preživljenje duže od godine dana preporuča se ugradnja ICD-a (preporuka IA prema ESC smjernicama). Ugradnja ICD-a predstavlja metodu izbora u suzbijanju VT-a kod nasljednih kanalopatija.
Kateterska ablacija indicirana je kod bolesnika koji su rezistentni na medikamentnu terapiju, a imaju kontraindikaciju ili ne žele ugradnju ICD-a. Posebno je korisna kod bolesnika kod kojih je VT uzrokovana ožiljkom ili dilatacijskom kardiomiopatijom nakon infarkta miokarda (kod tih bolesnika VT je najčešće uzrokovana kružnim mehanizmom). Kirurška ablacija preostaje kao mogućnost nakon neuspjele kateterske ablacije, posebno ako se radi o bolesnicima s aneurizmom lijevoga ventrikula nakon infarkta miokarda.
Prognoza takvih bolesnika ponajprije ovisi o osnovnoj bolesti. Generalno gledano, kod bolesnika sa strukturno zdravim srcem prognoza je povoljna, a pojava sinkope i iznenadne srčane smrti rijetka.
FIBRILACIJA VENTRIKULA
Definicija i etiologija. Fibrilacija ventrikula (FV) predstavlja kaotičnu aktivaciju ventrikula koja nastaje uslijed izbijanja ektopičnih impulsa difuzno unutar ventrikularnoga miokarda što dovodi do „treperenja“ ventrikula i izostanka učinkovitih kontrakcija posljedično čemu se razvija hemodinamski arest koji vodi u kliničku smrt. Fibrilacija ventrikula dijeli istu etiopatogenezu kao i VT, a često se i događa da početno nastala VT u prelazi u FV. Fibrilacija ventrikula predstavlja najčešći uzrok iznenadne srčane smrti.
Klinička slika i dijagnoza. Nakon 8 do 10 sekundi od pojave FV-a (a time i hemodinamskoga aresta) bolesnici gube svijest i u stanju su kliničke smrti, koja je još reverzibilna. Za 3 do 5 minuta uslijed ireverzibilnih ishemičkih oštećenja mozga nastupa moždana smrt. Nakon gubitka svijesti moguća je i pojava generaliziranih klonično-toničnih grčeva nalik velikom epileptičkom napadaju, koji nastaju zbog moždane hipoperfuzije. Dijagnoza se postavlja na osnovi kliničke slike i EKG nalaza na kojemu umjesto normalnih QRS-kompleksa vidimo mnoge nepravilne i nejednake sinusoidne valove (Slika 1.52.).

Slika 1.52. EKG nalaz – fibrilacija ventrikula
Liječenje. Fibrilacija ventrikula predstavlja arestni ritam koji zahtijeva provođenje mjera kardiopulmonalne reanimacije što je detaljno opisano u poglavlju o intenzivnoj medicini. Prekid FV-a i uspostava normalnoga ritma spojivoga sa životom provodi se primjenom elektrošoka (defibrilacije). Rana defibrilacija osnovni je preduvjet uspješnoga oporavka i preživljenja ovih bolesnika. Sa svakom minutom koja se izgubi do trenutka isporuke elektrošoka (defibrilacije) smanjuje se vjerojatnost preživljenja za 7 do 10 %. Svi bolesnici koji prežive VF, u odsutnosti reverzibilnih uzroka ili kada je ona nastupila u vremenskom periodu nakon 48 sati od akutnog infarkta miokarda, kod kojih se očekuje preživljenje duže od godine dana, indicirana je ugradnja kardioverter-defibrilatora (ICD) s ciljem sekundarne prevencije iznenadne srčane smrti zbog očekivanoga recidiva malignoga ventrikularnog poremećaja ritma.
IZNENADNA SRČANA SMRT
Definicija. Iznenadna srčana smrt definira se kao netraumatski i neočekivan fatalni događaj koji se događa unutar jednoga sata od početka simptoma, za koju se pretpostavlja ili dokaže da je kardijalne etiologije s obzirom na ranije poznatu srčanu bolest, srčanu bolest koja je dokazana autopsijom te neotkriveni ekstrakardijalni uzrok smrti (tzv. aritmogena smrt). Ako nitko nije svjedočio smrti, iznenadna smrt se definira kao smrt koja je nastupila kod osobe za koju se zna da je bila u dobrom zdravstvenom stanju u protekla 24 sata.
Etiologija. U više od 70 % slučajeva uzrok iznenadne srčane smrti je koronarna bolest srca, a kod oko 20 % bolesnika s koronarnom bolesti iznenadna srčana smrt predstavlja njihovu prvu manifestaciju. U oko 20 % slučajeva uzrok iznenadne srčane smrti čine ostale strukturne bolesti srca (idiopatska kardiomiopatija, hipertrofijska kardiomiopatija, bolesti srčanih zalistaka, kongenitalne srčane anomalije, aritmogena displazija desnog ventrikula, miokarditis), dok ostalih 10 % čine promjene na strukturno zdravom srcu (sindrom produljenoga QT-intervala, Brugada sindrom, katekolaminergična polimorfna VT) ili ona ostaje nepoznatoga i nerazjašnjenog uzroka. Srčane bolesti koje su povezane s iznenadnom srčanom smrti razlikuju se kod mlađih i starijih bolesnika. U mlađoj se populaciji najčešće radi o kanalopatijama (sindrom produljenoga QT-intervala), miokarditisima i kardiomiopatijama, dok se kod starijih bolesnika uglavnom radi o kroničnim degenrativnim bolestima srca.
Klinička slika i pristup. Kod više od 80 % bolesnika iznenadna srčana smrt se manifestira FV-om ili VT-om bez pulsa, dok se kod ostalih 20 % prezentira asistolijom ili električnom aktivnosti srca bez pulsa. Kod većine bolesnika iznenadna srčana smrt nastaje bez prodromalnih simptoma ili se javi vrlo brzo nakon njih (iznenadna slabost, bol i stezanje u prsima, otežano disanje). Nastup iznenadne srčane smrti nalaže promptno pružanje osnovnih ili uznapredovalih mjera održavanja života.
Prevencija iznenadne srčane smrti predstavlja skup mjera kojima je cilj smanjiti rizik od nastanka iznenadne srčane smrti kod bolesnika koji posjeduju rizik za nju, ali je nisu doživjeli (primarna prevencija) ili smanjiti rizik od njezine ponovne pojave kod bolesnika koji su je već imali (sekundarna prevencija). Pojedine mjere kojima se ostvaruje ova prevencija navedene su u odgovarajućim dijelovima (koronarna bolest, srčano popuštanje i dr.).
SINDROM IZNENADNE SRČANE SMRT KOD SPORTAŠA
Definicija i epidemiologija. Iznenadna srčana smrt definira se kao nastup nagle i neočekivane smrti uzrokovane gubitkom srčane funkcije koja se događa unutar jednoga sata od početka simptoma kod naizgled zdravih pojedinaca. Ta je pojava posebno česta kod osoba koje se aktivno i profesionalno bave sportskim aktivnostima, a njezina incidencija, odnosno učestalost kod mladih sportaša (osoba koje se aktivno bave sportskom aktivnošću u dobi do 35. godine života), kreće se između 0,5 do 2 slučaja na 100 000 sportaša u vremenskom periodu od godine dana. Također, učestalost se povećava s dobi, a s obzirom na spol znatno je češća kod muškaraca u odnosu na žene.
Etiologija. Uzroci iznenadne smrti u sportaša ponajprije ovise o njihovoj dobi, tako da je kod sportaša starijih od 35 godina najčešći uzrok koronarna bolest, tj. ateroskleroza koronarnih arterija s pratećim malignim poremećajima srčanoga ritma, dok se kod mlađih sportaša nalazi širi spektar bolesti i stanja koje se mogu povezati s iznenadnom srčanom smrti. Najčešće se radi o nasljednim kardiomiopatijama kakve su hipertrofijska i dilatacijska kardiomiopatija, aritmogena displazija desnoga ventrikula te kanalopatije, kao što su sindrom produljenoga i kratkog QT-intervala, Brugada sindrom te katekolaminergična polimorfna ventrikularna tahikardija. Kod jednoga dijela bolesnika iznenadna srčana smrt može biti uzrokovana i potresom srca (lat. Commotio cordis) koji predstavlja funkcionalni poremećaj provodnoga sustava srca koji rezultira nastankom malignoga poremećaja ritma na podlozi potpuno strukturno i funkcionalno urednoga srca, najčešće uzrokovanoga fatalnim udarcem (lopta, sudar) u prsni koš u vrijeme vulnerabilne faze rane repolarizacije ventrikula koja odgovara prvoj polovici T-vala u EKG-u.
Klinička slika. Većina bolesnika nema nikakvih simptoma i kod većine je njih iznenadna srčana smrt prva i jedina manifestacija postojeće funkcionalne ili strukturne bolesti srca. Detaljnom se anamnezom kod jednoga dijela bolesnika mogu dobiti podaci o prisutnosti povremenih sinkopa, opresija u prsima, palpitacija, nedostataka zraka ili pretjeranoga umora. Ako su i prisutni, ti su simptomi obično blagi i ne pridaje im se na važnosti.
Dijagnoza i rano prepoznavanje ugroženih sportaša predstavlja osnovnu mjeru u kliničkom pristupu ovom problemu. Ono je koncipirano kroz redovne liječničke preglede kojima se podvrgavaju sportaši, a koji u najmanju ruku podrazumijevaju uzimanje detaljne obiteljske i osobne anamneze, fizikalni pregled te EKG, ergometriju. Ako se navedenim metodama ne otkriju rizični čimbenici, sportaše se proglašava zdravstveno sposobnim, dok nalaz određenoga rizičnog čimbenika zahtijeva daljnju evaluaciju i procjenu sposobnosti (Holter-EKG, ehokardiografija i druge slikovne metode, koronarografija i dr.) – Slika 1.53.
Slika 1.53. Shematski prikaz probira sportaša na rizične čimbenike iznenadne srčane smrti.
Osnovni rizični čimbenici koje dobivamo na temelju anamnestičkih podataka (obiteljska i osobna anamneza) i fizikalnoga pregleda prikazani su u Tablici 1.33.
|
Tablica 1.33. Rizični čimbenici za iznenadnu srčanu smrt kod sportaša
|
|
Obiteljska anamneza
|
Osobna anamneza
|
Fizikalni pregled
|
|
Iznenadna srčana smrt u obitelji prije 50. godine života;
Nesposobnost uslijed bolesti srca prije 50. godine života u užoj obitelji;
Nasljedne srčane bolesti u obitelji (kardiomiopatije, kanalopatije).
|
Nerazjašnjen gubitak svijesti;
Nelagoda u prsima pri naporu;
Lupanje i/ili preskakanje srca;
Dispneja disproporcionalna naporu;
Arterijska hipertenzija;
Anamneza šuma na srcu.
|
Auskultacijski šum ili nepravilan ritam;
Razlike u snazi pulsnoga vala na ekstremitetima;
Aspekt Marfanovoga sindroma;
Razlike u vrijednostima krvnoga tlaka izmjerenoga na obje ruke.
|
EKG ima najveću kliničku važnost u procjeni rizika od iznenadne srčane smrti kod sportaša. U Tablici 1.34. su prikazani uredni, granični i patološki nalazi EKG-a koje možemo naći u sportaša te preporuke za nastavak daljnje dijagnostičke evaluacije.
|
Tablica 1.34. Elektrokardiografski nalazi sportaša
|
|
Normalni nalazi
|
Granični nalazi
|
Patološki nalazi
|
|
Povećana QRS-voltaža;
Nekompletni blok desne grane;
Rana repolarizacija;
Inverzija T-vala V1-V3 u djece u dobi ranijoj od 16 godina;
Sinusna bradikardija ili sinusna aritmija;
Ektropični atrijski ili spojni ritam;
AV-blok prvoga stupnja (PR-prolongacija);
AV-blok drugoga stupnja (tip 1);
ST-elevacija koju slijedi inverzija T-vala u V1-V4 kod crnaca.
|
Lijeva električna os;
Dilatacija lijevoga atrija;
Desna električna os;
Dilatacija desnoga atrija;
Kompletni blok desne grane.
|
Inverzija T-vala;
Depresija ST-segmenta;
Patološki Q-zupci;
Kompletni blok lijeve grane;
QRS > 140 ms;
Epsilon val;
Ventrikularna ekstrasistolija;
Produžen QT-interval;
Brugada tip I;
Teška bradikardija (< 30/min);
PR-interval > 400 ms;
AV-blok drugoga stupnja (tip 2);
AV-blok trećega stupnja;
Atrijske i ventrikularne tahiaritmije.
|
Uredan nalaz EKG-a osoba bez simptoma i bez navedenih upozoravajućih podataka u osobnoj ili obiteljskoj anamnezi ne zahtijeva daljnu kardiološku evaluaciju. Sportaši s patološkim nalazom EKG-a zahtijevaju daljnju kardiološku evaluaciju, dok se kod sportaša s graničnim nalazom EKG-a predlaže ponovljeno snimanje te se ako promjena perzistira i u drugom nalazu nalaže daljnja kardiološka obrada.
Prevencija iznenadne srčane smrti kod sportaša provodi se na dvije razine. Primarna prevencija obuhvaća redovne liječničke preglede sportaša kako je prethodno opisano, dok sekundarna prevencija podrazumijeva opremljenost (automatski defibrilatori) i educiranost o mjerama kardiopulmonalne reanimacije na mjestima gdje se provode zahtjevne fizičke (sportske) aktivnosti (stadioni, dvorane i sl.).
ATRIOVENTRIKULARNI I INTRAVENTRIKULARNI POREMEĆAJI PROVOĐENJA
Atrioventrikularni poremećaji provođenja podrazumijevaju postojanje atrioventrikularnoga bloka koji onemogućava odgovarajući prijenos podražaja iz atrija u ventrikule preko atrioventrikularnoga čvora ili zajedničke grane Hisova snopa, dok intraventrikularni poremećaji provođenja podrazumijevaju poremećaje provođenja na razini lijeve ili desne grane Hisova snopa.
ATRIOVENTRIKULARNI BLOK
Definicija. Atrioventrikularni blok (AV-blok) predstavlja poremećaj provođenja srčanoga impulsa iz atrija u ventrikule, a nastaje na razini atrioventrikularnoga čvora ili glavne grane Hisova snopa. Poremećaji koji nastaju na razini atrioventrikularnoga čvora raspoznaju se po uskim QRS-kompleksima (< 120 ms), dok se oni na razini Hisova snopa (ili nižih dijelova provodnoga sustava) raspoznaju prema širokim QRS-kompleksima (> 120 ms) na EKG-u. Razlikujemo tri stupnja atrioventrikularnoga bloka.
Etiologija. Najčešći uzrok pojave atrioventrikularnoga bloka je koronarna bolest srca, odnosno fibroza koja nastaje kao posljedica ishemije i nekroze, a remeti normalnu strukturu miokarda i provodljivost impulsa. Također, atrioventrikularni blok može nastati i u podlozi pojačanoga tonusa parasimpatikusa, uslijed primjene lijekova koji produžavaju vrijeme provođenja impulsa kroz atrioventrikularni čvor (digitalis, beta blokatori, blokatori kalcijskih kanala), kao i drugih strukturnih bolesti srca (kongenitalne anomalije, infiltrativne bolesti srca, miokarditis ili kardiomiopatije).
PQ-prolongacija predstavlja samo usporeno provođenje električnoga impulsa kroz atrioventrikularni čvor, ali je svaki impuls proveden, pa je stari naziv atrioventrikularni blok prvog stupnja za ovaj entitet neprimjeren. Na EKG-u ga karakterizira produljenje PR-intervala dulje od 200 ms (Slika 1.54.).
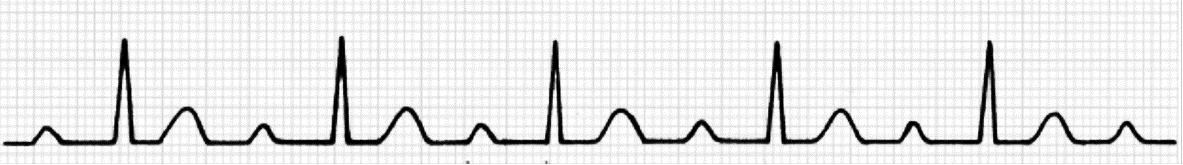
Slika 1.54. EKG nalaz – PQ prolongacija
Atrioventrikularni blok drugoga stupnja naziva se i intermitentnim blokom jer se odnosi na stanje u kojemu se neki impulsi provedu, a neki ostaju blokirani i ne mogu se provesti. Ovisno o periodici provođenja impulsa, razlikujemo dva podtipa ovog bloka: Mobitz I ili Wenckebach i Mobitz II
Mobitz I ili Wenckebach karakterizira postupno produljenje PR-intervala sa svakim srčanim ciklusom sve dok ne izostane prijenos jednoga podražaja, što se na EKG-u prikazuje kao P-val iza kojega nema QRS-kompleksa (Slika 1.55.). Iznimno se taj oblik atrioventrikularnoga bloka može pojaviti i kao fiziološka varijanta, a obično je to slučaj kod dobro utreniranih sportaša s naglašenim tonusom parasimpatikusa.
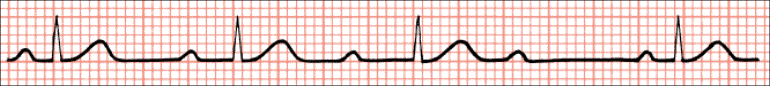
Slika 1.55. EKG nalaz – AV blok II. stupnja, Mobitz I
Mobitz II karakterizira konstantan PR-interval, jednake duljine, uz povremene pojedinačne izostale kondukcije što se na EKG-u prikazuje kao P-val bez QRS-kompleksa koji bi ga trebao slijediti (Slika 1.56.).
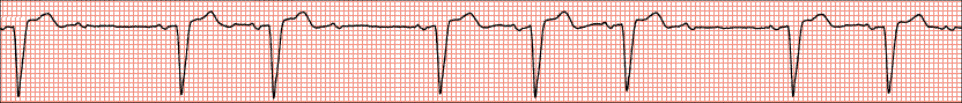
Slika 1.56. EKG nalaz – AV blok II. stupnja, Mobitz II
Atrioventrikularni blok visokoga stupnja označava pojavu u kojemu je većina P-valova bez pripadajućih QRS-kompleksa, označava situaciju u kojoj se tek manji broj atrijskih impulsa prenese na ventrikule, što se može vidjeti u sklopu atrioventrikularnoga bloka drugoga stupnja. Kada govorimo o atrioventrikularnom bloku visokoga stupnja, taj omjer je veći od 3:1 (svaki treći atrijski impuls prenese se na ventrikule) (Slika 1.57.).
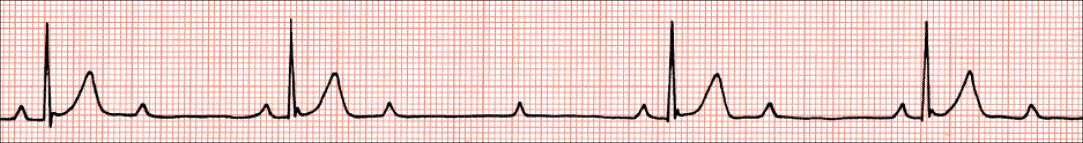
Slika 1.57. EKG nalaz – AV blok visokog stupnja
Atrioventrikularni blok trećega stupnja naziva se još i potpuni ili totalni atrioventrikularni blok, a karakterizira ga potpuni izostanak prijenosa električnoga impulsa iz atrija u ventrikule. U takvoj situaciji javlja se disinkronija između atrijske i ventrikularne električne i mehaničke aktivnosti, s obzirom na to da se atriji kontrahiraju vlastitom frekvencijom koju vodi sinusni čvor, a ventrikuli svojom frekvencijom koju vode niži centri s nižom frekvencijom. Na EKG zapisu uočava se pojava P-valova koji nemaju stalan i pravilan odnos s QRS-kompleksima (Slika 1.58.).
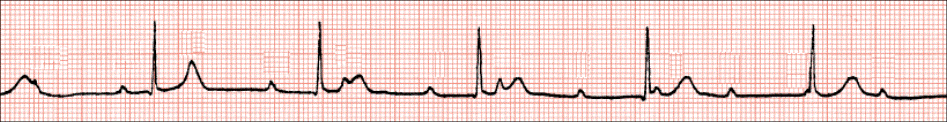
Slika 1.58. EKG nalaz – AV blok III. stupnja (totalni AV blok)
Klinička slika ovisi o težini bolesti, odnosno frekvenciji ventrikula. PQ-prolongacija predstavlja asimptomatsku pojavu, dok se kod atrioventrikularnoga bloka drugoga stupnja mogu pojaviti simptomi u uvjetima snižene srčane frekvencije, obično kod bloka visokoga stupnja. Najčešće se radi o simptomima koji ukazuju na smanjeni srčani minutni volumen kao što su umor, pospanost, gubitak koncentracije, omaglice te u konačnici gubitak svijesti. Atrioventrikularni blok trećega stupnja praćen je obično kliničkom slikom hemodinamske nestabilnosti s hipotenzijom, poremećajima stanja svijesti ili srčanim popuštanjem.
Dijagnoza se postavlja na osnovi kliničke slike i EKG nalaza. U slučaju sumnje na intermitentni poremećaj provođenja, koji nije bio registriran na standardnom 12-kanalnom EKG-u, potreban je 24-satni ili 48-satni Holter EKG nalaz. Tipični EKG nalazi pojedinih stupnjeva atrioventrikularnog bloka prethodno su opisani.
Liječenje se u prvom redu oslanja na ispravljanje i liječenje mogućih uzroka poremećaja provođenja. Bolesnici s PQ-prolongacijom su bez simptoma i ne zahtijevaju specifično liječenje. Specifično liječenje indicirano je u simptomatskih bolesnika i bolesnika s atrioventrikularnim blokom visokoga stupnja.
Inicijalno liječenje podrazumijeva primjenu specifičnih lijekova, u prvom redu atropina (inicijalna doza 0,5 mg iv, prema potrebi ponavljati svakih pet minuta do ukupne doze od 3 mg), a može se pokušati i s primjenom dopamina i teofilina. Učinak atropina pokazuju samo bradiaritmije s uskim QRS-kompleksom. Ako bolesnici ne reagiraju na primjenu atropina, indicirana je hitna elektrostimulacija (transkutana ili transvenska).
Dugoročno liječenje podrazumijeva eventualno trajnu elektrostimulaciju i ona se primjenjuje kod bolesnika s atrioventikularnim blokom i izraženim simptomima smanjenoga srčanoga minutnog volumena, u odsutnosti potencijalno reverzibilnih uzroka na koje se može djelovati.
INTRAVENTRIKULARNI POREMEĆAJI PROVOĐENJA
Intraventrikularni poremećaji provođenja označavaju poremećaje provođenja podražaja na bilo kojoj razini provodnoga sustava ispod zajedničke grane Hisova snopa, što uključuje lijevu granu Hisova snopa zajedno s njezinim prednjim i stražnjim ogrankom te desnu granu Hisova snopa. Ovisno o težini poremećaja razlikujemo nekomplentni intraventrikularni blok provođenja (provođenje je usporeno, ali ostvarivo) te kompletni intraventrikularni blok provođenja (provođenje je u potpunosti blokirano), što se prepoznaje i razlikuje prema trajanju QRS-kompleksa. Kod nekompletnoga bloka trajanje QRS-kompleksa nije produljeno (traje između 110 i 120 ms), dok se kod kompletnoga bloka njegovo trajanje produljuje na više od 120 ms. Fascikularni blok naziv je za intraventrikularni poremećaj provođenja na razini prednjega ili stražnjeg ogranka lijeve grane Hisova snopa. Najčešći klinički oblici intraventrikularnoga poremećaja provođenja su blok desne grane, blok lijeve grane te fascikularni blokovi (prednji lijevi fascikularni blok, stražnji lijevi fascikularni blok) i njihove kombinacije (bifascikularni i trifascikularni blok). Iako se neki oblici intraventrikularnoga poremećaja provođenja mogu vidjeti i u fiziološkim varijantama, većina ih nastaje kao posljedica različitih strukturnih srčanih poremećaja zbog koronarne bolesti, primarne i sekundarne kardiomiopatije, miokarditisa ili kongenitalnih srčanih anomalija.
Blok desne grane označava poremećaj provođenja podražaja na razini desne grane Hisova snopa, što dovodi do zakašnjele depolarizacije desnoga ventrikula u odnosu na lijevi i stvara dissinkroniju pri njihovoj kontrakciji, s obzirom na to da se najprije kontrahira lijevi ventrikul, a potom desni. Kompletni blok desne grane može se pojaviti i kod strukturno zdravoga srca, može ukazivati na patološko stanje, npr. infarkt miokarda anteriorne lokalizacije ili naprezanje desnoga ventrikula u sklopu akutne plućne patologije kao kod plućne tromboembolije. EKG promjene kod bloka desne grane uključuju trajanje QRS-kompleksa duže od 120 ms i pocijepani R-zubac u desnim prekordijalnim odvodima (dominantno u V1 i V2), što daje sliku QRS-kompleksa koja podsjeća na slovo „M“ uz negativan ili bifazičan T-val u V1 (slika 1.59.). Blok desne grane ne dovodi do znatnijih promjena ST-spojnice pa ne utječe značajnije na dijagnostiku akutnoga infarkta miokarda na temelju EKG promjena.
Blok lijeve grane označava poremećaj provođenja podražaja na razini lijeve grane Hisova snopa, što dovodi do zakašnjele depolarizacije lijevog ventrikula u desni. Desni ventrikul kontrahira se nešto ranije u odnosu na lijevi zbog vremena potrebnog da val depolarizacije iz desnoga ventrikula prijeđe na lijevi ventrikul. Prisutnost bloka lijeve grane upućuje na strukturnu bolest srca. Karakteristične promjene na EKG-u uključuju trajanje QRS-kompleksa duže od 120 ms, pojavu čvorastoga ili usječenog vrha R-vala dominantno u QRS-kompleksima lijeve strane srca (V5, V6, I, aVL), uz karakteristične promjene ST-spojnice: silazna depresija ST-spojnice u lijevim pekordijalnim odvodima (V5,V6) te elevacija ST-spojnice u desnim prekordijalnim odvodima (Slika 1.59.). Navedene sekundarne promjene ST-spojnice onemogućavaju odgovarajuću dijagnostiku akutnog infarkta miokarda na temelju EKG nalaza.
|
Normalni nalaz
|
|
Blok desne grane
|
|
Blok lijeve grane
|
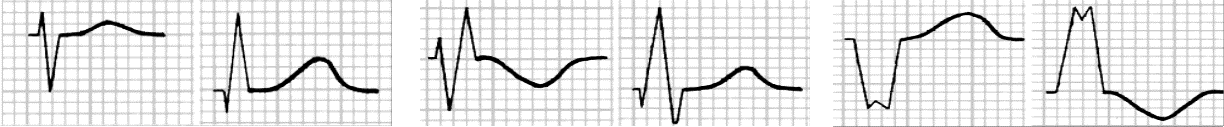
Slika 1.59. EKG osobine bloka desne i lijeve grane
Fascikularni blokovi. Prednji lijevi fascikularni blok označava poremećaj provođenja na razini prednjega ogranka lijeve grane Hisova snopa, a karakterizira ga trajanje QRS-kompleksa preko 120 ms, lijeva električna os te pojava maloga Q-zupca u I i aVL-odvodu te mali R i duboki S-zubac u II, III i aVF-odvodu. Stražnji lijevi fascikularni blok označava poremećaj provođenja na razini stražnjega ogranka desne grane Hisova snopa, a karakteriziraju ga produljeni QRS-kompleks - preko 120 ms, desna električna os te pojava malog R i dubokog S-zupca u I i aVL-odvodu te malog Q-zupca u II, III i aVF-odovodu.
Bifascikularni i trifascikularni blok. Bifascikluarni blok označava kompletni blok desne grane u kombinaciji s prednjim ili stražnjim lijevim fascikularnim blokom, dok trifascikularni blok podrazumijeva kombinaciju bifascikularnog bloka s PQ-prolongacijom (AV-blokom I stupnja). Kod bolesnika koji su bez simptoma i nemaju sinkopane atake vjerojatost progresije u totalni atrioventrikularni blok je mala.
Klinički pristup. Nalaz bloka desne ili lijeve grane, kao i prednjega ili stražnjeg lijevog fascikularnoga bloka pobuđuju sumnju na strukturnu bolest srca te zahtijevaju dijagnostičku obradu koja uključuje ehokardiografiju, ali ne zahtijeva specifični oblik liječenja.
DOKNADNI RITMOVI
NODALNI RITAM
Nodalni ritam označava srčani ritam koji nastaje u uvjetima kada atrioventrikularni čvor preuzme aktivnost centra vodiča umjesto sinusnoga čvora, u slučaju njegova poremećaja ili bolesti. U atrioventrikularnom čvoru impulsi nastaju s frekvencijom od 40-60/min što osigurava dostatni minutni volumen za održavanje cirkulacije i zadovoljavanje metaboličkih potreba organizma u mirovanju, dok se pri opterećenju javljaju simptomi i znakovi nezadovoljavajućega minutnog volumena. Klinička slika, osim spomenutih simptoma i znakova nezadovoljavajućega minutnog volumena pri opterećenju, ovisi i o osnovnoj bolesti i pridruženim stanjima koji su doveli do disfunkcije sinusnoga čvora. Dijagnoza se postavlja na temelju EKG nalaza koji uključuje pravilnu, ritmičnu pojavu urednih QRS-kompleksa s frekvencijom od 40 do 60 u minuti, a nedostaju im P-valovi, ili su oni negativni, ili slijede odmah iza QRS-kompleksa. Liječenje je etiološko, a u većini slučajeva potrebna je srčana elektrostimulacija kada je osnovni uzrok nekorektibilan.
IDIOVENTRIKULARNI RITAM
Idioventrikularni ritam označava srčani ritam koji nastaje u uvjetima kada Purkinjeove stanice ventrikularnoga miokarda preuzmu aktivnost centra vodiča, što se događa kada tu sposobnost izgube sinusni čvor, kao fiziološki pacemaker, i atrioventrikularni čvor, kao prvi sljedeći fiziološki pacemaker. Idioventrikularni ritam obično se javlja kada dođe do potpunoga izostanka depolarizacije ventrikula iz viših centara uslijed razvoja atrioventrikularnoga bloka ili drugih bolesti. U Purkinjeovim stanicama ventrikularnoga miokarda impuls se stvara frekvencijom od 15 - 40/min, što u većini slučajeva nije dostatno niti za osnovnu perfuziju vitalnih organa te se kod takvih bolesnika vrlo brzo razvija kardiopulmonalni zastoj. Takav se ritam često može vidjeti tijekom reanimacije ili kao agonalni ritam osoba koje umiru. Liječenje je usmjereno na osnovnu bolest te poduzimanje mjera kardiopulomonalne reanimacije. Kada je prisutan atrioventrikularni blok, indicirana je hitna privremena srčana elektrostimulacija.
EKSTRASISTOLE I DRUGI POREMEĆAJI SRČANOGA RITMA
Ekstrasistole predstavljaju prijevremene kontrakcije ventrikula koje nastaju kao posljedica ektopičnoga stvaranja impulsa izvan sinus-atrijskoga čvora, a koji se prenose do ventrikula i izazivaju njegov podražaj (kontrakciju). Ovisno o mjestu nastanka impulsa (žarišta), razlikujemo supraventrikularne (atrijske i nodalne) te ventrikularne ekstrasistole.
SUPRAVENTRIKULARNE EKSTRASISTOLE
Definicija. Supraventrikularne ekstrasistole (SVES) predstavljaju prijevremene kontrakcije koje nastaju kao posljedica ektopičnoga stvaranja impulsa u atrijima (atrijske ekstrasistole) ili atrioventrikularnom provodnom sustavu (nodalne ekstrasistole). Radi se o relativno čestoj pojavi koja ne mora označavati patološko stanje, nego se može javiti i kod zdravih pojedinaca.
Atrijske ekstrasistole mogu nastati iz jednoga ili više žarišta (fokusa) unutar miokarda desnoga ili lijevog atrija. Prepoznatljive su po P-valu koji je različit od onoga koji nastaje u sinusnom ritmu, osim ako se radi o izvorištu u neposrednoj blizini sinusnoga čvora. Ako se radi o izoliranom žarištu, nastali P-valovi jednake su morfologije, a ako se radi o više žarišta vidimo P-valove različite morfologije. Većina se nastalih električnih impulsa prenosi iz žarišta preko atrija i atioventrikularnoga sustava na ventrikule i dovodi do njihove kontrakcije, što obilježava pojava QRS-kompleksa koji ima normalnu morfologiju sinusnoga ritma. Ponekad je nastali električni impuls blokiran u samom atrijskom miokardu i ne prevede se do ventrikula, što se bilježi kao pojava P-vala koji se razlikuje od sinusnoga, a ne slijedi ga QRS-kompleks. To je nekada moguće zamijeniti s atrioventrikularnim blokom drugog stupnja.
Nodalne (spojne) ekstrasistole nastaju u području atrioventrikularnoga sustava provođenja, i to vjerojatno iz Hisova snopa, s obzirom na to da sam atrioventrikularni čvor nema sposobnost automatizma. Ova vrsta ekstrasistola javlja se iznimno rijetko, i obično su povezane sa strukturnom bolesti srca ili se mogu javiti u sklopu intoksikacije digitalisom. Nastali impuls može se provesti anterogradno na ventrikule i dovesti do njihove kontrakcije što se bilježi kao prijevremena pojava QRS-kompleksa uredne morfologije bez prethodnoga P-vala ili se može retrogradno provesti na atrije i izazvati njihovu kontrakciju što se bilježi kao P-val izmijenjene morfologije, koji obično pada nakon prethodnoga QRS-kompleksa (Slika 1.60.).
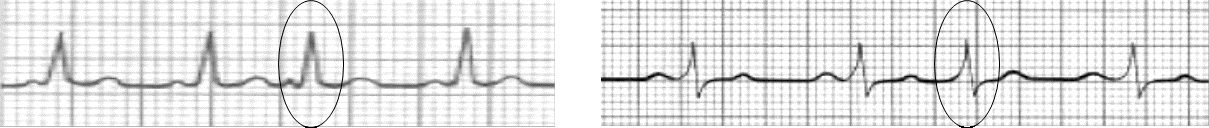
Slika 1.60. EKG nalaz – atrijska ekstrasistola (lijevo) i spojna ekstrasistola (desno)
Klinička slika i značaj. Pojava supraventrikularnih ekstrasistola obično je asimptomatske i benigne naravi, a samo kod manjega broja osoba mogu izazvati palpitacije. Pojavu supraventikularnih ekstrasistola može isprovocirati pojačan unos alkohola, nikotina ili drugih adrenergičkih stimulanasa. Kod nekih osoba pojava atrijskih ekstrasistola može potencirati nastanak AVRT ili AVNRT tahikardije što je opisano u poglavlju o supraventrikularnim paroksizmalnim tahikardijama.
Dijagnoza se postavlja na osnovi EKG-a. Povremene pojedinačne supraventrikularne ekstrasistole mogu se otkriti kod oko 60 % zdravih pojedinaca tijekom snimanja 24-satnog Holter EKG-a. Kod osoba kod kojih nalazimo učestale supraventrikularne ekstrasistole, osobito ako su nodalne, indicirana je šira kardiološka obrada koja uključuje ergometrijsko testiranje i ehokardiografiju.
Liječenje supraventrikularnih ekstrasistola nije potrebno, osobito ako su one rijetke i asimptomatske. U slučaju česte pojave opetovanih supraventrikularnih ekstrasistola potrebno je eliminirati moguće okidače, kao što su alkohol, nikotin ili adrenergički stimulansi, a tek se kod manjega broja osoba, ako su one i dalje prisutne, mogu primijeniti beta blokatori ili blokatori kalcijskih kanala.
VENTRIKULARNE EKSTRASISTOLE
Definicija. Ventrikularne estrasistole (VES) predstavljaju prijevremene kontrakcije ventrikula koje nastaju kao posljedica ektopičnoga stvaranja električnoga impulsa u ventrikulima.
Etiopatogeneza. VES može nastati na podlozi strukturno zdravoga srca zbog pojačane adrenergičke stimulacije, hipertireoze, elektrolitnoga poremećaja ili u sklopu različitih srčanih oboljenja, kao što su npr. ishemijska kardiomiopatija, hipertrofijska kardiomiopatija, kongenitalne anomalije. Žarište ili fokus nastanka ektopičnoga električnog imuplsa koji dovodi do depolarizacije i kontrakcije može se pojaviti bilo gdje unutar miokarda lijevoga ili desnog ventrikula, a nastali depolarizacijski val dalje se širi mimo provodnoga sustava dovodeći do kontrakcije ventrikula. Nastali impulsi uglavnom se ne provode retrogradno u atrije zbog čega se EKG nalaz sastoji od proširenoga i morfološki izmijenjenoga QRS-kompleksa kojemu ne prethodi P-val i nakon kojega slijedi kompenzacijska stanka ili pauza. Ako se električni impuls ipak retrogradno prevede u atrije, on se prezentira kao negativni P-val koji je najizraženiji u inferiornim odvodima (II, III, aVF).
Oblici ventrikularnih ekstrasistola. Ovisno o broju fokusa, razlikujemo monomorfne ventrikularne ekstrasistole koje su iste morfologije i koje nastaju iz samo jednoga fokusa, te polimorfne ventrikularne ekstrasistole koje su različite morfologije i nastaju iz više fokusa. Prema učestalosti možemo govoriti o pojedinačnim ventrikularnim ekstrasistolama ili se mogu javljati određenom pravilnošću, kao što su bigeminija, trigeminija ili kvadrigeminija, tj. kao svaka druga, treća ili četvrta. Dvije uzastopne ventrikularne ekstrasistole nazivaju se parom, a tri ili više uzastopnih ventrikularnih ekstrasistola smatra se već ventrikularnom tahikardijom, ako je srčana frekvencija viša od 100 otkucaja u minuti. Salva ventrikularnih ekstrasistola označava pojavu uzastopne tri do četiri ventrikularne ekstrasistole koje se pojavljuju u određenim vremenskim intervalima. R/T ("R na T") fenomen označava ventrikularnu ekstrasistolu koja se pojavljuje na samom vrhu prethodnoga T-vala ili odmah iza njega i ima ozbiljniji prognostički značaj (Slika 1.61.).
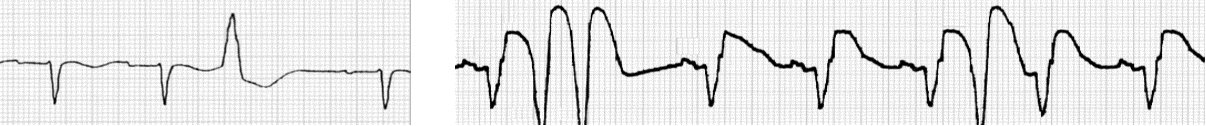
Slika 1.61. EKG nalaz – izolirana VES (lijevo) te VES u paru i R/T fenomen (desno)
Klinička slika. Ventrikularne ekstrasistole mogu se javiti kao asimptomatski poremećaj. Ako su učestale i izražene, bolesnici se mogu žaliti na osjećaj preskakanja i nepravilnoga rada srca, navode da osjete pauze u radu srca te mogu biti uznemireni i uplašeni. Kod zdravih osoba fizički napor obično dovodi do iščezavanja ventrikularnih ekstrasistola i srčani ritam postaje pravilan.
Dijagnoza se postavlja na temelju EKG nalaza. Kod bolesnika kod kojih se na standardnom 12-kanalnom EKG-u bilježe učestale ventrikularne ekstrasistole preporuča se 24-satno Holter EKG snimanje zbog otkrivanja formi i utvrđivanja učestalosti ovih ekstrasistola, što ima bitan utjecaj na donošenje odluke o terapijskom pristupu. Kod bolesnika koji imaju učestali VES potrebno je isključiti prisutnost elektrolitnih poremećaja, hipertireoze i strukturne bolesti srca (ehokardiografija). Rizik od nastanka maligne ventrikularne aritmije viši je ako je VES učestaliji, polimorfan ili se radi o salvama VES-a ili R/T fenomenu.
Liječenje. Kod bolesnika koji imaju rijetke ventrikularne ekstrasistole, osobito u podlozi strukturno zdravoga srca liječenje nije potrebno, a nekada samo pojašnjenje bolesniku da se radi o benignoj pojavi djeluje povoljno na nestanak simptoma ako su prisutni. Specifično liječenje indicirano je kod bolesnika s učestalim ventrikularnim ekstrasistolama kada ih je više od 10 % ukupnih srčanih otkucaja, posebno ako je u podlozi srčano oboljenje i povezani su s izraženim simptomima. Osnovu liječenja čini primjena beta blokatora ili nedihidropiridinskih blokatora kalcijskih kanala (verapamil, diltiazem). Kod bolesnika koji i dalje imaju simptome i imaju rizičnije forme ventrikularnih ekstrasistola (salve, R/T fenomen), a koje se ne uspijevaju suzbiti lijekovima, može se razmotriti i mogućnost elektrofiziološkog ispitivanja i kateterske ablacije ektopičnih fokusa.
SINDROM PRODULJENOGA QT-INTERVALA
Definicija. Sindrom produljenoga QT-intervala (LQTS – engl. long QT-syndrome) predstavlja stečenu ili nasljednu elektrokardiografsku abnormalnost s korigiranim QT-intervalom (QTc ≥ 500 ms), koja je povezana s pojavom malignih ventrikularnih poremećaja srčanoga ritma, sinkope i povećanim rizikom od nastanka nagle srčane smrti.
Patofiziologija. QT-interval na EKG-u predstavlja period ventrikularne depolarizacije i repolarizacije koje su uvjetovane transmembranskim ionskim prijenosom: depolarizacija je uvjetovana ulazom natrija i kalcija u stanice, dok je repolarizacija uvjetovana izlaskom kalija iz stanica. Povećanjem depolarizacije i/ili smanjenjem repolarizacije dolazi do produljenjaa QT-intervala, što stvara preduvjet za nastanak malignih ventrikularnih poremećaja srčanoga ritma, a time i nagle srčane smrti. To može biti posljedica nasljednih mutacija gena koji dovode do poremećaja kalijskih ili natrijskih kanala ili nekih stečenih bolesti i stanja (stečeni i kongenitalni LQTS).
Stečeni sindrom produljenoga QT-intervala pojavljuje se u sklopu strukturnih srčanih oboljenja, elektrolitnih poremećaja (hipokalijemija, hipomagnezijemija), kao i uslijed primjene nekih lijekova (Tablica 1.35.).
Kongenitalni sindrom produljenoga QT-intervala nastaje kao posljedica mutacija gena natrijskih i kalijskih kanala koji dovode do produljene repolarizacije. Do sada je opisano trinaest specifičnih mutacija koje su razvrstane u četiri klinička sindroma. Romano-Wardov sindrom je najučestaliji oblik (učestalost 1:2500), a nasljeđuje se autosomno-dominantnim putem. Jervell-Lange-Nielsenov sndrom je rjeđi i nasljeđuje se autosomno-recesivnim putem, a karakterizira ga i pojavnost prirođene nagluhosti. Andersenov sindrom obilježen je učestalim aritmijama, malformacijama i paralizom. Timothyev sindrom je najrjeđi, a obilježen je teškim LQTS, srčanim i somatskim malformacijama te autizmom.
Klinička slika. Većina bolesnika sa sindromom produljenoga QT-intervala je bez simptoma. Mogu se pojaviti palpitacije i različite tahiaritmije praćene sinkopom. Prva manifestacija može biti maligni poremećaj srčanoga ritma i nagla srčana smrt.
Dijagnoza se postavlja na temelju anamnestičkih podataka o postojanju rane srčane smrti u obitelji, kliničkih simptoma (sinkope, prirođena nagluhost) te EKG nalaza (Slika 1.62.). Budući da se QT-interval normalno skraćuje povećanjem srčane frekvencije, pri postavljanju dijagnoze produljenoga QT-intervala koriste se vrijednosti korigiranoga QT-intervala (QTc) koji se računa prema Bazettovoj formuli (QTc=Qt/√RR). O sindromu produljenoga QT-a govorimo kada je QTc 500 ms. U dijagnostičkoj je obradi potrebno isključiti sve druge stečene uzroke produljenoga QT-intervala (ehokardiografija, određivanje elektrolita, procjena lijekova koje bolesnik uzima). Kod bolesnika sa sumnjom na kongenitalni LQTS indicirano je i genetsko testiranje.
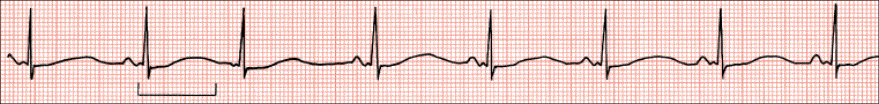
Slika 1.62. EKG nalaz – sindrom produljenoga QT-intervala
Liječenje. Osnovu liječenja čini korekcija rizičnih čimbenika koji mogu dovesti do produljenja QT-intervala (isključivanje lijekova, korekcija elektrolitnih poremećaja). U akutnom liječenju tahiaritmija bolesnika s produljenim QT-intervalom treba izbjegavati antiaritmike Ia, Ic i III skupine koji dodatno produljuju QT-interval, pa se preporučaju beta blokatori. Torsades de pointes, kao najčešći oblik ventrikularnoga poremećaja srčanoga ritma kod ovih bolesnika, liječi se intravenskom primjenom magnezija. U kroničnom liječenju sindroma produljenog QT-intervala najznačajnije mjesto zauzimaju beta blokatori. Kirurška denervacija - cervikotorakalna simpatektomija, indicirana je kad su beta blokatori neučinkoviti. Implantacija ICD-a preporuča se kod bolesnika s rekurentnim sinkopama, samoprekidajućim VT-ima ili preživljenim srčanim arestom.
BRUGADIN SINDROM
Definicija. Brugadin sindrom predstavlja rijetku genetski uvjetovanu srčanu aritmiju uz odsutnost strukturne bolesti srca. Karakterizira ju blok desne grane i perzistentna elevacija ST-segmenta u desnim prekordijalnim odvodima koja se povezuje s povećanim rizikom od nastanka malignih ventrikularnih poremećaja srčanoga ritma i nagle srčane smrti. Procjenjuje se da prevalencija Brugadina sindroma iznosi 5/10 000 te da je uzrok najmanje 4 % svih naglih srčanih smrti. Češće se susreće kod muškaraca u odnosu na žene.
Etiopatogeneza. Brugadin sindrom predstavlja nasljednu kanalopatiju koja pogađa natrijeve, kalijeve i kalcijske kanale. Dosad je opisano više od 300 mutacija različitih gena koji kodiraju navedene kanale i proteine povezane s njima, a većina njih se prenosi autosomno-dominantnim putem. Ventrikularni poremećaji srčanoga ritma nastaju zbog varijabilnosti (heterogenosti) u rasporedu normalnih i abnormalnih kanala različitih miocita unutar ventrikularnoga miokarda što dovodi do heterogenosti refraktornih perioda. Razlike u refrakternom periodu (period oporavaka nakon depolarizacije) mogu biti uzrok stvaranja kružnoga mehanizma koji će dovesti do preuranjenih kontrakcija ventrikula i ventrikularnoga poremećaja srčanoga ritma.
Klinička slika. Bolesnici s Brugadinim sindromom uglavnom su bez simptoma do pojave životno ugrožavajuće ventrikularne aritmije, a samo manji dio bolesnika ima ranije sinkope i palpitacije. Kod oko 20 % bolesnika mogu se naći i supraventrikularne aritmije, najčešće fibrilacija atrija. Iako se radi o prirođenom poremećaju, aritmije se uglavnom razvijaju u srednjoj životnoj dobi. Najčešće se radi o naglom nastupu polimorfne VT ili FV, i to većinom tijekom noći, u snu. Nije zabilježena pojava aritmija za vrijeme fizičke aktivnosti ili napora.
Dijagnoza se postavlja na temelju EKG-a (Slika 1.63.). Razlikuju se tri oblika: tip I (engl. coved type) karakteriziran elevacijom ST-segmenta > 2 mm s negativnim T-valovima u V1-V3 odvodima; tip II (engl. seddle-back type) karakteriziran elevacijom ST-segmenta > 2 mm, sedlastoga oblika, s pozitivnim ili bifazičnim T-valovima u V1-V3 odvodima te tip III koji se definira kao jedan od prethodna dva oblika, ali s elevacijom ST-segmenta < 1 mm. U nejasnim slučajevima radi se provokacijski test blokatorom natrijskih kanala koji se smatra pozitivnim ako se nakon njegove primjene pojavi karakterističan EKG obrazac, što pomaže u razotkrivanju prikrivenih i latentnih oblika Brugadina sindroma.
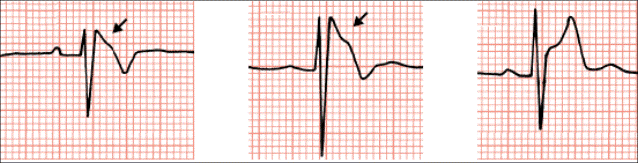
Slika 1.63. EKG osobine Brugada sindroma
Brugada fenokopija je naziv za pojavu EKG obrasca karakterističnog za Brugada sindrom, uz odsutnost specifičnoga nasljednog defekta. Mogu ga uzrokovati različita stanja i bolesti, kao što su metabolički poremećaji (hiponatrijemija, hiperkalijemija, hipokalijemija, acidoza, adrenalna insuficijencija), mehanička kompresija (pektus ekskavatum, medijastinalni tumor, hematoperikard), ishemija miokarda te ostale bolesti mioperikarda. Osnovno obilježje Brugada fenokopija je njihovo iščezavanje s normalizacijom EKG nalaza nakon uklanjanja uzročnih čimbenika.
Liječenje ovih bolesnika usmjereno je na prevenciju malignih ventrikularnih poremećaja srčanoga ritma i nagle srčane smrti. U obzir dolazi i farmakoterapija te kateterska ablacija, ali jedina dokazana, učinkovita metoda liječenja je ugradnja ICD-a. Ugradnja ICD-a preporuča se svim bolesnicima koji su preživjeli srčani arest i koji imaju dokumentiranu pojavu VT-a bez ili sa sinkopom, a može biti korisna i kod bolesnika koji u anamnezi imaju sinkopu za koju se može pretpostaviti da je bila uzrokovana ventrikularnim poremećajima srčanoga ritma.
Definicija. Ateroskleroza predstavlja kroničnu upalno-degenerativnu bolest arterija koja je osnovni i najčešći uzrok koronarne bolesti srca, a obilježava ju ishemija miokarda uslijed neravnoteže između potrošnje i ponude kisika. Ateroskleroza, osim što je glavni uzrok koronarne bolesti, nalazi se i u podlozi drugih krvožilnih bolesti kao što su cerebrovaskularna i periferna arterijska bolest. Osnovno je obilježje ateroskleroze stvaranje vezivno-masnih lezija u stijenkama arterija, tzv. ateroma, koji narušavaju normalan protok krvi i dovode do ispada perfuzije te razvoja ishemije. Cijeli proces stvaranja ateroma naziva se aterogeneza i ona se odvija kroz više desetaka godina, počevši već od mlađe odrasle dobi. Početne aterosklerotske promjene nalaze se već u stijenkama velikih krvnih žila dvadestogodišnjaka, a brzina napredovanja ovisi o prisutnosti rizičnih čimbenika koji pogoduju njezinom razvoju. U daljnjem će tekstu biti razmatrani osnovni koncepti nastanka i razvoja ateroskleroze koronarnih arterija, kao najčešćega uzroka koronarne bolesti, iako treba imati na umu da i neke druge bolesti i stanja mogu dovesti do istoga ishoda, a oni će biti posebno opisani.
Epidemiologija. Prema procjenama Svjetske zdravstvene organizacije, od kardiovaskularnih bolesti na godišnjoj razini umire oko 3,8 milijuna muškaraca i 3,4 milijuna žena diljem svijeta, a osnovnu podlogu tih bolesti čini ateroskleroza. Također, procjenjuje se da unutar Europe svaki treći muškarac i svaka četvrta žena umiru od posljedica koronarne bolesti, odnosno akutnoga infarkta miokarda ili ishemijske kardiomiopatije, što ovu bolest svrstava među glavne javnozdravstvene probleme. Intenzivna edukacija opće populacije o rizičnim čimbenicima i načinima prevencije ateroskleroze i koronarne bolesti dovela je do toga da se u zadnjih desetak godina u zapadnim zemljama bilježi kontinuirani pad smrtnosti od ovih bolesti, čemu dodatno pridonose značajno napredniji načini i mogućnosti liječenja.
Patogeneza. Ateroskleroza nastaje kao posljedica kompleksnih patofizioloških zbivanja, a u načelu predstavlja upalni odgovor na prisutnost lipidnih čestica, poglavito lipoproteina niske gustoće (engl. LDL – low-density lipoprotein) u stijenci krvnih žila. Sam proces započinje razvojem endotelne disfunkcije koja rezultira povećanom propusnošću endotelne barijere za LDL-čestice koje se potom odlažu i nakupljaju u intimi arterijske stijenke. Endotelna disfunkcija može nastati kao posljedica različitih utjecaja poput mehaničkoga stresa zbog arterijske hipertenzije, biokemijskih abnormalnosti zbog hiperlipidemije ili hiperglikemije, imunoloških čimbenika kao što su slobodni kisikovi radikali iz duhanskoga dima, upala poput infekcija C. pneumoniae te genetske predispozicije. LDL unesen u intimu arterijske stijenke veže se za proteoglikane izvanstaničnoga matriksa te se uslijed aktivnosti lokalne mijeloperoksidaze i NADPH oksidaze oksidira, pri čemu se oslobađaju biološki aktivni fosfolipidi koji imaju sposobnost aktivacije endotelnih stanica. Aktivirane endotelne stanice na svojoj površini eksprimiraju adhezivne molekule (VCAM-1, ICAM-1) te pojačano luče kemokine, tvari koje privlače monocite i limfocite, a sve to omogućava njihovu regrutaciju i nakupljanje unutar arterijske stijenke. Pod utjecajem lokalnih čimbenika rasta monociti se pretvaraju u makrofage koji putem svojih specifičnih receptora, tzv. receptora čistača, fagocitiraju oksidirane LDL-čestice te se tako pretvaraju u stanice krcate lipidima, odnosno u tzv. pjenušave stanice. Aktivacija makrofaga praćena je i pojačanom produkcijom proupalnih citokina, eikozanoida, slobodnih kisikovih radikala te proteaza koji dodatno potiču upalni odgovor. Osim makrofaga, veliku ulogu u tom upalnom procesu imaju i T-limfociti koji prepoznaju antigene na površini makrofaga (komponente LDL-čestica), što dovodi do njihove aktivacije i pojačane proizvodnje citokina Th1 puta (INF-γ, TNF-α). U patogenezi ovih događaja treba napomenuti i antiaterogenu ulogu lipoproteina visoke gustoće (engl. HDL – high-density lipoprotein) koji imaju sposobnost preuzimanja kolesterola iz pjenušavih stanica putem specifičnih transportnih mehanizama te usporavanja progresije i napredovanja ateroskleroze. Osim na endotelne stanice, proupalni citokini i drugi medijatori djeluju i na glatkomišićne stanice koje postupno migriraju u prostor intime gdje poprimaju fibroblastični fenotip te stvaraju vezivno tkivo koje stabilizira aterosklerotski plak stvarajući tzv. vezivnu kapu. Daljnja progresija i rast ateroma dovodi do njegovog izbočenja u lumen arterije što postupno smanjuje protok krvi uzrokovajući distalnu hipoperfuziju. Stabilni plak u određenim okolnostima može postati nestabilan, što se definira prekidom kontinuiteta vezivnoga sloja ateroma pojavom fisura i ruptura plaka, što omogućava doticaj krvi sa sadržajem lipidne jezgre ateroma u kojemu nalazimo protrombogene tvari poput tkivnoga faktora ili fosfolipida, a to u konačnici inducira agregaciju trombocita i formiranje ugruška koji može u potpunosti zaustaviti protok krvi kroz arteriju te dovesti do ishemije i nekroze distalno irigiranoga područja. Nestabilnost plaka nastaje kao posljedica pojačane endogene upalne aktivnosti koja dovodi do degradacije vezivne kape, pojačane osjetljivosti plaka na mehanička naprezanja, njegove erozije, fisure ili rupture. Brzina napredovanja toga procesa ponajprije ovisi o prisutnosti rizičnih čimbenika koji pogoduju razvoju ateroskleroze (vidi kasnije). Što su oni više i jače izraženi, to je i brzina napredovanja takvih promjena brža. Tako npr. osobe s neprepoznatom i neliječenom obiteljskom hiperkolesterolemijom znatno ranije razvijaju koronarnu bolest u odnosu na ostalu populaciju.
Patologija. Navedene patogenetske promjene prate i odgovarajuće patomorfološke promjene koje se uočavaju na stijenci krvnih žila, a koje se prema klasifikaciji Američkog kardiološkog društva mogu podijeliti u šest skupina: masne pjege (tip I), masne pruge (tip II), intermedijarne lezije (tip III), aterom (tip IV), fibroaterom (tip V) te komplicirani aterom (tip VI). Vremenski slijed razvoja ovih promjena prikazan je shematski na Slici 1.64.

Slika 1.64. Shematski prikaz vremenskoga slijeda pojave aterosklerotskih promjena
Masne pjege predstavljaju inicijalne aterosklerotske lezije. Mikroskopski se radi o pojedinačnim nakupinama makrofaga i pjenušavih stanica koje dovode do sitno-točkastih, žućkastih uzdignuća i neravnina s unutarnje strane arterijske stijenke, bez utjecaja na hemodinamiku.
Masne pruge nastaju iz masnih pjega, a karakterizirane su većinom untarstaničnim nakupljanjem lipida što se makroskopski vidi kao stvaranje linearnih žućkastih uzdignuća s unutarnje strane arterijske stijenke. Takve se promjene dominantno nalaze u ishodištima velikih arterija iz aorte i oko njih.
Intermedijarne lezije čine mikroskopske promjene, kao i kod masnih pruga, ali s dodatnom umjerenom izvanstaničnom akumulacijom lipida. Makroskopski se uočavaju kao linearna, mjestimično proširena uzdignuća s unutarnje strane arterijske stijenke koja su najizraženija u području aorte i njezinih velikih ogranaka.
Aterom je naziv za aterosklerotski plak karakteriziran izraženim intracelularnim i ekstracelularnim nakupljanjem lipida uz slabo izraženu vezivnu kapu koju čine glatkomišićne stanice. Makroskopski se prikazuju kao široke i nepravilne mase koje se izbočuju u lumen arterija te, ovisno o veličini, dovode do njihova suženja.
Fibroaterom nastaje jačanjem vezivne kape ateroma koja okružuje središnju lipidnu jezgru uslijed proliferacije glatkomišićnih stanica što ateromu daje stabilnost. Stvaranjem fibroateroma arterije postaju krute i neelastične, a česte su i sekundarne kalcifikacije.
Komplicirani aterom naziv je za sve promjene koje se mogu dodatno razviti na podlozi ateroma ili fibroateroma, a koje ga čine nestabilnim i potencijalno opasnim zbog krvarenja u ateromu, fokalnih ruptura, ulceracija, i superponiranih tromboza.
Rizični čimbenici koji pogoduju razvoju ateroskleroze mogu se podijeliti u dvije osnovne skupine: nepromjenjivi i promjenjivi. Nepromjenjivi su čimbenici oni na koji ne možemo utjecati, a to su dob, spol i genetska predispozicija (konstitucijski čimbenici). Za razliku od njih, promjenjivi su čimbenici oni na koje možemo utjecati, a to su hiperlipidemija, arterijska hipertenzija, šećerna bolest, pretilost, stres, kao i neki oblici ponašanja (pušenje, tjelesna neaktivnost i prehrambene navike).
Dob. Kako je već navedeno, izraženost aterosklerotskih promjena usko je povezana s dobi bolesnika. Iako se radi o bolesti čije se najranije pojave uočavaju već u prvim desetljećima života, ona ima sporoprogresivan tijek i tek se u kasnijoj životnoj dobi bolest manifestira u svom punom patološkom i kliničkom smislu. Rizik od nastanka posljedica ateroskleroze, što uključuje i koronarnu bolest, raste sa životnom dobi i najveći je u šestom i sedmom desetljeću života nakon čega se bilježi ponovni pad.
Spol. Generalno gledano, muškarci posjeduju viši rizik i u većoj su opasnosti od razvoja ubrzane ateroskleroze i njezinih posljedica u odnosu na žene, dok su one u reproduktivnoj dobi. Nakon nastupa menopauze i kod žena se bilježi povećanje rizika koji se u šestom i sedmom desetljeću života izjednačava s onime kod muškaraca. Navedena zaštita pripisuje se protektivnom učinku endogenoga estrogena, dok primjena hormonskoga nadomjesnog liječenja ne dovodi do snižavanja rizika od razvoja posljedica ateroskleroze.
Genetika. Činjenica da se kardiovaskularne bolesti češće javljaju u nekim obiteljima upućuje na važnost utjecaja genetske predispozicije za razvoj ateroskleroze. Iako do sada nisu identificirani točni geni koji bi se povezivali s aterosklerozom, najčešće se govori o polimorfizmima gena koji kodira angiotenzin konvertazu (DD genotip). Također, genetska predispozicija za aterosklerozu ogleda se i kroz povezanost specifičnih genetskih promjena s određenim rizičnim čimbenicima, kao što su hiperlipidemija, hipertenzija ili šećerna bolest.
Hiperlipidemija je jedan od najvažnijih promjenjivih rizičnih čimbenika u razvoju ateroskleroze. Povišene vrijednosti LDL kolesterola uz snižene vrijednosti HDL kolesterola predstavljaju osnovni poremećaj metabolizma lipida koji je povezan s ubrzanim razvojem ateroskleroze, dok hipertrigliceridemija ima manju ulogu u razvoju ateroskleroze. Sniženje vrijednosti LDL kolesterola dokazano smanjuje rizik od nastanka komplikacija ateroskleroze, kao što su koronarna bolest ili cerebrovaskularna bolest.
Arterijska hipertenzija drugi je značajan promjenjivi rizični čimbenik u razvoju ateroskleroze. Učestalost ateroskleroze i njezinih posljedica izravno je povezana s vrijednostima krvnog tlaka i to u jednakoj mjeri i s vrijednostima sistoličkoga i dijastoličkog tlaka. Primjena antihipertenziva značajno smanjuje kardiovaskularni mortalitet kao posljedicu uznapredovale ateroskleroze.
Šećerna bolest. Metabolički profil koji se viđa kod bolesnika sa šećernom bolesti, a koji u prvom redu obuhvaća hiperglikemiju i hiperlipidemiju, nepovoljno djeluje na funkciju endotela te izaziva endotelnu disfunkciju, zbog čega se šećerna bolest, osobito tip II, često povezuje s razvojem ateroskleroze. Smrtnost osoba sa šećernom bolesti od koronarne bolesti višestruko je veća u usporedbi s osobama bez šećerne bolesti. Šećerna bolest se obično pojavljuje s pretilošću centralnoga ili abdominalnog tipa, hiperlipidemijom i arterijskom hipertenzijom, što se naziva metaboličkim sindromom.
Stres i životne navike. Kronična izloženost stresu i gubitak obrambenih mehanizama za stresne događaje i situacije također se povezuje s ubrzanom aterosklerozom. To se najvećim dijelom tumači stanjem pojačane aktivacije simpatikusa i posljedičnom dominacijom tzv. stresnih hormona (adrenalina, noradrenalina, kortizola), što predstavlja normalan, fiziološki odgovor na stanje stresa. Pušenje, tjelesna neaktivnost (sjedilački način života), nezdrava prehrana i prekomjerna konzumacija alkohola također su važni rizični čimbenici koji potiču razvoj ateroskleroze.
Laboratorijski rizični čimbenici. Na temelju brojnih provedenih studija danas su poznati neki laboratorijski parametri koji se povezuju s razvojem ateroskleroze. To su u prvom redu povećane vrijednosti fibrinogena, visoko-osjetljivoga C-reaktivnog proteina (engl. hsCRP – high sensitivity C-reactive Protein) i homocisteina te mikroalbuminurija kao marker bubrežnoga oštećenja.
Klinički pristup. Ateroskleroza je primarno patomorfološka dijagnoza s različitim kliničkim manifestacijama (koronarna bolest, cerbrovaskularna bolest, periferna arterijska bolest) nužan je sveobuhvatan pristup koji podrazumijeva prepoznavanje bolesnika s rizičnim čimbenicima s ciljem djelovanja na njih, što se postiže metodama primarne i sekundarne prevencije.
Farmakoterapija ateroskleroze. Jedinstvena farmakoterapija ateroskleroze ne postoji, a lijekovi koji se koriste kod ovih bolesnika su usmjereni na liječenje rizičnih čimbenika (antilipemici, antihipertenzivi, antidijabetici, inzulin) te na liječenje posljedica ateroskleroze. Ipak se dvije skupine lijekova posebno ističu kod ovih bolesnika, s obzirom na to da imaju određene specifične učinke na same aterosklerotske lezije te njihovu progresiju/regresiju, a to su statini i acetilsalicilna kiselina.
Statini (inhibitori HMG-CoA reduktaze) primarno i dominantno služe u liječenju hiperkolesterolemije te samim snižavanjem vrijednosti LDL kolesterola imaju povoljan utjecaj na smanjenje razvoja aterosklerotskih plakova. Naknadno je dokazana i njihova korist u prevenciji endotelne disfunkcije, kao i inhibitorna aktivnost imunoloških reakcija i posljedične upale - glavnih komponenata nestabilnoga plaka, čime se tumači njihova uloga u stabilizaciji aterosklerotskih plakova.
Acetilsalicilna kiselina također je jedan od lijekova čija primjena ima značajan utjecaj na klinički tijek bolesnika koji imaju izražene aterosklerotske promjene. Osim što djeluje na upalnu komponentu bolesti, a time i njezinu stabilnost, taj lijek inhibira agregaciju trombocita nepovoljno djelujući na stvaranje poroagregatornih prostaglandina i time smanjuje rizik od fatalnih posljedica u slučaju rupture ili fisure plaka (smanjuju mogućnost nastanka potpune okluzije). Primjena toga lijeka u primarnoj prevenciji koronarne bolesti dokazano smanjuje rizik od razvoja akutnoga infarkta miokarda.
DEFINICIJA, TERMINOLOGIJA I KLINIČKA PODJELA KORONARNE BOLESTI
Koronarna bolest označava skupinu kliničkih entiteta koji nastaju kao posljedica neravnoteže između potrebe i ponude krvi i kisika u miokardu, što u konačnici rezultira njegovom ishemijom. Koronarna bolest srca jedan je od vodećih uzroka mortaliteta i invaliditeta u zemljama širom svijeta, pa tako i u Hrvatskoj. Ona obuhvaća širok spektar kliničkih entiteta čija se podjela dijelom zasniva na etiopatogenezi (okluzivna i neokluzivna koronarna bolest), a dijelom na kliničkoj slici i kliničkom tijeku (kronična stabilna koronarna bolest i akutni koronarni sindrom), što je i shematski prikazano na Slici 1.65.
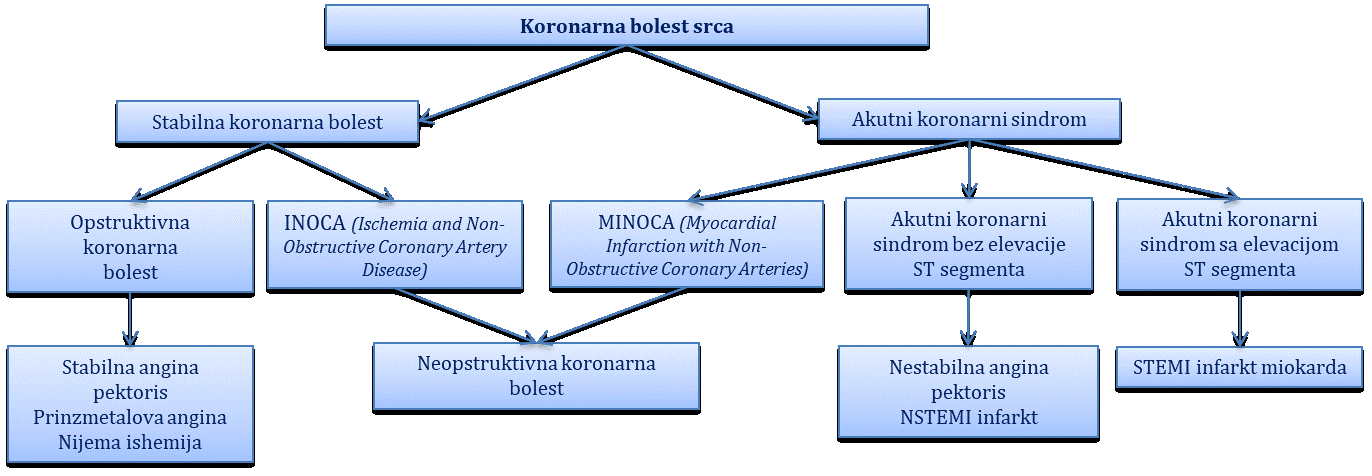
Slika 1.65. Shematski prikaz podjele koronarne bolesti srca.
S obzirom na to da je ishemija miokarda glavno obilježje koronarne bolesti i da ona može dovesti do razvoja infarkta, potrebno je poznavati kliničke kriterije koji ga obilježavaju i na temelju kojih je moguće postaviti dijagnozu akutnoga infarkta miokarda.
Univerzalna definicija infarkta miokarda. Prema četvrtoj revidiranoj univerzalnoj definiciji iz 2018. godine, infarkt miokarda definira se kao prisutnost ozljede miokarda koju karakterizira povišena razina kardioselektivnih enzima (troponina), u kliničkim uvjetima koji ukazuju na ishemiju, i obuhvaćaju bar jedan od navedenih kriterija:
1) klinička simptomatologija ishemije (stenokardija ili njezin ekvivalent);
2) novonastale promjene u elektrokardiogramu (elevacija ili depresija ST-segmenta, negativni, bifazični ili terminalno pozitivni T-valovi);
3) pojava patoloških Q-zubaca u elektrokardiogramu;
4) slikovnim metodama dokazan gubitak vijabilnoga miokarda ili novonastali ispadi regionalne kontraktilnosti; te
5) koronarografijom ili autopsijom dokazana aterosklerotska koronarna bolest.
Ozljeda miokarda. Prema univerzalnoj definiciji infarkta miokarda nastoji se što jasnije razgraničiti pojam ozljede miokarda (engl. myocardial injury), koji se može naći u okviru različitih bolesti i stanja, od termina infarkta miokarda povezanoga s koronarnom bolešću. Ozljeda miokarda definira se porastom kardioselektivnih enzima, prvenstveno troponina, za najmanje jednu vrijednost iznad 99. percentile gornje referentne vrijednosti, i ukazuje na ozljedu miokarda bilo koje etiologije. Ako se radi o stabilno povišenim vrijednostima, govorimo o kroničnoj ozljedi miokarda, a ako se prati dinamika povišenih troponina (rast/pad), govorimo o akutnoj ozljedi miokarda ili akutnom infarktu miokarda ovisno o prisutnosti kliničkih kriterija za ishemiju miokarda (Slika 1.66.).
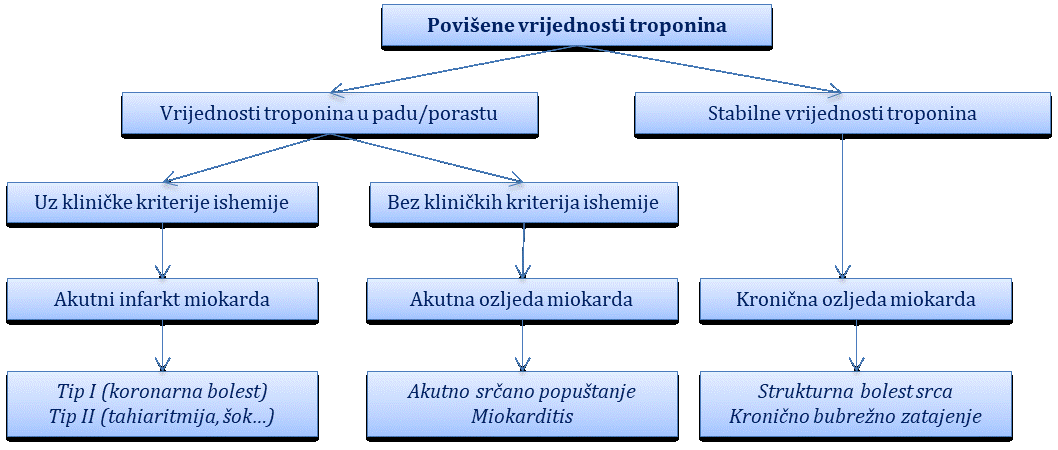
Slika 1.66. Shematski prikaz odnosa ozljede i infarkta miokarda.
Prema tome, povišene vrijednosti troponina ne sugeriraju nužno da se radi o akutnom infarktu miokarda, već imaju puno širu diferencijalno-dijagnostičku sliku i interpretaciju treba stvoriti sukladno kliničkoj slici i prilikama. Diferencijalna dijagnoza povišenih vrijednosti troponina uključuje sljedeće bolesti i stanja:
1) akutno koronarno zbivanje uvjetovano aterosklerotskom bolesti koronarnih arterija s rupturom plaka i superponiranom tombozom;
2) oštećenje miokarda uslijed neravnoteže između potrebe za kisikom i njegove ponude zbog tahiaritmije, bradiaritmije, disekcije aorte, hipertrofijske kardiomiopatije, krvotočnoga urušaja - šoka, teške respiratorne insuficijencije, teške anemije, hipertenzivne krize, spazma koronarnih arterija, vaskulitisa ili disekcije koronarnih arterija;
3) oštećenje miokarda u odsutnosti ishemije zbog kontuzije srca, operacija i intervencija na srcu, rabdomiolize koja uključuje miokard, miokarditisa, kardiotoksičnoga učinka lijekova i kemikalija te
4) multifaktorsko ili neodređeno oštećenje miokarda zbog srčanoga popuštanja, teške plućne embolije, plućne hipertenzije, sepse, bubrežne insuficijencije, akutnoga neurološkog oboljenja, infiltrativne bolesti miokarda ili teškoga fizičkog napora.
Podjela infarkta miokarda. Prema navedenoj univerzalnoj definiciji infarkta miokarda, razlikujemo šest tipova, ovisno o patofiziološkim, patološkim i kliničkim pokazateljima.
Infarkt miokarda tip I (spontani infarkt miokarda) nastaje kao posljedica nestabilnosti aterosklerotskoga plaka unutar koronarne arterije praćene razvojem rupture plaka, erozije ili fisure te superponirane tromboze koja zahvaća jednu ili više koronarnih arterija (akutni koronarni sindrom).
Infarkt miokarda tip II (sekundarni infarkt miokarda uslijed ishemijske neravnoteže) označava razvoj nekroze miokarda koja nije povezana s koronarnom bolesti, nego nastaje kao posljedica neravnoteže između potrebe za kisikom i njegove ponude u miokardu u određenom trenutku. Najčešći uzroci nabrojani su u diferencijalnoj dijagnozi povišenih vrijednosti troponina.
Infarkt miokarda tip III (infarkt miokarda koji dovodi do smrtnoga ishoda) označava srčanu smrt kojoj su prethodili simptomi i/ili elektrokardiografski kriteriji ishemije miokarda, a koja je nastupila prije uzorkovanja krvi (bez potvrde povišenih kardioselektivnih enzima).
Infarkt miokarda tip IVa (infarkt miokarda u vezi s perkutanom koronarnom intervencijom) infarkt je čiji se razvoj povezuje s perkutanom koronarnom intervencijom, a definira se sljedećim kriterijima: 1) porast vrijednosti troponina za više od pet puta u odnosu na gornje referentne vrijednosti ako su početne vrijednosti bile uredne, ili porast vrijednosti troponina za više od 20 % u odnosu na početne vrijednosti ako su one bile patološke te 2) prisutnost jednoga od navedenih drugih kriterija: simptomi ishemije miokarda, novonastale ishemijske promjene na elektrokardiogramu, angiografski gubitak otvorenosti koronarne arterije ili neka druga komplikacija (usporeni protok, no-reflow fenomen, distalna emobolizacija), slikovni dokaz novonastaloga gubitka vijabilnoga miokarda ili novonastali poremećaj regionalne kontraktilnosti.
Infarkt miokarda tip IV b (infarkt miokarda u vezi s trombozom stenta) je infarkt koji se razvija uslijed tromboze u stentu (engl. in stent thrombosis), a dokazuje se koronarografijom ili autopsijom.
Infarkt tip V (infarkt u vezi s kardiokirurškim premoštenjem, CABG) infarkt je miokarda čiji se razvoj povezuje s kardiokirurškim zahvatom, a njegova se dijagnoza temelji na sljedećim kriterijima: 1) povišenje vrijednosti troponina za više od deset puta od gornjih referentnih vrijednosti kod bolesnika s normalnim početnim vrijednostima te 2) prisutnost nekoga od drugih navedenih kriterija: novonastali patološki Q-zupci ili blok lijeve grane, angiografski dokazana okluzija presatka ili nativne koronarne arterije, slikovni dokaz novonastaloga gubitka vijabilnoga miokarda ili novonastali poremećaj regionalne kontraktilnosti.
STABILNA KORONARNA BOLEST (STABILNA ANGINA PEKTORIS)
Definicija. Stabilna koronarna bolest podrazumijeva tranzitornu (prolaznu) ishemiju miokarada koja se javlja kao posljedica reverzibilnoga nesklada između opskrbe i potrebe miokarda za krvi i kisikom, što je potencirano tjelesnim naporom, emocionalnim ili drugim stresom, a iznimno se može javiti i u mirovanju. Glavna klinička manifestacija stabilne koronarne bolesti je stenokardija koja se javlja pri naporu ili stresu, a prestaje u mirovanju (stabilna angina pektoris), ali se može prezentirati i atipičnim simptomima (atipična angina) ili može biti asimptomatska (nijema ishemija miokarda).
Epidemiologija. Stvarnu prevalenciju stabilne koronarne bolesti teško je procijeniti, ali smatra se da od nje boluje 1 do 4 % opće populacije. Učestalost stabilne koronarne bolesti povećava se s dobi kod oba spola, a karakteristično je ona učestalija kod žena srednje životne dobi, dok je u starijoj životnoj dobi učestalija kod muškaraca. Činjenica je da se javlja smanjenje stope smrtnosti od ove skupine bolesti uz jednak trend obolijevanja, što upućuje na bolje i uspješnije liječenje i osigurava bolju prognozu ovim bolesnicima.
Etiopatogeneza. Osnovno etiopatogenetsko obilježje stabilne koronarne bolesti prolazna je ishemija miokarda koja nastaje uslijed nesklada između opskrbe i potrebe miokarda za krvi i kisikom, što se može dogoditi uslijed anatomskih i/ili funkcionalnih promjena na koronarnim arterijama. Kao i u ostalim oblicima koronarne bolesti srca, glavnu ulogu ima ateroskleroza koronarnih arterija povezana s anatomskim i funkcionalnim promjenama koje uvjetuju ovo stanje. Današnja saznanja uključuju i druge mehanizme kojima se tumači nastanak stabilne koronarne bolesti, osobito kod bolesnika s naizgled urednim koronarografskim nalazom.
Anatomske promjene koronarnih arterija koje dovode do dinamičkih suženja koja onemogućuju normalan protok krvi nisu ograničene samo na velike, epikardijalne koronarne arterije, nego one mogu biti distribuirane i po njezinim ograncima unutar miokarda, što se ne može prikazati slikovnim metodama (tzv. mikrovaskularna angina). Najčešći uzrok anatomskih promjena koronarnih arterija je ateroskleroza koja sužava lumen koronarnih arterija i tako smanjuje krvni protok do razine na kojoj je on dostatan za normalnu opskrbu miokarda u stanju mirovanja, ali kod pojave povećane potrebe za krvlju i kisikom (napor, stres) takve koronarne arterije postaju insuficijentne u osiguravanju dostatne perfuzije te se posljedično razvija ishemija. Osim ateroskleroze, kao glavnoga uzroka stabilne koronarne bolesti, i neka druga stanja mogu biti uzrokom stenoza koronarnih arterija i dovesti do istih ishoda (kongenitalne anomalije, mikrovaskularna remodelacija posljedično hipertrofiji miokada i sl.).
Funkcionalne promjene koronarnih arterija nastaju uslijed endotelne disfunkcije epikardnih arterija i/ili mikrovaskulature miokarda, a očituju se kroz dva temeljna poremećaja: pojačana vazokonstrikcija te oslabljena vazodilatacija. Ovi poremećaji samostalno, ili češće u kombinaciji s patoanatomski promijenjenim krvnim žilama, doprinose razvoju ishemije miokarda. Dosadašnja istraživanja upućuju na promjene koje su vrlo vjerojatno posljedica poremećaja utjecaja različitih kemijskih supstanci na sam endotel, zbog rezistencije endotela na učinak vazodilatatornih tvari kao što su dušični oksid, adenozin i prostaciklin, ili pojačan odgovor endotela na vazokonstrikcijske tvari kao što je endotelin-1. Čimbenici koji pogoduju nastanku endotelne disfunkcije su brojni (fizikalni, kemijski, imunološki), a objašnjeni su u patogenezi ateroskleroze.
Bez obzira na prethodno opisan uzrok, posljedično dolazi do razvoja hipoperfuzije u području miokarda koji krvlju opskrbljuje zahvaćena arterija, a uslijed hipoperfuzije razvija se ishemija te metabolizam kardiomiocita prelazi s aerobnoga na anaerobni. Stvaranjem energije u anaerobnom metabolizmu nastaje mliječna kiselina koja zajedno s drugim supstancama, kao što je adenozin, stimulira nociceptore i dovodi do razvoja osjeta bola. Također, u ishemijom zahvaćenom području miokarda razvija se sistolička i dijastolička disfunkcija što rezultira regionalnim ispadom kontraktilnosti, tzv. hipokinezom. Sve navedene promjene su reverzibilne i nakon uspostave dostatne perfuzije putem mirovanja ili primjene nitroglicerina, one se povlače.
Čimbenici koji utječu na razvoj ishemije kod bolesnika sa stabilnom koronarnom bolesti navedeni su u Tablici 1.36., a razlikujemo one koji povećavaju potrebe miokarda za kisikom (engl. demand angina) od onih koji smanjuju opskrbu miokarda kisikom (engl. supply angina).
|
Tablica 1.36. Čimbenici koji utječu na razvoj ishemije u stabilnoj koronarnoj bolesti
|
|
Čimbenici koji povećavaju potrebe miokarda za kisikom, tzv. „demand angina“
|
Čimbenici koji smanjuju opskrbu miokarda kisikom, tzv. „supply angina“
|
|
Srčana frekvencija
Arterijski krvni tlak
Kontraktilnost miokarda
Hipertrofija lijevoga ventrikula
|
Trajanje dijastole
Tlak koronarne perfuzije
Vaskularni tonus koronarnih arterija
Oksigenacija (hemoglobin i saturacija kisikom)
|
Klinička slika. Glavno kliničko obilježje stabilne koronarne bolesti je stabilna angina pektoris, a može se očitovati i kao atipična angina i nijema ishemija miokarda.
Stabilna angina pektoris očituje se tipičnim bolom u prsima koji nazivamo stenokardijom, a definiraju ga četiri odrednice: karakter, lokalizacija, provokacija i trajanje. Bolesnici opisuju bol kao osjećaj pritiska, stezanja ili težine u prsima što je obično praćeno tjeskobom i strahom. Rjeđe bol opisuju kao žarenje ili pečenje ili kao neodređenu nelagodu u prsima (opresije). Tegobe se lokaliziraju u sredoprsju, retrosternalno, a česta je i pojava širenja i to najčešće prema lijevoj strani vrata, ramena i ruke, dok je širenje prema desnoj strani, vratu i donjoj čeljusti ili prema epigastriju nešto rjeđa pojava. Stenokardija je najčešće provocirana fizičkim naporom, emocionalnim stresom, izlaganjem hladnoći ili konzumiranjem obilnoga obroka. U stabilnoj koronarnoj bolesti pojava stenokardije u mirovanju je rijetka pojava, a najčešće se javlja u okviru Prinzmentalove angine (vidi kasnije). Pojava stenokardija u mirovanju ili tijekom noći kod ovih bolesnika ukazuje na prijelaz iz stabilne u nestabilnu koronarnu bolest, odnosno razvoj akutnoga koronarnog sindroma. Tegobe pri stabilnoj angini pektoris traju kratko, obično do deset minuta i smiruju se prekidom provokacijskoga čimbenika, mirovanjem ili primjenom nitroglicerina. Bol koji traje dulje od dvadeset minuta, ne popušta u mirovanju ili nakon ponovljene primjene nitroglicerina, upućuje na akutni koronarni sindrom. U razlikovanju bolova u prsima treba napomenuti da stenokardija u tipičnim slučajevima nije povezana s pokretima, promjenama položaja tijela, kašljanjem i disanjem (dubokim udahom). Pri stupnjevanju težine angine pektoris koristi se klasifikacija Kanadskog kardiovaskularnog društva koja uključuje sve spektre angine pektoris od stabilne do nestabilne (Tablica 1.37.).
|
Tablica 1.37. Kanadska klasifikacija angine pektoris
|
|
Stupanj
|
Anamneza
|
|
Prvi razred
|
Bez ograničenja svakodnevnih fizičkih aktivnosti.
Tegobe su prisutne pri jakom, brzom ili dugotrajnom opterećenju.
|
|
Drugi razred
|
Lagano ograničenje svakodnevnih fizičkih aktivnosti i ranojutarnji simptomi.
Tegobe su prisutne pri brzom hodu, penjanju uzbrdo, pri izlaganju hladnoći, nakon obroka.
|
|
Treći razred
|
Značajno ograničenje svakodnevnih fizičkih aktivnosti
Tegobe su prisutne već pri laganom hodu nakon 100 m ili nakon penjanja na 1. kat normalnom brzinom.
|
|
Četvrti razred
|
Potpuno ograničenje svakodnevnih fizičkih aktivnosti.
Tegobe prisutne i pri najmanjem naporu ili u mirovanju.
|
Atipična angina naziv je za kliničku prezentaciju stabilne koronarne bolesti pri kojoj se nastala ishemija miokarda klinički ne prezentira ranije opisanom stenokardijom, nego kliničkom slikom dominiraju neki drugi, atipični znakovi, zbog čega je često dijagnoza stabilne koronarne bolesti kod takvih bolesnika otežana. Takve simptome i znakove nazivamo ekvivalentima angine, a oni uključuju dispneju, nespecifičan umor, intoleranciju napora, gastrične smetnje (dispepsiju) ili vrtoglavicu.
Nijema ishemija miokarda podrazumijeva asimptomatsko kliničko očitovanje kod bolesnika koji imaju jasne i objektivne znakove stabilne koronarne bolesti (npr. elektrokardiografske promjene u naporu, pozitivnu stres scintigrafiju miokarda i sl.). To se može vidjeti kod bolesnika s visokim pragom podražljivosti za osjet bola, kod bolesnika s autonomnom neuropatijom (npr. bolesnika sa šećernom bolesti) ili kod psihološkog aprikrivanja boli.
Inicijalna dijagnostička obrada. Osnovnu dijagnostičku obradu bolesnika kod kojih se sumnja na stabilnu koronarnu bolest čini elektrokardiogram u mirovanju, laboratorijska dijagnostika, ehokardiografija te rendgenogram srca i pluća.
EKG u mirovanju osnovna je dijagnostička metoda kod sumnje na koronarnu bolest. Kod bolesnika sa stabilnom koronarnom bolesti elektrokardiografske promjene specifične za ishemiju miokarda su promjene ST-T segmenta s horizontalnom ili sporosilaznom depresijom ST-segmenta, aplaniranim ili negativnim T-valovima. Takve se promjene nalaze kod tek polovice bolesnika koji imaju simptome. Kod interpretacije elektrokardiograma ovakvih bolesnika bitno je potražiti moguće patološke Q-zubce koji upućuju na preboljeni infarkt miokarda, a često se viđaju i drugi patološki nalazi, kao što su znakovi hipertrofije ventrikula, blok lijeve ili desne grane, nespecifični poremećaji provođenja ili ventrikularni poremećaji srčanoga ritma.
Laboratorijska dijagnostika. Standardna laboratorijska obrada bolesnika sa sumnjom na stabilnu koronarnu bolest uključuje sljedeće analize: 1) kompletna krvna slika, 2) lipidogram (ukupni kolesterol, LDL kolesterol, HDL kolesterol, trigliceridi), 3) određivanje glukoze u plazmi i glikoziliranoga HbA1c hemoglobina, 4) određivanje vrijednosti kreatinina i glomerularne filtracije, 5) određivanje vrijednosti hormona štitne žlijezde (tireotropni hormon, trijodtironin, tiroksin), 6) određivanje vrijednosti kreatinin kinaze i jetrenih enzima obvezno je prije uvođenja statina u terapiju te 7) određivanje NT-proBNP-a kod sumnje na sindrom srčanoga popuštanja. Određivanje vrijednosti kardioselektivnih enzima provodi se u hitnoj službi kod sumnje na akutni koronarni sindrom (engl. „rule-out algoritam“).
Rendgenogram srca i pluća rutinski se snima svim bolesnicima prvenstveno radi isključenja eventualnih dodatnih ekstrakardijalnih komorbiditeta. Kardiomegalija, zastojni hilusi i plućna kongestija mogu upućivati na razvijenu ishemijsku kardiomiopatiju i srčano popuštanje.
Ehokardiografija je indicirana za sve bolesnike sa simptomima stabilne koronarne bolesti. Glavni ciljevi ehokardiografije kod tih su bolesnika: 1) otkrivanje regionalnoga poremećaja kontraktilnosti miokarda u vidu hipokineze ili akineze kao najkarakterističnijega ehokardiografskog znaka koronarne bolesti; 2) određivanje sistoličke i dijastoličke funkcije srca s obzirom na to da snižena istisna frakcija kod ovih bolesnika predstavlja iznimno nepovoljan prognostički znak te 3) isključenje drugih potencijalnih uzroka navedenih simptoma, kao što su hipertrofijska kardiomiopatija, aortna stenoza i drugo. U slučaju da se ne može provesti primjereno ehokardiografsko snimanje zbog tehničkih razloga, indicirana je magnentna rezonanca srca koja može pružiti potrebne informacije koje nisu dobivene ehokardiografski i njome se također može procijeniti morfologiju srčanih struktura i funkciju ventrikula.
Holter 24-satno snimanje EKG-a korisno je u otkrivanju spomenutih prolaznih elektrokardiografskih ishemijskih promjena i utvrđivanju njihove povezanosti s postojećim simptomima te u registriranju poremećaja srčanoga ritma te se na taj način zaokružuje sveukupna progostička ozbiljnost stanja bolesnika.
Ako na temelju navedene obrade nije postignuta dovoljna razina sigurnosti u dijagnozu stabilne koronarne bolesti, preporuča se provesti proširenu dijagnostičku obradu (vidi dalje). Postoji li velika sigurnost da se radi o koronarnoj bolesti stabilnoga tipa, indicira se invazivna kardiološka obrada, odnosno koronarografija kojom se potvrđuju dijagnoze i lociraju promjene na koronarnim arterijama.
Proširena dijagnostička obrada sastoji se od različitih neinvazivnih slikovnih radioloških ili nuklearno-medicinskih dijagnostičkih postupaka kojima se dokazuje postojanje ishemije miokarda, pa se većina ovih pretraga izvodi pod opterećenjem. Najčešće metode proširene dijagnostičke obrade su: ergometrija, ehokardiografija u opterećenju, magnetna rezonanca srca u opterećenju, perfuzijska scintigrafija miokarda i kompjuterizirana tomografija.
Ergometrija predstavlja dijagnostičku pretragu pri kojoj se prati elektrokardiogram bolesnika podvrgnutoga fizičkom naporu na pokretnoj traci ili sobnom biciklu. Njome se u strogo kontroliranim uvjetima fizičkim opterećenjem postupno povećava srčana frekvencija i potrošnja kisika i otkrivaju znakovi ishemije, te potvrđuje postojanje koronarne bolesti i određuje prag pojave kako ishemijskih promjena tako i stenokardija, s obzirom na intenzitet opterećenja. U provođenju testa najčešće se koristi Bruceov protokol pri kojemu se bolesnik postupno izlaže sve jačem opterećenju do postizanja ciljne srčane frekvencije, odnosno do postizanja maksimalne potrošnje kisika. Test se prekida kada se kod bolesnika izazovu simptomi i/ili elektrokardiografski znakovi ishemije. Važni su i indirektni podaci o pojavi prognostički značajnih aritmija ili značajnoga pada arterijskoga krvnog tlaka tijekom opterećenja, što upućuje na ozbiljnost bolesti. Ostala ograničenja i kontraindikacije opisane su u poglavlju o dijagnostičkim postupcima u kardiologiji.
Ehokardiografija u opterećenju ili stres-ehokardiografija podrazumijeva izvođenje ehokardiografije nakon što se bolesnik izloži opterećenju, bilo fizičkom ili medikamentnom s dobutaminom, čime se mogu izazvati regionalni poremećaji kontraktilnosti koji upućuju na regionalnu ishemiju i prisutnost koronarne bolesti. Dodavanjem danas dostupnih kontrastnih sredstava za vrijeme stres-ehokardiografije postiže se bolja vizualizacija i preciznija evaluacija.
Magnetna rezonanca srca u opterećenju podrazumijeva snimanje MR-a srca nakon farmakološkoga opterećenja dobutaminom, daje informacije kao i stres-ehokardiografija, i sastoji se od otkrivanja pojave regionalnih poremećaja kontraktiliteta miokarda. Ova se pretraga najčešće koristi kod bolesnika kod kojih se ehokardiografijom ne može postići vizualizacija prikladna za procjenu. Dodatnom primjenom gadolinija moguća je markacija ožiljka unutar miokarda kao znaka ranije preboljenoga infarkta miokarda.
Perfuzijska scintigrafija miokarda temelji se na primjeni radiofarmaka i slikovnom prikazu njihove raspodjele u miokardu lijeve klijetke metodom planarne scintigrafije gama kamerom ili jednofotonske emisijske kompjuterizirane tomografije (SPECT). Pretraga se izvodi nakon opterećenja bolesnika što se postiže fizičkom aktivnosti ili primjenom lijekova (dobutamin, adenozin). Pretraga omogućava i procjenu vijabilnosti miokarda u području prikazanoga ispada perfuzije.
MSCT-koronarografija omogućava neinvazivnu analizu patoanatomskih promjena na koronarnim arterijama. Ona uključuje i procjenu stupnja kalcifikacija na koronarnim arterijama koje su snažno povezane s koronarnom aterosklerozom.
Ako se navedenim pretragama postavi sumnja na koronarnu bolest, jednako kao i kod bolesnika kojima se sumnja postavi na temelju inicijalne dijagnostičke obrade, potrebna je invazivna kardiološka obrada, odnosno koronarografija.
Invazivna kardiološka obrada zlatni je standard u dijagnostici koronarne bolesti, iako nije uvijek nužna za potvrđivanje dijagnoze stabilne koronarne bolesti. Koronarografija je indicirana kod svih bolesnika sa simptomima koji se ne povlače unatoč optimalnoj medikamentnoj terapiji, kao i kod bolesnika kod kojih je provedena proširena dijagnostička obrada čiji rezultati ukazuju na visoku vjerojatnost teške koronarne bolesti temeljenu na stratificiranju rizika, prema Tablici 1.38.
|
Tablica 1.38. Stratifikacija rizika kod bolesnika sa stabilnom koronarnom bolesti
|
|
Visoki rizik
(godišnja stopa mortaliteta > 3 %)
|
Srednji rizik
(godišnja stopa mortaliteta 1 – 3 %)
|
Niski rizik
(godišnja stopa mortaliteta < 1 %)
|
|
Duke ergometrijski skor ≤ 11
Istisna frakcija < 35 %
Zona ishemije > 10 % (slikovnim metodama)
Proširena ishemija na stres-ehokardiografiji
|
Duke ergometrijski skor 11 do 5
Istisna frakcija 35 – 49 %
Zona ishemije 1 – 9 % (slikovnim metodama)
Umjerena ishemija na stres-ehokardiografiji
|
Duke ergometrijski skor ≥ 5
Istisna frakcija > 50 %
Uredne slikovne metode
Uredna stres-ehokardiografija
|
|
Apsolutno indicirana invazivna kardiološka obrada
|
Invazivnu kardiološku obradu treba razmotriti (komorbiditeti).
|
Invazivna kardiološka obrada nije indicirana.
|
Koronarografija se temelji na unošenju kontrastnoga sredstva izravno u lijevu ili desnu koronarnu arteriju kroz kateter uveden preko femoralne ili radijalne arterije, što omogućava analizu njihova lumena i pronalaska stenoza. Kod 80 % bolesnika podvrgnutih koronarografiji otkrije se odgovarajuća lezija koja se nađe u jednoj ili više koronarnih arterija. Kod 25 % bolesnika radi se o jednožilnoj, 25 % bolesnika dvožilnoj, i kod 25 % bolesnika trožilnoj koronarnoj bolesti. U 5 % slučajeva se radi o zahvaćanju debla lijeve koronarne arterije. Kod ostalih 20 % bolesnika prikazane epikardne koronarne arterije su uredne i bez stenoza. Tada govorimo o neokluzivnoj koronarnoj bolesti. Na temelju nalaza koronarografije donosi se i konačna odluka o strategiji liječenja optimalnom medikamentnom terapijom ili revaskularizacijom miokarda, bilo putem interventnih tehnika, bilo kirurškim putem.
Opće terapijske mjere u liječenju bolesnika sa stabilnom koronarnom bolesti uključuju: 1) edukaciju bolesnika, 2) smanjenje ili uklanjanje čimbenika rizika, 3) liječenje bolesti/stanja koja mogu pogoršati koronarnu bolest te 4) prilagođavanje tjelesne aktivnosti stanju oboljeloga. Edukacija bolesnika uključuje objašnjenje njegovoga stanja, prirode bolesti, mogućih načina liječenja, kao i važnosti pridržavanja uputa liječnika. Isplanirani program rehabilitacije treba biti poticajan u smislu potrebe za snižavanjem tjelesne mase, povećanjem tjelesne aktivnosti u skladu s bolesti i otklanjanju drugih čimbenika rizika. Dobra psihološka priprema bolesnika preduvjet je uspješne terapije. Smanjenje ili uklanjanje čimbenika rizika uključuje prestanak pušenja, ograničenje unosa alkohola na 20 g/dan za muškarce i 10 g/dan za žene, neslanu i nemasnu ishranu, kao i liječenje hiperlipidemije, arterijske hipertenzije i šećerne bolesti. Utjecajem na navedene čimbenike rizika smanjuje se progresija koronarne ateroskleroze, a time i napredovanje stabilne koronarne bolesti. Kod svih je bolesnika potrebno na odgovarajući način liječiti i kontrolirati bolesti i stanja koja mogu pogoršati koronarnu bolest, kao što su anemija, kronična plućna bolest, hipertireoza i druge. Bolesnici koji imaju stabilnu koronarnu bolest trebaju prilagoditi tjelesnu aktivnost svome stanju i mogućnosti. Preporuča se izbjegavanje težih fizičkih napora, ali se preporuča provođenje aerobnih vježbi i to u minimalnom trajanju od 30 minuta, bar tri puta tjedno. Kontrolom rizičnih čimbenika nastoji se postići sljedeće ciljne vrijednosti: LDL kolesterol < 1,4 mmol/L, krvni tlak < 130/85 mmHg te HbA1c hemoglobin < 7,0 %.
Konzervativno liječenje stabilne koronarne bolesti. U liječenju stabilne koronarne bolesti koriste se lijekovi koje možemo svrstati u dvije skupine: antiishemijski lijekovi te lijekovi koji utječu na tijek bolesti, tj. preveniraju neželjene događaje (akutni infarkt, srčano popuštanje, smrtnost) – Tablica 1.39. Shematski prikaz strategije konzervativnog liječenja stabilne koronarne bolesti prikazan je na Slici 1.67.
|
Tablica 1.39. Lijekovi za liječenje stabilne koronarne bolesti
|
|
Antiishemijski lijekovi
|
Lijekovi koji utječu na tijek bolesti
|
|
Nitrati kratkog i dugog djelovanja
Beta blokatori
Blokatori kalcijskih kanala
Ivabradin
Ostali, rjeđe korišteni
|
Antitrombocitni lijekovi
Hipolipemici (statini)
ACE inhibitori ili blokatori AT-receptora
Antagonisti aldosterona
|
Antiishemijski lijekovi. U ovo skupinu ubrajamo beta blokatore, nitrate, blokatore kalcijskih kanala, ivabradin i druge, rjeđe korištene lijekove.
Beta blokatori predstavljaju glavne antiishemijske lijekove korištene za liječenje stabilne koronarne bolesti (lijekovi prvoga izbora). Oni svoj učinak ostvaruju blokiranjem simpatičkih učinaka na srce, što se očituje smanjenjem srčane frekvencije i kontraktilnosti, čime se smanjuju potrebe miokarda za krvi i kisikom. Osim toga, usporavanjem atrioventrikularnoga provođenja produljava se vrijeme dijastole što osigurava bolju perfuziju miokarda, s obzirom na to da se protok krvi kroz koronarne arterije odvija samo u fazi dijastole. Također, beta blokatori poboljšavaju kliničke ishode bolesnika s koronarnom bolesti smanjujući incidenciju fatalnih događa kao što su infarkt miokarda i nagla srčana smrt, iako je to dokazano samo u studijama na bolesnicima nakon preboljenoga infarkta miokarda, dok ne postoje podaci koji se odnose na bolesnike sa stabilnom koronarnom bolesti. Najčešće korišteni beta blokatori u ovoj indikaciji su oni s dominantnim učinkom na β1-receptore, kao što su metoprolol (2 x 50 – 200 mg/dan), bisoprolol (1 x 5 – 20 mg/dan), atenolol (1 x 50 – 200 mg/dan), nebivolol (1 x 5 mg/dan) te karvediol (dvaput po 2,5 – 25 mg/dan). Nebivolol i bisoprolol se djelomično izlučuju putem bubrega, stoga se izbjegava njihova primjena prilikom bubrežnoga oštećenja. Relativne kontraindikacije za primjenu beta blokatora su opstruktivne bolesti pluća (kronična opstruktivna plućna bolest, bronhalna astma) i dekompenzirana faza srčanoga popuštanja, dok je njihova primjena kod bradiaritmija apsolutno kontraindicirana.
Nitrati se u kliničkoj praksi nalaze među najčešće korištenim antiishemijskim lijekovima, a primarno se koriste za ublažavanje simptoma stenokardije. Učinak ostvaruju u samim glatkomišićnim stanicama u kojima se metaboliziraju u dušični oksid, jedan od najpotentnijih vazodilatatora. Vazodilatacijom koronarnih arterija poboljšava se koronarna perfuzija, a sistemska venodilatacija smanjuje srčano predopterećenje, a time i tlak lijevoga ventrikula na kraju dijastole, zbog čega se smanjuje pritisak na subendotelni miokard i poboljšava protok krvi kroz njega. Razlikuju se nitrati kratkoga i dugog djelovanja.
Nitroglicerin je glavni predstavnik nitrata kratkoga djelovanja koji se primjenjuje sublingvalno kako bi ostvario brzi učinak, a koristi se za prekid stenokardije ili njegovu prevenciju primjenom lijeka prije fizičkoga opterećenja. Primjenjuje se u obliku spreja, a najčešće ga primjenjuju sami bolesnici koji su prošli edukaciju. Primjenjuje se u dozi od jednoga do dva potiska u kojima je 0,3 do 0,6 mg lijeka, a prema potrebi se primjena može ponoviti za 5 do 10 minuta ako izostane pozitivan klinički učinak. Sublingvalni izosobit-dinitrat u dozi od 2,5 do 5 mg rjeđe se koristi u odnosu na nitroglicerin.
Nitrati dugoga djelovanja primjenjuju se peroralno ili topički u obliku masti, paste, transdermalnih flastera, a osiguravaju dugotrajniji vazodilatacijski učinak te time sprečavaju razvoj anginoznih tegoba i poboljšavaju toleranciju napora. Najčešće primjenjivani su izosorbit-dinitrat u dozi od 3 x 10 – 40 mg/dan te izosorbit-mononitrat u dozi od dvaput po 10 – 40 mg/dan ili jednom po 60 - 120 mg ako se radi o sporo otpuštajućim preparatima. Nitrati se obično dodaju kao dodatni antiishemijski lijekovi ako se uz beta blokator ili blokator kalcijskoga kanala ne može postići kontrola simptoma. Zbog izbjegavanja tolerancije i tahifilaksije pri primjeni ovih lijekova, preporuča se osiguravanje dnevnoga perioda od 8 do 12 sati bez nitrata, zbog čega se najčešće ordiniraju u dvije dnevne doze, u 8 i 16 sati.
Glavne nuspojave nitrata su vazodilatacijom izazvana glavobolja i crvenilo lica, arterijska hipotenzija i bradikardija. Radi mogućnosti nagloga pada tlaka i nesvjestice, bolesnicima se savjetuje da nitroglicerin primjenjuju samo u sjedećem položaju zbog mogućnosti pada i ozljeđivanja. Nitrati se ne smiju primjenjivati u kombinaciji s drugim vazodilatatorima, kao što su inhibitori fosfodiesteraze (sildenafil, vardenafil, tadalafil).
Blokatori kalcijskih kanala ostvaruju svoj antiishemijski učinak dovodeći do vazodilatacije i/ili smanjenja srčane frekvencije. Dihidropiridinski blokatori kalcijskih kanala primarno djeluju vazodilatatorno (amlodipin, felodipin), dok nedihidropiridinski (verpamil, diltiazem) primarno djeluju na srčanu frekvenciju. Iako su blokatori kalcijskih kanala podjednako učinkoviti u kontroli anginoznih smetnji kod ovih bolesnika kao i beta blokatori, ipak se ne koriste u prvoj liniji jer za razliku od beta blokatora nemaju dokazani učinak na tijek bolesti i prevenciju kardiovaskularnoga mortaliteta. Blokatore kalcijskih kanala u terapiju se uključuje kod bolesnika koji ne mogu uzimati beta blokatore ili kod bolesnika kod kojih se primjenom beta blokatora i nitrata ne može postići kontrola simptoma. Istodobna primjena beta blokatora i nedihidropridinskih blokatora kalcijskih kanala nije poželjna zbog opasnosti od razvoja poremećaja srčanoga provođenja. Od blokatora kalcijskih kanala pri ovoj se indikaciji najčešće koriste amlodipin (2,5 – 10 mg/dan), nikardipin (3 x 20 – 40 mg/dan), verapamil (3 x 80 – 160 mg) i diltiazem (3 x 30 – 90 mg/dan). Primjena ovih lijekova kontraindicirana je kod bolesnika s dokazanom sistoličkom disfunkcijom lijevoga ventrikula, a ako su neophodni, treba primjenjivati samo amlodipin.
Ivabradin je lijek čiji se antiishemijski učinak temelji primarno na snižavanju srčane frekvencije selektivnom i specifičnom inhibicijom If struje predvodnika srčanoga ritma, bez utjecaja na kontraktilnost i krvni tlak. Ivabradin se primjenjuje samostalno ili u kombinaciji s beta blokatorima, ako uz primjenu beta blokatora nije postignuta ciljna frekvencija. Primjenjuje se samo kod bolesnika sa sinusnim ritmom i srčanom frekvencijom većom od 70/min u početnoj dozi od dvaput po 2,5 mg do najviše doze od dvaput po 7,5 mg.
Ranolazin je antiishemijski lijek nepoznatog mehanizma djelovanja, koji dovodi do smanjenja intracelularne koncentracije kalcija i poboljšanja relaksacije miokarda te dijastoličkoga tonusa lijeve klijetke. Ranolazin dokazano poboljšava toleranciju napora i smanjuje anginozne napadaje kod bolesnika sa stabilnom koronarnom bolesti. Zbog mogućnosti produljenja QT-intervala ne smije se primjenjivati kod bolesnika s već produljenim QT-intervalom, niti s lijekovima koji ga produljuju. Primjenjuje se u dozi od dvaput po 750 mg/dan i siguran je kada se koristi s lijekovima za liječenje erektilne disfunkcije.
Ostali antiishemijski lijekovi. Nikorandil je derivat nikotinamida s dominantnim vazodilatacijskim učinkom na epikardne koronarne arterije posredovan stimulacijom ATP-osjetljivim kalijskim kanalima u glatkomišićnim stanicama. Koristi se u drugoj liniji liječenja zajedno s beta blokatorom ili blokatorom kalcijskih kanala. Smatra se da dugotrajna primjena ovoga lijeka može biti povezana sa stabilizacijom aterosklerotskih plakova. Trimetazidin je antiishemijski metabolički modulator koji sprečava smanjenje unutarstanične koncentracije ATP-a tijekom ishemije što osigurava uredan rad membranskih pumpi i transmembranski protok natrija i kalija za vrijeme ishemije. Primjenjuje se u dozi od dvaput po 35 mg/dan u kombinaciji s beta blokatorima u drugoj liniji liječenja stabilne koronarne bolesti. Lijek je kontraindiciran kod bolesnika s bolestima pokreta (parkinsonizam, esencijalni tremor). Dokazano je i da trimetazidin poboljšava vrijednosti HbA1c hemoglobina kod bolesnika sa šećernom bolesti.
Prema preporukama Europskoga kardiološkog društva u antiishemijskom liječenju stabilne koronarne bolesti u prvoj liniji liječenja indicirani su kratkodjelujući nitrati koji se koriste za prekid napada te beta blokatori, odnosno blokatori kalcijskih kanala (kada su beta blokatori kontraindicirani) za prevenciju anginoznih napadaja. U drugoj liniji liječenja preporuča se dodatna primjena dugodjelujućih nitrata ili ivabradina, nikorandila ili ranolazina uz ranije uvedene beta blokatore ili blokatore kalcijskih kanala, a u obzir dolazi i primjena trimetazidina. Kod bolesnika s vazospastičnom (Prinzmetalovom) anginom prednost se daje kombinaciji blokatora kalcijskih kanala i nitrata u odnosu na beta blokatore.
Lijekovi koji utječu na tijek bolesti jesu antitrombocitini lijekovi, hipolipemici (statini) te lijekovi s učinkom na sustav renin-angiotenzin.
Antitrombocitni lijekovi indicirani su kod svih bolesnika sa stabilnom koronarnom bolesti, bez obzira na strategiju liječenja (medikamentno, revaskularizacija). Kod bolesnika koji se primarno liječe optimalnom medikamentnom terapijom antiagregacijski lijekovi se primjenjuju s ciljem prevencije superponirane tromboze u slučaju rupture aterosklerotskoga plaka, a s tom su svrhom na raspolaganju acetilsalicilna kiselina u dnevnoj dozi od 75 – 100 mg kao lijek izbora i klopidogrel kao predstavnik P2Y12 inhibitora koji se primjenjuje u inicijalnoj dozi od 300 – 600 mg, nakon čega se nastavlja s jednom dnevnom dozom od 75 mg, i to samo ako je primjena acetilsalicline kiseline kontraindicirana. Primjena prasugela i tikagrelora pri ovoj indikaciji nije ispitivana (nema odgovarajućih studija), ali nije apsolutno kontraindicirana. Dvojna antitrombocitna terapija kod ove skupine bolesnika indicirana je kod osoba s visokim rizikom od ishemijskoga incidenta, uz mali rizik od pojave krvarenja (osobe kojima je slikovnim metodama dokazana ishemija ili koronarografski utvrđen trožilna koronarna bolest s proksimalnom stenozom, stenozom lijeve glavne ili proksimalne lijeve koronarne artrije). Drugu skupinu bolesnika sa stabilnom koronarnom bolesti čine bolesnici kod kojih je provedena interventna revaskularizacija miokarda s ugradnjom stenta, s obzirom na to da je kod njih uglavnom godinu dana nakon intervencijskoga zahvata indicirana dvojna antitrombocitna terapija koju čini kombinacija acetilsalicilne kiseline i P2Y12 inhibitora (obično klopidogrela koji se preferira kod bolesnika sa stabilnom koronarnom bolesti).
Hipolipemici. Statini dokazano smanjuju mortalitet i neželjene kardiovaskularne događaje kod bolesnika sa stabilnom koronarnom bolesti. Svako smanjenje vrijednosti LDL kolesterola od 1 % smanjuje rizik od neželjenih kardiovaskularnih bolesti za 2 do 3 %. Osim snižavanja vrijednosti kolesterola, statini ostvaruju i druge pozitivne učinke, kao što je stabilizacija aterosklerotskoga plaka. Primjena drugih hipolipemika ne rezultira navedenim sniženjem incidencije neželjenih kardiovaskularnih događaja. Ciljne vrijednosti LDL kolesterola kod ovih bolesnika su < 1,4 mmol/l, ili 50 %-tno smanjenje početnih vrijednosti LDL kolesterola kod bolesnika kod kojih se ne mogu postići navedene ciljne vrijednosti. Primjena fibrata opravdana je kod bolesnika s hipertrigliceridemijom.
Lijekovi s učinkom na renin angiotenzin sustav indicirani su kod bolesnika sa stabilnom koronarnom bolesti koji imaju pridruženu arterijsku hipertenziju, oštećenu sistoličku funkciju lijevoga ventrikula (EF < 40 %) te šećernu ili kroničnu bubrežnu bolest koja nije u završnim stadijima. Primjena ovih lijekova kod bolesnika s očuvanom sistoličkom funkcijom lijevoga ventrikula nije opravdana. U prvom redu primjenjuju se ACE inhibitori, a u slučaju nepodnošenja prelazi se na antagoniste angiotenzinskih receptora. Antagoniste aldosterona (spirinolakton, eplerenon) primjenjuje se samo kod bolesnika koji su imali neželjeni kardiovaskularni događaj (postinfarktnu anginu pektoris) te imaju istisnu frakciju manju od 40 %, šećernu bolest ili srčano popuštanje. Pozitivan učinak ovih lijekova ostvaruje se inhibicijom srčanoga remodeliranja nakon neželjenoga kardiovaskularnog događaja, tj. infarkta miokarda. Oprez je kod primjene ovih lijekova potreban kod bolesnika s bubrežnim oštećenjem zbog mogućnosti nastanka hiperkalijemije.
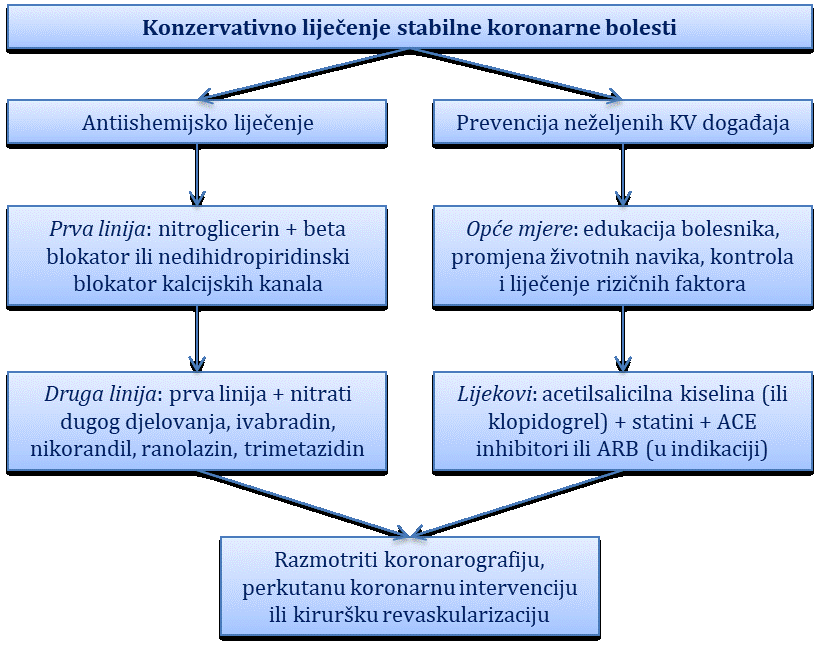
Slika 1.67. Shematski prikaz strategije konzervativnog liječenja stabilne koronarne bolesti.
.
Revaskularizacija miokarda kod bolesnika sa stabilnom koronarnom bolesti temelji se na nalazu koronarografije, a podrazumijeva perkutanu koronarnu intervenciju ili kardiokiruršku revaskularizaciju miokarda. Revaskularizacija miokarda kod bolesnika sa stabilnom koronarnom bolesti indicirana je u sljedećim situacijama: 1) perzistencija simptoma (anginozne tegobe) unatoč optimalnoj medikamentnoj terapiji; 2) stenoza glavne grane lijeve koronarne arterije veća od 50 % bez obzira na prisutnost ili odsutnost simptoma te 3) trožilna koronarna bolest uz istisnu frakciju manju od 50 % ili kod bolesnika koji su imali akutni infarkt miokarda. Revaskularizacija miokarda kod ovih bolesnika dokazano produžuje životni vijek, prevenira nastanak neželjenih kardiovaskularnih događaja, poboljšava zdravstveni status i kvalitetu života.
Izbor načina revaskularizacije miokarda (perkutana koronarna intrevencija ili kirurška revaskularizacija) ovisi o više čimbenika, među kojima su:
1) anatomski čimbenici (jednožilna ili višežilna koronarna bolest, zahvaćenost debla lijeve koronarne arterije, prisutnost kronične totalne okluzije koronarne arterije (CTO, od engl. chronic total occlusion), Syntax skor;
2) klinički čimbenici (dob bolesnika, šećerna bolest i drugi komorbiditeti, funkcija lijevoga ventrikula); 3) tehnički čimbenici (kompletna ili inkompletna revaskularizacija, stanje nakon kardiokirurške revaskularizacije, stanje nakon perkutane intervencije); te
3) lokalni čimbenici (dostupnost metode, educiranost i iskustvo operatera, želje bolesnika).
Načelno, perkutana koronarna intervencija izvodi se kod bolesnika s jednožilnom ili dvožilnom koronarnom bolesti uz povoljne anatomske uvjete, dok trožilna koronarna bolest i stenoza glavnoga debla lijeve koronarne arterije u pravilu zahtijevaju kiruršku revaskularizaciju, iako se ove odluke najčešće donose na temelju zaključka konzilija koji se sastoji od kardiologa i kardiokiruga (Slika 1.68.).
Perkutana koronarna intervencija (PCI) započinje postavljanjem uvodnice u femoralnu ili radijalnu arteriju, kroz koju se postavlja žica vodilica u koronarnu arteriju u kojoj se izvodi zahvat uz rendgenološko navođenje. Preko žice vodilice dovodi se poseban balon na mjesto stenoze gdje se napuhavanjem širi i dilatira mjesto stenoze. Istim načinom se u to područje postavlja metalna potpornica (stent) kako bi se osigurala dugotrajnija prohodnost. Danas se kod ugradnje stentova preferira ugradnja DES stentova (engl. DES - drug-eluting stents) koji su impregnirani posebnim lijekovima s antiproliferativnim učinkom koji sprečavaju nastanak neointimalne hiperplazije odgovorne za nastanak restenoze, što se češće događa kod ugradnje stentova od čistoga metala (engl. BMS - bare-metal stents). Zbog sporije endotelizacije nakon ugradnje DES stentova, osobito onih iz prve generacije, indicirana je duža primjena dvojne antitrombocitne terapije s ciljem sprečavanja nastanka tromboza u stentu (engl. in stent thrombosis). Bolesnicima sa stabilnom koronarnom bolesti obično se daje dvojna antitrombocitna terapija (acetilsalicilne kiseline i klopidrogela) kroz 6 do 12 mjeseci. Kraća primjena opravdana je samo kod bolesnika s visokim rizikom od krvarenja, i nosi rizik od razvoja in stent tromboze. Primjena prasugrela ili tikagrelora može se razmotriti u slučaju razvoja in stent tromboze kod bolesnika koji su bili na klopidrogelu ili kod nekih specifičnih, visokorizičnih bolesnika, na primjer kod stentiranja glavnoga debla lijeve koronarne arterije, trombofilije ili šećerne bolesti. Bolesnicima s akutnim koronarnim sindromom, kao i bolesnicima koji se podvrgavaju elektivnoj koronarografiji nakon čega se odmah nastavlja s intervencijskim zahvatom i ugradnjom stenta, daje se udarna doza P2Y12 inhibitora (klopidogrel 600 mg odjednom peroralno) neposredno prije same intervencije. Bolesnicima koji se podvrgavaju elektivnoj perkutanoj koronarnoj intervenciji P2Y12 inhibitori se daju nekoliko dana ranije (klopidogrel 75 mg). Najčešće akutne komplikacije PCI-a uključuju okluziju koronarne arterije ili njezinih ogranaka trombom ili intimalnim disekatom kao posljedicom manipulacije na koronarnoj arteriji i javljaju se u 2 do 5 % slučajeva, dok je najčešća kronična komplikacija razvoj restenoze zbog neointimalne proliferacije, koja postupno stvara stenozu u stentu. Povećan rizik od restenoze imaju bolesnici sa šećernom bolesti, kalcificiranim lezijama, koronarnim arterijama manjega promjera te s kompliciranijim zahvatima, npr. bifurkacijskim lezijama na odvajanju arterija. Ponovni razvoj anginoznih smetnji nakon perkutane intervencije događa se kod 5 do 10 % stentiranih bolesnika.
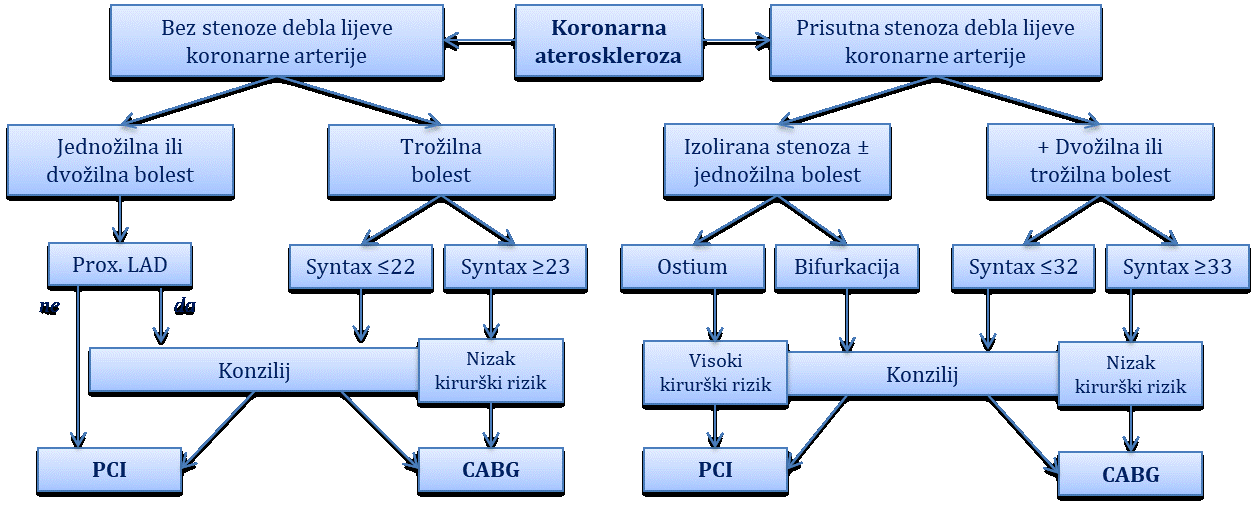
Slika 1.68. Shematski prikaz strategije odabira načina revaskularizacijskoga pristupa.
(Syntax – bodovni sustav kojim se ocjenjuje kompleksnost lezije)
Kirurška revaskularizacija miokarda (engl. CABG - coronary artery bypass grafting) predstavlja kardiokirurški zahvat pri kojemu se bolesnikove krvne žile koriste kao premosnice ili transplantati (unutarnja mamilarna arterija, radijalna arterija, dijelovi vene safene magne) radi spoja, odnosno premosnice između aorte ili njezinih ogranaka s koronarnom arterijom na mjestu distalno od stenoze/opstrukcije, čime se osigurava odgovarajući protok krvi. Zahvat se može izvoditi na kucajućem srcu (engl. off-pump operation) ili na srcu u izazvanom arestu (engl. on-pump operation). Zahvat nosi visok rizik od komplikacija i smrtnoga ishoda kod starijih bolesnika, bolesnika s drugim kroničnim bolestima i narušenim općim zdravstvenim stanjem, stoga je potrebna dobra procjena opravdanosti izvođenja zahvata kod takvih bolesnika.
Prognoza. Današnji pristup i mogućnosti liječenja bolesnika sa stabilnom koronarnom bolesti značajno su poboljšali ishode i prognozu takvih bolesnika. Godišnja stopa smrtnosti bolesnika sa stabilnom koronarnom bolesti iznosi oko 2 % za bolesnike koji su podvrgnuti revaskularizaciji i oko 4 % za bolesnike koji su na optimalnoj medikamentnoj terapiji. Kod određenoga broja bolesnika (čak i do 30 %) i nakon uspješno odrađene revaskularizacije simptomi bolesti ostaju i dalje prisutni, što značajno narušava kvalitetu života.
AKUTNI KORONARNI SINDROM BEZ ELEVACIJE ST-SEGMENTA (NESTABILNA ANGINA PEKTORIS I NSTEMI INFARKT)
Definicija. Akutni koronarni sindrom bez elevacije ST-segmenta ili NSTEMI (engl. non-ST elevation acute myocardial infarction) predstavlja akutnu ishemiju miokarda koja nastaje uslijed subokluzije ili prolazne okluzije koronarnih arterija koja se klinički manifestira stenokardijom, ali bez elevacije ST-segmenta na elektrokardiogramu. Ovisno o vremenskom trajanju ishemije i nastanku nekroze miokarda, razlikuju se dva entiteta: nestabilna angina pektoris koju karakterizira odsutnost nekroze miokarda te infarkt miokarda bez elevacije ST-segmenta (NSTEMI infarkt) kojeg karakterizira subendokardna nekroza miokarda (Tablica 1.40.).
Nestabilna angina pektoris. Definicija nestabilne angine temelji se na kliničkoj prezentaciji, a mora zadovoljiti jedan od sljedeća tri kriterija:
1) anginozne smetnje postaju intenzivnije, duže traju i češće se javljaju (crescendo angina), radi se o pogoršanju postojeće stabilne angine;
2) novonastala angina pektoris ili angina pektoris de novo (nastala unutar mjesec dana i javlja se nakon minimalnoga napora); te
3) pojava anginoznih bolova u mirovanju i/ili minimalnom naporu, traje duže od 20 min te ne popušta nakon primjene nitroglicerina.
NSTEMI infarkt. Definicija NSTEMI infarkta temelji se na elektrokardiografskom nalazu te porastu kardioselektivnih enzima, napose troponina. Izostanak elevacije ST-segmenta uz signifikantan porast troponina temeljna je karakteristika NSTEMI infarkta. Pri tome EKG može biti uredan ili pokazivati neke od znakova ishemije (depresija ST-segmenta, aplanirani ili negativni T-valovi).
|
Tablica 1.40. Razlike između NSTEMI infarkta i nestabilne angine pektoris
|
|
Karakteristike
|
NSTEMI infarkt
|
Nestabilna angina pektoris
|
|
Klinička prezentacija
|
Bol u prsima (stenokardija)
|
Bol u prsima (steokardija)
|
|
Etiološki mehanizam
|
Plak ruptura i superponirana tromboza
|
Plak ruptura i superponirana tromboza
|
|
Patogenetski mehanizam
|
Potpuna, prolazna okluzija
|
Subokluzija
|
|
Konačni ishod
|
Subendokardna nekroza
|
Bez nekroze
|
Zbog svoje kliničke sličnosti, kao i jednakoga dijagnostičko-terapijskog pristupa, ova se dva klinička entiteta opisuju zajedno.
Epidemiologija. Procjenjuje se da od ukupnoga broja bolesnika koji su hospitalizirani s dijagnozom akutnoga koronarnog sindroma dvije trećine čine bolesnici s akutnim koronarnim sindromom bez elevacije ST-segmenta. Polovica su bolesnici stariji od 65 godina i žene.
Etiopatogeneza. Najčešći uzrok razvoja akutnoga koronarnog sindroma bez elevacije ST-segmenta jednak je kao i kod akutnoga koronarnog sindroma s elevacijom ST-segmenta, a to je nestabilnost aterosklerotskoga plaka koja rezultira erozijom, fisurom ili rupturom koja dovodi do superponirane tromboze. Superponirana tromboza može rezultirati nastankom subokluzije koja dovodi do znatnoga smanjenja protoka krvi, ali ne i do potpunoga prekida krvi, ili do potpune, ali prolazne okluzije (spontana razgradnja tromba endogenom fibrinolizom) koja ovisno o trajanju dovodi do nastanka infarkta. Infarkt koji se razvije kod ovih bolesnika ne zahvaća cijelu stijenku miokarda (transmuralni infarkt), nego samo njegov dio uz endokard (subendokardijalni infarkt). Čimbenici koji određuju hoće li se akutni koronarni sindrom bez elevacije ST-segmenta očitovati kao nestabilna angina ili kao NSTEMI infarkt su oni koji determiniraju razvoj nekroze: 1) promjer ostatnoga lumena subokludirane žile (što je veći stupanj subokluzije, to je manji protok krvi, osobito u subendokardnoj zoni); 2) vremensko trajanje okluzije/subokluzije (spontana fibrinoliza može dovesti do spontane razgradnje ugruška i ponovne uspostave krvnoga protoka); te 3) razvijenost kolateralne cirkulacije (dotok krvi u ishemijsko područje razvijenim ograncima iz drugih koronarnih arterija). U slučajevima izražene kolateralne cirkulacije nekada se i potpuna trombotska okluzija koronarne arterije može prezentirati kao akutni koronarni sindrom bez elevacije ST-segmenta, s obzirom na to da u područje miokarda koje opskrbljuje okludirana arterija dolazi krv iz drugih izvora što sprečava potpunu nekrozu i odumiranje miokarda.
Akutni koronarni sindrom bez elevacije ST-segmenta može nastati i bez značajnoga patomorfološkog supstrata na koronarnim arterijama, što se javlja u uvjetima neravnoteže između potrebe i ponude kisika miokardu zbog čega se razvija ishemija. Smanjenu ponudu kisika miokardu možemo naći pri stanjima kao što su arterijska hipotenzija, teška anemija ili hipoksemija iz drugih uzroka, dok povećanu potrebu miokarda za kisikom nalazimo u sklopu tahikardnih poremećaja srčanoga ritma, teške arterijske hipertenzije, tireotoksikoze i sl.
Ostali, rjeđi uzorci mogu uključivati prolongirani vazospazam koronarne arterije uslijed lokalnoga poremećaja endotelne disfunkcije (Prinzmetalova angina pektoris, učinak kemijskih supstanci kao što su kokain ili triptani) ili spontane disekcije koronarne arterije, što je najčešće povezano s vaskulitisima ili kod žena za vrijeme poroda zbog naprezanja.
Klinička slika. Glavni i vodeći simptom akutnoga koronarnog sindroma je bol u prsima koji se može javiti pri naporu, ali i u mirovanju. Bolesnici ga opisuju kao težinu, žarenje ili pritisak koji se dominantno javlja iza prsne kosti, i može se širiti u lijevu ili desnu ruku, vrat i čeljust ili epigastrij. Pri tome se bolesnici često žale na mučninu, slabost i otežano disanje. Tegobe mogu biti rekurentne prirode ili perzistentne. Bolovi su kod ovih bolesnika generalno slabije izraženi nego kod bolesnika sa STEMI infarktom. Također, veći je postotak bolesnika s atipičnim kliničkim prezentacijama kao što su neodređene opresije, nelagoda u prsima ili gornjem abdomenu, dominacija dispnoičnih smetnji ili neobjašnjiv umor. Ovo se obično susreće kod mlađih (< 40 godina) ili starijih (> 75 godina) osoba, kod bolesnika sa šećernom bolesti, bubrežnom insuficijencijom ili demencijom. Kod oko 10 % bolesnika akutni koronarni sindrom prezentirat će se akutnim srčanim popuštanjem, a takvi bolesnici ukupno gledano imaju veći mortalitet. Fizikalni status ovih bolesnika uglavnom je uredan. Na akutno srčano popuštanje treba misliti kod bolesnika s hipotenzijom, hladnom periferijom te auskultacijskim nalazom s vlažnim hropcima na plućima, krepitacijama, koji upućuje na kongestiju.
Dijagnoza. Osnovni dijagnostički postupci kod ovih bolesnika podrazumijevaju elektrokardiografiju te određivanje vrijednosti kardioselektivnih enzima, a prema potrebi se mogu nadopuniti neinvazivnim slikovnim metodama (konvencionalna ehokardiografija, stres-ehokardiografija, scintigrafija miokarda, magnetna rezonanca srca, višeslojna kompjuterizirana tomografija koronarnih arterija) ili koronarografijom. Neinvazivne slikovne dijagnostičke metode obično su indicirane kod bolesnika s jasnom kliničkom slikom akutnoga koronarnog sindroma uz uredan elektrokardiogram i mirne kardioselektivne enzime.
EKG je osnovna i prva dijagnostička metoda kod bolesnika koji se prezentiraju bolovima u prsima. Trećina takvih bolesnika ima uredan nalaz elektrokardiograma, dok se kod ostalih mogu otkriti promjene u vidu depresije ST-segmenta, tranzitorne elevacije ST-segmenta (< 20 minuta) te promjene T-valova (aplanirani ili negativni). Nalaze treba uspoređivati s ranijim elektrokardiografskim zapisima da bi se pratila dinamika, tj. da bi se uočile stacionarne promjene. Patološki nalazi (depresija ST-segmenta, negativni T-valovi) koji se javljaju prilikom bolova, a nestaju s povlačenjem bolova visoko su specifični za ove bolesnike. Kod bolesnika s inicijalno urednim nalazom elektrokardiograma potrebno je češće ponavljati snimanje unutar prva 24 sata, osobito ako dođe do promjene u kliničkoj slici (pojava bolova). Također, kod bolesnika s urednim elektrokardiogramom uz jasnu kliničku sliku ishemije miokarda potrebno je pretragu dopuniti dodatnim elektrodama za desni ventrikul i stražnji zid lijevoga ventrikula (V7-V9 i V3R i V4R) koji mogu biti opskrbljeni cirkumfleksnom arterijom.
Kardioselektivni enzimi zajedno s 12-kanalim EKG-om predstavljaju osnovu dijagnostičkoga postupka kod bolesnika s akutnim koronarnim sindromom te omogućavaju razgraničenje dijagnoze nestabilne angine pektoris od NSTEMI infarkta miokarda. Povišene vrijednosti tih biomarkera upućuju na nekrozu miokarda te označavaju da se radi o NSTEMI infarktu, dok kod bolesnika s urednim vrijednostima govorimo o nestabilnoj angini pektoris. Troponini (troponin I i troponin T) osjetljiviji su markeri kardiomiocitne lezije u odnosu na kreatinin-fosfokinazu (CK) i njegov izoenzim CK-MB te mioglobin. Kod bolesnika s akutnim infarktom vrijednosti troponina su povišene (ako se koriste testovi visoke osjetljivosti) već unutar sat vremena od nastupa simptoma, a ostaju povišene kroz nekoliko dana (nekada i do 14 dana). Korištenje osjetljivih (engl. sensitive) i visoko osjetljivih (engl. high-sensitive) testova za otkrivanje vrijednosti troponina povećava dijagnostičku točnost postavljanja dijagnoze akutnoga infarkta miokarda u odnosu na konvencionalne testove. Povišene vrijednosti tropinina mogu se naći i kod drugih bolesti i stanja, kao što su tahiaritmije, srčano popuštanje, hipertenzivna emergencija, krvotočni urušaj (šok), miokarditis, Takotsubo kardiomiopatija, strukturne bolesti srca (aortna stenoza), aortna disekcija, teška plućna hipertenzija, plućna tromboembolija, kronična bubrežna bolest, akutno neurološko zbivanje, stanje nakon kontuzije srca i traume prsišta, infiltrativne bolesti (amiloidoza, hemokromatoza, sarkoidoza), rabdomioliza te toksične lezije miokarda.
Određivanje CK-a i CK-MB-a ima značajnu ulogu u postavljanju dijagnoze reinfarkta, s obzirom na to da se vrijednosti CK-MB-a vrlo brzo normaliziraju (unutar 24 sata) u odnosu na troponine, pa ponovni porast u ranom postinfarktnom periodu ukazuje na reinfarkt miokarda. Mioglobin, iako najmanje specifičan, koristan je u najranijoj procjeni infarkta miokarda, s obzirom na to da se njegove povišene vrijednosti pojavljuju prije porasta ostalih kardioselektivnih enzima.
U kliničkoj primjeni manje je poznat marker kopeptin koji predstavlja C-terminalni kraj prohormona vazopresina, a koristi se za kvantifikaciju endogenoga stresa u različitim oboljenjima, pa tako i u infarktu miokarda. Vrijednosti kopeptina visoke su u početnim satima infarkta miokarda i uvijek se interpretiraju zajedno s troponinima (inicijalno mirni troponini uz povišene kopeptine ukazuju na razvoj akutnoga infarkta miokarda).
Kod bolesnika s inicijalno negativnim vrijednostima troponina preporuča se njihovo ponovno mjerenje kako bi se utvrdila njihova dinamika prema tzv. "Rule-in" i "Rule-out" algoritmu (Slika 1.69.). U kliničkoj praksi najčešće se primjenjuju 0h/3h algoritmi (mjerenje troponina s trostanim vremenskim odmakom), a kao alternativa moguć je 0h/2h algoritam (mjerenje troponina s jednosatnim vremenskim odmakom) ako se koriste visoko osjetljivi testovi za mjerenje troponina.
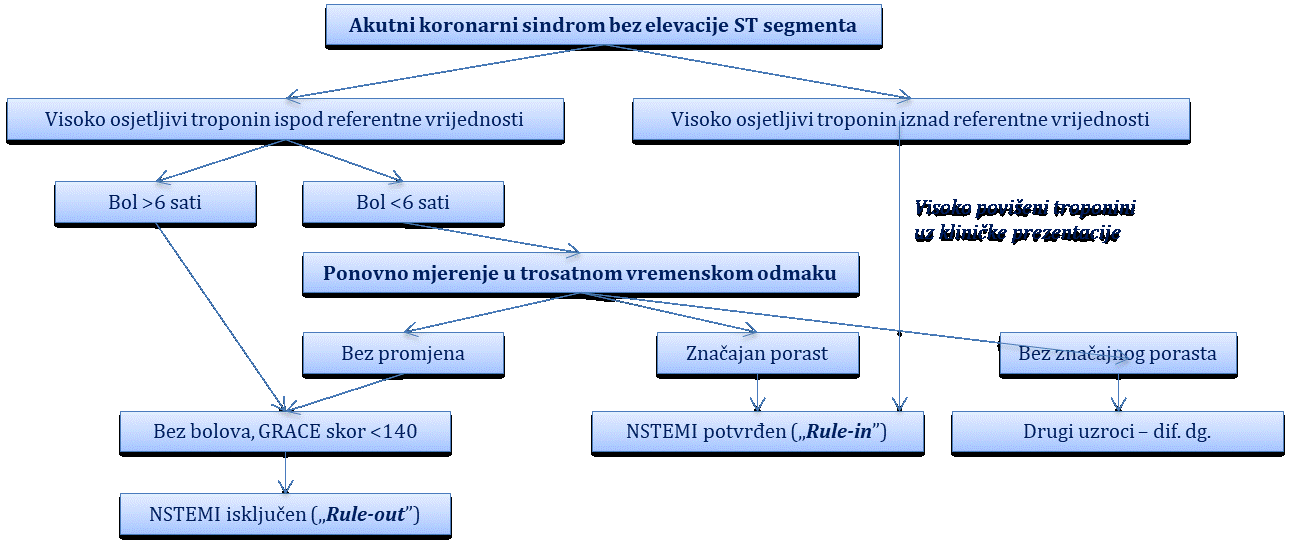
Slika 1.69. Shematski prikaz Rule-out i Rule-in trosatnog algoritma.
Ehokardiografiju bi trebalo rutinski obaviti kod svih bolesnika. Osnovni nalaz koji ukazuje na ishemiju miokarda podrazumijeva regionalni ispad kontraktilnosti miokarda u vidu hipokineze ili akineze, a u slučaju izostanka ovih pokazatelja na konvencionalnoj ehokardiografiji, na raspolaganju su naprednije i osjetljivije metode kao što su kontrastna ehokardiografija te strain analiza koje omogućavaju precizniju analizu regionalne funkcije miokarda. Ehokardiografija je nužna u procjeni sistoličke i dijastoličke funkcije, što je bitno u optimalizaciji dugoročne medikamentne terapije ovih bolesnika. Osim toga, ehokardiografija ima i diferencijalno-dijagnostičku ulogu u obradi bolesnika s bolovima u prsima (aortna disekcija, perikardijalna efuzija, aortna stenoza, hipertrofijska kardiomiopatija, dilatacija desnoga ventrikula kao pokazatelj plućne embolije i sl.). Kod bolesnika kod kojih je elektrokardiogram uredan, koji imaju mirne kardioselektivne enzime i koji su bez bolova kroz nekoliko sati preporuča se prije otpusta ili u što kraćem vremenu od otpusta učiniti stres-ehokardiografiju nakon fizičkoga opterećenja ili primjene lijekova (dobutamin, dipiridamol), s obzirom na njezinu negativnu prediktivnu vrijednost za ishemiju miokarda. Stres ehokardiografija pokazala se superiornijom u odnosu na ergometriju pri otkrivanju ishemije kod ove skupine bolesnika.
Scintigrafija miokarda u mirovanju također predstavlja neinvazivnu slikovnu metodu u procjeni ishemije i nekroze miokarda kod bolesnika s bolovima u prsima te urednim nalazom EKG-a i kardioselektivnih enzima. Uporabom radiofarmaka i njegovom smanjenom akumulacijom ili izostankom u određenim dijelovima miokarda gdje je oslabljena perfuzija ili je nema, moguća je detekcija zona ishemije i nekroze. Kombinirana scintigrafija miokarda bolesnika u mirovanju i pri opterećenju povećava dijagnostički značaj pretrage i povećava njezinu specifičnost i osjetljivost.
Magnetna rezonanca srca također omogućava funkcionalnu analizu procjenom perfuzije i abnormalnosti kontraktilnosti miokarda čime pomaže u otkrivanju ishemije kod ovih bolesnika. Osim toga, primjenom gadolinija omogućava se razgraničenje između staroga ožiljka i trenutne zone infarkta. MR srca indiciran je i u diferencijalnoj dijagnozi između miokarditisa, Takotsubo kardiomiopatije i akutnoga infarkta miokarda.
Višeslojna kompjuterizirana tomografija koronarnih arterija (MSCT koronarnih arterija) omogućava detaljan prikaz koronarnih arterija te se koristi kako bi se isključila koronarna bolest, s obzirom na to da pretraga ima visoku negativnu prediktivnu vrijednost, što ima velik značaj kod bolesnika koji se klinički prezentiraju kao akutni koronarni sindrom uz miran elektrokardiogram i kardioselektivne enzime. Pretraga nema veći značaj kod bolesnika s ranije poznatom koronarnom bolesti, a često se koristi i u evaluaciji koronarnih arterija bolesnika s ranije postavljenim stentovima ili ranije obavljenom kardiokirurškom revaskularizacijom.
Invazivna kardiološka obrada. Indikacije i optimalno vrijeme pristupa invazivnoj kardiološkoj obradi koja uključuje koronarografiju s ili bez perkutane koronarne intervencije opisani su u daljnjem tekstu.
Diferencijalna dijagnoza akutnoga koronarnog sindroma bez elevacije ST-segmenta je široka te obuhvaća različite bolesti i stanja, druga srčana oboljenja (perikarditis, miokarditis, tahiaritmije, akutno srčano popuštanje, hipertenzivna emergencija, aortna stenoza, Takotsubo kardiomiopatija), plućne bolesti (pneumotoraks, pleuritis, bronhopneumonija), akutni aortni sindrom, gastrointestinalni poremećaji (peptički ulkus, gastritis, pankreatitis, kolecistitis), koštano-mišićni poremećaji (trauma prsnoga koša, kostohondritis, poremećaji vratne kralješnice) te ostali (herpes zoster, anemija).
Liječenje. Bolesnici s akutnim koronranim sindromom bez elevacije ST-segmenta moraju se hospitalizirati u jedinici intenzivne koronarne skrbi koja omogućava stalno praćenje srčane funkcije (elektrokardiografski nadzor). Inicijalni terapijski pristup čini konzervativno (medikamentno) liječenje uz naknadnu ili hitnu invazivnu kardiološku obradu (koronarografija, perkutana koronarna intervencija).
Konzervativno liječenje. Temelj konzervativnoga (medikamentnog) liječenja akutnoga koronarnog sindroma bez elevacije ST-segmenta čini antiishemijsko, antitrombocitno i antikoagulacijsko liječenje.
Antiishemijsko liječenje. Antiishemijski ili antianginalni lijekovi su oni koji smanjuju potrebe miokarda za kisikom i poboljšavaju njegovu prokrvljenost, što rezultira smanjenjem ishemije miokarda. Glavni antiishemijski lijekovi su nitrati, beta blokatori i blokatori kalcijskih kanala.
Nitrati su vazodilatatori koji se kod ovih bolesnika primjenjuju kao terapija izbora za simptomatsko olakšanje, a taj učinak postižu venodilatacijom i smanjenjem srčanog predopterećenja, kao i dilatacijom koronarnih arterija što omogućava veći dotok krvi u miokard i bolju perfuziju. Najčešće se primjenjuje nitroglicerin i to sublingvalno u obliku spreja u dozi od 0,4 mg u jednom do dva potiska uz eventualno ponavljanje doze kroz 5 do 10 minuta. Ako ne dođe do smirivanja boli, nitroglicerin se može primijeniti i intravenskom infuzijom u dozi od 10 - 20 mcg/min. Intravenska primjena nitroglicerina preporuča se kod bolesnika s rekurentnom ili perzistentnom stenokardijom, nekontroliranom hipertenzijom ili sa znacima srčanoga popuštanja. Najčešće nuspojave primjene nitroglicerina su hipotenzija, glavobolja i refleksna tahikardija. Duža primjena infuzije nitroglicerina može dovesti do pojave tolerancije i gubitka učinka lijeka.
Rani početak liječenja beta blokatorima preporučuje se svim bolesnicima s anginoznim smetnjama ako ne postoje kontraindikacije za njihovu primjenu. Učinak se temelji na kompetitivnoj inhibiciji beta adrenergičkih receptora, čime se smanjuje učinak cirkulirajućih katekolamina na miokard (smanjenje srčane frekvencije, smanjenje kontraktilne snage) te se tako smanjuje potrebu miokarda za kisikom. Primjena beta blokatora kod bolesnika koji imaju nestabilnu anginu pektoris, a koji ih nisu uzimali prije hospitalizacije, dokazano smanjuje rizik od razvoja akutnoga infarkta miokarda. Kod tih se bolesnika preporuča peroralna primjena bisoprolola (početna doza 1 x 1,25 - 2,5 mg/dan) ili metoprolola (početna doza 3 x 50 mg/dan) uz postupno podizanje doze lijeka održavajući ciljne vrijednosti srčane frekvencije u rasponu od 50 do 60/min. Beta blokatori su kontraindicirani kod bolesnika sa simptomima srčanoga popuštanja, hipotenzijom, hemodinamskom nestabilnosti ili poremećajima srčanoga provođenja. Primjena ovih lijekova kod bolesnika s kroničnom opstruktivnom bolesti nije kontraindicirana, ali se daje uz povećan oprez i moguće pogoršanje plućnih simptoma.
Blokatori kalcijskih kanala nemaju dokazan jasan klinički uspjeh u liječenju ovih bolesnika i koriste se samo kao rezervni antiishemijski lijekovi kod bolesnika koji imaju uporne anginozne smetnje unatoč primjeni beta blokatora i nitrata ili kada su ti lijekovi kontraindicirani. Učinak se temelji na arterijskoj vazodilataciji i usporavanju srčanoga ritma. U ovu se svrhu preporuča primjena diltiazema (180 - 360 mg/dan podjeljeno u dvije ili tri doze), a njegova primjena kontraindicirana je kod bolesnika sa sistoličkom disfunkcijom te kod bolesnika s plućnom kongestijom. Istodobna primjena beta blokatora i blokatora kalcijskih kanala treba se izbjegavati zbog mogućega singerističnog djelovanja na usporavanje provođenja impulsa kroz atrioventrikularni čvor i mogućnosti nastanka atrioventrikularnoga bloka. Primjena kratkodjelujućega nifedipina kod ovih bolesnika nije preporučljiva.
Antitrombocitno liječenje indicirano je kod svih bolesnika s akutnim koronarnim sindromom bez elevacije ST-segmenta. Dvojna antitrombocitna terapija (acetilsalicilna kiselina i P2Y12 inhibitor) koja se provodi kroz period od 12 mjeseci indicirana je kod bolesnika kojima je implantiran stent ili u slučajevima recidivirajućega akutnog infarkta miokarda bez implantacije stenta s difuznom aterosklerotskom bolešću epikardijalnih koronarnih arterija, osim ako bolesnici nemaju specifičnih kontraindikacija. Bolesnici koji su alergični ili ne podnose acetilsalicilinu kiselinu liječe se samo P2Y12 inhibitorima. Kod izbora P2Y12 inhibitora danas se preferira prasugrel za sve pacijente bez obzira na početnu strategiju liječenja, uključujući i one koji su prethodno liječeni klopidogrelom. Drugi antitrombocitni lijek izbora je tikagrelor, a klopidogrel je indiciran samo ako su prethodna dva lijeka nedostupna ili kontraindicirana. Također, klopidogrel se preporuča kao lijek izbora za bolesnike kojima je potrebna oralna antikoagulacijska terapija (varfarin, novi antikoagulantni lijekovi). Osnovne karakteristike P2Y12 inhibitora prikazane su u Tablici 1.41.
Acetilsalicilna kiselina (aspirin) preporučuje se svim bolesnicima koji nemaju kontraindikacije u inicijalnoj dozi od 150 – 300 mg te kasnije u dozi održavanja od 75 – 100 mg/dan ovisno o strategiji liječenja.
Klopidogrel je P2Y12 inhibitor koji primijenjen s acetilsalicilnom kiselinom ima sinergistički učinak na inhibiciju agregacije trombocita. Primjenjuje se kao predlijek koji se metabolizira sustavom enzima citokroma P-450 u aktivni oblik. Polimorfizmi ovoga sustava koji se nalaze u 15 do 20 % populacije, kao i primjena lijekova koji ga inhibiraju (omeprazol, esomeprazol, cimetidin, flukonazol, ketokonazol, vorikonazol, fluoksetin) usporavaju metabolizam predlijeka u aktivan oblik čime se smanjuje njegov antiagregacijski učinak. Početna doza klopidogrela iznosi 300 do 600 mg, a doza održavanja iznosi 1 x 75 mg/dan.
Prasugrel je također P2Y12 inhibitor, ali za razliku od klopidogrela ima veći i brži antiagregacijski učinak, a indiciran je samo kod bolesnika kojima je predviđena perkutana koronarna intervencija u ranoj strategiji liječenja. Daje se u početnoj dozi od 60 mg nakon čega se nastavlja s dozom od 1 x 10 mg/dan. Komplikacije uz primjenu prasugrela povezane su najčešće s intrakranijskim krvarenjem kod bolesnika koji su preboljeli moždani udar pa ga se tim bolesnicima ne smije davati, a ne preporuča se ni bolesnicima starijim od 75 godina i bolesnicima koji imaju manje od 60 kg. Najveću korist od primjene prasugrela imaju bolesnici sa šećernom bolesti.
Tikagrelor je danas najčešće korišten P2Y12 inhibitor s obzirom na više prednosti: ne zahtijeva aktivaciju u jetri, ima brži početak djelovanja i izraženiji antitrombocitni učinak te posreduje reverzibilnu inhibiciju P2Y12 receptora zbog čega se funkcija trombocita brže oporavlja nakon prekida terapije u odnosu na druge P2Y12 inhibitore. Primjenjuje se u inicijalnoj dozi od 180 mg, a nastavlja se sa dozom od dvaput po 90 mg/dan. Primjena ovoga lijeka kontraindicirana je kod bolesnika s anamnezom intrakranijskoga krvarenja.
Intravenski antitrombocitni lijekovi kao što su inhibitori glikoproteina IIb/IIIa (eptifibatid, tirofiban, abciximab) primjenjuju se isključivo kod perkutanih koronarnih intervencija u ranoj strategiji liječenja, i to samo kod bolesnika s kompliciranim zahvatom (veliki tromb, distalne embolizacije), a rutinska se primjena ne preporuča. Lijekovi se primjenjuju intravenski za vrijeme intervencije, a s primjenom se može nastaviti 12 do 24 sata nakon intervencije.
|
Tablica 1.41. Osnovne karakteristike P2Y12 inhibitora
|
|
Karakteristike
|
Klopidogrel
|
Prasugrel
|
Tikagrelor
|
|
Kemijska klasa
|
Thinopiridin
|
Thinopiridin
|
Cyclopentyl-triazolopyrimidin
|
|
Konvencionalna doza
|
300 - 600 mg inicijalno, nastavak 1 x 75 mg/dan
|
60 mg inicijalno, nastaviti s 1 x 10 mg/dan
|
180 mg inicijalno, nastaviti s 2 x 90 mg/dan
|
|
Doza u pri kroničnoj bolesti bubrega
|
Faza III
|
Prilagodba nije potrebna
|
Prilagodba nije potrebna
|
Prilagodba nije potrebna
|
|
Faza IV
|
Prilagodba nije potrebna
|
Prilagodba nije potrebna
|
Prilagodba nije potrebna
|
|
Faza V
|
Koristiti iznimno, ista doza
|
Koristiti iznimno, ista doza
|
Koristiti iznimno, ista doza
|
|
Način vezivanja
|
Ireverzibilan
|
Ireverzibilan
|
Reverzibilan
|
|
Način aktivacije
|
Aktivacija predlijeka u jetri
|
Aktivacija predlijeka u jetri
|
Nije potrebna aktivacija
|
|
Vrijeme do očetka učinka
|
2 - 6 sati
|
30 minuta
|
30 minuta
|
|
Trajanje učinka
|
3 - 10 dana
|
7 - 10 dana
|
3 - 5 dana
|
|
Prekid prije operacije
|
5 dana
|
7 dana
|
5 dana
|
Kako je navedeno, primjena dvojne antitrombocitne terapije kod bolesnika s akutnim koronarnim sindromom bez elevacije ST-segmenta preporuča se u razdoblju do godine dana, a nakon toga se može razmotriti i daljnja primjena, ali nakon procjene ishemije i rizika od krvarenja. Kod bolesnika s visokim rizikom od krvarenja P2Y12 inhibitor može se koristiti u kraćem vremenskom periodu, ali minimalno tri do šest mjeseci kod bolesnika koji su podvrgnuti perkutanoj koronarnoj intervenciji i imaju implantirani DES stent prve generacije ili mjesec do tri mjeseca ako imaju implantirani BMS stent ili DES stent druge generacije. Kod bolesnika koji su na dvojnoj antitrombocitnoj terapiji i moraju se podvrgnuti nekardiološkoj operaciji preporuča se prekid uzimanja P2Y12 inhibitora te obavljanje zahvata pet dana od prekida uzimanja tikagrelora ili klopidogrela ili sedam dana nakon prekida uzimanja prasugela (uz uvjet da bolesnik nema visok rizik od ishemijskog događaja).
Antikoagulacijsko liječenje indicirano je kod svih bolesnika s akutnim koronarnim sindromom bez elevacije ST-segmenta ako nemaju kontraindikacije kao što je aktivno krvarenje. Za bolesnike koji se liječe primarno konzervativnim načinom na raspolaganju su heparini (nefrakcionirani ili niskomolekularni) i fondaparinuks, dok se kod bolesnika kod kojih je indicirana primarna perkutana konoronarna intervencija koriste samo heparini (nefrakcionirani, niskomolekularni). Bivalirudin se također može koristi u liječenju bolesnika kod kojih se planira perkutana koronarna intervencija, ali samo kao alternativa heparinu. Pristup bolesniku koji zahtijeva primjenu peroralnih antikoagulantnih lijekova (npr. fibrilacija atrija) prikazan je shematski.
Nefrakcionirani heparin pojačava inhibitorno djelovanje antitrombina III na aktivirane faktore koagulacije te tako sprečava širenje tromba. Nefrakcionirani heparin primjenjuje se intravenski i to tako da se najprije da intravenski bolus od 60 ij/kg nakon čega slijedi kontinuirana infuzija u dozi od 12 ij/kg/h (maksimalno 1000 ij/sat) uz održavanje produljenog aPTV-a za 1,5 do 2 puta od normale (obično je to aPTV od 50 do 70 sekundi). Kontinuirana infuzija primjenjuje se kroz 48 sati ili do postizanja revaskularizacije. Praćenje aPTV-a indicirano je svakih šest sati s obzirom na različit i individualan odgovor, što i nalaže titriranje doze. Kod 10 do 20 % bolesnika razvija se blaga trombocitopenija, dok se kod 1 do 5% može razviti i teži oblik (HIT - heparinom inducirana trombocitopenija).
Niskomolekularni heparini predstavljaju fragmente nefrakcioniranoga heparina sa snažnom anti-Xa i anti-IIa aktivnošću uz predvidljiv antikoagulantni učinak i duži poluživot zbog čega nije potrebno laboratorijsko praćenje doziranja lijeka. Dva su niskomolekularna heparina odobrena za liječenje akutnoga koronarnog sindroma, a to su enoksaparin i deltaparin. Oba se lijeka primjenjuju supkutano, enoksaparin u dozi od 1 mg/kg dva puta na dan, a deltaparin u dozi od 120 ij/kg (maksimalno 10 000 ij) dva puta na dan. Liječenje se provodi uglavnom tijekom cijele hospitalizacije ili do osam dana. Doza niskomolekularnih heparina mora se prilagoditi kod bolesnika s oštećenom funkcijom bubrega i daje se u jednoj dnevnoj dozi.
Fondaparinuks je sintetski selektivni inhibitor aktiviranog faktora X (Xa) s antitrombotskim učinkom usporedivim s enoksaparinom. Kao i niskomolekularni heparini, fondaparinuks ne zahtijeva laboratorijsko praćenje i prilagodbu doze, a nosi najniži rizik od krvarenja. Primjenjuje se supkutano u dozi od 2,5 mg/dan tijekom pet dana ili do otpusta iz bolnice. Zbog primijećene veće učestalosti tromboze povezane s kateterom, primjena fondaparinuksa ne preporuča se za bolesnike kod kojih se planira invazivna kardiološka obrada. Kod bolesnika koji su započeli liječenje fondaprinuksom, a kod kojih se razvije indikacija za perkutanu koronarnu intervenciju, preporuča se primjena jednoga intravenskog bolusa nefrakcioniranoga heparina (70 - 85 ij/kg) tijekom postupka kako bi se smanjio rizik od tromboze.
Bivalirudin je izravni inhibitor trombina koji se kod ovih bolesnika koristi samo kao alternativni antikoagulans za bolesnike koji idu na perkutanu koronarnu intervenciju. Lijek se primjenjuje intravenski, najprije kao bolus od 0,75 mg/kg nakon čega slijedi kontinuirana infuzija u dozi od 1,75 mg/kg/sat tijekom četiri sata nakon intervencije. Kombinirana primjena heparina i inhibitora glikoproteina IIb/IIIa pokazuje jednaki učinak u prevenciji ishemijskih događaja kao i bivalirudin, ali je primjena bivalirudina povezana s manjim rizikom od krvarenja.
Kod bolesnika koji su od ranije na peroralnoj antikoagulacijskoj terapiji novim antikoagulantnim lijekovima, parenteralna primjena navedenih antikoagulantnih lijekova provodi se bez obzira na vrijeme zadnjega uzimanja lijeka, a ako se radi o bolesnicima koji su bili na varfarinu, antikogulansi se ne daju ako je INR > 2.5.
Kod bolesnika s indikacijom za liječenje oralnim antikoagulantnim lijekovima (fibrilacija atrija, venska tromboembolija, mehanička valvula) preporuča se njihovo dodavanje antiagregacijskoj terapiji (trostruka terapija). Pristup ovim bolesnicima i način liječenja prikazani u shemi na Slici 1.70. Kod takvih se bolesnika od P2Y12 inhibitora primjenjuje isključivo klopidogrel. Minimalno trajanje trostruke terapije može biti tjedan dana (potom izostaviti acetilsalicilnu kiselinu) ako je rizik od krvarenja značajno veći od rizika razvoja ishemijskoga incidenta.
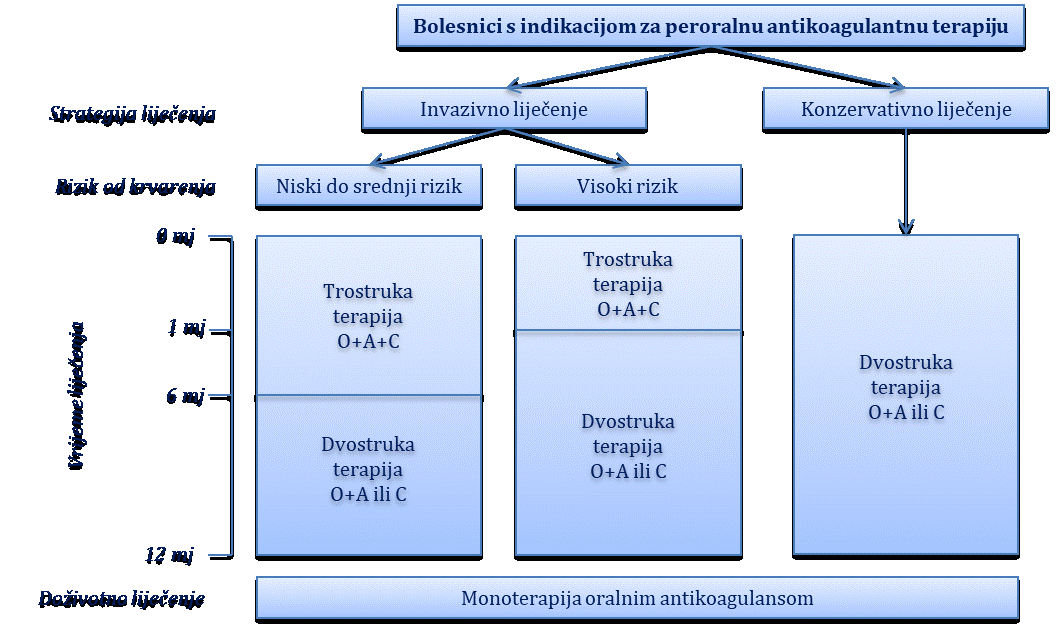
Slika 1.70. Shematski prikaz pristupa bolesniku s akutnim koronarnim sindrom i indikacijom za oralnim antikoagulansima. (O – oralni antikoagulans, A – acetilsalicilna kiselina, C – klopidogrel)
Ostala medikamentna terapija. Kao i kod bolesnika s akutnim koronarnim sindromom s elevacijom ST-segmenta preporuča se što ranije uvođenje statina u terapiju, s obzirom na njihov povoljan učinak na stabilizaciju aterosklerotskoga plaka i endotelnu disfunkciju. Liječenje se započinje primjenom statina u visokim dozama (atorvastatin 80 mg/dan, rosuvastatin 40 mg/dan) uz kontrolu lipidograma nakon četiri do šest tjedana te snižavanje doze kada se postigne sniženje LDL kolesterola za više od 50 % u odnosu na početne vrijednosti ili se postigne ciljna vrijednost LDL-a od 1,4 mmol/L. Primjena inhibitora protonske pumpe zajedno s antiagregacijskim i antikoagulantnim lijekovima indicirana je kod svih bolesnika s anamnezom gastrointestinalne hemoragije, kao i kod bolesnika s povećanim riziku od nje, a to su bolesnici s H. pylori infekcijom, dispeptičkim tegobama, starosnom dobi > 60 godina, oni koji istovremeno uzimaju antikoagulanse i/ili steroida te zlouporabljuju alkohol. Preporuke za primjenu lijekova s učinkom na renin-angiotenzin-aldosteron sustav jednake su kao i kod bolesnika s akutnim koronarnim sindromom s elevacijom ST-segmenta.
Koronarografija i perkutana koronarna intervencija. Perkutana koronarna intervencija (PCI) predstavlja interventni zahvat revaskularizacije miokarda pri kojemu se vrši balonska dilatacija koronarne arterije u području stenoziranoga dijela te se na isto mjesto postavlja metalna potpornica ili stent koji osigurava protok i sprečava restenozu. Primarna perkutana koronarna intervencija danas je temeljni način liječenja akutnoga koronarnog sindroma s elevacijom ST-segmenta, kao i nestabilnoga akutnoga koronarnog sindroma bez elevacije ST-segmenta. Osim toga, razlikujemo i perkutanu transluminalnu koronarnu angioplastiku (PTCA), interventni zahvat revaskularizacije miokarda koji se sastoji samo od balonske dilatacije koronarne arterije bez postavljanja stenta, a izvodi se samo u slučaju nemogućnosti postavljanja stenta (anatomska varijacija i sl.) ili kod bolesnika s kontraindiciranom postproceduralnom primjenom antitrombocitnih lijekova.
Temeljno je pitanje kod bolesnika s akutnim koronarnim sindromom bez elevacije ST-segmenta koje bolesnike treba uputiti na invazivnu kardiološku obradu (koronarografija s ili bez perkutane koronarne intervencije) i u kojem vremenskom periodu. Procjena potrebe i hitnoće invazivne obrade temelji se na procjeni rizika od loših kliničkih ishoda prema čemu razlikujemo tri skupine bolesnika: bolesnici s vrlo visokim rizikom, bolesnici s visokim rizikom te bolesnici s nisikim rizikom (vidi Tablicu 1.42.). Na temelju svrstavanja bolesnika u neku od navedenih kategorija odlučuje se o vremenskom periodu u kojemu se treba provesti invazivna obrada: bolesnici s vrlo visokim rizikom trebaju biti podvrgnuti invazivnoj obradi i liječenju unutar dva sata (hitna invazivna strategija), bolesnici s visokim rizikom trebaju biti podvrgnuti invanzivnoj obradi i liječenju unutar 24 sata (rana invazivna strategija) dok se kod bolesnika s niskim rizikom preporuča najprije provesti neinvazivnu obradu (stres-ehokardiografija ili stres MRI), a potom, ovisno o rezultatu, invazivnu obradu i liječenje. Kod izvođenja intervencije preporuča se radijalni pristup u odnosu na femoralni te ugradnja DES stentova novije generacije. Antitrombocitnu premedikaciju čini primjena acetilsalicilne kiseline u dozi od 300 mg, dok se ranije rutinski preporučena primjena P2Y12 inhibitora danas ne preporučuje dok nije poznata koronara (pato)anatomija.
|
Tablica 1.42. Kategorizacija bolesnika prema riziku (vrlo visoki, visoki, niski)
|
|
Bolesnici s vrlo visokim rizikom
|
Bolesnici s visokim rizikom
|
Bolesnici s niskim rizikom
|
|
Hemodinamska nestabilnost
Kardiogeni šok
Tvrdokorna stenokardija
Maligne aritmije
Mehaničke komplikacije
Akutno srčano popuštanje
Intermitentna ST elevacija
|
Potvrđena NSTEMI dijagnoza
Dinamičke ST-T promjene
Novonastale ST-T promjene
Stanje nakon aresta bez elevacije ST-segmenta ili kardiogenog šoka
GRACE skor > 140
|
Porast tropinina bez jasnih rizičnih čimbenika koronarne bolesti
|
Prognoza. Iako je kratkoročni mortalitet (smrtnost u bolnici) nešto manji kod bolesnika s akutnim koronarnim sindromom bez elevacije ST-segmenta u odnosu na one s elevacijom ST-segmenta (7 % nasuprot 5 %), stope smrtnosti nakon šest mjeseci gotovo su izjednačene (12 % nasuprot 11 %). Međutim, dugoročno praćenje pokazalo je da bolesnici s akutnim koronarnim sindromom bez ST-elevacije imaju dvostruko veću smrtnost od onih sa ST-elevacijom nakon četiri godine.
AKUTNI KORONARNI SINDROM S ELEVACIJOM ST-SEGMENTA (STEMI INFARKT)
Definicija. Akutni koronarni sindrom s elevacijom ST-segmenta ili STEMI (engl. ST elevation acute myocardial infarction) predstavlja ishemiju miokarda koja zahvaća punu debljinu stijenke (transmuralno), tj. nastaje uslijed potpunoga prekida, odnosno okluzije krvnoga protoka kroz neku od koronarnih epikardnih arterija, što se očituje karakterističnom promjenom u elektrokardiogramu u vidu elevacije ST-segmenta ili novonastaloga bloka lijeve grane kao ekvivalenta STEMI infarkta.
Epidemiologija. STEMI čini oko 30 % svih dijagnosticiranih akutnih infarkta miokarda, što je relativno manje nego u ranijim godinama zbog apsolutno povećanoga broja dijagnosticiranih NSTEMI i posljedično ukupnoga broja infarktā. To je rezultat dostupnosti selektivnih i osjetljivih markera nekroze miokarda kojima je unaprijeđena dijagnostika. Zahvaljujući dostupnosti suvremenih metoda liječenja, kao što su perkutane koronarne intervencije, smrtnost uslijed STEMI-a značajno se snizila.
Etiopatogeneza. Osnovni patogenetski mehanizam razvoja STEMI-a uključuje potpunu okluziju epikardne koronarne arterije koja je u 95 % slučajeva povezana s aterosklerozom, a kod manjega broja bolesnika (< 5%) može biti uzrokovana i drugim mehanizmima. Koronarna okluzija dovodi do potpunoga prekida protoka krvi te uvjetuje razvoj distalne transmuralne ishemije (ishemija koja zahvaća punu debljinu stijenke) irigiranoga područja miokarda koja, ako potraje, dovodi do nekroze i potpunoga propadanja miocita s naknadnim stvaranjem ožiljnoga tkiva.
Ateroskleroza je glavni i osnovni uzrok STEMI-a, što se povezuje s rupturom ili erozijom aterosklerotskoga plaka i nastankom superponirane tromboze. Ove komplikacije aterosklerotskoga plaka nastaju na podlozi tzv. nestabilnoga plaka, čemu pogoduju sljedeći čimbenici: 1) lokalna upalna aktivnost zbog pojačane aktivnosti makrofaga u aterosklerotskim plakovima koja rezultira pojačanim stvaranjem metaloproteinaza, enzima koji razgrađuju kolagenska vlakna i stanjuju fibroznu kapu plaka; 2) sistemska upalna aktivnost (akutni koronarni sindrom češći je kod osoba s povišenim vrijednostima upalnih markera); 3) mehaničke karakteristike i anatomska distribucija (plakovi smješteni na račvištima više su izloženi mehaničkom stresu). Pucanjem plaka omogućava se kontakt krvi s lipidnom jezgrom koja sadrži izrazito trombogene tvari kao što su fosfolipidi, tkivni faktor i kolagen te posljedično dolazi do aktivacije i agregacije trombocita, stvaranja fibrinske mreže i u konačnici nastanka ugruška koji u potpunosti opstruira lumen koronarne arterije. Ako ne dođe do spontane fibrinolize nastaloga ugruška i ako zahvaćeno područje miokarda ne dobije krv i kisik iz neke kolateralne krvne žile, razvit će se ireverzibilno oštećenje, odnosno infarkt.
Ostali uzroci. Osim navedenoga mehanizma, u ostalih 5 % slučajeva STEMI može nastati i drugim, znatno rjeđim mehanizmima, a to su: 1) koronarna embolija zbog tromba iz lijevoga ili desnog atrija, vegetacije mitralne ili aortne valvule, masne i zračne embolije; 2) koronarna tromboza bez ateroskleroze kod anemije srpastih stanica, policitemije rubrae verae, trombocitoze, diseminirane intravaskularne koagulopatije, hiperviskoznog i drugih stanja trombofilije; 3) vaskulitis koronarnih arterija u okviru Takayasu vaskulitisa, Kawasakijeve bolesti, lupusnog vaskulitisa, 4) protrahirani spazam koronarne arterije kod predoziranja kokainom i amfetaminima; 5) spontana koronarna disekcija, 6) okluzija ishodišta koronarnih arterija kod disekcije aorte, leuteičnoga aortitisa, aortne stenoze te 7) kongenitalna anomalija te traumatska lezija koronarnih arterija. Neovisno o uzroku, konačni ishod je isti – potpuna okluzija koronarne arterije s posljedičnim razvojem ishemije i nekroze miokarda.
Patofiziologija. Osnovno patofiziološko obilježje STEMI-a predstavlja tkivna ishemija i anoksija koje se javlja uslijed potpune okluzije koronarne arterije. Istraživanja na animalnim modelima pokazala su da smrt miocita nastupa već nakon 15 minuta od prekida dotoka krvi, a prve stanice koje stradavaju su one koje se nalaze uz endokard te se ishemijsko oštećenje miokarda kreće u smjeru od endokarda prema epikardu. Za razvoj nekroze potrebno je i do nekoliko sati zbog čega se ponovnom uspostavom krvotoka, tj. reperfuzijom unutar tri do šest sati, može postići djelomično spašavanje zahvaćenoga miokarda.
Rane patofiziološke posljedice ishemije miokarda u STEMI infarktu uključuju disfunkciju lijevoga ventrikula te električnu nestabilnost miokarda. Disfunkcija lijevoga ventrikula očituje se sistoličkom i dijastoličkom disfunkcijom. Sistolička disfunkcija manifestira se smanjenjem kontraktilne snage uslijed ispada funkcije zahvaćenoga dijela miokarda, a težina disfunkcije ovisi o veličini ishemijom zahvaćenoga miokarda. Procjenjuje se da oštećenje koja zahvaća više od 20 % miokarda lijevoga ventrikula rezultira razvojem kliničke slike srčanoga popuštanja, a više od 40 % slikom kardiogenoga šoka. Dijastolička disfunkcija podrazumijeva neodgovarajuću relaksaciju miokarda zbog čega se povisuje tlak punjenja lijevoga ventrikula dovodeći do prekomjernoga rastezanja miofibrila (Frank-Starlingov zakon) koji ne mogu dovesti do pojačane kontrakcije, nego rezultiraju dilatacijom lijevoga ventrikula. Dilatacija lijevoga ventrikula dovodi do povećanja volumena krvi na kraju dijastole uz povišen tlak, što može dovesti do plućne kongestije, a u težim slučajevima i do plućnoga edema te subendokardijalne ishemije. Električna nestabilnost miokarda nastaje uslijed disfunkcije membranskih kanala izazvane ishemijom i lokalnoga poremećaja transmembranskoga potencijala, što može dovesti do patoloških izbijanja i pojave srčanih aritmija koje se mogu kretati od klinički manje značajnih (npr. ekstrasistole) do malignih poremećaja srčanoga ritma (ventrikularna tahikardija, ventikulska fibrilacija) koji su najčešći neposredni uzroci smrti kod ovih bolesnika.
Kasne patofiziološke posljedice ishemije miokarda u STEMI infarktu podrazumijevaju nastanak remodeliranja lijevoga ventrikula, što je povezano s razvojem sindroma srčanoga popuštanja. Nakon nekroze miokarda koju kasnije prati proces ožiljkavanja, preostali miokard nastoji pojačanom kontraktilnošću (hiperkinetičke kontrakcije) kompenzacijski nadoknaditi nastali gubitak miokarda, s ciljem očuvanja minutnoga volumena. Pojačana sistolička aktivnost ostatnoga miokarda prenosi se i na područje nekroze i ožiljka što dovodi do njegova paradoksalnog gibanja (u suprotnom smjeru) te može dovesti do razvoja aneurizmatskoga proširenja. S vremenom to dovodi do karakterističnih promjena u građi, obliku i veličini lijevoga ventrikula (stanjenje miokarda u području infarkta, kompenzacijska hipertrofija ostatnoga miokarda, povećanje volumena), što nazivamo remodeliranjem lijevoga ventrikula pri čemu veliku ulogu imaju neurohormonski mehanizmi (vidi poglavlje o srčanom zatajenju). Ovako promijenjen lijevi ventrikul ne može održavati normalan minutni volumen te dolazi do razvoja sindroma srčanoga popuštanja. Izraženost tih promjena izravno je povezana s veličinom infarktom zahvaćenoga miokarda - što je veća zona infarkta, to je naglašenije remodeliranje. Shematski prikaz patofizioloških posljedica ishemije miokarda nakon STEMI-a dan je na Slici 1.71.
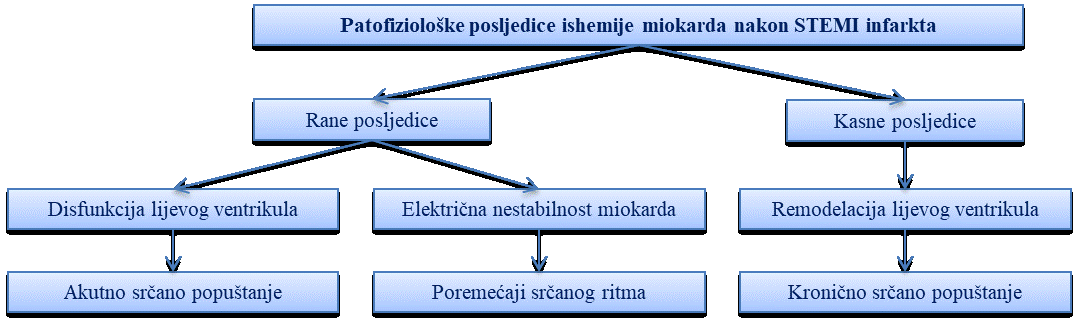
Slika 1.71. Shematski prikaz patofizioloških posljedica ishemije miokarda nakon STEMI-a.
Klinička slika. Većina bolesnika (> 80 %) sa STEMI-em ima karakterističnu kliničku sliku kojom dominira izražen bol u prsnom košu. Simptomi i znakovi nastaju naglo i razvijaju se brzo. Uglavnom se javljaju u mirovanju, najčešće pred jutro, iako se mogu javiti u bilo koje doba dana, kao i za vrijeme tjelesne aktivnosti ili emocionalnoga uzbuđenja, ali za razliku od stabilne koronarne bolesti ne povlače se mirovanjem ili primjenom nitroglicerina.
Bol kod bolesnika sa STEMI-e ima odlike dubokoga i visceralnoga bola koji bolesnici opisuju kao jak, s karakterom stezanja i razdiranja. Najčešće je lokaliziran retrosternalno s karakterističnim širenjem u lijevo rame i ruku, iako se može širiti i prema desnoj ruci, vratu i donjoj čeljusti te prema epigastriju. Infarkt donje stijenke srca, tzv. inferiorni infarkt, manifestira se dominantno bolovima u epigastriju. Prateći simptomi i znakovi uključuju bljedoću i preznojenost, mučninu i povraćanje, parestezije u ekstremitetima, dispneju te izražen strah od nadolazeće smrti. Bolovi ne mijenjaju svoj intenzitet niti karakteristike promjenama položaja tijela niti su povezani s disanjem.
Atipične manifestacije. Kod oko 20 % bolesnika STEMI se može prezentirati atipičnom kliničkom slikom. Žene, stariji bolesnici i osobe koje boluju od šećerne bolesti ne moraju imati opisanu tipičnu kliničku sliku jer kod njih uslijed razvijene neuropatije osjet bola ne mora biti jako izražen te oni mogu biti u potpunosti asimptomatski ili se žaliti na neodređenu i nespecifičnu nelagodu u prsnom košu (tzv. prekordijalne opresije), naglo nastalu slabost i mučninu, nedostatak zraka i sl.
Fizikalni pregled. Bolesnici sa STEMI-e obično su blijedi, hladnih okrajina te orošeni hladnim i ljepljivim znojem. Na psihičkom planu jasno pokazuju znakove anksioznosti i nemira pokušavajući smanjiti osjet bola promjenama položaja tijela, savijanjem, istezanjem, okretanjem u krevetu. Kod velikoga dijela bolesnika srčana frekvencija i krvni tlak su uredni, dok kod jedne četvrtine nalazimo znakove aktivacije simpatikusa s tahikardijom i hipertenzijom, a kod bolesnika s inferiornim infarktom možemo naći i znakove parasimpatičke aktivnosti s bradikardijom i hipotenzijom. Bolesnici u kardiogenom šoku imaju poremećaj stanja svijesti, izraženu hipotenziju i oliguriju. Auskultacijski nalaz srca kod većine je bolesnika uredan, a nekada se može pojaviti treći i četvrti srčani ton kao znak ventrikularne disfunkcije. Pojava sistoličkoga šuma, osobito ako nije bio dokumentiran ranije, upućuje na razvoj mehaničke komplikacije kao što je ruptura papilarnoga mišića i akutna mitralna regurgitacija. Nerijetko su ovi bolesnici i subfebrilni što je rezultat otpuštanja pirogenih tvari iz nekrotičnoga miokarda.
Dijagnoza. Inicijalna dijagnoza STEMI-a počiva na kliničkoj slici, nalazu elektrokardiograma te pozitivnom nalazu kardioselektivnih enzima, a može se dopuniti ehokardiografijom i drugim slikovnim metodama. Točno mjesto okluzije koronarne arterije vizualizira se tijekom koronarografije koja prethodi perkutanoj koronarnoj intervenciji, danas zlatnom standardu u liječenju ovih bolesnika.
EKG predstavlja osnovni dijagnostički postupak kod svih bolesnika s bolovima u prsima i/ili sumnjom na koronarnu bolest. Osim inicijalnog snimanja, EKG se treba češće ponavljati kako bi se pratila dinamika promjena, osobito kod bolesnika koji mijenjaju kliničku sliku. Klasičan vremenski slijed pojave elektrokardiografskih znakova akutne ishemije miokarda, kao i prepoznavanje lokalizacije infarkta, opisani su u poglavlju o interpretaciji elektokardiograma.
Tipičan elektrokardiografski nalaz koji upućuje na STEMI uključuje elevaciju, tj. podizanje ST-segmenta koji se mora naći u minimalno dva susjedna odvoda i mora imati sljedeće mjerne karakteristike: 1) ≥ 0,25 mV (2,5 mm) kod muškaraca mlađih od 40 godina; 2) ≥ 0,2 mV (2,0 mm) kod muškaraca starijih od 40 godina te 3) ≥ 0,15 mV (1,5 mm) kod žena u odvodima V2-V3 i/ili ≥ 0,1 mV (1,0 mm) u ostalim odvodima, a sve to uz odsutnost hipertrofije lijevoga ventrikula i bloka lijeve grane. Kod bolesnika s inferiornim infarktom preporuča se snimanje dodatna dva desna prekordijalna odvoda (V3R i V4R) jer elevacija ST-segmenta u tim odvodima (≥ 0,1 mV) upućuje na popratni infarkt desnoga ventrikula (proksimalna okluzija desne koronarne arterije). Također, depresija ST-segmenta u odvodima V1 do V3, osobito u prisutnosti pozitivnoga T-vala upućuje na infarkt stražnje stijenke usljed okluzije nedominantne lijeve cirkumfleksne arterije, zbog čega se preporuča snimanje dodatnim stražnjim odvodima (V7-V9). Elektrokardiografska dijagnostika STEMI-a može biti otežana u situacijama kao što su blok lijeve grane, ventrikularna elektrostimulacija, izolirani posteriorni infarkt miokarda, okluzija debla lijeve koronarne arterije.
Novonastali blok lijeve grane kod bolesnika s kliničkom sumnjom na akutnu ishemiju miokarda smatra se ekvivalentom STEMI infarkta i ti se bolesnici zbrinjavaju jednako kao i oni s tipičnom elevacijom ST-segmenta. Dijagnostički su složeniji bolesnici koji od ranije imaju blok lijeve grane i koji se prezentiraju kliničkom slikom akutnoga koronarnog sindroma. Iako postoje razni algoritmi koji se koriste u prepoznavanju STEMI-a kod bloka lijeve grane, kao npr. Sgarbossa kriteriji, oni nisu dijagnostički pouzdani. Prisutnost konkordantne ST-elevacije, tj. ST-elevacija u odvodima s pozitivnim QRS-kompleksima jedan je od najboljih pokazatelja prisutnosti infarkta. U ovim dvojbama često pomaže pozitivan brzi troponinski test s point-of-care uređajima koji potkrepljuju dijagnozu akutnoga infarkta. Klasični i modificirani Sgarbossa kriteriji prikazani su u Tablici 1.43.
|
Tablica 1.43. Originalni Sgarbossa kriteriji
|
|
Kriterij
|
Broj bodova
|
|
Konkordantna ST-elevacija ≥ 1 mm (u odvodima s pozitivnim QRS-kompleksima)
|
5
|
|
Konkordantna ST-depresija ≥ 1 mm (odvodima V1 do V3)
|
3
|
|
Izražena diskordinantna ST-elevacija ≥ 5 mm (u odvodima s negativnim QRS-kompleksima)
|
2
|
|
Zbroj bodova od 3 i više nosi 90 %-tnu specifičnost na prisutnost akutnoga infarkta.
|
Ventrikularna elektrostimulacija onemogućava odgovarajuću analizu i tumačenje ST-segmenta. Kod ovih se bolesnika dijagnoza temelji na kliničkoj procjeni i pozitivnim kardioselektivnim enzimima. Kada se zna da bolesnik nije u potpunosti ovisan o ventrikularnoj elektrostimulaciji, može se izvršiti reprogramiranje kako bi se analizirao elektrokardiogram bez ventrikularne elektrostimulacije, što dolazi u obzir samo ako ne odgađa vrijeme početka reperfuzijske terapije.
Dijagnoza izoliranog STEMI-a stražnje stijenke često ostaje neprepoznata ako se elektrokardiografski nalaz ne interpretira detaljno. Dominantni nalaz koji ukazuje na izolirani STEMI stražnje stijenke uključuje izoliranu depresiju ST-segmenta ≥ 0,05 mV u odvodima V1 do V3 na 12-kanalnom EKG-u. Kod takvih se nalaza preporuča snimanje s dodatnim posteriornim odvodima (V7-V9) u kojima se uočava ST-elevacija veća od 0,05 mV (odnosno 0,1 mV za muškarce mlađe od 40 godina).
Elektrokardiografski nalaz okluzije glavnoga debla lijeve koronarne arterije (engl. left main coronary obstruction) ne predstavlja upečatljiv nalaz na prvi pogled, a predstavlja kritično kliničko stanje. Na ovu situaciju ukazuje prisutnost depresije ST-segmenta u inferolateralnim odvodima uz elevaciju ST-segmenta koja je obično prisutna samo u aVR-odvodu, a nekada se može naći i u V1 odvodu.
Kardioselektivni enzimi. Iako se dijagnoza i odluka o hitnoj reperfuzijskoj terapiji donosi već na osnovi kliničke slike i EKG nalaza, određivanje vrijednosti kardioselektivnih enzima i dalje ima bitnu ulogu u pristupu ovim bolesnicima. Standard u biokemijskoj dijagnostici akutnoga infarkta miokarda imaju troponini (troponin T, troponin I) te kreatinin fosfokinaza (CK) i njegov izoenzim CK-MB.
Troponini (troponin T i troponin I) predstavljaju glavne kardioselektivne enzime koji se danas koriste u kliničkoj praksi. Radi se o specifičnim proteinima koji su sastavni dio sarkomera i koji se klasičnim metodama mjerenja ne detektiraju u krvi ili se detektiraju u minimalnim vrijednostima sve do pojave nekroze miokarda - kada se u većim količinama oslobađaju u krv i postaju jasno detektibilni. Njihov porast očekuje se unutar jednog do četiri sata od pojave simptoma, maksimalne vrijednosti postižu kroz 8 do 12 sati i održavaju se do 24 sata od pojave simptoma, a potom počinju padati i normaliziraju se kroz pet do deset dana. Dugo zadržavanje povišenih vrijednosti troponina u serumu može maskirati pojavu reinfarkta zbog čega je praćenje vrijednosti CK-MB-a u takvim okolnostima od velikoga značaja, s obzirom na to da se njegove povišene vrijednosti normaliziraju unutar 24 sata i stoga njihov ponovni porast sugerira razvoj reinfarkta. U kliničkoj praksi u dijagnostici infarkta miokarda nema razlike u pogledu određivanja troponina I ili troponina T, uz napomenu da je vjerojatnost lažno pozitivnih nalaza kod bolesnika s oštećenom bubrežnom funkcijom veća kod mjerenja troponina T u odnosu na troponin I. Kod interpretacije ovih nalaza treba imati na umu da povišene vrijednosti troponina nalazimo i u različitim drugim bolestima i stanjima te se njihove vrijednosti trebaju interpretirati zajedno s kliničkim i EKG pokazateljima.
Diferencijalna dijagnoza povišenih vrijednosti troponina je široka i uključuje različite bolesti i stanja: 1) ostali kardijalni uzroci (srčano popuštanje, kardiomiopatija, disekcija aorte, teška stenoza aortnoga zaliska, protrahirane tahiaritmije te traumatske i druge mehaničke ozljede miokarda); 2) pulmonalni uzroci (plućna tromboembolija, plućna hipertenzija, respiratorna insuficijencija); 3) neurološki uzroci (ishemijski ili hemoragijski inzult) te 4) ostali uzroci (septično stanje, bubrežno zatajenje).
Vrijednosti kreatinin-fosfokinaze (CK) rastu unutar 8 do 24 sata od pojave simptoma bolesti i vraćaju se u normalu kroz 48 do 72 sata. Ovaj enzim je osjetljiv, ali ne i dovoljno specifičan jer ga nalazimo i kod nekroze drugih tkiva. Da bi se postigla veća specifičnost, zajedno s CK-om određuje se i njegov izoenzim CK-MB koji je karakterističan za miokard te se prati njihov omjer. Kod infarkta miokarda CK-MB čini više od 10 % ukupnog CK-a. U zadnje vrijeme mjeri se i tzv. maseni CK-MB koji može biti pokazatelj opsežnosti akutnoga infarkta miokarda.
Ostali laboratorijski nalazi. Svim se bolesnicima standardno određuju osnovni hematološki, koagulacijski i biokemijski parametri, što je važno za otkrivanje komborbiditeta i procjenu rizičnih čimbenika koronarne bolesti (lipidogram, glikemija i sl.). Često se kod bolesnika s akutnim infarktom miokarda unutar prvih nekoliko dana prate umjereno povišene vrijednosti leukocita i C-reaktivnog proteina, koje nisu posljedica infektivnoga stanja.
Rendgenogram srca i pluća ovih bolesnika uglavnom je uredan, ali kod težih se infarkata uslijed razvoja akutnoga srčanog popuštanja mogu naći zastojni hilusi te zastojne promjene plućne cirkulacije. Kod bolesnika s proširenim medijastinumom treba diferencijalno dijagnostički misliti i na moguću akutnu disekciju aorte, osobito ako je udružena s bolovima u leđima i hipertenzivnom krizom.
Ehokardiografija omogućava brzu i laku procjenu srčane sistoličke i dijastoličke funkcije, a ima i bitnu ulogu u ocjeni veličine miokardne lezije na što ukazuje regionalni ispad kontraktiliteta miokarda. Ehokardiografija i obojeni dopler imaju glavnu ulogu u dijagnostičkoj evaluaciji bolesnika s akutnim infarktom miokarda i novonastalim šumom na srcu, s obzirom na to da omogućuju analizu valvularnoga aparata i procjenu eventualne valvularne greške kao mehaničke komplikacije akutnoga infarkta. Ehokardiografiju treba obaviti i kod svih bolesnika tijekom hospitalizacije pred otpust kako bi se procijenio stupanj oporavka miokarda nakon repefuzijskoga liječenja i radi dobivanja uvida u globalnu srčanu funkciju (postojanje i stupanj sistoličke i/ili dijastoličke disfunkcije) te postajanje aneurizme lijevoga ventrikula i/ili intramuralnoga tromba.
Radionuklidna dijagnostika (scintigrafija tehnecijem ili talijem, magnetna rezonanca uz primjenu gadolinija) ne provodi se rutinski, ali se može indicirati nakon provedene reperfuzijske terapije, s ciljem dobivanja uvida u veličinu miokardne nekroze te perfuzije i vijabilnosti miokarda, radi planiranja daljnjega liječenja.
Diferencijalna dijagnoza STEMI-a uključuje akutni perikarditis, akutni miokarditis, stresom induciranu kardiomiopatiju (Takotsubo kardiomiopatija) te ranu repolarizaciju s bolovima u prsima nekardijalnoga porijekla.
Liječenje bolesnika sa STEMI-em odvija se na nekoliko razina: zbrinjavanje bolesnika u hitnoj službi, odabir i primjena reperfuzijskoga liječenja kao glavne okosnice liječenja te nastavak konzervativnoga, medikamentnog liječenja. Sve se bolesnike nakon postavljene dijagnoze mora smjestiti u jedinice intenzivne koronarne skrbi koje omogućavaju kontinuirani nadzor, a nakon provedenoga reperfuzijskog liječenja i stabilizacije bolesnici se mogu smjestiti i na odjel uz preporuku nastavka praćenja putem telemetrije. Kod nekompliciranih bolesnika ukupno trajanje bolničkoga liječenja u prosjeku traje pet do sedam dana.
Zbrinjavanje bolesnika u hitnoj službi započinje prvim kontaktom s bolesnikom koji u anamnezi ima bolove u prsima. Nakon što se bolesniku na temelju kliničkoga nalaza i EKG kriterija postavi dijagnoza STEMI-a, indicirano je strogo mirovanje, uspostava kontinuiranoga nadzora (kontinuirano praćenje EKG zapisa) te osiguranje intravenskoga puta. Liječenje bolesnika u ovoj fazi podrazumijeva primjenu kisika, intravenskih opioida (morfij) te acetilsalicilne kiseline.
Oksigenoterapija je indicirana kod bolesnika s izraženim dispnoičnim tegobama, saturacijom arterijske krvi ispod 90 % te kod bolesnika sa znacima akutnoga srčanog popuštanja. Nije dokazana terapijska korist od primjene kisika kod bolesnika bez navedenih indikacija. Neinvazivna ili invazivna mehanička ventilacija primjenjuju se kod bolesnika s kliničkom slikom akutnoga kardiogenoga edema pluća.
Morfij je intravenski opioid koji se koristi za kupiranje bolova, a osim analgetskoga učinka, ima i anksiolitičko djelovanje što mu daje dodatnu prednost kod ovih bolesnika. Primjenjuje se intravenskim putem u dozi od 2 - 4 mg uz mogućnost ponavljanja doze nakon 10 do 15 minuta. Najčešće nuspojave su mučnina i povraćanje zbog čega se preporuča preventivna primjena antiemetika (npr. metoklopramid 10 mg iv), hipotenzija i bradikardija koje dobro reagiraju na atropin te depresija centra za disanje koja zahtijeva primjenu naloksona (0,1 - 0,2 mg iv svakih 15 minuta do oporavka disanja).
Acetilsalicilna kiselina indicirana je kod svih bolesnika sa STEMI-em, ako nije iz nekoga razloga kontraindicirana. Daje se u obliku tableta koje treba sažvakati kako bi se osigurala brža apsorpcija, a inicijalna doza iznosi 162 ili 325 mg (kod nas se standardno daje 300 mg). Ako bolesnici iz nekoga razloga ne podnose acetilsalicilnu kiselinu, mogu se primijeniti inhibitori adenozin difosfatnih receptora (P2Y12 inhibitori): klopidogrel 600 mg, prasugel 60 mg ili tikagrelor 180 mg. Ti se lijekovi primjenjuju zbog svoga snažnoga antiagregacijskog učinka na trombocite čime se ometa superponirana tromboza nakon rupture ili fisure plaka.
Kod hitnoga zbrinjavanja bolesnika sa STEMI-em desnoga ventrikula prateća hipotenzija ispravlja se nadoknadom volumena, a primjena morfija ili vazodilatatora (nitroglicerin) je kontraindicirana. Ako se hipotenzija ne korigira volumnom nadoknadom (nakon primjene 500 do 1000 ml infuzijskih otopina), indicirana je primjena dobutamina.
Reperfuzijsko liječenje STEMI-a predstavlja temelj liječenja (Slika 1.72.). Indicirano je za sve bolesnike sa STEMI-em (ili novonastalim blokom lijeve grane kao ekvivalentom STEMI-a), koji se jave u bolnicu unutar 12 sati od početka simptoma. Također, reperfuzijsko liječenje treba razmotriti i kod bolesnika sa simptomima koji su počeli i prije više od 12 sati ili kada se ono ne može točno procijeniti. Koronarna reperfuzija postiže se perkutanom koronarnom intervencijom, fibrinolitičkom (trombolitičkom) terapijom ili kirurškom revaskularizacijom.
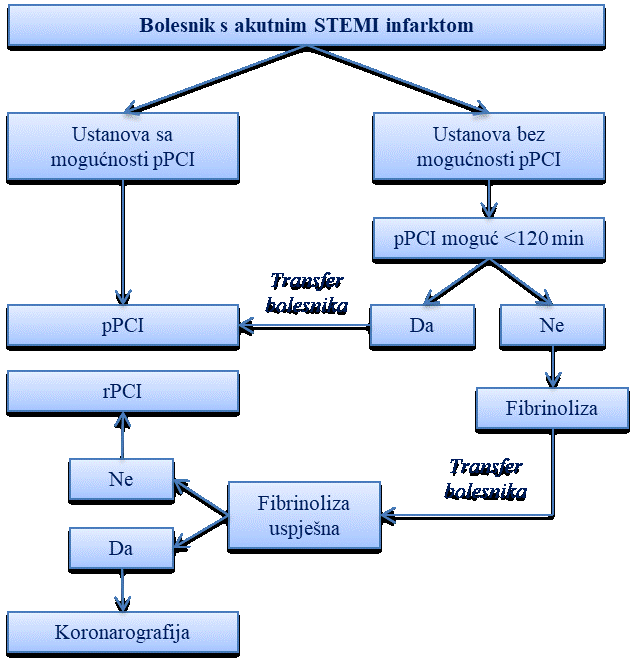
Slika 1.72. Shematski prikaz postupanja kod bolesnika sa STEMI-em.
Perkutana koronarna intervencija označava mehaničku revaskularizaciju okludirane koronarne arterije preko specijalnih katetera koji se uvode u koronarne arterije kroz femoralnu ili radijalnu arteriju. Mehanička revaskularizacija može se postići balonskom dilatacijom i postavljanjem stenta, ili u nekim slučajevima samo balonskom dilatacijom (PTCA). U osnovi se razlikuju dva oblika perkutane koronarne intervencije: primarna (pPCI) i spasilačka (rPCI - engl. rescue). O primarnoj perkutanoj koronarnoj intervenciji govori se kada se izvodi kao prva metoda u rekanalizaciji okludirane koronarne arterije, dok spasilačka perkutana koronarna intervencija predstavlja intervenciju koja se provodi nakon neuspješne fibrinolize.
Glavne prednosti perkutane koronarne intervencije u odnosu na fibrinolizu su veći postotak uspješne reperfuzije, smanjen rizik od intracerebralne hemoragije, manja učestalost rezidualnih stenoza, rekurentnih ishemija i infarkata te bolji klinički ishodi kod bolesnika s kardiogenim šokom. Glavni nedostaci u odnosu na fibrinolizu su smanjena dostupnost metode, duži vremenski period čekanja do početka terapije, ovisnost o iskustvu operatera te povećani novčani troškovi liječenja.
Standardno se prije intervencije bolesnicima daje antiagregacijska terapija, tzv. premedikacija. Dvojna antiagregacijska terapija daje se što ranije prije intervencije, a uključuje peroralnu primjenu acetilsalicilne kiseline (aspirin 300 mg) i nekog od P2Y12 inhibitora: 1) prasugrel u dozi od 90 mg u klopidogrel-naivnih bolesnika te ako bolesnici nemaju od ranije poznatu cerebrovaskularnu bolest i mlađi su od 75 godina; 2) tikagrelor u dozi od 180 mg ili 3) klopidogrel u dozi od 600 mg kada primjena prasugrela ili tikagrelora nije dostupna ili je kontraindicirana. Tikagrelor može na početku liječenja (obično u prvom tjednu terapije) biti povezan s pojavom dispneje i asimptomatske bradikardije.
Dodatno pojačanje antiagregacijskoga učinka primjenom inhibitora IIb/IIIa glikoproteina ne primjenjuje se rutinski i rezervirano je samo za pojedine slučajeve kao što su pacijenti s angiografski potvrđenim masivnim trombom unutar koronarne arterije, slabim ili odsutnim protokom krvi kroz koronarnu arteriju nakon intervencije te u slučaju distalnih embolizacija tijekom intervencije. Pri tim se indikacijama ovi lijekovi najčešće primjenjuju intrakoronarno ili intravenski tijekom same intervencije, a na raspolaganju su nam abciksimab, eptifibatid te tirofiban.
U načelu se primarnu PCI preporuča obaviti samo na arteriji odgovornoj za infarkt (engl. culprit lesion), dok se eventualne ostale stenoze (engl. non-culprit lesion) rješavaju naknadno. Iznimku čine sljedeće situacije: 1) bolesnici s kardiogenim šokom koji imaju više kritičnih stenoza (> 90 %) ili nestabilnih lezija te 2) bolesnici kod kojih je ishemija prisutna i nakon intervencije na pretpostavljenoj odgovornoj leziji.
Osnovni princip primarne PCI podrazumijeva implantaciju stenta, intraluminalne metalne potpornice koja se uvodi putem specijalnih katetera u neekspandiranom obliku na mjesto stenoze te se potom ekspandira kako bi se proširio lumen žile i tako ostao trajno prohodan. Danas na raspolaganju stoji nekoliko vrsta stentova: obični metalni stentovi (BMS, od engl. bare-metal stent), stentovi koji otpuštaju lijekove (DES, od engl. drug-eluting stent) te biorazgradivi stentovi (BRS, od engl. bioresorbable stent). Uvođenjem implantacije BMS stentova značajno su se poboljšali angiografski rezultati u odnosu na samu balonsku angioplastiku (PTCA), ali neointimalna hiperplazija i posljedična restenoza na mjestu postavljanja stenta predstavljali su velika ograničenja. Posljedično tome razvijeni su DES stentovi obloženi antiproliferativnim lijekovima koji se sporo otpuštaju i imaju lokalni antiproliferacijski učinak, čime se smanjuje rizik od neointimalne hiperplazije, ali se istodobno povećava rizik in stent tromboze zbog čega bolesnici duže vremena moraju uzimati dvojnu antiagregacijsku terapiju. Novije generacije DES stentova obložene su antiproliferativnim lijekovima koji omogućavaju endotelizaciju stenta, ali ne i proliferaciju glatkomišićnih stanica čime se i kod njih smanjuje rizik nastanka in stent tromboze, iako je ona i dalje prisutna. Biorazgradivi stentovi su izgrađeni od biorazgradivoga materijala te kroz dvije do tri godine bivaju razgrađeni unutar krvnih žila, ali nisu široko zastupljeni u kliničkoj praksi. Rizik in stent tromboze smanjuje se primjenom antiagregacijskih lijekova. Kod bolesnika s akutnim koronarnim sindromom indicirana je dvostruka antiagregacijska terapija (acetilsalicilna kiselina i P2Y12 inhibitor) tijekom perioda od jedne godine bez obzira na način liječenja i vrstu stenta, nakon čega se nastavlja doživotna terapija acetilsalicilnom kiselinom, dok daljnja primjena P2Y12 inhibitora treba biti individualizirana i utemeljena je na balansiranju između rizika tromboze i krvarenja.
Procjena različitih stupnjeva uspostavljenoga krvotoka nakon otvaranja okludirane krvne žile koja je dovela do infarkta dijeli se u nekoliko stupnjeva prema TIMI klasifikaciji (engl. thrombolysis in myocardial infarction): TIMI O (nedostatak anterogradnog protoka distalno od mjesta okluzije); TIMI I (parcijalno širenje kontrasta dalje od opstrukcije uz nedostatak punjenja distalnoga dijela žile); TIMI II (održana prohodnost žile s usporenim punjenjem i ispiranjem) te TIMI III (normalan brzi anterogradni protok i ispiranje).
Fibrinolitička terapija podrazumijeva sistemsku primjenu fibrinolitika, lijekova koji imaju sposobnost razgradnje nastaloga ugruška, čime se nastoji ponovno uspostaviti krvni protok kroz okludiranu krvnu žilu. S obzirom na prednosti primarne PCI, primjena fibrinolitika u liječenju ovih bolesnika indicirana je samo ako su ispunjeni sljedeći kriteriji: 1) vremenski period od početka simptoma nije dulji od 12 sati; 2) nemogućnost osiguranja transporta bolesnika do ustanove koja može pružiti primarnu PCI u vremenskom periodu kraćem od 120 minuta te 3) bolesnik nema kontraindikacija za primjenu fibrinolitika. Ako su ispunjeni navedeni kriteriji, opravdana je primjena fibrinolitika, ali se svakako preporuča transfer bolesnika u ustanovu koja može pružiti PCI svim bolesnicima, a to osobito vrijedni za bolesnike s neuspješnom fibrinolizom, bolesnike s razvijenim kardiogenim šokom i akutnim srčanim popuštanjem te za bolesnike s reinfarktom.
Jedan od osnovnih koraka u primjeni fibrinolitičke terapije je isključenje postojanja apsolutnih i relativnih kontraindikacija. Glavni rizik kod primjene fibrinolitika je krvarenje. Najozbiljnija i potencijalno fatalna komplikacija fibrinolitičke terapije je intrakranijska hemoragija koja se javlja u 0,5 do 1 % bolesnika, a glavni rizični čimbenik je starija životna dob (> 75 godina), ženski spol i arterijska hipertenzija.
Apsolutne kontraindikacije jesu: 1) anamneza intrakranijskoga krvarenja ili moždanoga udara nepoznatoga porijekla (ishemija, hemoragija); 2) anamneza ishemijskoga moždanog udara unutar šest mjeseci (osim akutnoga moždanog udara unutar 4 sata od razvoja); 3) tumori i AV malformacije središnjega živčanog sustava; 4) nedavna velika trauma, opsežnija operacija ili ozljeda glave u prethodna tri tjedna; 5) gastrointestinalno krvarenje u posljednjih mjesec dana; 6) poznati poremećaj krvarenja (hemoragijska dijateza); 7) suspektna ili dokazana disekcija aorte te 8) punkcije na nekompresibilnim mjestima unutar 24 sata (biopsija jetre, lumbalna punkcija).
Relativne kontraindikacije su: 1) tranzitorna ishemijska ataka (TIA) u posljednjih šest mjeseci; 2) oralno antikoagulacijsko liječenje; 3) trudnoća i stanje iza poroda (do tjedan dana); 4) refraktorna hipertenzija (RR > 180/110 mmHg); 5) uznapredovala bolest jetre; 6) infektivni endokarditis; 7) aktivna ulkusna bolest te 8) prolongirana kardiopulmonalna reanimacija (> 10 minuta).
Radi što bolje učinkovitosti fibrinolitičke terapije, potrebna je što ranija primjena (preporučeno vrijeme od dolaska do primjene lijeka je manje od 30 minuta, tzv. "door-to-needle time"). Za fibrinolitičku reperfuziju preporuča se primjena fibrin-specifičnih fibinolitika kao što su alteplaza, reteplaza ili tenekteplaza (Tablica 1.44.). Uz primjenu fibrinolitika indicirana je i istodobna primjena antiagregacijske i antikoagulacijske terapije kako je to u nastavku opisano.
|
Tablica 1.44. Doza fibrinolitika u reperfuzijskom liječenju
|
|
Fibrinolitik
|
Terapijska shema
|
|
Alteplaza (tPA)
|
1) 15 mg iv bolus;
2) 0,75 mg/kg iv tijekom 30 minuta (do 50 mg);
3) 0,5 mg/kg iv tijekom 60 minuta (do 35 mg).
|
|
Reteplaza (rPA)
|
1) 10 jedinica iv bolus
2) ponoviti 10 jedinica iv bolusa za 30 minuta
|
|
Tenekteplaza (TNK-tPA)
|
1) Jednokratni iv bolus: 30 mg (< 60 kg), 35 mg (60 - 69 kg), 40 mg (70 - 79 kg), 45 mg (80 - 89 kg) te 50 mg (> 90 kg).
|
Kao i kod primarne PCI, preporuča se dvojna antiagregacijska terapija koju čine acetilsalicilna kiselina u početnoj dozi od 300 mg tbl, s nastavkom doze održavanja 1 x 100 mg/dan te klopidogrel ako se radi o bolesnicima mlađim od 75 godina (početna doza 300 mg tbl, nastaviti 1 x 75 mg/dan). Učinak tikagrelora i prasugrela kod primjene fibrinolitičke terapije nije istražen te se za sada ne preporuča.
Parenteralna antikoagulacija indicirana je tijekom i nakon fibrinolize. U tu se svrhu primjenjuje nefrakcionirani heparin ili niskomolekularni heparin (enoksparain), a provedena istraživanja daju kliničku prednost enoksaparinu u odnosnu na nefrakcionirani heparin. Nefrakcionirani heparin najprije se daje kao intravenski bolus u dozi od 60 ij/kg nakon čega slijedi kontinuirana intravenska infuzija u dozi od 12 ij/kg/h kroz 24 do 48 sati uz održavanje aPTV-a između 50 i 70 sekundi. Enoksaparin se osobama mlađim od 75 godina daje kao intravenski bolus od 30 mg nakon čega se nastavlja sa supkutanom primjenom od 1 mg/kg svakih 12 sati (prva doza 15 minuta nakon intravenskoga bolusa), a daje se do otpusta iz bolnice, najduže osam dana. Osobama starijim od 75 godina enoksaparin se daje bez intravenskoga bolusa, i primjenjuje se supkutano u dozi od 0,75 mg/kg svakih 12 sati. Kod bolesnika s glomerularnom filtracijom manjom od 30 ml/min, bez obzira na dob, preporučena doza se ne primjenjuje svakih 12 sati, nego svaka 24 sata. Za bolesnike koji su liječeni streptokinazom preporuča se nastavak antikoagulacijskoga liječenja fondaparinuksom (2,5 mg kao intravenski bolus nakon čega slijedi supkutana primjena u dozi od 2,5 mg jednom na dan do otpusta iz bolnice ili do najviše osam dana).
Uspješnost fibrinolitičke terapije tumači se kliničkim poboljšanjem (povlačenje bolova u prsima) te na temelju EKG kriterija koji podrazumijevaju spuštanje ST-segmenta za više od 50 % početne visine kroz 60 do 90 minuta. Kod bolesnika kod kojih se ne postignu ovi kriteriji, fibrinolizu proglašavamo neuspješnom te su ti bolesnici kandidati za spasilačku rPCI. Kod bolesnika s uspješnom fibrinolizom prema navedenim kriterijima preporuča se koronarografija unutar 3 do 24 sata od provedene fibrinolitičke terapije.
Kardiokirurška revaskularizacija (CABG, od engl. coronary artery baypass grafting) najrjeđi je oblik reperfuzijskoga liječenja kod bolesnika sa STEMI-e i manje od 5 % ovih bolesnika biva hitno operirano. Najčešće indikacije za kardiokiruršku revaskularizaciju kod ovih su bolesnika: 1) neuspješna ili komplicirana perkutana koronarna intervencija; 2) nastanak mehaničke komplikacije infarkta miokarda (ruptura miokarda, ruptura interventrikularnoga septuma, akutna mitralna regurgitacija) te 3) okluzija debla lijeve koronarne arterije i višežilna teška koronarna bolest. Postoje razmimoilaženja u stavovima oko ove indikacije, iako je sve više stavova koji preferiraju pPCI kod ovih bolesnika, osobito ako se radi o bolesniku u kardiogenom šoku te zahvat izvodi iskusan operater. Vrijeme operacije ovisi ponajprije o vremenu prezentacije bolesnika kirurgu. Ako se radi o hitnoj indikaciji za operativno liječenje, a bolesnici se nalaze u periodu od 6 sati od početka simptoma, indicira se trenutna operacija s ciljem formiranja premosnice do unutar 12 sati od početka bolova, zbog spašavanja vijabilnosti miokarda. Ako se radi o vremenu prezentacije duljem od 6 sati od početka bolova, nije za očekivati da će se premosnica formirati unutar prvih 12 sati i kod takvih je bolesnika izvjestan razvoj nekroze te se kod njih operativnom zahvatu može pristupiti kroz tri do četiri dana kada se postigne stabilizacija bolesnika. Kod bolesnika koji idu na hitnu operaciju potrebno je osigurati zadovoljavajuću hemodinamsku stabilizaciju, što može uključivati farmakoterapijske mjere te intraaortnu balonsku pumpu koja se može postaviti tijekom intervencije. Intraaortna balonska pumpa postavlja se samo ako se radi o kardiogenom šoku i mehaničkoj komplikaciji akutnoga infarkta miokarda, dok njezina uloga u ostalim indikacijama nije jasna.
Farmakoterapija i dugoročno liječenje. Osim općih mjera, pri liječenju ovih bolesnika koriste se lijekovi iz različitih skupina: antagregacijski lijekovi, antikoagulansi, beta blokatori, lijekovi s učinkom na renin-angiotenzin-aldosteron sustav, hipolipemici te ostali lijekovi.
Osnovne ili temeljne mjere liječenja ovih bolesnika podrazumijevaju prestanak pušenja, dijetnu ishranu i kontrolu tjelesne težine, primjerenu tjelesnu aktivnost te liječenje drugih čimbenika rizika (arterijska hipertenzija, hiperlipidemija, šećerna bolest). Bolesnici sa STEMI-em koji su prošli uspješnu reperfuzijsku terapiju i nemaju komplikacija mogu se mobilizirati drugi ili treći dan. Nakon otpusta se preporuča postupno povećanje aktivnosti, ali načelno se unutar četiri do šest tjedana nakon infarkta preporuča pošteda od težih psihofizičkih napora. Nakon toga se bolesnici postupno vraćaju normalnom životnom ritmu i poslu.
Antiagregacijska terapija. Acetilsalicilna kiselina (ASK) jedan je od ključnih lijekova za ove bolesnike i preporuča se svim bolesnicima koji nemaju kontraindikacije za njegovu primjenu. Kod bolesnika sa STEMI-em, bez obzira na strategiju reperfuzijskoga liječenja, treba što prije dati 300 mg ASK u obliku tablete koje bolesnici sažvaču kako bi osigurali što bržu apsorpciju, a nakon toga se nastavlja s dozom od 100 mg jednom na dan, obično poslije ručka kao bi se smanjila iritacija želučane sluznice. Ta doza i način primjene lijeka preporuča se doživotno kod ovih bolesnika. Kod bolesnika kod kojih je primjena ASK kontraindicirana preporuča se primjena klopidogrela u jednoj dnevnoj dozi od 75 mg.
U prvih dvanaest mjeseci svim se bolesnicima sa STEMI-em, bez obzira na vrstu reperfuzijskoga liječenja, preporuča dvojna antiagregacijska terapija (DAPT, od engl. dual antiplatelet therapy) koju čini acetilsalicilna kiselina u kombinaciji s nekim od P2Y12 inhibitora (klopidogrel, tikagrelor, prasugel). Izbor P2Y12 inhibitora ovisi o vrsti reperfuzijskoga liječenja što je ranije opisano (klopidogrel se primjenjuje kod fibrinolize, dok je kod primarne perkutane intervencije lijek izbora tikagrelor ili prasugel, a klopidogrel se koristi iznimno). U Tablici 1.45. navedene su preporučene doze u liječenju. Do sada nije dokazana klinička korist od primjene dvostruke antiagregacijske terapije u periodu duljem od dvanaest mjeseci, a strogi minimum dvostruke antiagregacijske terapije za bolesnike koji su dobili BMS stent je mjesec dana, za DES stent šest mjeseci. Kod bolesnika s fibrilacijom atrija i potrebom za trajnom peroralnom antikoagulacijom primjenjuje se trojna terapija koju čine dvostruka antiagregacijska terapija i oralni antikoagulans (varfarin ili NOAC), ali ona nosi povećan rizik od krvarenja zbog čega se treba koristiti što je kraće moguće, iako ovo područje nema jasnih smjernica i uputa o postupanju, osim jasne upute da se pri odabiru P2Y12 inhibitora daje jasna prednost klopidogrelu.
|
Tablica 1.45. Doziranje i mjere opreza kod primjene P2Y12 inhibitora
|
|
Lijek
|
Doziranje lijeka kod bolesnika
|
Mjere opreza
|
|
pPCI
|
Fibrinoliza
|
Bez reperfuzije
|
|
Klopidogrel
|
Početna doza 600 mg, nastaviti prvih 7 dana 2 x 75 mg, potom 1 x 75 mg
|
Početna doza 300 mg, nastaviti s 1 x 75 mg kod bolesnika < 75 godina
|
1 x 75 mg/dan
|
Ne davati kod bolesnika s oštećenom funkcijom jetre.
|
|
Tikagrelor
|
Početna doza 180 mg, nastaviti 2 x 90 mg/dan
|
Nema indikaciju
|
Nema indikaciju
|
Ne davati kod bolesnika s anamnezom intrakranijske hemoragije
|
|
Prasugel
|
Početna doza 60 mg, nastaviti 1 x 10 mg/dan (odnosno 1 x 5 mg ako je tjelesna težina < 60 kg ili dob > 75 godina)
|
Nema indikaciju
|
Nema indikaciju
|
Ne davati kod bolesnika s anamnezom moždanog udara, oprez kod starijih osoba (> 75 god) i mršavih osoba(< 60 kg)
|
Antikoagulacijska terapija indicirana je kod svih bolesnika sa STEMI-e, a primjenjuje se osam dana, odnosno do otpusta. Na raspolaganju su niskomolekularni heparin (enoksaparin), nefrakcionirani heparin te inhibitor faktora Xa (fondaparinuks). Kod bolesnika podvrgnutih primarnoj koronarnoj intervenciji preporuča se supkutana primjena enoksaparina u dozi od 1 mg/kg jednom na dan, dok kod bolesnika koji su podvrgnuti fibrinolitičkoj terapiji na raspolaganju stoje nefrankcionirani heparin, enoksaparin i fondaparinuks u dozama prethodno navedenim u tekstu. Dugotrajna antikoagulacijska terapija indicirana je kod bolesnika nakon akutnoga infarkta, ako bolesnici iz nekog razloga ne mogu uzimati antitrombocitne lijekove, kod bolesnika s perzistentnom ili paroksizmalnom fibilacijom atrija, bolesnika s dokazanim intramuralnim trombom unutar lijevoga ventrikula, a može se razmotiriti i kod nekih bolesnika s ekstenzivnim poremećajem gibanja stijenke lijevoga ventrikula (hipokineza, akineza) uz izraženo sniženu istisnu frakciju (visoki rizik od nastanka ugruška). Dugotrajno antikoagulacijsko liječenje provodi se varfarinom uz održavanje INR-a između 2 i 3 ili novim antikoagulantnim lijekovima.
Blokatori beta adrenergičkih receptora predstavljaju temelj antiishemijskoga liječenja, s obzirom na to da smanjujući srčanu frekvenciju i kontraktilnost smanjuju potrebe miokarda za kisikom. Osim toga, imaju povoljan utjecaj i na električnu stabilnost miokarda što prevenira nastanak malignih poremećaja srčanoga ritma. Primjena ovih lijekova indicirana je kod svih bolesnika ako nemaju znakove srčanoga popuštanja ili neku drugu kontraindikaciju (bradikardija, srčani blokovi, teška plućna bolest). Liječenje započinje nižim dnevnim dozama (npr. bisoprolol 1,25 mg, nebivolol 2,5 mg, karvediol 6,25 mg, metoprolol 25 mg) te se one postupno povisuju do ciljnih vrijednosti uz praćenje srčane frekvencije i tlaka (držati srčanu frekvenciju iznad 60/min te sistolički tlak iznad 100 mmHg).
Inhibitori sustava renin-angiotenzin-aldosteron sastavni su dio terapije ovih bolesnika, i daju se zbog pozitivnoga učinka na proces remodeliranja miokarda čime se usporava progresija bolesti i odgađa razvoj sindroma srčanoga popuštanja. Najveću korist od ove skupine lijekova imaju bolesnici sa smanjenom istisnom frakcijom (< 40 %), bolesnici s infarktom velikoga područja miokarda, oni sa simptomima srčanoga popuštanja te bolesnici sa šećernom bolesti. Inhibitori enzima angiotenzin-konvertaze (ACE-inhibitori) lijekovi su izbora, i trebaju se uključiti u terapiju svim bolesnicima unutar prva 24 sata, ako nemaju kontraindikacije kao što su hipotenzija ili značajna bubrežna bolest. Liječenje treba započeti nižim dozama uz postupno povećanje (ramipril 2,5 - 10 mg, perindopril 2 - 8 mg, trandolapril 1 - 4 mg). Kod bolesnika koji ne toleriraju ACE inhibitore primjenjuju se blokatori angiotenzinskih receptora (ARB-ovi) kao što su valsartan (80 - 160 mg) ili losartan (25 - 100 mg). Primjena selektivnih antagonista aldosteronskih receptora kao što je eplerenon (25 - 50 mg/dan) ili spirinolakton (25 - 50 mg/dan) dokazano smanjuje ukupni i kardiovaskularni mortalitet kod bolesnika nakon preboljenoga akutnog infarkta miokarda, a uključuju se u terapiju kada je istisna frakcija manja od 40 %. Ovi se lijekovi kombiniraju s beta blokatorima i ACE-inhibitorima ili ARB-ovima, a glavna im je nuspojava hiperkalijemija, zbog čega se češće moraju kontrolirati vrijednosti kalija.
Hipolipemici. Primjena statina indicirana je kod svih bolesnika s akutnim infarktom miokarda, a započinje već u prvim danima liječenja. Osim što korigiraju hiperkolesterolemiju kao jedan od glavnih rizičnih čimbenika u razvoju kardiovaskularnih bolesti, statini imaju i povoljan učinak na stabilizaciju ateroskleroskih plakova, stoga su indicirani kod ovih bolesnika bez obzira na vrijednosti lipidograma. Obično se započinje s atorvastatinom u dozi od 80 mg/dan uz kontrolu lipidograma za četiri do šest tjedana. Kada se postigne smanjenje vrijednosti LDL kolesterola za više od 50 % početnih vrijednosti, doza se može smanjiti na 40 mg/dan. Ciljne vrijednosti LDL kolesterola kod ovih bolesnika su manje od 1,4 mmol/L. Također, ovim se bolesnicima preporuča i primjena omega-3 masnih kiselina.
Ostali lijekovi. Primjena nitrata dugoga djelovanja kod ovih bolesnika nije indicirana, a primjena nitrata kratkog djelovanja (nitroglicerin) opravdana je s ciljem automedikacije kada se kod bolesnika pojave stenokardične tegobe (postinfarktna angina). Nitroglicerin se obično koristi u obliku sublingvalnoga spreja, a primjenjuje se u dozi od 1 do 2 potiska (0,4 - 0,8 mg) kod pojave stenokardije. Bolesnike je potrebno podučiti da lijek može izazvati značajnu hipotenziju i glavobolju i da se iz toga razloga primjenjuje u sjedećem položaju. Iako se ubrajaju u antiishemijske lijekove, blokatori kalcijskih kanala nisu pokazali sposobnost smanjenja smrtnosti nakon akutnoga infarkta te se ne primjenjuju rutinski kod ovih bolesnika. Blokatori kalcijskih kanala indicirani su kod bolesnika bez značajne sistoličke disfunkcije s istisnom frakcijom > 40%, koji ne toleriraju beta blokatore i imaju potrebu za primjenom antiishemijskih/antianginalnih lijekova (amlodipin 5 - 10 mg/dan, diltiazem 120 - 480 mg/dan). Zbog primjene višestruke antitrombocitne terapije i/ili antikoagulacijske terapije preporuča se gastroprotekcija inhibitorima protonske pumpe ili blokatorima histaminskih (H2) receptora.
Prognoza. Značajan napredak u pristupu liječenja i mogućnosti reperfuzijskog liječenja doveli su do značajnoga sniženja stope mortaliteta u posljednjih dvadesetak godina. Ukupna stopa smrtnosti od STEMI-a tijekom hospitalizacije iznosi oko 5 do 6%, a ukupna jednogodišnja stopa smrtnosti iznosi 7 do 15%.
KOMPLIKACIJE AKUTNOGA INFARKTA MIOKARDA
Glavne komplikacije koje prate akutni infarkt miokarda, osobito STEMI infarkta, poremećaji su srčanoga ritma, akutno srčano popuštanje i kardiogeni šok te mehaničke komplikacije.
POREMEĆAJI SRČANOGA RITMA
Poremećaji srčanoga ritma česta su pojava kod bolesnika s akutnim koronarnim sindromom, osobito u ranoj fazi akutnoga infarkta miokarda, a većina njih je prolazna i hemodinamski beznačajna. Proaritmogeni učinak ishemije miokarda proizlazi iz nekoliko patofizioloških odrednica: naglašena aktivnost simpatikusa, poremećaj intracelularne i ekstracelularne koncentracije elektrolita, lokalni acidobazni poremećaji (stvaranje laktata), utjecaj slobodnih radikala kisika u ranoj fazi reperfuzije i sl.
Ventrikularna ekstrasistolija gotovo je redovna pojava kod bolesnika tijekom prvih dana nakon akutnoga infarkta miokarda. Povremene ventrikularne ekstrasistole ne zahtijevaju liječenje, osim ako ne nose rizik od nastanka malignih aritmija (učestale i polimorfne ventrikularne ekstrasistole, R na T fenomen). Liječenje se najčešće sastoji od pojačanja primjene beta blokatora ili u težim oblicima primjene amiodarona.
Akcelerirani idioventrikularni ritam često se pojavljuje nakon reperfuzije. Karakteriziraju ga široki QRS-kompleksi koji nalikuju na ventrikularnu tahikardiju, ali s nižom frekvencijom (60 - 120/min). Uspostava sinusnoga ritma gotovo je uvijek spontana te nije potrebna primjena antiaritmika.
Ventrikularna tahikardija (VT) također je česta kod bolesnika nakon infarkta miokarda, osobito u prvim satima nakon reperfuzijske terapije. One su obično kratkoga trajanja, spontano se vraćaju u sinusni ritam i ne izazivaju hipotenziju (tzv. samoprekidajuća ventrikularna tahikardija, engl. non-sustained VT). Dulje epizode VT-a (engl. sustained VT) mogu dovesti do hemodinamske nestabilnosti i srčanoga popuštanja, a mogu prijeći i u ventrikularnu fibrilaciju ili VT bez pulsa. Kod bolesnika s VT-om i nepovoljnim znakovima indicirana je hitna elektrokardioverzija (sinkroni DC šok 100 - 150 J), dok je liječenje hemodinamskih stabilnih bolesnika medikamentno, a lijek izbora je amiodaron: 150 - 300 mg bolusno ili u obliku infuzije kroz pola sata uz nastavak kontinuirane primjene amiodarona 450 - 600 mg tijekom 24 sata, doza amiodarona ne bi trebala prijeći 1200 mg u 24 sata.
Ventrikularna fibrilacija i ventrikularna tahikardija bez pulsa predstavljaju arestne aritmije koje nalažu trenutnu kardiopulmonalnu reanimaciju. Mogu nastati iznenada ili iz prethodne ventrikularne tahikardije. Presudnu ulogu u liječenju ovih malignih poremećaja srčanoga ritma ima rana defibrilacija. Što je veći vremenski odmak od nastupa VF/VT-a bez pulsa do defibrilacije, to je i manja šansa za povrat u neki ritam koji je spojiv sa životom (ne nužno sinusni ritam). Pojava ventrikularnih poremećaja ritma u prvih 48 sati ne smatra se dugoročno lošim prognostičkim znakom. Njihova pojava nakon 48 sati od početka bolesti smatra se lošim prognostičkim znakom i zahtijeva ugradnju kardioverter-defibrilatora (ICD). Indikacije za ugradnju ICD-a navedene su u Tablici 1.46.
|
Tablica 1.46. Indikacije za ugradnju ICD-a kod bolesnika nakon akutnoga infarkta miokarda
|
|
1) Primarna prevencija kod bolesnika kod kojih je dokazana permanentno oštećena funkcija lijevoga ventrikula (EF < 35 %) u periodu duljem od šest tjedana od akutnoga infarkta miokarda.
2) Sekundarna prevencija kod bolesnika koji su imali hemodinamski značajnu ventrikularnu tahikardiju ili ventrikularnu fibrilaciju, a nakon 48 sati od početka bolesti.
|
Novonastala fibrilacija atrija razvije se kod oko 28 % bolesnika s akutnim infarktom miokarda i to najčešće unutar prva 24 sata od nastupa infarkta. Glavni čimbenici rizika za razvoj fibrilacije atrija kod ovih bolesnika su uznapredovala životna dob, veličina infarciranoga područja, akutno srčano popuštanje, poremećaji elektrolita (hipokalijemija, hipomagnezijemija) te hipoksija i plućni komorbiditeti. Posljedično razvoju fibrilacije atrija moguć je nastanak sistemske embolizacije te pogoršanje sistoličke funkcije uvjetovano gubitkom doprinosa atrijske kontrakcije te tahiaritmije ventrikula. Fibrilacija atrija kod ovih se bolesnika često spontano konvertira nakon kraćega vremena iznova u sinusni ritam, no ako perzistira i dovodi do tahiaritmije ventrikula, zahtijeva terapijski pristup. Kod bolesnika s brzom fibrilacijom atrija i nepovoljnim znakovima (hemodinamska nestabilnost, srčano popuštanje, klinički znakovi ishemije) indicirana je hitna elektrokardioverzija (sinkrona isporuka DC šoka od 100 J). Kod bolesnika koji nemaju izražene nepovoljne znakove liječenje je medikamentno, a za ponovnu uspostavu sinusnoga ritma, kao i za postizanje kontrole frekvencije ventrikula, najčešće se koristi amiodaron (150 mg intravenski bolus uz nastavak kontinuiranom infuzijom u dozi od 15 – 30 mg/h). Ako se ne može postići uspostava sinusnoga ritma, osnovni je cilj postići kontrolu frekvencije ventrikula, beta blokatora kod bolesnika s očuvanom sistoličkom funkcijom (metoprolol 2,5 – 5 mg iv svakih 2 – 5 minuta do postizanja ciljne frekvencije ili maksimalne doze lijeka od 15 mg tijekom 10 minuta; esmolol 50-200 mcg/kg/min). Alternativno se umjesto beta blokatora mogu primijeniti i blokatori kalcijskih kanala (diltiazem 5 - 15 mg/h). Kod razvoja fibrilacije atrija svim je bolesnicima indicirano uvođenje antikoagulacijske terapije. Uz navedeno liječenje kod većine se bolesnika postigne konverzija u sinusni ritam, dok je kod ostalih indiciran nastavak liječenja s kontrolom frekvencije ventrikula i antikoagulacijsko liječenje.
Ostale supraventrikularne tahiaritmije uključuju sinusnu tahikardiju, supraventrikularne ekstrasistole te, rijetko, supraventrikularnu tahikardiju. One su obično samoograničavajuće i uglavnom dobro reagiraju na vagalne manevre (npr. masaža karotidnoga sinusa), a kao lijek izbora nameće se intravenski adenozin. Beta blokatori mogu se koristiti u kontroli ovih ritmova samo ako se ne radi o bolesnicima sa slikom srčanoga popuštanja.
Sinusna bradikardija česta je pojava kod bolesnika s inferiornim infarktom, a razvija se obično unutar nekoliko sati od nastupa simptoma. Sinusnu bradikardiju liječimo samo kada je simptomatska, davanjem atropina (0,5 do 1 mg iv), a rijetko u obzir dolazi i ugradnja privremenog srčanoga elektrostimulatora.
Poremećaji atrioventrikularnoga provođenja najčešće se javljaju kod bolesnika s akutnim infarktom miokarda (IM) inferiorne lokalizacije. Kod infarkta inferiorne lokalizacije poremećaj provođenja obično se nalazi iznad Hisova snopa te je praćen razvojem bradikardije s uskim QRS-kompleksima (< 40/min), što je povezano s boljim kliničkim ishodima, manjim mortalitetom i češćim spontanim povratom u sinusni ritam, dok je kod IM-a anteriorne lokalizacije poremećaj provođenja obično ispod Hisova snopa, zbog čega nastaje bradikardija širokih i nepravilnih QRS-kompleksa (< 40/min) koja je povezana s lošijim ishodima i većom stopom mortaliteta te je u tom slučaju potrebna trajna elektrostimulacija. AV-blok trećeg stupnja (kompletni AV-blok) zahtijeva hitnu elektrostimulaciju koja se provodi paralelno s postupkom revaskularizacije.
AKUTNO SRČANO POPUŠTANJE I KARDIOGENI ŠOK
Definicija. Akutno srčano popuštanje i kardiogeni šok nastaju kao rezultat razvoja sistoličke disfunkcije srca uslijed nastale ishemije i nekroze miokarda. Akutno srčano popuštanje klinički postaje manifestno već kod gubitka 20 do 25 % ukupne mase miokarda, a kardiogeni šok nastaje kada je taj gubitak veći od 40 %. Akutno srčano popuštanje i kardiogeni šok predstavljaju izuzetno loše prognostičke pokazatelje i povezani su s visokom stopom smrtnosti.
Etiopatogeneza. U razvoju akutnoga srčanog popuštanja, osim ishemije i nekroze miokarda, veliku ulogu imaju i pojava ishemijom izazvanih poremećaja srčanoga ritma, kao i nastale mehaničke komplikacije (ruptura papilarnih mišića, ruptura interventrikularnoga septuma) te od ranije postojeći komorbiditeti, kao što su kronične plućne bolesti, infekcije, anemija, kronična bubrežna bolest i sl. Radi se o kombiniranom poremećaju sistoličke i dijastoličke funkcije što rezultira smanjenim minutnim volumenom i arterijskom hipotenzijom te porastom tlaka punjenja lijeve klijetke što se retrogradno prenosi na plućnu cirkulaciju te dovodi do plućne kongestije. Kardiogeni šok nastaje kao posljedica sistemske hipoperfuzije uslijed smanjenoga srčanog izbačaja i opće hipoksije što rezultira prelaskom stanica na anaerobni metabolizam praćen pojačanim stvaranjem laktata i posljedičnom metaboličkom acidozom.
Klinička slika. Glavni simptomi i znakovi posljedica su plućne kongestije (izražene dispnoične tegobe, hroptanje, nepodnošenje ležećega položaja, auskultacijski nalaz vlažnih hropaca) te smanjenoga srčanog izbačaja (blijeda i hladna koža na periferiji, filiformni puls, poremećaj stanja svijesti, oligoanurija). U određivanju težine akutnoga srčanog popuštanja kod bolesnika s akutnim infarktom miokarda služimo se Killipovom klasifikacijom (Tablica 1.47.).
|
Tablica 1.47. Killipova klasifikacija akutnoga srčanog popuštanja u akutnom infarktu miokarda
|
|
Stupanj
|
Naziv
|
Kliničke manifestacije
|
|
I. stupanj
|
Bez naziva
|
Auskultacijski nalaz uredan (bez hropaca i trećega srčanog tona)
|
|
II. stupanj
|
Plućna kongestija
|
Vlažni hropci do polovice pluća i/ili pojava trećega srčanog tona
|
|
III. stupanj
|
Plućni edem
|
Vlažni hropci iznad polovice pluća
|
|
IV. stupanj
|
Kardiogeni šok
|
Refrakterna hipotenzija, laktacidoza
|
Dijagnoza akutnoga srčanog popuštanja postavlja se na osnovi kliničke slike, EKG-a (poremećaji srčanoga ritma i provođenja, novonastali znakovi ishemije miokarda), rendgenograma srca i pluća (izražene kongestivne promjene pluća, kardiomegalija) te hitne ehokardiografije (procjena sistoličke i dijastoličke funkcije, mehaničke komplikacije).
Liječenje akutnoga srčanog popuštanja provodi se paralelno s liječenjem akutnoga infarkta miokarda i ovisi o stupnju i posljedičnim kliničkim manifestacijama. Svim bolesnicima treba osigurati odgovarajuću respiratornu potporu ovisno o težini respiratorne insuficijencije (oksigenoterapija, neinvazivna mehanička ventilacija, invazivna mehanička ventilacija).
Liječenje plućne kongestije (II. stupanj po Killipu) podrazumijeva primjenu diuretika Henleove petlje kakav je furosemid u dozi od 20 do 40 mg iv uz ponavljanje svakih 1 do 4 sata ako je to potrebno, te vazodilatatora (npr. nitroglicerin sublingvalno ili intravenski) ako je krvni tlak održan (> 90 mmHg). Također, kod svih bolesnika s održanim krvnim tlakom, normovolemijom i urednom (ili blaže poremećenom) bubrežnom funkcijom, kojima je dokazana značajna sistolička disfunkcija (EF < 40%) indicirana je što ranija primjena ACE inhibitora (ili ARB-ova) te antagonista aldosterona (značajno smanjuju remodelaciju miokarda i poboljšavaju kliničke ishode).
Liječenje plućnoga edema (III. stupanj po Killipu) podrazumijeva frakcioniranu ili kontinuiranu primjenu diuretika Henleove petlje - furosemida (20 - 40 mg iv svakih 1 - 4 sata ili 125 - 250 mg kontinuirano tijekom 24 sata), morfija (2 - 4 mg iv uz metoklopramid, prema potrebi ponoviti dozu) i vazodilatatora kada je održan krvni tlak (nitroglicerin 50 mg iv kontinuirano kroz 24 sata). U slučaju izražene hipotenzije u terapiju se uvode vazoaktivni lijekovi (dopamin, dobutamin, noradrenalin, levosimendan). Kod bolesnika s dokazanom sistoličkom disfunkcijom uz istisnu frakciju nižu od 40 %, uz odsutnost kontraindikacija preporuča se primjena antagonista aldosterona (eplerenon, spirinolakton).
Liječenje kardiogenoga šoka (IV. stupanj po Killipu) u prvom redu podrazumijeva hemodinamsku stabilizaciju bolesnika primjenom vazoaktivnih lijekova (inotropi/vazopresori) i/ili primjenom uređaja za mehaničku cirkulatornu potporu (engl. IAB – intra-aortic ballon pump; LVAD - left ventricular assist devices). Osnovnu mjeru liječenja čini hitna revaskularizacija miokarda (PCI, CABG). Kod bolesnika s kardiogenim šokom uvijek treba misliti i na druge moguće uzroke tvrdokorne hipotenzije, kao što su hipovolemija, lijekovima izazvana hipotenzija, tamponada perikarda, mehaničke komplikacije infarkta miokarda ili infarkt desnoga ventrikula. Lijek izbora u hemodinamskoj stabilizaciji ovih bolesnika je dopamin, a u obzir dolaze i dobutamin i noradrenalin i njihove kombinacije.
Prognoza. Akutno srčano popuštanje i kardiogeni šok udruženi su s lošim kliničkim ishodima i stopa jednomjesečne smrtnosti kod ovih bolesnika kreće se između 40 i 80 %. Najbolje ishode imaju bolesnici koji se hitno podvrgavaju revaskularizacijskom postupku kojime se rješava odgovorna (engl. culprit) lezija koja je dovela do IM-a. Studije koje su pratile ishode bolesnika kod kojih je primjenjivana intraaortna balonska pumpa kao opcija mehaničke cirkulacijske potpore nisu pokazale značajno bolje kliničke ishode te njezina primjena u liječenju ovih bolesnika ostaje nerazjašnjena.
MEHANIČKE KOMPLIKACIJE
Mehaničke komplikacije AIM-a čine 15 do 20 % uzroka smrti bolesnika u ranoj fazi kliničkoga tijeka bolesti. One su obično povezane s rupturom papilarnih mišića, rupturom interventrikularnoga septuma te rupturom slobodne stijenke ventrikula. U kasnijoj fazi bolesti moguć je i nastanak aneurizme lijevoga ventrikula koja nosi opasnost od stvaranja intramuralnoga tromba i sistemske embolizacije. Svako kliničko pogoršanje bolesnika praćeno novonastalim šumom na srcu u ranoj fazi infarkta miokarda treba pobuditi sumnju na nastalu mehaničku komplikaciju infarkta miokarda. Osnovna dijagnostička metoda u otkrivanju ovih komplikacija je ehokardiografija, a liječenje je u pravilu kirurško. Kod izražene hemodinamske nestabilnosti kod bolesnika s ovim komplikacijama može se primjenom intraaortne balonske pumpe pokušati postići stabilizacija, iako to predstavlja samo privremenu mjeru do konačnoga operativnog zahvata.
Ruptura papilarnih mišića rijetka je mehanička komplikacija koja nastaje uslijed ishemije i nekroze samih mišića, prisutna je kod manje od 1 % bolesnika s prednjim ili stražnjim transmuralnim infarktom lijevoga ventrikula, najčešće između 3. i 7. dana bolesti. Ruptura papilarnih mišića dovodi do akutne, teške mitralne insuficijencije koja dovodi do akutnoga srčanog popuštanja i razvoja kardiogenoga edema pluća. Na ovu komplikaciju ukazuje naglo pogoršanje kliničkoga tijeka bolesti praćeno razvojem plućnoga edema uz pojavu novonastaloga holosistoličkog šuma nad mitralnim ušćem, a često i uz pojavu trećega srčanog tona. Dijagnoza se potvrđuje EKG-om, a liječenje podrazumijeva hitan kirurški zahvat.
Ruptura interventrikularnoga septuma, slično kao i ruptura papilarnih mišića, nastaje kao komplikacija septalnoga transmuralnog infarkta miokarda. Obično se susreće kod starijih bolesnika, bolesnika s nereguliranom hipertenzijom te bolesnika koji su liječeni fibrinolizom. Nastanak rupture u području interventrikularnoga septuma uvjetuje nastanak lijevo-desnoga spoja koji ovisno o veličini može dovesti do hemodinamske destabilizacije bolesnika. Kliničke manifestacije uključuju razvoj hipotenzije, dispneje i slike dekompenzacije desne strane srca (sistemska kongestija) uz pojavu novonastaloga holosistoličkog šuma parasternalno lijevo i desno. Dijagnoza se potvrđuje ehokardiografski, a liječenje se sastoji od kirurškoga zbrinjavanja septalnoga defekta.
Ruptura slobodne stijenke ventrikula rijetka je komplikacija IM-a koja se viđa kod manje od 1 % bolesnika s naglom srčanom smrti tijekom prvih dva do sedam dana od nastupa bolesti. Ruptura je najčešće lokalizirana na prednjem zidu lijevoga ventrikula i dovodi do prodora krvi u perikard uz nastanak srčane tamponade. Ova komplikacija gotovo redovito završava smrtnim ishodom. Kod manjega broja bolesnika mjesto rupture može se spontano zatvoriti priležnim perikardom, što kasnije dovodi do formiranja pseudoaneurizme. Dijagnoza se postavlja na temelju ehokardiografije (ili neke druge slikovne metode), a liječenje je kirurško.
Aneurizma lijevoga ventrikula najčešća je mehanička komplikacija AIM-a, može se naći kod 10 do 20 % bolesnika nakon preboljenoga transmuralnog infarkta, obično prednjeg zida. Radi se o ograničenom vrećastom proširenju stijenke miokarda koje nastaje uslijed remodelacije miokarda uvjetovano stanjivanjem i istezanjem područja miokarda zahvaćenog nekrozom. To je stanje obično asimptomatsko, ali može biti uzrok sistemske embolizacije (uslijed formiranja intramuralnoga tromba), pojave ventrikularnih aritmija ili srčanoga popuštanja (veće aneurizme). Na aneurizmu lijevoga ventrikula ukazuje perzistentna elevacija ST-segmenta koja traje dulje od četiri do osam tjedana, a dijagnoza se postavlja na temelju ehokardiografije ili neke druge slikovne metode. Manje aneurizme, ako ne prave hemodinamske smetnje i ne dovode do aritmija ili srčanoga popuštanja, ne moraju se kirurški liječiti, već se prate, ali uz obveznu trajnu antikoagulacijsku terapiju. Kod bolesnika s razvijenim simptomima srčanoga popuštanja, ventrikularnim aritmijama ili opetovanim tromboembolijskim incidentima, unatoč optimalnom konzervativnom liječenju indicira se kirurško liječenje.
OSTALE KOMPLIKACIJE
Perikarditis je česta pojava kod bolesnika s transmuralnim infarktom i može se naći kod oko 20 do 50 % bolesnika. Najčešće prolazi asimptomatski i nema veći klinički značaj. Nastaje uslijed kemijskoga nadražaja priležećega perikarda nekrotičnom masom, obično se javlja tijekom prvoga tjedna bolesti. Klinički se prezentira karakterističnim bolom koji mijenja intenzitet ovisno o respiraciji i promjeni položaja s olakšanjem bola u sjedećem položaju s naginjanjem prema naprijed. Kod 20 % bolesnika može se čuti perikardijalno trenje. Dijagnoza se postavlja na temelju kliničkoga nalaza i ehokardiografije (hiperehogeni perikard, perikardijalni izljev). Posebno liječenje uglavnom nije potrebno (indometacin i kortikosteroidi slabe cijeljenje nekroze i mogu predisponirati nastanak mehaničke komplikacije). Također, potreban je dodatni oprez u primjeni antikoagulantnih lijekova zbog mogućega razvoja hemoragijskoga perikardijalnog izljeva.
Dresslerov sindrom označava rijetku autoimunu bolest koju karakterizira pojava perkarditisa i/ili pleuritisa i to u vremenskom periodu od jednoga do dvanaest tjedana od akutnoga infarkta miokarda. Otkrije se kod manje od 5 % bolesnika, a karakteriziran je leukocitozom, vrućicom, boli u prsima te rjeđe, razvojem perikardijalnoga ili pleuralnog izljeva. Dijagnoza se postavlja na osnovi anamnestičkih podataka (podatak o nedavnom akutnom infarktu miokarda), radiološke snimke pluća (pleuralni izljev) i ehokardiografije (hiperehogeni perikard, perikardijalni izljev). Liječenje uključuje kratkotrajnu primjenu nesteroidinih protuupalnih lijekova (ibuprofen, indometacin), a u težim slučajevima mogu se primijeniti i kortikosteroidi. Bolest je sklona recidiviranju u prvim mjesecima.
Intramuralni trombi i sistemska embolizacija rijetke su pojave koje se mogu naći kod bolesnika koji su preboljeli IM prednje stijenke lijevoga ventrikula većega opsega. Intramuralni trombi obično se otkrivaju na ehokardiografiji te zahtijevaju antikoagulacijsko liječenje kroz tri mjeseca (početno niskomolekularni heparin praćen peroralnom antikoagulacijom), nakon čega treba napraviti kontrolnu ehokardiografiju.
OSTALI OBLICI KORONARNE BOLESTI
Prinzmetalova (vazospastična) angina predstavlja poseban oblik stabilne koronarne bolesti koju karakterizira epizodna pojava stenokardije udružene s elevacijom ST-segmenta, uz odsutnost teške, fiksne stenoze koronarne arterije i ostalih kriterija akutnoga koronarnog sindroma. Radi se o prolaznoj transmuralnoj ishemiji miokarda koja se razvija uslijed izraženoga spazma koronarne arterije koji prekida dovod krvi miokardu, a ne pokazuje znakove aterosklerotske bolesti ili ima nesignifikantnu aterosklerotsku stenozu. Vazospazam se javlja kao posljedica endotelne i/ili vazomotorne disfunkcije koronarnih arterija (poremećaj odnosa i osjetljivosti na vazodilatacijske i vazokonstrikcijske tvari), što se češće javlja u patološki promijenjenim arterijama (ateroskleroza) ili se može javiti kao samo jedna od manifestacija sistemskoga vazomotornog poremećaja na što ukazuje povezanost s drugim bolestima koje imaju sličan patofiziološki mehanizam (Raynaudova bolest, migrena). S obzirom na to da se radi o potpunoj okluziji i transmuralnoj ishemiji, naknadna spontana reperfuzija koja nastaje nakon opuštanja koronarne arterije može biti uzrok pojave malignih poremećaja srčanoga ritma (poremećaji atrioventrikularnoga provođenja kod okluzije desne koronarne arterije ili ventrikularne tahikardije ili fibrilacije kod okluzije lijeve koronarne arterije). Stenokardija se kod ovih bolesnika obično javlja u mirovanju i to najčešće u jutarnjim satima kada je najizraženija simpatička aktivnost, iako su kod jedne trećine boelsnika tegobe povezane uz napor. Tegobe su epizodnoga karaktera, kratko traju i dobro reagiraju na primjenu nitroglicerina. Također, pojačanu učestalost ovih napadaja mogu uzrokovati i zlouporaba nikotina i alkohola, kao i nekih psihoaktivnih tvari kao što je kokain. Postavljanje dijagnoze kod ovih je bolesnika ponekad teško, a temelji se na kontinuiranoj elektrokardiografiji na kojoj se bilježi prolazna elevacija ST-segmenta u vremenu za koje bolesnik navodi da je imao stenokardiju te na koronarografiji u kojoj nalazimo nesignifikantne stenoze ili uredne koronarne arterije. Točnost dijagnoze povećava intrakoronarna primjena vazokonstriktora (npr. acetilkolin) za vrijeme koronarografije (izazivanje spazma). Liječenje podrazumijeva izbjegavanje izlaganju čimbenicima koji povećavaju učestalost napada, a medikamentna terapija zasniva se na primjeni dihidropiridinskih blokatora kalcijskih kanala (amlodipin). U načelu bolesnici s Prinzmetalovom anginom imaju dobru prognozu i petogodišnje preživljenje prisutno je u više od 95 % slučajeva.
Nijema ishemija miokarda naziv je za oblik stabilne koronarne bolesti u kojoj nalazimo objektivne pokazatelje ishemije miokarda (elektrokardiografski nalaz, koronarografski nalaz) uz odsutnost kliničkih smetnji u vidu stenokardija ili njezinih ekvivalenata. Patofiziološko objašnjenje ove pojave nije u potpunosti razjašnjeno, ali kao mogući razlozi spominju se intenzitet i trajanje ishemije (nedovoljno duga i nedovoljno jaka da bi izazvala osjet bola), razlike u individualnom osjetu bola (visok prag podražljivosti za bol), stanje povišene razine endogenih opioida (npr. endorfini, dinorfini) te poremećaji prijenosa osjeta bola, što se najčešće viđa kod bolesnika s dijabetičkom neuropatijom. Postavljanje dijagnoze kod takvih bolesnika je otežano s obzirom na to da se ne javljaju na liječničke preglede te se temelji na slučajno otkrivenom objektivnom nalazu (promjene ST-segmenta u elektrokardiogramu, ispadi kontraktiliteta na ehokardiografiji) koji nalaže daljnju dijagnostičku obradu koja je jednaka kao i kod bolesnika s prethodno opisanom stabilnom ili atipičnom anginom pektoris. Također, terapijski pristup jednak je kao i u navedenim bolestima. Nijema ishemija miokarda može biti povezana s naglom srčanom smrti uslijed ishemijom izazvanih malignih poremećaja srčanoga ritma.
NEOPSTRUKTIVNA KORONARNA BOLEST
Uvod. Neopstruktivna koronarna bolest predstavlja klinički entitet koji se odnosi na grupu bolesnika koji se prezentiraju klasičnim simptomima i znakovima koronarne bolesti, a čiji nalazi koronarografije ne pokazuju značajne (signifikantne) stenoze ili su epikardne koronarne arterije u potpunosti uredne. S obzirom na sve dostupniju invazivnu kardiološku dijagnostiku, jasno je da je ova skupina bolesnika brojna i da oni čine zaseban klinički entitet koji se po svojim karakteristikama i obilježjima razlikuje od tipične opstruktivne koronarne bolesti.
Terminologija i definicije. Kako se radi o relativno novom pojmu, do danas nema jasnih i općeprihvaćenih podjela i klasifikacija te se na ovom području susreće različita terminologija i različite podjele, no krajnje kliničko shvaćanje, dijagnostička obrada i liječenje idu u istom smjeru. Jedan od prvih pojmova koji se odnosio na ovo stanje je srčani sindrom X, no on je danas zamijenjen drugim terminima kao što su INOCA, mikrovaskularna angina te MINOCA.
INOCA (engl. ischemia and non-obstrucitve coronary artery disease) naziv je za kliničko stanje koje karakterizira klinička slika stabilne koronarne bolesti, čiji nalaz koronarografije pokazuje nesignifikantnu stenozu koronarne arterije, odnosno stenozu koja zahvaća do maksimalno 50 % lumena koronarne arterije. Za stenozu manju od 30 % možemo sa sigurnošću reći da je nesignifikantna, dok stenoze koje zahvaćaju 30 do 50 % lumena koronarne arterije zahtijevaju dodatnu procjenu hemodinamskoga značaja procjenom FFR-a (engl. fractional flow reserve) prije nego se proglase nesignifikantnom.
Mikrovaskularna angina ili sindrom koronarne mikrovaskularne disfunkcije odnosi se na kliničko stane koje također karakterizira klinička slika stabilne koronarne bolesti, ali za razliku od INOCA-e u kojoj nalazimo nesignifikantne stenoze, kod ovih su bolesnika koronarne arterije potpuno uredne te se za potvrdu ove dijagnoze trebaju provesti dodatni funkcionalni testovi kojima se dokazuje postojanje mikrovaskularne disfunkcije.
MINOCA (engl. myocardial infarction with non-obstructive coronary arteries) kliničko je stanje karakterizirano prisutnošću kliničkih i laboratorijskih znakova infarkta miokarda (stenokardija, dinamika kardioselektivnih enzima, elektrokardiografske promjene) u odsutnosti signifikantne stenoze koronarnih arterija (ili uz uredne koronarne arterije) prikazane na koronarografiji.
Epidemiologija. Stvarna prevalencija ovoga kliničkog entiteta među bolesnicima koji se prezentiraju bolovima u prsima je nepoznata, iako se može zaključiti da se radi o sve većem broju bolesnika, što je prvenstveno posljedica unaprijeđene i dostupnije dijagnostičke obrade putem koronarografije. Neopstruktivnu koronarnu bolest možemo susresti kod oba spola, u svim životnim dobima, ali obično se radi o mlađim bolesnicima. Najčešće se bolest dijagnosticira krajem četvrtoga i početkom petog desetljeća i to češće kod žena. Prosječna učestalost MINOCA-e među svim bolesnicima s infarktom miokarda iznosi oko 6 % s rasponom od 1 do 14 %, ovisno o studiji. S obzirom na to da su i kod ovih bolesnika tradicionalni rizični čimbenici jače zastupljeni nego u općoj, zdravoj populaciji pretpostavlja se da imaju određenu ulogu i u razvoju ovoga sindroma.
Patofiziologija. Iako točan etiopatogenetski mehanizam koji dovodi do ishemije u neopstruktivnoj koronarnoj bolesti nije poznat, vjeruje se da je on multifaktorske prirode, a da u osnovi nalazimo morfološki i/ili funkcionalni poremećaj endotela epikardnih koronarnih arterija i/ili mikrovaskulature miokarda što u konačnici rezultira smanjenjem perfuzije miokarda koja se definira smanjenom rezervom koronarnoga protoka (CFR, od engl. coronary flow reserve). Rezerva koronarnoga protoka definira se kao opseg povećanja koronarnoga protoka koji se može postići između bazalne i maksimalne koronarne perfuzije, tj. predstavlja omjer protoka krvi tijekom hiperemije miokarda i protoka krvi kroz miokard u mirovanju. Endotelna disfunkcija u prvom se redu očituje pojačanom osjetljivošću koronarnoga krvožilja na vazokonstriktore te smanjenom osjetljivošću na vazodilatatore što uvjetuje smanjenu perfuziju, a može biti povezana i s drugim poremećajima, kao što je hiperplazija i hipertrofija glatkomišićnih stanica mišićnoga sloja. Opisani poremećaj endotela može se javiti na strukturno zdravim krvnim žilama, ali najčešće se javlja kao posljedica aterosklerotske bolesti ili drugih bolesti koje zahvaćaju miokard, zbog čega se i razlikuje nekoliko oblika koronarne mikrovaskularne disfunkcije (Tablica 1.48.).
|
Tablica 1.48. Koronarna mikrovaskularna disfunkcija
|
|
Tip I
|
Primarna koronarna mikrovaskularna disfunkcija u odsutnosti opstruktivne bolesti koronarnih arterija i/ili bolesti miokarda.
|
|
Tip II
|
Koronarna mikrovaskularna disfunkcija u podlozi bolesti miokarda kao što je hipertenzivna bolest miokarda ili hipertrofijska kardiomiopatija.
|
|
Tip III
|
Koronarna mikrovaskularna disfunkcija u podlozi opstruktivne koronarne bolesti.
|
|
Tip IV
|
Koronarna mikrovaskularna disfunkcija udružena s revaskularizacijom miokarda.
|
|
Tip V
|
Koronarna mikrovaskularna disfunkcija nakon transplantacije srca.
|
Kod jednoga dijela bolesnika s bolovima u prsima koji imaju karakter anginoznih smetnji, a ne mogu se povezati s opstruktivnom koronarnom bolesti, oni ne moraju nužno biti povezani s neopstruktivnom koronarnom bolesti, nego se može raditi o izraženoj hiperalgeziji, tj. pojačanoj osjetljivosti na osjet bola, što može biti uzrokovano poremećajem simpatovagalne inervacije ili smanjene aktivnosti endogenoga opioidnog sustava.
U etiopatogenezi MINOCA-e najčešće se spominju protrahirani spazam koronarnih arterija, disekcija koronarne arterije, vaskulitisi koronarnih arterija, Takotsubo kardiomiopatija, miokarditis, embolija koronarnih arterija (tromboembolija, zračna embolija) te drugi oblici infarkta miokarda tipa 2.
Klinička slika bolesnika s neopstruktivnom koronarnom bolesti slična je kao i kod bolesnika s opstruktivnom koronarnom bolesti. Bolesnici imaju dominantno izražene anginozne tegobe ili njezine ekvivalente, koji se ne moraju nužno javljati pri naporu nego već i u mirovanju. Također, anginozne smetnje u pravilu traju nešto dulje nego one kod bolesnika s opstruktivnom koronarnom bolesti i pokazuju slabiji odgovor na primjenu nitroglicerina. Pri fizikalnom pregledu ne nalazimo specifičnih kliničkih obilježja.
Dijagnoza. Početna dijagnostička obrada kod ovih bolesnika jednaka je kao i kod bolesnika s opstruktivnom koronarnom bolesti, a uključuje detaljnu anamnezu i fizikalni pregled te inicijalne neinvazivne dijagnostičke metode (EKG u mirovanju i naporu, ehokardiografija, scintigrafija miokarda) nakon kojih može slijediti invazivna kardiološka obrada putem koronarografije. Koronarografija je ključna za definiranje ovih bolesnika: kada se koronarografijom otkriju nesignifikantne stenoze (< 50%) ili uredne epikardne koronarne arterije, postavlja se dijagnoza neokluzivne koronarne bolesti. Daljnja dijagnostička obrada koja se može provoditi kod ovih bolesnika nije sastavni dio rutinske obrade i može uključivati nekoliko metoda: procjena hemodinamske značajnosti nesignifikatne stenoze (FFR, engl. fractional flow reserve), mjerenje rezerve koronarnoga protoka (CFR, engl. coronary flow reserve) te ispitivanje mikrovaskularnoga spazma (test acetilkolinom i adenozinom).
FFR (engl. fractional flow reserve) predstavlja metodu koja se koristi u procjenjivanju hemodinamskoga značaja nesignifikantnih stenoza koje opstruiraju 30 do 50 % lumena koronarne arterije (stenoze koje opstruiraju manje od 30 % lumena nedvojbeno su hemodinamski neznačajne), a sama metoda ima veliki klinički značaj u pogledu procjene potrebe za perkutanom intervencijom. Hemodinamski značajne stenoze su one koje mogu dovesti do ishemije miokarda i kao takve zahtijevaju intervencijsko liječenje. Metoda se temelji na mjerenju tlakova unutar koronarne arterije posebnim kateterima u dvije točke: proksimalno (pa) i distalno od mjesta stenoze (pd). Omjer dobivenih vrijednosti (pd/pa) predstavlja FFR i ako je on manji od 0.80, ukazuje na hemodinamski značajnu stenozu. Mjerenja se provode u stanju hiperemije miokarda što se izaziva primjenom adenozina ili papaverina.
CFR (engl. coronary flow reserve) mjera je koja predstavlja maksimalno povećanje protoka krvi kroz koronarne arterije iznad normalnoga volumena u mirovanju, a smanjenje CFR-a ukazuje na prisutnost mikrovaskularne disfunkcije unatoč morfološki urednim koronarnim arterijama. Mjerenje CFR-a podrazumijeva mjerenje protoka krvi kroz koronarne arterije posebnim metodama (doplerska metoda, termodilucijska metoda) u mirovanju i nakon infuzije koronarnoga vazodilatatora (adenozin), a njihov omjer predstavlja CFR i normalno iznosi 2,5 do 5. Vrijednosti CFR-a niže od 2,5 ukazuju na prisutnost mikrovaskularne disfunkcije te se tada sa sigurnošću može reći da su bolesnikove tegobe posljedica ishemije miokarda uzrokovane mikrovaskularnom disfunkcijom, tj. da ima mikrovaskularnu anginu. Osim koronarografski, CFR se može mjeriti i pomoću posebne doplerske tehnike tijekom ehokardografije i uz pomoć pozitron emisijske tomografije (PET).
Ispitivanje mikrovaskularnoga spazma podrazumijeva provokacijske koronarne testove koji se temelje na primjeni vazokonstriktora ili vazodilatatora i praćenjem odgovora koronarnih arterija na njihovu primjenu. Neodgovarajući vazokonstrikcijski ili vazodilatacijski odgovor također ukazuje na endotelnu, odnosno mikrovaskularnu disfunkciju. U tu se svrhu najčešće primjenjuje acetilkolin koji fiziološki dovodi do vazodilatacije, no u prisutnosti endotelne disfunkcije dovodi do paradoksalne vazokonstrikcije. Test se smatra pozitivnim ako tijekom primjene acetilkolina dođe do smanjenja promjera koronarnih arterija za više od 75 % u odnosu na početni promjer te bolesnik razvije klinička i EKG obilježja ishemije miokarda. U procjeni mikrovaskularnoga spazma može se koristiti i adenozin koji dovodi do dilatacije koronarnih arterija. Izostanak vazodilatacije koronarnih arterija nakon primjene adenozina, kao i vrijednost CRF-a niža od 2,5, ukazuje na endotelnu disfunkciju i smanjenu osjetljivost koronarnih arterija na vazodilatatore.
Ako su nalazi navedenih pretraga i mjerenja uredni kod bolesnika kod kojih se sumnja na neopstruktivnu koronarnu bolest, s velikom se sigurnošću može ustvrditi da ona nije uzrok bolesnikovih tegoba zbog kojih je i započeta obrada i zbog kojih je bolesnik podvrgnut koronarografiji.
Dijagnostički kriteriji za postavljanje dijagnoze MINOCA-e su: 1) prisutnost kriterija za postavljanje dijagnoze akutnoga infarkta miokarda prema univerzalnoj definiciji infarkta miokarda; 2) nalaz neopstruktivne koronarne bolesti na koronarografiji (uredne arterije ili nesignifikantne stenoze) te 3) jasna odsutnost drugoga kliničkog uzroka koji može dovesti do akutne ozljede miokarda.
Liječenje. Pri stabilnoj neopstruktivnoj koronarnoj bolesti temelj liječenja čini djelovanje na rizične čimbenike koji su jednaki kao i za opstruktivnu koronarnu bolest te povremena primjena kratkodjelujućih nitrata (nitroglicerin sublingvalno). Kod bolesnika kod kojih se tim intervencijama ne postiže kontrola bolesti lijekovi izbora su beta blokatori (npr. bisoprolol u početnoj dozi od 2,5 mg/dan uz postupnu titraciju do 10 mg/dan ako to bolesnik tolerira), a kada ih bolesnici ne toleriraju ili su kontraindicirani, ili ne pokazuju uspjeh u pogledu kontrole bolesti, u terapiju je potrebno uvesti kalcijske blokatore (diltiazem u obliku sporo otpuštajućih tableta u početnoj dozi od 180 mg/dan do maksimalne doze od 540 mg/dan). Kombinacija beta blokatora i blokatora kalcijskih kanala nije opravdana. Primjena blokatora kalcijskih kanala kao lijekova prvoga izbora opravdana je kod bolesnika kod kojih se pretpostavlja da je glavni patogenetski mehanizam bolesti vazokonstrikcija. Iako nema jasnih dokaza, primjena acetilsalicilne kiseline i statina čini se opravdanom u slučaju dokaza aterosklerotske bolesti ili prisutnosti višestrukih rizičnih čimbenika. Ovisno o okolnostima i drugim indikacijama, u obzir dolazi i primjena lijekova s utjecajem na renin-angiotenzin sustav. Od ostalih lijekova koja imaju potencijalni terapijski učinak kod ovih bolesnika navode se triciklički antidepresivi (imipriamin), estrogeni, inhibitori fosfodiesteraze (sildenafil), L-arginin, ranolazin, ivabradin te metformin. Liječenje MINOCA-e temelji se na etiopatogenetskom mehanizmu.
PREVENCIJA KARDIOVASKULARNIH BOLESTI
Uvod. Prevencija kardiovaskularnih bolesti obuhvaća skup postupaka i intervencija čiji je cilj otkrivanje potencijalnih rizičnih čimbenika koji se povezuju s njihovim razvojem te njihovo uklanjanje ili umanjenje njihova učinka. Ostvaruje se populacijskim pristupom, tj. djelovanjem na cijelu populaciju mijenjanjem načina života i čimbenika okoliša te društvenih i ekonomskih odrednica, ili individualnim pristupom usmjerenim na pojedinca i otkrivanjem i liječenjem čimbenika rizika kod njega. Smatra se da više od 50 % smrti vezanih uz koronarnu bolest može biti prevenirano djelovanjem na rizične čimbenike.
Procjena kardiovaskularnoga rizika. Osnovni korak u prevenciji kardiovaskularnih bolesti je procjena rizika za njihovu pojavnost u pojedinaca. Prema smjernicama Europskoga kardiološkog društva sistematičnu procjenu kardiovaskularnoga rizika treba započeti kod svih muškaraca u dobi iznad 40 i žena iznad 50 godina ako nemaju već od ranije poznate kardiovaskularne rizike (obiteljska anamneza, hiperkolesterolemija, arterijska hipertenzija, pušenje, šećerna bolest), a kod osoba s povećanim kardiovaskularnim rizikom procjenu treba raditi i ranije. Procjenu treba ponavljati svakih pet godina, a kod rizičnih osoba i češće.
SCORE tablice. Za procjenu kardiovaskularnoga rizika u praksi se najčešće koriste SCORE tablicama (engl. systemic coronary risk estimation) kojima se procjenjuje desetogodišnji rizik od smrti uzrokovane kardiovaskularnim bolestima. Korištenje SCORE tablica namijenjeno je naizgled zdravim bolesnicima koji do sada nisu oboljeli od kardiovaskularne bolesti i nemaju vrlo visok ili visoki rizik od obolijevanja od kardiovaskularnih bolesti. Procjena rizika SCORE tablicama temelji se na dobi i spolu bolesnika, kao i prisutnosti i izraženosti najvažnijih rizičnih čimbenika, a to su pušenje, hiperkolesterolemija te vrijednost sistoličkoga krvnog tlaka. Na temelju poznavanja tih parametara iz SCORE tablice se jednostavnim pregledom može odrediti desetogodišnji rizik izražen u postocima. Ovisno o postotku procijenjenoga rizika, bolesnike se svrstava u jednu od skupina: 1) osobe s niskim ili umjerenim rizikom (SCORE < 5 %); 2) osobe s visokim rizikom (SCORE 5 – 9 %) te 3) osobe s vrlo visokim rizikom (SCORE > 10 %). Razlikuju se dvije vrste SCORE tablica: one koje se koriste u zemljama s niskim rizikom od obolijevanja od kardiovaskularnih bolesti te one koje se koriste u zemljama s visokim i vrlo visokim rizikom u koje ubrajamo i Hrvatsku.
Kategorije rizika od kardiovaskularnih bolesti. S obzirom na prisutnost određenih bolesti i rizičnih čimbenika te njihov izražaj, kao i SCORE rezultata, osobe možemo kategorizirati u četiri skupine ovisno o riziku od pojavnosti kardiovaskularnih bolesti: vrlo visok rizik, visok rizik, umjeren rizik te nizak rizik.
Osobe s vrlo visokim rizikom su osobe koje imaju neki od sljedećih kriterija: 1) verificirana kardiovaskularna bolest; 2) šećerna bolest s oštećenjem ciljnih organa (npr. proteinurija) ili pridruženi veliki rizični čimbenici (pušenje, hiperkolesterolemija, hipertenzija); 3) kronična bolest bubrega s GFR-om < 30 mL/min/1.73m2; 4) dijagnostičkim metodama (koronarografijom ili CD-om karotida) dokazana ateroskleroza (plak) na epikardijalnim arterijama ili karotidama te 5) SCORE rizik > 10%.
Osobe s visokim rizikom osobe su koje imaju bilo koji od sljedećih kriterija: 1) šećerna bolest tip 2 bez drugih KV čimbenika ili oštećenja ciljnih organa; 2) značajno visoki pojedinačni čimbenici rizika trigliceridi > 8 mmol/L, LDL > 4,9 mmol/L, RR ≥ 180/110 mmHg, osobe s obiteljskom hiperkolesterolemijom; 3) umjerena kronična bubrežna bolest (GFR 30 - 59 mL/min/1.73 m2) te 4) SCORE rizik između 5 i 10 %.
Osobe s umjerenim rizikom su one koje imaju SCORE ≥ 1 i < 5%, a osobe s niskim rizikom su one koje imaju vrijednosti SCORE < 1 %.
Razine prevencije kardiovaskularnih bolesti. Prevencija kardiovaskularnih bolesti odvija se na dvije razine: primarna i sekundarna. Primarna prevencija usmjerena je na zdrave ili bolesne osobe koje nisu razvile neku od kardiovaskularnih bolesti, dok se sekundarna prevencija odnosi na osobe koje su već razvile neku od kardiovaskularnih bolesti te su njezine mjere usmjerene na sprečavanje novih kardiovaskularnih incidenata i poboljšanje kvalitete života. U kontekstu prevencije kardiovaskularnih bolesti razlike između mjera primarne i sekundarne prevencije nisu razgraničene i većina se preventivnih mjera koristi i u jednom i u drugom obliku prevencije, kao što su npr. promjena životnoga stila i navika. Mjere primarne i sekundarne prevencije mogu biti nefarmakološke i farmakološke (Tablica 1.49.).
Nefarmakološke mjere prevencije kardiovaskularnih bolesti podrazumijevaju prestanak pušenja, promjene prehrambenih navika, odgovarajuću tjelesnu aktivnost, normalizaciju tjelesne težine te suzbijanje psihosocijalnoga stresa i depresije.
Prestanak pušenja predstavlja jednu od najučinkovitijih mjera prevencije kardiovaskularnih bolesti, s obzirom na to da je pušenje pored hiperlipidemije jedan od najznačajnijih rizičnih čimbenika. Nakon prestanka pušenja rizik od ovih bolesti kod osobe se izjednačava s rizikom kod nepušača nakon tri do pet godina. Preporuča se izbjegavati i pasivne oblike pušenja. Osim savjetovanja o nužnosti prestanka pušenja, na raspolaganju su i druge metode koje uključuju bihevioralni pristup i farmakoterapiju.
Promjena prehrambenih navika ima izravan utjecaj na smanjenje rizika od nastanka samih kardiovaskualrnih bolesti, kao i njezinih drugih rizičnih čimbenika (arterijska hipertenzija, hiperlipidemija, šećerna bolest). Koncept zdrave prehrane podrazumijeva smanjenje unosa zasićenih masnih kiselina u zamjenu za nezasićene masne kiseline (omega-3 masne kiseline, mononesaturirane i polinesaturirane masne kiseline), smanjen unos soli (< 5 g/dan), pojačani unos voća (> 200 g/dan) i povrća (> 200 g/dan), unos 30 do 45 g vlakana dnevno (žitarice cijelog zrna) te ograničenje unosa alkohola do 20 g/dan za muškarce i 10 g/dan za žene.
Odgovarajuća tjelesna aktivnost značajna je mjera kojom se smanjuje ukupni kardiovaskularni rizik, a povećava kardiorespiratorna kondicija, smanjuje pojavnost drugih komorbiditeta te značajno poboljšava kvaliteta života. Zdravim odraslim osobama preporuča se umjerena tjelesna aktivnost u trajanju od najmanje 150 minuta kroz period od tjedan dana ili 75 minuta ako se radi o intenzivnim tjelesnim naporima. Bolesnicima s već razvijenim kardiovaskularnim oboljenima, ako im to stanje dopušta, preporuča se svakodnevna tjelesna aktivnost u trajanju od 30 do 60 minuta u vidu brzoga hoda, vožnje biciklom ili laganoga plivanja.
Normalizacija tjelesne težine postiže se prethodno navedenim mjerama promjene prehrambenih navika, zdravom ishranom i tjelesnom aktivnošću. U svrhu prevencije kardiovaskularnih bolesti preporuča se postizanje i održavanje indeksa tjelesne mase između 20 i 25 kg/m2 uz obim struka < 94 cm za muškarce i < 80 cm za žene.
Suzbijanje psihosocijalnoga stresa i depresije također ima značajnu ulogu u prevenciji kardiovaskularnih bolesti (smanjenje simpatičkoga odgovora, smanjeno lučenje kortizola) te se svima preporuča redukcija stresa (odmor, strukturiran fizički trening) te eventualna psihofarmakoterapija kod osoba s izraženim poremećajem raspoloženja (depresija).
|
Tablica 1.49. Glavni ciljevi primarne i sekundarne prevencije kardiovaskularnih bolesti
|
|
Pušenje
|
Izbjegavanje izloženosti duhanskom dimu u bilo kojem obliku (aktivno/pasivno pušenje)
|
|
Prehrana
|
Zdrava ishrana koja se temelji na smanjenom unosu zasićenih masnih kiselina i naglaskom na cjelovitim žitaricama, voću i povrću te ribi.
|
|
Tjelesna aktivnost
|
Najmanje 150 minuta umjerene tjelesne aktivnosti kroz tjedan dana (30 minuta kroz pet dana) ili 75 minuta intenzivne tjelesne aktivnosti kroz tjedan dana (15 minuta kroz pet dana).
|
|
Krvni tlak
|
Generalno vrijednosti niže od 140/90 mmHg (viša u starijih osoba, niža u dijabetičara).
|
|
Lipidogram (ciljne vrijednosti)
|
LDL kolesterol
|
Bolesnici s vrlo visokim rizikom: < 1,4 mmol/L ili > 50% redukcije
Bolesnici s visokim rizikom: < 1,8 mmol/L ili redukcija od najmanje 50 %
Bolesnici s umjerenim rizikom: < 2,6 mmol/L
Bolesnici s niskim rizikom: < 3,0 mmol/L
|
|
HDL kolesterol
|
Ne postoji ciljna vrijednost, preporuča se > 1,0 mmol/L za muškarce i > 1,2 mmol/L za žene
|
|
Trigliceridi
|
Ne postoji ciljna vrijednost, preporuča se < 1,7 mmol/L
|
|
Šećerna bolest
|
HbA1c < 7%
|
Farmakološke mjere prevencije kardiovaskularnih bolesti. Primjena određenih skupina lijekova pokazala je pozitivan učinak u pogledu prevencije kardiovaskularnih bolesti, bilo da se radi o primarnoj prevenciji, bilo sekundarnoj. Lijekovi koji se najčešće spominju u tom kontekstu su beta blokatori, antiagregacijski lijekovi, hipolipemici (statini i ostali) te lijekovi s učinkom na renin-angiotenzin sustav. Njihova uloga i značaj kod bolesnika s koronarnom bolesti opisana je u odgovarajućim dijelovima udžbenika (vidi terapija stabilne koronarne bolesti i akutnoga koronarnog sindroma).
Definicija i epidemiologija. Akutna reumatska vrućica predstavlja autoimunu, multisistemsku upalnu bolest koja nastaje kao komplikacija preboljene nazofaringealne infekcije koju uzrokuje β-hemolitički streptokok grupe A, a očituje se afekcijom srca (endokarditis), zglobova (artritis), središnjega živčanog sustava (koreja) te kože i potkožnoga tkiva (eritema marginatum, supkutani čvorići). Učestalost ove bolesti široko varira od manje od 0,5% na 100 000 stanovnika u visoko razvijenim zemljama do više od 100 na 100 000 stanovnika u nerazvijenim i siromašnim zemljama. Reumatska vrućica nešto se češće javlja kod žena u odnosu na muškarce, najčešće u dobi između 5 i 15 godina. Pojava bolesti prije 5. godine života, kao i nakon 40. godine izuzetno je rijetka. Klinički tijek bolesti može biti samoograničavajući s potpunom rezolucijom ili sporoprogredirajući s razvojem kronične valvularne bolesti (najčešće mitralne stenoze), što se naziva kroničnom reumatskom bolesti srca.
Etiopatogeneza. Akutna reumatska vrućica nastaje kao posljedica asimptomatske ili simptomatske infekcije nazofarinksa koju uzrokuje β-hemolitički streptokok grupe A, koja se obično razvija u vremenskom periodu od dva do tri tjedna nakon infekcije, dok je ranija ili kasnija pojava moguća, ali izuzetno rijetka pojava. Karakteristično je da pojavnost akutne reumatske vrućice nakon infekcija ovim uzročnikom drugih lokalizacija (npr. koža, mokraćni sustav) nije zabilježena. Opće prihvaćena teorija o nastanku akutne reumatske vrućice podrazumijeva autoimuni mehanizam koji nastaje kao posljedica križne reaktivnosti u kojoj protutijela stvorena na antigene bakterije (M-protein, N-acetilglukozamin, streptokinaza) zbog svoje strukturne sličnosti reagiraju na vlastite antigene endokarda, miokarda, perikarda, zglobova, kože i središnjega živčanog sustava pri čemu se razvijaju upala i oštećenja. U novije se vrijeme ispituje i genetska predispozicija za razvoj bolesti, a smatra se da je njezina pojavnost veća kod bijelaca s HLA-DR4 haplotipom.
Patologija. Kako je već navedeno, akutna reumatska vrućica multisistemska je bolest koja najčešće zahvaća srce, zglobove, središnji živčani sustav te kožu i potkožno tkivo. Zahvaćenost srca očituje se upalom jednog ili sva tri srčana sloja (endokarditis, miokarditis, perikarditis, pankarditis), a najčešću kliničku manifestaciju predstavlja endokarditis (reumatski endokarditis), često praćen nastankom kronične deformacije zalistaka, što uvjetuje razvoj valvularne greške (kronična reumatska bolest srca). Najčešće se radi o mitralnom zalisku (75 – 80 %), dok je zahvaćenost drugih zalistaka nešto rjeđa (aortni zalistak 30 %, trikuspidalni i zalistak plućne arterije < 5 %). Reumatski miokarditis karakteristično je obilježen stvaranjem brojnih žarišta fibrinoidne nekroze koju nazivamo Aschoffova tjelešca te predisponira pojavu poremećaja srčanoga ritma, srčanoga popuštanja i tromboembolijskih incidenata. Perkiarditis je često obilježen nastankom perikardijalnoga izljeva. Afekcija zglobova očituje se kao migratorni poliartritis kod kojega dominiraju eksudacijske promjene bez značajnije proliferacije zbog čega kod bolesnika ne ostaju trajne posljedice. Promjene na središnjem živčanom sustavu su nespecifične, a najčešće zahvaćaju bazalne ganglije što uvjetuje karakterističnu kliničku sliku s koreiformnim pokretima. Promjene na koži i potkožnom tkivu uključuju pojavu granuloma sa žarištima fibrinoidne nekroze uz perivaskularne infiltrate velikih stanica s blijedim i istaknutim jezgrama.
Klinička slika. Bolest karakteriziraju opći infektivni simptomi (febrilno stanje, algični sindrom, umor) uz razvoj specifičnih simptoma i znakova na zahvaćenim tkivima i organima. Endokarditis ili pankarditis susreće se kod 50 do 70 % bolesnika, migratorni poliartritis kod 35 do 65 % bolesnika, koreja kod 10 do 30 % bolesnika te eritema marginatum i supkutani čvorići kod 5 do 10 % bolesnika.
Karditis. Na afekciju srca ukazuju nespecifični simptomi i znakovi kao što su bol u prsima, dispneja te palpitacije. Pri fizikalnom pregledu bolesnici obično imaju tahikardiju koja nije u razmjeru s povišenom temperaturom te auskultacijski šum, najčešće mitralne insuficijencije (ostali, rjeđi, šumovi koji mogu nastati su šum aortne insuficijencije, mitralne stenoze te trikuspidalne insuficijencije). U težim oblicima moguć je i razvoj sindroma srčanoga popuštanja, kao i poremećaja srčanoga ritma.
Migratorni poliartritis asimetrično zahvaća velike zglobove kao što su koljena, kukovi, laktovi i ramena, dok su mali zglobovi šaka i stopala rijetko zahvaćeni. Istodobno je zahvaćeno više zglobova, a nakon što se upala smiri, dolazi do pojave upale na drugim zglobovima zbog čega se ovo kliničko očitovanje i naziva migratornim poliartritisom. Akutnu fazu upale karakteriziraju otok, bol, crvenilo i ograničenje pokreta uz stvaranje izljeva, a po smirivanju upale dolazi do potpune rezolucije bolesti bez trajnih posljedica.
Koreiformni pokreti (Sydenhamova koreja, koreja minor, ples sv. Vida) posljedica su afekcije središnjega živčanog sustava, a obično se javljaju nakon dužega perioda latencije (1 do 6 mjeseci), i to daleko češće kod osoba ženskoga spola. Kliničku sliku prate emocionalna labilnost, nehotični pokreti svih mišića, a posebno mišića ruku i lica. Kod većine se bolesnika postiže spontani potpuni oporavak kroz nekoliko mjeseci, dok kod manjega broja bolesnika navedeni ispadi mogu ostati doživotno.
Erythema marginatum predstavlja kožnu manifestaciju akutne reumatske vrućice u obliku ograničenoga crvenila lokaliziranoga u području trupa ili ekstremiteta s koncentričnim širenjem prema periferiji uz istodobnu pojavu centralnoga blijeđenja.
Supkutani noduli predstavljaju čvrste i bezbolne čvoriće veličine graška na ekstenzornim stranama velikih zglobova i predstavljaju ranije opisane supkutane granulome.
Prirodni tijek bolesti. Tijek bolesti uvelike varira i teško ga je predvidjeti. Oko 75 % akutnih reumatskih napadaja spontano nestaje unutar šest tjedana, 90 % unutar dvanaest tjedana, a manje od 5 % traje duže od šest mjeseci. Kada se akutna reumatska vrućica jednom povuče i pri tome prođe period duži od dva mjeseca, bolesnici se smatraju izliječenima, a ponovni razvoj moguć je samo nakon ponovne streptokokne infekcije.
Dijagnoza akutne reumatske vrućice postavlja se na temelju anamnestičkih podataka, laboratorijskih nalaza, slikovnih i drugih specifičnih dijagnostičkih metoda.
Laboratorijski nalazi. Kod gotovo svih bolesnika u akutnoj fazi sedimentacija eritrocita je ubrzana, povišene su vrijednosti C-reaktivnoga proteina uz umjerenu leukocitozu. Kod sumnje na akutnu reumatsku vrućicu potrebno je uzeti bris nazofarinksa (pozitivan nalaz na β-HSA otkrije se kod 25 % bolesnika) te odrediti antistreptolizinski titar (AST-0) čije povišene ili rastuće vrijednosti podupiru dijagnozu, ali kod jedne petine bolesnika one mogu biti uredne (osobito kod bolesnika s korejom). U svrhu postavljanja dijagnoze streptokokne infekcije služimo se i određivanjem specifičnih protutijela na streptokoke (ADNB, anti DNA-aza B), a oni su najviša nakon šest do osam tjedana od početka bolesti.
Ostale dijagnostičke metode ovise o kliničkim manifestacijama. Mogu uključivati EKG nalaz s poremećajima srčanoga ritma i nespecifičnim promjene ST-segmenta kod miokarditisa, ehokardiografiju (procjena morfologije i funkcije srčanih zalistaka), punkciju zglobne tekućine, biopsiju kožnih promjena.
Jonesovi dijagnostički kriteriji. Postavljanje dijagnoze akutne reumatske vrućice zasniva se na Jonesovim dijagnostičkim kriterijima koji su podijeljeni u dvije kategorije (veliki i mali kriteriji) te nisu jednaki za osobe s niskim i osobe s umjerenim ili visokim rizikom (Tablica 1.50.). Dijagnoza se postavlja ako bolesnik ima dva velika kriterija ili jedan veliki i dva mala kriterija, uz dokazanu nedavnu infekciju β-hemolitičkim streptokokom. Populacija s niskim rizikom ona je u kojoj se slučajevi akutne reumatske vrućice javljaju kod ≤ 2/100 000 djece školske dobi ili se reumatska bolest srca dijagnosticira s učestalošću ≤ 1/1000 bolesnika bilo koje dobi tijekom jedne godine.
|
Tablica 1.50. Revidirani Jonesovi kriteriji iz 2015. Godine
|
|
Veliki kriteriji
|
|
Populacija niskoga rizika
|
Populacija umjerenoga i visokog rizika
|
|
Karditis (supklinički, klinički); artritis (samo poliartritis); koreja; eritema marginatum; supkutani čvorići.
|
Karditis (supklinički, klinički); artritis (mono ili poliartritis, poliartralgija); koreja; eritema marginatum; supkutani čvorići.
|
|
Mali kriteriji
|
|
Populacija niskoga rizika
|
Populacija umjerenoga i visokog rizika
|
|
Poliartralgija; hiperpireksija (> 38,5); sedimentacija eritrocita > 60 mm/h i/ili CRP > 30 mg/L; prolongirani PR-interval (EKG)
|
Monoartralgija; hiperpireksija (> 38,5); sedimentacija eritrocita > 30 mm/h i/ili CRP > 30 mg/L; prolongirani PR-interval (EKG)
|
Liječenje. Osnovu liječenja bolesnika s akutnom reumatskom vrućicom čini mirovanje te antimikrobna i protuupalna terapija (salicilati, kortikosteroidi). Bolesnicima se preporuča mirovanje sve dok ne postanu afebrilni (bez primjene antipiretika) te do normalizacije vrijednosti sedimentacije eritrocita i srčane frekvencije.
Antimikrobno liječenje. Osnovu liječenja akutne reumatske vrućice čini liječenje streptokokne infekcije ako je ona prisutna. Lijek izbora predstavlja penicilin, bilo primijenjen u jednoj parenteralnoj dozi (benzilpenicilin 1,2 milijuna jedinica intramuskularno), bilo peroralno kroz deset dana (fenoksimetilpenicilin 4 x 250 mg). U slučaju alergije bolesnicima se daju cefalosporini prve generacije (cefaleksin, cefadroksil) ili makrolidi (eritromicin, azitromicin, klaritromicin).
Salicilati se primjenjuju kod svih bolesnika, a njihov primarni učinak je simptomatsko olakšanje, osobito kod bolesnika s izraženim zglobnim manifestacijama, dok ne pokazuju utjecaj na prirodni tijek bolesti. Lijek izbora je acetilsalicilna kiselina, a bolesnici mogu zahtijevati visoke doze (0,6 do 0,9 g svakih šest sati).
Kortikosteroidi se primjenjuju kod bolesnika kod kojih se ne postiže simptomatsko olakšanje primjenom salicilata. Do sada nema jasnih dokaza koji bi ukazivali na to da korotikosteroidi utječu na prirodni tijek bolesti, odnosno da sprečavaju ili minimaliziraju oštećenja na srcu. Najčešće se primjenjuje prednizon u dozi od 40 do 60 mg/dan uz postupno snižavanje doze svaka dva tjedna.
Ostale napomene. Ako se kod bolesnika razvije srčano popuštanje ili se pojavi poremećaj srčanoga ritma, liječi ih se prema ustaljenim načelima. Kronična reumatska bolest srca kojom dominira oštećenje zalistaka teškoga stupnja zahtijevat će kiruršku korekciju. Kod bolesnika s izraženim koriformnim simptomima liječenje se temelji na primjeni sedativa, antiepileptika, kortikosteroida te u najtežim oblicima imunoglobulina i/ili plazmaferezi.
Prevencija akutne reumatske vrućice. Primarna prevencija akutne reumatske vrućice temelji se na ranom liječenju akutne streptokokne infekcije gornjih dišnih puteva. Sekundarna prevencija odnosi se na bolesnike koji su imali epizodu akutne reumatske vrućice, s ciljem prevencije njezinog recidiva. U tu se svrhu najčešće primjenjuje benzilpenicilin u dozi od 1,2 milijuna jedinica jednom mjesečno, a ako su bolesnici alergični na penicilin, primjenjuje se eritromicin (2 x 250 tbl mg/dan) ili neki od cefalosporina prve generacije. Profilaksa se provodi do pet godina nakon prve epizode bolesti ili do navršene 21. godine života ako se bolest nije prezentirala karditisom. Ako je prva epizoda bolesti uključivala karditis, ali bez zaostale valvularne greške, profilaksa se provodi do deset godina od prve epizode, a ako je zaostala valvularna greška, ona se provodi duže od deset godina, odnosno do navršene 40. godine života.
Definicija. Infektivni endokarditis naziv je za upalu endokarda uzrokovanu biološkim uzročnicima, najčešće bakterijama i gljivama. Infektivni endokarditis primarno pogađa srčane zaliske stvarajući karakteristične vegetacije, ali se infekcija može pojaviti i na drugim intrakardijalnim lokalizacijama. Ovisno o etiologiji i kliničkim značajkama, razlikujemo nekoliko oblika infektivnoga endokarditisa: akutni bakterijski endokarditis, subakutni bakterijski endokarditis, mikotični endokarditis te endokarditis umjetnih zalistaka.
Epidemiologija. Točna incidencija infektivnoga endokarditisa je nepoznata te se procjenjuje na šest do osam oboljelih na 100 000 stanovnika u razvijenim zemljama, a gledajući prema spolu nešto se češće javlja kod muškaraca u odnosu na žene (omjer muškarci: žene iznosi 1,7:1). Pojava infektivnoga endokarditisa povezuje se s određenim bolestima i stanjima, tj. rizičnim čimbenicima koji pogoduju ulasku uzročnika u cirkulaciju i/ili njihovoj prijemčivosti za endokard, a to su najčešće degenerativne i druge bolesti srčanih zalistaka (stenoze, regurgitacije), prisutnost umjetnih zalistaka, intravenska aplikacija droge i lijekova, kongenitalne srčane bolesti (anomalije zalistaka, ventrikularni septalni defekt, kompleksne srčane anomalije), prisutnost privremenih ili trajnih vaskularnih katetera, različiti invazivni dijagnostički postupci i sl.
Etiopatogeneza. Dva su osnovna etiopatogenetska čimbenika u razvoju infektivnoga endokarditisa, a to su prisutnost patogena u krvi (bakterijemija, fungemija) te njihova adherencija za endokard.
Prisutnost patogena u krvi. Bakterijemija i fungemija mogu nastati različitim mehanizmima koji mogu biti vezani uz samoga bolesnika (širenje uzročnika iz primarnoga žarišta, intravenska aplikacija droga ili lijekova) ili može biti povezana s različitim dijagnostičkim i terapijskim postupcima (kirurški zahvati, invazivne dijagnostičke metode). Bakterijemiju podržavaju i oslabljeni obrambeni imunološki mehanizmi, što je slučaj kod imunokompromitiranih pojedinaca.
Adherencija patogena za endokard predstavlja inicijalni korak u nastanku endokarditisa. Većina endokarditisa nastaje na podlozi oštećenoga endokarda zbog degenerativnih promjena, kongenitalnih anomalija, reumatske bolest srca i sl., što pogoduje agregaciji trombocita i taloženju fibrina koji uvjetuju stvaranje sterilnih vegetacija koje predstavljaju dobar medij za naseljavanje i razmnožavanje bakterija. One zatim dospijevaju u srce putem krvi te koje postupno invadiraju endokard i okolne strukture.
Mikrobiologija. Kako je već navedeno, ovisno o uzročnicima, ali i kliničkom tijeku, razlikuje se nekoliko oblika infektivnoga endokarditisa: akutni bakterijski endokarditis, subakutni bakterijski endokarditis, mikotični endokarditis te endokarditis umjetnih zalistaka. Infektivni endokarditis najčešće je uzrokovan bakterijama i to streptokokima, stafilokokima i enterokokima koje nalazimo kao normalne stanovnike mikrobiološke flore kože, ždrijela, mokraćnoga ili probavnog sustava, s time da oni u određenim trenucima mogu dospjeti u krv i izazvati prolaznu ili trajnu bakterijemiju.
Akutni bakterijski endokarditis praćen je naglim razvojem i burnom simptomatologijom. Obično je uzrokovan patogenima jake virulencije te se razvija na do tada zdravim (nativnim) srčanim zaliscima. Najčešći uzročnici ovoga oblika endokarditisa su Staphylococcus aureus, Streptococcus penumoniae te Streptococcus pyogenes.
Subakutni bakterijski endokarditis praćen je sporijim razvojem i manje izraženom simptomatologijom, a obično je uzrokovan patogenom slabije virulencije te se razvija na patološki promijenjenim zaliscima. Najčešći uzročnici ovoga endokarditisa su Streptococcus viridans, Enterococcus faecalis, Staphylococcus epidermidis.
Mikotični endokarditis nastaje kao posljedica fungemije te se obično susreće kod imunokompromitiranih bolesnika sa stečenom ili prirođenom imunodeficijencijom. Najčešći uzročnici mikotičnoga endokarditisa su Aspergilus spp., Candida spp. te Histoplasma spp.
Endokarditis umjetnih zalistaka poseban je klinički entitet koji se može klasificirati u dvije grupe ovisno o vremenskom intervalu između pojave bolesti i kirurškoga zahvata: rani (unutar godine dana) i kasni (nakon godine dana). Najčešći uzročnici ranoga endoakrditisa umjetnih zalistaka su Staphylococcus aureus, koagulaza-negativni stafilokoki, gram-negativni bacili, enterokoki i gljive, dok su najčešći uzročnici kasnoga endokarditisa umjetnih zalistaka koagulaza negativni stafilokoki, Staphylococcus aureus, viridans streptokoki i enterokoki.
Ostali uzročnici. Osim navedenih uzročnika, endokarditis mogu uzrokovati i neki drugi patogeni. U oko 5 % slučajeva endokarditisa uzročnici mogu biti gram-negativne bakterije tzv. HACEK grupe (Haemophilus spp., Aggregatibacter spp., Cardiobacterium hominis, Eikenella corrodens, Kingella spp.), a osobito su česte kod intravenskih ovisnika.
Kultura-negativan endokarditis naziv je za infektivni endokarditis kod kojega se iz uzetih hemokultura ne može izolirati uzročnik. Događa se kod oko 5 - 10% bolesnika koji nisu bili na prethodnoj antibiotskoj terapiji i u 35 % bolesnika koji su prethodno liječeni antibioticima. Kod pojave kultura-negativnoga endokarditisa treba pomišljati i na moguće druge uzročnike endokarditisa, kao što su gljive i bakterije koje se ne mogu uzgojiti na klasičnim hranjivim podlogama ili imaju značajno dulji period inkubacije (Coxiella burenti, Brucella spp., Bartonella henselae, Chlamidia spp., Legionella spp.).
Komplikacije. Infektivni endokarditis može biti praćen različitim komplikacijama. Među najčešćima su septičke embolizacije koje nastaju otkidanjem vegetacija i nošene krvnom strujom dospijevaju u udaljena tkiva i organe uzrokovajući apscedirajuću upalu. Najčešće komplikacije koje nastaju na taj način su apscedirajući meningoencefalitis i apscedirajuća pneumonija. Upala koja zahvaća sam srčani zalistak dovodi do njegove destrukcije što u akutnoj fazi može uzrokovati akutnu valvularnu bolest zbog ruptura zaliska i/ili tetivnih struna te simptome akutnoga srčanog popuštanja, dok u kroničnoj fazi fibroza, kalcifikacija i deformacije mogu uzrokovati kroničnu valvularnu bolest sa stenozom ili regurgitacijom. Česte su i imunološki posredovane komplikacije koje nastaju odlaganjem stvorenih imunokompleksa (protutijelo i antigen) u druga tkiva i organe (vaskulitis, glomerulonefritis).
Klinička slika. Kliničke manifestacije infektivnoga endokarditisa su različite i nespecifične. Kod nekih se bolesnika bolest razvija brzo i ima izraženu simptomatologiju (akutni endokarditis), dok se kod drugih razvija kroz duži period i nema izraženu simptomatologiju (subakutni endokarditis). Glavne kliničke manifestacije uključuju opći infektivni sindrom, simptome i znakove vezane uz srce te simptome i znakove mogućih komplikacija.
Opći infektivni sindrom predstavlja najčešću i dominantnu kliničku manifestaciju infektivnoga endokarditisa. Povišena tjelesna temperatura praćena zimicom i tresavicom prisutna je kod većine bolesnika, iako kod starijih i kroničnih bolesnika ona može biti umjereno povišena, pa čak i normalna. Bolesnici se žale na umor, malaksalost, gubitak teka te opći algični sindrom (glavobolja, bolovi u kostima i mišićima). Kod većine bolesnika prisutna je i bolna splenomegalija.
Kardijalni simptomi i znakovi ne moraju biti jasno izraženi. Bolesnici se mogu žaliti na dispneju, nespecifične bolove i nelagodu u prsištu te palpitacije. Auskultacijski šum nad prekordijem, osobito ako ranije nije postojao, kod bolesnika s vrućicom mora pobuditi posumnju na infektivni endokarditis. U akutnoj fazi bolesti mogući je i razvoj akutnoga srčanog popuštanja posljedično značajnoj valvularnoj patologiji koja u znatnoj mjeri narušava hemodinamiku.
Simptomi i znakovi komplikacija. Cerebralne i ostale sustavne septične embolizacije (pluća, kosti, slezena) nalazimo kod oko 25 % bolesnika s infektivnim endokarditisom i obično se javljaju prije uvođenja antimikrobne terapije ili unutar tjedan dana od početka antimikrobnoga liječenja. Posljedično perifernim mikroembolizacijama i odlaganju imunokompleksa, kod ovih bolesnika možemo naći i karakteristične kožne i sluzničke manifestacije kao što su Oslerovi čvorići (mali i bolni čvorići crvenkaste boje koji se najčešće susreću na palmarnim stranama dlanova i tabana), Janewayove lezije (bezbolne eritematozne lezije dlanova i tabana) te Rothove točke (eksudativne lezije rožnice). Karakterističan nalaz kod bolesnika s infektivnim endokarditisom su i zone linerane hemoragije u području ležišta noktiju, kao i petehije lokalizirane po konjuktivama i mekom nepcu. Hematurija i proteinurija uz različiti stupanj oštećenja bubrežne funkcije mogu nastati kao posljedica imunološki posredovanoga glomerulonefritisa s ili bez septičke embolizacije bubrežnih krvnih žila.
Dijagnoza infektivnoga endokarditisa temelji se na anamnezi, fizikalnom pregledu, laboratorijskim nalazima te ehokardiografiji uz mikrobiološku dijagnostičku obradu. Anamneza i fizikalni pregled ključni su za postavljanje sumnje na infektivni endokarditis. Svako febrilno stanje uz novootkriveni šum na srcu, osobito uz prisutnost rizičnih čimbenika treba pobuditi sumnju na ovu bolest.
Laboratorijska dijagnostika. Kod većine bolesnika s infektivnim endokarditisom nalazimo ubrzanu sedimentaciju eritrocita, C-reaktivnoga proteina, povišene vrijednosti leukocita te kada bolest duže traje anemiju kronične bolesti (sideropenična anemija). U slučaju razvoja glomerulonefritisa prisutni su i umjereno povišeni metaboliti dušika te proteinurija i/ili hematurija. Kod određenoga broja bolesnika prisutan je i pozitivan reumatoidni faktor.
Mikrobiološka dijagnostika. Osnovu postavljanja dijagnoze infektivnoga endokarditisa predstavlja mikrobiološka identifikacija uzročnika iz krvi bolesnika (hemokultura). Kako bi se povećala osjetljivost metode, potrebno se pridržavati osnovnih pravila pri uzimanju hemokultura: 1) hemokulture se trebaju uzeti prije početka antimikrobnoga liječenja (ako je antimikrobno liječenje započeto, a bolesnici su stabilni, preporučeno je prekinuti liječenje na dva do tri dana, ponoviti uzorkovanje te potom nastaviti s liječenjem); 2) postupak treba izvoditi u strogim aseptičkim uvjetima kako bi se smanjila mogućnost kontaminacije; 3) pri uzorkovanju se uzima najmanje 10 mL krvi i to u dvije odvojene epruvete što nazivamo jednim setom (aerobna i anaerobna); 4) preporučeno je uzimanje najmanje tri seta hemokultura s različitih mjesta u vremenskim intervalima od nekoliko sati (6 do 12 sati). Vjerojatnost izolacije uzročnika veća je kada se krv uzorkuje u vrijeme vrućice, tresavice i zimice (tzv. hemokultura u febrilitetu). Kod bolesnika s tzv. kultura negativnim endokarditisom prvi korak uključuje serološke pretrage i/ili molekularne pretrage (PCR) na manje česte uzročnike kao što su Coxiella burneti, Bartonella spp., Legionella spp., Brucella spp., Myocoplasma spp. i dr.
Ehokardiografija zajedno s mikrobiološkim uzorkovanjem predstavlja temelj dijagnostičke obrade, a u tu se svrhu izvode transtorakalna (TTE) i transezofagealna ehokardiografija (TEE), s time da TEE ima značajno veću osjetljivost (90 – 95 %) u usporedbi s TTE (50 – 60 %). TTE se preporuča kao prvi izbor, dok se TEE izvodi u slučaju negativnoga nalaza TTE, osim kod bolesnika s umjetnim valvulama ili intrakardijalnim uređajima, kada je TEE prvi izbor. Kod bolesnika s negativnim nalazima TTE i TEE, uz prisutnost visoke kliničke sumnje na infektivni endokarditis pretrage treba ponoviti za pet do sedam dana. Osnovi ehokardiografski nalazi koji ukazuju na infektivni endokarditis su prisutnost vegetacija i apscesa (Slika 1.73.). Vegetacije se prikazuju kao oscilirajuće ili neoscilirajuće hiperehogene mase na zaliscima, drugim intrakardijalnim strukturama ili intrakardijalnom materijalu, dok apscesi predstavljaju zadebljano, inhomogeno perivalvularno područje sa svjetlijim i tamnijim arealima. Dehiscencija umjetne valvule predstavlja glavni ehokardiografski znak infektivnog endokarditisa kod bolesnika s umjetnim valvulama. TTE i TEE preporučene su metode i za praćenje terapijskoga odgovora bolesnika na antimikrobnu terapiju, kao i stanja po završetku liječenja.
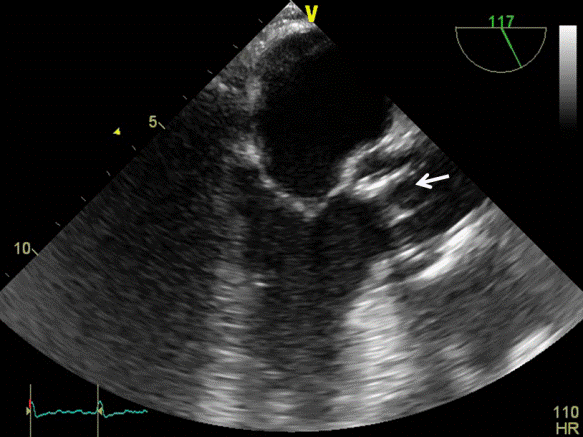
Slika 1.73. Endokarditis mehaničke aortalne proteze
Nove slikovne metode. Ako se kod bolesnika pomoću ehokardiografskih metoda ne dokaže infektivni endokarditis, a postoji visoka sumnja na njega, osobito kod bolesnika s umjetnim valvulama ili prisutnim intrakardijalnim stranim materijalom (npr. elektrode elektrostimulatora) na raspolaganju su druge slikovne dijagnostičke metode, kao što su kardijalni CT te nuklearno-medicinske slikovne metode. Kardijalni CT omogućava jasniji prikaz paravalvularnih lezija (vegetacije, apscesi) koje mogu ukazivati na infektivni endokarditis u odnosu na ehokardiografiju. U dijagnostici infektivnoga endokarditisa umjetnih valvula značajnu ulogu mogu imati nuklearno-medicinske slikovne tehnike koje mogu ukazivati na pojačanu aktivnost na mjestu umjetne valvule pomoću 18F-FDG-PET/CT-a (samo ako je od postavljanja valvule prošlo najmanje tri mjeseca) ili SPECT/CT-a radioaktivno obilježenim leukocitima što se smatra pozitivnim znakom prisutnosti infektivnoga endokarditisa.
Ostale dijagnostičke pretrage. Elektrokardiogram većine bolesnika je uredan ili nespecifično promijenjen, osobito u slučaju razvoja miokarditisa. Rendgenogram srca i pluća može biti uredan, rjeđe se otkriju kardiomegalija i/ili znakovi srčanoga popuštanja u teškim oblicima, a kod prisutnosti septičkih embolizacija pluća mogući su nalazi koji upućuju na razvoj apscesa i infarkta pluća, što je češće kod endokarditisa desne strane srca. Kod sumnje na druge specifične embolizacije potrebno je provesti odgovarajuće dijagnostičke metode (cerebralna magnetna rezonanca, kompjuterizirana tomografija abdomena i sl.).
Dijagnostički algoritam. Za postavljanje dijagnoze infektivnoga endokarditisa koriste se modificirani Duke kriteriji prošireni prema preporukama Europskoga kardiološkog društva (ESC) iz 2015. godine (Tablica 1.51.). Dijagnoza infektivnoga endokarditisa definitivna je ako se nađu: 1) dva velika kriterija, 2) jedan veliki i jedan ili više malih kriterija ili 3) tri ili više mala kriterija.
|
Tablica 1.51. Modificirani Duke kriteriji za dijagnozu infektivnoga endokarditisa
|
|
Glavni kriteriji
|
Sporedni kriteriji
|
|
(1) Pozitivna hemokultura za IE:
- Tipični mikroorganizmi za infektivni endokarditis izolirani iz dvije odvojene hemokulture;
- Perzistentna bakterijemija s bilo kojim mikroorganizmom (dvije pozitivne hemokulture koje su uzete s više od 12 sati razmaka ili najmanje tri pozitivne hemokulture od najmanje četiri uzete hemokulture uzete s međusobnim razmakom većim od jednog sata);
- Jedna pozitivna hemokultura na Coxiella burneti ili titar IgG antitijela > 1:800
|
(1) Prisutnost rizičnih čimbenika (srčano oboljenje, injekcijska primjena lijekova/droga;
(2) Tjelesna temperatura > 38;
(3) Prisutnost vaskularnih fenomena (distalne septičke embolizacije, septički plućni infarkt);
(4) Imunološke komplikacije (glomerulonefritis, pozitivan reumatoidni faktor, Oslerovi čvorići);
(5) Pozitivan hemokultura koja ne ispunjava glavni kriterij ili serološki nalazi aktivne infekcije s organizmom konzistentnim s IE.
|
|
(2) Pozitivan nalaz slikovnih metoda za IE:
- Pozitivan ehokardiografski nalaz na infektivni endokarditis;
- Paravalvularne lezije otkrivene na kardijalnom CT-u;
- Pojačana aktivnost vidljiva 18F-FDG-PET/CT ili SPECT/CT.
|
Liječenje. Osnovu liječenja infektivnoga endokarditisa čini produljena antimikrobna terapija koja se u prvom redu treba temeljiti na nalazu hemokulture i antibiograma. Ako su bolesnici klinički stabilni, antimikrobno liječenje preporuča se nakon prispijeća nalaza hemokulture, dok se kod ostalih započinje empirijsko liječenje utemeljeno na lokalnim preporukama sukladno kliničkom stanju i rizičnim čimbenicima kod bolesnika. Ako je započeto empirijsko antibiotsko liječenje, ono se prema potrebi korigira sukladno nalazu hemokulture, odnosno antibiograma. Antibiotsko liječenje kod bolesnika s endokarditisom umjetnih valvula treba trajati najmanje šest tjedana, dok se kod ostalih provodi u periodu od dva do šest tjedana. Jedan dio bolesnika zahtijevat će i kirurško liječenje. To su najčešće bolesnici kod kojih se antimikrobnom terapijom ne postiže kontrola bolesti i kod kojih se razviju akutne komplikacije ili kod kojih postoji visok rizik od nastanka komplikacija. Također, kod takvih je bolesnika potrebno razmotriti uvođenje antikoagulacijske terapije.
Empirijska antimikrobna terapija indicirana je kod svih bolesnika s infektivnim endokarditisom čije stanje ne dozvoljava čekanje nalaza hemokulture i antibiograma. Izbor antibiotika ovisi o lokalnim smjernicama za antibiotsko liječenje, kliničkom stanju i rizičnim čimbenicima bolesnika (Tablica 1.52.).
|
Tablica 1.52. Empirijsko liječenje infektivnoga endokarditisa
|
|
Karakteristike bolesnika
|
Preporučena antibiotska terapija
|
|
Prirodni zalisci, domicilna infekcija, nizak rizik od MRSA infekcije
|
Ampicilin/klavulonska kiselina (3 x 1,2 g iv) + gentamicin (3 x 1mg/kg iv) ili ampicilin/sulbaktam (4 x 3 g iv)
|
|
Hospitalna infekcija, povećan rizik od MRSA infekcije, alergija na penicilin
|
Vankomicin (2 x 1 g iv) + genatmicin (3 x 1 mg/kg iv)
|
|
Umjetni zalisci
|
Vankomicin (2 x 1 g iv) + gentamicin (3 x 1 mg/kg iv) + rimfampicin (3 x 300 mg po)
|
Ciljana antimikrobna terapija temelji se na nalazu hemokulture i provedenoga testiranja osjetljivosti na antibiotike (antibiogram). Ako započeto empirijsko liječenje pokriva izoliranu bakteriju iz hemokulture, nastavlja se započeto liječenje, no ako ne pokriva, potrebno je promijeniti izbor antibiotika prema rezultatu antibiograma. U Tablici 1.53. su navedeni uzročnici te najčešći antibiotici koji se koriste u njihovom liječenju (prvi i drugi izbor), kao i preporučena duljina liječenja.
Kirurško liječenje infektivnoga endokarditisa podrazumijeva zamjenu inficirane valvule i uklanjanje vegetacija s popravkom zaliska, a glavne indikacije su: 1) razvoj akutnoga srčanog popuštanja uslijed akutne valvularne greške; 2) izostanak terapijskoga odgovora na primjenu antibiotika (perzistentna bakterijemija i vrućica > 7 - 10 dana); 3) visok rizik od nastanka septičkih embolizacija (vegetacije > 10 mm); 4) formiranje apscesa; 5) dokazane septičke embolizacije; 6) mikotični endokarditis te 7) endokarditis umjetnih zalistaka. Prema hitnosti razlikujemo operacije najvišega stupnja hitnosti koje se izvode unutar 24 sata, i izvode se kod bolesnika s izraženim akutnim srčanim popuštanjem (kardiogeni šok), hitne operacije (unutar tjedan dana) koje se izvode uz ostale navedene indikacijama te elektivne operacije koje se izvode kod ostalih bolesnika nakon provedene antibiotske terapije.
Ostale terapijske napomene. Infektivni endokarditis povezan sa srčanim uređajima zahtijeva njihovo vađenje i produljeno antimikrobno liječenje. Uređaji se mogu uklanjati perkutano ili operativno, što ovisi o veličini vegetacija i vrsti uređaja. Ako je potrebna nova implantacija uređaja preporuča se, ako je to moguće, odgoditi ju za nekoliko dana ili tjedana. Ako je bolesnik ovisan o elektrostimulaciji, može se postaviti privremeni uređaj s njegovom implantacijom na suprotnoj strani. Kod bolesnika koji imaju mehaničke zaliske prekida se peroralna antikoagulacijska terapija te se bolesnici prebacuju na niskomolekularni heparin tijekom jednoga ili dva tjedna. U slučaju velikih krvarenja preporuča se prekid antitrombocitne terapije, a kod intrakranijskih krvarenja i prekid antikoagulacijske terapije.
Prognoza. Infektivni endokarditis je teško oboljenje i, ako se ne liječi, kod većine bolesnika završava smrtnim ishodom. Primjenom antimikrobnih lijekova i/ili kirurškoga liječenja klinički ishodi su daleko bolji te se ukupna smrtnost takvih bolesnika kreće od 15 do 35 %. Recidiv infektivnoga endokarditisa bilježi se kod 12 do 16 % bolesnika.
Profilaksa infektivnoga endokarditisa ograničena je na bolesnike s najvišim rizikom razvoja infektivnoga endokarditisa, i to kod izloženosti visokorizičnim zahvatima koji su praćeni prolaznom bakterijemijom (Tablica 1.54.).
Bolesnici s najvišim rizikom nastanka infektivnoga endokarditisa su bolesnici s umjetnim zaliscima, bolesnici nakon preboljenoga infektivnog endokarditisa, bolesnici s prirođenim srčanim greškama, kao i oni s korigiranim defektom i postavljenim umjetnim materijalom perkutanom ili kirurškom tehnikom do šest mjeseci nakon zahvata te bolesnici s transplantiranim srcem i s bolešću srčanih zalistaka.
Visokorizični zahvati uz koje je indicirana profilaksa infektivnoga endokarditisa u navedenim skupinama su stomatološki zahvati koji dovode do narušavanja integriteta sluznice usne šupljine, zahvati na dišnom sustavu koji dovode do narušavanja integriteta sluznice dišnih puteva, zahvati na gastrointestinalnom sustavu s dokazanom infekcijom, zahvati na urinarnom sustavu s dokazanom infekcijom te zahvati koji zahvaćaju inficiranu kožu ili meka tkiva.
|
Tablica 1.54. Profilaksa infektivnoga endokarditisa
|
|
Zahvat
|
Preporučena profilaksa
|
|
Zahvati u ustima, jednjaku i gornjim dišnim putevima
|
Amoksicilin 2 g po 30 do 60 min prije zahvata; ili
Ampicilin 2 g iv 30 do 60 min prije zahvata; ili
Cefaleksin 2 g po 30 do 60 min prije zahvata; ili
Cefazolin 1 g iv 30 do 60 min prije zahvata.
Kod alergije na penicilin:
Klaritromicin 600 mg po 1 sat prije zahvata
|
|
Zahvati na gastrointestinalnom i genitourinarnom sustavu
|
Amoksicilin 2 g po 1 sat prije zahvata + 1 g po 6 sati kasnije; ili
Ampicilin 2 g iv/im 30 min prije zahvata + 1 g iv 6 sati kasnije.
Kod alergije na penicilin:
Vankomicin 1 g iv kroz 1 sat unutar 30 min prije zahvata; ili
Teikoplanin 400 mg iv unutar 30 min prije zahvata.
|
|
Zahvati kroz inficiranu kožu, potkožu ili mišiće
|
Amoksicilin 2 g po 1 sat prije zahvata.
Ako je uzročnik S. aureus treba primijeniti flukloksacilin ili vankomicin u slučaju alergije na peniclin.
|
Stomatološki zahvati koji ne zahtijevaju profilaksu infektivnoga endokarditisa su injekcija anestetika kroz tkivo koje nije inficirano, skidanje šavova, rendgensko snimanje zubi, postavljanje pomičnih ortodontskih pomagala ili kopči te njihovo namještanje te traumatsko krvarenje iz usne ili oralne sluznice.
Definicija i epidemiologija. Miokarditis je upala srčanoga mišića infektivne ili neinfektivne prirode, koja se klinički može manifestirati u akutnoj, subakutnoj i kroničnoj formi. Stvarnu incidenciju i prevalenciju miokarditisa u općoj populaciji teško je procijeniti s obzirom na široku varijabilnost kliničke prezentacije, koja se kreće od asimptomatskoga patološkog EKG nalaza pa sve do teških kliničkih oblika praćenih srčanim zatajenjem ili iznenadnom srčanom smrti. Prema nekim registrima, procijenjena incidencija miokarditisa iznosi oko 20 slučajeva na 100 000 stanovnika. Pojavnost miokarditis jednaka je kod oba spola, a obično se javlja u mlađoj životnoj dobi.
Etiologija. Miokarditis mogu uzrokovati različiti infektivni i neinfektivni uzročnici tako da razlikujemo infektivni, toksični te imunološki posredovani miokarditis. U razvijenim su zemljama najčešći uzročnici miokarditisa virusi i to Coxsackie, adenovirusi i virusi influenze, a sve je veća i pojavnost miokarditisa povezanoga s HIV-infekcijom. Ostali oblici infektivnoga mioakrditisa danas se rjeđe susreću i određeni su specifičnim epidemiološko-zemljopisnim značajkama (npr. miokarditis u sklopu Chagasove bolesti uzrokovane protozoom Trypanosoma cruzi endemski se javlja u područjima centralne i sjeverne Amerike). Toksični i imunološki posredovani miokarditisi javljaju se sporadično.
Infektivni miokarditis može biti uzrokovan različitim infektivnim agensima kao što su virusi, bakterije, gljive, spirohete, rikecije, protozoi i paraziti. Najčešći infektivni uzročnici prikazani su u Tablici 1.55.
|
Tablica 1.55. Popis najčešćih infektivnih uzročnika miokarditisa
|
|
Virusi
|
Coxackievirus A, B; Echoviridae; Adenoviridae; Virus influnzae ; Herpres simplex virus; Varicella zoster virus; Cytomegalovirus; Hepatitis C virus; Ebstein-Barr virus
|
|
Bakterije
|
Corynebacterium diphteriae; Haemophilus influenzae ; Mycoplasma pneumoniae; Salmonella spp.; Neisseria spp.; Streptococcus spp.; Staphylococcus spp.; Mycobacterium
|
|
Gljive
|
Aspergillus spp.; Candida spp.; Cryptococcus spp.; Actinomyces spp.; Blastomyces spp.; Histoplasma spp.; Coccidioides spp.
|
|
Spirohete i rikecije
|
Treponema pallidum; Borrelia burgdorferi; Leptospira; Coxiella burneti; Rickettsia rickettsii; Rickettsia tsutsugamushi
|
|
Paraziti i protozoe
|
Trypanosoma cruzi; Toxoplasma gondii; Trichinela spiralis, Echinococcus granulosus, Tenia solium
|
Toksični miokarditis može nastati uslijed izlaganja različitim lijekovima i drogama (antraciklini, katekolamini, amfetamini, koakin, ciklofosfamid, 5-fluorouracil, interferon), teškim metalima (željezo, olovo, bakar), fizikalnim agensima (radijacija, elektricitet, hiperpireksija) te ostalim toksinima (ugrizi pauka, zmije).
Imunološki posredovani miokarditis nastaje uslijed reakcija preosjetljivosti na lijekove (penicilin, sulfonamidi, tetraciklini, metildopa, streptomicin, tiazidi, indometacin, triciklički antidepresivi) ili imunoloških reakcija usmjerenih na autoantigene (Churg-Straussov sindrom, miokarditis orijaških stanica, sistemski eritematozni lupus, sistemska skleroza, sarkoidoza, polimiozitis) ili aloantigene (reakcija odbacivanja transplantata).
Patogeneza. Oštećenje kardiomiocita pri miokarditisu može nastati na dva načina: 1) primarnim ili direktnim citopatskim djelovanjem etiološkoga agensa na kardiomiocite te 2) sekundarnim ili indirektnim mehanizmima kao što su imunološki posredovano oštećenje, poremećaj ekspresije citokina ili indukcija apoptoze, što je potaknuto etiološkim agensom. Ovo oštećenje obično prolazi kroz dvije faze, i to su faza akutnoga i faza kroničnoga oštećenja. U fazi akutnoga oštećenja koja traje do dva tjedna oštećenje kardiomiocita dominantno je uvjetovano direktnim citopatskim učinkom koji dovodi do povećanoga stvaranja i otpuštanja proupalnih citokina (interleukin-1, faktor tumorske nekroze α) koji uzrokuju specifične morfološke (nekroza), ali i funkcionalne promjene u miokardu (poremećaj kontraktilnosti, poremećaj provođenja). U fazi kroničnoga oštećenja koja nastupa nakon dva tjedna oštećenje kardiomiocita je dominantno uzrokovano imunološki usmjerenom reakcijom na kardiomiocite. Ona može biti posljedica abnormalne ekspresije antigena na površini kardiomiocita (npr. inkoroporacija virusnoga genoma u genom domaćina i stvaranje virusnih antigena) koje imunološki sustav prepoznaje kao strane te otpočinje specifičnu usmjerenu reakciju na njih. Isto tako, ona može nastati i kao posljedica izlaganja specifičnih intracelularnih molekula imunološkom sustavu nakon inicijalnoga oštećenja kardiomiocita, koje imunološki sustav može prepoznati kao strane te dovesti do autoimune reakcije sa stvaranjem specifičnih autoantitijela (npr. autoantitijela na α-miozin, autoantitijela na β-1 adrenoreceptore). Aktivno stvaranje i otpuštanje proupalnih citokina u kroničnoj fazi miokardnoga oštećenja može dovesti do aktivacije metaloproteinaza matriksa koje uzrokuju oštećenje (disrupciju) kolagenskih i elastinskih vlakana što dovodi do dilatacije i razvoja sekundarne dilatacijske kardiomiopatije.
Patologija. Makroskopski nalaz srca u miokarditisu može biti uredan ili može pokazivati određeni stupanj dilatacije. Mikroskopski nalaz ponajprije ovisi o etiologiji, ali i o fazi (akutni ili kronični miokarditis). Akutnu fazu obilježava edem intersticija, nekroza kardiomiocita te obilni upalni infiltrat koji je najčešće sačinjen od limfocita i monocita, dok u kroničnoj fazi nalazimo žarišta fibroze kao odgovor na nekrozu kardiomiocita uz znatno slabije izražen upalni infiltrat. Prema Dallasovim kriterijima razlikujemo četiri oblika miokarditisa, što se temelji na inicijalnoj i/ili opetovanim biopsijama endomiokarda: aktivni miokarditis, granični miokarditis, perzistentni miokarditis te miokarditis u sanaciji (Tablica 1.56.). U diferencijalnoj dijagnozi etiologije miokarditisa pomažu i druge patohistološke tehnike, kao što je PCR metoda koja nam služi u detekciji virusnoga genoma ili imunohistokemijske metode kojima otkrivamo specifične molekule u bioptatu.
|
Tablica 1.56. Dallasova patohistološka klasifikacija miokarditisa
|
|
Oblik miokarditisa
|
Patohistološki nalaz
|
|
Aktivni miokarditis
|
Upalni infiltrat s nekrozom kardiomiocita, s ili bez fibroze
|
|
Granični miokarditis
|
Upalni infiltrat bez nekroze i fibroze miokarda
|
|
Perzistentni miokarditis
|
Znakovi aktivnoga miokarditisa na ponovljenoj biopsiji
|
|
Miokarditis u sanaciji
|
Dominacija fibroze uz oskudni upalni infiltrat
|
Klinička slika miokarditisa je nespecifična, pokazuje znatne varijacije i ovisi o tome radi li se o izoliranoj bolesti ili se miokarditis javlja kao jedna od manifestacija u sklopu sistemskih oboljenja. Virusni miokarditis, kao najčešći etiološki oblik miokarditisa, obično prolazi asimptomatski ili su simptomi blago izraženi, pa bolesnici i ne obraćaju veću pozornost na njih. Bolest je karakterizirana prolaznim febrilnim stanjem i različito izraženim općim i nespecifičnim infektivnim simptomima (umor, algični sindrom, proljevi, kašalj, kataralni simptomi) koji traju kroz nekoliko dana te se potom smiruju. Simptomi koji upućuju na mogući miokarditis razvijaju se nakon pet do sedam dana, a najčešće su to dispneja (72 %), bol u prsima (32 %) te palpitacije (18 %). Razvoj akutnoga srčanog popuštanja, teškoga poremećaja srčanoga ritma ili iznenadne srčane smrti javlja se kod manje od 10 % oboljelih osoba. Kod određenoga broja bolesnika prva klinička manifestacija virusnoga miokarditisa može biti srčano popuštanje uvjetovano razvojem sekundarne dilatacijske kardiomiopatije. Fizikalni nalaz ovih bolesnika je nespecifičan. Najčešći patološki znakovi su tahikardija, auskultacijski tiši tonovi te pojava trećega srčanog tona. Ako je upalom zahvaćen i perikard, može se čuti i perikardijalno trenje.
Dijagnoza miokarditisa postavlja se na osnovi anamneze, laboratorijskih nalaza, nalaza EKG-a, slikovnih dijagnostičkih metoda te, prema potrebi, biopsije endomiokarda. S obzirom na nespecifičnu kliničku sliku, postavljanje same dijagnoze akutnoga miokarditisa često je otežano i predstavlja klinički izazov. U kliničkoj praksi najčešće se radi o bolesniku koji se javlja s nespecifičnim kliničkim simptomima i znakovima, s ili bez EKG promjena uz povišene vrijednosti troponina kao odraza oštećenja kardiomiocita. Kod takvih bolesnika osnovni korak predstavlja isključenje drugih mogućih uzroka (npr. koronarna bolest) te promišljanje o miokarditisu kao mogućoj dijagnozi.
Anamnestički podaci često su ključni za postavljanje dijagnoze miokarditisa. Pojava kardijalnih smetnji kod mlađih osoba koji su nedavno imali simptome koji upućuju na virusnu infekciju visoko su suspektni na miokarditis. Podaci o izlaganju drugim potencijalnim uzrocima miokarditisa također imaju visok značaj.
Elektrokardiografski nalaz je nespecifičan, a može uključivati pojavu sinusne tahikardije (ili neke druge tahiaritmije), atrioventrikularnoga poremećaja provođenja, nespecifične promjene ST-spojnice i T-valova, pojavu patološkoga Q-zupca te QRS mikrovoltažu. Promjene su obično prolazne. Nekada su patološki oblici EKG-a jedini znak miokarditisa.
Laboratorijska dijagnostika. Na miokarditis mogu upućivati povišeni upalni parametri kao što su ubrzana sedimentacija eritrocita, povišeni C-reaktivni protein te leukocitoza, a njihove vrijednosti ne moraju biti značajno povišene. Povišene vrijednosti kardioselektivnih enzima, osobito troponina, ukazuju na nekrozu kardiomiocita, a povišene vrijednosti NT-proBNP-a na razvoj srčanoga popuštanja. Kod sumnje na miokarditis potrebno je provesti i druge, specifične laboratorijske pretrage kao što su serološke pretrage na najznačajnije viruse te imunološke biljege pri sumnji na autoimune bolesti.
Slikovne dijagnostičke metode. Klasični rendgenogram srca i pluća nema veći dijagnostički značaj u postavljanju dijagnoze miokarditisa. Kardiomegalija može nastati kao posljedica dilatacije, što se obično viđa pri kroničnom obliku kada se razvije dilatacijska kardiomiopatija. Ehokardiografija se radi svim bolesnicima i može uključivati različite patološke nalaze kao što su sistolička disfunkcija s ili bez dilatacije lijevoga ventrikula, regionalni poremećaj kontraktilnosti, različiti stupanj dijastoličke disfunkcije te perikardijalni izljev, ali oni nisu specifični za miokarditis te se mogu naći i uslijed drugih oboljenja. Pojačana ehogenost miokarda može biti odraz intersticijskoga edema i infiltracije miocita. Magnetna rezonanca srca danas predstavlja osnovnu slikovnu dijagnostičku metodu kod bolesnika sa sumnjom na miokarditis, a omogućava detaljniju morfološku analizu miokarda, otkrivanje zona inflamacije i nekroze miokarda uz pericelularni i celularni edem te diferencijaciju naspram ishemijskih oštećenja.
Endomiokardijalna biopsija ostaje zlatni standard u postavljanju dijagnoze miokarditisa. Ona se ne izvodi rutinski svim bolesnicima, već onima koji razviju teško srčano zatajenje unutar dva tjedna od početka simptoma unatoč optimalnoj medikamentnoj terapiji te kod bolesnika kod kojih zaostane dilatacija lijevoga ventrikula tri mjeseca od početka simptoma, unatoč optimalnoj medikamentnoj terapiji. S obzirom na to da patološki supstrat miokarditisa ne mora biti jednako zastupljen u svim dijelovima miokarda, mogući su i lažno negativni nalazi, što se viđa u trećini slučajeva.
Diferencijalna dijagnoza je široka i uključuje različite bolesti i stanja među kojima su najznačajnija koronarna bolest srca te ostali oblici dilatacijskih kardiomiopatija.
Liječenje miokarditisa uključuje opće mjere, simptomatsko te specifično liječenje. Opće mjere podrazumijevaju mirovanje, izbjegavanje fizičkoga opterećenja (kroz najmanje šest mjeseci), izbjegavanje unosa alkohola te korekciju drugih kardiovaskularnih rizičnih čimbenika. Ako je poznata etiologija, potrebno je paralelno provoditi i liječenje uzročnoga stanja.
Simptomatsko liječenje podrazumijeva liječenje nastaloga srčanog popuštanja i/ili poremećaja srčanoga ritma. Kod bolesnika s istisnom frakcijom sniženom ispod 40 % preporuča se započeti liječenje ACE-inhibitorima te beta blokatorima. Kod izraženih kongestivnih smetnji primjenjuju se diuretici. Primjenu nesteroidnih protuupalnih lijekova treba izbjegavati u akutnoj fazi i može se ograničiti samo na bolesnike koji imaju izražene simptome mioperikarditisa, a imaju urednu ili blago oštećenju sistoličku funkciju. U slučaju aritmija, primjena antiaritmika mora biti s oprezom zbog negativnoga inotropnog djelovanja većine takvih lijekova, što može pogoršati sistoličku funkciju. Bolesnici koji razviju hemodinamsku nestabilnost liječe se po ustaljenim principima liječenja akutnoga srčanog popuštanja (inotropna potpora, mehanička cirkulacijska potpora).
Specifično liječenje podrazumijeva primjenu antivirotika, imunosupresiva i imunoglobulina. Rutinsko antivirusno liječenje nije preporučeno u liječenju virusnoga miokarditisa. Empirijska primjena antivirotika kao što je plekonaril koji se koristi u liječenju enterovirusnih infekcija opravdana je samo u ranoj fazi bolesti (što se odnosi na mali broj bolesnika s obzirom na to da se kasno javljaju i kasno dijagnosticiraju). Primjena kortikosteroida i imunosupresiva (prednizolon, azatioprin) nije indicirana rutinski za sve bolesnike s obzirom na to da provedene studije nisu pokazale veće razlike u pogledu mortaliteta kada su se uspoređivali bolesnici koji su primali imunosupresive i oni koji ih nisu primali. Ona je rezervirana za liječenje miokarditisa orijaških stanica (kasnije opisano), kao i drugih oblika imunološki posredovanih miokarditisa kod kojih je isključena infektivna etiologija, a koji su refrakterni na konvencionalno liječenje srčanoga popuštanja. Primjena intravenskih humanih imunoglobulina kod ovih bolesnika također je kontroverzna, a može biti opravdana kod bolesnika s autoimunom etiologijom miokarditisa.
Prognoza. Većina bolesnika s miokarditisom, uz odsutnost značajnije sistoličke i/ii dijastoličke disfunkcije, potpuno se oporavi unutar nekoliko tjedana bez trajnih posljedica. Bolesnici koji razviju značajniju sistoličku disfunkciju (EF < 35%) imaju lošiju prognozu te često razvijaju dilatacijsku kardiomiopatiju koja može zahtijevati transplantaciju srca.
Miokarditis orijaških stanica ili gigantocelularni miokarditis oblik je teškoga miokarditisa koji karakterizira prisutnost multinuklearnih, orijaških stanica u bioptatu miokarda. Točna etiologija ovoga oblika miokarditisa nije poznata, ali može biti povezana sa sarkoidozom, timomom i autoimunim bolestima. Klinički je karakteriziran brzoprogresivnim tijekom, tahiaritmijama i lošom prognozom. Primjena kortikosteroida, imunosupresiva i imunoglobulina apsolutno je indicirana kod ovih bolesnika.
AKUTNI PERIKARDITIS I DRUGE BOLESTI PERIKARDA
AKUTNI PERIKARDITIS
Definicija i epidemiologija. Akutni perikarditis je naziv za akutnu upalu perikarda, infektivnu i neinfektivnu. Incidencija perikarditisa procjenjuje se na oko 20 do 25 slučajeva na 100 000 stanovnika u periodu od godine dana. Češće se javlja u mlađoj životnoj dobi i češće se javlja kod muškaraca u odnosu na žene.
Etiopatogeneza. Akutni perikarditis može biti uzrokovan različitim infektivnim i neinfektivnim uzročnicima (Tablica 1.57.). Najčešći klinički oblici akutnoga perikarditisa su virusni, bakterijski, tuberkulozni, uremijski, neoplastični, radijacijski i postinfarktni perikarditis. U više od 80 % slučajeva akutnoga perikarditisa radi se o virusnom ili idiopatskom perikarditisu.
|
Tablica 1.57. Etiologija akutnoga perikarditisa
|
|
Infektivni akutni perikarditis
|
Neinfektivni akutni perikarditis
|
|
Virusni perikarditis
Bakterijski perikarditis
Tuberkulozni perikarditis
Gljivični perikarditis
Parazitarni perikarditis
|
Autoimuni perikarditis
Neoplastični perikarditis
Metabolički perikarditis
Posttraumatski perikarditis
Lijekovima izazvan perikarditis
|
Upala perikarda karakterizirana je zadebljanjem listova perikarda kao posljedice pojačane prokrvljenosti, izvanstaničnoga edema te stanične infiltracije, a karakteristična je i eksudativna komponenta pri čemu dolazi do pojačanoga nakupljanja tekućine između listova perikarda i razvoja perikardijalnoga izljeva. Ovisno o etiologiji, izljev može biti serozan, fibrinozan, hemoragičan ili purulentan. Izljev je obično umjeren i ne dovodi do značajnijih patofizioloških poremećaja, no kada je obilan ili se brzo stvara, moguć je razvoj srčane tamponade koja ugrožava dijastoličko punjenje i može dovesti do razvoja opstruktivnoga šoka. U kasnijoj fazi bolesti moguća je organizacija eksudata te fibrozna pregradnja što uz pojačano odlaganje kalcija može dovesti do nastanka kroničnoga konstriktivnog perikarditisa.
Klinička slika. Perikarditis se najčešće očituje retrosternalnim bolom u prsištu koji može imati miješan karakter anginoznoga i pleuralnog bola. Bol je izraženiji u ležećem položaju, dok se pri uspravljanju u sjedećem položaju s prsima nagnutim prema naprijed smanjuje. Također, bol se pojačava prilikom inspirija, a smanjuje u ekspiriju. Bol se može širiti i prema ramena i straga u leđa, između lopatica. Za razliku od ishemijskoga bola, bol je kod akutnoga perikarditisa stalan i ne ovisi o tjelesnom naporu. Opći infektivni simptomi kao što su vrućica, umor, algični sindrom mogu biti izraženi, ali ne dominiraju kliničkom slikom. Najznačajniji fizikalni nalaz kod ovih bolesnika je perikardijalno trenje koje se najbolje čuje pri auskultaciji srca uz donji lijevi rub sternuma, promjenjive je jačine i intenziteta i često je ovisno o položaju tijela, najbolje se čuje u sjedećem položaju kada je trup nagnut prema naprijed. Perikardijalno trenje se sastoji od tri komponente: atrijska (presistolička), ventrikularna (sistolička) i protodijastolička (faza brzoga punjenja ventrikula), a najbolje se čuje tijekom ventrikularne komponentne (tijekom kontrakcije ventrikula).
Dijagnoza akutnoga perikarditisa postavlja se na temelju anamneze i fizikalnoga nalaza (perikardijalno trenje), EKG-a, laboratorijskih nalaza, ehokardiografije te prema potrebi i drugih slikovnih metoda.
EKG kod bolesnika s akutnim perikarditisom daje karakterističnu sliku konkavne elevacije ST-segmenta uz istodobnu depresiju PR-segmenta koja je prisutna u svim odvodima osim u aVR-u i V1, gdje nalazimo obrnutu sliku. Opisana ST-elevacija javlja se i nestaje određenom vremenskom dinamikom. Karakteristične EKG promjene događaju se kroz nekoliko faza: 1) prva faza (prvi sati) obilježena je elevacijom ST-segmenta i pozitivnim T-valovima; 2) druga faza (prvi dani) obilježena je vraćanjem ST-segmenta u izoelektričnu liniju; 3) treća faza (prvi tjedni) obilježena je inverzijom T-valova koji postaju negativni, bez smanjenja R-zubaca i bez pojave patološkoga Q-zupca te 4) četvrta faza (mjeseci) obilježena je vraćanjem T-valova u početni, pozitivni otklon.
Laboratorijski nalazi ukazuju na povišene vrijednosti upalnih parametara (sedimentacija eritrocita, C-reaktivni protein, prokalcitonin, leukociti), a ako je upalom zahvaćen i miokard, nalazimo i povišene kardioselektivne enzime, posebno troponin. Povišene vrijednosti troponina zajedno s opisanom elevacijom ST-segmenta mogu dovesti do otežane diferencijacije akutnoga perikarditisa i akutnoga koronarnog sindroma, osobito uz izražene bolove u prsnom košu.
Ehokardiografija omogućava prikaz perkardijalnoga izljeva koji se nađe kod većine bolesnika s akutnim perikarditisom uz zadebljale i hiperehogene listove perikarda. Uredan ehokardiografski nalaz ne isključuje dijagnozu akutnoga perikarditisa.
Dijagnostička perikardiocenteza rijetko je indicirana zbog potencijalno po život opasnih komplikacija.
Ostale dijagnostičke metode. Rendgenogram srca i pluća nema veću dijagnostičku važnost u dijagnostici akutnoga perikarditisa, ali može imati značajno mjesto u diferencijalnoj dijagnostici bolesnika koji se javljaju s bolovima u prsima. Kod većih perikardijalnih izljeva uočava se kardiomegalija. Kod bolesnika s nejasnom dijagnozom akutnoga perikarditisa nakon ehokardiografije preporuča se magnetna rezonanca (MR) srca koja omogućava detaljniju morfološku analizu perikarda i uočavanje znakova upale.
Diferencijalna dijagnoza obuhvaća različite bolesti i stanja; akutni infarkt miokarda, disecirajuća aneurizma aorte, akutna plućna embolija, pleuritis, ezofagealna patologija, akutni medijastinitis.
Liječenje akutnoga perikarditisa temelji se na etiologiji. U ovome dijelu bit će opisano liječenje idiopatskoga perikarditisa kao najčešćega kliničkog oblika, dok će u nastavku teksta biti opisano liječenje specifičnih kliničkih oblika perikarditisa. Svim se bolesnicima savjetuje izbjegavanje fizičkih napora i mirovanje do povlačenja simptoma i normalizacije laboratorijskih nalaza, za što je ponekad potrebno i više mjeseci. Prvu liniju liječenja čini primjena nesteroidnih protuupalnih lijekova, dok se primjena kolhicina i kortikosteroida preporuča kod težih oblika. Preporučeno vrijeme medikamentnoga liječenja iznosi minimalno tri do četiri tjedna kako bi se smanjila stopa recidiva bolesti. Također, kod ovih bolesnika preporuča se izbjegavanje antitrombocitne i antikoagulacijske terapije zbog mogućnosti razvoja hematoperikarda.
Nesteroidini protuupalni lijekovi predstavljaju prvu liniju liječenja akutnoga perikarditisa kod većine oboljelih. Najčešće se primjenjuju acetilsalicilina kiselina i ibuprofen. Početna doza acetilsalicilne kiseline iznosi 600 do 900 mg svakih osam sati, dok se ibuprofen primjenjuje u dozi od 600 mg svakih osam sati. Liječenje se u ovim dozama primjenjuje tijekom 7 do 14 dana, a potom se doza postupno smanjuje (acetilsalicilna kiselina 250 - 500 mg, a ibuprofen 200 - 400 mg tijekom jednoga do dva tjedna). Tijekom primjene ovih lijekova zbog povećanog rizika od nastanka ulkusne bolesti preporuča se provođenje gastroprotekcije inhibitorima protonske pumpe.
Kolhicin predstavlja drugu liniju liječenja, a uvodi se u terapiju kod bolesnika kod kojih simptomi bolesti perzistiraju ili se pogoršavaju nakon više od 72 sata od početka liječenja nesteroidnim protuupalnim lijekovima, s kojima se i primjenjuju kao kombinirana terapija. Kolhicin se primjenjuje u jednoj dnevnoj dozi od 0,5 mg kod bolesnika koji imaju tjelesnu težinu do 70 kg, dok se kod bolesnika koji su teži od 70 kg primjenjuje u dvije dnevne doze. Liječenje se primjenjuje tijekom najmanje tri mjeseca, iako nije obvezno snižavanje doze na kraju liječenja, preporuča se tijekom zadnja dva tjedna smanjiti dozu lijeka. Kod bolesnika koji su dobivali lijek u jednoj dnevnoj dozi on se primjenjuje svaki drugi dan, dok se kod bolesnika s dvostrukom dnevnom dozom ona smanjuje na jednu dnevnu dozu. Kod bolesnika s perzistentnim i rekurentnim perikarditisom liječenje kolhicinom može trajati i do šest mjeseci. Primjena lijeka izbjegava se kod bolesnika s oštećenom funkcijom jetre i bubrega, a najčešća nuspojava je proljev.
Kortikosteroidi se primjenjuju kod najtežih oblika bolesti kod kojih se ne postiže terapijski uspjeh kombiniranom terapijom nesteroidnih protuupalnih lijekova i kolhicinom. Liječenje kortikosteroidima traje četiri do šest tjedana, a početna doza iznosi 0,025 - 0,5 mg/kg uz kasnije postupno snižavanje doze. Primjena imunosupresiva kao što su ciklofosfamid, azatioprin, metotreksat i/ili primjena humanih imunoglobulina rezervirana je kao zadnja mogućnost kod bolesnika koji ne reagiraju niti na jedan oblik od navedenih vrsta liječenja.
Terapijska perikardiocenteza i/ili kirurško liječenje (subtotalna perikardiektomija) indicirani su kod bolesnika s kroničnim perikardijalnim izljevom koji dovodi do poremećaja dijastoličke funkcije srca, do razvoja tamponade ili nosi rizik od razvoja kroničnoga konstriktivnog perikarditisa.
Prognoza. Idiopatski perikarditis je najčešće samoograničavajuća bolest koja dobro reagira na primjenu nesteroidnih protuupalnih lijekova te se u potpunosti povlači bez trajnih posljedica. Kod oko 25 % bolesnika bilježi se recidiv bolesti kroz nekoliko mjeseci, a oko 5 % bolesnika razvije tamponadu perikarda, kao najtežu i potencijalno smrtonosnu komplikacija. Prognoza drugih oblika perikarditisa zasebno je opisana.
POSEBNI OBLICI AKUTNOGA PERIKARDITISA
Virusni perikarditis zajedno s idiopatskim perikarditisom predstavlja najčešći oblik koji se susreće u kliničkoj praksi. Najčešći uzročnici su Coxsackie B virus, ehovirusi te Epstein-Barrov virus, a vrijeme njihove najveće pojavnosti je proljeće. Kod većine bolesnika nalazimo podatke o preboljenom akutnom infektu i simptomima nalik gripi koji su prethodili nastanku perikarditisa. U laboratorijskim nalazima bilježimo ubrzanu sedimentaciju eritrocita, povišeni C-reaktivni protein te umjereno povišene kardioselektivne enzime. Svim bolesnicima preporuča se serološka ili molekularna dijagnostika na najčešće viruse. Liječenje je istovjetno kao i kod idiopatskoga perikarditisa. Glavne komplikacije su tamponada i recidivirajući perikarditis, a prognoza je načelno dobra i većina se bolesnika u potpunosti oporavi bez trajnih posljedica.
Bakterijski (gnojni) perikarditis rjeđi je oblik perikarditisa uzrokovan bakterijama koje dovode do stvaranja gnoja i purulentnoga perikardijalnog izljeva (Staphylococcus aureus, Streptococcus pneumoniae). Klinička slika praćena je visokom temperaturom i izraženim općim infektivnim sindromom. Kod trećine bolesnika razvija se klinička slika tamponade, a kod još trećine kronični konstriktivni perikarditis. Dijagnoza se postavlja na temelju burne kliničke slike, izražene leukocitoze s neutrofilijom i skretanjem u lijevo, a potvrđuje perikardiocentezom i analizom izljeva. Liječenje se sastoji od terapijske drenaže perikardijalne šupljine, intravenskih antibiotika, a kod jednoga dijela bolesnika indicirano je i operativno liječenje. Bolest je praćena lošom prognozom i visokom stopom mortaliteta.
Tuberkulozni perikarditis danas se rijetko susreće, a nastaje hematogenom ili limfogenom diseminacijom uzročnika tuberkuloze (Mycobacterium tuberculosis), najčešće iz pluća. Ta se komplikacija tuberkuloze obično susreće u imunokompromitiranih bolesnika. Na tuberkuloznu etiologiju perikarditisa ukazuju kronične subfebrilne temperature, noćno preznojavanje, malaksalost, gubitak teka i gubitak na težini, osobito prisutnost respiratornih manifestacija (kašalj, hemoptize). Dijagnoza se potvrđuje punkcijom perikardijalnoga izljeva i mikrobiološkim dokazom uzročnika, a liječenje se provodi antituberkuloticima uz dodatak prednizolona kroz dva do šest tjedana. Bolest je često komplicirana razvojem kroničnoga konstriktivnog perikarditisa.
Postinfarktni perikarditis razvija se kod oko 20 do 50 % bolesnika tijekom prvih nekoliko dana od nastanka akutnoga infarkta miokarda, osobito anteriorne lokalizacije, a nastaje uslijed kemijskoga nadražaja priležećega perikarda nekrotičnom masom. Pojava perikarditisa u vezi s akutnim infarktom miokarda viđa se i kod bolesnika s Dresslerovim sindromom, rijetkom autoimunom bolesti koja je praćena razvojem pleuritisa i/ili perikarditisa, što se javlja tijekom 1. do 12. tjedana od infarkta. U liječenju treba izbjegavati nesteroidne protuupalne lijekove i kolhicin zbog slabijega cijeljenja infarktne zone. Više o ovim stanjima vidi u poglavlju o komplikacijama akutnoga koronarnog sindroma.
Uremični perikarditis javlja se u sklopu terminalne faze kroničnoga bubrežnoga zatajenja (uremija) i povezan je s povišenim vrijednostima ureje u krvi (> 60 mmol/L), iako nema jasne povezanosti između koncentracije ureje i kreatinina u serumu s pojavnosti i težinom bolesti. Bolest se rjeđe javlja kod bolesnika koji su na peritonejskoj dijalizi nego onih na hemodijalizi. Nastup bolesti obično je potaknut infektom ili neodgovarajućom dijalizom. Klinički se očituje kao akutni perikarditis praćen stvaranjem veće količina eksudata što može rezultirati razvojem tamponade. Liječenje uključuje intenzivirano liječenje hemodijalizom uz izbjegavanje sistemske heparinizacije uz primjenu nesteroidnih protuupalnih lijekova.
Neoplastični perikarditis javlja se kao posljedica reakcije perikarda na infiltraciju tumorskim stanicama (metastaze karcinoma bronha, dojke, leukemična infiltracija, Hodgkinov i non-Hodgkinov limfom). Karakteristično je naglo i brzo stvaranje izljeva (gubitak elastičnosti zbog infiltracije), a dijagnoza se postavlja na temelju citološke analize punktata. Liječenje se sastoji od liječenja osnovne bolesti, terapijske perikardiocenteze, a u obzir dolazi i subtotalna perikardiektomija. Prognoza je loša.
Radijacijski perikarditis najčešće se javlja kao komplikacija radijacijske terapije torakalne regije. Može se javiti tijekom zračenja ili tjednima, pa i mjesecima nakon zračenja. Klinički se očituje kao kronični perikardijalni izljev ili kao kronični konstriktivni perikarditis. Dijagnoza se postavlja citološkim pregledom punktata, u prvom redu zbog isključenja malignoga perikarditisa. Liječenje je simptomatsko, a perikardiocenteza preporučena je samo kod velikih izljeva. Primjena kortikosteroida može biti od koristi.
Perikarditis u sklopu autoimunih bolesti može se javiti uslijed raznih bolesti, kao što su akutna reumatska vrućica, sistemski eritematozni lupus, reumatoidni artritis, sklerodermija. Više o kliničkim manifestacijama, dijagnozi i liječenju opisano je u odgovarajućim dijelovima udžbenika.
Postkardiotomijski sindrom je sindrom koji karakterizira pojava vrućice, akutnoga perikarditisa i/ili pleuritisa s mogućim plućnim infiltratima, a nastaje unutar dva do četiri tjedna nakon otvorene operacije srca koja je uključivala inciziju i manipulaciju perikardom. Slično stanje opisuje se i kod perforacije miokarda kateterom ili elektrodom srčanoga elektrostimulatora, tupe traume srca ili dijagnostičke punkcije lijevoga ventrikula. Klinička slika je identična kao i kod idiopatskoga perikarditisa uz češće i obilnije stvaranje izljeva. Dijagnoza se postavlja na osnovi anamnestičkoga podataka o nedavnoj operaciji srca uz ostale znakove akutnoga perikarditisa. Kolhicin i kortikosteroidi čine temelj medikamentnoga liječenja.
PERIKARDIJALNI IZLJEV
Definicija. Perikardijalni izljev (perikardijalna efuzija) označava patološko stanje karakterizirano pojavom povećane količine tekućine u perikardijalnom prostoru. Perikardijalni prostor normalno sadržava 25 do 50 ml tekućine. Ovisno o brzini stvaranja izljeva i kliničkoj slici, razlikujemo akutni perikardijalni izljev, praćen brzim stvaranjem i izraženom kliničkom slikom, te subakutni, odnosno kronični koji je obilježen sporijim stvaranjem izljeva te asimptomatskim ili blago simptomatskim tijekom.
Etiologija. Perikardijalni izljev najčešće nastaje kao posljedica akutnoga perikarditisa (virusni, idiopatski, postinfarktni, bakterijski, tuberkulozni), autoimunih bolesti, operacija i trauma prsnoga koša, karcinoze perikarda, zračenja medijastinuma, bubrežnoga zatajenja i uremije, miksedema te propagacije aortne disekcije.
Patofiziologija. Utjecaj perikardijalnoga izljeva na hemodinamku i srčanu funkciju ponajprije ovisi o brzini stvaranja izljeva. Perikard je u osnovi elastičan i ako je stvaranje izljeva polagano, dolazi do njegova istezanja pri čemu se povećava intraperikardijalni prostor koji može primiti veću količinu izljeva, a da ne dođe do značajnijega porasta intraperikardijalnoga tlaka. Ako je stvaranje izljeva brzo, izostaje taj kompenzacijski mehanizam, pa i manje količine izljeva mogu biti uzrok značajnijega porasta intraperikardijalnoga tlaka koji ometa srčano punjenje te nastaje tamponada perikarda sa srčanim popuštanjem.
Klinička slika. Subakutni i kronični perikardijalni izljevi obično su asimptomatski, osobito ako su manji ili se bolesnici žale na tupu bol ili osjećaj nelagode u prsnom košu. Kod velikih izljeva moguća je kompresija na okolne strukture što može imati različite kliničke manifestacije: disfagiju, kašalj, promuklost, štucanje, osjećaj punine u gornjem abdomenu. Pri fizikalnom pregledu nalazimo povećanje relativne apsolutne mukline srca, prigušene srčane tonove te pozitivan Ewartov znak: perkutorna i auskultacijska muklina ispod lijeve skapule koja nastaje uslijed kompresije izljeva na plućno krilo. Akutni perikardijalni izljev praćen je razvojem srčanoga popuštanja zbog tamponade perikarda, što je opisano u nastavku. Također, klinička slika ovisi i o bolesti u podlozi (akutni perikarditis, autoimuno oboljenje i sl.).
Dijagnoza perikardijalnoga izljeva postavlja se na temelju kliničke slike, EKG-a, rendgenograma srca i pluća te ehokardiografije. EKG kod bolesnika s većim perikardijalnim izljevom pokazuje mikrovoltažu, često uz kompenzacijsku sinusnu tahikardiju. Radiografski se perikardijalni izljev može uočiti tek kada je njegova količina veća od 300 ml, a glavni nalaz uključuje uvećanu srčanu sijenu koja se često opisuje kao kapljičasto uvećanje. Ehokardiografija je dijagnostička metoda izbora pri sumnji na perikardijalni izljev jer omogućava uočavanje i manjih količina izljeva, njegovu distribuciju oko srčanih komora, kao i procjenu njegova utjecaja na srčanu funkciju (Tablica 1.58., Slika 1.74.). Rijetko, u nejasnim situacijama u obzir dolazi i izvođenje drugih slikovnih dijagnostičkih metoda (CT ili MR).
|
Tablica 1.58. Ehokardiografska kvantifikacija perikardijalnoga izljeva
|
|
Veličina izljeva
|
Ehokardiografske karakteristike
|
|
Mali izljevi
(50 - 100 mL)
|
Obično se nalaze samo posteriorno i uključuju odvajanje listova perikarda između kojih nalazimo anehogeno područje debljine oko 10 mm (mjereno na kraju dijastole)
|
|
Umjereni izljevi
(100 do 500 mL)
|
Oplakuju cirkumferencijalno gotovo cijelo srce, ali više straga promatrano iz subokostalne projekcije Anehogeno područje obično je između 10 do 20 mm (mjereno na kraju dijastole)
|
|
Veliki izljevi
(> 500 mL)
|
Oplakuju cirkumferencijalno cijelo srce promatrano iz subkostalne projekcije s debljinom anehogenoga područja većim od 20 mm (mjereno na kraju dijastole)
|
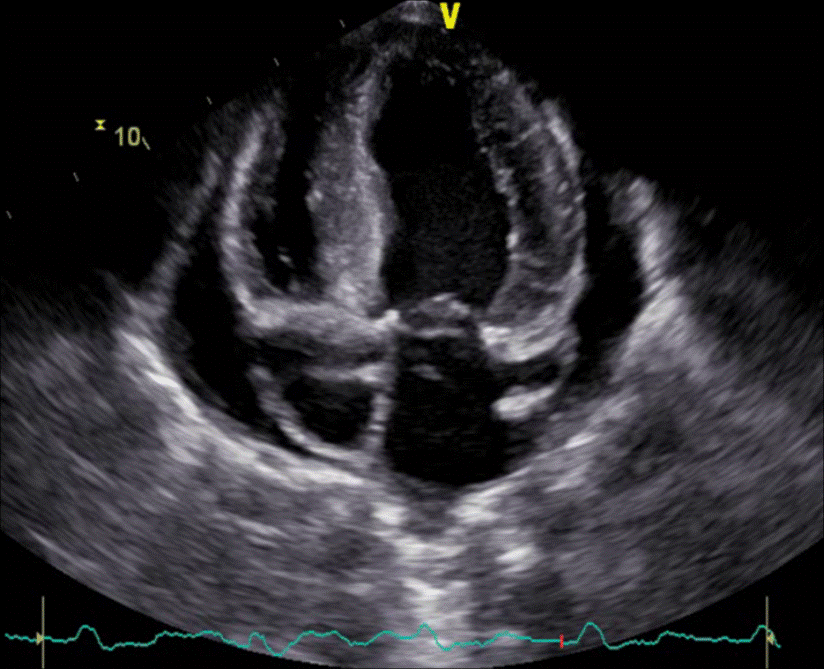
Slika 1.74. Ehokardiografski prikaz perikardijalnoga izljeva
Sastavni dio dijagnostičkoga postupka kod ovih je bolesnika i otkrivanje uzroka nastaloga perikardijalnoga izljeva. U tome pomažu anamnestički podaci (nedavni infarkt miokarda ili febrilno stanje, prisutnost artralgija i mialgija, izlaganje zračenju i sl.), laboratorijski nalazi (uremija, hormoni štitne žlijezde, antinuklearna antitijela), kao i već navedene slikovne metode (ehokardiografija, rendgenogram, CT ili MR srca).
Dijagnostička perikardoceneteza rijetko se izvodi, prvenstveno zbog svoje invazivne prirode, a uključuje biokemijsku, citološku i mikrobiološku analizu. Analiza perikardijalnoga izljeva obično se vrši kod bolesnika kojima se radi perikardiocenteza primarno iz terapijskih razloga ili kod osnovane sumnje na gnojnu ili tuberkuloznu etiologiju.
Liječenje. Terapijski pristup bolesniku s perikardijalnim izljevom temelji se na njegovom utjecaju na hemodinamsku stabilnost (pojava srčanoga popuštanja). Kod bolesnika s akutnim perikardijalnim izljevom i tamponadom srca indicirana je hitna perikardiocenteza. Kod bolesnika kod kojih nije izražena hemodinamska nestabilnost, čak i u prisustvu velikih izljeva, inicijalno liječenje je konzervativno i podrazumijeva kliničko praćenje (klinički pregledi, kontrolni ultrazvučni pregledi, praćenje) te liječenje etiološkoga entiteta koji je doveo do nastanka izljeva. Kod bolesnika s velikim izljevima preporuča se ne primjenjivati antikoagulantne lijekove, kao i izbjegavanje deplecije intravaskularnoga volumena (prekomjerne količine diuretika, dehidracija).
SRČANA TAMPONADA
Definicija i etiopatogeneza. Srčana tamponada naziv je za perikardijalni izljev koji dovodi do porasta intraperikardijalnoga tlaka u tolikoj mjeri da ometa normalno srčano punjenje i dovodi do razvoja znakova akutnoga srčanog popuštanja (opstruktivni šok). Jedan je od osnovnih patomorfoloških znakova srčane tamponade prisutnost perikardijalnoga izljeva koja dovodi do kompresije srčanih komora što onemogućava odgovarajuće dijastoličko punjenje srca s posljedičnim smanjenjem udarnoga volumena. Srčana tamponada nastaje u uvjetima brzoga stvaranja perikardijalnoga izljeva kada se perikard ne stigne prilagoditi rastezanjem i povećanjem intraperikardijalnoga prostora.
Klinička slika kod ovih bolesnika nastaje brzo, unutar nekoliko minuta ili sati (ako je uzrok krvarenje posljedično traumi, jatrogenoj ozljedi miokarda ili rupturi aneurizme u intraperikardijalni prostor), pa govorimo o akutnoj tamponadi, ili unutar nekoliko dana, što je obično slučaj kod težih oblika perikarditisa, pa govorimo o subakutnoj tamponadi. Bolesnici se žale na bolove u prsima, nedostatak zraka uz postupan razvoj znakova sistemske kongestije (uvećane vratne vene, periferni edemi, hepatomegalija) te znakova neodgovarajućega srčanoga minutnog volumena (hipotenzija, poremećaj svijesti, oligurija). Redovni nalaz kod ovih bolesnika je i tahikardija kojom se pokušava kompenzirati smanjen udarni volumen.
Dijagnoza se postavlja na osnovi kliničke slike i slikovnih metoda (radiogram, ultrazvuk). Metoda izbora u dijagnostici je ultrazvuk srca koji pokazuje perikardijalni izljev koji dovodi do kompresije i kolapsa srčanih šupljina što je uz opisanu kliničku sliku dovoljno za postavljanje dijagnoze, kao i indikaciju za hitnu perikardiocentezu.
Liječenje podrazumijeva izvođenje hitne perikardiocenteze. Perikardiocenteza se izvodi uz kontrolu ultrazvuka, subkostalnim pristupom, a zbog čestoga recidiva izljeva obično se odmah postavlja i odgovarajući kateter koji služi za produljenu drenažu perikardijalnoga prostora kroz 24 do 48 sati. Ako se radi o hematoperikardu, liječenje obično zahtijeva CT ili MR dijagnostiku i hitan operativni zahvat.
KRONIČNI KONSTRIKTIVNI PERIKARDITIS
Definicija. Kronični konstriktivni perikarditis naziv je za kronično stanje u kojemu dolazi do fibrozne i kalcificirajuće promjene perikarda uz smanjenje njegove elastičnosti, što dovodi do poremećaja dijastoličkoga punjenja ventrikula («srce u oklopu»).
Etiopatogeneza. U 35 % slučajeva kroničnoga konstriktivnog perikarditisa etiologija je nepoznata, u 10 % nastaje u sklopu virusnoga i idiopatskog perikarditisa, a 5 % uzrokuje tuberkulozni perikarditis. Ostali, rjeđi, uzroci su uremijski i radijacijski perikarditis, traumatski hemoperikard te autoimune bolesti kao što su sistemski eritematozni lupus i reumatoidni artritis. Kronični konstriktivni perikaditis nastaje kao posljedica organizacije i reparacije tkiva perikarda nakon akutne upale, obilježeno odlaganjem fibrina i stvaranjem adhezija uz sekundarnu kalcifikaciju što cijeli perikard pretvara u čvrstu vezivnu opnu. Navedene patohistološke promjene perikarda ometaju normalno dijastoličko punjenje ventrikula, pri čemu je ono smanjeno i ograničeno na sam početak dijastole, a to u konačnici dovodi do smanjenoga udarnog i minutnoga volumena srca.
Klinička slika. Kronični konstriktivni perikarditis u prvom je redu praćen simptomima i znakovima plućne i sistemske kongestije, a kasnije se razvijaju i znakovi smanjenoga minutnog volumena srca. U uznapredovaloj fazi bolesti prisutna je i anasarka (generalizirani edem cijeloga tijela). Sličnu kliničku sliku imaju i druge bolesti, što treba uzeti u obzir u diferencijalnoj dijagnostici: ciroza jetre, opstrukcija gornje ili donje šuplje vene, restriktivna kardiomiopatija, miksom desnoga atrija, valvularna bolest srca.
Dijagnoza se postavlja na osnovi slikovnih dijagnostičkih metoda. Rendgenogram srca i pluća može ukazivati na uvećanu sjenu gornje šuplje vene i oba atrija uz kalcifikacije u području perikarda, ali nije dovoljno niti specifična niti osjetljiva pri postavljanju dijagnoze kroničnoga konstriktivnog perikarditisa. Glavne dijagnostičke metode su ehokardiografija (hiperehogeni perikard, narušena dijastolička funkcija srca) te kompjuterizirana tomografija i/ili magnetna rezonanca srca.
Liječenje. Početno liječenje je medikamentno i obuhvaća primjenu nesteroidnih protuupalnih lijekova i kolhicina zajedno s diureticima, što kod dijela bolesnika kod kojih bolest traje manje od tri mjeseca može dovesti do potpune rezolucije. Kod bolesnika koji ne reagiraju na medikamentno liječenje ili imaju značajno hemodinamsko opterećenje indicirano je kirurško liječenje (dekortikacija). Oporavak dijastoličke funkcije srca nakon operacije je postupan i traje i do nekoliko mjeseci.
DEFINICIJA I KLASIFIKACIJA KARDIOMIOPATIJA
Kardiomiopatije predstavljaju bolesti srčanoga mišića karakterizirane kroničnim i progresivnim tijekom s dugom asimptomatskom fazom, koje u konačnici dovode do razvoja sindroma srčanoga popuštanja te mogu biti povezane s nastankom iznenadne srčane smrti.
Definicija kardiomiopatija imala je različite verzije kroz vrijeme, a danas se najčešće koristi i spominje definicija Europskoga kardiološkog društva iz 2008. godine koja kardiomiopatije definira kao strukturni i/ili funkcionalni poremećaj srčanoga mišića u odsutnosti koronarne, hipertenzivne i valvularne bolesti srca, kao i prirođenih srčanih bolesti. Navedena definicija ima namjeru skretanja pozornosti na druge, osobito nasljedne oblike kardiomiopatija, koji mogu imati slična morfološka obilježja kao navedene bolesti, a često ostaju neprepoznate i neliječene.
Postavljanje točne etiološke dijagnoze kardiomiopatije u kliničkoj praksi predstavlja poseban izazov, a često je i nemoguće zbog preklapanja i postojanja više uzroka i bolesti koji se mogu dovesti u vezu s nastankom kardiomiopatije.
Temeljna podjela kardiomiopatija zasnovana je na patomorfološkim karakteristikama, tako da razlikujemo nekoliko temeljnih oblika kardiomiopatija: dilatacijsku, hipertrofijsku, restriktivnu kardiomiopatiju te posebne oblike, kao što su aritmogena displazija desnoga ventrikula, te druge neklasificirane i specifične oblike.
U podjeli kardiomiopatija razlikujemo i primarne i sekundarne kardiomiopatije. Primarne nastaju kao posljedica nasljednih poremećaja koji imaju reperkusije na strukturu i/ili funkciju miokarda i kod kojih je bolest miokarda temeljna klinička manifestacija, dok sekundarne podrazumijevaju promjene na miokardu koje se javljaju u sklopu drugih bolesti u kojima su one samo dio ukupne kliničke manifestacije.
U nastavku teksta posebno će biti razmotrene dilatacijska kardiomiopatija, hipertrofijska kardiomipatija, restriktivna kardiomiopatija, aritmogena displazija desnoga ventrikula te neklasificirani i specifični oblici kardiomiopatija.
DILATACIJSKA KARDIOMIOPATIJA
Definicija i epidemiologija. Dilatacijska kardiomiopatija (DKM) predstavlja bolest srčanoga mišića koju morfološki karakterizira dilatacija lijevoga ili oba ventrikula uz izraženu sistoličku disfunkciju koja se definira sniženom istisnom frakcijom (EF < 40%) i/ili frakcijom skraćenja (FS < 25%), u odsutnosti koronarne, valvularne, hipertenzivne ili kongenitalne srčane bolesti. Prevalencija ovoga oblika kardiomiopatije kod odraslih je 14 do 36 na 100 000 osoba. Pojavnost je podjednaka kod oba spola s iznimkom DKM povezane s nasljednim bolestima koje se prenose X-kromosomom pa se pojavljuje samo kod muškaraca.
Etiopatogeneza. Ovisno o načinu nastanka, razlikujemo primarnu (prirođenu) i sekundarnu (stečenu) DK. Idiopatska dilatacijska kardiomiopatija je naziv za DKM kojoj se uzrok ne zna niti nakon opsežne dijagnostičke obrade.
Primarna dilatacijska kardiomiopatija nastaje kao posljedica nasljednih genetskih poremećaja koji uvjetuju razvoj strukturnih promjena na srcu koje će rezultirati nastankom dilatacije srčanih šupljina. Kod 25 do 50 % bolesnika koji razviju DKM smatra se da je etiologija genetski uvjetovana. Ovaj se oblik može javiti kao izolirana DKM bez drugih sistemskih manifestacija, ili kao dio kliničke slike različitih nasljednih sindroma (npr. mišićna distrofija). Iako se radi o nasljedno uvjetovanom obliku kardiomiopatije, njezina manifestacija nije nužno vezana uz djetinjstvo i mlađu dob, već se može pojaviti i u kasnoj životnoj dobi.
Izolirana primarna DKM javlja se kao posljedica genetskih poremećaja koji se primarno manifestiraju poremećajem građe i strukture miokarda te je srčano popuštanje glavna klinička manifestacija kod ovih bolesnika. Radi se najčešće o poremećajima gena koji su odgovorni za stvaranje citoskeletnih, sarkomernih i nuklearnih proteina, a najčešći put nasljeđivanja je autosomno-dominantni, rijetko se radi o autosomno-recesivnom, X-vezanom ili mitohondrijskom nasljeđivanju. Do danas je poznato više desetaka gena i genetskih mutacija povezanih s razvojem DKM-a, a neki od najčešćih primjera prikazani su u Tablici 1.59.
|
Tablica 1.59. Najčešći geni povezani s nastankom izolirane dilatacijske kardiomiopatije
|
|
Protein
|
Gen
|
Način nasljeđivanja
|
Učestalost
|
|
Proteini sarkomere
|
|
Titin
|
TTN
|
AD
|
15 – 25 %
|
|
Teški lanac beta miozina
|
MYH7
|
AD
|
4 – 6 %
|
|
Troponin C
|
TNNT2
|
AD
|
3 – 5 %
|
|
Miozin-vezujući protein C
|
MYPBC3
|
AD
|
1 %
|
|
Proteini citoskeleta
|
|
Dezmin*
|
DES
|
AD, AR
|
< 1 %
|
|
Distrofin*
|
DMD
|
X-vezano
|
< 1 %
|
|
Nuklearni i ostali proteini
|
|
Laminin A/C
|
LMNA
|
AD, AR
|
4 – 8 %
|
|
RNA-vezujući protein
|
RBM20
|
AD
|
3 – 5 %
|
|
Kardijalni natrijski kanal
|
SCN5A
|
AD
|
1 – 2 %
|
*moguća pojava kao izolirana kardiomiopatija, ali i u sklopu nasljednih sindroma
Primarna DKM može se javiti i kao jedna od manifestacija nasljednih poremećaja koji imaju reperkusije na više organa ili organskih sustava. Najčešće se radi o nasljednim neuromuskularnim poremećajima, kao što su Duchenneova, Beckerova ili Emery-Dreifussova mišićna distrofija (mutacije gena za distrofin), a može se javiti i uslijed nekih drugih nasljednih sindroma kao što su hereditarna hemokromatoza, nasljedne dezmopatije, nasljedna sideroblastična anemija.
Sekundarna dilatacijska kardiomiopatija nastaje kao posljedica različitih stečenih bolesti i stanja, a kako nije genetski i nasljedno uvjetovana, često se govori o sporadičnoj DKM. Sekundarna DKM može nastati kao posljedica infekcijskoga miokarditisa, bolesti odlaganja i infiltrativih bolesti, toksičnoga učinka lijekova i drugih toksina, upalnih i autoimunih bolesti, endokrinih i nutritivnih poremećaja, kao i drugih specifičnih stanja (Tablica 1.60.). Patogenetski mehanizmi kojima navedeni čimbenici dovode do dilatacije srčanih šupljina opisani su u odgovarajućim poglavljima, a najčešći oblici sekundarnih DKM zasebno na kraju poglavlja.
|
Tablica 1.60. Najčešći uzroci sekundarne dilatacijske kardiomiopatije
|
|
Infekcijski miokarditis
|
Bolesti odlaganja
|
Toksini i lijekovi
|
|
Virusni miokarditis
Bakterijski miokarditis
Gljivični miokarditis
Parazitarni miokarditis
|
Hemokromatoza
Amiloidoza
|
Antraciklini, ciklofosfamid
Antivirotici (zidovudin, didanosin)
Etanol, kokain, amfetamini
Kobalt, litij, berilij, ugljični monokisd
|
|
Upalne i autoimune bolesti
|
Endokrini i nutritivni poremećaji
|
Ostale bolest i stanja
|
|
Sistemski lupus, reumatoidni artritis
Dermatomiozitis, sklerodermija
Sarkoidoza, vaskulitisi
Hipersenzitivni miokarditis
|
Hiper/hipotireoza, poremećaji hormona rasta
Šećerna bolest, Cushingov sindrom
Hipokalcijemija, hipofosfatemija, uremija
Deficit tiamina, selenija i niacina
|
Peripartalna kardiomiopatija
Kardiomiopatija uzrokovana tahikardijom
Opstruktivna apneja u spavanju (OSA)
Postradijacijska kardiomiopatija
|
Patofiziologija. Navedeni etiološki mehanizmi svaki na svoj način dovode do dilatacije i smanjenja kontraktilne snage miokarda što uvjetuje pad srčanoga minutnog volumena. Njegov početni pad kompenziraju tahikardija i ograničena hipertrofija miocita, tako da bolesnici dugo mogu biti bez simptoma. Osim toga, aktiviraju se i drugi kompenzacijski mehanizmi kako je to opisano u poglavlju o srčanom popuštanju (neurohumoralni mehanizmi). Daljnja progresija bolesti dovodi do insuficijencije kompenzacijskih mehanizama, čemu pridonose ishemija miokarda uslijed hipertrofije i tlačnoga opterećenja (pojačana napetost stijenke miokarda) te prateće funkcionalne valvularne greške (mitralna i trikuspidalna regurgitacija) koje nastaju uslijed širenja prstenova atrioventrikularnih zalistaka. Tada bolesnici ulaze u fazu dekompenzacije što se klinički prezentira razvojem srčanoga popuštanja. Osim toga, dilatirane srčane šupljine i neodgovarajuća kontrakcija miokarda mogu biti uzrokom nastanka intramuralnih tromba koji povećavaju rizik od nastanka tromboembolijskih incidenata.
Patologija. Dilatacijsku kardiomiopatiju karakterizira uvećano i mlohavo srce koje je nekoliko puta veće od svoje normalne težine s naznačenim proširenjem svih srčanih komora. Stijenka lijevoga ventrikula obično je zadebljana kao odgovor na tlačno i volumno opterećenje. Mikroskopski nalaz uključuje izdužene i hipertrofijske miocite s izraženom intersticijskom fibrozom i brojnim ožiljcima koji nastaju kao posljedica propadanja miocita.
Klinička slika. Simptomi i znakovi DKM-a najčešće nastaju u odrasloj dobi, obično između 20. i 60. godine života. Bolest ima relativno dug asimptomatski period u kojem bolesnici mogu imati naznačenu tahikardiju. U tom periodu bolest se obično slučajno otkrije, nalazom uvećane sjene srca putem slikovnih pretraga koje onda zahtijevaju daljnju dijagnostičku obradu. Rani simptomi obično su umor i dispneja pri naporu. Bolesnici navode da teže toleriraju fizičke napore, a česti su i poremećaji srčanoga ritma što se najčešće prezentira palpitacijama. S progresijom bolesti dolazi i do razvoja kliničke slike srčanoga popuštanja sa simptomima hipoperfuzije i kongestije. Fizikalni nalaz nije nespecifičan i ovisi o stadiju bolesti. Ictus cordis je pomaknut lateralno i prema dolje što uvjetovano kardiomegalijom, a auskultacijom se može čuti šum relativne mitralne i/ili trikuspidalne regurgitacije. U fazi razvijene bolesti prisutni su svi znakovi srčanoga popuštanja (periferni edemi, ascites, izražene jugularne vene, hepatojugularni refluks, hepatomegalija, periferna cijanoza, auskultacijski znakovi plućne kongestije).
Dijagnoza dilatacijske kardiomiopatije događa se na dvije razine. Najprije se postavlja dijagnoza DKM-a utemeljena na kliničkoj slici, EKG-u, rendgenskoj snimci srca i pluća te ehokardiografiji, a potom slijedi dijagnostička obradu otkrivanja uzroka DKM-a.
Inicijalna dijagnostika temelji se na pojavnosti kliničkih simptoma i znakova srčanoga popuštanja ili na slučajnom patološkom nalazu EKG-a, rendgenograma ili ultrazvuka srca.
EKG nalazi su nespecifični, a najčešće uključuju pojavu sinusne tahikardije, fibrilacije atrija i bloka lijeve grane. Česte su i nespecifične promjene ST-spojnice i T-vala što može stvarati pseudoinfarktnu sliku (osobito često u lateralnim i inferionim odvodima). Kod većine se bolesnika mogu naći i kriteriji za dilataciju lijevoga i/ili desnog atrija te hipertrofije lijevoga ventrikula. Kod izražene kardiomegalije može se naći i mikrovoltaža QRS-kompleksa. Zbog česte pojave supraventikularnih i ventrikularnih aritmija preporuča se snimanje Holter EKG-a.
Na standardnoj je rendgenološkoj snimci srca i pluća prisutna kardiomegalija s povećanim kardiotorakalnim omjerom (> 0.5). U uznapredovaloj su fazi prisutni i radiološki znaci plućne kongestije (kranijalna redistribucija krvotoka, naglašeni i prominentni hilusi, Kerleyeve B linije, pleuralni izljevi).
Ehokardiografija predstavlja zlatni standard u otkrivanju DKM-a, s obzirom na to da daje jasan uvid u morfologiju srčanih šupljina, omogućava procjenu sistoličke funkcije te otkriva sekundarne patološke promjene (funkcionalne valvularne greške, intramuralni trombi). Glavni ultrazvučni dijagnostički parametri dilatacijske kardiomiopatije su dilatacija srčanih šupljina, difuzno smanjena kontratilnost uz znakove sistoličke difunkcije (EF < 40 %, FS < 25 %). Osim toga, ehokardiografija je korisna i u procjeni etioloških čimbenika i diferencijalnoj dijagnostici DKM-a (regionalni poremećaj kontraktilnosti miokarda, nalaz valvularnih i kongenitalnih grešaka).
Etiološka dijagnostika. Nakon postavljanja dijagnoze DKM-a potrebno je isključiti postojanje koronarne, valvularne, hipertenzivne i kongenitalne srčane bolesti kao mogućega uzroka sličnih morfoloških promjena. Dijelom se to oslanja na anamnezu (dugogodišnja neregulirana hipertenzija, anamneza anginoznih smetnji), a dijelom na neinvazivne i invazivne pretrage (ehokardiografija i druge slikovne metode, koronarografija). Nakon isključenja srčanih oboljenja potrebno je provesti dijagnostičku obradu s ciljem otkrivanja mogućega uzroka, koja uključuje laboratorijsku dijagnostiku, specifične slikovne metode te invazivne procedure (kateterizacija srca, endomiokardna biopsija).
Na primarnu, genetski uvjetovanu DKM treba pomišljati kod bolesnika koji imaju obiteljsku anamnezu pozitivnu na slična oboljenja ili iznenadne srčane smrti u mlađoj životnoj dobi. Iako se ne provode rutinski, rade se i specifična genetska ispitivanja.
Laboratorijska dijagnostika uključuje određivanje hematoloških, biokemijskih i koagulacijskih parametara (kompletna i diferencijalna krvna slika, sedimentacija eritrocita, ionogram, ferogram, mišićni enzimi, ukupni proteini i albumini, koagulogram), ali i specifičnih pretraga, kao što su hormoni štitnjače, serologija na najčešće infektivne uzročnike miokarditisa te imunološko-reumatološke pretrage. Patološki nalazi određenih laboratorijskih nalaza mogu biti pokazatelj specifičnoga uzroka DKM-a.
Magnetna rezonanca srca danas se preporuča svim bolesnicima s DKM-om, s obzirom na njezino bitno mjesto u dijagnostici miokarditisa i infiltrativnih bolesti, jednima od najčešćih uzroka sekundarne DKM. Magnetna rezonanca primjenom gadolinija omogućava dodatne prednosti, kao što je utvrđivanje etiološke naravi ožiljaka miokarda (upala ili infarkt).
Invazivna dijagnostička obrada uključuje koronarografiju kojom se isključuju koronarne bolesti, dok se kateterizacija desnoga srca i endomiokardna biopsija izvode rjeđe, i to kod bolesnika s nerazjašnjenom etiologijom i nakon provedene opisane obrade. Kateterizaciju srca s mjerenjem plućnih tlakova treba obaviti u pripremnoj obradi prije transplantacije srca radi procjene plućne hipertenzije i plućne vaskularne rezistencije.
Diferencijalna dijagnoza. Kod bolesnika s DKM-om potrebno je najprije isključiti srčana oboljenja koja mogu dovesti do sličnih morfoloških i kliničkih obilježja, a to su koronarna bolest srca, hipertenzivna bolest srca, bolesti srčanih zalistaka i kongenitalne srčane bolesti. Daljnja diferencijalna dijagnoza usmjerena je na pronalaženje uzroka (primarna ili sekundarna DKM), što uključuje genetske poremećaje i bolesti i stanja navedena u Tablici 1.60.
Liječenje bolesnika s DKM-om uglavnom je nespecifično i oslanja se na metode liječenja opisane u poglavlju o kroničnom srčanom popuštanju. Ako je etiologija poznata i izlječiva, liječenje mora biti usmjereno na nju. Osim toga, potrebno je raditi i na liječenju i uklanjanju standardnih kardiovaskularnih rizika koji mogu dodatno pogoršavati bolest. Ako se radi o idiopatskoj DKM ili DKM poznatoga, ali neizlječivoga uzroka, liječenje se provodi po načelu liječenja kroničnoga srčanog popuštanja primjenom lijekova koji utječu na tijek bolesti (beta blokatori, ACE inhibitori ili blokatori angiotenzinskih receptora, antagonisti mineralokortikoidnih receptora, angiotenzin receptor-neprilisin inhibitor) ili dovode do simptomatskoga olakšanja (diuretici), kao i primjenom nefarmakoloških mjera liječenja (ICD, CRT, mehanička cirkulacijska potpora) u posebno definiranim indikacijama. Potrebno je i liječenje nastalih poremećaja srčanoga ritma (npr. fibrilacija atrija), kao i antikoagulacijsko liječenje u definiranim indikacijama (fibrilacija atrija, ehokardiografski dokazan intramuralni tromb). Krajnja terapijska mogućnost je transplantacija srca. Kao krajnja metoda liječenja kod oboljelih kod kojih primjenom medikamentozne terapije nije postignuta stabilizacija bolesti navodi se mogućnost transplantacije srca.
Prognoza ovih bolesnika prvenstveno ovisi o vremenu postavljanja dijagnoze. Ako se dijagnoza postavi u asimptomatskoj, kompenziranoj fazi, primjenom mjera liječenja može se znatno odgoditi vrijeme nastanka simptoma i znakova dekompenzacije, održati kvalitetu života i produljiti očekivani životni vijek. Kada se pojave simptomi srčanoga popuštanja, prognoza je jednaka kao i kod drugih bolesnika s kroničnim srčanim popuštanjem i petogodišnje preživljenje je manje od 50 %. Stopa godišnja mortaliteta je od 11 do 13 %, uvelike ovisi i o uzročnoj bolesti.
Prevencija. S obzirom na to da je DKM kod velikoga dijela bolesnika genetski uvjetovan, preporuča se dijagnostički probir najbližih srodnika oboljele osobe, bez obzira na postojanje simptoma. To uključuje EKG i ehokardiografiju, a zbog sporoga razvoja bolesti, treba ih ponavljati svakih pet godina do navršene 50. godine života. Na taj se način bolest otkriva ranije i rezultati liječenja su uspješniji.
HIPERTROFIJSKA KARDIOMIOPATIJA
Definicija i epidemiologija. Hipertrofijska kardiomiopatija (HKM) naziv je za nasljednu bolest srčanoga mišića karakteriziranu hipertrofijom lijevoga ventrikula u odsutnosti tlačnoga i/ili volumnog opterećenja kojim bi se ona objasnila. Radi se o najčešćoj nasljednoj bolesti miokarda s prevalencijom od između 0,2 i 0,5 % u općoj populaciji i jednome od najčešćih uzroka iznenadne srčane smrti mladih osoba. Podjednako se javlja kod oba spola i u svim dobnim skupinama. Bolest karakterizira raznolik klinički tijek, od asimptomatske bolesti i normalnoga očekivanog trajanja života pa sve do brzoprogresivnoga srčanog popuštanja i povećanoga rizika od nastanka iznenadne srčane smrti.
Etiopatogeneza. Hipertofijska kardiomiopatija nastaje kao rezultat mutacija gena odgovornih za nastanak proteina sarkomere, osnovne kontraktilne jedinice poprečno-prugaste muskulature. Do danas je poznato više od 400 mutacija na jedanaest različitih gena koje mogu dovesti do pojave ove bolesti. Mutacije su prisutne kod više od polovice bolesnika i nasljeđuju se autosomno-dominantnim putem, dok se kod jednoga dijela bolesnika radi i o novonastalim, tzv. „de novo“ mutacijama. Najčešći geni i mehanizmi nasljeđivanja te njihova učestalost prikazani su u Tablici 1.61. Smatra se da su nastale mutacije odgovorne za povećanu aktivaciju miofilamenata, a time i povećanu kontraktilnost miokarda u cijelosti, što tijekom vremena vodi u hipertrofiju. Točni mehanizmi kojima se ostvaruje ta pojačana aktivacija miofilamenata nije u potpunosti istražena, a različiti eksperimentalni modeli ukazuju na više mogućnosti: povećan neuralni ulaz (engl. uptake) noradrenalina u kardiomiocite, što vodi snažnom simpatičkom učinku, poremećena aktivacija angiotenzin II tip 1 i tip 2 receptora koji djeluju kao modulatori hipertrofije, pojačana osjetljivost na kalcij koja dovodi do hiperkontraktilnosti.
|
Tablica 1.61. Najčešće mutacije gena povezane s hipertrofijskom kardiomiopatijom
|
|
Protein
|
Gen
|
Način nasljeđivanja
|
Učestalost
|
|
Teški lanac beta miozina
|
MYH7
|
AD
|
30 – 40 %
|
|
Miozin-vezujući protein
|
MYBPC3
|
AD
|
30 – 40 %
|
|
Troponin T
|
TNNT2
|
AD
|
10 – 15 %
|
|
Troponin I
|
TNNI3
|
AD
|
2 – 5 %
|
|
Αlfa-tropomiozin
|
TPM1
|
AD
|
1 – 2 %
|
|
Laki lanac miozina
|
MYL3
|
AD
|
1 %
|
Sličan klinički fenotip (hipertrofija lijevoga ventrikula) može se naći i u sklopu drugih nasljednih sindroma, kao što su Friedreichova ataksija, neurofibromatoza tip I i II, nasljedna sferocitoza, bolesti odlaganja glikogena te lizosomske bolesti.
Patologija. Hipertrofijska kardiomiopatija pokazuje heterogenu morfološku sliku. Najčešće se radi o difuznoj hipertrofiji lijevoga ventrikula koja je najizraženija u području intraventrikularnoga septuma, ali se mogu naći i drugi oblici - kao što su koncentrična hipertrofija srednjega dijela ventrikula s aneurizmatskim proširenjem apeksa ili hipertrofija lijevoga ventrikula s dominantnom hipertrofijom apeksa. Istodobnu hipertrofiju desnoga ventrikula nalazimo kod oko 40 % bolesnika. Često se nalaze i druge promjene, kao što su anomalije papilarnih mišića i mitralnih kuspisa. Debljina stijenke lijevoga ventrikula u HKM-u može znatno varirati - od 15 mm pa sve do 50 mm (prosječno iznosi oko 20 mm). Mikroskopski se nalaze znakovi izražene hipertrofije kardiomiocita uz izraženu disorganizaciju miokardnih mišićnih vlakana te područja intersticijske fibroze. Kod više od 80 % bolesnika prisutne su i promjene na koronarnim arterijama u vidu suženja lumena i zadebljanja stijenke na račun proliferacije glatkomišićnih stanica srednjeg mišićnoga sloja (medija).
Patofiziologija. Razvoj HKM-a praćen je razvojem nekoliko značajnih patofizioloških posljedica: dijastolička disfunkcija, poremećaj hemodinamike te miokardna ishemija. Osim toga, HKM je povezana s višom učestalošću ventrikularne tahiaritmije i iznenadne srčane smrti.
Dijastolička disfunkcija je osnovni patofiziološki poremećaj kod bolesnika s HKM-om, a nastaje kao posljedica povećane krutosti (smanjene popustljivosti) miokarda lijevoga ventrikula što dovodi do otežane relaksacije i povećanja tlaka na kraju dijastole. Dijastoličku disfunkciju prati i smanjena brza faza punjenja lijevoga ventrikula uslijed produljene relaksacije, stoga ovi bolesnici teže podnose razvoj fibrilacije i undulacije atrija.
Poremećaj hemodinamike. Hipertrofijska kardiomiopatija može dovesti do opstrukcije izlaznoga trakta lijevoga ventrikula što nazivamo opstrukcijska HKM, i ona je uzrokovana pomakom prednjega mitralnog kuspisa prema naprijed tijekom sistole, pri čemu on dolazi u kontakt s hipertrofiranim septumom što dovodi do opstrukcije pri izgonu krvi prema aorti (SAM, od engl. systolic anterior motion). Na opstrukciju ukazuje povećan sistolički gradijent tlaka u izlaznom traktu lijeve klijetke (> 30 mmHg/s). Opstruktivni tip HKM-a povezan je s težom kliničkom slikom i lošijim kliničkim ishodima.
Ishemija miokarda nastaje uslijed već opisanih promjena na koronarnim arterijama koje se mogu naći kod ovih bolesnika, ali i zbog nesklada u količini tkiva miokarda i veličine koronarne krvne mreže (koronarna cirkulacija postaje insuficijentna za opskrbu hipertrofiranoga miokarda krvlju i kisikom). Dijastolička disfunkcija također doprinosi ishemiji miokarda produljenom relaksacijom koja ometa punjenjenje i protok krvi kroz koronarne arterije.
Klinička slika. Većina bolesnika s HKM-om ima dug asimptomatski period i tada se bolest najčešće dijagnosticira prilikom slučajnoga patološkog nalaza EKG-a koji ukazuje na hipertrofiju lijevoga ventrikula ili slučajno otkrivenoga auskultacijskog šuma. Tri osnovne kliničke manifestacije kod ovih bolesnika su: 1) dispneja prisutna kod više od 90 % oboljelih, nastaje uslijed dijastoličke disfunkcije, povećanja tlaka u lijevom ventrikulu na kraju dijastole i posljedičnoga prijenosa na plućnu cirkulaciju što uvjetuje nastanak plućne kongestije; 2) anginozne smetnje kod 70 do 80 % bolesnika, a posljedica su opisane ishemije miokarda te 3) palpitacije, presinkope i sinkope koje nastaju kao posljedica paroksizmalnih poremećaja srčanoga ritma i/ili opstrukcije izlaznoga trakta lijevoga ventrikula. Nekada je prvo i jedino očitovanje bolesti nastanak iznenadne srčane smrti koja nastaje kao posljedica ventrikularne tahikardije ili ventrikularne fibrilacije. Karakteristično je da bolesnici s distalnom ili apikalnom hipertrofijom imaju manje izražene simptome, bolje podnose napor i imaju ukupno bolju prognozu. Najznačajniji znak pri fizikalnom pregledu je prisutnost glasnoga sistoličkog šuma pri opstrukciji izlaznoga trakta lijevoga ventrikula koji se najbolje čuje uz donji lijevi rub sternuma i na apeksu.
Dijagnoza HKM-a, slično kao i kod drugih oblika kardiomiopatije, sastoji se od inicijalne obrade koju čine temeljito uzeta anamneza, fizikalni pregled, EKG te slikovne metode. Na temelju njih postavlja se dijagnoza HKM-a, a potom se provodi obrada s ciljem isključivanja drugih mogućih uzroka HKM-a i genetsko testiranje.
EKG je patološki kod više od 95 % bolesnika. Temeljni nalaz uključuje prisutnost kriterija za hipertrofiju lijevoga ventrikula s devijacijom električne osi ulijevo. Na prisutnost septalne hipertrofije ukazuju patološki Q-zupci u lijevim perkordijalnim i inferiornim odvodima (V4-V6, II, III, aVF) te visoki R-zupci u desnim (V1 - V3). Kod bolesnika s opstruktivnim tipom HKM-a može se naći i produljen QT-interval. Bolesnici s apikalnom hipertrofijom pokazuju izražene negativne T-valove u prekordijalnim odvodima, osobito u području V3 i V4. Otkrivanje supraventrikularnih i ventrikularnih aritmija omogućava Holter-EKG.
Ergometrija omogućava otkrivanje poremećaja srčanoga ritma uvjetovanih tjelesnim naporom, a omogućava i procjenu funkcionalnoga kapaciteta i koronarne rezerve. Tijekom opterećenja se kod bolesnika s izraženom opstrukcijom izlaznoga trakta lijevoga ventrikula može javiti hipotenzija, bilo od samoga početka, bilo nakon početnoga maksimalnog porasta, što predstavlja loš prognostički znak.
Rendgenogram srca i pluća ovih bolesnika može izgledati normalno, osobito u početku bolesti. Kasnije se kod bolesnika može pojaviti kardiomegalija s karakterističnim izbočenjem lijeve konture srca. U najtežim oblicima nalaze se kongestivne plućne promjene kao odraz izražene dijastoličke disfunkcije.
Ehokardiografija predstavlja slikovnu metodu izbora u dijagnostici HKM-a. Ona omogućava detaljnu morfološku analizu lijevoga i desnoga ventrikula, procjenu sistoličke i dijastoličke funkcije srca, kao i procjenu opstrukcije izlaznoga trakta lijevoga ventrikula. Na HKM ukazuje debljina stijenke lijevoga ventrikula preko 15 mm, a hipertrofija je najčešće izražena u području prednjega interventrikularnog septuma, dok su stražnji dio septuma i slobodna stijenka rjeđe zahvaćeni. Kod 28 % bolesnika zahvaćen je samo jedan segment lijevoga ventrikula, kod 38 % dva segmenta, a kod 34 % tri ili više segmenata, ili se radi o difuznoj hipertrofiji. Što je hipertrofija proksimalnije, to je veća vjerojatnost pojave pomaka prednjega mitralnog kuspisa prema naprijed (SAM) i opstrukcije izlaznoga trakta lijevoga ventrikula. Opstrukcija se procjenjuje mjerenjem tlačnoga gradijenta pomoću kontinuiranoga doplera: trećina bolesnika ima sistolički gradijent tlaka u izlaznom traktu lijevoga ventrikula veći od 30 mmHg u mirovanju što predstavlja jasnu opstrukciju; trećina ih ima tlačni gradijent manji 30 mmHg u mirovanju i veći od 30 mmHg pri provokaciji što predstavlja latentnu opstrukciju, dok trećina bolesnika ima tlačni gradijent manji od 30 mmHg i u mirovanju i u naporu, što isključuje postojanje opstrukcije izlaznoga trakta lijevoga ventrikula. Kod više od 50 % bolesnika prisutna je i dilatacija lijevoga ventrikula (više od 55 mm mjereno na kraju dijastole). Ispitivanje tlačnoga gradijenta pri naporu omogućava stres-ehokardiografija.
Magnetna rezonanca srca (CMR, od engl. cardiac magnetic resonance) sve je češće korištena slikovna metoda u dijagnostici HKM-a, kao i bolesti srčanoga mišića uopće. Predstavlja metodu izbora kod bolesnika s nejasnim nalazom ehokardiografije, osobito ako je ona tehnički teže izvediva (npr. zbog konstitucije bolesnika). Ova pretraga daje izvrstan uvod u opseg i lokalizaciju hipertrofije (morfološke značajke), kako lijevoga, tako i desnoga ventrikula, kao i abnormalnosti mitralnoga zaliska, a osobito je značajna u dijagnostici apikalne hipertrofije i aneurizme koju je teže vizualizirati ehokardiografski. Također, ova pretraga omogućava diferencijalno dijagnostičko razlučivanje HKM-a od ostalih metaboličkih i infiltrativnih kardiomiopatija. Koristi se i u svrhu probira i rane dijagnoze HKM-a kod bolesnika kojima nije dostupno genetsko testiranje ili su nalazi genetskih testiranja nejasni.
Invazivna dijagnostička obrada. Koronarografija, kateterizacija lijevoga srca s ili bez biopsije miokarda te elektrofiziološko ispitivanje ne primjenjuju se rutinski, već samo u posebnim situacijama (isključivanje ili potvrda promjena na koronarnim arterijama uslijed anginoznih smetnji, ispitivanje aritmičnih uzroka učestalih sinkopa).
Diferencijalna dijagnoza je široka i uključuje hipertrofiju miokarda koja može nastati iz različitih razloga. Pri tome treba najčešće pomišljati na aortnu stenozu, hipertenzivnu bolest srca te bolesti nakupljanja (Fabryjeva bolest, Pompeova bolest).
Klinički probir na HKM. S obzirom na to da se najčešće radi o autosomno-dominantno uvjetovanom nasljednom poremećaju, kod svih bolesnika kod kojih se utvrdi ova dijagnoza potrebno je provesti genetsko savjetovanje i otkriti osobe potencijalno izložene riziku od razvoja ove kardiomiopatije. Kod tih se osoba preporuča provođenje probira koji se sastoji od EKG-a i ehokardiografije, izvođenih u vremenskim intervalima od 12 do 18 mjeseci počevši od 12. godine života pa sve dok se ne postigne potpuni rast i razvoj (obično do 18. ili 21. godine života), a nakon toga se probir može provoditi u vremenskim intervalima od pet godina.
Liječenje. Glavni terapijski ciljevi kod bolesnika s HKM-om su kontrola simptoma te prevencija iznenadne srčane smrti. Liječenje HKM-a podrazumijeva primjenu lijekova, ugradnju kardioverter defibrilatora (ICD) te kirurške i druge interventne metode liječenja. Svim bolesnicima preporučuje se izbjegavanje tjelesnih napora, dehidracije kao i kontrola rizičnih čimbenika koji uvjetuju razvoj koronarne bolesti.
Medikamentno liječenje indicirano je za sve simptomatske bolesnike s HKM-om, dok ostaje nejasan stav oko liječenja asimptomatskih bolesnika, a odluka o tome temelji se na prisutnosti rizičnih čimbenika za iznenadnu srčanu smrt. Temeljni lijekovi u liječenju HKM-a su lijekovi s primarno negativnim inotropnim učinkom koji usporavaju izbacivanje krvi u ranoj fazi sistole te produljuju dijastoličko punjenje. Beta blokatori predstavljaju lijek izbora kod ovih bolesnika i čine prvu liniju liječenja. Doza beta blokatora postupno se titrira do postizanja ciljne srčane frekvencije od 50 do 70 u minuti u mirovanju i 130 do 140 u minuti tijekom opterećenja. Blokatori kalcijskih kanala (primarno verapamil) koriste se kod bolesnika kojima se kontrola simptoma ne može postići uz beta blokatore kao dodatna terapija (iako se njihova kombinacija treba izbjegavati) ili kao zamjena za njih kod bolesnika koji ih loše podnose ili su kontraindicirani. Početna doza verapamila iznosi 120 mg/dan te se postupno titrira do ciljanih vrijednosti frekvencije ili maksimalne doze (480 mg/dan). U liječenju pridruženih aritmija koje se ne mogu kontrolirati primjenom beta blokatora ili blokatora kalcijskih kanala koriste se dizopiramid ili amiodaron. Dizopiramid se može koristiti dodatno i kao lijek koji smanjuje opstrukciju izlaznoga trakta lijevoga ventrikula, npr. kod bolesnika s visokim tlačnim gradijentnom, koji su simptomatski unatoč primjeni beta blokatora.
Elektrostimulacija srca koristi se u liječenju simptomatskih bolesnika s izraženom opstrukcijom izlaznoga trakta lijevoga ventrikula koji nisu kandidati za kirurško ili intervencijsko liječenje, ili u slučaju razvoja bradiaritmije koja svakako zahtijeva elektrostimulaciju. Ovim se bolesnicima postavlja dvokomorni (DDD) elektrostimulator koji se namjesti tako da izazove asinkroniju pri kontrakcijama ventrikula, odnosno da se postigne nešto ranija kontrakcija desnoga ventrikula koja će dovesti do paradoksalnoga pomaka interventrikularnoga septuma što će u konačnici smanjiti stupanj opstrukcije izlaznoga trakta lijevoga ventrikula pri protoku krvi nakon kontrakcije lijevoga ventrikula.
Kardioverter defibrilator (ICD) se koristi u primarnoj i sekundarnoj prevenciji iznenadne srčane smrti. Ugradnja ICD-a apsolutno je indicirana za sve bolesnike koji su preživjeli kardijalni arest uslijed maligne ventrikularne aritmije (sekundarna prevencija). Pri odluci o ugradnji ICD-a u svrhu primarne prevencije koristi se procjena petogodišnjega rizika od iznenadne srčane smrti (formula koju čine definirane prognostičke varijable, SCD HCM risk calculator), a ugradnja ICD-a opravdana je ako je petogodišnji rizik veći od 6 %, iako se uz to u obzir uzimaju i drugi parametri (životni stil, socioekonomski status, psihičko zdravlje).
Kirurško liječenje indicirano je kod bolesnika koji imaju simptome unatoč optimalnoj medikamentnoj terapiji i koji imaju izraženu opstrukciju izlaznoga trakta lijevoga ventrikula (NYHA III-IV, tlačni gradijent > 50 mmHg). U tu se svrhu izvodi klasična ili proširena septalna miektomija. Među komplikacijama ove metode navode se AV-blok, aortna regurgitacija te intraventrikularni septalni defekt. Septalna miektomija smanjuje rizik od nastanka iznenadne srčane smrti, što predstavlja prednost pred alkoholnom ablacijom septuma kojom nastala nekroza može imati aritmogeni potencijal.
Alkoholna septalna ablacija predstavlja manje invazivnu metodu redukcije septalnoga miokarda, a temelji se na aplikaciji 2 ml apsolutnoga alkohola u prvu septalnu granu lijeve silazne koronarne arterije što dovodi do infarkta i posljedičnoga stanjenja miokarda. Konačni učinci ove metode vidljivi su tek tri mjeseca od zahvata. Ona se obično izvodi kod starijih osoba kod kojih je operativno liječenje kontraindicirano ili nosi visoki rizik. Nastala nekroza može biti aritmogeni fokus iz kojega mogu nastati i potencijalno životno ugrožavajuće aritmije. Ostale komplikacije podrazumijevaju perforacija miokarda i ventrikularni septalni defekt.
Terapijski algoritam. Osnovni terapijski pristup bolesnicima s HKM-om ovisi o tome imaju li ili ne opstrukciju izlaznoga trakta lijevoga ventrikula.
Bolesnici bez opstruktivne patologije. Liječenje ovih bolesnika ovisi o tome imaju li izražene simptome srčanoga popuštanja ili angine ili ih nemaju. Ako nemaju simptoma, preporučuju se redovne kontrole u vremenskim intervalima od godine dana. Kod bolesnika sa simptomima pristup ovisi o sistoličkoj funkciji. Ako je istisna frakcija (EF) manja od 50 %, pristupa se standardnom liječenju kako je to opisano u odgovarajućim poglavljima, dok kod bolesnika s istisnom frakcijom (EF) iznad 50 % osnovu liječenja čine beta blokatori i/ili blokatori kalcijskih kanala, dok se diuretici i lijekovi s učinkom na sustav renin-angiotenzin trebaju izbjegavati i koristiti samo kod bolesnika koji ne reagiraju na opisano liječenje.
Bolesnici s opstruktivnom patologijom. Kod svih bolesnika s opstrukcijom izlaznoga trakta lijevoga ventrikula potrebno je izbjegavanje primjene vazodilatatora i diuretika u visokim dozama. Kod bolesnika bez simptoma uz navedene preporuke nije potrebno daljnje liječenje, nego se bolesnike nastavlja pratiti u vremenskim intervalima od jedne godine. Ako su prisutni simptomi srčanoga popuštanja ili anginozne smetnje, započinje se medikamentnom terapijom koju u prvom redu čine beta blokatori sami ili kombinirani s blokatorima kalcijskih kanala i/ili dizopiramidom. Ako bolesnici i dalje imaju simptome, indicirano je invazivno liječenje. Ako se radi o kandidatima za operativno liječenje, pristupa se septalnoj miektomiji, a ako ne, preporuča se alkoholna septalna ablacija. Ako je kod bolesnika kontraindicirana i alkoholna septalna ablacija, može se razmotriti ugradnja dvokomornoga elektrostimulatora srca.
Prognoza. Kod većine je bolesnika HKM sporoprogresivna bolest i bolesnici dugo mogu živjeti bez značajnijih ograničenja. Rizični čimbenici koji predisponiraju iznenadnu srčanu smrt su masivna HLV (> 30 mm), pozitivna obiteljska anamneza na iznenadnu srčanu smrt u dobi ispod 50 godina, nalaz ventrikularnih poremećaja ritma u Holter-EKG-u, ranije neobjašnjene i učestale sinkope te abnormalni pad krvnoga tlaka u opterećenju. Godišnja stopa smrtnosti ovih bolesnika iznosi oko 1 %.
RESTRIKCIJSKA KARDIOMIOPATIJA
Definicija i epidemiologija. Restrikcijska kardiomiopatija (RKM) vrsta je kardiomiopatije koju karakterizira krutost i neelastičnost stijenki ventrikula što rezultira poremećajem dijastoličke funkcije uz urednu ili blago narušenu sistoličku funkciju. Radi se o najrjeđem obliku kardiomiopatije koja podjednako zahvaća oba spola te se obično klinički manifestira već u adolescenciji ili mlađoj odrasloj dobi.
Etiopatogeneza. Prema etiologiji, RKM može biti primarna i sekundarna. Primarna restrikcijska kardiomiopatija je nepoznatoga i nejasnog uzroka, a vjeruje se da se radi o genetskom poremećaju, s obzirom na pozitivnu obiteljsku anamnezu na slične poremećaje kod većine oboljelih. Dosadašnja istraživanja pokazala su najveću povezanost između mutacija gena za troponin I (TNNI3) i teški lanac β-miozina (MYH7) s pojavnošću primarne RKM. Sekundarna restrikcijska kardiomiopatija može nastati kao posljedica različitih neinfiltrativnih i infiltrativnih sistemskih bolesti koje pored ostalih tkiva zahvaćaju i miokard, što rezultira njegovim strukturnim i morfološkim promjenama koje uvjetuju gubitak elasticiteta i razvoj krutosti. U kliničkoj su praksi najčešći uzroci takvoga stanja amiloidoza, sarkoidoza, hemokromatoza, Lofflerov sindrom (hipereozinofilni sindrom) te endomiokardna fibroza.
Patofiziologija. Osnovno patološko obilježje RKM-a predstavlja narušena dijastolička funkcija srca (otežano punjenje ventrikula tijekom dijastole). Posljedično promjenama na stijenci ventrikula (krutost, neelastičnost) dolazi do otežane i produljene relaksacije koja dovodi do porasta tlaka punjenja i otežanoga pražnjenja atrija, zbog čega se oni kompenzatorno dilatiraju. Povišen dijastolički tlak lijevoga ventrikula retrogradno se može prenijeti i na plućnu cirkulaciju dovodeći do plućne kongestije. Sistolička funkcija ovih bolesnika je očuvana ili neznatno narušena.
Patologija. Glavna makromorfološka obilježja RKM-a uključuju dilataciju lijevoga i desnog atrija uz istodobno smanjenje volumena oba ventrikula. Histološki nalaz ponajprije ovisi o etiologiji: u primarnoj RKM obično nalazimo multipla žarišta intersticijske fibroze difuzno po miokardu lijevoga i desnog ventrikula; u sarkoidozi nalazimo brojne nekazeozne granulome; u hemokromatozi stanice su ispunjene pigmentom hemosiderinom.
Klinička slika je nespecifična, često podložna osnovnoj bolesti i ovisna o njoj. Posljedično razvoju RKM-a bolesnici razvijaju sliku srčanoga popuštanja (dispneja, ortopneja, nepodnošenje napora, periferni edemi, hepatomegalija), kao i česte napade supraventrikularnih i ventrikularnih poremećaja srčanoga ritma (palpitacije, omaglice, sinkope) ili poremećaje atrioventrikularnoga provođenja (simptomatske bradiaritmije). Iznenadna srčana smrt kao posljedica ove kardiopatije rijetko se događa. Pri kliničkom pregledu mogu se otkriti tipični znaci srčanoga popuštanja: proširene jugularne vene s dijastoličkim kolapsom (Friedreichov znak) ili proširenjem tijekom inspirija (Kussmaulov znak), a auskultacijski nalaz na plućima može upućivati na kongestiju (vlažne krepitacije i hropci).
Dijagnoza se postavlja na temelju kliničke slike, EKG-a, slikovnih dijagnostičkih metoda te u nejasnim slučajevima kateterizacijom i biopsijom endomiokarda.
EKG. Najčešće patološke promjene kod ovih bolesnika su pojava patoloških P-valova (P-pulmonale, P-mitrale) koji nastaju kao odraz biatrijske dilatacije uz nespecifične promjene ST-segmenta i T-vala, što je najizraženije u inferolateralnim odvodima. Često je prisutna difuzna mikrovoltaža (smanjena amplituda QRS-kompleksa).
Slikovne dijagnostičke metode. Rendgenogram srca i pluća ne pokazuje specifične promjene, srce je često uredne veličine ili pokazuje znakove umjerene kardiomegalije na račun dilatiranih atrija uz znakove plućne kongestije u kasnijim fazama (vaskularni hilusi, kranijalna redistribucija). Ehokardiografija je ključna metoda koja, osim uvida u morfologiju, omogućava i funkcionalnu procjenu srčane funkcije. Najčešći ehokardiografski nalaz ovih bolesnika pokazuje dilataciju oba atrija, smanjene volumene oba ventrikula uz relativno hipertrofirani miokard te urednu sistoličku (ili umjereno premećenu) i narušenu dijastoličku funkciju. Magnetna rezonanca srca omogućava detaljniju analizu morfologije miokarda te ima značajnu ulogu u otkrivanju etiologije. Ova se pretraga preporuča kod svih bolesnika sa sumnjom na RKM.
Invazivna dijagnostika uključuje kateterizaciju srca i endomiokardnu biopsiju, što se radi u nejasnim slučajevima. Osim toga, kateterizacija omogućava mjerenje intrakardijalnih tlakova što omogućava razlikovanje RKM-a od drugih sličnih patoloških stanja, kao što je kronični konstrikcijski perikarditis. Za razliku od kroničnoga konstrikcijskog perikarditisa, dijastolički tlak u lijevom ventrikulu uslijed RKM-a svega je nekoliko mmHg veći od tlaka u desnom ventrikulu.
Liječenje. Specifično liječenje RKM-a ne postoji. Ako je poznat uzrok, treba ga liječiti. U pogledu olakšanja simptoma kod ovih je bolesnika indicirana primjena niskih doza diuretika, a primjenjuju se i beta blokatori i inhibitori sustava renin-angiotenzin, iako njihova učinkovitost kod ovih bolesnika nije do kraja istražena. Većina bolesnika, osobito onih s primarnom RKM razviju srčano popuštanje koje će zahtijevati transplantaciju srca.
Prognoza. Prirodni tijek bolesti kod većine je bolesnika spor i protrahiran. Većina bolesnika preživi i više od deset godina od postavljanja dijagnoze, osim u slučaju nekih posebnih oblika poput amiloidoze koja ima brzopogresivni tijek, kada se bolesnike podvrgava transplantaciji srca ili brzo umiru.
ARITMOGENA DISPLAZIJA DESNOGA VENTRIKULA
Definicija i epidemiologija. Aritmogena displazija desnoga ventrikula (ARVC, od engl. arrhythmogenic right ventricular cardiomyopathy) predstavlja autosomno-dominantni nasljedni poremećaj kojega karakterizira gubitak kardiomiocita, poglavito desnoga ventrikula, uz zamjenu fibroznim ili fibrozno-masnim tkivom, što je klinički obilježeno srčanim popuštanjem te povećanim rizikom od nastanka ventrikularnih artimija i iznenadne srčane smrti. Prevalencija ove bolesti u odrasloj populaciji varira u rasponu od 1:1000 do 1:5000. S obzirom na to da je pojava ventrikularnih aritmija obično povezana s tjelesnim naporom, ova se nasljedna kardiomiopatija smatra jednim od češćih uzroka iznenadne srčane smrti u sportaša. Muškarci dva do tri puta češće obolijevaju od ove kardiomiopatije.
Etiologija. Aritmogena displazija desnoga ventrikula nastaje uslijed mutacije gena koji su odgovorni za stvaranje strukturnih i funkcionalnih komponenata (proteina) dezmosoma, posebne vrste međustaničnih spojeva između kardiomiocita. Pojedini dezmosomski proteini mogu djelovati i kao signalne molekule koje mogu utjecati na različite signalne puteve i mijenjati gensku ekspresiju kardiomiocita te tako promovirati apoptozu i posredovati izražavanje fibrogenoga i/ili adipogenog fenotipa, što se događa u ovoj nasljednoj kardiomiopatiji. Najčešće se radi o genima za plakofilin 2 (PKP2), dezmoglein 2 (DSG2), dezmoplakin (DSP), dezmokolin 2 (DSC) te spojni plakoglobin (JUP). Put nasljeđivanja dominantno je autosomno-dominantni, ali postoje i rijetke iznimke koje se nasljeđuju autosomno-recesivnim putem, a to su Naxosova bolest koja nastaje uslijed mutacije gena za spojni plakoglobin, te Carvajalov sindrom koji nastaje uslijed mutacije gena za dezmoplakin. Osim opisanim promjenama na desnom ventrikulu, oba su entiteta obilježena i palmoplantarnom keratodermijom.
Patogeneza. Posljedično navedenim mutacijama dolazi do poremećaja genske ekspresije kardiomiocita desnoga ventrikula, iako se slične promjene mogu naći i u području intraventrikularnoga septuma i lijevoga ventrikula, ali su značajno slabije izražene. To uvjetuje progresivan gubitak miokarda desnoga ventrikula koji se zamjenjuje vezivnim ili vezivno-masnim tkivom. U ranim počecima bolesti ove su promjene lokaliziranoga karaktera, a na tim mjestima moguć je razvoj aneurizmatskih proširenja, dok se s razvojem bolesti cijeli miokard desnoga ventrikula dilatira i stanjuje (poput vreće). Tako izmijenjen miokard izvor je nastanka mogućih ventrikularnih poremećaja srčanoga ritma koji mogu postati uzrok iznenadne srčane smrti, osobito za vrijeme izraženoga fizičkog opterećenja (sportaši, teški fizički radnici).
Klinička slika. Bolest karakterizira sporo-progresivan tijek i ona najčešće postaje klinički manifestna u srednjoj životnoj dobi (najčešće u tridesetim godinama), a do tada je asimptomatska. Kliničke manifestacije uključuju pojavu simptoma i znakova srčanoga popuštanja te paroksizama ventrikularnih poremećaja ritma (palpitacije, presinkopa, sinkopa). Karakteristično, navedeni simptomi i znakovi izraženiji su tijekom i neposredno nakon napora (osobito simptomi poremećaja srčanoga ritma). Kod velikoga broja oboljelih prvi i jedni znak bolesti može biti iznenadna srčana smrt. Kod više od 50 % bolesnika fizikalni nalaz je uredan, dok se kod druge polovice može zabilježiti pocijepan drugi srčani ton, a nekada i šum trikuspidalne regurgitacije. Kod bolesnika koji ne umru od malignih poremećaja srčanoga ritma razvija se refraktorno obostrano srčano popuštanje koje će zahtijevati transplantaciju srca.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, kliničke slike, EKG-a, ehokardiografije te magnetne rezonance srca. Radi se i genetska (molekularna) dijagnostika kojom se potvrđuje prisutnost mutacije.
Anamnestički podatak o iznenadnoj i ranoj smrti bliskih srodnika (smrt prije pedesete godine života) ima visok dijagnostički značaj, budući da više od 30 % oboljelih ima bliskoga srodnika s istom bolesti, osobito to vrijedi za mlađe muškarce koji se žale na palpitacije, presinkope i sinkope.
EKG ovih bolesnika početno može biti uredan, no s razvojem bolesti pojavljuju se i znakovi koji upućuju na ovo oboljenje, a to su kompletan ili nekompletan blok desne grane s negativnim T-valovima u desnim prekordijalnim odvodima (V1-V3). Karakterističan je i nalaz tzv. epsilon-vala koji predstavlja mali pozitivan otklon na samom kraju QRS-kompleksa. Česta je i pojava ventrikularnih ekstrasistola te postojane ili nepostojane monomorfne ventrikularne tahikardije, što je vidljivo na Holter-EKG-u, osobito za vrijeme fizičke aktivnosti. Kod bolesnika s urednim EKG nalazom potrebno je obaviti i ergometriju.
Slikovne metode. Neophodnu pretragu kod ovih bolesnika predstavlja ehokardiografija kojom se analizira morfologija desnoga ventrikula (stanjeni zid, dilatacija, ispad kontraktilnsti, aneurizmatska proširenja), ali je kod svake sumnje na aritmogenu displaziju desnoga ventrikula indicirana i magnetna rezonanca srca koja omogućava detaljniju analizu miokarda s procjenom udjela masnoga i fibroznog tkiva.
Pri dijagnostici aritmogene displazije desnoga ventrikula koriste se tzv. TFC kriteriji (engl. task force criteria), koje je donijelo Europsko kardiološko društvo 2010. godine, a temelje se na velikim i malim kriterijima podijeljenim u nekoliko kategorija: 1) globalna ili regionalna disfunkcija ili poremećaj strukture (ehokardiografski nalaz, nalaz magnetne rezonance); 2) histološke promjene stijenke ventrikula (udio ostatnih stanica miokarda u odnosu prema vezivnom i masnom tkivu); 3) EKG abnormalnosti repolarizacije; 4) EKG abnormalnosti depolarizacije; 5) prisutnost ventrikularnih aritmija te 6) obiteljska anamneza.
Diferencijalna dijagnoza obuhvaća druge nasljedne oblike kardiomiopatija, sindrom dugoga QT-intervala, Brugada sindrom, katekolaminergičnu polimorfnu ventrikularnu tahikardiju, miokarditis, sarkoidozu te druge oblike restriktivnih kardiomiopatija.
Liječenje bolesnika s minimalnim morfološkim promjenama uz odsutnost životno ugrožavajućih aritmija može se provoditi medikamentno i uključuje primjenu beta blokatora, amiodarona ili sotalola. Kod bolesnika sa simptomatskim ventrikularnim tahiaritmijama indicira se ugradnja ICD-a u svrhu primarne prevencije iznenadne srčane smrti. U obzir dolazi i kateterska ablacija, osobito kod bolesnika s recidivima ventrikularnih tahiaritmija unatoč optimalnoj medikamentnoj. Primjena lijekova koji utječu na renin-angiotenzin-aldosteron sustav opravdana je kod bolesnika s dokazanom sistoličkom srčanom disfunkcijom. Kod bolesnika u uznapredovaloj fazi bolesti indicirana je transplantacija srca. Također, svim bolesnicima preporuča se izbjegavanje teških fizičkih aktivnosti i aktivno bavljenje sportom.
Prognoza. Prediktori loših kliničkih ishoda kod ovih bolesnika su rana klinička manifestacija bolesti, teška fizička aktivnost bolesnika, teška dilatacija desnoga ventrikula, zahvaćanje lijevoga ventrikula te učestale ventrikularne tahiaritmije.
NEKLASIFICIRANI I SPECIFIČNI OBLICI KARDIOMIOPATIJA
U nastavku će biti opisani najznačajniji neklasificirani i specifični oblici kardiomiopatija kao što su alkoholna kardiomiopatija, peripartalna kardiomiopatija, stresna kardiomiopatija (Takotsubo kardiomiopatija), nekompaktna kardiomiopatija lijevoga ventrikula (spužvasta kardiomiopatija) te kardiomiopatija uzrokovana tahiaritmijom.
ALKOHOLNA KARDIOMIOPATIJA
Alkoholna kardiomiopatija oblik je stečene (sekundarne) DKM koja je posljedica dugotrajnoga uživanja alkoholnih pića, čija je pojavnost izravno povezana s količinom i duljinom konzumacije alkohola. Pojavnost je veća što je dulje vrijeme i veća količina konzumiranoga alkohola. Žene su osjetljivije u pogledu razvoja alkoholne kardiomiopatije u odnosu na muškarce. Iako patogeneza ove vrste kardiomiopatije nije u potpunosti razjašnjena, smatra se da ona nastaje kao posljedica bilo izravnoga ili neizravnoga (putem metabolita) utjecaja etanola na miokard. To podrazumijeva razvoj oksidativnoga stresa, poremećaj mitohondrijske funkcije i metabolizma masnih kiselina, što sve vodi u nekrozu ili apoptozu miocita. Simptomi i znakovi alkoholne kardiomiopatije jednaki su kao i kod drugih oblika DKM-a s naglaskom eventualnoga postojanja kliničkih stigmi kroničnoga alkoholizma, kao što su palmarni eritem, spider nevusi, teleangiektazije i drugi. Dijagnoza se postavlja na temelju ehokardiografskih znakova DKM-a (dilatacija i narušena sistolička funkcija lijevoga ventrikula) uz anamnezu kroničnoga alkoholizma i isključene druge moguće uzroke (arterijska hipertenzija, koronarna bolest, valvularna bolest). U prilog ovoj dijagnozi idu i specifični laboratorijski nalazi kao što su trombocitopenija, megaloblastična anemija, povišenje jetrenih enzima, osobito gamaglutamil transferaze (GGT) te jetrenih transaminaza s karakterističnim omjerom (AST > ALT). S obzirom na to da je alkoholna kardiomiopatija potencijalno reverzibilna, naglasak u liječenju ovih bolesnika je na apsolutnoj i trajnoj apstinenciji od konzumiranja alkoholnih pića. Ostale mjere liječenja jednake su kao i kod ostalih oblika DKM-a, s naglaskom na suplementaciji vitamina B skupine čiji se deficit javlja kod ove skupine bolesnika i može pridonijeti razvoju i pogoršanju bolesti.
PERIPARTALNA KARDIOMIOPATIJA
Peripartalna kardiomiopatija naziv je za sekundarnu kardiomiopatiju koju karakteriziraju sljedeće kliničke značajke: 1) razvoj simptoma i znakova srčanoga popuštanja u zadnjem mjesecu trudnoće ili unutar pet mjeseci nakon poroda; 2) ehokardiografski dokazana sistolička disfunkcija s istisnom frakcijom manjom od 45 %, s ili bez nalaza dilatacije lijevoga ventrikula te 3) odsutnost drugoga poznatog, potencijalnog uzroka srčanoga popuštanja (preegzistirajuća bolest srca). Učestalost ove kardiomiopatije kreće se između 1/4000 do 1/15 000 poroda, a rizični čimbenici su višeplodna trudnoća, starija životna dob rodilje, pothranjenost, produljena tokoliza te arterijska hipertenzija i preeklampsija. Točan etiopatogenetski mehanizam nastanaka ove kardiomiopatije nije poznat, ali vjeruje se da se radi o imunološki posredovanoj bolesti s obzirom na nalaz izražene limfocitne infiltracije miokarda u većini slučajeva. Sve više se govori i o ulozi oksidativnoga stresa koji dovodi do aktivacije katepsina D, lizosomalnoga enzima koji djeluje na prolaktin pretvarajući ga u podjedinicu koja ima snažan proupalni, antiangiogeni i proapoptotični učinak čime podržava upalu endotela te poremećen metabolizam i funkciju kardiomiocita. Bolest se klinički očituje uobičajenim simptomima i znakovima srčanoga popuštanja. Dijagnoza se postavlja na temelju kliničke slike i nalaza, a potvrđuje ehokardiografijom. Pri postavljanju dijagnoze bitan je podatak o eventualnim ranijim bolestima srca, bilo da su dokazane ili da se na njih sumnja. Osnovu terapije čine diuretici i ACE inhibitori (ili blokatori angiotenzinskih receptora), a brojne studije pokazale su i koristan učinak primjene bromokripitina (dvaput 2,5 mg tbl kroz dva tjedna, potom 1 x 2,5 mg tbl kroz još šest tjedana), s obzirom na njegov suprimirajući učinak na prolaktin. Kod više od 50 % žena primjećuje se povlačenje simptoma i oporavak srčane funkcije kroz šest mjeseci, oko 10 % trudnica doživljava iznenadnu srčanu smrt, a oko 5 % razvije bolest koja će zahtijevati transplantaciju.
STRESNA KARDIOMIOPATIJA (TAKOTSUBO KARDIOMIOPATIJA)
Takotsubo kardiomiopatija ili kardiomiopatija uzrokovana stresom predstavlja stečen oblik kardiomiopatije koja se očituje kao prolazna apikalna disfunkcija lijeve klijetke karakterizirana akinezom i specifičnim aneurizmatskim proširenjem nalik na japansku napravu za hvatanje hobotnice, po čemu je i dobila ime, a klinički i elektrokardiografski nalikuje na akutni infarkt miokarda. Točna učestalost ove kardiomiopatije je nepoznata, ali prema nekim podacima 1,5 do 2,5 % hospitaliziranih bolesnika s dijagnozom akutnoga koronarnog sindroma zadovoljava kriterije za postavljanje dijagnoze Takotsubo kardiomiopatije. Bolest se znatno češće javlja kod žena (omjer 9:1) i to u starijoj životnoj dobi. Kod većine bolesnika razvoju ovoga sindroma prethodni snažan emocionalni ili fizički stres. Točan patogenetski mehanizam ovoga poremećaja nije poznat, ali spominju se produljeni spazam koronarnih arterija i hiperadrenergički sindrom. Vodeći simptom je bol u prsima, a bolesnici mogu imati i dispneju te sinkope. U početku bolesnici mogu biti izrazito hemodinamski nestabilni, što se popravlja kroz nekoliko dana. EKG nalaz ovih bolesnika najčešće pokazuje elevaciju ST-segmenta u prekordijalnim odvodima što uz opisanu kliničku sliku zahtijeva hitnu koronarografiju pri čemu se prepoznaju uredne epikardne krvne žile. ST-elevacija je obično kratkoga trajanja i već se kroz nekoliko sati vraća u izolektričnu liniju, ali zajedno s time dolazi do negativizacije T-vala što je najizraženije trećega dana bolesti. Karakteristično baloniranje lijevoga ventrikula obično se vidi već tijekom koronarografije kada se istodobno obavi i ventrikulografija, a potvrđuje se ehokadiografijom. Liječenje je simptomatsko, a osobito je važna hemodinamska stabilizacija kroz prvih nekoliko dana, nakon čega se prati postupan oporavak. Neki autori zagovaraju primjenu intraaortne balonske pumpe u postupku hemodinamske stabilizacije u odnosu na inotrope i vazopresore, s obzirom na to da se kao mogući uzroci ovoga stanja spominju katekolamini (noradrenalin, dopamin). U liječenju se primjenjuju i drugi standardni lijekovi kao što su beta blokatori te ACE inhibitori. U načelu je prognoza ovih bolesnika dobra, a smrtni ishodi su rijetki (< 1 %).
NEKOMPAKTNA KARDIOMIOPATIJA LIJEVOGA VENTRIKULA
Nekompaktna kardiomiopatija lijevoga ventrikula predstavlja rijedak oblik kardiomiopatije koju karakteriziraju morfološke promjene lijevoga ventrikula u smislu izostanka remodeliranja trabekula u kompaktni sloj miokarda tijekom embriogeneze zbog čega on poprima spužvasti izgled pa se ova kardiomiopatija naziva još i spužvasta kardiomiopatija. Pretpostavljena učestalost ovoga poremećaja kreće se od 0.014 do 0,25 %. Može se razviti kao izolirana bolest ili se može naći zajedno s nekim drugim kongenitalnim srčanim bolestima (septalni defekti, koarktacija aorte, stenoza zalistaka plućne arterije). Radi se o heterogenoj genetskoj osnovi bolesti, a kao najčešći gen odgovoran za njezin nastanak navodi se TAZ gen koji se nalazi na 28. kromosomu, kao i već spominjani gen za teški lanac β-miozina (MYH7), troponin T (TNNT2) i dr. Ovako promijenjen lijevi ventrikul dovodi do kombinirane sistoličko-dijastoličke disfunkcije, a predstavlja i izražen aritmogeni potencijal. Klinički se bolest može pojaviti u djetinjstvu i u kasnijoj, odrasloj dobi. Temeljno kliničko očitovanje je sindrom srčanoga popuštanja i pojava tahiaritmija, a povećan je rizik i od nastanka intramuralnih tromba i sistemskih embolizacija. Osnovni ehokardiografski nalazi koji upućuju na spužvastu kardiomipatiju su: 1) segmentalna, dvoslojna struktura hipertrofičnoga miokarda s omjerom nekompaktnoga i kompaktnog sloja > 2; 2) prikaz protoka kroz nekompaktni miokard ili intertrabekularne recesuse koji komuniciraju s lijevim ventrikulom (obojeni dopler) te 3) karakteristična lokalizacija opisanih promjena u srednjim i apikalnim segmentima inferiorne i lateralne srčane stijenke. Preporuča se magnetna rezonanca srca kod svih bolesnika jer omogućava jasnije razlikovanje ove bolesti od drugih patoloških promjena. Liječenje je nespecifično te podrazumijeva sve farmakološke i nefarmakološke mjere liječenja srčanoga popuštanja.
KARDIOMIOPATIJA UZROKOVANA TAHIARITMIJOM
Prolongirana supraventikularna ili ventrikularna tahiaritmija može dovesti do akutne dilatacije ventrikula i pogoršanja sistoličke funkcije, što nazivamo tahikardiomiopatijom. Usporavanje i/ili konverzija u sinusni ritam osnovni je terapijski postupak kod ovih bolesnika i obično dovodi i do brzoga oporavka srčane funkcije.
Aortni zalistak nalazimo između lijevoga ventrikula i aorte neposredno ispod Valsalvinih sinusa. Njegova je funkcija da spriječi povrat krvi iz aorte nazad u lijevi ventrikul za vrijeme dijastole. Sastoji se od tri kuspisa ili listića (nekoronarni kuspis te desni i lijevi koronarni kuspis) koji su građeni od tri sloja (lamina ventricularis, lamina spongiosa, lamina fibrosa) pretežno od kolagenih vlakana tipa I i III te nešto manje zastupljenih elastinskih vlakana i međustanične tvari. Glavne bolesti aortnoga zaliska su aortna stenoza te aortna regurgitacija.
AORTNA STENOZA
Definicija i epidemiologija. Aortna stenoza (AS) predstavlja bolest aortnoga zaliska u kojoj je njegova površina sužena te se ne može u potpunosti otvoriti, što dovodi do sistoličkoga opterećenja lijevoga ventrikula i njegove posljedične koncentrične hipertrofije. Radi se o jednoj od najčešćih bolesti srčanih zalistaka s velikim kliničkim značajem, osobito kod osoba starije životne dobi. Epidemiologija AS-a usko je povezana sa zemljopisnim odrednicama i etiologijom. U razvijenim zapadnim zemljama kod osoba starijih od 65 godina prevalencija aortne stenoze iznosi 2 do 7 %, a najčešće je uzrokovana degerativnim promjenama aortnog zaliska, dok je njezina pojavnost u mlađoj životnoj dobi daleko rjeđa i obično je povezana s kongenitalnim anomalijama, kao što je bikuspisni aortni zalistak. U nerazvijenim zemljama s većom učestalošću akutne reumatske vrućice njezine sekvele predstavljaju čest uzrok AS-a, posebno kod osoba mlađe životne dobi. Aortnu stenozu karakterizira i veći klinički značaj u odnosu na ostale bolesti srčanih zalistaka. Iako je prevalencija mitralne insuficijencije znatno veća od aortne stenoze, daleko je veći postotak osoba koje se podvrgavaju kardiokirurškom liječenju zbog aortne stenoze nego zbog mitralne insuficijencije.
Etiopatogeneza. Najčešći uzroci AS-a su kalcificirajuća i bikuspisna bolest aortnoga zaliska te kronična reumatska bolest srca.
Kalcificirajuća bolest aortnoga zaliska predstavlja kroničnu, degenerativnu bolest aortnoga zaliska čija prevalencija raste proporcionalno sa životnom dobi. Klinički najčešće postaje manifestna u dobi između šestoga i osmog desetljeća života. Radi se o kroničnom upalnom procesu koji po mnogočemu nalikuje na aterosklerozu, čije početne promjene uključuju zadebljanje subendotelnoga prostora koji je infiltriran brojnim makrofazima i T-limfocitima, što dovodi do stvaranja plakova krcatih lipoproteinima. S vremenom dolazi do fibroze i kalcificiranja čime se povećava krutost i smanjuje elastičnost kuspisa dovodeći do njihova suženja i otežanoga protoka krvi. Rizični čimbenici za pojavnost kalcificirajuće bolesti aortnoga zaliska istovjetni su onima za pojavu ateroskleroze (starija dob, muški spol, genetska predispozicija, hiperlipidemija, arterijska hipertenzija i dr.). Novija istraživanja ukazuju ne samo na kalcifikaciju kao osnovni poremećaj aortnoga zaliska u ovoj skupini bolesnika, već se sve više govori o formiranju pravoga koštanog tkiva.
Bikuspisna bolest aortnoga zaliska predstavlja kongenitalnu anomaliju pri kojoj je aortni zalistak građen od dva kuspisa, a pojavljuje se u oko 1 % populacije s nešto višom učestalošću kod muškaraca. Takvi bolesnici pokazuju veći rizik od nastanka simptomatske AS (ali i regurgitacije) u mlađoj životnoj dobi. Patofiziološki mehanizam nastanka AS-a povezuje se s povećanim mehaničkim stresom kuspisa koji nastaje uslijed turbulentnoga prolaska krvi kroz ovako izmijenjen aortni zalistak što uvjetuje početno oštećenje i potiče razvoj upalnoga procesa. Osim toga, ovi bolesnici češće imaju veće dimenzije na razini Valsalvinih sinusa i ascedentne aorte te povećan rizik od nastanka aneurizme i disekcije. Klinički se bolest obično pojavljuje nakon trećega desetljeća života.
Kronična reumatska bolest srca danas je rijetki uzrok AS-a u razvijenim zemljama posljedično odgovarajućoj primarnoj prevenciji. Stenoza aortnoga zaliska kod ovih bolesnika nastaje kao posljedica ožiljkavanja zalistaka koje prati akutnu upalu, pri čemu dolazi do međusobnoga urastanja, tj. fuzije distalnih rubova kuspisa, što izaziva stenozu i otežan protok krvi kroz zalistak. 30 do 40 % ovih bolesnika istodobno ima i bolest mitralnoga zaliska.
Ostale bolesti i stanja koja se povezuju s nastankom AS-a su metaboličke bolesti (Pagetova bolest), autoimune bolesti (sistemski eritematozni lupus), kronična bolest bubrega, unikuspidalni aortni zalistak.
Patofiziologija. Osnovni patofiziološki poremećaj u AS-u je sistoličko opterećenje lijevoga ventrikula koje nastaje kao posljedica suženja i nedovoljno otvorenoga aortnog ušća. Otežano i nepotpuno pražnjenje dovodi do porasta tlaka u lijevom ventrikulu što izaziva kompenzacijsku koncentričnu hipertrofiju koja osigurava snažniju kontrakciju i nadvladavanje nastaloga otpora. Ipak, s dužim vremenskim periodom koji je praćen progresijom AS-a i hipertrofijom lijevoga ventrikula dolazi do razvoja dijastoličke i sistoličke disfunkcije te klinički manifestne bolesti. Osim toga, izražena hipertrofija miokarda dovodi i do razvoja ishemije i pojave anginoznih smetnji.
Hemodinamski poremećaj protoka krvi kroz aortni zalistak. Normalna površina aortnoga zaliska iznosi 3 do 4 cm2, a hemodinamski značajna AS nastaje kada se ta površina smanji na ispod jedne trećine. Nastala stenoza uvjetuje razvoj tlačnoga gradijenta između lijevoga ventrikula i aorte koji dovodi do poremećaja brzine protoka krvi kroz njega. Što je površina manja, to je tlačni gradijent veći, kao i brzine protoka krvi kroz zalistak. Kada je, na primjer, površina aortnoga zaliska između 1,3 i 2,5 cm2, tlačni gradijent iznosi 10 do 15 mmHg, dok se kod površine od 1 cm2 povisuje na 50 mmHg, a kod 0,5 cm2 na 100 mmHg.
Dijastolička disfunkcija nastaje kao posljedica hipertrofije miokarda i dovodi do usporene i smanjene relaksacije stijenke lijevoga ventrikula što povećava tlak u lijevom ventrikulu tijekom dijastole. Povišen dijastolički tlak lijevoga ventrikula otežava njegovo punjenje krvlju iz atrija za vrijeme dijastole, što je u prvom redu posljedica razlike u tlakovima između atrija i ventrikula (tlak u atriju mora biti viši od onoga u ventrikulu), zbog čega do izražaja dolazi doprinos atrijske kontrakcije na kraju dijastole koja osigurava nadvladavanje povišenoga tlaka u lijevom ventrikulu i njegovo odgovarajuće punjenje. Razvoj fibrilacije atrija kod ovih bolesnika koja je praćena gubitkom atrijske kontrakcije povezan je s naglim pogoršanjem kliničke slike i nastankom plućne kongestije.
Sistolička disfunkcija kod ovih bolesnika također pridonosi razvoju klinički manifestne bolesti. Očituje se smanjenom kontraktilnom snagom koja nastaje uslijed brojnih patofizioloških mehanizama koji uključuju poremećaj prometa kalcija u uvjetima hipertrofiranih kardiomicita, mikrotubularnu hiperpolimerizaciju te razvoj ishemije. Sistolička disfunkcija očituje se smanjenom istisnom frakcijom lijevoga ventrikula. Karakteristično, sistolička disfunkcija jače je izražena kod muškaraca nego kod žena.
Ishemija miokarda redovna je pojava kod bolesnika s teškom AS i izraženom hipertrofijom lijevoga ventrikula, čak i u odsustvu koronarne bolesti. Ona se objašnjava pojačanom potrebom hipertrofiranoga miokarda za krvlju i kisikom. S povećanjem mase miokarda dolazi do nesrazmjera između količine miokarda i veličine koronarne krvne mreže budući da je njezino širenje ograničene prirode te ona postaje insuficijentna u osiguranju odgovarajućega dotoka krvi i kisika. Osim toga, ovi bolesnici često imaju aterosklerotske promjene na koronarnim krvnim žilama, tj. koronarnu bolest, što dodatno pogoršava ishemiju.
Stupnjevanje aortne stenoze. Na temelju osnovnih ehokardiografskih mjerenja koja uključuju određivanje površine aortnoga zaliska, srednjega tlačnog gradijenta te brzine protoka kroz aortni zalistak, aortnu stenozu dijelimo u tri stupnja: blaga, umjerena i teška AS (Tablica 1.62.). Navedeno stupnjevanje ne pokazuje uvijek jasnu kliničku korelaciju tako da nekada bolesnici s teškom AS nemaju simptome, dok se kod bolesnika s umjerenom AS oni mogu naći. U pravilu, simptomi AS-a nastaju kada je površina aortnoga zaliska manja od 1 cm2 i kada je gradijent tlaka veći od 40 mmHg. Zbog utjecaja površine tijela, mjerenje površine aortnoga zaliska preporuča se izražavati u indeksiranom obliku koji se oslanja na visinu bolesnika i izražava se u cm2/m2.
|
Tablica 1.62. Stupnjevanje aortne stenoze
|
|
Parametar
|
Blaga
|
Umjerena
|
Teška
|
|
Brzina aortnoga mlaza (m/s)
|
2,6 - 2,9
|
3,0 - 3,9
|
> 4
|
|
Srednji gradijent tlaka (mmHg)
|
< 30
|
30 – 50
|
> 50
|
|
Površina aortnoga zaliska (cm2)
|
> 1,5
|
1,0 - 1,5
|
< 1,0
|
|
Indeksirana površina (cm2/m2)
|
> 0,85
|
0,60 - 0,85
|
< 0,60
|
Posebni hemodinamski oblici AS-a su aortna stenoza s niskim gradijentom i niskim protokom (engl. low-flow, low-gradient aortic stenosis) te AS s visokim gradijentom i niskim protokom (engl. low-flow, high-gradient aortic stenosis).
Aortna stenoza s niskim gradijentom i niskim protokom definirana je površinom aortnoga zaliska manjom od 1,0 cm2, brzinom protoka manjom od 4 m/s i tlačnim gradijentom manjim od 40 mmHg. Ovaj oblik AS-a obično se javlja kod bolesnika sa značajnom sistoličkom disfunkcijom s EF < 50 %.
Aortna stenoza s visokim gradijentom i niskim protokom definirana je površinom aortnoga zaliska manjom od 1,0 cm2, brzinom protoka manjom od 4 m/s i tlačnim gradijentom iznad 40 %, što se iznimno rijetko susreće u kliničkoj praksi i to obično kod bolesnika s očuvanom istisnom frakcijom (EF > 50 %) koji imaju izraženu hipertrofiju i smanjen volumen lijevoga ventrikula.
Glavna klinička implikacija ovih oblika AS-a je otežana procjena stupnja bolesti te je, da bi razlikovali tešku i umjerenu aortnu stenozu, kod ovih bolesnika potrebno obaviti dobutaminsku stres-ehokardiografiju. O teškoj AS kod ovih bolesnika govorimo kada u opterećenju površina zaliska ostane manja od 1,0 cm2, a brzina protoka se poveća iznad 4 m/s.
Klinička slika. Aortnu stenozu prati relativno dug asimptomatski period, pa se najčešće dijagnosticira na temelju pregleda slučajno otkrivenoga šuma srca. Tipične manifestacije AS-a uključuju trijas: dispneju, sinkopu i anginozne smetnje. Prelazak AS-a u simptomatsku fazu ujedno predstavlja i loš prognostički znak, budući da većina neliječenih bolesnika nakon pojave simptoma završava smrtnim ishodom kroz 2 do 5 godina.
Dispneja se javlja kao posljedica dijastoličke disfunkcije i prateće plućne kongestije. Najprije se javlja pri tjelesnim naporima, a kasnije može biti prisutna i u mirovanju. Uz dispneju se u uznapredovaloj fazi bolesti razvijaju i drugi karakteristični znakovi srčanoga popuštanja.
Anginozne smetnje (stenokardija) javljaju se kao posljedica ishemije miokrada i istovjetne su onima koje nalazimo pri koronarnoj bolesti.
Sinkopa je kod ovih bolesnika obično povezana s naporom, kao posljedica razvoja hipotenzije uslijed periferne vazodilatacije uvjetovane naporom i nemogućnošću srca da poveća minutni volumen kao odgovor na nastalu hipotenziju. Sinkopa se može javiti i nevezano uz napor što se obično viđa u slučaju pojave težega poremećaja srčanoga ritma koji imaju veću učestalost kod ovih bolesnika.
Fizikalni status. Auskultacijom se kod ovih bolesnika otkriva karakteristični sistolički (ejekcijski) šum aortne stenoze koji je najbolje čujan u drugom interkostalnom prostoru parasternalno desno (auskultacijska lokacija aortnog zaliska) te se širi prema vratu. Jačina šuma ovisi o stupnju opstrukcije - što je aortna stenoza veća, to je i šum glasniji, kada je kontraktilnost miokarda očuvana. Slabljenjem kontraktilne sposobnosti lijevoga ventrikula i padom sistoličke funkcije šum postaje slabiji. Pri palpaciji pulsa, pulsni val je oslabljen i kasni za kontrakcijom lijevoga ventrikula (tzv. pulsus parvus et tardus).
Dijagnoza se postavlja već na temelju fizikalnoga nalaza u kojem je prisutan karakterističan sistolički šum gruboga karaktera i potvrđuje se i kvantificira ehokardiografijom.
EKG obično ukazuje na postojanje hipertrofije lijevoga ventrikula s često prisutnim dubokim, simetričnim negativnim T-valovima u prekordijalnim odvodima.
Rendgenogram srca i pluća u početnim fazama je uredan. Često se vide kalcifikati u području aortnoga ušća. Kod bolesnika s bikuspisnom valvulom često je prisutna naglašena i uvećana ascedentna aorta.
Ehokardiografija je temeljna dijagnostička metoda za postavljanje dijagnoze AS-a (Slika 1.75.). Ona omogućava morfološku analizu aortnoga zaliska i lijevoga ventrikula, analizu hemodinamskih parametara te procjenu sistoličke i dijastoličke funkcije srca. Morfološka analiza aortnoga ušća uključuje određivanje broja kuspisa aortnoga zaliska, uočavanje degenerativnih promjena (zadebljali, kalcificirani, hiperehogeni i slabo pokretni kuspisi), kao i orijentacijsko planimetrijsko mjerenje površine aortnoga zaliska. Često se vidi hipertrofija lijevoga ventrikula. Kvantificiranje, odnosno određivanje stupnja AS-a, provodi se doplerskom tehnikom mjerenjem transaortalne brzine protoka i matematičkom formulom proračuna površine aortnog azaliska, baziranom na Bernoullijevom zakonu.
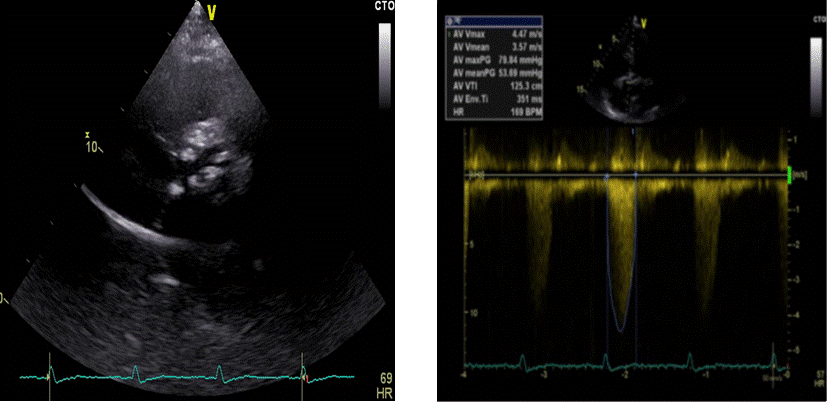
Slika 1.75. Ehokardiografski nalaz teške aortne stenoze
Koronarografija se izvodi kod svih bolesnika koji se pripremaju za operativno liječenje s ciljem evaluacije koronarnih arterija i procjene potrebe za eventualnim istovremenim i aortokoronarnim premoštenjem, odnosno kombiniranim kirurškim zahvatom.
Ostale pretrage. Magnetna rezonanca (MR) i kompjuterizirana tomografija srca (MSCT) nisu dio rutinske dijagnostičke obrade i indicirane su kod bolesnika kod kojih se ehokardiografija ne može izvesti na odgovarajući način, gdje je procjena onemogućena zbog loše ehokardiografske vidljivosti, tzv. lošega ehokardiografskog prozora, te kod bolesnika kod kojih se planira transkateterska intervencija, tzv. TAVI. Ove pretrage omogućavaju dodatne informacije o dimenzijama i geometriji aortnoga korijena, kao i ascedentne aorte, a MSCT ima značajnu ulogu u kvantifikaciji kalcifikacija aortnoga zaliska. Kateterizacija lijevoga srca također nije dio rutinske obrade bolesnika, a indicirana je za bolesnike s nejasnim nalazima neinvazivnih dijagnostičkih pretraga.
Diferencijalna dijagnoza. Aortnu stenozu važno je razlikovati od drugih, sličnih stanja, kao što su supravalvularna ili subvalvularna opstrukcija (najčešće uzrokovana fibroznim opnama kao posljedicom poremećaja u razvoju) te hipertrofijska kardiomiopatija s opstrukcijom izlaznoga trakta lijevoga ventrikula. Kod ovih bolesnika potrebno je isključiti i moguću pridruženu koronarnu bolest s kojom se može značajno preklapati.
Liječenje aortne stenoze uključuje medikamentno liječenje te metode zamjene aortnoga zaliska kardiokirurškim ili transkateterskim putem.
Medikamentno liječenje bolesnika s AS-om nema veći klinički učinak s obzirom na to da do sada nema randomiziranih studija koje potvrđuju da farmakološke terapije mogu utjecati na sam tijek bolesti i usporenje njezine progresije. Medikamentno liječenje opravdano je kod simptomatskih bolesnika, a provodi se prema opisanim načelima liječenja kroničnoga srčanog popuštanja uz sljedeće preporuke: 1) primjena ACE inhibitora (ili antagonista angiotenzinskih receptora) i beta blokatora je opravdana, ali se treba provoditi s nižim dozama i uz povećan oprez; 2) prilikom primjene diuretika i drugih vazodilatatora (nitrati) potreban je poseban oprez s obzirom da mogu dovesti do značajnoga smanjenja venskoga priljeva, a time i minutnoga volumena; 3) liječenje arterijske hipertenzije treba se temeljiti na primjeni blokatora kalcijskih kanala te 4) kod simptomatskih bolesnika sa znakovima srčanoga zatajenja koji nisu kandidati za operativno liječenje uključuju se diuretici.
Zamjena aortnoga zaliska (AVR, od engl. aortic valve replacement) predstavlja neophodnu terapijsku mogućnost u fazi teške AS koja je postala simptomatska, njome se produljuje životni vijek i podiže kvaliteta života. Indikacije za zamjenu aortnoga zaliska opisane su u nastavku teksta. Dvije osnovne metode zamjene aortnoga zaliska su kardiokirurška zamjena (SAVR, od engl. surgical aortic valve replacement) te transkateterska zamjena aortnoga zaliska (TAVR, od engl. transcatheter aortic valve replacement ili TAVI, od engl. transcatheter aortic valve implantation).
Indikacije za zamjenu aortnoga zaliska preporuke klase I (zamjena aortnoga zaliska je apsolutno preporučena u liječenju ovih bolesnika) su:
1) simptomatski bolesnici s teškom AS (gradijent tlaka > 40 mmHg; brzina protoka > 4,0 m/s);
2) simptomatski bolesnici s teškom AS s niskim gradijentnom tlaka (< 40 mmHg) i EF < 50 %;
3) asimptomatski bolesnici s teškom AS i sistoličkom disfunkcijom (EF < 50 %); te
4) bolesnici s teškom AS kod kojih se planira drugi kardiokirurški zahvat (npr. CABG ili operacija ascedentne aorte).
Indikacije za zamjenu aortnoga zaliska preporuke klase IIa (zamjena aortnoga zaliska treba se razmotriti u liječenju ovih bolesnika) su:
1) simptomatski bolesnici s teškom AS i niskim gradijentom tlaka (< 40 mmHg) i EF > 50 %;
2) asimptomatski bolesnici s teškom AS i lošim testom opterećenja (razvoj hipotenzije);
3) bolesnici s umjerenom AS kod kojih se planira drugi kardiokirurški zahvat (npr. CABG ili operacija ascedentne aorte); te
4) asimptomatski bolesnici s normalnom EF, bez abnormalnosti u testovima opterećenja i uz mali operativni rizik ako je zadovoljen jedan od uvjeta: vrlo teška aortna stenoza (brzina protoka > 5,5 m/s), brza progresija bolesti (povećanje brzine protoka više od 0,3 m/s godišnje), značajno povišene vrijednosti NT-proBNP te teška plućna hipertenzija bez drugoga objašnjenja.
Kardiokirurška zamjena aortnoga zaliska (SAVR, od engl. surgical aortic valve replacement) označava operacijski zahvat pri kojemu se vrši zamjena aortne valvule torakotomijskim pristupom, pri čemu se uklanja oboljeli zalistak te se na njegovo mjesto ugrađuje umjetni biološki ili mehanički zalistak. SAVR se preporuča svim bolesnicima s indikacijom za zamjenu aortnoga zaliska koji imaju niski rizik za operacijski tretman (EuroSCORE < 4 %) bez drugih rizičnih čimbenika. Biološki zalisci mogu biti na metalnom prstenu ili bez njega, a podložni su degenerativnim promjenama te imaju vijek trajanja od oko deset godina, ali ne zahtijevaju antikoagulacijsku terapiju, dok su mehanički zalisci dugotrajniji, ali nose rizik od tromboze pa je indicirana doživotna antikoagulacijska terapija. Današnje preporuke Europskoga kardiološkog društva preferiraju mehaničke zaliske kod bolesnika koji su mlađi od 60 godina, a biološke zaliske kod bolesnika starijih od 65 godina, kao i za bolesnike s kontraindiciranom antikoagulacijskom terapijom ili bolesnike kojima se INR ne može održavati u terapijskim granicama zbog konkomitantnih bolesti ili nesuradljivosti bolesnika. Operativni mortalitet pri ovom zahvatu je nizak i čini 2 do 5 %.
Kod bolesnika s istodobnim proširenjem aortnoga korijena i/ili ascedentne aorte (> 4,5 cm) preporuča se istodobno s operacijom zamjene aortnoga zaliska zamijeniti aortni korijen, tzv. Bentallov postupak, aortni zalistak i ascedentna aorta dolaze kao jedan prostetički materijal na koji se ušivaju koronarne arterije ili Wheatov postupak kojim se posebno se zamjenjuje aortni zalistak, a posebno ascedentna aorta, s time da se ostavi nativna aorta između prostetičkih materijala i to u dijelu iz kojega izlaze koronarne arterije.
Bolesnici s mehaničkim umjetnim zaliskom zahtijevaju antikoagulantu terapiju varfarinom uz održavanje INR-a u terapijskim vrijednostima između 2.0 i 3.0. Novije mehaničke proteze, tzv. On-X, omogućavaju niži raspon vrijednosti INR-a od 1.5 do 2.0. Primjena direktnih oralnih antikoagulantnih lijekova (DOAC) u ovoj indikaciji se ne preporučuje. Općenito gledano, tromboza mehaničkoga aortnog zaliska je rjeđa pojava od tromboze mitralnoga zaliska zbog bržih protoka krvi kroz ušće zaliska, ali bez obzira na to, u slučaju potrebe za prekidom peroralne antikoagulacijske terapije bolesnici se prevode na niskomolekularni heparin. Također, primjena antikoagulacijske terapije po istom načelu indicirana je i kod bolesnika nakon ugradnje biološke aortne valvule, ali se ona provodi samo kroz tri mjeseca od ugradnje.
Transkateterska zamjena aortnoga zaliska (TAVR, od engl. transcatheter aortic valve replacement ili TAVI - transcatheter aortic valve implantation) podrazumijeva manje invazivan zahvat pri kojemu se aortni zalistak mijenja posebnom procedurom preko katetera uvedenoga u aortu, najčešće transfemoralnim pristupom. Indiciran je kod bolesnika kod kojih je indicirana zamjena aortnoga zaliska, ali je standardni kardiokirurški zahvat kontraindiciran zbog visokoga operativnog rizika. Nakon ovoga zahvata kod bolesnika je indicirana dvojna antitrombocitna terapija kroz prvih šest mjeseci od ugradnje s klopidogrelom i acetilsalicilnom kiselinom, nakon čega se nastavlja samo s acetilsalicilnom kiselinom.
Balonska valvulopastika indicirana je kod bolesnika sa značajnom hemodinamskom ugroženosti, kao privremena mogućnost (tzv. bridging metoda) do kardiokirurške ili transkateterske zamjene aortnoga zaliska u posebnim situacijama. Također, ona se može razmotriti i kao palijativna metoda za simptomatske bolesnike s teškom AS kod kojih je i kardiokirurška i transkataterska zamjena aortnoga zaliska neizvodiva.
Prognoza bolesnika je ovisna o stupnju AS-a. Kritičan moment koji značajno pogoršava prognozu odnosno smanjuje očekivano trajanje života je pojava kliničkih simptoma. Nakon pojave jednoga simptoma iz karakterističnoga trijasa (dispneja, angina, sinkopa) petogodišnje preživljenje neliječenih bolesnika iznosi 5 do 15 %. Nakon kirurškoga zahvata ono se izjednačava sa zdravom populacijom.
AORTNA REGURGITACIJA (INSUFICIJENCIJA)
Definicija i epidemiologija. Aortna regurgitacija (AR) predstavlja bolest aortnoga zaliska kod koje dolazi do nepotpunoga zatvaranja aortnoga ušća uslijed nepotpune koaptacije kuspisa, što omogućava povrat krvi iz aorte u lijevi ventrikul za vrijeme dijastole i dovodi do njegova volumnog opterećenja. Prema vremenu nastanka i kliničkim manifestacijama razlikujemo akutnu i kroničnu AR. Aortna regurgitacija može se naći kod 30 % opće populacije, ali samo njih 5 do 10 % razvije teški oblik bolesti. Bolest se nešto češće susreće kod muškaraca nego kod žena, a učestalost raste sa životnom dobi i obično se radi o bolesnicima iznad petoga desetljeća života.
Etipatogeneza. Aortna regurgitacija može nastati uslijed patoloških procesa koji zahvaćaju kuspise aortnoga zaliska dovodeći do njihova kvrčenja i skraćivanja na način da oni ne mogu u potpunosti zatvoriti aortno ušće ili može nastati uslijed patoloških procesa koja zahvaćaju aortni korijen pri čemu se on širi tako da se aortno ušće ne može zatvoriti niti u prisutnosti urednih aortnih kuspisa (Tablica 1.63.). Često se radi o bolestima i stanjima koje pogađaju i aortne kuspise i aortni korijen istodobno.
|
Tablica 1.63. Etiologija aortne regurgitacije
|
|
Bolesti koje pogađaju aortne kuspise
|
Bolesti koje pogađaju aortni korijen
|
|
Kongenitalni poremećaji (bikuspisna valvula)
Infektivni endokarditis
Akutna reumatska vrućica i kronična reumatska bolest srca
Miksomatozna degeneracija (prolaps)
Ankilozirajući spondilitis
Sifilitični aortitis
|
Disekcija aorte
Aneurizma ascedentne aorte
Bikuspisna aortna valvula
Marfanov i Ehlers-Danlosov sindrom
Teška arterijska hipertenzija
Aortitis različite etiologje
|
Patofiziologija. U kliničkom i patofiziološkom kontekstu akutna i kronična AR predstavljaju dva različita entiteta s različitom patofiziologijom, kliničkim tijekom i prognozom.
Akutna AR praćena je naglim razvojem, težim kliničkim tijekom i lošijom prognozom zbog nedostatka vremena za razvoj kompenzacijskih mehanizama, odnosno vremena dovoljnoga da se lijevi ventrikul prilagodi nastalom volumnom opterećenju. Akutna AR najčešće nastaje kao posljedica akutnoga infektivnog endokarditisa, akutne reumatske vrućice, disekcije aorte te traume prsnoga koša. Naglo nastali povrat krvi iz aorte u lijevi ventrikul dovodi do progresivnoga porasta tlaka unutar lijevoga ventrikula tijekom dijastole, koji je najviši na njezinom kraju (LVEDP, od engl. left ventricular end-diastolic pressure), a lijevi ventrikul ga ne može kompenzirati povećanjem svoga volumena, odnosno dilatacijom. Nastali porast tlaka unutar lijevoga ventrikula prenosi se na lijevi atrij i plućni krvožilni sustav dovodeći do plućne kongestije i plućnoga edema. Također, udarni volumen srca smanjuje se proporcionalno količini regurgitirane krvi tijekom dijastole, što srce pokušava kompenzirati ubrzanjem frekvencije. Brža frekvencija ima pogodan način da skraćenjem dijastole smanjuje količinu regurgitirajuće krvi u lijevi ventrikul. Razvoj kompenzatorne vazokonstrikcije kao odgovora na nastali smanjeni udarni volumen i hipotenziju (kardiogeni šok) dodatno pogoršava srčanu funkciju povećavajući tlačno opterećenje.
Kronična AR praćena je sporijim razvojem, povoljnijim kliničkim tijekom i boljom prognozom. Uzrokovana je sporoprogresivnim bolestima koje dovode do postupnoga razvoja regurgitacije što omogućava prilagodbu lijevoga ventrikula na nastalo opterećenje. Vraćanje krvi iz aorte u lijevi ventrikul dovodi do povećanja količine krvi, a time i tlaka unutar lijevoga ventrikula, što osobito dolazi do izražaja na samom kraju dijastole. Kako se opisani proces događa kroz dulji vremenski period, lijevi ventrikul prilagođava se postupnom dilatacijom i umjerenom kombiniranom koncentričnom i ekscentričnom hipertrofijom, tako da omogućava održavanje tlakova tijekom dijastole urednim ili blago povišenim, kao i održavanje zadovoljavajućega udarnog volumena kroz dulji vremenski period. Vraćanje krvi iz aorte tijekom dijastole smanjuje punjenje koronarnih arterija, što može voditi u difuznu ishemiju miokarda. Također, dilatacija lijevoga ventrikula dovodi do širenja mitralnoga prstena što može uzrokovati sekundarnu mitralnu regurgitaciju. Kompenzatorni mehanizmi omogućavaju održavanje hemodinamskih prilika urednima kroz neko vrijeme, no s daljnjom progresijom bolesti oni postaju nedostatni, pa dolazi do razvoja klinički manifestnoga srčanog popuštanja.
Klinička slika AR-a razlikuje se kod bolesnika s akutnom od bolesnika s kroničnom prezentacijom bolesti. Fizikalni nalaz temelji se na auskultaciji srca i uočavanju tzv. perifernih znakova AR-a.
Akutna AR praćena je burnom simptomatologijom koja se brzo razvija, a čine je kardiogeni edem pluća (dispneja, hroptanje, kašalj, iskašljavanje pjenušavoga sadržaja), kardiogeni šok (hipotenzija, blijeda koža orošena hladnim znojem, oligurija, poremećaj stanja svijesti) te moguća pojava malignih srčanih aritmija.
Kronična AR ima dug asimptomatski period koji može trajati deset i više godina, a bolest se tada najčešće otkrije dijagnostičkom obradom otkrivenoga novonastalog šuma na srcu. Prvi znakovi bolesti su dispneja pri naporu, ortopneja i paroksizmalna noćna dispneja. Postupno se s progresijom bolesti razvija klasična slika kroničnoga srčanog popuštanja. Anginozne smetnje mogu nastati uslijed opisane ishemije miokarda, a presinkope i sinkope uslijed poremećaja srčanoga ritma.
Temeljni auskultacijski nalaz predstavlja dijastolički visokofrekventni šum koji se najbolje čuje pri sjedećem položaju u kojemu je trup blago nagnut prema naprijed dok bolesnik zadržava dah. Punctum maximum ovoga šuma je u trećem i četvrtom interkostalnom prostoru uz lijevi rub sternuma. Na težinu AR-a ne ukazuje intenzitet šuma, nego njegovo trajanje (što je veći stupanj regurgitacije, šum dulje traje). Kod teške AR moguće je razlikovati i pojavu srednjega i kasnoga dijastoličkog šuma nad apeksom, tzv. Austin-Flintov šum, koji nastaje uslijed prolaska krvi kroz inače normalan mitralni zalistak koji se zbog regurgitacijskoga mlaza i pritiska na prednji mitralni kuspis ne otvara u potpunosti i stvara relativnu stenozu.
Periferni fizikalni znakovi koje nalazimo kod bolesnika s AR-om su različiti: Hillov znak (razlika vrijednosti sistoličkoga brahijalnog i poplitealnoga tlaka viša od 20 mmHg); Mayneov znak (pad dijastoličkoga tlaka za više od 15 mmHg nakon podizanja ruku); Corriganov puls (brzi uspon i brzi pad pulsnoga vala nad karotidama); de Mussetov znak (trzanje glavom sinkrono s pulsacijama srca); Durozierov znak (kombinirani sistoličko-dijastolički šum nad femoralnom arterijom pri postupnoj kompresiji).
Dijagnoza se postavlja na temelju kliničke slike, fizikalnoga pregleda, EKG-a i ehokardiografije, a prema potrebi se izvode i druge dijagnostičke metode.
EKG je sastavni dio kardiološke obrade, ali nije specifičan u postavljanju dijagnoze AR-a. Većina bolesnika ima znakove hipertrofije lijevoga ventrikula sa znacima volumnoga opterećenja s visokim R-zupcima i dubokim T-valovima u lijevim te dubokim S-zupcima u desnim prekordijalnim odvodima.
Ehokardiografija predstavlja glavnu dijagnostičku metodu za dokazivanje AR-a, kojom se može procijeniti morfologiju aortnoga zaliska i promjer aortnoga korijena, utvrditi stupanj težine AR-a te procijeniti veličinu i funkciju lijevoga ventrikula. Procjena težine AR-a vrši se na temelju strukturnih, doplerskih i kvantitativnih parametara, a razlikuju se blaga, umjerena i teška aortna insuficijencija (Tablica 1.64.).
|
Tablica 1.64. Ehokardiografska procjena težine aortne regurgitacije
|
|
Ehokardiografski parametri
|
Blaga
|
Umjerena
|
Teška
|
|
Strukturni parametri
|
|
Veličina lijevoga ventrikula
|
Normalan
|
Normalan/dilatiran
|
Dilatiran
|
|
Morfologija aortnih kuspisa
|
Uredni/patološki
|
Uredni/patološki
|
Patološki
|
|
Doplerski parametri
|
|
Regurgitirajući mlaz – širina (%)
|
< 25
|
25 - 65
|
> 65
|
|
Vena contracta (mm)
|
< 3
|
3 - 6
|
> 6
|
|
Reverzni tok krvi u descedentnoj aorti
|
Bez/rana dijastola
|
Bez/rana dijastola
|
Holodijastolički
|
|
Kvantitativni parametri
|
|
Regurgitirajući volumen (ml/otkucaj)
|
< 30
|
30 - 59
|
> 60
|
|
Regurgitirajuća frakcija (%)
|
< 30
|
30 - 49
|
> 50
|
|
Efektivni regurgitirajući otvor (cm2)
|
< 0,10
|
0,10 - 0,29
|
> 0,30
|
Strukturni parametri koji se uzimaju u obzir pri procjeni AR-a su veličina lijevoga ventrikula (normalan ili dilatiran) te morfološke značajke aortnih kuspisa (normalni, patološki).
Doplerski parametri uključuju prikaz regurgitirajućega mlaza i venae contractae, tj. njihovih širina. Obojenim doplerom prikazuje se regurgitirajući mlaz koji ide iz aorte preko aortnoga ušća i izlaznoga trakta lijevoga ventrikula nazad u lijevi ventrikul. Njegova se širina procjenjuje u izlaznom traktu lijevoga ventrikula te se izražava u postotku površine kojega on zauzima unutar izlaznoga trakta. Vena contracta je naziv za najužu širinu prikazanoga regurgitirajućeg mlaza, a ona se nalazi neposredno ispod anatomskoga regurgitirajućeg otvora na aortnom zalisku. Što je regurgitacija veća, to je veći promjer venae contractae i širina regurgitirajućega mlaza u izlaznom traktu lijevoga ventrikula. Dodatni doplerski parametar koji pomaže pri procjeni težine AR-a je prisutnost dijastoličkoga obrata tijeka krvi u descedentnoj aorti kojega nema u blagoj, a prisutan je u teškoj AR.
Kvantitativni parametri korišteni za procjenu AR-a su regurgitirajući volumen, regurgitirajuća frakcija te efektivni regurgitirajući otvor. Regurgitirajući volumen (RV) dobiva se oduzimanjem udarnoga volumena mitralnoga zaliska od udarnoga volumena aortnoga zaliska, a dobiveni rezultat označava veličinu regurgitirajućega volumena koja se izražava u mililitrima po otkucaju. Zbog regurgitirajuće komponente, protok kroz aortni zalistak veći je od protoka kroz mitralni zalistak. Udarni volumen mitralnoga i aortnog zaliska računa se matematički umnoškom površine zaliska i vremenskoga integrala brzine (VTI). Regurgitirajuća frakcija (RF) označava omjer regurgitirajućega volumena i udarnoga volumena aortnoga zaliska i izračunava se u postotku (%). Efektivni regurgitirajući otvor (ERO) izračunava se matematički, dijeljenjem regurgitirajućega volumena s vremenskim integralom brzine (VTI) izlaznoga trakta lijevoga ventrikula, a izražava se u cm2.
Ostale dijagnostičke metode. Rendgenogram srca i pluća dio je rutinske obrade, ali nema veći dijagnostički značaj (kardiomegalija i plućna kongestija ukazuju na razvoj srčane dekompenzacije). Kod bolesnika s nejasnim nalazima ehokardiografije preporuča se magnetna rezonanca srca (MRC), a kod bolesnika s anginoznim smetnjama koronarografija, osobito u prisutnosti drugih neizravnih znakova ishemije miokarda i kardiovaskularnih rizičnih čimbenika. Svim bolesnicima s dilatiranom ascendentnom aortom (> 40 mm) preporučeni su CT ili MR angiografija.
Liječenje kronične AR može biti konzervativno i operativno. Medikamentno liječenje, kao i kod aortne stenoze, nije pokazalo veći klinički značaj u pogledu utjecaja na tijek same bolesti, pa je osnova liječenja AR-a kirurška.
Kod razvoja simptoma kroničnoga srčanog popuštanja pristupa se standardnom načinu liječenja kako je to opisano u poglavlju o kroničnom srčanom popuštanju. Iako nema jasnih dokaza, svim bolesnicima s Marfanovim sindromom i biksupisnom aortnom valvulom i dilatiranom aortom, bez obzira na postojanje simptoma, preporuča se primjena beta blokatora i/ili ACE inhibitora (ili blokatora angiotenzinskih receptora). U toj se indikaciji posebno ističe losartan.
Operativno liječenje uključuje zamjenu aortnoga zaliska, a operacija je apsolutno indicirana kod: a) bolesnika s AR-om bilo kojega stupnja i značajno proširenom ascendentnom aortom (> 55 mm, odnosno 50 mm za bolesnike s bikuspisnom valvulom i 45 mm za bolesnike s Marfanovim sindromom) te b) bolesnika s teškim AR-om bez uvećane ascendente aorte ako su simptomatski, ili su asimptomatski, ali imaju narušenu sistoličku funkciju (EF < 50 %) ili promjer lijevoga ventirkula na kraju dijastole (LVEDD, od engl. left ventricular end-diastolic diameter) veći od 70 mm ili na kraju sistole (LVESD, od engl. left ventricular end-sistolic diameter) veći od 50 mm.
Asimptomatski bolesnici s blagim i umjerenim AR-om, kao i oni s teškim, koji ne zadovoljavaju navedene kriterije, nisu kandidati za kirurško liječenje i kod njih se provode redovne kontrole u vremenskim intervalima od 6 do 12 mjeseci, a ako se uoči progresija, i češće.
Liječenje akutne AR odvija se u jedinicama intenzivnoga liječenja. Liječenje plućnoga edema i kardiogenoga šoka provodi se prema ustaljenim načelima (respiratorna resuscitacija, primjena inotropa i vazopresora) uz istodobnu dijagnostiku i liječenje uzroka, što u pravilu uključuje hitan kardiokirurški zahvat.
Prognoza. Akutni AR predstavlja životno ugrožavajuće stanje koje je praćeno visokom stopom mortaliteta unatoč poduzetim mjerama liječenja (do 75 %). Stopa progresije asimptomatskoga AR-a u simptomatski iznosi manje od 6 % godišnje. Stopa iznenadne srčane smrti ovih bolesnika iznosi 0,2 % godišnje. Ako se kronični AR na vrijeme dijagnosticira i liječi, u pravilu ima dobru prognozu.
BOLESTI MITRALNOGA ZALISKA
Mitralni ili bikuspisni zalistak nalazi se između lijevoga atrija i lijevoga ventrikula, a glavna mu je uloga sprečavanje povrata krvi iz lijevoga ventrikula u lijevi atrij za vrijeme sistole, odnosno kontrakcije lijevoga ventrikula. Mitralni zalistak sastoji se od mitralnoga prstena (lat. annulus mitralis), prednjega i stražnjeg listića (lat. cuspis anterior et posterior) te tendinealnih niti/kordi (lat. cordae tendineae) kojima su listići povezani s papilarnim mišićima koji polaze od zidova lijevoga ventrikula. Papilarni mišići (anterolateralni i posteromedijalni) zajedno s kordama sprečavaju prolaps (izvrtanje) mitralnih kuspisa prema lijevom atriju u vrijeme dijastole i tako sprečavaju pojavu regurgitacije.
MITRALNA STENOZA
Definicija i epidemiologija. Mitralna stenoza (MS) je bolest mitralnoga zaliska koju obilježava smanjenje površine mitralnoga ušća s otežanim protokom krvi iz lijevoga atrija u lijevi ventrikul tijekom dijastole i otežanim dijastoličkim pražnjenjem lijevoga atrija. Pojavnost MS-a danas je u razvijenim zemljama rijetka (oko 1:100 000), što je posljedica smanjene učestalosti reumatske vrućice kao glavnoga uzroka MS-a. Ali, u manje razvijenim zemljama (Indija, Afrika) gdje je upotreba antibiotika slabija i viša je stopa reumatske vrućice, i MS je još uvijek značajno prisutna bolest srčanih zalistaka. Zbog uske povezanosti MS-a i reumatske vrućice koja se češće razvija kod žena, i sama prevalencija MS-a viša je kod žena u odnosu na muškarce.
Etiopatogeneza. Najčešći uzroci nastanka MS-a su akutna reumatska vrućica (nerazvijene zemlje) te degenerativna kalcifikacija mitralnoga prstena i kuspisa (razvijene zemlje). Ostali, rjeđi uzroci mogu biti infektivni endokarditis, kongenitalno uvjetovana stenoza, intrakavitarni tumori koji dovode do funkcionalne stenoze, sistemske bolesti vezivnoga tkiva (sistemski eritematozni lupus, reumatoidni artritis), bolesti nakupljanja (Fabrijeva bolest, mukopolisaharidoza). Poseban oblik MS-a predstavlja Lutembacherov sindrom koji predstavlja kombinaciju urođenoga ili stečenog MS-a s atrijskim septalnim defektom.
Akutna reumatska vrućica pokazuje sklonost zahvaćanju mitralnoga zaliska pri čemu kuspisi u akutnoj fazi postaju zadebljani i vulnerabilni, dok u fazi reparacije dolazi do njihove fibroze i kalicifikacije, pri čemu dolazi do njihove međusobne fuzije koja onemogućava njihovo normalno otvaranje i uvjetuje nastanak stenoze (kronična reumatska bolest srca).
Degenerativna kalcifikacija mitralnoga prstena i kuspisa javlja se kod starijih osoba i čini najčešći uzrok MS-a u razvijenim zemljama. Ipak, taj proces nije toliko izražen kao što je to kod aortnoga zaliska, što se tumači manjim brzinama protoka kroz sam zalistak, manjim mehaničkim opterećenjem i posljedičnim traumama.
Patofiziologija. Normalna površina mitralnoga zaliska odraslih osoba iznosi 4 do 6 cm2, a suženje zaliska ispod 2 cm2 dovodi do hemodinamski i klinički značajnoga MS-a. Otežan protok krvi kroz stenozirani mitralni zalistak dovodi do tlačnoga opterećenja lijevoga atrija i posljedičnoga porasta tlaka u njemu te kompenzatorne hipertrofije i dilatacije. Povišen tlak unutar lijevoga atrija retrogradno se prenosi na plućnu cirkulaciju što dovodi do plućne kongestije, a otvaraju se i kolaterale prema bronhalnim venama, što može uzrokovati krvarenje u dišnim putevima. Masa lijevoga ventrikula ostaje nepromijenjena ili se blago smanji, dok je udarni (minutni) volumen u mirovanju uredan, no ne može se povećati pri opterećenju, zbog čega bolesnici slabije toleriraju napor. Doprinos atrijske kontrakcije dijastoličkom punjenju lijevoga ventrikula izražen je kod ovih bolesnika, stoga nastanak fibrilacije atrija može biti praćen naglim pogoršanjem i nastankom plućnoga edema. U uznapredovaloj fazi bolesti povećan tlak u plućnom krvožilju prenosi se i na desno srce pri čemu nastaje sekundarna trikuspidalna regurgitacija.
Klinička slika. Bolest pokazuje sporoprogresivan karakter i dug asimptomatski period. Prvi simptomi su slabija tolerancija napora, dispneja koja je u početku povezana s naporom, a kasnije se može javiti i u mirovanju te učestale hemoptize. Nekada prvi znak može biti novonastala fibrilacija atrija praćena palpitacijama. Ona je osobito česta kod ovih bolesnika zbog dilatacije atrija koja pogoduje nastanku fibrilacije atrija. Izražena dilatacija lijevoga atrija može uzrokovati kompresiju na simpatički živčani lanac i povratni laringealni živac, zbog čega se mogu razviti Hornerov sindrom (istostrana anhidroza, ptoza, mioza i endoftalmus) te promuklost (Ortnerov sindrom). S progresijom bolesti dolazi do razvoja tipične kliničke slike kroničnoga srčanog popuštanja.
Pri fizikalnom pregledu mogu se uočiti karakteristični znakovi kao što su facies mitralis (karakteristični izgled lica koji uključuje crvenilo i hiperemiju obraza uz perioralnu cijanozu), malen i slabo punjen arterijski pulsni val, distendirane jugularne vene te pomak srčanoga vrha (ictus cordis) u lijevo. Auskultacijski nalaz na srcu uključuje pojavu pljeska otvaranja nakon kojega slijedi dijastolički šum najbolje čujan nad mitralnim ušćem u lijevom bočnom položaju, pojačavan nakon tjelesne aktivnosti (npr. čučnjevi, hod uz stepenice). Dužina trajanja dijastoličkoga šuma korelira s težinom MS-a (što dulje traje, stenoza je teža). U razvijenoj fazi bolesti nalazimo i znakove sistemske kongestije (hepatomegalija, ascites, periferni edemi) uz auskultacijski dijastolički šum sekundarne trikuspidalne insuficijencije (Graham-Steelov šum).
Dijagnoza MS-a se zasniva na fizikalnom nalazu, EKG-u, rendgenogramu srca i pluća te ehokardiografiji (transtorakalna, transezofagealna) te, prema potrebi, drugim dijagnostičkim metodama.
EKG kod bolesnika s MS-om u početku ukazuje na dilataciju lijevoga atrija (P-mitrale), a kasnije se nalaze i znakovi dilatacije desnoga atrija (P-pulmonalne) te hipertrofije desnoga ventrikula. Kod velikoga broja bolesnika prisutna je i fibrilacija atrija kao posljedica dilatacije atrija.
Rendgenogram srca i pluća početno ukazuje na dilataciju lijevoga atrija što je vrlo često teško uočljiv nalaz (širenjem lijevoga atrija prema desno njegova sjena preklapa se sa sjenom desnoga atrija stvarajući sliku dvostruke sjene na desnoj strani srčane siluete), no s napredovanjem bolesti razvija se kardiomegalija s uvećanom desnom stranom srca, te znaci plućne hipertenzije (naglašena plućna arterija) i plućne kongestije.
Ehokardiografija ima ključnu ulogu u dijagnostici MS-a. Standardno se izvodi transtorakalnim pristupom (TTE), ali zbog bolje vizualizacije i morfološke procjene cjelokupnoga mitralnog zaliska, izvodi se i transezofagealnim putem (TEE), osobito prije operacijskoga liječenja (procjena opravdanosti rekonstrukcije zaliska u odnosu na potpunu zamjenu), ali i u procjeni aurikule lijevoga atrija u pogledu prisutnosti intramuralnoga tromba. Ehokardiografija omogućava morfološku procjenu mitraloga prstena, kuspisa i kordi te omogućava funkcionalna mjerenja koja su ključna u procjeni težine mitralne stenoze (Tablica 1.65.).
|
Tablica 1.65. Ehokardiografska procjena mitralne stenoze
|
|
Parametar
|
Blaga
|
Umjerena
|
Teška
|
|
Površina mitralnoga zaliska, MVA (cm2)
|
> 1,5
|
1,0 - 1,5
|
< 1
|
|
Poluvrijeme tlaka, PHT (ms)
|
< 100
|
100 - 300
|
> 300
|
|
Srednji gradijent tlaka, MPG (mmHg)
|
< 5
|
5 - 10
|
> 10
|
|
Plućni arterijski tlak, PAP (mmHg)
|
< 30
|
30 - 50
|
> 50
|
Morfološki znakovi koji upućuju na MS su zadebljanje (> 3 mm), hiperehogenost te smanjena pokretljivost i separacija mitralnih kuspisa uz dilataciju lijevoga atrija. Osim toga, primjenom obojenoga doplera jasno se može raspoznati uski i turbulentni dijastolički protok krvi nalik plamenu svijeće koji je usmjeren prema vršku lijevoga ventrikula.
Osnovna ehokardiografska mjerenja nužna za procjenu težine mitralne stenoze su površina mitralnoga zaliska - MVA (cm2), poluvrijeme tlaka – PHT (ms), srednji gradijent tlaka - MPG (mmHg), te plućni arterijski tlak (mmHg).
Površina mitralnoga prstena (MVA, od engl. mitral valve area) može se izračunati planimetrijskom metodom u 2D-prikazu ocrtavanjem rubova mitralnoga otvora u ranoj dijastoli iz kratke parasternalne osi (kada je najvećega promjera) te se automatski izračunava površina u cm2.
Poluvrijeme tlaka (PHT, od engl. pressure half time) također je mjera koja omogućava procjenu težine mitralne stenoze, a može se koristiti i za neizravni izračun površine mitralnoga zaliska. PHT označava vrijeme izraženo u milisekundama potrebno da transmitralni valvularni gradijent padne na 50 % svoje početne vrijednosti, a mjeri se pomoću kontinuiranoga doplera usmjerenoga na mitralni zalistak iz apikalne projekcije. Što je MS teža, to je i PHT duži (zbog stenoze je potrebno dulje vrijeme da padne gradijent tlaka). Uvrštavanjem vrijednosti PHT-a u formulu (MVA = 220/PHT) neizravno se može izračunati i površina mitralnoga zaliska.
Srednji gradijent tlaka (MPG, od engl. mean pressure gradient) mitralnoga zaliska omogućava metoda kontinuiranoga doplera koja se vrši iz apikalne projekcije. MPG je proporcionalan težini mitralne stenoze, što je MS jače izražena, to je i viši srednji gradijent tlaka.
Plućni arterijski tlak neizravno se procjenjuje mjerenjem brzine protoka u trikuspidalnoj regurgitaciji (kasnije opisano), a izražava se u mmHg. Što je MS teža, to je i veći stupanj prateće sekundarne plućne hipertenzije, odnosno plućnoga arterijskog tlaka.
Kod bolesnika kod kojih postoji neslaganje između simptoma i ehokardiografskih parametara težine MS-a (bolesnici navode izražene simptome, a ehokardiografski nalaz je uredan ili blago patološki) preporuča se stres-ehokardiografija, odnosno procjena srednjega gradijenta tlaka pri opterećenju. Kod ovih bolesnika i nakon minimalnoga opterećenja može doći do značajnoga porasta srednjega gradijenta tlaka.
Medikamentno liječenje odnosi se na asimptomatske i blago simptomatske bolesnike koji nisu kandidati za neki od oblika intervencijskoga liječenja. U liječenju se primjenjuju standardni lijekovi koji se i inače koriste u liječenju srčanoga popuštanja (diuretici, beta blokatori, blokatori kalcijskih kanala, digoksin). Pojavom fibrilacije atrija potrebna je uz antiaritmičku i antikoagulacijska terapija.
Liječenje fibrilacije atrija kod ovih je bolesnika važno, s obzirom na to da je njezin nastup kod ovih bolesnika često povezan s akutnom dekompenzacijom i razvojem plućnoga edema. Konverzija u sinusni ritam rijetka je pojava, osobito ako je lijevi atrij proširen više od 4,5 cm. Ključnu ulogu u liječenju fibrilacije atrija ima održavanje kontrole frekvencije ventrikula i peroralna antikoagulacijska terapija. U peroralnoj antikoagulacijskoj terapiji u ovoj indikaciji isključivo se primjenjuje varfarin, dok se primjena direktnih antikoagulantnih lijekova za sada ne preporuča.
Antikoagulacijsko liječenje kod bolesnika s MS-om, osim u slučaju pojave fibrilacije atrija, indicirano je i u sinusnom ritmu u sljedećim situacijama: 1) pozitivna anamneza na tromboembolijski incident, 2) dokazano postojanje intramuralnoga tromba u lijevom atriju, 3) promjer lijevoga atrija u M-načinu prikaza veći od 50 mm ili volumen lijevoga atrija veći od 60 ml/m2. Kao i kod fibrilacije atrija, preporučena je primjena samo antagonista vitamina K (varfarina), dok se primjena direktnih antikoagulantnih lijekova ne preporuča. Ciljne vrijednosti INR-a u liječenju ovih bolesnika kreću se između 2 i 3.
Intervencijsko liječenje uključuje perkutanu mitralnu komisurotomiju i operaciju mitralnoga zaliska (otvorena komisurotomija ili zamjena zaliska).
Indikacije. Temeljna indikacija za intervencijsko liječenje je simptomatski MS s površinom mitralnoga zaliska ispod 1,5 cm2, a može se razmotriti i kod asimptomatskih bolesnika s visokim rizikom od tromboembolije ili dekompenzacije. Visok rizik od tromboembolije imaju bolesnici s pozitivnom anamnezom na trombozu, bolesnici s novonastalom fibrilacijom atrija te spontanim kontrastom u lijevom atriju. Visok rizik od dekompenzacije imaju bolesnici s plućnim arterijskim tlakom višim od 50 mmHg, bolesnici koji imaju potrebu za nekardijalnom operacijom te bolesnice koje planiraju trudnoću.
Izbor zahvata. U izboru intervencijskoga liječenja prednost se daje perkutanoj mitralnoj komisurotomiji, dok se kirurško liječenje preporuča kod bolesnika koji imaju kontraindikacije za navedenu proceduru. Pri odluci o izvođenju perkutane mitralne komosiurotomije u obzir treba uzeti pogodnosti i kontraindikacije vezane uz samu proceduru (Tablica 1.66.).
|
Tablica 1.66. Pogodnosti i kontraindikacije za perkutanu mitralnu komisurotomiju
|
|
Kliničke i anatomske pogodnosti
|
Kontraindikacije
|
|
Kliničke pogodnosti: bolesnici nisu visoke životne dobi*,
odsutnost fibrilacije atrija, odsutnost plućne hipertenzije,
bolesnici nisu u klasifikaciji NYHA IV.
*visoka dob nije stroga nepogodnost za zahvat, on je opravdan i u visokoj životnoj dobi ako je operacija kontraindicirana
Anatomske pogodnosti temeljene na specifičnim bodovnim
sustavima (Wilkins score, Cormier score, Echo score).
|
Površina mitralnog zaliska > 1,5 cm2;
Tromb u lijevom atriju;
Odsustvo mitralne regurgitacije (kombinirana greška);
Teška ili bikomisuralna kalcifikacija;
Odsustvo komisuralne fuzije;
Teška konkomitantna bolest aortnog ili trikuspidalnog zaliska;
Konkomitantna koronarna bolest koja zahtijeva CABG.
|
Perkutana mitralna komisurotomija je zahvat koji se izvodi uz lokalnu anesteziju transfemoralnim venskim pristupom. Poseban balonski kateter uvodi se kroz gornju šuplju venu u desni atrij, a potom transseptalnom punkcijom u lijevi atrij te se pozicionira u područje mitralnoga zaliska gdje se ekspandira. Uspješnost zahvata definira se povećanjem površine mitralnoga zaliska preko 1,5 cm2. Mortalitet vezan uz opisanu proceduru je nizak i iznosi manje od 0,5 %. Ponavljanje procedure moguće je ako bolesnik ponovno zadovoljava navedene kriterije (ima kliničke i anatomske pogodnosti te nema kontraindikacije).
Kardiokirurški zahvat izvodi se samo kod bolesnika koji imaju kontraindikacije za perkutanu balonsku komisurotomiju ili nemaju zadovoljene kliničke i anatomske pogodnosti za nju. U obzir dolazi kirurška rekonstrukcija zaliska (otvorena komisurotomija) te zamjena mitralnoga zaliska, što je indicirano kod bolesnika s kombiniranom mitralnom greškom (stenoza i regurgitacija) i bolesnika koji imaju Echo score veći od 8. Operativni mortalitet iznosi 1 do 3 %. Zbog sporijih protoka, mehaničke mitralne valvule nose veći rizik od tromboze te se pri peroralnom antikoagulacijskom liječenju varfarinom kod ovih bolesnika INR mora održavati u većem rasponu, tj. između 2,5 i 3,5 zajedno s primjenom acetilsalicilne kiseline. Primjena varfarina preporuča se i do šest mjeseci nakon ugradnje biološke mitralne valvule.
Prognoza. Mitralna stenoza predstavlja sporoprogresivnu bolest koja ima latentni period od 20 do 40 godina prije pojave simptoma. Simptomatska neliječena MS ima lošu prognozu koja nosi petogodišnji mortalitet od oko 65 %. Uz opisane mjere liječenja (prvenstveno intervencijske) stopa petogodišnjega preživljenja iznosi preko 80 %. Najlošiji prognostički znak kod ovih bolesnika razvoj je plućne hipertenzije (bolesnici s teškim oblikom sekundarne plućne hipertenzije imaju medijan preživljenja oko tri godine).
MITRALNA REGURGITACIJA (INSUFICIJENCIJA)
Definicija i epidemiologija. Mitralna regurgitacija (MR) predstavlja bolest mitralnoga zaliska pri kojoj dolazi do nepotpunoga zatvaranja njegova ušća, što omogućava povrat krvi iz lijevoga ventrikula u lijevi atrij u vrijeme sistole i dovodi do njegovoga volumnog opterećenja. Mitralna regurgitacija na drugom je mjesto po učestalosti među bolestima srčanih zalistaka, odmah iza aortne stenoze, a procjenuje se da ima godišnju incidenciju od 5:10 000 stanovnika.
Etiopatogeneza. Mitralna regurgitacija može nastati zbog poremećaja bilo koje komponente samoga zaliska (prsten, kuspisi, korde, papilarni mišići, pripadajući miokard). Ovisno o nastanku, razlikuju se primarni i sekundarni MR, a prema kliničkom nastupu razlikuju se akutni i kronični (Tablica 1.67.).
Akutni MR nastaje naglo, kroz nekoliko sati ili dana, najčešće kao posljedica akutnih bolesti kao što su akutni infarkt miokarda (nekroza i disfunkcija papilarnih mišića), akutni infektivni endokarditis ili trauma prsnoga koša i srca.
Kronični MR obilježen je postupnim razvojem, obično kroz više godina, a može biti primarni i sekundarni. Primarni nastaje zbog bolesti koje pogađaju i oštećuju sam zalistak (tzv. organski MR), dok je sekundarni posljedica bolesti koje dovode do promjene u geometriji lijevoga ventrikula (dilatacija) s posljedičnim širenjem prstena mitralnoga zaliska, dok su ostale komponente uredne i nisu zahvaćene patološkim procesom (tzv. funkcionalni MR).
|
Tablica 1.67. Najčešći uzroci kronične mitralne regurgitacije
|
|
Primarna mitralna regurgitacija (organska)
|
Sekundarna mitralna regurgitacija (funkcionalna)
|
|
Prolaps mitralne valvule
Kalcifikacija mitralnog zaliska
Miksomatozna degeneracija mitralnog zaliska
Reumatska vrućica, infektivni endokarditis
Nasljedne i stečene bolesti vezivnog tkiva
|
Kalcifikacija mitralnog zaliska
Dilatacijska kardiomiopatija
Ishemijska kardiomiopatija
Hipertrofijska kardiomiopatija
Kronična fibrilacija atrija s uvećanim lijevim atrijem
|
Najčešći uzroci primarnoga kroničnog MR-a su prolaps mitralne valvule (odgovoran za više od 90 % slučajeva) te kalcifikacija i miksomatozna degeneracija mitralnoga zaliska, dok su najčešći uzroci sekundarnoga MR-a dilatacijska i ishemijska kardiomiopatija.
Patofiziologija. Akutni MR praćen je naglim i brzim razvojem patofizioloških zbivanja koja u prvom redu uključuju volumno opterećenje lijevoga atrija, na što se on ne stigne prilagoditi dilatacijom i hipertrofijom. Posljedično tome, dolazi do nagloga porasta tlaka unutar desnoga atrija, što se retrogradno prenosi na plućne krvne žile dovodeći do plućne kongestije i nastanka plućnoga edema. Isto tako, uslijed značajnoga gubitka krvi iz lijevoga ventrikula u lijevi atrij prilikom kontrakcije lijevoga ventrikula smanjuje se i volumen izbačene krvi u aortu (udarni volumen) te srce nastoji održati minutni volumen urednim povećanjem frekvencije. Kronični MR obilježen je sporim razvojem i postupnim porastom tlaka unutar lijevoga atrija, zbog čega se on stigne kompenzacijski prilagoditi u smislu dilatacije i ekscentrične hipertrofije. Ta prilagodba omogućava smanjenje tlaka unutar lijevoga atrija, kao i održavanje minutnoga volumena, zbog čega bolesnici godinama ostaju asimptomatski. Ipak, s vremenom ti kompenzacijski mehanizmi postaju nedostatni te dolazi do faze dekompenzacije, odnosno razvoja klinički manifestne bolesti.
Klinička slika. Akutni MR nastupa naglo i prezentira se slikom akutnoga plućnog edema i kardiogenoga šoka zajedno s manifestacijama uzročne bolesti. Kronični MR ima dug asimptomatski period, a prvi simptomi nastaju kao posljedica plućne kongestije (dispneja, ortopneja, paroksizmalna noćna dispneja) i smanjenoga minutnog volumena (slaba tolerancija napora). S razvojem bolesti dolazi i do nastanka tipične kliničke slike kroničnoga srčanog popuštanja. Kliničkom slikom sekundarnoga MR-a dominiraju klinička očitovanja osnovne bolesti u podlozi. Fizikalni pregled ovih bolesnika otkriva holosistolički šum koji se najbolje čuje nad iktusom s karakterističnim širenjem u lijevu aksilu, s čestim čujnim mezosistoličkim klikom kod prolapsa mitralnih kuspisa.
Dijagnoza se postavlja na temelju kliničke slike i fizikalnoga nalaza, EKG-a, rendgenograma srca i pluća te ehokardiografije. Dodatno se obrada može proširiti drugim pretragama, kao što su magnetna rezonanca, kompjuterizirana tomografija srca ili kateterizacija lijevoga srca.
EKG kod bolesnika s razvijenom bolesti obično ukazuje na dilataciju lijevoga atrija (P-mitrale) i određeni stupanj hipertrofije lijevoga ventrikula s ili bez patološke električne osi u lijevo. Zbog dilatacije lijevoga atrija često je prisutna i fibrilacija atrija.
Rendgenogram srca i pluća može ukazivati na uvećanje srčane sjene (kardiomegaliju) s karakterističnim uvećanjem lijevoga atrija i izraženim znakovima plućne kongestije u uznapredovaloj fazi bolesti. Kod nekih se bolesnika ističu i kalcifikacije mitralnoga zaliska.
Ehokardiografija omogućava morfološku analizu sastavnica mitralnoga zaliska, lijevih srčanih šupljina, kao i procjenu sistoličke i dijastoličke funkcije. Specifična ehokardiografska mjerenja omogućavaju određivanje stupnja težine MR-a, što je navedeno u Tablici 1.68. (objašnjenja pojedinih parametara nalaze se u poglavlju o AR).
|
Tablica 1.68. Ehokardiografska procjena težine mitralne regurgitacije
|
|
Parametar
|
Blaga
|
Umjerena
|
Teška
|
|
Angiografska ocjena
|
1+
|
2+
|
3+, 4+
|
|
Veličina lijevog atrija i ventrikula (LA, LV)
|
Uredan
|
Uredan/dilatiran
|
Dilatiran
|
|
Površina regurgitirajućeg mlaza (% od LA)
|
< 20 %
|
20 – 40 %
|
> 40 %
|
|
Vena contracta (cm)
|
< 0,30
|
0,3 - 0,69
|
> 0,70
|
|
Regurgitirajući volumen (ml/otkucaju)
|
< 30
|
30 - 59
|
> 60
|
|
Regurgitirajuća frakcija (%)
|
< 30
|
30 - 49
|
> 50
|
|
Efektivni regurgitirajući otvor (cm2)
|
< 0,20
|
0,20 - 0,39
|
> 0,40
|
U prijeoperacijskoj analizi mitralnoga zaliska koristi se Carpentierova klasifikacija koja uključuje detaljan opis anatomske lezije, a za bolji prikaz i procjenu primjenjuje se transezofagealni pristup (TEE). Kod bolesnika kod kojih postoji diskrepancija između simptoma i ehokardiografskoga nalaza u mirovanju (bolesnici navode jaču simptomatologiju koja se ne objašnjava nalazom ehokardiografije) indicirana je stres-ehokardiografija (i mali napori mogu dovesti do značajno promijenjenih nalaza ehokardiografskih mjerenja).
Liječenje akutnoga MR-a zahtijeva promptnu hemodinamsku stabilizaciju bolesnika (diuretici, vazodilatatori, inotropi, intraaortna balonska pumpa) te hitnu kardiokiruršku intervenciju.
Liječenje kroničnoga primarnog MR-a podrazumijeva mjere medikamentnoga liječenja prema ustaljenim principima liječenja bolesnika s kroničnim srčanim popuštanjem uz prepoznavanje indikacije za kiruršku reparaciju ili zamjenu mitralnoga zaliska.
Operativno liječenje (reparacija ili zamjena zaliska) apsolutno je indicirano za sve simptomatske bolesnike koji imaju istisnu frakciju iznad 30 % te kod asimptomatskih bolesnika s disfunkcijom lijevoga ventrikula (istisna frakcija manja od 60 % i/ili promjer lijevoga ventrikula na kraju sistole veći od 45 mm).
Operativno liječenje (reparacija ili zamjena zaliska) može se razmotriti i kod asimptomatskih bolesnika koji imaju očuvanu funkciju lijevoga ventrikula (istisna frakcija veća od 60 % i/ili promjer lijevoga ventrikula na kraju sistole manji od 45 mm), a imaju fibrilaciju atrija posljedično mitralnoj insuficijenciji ili plućnu hipertenziju (srednji plućni arterijski tlak viši od 50 mmHg u mirovanju).
Operativno liječenje koje uključuje samo reparaciju mitralnoga zaliska može se razmotriti i kod simptomatskih bolesnika koji imaju značajno narušenu funkciju lijevoga ventrikula (istisna frakcija manja od 30 %) i koji su otporni na medikamentno liječenje, a imaju malo komorbiditeta i relativno su dobroga općeg stanja.
Reparacija mitralnoga zaliska metoda je izbora u operativnom liječenju kada se na osnovi anatomskih karakteristika procijeni da bi ona bila uspješna i da bi njezini rezultati bili trajniji, dok se kod svih ostalih bolesnika preporuča zamjena mitralnoga zaliska. Kod bolesnika s visokim operativnim rizikom i indikacijom za operativno liječenje u obzir dolazi i perkutana reparacija zaliska.
Bolesnici s blagim i umjerenim MR-om, kao i oni s teškim MR-om i očuvanom istisnom frakcijom (EF > 60 %) ne zahtijevaju posebne oblike liječenja, nego se redovno kontroliraju u vremenskim razmacima od šest mjeseci do godine dana. Ako se na kontrolnom pregledu utvrdi postojanje indikacije za operativno liječenje prema navedenim preporukama, preporuča se izvođenje rane operacije (u roku od dva mjeseca), s obzirom na to da takvi bolesnici postižu značajno bolje ishode.
Liječenje kroničnoga sekundarnog MR-a usko je povezano s liječenjem uzročne bolesti koja je dovela do razvoja MR-a. Operativno liječenje mitralnoga zaliska apsolutno je indicirano kod bolesnika koji imaju teški MR i istisnu frakciju veću od 30 %, a bit će podvrgnuti kardiokirurškoj revaskularizaciji (CABG), a može se razmotriti i kod bolesnika koji imaju istisnu frakciju nižu od 30 %. Kada revaskularizacija nije indicirana, operacija se može razmotriti u simptomatskih bolesnika s teškim sekundarnim MR-om i istisnom frakcijom većom od 30 % kada su bolesnici refrakterni na standardno liječenje srčanoga popuštanja. Kao metoda liječenja navodi se i transkateterski popravak mitralnoga zaliska MitraClip uređajem, a rezervirano je poglavito za bolesnike s funkcionalnim MR-om koji nisu kandidati za kardiokirurški zahvat.
Prognoza primarnoga MR-a ovisi o težini bolesti. Bolesnici s blagim i umjerenim stupnjem bolesti imaju povoljnu prognozu i mogu živjeti više desetaka godina bez značajnijih tegoba. Bolesnici s teškim oblikom bolesti uz medikamentno i/ili kirurško liječenje imaju stopu petogodišnjega preživljenja od 70 do 80 %, dok prosječno preživljenje bez kirurške intervencije iznosi svega dvije do tri godine. Prognoza sekundarnoga MR-a ovisi o uzročnoj bolesti.
PROLAPS MITRALNOGA ZALISKA
Definicija i epidemiologija. Prolaps mitralnoga zaliska (PMZ) naziv je za pojavu izvrtanja jednoga ili oba kuspisa mitralnoga zaliska u lijevi atrij tijekom sistole što može dovesti do manjega ili većeg stupnja MR-a. On ujedno predstavlja i jednu od najčešćih prirođenih anomalija srčanih zalistaka s incidencijom u općoj populaciji od 0,5 do 15 %.
Etiopatogeneza i patofiziologija. Pojavnost PMZ-a povezuje se s genetskim čimbenicima (poremećena proizvodnja kolagena tipa III), nasljednim bolestima vezivnoga tkiva (Marfanov sindrom, Ehlers-Danlosov sindrom, osteogenesis imperfecta), miksomatoznom degeneracijom mitralnoga zaliska, reumatskom vrućicom i koronarnom bolesti (ishemija papilarnih mišića). Kod većine bolesnika prolaps mitralnoga zaliska ostaje nepoznate etiologije. Izvrtanje kuspisa u lijevi atrij pri kontrakciji lijevoga ventrikula dovodi do pojave sistoličkoga povrata krvi, a patofiziološke posljedice ponajprije ovise o veličini regurgitacijskoga otvora koji nastaje nakon izvrtanja kuspisa. Ako je on malen, ne mora imati nikakve reperkusije na hemodinamiku, no kod većih dimenzija on uvjetuje razvoj patofizioloških događaja kako je to opisano u dijelu o mitralnoj insuficijenciji.
Klinička slika. Većina bolesnika s PMZ-om su asimptomatski i bolest se dijagnosticira na temelju slučajno otkrivenoga šuma na srcu ili kao slučajan ehokardiografski nalaz. Kod dijela bolesnika mogu biti izražene palpitacije, sinkope i bol u prsima. Palpitacije i sinkope objašnjavaju se istodobnom prisutnošću autonomne disfunkcije, dok se bol u prsima povezuje s povećanom napetošću papilarnih mišića koja nastoji kompenzirati nastalo izvrtanje zalistaka, što dovodi do njihove ishemije. Kod bolesnika s izraženim MR-om postupno se razvija klinička slika srčanoga popuštanja. Tipični auskultacijski nalaz uključuje pojavu mezosistoličkoga klika koji nastaje izvrtanjem kuspisa, a kada je pridružena značajan MR, na njega se nastavlja telesistolički šum.
Dijagnoza se postavlja na temelju ehokardiografskoga nalaza. Ehokardiografska definicija PMZ-a podrazumijeva nalaz protruzije jednoga ili oba kuspisa mitralnoga zaliska u lijevi atrij za 2 ili više milimetara izvan ravnine mitralnoga prstena u 2D-prikazu iz pozicije duge parasternalne osi. Dodatno se provodi istraživanje postojanja MR-a kako je to opisano u dijelu o MR-u (obojeni dopler, pulsni dopler, kontinuirani dopler). U dijagnostičkoj obradi ovih bolesnika potrebno je učiniti i Holter EKG (česte su pojave supraventrikularnih i ventrikularnih poremećaja srčanoga ritma) te CT ili MR angiografiju aorte, s obzirom na to da je učestalost dilatacije i aneurizme ascedentne aorte veća kod ovih bolesnika (povezano s poremećajima vezivnoga tkiva).
Liječenje asimptomatskih bolesnika s PMZ-om bez značajnih hemodinamskih reperkusija nije potrebno. Liječenje simptomatskih bolesnika uključuje primjenu beta blokatora kod bolesnika s palpitacijama i učestalim ventrikularnim i supraventrikularnim ekstrasistolama te profilaksu infektivnoga endokarditisa (samo ako uz prolaps nalazimo i MR). Operativno liječenje indicirano je ako je volumen regurgitirajuće krvi veći od 60 ml/otkucaj, ako je frakcija regurgitacije veća od 50 % te ako je površina regurgitacijskoga otvora veća od 0,4 cm2. Pri operativnom liječenju ovih bolesnika prednost se daje kirurškoj rekonstrukciji zaliska (reparacija) u odnosu na zamjenu.
Komplikacije koje prate PMZ su progresivni MR, infektivni endokarditis, ruptura tendinealnih kordi, fibrilacija atrija, tranzitorne ishemijske atake, cerebrovaskularni inzult te iznenadna srčana smrt.
Prognoza. Većina bolesnika s PMZ-om ima benigni klinički tijek i dobru prognozu. Kod 10 % bolesnika se tijekom života razvije neka od navedenih komplikacija. Razvoj progresivnoga MR-a češći je kod žena u odnosu na muškarce s PMZ-om.
BOLESTI ZALISKA PLUĆNE ARTERIJE
Zalistak plućne arterije građen je od kuspisa koji se nalaze između desnoga ventrikula i plućne arterije. On sprečava vraćanje krvi iz plućne arterije u desni ventrikul u vrijeme dijastole. Osnovni poremećaji zaliska plućne arterije su njegova stenoza i regurgitacija.
STENOZA ZALISKA PLUĆNE ARTERIJE
Definicija. Stenoza zaliska plućne arterije (SZPA) predstavlja suženje zaliska plućne arterije koje dovodi do otežanog protoka krvi iz desnog ventrikula u plućnu arteriju za vrijeme sistole uz posljedično tlačno opterećenje desnog ventrikula. S obzirom na nastanak, razlikuju se kongenitalna i stečena SZPA.
Kongenitalna SZPA je najčešći oblik SZPA-e, a nastaje kao posljedica poremećaja u razvoju samoga zaliska tijekom fetalnoga perioda, bilo da je ono genetski uvjetovano, bilo uslijed djelovanja za sada nepoznatoga teratogenog čimbenika. Stenoza zaliska plućne arterije često se pojavljuje u sklopu Nonnanovoga sindroma (mutacija PTPN1 gena) te kod bolesnika s tetralogijom Fallot. Više o kongenitalnoj SZPA-i piše u poglavlju o prirođenim srčanim greškama te se nastavak teksta odnosi na stečenu SZPA-u.
Stečena SZPA rijetko se susreće u kliničkoj praksi, a može nastati kao posljedica infektivnoga endokarditisa, reumatske vrućice ili intrakardijalnoga tumora koji dovodi do funkcionalne opstrukcije protoka krvi kroz pulmonalno ušće. Stečena SZPA može nastati i kao komplikacija karcinoidnoga sindroma pri čemu dugotrajno lučenje serotonina može dovesti do strukturnih promjena samih zalistaka.
Patofiziologija. Sistoličko tlačno opterećenje desnoga ventrikula predstavlja temeljnu patofiziološku posljedicu SZPA-e. Otežano pražnjenje dovodi do porasta tlaka unutar desnoga ventrikula što uzrokuje kompenzatornu hipertrofiju kojom se nastoji nadvladati nastalo opterećenje. Povećanje mišićne mase desnoga ventrikula ne prati i povećanje krvožilja, što dovodi do ishemije i brojnih mikroinfarkata dodatno smanjujući istisnu sposobnost desnoga ventrikula. Smanjena istisna snaga desnoga ventrikula dovodi do smanjenoga priljeva krvi u lijevo srce i smanjenja udarnog, odnosno minutnoga volumena srca. Povišen tlak u desnom ventrikulu prenosi se retrogradno na desni atrij dovodeći do sekundarne trikuspidalne regurgitacije i nastanka tipične slike desnostranoga srčanog popuštanja (sistemska kongestija).
Klinička slika. Kao i druge bolesti zalistaka, SZPA je praćena dugim asimptomatskim periodom u kojemu se obično dijagnosticira obradom slučajno otkrivenoga šuma na srcu. Prvi simptomi koji se javljaju kod bolesnika uključuju slabu toleranciju i dispneju u naporu. U razvijenoj fazi bolesti pojavljuju se tipični znakovi globalnoga srčanog popuštanja. Glavni nalaz pri fizikalnom pregledu uključuje sistolički šum nad plućnom arterijom u drugom interkostalnom prostoru uz lijevi rub sternuma koji se najbolje čuje u inspiriju. Kod bolesnika s blagom i umjerenom SZPA-om prije pojave šuma često se čuje ejekcijski klik, dok se u teškoj on stapa s prvim srčanim tonom te postaje nečujan.
Dijagnoza SZPA-e temelji se na sumnji pri fizikalnom pregledu i potvrdi dijagnoze putem ehokardiografije. Rutinski se radi EKG, rendgenogram srca i pluća, a prema potrebi se provode i druge metode (magnetska rezonanca, kateterizacija srca).
EKG ovih bolesnika može biti uredan, osobito u ranoj fazi bolesti, dok se kasnije mogu javiti skretanje električne osi u desno te znakovi hipertrofije desnoga ventrikula i dilatacije desnoga atrija na EKG-u.
Rendgenogram srca i pluća sastavni je dio dijagnostičke obrade, a može pokazati poststenotičku dilataciju glavnoga stabla plućne arterije na PA projekciji, dok se na lijevoj lateralnoj projekciji vidi smanjenje retrosternalnoga zračnog prostora na račun uvećane desne strane srca.
Ehokardiografija je kao i kod ostalih bolesti zalistaka temeljna dijagnostička metoda kojom se postavlja dijagnoza SZPA-e i ocjenjuje njezina težina. Ona omogućava morfološku procjenu zaliska plućne arterije i kuspisa, kao i morfologije desnih srčanih komora (hipertrofija desnoga ventrikula, dilatacija desnoga atrija). Mjerenjem maksimalne brzine protoka (Vmax) i maksimalnoga tlačnog gradijenta (PG) kroz zalistak plućne arterije određuje se stupanj težine SZPA-e (blaga, umjerena ili teška) kako je prikazano u Tablici 1.69.
|
Tablica 1.69. Ehokardiografsko stupnjevanje stenoza zaliska plućne arterije
|
|
Parametar
|
Blaga
|
Umjerena
|
Teška
|
|
Vmax (m/s)
|
< 3
|
3 - 4
|
> 4
|
|
PG (mmHg)
|
< 36
|
36 - 64
|
> 64
|
Ostale dijagnostičke metode uključuju kateterizaciju srca koja omogućava izravno mjerenje tlakova u desnom atriju, desnom ventrikulu i plućnoj arteriji, što se obično vrši u prijeoperacijskoj obradi te magnetnu rezonancu ili kompjuteriziranu tomografiju kod bolesnika s nejasnim ehokardiografskim nalazima.
Liječenje. Blagi oblici SZPA-e ne zahtijevaju posebne mjere liječenja, nego ih se redovno prati. Bolesnici s umjerenom i teškom SZPA-om kandidati su za intervencijsko liječenje koje se provodi kod svih simptomatskih bolesnika koji imaju maksimalni tlačni gradijent (PG) veći od 50 mmHg te kod svih asimptomatskih bolesnika koji imaju maksimalni tlačni gradijent (PG) veći od 60 mmHg. Metoda izbora je perkutana balonska valvuloplastika (dilatacija pulmonalnoga ušća putem širenja balona koji se postavlja kroz ušće), a u obzir dolazi i standardni kardiokirurški zahvat pri kojemu se može pokušati napraviti rekonstrukcija zaliska (komisurotomija) ili se cijeli zalistak mijenja. U novije se vrijeme sve više u liječenju primjenjuje i perkutana implantacija zaliska plućne arterije. Medikamentno liječenje provodi se samo u simptomatske svrhe prema opisanim načelima liječenja kroničnoga srčanog popuštanja.
REGURGITACIJA ZALISKA PLUĆNE ARTERIJE
Definicija. Regurgitacija zaliska plućne arterije (RZPA) označava poremećaj zaliska plućne arterije koji je obilježen dijastoličkim povratom krvi iz plućne arterije u desni ventrikul što dovodi do njegova volumnoga opterećenja.
Etiologija. RZPA može nastati kao posljedica primarnoga poremećaja zaliska plućne arterije (kongenitalne anomalije, endokarditis, karcinoidni sindrom, postoperativno), uslijed proširenja prstena zaliska plućne arterije (idiopatska dilatacija, plućna hipertenzija, Marfanov sindrom) ili njihovom kombinacijom. U kliničkoj praksi RZPA je najčešće povezana s proširenjem glavne grane plućne arterije, a time i prstena zaliska plućne arterije kod bolesnika s primarnom ili sekundarnom plućnom hipertenzijom.
Patofiziologija. Glavno patofiziološko zbivanje u RZPA-i podrazumijeva vraćanje krvi iz plućne arterije u desni ventrikul u vrijeme dijastole što povećava volumen i tlak unutar desnoga ventrikula. Kao odgovor na to zbivanje, desni se ventrikul dilatira te se razvije umjerena ekscentrična hipertrofija kojom se nastoji kompenzirati nastalo opterećenje desnoga ventrikula (kompenzirani period). Povišeni tlak u desnom ventrikulu prenosi se i na desni atrij koji se također dilatira. U konačnici dolazi do razvoja desnostranoga srčanog popuštanja, a zbog smanjenoga punjenja lijevoga ventrikula i smanjenoga udarnog i minutnoga volumena razvijaju se i klinički znakovi popuštanja lijeve strane srca.
Klinička slika. Regurgitacija zaliska plućne arterije ima dug asimptomatski period, a kliničkom slikom dominiraju simptomi i znakovi osnovne bolesti, najčešće plućne hipertenzije, koji se često preklapaju s kliničkim manifestacijama kroničnoga srčanog popuštanja koji se javljaju u uznapredovaloj fazi bolesti. Auskultacijski nalaz na srcu uključuje pojavu dijastoličkoga šuma (Graham-Steelov šum) koji se najbolje čuje iznad plućne arterije (drugi interkostalni prostor uz lijevi rub sternuma).
Dijagnoza Regurgitacija zaliska plućne arterije postavlja se na temelju sumnje u fizikalnom nalazu i potvrđuje ehokardiografijom, kao ključnom dijagnostičkom metodom kojom se i kvantificira njezina težina, odnosno određuje stupanj regurgitacije. Dodatna obrada uključuje EKG, rendgenogram srca, prvenstveno radi diferencijalne dijagnostike i isključenja komorbiditeta. Prema potrebi se izvode i druge dijagnostičke metode (magnetna rezonanca, kateterizacija srca).
EKG u uznapredovaloj fazi bolesti može uključivati skretanje električne osi u desno, kompletni ili nekompletni blok desne grane te znakove hipertrofije desnoga ventrikula i dilatacije desnoga atrija.
Rendgenogram srca i pluća većine bolesnika je uredan, a kod razvoja srčanoga popuštanja moguće je evidentirati kardiomegaliju na račun uvećane desne konture srca. U slučaju plućne hipertenzije uočavaju se i prominentne lijeva i desna grana plućne arterije, kao i zajedničko stablo.
Ehokardiografija omogućava morfološku procjenu zaliska plućne arterije, kao i desnih srčanih šupljina (dilatacija desnoga atrija, ekscentrična hipertrofija desnoga ventrikula), a pomoću obojanoga doplera moguće je uočiti regurgitacijski mlaz koji potiče od plućne arterije te je usmjeren u desni ventrikul. Ehokardiografske značajke regurgitacije zaliska plućne arterije prikazane su u Tablici 1.70.
|
Tablica 1.70. Ehokardiografske karakteristike regurgizacije zaliska plućne arterije
|
|
Parametar
|
Blaga
|
Umjerena
|
Teška
|
|
Morfologija zaliska plućne arterije
|
Uredna
|
Uredna ili patološka
|
Patološka
|
|
Veličina desnoga ventrikula
|
Uredan
|
Uredan ili dilatiran
|
Dilatiran
|
|
Veličina regurgitacijskoga mlaza
|
Tanki
|
Srednje izražen
|
Debeli
|
|
Brzina mlaza
|
Spora akceleracija
|
Varijabilno
|
Stupnjevita deceleracija
|
|
Usporedba plućnoga i sistemskoga protoka
|
Umjereno povećan
|
Varijabilno
|
Izraženo povećan
|
|
Omjer veličine mlaza i izlaznoga trakta
|
< 34%
|
35 – 74 %
|
> 75 %
|
Ostale dijagnostičke pretrage uključuju magnetnu rezonancu srca koja se izvodi kod nejasnih ehokardiografskih nalaza te kateterizaciju srca koja se radi u prijeoperacijskoj obradi i dokazivanju plućne hipertenzije.
Liječenje RZPA-e u prvom redu podrazumijeva liječenje osnovne bolesti, najčešće plućne hipertenzije. Kod razvoja srčanoga popuštanja primjenjuju se standardni lijekovi kako je to opisano u poglavlju o kroničnom srčanom popuštanju. Liječenje perkutanom tehnikom ili standardnom kardiokirurškom metodom indicirano je za simptomatske bolesnike s teškom RZPA-om, nastalom uslijed primarnih poremećaja plućnoga zaliska.
BOLESTI TRIKUSPIDALNOGA ZALISKA
Trikuspidalni zalistak nalazi se između desnoga atrija i desnoga ventrikula. Glavna mu je uloga da spriječi povrat krvi iz desnoga ventrikula u desni atrij za vrijeme sistole, odnosno kontrakcije desnoga ventrikula. Slično kao i mitralni zalistak, sastoji se od prstena, kuspisa, kordi i papilarnih mišića. Za razliku od mitralnoga zaliska koji se sastoji od dva kuspisa, trikuspidalni zalistak sastoji se od tri kuspisa: prednjega, srednjega i septalnog. Najznačajnije bolesti trikuspidalnoga zaliska su stenoza i regurgitacija.
TRIKUSPIDALNA STENOZA
Definicija. Stenoza trikuspidalnoga zaliska ili trikuspidalna stenoza (TS) rijetka je valvularna bolest koju karakterizira suženje trikuspidalnoga zaliska, što dovodi do otežanoga protoka krvi, odnosno otežanoga dijastoličkoga pražnjenja desnoga atrija i njegove posljedične dilatacije i hipertrofije.
Etiopatogeneza. Najčešći uzroci TS-a su kongenitalno uvjetovana stenoza te stenoza u sklopu kronične reumatske bolesti srca. Drugi, rjeđi uzroci TS-a mogu biti karcinoidni sindrom, infektivni endokarditis ili intrakavitarne mase (miksom, tromb). Trikuspidalna stenoza povezana s reumatskom vrućicom izuzetno se rijetko javlja samostalno i u većini slučajeva dolazi zajedno s promjenama na mitralnom zalisku.
Patofiziologija. Osnovni patofiziološki poremećaj kod bolesnika s TS-om predstavlja otežan protok krvi iz desnoga atrija u desni ventrikul tijekom dijastole. Navedeni poremećaj dovodi do postupnoga povećanja tlaka unutar desnoga atrija i njegovoga odgovora u vidu dilatacije i hipertrofije kojom se nastoji kompenzirati nastalo tlačno opterećenje. Povišen tlak unutar desnoga atrija retrogradno se širi na sistemski venski sustav dovodeći do razvoja opće kongestije (zastoj vratnih vena, hepatosplenomegalija, portalna hipertenzija, ascites, periferni edemi). S druge strane, neodgovarajuće punjenje desnoga ventrikula rezultira smanjenim priljevom krvi u lijevo srce, a time i smanjenim minutnim volumenom. Kod bolesnika s konkomitantnim stenozama mitralnoga i trikuspidalnoga zaliska plućna hipertenzija i plućna kongestija slabo dolaze do izražaja zbog smanjenoga punjenja lijevoga atrija i ventrikula krvlju iz desne strane srca.
Klinička slika. Izoliran TS ima sporoprogresivan tijek i dug asimptomatski period, a kada se i razviju simptomi i znakovi, ponajprije upućuju na desnostrano srčano popuštanje (distendirane vratne vene, periferni edemi, ascites), iako zbog smanjenoga minutnog volumena ovi bolesnici mogu imati i zaduhu te slabu toleranciju napora. Kako je TS većinom vezan uz istodobni poremećaj mitralnoga ili aortnoga zaliska, kliničke manifestacije navedenih poremećaja dominiraju kliničkom slikom. Glavni fizikalni nalaz kod bolesnika s TS-om predstavlja holo- ili mid-dijastolički šum koji se najbolje čuje u auskultacijskoj projekciji trikuspidalnoga ušća (lijeva i desna strana donjega ruba sternuma). Hepatomegalija i hepatojugularni refleks javljaju se kod bolesnika s uznapredovalim desnostranim srčanim popuštanjem.
Dijagnoza TS-a postavlja se na osnovi kliničke slike, auskultacijskoga nalaza te osnovne kardiološke obrade (ehokardiografija, EKG, rendgenogram srca i pluća). Prema potrebi se provode i druge dijagnostičke metode (magnetna rezonanca srca, kateterizacija srca).
EKG ovih bolesnika početno je uredan, a kasnije su prisutni znaci dilatacije i hipertrofije desnoga atrija. Češća je i pojavnost fibrilacije atrija.
Rendgenogram srca i pluća sastavni je dio obrade ovih bolesnika koji u uznapredovaloj fazi bolesti ukazuje na kardiomegaliju s dominantno proširenom desnom stranom srca. Kod nekih bolesnika nalazimo i dilatirane i prominentne gornju šuplju venu i venu azigos.
Ehokardiografija, kao i kod ostalih valvularnih bolesti, predstavlja osnovnu dijagnostičku metodu. Ona omogućava morfološku procjenu trikuspidalnoga zaliska (zadebljali i slabo pokretni kuspisi), desnih srčanih šupljina (smanjen volumen desnoga ventrikula, dilatiran i hipertrofiran desni atrij) te donje šuplje vene (dilatacija), kao i specifična mjerenja: površina zaliska (cm2), transvalvularni gradijent (mmHg) te poluvijek tlaka - PHT (ms). Do danas nema opće prihvaćene podjele TS-a prema težini, ali se drži da je klinički značajna ona stenoza koja je obilježena površinom zaliska manjom od 1 cm2, uz transvalvularni gradijent veći od 40 mmHg te PHT duži od 190 ms.
Liječenje. Medikamentno liječenje simptomatskih bolesnika temelji se na standardnom liječenju kroničnoga srčanog popuštanja s naglaskom na primjeni diuretika i restrikcije unosa soli i vode. Kod bolesnika kod kojih se ne može postići kontrola bolesti konzervativnim mjerama liječenja indicirano je operativno liječenje koje se temelji na zamjeni trikuspidalne valvule. Ako se radi o bolesti mitralne valvule, preporučeno je zahvat izvršiti istovremeno. Zbog visokoga rizika i sklonosti nastanku tromboze, obično se kod ove indikacije preferira ugradnja bioloških valvula u odnosu na mehaničke. Perkutana balonska valvuloplastika zbog ograničenoga broja bolesnika i veće učestalosti postproceduralne regurgitacije nije ušla u svakodnevnu kliničku praksu i rijetko se izvodi.
TRIKUSPIDALNA REGURGITACIJA (INSUFICIJENCIJA)
Definicija. Trikuspidalna regurgitacija (TR) predstavlja bolest trikuspidalnoga zaliska pri kojoj dolazi do nepotpunoga zatvaranja trikuspidalnoga ušća što omogućava povrat krvi iz desnoga ventrikula u desni atrij za vrijeme sistole te dolazi do njegovoga volumnoga opterećenja. Ovisno o etiologiji, razlikujemo primarni i sekundarni TR.
Primarni TR naziva se još i organskim, a nastaje uslijed primarne bolesti trikuspidalnoga ušća, čemu uzrok može biti reumatska vrućica, infektivni endokarditis, mikromatozna degeneracija, trauma ili ishemija.
Sekundarni TR naziva se još i funkcionalnim, s obzirom na to da nije posljedica primarne bolesti zaliska, nego nastaje uslijed patofizioloških promjena uvjetovanih drugim bolestima i stanjima, najčešće onima koje dovode do dilatacije desnoga ventrikula, a time i samoga prstena trikuspidalnoga zaliska (teška plućna hipertenzija, postinfarktna remodelacija desnoga ventrikula, dilatacijska kardiomiopatija i sl.).
Patofiziologija. Trikuspidalna regurgitacija rezultira sistoličkim povratom krvi iz desnoga ventrikula u desni atrij dovodeći primarno do njegova volumna opterećenja i posljedične kompenzatorne dilatacije. Posljedično disfunkciji desne strane srca razvija se s jedne strane sustavna kongestija, a s druge strane manifestacije smanjenoga minutnog volumena s obzirom na neodgovarajuće punjenje lijevih srčanih komora.
Klinička slika TR-a obilježena je u prvom redu simptomima u znakovima desnostranoga srčanog popuštanja (distendirane vratne vene, periferni edemi, ascites), a bolesnici se žale i na dispnoične tegobe te slabu toleranciju napora (brzo umaranje). Najznačajniji fizikalni nalaz predstavlja auskultacijski holosistolički šum koji se najbolje čuje uz lijevi i desni rub sternuma. Kod bolesnika sa sekundarnim TR-om kliničkom slikom i fizikalnim nalazom dominiraju simptomi i znakovi osnovne bolesti.
Dijagnoza TR-a temelji se na kliničkoj slici i nalazu EKG-a, rendgenogramu srca i pluća te ehokardiografiji. Na EKG-u nalazimo znakove dilatacije desnoga atrija (P-pulmonale) te nekompletni ili kompletni blok desne grane. Rendgenogram srca i pluća ukazuje na kardiomegaliju i naglašene gornju šuplju venu i venu azigos. Ehokardiografija kao glavna dijagnostička metoda ima više prednosti i značenja: omogućava morfološku procjenu trikuspidalnoga zaliska, desnih srčanih komora i donje šuplje vene, omogućava specifična mjerenja nužna za procjenu težine bolesti te ima značajnu ulogu u diferencijalnoj dijagnozi kod bolesnika sa sekundarnim TR-om. Osnovni ehokardiografski nalazi i procjena težine TR-a prikazani su u Tablici 1.71. Objašnjenja pojedinih parametara nalaze se u poglavlju o aortnoj regurgitaciji.
|
Tablica 1.71. Ehokardiografska procjena trikuspidalne regurgitacije
|
|
Parametar
|
Blaga
|
Umjerena
|
Teška
|
|
Morfologija trikuspidalnoga zaliska
|
Normalna
|
Normalna/patološka
|
Patološka
|
|
Veličina desnoga atrija
|
Normalna
|
Normalna/dilatacija
|
Dilatacija
|
|
Efektivni regurgitirajući otvor (cm2)
|
< 0,2
|
0,2 - 0,4
|
> 0,4
|
|
Površina regurgitirajućeg mlaza (cm2)
|
< 5,0
|
5 - 10
|
> 10
|
|
Vena contracta (cm)
|
Ne definira se
|
< 0,7
|
> 0,7
|
Liječenje. Medikamentno liječenje provodi se kod simptomatskih bolesnika prema načelima liječenja kroničnoga srčanog popuštanja. Osnovni izazov u liječenju ovih bolesnika je odrediti indikaciju za operativno liječenje koje uključuje kiruršku reparaciju zaliska ili njegovu zamjenu. Na odluku o operativnom liječenju TR-a značajno utječe potreba za istovremenom operacijom lijevostranoga zaliska (aortni ili mitralni).
Kod bolesnika kod kojih postoji potreba za operacijom lijevostranoga zaliska, a imaju teški TR, apsolutno je indicirana i istodobna operacija triksupidalne valvule. Ako ovi bolesnici imaju blag ili umjeren TR, istovremena operacija trikuspidalne valvule indicirana je samo ako bolesnici imaju izraženu dilataciju trikuspidalnoga prstena i/ili ispoljavaju znakove desnostrane srčane slabosti.
Kod bolesnika kod kojih ne postoji potreba za operacijom lijevostranoga zaliska operacija trikuspidalnoga zaliska u obzir dolazi samo ako se radi o teškom TR-u, i to pri sljedećim indikacijama:
1) bolesnici s teškim primarnim TR-om i značajnom simptomatologijom;
2) bolesnici s teškim primarnim TR-om bez značajne simptomatologije, ali uz prisutnost značajne dilatacije desnoga ventrikula i progresivne desnostrane srčane slabosti;
3) bolesnici s teškim sekundarnim TR-om u odsustvu teške disfunkcije lijevoga ventrikula i plućne hipertenzije i uz značajnu simptomatologiju; te
4) bolesnici s teškim sekundarnim TR-om u odsustvu teške disfunkcije lijevoga ventrikula i plućne hipertenzije bez značajne simptomatologije, ali u prisustvu značajne dilatacije desnoga ventrikula i progresivne desnostrane srčane slabosti.
Kod bolesnika s teškim sekundarnim TR-om u prisustvu teške disfunkcije lijevoga ventrikula i/ili plućne hipertenzije operativno liječenje triksupidalnoga zaliska nije indicirano te se u tih bolesnika provode samo mjere konzervativnoga liječenja srčanoga popuštanja.
Briga za bolesnika s umjetnim srčanim zaliscima i njegovo liječenje danas zauzima bitno mjesto u svakodnevnoj kliničkoj praksi, s obzirom na to da je sve veći broj bolesnika kojima se oni ugrađuju. Razlikuju se dvije osnovne vrste umjetnih srčanih zalistaka: mehanički i biološki. U daljnjem tekstu bit će razmatrane osnovne razlike između umjetnih srčanih zalistaka, osnovne napomene pri izboru umjetnoga srčanog zaliska, antikoagulacijsko liječenje nakon ugradnje umjetnih srčanih zalistaka i preporuke za prekid antikoagulacijskoga liječenja prije planiranih invazivnih procedura te zbrinjavanje komplikacija umjetnoga srčanog zaliska.
VRSTE UMJETNIH SRČANIH ZALISTAKA
Umjetni srčani zalisci sastoje se od dva osnova dijela, a to su prsten koji se učvršćuje za miokard i okludirajući mehanizam koji predstavlja umjetne kuspise koji reguliraju protok krvi. Ovisno o materijalima od kojih su načinjeni, razlikujemo mehaničke zaliske (sintetski materijali) i biološke zaliske koji mogu biti homografti (dobiveni iz humanih preparata zalistaka) ili ksenografti (dobivenih iz životinjskih preparata zalistaka, obično svinje ili goveda). Glavna prednost mehaničkih zalistaka je dugotrajnost, dok je glavni nedostatak trombogenost koja zahtijeva trajno antikoagulacijsko liječenje. Nasuprot tome, biološki zalisci nemaju izraženu trombogenost zbog čega zahtijevaju kratku postoperativnu antikoagulacijsku terapiju, ali su podložni degenerativnim procesima zbog čega imaju kraći vijek trajanja.
IZBOR UMJETNOGA SRČANOG ZALISKA
Pri izboru umjetnoga srčanog zaliska (mehanički ili biološki) u obzir se uzima nekoliko parametara od kojih su najbitniji bolesnikova preferencija, rizik od krvarenja i postojanje kontraindikacija za antikoagulacijsko liječenje te dob, odnosno očekivano trajanje života bolesnika.
Mehanički srčani zalistak ima prednost u sljedećim situacijama: 1) kod bolesnika koji nemaju kontraindikacije za dugotrajno anikoagulacijsko liječenje; 2) kod bolesnika koji imaju rizik od ubrzanoga pogoršanja strukture zaliska (mehanički su otporniji); 3) kod bolesnika koji su već na antikoagulacijskoj terapiji zbog mehaničke proteze na drugom mjestu; 4) kod bolesnika koji su mlađi od 60 godina (aortni zalistak), odnosno 65 godina (mitralni zalistak); 5) kod bolesnika koji imaju razuman očekivani životni vijek (> 10 godina), a kod kojih je potencijalna ponovna operacija zaliska visoko rizična te 6) kod bolesnika koji su od ranije na antikoagulacijskom liječenju zbog rizika od tromboembolijskoga incidenta.
Biološki srčani zalistak ima prednost u sljedećim situacijama: 1) kod bolesnika koji inzistira na biološkom zalisku; 2) kod bolesnika koji se podvrgava operaciji zamjene mehaničkoga zaliska zbog tromboze unatoč odgovarajućem antikoagulacijskom liječenju; 3) kod bolesnika s malim rizikom od ponovne operacije zamjene zaliska; 4) kod mlađih bolesnica koje planiraju trudnoću; 5) kod bolesnika koji su stariji od 65 godina (aortni zalistak), odnosno 70 godina (mitralni zalistak) te 6) kod bolesnika čiji je životni vijek kraći od predviđenoga trajanja biološkoga zaliska (obično deset godina).
ANTIKOAGULACIJSKO LIJEČENJE BOLESNIKA S UMJETNIM SRČANIM ZALISCIMA
Kako je već navedeno, bolesnici s umjetnim srčanim zaliscima zahtijevaju antikoagulacijsko liječenje s ciljem sprečavanja tromboze zaliska i nastanka tromboembolijskoga incidenta. U nastavku su navedene preporuke za antikoagulacijsko liječenje bolesnika s mehaničkim i biološkim umjetnim zaliscima.
Preporuke za antikoagulacijsko liječenje bolesnika s mehaničkim srčanim zaliskom: 1) kod svih bolesnika indicirana je doživotna peroralna antikoagulacijska terapija varfarinom; 2) kod bolesnika kod kojih je indicirano privremeno prekidanje uzimanja varfarina prelazi se na primjenu niskomolekularnoga ili nefrakcioniranoga heparina; 3) dodavanje niske doze acetlisalicilne kiseline (75 - 100 mg/dan) varfarinu može se razmotriti kod bolesnika nakon tromboembolijskoga incidenta koji se dogodio usprkos održavanim ciljnim vrijednostima INR-a, kao i kod bolesnika s konkomitantnom aterosklerozom; 4) primjena direktnih antikoagulantnih lijekova kod ovih je bolesnika kontraindicirana. Ciljne vrijednosti INR-a kod ovih bolesnika prikazane su u Tablici 1.72.
|
Tablica 1.72. Ciljne vrijednosti INR-a za mehaničke umjetne zaliske
|
|
Sklonost proteze tromboziranju
|
Rizični čimbenici za trombozu vezani uz bolesnika
|
|
Bez čimbenika rizika
|
S jednim ili više čimbennika rizika
|
|
Niska sklonost
|
2,5
|
3,0
|
|
Srednja sklonost
|
3,0
|
3,5
|
|
Visoka sklonost
|
3,5
|
4,0
|
Preporuke za antikoagulacijsko liječenje bolesnika s biološkim srčanim zaliskom: 1) peroralna antikoagulacijska terapija varfarinom indicirana je kod svih bolesnika do tri mjeseca nakon ugradnje zaliska (kod ugradnje mitralnoga zaliska i do šest mjeseci); 2) doživotna primjena peroralne antikoagulacijske terapije indicirana je samo ako postoji neka druga indikacija za njezino provođenje (npr. opetovani plućni tromboembolizmi u podlozi nasljedne trombofilije); 3) kod zamjene aortnoga zaliska može se razmotriti i primjena niske doze acetilsaliciline kiseline (75 - 100 mg/dan) tijekom prva tri mjeseca od zahvata.
Antitrombocitno liječenje kod bolesnika s akutnim koronarnim sindromom i kod bolesnika koji su već na peroralnom antikoagulacijskom liječenju varfarinom zbog ugrađenoga umjetnog zaliska objašnjeno je u poglavlju o akutnom koronarnom sindromu bez elevacije ST-segmenta (vidi shemu).
Prekid antikoagulacijskoga liječenja za planirane invazivne zahvate predstavlja poseban problem i izazov kod ovih bolesnika te često ostaje na individualnoj procjeni liječnika. Kako bi se spriječila mogućnost krvarenja s jedne strane i tromboze umjetnoga zaliska s druge strane, potrebno je kod ovih bolesnika prekinuti uzimanje varfarina pet dana prije planiranoga zahvata te bolesnike prevesti na niskomolekularni heparin (najčešće enoksaparin). INR prije zahvata mora biti manji od 1,5. Ponovno uključivanje varfarina ovisi o riziku od krvarenja, što procjenjuje operater (obično je kod manjih elektivnih operacija tipa kolecistektomije ili hernioplastike to nakon dva do tri dana, dok kod operacija koje su praćene većim rizikom od krvarenja, kao što su to zahvati na velikim krvnim žilama, to može trajati i više tjedana). Niskomolekularni heparin primjenjuje se cijelo vrijeme dok se ponovno ne postignu ciljne vrijednosti INR-a nakon ponovnoga uključivanja varfarina.
PRAĆENJE BOLESNIKA S UMJETNIM SRČANIM ZALISCIMA
Bolesnici s umjetnim srčanim zaliscima zahtijevaju cjeloživotno praćenje od strane kardiologa. To u prvom redu podrazumijeva redovne ehokardiografske preglede kako bi se pratila njihova funkcija, ali i uočila moguća komplikacija (paravalvularno propuštanje - engl. leak, tromboza). Prvi ehokardiografski pregled indiciran je mjesec dana od zahvata, drugi nakon godine dana od zahvata, a dalje se provodi jednom godišnje. Pregled se obično izvodi transtorakalnim pristupom (TTE), no kod lošijega prikaza indiciran je transezofagealni pristup (TEE). Praćenje ovih bolesnika usmjereno je i na redovno određivanje vrijednosti INR-a kod bolesnika koji su na trajnoj antikoagulacijskoj terapiji varfarinom, što je nužno u pogledu titriranja doze lijeka i osiguranja ciljnih vrijednosti INR-a. Kod sumnje na disfunkciju umjetne valvule u cilju analize njegove morfologije indicira se i MSCT ili MR srca.
ZBRINJAVANJE KOMPLIKACIJA UMJETNIH SRČANIH ZALISTAKA
Tromboza. Tromboza mehaničkoga zaliska zahtijeva hitnu reoperaciju i zamjenu zaliska ako se radi o hemodinamski nestabilnim bolesnicima bez teških komorbiditeta, dok se fibrinoliza ostavlja kao alternativna mogućnost. Pri trombozi biološkoga zaliska najprije se preporuča terapija niskomolekularnim heparinom i/ili peroralnim antikoagulansom (varfarin) prije odluke o potrebi za reoperacijom.
Paravalvularno propuštanje (engl. paravalvular leak) podrazumijeva regurgitaciju krvi u području oko prstena mehaničkoga zaliska. Reoperacija kod ovih bolesnika indicirana je ako je ova pojava udružena s endokarditisom ili hemolitičkom anemijom, a kod bolesnika s visokim operativnim rizikom u obzir dolazi i transkateterska reparacija.
Slabljenje funkcije umjetnoga srčanog zaliska označava postupni gubitak njegove funkcije što se procjenjuje na temelju ehokardiografije, a najčešće se prezentira razvojem regurgitacije ili stenoze (povećanje transvalvularnoga gradijenta). Reoperacija takvih bolesnika indicirana je kod svih simptomatskih bolesnika, kao i asimptomatskih bolesnika s niskim operativnim rizikom. Kod bolesnika s disfunkcijom aortnoga umjetnog zaliska u obzir dolazi i transkataterska implantacija zaliska (TAVI).
Definicija. Prirođene srčane greške označavaju poremećaj u strukturi i/ili funkciji srca koji postoji od rođenja, a klinički se može očitovati i u odrasloj dobi. Prevalencija u općoj populaciji iznosi oko 1 % i predstavlja najčešće prirođene anomalije uopće. Zbog poboljšanja kirurške tehnike i metoda intenzivnoga liječenja u zadnjih pedesetak godina više od 90 % djece s kongenitalnim srčanim greškama preživljava i ulazi u odraslu dob te je stoga sve više odraslih osoba s kongenitalnim srčanim grešakama. Dio tih bolesnika odnosi se na one koji su asimptomatski i kojima srčana greška nije dijagnosticirana u djetinjstvu, nego kasnije, u odrasloj dobi.
Etiologija. Točni uzroci i mehanizmi prirođenih srčanih grešaka nisu u potpunosti poznati, a smatra se da određenu ulogu igraju genetika, vanjski čimbenici te bolesti majke. Kongenitalne srčane greške češće se javljaju pri određenim kromosomopatijama (npr. kod trisomije 13 i trisomije 21) ili genopatijama. Vanjski čimbenici koji se povezuju s kongenitalnim srčanim grešakama mogu biti biološki (toksoplazma, rubeola, citomegalovirus, herpes simpleks virus), kemijski (talidomid, fenitoin, toksini) i fizikalni (radijacija). Češća je pojavnost ovih bolesti i kod majki s nekim kroničnim bolestima (npr. dijabetes, alkoholizam).
Klasifikacija. Postoji nekoliko klasifikacija prirođenih srčanih bolesti. Najbitnije klasifikacije su patoanatomska i hemodinamska klasifikacija. Patoanatomska podjela zasniva se na morfološkim karakteristikama (defekti srčanih pregrada, spojevi između velikih arterija, stenoze ili atrezije srčanih zalistaka te abnormalni položaj srca ili krvnih žila), a hemodinamska na funkcionalnim karakteristikama. Hemodinamski, razlikuju se srčane greške sa spojevima (shunt) i bez spojeva. Greške sa spojevima mogu biti tipa lijevo-desnih spojeva ili spojeva bez cijanoze ili s kasnom cijanozom (ASD, VSD, PDA) ili desno-lijevih spojeva ili spojeva s ranom cijanozom (tetralogija Fallot, Ebsteinova anomalija). Greške bez spojeva su stenoze ili aterzije zalistaka, koarktacija, abnormalni položaji srca i velikih krvnih žila i sl.
Klinička slika. Bolest se ne mora manifestirati odmah u djetinjstvu, nego se može prvi puta manifestirati u odrasloj dobi. Većina tih bolesti ima dug asimptomatski period. Neke se mogu manifestirati odmah kod rođenja (greške s ranom cijanozom) i zahtijevaju hitno operativno liječenje. Kod ove djece često su oslabljeni rast i razvoj, česte su respiratorne infekcije i endokarditisi.
Standardni dijagnostički postupci su anamneza, fizikalni pregled, elektrokardiografija, pregledna radiološka snimka srca i pluća, ultrazvučni pregled, magnetna rezonancija, kataterizacija te angiokardiografija. Najbitnije je otkriti šum na srcu kod djece te ih pravovremeno poslati na ultrazvučni pregled.
Liječenje je konzervativno i kirurško. Konzervativno liječenje obuhvaća medikamentoznu terapiju (ograničavanje napora, profilaksa endokarditisa, liječenje aritmija i sl.). Kirurško liječenje podrazumijeva korektivne operativne zahvate kojima se rješavaju greške te palijativne zahvate koji se primjenjuju kod bolesnika kod kojih se ne može izvesti korektivna operacija, a cilj takvih zahvata je smanjiti (ublažiti) simptome.
PRIROĐENE SRČANE GREŠKE S LIJEVO-DESNIM SPOJEM
Najčešće prirođene srčane greške s lijevo-desnim spojem su atrijski septalni defekt (ASD), ventrikularni septalni defekt (VSD) te duktus arteriosus persistens (PDA).
ATRIJSKI SEPTALNI DEFEKT (ASD)
Definicija i tipovi. ASD je prirođena komunikacija između lijevoga i desnog atrija s patološkim protokom krvi iz lijevoga atrija u desni, tako da se povećava protok kroz desno srce i pluća. ASD je jedna od češćih kongenitalnih anomalija, koja se može po prvi puta očitovati u odrasloj dobi. Češće se susreće kod žena nego muškaraca. Razlikuju se tri tipa ASD-a (tip ostium secundum, tip sinus venosus, tip ostium primum). ASD tipa ostium secundum najčešći je tip (70 %) i nalazi se u području fose ovalis (srednji dio septuma). ASD tipa ostium primum predstavlja defekt donjeg dijela atrijskoga septuma koji je često udružen s rascjepom prednjega mitralnog kuspisa. Taj se oblik ASD-a često susreće kod osoba s Downovim sindromom. ASD tipa sinus venosus predstavlja defekt smješten visoko u atrijskom septumu, a s njime često dolazi i anomalni utok vena desnoga pluća u desni atrij. Zasebna anomalija je canalis atrioventricularis communis koju čine ASD tipa ostium primum i visoki VSD uz postojanje zajedničkoga atrioventrikularnog zaliska (poremećaj endokardnih jastučića).
Patofiziologija. Na dinamiku i razvoj bolesti najviše utječe veličina defekta. Mali defekti (< 0,5 cm u promjeru) dovode do neznatnoga šanta i ne dovode do većih hemodinamskih promjena, za razliku od većih defekata (> 2 cm u promjeru) koji su uzrok značajnijeg šanta i dovode do značajnijih hemodinamskih promjena. Zbog visokoga tlaka u lijevom atriju i veće popustljivosti desnoga atrija, krv teče iz lijevoga u desni atrij (lijevo-desni šant). To postupno dovodi do dijastoličkoga preopterećenja što vodi prema dilataciji i hipertrofiji desnoga srca, a povećani protok kroz plućne krvne žile dovodi do razvoja plućne hipertenzije. U konačnici, porast plućne vaskularne rezistencije (plućna hipertenzija) dovodi do dodatnoga opterećenja desnoga srca, porasta tlaka u desnom atriju i reverzije spoja (Eisenmengerov sindrom – opisano u nastavku). Reverzija spoja kod ASD-a rjeđa je pojava u odnosu na VSD i obično se ne dogodi prije trećeg desetljeća.
Klinička slika. ASD je dugo vremena asimptomatski. U pedijatrijskoj populaciji može biti povezan sa slabijim napredovanjem djeteta te sa sklonošću respiratornim infekcijama. Kliničke manifestacije rijetke su prije četvrtoga desetljeća života (atrijske aritmije, progresivna dispneja, simptomi desnostranoga srčanog zatajenja). Moguće komplikacije su paradoksalna embolija i cerebralni apsces, što je rjeđe.
Fizikalni nalaz. U auskultacijskom nalazu čujan je umjereno glasan, kratak mezosistolički šum, koji se najbolje čuje nad plućnim ušćem u drugom i trećem interkostalnom prostoru uz lijevi rub sternuma, a posljedica je povećanoga protoka krvi kroz pulmonalnu valvulu. Tipičan je rascjep drugoga srčanog tona koji se u inspiriju ne povećava, pa se naziva fiksnim rascjepom. Posljedica je produljenoga pražnjenja desnoga ventrikula.
Dijagnoza se postavlja na osnovi fizikalnoga nalaza, elektrokardiografije, ehokardiografije te kateterizacije srca u prijeoperativnoj obradi. U slučaju sumnje na kompleksniju anomaliju atrijskoga septuma preporuča se višeslojna kompjuterizirana tomografija ili magnetska rezonanca.
EKG najčešće pokazuje inkompletan blok desne grane, a mogu se registrirati i desna električna os, poremećaji stvaranja i provođenja impulsa u atrijima (atrijske ekstrasistole, atrijska fibrilacija, PR prolongacija) te znakovi dilatacije lijevoga atrija i hipertrofije desnoga ventrikula.
Radiogram srca i pluća pokazuje uvećanu desnu konturu srca (desni atrij i ventrikul), naglašenu plućnu vaskulaturu uslijed povećanoga protoka krvi te dilataciju zajedničke plućne arterije i većih ogranaka.
Ehokardiografija je danas zlatni standard u dijagnostici ASD-a. Ona omogućava uvid u morfološke promjene (dilatacija lijevih srčanih šupljina i plućne arterije te paradoksalno gibanje interventrikularnoga septuma kao posljedice volumnoga opterećenja desnoga ventrikula). Doplerskim pregledom moguće je odrediti točno mjesto defekta i pratiti tok krvi kroz njega. Ehokardiografija kombinirana s kontrastnom ehokardiografijom ukazuje na prolaz krvi iz jednoga u drugi atrij. U nejasnim situacijama transezofagealna ehokardiografija može dati više podataka i omogućiti bolju vizualizaciju defekta, osobito kod ASD-a tipa sinus venosus.
Kataterizacija srca potvrđuje dijagnozu s nalazom povišene saturacije kisika već u desnom atriju zbog prolaza saturirane krvi iz lijevoga u desni atrij. Indicirana je u prijeoperativnoj obradi, a uključuje određivanje veličine i položaja defekta, mjerenje plućnoga arterijskog tlaka, mjerenje plućnoga vaskularnog otpora te određivanje veličine lijevo-desnoga šanta (omjer sistemskoga i plućnog protoka - matematički izračun iz vrijednosti sistemske arterijske saturacije, miješane venske saturacije, plućne venske saturacije te plućne arterijske saturacije).
Liječenje. Asimptomatske bolesnike s malim defektima atrijskoga septuma i malim lijevo-desnim šantom nije potrebno specifično liječiti. Korekcija ASD-a u odrasloj dobi indicirana je kod svih bolesnika sa značajnim lijevo-desnim šantom (omjer plućnoga i sistemskog protoka veći od 1.5:1.0), u odsutnosti plućne hipertenzije. Korekcija greške može se izvoditi kirurškim putem ili perkutanom transkateterskom intervencijom. Korekcija greške ne preporučuje se kod asimptomatskih bolesnika s malim defektom i malim lijevo-desnim šantom, kao ni kod bolesnika s razvijenim Eisenmenergovim sindromom.
Prognoza. Bolesnici s malim defektima obično doživljavaju normalan životni vijek bez posebnih intervencija. Veći defekti koji dovode do značajnijega lijevo-desnog šanta klinički manifestni postaju uglavnom nakon 40. godine. Tada se javljaju srčane aritmije (osobito fibrilacija atrija) te srčano popuštanje koje je najčešći uzork smrti tih bolesnika. S obzirom na nizak rizik od razvoja bakterijskoga endokarditisa, standardna antibiotska profilaksa nije indicirana.
VENTRIKULARNI SEPTALNI DEFEKT (VSD)
Definicija. VSD je prirođena srčana greška s patološkom komunikacijom (defektom) između lijevoga i desnoga ventrikula te patološkim protokom krvi iz lijevoga u desni ventrikul. VSD je jedna od najčešćih (20 %) kongenitalnih srčanih grešaka s podjednakom učestalošću kod oba spola. Razlikuju se defekti membranskoga dijela septuma (80 %) i defekti mišićnoga dijela septuma (20 %). Gerbodeov defekt oblik je visokoga VSD-a koji omogućava komunikaciju između lijevoga ventrikula i desnoga atrija. Rogerova bolest je naziv za mali VSD koji ne stvara probleme, a često i spontano zacijeli.
Patofiziologija. Razvoj bolesti i nastanak reverzije spoja ovise o veličini defekta. Mali defekti uzrokuju nikakve ili minimalne funkcionalne smetnje i hemodinamske promećaje, s obzirom na to da je protok kroz plućne krvne žile minimalno povećan. Nasuprot tome, veliki defekti uzrokuju znatan lijevo-desni spoj s obzirom na to da je sistemski vaskularni otpor veći od plućnoga vaskularnog otpora, pa se krv iz lijevoga ventrikula vraća nazad u desni ventrikul kroz defekt. To dovodi do povećanoga protoka krvi kroz plućnu cirkulaciju, što izaziva niz funkcionalnih poremećaja i strukturnih promjena plućnih krvnih žila i postupno povećava plućni vaskularni otpor (razvoj plućne hipertenzije). S porastom plućnoga vaskularnog otpora smanjuje se i lijevo-desni spoj, a kada plućni vaskularni otpor bude jednak ili veći od sistemskoga vaskularnog otpora, dolazi do reverzije što znači da krv teče iz desnoga u lijevi ventrikul.
Klinička slika. Klinički tijek bolesti ponajprije ovisi o veličini defekta i prisutnosti plućne hipertenzije. Odrasle osobe s manjim defektima i normalnim plućnim vaskularnim otporom obično su bez simptoma. Kliničke manifestacije javljaju se s razvojem plućne hipertenzije što se obično viđa kod većih defekata. Postoji veća sklonost infekcijama, kao i poteškoće u razvoju kod djece. Početni simptomi su dispneja i hemoptize, a razvijena klinička slika podrazumijeva zatajenje desne strane srca. Reverzija protoka (Einsenmengerova reakcija), zbog sistemske hipoksemije, praćena je razvijem centralne cijanoze i batićastih prstiju.
Fizikalni nalaz. Auskultatorno čuje se sistolički šum nad Erbovom točkom u 3. i 4. interkostalnom prostoru parasternalno lijevo, gdje se ponekad palpatorno može osjetiti i strujanje krvi. Jačina šuma ne govori o veličini defekta. Manji defekti obično proizvode visoko-frekventni sistolički šum koji završava prije kraja sistole jer kontrakcija ventrikula dovodi do zatvaranja defekta. Veći defekti sa značajnijim lijevo-desnim šantom proizvode holosistolički šum koji se smanjuje paralelno s razvojem plućne hipertenzije i smanjenjem lijevo-desnoga šanta, odnosno smanjenjem protoka krvi kroz defekt.
Dijagnoza. Dijagnostički postupci uključuju elektrokardiografiju, rendgen srca i pluća, ehokardiografiju te druge slikovne metode i kakaterizaciju srca.
EKG može biti uredan ili pokazivati ponajprije znakove bolesti desnoga srca (hipertrofija desnoga ventrikula, dilatacije desnoga atrija, blok desne grane).
Rendgen srca i pluća dugo je normalan, a tek u kasnijim fazama prisutno je uvećanje desne srčane konture te znakovi plućne hipertenzije (uvećana sjena plućne arterije, pojačan plućni vaskularni crtež).
Ehokardiografija je zlatni standard u dijagnostici VSD-a, njome se prikazuju lokalizacija i veličina defekta te smjer protoka krvi kroz defekt. Osim toga, ehokardiografija ima ulogu u procjeni plućne hipertenzije mjerenjem njezinih neizravnih znakova (povećane dimenzije desnih srčanih šupljina, prisutnost i brzina trikuspidalne regurgitacije, TAPSE - tricuspid annular plane systolic excursion).
Višeslojna kompjuterizirana tomografija (MSCT) ili magnetna rezonanca (MRI) indicirani su kod sumnje na složenije kongeitalne anomalije.
Kateterizacija srca pokazuje porast saturacije kisika u desnom ventrikulu. Indicirana je u prijeoperacijskoj obradi. Tako se sa sigurnošću može izračunati plućni vaskularni otpor i stupanj plućne hipertenzije, s obzirom na to da je to ključno u procjeni operabilnosti defekta. Povećan plućni vaskularni otpor i povećan omjer plućnoga vaskularnog otpora i sistemskoga vaskularnog otpora govore u prilog inoperabilnosti. Osim toga, kateterizacija omogućava i određivanje veličine intrakardijalnoga lijevo-desnog šanta koja se izražava omjerom sistemskoga i plućnog protoka (matematički izračun iz vrijednosti sistemske arterijske saturacije, miješane venske saturacije, plućne venske saturacije te plućne arterijske saturacije). Mali lijevo-desni spojevi daju omjer manji od 1.5:1.0, srednje izraženi daju omjer od 1.5:1, a veliki daju omjer veći od 1.5:1.0. Tijekom kateterizacije se može i procijeniti vazoreaktivnost plućne arterije na primjenu vazodilatatora.
Liječenje. Mali defekti koji ne dovode do hemodinamskih poremećaja i kliničkih manifestacija ne zahtijevaju poseban oblik liječenja u smislu zatvaranja defekta (omjer sistemskoga i plućnog protoka < 1.5:1.0). Zatvaranje defekta kod odraslih osoba indicirano je kod postojanja većeg lijevo-desnoga šanta (omjer sistemskoga i plućnog protoka > 1.5:1.0), uz odsutnost plućne hipertenzije, tj. povišenih vrijednosti plućnoga vaskularnog otpora (plućna vaskularna rezistencija trebala bi iznositi manje od dvije trećine sistemskoga vaskularnog otpora). Zatvaranje se može izvršiti klasičnim kardiokirurškim zahvatom ili transkateterski pomoću ugradnje okludera. Kod odraslih osoba s razvijenom plućnom hipertenzijom zatvaranje defekta je kontraindicirano, jer bi neposredno nakon operacije i zatvaranja defekta (koji u ovakvim okolnostima služi kao ispušni ventil) došlo do desnostranoga srčanog popuštanja. Medikamentno liječenje u ovakvim se okolnostima zasniva na primjeni plućnih vazodilatatora, a treba uzeti u obzir i mogućnost kombinirane transplantacije srce-pluća ili transplantacije pluća sa zatvaranjem VSD-a. Profilaksa bakterijskoga endokarditisa preporuča se svim bolesnicima s nekorigiranim defektom ili kod bolesnika s rezidualnim šantom nakon kirurške ili perkutane intervencije.
Prognoza. U 30 do 40 % slučajeva dolazi do spontanoga zatvaranja defekta do druge godine života. Osobe s malim VSD-om, kao i osobe kod kojih je zatvaranje defekta učinjeno na vrijeme, imaju normalno očekivano trajanje života. Kod bolesnika s velikim defektom srčano zajatenje se razvija rano te bolesnici obično ne žive više od 40 godina bez intervencija.
DUKTUS ARTERIOSUS PERSISTENS (PDA)
Anatomija. Ductus arteriosus (ductus Botali) spaja descedentnu aortu (distalno od polazišta lijeve potključne arterije) i lijevu plućnu arteriju. Za vrijeme intrauterinoga života otvorenim ga drže povišene razine prostaglandina i smanjena koncentracija kisika. On osigurava da oksigenirana krv iz placente obiđe neekspandirana pluća i rastereti ih da se mogu nesmetano razvijati. Poslije poroda dolazi do obrata razine prostaglandina i kisika što pogoduje zatvaranju Botalovoga duktusa i on se pretvara u ligamentum arteriosum.
Definicija. PDA označava perzistentnu komunikaciju između aorte i plućne arterije nakon rođenja putem Botalova kanala. Ova anomalija predstavlja ekstrakardijalni lijevo-desni šant. Češće se javlja kod ženske djece i nedonoščadi. Na zatvaranje Botalovoga kanala nekada je potrebno pričekati i do nekoliko dana poslije poroda.
Patofiziologija. Zbog povišenoga tlaka u aorti krv teče iz aorte u plućnu arteriju pa tako dovodi do povećanja protoka kroz plućnu cirkulaciju (primjer ekstrakardijalnoga lijevo-desnog spoja). Hemodinamske promjene ovise o veličini samoga duktusa. Veći duktusi omogućavaju značajniji protok krvi i značajnije povišenje protoka kroz plućnu cirkulaciju, što u konačnici dovodi do povećanja plućnoga vaskularnog otpora i razvoja plućne hipertenzije. Ipak, razvoj Eisenmengerova sindroma rijetko se susreće. Rijetko, duktus se može aneurizmatski promijeniti te kalcificirati uz mogućnost rupture i krvarenja.
Klinička slika. Ova se anomalija danas rijetko susreće u odrasloj dobi. Ako se radi o otvorenom duktusu manjega promjera, bolesnici su asimptomatski te osim auskultacijskih znakova nemaju drugih manifestacija, iako imaju povećan rizik od nastanka bakterijskoga endokarditisa. Duktusi većeg promjera obično ne daju simptome u djetinjstvu, ali u adolescenciji i mlađoj odrasloj dobi mogu izazivati umor, dispneju i palpitacije. U uznapredovalim slučajevima javljaju se znakovi srčanoga popuštanja (plućna hipertenzija, reverzija spoja).
Fizikalni nalaz. Glavni auskultacijski nalaz na srcu uključuje kontinuirani sistoličko-dijastolički šum („šum vodenoga čekića“) koji se najbolje čuje u prvom i drugom lijevom interkostalnom prostoru i lijevoj infraklavikularnoj regiji. Karakterističan je i divergentan krvni tlak, tj. snižene vrijednosti dijastoličkoga krvnog tlaka. U slučaju reverzije spoja javlja se tzv. diferencijalna cijanoza (cijanoza donjeg dijela tijela) koja se javlja zbog toga što otvoreni duktus vodi deoksigeniranu krv distalno od polazišta lijeve potključne arterije pa je krv za donje ekstremiteta siromašnija kisikom od one za gornje ekstemitete i glavu.
Dijagnoza. Klasična dijagnostička obrada uključuje elektrokardiografiju, rendgen srca i pluća, ehokardiografiju i/ili druge slikovne metode te rjeđe, kateterizaciju srca. Elektrokardiogram je normalan ili su prisutni znaci hipertrofije lijevoga ventrikula. Radiološki nalaz srca i pluća pokazuje povećan lijevi ventrikul, jače izraženi luk aorte te trunkus arterije pulmonalis. Ehokardiografija prikazuje povećan lijevi atrij i lijevi ventrikul te omogućava prikaz i veličinu spoja uz mjerenje hemodinamskih parametara. MSCT angiografija može dobro prikazati veličinu i položaj duktusa. Kateterizacija srca indicirana je u prijeoperacijskoj obradi.
Liječenje. Zatvaranje duktusa u odrasloj dobi preporuča se kod svih bolesnika sa značajnijim lijevo-desnim šantom u odsutnosti plućne hipertenzije. Zatvaranje se može izvršiti klasičnim kardiokirurškim zahvatom (ligatura ili presijecanje duktusa) ili perkutanom intervencijom (plasiranje u duktus smotuljka žice koji kasnije dovede do embolizacije i obliteracije duktusa). Kontraindikacije za zatvaranje duktusa su reverzija spoja i istodobna prisutnost srčanih grešaka s cijanozom (desno-lijevi šant). U slučaju postojanja plućne hipertenzije i kontraindikacija za zatvaranje duktusa, bolesnici mogu imati korist od plućnih vazodilatatora. Zbog sklonosti bolesnika s PDA-om bakterijskom endokarditisu, liječenje se preferira učiniti u djetinjstvu (optimalna dob za zatvaranje je između 3. i 4. godine). Ako se PDA otkrije odmah nakon rođenja, zatvaranje se može pokušati izazvati davanjem inhibitora sinteze prostaglandina (indometacin, ibubrofen).
Prognoza. Veliki duktusi i lijevo-desni šantevi ako se ne liječe na vrijeme nose visok rizik od smrti uslijed srčanoga zatajenja rano u životu. Manji duktusi kompatibilni su s dužim preživljenjem, a srčano zatajenje javlja se kasnije u životu. PDA je povezana i s češćom pojavnošću bakterijskoga endokarditisa i endarteritisa. Svim bolesnicima s PDA-om preporuča se profilaksa bakterijskoga endokarditisa.
PRIROĐENE SRČANE GREŠKE S DESNO-LIJEVIM SPOJEM
Najčešće prirođene srčane greške s desno-lijevim spojem su teralogija Fallot i Ebsteinova anomalija. U ovu skupinu ubrajamo i Eisenmenergov sidrom koji označava reverziju lijevo-desnoga spoja u desno-lijevi spoj.
EISENMENGEROV SINDROM
Definicija. Eisenmenergov sindrom označava reverziju lijevo-desnoga spoja (srčane greške bez cijanoze) u desno-lijevi spoj uslijed razvoja sekundarne plućne hipertenzije kao posljedice povećanoga plućnog krvotoka. Razvoj ovoga sindroma povezan je s lošijom prognozom i kliničkim ishodima.
Patofiziologija. Kod prirođenih srčanih grešaka s lijevo-desnim spojem (ASD, VSD, PDA) zbog razlike u tlakovima između lijeve i desne strane srca i razlike u popustljivosti, krv prolazi kroz patološki defekt s lijeve na desnu stranu srca (povećan tlak lijevoga srca, povećana popustljivost desnoga srca). To izaziva volumno opterećenje desnoga srca i povećani protok krvi kroz pluća što s vremenom dovodi do povećanja plućne vaskularne rezistencije i pojave sekundarne plućne hipertenzije što onda dovodi i do tlačnoga opterećenja desnoga srca. I tlačno i volumno optrećenje srca dovodi do povećanja tlaka u njemu koji sada postaje viši nego u lijevom srcu i to dovodi do obrata u smjeru kretanja krvi i sad ona počinje teći iz desnoga u lijevo srce.
Klinička slika. S razvojem Eisenmenergova sindroma razvijaju se i umor, slaba tolerancija napora te dispneja. Često se javljaju i supraventrikularni poremećaji ritma kao što je atrijska fibrilacija i undulacija praćena palpitacijama. Zbog kronične hipoksemije kompenzacijski se razvija eritrocitoza te simptomi hiperviskoznosti (glavobolje, vrtoglavice, parestezije, hemoptize, cerebrovaskularni inzult). U konačnici se razvija slika srčanoga popuštanja. Glavni fizikalni znakovi su cijanoza i batićasti prsti. S razvojem Eisenmengerova sidroma opisani šumovi srčane greške polako slabe i nestaju.
Dijagnoza. Na Eisenmenergov sindrom u tijeku dijagnostičke obrade osnovne srčane greške treba posumnjati kada se otkriju radiološki ili ehokardiografski znaci plućne hipertenzije. Kod postavljene sumnje na ovaj sindrom, a osobito ako se planira korektivni zahvat, potrebno je izvršiti kateterizaciju srca (mjerenje tlakova, procjena veličine šanta).
Liječenje. Klasično korektivno liječenje srčanih grešaka u podlozi (zatvaranje defekta) nakon razvoja ovoga sindroma je kontraindicirano (tako bi optrećeni desni ventrikul izgubio jedini odušak za tlak, što bi dovelo do brzoga razvoja desnostrane srčane dekompenzacije). Liječenje Eisenmenergova sindroma može biti konzervativno i operativno. Konzervativno uključuje primjenu plućnih vazodilatatora, simptomatskoga medikamentnoga liječenja srčanoga popuštanja te povremenih venepunkcija zbog eritrocitoze. Kirurško liječenje podrazumijeva istodobnu korekciju srčane greške i transplantaciju pluća ili istodobnu transplantaciju srca i pluća. S obzirom na slabu dostupnost ovakvoga pristupa liječenju, kao i slab uspjeh, većina se bolesnika ipak liječi konzervativno. Ovi bi bolesnici trebali izbjegavati deplecije intravaskularnoga volumena, boravak na visokim nadmorskim visinama kao i korištenje sistemskih vazodilatatora. Ženama u fertilnoj dobi ne preporuča se trudnoća.
Prognoza. Načelno, progoza je loša. 80 % bolesnika umire unutar deset godina od postavljanja dijagnoze. Smrt je obično iznenadna, najvjerojatnije uslijed nastanka maligne aritmije. Drugi česti uzroci su srčani infarkt, moždani udar te masivna hemoptiza (posljedice eritrocitoze i hiperviskoznosti).
TETRALOGIJA FALLOT
Definicija. Tetralogija Fallot je desno-lijeva srčana anomalija koju karakterizira: plućna stenoza (obično valvularnoga tipa, rjeđe subvalvularna), veliki ventrikularni septalni defekt, dekstropozicija aorte koja jaše nad VSD-om te hipertrofija desnoga ventrikula. Ako nalazimo i ASD, govorimo o pentalogiji. S obzirom na to da se radi o kompliciranoj i teškoj srčanoj anomaliji koja se prezentira cijanozom od samoga rođenja, preživljenje i ulazak u odraslu dob omogućava samo na vrijeme učinjena kardiokirurška intervencija.
Patofiziologija. Najveće patofiziološko značenje imaju plućna stenoza i VSD. Plućna stenoza uvjetuje hipertrofiju desnoga ventrikula i porast tlaka koji postaje viši od tlaka u lijevom ventrikulu pa zato krv teče iz desnoga u lijevi ventrikul (desno-lijevi shunt). Također, uslijed plućne stenoze smanjen je protok krvi kroz pluća što pogoršava destauraciju i hipoksemiju. Korijen aorte obično je proširen, pa nalazimo i različit stupanj aortalne regurgitacije. Zbog toga se hipoksemija, cijanoza i policitemija javljaju već kod rođenja ili ubrzo nakon njega, te daljnje preživljenje ovisi o operativnom liječenju. U odrasloj su dobi hemodinamski poremećaji posljedica korektivnoga zahvata. U konačnom zbrinjavanju tetralogije Fallot zatvara se ventrikularni septalni defekt te se radi proširenje izlaznoga trakta desnoga ventrikula i pulmonalnoga ušća. Uslijed tih kirurških manipulacija često zaostaje određeni stupanj pulmonalne regurgitacije koji se s vremenom može pogoršavati te dovesti do razvoja zatajenja desne strane srca. Osim toga, ovi su bolesnici kasnije skloniji razvoju opasnih ventrikularnih aritmija.
Klinička slika. Tetraloga Fallot obično se očituje već kod rođenja ili ubrzo nakon njega. Glavne manifestacije su cijanoza, slabo napredovanje u rastu i razvoju, a kasnije se javljaju batićasti prsti te hiperviskozni sindrom uslijed policitemije. Bez kirurške intervencije većina djece umire u prvih deset godina života. Većina odraslih bolesnika s korigiranom tetralogijom Fallot su asimptomatski te normalno podnose fizičke napore i ne zahtijevaju specifičnu terapiju (osim profilakse bakterijskoga endokarditisa), sve dok se ne razvije zatajenje desne strane srca ili se ne pojave klinički značajne aritmije.
Fizikalni nalaz. Osobitosti fizikalnoga nalaza ovih bolesnika ovise o ranijim operativnim zahvatima. Razlike u jačini pulsnoga vala desne i lijeve radijalne ili brahijalne arterije može biti posljedica ranije kreiranoga sistemsko-pulmonalnog šanta (operacija kojom se nastoji privremeno poboljšati plućna cirkulacija i oksigenacija krvi) u kojoj se jedna od potključnih arterija spaja s plućnom arterijom pa je na toj strani oslabljen pulsni val. Jugularne venske pulsacije mogu biti posljedica trikuspidalne regurgitacije. Dominantni auskultacijski nalaz je dijastolički šum pulmonalne regurgitacije.
Dijagnoza. Praćenje operiranih bolesnika u odrasloj dobi uključuje evaluaciju elektrokardiograma, rendgena srca i pluća te ehokardiografskoga nalaza. U elektrokardiogramu obično nalazimo znakove hipertrofije desnoga ventrikula, skretanje električne osi udesno te blok desne grane. Bolesnici koji imaju QRS-kompleks širi od 180 sekundi imaju veći rizik od iznenadne srčane smrti te se takve bolesnike treba češće kontrolirati, a to uključuje češći Holter monitoring kako bi se uočili paroksizmi težih ventrikulskih aritmija. Širina QRS-kompleksa korespondira s veličinom desnoga ventrikula, a kod nekih bolesnika zapaženo je suženje QRS-kompleksa nakon smanjenja trikuspidalne regurgitacije nakon operativnoga zbrinjavanja pluće valvule. Radiogram srca i pluća prikazuje normalno veliko srce uz uzdignut vršak srca zbog hipertrofije desnoga ventrikula (srce poput klompe) te nešto uvećanu sjenu aorte položenu više u desnu stranu. Ehokardiografija ima ulogu u procjeni funkcije desnoga i lijevog ventrikula, procjeni pulmonalne regurgitacije ili eventualno aortalne regurgitacije uslijed dilatacije aorte. Morfološke promjene detaljnije mogu prikazati višeslojna kompjuterizirana tomografija ili magnetna rezonanca.
Liječenje. Tetralogija Fallot je apsolutna indikacija za operacijsko liječenje i treba ga izvesti što ranije. Ako je stanje djeteta teško, najprije se pristupa nekoj od palijativnih operacija kojima se nastoji poboljšati saturacija arterijske krvi, a to je najčešće tzv. Blalockov shut pri čemu se kreira spoj između sistemskoga i plućnoga krvotoka (najčešće između jedne od potključnih arterija i plućne arterije), kako bi se povećao protok krvi kroz plućnu cirkulaciju. Nakon poboljšanja stanja pristupa se korektivnom zahvatu koji se izvodi u ekstrakorporalnoj cirkulaciji, a kojim se rješava stenoza plućne valvule (valvulotomija ili infundibilektomija) te se zatvara ventrikularni septalni defekt. Reoperacija u odrasloj dobi najčešće je indicirana zbog razvoja teške pulmonalne regurgitacije ili rjeđe, pulmonalne restenoze. Danas se sve češće zamjena pulmonalnoga zaliska vrši transkateterskim putem. U 20 do 30 % bolesnika razvit će se i klinički značajne ventrikularne ili supraventirkularne aritmije koje će zahtijevati medikamentozno liječenje, elektrofiziološko ispitivanje i eventualnu radiofrekventnu ablaciju ili implantaciju kardioverter defibrilatora. S obzirom na visok rizik od razvoja infektivnoga endokarditisa, kod ovih je bolesnika indicirana antibiotska profilaksa prije dentalnih ili elektivnih kirurških zahvata.
Prognoza. Bolesnici s korigiranom tetralogijom Fallot u odrasloj dobi obično nemaju veće kliničke smetnje i žive normalnim životom. Glavni problemi u odrasloj dobi su razvoj pulmonalne regurgitacije i pojava srčanih aritmija, stoga je potrebno sve bolesnike redovno kardiološki kontrolirati i na vrijeme rješavati navedne kliničke smetnje.
EBSTEINOVA ANOMALIJA
Definicija. Ebstenova anomalija je anomalija trikuspidalne valvule pri čemu je ona pomaknuta u desni ventrikul tako da u konačnici imamo povećan desni atrij i smanjen desni ventrikul. Uz to obično nalazimo insuficijenciju trikuspidalne valvule, iako nekada ona može biti i stenozirana. Osamdeset posto bolesnika s ovom anomalijom ima i atrijski septalni defekt.
Patofiziologija. Težina hemodinamskih promjena ponajprije ovisi o veličini pomaka triksupidalnoga ušća te o funkcionalnom stanju samoga ušća (prisutnost regurgitacije ili stenoze). Bolesnici koji imaju mali pomak i koji nemaju izraženu trikuspidalnu regurgitaciju nemaju veće hemodinamske poromjene, a ako postoji i atrijski septalni defekt, šant može biti i lijevo-desni jer je tlak u lijevom atriju viši od onoga u desnom. Nasuprot tome, bolesnici s jakim pomakom trikuspidalnoga ušća i izraženom trikuspidalnom regurgitacijom imaju povećan tlak u desnom atriju koji nadilazi onaj u lijevom te dolazi do strujanja krvi iz desnoga u lijevi atrij što ovu anomaliju ubraja u srčane greške s desno-lijevim spojem.
Klinička slika. Klinička prezentacija ponajprije ovisi o težini morfoloških promjena tako da nalazimo širok raspon očitovanja, od teškoga zatajenja desnoga srca koje se razvija ubrzo po rođenju, do asimptomatskih odraslih bolesnika kojima se ova anomalija slučajno dijagnosticira. Dijagnoza se najčešće postavlja u ranom djetinjstvu u sklopu obrade incidentalnoga šuma koji se otkrije na sistematskom pregledu. Takva djeca mogu imati i različite stupnjeve usporenoga rasta i razvoja, brže se zamaraju te su sklonija respiratornim infekcijama. Ako se bolest manifestira u odrasloj dobi, to ujedno implicira i lakše morfološke promjene, a najčešće se prezentira nastupom supraventrikularnih aritmija.
Dijagnoza. Auskultacijski nalaz uključuje sistolički šum trikuspidalne regurgitacije koji se najbolje čuje nisko parasternalno lijevo. Elektrokardiogram obično uključuje znakove dilatacije desnoga atrija, desnu električnu os te blok desne grane. Česte su i supraventrikularne artimije. Ehokardiografski se ocjenjuje morfologija i veličina desnoga i lijevoga atrija, uočava prisustvo atrijskoga septalnog defekta te ocjenjuje funkcionalno stanje trikuspidalne valvule. Višeslojna kompjuterizirana tomografija i magnetna rezonanca pružaju detaljan morfološki pregled. Kateterizacija srca i angiografija provode se uglavom u prijeoperacijskoj obradi.
Liječenje. Kod asimptomatskih odraslih osoba nije potrebno specifično liječenje osim profilakse infektivnoga endokarditisa i redovnoga kardiološkog praćenja. Bolesnici sa simptomatskim zatajenjem desnoga srca zahtijevaju primjenu diuretika. U slučaju pojave aritmija liječenje se provodi prema uobičajenim smjernicama. Kirurško liječenje u odrasloj dobi rezervirano je za bolesnike koji ostaju simptomatski unatoč konzervativnom liječenju (zamjena trikuspidalnoga zaliska, popravak atrijskoga septalnog defekta).
PRIROĐENE SRČANE GREŠKE BEZ SPOJEVA
Najčešće srčane greške bez spojeva su koarktacija aorte, kongenitalne stenoze srčanih zalistaka, kompletna i korigirana transpozicija velikih krvnih žila, truncus arteriosus te abnormalni položaji srca.
KOARKTACIJA AORTE
Definicija. Koarktacija aorte srčana je anomalija karakterizirana suženjem lumena aorte koje je najčešće lokalizirano distalno do polazišta lijeve potključne arterije u blizini polazišta ligamenta arteriosuma (obiterirani duktus arteriosus). Dosta rjeđe, mjesto koarktacije proksimalno je od polazišta lijeve potključne arterije. Ova anomalija češće pogađa muški spol i često je povezana s gonadalnom disgenezom, a često su prisutne i druge pridružene anomalije, kao što su bikuspidalna aortalna valvula, defekti atrijskoga i ventrikulskog septuma te aneurizme Willisovoga arterijskog kruga u mozgu.
Patofiziologija. Posljedica suženja aorte je razvoj proksimalne hipertenzije (glava, vrat, gornji udovi) i distalne hipotenzije (trup, donji ekstremiteti). Kako bi se ublažio učinak suženja aorte, razvija se kolateralna cirkulacija od potključnih arterija preko arterija mamarija, interokostalnih i epigastričnih arterija prema ilijačnim arterijama. Kolaterale mogu biti toliko izražene da koarktacija aorte ostaje potpuno asimptomatska. Potpuna okluzija aorte rijetko se susreće, a da bi se takvo stanje bilo kompatibilno sa životom, ono podrazumijeva perzistenciju otvorenoga duktusa arteriosusa preko kojega descedentna aorta dobiva krv za trup i donje udove.
Klinička slika. Većina odraslih je bez simptoma. Simptomi koji se javljaju posljedica su proksimalne hipertenzije (glavobolja, epistakse, vrtoglavice, palpitacije) te distalne hipotenzije (intermitentne klaudikacije, hladnoća i bljedoća donjih udova). Komplikacije koje se povezuju s koarktacijom aorte su hipertenzija i hipertenzivna bolest srca (srčano popuštanje), disekcija aorte, ubrzani razvoj koronarne bolesti, infektivni endokarditis te cerebrovaskularni incidenti (obično udruženi s rupturom intracerebralnih aneurizmi). Kod dvije trećine odraslih bolesnika s nekorigiranom koarktacijom razviju se simptomi srčanoga zatajenja nakon četvrtoga desetljeća života.
Fizikalni nalaz. Glavni fizikalni nalazi su slabe i jedva opipljive femoralne pulsacije, dobro punjeni pulsevi na vratu i gornjim udovima te razlike u tlakovima između gornjih i donjih udova. Ako je koarktacija lokalizirana proksimalno od polazišta lijeve potključne arterije, postoje i razlike između tlakova na lijevoj i desnoj ruci. Jakost sistoličkoga šuma uslijed suženja aorte ponajprije ovisi o veličini suženja (veća suženja stvaraju veći šum), a kod razvijene kolateralne cirkulacije auskultacijom cijeloga prekordija može se čuti holosistolički žamor.
Dijagnoza. Na elektrokardiogramu se obično nalaze znakovi hipertofije lijevoga ventrikula te pomak električne osi ulijevo. Na preglednom radiogramu srca i pluća tipičan znak koarktacije aorte je znak broja 3 ili obrnutoga slova E koji nastaje uslijed suženja aorte te prestenotične i poststenotične dilatacije descedentne aorte. Ostali znakovi uključuju povećanu srčanu sjenu, utisnuća proširenih interkostalih arterija u području stražnjih trećina trećeg do devetoga rebra te povećanu sjenu lijeve potključne arterije. Najbolji uvod u lokalizaciju i opseg suženja aorte pruža MSCT ili MR angiografija nakon davanja kontrastnoga sredstva. Ehokardiografski se može pratiti trasstenotični gradijent koji je signifikantan kada je preko 20 mmHg. Kataterizacija je indicirana u prijeoperacijskoj obradi te u cilju procjene stanja koronarnih arterija u odraslih osoba.
Liječenje. Kirurški korektivni zahvat ili perkutana balonska angioplastika i stentiranje indicirani su kod bolesnika kod kojih je trasstenotični tlačni gradijent veći od 20 mmHg. Izbor načina korekcije (operacijski, perkutano) ovisi o dobi bolesnika, anatomskim posebnostima aorte te pridruženim bolestima. Kirurška resekcija i zamjena aorte nosi 1 – 4 %-tni rizik od smrtnoga ishoda. Kod velikoga dijela bolesnika i nakon korekcije suženja zaostaje hipertenzija (uslijed trajne endotelne disfunkcije, poremećaja renin-angiotenzin sutava), a moguće su i restenoze i aneurizmatske dilatacije u području koarktacije, stoga se ti bolesnici češće moraju pratiti slikovnim metodama (npr. MSCT angiografija).
Prognoza. Većina neliječenih bolesnika s težim oblicima koarktacije aorte umire od posljedica hipertenzije, rupture aorte, infektivnoga endokarditisa ili cerebralnoga krvarenja prije 50. godine života.
KONGENITALNE STENOZE SRČANIH ZALISTAKA
Kongenitalna aortalna stenoza. Aortalna stenoza česta je kongenitalna greška koja u većini slučajeva ostaje neprepoznata do odrasle dobi te ne pravi veće kliničke poteškoće. Ona može biti subvalvularna, valvularna te supravalvularna. Najčešći oblik je valvularna sortalna stenoza, najčešće povezana s biksupidnom aortalnom valvulom. Bikuspidalnu aortalnu valvulu nalazimo u 2 do 3 % opće populacije, a češća je kod muškoga u odnosu na ženski spol. Ona ne mora stvarati stenozu odmah u ranom djetinjstvu ili odrasloj dobi, nego stvara preduvjete za bržu degeneraciju i kalcifikaciju, pa stenoza postaje manifestna tek u starijoj životnoj dobi. 20 % bolesnika s bikuspidalnom aortalnom valvulom ima još neki udruženi poremećaj, kao što je koarktacija aorte ili perzistentni duktus arteroisus. Glavne kliničke značajke su: sinkope, angina pektoris i srčano popuštanje. Asimptomatske odrasle osobe imaju normalan očekivani životni vijek. Kada se jednom pojave simptomi, daljnje preživljenje je ograničeno: kada se jednom razvije angina pektoris medijan preživljenja je pet godina, tri godine nakon pojave sinkopa te dvije godine nakon razvoja srčanoga popuštanja. Zbog toga je kod svih simptomatskih bolesnika indicirana kirurška zamjena aortalnoga zaliska. Subvalvularna aortna stenoza posljedica je hipertrofije izlaznoga trakta lijevoga ventrikula što se može naći u nekim genetski uvjetovanim hipertrofičnim kardiomiopatijama. Supravalvularna aortalna stenoza podrazumijeva stenozu početnoga dijela ascedentne aorte što se može naći u sklopu nekih nasljednih sindroma (Williams-Beurenov sindrom), a klinička važnost leži u povećanom tlaku u koronarnim arterijama koje su onda podložne ubrzanoj aterosklerozi i razvoju koronarne bolesti. Više o hemodinamici, klničkoj slici, dijagnostici i liječnju aortalne stenoze nalazi se u dijelu o bolestima srčanih zalistaka.
Kongenitalna pulmonalna stenoza. Pulmonalna stenoza također je jedna od češćih kongenitalnih anomalija, a može se pojaviti kao izolirana anomalija ili u kombinaciji s drugim anomalijama (obično uz ventrikularni septalni defekt). Ovisno o mjestu stenoze, razlikuju se valvularna, subvalvularna i supravalvularna plućna stenoza. Valvularna stenoza je najčešći oblik plućne stenoze. Supravalvularna stenoza povezana je s rubeolarnom embriopatijom i posljedičnim suženjem početnoga dijela plućne arterije. Subvalvularna stenoza posljedica je hipertrofije izgonskoga trakta desnoga ventrikula (u sklopu nekih hipertrofijskih kardiomiopatija). Manje stenoze dugo ostaju asimptomatske, a veće dovode do razvoja slike zatajenja desne strane srca. Hemodinamske promjene, klinička slika, dijagnostika i liječenje detaljno su opisani u dijelu o bolestima srčanih zalistaka.
KOMPLETNA TRANSPOZICIJA VELIKIH ARTERIJA
Kompletna transpozicija velikih arterija kompleksna je anomalija kod koje aorta izlazi iz desnoga ventrikula, a plućna arterija iz lijevoga ventrikula stvarajući dvije odvojene, paralelne cirkulacije. Tako sva venska krv koja dospije u desno srce završava u aorti zaobilazeći pluća, a krv iz lijevoga ventrikula završava u plućima te se ponovno plućnim venama vraća u lijevi atrij. Ova anomalija spojiva je sa životom samo ako postoji dodatna srčana greška koja stvara komunikaciju između ova dva krvotoka. Većina bolesnika ima atrijski septalni defekt, a manji broj ima perzistentni duktus arteriorsus ili ventrikularni septalni defekt. Ova se anomalija češće susreće u dječaka i čini oko 10 % slučajeva srčanih grešaka koje se očituju cijanozom odmah po rođenju. Anomalija je klinički manifestna već po rođenju (dispneja, hipoksemija, dekompenzacija) te zahtijeva brzu dijagnostiku i liječenje. Prvi terapijski postupci uključuju davanje prostaglandina kako bi duktus arteriosus ostao što dulje prohodan ili stvaranje šanta između desnoga i lijevog atrija (atrijska septostomija balon-kateterom ili operativna atrijska septektomija). Totalna korekcija izvodi se kirurškim putem. Djeca koja se ne operiraju obično ne preživljavaju dugo, a dugoročno preživljenje nakon kirurške korekcije ponajprije ovisi o vrsti kirurške tehnike. Bolesnici kojima je napravljen tzv. atrijski switch (Mustardova ili Senningova operacija) imaju najbolji uspjeh, iako se i kod njih u oko 30 % slučajeva razvija trikuspidalna regurgitacija i zatajenje funkcije desnoga ventrikula do trećega desetljeća života.
KORIGIRANA TRANSPOZICIJA VELIKIH ARTERIJA
Korigirana transpozicija velikih arterija označava anomaliju u kojoj nalazimo transpozicije velikih krvnih žila, ali i ventrikula. Na desnoj strani nalazi se ventrikul građen poput lijevoga ventrikula (glatka stijenka, bikuspidalni zalistak), a na lijevoj se strani nalazi ventrikul građen poput desnoga ventrikula (trabekularna građa, trikuspidalni zalistak). Aorta zbog novoga položaja septuma ostaje vezana uz lijevostrani ventrikul koji prima arterijsku krv, a plućna arterija uz desnostrani ventrikul koji prima vensku krv. Ako nema drugih srčanih anomalija, cirkulacija se odvija normalno: krv iz desnoga atrija kroz bikuspidalnu valvulu dolazi u desni ventrikul (morfologija lijevog ventrikula) te u plućnu arteriju, a oksigenirana krv dolazi u lijevi atrij te kroz trikuspidalnu valvulu u lijevi ventrikul (morfologija desnog ventrikula) te u aortu. Često je prisutna trikuspidalna insuficijencija. Pacijenti nemaju većih smetnji osim čestih aritmija. Elektrokardiogram je promijenjen zbog inverzije ventrikula: Q-zubac nalazi se u desnim (III, aVF, V1), a odsutan je u lijevim odvodima. Glavne dijagnostičke metode su ehokardiografija i kateterizacija. Liječenje i prognozu određuju pridružene srčane anomalije.
TRUNKUS ARTERIOSUS
Truncus arteriosus rijetka je srčana anomalija kod koje postoji samo jedno arterijsko deblo koje izlazi iz srca i prima krv iz oba ventrikula, a grana se na koronarne arterije, plućne arterije i aortu. Uz ovu anomaliju često dolazi i VSD. Prema Collettu i Edwardsu razlikuju se četiri tipa ove anomalije. U tipu I iz zajedničkoga arterijskog debla izlaze aorta i zajednička plućna arterija. U tipu II nedostaje zajednička plućna arterija, nego lijeva i desna plućna arterija direktno polaze sa stražnje strane ascedentne aorte. U tipu III također nedostaje zajednička plućna arterija, a lijeva i desna pluća arterija polaze s lateralnih strana ascedentne aorte. U tip IV nedostaje zajednička plućna arterija, ali i njezini ogranci, a pluća dobivaju krv iz kolaterala koji polaze iz aorte kroz bronhijalne arterije. Kako plućne arterije izlaze iz aorte, visok tlak se prenosi na plućnu cirkulaciju pa se brzo razvija plućna hipertenzija i kongestija. Cijanoza se rjeđe nalazi jer je arterijska saturacija kisikom veća od 85 %. Glavni simptomi su simptomi plućne kongestije i srčane insuficijencije. Ako se greška ne liječi od rane dobi, prati je visoka smrtnost (75 %). Operativno liječenje potrebno je što ranije izvršiti.
ABNORMALNI POLOŽAJ SRCA
Dekstrokardija označava pomak srca u desni hemitoraks s apeksom usmjerenim udesno. Može biti kongenitalna i stečena. Kongenitalna može biti izolirana ili u sklopu situs inversus. Izolirana dekstrokardija obično je udružena s različitim drugim srčanim anomalijama, a također nalazimo i inverziju nekih abdominalnih organa. Stečena dekstrokardija nastaje kod kongenitalnih malformacija izvan srca (ageneza pluća, lijevostrana dijafragmalna hernija) ili kod atelektaze pluća, pulmektomije te pneumotoraksa. Sinus inversus označava potpuni obrnuti položaj i torakalnih i abdominalnih organa. Jetra i želudac zamijene strane, a atriji prate trbušne organe bez obzira na smještaj srca kao cjeline (desni atrij je na strani gdje je jetra). Srce je funkcionalno uredno. Mezokardija označava srce u sredini prsnoga koša. Uglavnom se javlja bez drugih anomalija.
FIZIOLOGIJA KRVNOGA TLAKA
Za potpuno razumijevanje nastanka arterijske hipertenzije, kao i za razumijevanje djelovanja pojedinih lijekova kojima se liječi arterijska hipertenzija, potrebno je razumjeti fiziologiju krvnoga tlaka. U ovom dijelu opisane su osnove fiziologije krvnoga tlaka.
Krvni tlak definira se kao sila kojom krv vrši pritisak na stijenku krvne žile. On ovisi o nekoliko čimbenika. Za osiguravanje normalnoga funkcioniranja organizma bitno je održavati krvni tlak u rasponu optimalnih vrijednosti, bez prevelikih oscilacija, što omogućavaju različiti mehanizmi koje je potrebno poznavati jer upravo na njih utječu lijekovi koje koristimo za regulaciju krvnoga tlaka.
Tri su glavna čimbenika koja definiraju krvni tlak: srčani minutni volumen, periferni otpor i količina cirkulirajućega volumena. Promjenom bilo kojega od navedenih čimbenika dolazi i do promjene krvnoga tlaka, bilo da se smanjuje, bilo da se povećava.
Srčani minutni volumen količina je krvi koju srce izbaci iz lijevoga ventrikula u jednoj minuti, a definira se umnoškom udarnoga volumena (količina krvi koju srce izbaci iz lijevoga ventrikula prilikom jedne kontrakcije, odnosno sistole) i srčane frekvencije. Ako se uzme da prosječan udarni volumen iznosi oko 70 mL, a srčana frekvencija 70 otkucaja u minuti, dobiva se da srčani minutni volumen iznosi oko 4 900 ml/min (cca 5 L). Što je srčani minutni volumen veći, viša je i vrijednost sistemskoga krvnog tlaka i obrnuto.
Periferni otpor je otpor što ga stvaraju stijenke krvnih žila dok krv teče kroz njih, a definiran je promjerom krvne žile. S obzirom na to da krvne žile, osobito arterije, imaju mišićni sloj, one mogu mijenjati svoj promjer (lumen). Kontrakcijom mišićnoga sloja dolazi do smanjenja promjera krvne žile (vazokonstrikcija), što uzrokuje veći otpor pri prolasku krvi pa je periferni otpor veći, a s porastom perifernoga otpora raste i krvni tlak, kao i obrnuto (relaksacijom mišićnoga sloja dolazi do povećanja promjera krvne žile – vazodilatacije, a to vodi padu perifernoga otpora, a time i krvnoga tlaka).
Treći je čimbenik količina cirkulirajućega volumena i odnosi se na količinu krvi u krvnim žilama. Što je veći volumen krvi u krvnim žilama, veći je i pritisak na stijenku krvne žile, pa je u konačnici i krvni tlak veći, a što je manji volumen krvi, manji je pritisak na krvni žile, pa tako i krvni tlak pada.
Nekoliko je mehanizama kojima se krvni tlak održava u optimalnim vrijednostima. Ugrubo ih se može svrstati u dvije kategorije: mehanizmi kratkoročne kontrole krvnoga tlaka i mehanizmi dugoročne kontrole krvnoga tlaka (Tablica 1.73.). Kratkoročna kontrola krvnoga tlaka podrazumijeva brzu (trenutnu) kontrolu, koja je upravljana živčanim mehanizmima, poglavito baroreceptorskim sustavom, dok je dugoročna kontrola krvnoga tlaka usko povezana s regulacijom volumena tjelesnih tekućina, prema tome u njoj dominantnu ulogu ima bubreg.
|
Tablica 1.73. Mehanizmi kontrole krvnoga tlaka
|
|
Mehanizmi kontrole tlaka koji djeluju u sekundama
|
Mehanizmi kontrole tlaka koji djeluju u minutama
|
Dugoročni mehanizmi kontrole tlaka
|
|
Baroreceptorski sustav
Kemoreceptorski sustav
Ishemijski mehanizam središnjega živčanog sustava
|
Sustav renin-angiotenzin
Stres-relaksacija krvnih žila
Pomak tekućine kroz stijenku krvnih kapilara
|
Sustav bubrezi-tjelesne tekućine
|
Glavni mehanizam kratkoročne kontrole krvnoga tlaka je baroreceptorski sustav. U stijenci aorte i unutarnje karotidne arterije postoje receptori koji se nazivaju baroreceptorima. Oni daju informaciju o visini krvnoga tlaka te tu informaciju odašilju u središnji živčani sustav, točnije u produljenu moždinu gdje se nalazi vazomotorni centar. On prihvaća informacije i nalaže odgovor putem autonomnoga živčanog sustava. Ako je došlo do povišenja krvnoga tlaka, vazomotorni centar putem parasimpatičkih vlakana uzrokuje vazodilataciju (pad perifernoga otpora) i smanjenje srčane frekvencije, što dovodi do sniženja krvnoga tlaka, a ako je došlo do pada krvnoga tlaka, on putem simpatičkih vlakana dovodi do vazokonstrikcije (povećanje perifernoga otpora) i povišenja srčane frekvencije. Dakle, baroreceptorski sustav suprostavlja se sniženju i povišenju krvnoga tlaka djelujući na ukupni krvožilni otpor i srčanu frekvenciju te ga tako pokušava održati konstantnim. Također, ulogu vazomotornoga centra mogu pojačavati ili kočiti neki viši živčani centri, kao što su hipotalamus i moždana kora, u različitim okolnostima, kao što je npr. ishemija. Slično baroreceptorskom sustavu djeluje i kemoreceptorski sustav s tom razlikom da kemoreceptori bilježe promjene u sastavu krvi, osobito manjak kisika, višak ugljičnoga dioksida te višak vodikovih iona. Oni se aktiviraju kada padne arterijski tlak jer to ujedno znači manjak kisika te nakupljanje ugljičnoga dioksida i vodikovih iona.
Dugoročna kontrola krvnoga tlaka povezana je s regulacijom volumena tjelesnih tekućina, a u tome glavnu ulogu ima bubreg (sustav bubrezi-tjelesne tekućine). Kada se u tijelu nađe višak tekućine, volumen krvi i krvni tlak se povise. To povišenje tlaka djeluje na bubrege i oni počinju pojačano lučiti tekućinu, tj. povisuje se volumen izlučenoga urina, što se naziva tlačna diureza. Osim pojačanoga lučenja tekućine pri povišenom tlaku, bubreg pojačano uklanja natrij, što je tlačna natrijureza.
Osim sustavom bubrezi-tjelesne tekućine (tlačna diureza i natrijureza), bubrezi mogu regulirati tlak sustavom renin-angiotenzin. Renin je protein, odnosno enzim koji se stvara i otpušta iz bubrega kada dođe do pada arterijskoga tlaka (kod smanjenoga protoka krvi kroz bubrege). On se otpušta u sistemsku cirkulaciju gdje pretvara angiotenzinogen, protein koji se stvara u jetri, u angiotenzin I. Angiotenzin I se pri prolasku kroz pluća pretvara u angiotenzin II, a ključnu ulogu u toj pretvorbi ima angiotenzin konvertaza (ACE). Angiotenzin II ima dvojaku ulogu: djeluje kao snažan vazokonstriktor i tako izaziva povećanje perifernoga otpora, te potiče lučenje aldosterona, hormona kore nadbubrežne žlijezde koji djeluje na bubrege tako da zadržava tekućinu i u konačnici povisuje volumen cirkulirajuće tekućine. Konačni efekt je povišenje krvnoga tlaka.
PRIMARNA (ESENCIJALNA) ARTERIJSKA HIPERTENZIJA
Definicija. Primarna ili esencijalna arterijska hipertenzija naziv je za stanje trajno povišenoga sistoličkog i/ili dijastoličkoga tlaka u vrijednostima većima od 140/90 mmHg mjereno u ambulantnim uvjetima, koje nije posljedica specifičnih bolesti ili stanja. Prema smjernicama Europskoga kardiološkog društva u definiciji hipertenzije i vrijednosti krvnoga tlaka razlikujemo nekoliko kategorija: optimalan krvni tlak, normalan krvni tlak, visoko normalan krvni tlak, arterijska hipertenzija I., II. i III. stupnja te izolirana sistolička hipertenzija (Tablica 1.74.). Primarna hipertenzija čini 90 do 95 % svih slučajeva arterijske hipertenzije i predstavlja jedan od najznačajnijih kardiovaskularnih rizičnih čimbenika.
|
Tablica 1.74. Definicija arterijske hipertenzije i vrijednosti krvnoga tlaka prema ESC smjernicama iz 2018. g.
|
|
Kategorija
|
Sistolički krvni tlak (mmHg)
|
|
Dijastolički krvni tlak (mmHg)
|
|
Optimalan krvni tlak
|
< 120
|
i
|
< 80
|
|
Normalan krvni tlak
|
120 - 129
|
i/ili
|
80 – 84
|
|
Visoko normalan krvni tak
|
130 - 139
|
i/ili
|
85 – 89
|
|
Arterijska hipertenzija I. stupnja
|
140 - 159
|
i/ili
|
90 – 99
|
|
Arterijska hipertenzija II. stupnja
|
160 - 179
|
i/ili
|
100 – 109
|
|
Arterijska hipertenzija III. stupnja
|
≥ 180
|
i/ili
|
≥ 110
|
|
Izolirana sistolička hipertenzija
|
≥ 140
|
i
|
< 90
|
Epidemiologija. Arterijska hipertenzija kao jedan od najznačajnijih rizičnih čimbenika za razvoj kardiovaskularnih bolesti čini velik javnozdravstveni problem. Smatra se da od arterijske hipertenzije boluje više od 20 % ukupne populacije, dok je taj postotak kod osoba starijih od 65. godina znatno veći i čini i do 60 %. Pojavnost primarne arterijske hipertenzije ponajprije se povezuje s dobi te se njezina prevalencija povećava s godinama starenja i kod muškaraca i kod žena. Prevalencija arterijske hipertenzije u Europi procjenjuje se na 35 do 45 %, a prema rezultatima EH-UH studije iz 2007. godine, prevalencija arterijske hipertenzije u Republici Hrvatskoj iznosi 37,5 %. Također, smatra se da je arterijska hipertenzija odgovorna za 54 % cerebrovaskularnih incidenata te 47 % ishemijske srčane bolesti (koronarna bolest).
Etiopatogeneza primarne arterijske hipertenzije nije do kraja razjašnjena. Smatra se da nastaje kao rezultat međudjelovanja genetskih i vanjskih, egzogenih čimbenika koji mogu dovesti do poremećaja fizioloških mehanizama regulacije krvnoga tlaka. Temeljni patogenetski mehanizmi koji mogu dovesti do nastanka primarne arterijske hipertenzije su prekomjerna aktivacija simpatičkoga autonomnoga živčanog sustava, prekomjerna aktivacija sustava renin-angiotenzin-aldosteron te smanjenje tlačne natrijureze. U nastavku će biti navedeni najznačajniji etiološki čimbenici u razvoju primarne arterijske hipertenzije: genetski čimbenici, dob, pojačani unos soli, pretilost i drugi.
Dob. Povišenje vrijednosti krvnoga tlaka povezano sa starenjem predstavlja jednu od karakteristika starenja uopće. Ono je posljedica zamjene elastičnih vlakana kolagenim vlaknima u arterijskoj stijenci, zbog čega one postaju manje elastične i krute. To povećava periferni vaskularni otpor, a time i arterijski tlak. Ovaj proces dolazi do izražaja pri istodobnoj prisutnosti i drugih rizičnih čimbenika (singerizam).
Genetski čimbenik. Na genetsku predispoziciju kao rizični čimbenik u razvoju ovoga oblika hipertenzije ponajprije ukazuje sama činjenica da se arterijska hipertenzija češće javlja unutar nekih obitelji. Iako su provedena brojna istraživanja (analiza genske povezanosti) i nađeno je više genskih lokusa čije se promjene (SNP, engl. single nucleotide polymorphisms) povezuju s razvojem arterijske hipertenzije, niti jedan od njih nije snažno povezan s njezinim razvojem. Jedan od najčešće istraživanih gena koji se povezuju s nastankom arterijske hipertenzije je ACE gen čiji je DD genotip povezan s pojačanom produkcijom ovoga enzima, a time i s razvojem arterijske hipertenzije, dok su genotipovi II i ID povezani s niskom i srednje izraženom produkcijom ovoga enzima. Osim ovih genetskih poremećaja, do sada je otkriveno i trinaest gena čije su mutacije odgovorne za nastanak devet specifičnih sindroma čija je glavna karakteristika razvoj arterijske hipertenzije, zbog čega se ovi oblici arterijske hipertenzije izdvajaju u posebnu skupinu koju nazivamo monogenetske hipertenzije.
Prekomjeran unos soli. Poznata INTERSALT studija potvrdila je pozitivnu povezanost između pojave arterijske hipertenzije i pojačanoga unosa soli u prehrani (> 3 g/dan), kao i sniženje vrijednosti krvnoga tlaka kada se ograniči njezin unos. Pojačan unos soli povezuje se s retencijom tekućine te posljedičnim povećanjem intravaskularnoga volumena koji povećava srčani minutni volumen te uzrokuje perifernu vazokonstrikciju kao odgovor na povećanje minutnoga volumena (autoregulacijski mehanizam kojim se sprečava prekomjerna prokrvljenost tkiva u odsustvu pojačanih metaboličkih potreba). Povećani minutni volumen i periferna vazokonstrikcija uvjetuju povišenje vrijednosti krvnoga tlaka.
Pretilost zajedno s pojačanim unosom soli predstavlja jedan od najznačajnijih rizičnih čimbenika u razvoju primarne arterijske hipertenzije. Iako ovaj mehanizam nije još u potpunosti razjašnjen, smatra se da je povezan s povećanim cirkulirajućim volumenom kod ovih bolesnika, kao i pojačanom simpatičkom aktivnosti koja predstavlja kompenzacijski pokušaj da se sagori višak masnoga tkiva. Ulogu u nastanku arterijske hipertenzije imaju i različiti citokini koji nastaju u masnom tkivu, koji mogu izravno ili neizravno uzrokovati endotelnu disfunkciju i poremećaj vazodilatacijskoga i vazokonstrikcijskog odgovora.
Opstruktivna apneja u spavanju također se smatra bitnim rizičnim čimbenikom u razvoju arterijske hipertenzije. Ona je praćena ponavljajućim epizodama desaturacije arterijske krvi koja aktivira specifične kemoreceptore koje nalazimo u karotidnim tjelešcima i potom aktivira simpatički adrenergički sustav. Kod ovih se bolesnika pojačana simpatička aktivnost bilježi i tijekom budnoga stanja.
Ostali vanjski čimbenici koji se povezuju s razvoje arterijske hipertenzije su prekomjeran unos alkohola i pušenje (povećanje koncentracije cirkulirajućih katekolamina), smanjen unos kalija, smanjena tjelesna aktivnost, izloženost psihičkom stresu, kao i primjena nekih lijekova kao što su nesteroidni protuupalni lijekovi.
Patofiziologija. Kako je vrijednost arterijskoga tlaka određena vrijednostima minutnoga volumena i perifernoga otpora, koji su opet uvjetovani udarnim volumenom i srčanom frekvencijom (minutni volumen) te strukturom i funkcijom arterijske stijenke (periferni otpor), poremećaj bilo kojega od tih čimbenika može postati uzrokom razvoja arterijske hipertenzije. Prema tome, u razvoj primarne arterijske hipertenzije mogu biti uključeni različiti mehanizmi: 1) povećanje intravaskularnoga volumena (pojačani unos i zadržavanje natrija u organizmu); 2) pojačana aktivnost simpatičkoga autonomnoga živčanog sustava (cirkulirajući katekolamini pojačavaju srčanu kontraktilnost i frekvenciju te uzrokuju perifernu vazokonstrikciju pojačavajući periferni otpor); 3) pojačana aktivnost sustava renin-angiotenzin-aldosteron (u prisustvu primarne arterijske hipertenzije najčešće se povezuje s genetski uvjetovanim pojačanim stvaranjem angiotenzina II) te 4) remodelacija i upala arterijske stijenke koji dovode do krutosti i povećanja perifernoga otpora (ateroskleroza, prisutnost egzogenih toksina).
Klinička slika i kronične komplikacije arterijske hipertenzije. Arterijska hipertenzija sama po sebi predstavlja kod većine bolesnika asimptomatsku bolest koja postupno dovodi do brojnih komplikacija zbog čega se često i naziva tihim ubojicom. Manji broj bolesnika može imati različite simptome, a najčešći su dispneja (42 %), nervoza i razdražljivost (35 %), palpitacije (32 %), vrtoglavice i omaglice (30 %), perkordijalne boli (26 %), glavobolja i šumovi u ušima (23 %) te epistaksa (20 %). Najčešće kronične komplikacije neregulirane arterijske hipertenzije su hipertenzivna bolest srca, demencija i hipertenzivna cerebrovaskularna bolest, hipertenzivna bolest bubrega te hipertenzivna bolest krvnih žila.
Hipertenzivna bolest srca naziv je za skupinu morfoloških promjena na srčanom mišiću koje nastaju kao posljedica dugotrajne, neregulirane arterijske hipertenzije. Ona u prvom redu podrazumijeva hipertrofiju lijevoga ventrikula kao posljedicu dugotrajnoga tlačnog opterećenja (engl. afterload), koja može uzrokovati srčano popuštanje, ishemiju miokarda (koronarna bolest), pojavu malignih poremećaja srčanoga ritma, kao i iznenadnu srčanu smrt. Srčane komplikacije arterijske hipertenzije najčešći su uzrok morbiditeta ovih bolesnika.
Hipertenzivna cerebrovaskularna bolest skupni je naziv za komplikacije središnjega živčanog sustava koje se povezuju s povišenim vrijednostima krvnoga tlaka: cerebrovaskularni inzult, vaskularna demencija te hipertenzivna encefalopatija. Arterijska hipertenzija predstavlja jedan od najznačajnijih rizičnih čimbenika u razvoju ishemijskoga i hemoragijskoga cerebrovaskularnog inzulta te se snižavanjem vrijednosti krvnoga tlaka postiže značajno smanjuje njihove incidencije. Također, arterijska hipertenzija povezana je i s depozitima beta amiloida u središnjem živčanom sustavu, što je glavno obilježje vaskularne demencije. Hipertenzivna encefalopatija naziv je za komplikaciju arterijske hipertenzije koju karakterizira gubitak autoregulacijskoga mehanizma cerebralne perfuzije s posljedičnom hiperperfuzijom (vidi poglavlje: hipertenzivna urgencija i emergencija).
Hipertenzivna bolest bubrega jedan je od najznačajnijih uzroka bubrežnoga oštećenja i razvoja kronične bolesti bubrega u razvijenim zemljama. Osnovni mehanizam razvoja kronične bolesti bubrega uključuje hipertenzijom posredovano oštećenje preglomerularnih arteriola (glomerularna hiperperfuzija) koje u konačnici rezultira ishemijskim promjenama glomerula (segmentalna glomerularna skleroza) i postglomerularnih struktura. Početne promjene prezentiraju se asimptomatskim patološkim laboratorijskim nalazima (mikroalbuminurija) koje postupno progrediraju te završavaju terminalnom fazom bubrežnoga zatajenja koje će zahtijevati neki od načina nadomjesnoga liječenja bubrežne funkcije.
Hipertenzivna bolest krvnih žila. Arterijska hipertenzija predstavlja i jedan od vodećih rizičnih čimbenika u razvoju ateroskleroze, zbog čega se povezuje s pojavom disekcije i aneurizme aorte, kao i periferne arterijske bolesti. Smanjenjem vrijednosti krvnoga tlaka smanjuje se i rizik njihove pojavnosti.
Dijagnoza arterijske hipertenzije temelji se na metodama mjerenja arterijskoga krvnog tlaka. Kod svih bolesnika s postavljenom dijagnozom arterijske hipertenzije indicirana je dijagnostička evaluacija mogućih komplikacija, kao i probir bolesnika na sekundarne oblike arterijske hipertenzije.
Mjerenje arterijskoga tlaka osnovna je metoda na temelju koje se postavlja dijagnoza arterijske hipertenzije, i počiva na višekratnim mjerenjima vrijednosti krvnoga tlaka. Osnovne metode uključuju ambulantno i kućno mjerenje arterijskoga tlaka te kontinuirano mjerenje arterijskoga tlaka (KMAT). Na raspolaganju su i druge metode, kao što su mjerenje centralnoga arterijskog tlaka te mjerenje brzine pulsnoga vala.
Ambulantno mjerenje arterijskoga tlaka najčešći je oblik mjerenja arterijskoga tlaka i podrazumijeva njegovo mjerenje pri bolesnikovoj posjeti liječničkoj ordinaciji, dok je kućno mjerenje arterijskoga tlaka manje pouzdano, i primjenjuje se u evaluaciji antihipertenzivnoga liječenja, kao i kod sumnje na hipertenziju bijele kute ili maskirnu hipertenziju. Mjerenje se standardno vrši na nadlaktici, a osnovni preduvjet dobivanja odgovarajućih vrijednosti je pridržavanje pravila pravilnoga mjerenja arterijskoga tlaka.
Pravilno mjerenje arterijskoga tlaka zahtijeva poštivanje sljedećih uputa:
1) mjerenju arterijskoga tlaka pristupa se tek nakon što je ispitanik sjedio u miru najmanje tri do pet minuta na sobnoj temperaturi i ako je prošlo najmanje 30 minuta od zadnje konzumacije cigareta ili kofeinskoga napitka;
2) ispitanik sjedi na stolici sa spuštenim nogama s oba stopala na podu, noge ne smiju biti prekrižene, naslonjen je leđima na oslonac i rukom oslonjenom na podlogu stola u razini srca;
3) nadlaktica nad kojom se vrši mjerenje mora u potpunosti biti oslobođena od odjeće (potrebno je skinuti majicu ili košulju, a ne samo povući rukav prema gore);
4) kod mjerenja treba koristiti odgovarajuću veličinu manžete tlakomjera (dužina mora iznositi 80 %, a širina 40 % opsega nadlaktice mjereno na sredini nadlaktice);
5) kod postavljanja manžete na nadlakticu smještaj distalnoga ruba nadlaktice mora biti 2 do 3 cm iznad sredine lakatne jame što odgovara razini desnoga atrija, uz namještaj balona manžete na volarnoj strani ispružene ruke (ispravno postavljena manžeta je ona koja pokriva najmanje dvije trećine nadlaktice);
6) mjerenje se provodi u dva navrata s razmakom od dvije minute. Ako se vrijednosti razlikuju za više od 20/10 mmHg, pristupa se i trećem mjerenju, a konačni rezultat predstavlja srednju vrijednost zadnja dva mjerenja;
7) kod prvoga pregleda mjerenje se vrši na obje ruke, a u slučaju razlike u vrijednostima ubuduće se tlak mjeri na ruci s izmjerenim većim vrijednostima;
8) mjerenje arterijskoga tlaka treba izbjegavati na ruci koja je pogođena neurološkim deficitom ili na ruci na kojoj se nalazi arteriovenska fistula; te
9) pri prvom pregledu potrebno je izmjeriti i vrijednosti arterijskoga tlaka nakon 1. i 3. minute stajanja (normalno sistolički krvni tlak raste, a dijastolički pada u odnosu na vrijednosti dobivene u sjedećem položaju).
Ambulantno mjerenje arterijskoga tlaka nosi rizik od tzv. hipertenzije bijele kute koja podrazumijeva povišene vrijednosti arterijskoga tlaka u ambulantnom ili bolničkom okruženju, dok su vrijednosti arterijskoga tlaka u kućnim uvjetima uredne, što daje prednost drugim oblicima mjerenja (kućno mjerenje, kontinuirano mjerenje). Suprotna je hipertenziji bijele kute pojava tzv. maskirane, prikrivene hipertenzije koja podrazumijeva uredne ambulantne vrijednosti arterijskoga tlaka, dok su vrijednosti arterijskoga tlaka mjerene u drugim uvjetima povišene. I u tom slučaju bitnu ulogu ima kućno ili kontinuirano mjerenje arterijskoga tlaka. Hipertenzija bijele kute prisutna je kod oko 20 % populacije i ostaje otvoreno pitanje o njezinom utjecaju kao rizičnoga kardiovaskularnog čimbenika, dok je maskirana hipertenzija prisutna u oko 10 % populacije i za nju se zna da predstavlja jasan rizični kardiovaskularni čimbenik. Obilježja hipertenzije bijele kute i maskirane hipertenzije prikazane su u Tablici 1.75.
|
Tablica 1.75. Obilježja hipertenzije bijele kute i maskirane hipertenzije
|
|
Klinička sumnja na hipertenziju bijele kute
|
Klinička sumnja na maskiranu hipertenziju
|
|
Prvi stupanj arterijske hipertenzije pri ambulantnom mjerenju; ili
Visok arterijski tlak dobiven ambulantnim mjerenjima kod osoba s malim kardiovaskularnim rizikom te bez znakova oštećenja ciljnih organa.
|
Visoko normalan arterijski tlak pri ambulantnom mjerenju tlaka; ili
Normalne vrijednosti arterijskoga tlaka pri ambulantnom mjerenju kod osoba s visokim kardiovaskularnim rizikom ili uz znakove oštećenja ciljnih organa
|
Osnovne napomene pri kućnom mjerenju arterijskoga tlaka uključuju da se ono mora provoditi najmanje tijekom sedam dana, i to dva puta na dan (ujutro i navečer), a kod svakoga postupka arterijski tlak mjeri se dva puta (uzimaju se vrijednosti dobivene u prvom navratu, a kao konačna vrijednost uzimaju se srednje vrijednosti arterijskih tlakova dobivenih u drugom navratu mjerenja). Definicija hipertenzije pri kućnom mjerenju arterijskoga tlaka uključuje vrijednosti veće od 135/85 mmHg. Svi bolesnici moraju biti dobro educirani o mjerama pravilnoga mjerenja arterijskoga tlaka.
Kontinuirano mjerenje arterijskoga tlaka (KMAT) podrazumijeva mjerenje vrijednosti arterijskoga tlaka tijekom 24 ili više sati uz pomoć automatskoga oscilometrijskog tlakomjera koji se postavlja oko pasa spojenoga s pravilno namještenom manžetom na nadlaktici. Uređaj je programiran tako da tijekom dana mjeri vrijednosti tlaka svakih 15 do 20 minuta i svakih 30 minuta tijekom noći. Bolesnici za vrijeme mjerenja trebaju raditi uobičajene svakodnevne aktivnosti koje upisuju u dnevnik, uz izbjegavanje prekomjernoga fizičkog rada te uz napomenu ispružanja ruke tijekom samoga mjerenja. Osnovne indikacije za kontinuirano mjerenje arterijskoga tlaka su:
1) sumnja na hipertenziju bijele kute;
2) sumnja na maskiranu hipertenziju;
3) neusklađenost (nepodudaranje) između vrijednosti arterijskoga tlaka dobivenih kućnim i ambulantnim mjerenjem arterijskoga tlaka;
4) procjena rezistentne hipertenzije;
5) bolesnici s varijabilnim vrijednostima arterijskoga tlaka unutar istoga ili različitih posjeta;
6) praćenje antihipertenzivne terapije.
Pri interpretaciji nalaza KMAT-a određuje se broj ispravnih mjerenja (mora biti veći od 70 % ukupnih mjerenja), prosječan dnevni i noćni sistolički i dijastolički tlak, maksimalne i minimalne vrijednosti arterijskoga tlaka tijekom dana i noći, ukupna vrijednost dnevnoga i noćnoga arterijskog tlaka iznad normalne vrijednosti (UKIN za dan i noć), uočavanje jutarnjeg skoka tlaka te cijena tzv. diping statusa. Normalno se tijekom noći vrijednosti arterijskoga tlaka spuštaju za 10 do 20 % te se takvi ispitanici nazivaju diperi. Ako je taj pad manji od 10 %, govorimo o non-diperima, a ako je veći od 20 %, govorimo o ekstremnim diperima.
Definicija arterijske hipertenzije može se razlikovati u odnosu na metodu i način mjerenja arterijskoga tlaka kako je to navedeno u Tablici 1.76.
|
Tablica 1.76. Definicija arterijske hipertenzija utemeljena na različitim načinima mjerenja
|
|
Način mjerenja
|
Vrijednost sistoličkoga tlaka
|
Vrijednost dijastoličkoga tlaka
|
|
Ambulantno/hospitalno mjerenje
|
≥ 140 mmHg
|
≥ 90 mmHg
|
|
KMAT – cjelodnevni prosjek
|
≥ 130 mmHg
|
≥ 80 mmHg
|
|
KAMT – dnevni prosjek
|
≥ 135 mmHg
|
≥ 85 mmHg
|
|
KMAT – noćni prosjek
|
≥ 120 mmHg
|
≥ 70 mmHg
|
|
Kućno mjerenje (samomjerači)
|
≥ 135 mmHg
|
≥ 85 mmHg
|
Mjerenje centralnoga arterijskog tlaka predstavlja mjerenje vrijednosti tlaka u aorti i njezinim velikim ograncima. Iako ima bolju prediktivnost od brahijalnoga mjerenja, nije dio svakodnevne kliničke prakse. Centralni arterijski tlak niži je od brahijalnog, ali se starenjem ta razlika smanjuje. Referentne vrijednosti centralnoga arterijskog tlaka prikazane su u Tablici 1.77. Centralni arterijski tlak mjeri se ultrazvučnom metodom ili metodom aplanacijske tonometrije (izravno preko karotidne arterije ili neizravno preko radijalne arterije), a moguće je i putem posebnih oscilometrijskih uređaja. Temeljna indikacija za mjerenje centralnoga arterijskog tlaka je izolirana sistolička hipertenzija kod mlađih osoba gdje povišene vrijednosti sistoličkoga arterijskog tlaka dobivene brahijalnim mjerenjem mogu biti posljedica amplifikacije vala centralnoga tlaka koji je u tih bolesnika normalan.
|
Tablica 1.77. Referentne vrijednosti centralnoga arterijskog tlaka
|
|
Dob (godine)
|
Srednja vrijednost
|
Najniža vrijednost
|
Najviša vrijednost
|
|
20 – 30
|
101 mmHg
|
90 mmHg
|
112 mmHg
|
|
30 – 40
|
105 mmHg
|
94 mmHg
|
116 mmHg
|
|
40 – 50
|
108 mmHg
|
97 mmHg
|
119 mmHg
|
|
50 – 60
|
112 mmHg
|
101 mmHg
|
123 mmHg
|
|
60 – 70
|
115 mmHg
|
104 mmHg
|
126 mmHg
|
|
70 – 80
|
119 mmHg
|
108 mmHg
|
130 mmHg
|
|
80 – 90
|
122 mmHg
|
111 mmHg
|
133 mmHg
|
Mjerenje brzine pulsnoga vala (PWV, od engl. pulse wave velocity) predstavlja mjerenje kojim se dobiva uvid u krutost stijenki krvnih žila, i koje je prihvaćeno kao sastavni dio prvoga pregleda bolesnika s arterijskom hipertenzijom s ciljem otkrivanja oštećenja ciljnih organa. Vrijednost brzine pulsnoga vala > 10 m/s predstavlja graničnu vrijednost koja se smatra znakom oštećenja ciljnih organa. Osim starenja i arterijske hipertenzije, na ovu vrijednost utječu i druga patološka stanja, kao što su šećerna bolest, pušenje i sl. Mjerenje se vrši posebnim uređajem koji bilježi brzinu kretanja pulsnoga vala između karotidne i femoralne arterije uz pomoć tonometra koji se postavlja iznad karotidne arterije i manžete koja se postavlja oko bedra, što se prenosi u računalo, gdje se analizira i pretvara u krivulju pulsnoga vala.
Dijagnostička evaluacija. Kod svih bolesnika s dijagnosticiranom arterijskom hipertenzijom potrebno je izvršiti dijagnostičku evaluaciju kojoj je cilj otkriti eventualna oštećenja ciljnih organa i isključiti eventualne uzroke sekundarne arterijske hipertenzije. Inicijalnu dijagnostičku evaluaciju čine EKG, laboratorijska dijagnostika te ultrazvučni pregled bubrega s pregledom renalnih arterija (CDI). Prema potrebi, ovisno o dobivenim rezultatima, obrada se može proširiti i na druge dijagnostičke metode.
EKG je obvezan kod svih bolesnika s arterijskom hipertenzijom. Može biti uredan ili upućivati na prisutnu hipertenzivnu bolest srca s hipertrofijom lijevoga ventrikula, dilatacijom lijevoga atrija, poremećajima srčanoga ritma, što nalaže daljnju kardiološku obradu, odnosno ehokardiografiju te 24-satni Holter EKG pri sumnji na prisutnost poremećaja srčanoga ritma.
Osnovni laboratorijski nalazi uključuju određivanje sljedećih parametara krvi i urina: kompletna krvna slika, glukoza u krvi natašte, lipidogram (ukupni kolesterol, LDL-kolesterol, HDL-kolesterol i trigliceridi), ionogram (natrij, kalij), jetrene transaminaze, dušične metabolite (kreatinin, ureja); sediment urina, 24-satna proteinurija te omjer albimin/kreatinin u slučajnom uzorku urina. Na temelju nalaza serumskoga kreatinina potrebno je izračunati veličinu glomerularne filtracije. Kod bolesnika s graničnim vrijednostima glikemije preporuča se oralni test tolerancije na glukozu te glikozilirani hemoglobin (HbA1c). Navedene pretrage imaju ulogu u identificiranju drugih kardiovaskularnih rizika, kao i moguće povezanosti bubrega s arterijskom hipertenzijom.
Ultrazvučni pregled abdomena u prvom redu uključuje pregled bubrega i kanalnoga sustava kako bi se utvrdila eventualna povezanost arterijske hipertenzije i bolesti bubrega. CDI renalnih arterija ima ulogu u otkrivanju renovaskularne hipertenzije što je osobito važno kod mlađih bolesnika. Također, evaluacija nadbubrežnih žlijezda i aorte također ima bitnu ulogu kod ovih bolesnika zbog povezanosti arterijske hipertenzije s adenomima nadbubrežne žlijezde, kao i većom učestalošću aneurizama abdominalne aorte.
Pregled očne pozadine kao dio inicijalne obrade ne preporučuje se svim bolesnicima, nego samo ako se radi o bolesnicima sa šećernom bolesti, osobama mlađe životne dobi (< 35 godina) te kod bolesnika s rezistentnom hipertenzijom i/ili kliničkom slikom hipertenzivne krize.
Ostale dijagnostičke metode u evaluaciji ovih bolesnika ovise o kliničkoj indikaciji. Kod bolesnika sa sumnjom na hipertenzivnu cerebrovaskularnu bolest preporuča se CDI karotidnih arterija i arterija vertebro-bazilarnoga slijeva te CT ili MR mozga radi uočavanje eventualnih sitnih ishemija. Kod bolesnika s kliničkom slikom intermitentne klaudikacije indicira se određivanje pedo-brahijalnoga indeksa i, ovisno o nalazu, ultrazvučni pregled perifernih arterija.
Procjena kardiovaskularnoga rizika kod bolesnika s arterijskom hipertenzijom. Jedna od temeljnih odrednica pristupa liječenju bolesnika s arterijskom hipertenzijom, pored same vrijednosti krvnoga tlaka, procjena je kardiovaskularnoga rizika (desetogodišnji rizik od fatalnoga kardiovaskularnog događaja) prema kojemu se bolesnike svrstava u jednu od sedam kategorija: s niskim rizikom, s niskim do umjerenim rizikom, s umjerenim rizikom, s umjerenim do visokim rizikom, s visokim rizikom, s visokim do vrlo visokim rizikom te s vrlo visokim rizikom. Svrstavanje bolesnika u jednu od navedenih kategorija temelji se na vrijednosti arterijskoga tlaka te prisutnosti drugih kardiovaskularnih rizika, asimptomatskoga oštećenja ciljnih organa uzrokovanoga arterijskom hipertenzijom te prisutnosti kardiovaskularne, šećerne ili kronične bubrežne bolesti kako je to navedeno u Tablici 1.78.
|
Tablica 1.78. Procjena kardiovaskularnoga rizika kod bolesnika s arterijskom hipertenzijom
|
|
Stadij bolesti
|
Rizični čimbenici i oboljenja
|
Vrijednosti krvnoga tlaka
|
|
Normalan tlak
|
Prvi stupanj hipertenzije
|
Drugi stupanj hipertenzije
|
Treći stupanj hipertenzije
|
|
Stadij I
|
Bez drugih rizičnih čimbenika
|
Nizak rizik
|
Nizak rizik
|
Umjeren rizik
|
Visok rizik
|
|
1 ili 2 druga rizična čimbenika
|
Nizak rizik
|
Umjeren rizik
|
Umjeren do visok rizik
|
Visok rizik
|
|
>3 druga rizična čimbenika
|
Nizak do umjeren rizik
|
Umjeren do visok rizik
|
Visok rizik
|
Visok rizik
|
|
Stadij II
|
Oštećenje ciljnih organa, KBB 3. stadij ili DM bez komplikacija
|
Umjeren do visok rizik
|
Visok rizik
|
Visok rizik
|
Visok do vrlo visok rizik
|
|
Stadij III
|
Kardiovaskularno oboljenje, KBB 4. stadij, DM s komplikacijama
|
Vrlo visok rizik
|
Vrlo visok rizik
|
Vrlo visok rizik
|
Vrlo visok rizik
|
Legenda: KBB - kronična bolest bubrega, DM – šećerna bolest.
Pri tumačenju tablice kardiovaskularnoga rizika kod bolesnika s arterijskom hipertenzijom potrebno je poznavati ostale, druge kardiovaskularne rizike, odrednice asimptomatskoga oštećenja ciljnih organa uzrokovane arterijskom hipertenzijom te prisutne kardiovaskularne bolesti, što je pojašnjeno u Tablici 1.79.
|
Tablica 1.79. Kardiovaskularni rizici, odrednice oštećenja ciljnih organa i kardiovaskularna oboljenja
|
|
Dodatni kardiovaskularni rizici
|
Oštećenje ciljnih organa
|
Kardiovaskularno oboljenje
|
|
Muški spol;
Starija životna dob (> 65 godina);
Pušenje;
Hiperlipidemija;
Intolerancija glukoze;
Pretilost;
Prijevremena menopauza; te
Srčana frekvencija viša od 80/min.
|
PWV između karotidne i femoralne arterije > 10 m/s;
EKG i/ili ehokardiografski dokazana hipertrofija lijevoga ventrikula; Mikroalbuminurija;
Pedo-brahijalni indeks < 0,9; te
Znakovi retinopatije na ofalmoskopiji.
|
Cerebrorvaskularna bolest;
Koronarna bolest;
Srčano popuštanje;,
Patološki nalaz koronarografije;
Periferna arterijska bolest;
Fibrilacija atrija.
|
Liječenje arterijske hipertenzije podrazumijeva provođenje nefarmakoloških i farmakoloških mjera liječenja u svrhu postizanja ciljnih vrijednosti arterijskoga tlaka (Tablica 1.80.). Odluka o načinu liječenja ne temelji se samo na vrijednostima arterijskoga tlaka, nego ovisi i o ukupnom kardiovaskularnom riziku te prisutnosti oštećenja ciljnih organa. Iznesene preporuke o liječenju arterijske hipertenzije u nastavku teksta temelje se na smjernicama Europskoga kardiološkog društva iz 2018. godine.
Ciljne vrijednosti arterijskoga tlaka. Pri liječenju arterijske hipertenzije prvi cilj predstavlja snižavanje vrijednosti arterijskoga tlaka na vrijednosti niže od 140/90 mmHg u svih bolesnika te se, ako se to dobro tolerira, teži postizanju ciljnih vrijednosti od 130/80 mmHg ili niže. Kod bolesnika mlađih od 65 godina savjetuje se postizanje vrijednosti sistoličkoga krvnoga tlaka od 120 do 130 mmHg, dok se kod bolesnika starijih od 65 godina savjetuje postići sistolički krvni tlak od 130 do 140 mmHg. Ciljne vrijednosti tlaka kod ovih bolesnika ne bi smjele biti manje od 120 mmHg. Posebne skupine bolesnika čine bolesnici sa specifičnim komorbiditetima, kao što su šećerna bolest, koronarna bolest, kronična bolest bubrega te cerebrovaskularna bolest.
|
Tablica 1.80. Ciljne vrijednosti arterijskoga tlaka pri liječenju primarne arterijske hipertenzije
|
|
Kategorija
Bolesnika
|
Ciljne vrijednosti arterijskoga tlaka (mmHg)
|
|
18 – 64 god
|
65 - 79 god
|
> 80 god
|
|
Hipertenzija
|
120 - 130/70 - 79
|
130 - 139/70 – 79
|
130 - 139/70 - 79
|
|
+ šećerna bolest
|
120 - 130/70 - 79
|
130 - 139/70 – 79
|
130 - 139/70 - 79
|
|
+ koronarna bolest
|
120 - 130/70 - 79
|
130 - 139/70 – 79
|
130 - 139/70 - 79
|
|
+ kronična bolest bubrega
|
130 - 140/70 - 79
|
130 - 139/70 – 79
|
130 - 139/70 - 79
|
|
+ cerebrovaskularna bolest
|
120 - 130/70 - 79
|
130 - 139/70 – 79
|
130 - 139/70 - 79
|
Strategija liječenja arterijske hipertenzije. Kako je navedeno, liječenje arterijske hipertenzije sastoji se od primjene nefarmakoloških mjera (promjena životnih navika) te farmakoloških mjera liječenja (antihipertenzivni lijekovi). Nefarmakološke mjere provode se kod svih bolesnika, dok je primjena antihipertenzivnih lijekova indicirana za određene skupine bolesnika, što se temelji na vrijednosti arterijskoga tlaka, kardiovaskularnom riziku te prisustvu oštećenja ciljnih organa. Strategija liječenja arterijske hipertenzije prikazana je shematski (Slika 1.76.).
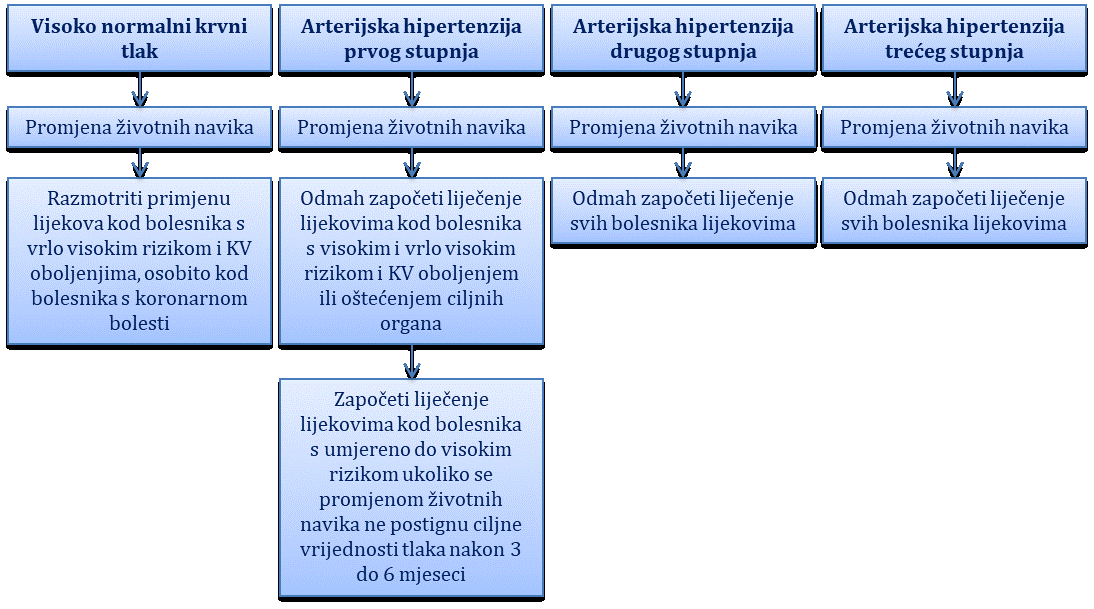
Slika 1.76. Shematski prikaz strategije liječenja primarne arterijske hipertenzije.
Nefarmakološke mjere liječenja predstavljaju promjenu životnih navika i čine osnovu liječenja arterijske hipertenzije bez obzira na primjenu lijekova te se primjenjuju u svim stadijima i oblicima arterijske hipertenzije. Najznačajnije nefarmakološke mjere liječenja arterijske hipertenzije su:
1) redukcija tjelesne težine (ciljni indeks tjelesne mase iznosi 20 do 25 kg/m2, svakako izbjegavati veći od 30 kg/m2);
2) smanjenje unosa soli (manje od 5 g/dan);
3) prestanak pušenja;
4) smanjenje unosa alkohola (za žene do 20 g/dan, za muškarce do 40 g/dan);
5) pridržavanje pravilne ishrane (tzv. mediteranski tip ishrane - voće, povrće, riba, maslinovo ulje, izbjegavanje zasićenih masnih kiselina);
6) osiguranje dostatnoga unosa kalija, kalcija i magnezija;
7) povećanje tjelesne aktivnosti (areobne vježbe - brzo hodanje, plivanje i sl., najmanje 30 minuta dnevno, više puta tjedno); te
8) izbjegavanje psihičkoga stresa uz primjenu metoda opuštanja.
Pridržavanje navedenih mjera u značajnoj mjeri smanjuje vrijednosti krvnoga tlaka, a time smanjuje i potrebu za farmakološkim intervencijama ili je umanjuje.
Farmakološke mjere liječenja primjenjuju se kod bolesnika kod kojih se ciljne vrijednosti krvnoga tlaka ne mogu postići pridržavanjem i provođenjem nefarmakoloških mjera liječenja, prema gore navedenim smjernicama strategije liječenja primarne arterijske hipertenzije. Danas postoji nekoliko skupina antihipertenziva kojima se može započeti liječenje (blokatori renin-angiotenzin sustava, blokatori kalcijskih kanala, diuretici, beta blokatori te ostali antihipertenzivi) pridržavajući se preporuka o izboru lijeka temeljeno na preferenciji pri određenim bolestima ili stanjima te uzimajući u obzir moguće apsolutne ili relativne kontraindikacije. Današnje preporuke upućuju na to da farmakološko liječenje arterijske hipertenzije kod većine bolesnika treba započeti dvojnom antihipertenzivnom terapijom (primjena dva antihipertenziva iz različitih skupina), dok je monoterapija opravdana samo za manji dio bolesnika. S obzirom na to da su istraživanja pokazala pozitivnu korelaciju između broja antihipertenziva koje bolesnici uzimaju i loše adherencije za lijek, danas se preferiraju fiksne kombinacije antihipertenziva u jednoj tableti (SPC, od engl. single pill combination). U nastavku teksta bit će iznesene osnovne karakteristike pojedinih skupina antihipertenziva te najčešći algoritmi farmakološkoga liječenja primarne arterijske hipertenzije.
Inhibitori angiotenzin konvertaze (ACE inhibitori) predstavljaju jedne od najčešće korištenih antihipertenziva u kliničkoj praksi (Tablica 1.81.). Primarni učinak ACE inhibitori ostvaruju inhibiranjem renin-angiotenzin sustava blokirajući angiotenzin konvertazu i na taj način pretvorbu angiotenina I u angiotenzin II. Posjeduju i druge učinke kao što su inhibicija razgradnje bradikinina koji stimulira stvaranje dušičnoga oksida i drugih vazodilatacijskih molekula, kao i smanjenje simpatičke adrenergičke aktivnosti. Većina lijekova dolazi u obliku predlijekova, a dominantni put izlučivanja je putem bubrega (osim fosinoprila i trandolaprila) koji se dijelom izlučuju putem jetre. ACE inhibitore karakterizira kardioprotektivan i nefroprotektivan učinak, kao i povoljan metabolički profil, što ih čini lijekovima izbora kod bolesnika s kroničnom kardiopatijom i nefropatijom. Najčešće nuspojave uključuju hipotenziju, umjeren porast dušičnih metabolita, hiperkalijemiju te kronični kašalj (posljedično povećanoj koncentraciji bradikinina). Angioedem je rijetka, ali potencijalno ugrožavajuća nuspojava ACE inhibitora. ACE inhibitori izrazito su teratogeni zbog čega se ne smiju primjenjivati kod trudnica. Najčešće korišteni ACE inhibtori su kaptopril (25 - 150 mg/dan), enalapril (5 - 40 mg/dan), lizinopril (5 - 40 mg/dan), perindopril (4 - 8 mg/dan), ramipril (1,25 - 20 mg/dan) te trandolapril (1 - 4 mg/dan).
|
Tablica 1.81. Kliničke karakteristike ACE inhibitora
|
|
Apsolutne kontraindikacije
|
Relativne kontraindikacije
|
Preporučena primjena
|
|
Trudnoća
Hereditarni angioedem
Hiperkalijemija (K > 5,5 mmol/L)
Bilateralna stenoza renalnih arterija
|
Žene u reproduktivnoj dobi koje ne koriste kontracepciju
|
Srčano popuštanje, hipertrofija LV-a
Koronarna bolest (stanje nakon AIM-a)
Dijabetička i nedijabetička nefropatija
Metabolički sindrom
|
Blokatori angiotenzinskih receptora (ARB) su lijekovi koji inhibiraju sustav renin-angiotenzin blokirajući vezanje angiotenzina II na specifične receptore i tako sprečavaju njegov učinak (Tablica 1.82.). Temeljni učinci i karakteristike jednaki su kao i kod ACE inhibitora te se prvenstveno koriste u liječenju bolesnika koji ne podnose primjenu ACE inhibitora (npr. kašalj). Antagonisti angiotenzinskih receptora pokazuju bolju zaštitu od moždanoga udara u odnosu na beta blokatore i ACE inhibitore. Kombinirana primjena ACE inhibitora i blokatora angiotenskih receptora se ne preporuča. Najčešće korišteni blokatori angiotenzinskih receptora su losartan (50 - 100 mg/dan), valsartan (80 - 320 mg/dan), kandesartan (8 - 32 mg/dan), eprosartan (400 - 800 mg/dan) te telmisartan (40 - 80 mg/dan).
|
Tablica 1.82. Kliničke karakteristike blokatora angiotenzinskih receptora
|
|
Apsolutne kontraindikacije
|
Relativne kontraindikacije
|
Preporučena primjena
|
|
Trudnoća
Hiperkalijemija (K > 5,5 mmol/L)
Bilateralna stenoza renalnih arterija
|
Žene u reproduktivnoj dobi koje ne koriste kontracepciju
|
Srčano popuštanje, hipertrofija LV-a
Koronarna bolest (stanje nakon AIM-a)
Dijabetička i nedijabetička nefropatija
Metabolički sindrom
|
Blokatori kalcijskih kanala snažni su antihipertenzivi koji svoj učinak postižu blokiranjem kalcijskih kanala, čime se sprečava utok kalcija u citoplazmu što dovodi do smanjenja intracitoplazmatske koncentracije kalcija. S obzirom na to da je za kontrakciju glatke muskulture potreban kalcij, taj manjak onemogućit će kontrakciju i dovesti do relaksacije glatke muskulature krvnih žila. Tako posredovana vazodilatacija smanjuje periferni otpor, a time i arterijski krvni tlak. S obzirom na to da kalcijske kanale osim u glatkomišićnim stanicama krvnih žila nalazimo i na drugim mjestima, kao što su srčane stanice (kardiomiociti), ovi lijekovi mogu imati i druge učinke kao što su usporavanje srčane frekvencije i atrioventrikularnoga provođenja. Za antihipertenzivno djelovanje bitan je učinak na glatkomišićne stanice krvnih žila (vaskularna selektivnost), dok se nastoji izbjeći učinak na kardiomiocite. Vaskularnu selektivnost nemaju starije generacije blokatora kalcijskih kanala, dok je novije generacije imaju te se stoga oni preferiraju u liječenju arterijske hipertenzije. Na temelju vaskularne selektivnosti, blokatore kalcijskih kanala dijelimo u dvije skupine: nedihidropiridini (verapamil, diltiazem) koji nisu selektivni i djeluju i na krvne žile i na srce te dihidropiridini (nifedipin, amlodipin, lacidipin) koji su selektivniji te poglavito djeluju na krvne žile (omjer učinka verapamila na krvne žile i miokard je 1:1, dok je amlodipina 10:1 ili kod novijih generacija, kao što je lacidipin, 100:1). Kao i ostali antihipertenzivi, blokatori kalcijskih kanala mogu se koristiti kao monoterapija ili u kombinaciji s drugim antihipertenzivima (inhibitori angiotenzin konvertaze, blokatori beta adrenergičkih receptora). Kombinacija blokatora kalcijskih kanala i diuretika nije se pokazala učinkovitom. Starije generacije, kao što je nifedipin, karakterizira veća učestalost nuspojava kao što su napadaji vrućine, crvenilo i glavobolja (posljedica dilatacije arteriola). Također, specifičnija nuspojava blokatora kalcijskih kanala su i edemi koji su posljedica dilatacije arteriola i promjene transkapilarnoga gradijenta tlaka, a ne zbog zadržavanja soli i vode. Blokatore kalcijskih kanala treba davati s oprezom kod bolesnika sa srčanim popuštanjem zbog njihova negativnoga inotopnog djelovanja. Amlodipin je jedini lijek iz ove skupine s utvrđenom sigurnošću kod bolesnika s teškim oblikom srčanoga zatajenja. Najčešće korišteni kalcijski blokatori su amlodipin (2,5 - 10 mg/dan), diltiazem (90 - 360 mg/dan), diltiazem SR (180 - 480 mg/dan), felodipin (2,5 - 10 mg/dan), lacidipin (2 - 6 mg/dan) i lerkanidipin (10 - 30 mg/dan). Kliničke karakteristike blokatora kalcijskih kanala prikazane su u Tablici 1.83.
|
Tablica 1.83. Kliničke karakteristike blokatora kalcijskih kanala
|
|
Apsolutne kontraindikacije
|
Relativne kontraindikacije
|
Preporučena primjena
|
|
SA ili AV blok
Teška disfunkcija LV-a (EF < 40%)
Srčana frekvencija < 60/min
|
Opstipacija
|
Angina pektoris
Karotidna ateroskleroza
Supraventrikularna tahikardija
|
Beta blokatori su lijekovi koji svoj antihipertenzivni učinak ostvaruju djelujući na srce smanjujući njegovu kontraktilnost (negativno inotropno djelovanje) i frekvenciju (negativno kronotropno djelovanje), što dovodi do smanjenja srčanoga minutnog volumena. Osim toga, beta blokatori smanjuju otpuštanje renina te simpatičku adrenergičku aktivnost. Iako različiti beta blokatori imaju različita farmakodinamska i farmakokinetička svojstva, u konačnici svi imaju podjednak antihipertenzivni učinak. Jedno od osnovnih obilježja beta blokatora je kardioselektivnost, odnosno preferencija prema β1 adrenergičkim receptorima koji se nalaze u srcu u odnosu na β2 receptore koje nalazimo u bronhima i perifernim krvnim žilama čijom se stimulacijom izaziva bronhodilatacija i vazodilatacija, a blokadom suprotan učinak. Najznačajniji beta blokatori koji pokazuju sklonost srčanim β1 receptorima (tzv. selektivni beta blokatori) su atenolol, bisoprolol, esmolol, metoprolol i nebivolol. Beta blokatori s dodatnim vazodilatacijskim učinkom su karvediol (putem blokade α1 adrenergičkih receptora) te nebivolol (putem oslobađanja dušičnoga oksida). Beta blokatori (s iznimkom nebivolola) imaju loš metabolički profil (pogoršavaju hiperglikemiju i hiperlipidemiju) zbog čega se izbjegavaju kod bolesnika s metaboličkim sindromom, a najčešće nuspojave uključuju bronhospazam ili pogoršanje kroničnih opstruktivnih plućnih smetnji, Raynaudov fenomen, debljanje te erektilnu disfunkciju. Beta blokatori koji se najčešće primjenjuju u liječenju arterijske hipertenzije su: atenolol (25 - 100 mg/dan), bisoprolol (2,5 - 10 mg/dan), esmolol (25 - 300 mcg/kg/min), metoprolol (50 - 200 mg/dan) i nebivolol (2,5 - 10 mg/dan). Kliničke karakteristike beta blokatora prikazane su u Tablici 1.84.
|
Tablica 1.84. Kliničke karakteristike beta blokatora
|
|
Apsolutne kontraindikacije
|
Relativne kontraindikacije
|
Preporučena primjena
|
|
SA ili AV blok
Teška disfunkcija LV-a (EF < 40%)
Srčana frekvencija < 60/min
|
Metabolički sindrom
Intolerancija glukoze
Sportaši i fizički aktivne osobe
|
Koronarna bolest
Srčano popoštanje
Tahiaritmije
Trudnoća
|
Diuretici se ubrajaju među najstarije antihipertenzive. Oni svoj antihipertenzivni učinak primarno ostvaruju povećanjem diureze, tj. pojačanim izlučivanjem soli i vode iz organizma zbog čega se smanjuje cirkulirajući volumen, ali imaju i utjecaj na smanjenje perifernoga otpora dovodeći do vazodilatacije. Diuretici koji se koriste kao antihipertenzivi su tiazidski diuretici, diuretici koji štede kalij te diuretici Henleove petlje.
Tiazidski diuretici predstavljaju jedne od najstarijih antihipertenziva koji još uvijek zauzimaju vodeće mjesto u terapiji hipertenzije, bilo kao monoterapija (danas rijetko), bilo u kombinaciji s drugim antihipertenzivima. Učinak se postiže blokiranjem Na/Cl crpke u distalnom tubulu što uzrokuje pojačano lučenje natrija, a time i vode. Dugoročno tiazidi dovode i do vazodilatacije koja uzrokuje smanjenje perifernoga otpora. Tiazidi se često kombiniraju s drugim antihipertenzivima, osobito s beta blokatorima, ACE inhibitorima te inhibitorima angiotenzinskih receptora, dok se kombinacija s blokatorima kalcijskih kanala nije pokazala tako učinkovitom. Glavne nuspojave su metaboličke: hipokalijemija, inzulinska rezistencija, hiperuricemija te hiperkolesterolemija. Ipak, tiazidi ostaju sigurni, učinkoviti i jeftini antihipertenzivi. Najčešći tiazidski diuretici u kliničkoj praksi su hidroklorotiazid (12,5 - 25 mg/dan), indapamid (1,25 - 2,5 mg/dan), klortalidon (12,5 - 25 mg/dan) te metolazon (2,5 - 10 mg/dan). Kliničke karakteristike tiazidskih diuretika prikazane su u Tablici 1.85.
|
Tablica 1.85. Kliničke karakteristike tiazidskih diuretika
|
|
Apsolutne kontraindikacije
|
Relativne kontraindikacije
|
Preporučena primjena
|
|
Giht (urična dijateza)
|
Metabolički sindrom
Intolerancija glukoze
Trudnoća
Hiperkalcijemija, hipokalijemija
|
Izolirana sistolička hipertenzija
Srčano popuštanje
Hipertenzija u crnoj rasi
|
Diuretici koji štede kalij imaju gotovo zanemariv učinak na regulaciju krvnoga tlaka, ali su dobri u kombinaciji s drugim diureticima jer sprečavaju gubitak kalija. Ipak, treba biti oprezan pri njihovoj primjeni, osobito kod bolesnika koji dodatno uzimaju preparate kalija zbog mogućega razvoja hiperkalijemije i posljedično opasne srčane aritmije. Predstavnik ove skupine je spirinolakton, antagonist aldosterona koji blokirajući aldosteronske receptore uzrokuje pojačano izlučivanje natrija, dok istodobno smanjuje izlučivanje kalija. S obzirom na to da se spirinolakton može vezati i na progesteronske i androgene receptore, može uzrokovati povećanje grudi kod muškaraca (ginekomastija), pojačanu dlakavost (hirzutizam) te poremećaje menstruacijskoga ciklusa kod žena. Zbog toga se danas češće koriste selektivniji antagonisti aldosterona, kakav je eplerenon, čime se izbjegava ovaj endokrinološko-metabolički učinak.
Diuretici Henleove petlje predstavljaju potentnije diuretike od tiazida je uzrokuju veću diurezu, ali u kliničkom pogledu predstavljaju slabije antihipertenzive. Tiazidi imaju manji diuretski i veći antihipertenzivni učinak, dok diuretici Henleove petlje imaju veći diuretski i manji antihipertenzivni učinak. Učinak postižu blokadom Na/K/Cl kotransportera na uzlaznom kraku Henleove petlje čime se pojačava izlučivanje natrija i vode, a slično kao i tiazidi, pri dugoročnoj primjerni djeluju i kao umjereni vazodilatatori. Ovi diuretici se u svrhu liječenja hipertenzije obično daju bolesnicima s oštećenom bubrežnom funkcijom, kroničnim srčanim popuštanjem ili kod bolesnika koji imaju izražene edeme iz bilo kojih drugih razloga. Predstavnik ove skupine je furosemid.
Ostali antihipertenzivi obuhvaćaju lijekove koji djeluju na α-adrenergičke receptore (blokatori α1 i agonisti α2 adrenergičkih receptora) te direktne vazodilatatore, a primjenjuju se kod bolesnika kod kojih se na temelju prethodno navedenih lijekova, tj. njihove kombinacije ne postiže zadovoljavajuća kontrola arterijskoga tlaka.
Blokatori α1-adrenergičkih receptora ili periferni alfa-adrenergički blokatori su lijekovi koji blokiraju α1- adrenergičke receptore koje nalazimo u krvnim žilama i čijom stimulacijom dolazi do vazokonstrikcije. Njihovom blokadom izaziva se vazodilatacija i pad perifernoga otpora što vodi padu krvnoga tlaka. Iako ovi lijekovi pokazuju dobar učinak u snižavanju krvnoga tlaka, studije su pokazale da ne dovode i do smanjenja morbiditeta i mortaliteta od kardiovaskularnih incidenata, pa nisu lijekovi prve linije antihipertenzivnoga liječenja te se obično koriste u kombinaciji s drugim antihipertenzivima. Glavne nuspojave su ortostatska hipotenzija, nestabilnost, mučnina i nemir. Predstavnici ove skupine su urapidil, doksazosin te prazosin.
Agonisti α2-adrenergičkih receptora su lijekovi koji stimulacijom α2-adrenergičkih receptora u vazomotornom centru smanjuju simpatičku adrenergičku aktivnost (tj. lučenje noradrenalina) čime se posreduje centralni antihipertenzivni učinak. Iako imaju snažni antihipertenzivni učinak, zbog izraženih nuspojava (ortostatska hipotenzija, pospanost, erektilna disfunkcija) ne koriste se kao lijekovi izbora. Mogu imati i opasnije nuspojave kao što su hemolitička anemija, trombocitopenija te leukopenija. Predstavnici ove skupine su metildopa te moksonidin. Metildopa je najčešće korišteni antihipertenziv u trudnoći.
Direktni vazodilatatori posreduju izravni učinak na glatkomišićne stanice arteriola u smislu relaksacije i posljedičnoga pada perifernoga otpora. Najpoznatiji predstavnik ove skupine je natrij-nitroprusid. U dodiru s eritrocitima (oksihemoglobin) molekula nitroprusida se raspada pri čemu se oslobađaju dušični oksid, cijanidi i methomoglobin koji su sastavni dio lijeka. Pad krvnoga tlaka uvjetovan je oslobađanjem molekule dušičnoga oksida, dok su oslobođeni cijanidi opasni i mogu uzrokovati metaboličke promjene (acidoza), aritmije i smetnje živčanoga sustava. Zbog svoga izraženoga antihipertenzivnog učinka, kao i zbog mogućih nuspojava, natrijev-nitroprusid se koristi samo u liječenju hipertenzivnih hitnoća.
Izbor antihipertenziva. Inicijalno liječenje arterijske hipertenzije temelji se na primjeni antihipertenziva iz pet osnovnih skupina: ACE inhibitori, blokatori angiotenzinskih receptora, kalcijski blokatori, tiazidi i tiazidima slični diuretici te beta blokatori. Primjena drugih, ostalih antihipertenzivna indicirana je u slučajevima kod kojih se primjenom ovih lijekova ne postižu ciljne vrijednosti arterijskoga tlaka. Inicijalno liječenje gotovo svih bolesnika temelji se na primjeni dva antihipertenziva iz različitih skupina i to u fiksnoj kombinaciji u jednoj tableti (SPC, engl. single pill combination). Pri tome se najčešće kombiniraju inhibitori renin-angiotenzin sustava (ACE inhibitori ili ARB) s kalcijskim blokatorima ili tiazidskim diureticima, dok se kombinacija beta blokatora i tiazidskoga diuretika rjeđe koristi i to u indikacijama kada je poželjna primjena beta blokatora (bolesnici s koronarnom bolesti, srčanim popuštanjem). Monoterapija kao inicijalno liječenje arterijske hipertenzije dolazi u obzir kod bolesnika s prvim stupnjem arterijske hipertenzije čije su vrijednosti sistoličkoga tlaka niže od 150 mmHg, kod bolesnika s visoko normalnim krvnim tlakom i vrlo visokim kardiovaskularnim rizikom te kod starijih bolesnika. Ako se dvojnom antihipertenzivnom terapijom ne postižu ciljne vrijednosti arterijskoga tlaka, kao drugi korak liječenja arterijske hipertenzije indicirana je trojna terapija, a ako niti trojna antihipertenzivna terapija ne dovodi do uspjeha, u trećem koraku liječenja indicira se dodatak antagonista mineralokortikoidnih receptora (spirinolakton, eplerenon) ili drugih antihipertenziva, kada nisu kontraindicirani. Primjena trojne antihipertenzivne terapije danas je također dostupna u obliku jedne tablete te se njihova primjena preporuča jednako kao i kod dvojne antihipertenzivne terapije, sve u cilju bolje suradljivosti bolesnika i redovnoga uzimanja lijekova. Bez obzira na primjenu antihipertenziva bolesnici moraju biti upoznati s važnosti nastavka provođenja mjera nefarmakološkoga liječenja jer antihipertenzivi nisu zamjena za njih, nego se provode zajedno, kao komplementrane metode liječenja koje se nadopunjavaju. U nastavku teksta bit će prikazan algoritam antihipertenzivne terapije bolesnika s nekompliciranom hipertenzijom, dok će liječenje hipertenzije kod bolesnika s najčešćim komorbiditetima biti posebno opisano.
Algoritam antihipertenzivne terapije bolesnika s nekompliciranom hipertenzijom:
1) inicijalno liječenje temelji se na dvojnoj antihipertenzivnoj terapiji koja uključuje ACE inhibitor ili blokator angiotenzinskih receptora s kalcijskim blokatorom ili tiazidnim diuretikom, a moguće je razmotriti monoterapiju kod bolesnika s prvim stupnjem arterijske hipertenzije čije su vrijednosti sistoličkoga tlaka niže od 150 mmHg, kod bolesnika s visoko normalnim krvnim tlakom i vrlo visokim kardiovaskularnim rizikom te kod starijih bolesnika (> 80 godina);
2) ako se navedenim liječenjem ne postižu ciljne vrijednosti arterijskoga tlaka, indicira se trojna antihipertenzivna terapija koju čine ACE inhibitor ili blokator angiotenzinskih receptora uz kalcijski blokator i tiazidski diuretik;
3) ako se niti trojnom terapijom ne postižu ciljne vrijednosti arterijskoga tlaka, govorimo o rezistentnoj arterijskoj hipertenziji te se kod tih bolesnika uz trojnu terapiju uvodi dodatni antihipertenziv, najčešće sprinolakton ili drugi antihipertenziv (drugi diuretik, alfa-blokator);
4) beta blokatore treba uključiti u terapiju u bilo kojemu koraku u liječenju ako bolesnici imaju za to specifičnu indikaciju kao što je srčano popuštanje, koronarna bolest, atrijska fibrilacija ili u mlađih žena koje planiraju trudnoću ili su trudne.
Liječenje i klinički pristup posebnim oblicima arterijske hipertenzije: rezistentna arterijska hipertenzija, hipertenzija bijele kute te maskirana hipertenzija.
Rezistentna hipertenzija definira se kao hipertenzija koja ostaje rezistentna unatoč provođenju preporučenih mjera liječenja koje obuhvaćaju nefarmakološke mjere i trojnu antihipertenzivnu terapiju, odnosno čije se vrijednosti ne spuštaju ispod 140/90 mmHg. Procjenjuje se da se prevalencija rezistentne hipertenzije među bolesnicima koji boluju od arterijske hipertenzije kreće između 5 i 30 %. Prije postavljanja dijagnoze rezistentne hipertenzije treba isključiti moguće uzroke tzv. pesudorezistentne hipertenzije, a oni uključuju: 1) lošu adherenciju bolesnika i neredovito uzimanje propisanih lijekova, 2) fenomen bijele kute (mjerenje povišenih vrijednosti tlaka u ambulantnim uvjetima), 3) lošu i neodgovarajuću tehniku mjerenja arterijskoga tlaka, 4) kliničku inerciju u pogledu neodgovarajuće kombinacije i/ili doze antihipertenzivnih lijekova te 5) izraženu kalcifikaciju brahijalne arterije što nerealno povisuje vrijednost izmjerenoga tlaka. Rezistentna hipertenzija češće se javlja kod starijih bolesnika (> 75 godina), pretilih bolesnika te bolesnika koji se ne pridržavaju nefarmakoloških mjera liječenja (pojačan unos soli i dr.). Ona može biti povezana s istovremenom primjenom drugih lijekova (oralni kontraceptivi, simpatomimetici, nesteroidni protuupalni lijekovi, eritropoetin, steroidi) ili se može raditi o neprepoznatoj sekundarnoj hipertenziji (primarni hiperaldosteronizam, aterosklerotska renovaskularna bolest, opstruktivna apneja u spavanju, kronična bolest bubrega.). U dijagnostici rezistentne hipertenzije najčešće se primjenjuje metoda kontinuiranoga mjerenja arterijskoga tlaka (KMAT), a kod svih je bolesnika potrebno isključiti uzroke pseudorezistentne hipertenzije te provesti dijagnosičku obradu s ciljem isključenja sekundarne arterijske hipertenzije. Liječenje rezistentne hipertenzije temelji se na naglašavanju nužnosti pridržavanja nefarmakoloških mjera liječenja, korekciji postojeće diuretske terapije te dodavanju dodatnoga antihipertenziva na postojeću trojnu terapiju. Korekcija postojeće diuretske terapije podrazumijeva podizanje doze postojećega diuretika (najčešće hidroklorotiazida) ili prelaskom na jači diuretik kao što je indapamid ili klortalidon, odnosno furosemid ako je glomerularna filtracija manja od 30 mL/min. Ako se ovom intervencijom ne postigne zadovoljavajuća regulacija arterijskoga tlaka, indicirano je uvođenje dodatnoga antihipertenziva. Najprije se uvodi antagonist mineralokortikoidnih receptora kakav je spirinolakton i to u dozi od 25 do 50 mg/dan, uz preduvjet da je glomerularna filtracija veća od 45 mL/min te da je koncentracija kalija manja od 4,5 mmol/L. Glavna ograničenja primjene ovoga lijeka su antiandrogene nuspojave kod muškaraca (ginekomastija, gubitak dlakavosti) te menstruacijski poremećaji kod žena. Kao zamjena za spirinolakton može se primijeniti selektivniji eplerenon u dozi od 50 do 100 mg/dan. Kod bolesnika koji uzimaju antagoniste mineralokortikoidnih receptora potrebne su redovne kontrole vrijednosti dušičnih metabolita i kalija na godišnjoj razini. Kao alternativa kod bolesnika kod kojih je kontraindicirana primjena antagonista mineralokortikoidnih receptora navode se bisoprolol (5 - 10 mg/dan) ili urapidil (dvaput po 30 mg/dan) ili neki drugi α1 blokator. Primjena centralnih antihipertenziva (moksonidin, metildopa) ostaje kao krajnja linija liječenja ovih bolesnika.
Hipertenzija bijele kute definira se povišenim vrijednostima arterijskoga tlaka pri ambulantnom mjerenju, dok u kućnim uvjetima bolesnici imaju normalne vrijednosti tlaka. Većinom se radi o arterijskoj hipertenziji prvoga stupnja. Hipertenzija bijele kute povezana je s povećanim rizikom od razvoja metaboličkih rizičnih čimbenika (hipelipidemija, hiperglikemija), kao i s asimptomatskim oštećenjem ciljnih organa, osobito cerebrovaskularne bolesti. Pristup ovim bolesnicima uključuje češće kontrole vrijednosti arterijskoga tlaka, kao i primjenu nefarmakoloških mjera liječenja. Jasnih preporuka o uključivanju lijekova kod ove skupine bolesnika nema te se to prepušta individualnoj procjeni, a svakako je opravdano kod bolesnika s visokim rizikom od razvoja cerebrovaskularne bolesti.
Maskirana hipertenzija odnosi se na pojavu pri kojoj bolesnici tijekom mjerenja arterijskoga tlaka u ambulantnim uvjetima imaju uredne vrijednosti, dok su one povišene u kućnim uvjetima odnosno izvan ambulante. Kod ovih bolesnika češće nalazimo istodobno prisutne metaboličke poremećaje kao što su hiperlipidemija i hiperglikemija te asimptomatska oštećenja ciljnih organa, a obično se susreće kod mlađih osoba. Pristup ovoj skupini bolesnika uključuje češće kontrole vrijednosti arterijskoga tlaka, primjenu nefarmakoloških mjera liječenja, a opravdana je i primjena antihipertenziva.
Liječenje hipertenzije kod bolesnika sa specifičnim komorbiditetima podrazumijeva liječenje hipertenzije kod bolesnika s najčešćim oboljenjima kao što su šećerna bolest, kronična bolest bubrega, kronična opstruktivna plućna bolest, koronarna bolest, sindrom srčanoga popuštanja, cerebrovaskularna bolest te fibrilacija atrija.
Šećerna bolest. Liječenje arterijske hipertenzije preporuča se za sve bolesnike sa šećernom bolesti čije vrijednosti tlaka prelaze 140/90 mmHg. Ciljne vrijednosti sistoličkoga tlaka kod ovih bolesnika su 120 - 130 mmHg za bolesnike mlađe od 65 godina (sistolički tlak niži od 120 mmHg se ne preporučuje), odnosno 130 - 139 za bolesnike starije od 65 godina, dok su ciljne vrijednosti dijastoličkoga tlaka za sve dobne skupine 70 - 80 mmHg (dijastolički tlak od 70 mmHg se ne preporučuje). Preporučeno inicijalno liječenje uključuje kombinaciju blokatora renin-angiotenzin sustava (ACE inhibitor ili ARB) te kalcijskoga blokatora ili tiazidskoga diuretika.
Kronična bolest bubrega. Liječenje arterijske hipertenzije preporuča se kod svih bolesnika s dijabetičkom i nedijabetičkom kroničnom bolesti bubrega kada su vrijednosti tlaka više od 140/90 mmHg. Preporučene ciljne vrijednosti arterijskoga tlaka za ove bolesnike iznose 130 - 139/70 - 80 mmHg. Preporučeno inicijalno liječenje ovih bolesnika čini kombinacija blokatora renin-angiotenzin sustava (ACE inhibitor ili ARB) s kalcijskim blokatorom ili diuretikom (tiazidski ili tiazidima slični diuretici kod očuvane glomerularne filtracije, odnosno diuretici Henleove petelje kod značajno narušene glomerularne filtracije < 30 mL/min).
Kronična opstruktivna plućna bolest. Zbog utjecaja na samu bolest, kao i liječenje (primjena beta agonista), kod ovih bolesnika treba izbjegavati primjenu neselektivnih beta blokatora (blokiranjem β2 receptora u bronhima inhibira se simpatikusom i/ili lijekovima izazvana bronhodilatacija). Također, kod ovih bolesnika treba izbjegavati i primjenu visokih doza diuretika zbog moguće hipokalijemije i njezinoga negativnog utjecaja na β2 receptore (bronhospazam), kao i poremećene bronhalne sekrecije (gusti, ljepljivi sekret). Lijekovi izbora za ovu skupinu bolesnika su blokatori renin-angiotenzin sustava (ACE inhibitor, ARB) te kalcijski blokatori. Opravdana je i primjena selektivnih beta blokatora ako ih bolesnici toleriraju. Inicijacija liječenja i ciljne vrijednosti arterijskoga tlaka jednake su kao i za populaciju bolesnika s nekompliciranom hipertenzijom.
Koronarna bolest. Liječenje arterijske hipertenzije opravdano je kod svih bolesnika s koronarnom bolesti. Ciljne vrijednosti sistoličkoga krvnog tlaka su 120 - 130 mmHg (ne manje od 120 mmHg) za bolesnike mlađe od 65 godina, odnosno 130 - 140 mmHg za bolesnike starije od 65 godina, dok su ciljne vrijednosti dijastoličkoga tlaka 70 - 80 mmHg (ne manje od 70 mmHg) za sve dobne skupine. Beta blokatori u kombinaciji s blokatorima renin-angiotenzin sustava (ACE inhibitor, ARB) čine osnovu liječenja hipertenzije ove skupine bolesnika. Primjena kalcijskih blokatora opravdana je kao alternativa beta blokatorima, a istodobna primjena s njima je rijetko indicirana i treba se izbjegavati.
Sindrom srčanoga popuštanja. Liječenje arterijske hipertenzije kod ovih je bolesnika indicirano kod vrijednosti arterijskoga tlaka veće od 140/90 mmHg. Ciljne vrijednosti tlaka jednake su kao i za bolesnike s koronarnom bolesti. Kod bolesnika sa srčanim popuštanjem (sa sniženom i s očuvanom istisnom frakcijom) preporuča se liječenje trojnom kombinacijom: blokator renin-angiotenzin sustava (ACE inhibitor, ARB), beta blokator i tiazidski diuretik, a prema potrebi se dodaje i antagonist mineralokortikoidnih receptora (spirinolakton). Kod bolesnika s izoliranom hipertrofijom lijevoga ventrikula (bez znakova srčanoga popuštanja) preporuča se dvojna terapija koju čine blokator renin-angiotenzin sustava (ACE inhibitor, ARB) te kalcijski blokator ili tiazidski diuretik, a ciljna vrijednost sistoličkoga tlaka u tih bolesnika iznosi 120 - 130 mmHg.
Cerebrovaskularna bolest. Kod bolesnika s akutnom intracerebralnom hemoragijom trenutno snižavanje vrijednosti arterijskoga tlaka nije preporučeno za bolesnike s vrijednostima sistoličkoga tlaka manjeg od 220 mmHg. Ako su vrijednosti sistoličkoga tlaka veće od 220 mmHg, preporuča se oprezno snižavanje do vrijednosti od 180 mmHg. Rutinsko snižavanje vrijednosti arterijskoga tlaka kod bolesnika s akutnim ishemijskim moždanim udarom nije indicirano, osim kod bolesnika koji ispunjavaju uvjete za trombolitičko liječenje za što se moraju postići vrijednosti manje od 180/105 mmHg prije i za vrijeme prva 24 sata liječenja. Kod bolesnika koji nisu kandidati za trombolitičko liječenje, ako se primjenjuju antihipertenzivi, vrijednost tlaka ne bi se smjela spustiti za više od 15 % tijekom prva 24 sata bolesti. Antihipertenzivno liječenje se kod bolesnika s cerebrovaskularnim događanjem preporuča odmah započeti ako se radi o tranzitornoj ishemijskoj ataci, odnosno nakon nekoliko dana ako se radi o inzultu. Preporučene vrijednosti sistoličkoga tlaka kod tih bolesnika iznose 120 - 130 mmHg. Preporučenu antihipertenzivnu terapiju čini blokator renin-angiotenzin sustava uz kalcijski blokator ili tiazidski diuretik.
Fibrilacija atrija. Beta blokatori ili nedihidropiridinski kalcijski blokatori čine sastavni dio liječenja fibrilacije atrija u svrhu kontrole frekvencije, s dodatnim antihipertenzivnim učinkom. Prisutnost arterijske hipertenzije kod bolesnika s fibrilacijom atrija dovoljan je rizični čimbenik da se uvede oralna antikoagulacijska terapija (CHA2DS2-VASc). Primjena oralnih antikoagulantnih lijekova trebala bi biti s oprezom kod bolesnika s izraženom hipertenzijom (> 180/110 mmHg) te je kod njih teže postići ciljne vrijednosti sistoličkoga tlaka od 130 - 140 mmHg. Ako se to ne može postići, preporuča se da bolesnici potpišu informirani pristanak o nastavku antikoagulacijskoga liječenja uzimajući u obzir rizik od možebitnoga krvarenja.
Kontrole i praćenje bolesnika. Nakon započinjanja liječenja antihipertenzivima, prvu kontrolu treba obaviti nakon ili unutar dva mjeseca kako bi se procijenilo odgovor na terapiju te uočile moguće nuspojave lijekova. Početni odgovor trebao bi se zamijetiti unutar jednoga do dva tjedna, a puni odgovor jasan je nakon dva mjeseca liječenja. Učestalost daljnjih kontrola ovisi o težini hipertenzije, postizanju ciljnih vrijednosti arterijskoga tlaka te bolesnikovoj suradljivosti, i uglavnom se provodi svakih tri do šest mjeseci. Dijagnostička evaluacija s ciljem otkrivanja oštećenja ciljnih organa trebala bi se provoditi najmanje svake dvije godine.
SEKUNDARNA ARTERIJSKA HIPERTENZIJA
Definicija i epidemiologija. Sekundarna arterijska hipertenzija (SAH) predstavlja oblik arterijske hipertenzije koji se povezuje s jasnim uzrokom čijom se dijagnostikom i liječenjem postiže zadovoljavajuća kontrola vrijednosti arterijskoga tlaka. Sekundarna arterijska hipertenzija čini između 5 i 15 % svih oblika AH-a s češćom pojavnošću među bolesnicima mlađe životne dobi. S obzirom na moguće izlječenje ovoga oblika AH-a, osobito kod mlađih bolesnika, prepoznavanje kliničkih ili laboratorijskih obilježja koji ukazuju na neki od oblika SAH-a ključni je dio kliničkoga pristupa na što je i usmjeren ovaj tekst, dok je detaljniji patofiziološki mehanizam opisan u odgovarajućim dijelovima.
Etiopatogeneza. Sekundarna arterijska hipertenzija može nastati uslijed različitih bolesti i stanja, među kojima su: 1) genetski uvjetovan SAH; 2) bolesti bubrežnoga parenhima i bubrežnih krvnih žila; 3) endokrinološki poremećaji; 4) kardiovaskularne bolesti; 5) SAH uzrokovan lijekovima te 6) ostali, rjeđi uzroci. U Tablici 1.86. su navedeni uzroci SAH-a prema učestalosti.
|
Tablica 1.86. Etiologija sekundarne arterijske hipertenzije
|
|
Česti uzroci sekundarne arterijske hipertenzije
|
Rjeđi uzroci sekundarne arterijske hipertenzije
|
|
Bolesti bubrežnoga parenhima
Bolesti krvnih žila bubrega
Primarni aldosteronizam
Opstruktivna apneja u spavanju
|
Cushingov sindrom
Hipo/hipertireoza
Feokromocitom
Koarktacija aorte
|
Bolesti bubrežnoga parenhima (renoprivna hipertenzija). Kronična bubrežna bolest jedan je od najčešćih uzroka SAH-a i nalazi se kod više od 85 % takvih bolesnika. Arterijska hipertenzija češće se razvija kod bolesnika s bolestima glomerula u odnosu na one s bolestima intersticija (npr. kronični pijelonefritis). Patofiziološki gledano, arterijska hipertenzija kod ovih bolesnika posljedica je dijelom povećanoga intravaskularnog volumena uslijed smanjene diureze, a dijelom pojačane aktivnosti sustava renin-angiotenzin i posljedične vazokonstrikcije. S obzirom na to da i sama hipertenzija uzrokuje promjene na bubrezima (nefroskleroza), nekada je teško procijeniti što je čemu prethodilo: hipertenzija bolesti bubrega ili bolest bubrega hipertenziji.
Bolesti krvnih žila bubrega (renovaskularna hipertenzija). Ovaj oblik sekundarne hipertenzije nastaje uslijed unilateralne ili bilateralne stenoze bubrežnih arterija koje dovode do hipoperfuzije bubrega i posljedične pojačane aktivacije renin-angiotenzin sustava. Ovaj oblik SAH-a može se naći kod 1 do 2 % bolesnika s AH-om. Najčešći uzrok kod bolesnika mlađe životne dobi je fibromuskularna displazija, dok je kod starijih bolesnika to aterosklerotska bolest renalnih arterija (vidi bolesti krvnih žila bubrega) Karakteristično, kod bolesnika s ateroskleotskom bolesti bubrežnih arterija moguća je pojava učestalih hipertenzivnih plućnih edema, što se naziva Pickeringov sindrom.
Primarni aldosteronizam najčešća je endokrinopatija povezana s razvojem SAH-a. Može biti povezana s unilateralnim funkcionalnim adenomom nadbubrežne žlijezde ili s bilateralnom adrenalnom hiperplazijom. Arterijska hipertenzija nastaje kao posljedica pojačanoga autonomnog stvaranja i izlučivanja aldosterona koji djeluje na distalni tubul dovodeći do zadržavanja natrija i tekućine (hipervolemija) uz pojačani gubitak kalija. Reninska aktivnost je kod ovih bolesnika snižena.
Opstruktivna apneja u spavanju (OSA, engl. obstructive sleep apnea) čest je uzrok SAH-a, a često se previđa i ne obraća mu se dovoljna pozornost. Mehanizam nastanka AH-a kod ovih bolesnika tumači se učestalim epizodama hipoksije tijekom noći što dovodi do pojačane aktivnosti simpatičkoga adenergičkog sustava, kao i aktivnosti renin-angiotenzin sustava. Kod ovih se bolesnika zapaža i veća učestalost generalizirane endotelne disfunkcije.
Cushingov sindrom. Arterijska hipertenzija kod bolesnika s Cushingovim sindrom posljedica je pojačanoga stvaranja i djelovanja kortizola (endogenoga ili egzogenog), hormona kore nadbubrežne žlijezde koji dovodi do retencije natrija i tekućine (hipervolemije) uslijed svojih mineralokortokoidnih učinaka, kao i do povišenih vrijednosti angiotenzinogena. Arterijska hipertenzija prisutna je kod više od 80 % bolesnika s Cushingovim sindromom.
Bolesti štitne žlijezde. Hipotireoza je najčešće povezana s izoliranim dijastoličkim AH-om koji nastaje kao posljedica periferne vazokonstrikcije kojom se nastoji održati perfuzija tkiva uslijed srčane slabosti izazvane manjkom hormona štitne žlijezde. Hipertireozu karakterizira pojačana kontraktilna snaga i srčana frekvencija, što povećava minutni volumen, a time i sistolički krvni tlak.
Feokromocitom je tumor srži nadbubrežne žlijezde karakteriziran pojačanim lučenjem katekolamina koji pojačavaju simpatičku adrenergičku aktivnost te tako dovode do povećanja arterijskoga tlaka. Kako se oni obično pulsatilno luče, tako je i bolest obilježena čestim skokovima vrijednosti arterijskoga krvnog tlaka, često u obliku hipertenzivnih kriza.
Koarktacija aorte rjeđi je uzrok SAH-a kod odraslih bolesnika, ali je kod djece i adolescenata na drugom mjestu po učestalosti. Točan patogenetski mehanizam kojim se objašnjava AH kod ovih bolesnika nije poznat (vjerojatno uzrokovan fizikalnim obilježjima bolesti – pojačana perfuzija gornjih dijelova tijela u odnosu na donje, ispod mjesta suženja aorte).
Lijekovi koji mogu uzrokovati sekundarnu hipertenziju su oralna kontracepcijska sredstva bazirana na estrogenima, nazalni dekongestivi (efedrin), kortikosteroidi, nesteroidni protuupalni lijekovi, stimulativne droge (amfetamini, kokain, ecstasy), preparati za mršavljenje (sibutramin, fenilpropanolamin) te neki kemoterapeutici i imunosupresivi lijekovi (ciklosporin, bevacizumab, sunitinib).
Monogenetske hipertenzije naziv su za rijetku skupinu SAH-a koje nastaju uslijed poremećaja jednoga gena odgovornoga za nastanak različitih genetskih sindroma koji među ostalim obilježjima imaju i AH. Najčešći primjeri su kongenitalna adrenalna hiperplazija, policistična bolest bubrega, Gordonov sindrom, Liddleov sindrom.
Učestalost pojedinih oblika sekundarne arterijske hipertenzije uvelike ovisi o dobi bolesnika kod kojih se razvije, što je i prikazano u Tablici 1.87.
|
Tablica 1.87. Dobna raspodjela uzroka sekundarne arterijske hipertenzije
|
|
10 do 20 godina
|
20 do 40 godina
|
40 do 65 godina
|
> 65 godina
|
|
Parenhimska bolest bubrega
Koarktacija aorte
Monogenetska hipertenzija
|
Parenhimska bolest bubrega
Fibromuskularna displazija
Monogenetska hipertenzija
|
Primarni aldosteronizam
Opstruktivna apneja u spavanju
Parenhimska bolest bubrega
Cushingov sindrom
Feokromocitom
|
Aterosklerotska bolest bubrežnih arterija
Parenhimska bolest bubrega
Bolesti štitnjače
|
Klinički pristup. Kako je već navedeno, ključni korak u kliničkom pristupu ovim bolesnicima je posumnjati na mogućnost SAH-a, što se obično temelji na samoj kliničkoj slici ili osnovnim laboratorijskim nalazima na temelju kojih se planira dodatna, ciljana dijagnostička obrada s ciljem potvrđivanja ili isključivanja SAH-a. Na moguću SAH upućuju sljedeće karakteristike: 1) pojava AH-a drugoga stupnja kod bolesnika mlađih od 40 godina; 2) akutno pogoršanje i brza progresija AH-a kod bolesnika za koje se zna da su do tada bili normotenzivni; 3) pojava rezistentnoga AH-a (AH kod kojeg se ne postižu ciljne vrijednosti arterijskoga krvnog tlaka unatoč trojnoj antihipertenzivnoj terapiji i nefarmakološkim mjerama liječenja); 4) bolesnici s trećim stupnjem AH-a i učestalim hipertenzivnim krizama bez obzira na dob i liječenje; 5) znakovi oštećenja ciljnih organa uvjetovanoga AH-om; 6) prisutnost kliničkih i/ili laboratorijskih nalaza svojstvenih endokrinološkim uzrocima AH-a; 7) prisutnost kliničkih obilježja opstruktivne apneje u spavanju te 8) prisutnost kliničkih znakova koji ukazuju na feokromocitom ili pozitivna obiteljska anamneza na feokromocitom. U Tablici 1.88. u nastavku navedeni su najčešći oblici SAH-a s glavnim kliničko-laboratorijskim obilježjima i preporučenim testovima kojima se potvrđuju.
|
Tablica 1.88. Klinička obilježja i dijagnostika najčešćih oblika sekundarne arterijske hipertenzije
|
|
Oblik sekundarne hipertenzije
|
Kliničko-laboratorijska obilježja
|
Preporučena dijagnostika
|
|
Parenhimska bolest bubrega
|
Hematurija, proteinurija, anemija
Nokturija, periferni edemi
|
Ureja, kreatinin, EGFR
Ultrazvuk bubrega
|
|
Fibromuskularna displazija bubrežnih arterija
|
Mlađe osobe, češće kod ženskoga spola
Auskultacijski šum periumbilikalno
|
CDI renalnih arterija
CT/MR angiografija
|
|
Aterosklerotska bolest bubrežnih arterija
|
Starije osobe, rizici ateroskleroze
Auskultacijski šum periumbilikalno
|
CDI renalnih arterija
CT/MR angiografija
|
|
Opstruktivna apneja u spavanju
|
Hrkanje, debljina, jutarnja glavobolja, cjelodnevna pospanost
|
Polisomnografija
|
|
Primarni aldosteronizam
|
Mišićna slabost
Hipokalijemija, hipernatrijemija
|
Serumski aldosteron i renin
Omjer aldosterona i renina
|
|
Feokromocitom
|
Epizodni simptomi
Pozitivna obiteljska anamneza
|
Metanefrini u serumu i 24-satnom urinu
|
|
Cushingov sindrom
|
Kušingoidni izgled
Hiperglikemija
|
Slobodni kortizol u 24-satnom urinu
|
|
Bolesti štitne žlijezde
|
Simptomi hipertireoze
Simptomi hipotireoze
|
TSH, slobodni T3 i T4
|
|
Koarktacija aorte
|
Razlike u tlakovima i pulsacijama gornjih i donjih ekstremiteta
|
Ehokardiografija, CT ili MR aortografija
|
Kod obrade bolesnika sa sumnjom na SAH obično se izvode sljedeće pretrage: 1) kompletna krvna slika i osnovni biokemijski nalazi (ureja, kreatinin, natrij, kalij, glukoza, jetrene transaminaze, lipidi); 2) hormoni štitne žlijezde (TSH, fT3. fT4); 3) reninska aktivnost plazme (PRA); 4) aldosteron, adrenokortikotropni hormon i kortizol u serumu; 5) slobodni kortizol, metanefrini i normetanefrini u 24-satnom urinu; 6) klirens endogenoga kreatinina; 7) proteini, natrij i kalij u urinu; 8) kontinuirano mjerenje krvnoga tlaka (KMAT) te 9) ultrazvuk bubrega i CDI renalnih arterija.
Specifična dijagnostička obrada, kao i liječenje i prognoza potvrđenoga uzroka sekundarne arterijske hipertenzije opisani su u odgovarajućim dijelovima.
Navedeni mehanizmi u normalnom okruženju omogućavaju zadovoljavanje potreba za povećanim metaboličkim potrebama, odgovarajuću perfuziju placente, kao i olakšanje gubitaka volumena tijekom samoga poroda (krvarenje). S druge strane, oni predstavljaju i određeni napor koji kod žena s postojećim srčanim oboljenjima može dovesti do njihove egzacerbacije, a u nekim situacijama mogu završiti i smrtnim ishodom.