BOLESTI BUBREGA I MOKRAĆNIH PUTEVA
Klinički pristup bolesniku s bolestima bubrega i mokraćnih puteva
Dijagnostički postupci u nefrologiji
Akutno bubrežno oštećenje
Kronična bubrežna bolest
Nadomještanje bubrežne funkcije
Uvod u glomerulske bubrežne bolesti
Najčešće glomerulske bolesti u kliničkoj praksi
Tubulointersticijske bubrežne bolesti
Vaskularne bubrežne bolesti
Cistična bubrežna bolest
Razvojni i nasljedni poremećaji bubrega
Infekcije mokraćnoga sustava
Nefrolitijaza i opstruktivna uropatija
Tumori mokraćnoga sustava
Literatura
KLINIČKI PRISTUP BOLESNIKU S BOLESTIMA BUBREGA I MOKRAĆNIH PUTEVA
U pristupu nefrološkim bolesnicima treba obratiti pozornost na osnovne simptome i znakove bolesti mokraćnoga sustava (poremećaji mokrenja, edemi, arterijska hipertenzija), pojavu patoloških nalaza u mokraći (proteinurija, cilindrurija, eritrociturija, hematurija) te nekih karakterističnih kliničkih nefroloških sindroma.
OSNOVNI SIMPTOMI I ZNAKOVI BOLESTI MOKRAĆNOGA SUSTAVA
POREMEĆAJI MOKRENJA
Poremećaji mokrenja jedan su od najčešćih simptoma i znakova koji se javljaju kod bolesnika s bolestima mokraćnoga sustava. Oni se dijele na poremećaje količine izlučene mokraće (oligurija/anurija, poliurija) te poremećaje ritma i kakvoće mokrenja (disurija, polakisurija, nokturija, inkontinencija, retencija).
Oligurija i anurija su nazivi za stanje smanjenoga stvaranja i/ili izlučivanja mokraće, a definiraju se količinom stvorene mokraće tijekom 24 sata (dnevna diureza). Ako je dnevna diureza manja od 500 ml, govorimo o oliguriji, a kada je ona manja od 100 ml, govorimo o anuriji. Ovisno o etiologiji, razlikujemo prerenalnu (posljedica smanjene bubrežne perfuzije), renalnu (posljedica bolesti bubrežnoga parenhima) te postrenalnu oligoanuriju (poremećaj otjecanja urina).
Poliurija je naziv za stanje pojačanoga stvaranja i izlučivanja mokraće, a definirana je dnevnom diurezom većom od 3000 ml. Uzroci mogu biti bubrežni (renalni) i izvanbubrežni (ekstrarenalni). Izvanbubrežnu poliuriju nalazimo kod prekomjernoga uzimanja tekućine, kod dijabetesa insipidusa te kod bolesti i ozljeda središnjega živčanog sustava, a može se naći uslijed još nekih bolesti (npr. šećerna bolest). Bubrežna poliurija nastaje zbog neprikladne reapsorpcije tekućine, pa bubreg luči mokraću niske specifične težine (tubulointersticijske bolesti). Poliurija se može naći i kod funkcionalnoga oporavka akutnoga bubrežnog oštećenja.
Disurija je naziv za poremećaje mokrenja koje obilježava bol ili osjećaj pečenja pri mokrenju, uz otežano mokrenje, s naporom i napinjanjem, a mlaz mokraće je isprekidan i slabiji. Često se javlja osjećaj da bolesnik nije potpuno ispraznio mokraćni mjehur. Uzroci mogu biti infekcije, zatim mehanički ili dinamički. Mehanički uzroci su smetnje prolazu mokraće što je prisutno kod striktura, tumora, bolesti prostate, kamenaca i sl. Dinamički uzroci podrazumijevaju poremećaje živaca i mišića koji sudjeluju u činu mokrenja, a obično se nalaze kod bolesti i ozljeda donjega dijela kralješnične moždine, bolesti živaca ili bolesti neuromuskularne ploče.
Polakisurija je naziv za učestalo mokrenje malih količina mokraće, a obično je prisutno kod bolesnika s infekcijama mokraćnoga sustava, kada je praćeno i bolovima i pečenjem. Ako se taj poremećaj javlja samo tijekom dana, a mokraća je bistra, onda se radi o neurasteniji (psihički uvjetovano), ali ako poremećaj traje i tijekom noći, vjerojatno se radi o poremećaju i bolesti mokraćnoga sustava (upala, urolitijaza, tumori).
Nokturija je naziv za mokrenje tijekom noći koje prekida spavanje, a obično je prisutna uz poliuriju. Češće se javlja kod starijih osoba ili kod pojačanoga unosa tekućine prije spavanja, a može biti i znak tubulointersticijskih bubrežnih bolesti (smanjena sposobnost koncentriranja mokraće).
Inkontinencija mokraće nemogućnost je voljnoga mokrenja, odnosno nemogućnost zadržavanja mokraće. Uzroci mogu biti različiti: bolesti mozga i kralješnične moždine, bolesti perifernih živaca (dijabetička neuropatija, tumori u zdjelici koji vrše pritisak) te anatomske promjene mokraćnoga sustava (ekstrofija mjehura, epispadija, fistule). Stresna inkontinencija nastaje kod žena, najčešće višerotkinja, zbog hernijacije baze mokraćnoga mjehura, a očituje se nevoljnim izlaskom mokraće iz mjehura pri povišenju intraabdominalnoga tlaka (kihanje, kašljanje, podizanje tereta).
Retencija mokraće može biti potpuna i nepotpuna. Potpuna retencija stanje je kada bolesnik uopće ne može mokriti uz izražen nagon za mokrenjem. Ono može biti uzrokovano mehaničkim (kamenci, tumori, strikture) ili dinamičkim smetnjama (poremećaji kralješnične moždine, oštećenje moždanoga središta za mokrenje, oštećenje refleksnoga luka). Nepotpuna retencija mokraće označava stanje kada bolesnik za vrijeme mokrenja ne može u potpunosti isprazniti mjehur, pa u njemu ostaje različita količina ostatne ili rezidualne mokraće. Uzroci su jednaki kao i kod potpune retencije mokraće. Retencija mokraće obično je praćena jakim suprapubičnim bolom uz mogućnost palpacije distendiranoga mjehura u infraumbilikalnom području.
EDEMI
Edemi su česta pojava kod bolesnika s bubrežnim bolestima, a nastaju uslijed nakupljanja tekućine u intersticijskom prostoru, osobito u području rahloga vezivnog tkiva. Pri bubrežnim bolestima karakteristična je pojava periorbitalnih edema, edema potkoljenica, a u najtežim slučajevima razvija se anasarka (generalizirani edem cijeloga tijela). Edemi su meki i tjestasti, a kod pojave slijede gravitacijsku ovisnost (najprije se javljaju perimaleolarno, a potom periorbitalno). Oni mogu nastati uslijed hipervolemije i povećanja hidrostatskoga tlaka unutar kapilarne mreže (anurični bolesnici) ili uslijed pada koloidno-osmotskoga tlaka plazme zbog velikoga gubitka bjelančevina putem bubrega (nefrotički sindrom). Uz edeme je iz istih patofizioloških razloga moguća i pojava izljeva u tjelesnim šupljinama, pa takvi bolesnici mogu imati ascites, pleuralni ili perikardni izljev.
ARTERIJSKA HIPERTENZIJA
Arterijska hipertenzija česta je pojava kod bolesnika s bubrežnim bolestima, a nekada je i njihov prvi znak. Uslijed bubrežnih bolesti ona može biti posljedica same hipervolemije ili prekomjerne aktivnosti RAAS-a (sustav renin-angiotenzin-aldosteron, od engl. renin-angiotensin-aldosteron system). Osim što može biti posljedica bubrežne bolesti, ona je može i izazvati ili pogoršati (hipertenzivna nefropatija). Renovaskularna hipertenzija je naziv za sekundarnu hipertenziju koja je posljedica suženja (stenoze) bubrežne arterije i posljedične povećane aktivnosti RAAS-a, a renoprivna hipertenzija je naziv za hipertenziju udruženu s parenhimskim bolestima bubrega. S obzirom na to da arterijska hipertenzija može pogoršati tijek bubrežne bolesti, većina terapijskih postupaka usmjerena je na njezin strogi nadzor, s obzirom na to da se tako koči napredovanje bubrežnoga oštećenja.
NAJČEŠĆI PATOLOŠKI NALAZI U MOKRAĆI
PROTEINURIJA
Definicija. Proteinurija je naziv za stanje povećane koncentracije bjelančevina u mokraći, i to u vrijednosti većoj od 150 mg u 24-satnom uzorku. Normalno u mokraći nalazimo manje količine bjelančevina koje mogu biti podrijetlom iz plazme ili mokraćnoga sustava (Tamm-Horsfallov protein) i one se ne smatraju patološkima. Svaka proteinurija zahtijeva kliničku obradu s obzirom na to da može ukazivati na različite bolesti i stanja.
Patofiziologija. Proteinurija se prema nastanku može podijeliti u nekoliko skupina: glomerulska, tubulska, glomerulo-tubulska te proteinurija zbog suviška.
Glomerulska proteinurija nastaje uslijed patoloških procesa koji primarno pogađaju glomerule. Građa i negativna električna nabijenost glomerulske bazalne membrane onemogućuje prolaz bjelančevina male i velike molekulske mase (albumini, globulini), dok se bjelančevine vrlo male molekulske mase (lizozim, β2-mikroglobulin) filtriraju i dospijevaju u tubule odakle se reapsorbiraju natrag u krvotok. Prigodom manjih oštećenja glomerulske bazalne membrane prolazit će bjelančevine manje molekulske mase (albumini, siderofilin), što se naziva selektivna glomerularna proteinurija, a pri većem oštećenju proći će i bjelančevine veće molekulske mase (npr. globulini) i to se naziva neselektivna glomerulska proteinurija.
Tubulska proteinurija nastaje uslijed patoloških procesa koji primarno pogađaju tubule, a očituje se smanjenom sposobnošću reapsorpcije bjelančevina vrlo male molekulske mase koji su prošli kroz glomerul. Prema tome, proteinuriju kvalitativno čine bjelančevine vrlo male molekulske mase (lizozim, β2-mikroglobulin, mioglobin).
Glomerulo-tubulska proteinurija nastaje uslijed patoloških procesa koji pogađaju i glomerule i tubule te se prezentiraju kao selektivna ili neselektivna glomerulska proteinurija uz prisutnost bjelančevina vrlo male molekulske mase.
Proteinurija zbog suviška ili proteinurija prelijevanja nastaje zbog povećanoga stvaranja određene bjelančevine u organizmu, a obično se radi o bjelančevinama male molekulske mase koje mogu proći kroz glomerule te čija koncentracija u tubulima premašuje sposobnost reapsorpcije. Najčešći primjer ovakve proteinurije je plazmacitom ili multipli mijelom.
Određivanje proteinurije. Proteinurija se može određivati orijentacijski vrpcom s reagensom, izračunavanjem omjera bjelančevina i kreatinina iz jednokratnoga uzorka mokraće, a zlatni standard i najtočniji postupak u procjeni proteinurije predstavlja određivanje vrijednosti bjelančevina iz mokraće skupljene tijekom 24 sata.
Određivanje proteinurije testnom vrpcom orijentacijski je postupak i pri njezinoj interpretaciji treba misliti na ograničenja u smislu dobivanja lažno pozitivnih rezultata (koncentrirana mokraća, lužnata mokraća, krvava mokraća, primjena radiokontrasta) ili lažno negativnih rezultata (razrijeđena mokraća, blaga proteinurija - mikroalbuminurija, niskomolekulska proteinurija).
Omjer bjelančevina i kreatinina u slučajnom uzorku mokraće prihvatljiviji je postupak u svakodnevnom radu s obzirom na to da se ne mora skupljati 24-satni uzorak mokraće. Omjer bjelančevina i kreatinina predstavlja približnu vrijednost bjelančevina izlučenih u 24 sata (npr. ako omjer iznosi 3, to približno odgovara izlučivanju 3 g bjelančevina u 24 sata). Omjer se dobiva matematički, dijeljenjem vrijednosti bjelančevina (mg/dl) s vrijednosti kreatinina (mg/dl) izmjerenih u slučajnom uzorku mokraće.
Kvantitativno određivanje proteinurije u 24-satnom uzorku mokraće najpouzdaniji je postupak za dokazivanje veličine proteinurije. Ugrubo se može reći za proteinurije koje su manje od 3 g/24 sata da su glomerulskoga ili tubulskog podrijetla, a za one koje su veće od 3 g/24 sata da su glomerulskoga podrijetla.
Klinički pristup. U kliničkom pristupu bolesniku s proteinurijom nameće se nekoliko bitnih pitanja: radi li se o fiziološkoj, prolaznoj ili ortostatičkoj proteinuriji te, ako se radi o patološkoj proteinuriji, radi li se o patologiji glomerula (glomerulska proteinurija), tubula (tubulska proteinurija) ili o proteinuriji zbog suviška.
Fiziološka proteinurija je naziv za pojavu bjelančevina u mokraći iznad vrijednosti od 150 mg/24 sata, bez da odmah uključuje patološko stanje. Može se vidjeti nakon teškoga fizičkog rada, u stanju emocionalnoga stresa, pri izlaganju hladnoći, tijekom febrilnoga stanja ili u trudnoći. Kod ovakvih stanja preporučuje se ponoviti mjerenje te ako ponovljeni nalaz bude uredan, govorimo o prolaznoj proteinuriji.
Ortostatička proteinurija je naziv za proteinuriju koja se javlja pretežno u stojećem položaju, a otkriva se kod adolescenata i mlađih odraslih osoba. Potvrđuje se skupljanjem mokraće tijekom jednoga dana, podijeljene u dvije posude, u jednu se skuplja urin od 7 do 23 sata (pretežno stojeći položaj) te od 23 do 7 sati drugoga dana (ležeći položaj). Ako u noćnom uzorku nema proteinurije, radi se o ortostatičkoj proteinuriji koja je klinički beznačajna i ne zahtijeva daljnju obradu.
Patološka proteinurija može biti glomerulska, tubulska ili zbog suviška. Ako je proteinurija veća od 3 g/24 sata ili nalazimo patološki sediment mokraće koji uključuje nalaz fino i grubo granuliranih cilindara, eritrocitnih cilindara ili dismorfičnih eritrocita, radi se o glomerulskoj proteinuriji, a u ostalim je situacijama za razlikovanje potrebno učiniti elektroforezu bjelančevina u mokraći.
HEMATURIJA
Definicija. Hematurija je naziv za pojavu krvi u mokraći koja može biti vidljiva golim okom (makrohematurija) ili pod mikroskopom (mikrohematurija). Da bi govorili o mikrohematuriji u sedimentu mokraće, moramo naći više od tri eritrocita po vidnom polju.
Etiologija. Uzroci hematurije mogu biti bubrežni i izvanbubrežni. Bubrežne uzroke dalje dijelimo na glomerulske i neglomerulske. Najčešći uzroci hematurije prikazani su u Tablici 5.1.
|
Tablica 5.1. Etiologija hematurije
|
|
Glomerulski bubrežni uzroci
|
Neglomerulski bubrežni uzroci
|
Izvanbubrežni uzroci
|
|
IgA nefropatija
Alporotov sindrom
Bolest tankih membrana
Membranoproliferativni glomerulonefritis
Brzoprogresivni glomerulonefritis
Anti-GBM nefritis
Postinfektivni glomerulonefritis
Lupusni nefritis
|
Policistična bolest bubrega
Hidronefroza
Papilarna nekroza (analgetička nefropatija)
Maligna hipertenzija
Infarkt bubrega
Tromboza bubrežne vene
Trauma bubrega
|
Infekcije mokraćnih puteva
Tumori mokraćnih puteva i mjehura
Urolitijaza
Koagulopatije
Trauma mokraćnih puteva
|
Klinički pristup. Temeljna pitanja pri kliničkom pristupu ovim bolesnicima su: radi li se o pseudohematuriji, ima li bolesnik infekciju mokraćnih kanala ili hemoragijsku dijatezu te ima li bolesnik hematuriju glomerulskoga ili neglomerulskog podrijetla.
Pseudohematurija označava crvenkasto-smećkasto obojenje mokraće koje naliči hematuriji, a boju ne daju eritrociti/hemoglobin. Takvo obojenje mokraće mogu uzrokovati neki lijekovi (fenacetin, rimfampcin, doksorubicin, metildopa), hrana (cikla, borovnice, paprika) te metaboličke bolesti (porfirija).
Hematurija u sklopu infekcije mokraćnih puteva najčešća je hematurija u kliničkoj praksi i zato kod svih bolesnika treba potražiti znakove mokraćne infekcije: disurične smetnje i patološki nalaz mokraće (leukociturija, pozitivni nitriti ili leukocitna esteraza, mnoštvo bakterija).
Hematurija u sklopu hemoragijske dijateze također je česta u kliničkoj praksi, osobito kod bolesnika na peroralnoj antikoagulantnoj terapiji. Svim bolesnicima s hematurijom (prvenstveno makrohematurijom) potrebno je odrediti koagulacijske parametre (PV, APTV) koji nam mogu ukazivati na poremećaj zgrušavanja krvi.
Glomerulska hematurija nastaje uslijed različitih glomerulskih bolesti, a na nju ukazuje nalaz eritrocitnih cilindara i/ili dismorfičnih eritrocita u sedimentu mokraće, a dodatni nalaz koji ukazuje na glomerulsku hematuriju je nalaz proteinurije veće od 0,5 g/dan. Ako se posumnja na glomerulsku bolest, potrebno je provesti dijagnostički postupak u tom smjeru.
Neglomerulska hematurija se prepoznaje po izostanku eritrocitnih cilindara i/ili dismorfičnih eritrocita u sedimentu mokraće, a zahtijeva dodatnu dijagnostičku obradu u smislu ultrazvuka, slikovnih kontrastnih pretraga i sl.
NAJČEŠĆI KLINIČKI NEFROLOŠKI SINDROMI
Najčešći klinički nefrološki sindromi su nefrotički sindrom, akutni nefritički sindrom, brzoprogresivni glomerulonefritis, kronični glomerulonefritis te asimptomatski poremećaji u mokraći, a opisani su u poglavlju o glomerulskim bolestima.
DIJAGNOSTIČKI POSTUPCI U NEFROLOGIJI
Među osnovne dijagnostičke pretrage u nefrologiji ubrajamo laboratorijske pretrage krvi i mokraće, postupke procjenjivanja bubrežne funkcije, slikovne i endoskopske dijagnostičke postupke te biopsiju i patohistološku bubrežnu dijagostiku.
LABORATORIJSKE KRVNE PRETRAGE
U specifične laboratorijske krvne pretrage kod nefroloških bolesnika ubrajamo određivanje vrijedosti dušičnih metabolita, a to su ureja i kreatinin, a u novije vrijeme i cistatin C. Njihove vrijednosti orijentacijski ukazuju na bubrežnu funkciju, s obzirom na to im se koncentracija povećava u stanjima smanjenja bubrežne funkcije jer je bubreg odgovoran za njihovo odstranjivanje iz organizma. Svakodnevno se koriste u kliničkoj praksi. Ostale krvne pretrage uključuju standardne hematološke, koagulacijske i biokemijske pretrage. U nefrologiji je bitno određivati koncentraciju elektrolita, elektroforezu bjelančevina te acidobazni status. S obzirom na to da je bubreg često sijelo patologije različitih sustavnih bolesti, osobito autoimunih, važno mjesto u dijagnostici imaju i serološke pretrage.
Kreatinin je dušični metabolit koji nastaje iz kreatin-fosfata, spoja koji u mišićnim stanicama služi kao izvor energije. Nakon davanja fosfatnih skupina potrebnih za nastajanje adenozin-trifosfata iz mišića se otpušta kreatin koji se u jetri pretvara u kreatinin, a on se potom luči iz organizma putem bubrega. Dominantni mehanizam izlučivanja kreatinina je glomerulska filtracija (90 %), dok se manji dio (10 %) luči putem tubulske sekrecije. S obzirom na to da je stvaranje kreatinina prilično ujednačeno i konstatno, mjerenje njegove koncentracije u krvi može uz visoki stupanj pouzdanosti ukazivati na sposobnost bubrega da ga luči, tj. na njegovu funkciju. U stanjima oštećenja bubrežne funkcije dolazi do smanjenja sposobnosti bubrega da luči kreatinin što se očituje porastom njegove serumske koncentracije.
Tumačenje vrijednosti kreatininemije. Referentni raspon koncentracije kreatinina u serumu iznosi 64 - 104 µmg/l (nešto je manji kod žena zbog manje mišićne mase). Vrijednosti kreatinina i glomerulske filtracije obrnuto su proporcionalne veličine te se svaki put kada se glomerulska filtracija smanji serumska koncentracija kreatinina poveća.
Ograničenja kreatinina pri procjeni bubrežne funkcije. Pri tumačenju nalaza kreatininemije na umu treba imati nekoliko ograničenja: a) mišićna masa, b) primjena lijekova, c) bubrežni kompenzacijski mehanizmi i d) laboratorijske (arteficijalne) greške.
S obzirom na to da je stvaranje kreatinina u najvećoj mjeri povezano s mišićnom masom, logično je da će osobe s manjom mišićnom masom imati i niže vrijednosti kreatinina u serumu, što treba imati na umu kod procjene bubrežne funkcije. Velik porast unutar referentnih vrijednosti može imati patološko značanje smanjenja bubrežne funkcije kod pojedinih skupina pacijenata. U te skupine ubrajamo žene, djecu, starije bolesnike, kahektične bolesnike te osobe koje konzumiraju hranu s malo mesa.
Primjena nekih lijekova može interferirati s izlučivanjem kreatinina što može dovesti do povećanja koncentracije kreatinina u serumu i bez prisutne oštećene funkcije bubrega. Takvi lijekovi su salicilati, spirinolakton, cimetidin, trimetoprim, triamteren i amilorid. Na taj način izazvana povećanja vrijednosti kreatinina su umjerena.
Kao odgovor na povećanu kreatininemiju uslijed smanjene glomerulske filtracije u početnim stupnjevima bubrežne bolesti kao kompenzacijski mehanizam javlja se povećanje tubulske sekrecije kreatinina što u tim početnim stupnjevima može davati dojam uredne bubrežne funkcije. Taj proces tubulske sekrecije kreatinina iscrpljuje se kada serumski kreatinin dosegne vrijednost od 140 do 170 µmg/l, nakon čega će svaki daljni pad vrijednosti glomerulske filtracije biti praćen porastom serumskoga kreatinina.
Također, treba imati na umu da kod laboratorijskoga određivanja kreatininemije može doći do arteficijalne greške kada u serumu nalazimo povećanu koncentraciju ketonskih tijela (ketoacidoza), kada se neka ketonska tijela pri instrumentalnoj obradi krvnih uzoraka očitavaju kao kreatinin, tako da dobivamo nalaz lažno povećanih vrijednosti kreatinina.
Ureja predstavlja glavni završni proizvod katabolizma bjelančevina u organizmu čije je izlučivanje uvjetovano glomerulskom filtracijom i tubulskom reapsorpcijom koja ponajprije ovisi o koncentracijskom gradijentu (u stanjima volumne deplecije stvara se koncentrirani urin te se posljedično povećava stopa tubulske reapsorpcije ureje, a time i njezina serumska koncentracija). Referentne vrijednosti serumske koncentracije ureje iznose od 2,8 do 8,3 mmol/l. S obzirom na to da na vrijedosti ureje, osim bubrežne funkcije, utjecaj mogu imati i druge bolesti i stanja (prikazano u Tablici 5.2.), tumačenje njezinih vrijednosti u svrhu procjene bubrežne funkcije je manje pouzdano i mora se tumačiti uglavnom usporedno s koncentracijom kreatinina.
|
Tablica 5.2. Uzroci povećane ili smanjene serumske koncentracije ureje
|
|
Uzroci povećane serumske koncentracije ureje
|
Uzroci smanjene serumske koncentracije ureje
|
|
Volumna deplecija (dehidracija, kraverenje)
Kortikosteroidna i citotoksična terapija
Prehrana bogata proteinima
Sepsa i katabolički stres
Opstruktivna uropatija
|
Prehrana siromašna proteinima
Teška bolest jetre
Pretjerana hidracija i SIADH
Hemodijaliza
Trudnoća
|
Cistatin C je niskomolekularna bjelančevina koja se u potpunosti izlučuje putem glomerulske filtracije te na njegovo izlučivanje ne utječu procesi tubulske sekrecije ili reapsorpcije te je kao takav objektivniji pokazatelj glomerulske filtracije. Unatoč svojim pozitivnim stranama, kao biljeg bubrežne funkcije nije ušao u rutinsku svakodnevnu kliničku praksu.
Serološke pretrage važne su u dijagnostici sustavnih bolesti (auto)imune etiologije. U tu se svrhu određuju različitia proutijela, kao što su antinuklearna (ANA), antineutrofilna citoplazmatska (c-ANCA i p-ANCA, povećani uglavnom uslijed nekih vaskulitisa), protutijela na glomerulsku bazalnu membranu (anti-GBM, povećani uglavnom kod Goodpastureova sindroma) te komponente komplementa (C3 i C4, smanjeni u aktivnoj bolesti i nekim glomerulopatijama).
LABORATORIJSKE PRETRAGE MOKRAĆE
Među laboratorijske pretrage mokraće ubrajamo tzv. kompletan pregled mokraće sa sedimentom, citološki pregled te mikrobiološki pregled (urinokultura). Mokraća se obično uzima ujutro, srednji čisti mlaz u kemijski čistu posudu. Količina mokraće izlučena tijekom 24 sata naziva se dnevna diureza.
Potpuni pregled mokraće rutinska je pretraga koja podrazumijeva promatranje izgleda i boje mokraće, određivanje specifične težine, kiselosti (pH), nitrita, leukocitne esteraze, bjelančevina, glukoze, ketona, urobilinogena i bilirubina te mikroskopski pregled sedimenta urina. Za biokemijske pretrage urina najčešće se koriste testne vrpce impregnirane različitim reagensima koji reagiraju promjenom boje u prisustvu određenih tvari ili molekula u mokraći, a reakcija se iskazuje semikvantitativno.
Izgled i boja mokraće. Normalno, boja mokraće može varirati od gotovo bezbojne do izraženo žute što ponajprije ovisi o koncentraciji urokroma (pigmenti koji se luče putem bubrega i mokraće) u izlučenoj mokraći: pri stvaranju veće količine mokraće dolazi do razrjeđivanja urokroma pa je boja mokraće svjetlija, i obrnuto. Nenormalna boja mokraće može biti znak bolesti ili se može javiti kao posljedica uzimanja nekih lijekova. Neki od primjera patološke boje i izgleda mokraće su: mliječna boja (infekcije - gnoj, hilurija, uratni kristali), ružičasta (hematurija), pjenušavi urin (proteinurija), zelenkasta boja (infekcija pseudomonasom, bilirubinurija), svijetlo do tamno crvena (hematurija, mioglobinurija), narančasta boja (primjena rimfampicina) i dr. Pri promatranju izgleda i boje mokraće obično se opisuje i bistrina urina. Normalno, urin je bistar, no ne mora svako zamućenje urina biti patološko. Najčešći uzrok zamućenja urina je taloženje fosfatnih kristala u lužnatoj mokraći što se obično vidljivo nakon obroka bogatoga bjelančevinama. Ostali uzroci zamućenosti mokraće su piurija, hilurija, lipidurija, hiperoksalurija te hiperurikozurija. Kod svakoga zamućenja potreban je pregled sedimenta.
Specifična težina mokraće. Specifična težina mokraće je omjer mase volumena mokraće s istim volumenom destilirane vode, a varira između 1002 i 1035 kg/l. Mokraća specifične težine manje od 1002 kg/l je razrijeđena, a iznad 1035 kg/l koncentrirana. Ako se u mokraći ne nalaze velike molekule poput glukoze i radiokontrasta, specifična težina je proporcionalna osmolalnosti urina (tvari veće molekulske mase dovode do nerazmjernoga porasta specifične težine u odnosu na osmolalnost). Određivanje specifične težine mokraće ima veliku ulogu u dijagnostici patologije tubula: primarna mokraća u Bowmanovoj čahuri ima specifičnu težinu od 1010 kg/l te su daljnje promjene posljedica procesa tubulske reapsorpcije i sekrecije. Prema tome, kada je tubulska funkcija oštećena, specifična težina mokraće bit će jednaka onoj primarne mokraće (1010 kg/l). Takvo stanje naziva se izostenurija, tj. nesposobnost bubrega da stvara koncentriranu mokraću (karakteristično za kroničnu bubrežnu bolest). Smanjenu specifičnu težinu mokraće nalazimo u stanjima hiperhidracije, primjene diuretika, dijabetesa insipidusa ili bolesti tubula, dok povećanu specifičnu težinu nalazimo u stanjima dehidracije, šećerne bolesti s izraženom glukozurijom ili nakon primjene kontrastnih sredstava ili manitola.
Kiselost (pH) mokraće. pH mokraće kreće se između 4,5 i 9. Mokraća koja ima pH između 4,5 i 5,5 smatra se kiselom, a 6,5 do 9 lužnatom. Prosječni pH mokraće iznosi između 5 i 6 uslijed stvaranja i lučenja endogenih kiselina. pH niži od 4,5 ili viši od 9 fiziološki je nemoguć. Lužnati urin nalazimo kod infekcija uzrokovanih bakterijama koje razgrađuju ureju (proteus), ako mokraća prije analize dugo stoji, u stanjima metaboličke ili respiracijske alkaloze, pri značajnom unosu agruma hranom ili uslijed lučenja nekih lijekova (natrijev bikarbonat, kalijev citrat, acetazolamid). Uzroci kiseloga urina mogu biti prekomjeran unos mesa i određenoga voća (npr. brusnice), stanja metaboličke ili respiracijske acidoze te može biti izazvan lijekovima (amonijev klorid).
Nitriti. Određene bakterije imaju sposobnost redukcije nitrata u nitrite čiji pozitivni nalaz u mokraći ukazuje na infekciju mokraćnih puteva takvim bakterijama. Osjetljivost toga testa u dijagnostici mokraćnih infekcija iznosi oko 50 %.
Leukocitna esteraza. S obzirom na to da je leukocitna esteraza enzim kojega luče leukociti, njihov pozitivan nalaz u mokraći posredan je pokazatelj leukociturije, a što je najčešće znak mokraćne infekcije. Osjetljivost ovoga testa u dijagnostici mokraćnih infekcija kreće se između 80 i 90 %.
Bjelančevine. U prosjeku zdrava osoba tijekom 24 sata normalno izluči do 150 mg bjelančevina, a lučenje veće količine nazivamo proteinurijom i ona uglavnom ukazuje na bubrežnu bolest. Klasično određivanje bjelančevina u mokraći kemijskim testnim vrpcama korisno je u svakodnevnoj praksi, no ipak ima svoja ograničenja: 1) rezultati ovise o specifičnoj težini mokraće (npr. jako koncentriran urin može dati lažnu sliku značajne proteinurije i obrnuto) te 2) klasične testne vrpce najosjetljivije su na albumine, dok su slabije osjetljive na druge vrste bjelančevina pa možemo imati lažno negativan nalaz kod proteinurije uzrokovane drugim vrstama bjelančevina (Bence-Jonesove bjelančevine i dr.).
Glukoza. Prolaskom krvi kroz glomerul glukoza se u potpunosti filtrira u primarnu mokraću, a potom gotovo u cijelosti biva reapsorbirana u tubulima. Glukoza se u mokraći pojavljuje u stanjima kada glomerulska filtracija glukoze nadmaši sposobnost tubula da je reapsorbira, a to se događa kada vrijednost glukoze u krvi prijeđe 10 mmol/l (tzv. bubrežni prag za izlučivanje glukoze). Glukozuriju nalazimo u raznim stanjima koja dovode do hiperglikemije: šećerna bolest, endokrinopatije (Cushingov sindrom, feokromocitom, akromegalija) te primjena lijekova (kortikosteroidi, tijazidi). Osim toga, glukozurija se može naći i uslijed stanja bez hiperglikemije, kao u trudnoći i u tzv. bubrežnoj glukozuriji.
Ketoni. Ketonska tijela (β-hidroksimaslačna, acetooctena i octena kiselina) nastaju kao rezultat razgradnje masti kao izvora energije u nedostatku ugljikohidrata. Pozitivni ketoni u mokraći ukazuju na ketozu koja može biti posljedica loše regulirane šećerne bolesti (nedostatak inzulina onemogućuje ulazak ugljikohidrata u stanice da bi se oni koristili u energetske svrhe), a mogu se naći i u stanjima gladovanja, nagloga mršavljenja, u trudnoći te pri predoziranju salicilatima. Treba imati na umu da u stanjima bubrežnoga zatajenja bubrezi ne mogu filtrirati ketonska tijela tako da kod tih bolesnika negativni ketoni u urinu ne opovrgavaju dijagnozu ketoze.
Urobilinogen i bilirubin. U mokraći se normalno može nalaziti urobilinogen koji nastaje u procesu metabolizma bilirubina i njegovo određivanje u urinu nema veće kliničko značenje. Bilirubin se normalno ne nalazi u urinu te je svaki pozitivan nalaz patološki i ukazuje na hepatobilijarnu patologiju. Bilirubin daje mokraći tamnu boju (poput piva) te ona postaje tamnija nekoliko dana prije nego bolesnik razvije žuticu.
Mikroskopski pregled sedimenta mokraće. Pri mikroskopskoj analizi sedimenta mokraće promatraju se prisutne stanice, cilindri te kristali u mokraći. Dijagnostičko značenje ima nalaz leukocita, eritrocita i epitalnih stanica u sedimentu urina. Nalaz cilindara u sedimentu urina nazivamo cilindrurija, a kristala kristalurija.
Normalan raspon leukocita u sedimentu mokraće je od 0 do 5 leukocita u vidnom polju velikoga povećanja. Nalaz više od 5 leukocita naziva se leukociturija ili piurija i ponajprije ukazuje na infekciju mokraćnoga sustava. Na infekciju bubrega (pijelonefritis) treba posumnjati kod bolesnika koji uz leukocituriju imaju i proteinuriju te leukocitne cilindre, dok je sama leukociturija obično posljedica infekcije mokraćnih puteva i mjehura. Kod svake leukociturije indicirana je mikrobiološka obrada mokraće (urinokultura). Leukocituriju uz negativnu urinokulturu nazivamo sterilnom (sterilna piurija), a ona se najčešće javlja kao posljedica već započetoga antibiotičkog liječenja, ali se može naći i uslijed nekih drugih bolesti i stanja (kortikosteroidna terapija, trudnoća, prostatitis, uretritis, tubulointersticijski nefritis, gljivične infekcije, tuberkuloza, infekcije atipičnim uzročnicima).
Normalan raspon eritrocita u sedimentu mokraće je 0 do 5 eritrocita u vidnom polju velikoga povećanja. Eritrociti se mogu gubiti putem glomerula, tubulointersticija ili iz mokraćnih puteva. Na glomerulsku etiologiju eritrociturije ukazuje nalaz dismorfičnih eritrocita te nalaz eritrocitnih cilindara. Pozitivan nalaz krvi u mokraći pri pregledu brzim testnim vrpcama uz negativan nalaz eritrocita pri mikroskopskom pregledu sedimenta može ukazivati na raspad eritrocita, mioglobinuriju ili hemoglobinuriju.
U mokraći se još mogu naći epitelne tubulske stanice, pločaste epitelne stanice te stanice prijelaznoga epitela. U normalnim uvjetima u mokraći se mogu naći epitelne tubulske stanice u manjem broju, dok veći broj ukazuje na tubulointersticijske bolesti. Nalaz pločastih epitelnih stanica nije patološki nalaz u mokraći. Također, u manjoj se mjeri u sedimentu mokraće mogu naći i stanice prijelaznoga epitela, dok njihov povećan broj možemo naći kod infekcija mokraćnoga sustava, nakon invazivnih postupaka (kateterizacija, cistoskopija) te kod karcinoma mokraćnoga mjehura prijelaznoga epitela.
Cilindri predstavljaju odljevne nakupine koji nastaju taloženjem različitih stanica ili tvari u tubulima tako da poprimaju njihov izgled i kao takvi se mogu naći u sedimentu mokraće. Ovisno o sastavu, razlikujemo nekoliko vrsta cilindara koji se mogu javiti pri određenim patološkim stanjima i bolestima: eritrocitni (nefritički sindrom, druge glomerulske bolesti, vaskulitis), leukocitni (pijelonefritis, tubulointersticijske bolesti), epitelni (akutna tubulska nekroza, intersticijski nefritis, glomerulonefritis), masni (nefrotički sindrom). Nalaz cilindara nije uvijek patološki nalaz i može se naći i kod zdravih pojedinaca, osobito pri koncentriranom urinu.
Nalaz kristala u sedimentu mokraće ima značajno dijagnostičko značenje kod bolesnika s nefrolitijazom pri utvrđivanju vrste kamenca. U mokraći se mogu naći kristali urične kiseline, kalcijevoga fosfata, kalcijeva okslata te cistinski kristali.
Citološki pregled mokraće podrazumijeva uzimanje uzorka mokraće za citološki pregled kod sumnje na tumor mokraćnoga sustava i poliomavirusne infekcije bubrežnoga presatka. Nalaz zloćudnih stanica vrlo je suspektan nalaz za zloćudnu bolest mokraćnih puteva, dok negativan nalaz ne isključuje zloćudnu bolest. Preporučuje se uzimanje prve jutarnje mokraće tijekom tri uzastopna dana.
Mikrobiološki pregled mokraće (urinokultura) označava uzorkovanje mokraće s ciljem mikrobiološke analize. Mokraća se skuplja u sterilnu posudu, a prije toga je potrebno oprati spolovilo te napomenuti da se uzima srednji čisti mlaz. Osim mikrobiološke identifikacije bakterije odmah se izrađuje i test osjetljivosti na antibiotike (antibiogram).
PROCJENA BUBREŽNE FUNKCIJE
Glomerulska filtracija označava brzinu kojom se plazma filtrira kroz glomerule, a mjerenje glomerulske filtracije predstavlja glavni klinički test za ispitivanje i procjenu bubrežne funkcije. Procjena glomerulske filtracije može biti izravna (postupak klirensa) ili posredna (matematički izračun na temelju serumske koncentracije kreatinina).
Izravna procjena glomerulske filtracije temelji se na postupku određivanja bubrežnoga klirensa. Bubrežni klirens neke tvari je volumen plazme koji bubrezi potpuno očiste od te tvari u jedinici vremena. Da bi dobili najvjerniji uvid u glomerulsku filtraciju, potrebno je mjeriti klirens tvari koja se u potpunosti filtrira u glomerulima te ne podliježe reapsorpciji u tubulima. U tu se svrhu koriste različite tvari kao što su inulin, radio-obilježena etilendiamintetraoctena kiselina – EDTA (od engl. ethylenediaminetetraacetic acid) i druge tvari, no s obzirom na to da se one fiziološki ne sintetiziraju u organizmu i moraju se arteficijalno unositi, njihova primjena u svakodnevnoj praksi je ograničena i primjenjuje se samo u strogim indikacijama (npr. procjena bubrežne funkcije bubrega živoga darivatelja bubrega za transplantaciju). U svakodnevnoj praksi mjerenje glomerulske filtracije temelji se na mjerenju klirensa endogeno stvorenoga kreatinina jer su njegove vrijednosti stvaranja i lučenja prilično konstantne.
Klirens endogenoga kreatinina (KEK) podrazumijeva volumen plazme koji se očisti od kreatinina u jedinici vremena i predstavlja glavni klinički test koji se koristi u svakodnevnoj praksi za procjenu glomerulske filtracije. Vrijednost KEK-a se dobiva matematičkim izračunom za koji nam je potrebna vrijednost kreatinina iz uzorka 24-satnoga urina, volumen 24-satnoga urina te vrijednost kreatinina u serumu, a dobivana vrijednost se korigira prema bolesnikovoj masi i visini. Normalna vrijednost KEK-a iznosi 1,8 do 3,3 ml/s/1,73 m2 tj. površine, odnosno107 do 197 ml/min/1,73 m2 tjelesne površine.
KEK = (koncentracija kreatinina u mokraći x volumen mokraće) / (koncentracija kreatinina u plazmi)
Kod procjene glomerulske filtracije mjerenjem klirensa kreatinina treba imati na umu da se u fiziološkim uvjetima 10 % kreatinina koji prođe filtraciju u glomerulima reapsorbira u tubulima, a taj postotak može biti i viši u stanjima glomerulskih bolesti, što može rezultirati nerealno boljom procjenom glomerulske filtracije nego što je ona u stvarnosti (to se najčešće susreće u početnim stupnjevima kronične bubrežne bolesti). Učinak tubulske reapsorpcije kreatinina na vrijednost pretrage može se poništiti jednokratnom primjenom lijekova koji blokiraju ovaj proces, npr. primjena 1200 mg cimetidina 2 sata pije početka skupljanja 24-satne mokraće.
Također, kod tumačenja vrijednosti KEK-a kao mjere glomerulske filtracije treba imati na umu da je ona pouzdana samo u slučajevima relativno ujednačenoga stvaranja kreatinina („mirno stanje ravnoteže kreatinina“). U stanjima nagloga povećanja ili smanjenja koncentracije serumskoga kreatinina, kao što je to kod pogoršanja ili ozdravljenja od akutnoga bubrežnog oštećenja ili pogoršanja otprije postojeće kroničneg bubrežne bolesti, klirens kreatinina ne predstavlja odgovarajući odraz glomerulske filtracije.
Neizravna procjena glomerulske filtracije temelji se na matematičkim izračunima koji se temelje na vrijednosti serumske koncentracije kreatinina. U kliničkoj praksi postoje različite formule koje se koriste za procjenu glomerulske filtracije kao što su Cockcroft-Gaultova te MDRD formula (engl. Modification of Diet in Renal Disease) koje su prije imale veće značenje, dok se danas najčešće koristi CKD-EPI (engl. Chronic Kidney Disease Epidemiology Collaboration) za bolesnike s indeksom tjelesne mase manjim od 30 kg/m2 te formula Salazar-Corcoran za bolesnike s indeksom tjelesne mase većim od 30 kg/m2. Neizravna procjena glomerulske filtracije manje je pouzdana od mjerenja KEK-a, ali je prihvatljivija u svakodnevnom, a posebice u ambulantnom radu (ne zahtijeva skupljanje 24-satne mokraće). Kao i kod određivanja KEK-a, da bi dobivene vrijednosti smatrali pouzdanima, potrebno je da koncentracija serumskoga kreatinina bude stabilna tijekom nekoliko dana.
ULTRAZVUČNI DIJAGNOSTIČKI POSTUPCI
Ultrazvuk bubrega i mokraćnoga mjehura jedna je od najčešćih slikovnih metoda koja se koristi u kliničkoj praksi prilikom dijagnostičke obrade bolesnika sa sumnjom na bubrežnu bolest. Radi se o jednostavnom, neškodljivom i jeftinom postupku što ga čini široko prihvatljivim. Ultrazvuk bubrega omogućuje procjenu veličine i položaja bubrega te ukazuje na osnovne patomorfološke promjene bubrega (dilatacija kanalnoga sustava, ciste, tumori, kamenci). Osim toga, omogućuje i pregled male zdjelice i retroperitonejskoga prostora te pregled mokraćnoga mjehura i prostate kod muškaraca. Uz to, ultrazvuk je presudan u izvođenju drugih dijagnostičko-terapijskih zahvata (bubrežna biopsija, postavljanje nefrostome i sl.). Doplerska analiza omogućuje mjerenje protoka i otpora krvnih žila bubrega što ima veliku ulogu u procjeni njihove patologije (stenoze, okluzije i sl.).
RADIOLOŠKI DIJAGNOSTIČKI POSTUPCI
Najznačajnije radiološke pretrage u nefrologiji su nativna radiološka snimka mokraćnoga sustava, kontrastna urografija, kompjutorizirana tomografija, magnetska rezonancija te digitalna supstrakcijska angiografija bubrežnih arterija.
Nativna radiološka snimka mokraćnoga sustava indicira se kod bolesnika sa sumnjom na urolitijazu. Tehnički, ovom se pretragom mogu otkriti anorganski konkrementi koji su dimenzija većih od 5 mm i lokalizirani u bubregu, mokraćovodima ili mokraćnom mjehuru.
Kontrastna urografija označava pretragu koja podrazumijeva morfološki prikaz kontrastom ispunjenih mokraćnih puteva (osobito bubrežnih čašica i nakapnice te mokraćovoda), a služi u dijagnostici opstruktivnih poremećaja. Ovisno o načinu primjene kontrasta, razlikujemo nekoliko podvrsta pretrage: intravenska urografija (intravenska primjena kontrasta), antegradna urografija (injiciranje kontrasta izravno u nakapnicu uz iglu pod ultrazvučnim nadzorom) te retrogradna urografija (primjena kontrasta putem ureteroskopa). S obzirom na današnje mogućnosti ultrazvučne dijagnostike i kompjutorizirane tomografije, ovi se postupci sve manje rabe u svakodnevnoj praksi.
Kompjutorizirana tomografija (CT) danas je jedna od najčešćih radioloških pretraga u nefrologiji, s obzirom na njezinu superiornost u odnosu na druge pretrage. Nativni ili kontrastni CT koristi se u dijagnostici i obradi suspektnih masa i/ili cista bubrega nađenih ultrazvukom koje su nejasne etiologije, zatim u dijagnostici nefrolitijaze (u zapadnim zemljama CT trbuha je postupak izbora kod suspektne nefrolitijaze), u svrhu procjene raširenosti zloćudnih tumora bubrega, u dijagnostici patologije retroperitonejskoga prostora i mokraćnoga mjehura te u dijagnostici žilnih bubrežnih poremećaja (angiografija bubrežnih arterija). Glavni nedostaci su izloženost velikim dozama zračenja te, pri uporabi kontrasta, njegova nefrotoksičnost.
Magnetska rezonancija (MR) predstavlja alternativu CT-u te se također pokazuje kao dobra pretraga u dijagnostici različitih solidnih i cističnih bubrežnih promjena, u procjeni proširenosti karcinoma bubrega, mokraćnoga mjehura i prostate te u dijagnostici žilnih poremećaja. Glavna prednost u odnosu na CT je izbjegavanje izloženosti velikim dozama zračenja. MR angiografija koristi kontrast na bazi gadolinija koji može dovesti do razvoja nefrogene sistemske skleroze, osobito kod bolesnika s izrazito sniženom glomerularnom filtracijom (posljednja istraživanja ukazuju na to da je taj rizik toliko malen da ova pretraga nije kontraindicirana niti kod ovih bolesnika).
Digitalna supstrakcijska angiografija bubrežnih arterija (DSA) je invazivna kontrastna radiološka pretraga bubrežne arterije koja se izvodi punkcijom femoralne arterije i uvođenjem katetera kroz aortu u bubrežne arterije s ubrizgavanjem kontrasta, s ciljem prikazivanja bubrežne arterije i njezinih ogranaka, odnosno patoloških promjena na njima (stenoze, okluzije). S obzirom na preciznost CT ili MR angiografije, koje nisu tako invazivne, ova se pretraga sve manje rabi u kliničkoj praksi.
NUKLEARNO-MEDICINSKI DIJAGNOSTIČKI POSTUPCI
Scintigrafija bubrega temelji se na primjeni radionuklidnih farmaka koji imaju sposobnost emitiranja gama zraka koje se detektiraju posebnim gama kamerama. Primjenjuju se radiofarmaci koji se nakupljaju i izlučuju putem bubrega, a razlikujemo statičku i dinamičku scintigrafiju. Statičkom scintigrafijom u prvom redu analiziramo morfološka obilježja bubrega (veličina, izgled, prisutnost ožiljaka i sl.), dok dinamička scintigrafija ukazuje na bubrežnu funkciju (analiza nakupljanja radiofarmaka u bubrezima – pokazatelj perfuzije te ekskrecije u kanalni sustav – pokazatelj opstrukcije). Pri tome se najčešće koriste sljedeći radiofarmaci: dimerkaptosukcinska kiselina obilježena tehnecijem (99mTc-DMSA), dietilaminopentocetena kiselina obilježena tehnecijem (99mTc-DTPA) te merkaptoacetiltriglicin obilježen tehnecijem (99mTc-MAG3). Uz ostale razvijene dijagnostičke postupke, scintigrafija bubrega se sve manje primjenjuje u kliničkoj praksi.
ENDOSKOPSKI DIJAGNOSTIČKI POSTUPCI
Cistoureteroskopija je invazivan dijagnostički postupak pri kojemu se posebnim instrumentom s kamerom ulazi kroz mokraćnu cijev u mokraćni mjehur i/ili mokraćovod s ciljem vizualizacije sluznice, uzimanja materijala za patohistološku dijagnostiku ili izvođenja određenih terapijskih zahvata. Pretraga se izvodi većinom na indikaciju uroloških bolesti pa uglavnom nije u domeni internista.
BIOPSIJA BUBREGA
Biopsija bubrega i uzorkovanje bubrežnoga parenhima predstavlja zlatni standard u dijagnostici parenhimskih bubrežnih bolesti. Danas se izvode perkutane biopsije bubrega automatskim uređajem na okidanje koji ima posebno izrađene igle kojima se dobije tkivo gotovo potpuno očuvane arhitekture, što je bitan preduvjet za prikladnu patohistološku analizu (Slika 5.1.). Biopsija se izvodi obično u ležećem položaju na trbuhu uz pritisak jastukom koji se stavlja ispod trbuha, a može se izvoditi i u položaju na boku i leđima. Cijeli postupak se izvodi pod ultrazvučnim nadzorom. Glavne indikacije, kontraindikacije i komplikacije prikazane su u Tablici 5.3. Nakon postupka preporučuje se hospitalno praćenje bolesnika tijekom 24 sata, ali se danas sve češće izvodi ambulantno (putem dnevne bolnice) uz mirovanje pod nadzorom 4 – 5 sati nakon biopsije, kada se kontroliraju krvna slika i mokraća Ako kontrolni nalazi postavljaju sumnju na komplikaciju – krvarenje, tada se to ultrazvučno provjeri i postupa sukladno nalazu. U većini slučajeva krvarenja radi se o kratkotrajnom prolaznom krvarenju u kanalni sustav, a rjeđe o perirenalnom hematomu koji se resorbira tijekom nekoliko dana. Ozbiljna krvarenja iznimno su rijetka. Više o biopsiji bubrega piše u poglavlju 'Glomerulske bolesti bubrega' (patohistološka dijagnostika glomerulskih bolesti).
|
Tablica 5.3. Indikacije, kontraindikacije i komplikacije biopsije bubrega
|
|
Indikacije
|
Kontraindikacije
|
Komplikacije
|
|
Nefrotički sindrom
Asimptomatska proteinurija
Asimptomatska hematurija
Akutni nefritički sindrom
Brzoprogresivni glomerulonefritis
Kronični glomerulonefritis
Nejasna bubrežna bolest
Bubrežni presadak
|
Adultna policistična bubrežna bolest
Izraziti poremećaj oblika i položaja
Uznapredovala kronična bubrežna bolest
Trudnoća viša od 30 tjedana gestacije
Hemoragijska dijateza
Hidronefroza
Infekcija bubrežnoga parenhima
Ekspanzivni proces
Solitarni bubreg (relativna)
|
Bol (obično umjerena)
Mikrohematurija
Makrohematurija
Perirenalni hematom
Infekcije bubrega i okolnoga tkiva
Ozljede okolnih organa
Arterijskovenska fistula
|
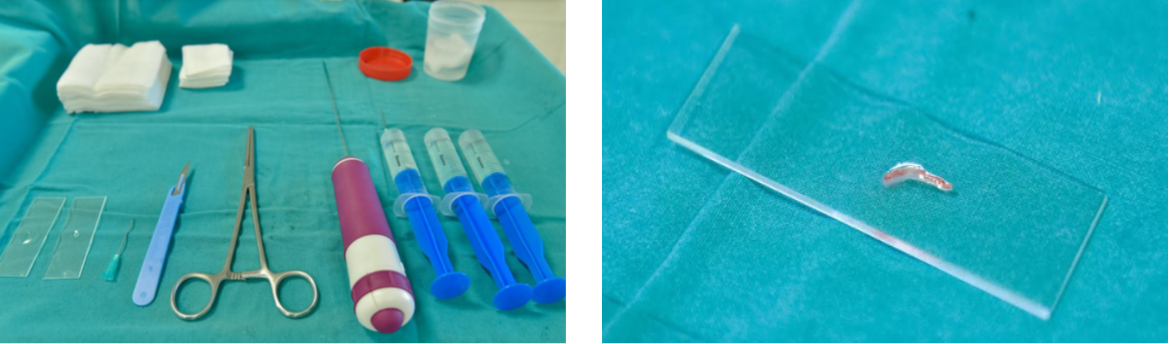
Slika 5.1. Biopsija bubrega (lijevo – oprema za postupak biopsije bubrega, desno – bioptat bubrega)
AKUTNO BUBREŽNO OŠTEĆENJE
Definicija. Akutno bubrežno oštećenje (prijašnji naziv akutno bubrežno zatajenje ili akutna renalna insuficijencija) predstavlja akutni, nagli poremećaj bubrežne funkcije koji se razvija unutar nekoliko sati ili dana te je obično reverzibilne prirode, ako se na vrijeme prepozna i otkloni njegov uzrok (oporavak tijekom nekoliko dana ili tjedana). Akutno bubrežno oštećenje ponajprije obilježava gubitak ekskrecijske bubrežne funkcije te posljedično zadržavanje dušičnih metabolita u krvi (azotemija), poremećaj regulacije volumena izvanstanične tekućine (hipervolemija) te elektrolitni poremećaj (hiperkalijemija, metabolička acidoza).
Stupnjevi. U procjeni težine akutnoga bubrežnog oštećenja danas se koriste dvije klasifikacije: RIFLE te KDIGO klasifikacija. Temelj obje klasifikacije leži u porastu serumskoga kreatinina i smanjenju izlučene mokraće. KDIGO (engl. The Kidney Disease: Improving Global Outcomes) podrazumijeva tri stupnja akutnoga bubrežnog oštećenja, dok klasifikacija RIFLE podrazumijeva tri stupnja poremećaja bubrežne funkcije – rizik, ozljeda i zatajenje (engl. R - risk, I - injury, F - failure) te dva ishoda – gubitak i završni stupanj bubrežne bolesti (engl. L - loss, E - end stage renal disease). Navedene klasifikacije i stupnjevi prikazani su tablično (Tablica 5.4. i Tablica 5.5.).
|
Tablica 5.4. Klasifikacija KDIGO
|
|
Stupanj
|
Serumski kreatinin
|
Diureza
|
|
Prvi stupanj
|
1,5 - 1,9 puta veći od bazalnih vrijednosti ili u porastu za bar 26,5 µmol/l
|
Manje od 0,5 ml/kg/sat tijekom 6 - 12 sati
|
|
Drugi stupanj
|
2 - 2,9 puta veći od bazalnih vrijednosti
|
Manje od 0,5 ml/kg/sat tijekom najmanje 12 sati
|
|
Treći stupanj
|
3 i više puta veći od bazalnih vrijednosti ili više od 354 µmol/l ili početak nadomjesštanja bubrežne funkcije
|
Manje od 0,3 ml/kg/sat tijekom najmanje 24 sata ili anurija tijekom barem 12 sati
|
|
Tablica 5.5. Klasifikacija RIFLE
|
|
Stupanj
|
Obilježja
|
|
R - risk
|
Porast kreatinina za bar 1,5 puta, pad GFR-a za bar 25 %
Diureza ispod 0,5 ml/kg/sat tijekom bar 6 sati
|
|
I - injury
|
Porast kreatinina za bar 2 puta, pad GFR-a za bar 50 %
Diureza ispod 0,5 ml/kg/sat tijekom bar 12 sati
|
|
F - failure
|
Porast kreatinina za bar 3 puta, pad GFR za bar 75 %
Diureza ispod 0,5 ml/kg/sat tijekom bar 24 sata ili anurija tijekom bar 12 sati
|
|
L - loss
|
Potpuni gubitak bubrežne funkcije
Nadomjesno liječenje dulje od 4 tjedna
|
|
E - end stage renal disease
|
Potpuni gubitak bubrežne funkcije
Nadomjesno liječenje dulje od 3 mjeseca
|
|
E - risk
|
Porast kreatinina za bar 1,5 puta, pad GFR-a za bar 25 %
Diureza ispod 0,5 ml/kg/sat tijekom bar 6 sati
|
Epidemiologija. Dijagnozu akutnoga bubrežnog oštećenja pri primitku u bolnicu ima oko 5 % bolesnika, dok se u jedinicama intenzivnoga liječenja ta učestalost povećava na 30 % pri primitku te se kod još otprilike 25 % bolesnika ona razvije tijekom boravka. Kod svih bolesnika s razvijenim akutnim bubrežnim oštećenjem pojavljuje se veća učestalost komplikacija, produljena hospitalizacija, kao i veća stopa smrtnosti, iako to ponajprije ovisi o težini bolesti. Učestalost akutnoga bubrežnog oštećenja osobito je česta kod septičkih bolesnika te se kod njih javlja s učestalošću od 25 %, odnosno 50 % ako se radi o septičkom šoku.
Etiopatogeneza. Klasično se pri razmatranju etiologije i patogeneze akutnoga bubrežnog oštećenja ona dijeli u tri kategorije ovisno o mjestu patofiziološkoga zbivanja: prerenalna (smanjena bubrežna perfuzija), renalna (bolesti tubula, glomerula i intersticija) te postrenalna (opstruktivna uropatija).
Prerenalno akutno bubrežno oštećenje najčešći je oblik akutnoga bubrežnog oštećenja (40 – 80 %), a nastaje kao posljedica bubrežne hipoperfuzije s posljedičnom ishemijom. Razvija se u slučajevima hipovolemije, smanjenoga srčanoga minutnog volumena, sustavne vazodilatacije te kod primjene određenih lijekova. Sustavna hipotenzija rezultira aktivacijom kompenzacijskih mehanizama kojima se pokušava održati normalna perfuzija mozga i miokarda (centralizacija krvotoka), a to su sustav renin-angitenzin-aldosteron, aktivacija simpatikusa te pojačano lučenje vazopresina i endotelina. Svi oni imaju vazokonstrikcijski učinak na mišićne i splanhične krvne žile, što dovodi do periferne i splanhične hipoperfuzije. S obzirom na to da je bubreg osjetljiv na ishemiju, postoji autoregulacijski mehanizam kojim se njegova perfuzija pokušava održati dostatnom i u uvjetima centralizacije krvotoka, a sve kako bi se očuvala glomerulska filtracija. Autoregulacijski mehanizam čini pojačana sinteza vazodilatatora kao što su prostaglandini i dušični oksid koji šire aferentnu arteriolu te angiotenzin II koji ima vazokonstrikcijski učinak na eferentnu arteriolu (veći broj receptora) kako bi se osigurao dostatan transglomerulski tlak i glomerulska filtracija. Ako patološko stanje perzistira ili se pogoršava, navedeni kompenzacijski mehanizmi postaju insuficijentni što će u konačnici rezultirati padom transglomerulskoga tlaka i glomerulske filtracije. Brzo otklanjanje uzroka i uspostava normalne perfuzije bubrega rezultirat će funkcionalnim oporavkom bubrežne funkcije, no ako se ishemija bubrega ne korigira, nastat će morfološke promjene i pravo, intrinzično bubrežno oštećenje (ishemijska akutna tubulska nekroza).
Hipovolemija se može naći u različitim bolestima i stanjima. Ona može biti posljedica dehidracije i smanjenoga unosa tekućine, pojačanoga gubitka tekućine (povraćanje, proljev, poliurija, opekline), gubitka tekućine u treći prostor (pankreatitis, peritonitis, crijevna opstrukcija) ili uslijed krvarenja.
Smanjen srčani minutni volumen i promjene žilnoga otpora. Smanjen srčani minutni volumen može biti posljedica bolesti miokarda (infarkt, upala), perikarda, tamponade, plućne embolije, globalnoga srčanog zatajenja te mehaničke ventilacije pozitivnim tlakom (bolesnici u JIL-u). Sustavnu vazodilataciju koja dovodi do značajne hipotenzije nalazimo ponajprije pri septičkom šoku i drugim sličnim stanjima (anafilaksija, anestezija).
Lijekovi koji mogu dovesti do akutnoga bubrežnog oštećenja su nesteroidni protuupalni lijekovi, ACE inhibitori te blokatori receptora angiotenzina II. Oni imaju učinak na autoregulacijske mehanizme kojima se nastoji održati transglomerulski tlak (NSAR blokiraju sintezu vazodilatacijskih prostaglandina, a ACE inhibitori i blokatori receptora angiotenzina II onemogućavaju vazokonstrikcijski učinak angiotenzina II na eferentnu arteriolu). Kontinuirana primjena adrenalina, noradrenalina i visokih doza dopamina dovodi do bubrežne vazokonstrikcije što pogoršava ishemiju bubrega.
Renalno (intrinzično) akutno bubrežno oštećenje nastaje uslijed oštećenja bubrežnoga parenhima koje rezultira morfološkim promjenama i promjenama bubrežne funkcije. Može se raditi o oštećenjima glomerula (akutni glomerulonefritis), tubula (akutna tubulska nekroza), intersticija (intersticijski nefritis) ili bubrežnih krvnih žila (sustavni vaskulitis). Četiri najčešća patološka entiteta koja se mogu prezentirati slikom akutnoga renalnoga bubrežnog oštećenja su akutna tubulska nekroza, intersticijski nefritis, akutni glomerulonefritis i vaskulopatije.
Akutna tubulska nekroza (ATN) je najčešći uzrok intrinzičnoga akutnoga bubrežnog oštećenja (oko 85 % slučajeva). Ona označava strukturno oštećenje tubula (nekroza, apoptoza) uslijed ishemije (ishemijska ATN) ili izravnoga učinka egzogenih ili endogenih nefrotoksina (toksična ATN). Ishemija bubrega, osim što dovodi do pada transglomerulskoga tlaka i glomerulske filtracije, ako je dovoljno jaka, dovodi i do neprikladne perfuzije bubrežnoga parenhima, što vodi prema strukturnim promjenama. Ishemijski ATN obično je udružen s produljenom hipotenzijom kod bolesnika s teškom volumnom deplecijom, šokom i sepsom. Toksični ATN uzrokovan je izravnim učinkom egzogenih (aminoglikozidi, amfotericin B, vankomicin, aciklovir, ciklosporin, radiološka kontrastna sredstva) ili endogenih nefrotoksina (mioglobinurija, hemoglobinurija, hiperuricemija). Navedeni toksini različitim patogenetskim mehanizmima mogu dovesti do tubulskoga oštećenja (izravan toksičan učinak, tubulska opstrukcija i mehaničko oštećenje, promjene hemodinamike, aktivacija neutrofila i sl.). Tubulske stanice posjeduju sposobnost regeneracije, tako da u slučaju uklanjanja uzročnoga čimbenika može doći do oporavka, a u tome veliku ulogu imaju različiti čimbenici rasta (inzulinu sličan čimbenik rasta I, epidermalni čimbenik rasta te čimbenik rasta hepatocita).
Intersticijski nefritis odgovoran je za 10 do 15 % slučajeva intrinzičnoga akutnoga bubrežnog oštećenja, a obilježavaju ga upalne promjene intersticija praćene edemom, staničnom infiltracijom i tkivnom destrukcijom. Najčešće je infektivne etiologije (streptokokne infekcije, leptospiroza, citomegalovirus, histoplazmoza), a može se razviti i kao posljedica uzimanja lijekova (penicilini, cefalosporini, sulfonamidi, fenitoin, alopurinol) ili u sklopu imunoloških poremećaja.
Akutni glomerulonefritis i vaskulopatije rjeđi su uzroci intrinzičnoga akutnoga bubrežnog oštećenja (oko 5 % slučajeva). Obično se radi o fokalnom ili difuznom mezangioproliferativnom glomerulonefritisu različite etiologije: glomerulonefritisi uzrokovani odlaganjem imunokompleksa (IgA nefropatija, postinfektivni glomerulonefritis, lupus nefritis i sl.), izravnim djelovanjem protutijela (Goodpastureov sindrom) ili stanično-posredovano oštećenje glomerula (pauci-immune akutni glomerulonefritis, tj. ANCA povezani vaskulitisi). Drugi, rjeđi vaskularni uzroci akutnoga bubrežnog oštećenja su hipertenzivna emergencija, diseminirana unutaržilna koagulopatija, hemolitičko-uremijski sindrom i trombotička trombocitopenična purpura, odnosno trombotička mikroangiopatija (TMA) do koje dovode.
Postrenalno akutno bubrežno oštećenje nastaje uslijed opstrukcije mokraćnih puteva na bilo kojoj razini i odgovorno je za 5 do 10 % svih slučajeva akutnoga bubrežnog oštećenja. Opstrukcija dovodi do zastoja mokraće i povišenja intraluminalnoga tlaka koji dovodi do oštećenja parenhima, smanjene bubrežne perfuzije te u konačnici smanjenja glomerulske filtracije. Kada se opstrukcija na vrijeme prepozna i razriješi, nastale promjene su reverzibilnoga karaktera. Da bi se razvilo akutno bubrežno oštećenje, opstrukcija mora biti lokalizirana između vrata mokraćnoga mjehura i vanjskoga otvora mokraćne cijevi ili mora doći do opstrukcije oba mokraćovoda ili samo jednoga kod bolesnika kojima funkcionira samo jedan bubreg.
Najčešći su uzorci benigna hiperplazija prostate kod muškaraca, uzimanje antikolinergika, tumori mokraćnoga mjehura, prostate i cerviksa kod žena, dok su rjeđi obostrana ureterolitijaza ili bilateralna papilarna nekroza.
Klinička slika. Simptomi i znakovi akutnoga bubrežnog oštećenja su nespecifični, osobito u početku bolesti. U kliničkoj slici dominiraju simptomi i znakovi uremijskoga sindroma, smanjena diureza, simptomi i znaci volumnoga preopterećenja te drugih komplikacija. Kako se akutno bubrežno oštećenje obično razvija u podlozi neke druge bolesti ili stanja (npr. sepsa), kliničkom slikom mogu dominirati simptomi i znakovi te osnovne bolesti, a da na akutno bubrežno oštećenje ukazuje samo smanjenje diureze i porast dušičnih metabolita u serumu.
Uremijski sindrom obilježava opća slabost i malaksalost, mučnina i povraćanje, neodređeni bolovi u trbuhu, slabljenje kognitivnih funkcija te razvoj poremećaj stanja svijesti.
Smanjena diureza. Najdominantniji znak akutnoga bubrežnog oštećenja je oligurija (diureza manja od 400 ml/dan) ili anurija (diureza manja od 100 ml/dan), dok su neoligurični oblici rjeđi u kliničkoj praksi (nefrogeni dijabetes insipidus, tubulointersticijski poremećaji). Anurija je povezana s lošijim kliničkim ishodima u odnosu na oliguriju. Svako smanjenje diureze treba pobuditi sumnju na akutno bubrežno oštećenje.
Volumno preopterećenje. Zbog smanjene diureze razvija se hipervolemija koja može dovesti do srčanoga popuštanja i plućne kongestije (dispneja, auskultacijski nalaz vlažnih hropaca, periferni edemi, distendirane vratne vene), osobito kod kroničnih kardiopata. Kod takvih bolesnika može se naći i hipertenziju te drugi izljeve (pleuralni izljevi, perikardni izljev, ascites).
Ostale komplikacije. Najčešće i među prvim komplikacijama razvijaju se poremećaji elektrolitnoga statusa: dolazi do zadržavanja vodikovih iona i razvoja metaboličke acidoze te kalija i hiperkalijemije koji nose svoje rizike i opasnosti. Hiponatrijemija je česta, ali nije prava, nego se razvija zbog dilucije u stanju hipervolemije. Rjeđe komplikacije uključuju zahvaćanje probavnoga sustava (erozivni gastritis i ulceracije zbog djelovanja uremijskih toksina), krvi i krvotvornih organa (pancitopenija zbog depresije koštane srži, sklonost krvarenju zbog disfunkcije trombocita), središnjega živčanog sustava (uremična encefalopatija) i druge.
Dijagnoza. Osnovni dijagnostički pristup bolesniku s akutnim bubrežnim oštećenjem uključuje anamnezu i fizikalni pregled, laboratorijske pretrage krvi i mokraće, osnovnu radiološku obradu te u nekim slučajevima biopsiju bubrega.
Anamneza i fizikalni pregled imaju ključnu ulogu u procjeni uzroka nastanka akutnoga bubrežnog oštećenja. Slabija hidracija, povraćanje, proljev, infekcije i sl., uz razvijene znakove dehidracije i hipovolemije (ortostatička hipotenzija, tahikardija, oslabljen turgor kože, suhe i obložene sluznice) mogu ukazivati na prerenalnu etiologiju, dok pozitivna anamneza na nefrolitijazu, bolest prostate i slične bolesti uz odgovarajuću kliničku sliku mogu ukazivati na postrenalnu etiologiju. Podaci o uzimanju lijekova koji mogu utjecati na bubrežnu funkciju bitni su pri procjeni intrinzičnoga uzroka akutnoga bubrežnog oštećenja (nesteroidni protuupalni lijekovi, ACE inhibitori, blokatori angiotenzin II receptora, antibiotici, kemoterapeutici, kontrastna sredstva i sl.).
Laboratorijske krvne pretrage. Osnovni i karakteristični znak akutnoga bubrežnog oštećenja porast je dušičnih metabolita u krvi (ureja, kreatinin), što se naziva azotemija. Dinamika ovih nalaza je brza, te kako nalazi brzo rastu, tako se i nakon uklanjanja uzroka brzo smanjuju i mogu se normalizirati tijekom nekoliko dana ili tjedana, ako ne nastupi nepovratno oštećenje. Ostali nalazi koji prate akutno bubrežno oštećenje su različiti stupnjevi hiperkalijemije i metaboličke acidoze, kao i hipokalcijemija. Ovisno o etiologiji, značajniju ulogu imaju i drugi nalazi (kreatin kinaza, mioglobin, urična kiselina, koagulacijska obilježja, serološki biljezi), što je prikazano tablično.
Laboratorijske pretrage mokraće. Sediment mokraće kod ovih bolesnika uglavnom je patološki i ima visok dijagnostički značaj. Sediment mokraće kod prerenalnoga akutnoga bubrežnog oštećenja može biti i uredan. Određeni patološki nalazi mogu ukazivati na etiologiju akutnoga bubrežnog oštećenja, što je prikazano u Tablici 5.6. Proteinurija je također čest nalaz, ali je ona uglavnom umjerenoga tipa (do 1 g/dan), dok su proteinurije nefrotičkoga razreda (> 3,5 g/dan) rjeđe i nalaze se eventualno uslijed teških brzoprogresivnih glomerulonefritisa, vaskulitisa ili intersticijskoga nefritisa.
|
Tablica 5.6. Diferencijalna dijagnoza patološkoga nalaza sedimenta urina
|
|
Patološki nalaz
|
Moguća etiologija
|
|
Pretežito uredan, hijalini cilindri
|
Prerenalno ili postrenalno ABO, arterijska tromboza ili embolija, HUS ili TTP
|
|
Eritrociti i eritrocitni cilindri
|
Glomerulonefritis, vaskulitis, maligna hipertenzija, trombotička mikroangiopatija
|
|
Leukociti i leukocitni cilindri
|
Intersticijski nefritis, pijelonefritis, odbacivanje bubrežnoga presatka, glomerulonefritis
|
|
Epitelni i pigementirani cilindri
|
Akutna tubulska nekroza, mioglobinurija, hemoglobinurija, tubulointersticijski nefritis
|
|
Granulirani cilindri
|
Akutna tubulska nekroza, glomerulonefritis, vaskulitis, tubulointerstcijski nefritis
|
|
Eozinofilurija
|
Alergijski intersticijski nefritis, ateroembolijska bolest, glomerulonefritis, pijelonefritis
|
|
Kristalurija
|
Akutna urična nefropatija, sindrom lize tumora, intoksikacija etilen-glikolom (kalcij-oksalat)
|
Radiološka dijagnostika. Osnovna radiološka pretraga kod bolesnika s akutnim bubrežnim oštećenjem je ultrazvuk bubrega. Ultrazvučno se odmah može zaključiti radi li se o opstruktivnoj uropatiji (dilatacija kanalnoga sustava) te dobiti uvid u to radi li se o akutnom poremećaju ili pogoršanju kronične bubrežne bolesti. Bubrezi su pri kroničnoj bubrežnoj bolesti obično smanjeni (osim kod dijabetičke nefropatije i infiltrativnih bolesti, autosomno dominantne policistične bubrežne bolesti i dugotrajne hidronefoze) i hiperehogeni. Kod akutnoga bubrežnog oštećenja bubrezi su obično uredne veličine i ehogenosti, s time da kod akutnoga intersticijskog nefritisa mogu biti i uvećani. Kod sumnje na krvožilnu etiologiju i kada se radi o bolesniku s presađenim bubregom indicirana je i doplerska analiza bubrežnih arterija i vena.
Biopsija bubrega indicirana je kod bolesnika kod kojih se prethodno navedenim pretragama ne može precizirati osnovni uzrok, tj. dijagnoza, ili njezina potvrda. Najčešće se indicira kod bolesnika kod kojih se sumnja na intrinzičnu patologiju, kao što su glomerulonefritis, intersticijski nefritis, vaskulitis ili poremećaj funkcije bubrežnoga presatka. Pretraga se mora izvoditi strogo racionalno zbog većega rizika od komplikacija, osobito od krvarenja.
Diferencijalna dijagnoza. Dvije osnovne dvojbe kod bolesnika s akutnim bubrežnim oštećenjem su: 1) radi li se o akutnom pogoršanju kronične bubrežne bolesti i 2) radi li se o prerenalnoj, renalnoj ili postrenalnoj patologiji, što je ključno zbog daljnjega pristupa liječenju, a u nastavku će biti opisana i tablično prikazana diferencijalna dijagnoza najčešćih uzroka akutnoga bubrežnog oštećenja (Tablica 5.7., Tablica 5.8., Tablica 5.9. i Tablica 5.10.).
Akutno bubrežno oštećenje ili akutno pogoršanje kronične bubrežne bolesti? U diferenciranju ova dva stanja pomaže nam nekoliko obilježja: 1) trajanje simptoma i znakova (npr. nokturija koja traje dulje vrijeme ukazuje na kroničnu bubrežnu bolest); 2) prijašnji patološki nalazi sedimenta mokraće i/ili nalaza ureje i kreatinina također ukazuju na kroničnu bolest; 3) ultrazvuk bubrega (u kroničnoj bubrežnoj bolesti oni su obično smanjeni i hiperehogeni, osim u slučaju dijabetičke nefropatije i infiltrativnih bolesti, autosomno dominantne policistične bubrežne bolesti ili dugotrajne opstrukcije, dok su kod akutnoga bubrežnog oštećenja normalne veličine ili povećani); 4) brze promjene vrijednosti serumskoga kreatinina ili eGFR govore u prilog akutnom procesu te 5) u laboratorijskim nalazima u kroničnoj bubrežnoj bolesti obično nalazimo anemiju kronične bolesti te hiperparatireoidizam (povišene vrijednosti paratireoidnoga hormona, hipokalcijemija, hiperfosfatemija).
Prerenalno, renalno ili postrenalno akutno bubrežno oštećenje? U procesu diferenciranja razine akutnoga bubrežnog oštećenja koristimo se anamnestičkim podacima, ultrazvučnom pretragom bubrega te nekim specifičnostima u laboratorijskim nalazima. Često nam već sami anamnestički podaci ukazuju na moguću etiologiju akutnoga bubrežnog oštećenja: krvarenje, dehidracija, pojačan gubitak tekućine, prekomjeran unos lijekova, izloženost kontrastnim sredstvima, nefrolitijaza, bolest prostate i dr. Ultrazvučna pretraga bubrega ključna je u razrješenju dvojbe radi li se o opstruktivnoj uropatiji i postrenalnom akutnom bubrežnom oštećenju. Određeni laboratorijski nalazi mogu ukazivati na renalnu ili prerenalnu etiologiju, a to su odnos ureje i kreatinina, frakcija ekskrecije natrija te sposobnost koncentriranja mokraće. Ove laboratorijske značajke temelje se na funkciji tubula koja je očuvana u prerenalnoj, a poremećena pri renalnom akutnom bubrežnom oštećenju. Odnos ureje i kreatinina u prerenalnom akutnom bubrežnom oštećenju pokazuje neproporcionalno povećane serumske koncentracije ureje u odnosu na kreatinin uslijed pojačane reapsorpcije ureje u tubulima što izostaje kod renalne etiologije. Frakcija ekskrecije natrija (FeNa) može biti korisna u procjeni prerenalne i renalne etiologije akutnoga bubrežnog oštećenja. U prerenalnoj azotemiji sa smanjenjem glomerulske filtracije pojačava se tubulska reapsorpcija natrija, zbog čega je FeNa smanjena (manja od 1 %), dok kod renalne etiologije, zbog poremećaja funkcije tubula, izostaje ova reapsorpcija te je FeNa veća (veća od 1 – 2 %). FeNa se matematički računa iz vrijednosti koncentracija natrija i kreatinina u serumu i u mokraći. Gubitak sposobnosti koncentriranja mokraće posljedica je oštećenja tubula, što nalazimo u renalnom akutnom bubrežnom oštećenju, a očituje se stvaranjem mokraće niske osmolalnosti (< 500 mOsm/kg).
|
Tablica 5.7. Diferencijalna dijagnoza najčešćih uzroka ABO-a
|
|
Etiološki entitet
|
Klinička obilježja
|
Laboratorijski nalazi
|
Napomena
|
|
Prerenalna azotemija
|
Smanjen unos tekućine
Pojačan gubitak tekućine
Krvarenje
Srčano popuštanje
Lijekovi (NSAID, ACE inhibitori, blokatori angitenzin II receptora)
|
Omjer ureja:kreatin > 20:1
FeNa < 1 %
Hijalini cilindri u sedimentu
Specifična težina mokraće > 1,018
Osmolalnost mokraće > 500 mOsm/kg
|
Smanjena FeNa te velika specifična težina i osmolanost mogu izostati ako se radi o kroničnoj bubrežnoj bolesti
|
|
Akutno bubrežno oštećenje udruženo sa sepsom
|
Sepsa, septički šok
|
Granulirani cilindri u sedimentu
Epitelne stanice u sedimentu
Pozitivne kulture (urin, krv)
|
FeNa može biti manja od 1 %, ali je obično veća od 1 % i osmolalnost mokraće veća od 500 mOsm/kg
|
|
Ishemijska akutna tubulska nekroza
|
Sistemska hipotenzija (šok)
Starija životna dob
Ranije poznata bubrežna bolest
|
Granulirani cilindri u sedimentu
Epitelne stanice u sedimentu
FeNa > 1 %
|
|
|
Tablica 5.8. Diferencijalna dijagnoza ABO-a uzrokovanoga endogenim toksinima
|
|
Etiološki entitet
|
Klinička obilježja
|
Laboratorijski nalazi
|
Napomena
|
|
Rabdomioliza
|
Traumatski crush sindrom
Dugotrajna imobilizacija
|
Povišen mioglobin i CK
Eritrociturija
|
FeNa može biti mala (< 1 %)
|
|
Hemoliza
|
Posttransfuzijska reakcija
|
Anemija, povećan LDH, smanjen haptoglobin
|
FeNa može biti mala (< 1 %)
|
|
Sindrom lize tumora
|
Nedavna kemoterapija
|
Hiperfosfatemija, hipokalcijemija,
hiperuricemija
|
|
|
Multipli mijelom
|
Vrućica, osip, artralgije
Izlaganje lijekovima
|
Monoklonski šiljak (elektroforeza bjelančevinaa), anemija
|
Biopsija koštane srži
Biopsija bubrega
|
|
Tablica 5.9. Diferencijalna dijagnoza ABO-a uzrokovanoga egzogenim toksinima
|
|
Etiološki entitet
|
Klinička obilježja
|
Laboratorijski nalazi
|
Napomena
|
|
Kontrastna nefropatija
|
Izlaganje radiološkim kontrastnim sredstvima
|
Porast serumskoga kreatinina za 1 - 2 dana, najveće vrijednosti 3. - 5. dan, oporavak vrijednosti tijekom 7 dana
|
FeNa može biti mala (
|
|
Lijekovi i toksini
|
Aminoglikozidi, cisplatina, tenofovir, zoledronat, etilenglikol
|
Granulirani cilindri i epitelne stanice; FeNa > 1 %
|
Može se javiti kao oligurično i neoligurično akutno bubrežno oštećenje
|
|
Intersticijski nefritis
|
Nedavno izlaganje lijekovima
Vrućica, osip, artralgije
Obično neoligurično akutno bubrežno oštećenje
|
Eozinofilija, sterilna piurija
|
Eozinofili u mokraći imaju ograničeno značenje; Biopsija bubrega može biti korisna
|
|
Tablica 5.10. Diferencijalna dijagnoza ABO-a ostalih uzroka
|
|
Etiološki entitet
|
Klinička obilježja
|
Laboratorijski nalazi
|
Napomena
|
|
Glomerulonefritis/vaskulitis
|
Osipi, artralgije, temperatura
Sinusitis, alveolarna hemoragija
|
ANA, ANCA, anti-GBM pozitivni
Sniženi C3 i C4
Krioglobulini, ASO titar
|
Biopsija bubrega je presudna za dijagnozu
|
|
Intersticijski nefritis
|
Intersticijski nefritis-uveitis sindrom, Legionela infekcije
Obično neoligurična ABO
|
Eozinofilija, sterilna piurija
|
Eozinofili u mokraći imaju ograničeno značenje; Biopsija bubrega može biti korisna
|
|
TTP/HUS
|
Neurološka očitovanja
Nedavna bolest praćena proljevom
Primjena kalcijneurinskoga inhibitora
|
Trombocitopenija, povećan LDH, anemija, schistociti u razmazu periferne krvi
|
Definitivna potvrda TTP probirom na ADAMTS13;
Biopsija bubrega
|
|
Ateroembolijska bolest
|
Nedavna bolest aorte, ispadi cirkulacije, generalizirana ateroskleroza
|
Eozinofili u urinu
Proteinurija
|
Biopsija bubrega
|
|
Postrenalno akutno bubrežno oštećenje
|
Nefrolitijaza, bolest prostate, tumor male zdjelice ili retroperitoneja
|
Piurija, hematurija
|
Ultrazvuk, kompjutorizirana tomografija
|
Liječenje. Temelj liječenja leži u liječenju i uklanjanju osnovnoga uzroka koji je doveo do akutnoga bubrežnog oštećenja. Što se ono prije prepozna i započne s liječenjem, to su i veći izgledi za oporavak bubrežne funkcije. Etiološko liječenje podrazumijeva liječenje podloge prerenalnoga bubrežnog oštećenja (prikladna resuscitacija izgubljenoga volumena, kardiocirkulatorna stabilizacija), postrenalnoga bubrežnog oštećenja (razrješenje opstrukcije) ili intrinzičnoga bubrežnog oštećenja (najčešće primjena kortikosteroida i/ili imunomodulatora, ovisno o uzročnom stanju/bolesti). Do postavljanja etiološke dijagnoze akutnoga bubrežnog oštećenja i njezine sanacije potrebno je provoditi liječenje kojim se nastoji potaknuti/održati bubrežna funkcija, spriječiti daljnje napredovanje bolesti te sprečavati i liječiti nastale komplikacije, a to možemo konzervativnim mjerama ili nekim od postupaka nadomještanja bubrežne funkcije.
Konzervativno liječenje akutnoga bubrežnog oštećenja u prvom redu podrazumijeva održavanje volumnoga i elektrolitnog statusa uz ostale simptomatske mjere (prevencija infekcija, prilagodba doze primjenjivanih lijekova, optimizacija nutritivnoga unosa).
Održavanje volumnoga statusa jedna je od glavnih mjera liječenja u akutnom bubrežnom oštećenju. Ona se temelji na procjeni volumnoga statusa (hipovolemičan ili hipervolemičan bolesnik), a na temelju fizikalnoga nalaza (edemi, turgor kože, vlažnost sluznica, vrijednost krvnoga tlaka) i drugih dijagnostičkih postupaka (radiološki dokazana plućna kongestija, ultrazvučno mjeren promjer donje šuplje vene, prisutnost B linija na ultrazvučnom pregledu pluća).
Svim hipovolemičnim bolesnicima potrebna je primjerena volumna resuscitacija infuzijskim otopinama (najprikladnije su kristaloidne otopine) ili u slučaju krvarenja krvnim pripravcima ili koloidnim otopinama (otopine hidroksietil škroba). Koloidne otopine indicirane su samo i jedino ako krvni pripravci nisu na raspolaganju, a radi se o hemoragijskom šoku. Praćenjem krvnoga tlaka i satne diureze procjenjuje se uspješnost volumne resuscitacije. Količina volumena koji se mora nadoknaditi individualno je različit i treba se korigirati prema kliničkim obilježjima (klinički status, diureza, mjerenje središnjega venskog tlaka), a može iznositi i više litara tekućine u prvim satima. Ako se nastavi nadoknada volumena bez da se postiže prikladna diureza, bolesnici ulaze u rizik od volumnoga preopterećenja i tada se mogu uključiti diuretici (davanje diuretika bez prethodne volumne resuscitacije je kontraindicirano). Najčešće se u tu svrhu primjenjuje furosemid, obično je početno bolusna primjena 40 - 80 mg intravenski, na što se nastavlja kontinuirana primjena 125 - 250 mg tijekom 24 sata. Iznimno se mogu primjenivati i veće doze. Diuretički učinak može se dodatno pokušati pojačati intravenskom primjenom klorotiazida (250 - 500 mg svakih 8 do 12 sati).
Kod hipervolemičnih bolesnika indicirana je promptna primjena diuretika uz restrikciju unosa soli i tekućine. Kako je to već opisano, diuretik izbora je furosemid, s ili bez dodatne primjene klorotiazida, a u obzir dolazi i primjena torasemida (sulfonamidski diuretik Henleove petlje). Ako se niti diureticima ne postigne odgovarajuća diureza, a bolesnici su ugroženi od hipervolemije (plućni edem), indiciran je postupak ultrafiltracije.
Održavanje elektrolitnoga statusa drugi je bitan čimbenik liječenja akutnoga bubrežnog oštećenja. Pri tome se u prvom redu misli na liječenje hiperkalijemije, metaboličke acidoze te drugih elektrolitnih poremećaja.
Hiperkalijemija predstavlja ozbiljan elektrolitni poremećaj koji može dovesti do poremećaja srčanoga ritma. Liječenje podrazumijeva primjenu kalcijeva-glukonata, inzulina i glukoze, diuretika (furosemid) te beta-agonista (salbutamol). Detaljno su liječenje i učinak lijekova opisani u dijelu o poremećajima elektrolita.
Metabolička acidoza u prvom se redu liječi primjenom natrijevoga bikarbonata, a uključuje se kada vrijednost bikarbonata u arterijskoj krvi padne ispod 15 mmol/l. Uporna metabolička acidoza koja ne reagira na mjere konzervativnoga liječenja zahtijevat će postupak hemodijalize.
Ostali elektrolitni poremećaji koji zahtijevaju liječenje su hiponatrijemija, hiperfosfatemija i hipokalcijemija. Hiponatrijemija zahtijeva restrikciju unosa tekućine, a rijetko se primjenjuju hipertonične otopine kao što je 3 %-tni NaCl, i to samo ako postoje simptomi. Hipokalcijemija i hiperfosfatemija mogu se popraviti smanjenjim unosom hrane koja sadrži fosfate te primjenom vezača fosfata (kalcijev acetat, aluminijev hidroksid), dok se venski pripravci kalcija primjenjuju samo kod jasno simptomatskih bolesnika.
Ostale simptomatske mjere liječenja akutnoga bubrežnog oštećenja prodrazumijevaju optimizaciju medikamentne terapije, primjeren nutritivni unos te prevenciju infekcija, tromboze i gastrointestinalnoga krvarenja.
Optimizacija medikamentne terapije podrazumijeva isključenje iz terapije lijekova koji mogu znatno naštetiti bubrežnoj funkciji (ACE inhibitori, blokatori angiotenzinskih receptora, nesteroidni protuupalni lijekovi) te prilagodbu doze ostalih lijekova oštećenoj bubrežnoj funkciji, osobito kada se radi o lijekovima koji se dominantno ili jedino luče putem bubrega i mokraćom.
Primjeren nutritivni unos podrazumijeva restrikciju unosa soli i kalija te ograničenje unosa bjelančevina na oko 40 g/dan (0,5 mg/kg/dan) uz osiguranje prikladnoga kalorijskog unosa (20 - 30 kcal/kg/dan). Prekomjeran unos bjelančevina povezan je s pogoršanjem azotemije. Ako se nutritivna potpora ne može osigurati enteralnim putem (per os, nazogastrična sonda), indicirana je i parenteralna prehrana.
Zbog sklonosti infekcijama bolesnicima se u terapiju uključuju antibiotici širokoga spektra u prilagođenoj dozi, prevencija gastrointestinalnoga krvarenja povezana s uremijom ostvaruje se primjenom inhibitora protonske pumpe (npr. pantoprazol 40 mg/dan 1 – 2 x dnevno), a venski tromboembolijski događaji preveniraju se primjenom niskomolekulskoga heparina.
Nadomještanje bubrežne funkcije (NBF, a engl. RRT – renal replacement therapy) indicirano je za bolesnike koji ne reagiraju na mjere konzervativnoga liječenja. Glavne indikacije su 1) volumno preopterećenje (plućna kongestija i edem), 2) hiperkalijemija i metabolička acidoza koje ne reagiraju na standarne mjere konzervativnoga liječenja te 3) uremijski sindrom (perikarditis, perikardni izljev, encefalopatija, uremično krvarenje). Ne postoji konsenzus pri kojim se laboratorijskim nalazima kreće s ovim oblikom liječenja, iako načelno gledano, serumska ureja veća od 30 mmol/l i/ili kreatinin veći od 600 µmol/l predstavljaju jednu od indikacija, ali sama odluka treba se temeljiti na sveobuhvatnom načelu (kliničko stanje, laboratorijski nalazi, kondicijsko stanje bolesnika, smislenost postupka). Također, ne postoji konsenzus niti o vremenu kada započeti s nadomještanjem bubrežne funkcije, kasni početak ovakvoga liječenja povezan je s većom učestalosti komplikacija koje nosi akutno bubrežno oštećenje, kao i s manjom stopom oporavka bubrežne funkcije, dok prerani početak može dovesti do nepotrebnoga izlaganja rizicima koje nosi ovaj postupak (komplikacije vezane uz osiguranje žilnoga pristupa, infekcije i dr.). Ipak, današnji stav u liječenju akutnoga bubrežnog oštećenja, a osobito kod kritično oboljelih bolesnika, temelji se na ranijem početku hemodijalize, dok ima još ostatne bubrežne funkcije, iako se po ovom pitanju vode različite rasprave i provode istraživanja. Načelno, u liječenju akutnoga bubrežnog oštećenja na raspolaganju nam stoje dvije vrste postupaka: intermitentna i kontinuirana dijaliza. Obje metode zahtijevaju osiguran prikladan venski put, što se obično kod akutnih bolesnika postiže postavljanjem netuneliranih središnjih venskih katetera namijenjenih za postupak dijalize u neku od velikih vena (v. femoralis, v. subclavia, v. iugularis interna).
Intermitentna dijaliza podrazumijeva postuapk dijalize koji se provodi intermitentno, svaki dan ili svakih nekoliko dana. Kod bolesnika koji još nisu bili dijalizirani početak mora biti postupan i prva dijaliza trebala bi trajati 1 do 2 sata da bi se izbjegli poremećaji uslijed nagloga uklanjanja uremijskih toksina, kao što je edem mozga (dijalizni disekvilibrij), a daljnje dijalize mogu trajati 1 do 2 sata kada se provode svaki dan ili 3 do 4 sata kada se provode svaka 3 do 4 dana (ali to u prvom redu ovisi o kliničkom stanju bolesnika i napredovanju oporavka bubrežne funkcije). Intermitentna dijaliza provodi se kod hemodinamički stabilnih bolesnika, a ovisno o indikaciji može se provoditi hemodijaliza, hemofiltracija ili hemodijafiltracija (kod volumno opterećenih bolesnika potrebna je ultrafiltracija i eliminacija vode, dok kod bolesnika u hipovolemiji dijalizu provodimo bez ultrafiltracije).
Kontinuirana dijaliza podrazumijeva postupak dijalize koji se provodi kontinuirano kroz 24 i više sati, a pogodna je za hemodinamički nestabilne bolesnike, osobito one koji se nalaze u jedinicama intenzivnoga liječenja. Glavna prednost leži u činjenici da se paralelno s eliminacijom volumena može vršiti i istodobna suspstitucija, tako da ne dolazi do značajnoga narušavanja hemodinamike (npr. ako stvarni gubitak iznosi 1000 ml/sat, a supstitucija 900 ml/sat, neto gubitak u konačnici iznosi 100 ml/sat). Postupci kontinuirane hemodijalize su spora kontinuirana ultrafiltracija (SCUF), kontinuirana veno-venska hemofiltracija (CVVH), kontinuirana veno-venska hemodijaliza (CVVHD) te kontinuirana veno-venska hemodijafiltracija (CVVHDF).
Načela rada, mogućnosti i indikacije za pojedine metode dijalize (intermitentne i kontinuirane) objašnjeni su u posebnom poglavlju (nadomještanje bubrežne funkcije).
Prognoza. Kod većine bolesnika s akutnim bubrežnim oštećenjem, kada se ono na vrijeme prepozna i pravilno liječi, oporavak bubrežne funkcije može se očekivati tijekom jednoga do tri tjedna, a u fazi oporavka često se prati pojačana diureza (tzv. diuretička ili poliurična faza) koja traje nekoliko dana. Nekomplicirano akutno bubrežno oštećenje ima smrtnost manju od 5 do 10 %, dok se taj postotak višestruko povećava kod bolesnika sa složenim akutnim bubrežnim oštećenjem (znakovi zatajenja drugih sustava/organa) i katkad iznosi i više od 50 do 70 %.
POSEBNI OBLICI AKUTNOGA BUBREŽNOG OŠTEĆENJA
Rabdomioliza nastaje kao posljedica oštećenja skeletnih mišića s posljedičnim otpuštanjem intracelularnoga mioglobina u cirkulaciju, što može dovesti do opstrukcije tubula i akutne tubulske nekroze, s posljedičnom kliničkom slikom akutnoga bubrežnog oštećenja. Uzroci mogu biti različiti: traumatična ozljeda, kompartment sindrom (crush ozljeda ili sindom nagnječenja tkiva), dugotrajne mišićne kontrakcije (epileptički status), tjelesni napor (dugotrajno trčanje, bicikliranje) ili lijekovima i toksinima uzrokovano oštećenje mišića (statini, antimalarici, zmijski otrovi, alkohol, heroin). U laboratorijskim nalazima nalazimo povećane serumske koncentracije kalija, fosfata i laktata uz značajan porast skeletnih enzima (kreatin kinaza, mioglobin, aspartat aminotransferaza). Glavni terapijski postupak je obilna hidracija i volumna resuscitacija, a kod visokih koncentracija serumskoga mioglobina preporučuje se i primjena natrijevoga bikarbonata (zalužnjavanje mokraće, bolje izlučivanje mioglobina). Kod traumatičnih oštećenja i kompartment sindroma indicirana je i kirurška obrada.
Kontrastna nefropatija označava akutno bubrežno oštećenje koje nastaje kao posljedica djelovanja kontrastnih radioloških sredstava na bazi joda, a tipično se razvija kod bolesnika s otprije poznatom (ili neprepoznatom) oštećenom bubrežnom funkcijom. Patofiziološki, oštećenje nastaje izravnim toksičnim učinkom, kao i posredno putem bubrežne vazokonstrikcije, a težina oštećenja ovisna je o dozi i količini kontrasta. Kontrastna nefropatija razvija se obično unutar 24 do 48 sati od primjene kontrasta. Najčešće se radi o prolaznom i reverzibilnom poremećaju, iako nekada mogu zaostati i trajne promjene. Rizični čimbenici za razvoj kontrastne nefropatije su uznapredovala životna dob, hipovolemija, srčano popuštanje te koegzistencija druge bubrežne patologije (npr. dijabetička ili hipertenzivna nefropatija) te primjena lijekova koji mogu narušiti bubrežnu funkciju (ACE inhibitori, NSAID). Kod bolesnika s rizičnim čimbenicima za razvoj kontrastne nefropatije preporučuje se priprema prije planirane pretrage, koja u prvom redu uključuje prikladnu hidraciju (1 l fiziološke otopine prije same pretrage te 1 l tijekom 8 - 12 sati nakon pretrage) te primjenu N-acetilcisteina (2 x 600 mg per os s razmakom od 12 sati, prije i poslije pretrage ili 1200 mg intravenski u hitnom postupku pije pretrage), iako njegov pozitivan učinak nije potvrđen ni dokazan. Uz ove preporuke preporučuje se i izbjegavanje istodobne primjene drugih nefrotoksina, uz korištenje manjih volumena kontrasta koji imaju manju osmolalnost.
Ostali oblici akutnoga bubrežnog oštećenja, kao što su hepatorenalni sindrom, kardiorenalni sindrom te sindrom lize tumora, bit će opisani u odgovarajućim poglavljima.
Definicija. Kronična bubrežna bolest (engl. chronic kidney disease, CKD), prijašnjega naziva kronično bubrežno zatajenje, podrazumijeva postupno, napredujuće i nepovratno propadanje bubrežne funkcije koje se razvija tijekom više mjesece ili godina.
Epidemiologija. Kronična bubrežna bolest kao klinički entitet bilježi sve veću učestalost u općoj populaciji s obzirom na sve veću učestalost šećerne bolesti i arterijske hipertenzije koji su među najbitnijim i najčešćim uzrocima kronične bubrežne bolesti. Također, učestalost raste i sa životnom dobi, pa je kronična bubrežna bolest daleko učestalija kod osoba starijih od 65 godina. Procjenjuje se da prevalencija kronične bubrežne bolesti u općoj populaciji u razvijenim zemljama iznosi 10 do 15 %.
Etiologija. Kronična bubrežna bolest može biti uzrokovana različitim bolestima i stanjima koje zahvaćaju bubreg, osobito ako se radi o duljem vremenskom razdoblju. Dva najčešća uzroka su šećerna bolest (dijabetička nefropatija), koja je odgovorna za 45 % slučajeva kroničnoga bubrežnog zatajenja, te arterijska hipertenzija (hipertenzivna nefroangioskleroza), koja je odgovorna za 30 % slučajeva. Mogući uzroci kronične bubrežne bolesti su i 1) prirođene i nasljedne bolesti (autosomno dominantna policistična bubrežna bolest, medularna cistična bolest, kongenitalna opstruktivna uropatija, tuberozna skleroza), 2) primarne bolesti glomerula (fokalna i segmentalna glomeruloskleroza, membranoproliferativni glomerulonefritis, IgA nefropatija, membranska nefropatija), 3) sekundarne bolesti glomerula (šećerna bolest, autoimune sustavne bolesti, bolesti odlaganja), 4) bolesti tubulointersticija (tubulointersticijski nefritis, refluksna nefropatija, nefropatija aristolohične kiseline, nefrokalcinoza, kronični pijelonefritis), 5) bolesti bubrežnih krvnih žila (hipertenzivna nefroangioskleroza, renovaskularna bolest, vaskulitis malih i srednje velikih arterija) te 6) opstruktivna uropatija (nefrolitijaza, bolesti prostate, tumori male zdjelice, retroperitonejska fibroza).
Patogeneza. Sve prethodno navedene bolesti koje mogu zahvatiti bubreg, a traju dulje vrijeme, mogu rezultirati razvojem kronične bubrežne bolesti, što je uvjetovano postupnim i polaganim propadanjem nefrona. Taj se proces polagano razvija tijekom nekoliko mjeseci i godina. Destrukcija nefrona dovodi do aktivacije kompenzacijskih mehanizama preostalih "zdravih" nefrona koji nastoje kompenzirati nastalo oštećenje, što se naziva teorija intaktnoga nefrona. Glavnu ulogu u tome ima angiotenzin II koji ima nekoliko patogenskih učinaka: 1) vazokonstrikcija postglomerulskih kapilara koja dovodi do povećanja intraglomerulskoga tlaka te posljedične hiperfiltracije i intraglomerulske hipertenzije, 2) djelujući na mezangijske stanice i podocite dovodi do širenja pora čime se omogućuje prolazak makromolekula kroz glomerulsku bazalnu membranu, 3) povećava stvaranje intersticijskoga matriksa koji dovodi do hipertrofije nefrona, povećavajući koncentraciju transformirajućega čimbenika rasta beta (TGF-β) koji potiče sintezu kolagena i diferencijaciju epitelnih stanica u miofibroblaste te povećavajući koncentraciju inhibitora aktivatora plazminogena (PAI-I) koji smanjuje proteolizu i degradaciju stvorenoga matriksa. Navedenim promjenama (hiperfiltracija i hipertrofija nefrona) nastoji se kompenzirati nastalo oštećenje što dovodi do toga da vrijednosti kreatinina ostaju relativno uredne, iako u tom trenutku već postoji značajno bubrežno oštećenje. Napredovanje osnovne bolesti i daljnje propadanje nefrona, kao i posljedično oštećenje preostalih nefrona posredovano intraglomerulskom hipertenzijom i hiperfiltracijom, dovodi do postupnoga slabljenja bubrežne funkcije u cijelosti (faza dekompenzacije), što će u konačnici rezultirati pojavom patoloških laboratorijskih nalaza (porast kreatinina očekuje se kada je oštećeno više od 50 % nefrona), a potom i kliničkih očitovanja (kada je oštećeno više od 80 % nefrona). Primjena ACE inhibitora i antagonista receptora za angiotenzin II pomažu smanjiti hiperfiltracijsko oštećenje nefrona te na taj način djeluju zaštitno te usporavaju napredovanje bubrežnoga oštećenja.
Stupnjevi kronične bubrežne bolesti. S obzirom na to da kronična bubrežna bolest nastupa postupno i da je obilježava polagano napredovanje, razlikujemo nekoliko stupnjeva bolesti. U kliničkoj praksi koristi se klasifikacija KDIGO (engl. Kidney Disease Improving Global Outcome), koja se temelji na vrijednosti glomerulske filtracije(GFR, od engl. glomerular filtration rate, stopa glomerulske filtracije). Stupnjevi kronične bubrežne bolesti prema klasifikaciji KDIGO prikazani su u Tablici 5.11.
|
Tablica 5.11. Stupnjevi kronične bubrežne bolesti prema klasifikaciji KDIGO
|
|
Stupanj
|
Opis
|
GFR (ml/min/1,73m2)
|
|
1
|
Bubrežno oštećenje s normalnim ili povećanim GFR-om
|
≥ 90
|
|
2
|
Blago smanjen GFR
|
60 - 89
|
|
3a
|
Blago do umjereno smanjen GFR
|
45 - 59
|
|
3b
|
Umjereno do teško smanjen GFR
|
30 - 44
|
|
4
|
Teško smanjen GFR
|
15 - 29
|
|
5
|
Završni stupanj (ESRD, od engl. end stage renal disease, završni stupanj bubrežne bolesti)
|
≤ 14
|
Klinička slika. Kronična bubrežna bolest dugo je asimptomatska bolest. Prvi simptomi se javljaju kod značajno narušene bubrežne funkcije (GFR < 10 ml/min/1,73m2), a posljedica su nakupljanja uremijskih toksina (uremijski sindrom). U kasnijim stupnjevima razvijaju se i klinička očitovanja brojnih komplikacija koje se postupno razvijaju kod ovih bolesnika. Prvi specifičniji znakovi kronične bubrežne bolesti su nokturija i poliurija, koje se javljaju kao posljedica smanjenje koncentracijske sposobnosti bubrega, dok se oligurija i anurija javljaju relativno kasno, kada su razvijeni i drugi znakovi (komplikacije).
Uremijski sindrom javlja se kod povišenih vrijednosti ureje u serumu (> 30 - 40 mmol/l). Simptomi i znakovi su nespecifični te uključuju umor, slabost i malaksalost, smanjen tek i gubitak na tjelesnoj masi, mučninu praćenu proljevom i povraćanjem, poremećaj kognitivnih funkcija te nesanicu, parestezije i mišićne grčeve, generaliziran svrbež u odsutnosti osipa, smanjen libido uz poremećaj menstruacijskoga ciklusa ili erektilne funkcije kod muškaraca, a bolesnici često navode i metalni okus u ustima.
Fizikalni pregled služi za uočavanje znakova koji se mogu javiti kod ovih bolesnika: bljedoća (posljedica anemije), tamne diskoloracije kože uz ogrebotine (posljedica uremijskoga svrbeža), znakovi volumnoga suviška (edemi koji se najprije javljaju periorbitalno, a kasnije i na potkoljenicama pa sve do razvoja anasarke) i dr.
Komplikacije. Kroničnu bubrežnu bolest prate brojne komplikacije koje uključuju različite organske sustave: poremećaji elektrolita i acidobazne ravnoteže, srčanožilne komplikacije, hematološke komplikacije, gastrointestinalne komplikacije, endokrinološke komplikacije, poremećaji koštanoga metabolizma, kožne komplikacije te neurološke komplikacije. Najčešće komplikacije kronične bubrežne bolesti bit će kasnije detaljnije opisane (patogeneza, klinička slika, dijagnostika i liječenje).
Dijagnoza. Pristup bolesniku s kroničnom bubrežnom bolesti sastoji se od dva dijela: prvo, potrebno je postaviti samu dijagnozu kronične bubrežne bolesti, a zatim je potrebno provesti široku dijagnostičku obradu s ciljem otkrivanja etiologije.
Anamneza i fizikalni pregled. Anamnezom dobivamo podatke o simptomima te prethodnim bolestima i stanjima koje se mogu povezati s kroničom bubrežnom bolesti (hipertenzija, dijabetes i sl.), a fizikalnim pregledom uočavamo karakteristične znakove koji se mogu javiti (bljedoća kože i sluznica, koža boje ilovače, uremijski zadah po amonijaku, otoci lica, udova).
Laboratorijski nalazi. Rutinski laboratorijski nalazi krvi ukazuju na povećane dušične metabolite u serumu (azotemija) različitoga stupnja, anemiju kronične bolesti (normocitna i normokromna anemija), poremećaj elektrolita (hipo- ili hipernatrijemija, hiperkalijemija, hipokalcijemija, hiperfosfatemija) te poremećaje acidobaznoga statusa (smanjeni bikarbonati, metabolička acidoza). Rutinski laboratorijski nalazi u mokraći mogu pokazati hematuriju (mikro- ili makro-), proteinuriju te glukozuriju, uz patološki nalaz sedimenta mokraće (patološka cilindrurija).
Ultrazvuk bubrega pokazuje smanjene i skvrčene bubrege hiperehogenoga odjeka, s iznimkama policističih bubrega, dijabetičke nefropatije, bolesti nakupljanja poput amiloidoze bubrega i dugotrajne opstruktivne nefropatije kada su oni povećanih dimenzija.
Procjena glomerulske filtracije. Za konačnu dijagnozu i utvrđivanje stupnja kronične bubrežne bolesti potrebno je procijeniti glomerulsku filtraciju bilo izravnim (klirens endogenoga kreatinina, KEK) ili neizravnim postupcima (CKD-EPI, Salazary) što je prethodno opisano. Treba imati na umu da je smanjenje glomerulske filtracije prvi laboratorijski znak bubrežnoga zatajenja, čak i prije porasta vrijednosti dušičnih metabolita u krvi te se stoga povremeno treba određivati kod bolesnika kod kojih su dokazane bolesti koje mogu dovesti do bubrežnoga zatajenja i u prisutnosti normalnih serumskih koncentracija ureje i kreatinina.
Dijagnostika etiološkoga entiteta podrazumijeva široku dijagnostičku obradu, s obzirom na to da kroničnu bubrežnu bolest mogu uzrokovati razne bolesti i stanja. Ona podrazumijeva proširenu laboratorijsku obradu krvi i mokraće (veličina proteinurije, elektroforeza bjelančevina u mokraći, diferencijalna krvna slika, imunološka laboratorijska obrada – koncentracija komplementa, probir na autoprotutijela, krioglubulini, protutijela na streptokokne antigene i najčešće viruse), proširenu radiološku obradu (kompjutorizirana tomografija, magnetna rezonancija) te konačno biopsiju bubrega.
Biopsija bubrega je presudna pretraga u diferencijalnoj dijagnozi kronične bubrežne bolesti, a nadopunjuje se prethodnim pretragama i nalazima. Biopsiju ima smisla raditi samo do određenoga stupnja bolesti (vrijednost serumske koncentracije kreatinina oko 300 µmg/l), jer u uznapredovalom stupnju bolesti, kada su bubrezi atrofični i skvrčeni, ne možemo dobiti prikladan tkivni materijal koji bi bio od dijagnostičkoga značenja. Indikacije i kontraindikacije, tehnika izvođenja te moguće komplikacije opisane su prethodno.
Liječenje. Primarni cilj kod ovih bolesnika je liječenje i nadzor osnovne bolesti koja je dovela do kronične bubrežne bolesti, a paralelno s njime provodimo i ostale mjere: opće mjere liječenja, dijetetičke mjere liječenja, liječenje nastalih komplikacija te konačno, u završnoj fazi bolesti, primjena postupaka nadomještanja bubrežne funkcije.
Opće mjere liječenja uključuju identifikaciju srčanožilnih rizičnih čimbenika i njihovu korekciju (prestanak pušenja, korekcija hiperlipidemije, smanjenje tjelesne mase, primjerena tjelesna aktivnost), bolji nadzor arterijske hipertenzije i šećerne bolesti, izbjegavanje primjene lijekova koji se luče bubrezima i koji mogu imati nefrotoksični učinak ili prilagodba njihove doze veličini glomerulske filtracije te pridržavanje dijetetičkoga režima. S obzirom na to da su ovi bolesnici ugroženi od infekcija, preporučuje se redovito procjepljivanje (hepatitis B, gripa, pneumokok).
Dijetetičke mjere liječenja uključuju restrikciju unosa bjelančevina, soli, kalija i fosfora. Kod svih bolesnika preporučuje se ograničiti unos bjelančevina životinjskoga podrijetla na 0,6 - 0,8 g/kg/dan, jer to dokazano usporava napredovanje bolesti, osim kod bolesnika koji imaju izraženu kaheksiju ili teški nefrotički sindrom. Bolesnici koji su na hemodijalizi trebali bi unositi veću količinu bjelančevina od navedene (1 - 2 g/kg). Kod bolesnika s uznapredovalom kroničnom bubrežnom bolesti bubreg ne može normalno održavati homeostazu natrija i vode, zbog čega se unos soli treba održavati na oko 2 g/dan, s obzirom na to da unos veće količine (> 3 g/dan) dovodi do zadržavanja soli i vode, s pojavom hipertenzije, a smanjen unos (< 1 g/dan) s hipotenzijom i volumnom deplecijom. Ograničenje unosa kalija odnosi se na bolesnike s GFR-om nižim od 20 ml/min/1,73 m2 ili bolesnike koji su razvili hiperkalijemiju. Unos kalija kod tih bolesnika treba ograničiti na 2 g/dan. Unos fosfata ograničen je na 800 - 1000 mg/dan. Fosfate nalazimo u većim količinama u gaziranim pićima, jajima, orašatim plodovima, grahu i mesu pa se preporučuje njihov smanjen unos hranom.
Liječenje komplikacija kronične bubrežne bolesti čini najveći dio liječenja ovih bolesnika. Komplikacije kronične bubrežne bolesti obično se počinju razvijati u trećem i četvrtom stupnju bolesti i imaju tendenciju napredovanja s pogoršanjem bolesti. Liječenje ovih komplikacija prikazano je zasebno u nastavku teksta.
Nadomještanje bubrežne funkcije rezervirano je za bolesnike s petim stupnjem bolesti, a uključuje postupke dijalize (hemodijaliza ili peritonejska dijaliza) te transplantaciju bubrega. Tada mjere konzervativnoga liječenja nastalih komplikacija postaju nedostatne te će, ako se ne započne s dijalizom (ili se ne učini transplantacija), u skorom vremenu nastupiti smrt bolesnika. Liječenje se obično započinje postupcima dijalize, nakon čega slijedi, ako nema kontraindikacija i ako bolesnik na to pristane, transplantacija bubrega. Transplantacija bubrega bez prethodnih hemodijaliza (preemptivna transplantacija) rijetko se provodi. Vrijeme početka dijalize nije strogo zadano, nego se temelji na individualnim situacijama, ali načelno se počinje kada GFR bude između 10 i 15 ml/min/1,73 m2. Ovisno o kliničkom stanju, mogućnostima i željama bolesnika na raspolaganju su hemodijaliza i peritonejska dijaliza. Liječenje dijalizom treba se planirati ranije, s obzirom na to da je bolesnicima potrebno osigurati prikladan žilni pristup (arterijskovenska fistula, središnji venski kateter) ili peritonejski kateter za bolesnike koji se kreću liječiti peritonejskom dijalizom. Žilni pristup se uglavnom kreira kod bolesnika koji imaju vrijednosti kreatininemije između 400 i 500 µmol/l ako nemaju šećernu bolest, a kod bolesnika sa šećernom bolesti i prije. Metode i načela nadomještanja bubrežne funkcije opisani su zasebno.
Prognoza. Bolesnici s kroničnom bubrežnom bolesti u odnosu na opću populaciju imaju veću učestalost ukupnoga pobola i smrtnosti. Prognoza ponajprije ovisi o etiologiji i treba se promatrati u tom kontekstu. Načelno gledano, bolesnici koji su liječeni transplantacijom imaju manji pobol i manju smrtnost u odnosu na bolesnike koji su cijelo vrijeme liječeni dijalizom, što transplantaciju bubrega nameće kao najbolju metodu liječenja kronične bubrežne bolesti u završnom stupnju bolesti.
KOMPLIKACIJE KRONIČNE BUBREŽNE BOLESTI
Kronična bubrežna bolest praćena je brojnim komplikacijama koje zahvaćaju razne organe i organske sustave: poremećaji elektrolita i acidobazne ravnoteže, srčanožilne komplikacije, hematološke komplikacije, poremećaji koštanoga metabolizma, gastrointestinalne komplikacije, endokrinološke komplikacije, kožne komplikacije te neurološke komplikacije
POREMEĆAJI ELEKTROLITA I ACIDOBAZNE RAVNOTEŽE
Hipo/hipernatrijemija. Koncentracija natrija u kroničnoj bubrežnoj bolesti ponajprije ovisi o uzročnoj bolesti, tako da se kod bolesti bubrežnoga intersticija i tubula (pijelonefritis, intersticijski nefritis, hidronefroza) razvija hiponatrijemija uslijed nemogućnosti reapsorpcije, dok se kod glomerularnih bolesti (glomerulopatije) javlja hipernatrijemija zbog smanjene glomerularne filtracije natrija. Održavanje normalne serumske koncentracije natrija najprije se postiže optimalnim unosom soli u organizam (oko 2 g/dan).
Hiperkalijemija je najopasniji elektrolitni poremećaj kod ovih bolesnika, s obzirom na mogućnost izazivanja malignih srčanih aritmija, a javlja se u uznapredovalim stupnjevima kronične bubrežne bolesti (4. i 5. stupanj), kada bubrezi više ne mogu izlučivati suvišak kalija. Ovaj poremećaj mogu podržavati pojačan unos kalija hranom te primjena lijekova koji smanjuju lučenje kalija bubrezima (amilorid, triamteren, spirinolakton, epleronon, ACE inhibitori, inhibitori receptora za angiotenzin II, nesteroidni protuupalni lijekovi) ili lijekova koji koče utok kalija u stanice (beta blokatori). Simptomi se javljaju kada se kalijemija poveća na 6,5 - 7 mmol/l, najprije u vidu mišićne slabosti, a potom može doći i do fatalih srčanih aritmija. Početne promjene na EKG-u su skraćenje QT-intervala i pojava visokih i šiljastih T-valova, dok se poslije QT-interval produljuje, a QRS proširuje i tada je velika opasnost od nastanka po život opasnih poremećaja srčanoga ritma. Kod svih bolesnika s kalijemijom većom od 6,5 mmol/l preporučuje se kontinuirani nadzor srčanoga ritma. Akutno liječenje hiperkalijemije opisano je u poglavlju o hiperkalijemiji. Kronična, umjerena hiperkalijemija u sklopu kronične bubrežne bolesti zahtijeva restrikciju unosa kalija (do 2 g/dan), eliminaciju ili smanjenje doze lijekova koji pogoršavaju hiperkalijemiju te primjenu diuretika Henleove petelje (furosemid).
Hiperfosfatemija i hipokalcijemija. Zbog smanjenoga izlučivanja fosfata razvija se hiperfosfatemija koja u kombinaciji sa smanjenim stvaranjem aktivnoga oblika vitamina D u bubregu dovodi do razvoja hipokalcijemije, Hipokalcijemija potiče lučenje parathormona, a oba poremećaja zajedno vode do poremećaja metabolizma kostiju koji se naziva renalna osteodistrofija. Novija saznanja upućuju na ulogu FGF-23 u početnim poremećajima ove patogeneze, čije povećano otpuštanje u krv u bubrezima djeluje fosfaturično. Ovi poremećaji su dalje u tekstu detaljno opisani, kao i njihovo liječenje.
Metabolička acidoza kod ovih bolesnika posljedica je nekoliko poremećaja, a javlja se kada se glomerulska filtracija smanji na vrijednosti niže od 10 ml/min/1,73 m2. Nastanak acidoze uvjetuju smanjena ekskrecija vodika i drugih kiselina nastalih različitim metaboličkim putevima te smanjena sposobnost bubrega da sintetizira i reapsorbira bikarbonate koji služe kao puferski sustav u održavanju acidobazne ravnoteže. Acidoza je obično umjerenoga tipa (pH oko 7,3), a klinički je obilježavaju slabost i malaksalost, mučnina, uz nekada povraćanje i bolovi u trbuhu. Kod produbljivanja acidoze javlja se duboko i šumno disanje (kompenzacijska hiperventilacija) uz postupan poremećaj stanja svijesti koji može napredovati sve do razine kome. Liječenje početnih poremećaja sastoji se od smanjenja unosa bjelančevina životinjskoga podrijetla te od peroralne primjene bikarbonata kada se oni smanje na manje od 15 - 10 mmol/l, a daje se NaHCO3 u početnoj dozi od 0,5 -1 mEq/kg/dan podijeljeno u dvije doze, s postupnim povećanjem doze ako je to potrebno.
SRČANOŽILNE KOMPLIKACIJE
Bolesnici s kroničnom bubrežnom bolesti dokazano imaju veću učestalost i smrtnost od srčanožilnih bolesti u odnosu na opću populaciju. Ove su komplikacije posljedica složenih patofizioloških mehanizama, a uključuju arterijsku hipertenziju, ubrzanu aterosklerozu, srčano popuštanje te uremijski perikarditis.
Arterijska hipertenzija razvija se kao posljedica višestrukih mehanizama: 1) poremećaja homeostaze natrija i vode koji dovode do hipervolemije, 2) pojačane aktivnosti sustava renin-angiotenzin te gubitka elastičnosti perifernih krvnih žila koji uvjetuju povećan periferni otpor te 3) deficita vazodiltatora. Karakteristično je hipertenzija kod ovih bolesnika napredujućega tijeka i osjetljiva je na restrikciju unosa soli. Udružena s drugim rizičnim čimbenicima podržava proces ateroskleroze i njezinih posljedica. Današnje preporuke sugeriraju da se vrijednosti arterijskoga tlaka kod ovih bolesnika održavaju ispod 140/90 mmHg (prema smjernicama Joint National Commission). Osnovu liječenja hipertenzije čini restrikcija unosa soli uz postupno uvođenje medikamentne terapije. Za nadzor hipervolemije primjenjuju se diuretici, i to početno tijazidi, a kada se gomerulska filtracija smanji na manje od 30 ml/min/1,73 m2, u terapiju se uvode diuretici Henleove petlje koji pokazuju veći i jači učinak. Kod bolesnika u početnim stupnjevima kronične bubrežne bolesti koji imaju izraženu proteinuriju, u terapiju se mogu uključiti i ACE inhibitori ili blokatori receptora za angiotenzin II, s preporukom kontrole kalija i kreatinina u serumu (početno svaka sva tjedna, a potom rjeđe) te kada se razvije hiperkalijemija ili se zabilježi porast kreatinina za više od 30 % od početnih vrijednosti treba smanjiti dozu lijeka ili ga potpuno obustaviti iz terapije. Kod težih oblika hipertenzije nekada je potrebno kombinirati više antihipertenziva iz različitih skupina.
Ubrzana ateroskleroza karakteristična je pojava u kroničnoj bubrežnoj bolesti, a posljedica je prisutnosti različitih rizičnih čimbenika kao što su arterijska hipertezija, hiperlipidemija, šećerna bolest, i drugo (debljina, pušenje, hiperhomocisteinemija, povećan oksidacijski stres), a tome pridonosi i pojačana kalcifikacija krvnih žila. Kalcifikacija se objašnjava učinkom uremičnih toksina na glatko-mišićne stanice krvnih žila koje pod njihovim utjecajem poprimaju fenotip sličan osteoblastima te pojačano sintetiziraju matriks koji je podložan kalcifikaciji. Tipični su kalcifikati medije arterijske stijenke. Konačne posljedice ubrzane ateroskleroze su koronarna srčana bolest, cerebrovaskularna bolest te periferna žilna bolest. Načela dijagnostike i liječenje opisani su u odgovarajućim dijelovima.
Srčano popuštanje nastaje prvenstveno kao posljedica volumnoga opterećenja zbog zadržavanja natrija i vode (hipervolemija), a pridonose mu i drugi čimbenici kao što su arterijska hipertenzija, anemija kronične bolesti, prisutnost arterijskovenske fistule i sl. Navedeni čimbenici početno dovode do nastanka hipertrofije lijevoga ventrikula, što doprinosi razvoju srčanoga popuštanja s očuvanom ejekcijskom frakcijom (dijastolička disfunkcija), no s napredovanjem bolesti dolazi do smanjenja kontraktilne snage i konačnoga nastanka srčanoga popuštanja sa smanjenom ejekcijskom frakcijom. Kliničkom slikom dominiraju znaci plućne kongestije i sustavne kongestije (dispneja, ortopneja, pretibijalni edemi, izražene vratne vene), a u određenim situacijama zatajenja moguć je i razvoj akutnoga kardiogenoga plućnog edema, često nakon pojačanoga unosa soli. Dijagnoza se postavlja na temelju radioloških znakova srčanoga popuštanja te ehokardiografije. Liječenje se temelji na nadzoru hipervolemije: restrikcija unosa soli te primjena diuretika (početno tijazidi, kasnije diuretici Henleove petelje). Primjena ACE inhibitora i blokatora receptora za angiotenzin II koji danas predstavljaju temelj liječenja srčanoga popuštanja moguća je, ali zahtijeva pažljivo nadziranje krvnoga tlaka te vrijednosti kreatinina i kalija u serumu.
Uremijski perikarditis se javlja u završnom stupnju kronične bubrežne bolesti uslijed djelovanja uremijskih toksina koji dovode i do fragilnosti krvnih žila perikarda, posljedično čemu se razvija perikardni izljev koji često može biti i hemoragičan, a može dovesti i do kliničke slike tamponade perikarda i kardiogenoga opstruktivnog šoka. Kliničkom slikom dominiraju bol u prsima, dispneja, auskultacijski se čuje perikardno trenje, a u EKG-u nalazimo klasične promjene (promjene ST-segmenta, mikrovoltaža). Izljev se dokazuje ultrazvučno, a perikardioceteza se rijetko izvodi. Pojava perikarditisa indikacija je za početak liječenja dijalizom.
Sindrom pothranjenosti, upale i ateroskleroze ili MIA sindrom (od engl. malnutrition-inflammation-atherosclerosis) je termin koji se sve više koristi kod bolesnika u uznapredovalom stupnju kronične bubrežne bolesti. Radi se o poremećaju koji opisuje poveznicu između tri temeljna patofiziološka koraka u razvoju srčanožilnih bolesti i komplikacija i koji objašnjava povećanu učestalost pobola i smrtnosti od srčanožilnih bolesti tih bolesnika. Pothranjenost, koja je česta u ovoj skupini bolesnika, pogoršava njihov ishod pogoršavajući upalu, a time i samu aterosklerozu i njezine posljedice. Dijagnoza se postavlja na temelju procjene obilježja uhranjenosti, određivanju upalnih biljega (bjelančevine akutne faze, citokini) te određivanju stupnja ateroskleroze (mjerenje debljine intime i medije krvnih žila). Liječenje se temelji na liječenju pothranjenosti i poboljšanju nutritivnoga statusa. Ovo je primjer tzv. reverzne epidemiologije gdje je ateroskleroza povezana sa smanjenim indeksom tjelesne mase i smanjenim serumskim koncentracijama lipida.
HEMATOLOŠKE KOMPLIKACIJE
Anemija kronične bolesti jedna je od najstalnijih komplikacija kronične bubrežne bolesti. Ona je u prvom redu posljedica smanjenoga stvaranja eritropoetina, što postaje jasno izraženo u trećem stupnju kronične bubrežne bolesti, a pridonose joj i drugi čimbenici, kao što su deprimirajući učinak uremičnih tokisna na koštanu srž, smanjena apsorpcija željeza iz probavnoga sustava (posljedično povećanoj koncentraciji hepcidina), nedostatak i poremećen metabolizam folata, pojačana destrukcija i smanjeni životni vijek eritrocita (uremični toksini, hemodijaliza), pojačan gubitak krvi (česta uzorkovanja, hemodijaliza, krvarenja iz probavnoga sustava) te primjena ACE inhibitora (interferencija s endogenim otpuštanjem eritropoetina). Posljedično se razvija normokromna i normocitna anemija (MCH i MCV su najčešće unutar referentnih vrijednosti). Liječenje anemije u kroničnoj bubrežnoj bolesti temelji se na primjeni rekombinantnih eritropoetina (epoetin, darbepoetin), a treba započeti kada se serumska koncentracija hemoglobina smanji na manje od 90 g/l. Primjenjuju se supkutano ili intravenski s napomenom da je učinak bolji za 30 % nakon supkutane primjene. Glavna nuspojava primjene rekombinantnih eritropoetina je hipertenzija koja će zahtijevati ili smanjenje doze navedenih lijekova ili pojačanje antihipertenzivne terapije. Ostale, rjeđe komplikacije su encefalopatija i aplazacija crvene loze posredovane antieritropoetinskim protutijelima (češće kod primjene epoetina). Cilj liječenja je postići serumsku koncentraciju hemoglobina na vrijednosti između 100 i 120 g/l (vrijednosti veće od 120 g/L nisu pokazale bolje kliničke ishode, a zabilježena je i veća pojavnost srčanožilnih komplikacija). Tijekom terapije preporučuje se učestalije mjerenje krvnoga tlaka te praćenje vrijednosti hemoglobina svakih 2 do 4 tjedna (očekivani porast hemoglobina kreće se oko 10 g/l tijekom 3 do 4 tjedna). Prije uvođenja ovih lijekova potrebno je odrediti ferogram (poželjna je serumska koncentracija feritina veća od 200 ng/ml) i vitamine skupine B te se u slučaju njihova nedostatka najprije mora provesti njihovo nadomještanje (peroralno ili intravensko željezo, vitamini B skupine). Kod slaboga odgovora na navedenu terapiju treba razmišljati o drugim uzrocima anemije, kao i o nastaku protueritropoetinskih antitijela. Korekcija anemije kod ovih bolesnika dokazano poboljšava životnu kakvoću, poboljšava toleranciju tjelesnoga napora te poboljšava kognitivne funkcije.
Hemoragijska dijateza javlja se u završnom stupnju kronične bubrežne bolesti, a glavni uzrok je poremećaj funkcije trombocita uzrokovan uremičnim toksinima, kao i skraćenim životnim vijekom trombocita. Klinički se očituje znacima sklonosti krvarenju (kožne petehije i hematomi), sporijim zaustavljanjem krvarenja nakon ozljeda te češćim krvarenjem iz probavnoga sustava. Liječenje se provodi kod simptomatskih bolesnika (prisutno krvarenje) te prije većih kirurških zahvata. Glavna terapijska opcija je uklanjanje uremijskih toksina hemodijalizom, a u obzir dolazi i primjena konjugiranih estrogena (2,5 - 5 mg peroralno, 5 do 7 dana) koji pokazuju pozitivan učinak na funkciju trombocita tijekom nekoliko tjedana nakon primjene. Također, prije većih kirurških intervencija ili kod jačih krvarenja može se primijeniti i dezmopresin koji ima kratkotrajni učinak (25 mcg intravenski u dvije doze, s razmakom 8 - 12 sati).
POREMEĆAJI KOŠTANOGA METABOLIZMA
Sekundarni hiperparatireoidizam i bubrežna osteodistrofija označavaju skup koštanih poremećaja koji se javljaju kod bolesnika s kroničnom bubrežnom bolesti, a nastaju kao posljedica poremećaja metabolizma fosfora, kalcija, vitamina D i parathormona. Sve započinje vrlo rano po nastanku kronične bubrežne bolesti kada se zbog manjega bubrežnog izlučivanja fosfora razvija hiperfosfatemija. Kao odgovor na porast fosfora dolazi do pojačaoga otpuštanja faktora rasta fibroblasta 23 (FGF23) iz osteoblasta koji pojačava izlučivanje fosfata bubrezima te se tako kompenzira nastali poremećaj. S daljnjim napredovanjem bolesti navedeni kompenzacijski mehanizam postaje nedostatan (kasni 3. stupanj kronične bubrežne bolesti) te se razvija klinički značajna hiperfosfatemija. Fosfati u suvišku dovode do vezanja ionskoga kalcija na sebe pri čemu nastaju kompleksi fosfata i kalcija koji se odlažu u razna tkiva (kalcifikacija) te i tako dolazi do razvoja hipokalcijemije. Hipokalcijemiji pridonosi i smanjena proizvodnja 1α-hidroksilaze u bubrezima koja pretvara neaktivan oblik vitamina D u aktivni oblik te se zbog nastaloga manjka aktivnoga vitamina D smanjuje resorpcija kalcija iz probavnoga sustava. Nastala hipokalcijemija, hiperfosfatemija te manjak aktivnoga vitamina D stimulira pojačano lučenje parathormona (sekundarni hiperparatireoidizam) koji potiče mobilizaciju kalcija iz kostiju te reapsorpciju kalcija u proksimalnim tubulima, nastojeći ispraviti nastalu hipokalcijemiju. Opisani metabolički poremećaji dovode do različitih promjena na kostima (osteitis fibrosa cystica, adinamična koštana bolest, osteomalacija, osteoporoza) koji se jednim imenom nazivaju bubrežna osteodistrofija. Prikaz poremećaja u renalnoj osteodistrofiji dan je u prikazu Slike 5.2.
Slika. 5.2. Prikaz poremećaja u renalnoj osteodistrofiji
Kliničkom slikom dominira bol u kostima, sklonost patološkim prijelomima te metastatičke (izvankoštane) kalcifikacije. U laboratorijskim nalazima najčešće vidimo hiperfosfatemiju, hipokalcijemiju, smanjene vrijednosti aktivnoga vitamina D, povišene vrijedosti parathormona te povišenu alkalnu fosfatazu kao pokazatelj pojačane koštane pregradnje. Klasični radiološki znak su subperiostealne lezije. Liječenje se sastoji iz dva koraka: prvi korak je kontrola hiperfosfatemije, a drugi (kada se normalizira razina serumskoga fosfora) je supresija lučenja PTH-a, tj. liječenje sekundarnoga hiperparatireoidizma.
Hiperfosfatemija se liječi restrikcijom unosa fosfata hranom te primjenom kelatora (vezača) fosfora u probavnom sustavu. Razlikujemo nekoliko vrsta vezača fosfata, a temeljna podjela je na osnovi sadržaja kalcija. Prije su češće korišteni vezači na bazi kalcija (kalcijev karbonat per os i kalcijev acetat) danas su zamijenjeni vezačima koji ne sadrže kalcij (sevelamer 800 - 3200 mg, lantan karbonat 500 - 1000 mg). Navedeni lijekovi se uzimaju uz glavne obroke s preporukama izbjegavanja uzimanja više od 1500 mg kalcija na dan kod kelatora koji sadrže kalcij te izbjegavanja primjene aluminijevoga hidroksida zbog čestih neuroloških komplikacija. Cilj liječenja hiperfosfatemije je održavanje koncentracije fosfora u serumu manjim od 1,45 mmol/l kod bolesnika koji nisu na dijalizi, odnosno između 1,13 i 1,78 mmol/l ako se liječe dijalizom.
Ako se uz normalizaciju fosfata u krvi ne postigne normalizacija kalcijemije i PTH-a, prelazi se na drugi korak u liječenju, a to je primjena vitamina D (aktivni oblik – kalcitriol ili analozi) i/ili kalcimimetika. Kalcitriol, koji predstavlja aktivni oblik vitamina D, danas se primjenjuje rjeđe nego prije (0,25 ili 0,5 mcg peroralno svaki ili svaki drugi dan), a sve se više primjenjuju analozi vitamina D (alfakalcidol) ili njegovi metaboliti (parikalcitol, dokserkalciferol). Za vrijeme primjene ovih lijekova potrebno je pratiti razinu fosfata i kalcija u krvi te je kod njihovoga porasta potrebno smanjiti dozu lijeka. Ako se uz ove postupke ne postiže normalizacija nalaza, u terapiju se mogu uključiti i kalcimimetici (cinakalcet, etelkalcetid) koji djeluju kao agonisti receptora osjetljivih na kalcij (stimulirajući receptore osjetljive na kalcij u doštitnim žlijezdama smanjuje lučenje PTH-a). Ciljne vrijednosti PTH-a kod ovih bolesnika nisu u okviru normalnih referentnih vrijednosti za opću populaciju, već ih se nastoji držati na barem dvostruko većoj vrijednosti od gornje referentne granice.
OSTALE KOMPLIKACIJE I POREMEĆAJI KRONIČNE BUBREŽNE BOLESTI
Probavni sustav. Najčešće komplikacije probavnoga sustava povezane su s hipergastrinemijom koja se pojačava kako se glomerulska filtracija smanjuje (gastrin se luči putem bubrega). Povećane koncentracije gastrina dovode do hipersekrecije želučane kiseline i s time povezanih komplikacija (erozije, ulkusi, krvarenja). Također, veća je učestalost i akutnoga pankreatitisa kod ovih bolesnika, a treba imati na umu i činjenicu da bolesnici s kroničnom bubrežnom bolesti mogu imati do tri puta više vrijednosti amilaza u serumu zbog smanjenoga izlučivanja putem bubrega.
Endokrinološki sustav i metabolički poremećaji. Osnovni endokrinološki poremećaj kod bolesnika s kroničnom bubrežnom bolesti je sekundarni hiperparatireoidizam, a mogući su i sljedeći: hiperprolaktinemija s galaktorejom i oligomenorejom; veća je učestalost razvoja hipotireoze; kod muškaraca nalazimo smanjenu koncentraciju testosterona što je povezano s gubitkom libida, erektilnom disfunkcijom te poremećenom spermatogenezom; kod žena se razvija poremećaj menstruacijskoga ciklusa (oligomenoreja, amenoreja) uslijed povećane koncentracije prolaktina i luteinizacijskoga hormona. Zbog smanjenoga izlučivanja inzulina putem bubrega, bolesnici sa šećernom bolesti koji su na inzulinskoj terapiji imaju veći rizik od razvoja hipoglikemije te je ponekad potrebno smanjivati dozu inzulina. Primjena metformina kod ovih bolesnika povezana je s povećanom učestalošću nastanka laktacidoze (preporučuje se izbjegavanje primjene metformina kod bolesnika s oštećenom bubrežnom funkcijom). Od metaboličkih poremećaja s većom učestalošću se javljaju ulozi (giht) zbog zadržavanja urata i hiperuricemije te hiperlipidemija (hipertrigliceridemija i hiperkolesterolemija).
Neurološke komplikacije. Najčešće komplikacije živčanoga sustava su uremična encefalopatija, periferna polineuropatija te disfunkcija autonomnoga živčanog sustava. Uremijska encefalopatija javlja se u uznapredovalom stupnju bubrežne bolesti, kada se glomerulska filtracija smanji na manje od 5 - 10 ml/min/1,73 m2. Poremećaji nastaju zbog izravnoga i neizravnog djelovanja uremijskih toksina. Glavna klinička očitovanja su letargija, konfuzija, gubitak kognitivnih funkcija, mišićna slabost te dublji poremećaji svijesti (sopor, koma). U ovu skupinu komplikacija ubrajamo i disekvilibrijski sindrom koji nastaje kada se tijekom dijalize odstrani velika količina ureje što ne prati prelazak ureje iz stanica središnjega živčanog sustava, s posljedičnim osmotičkim navlačenjem vode i nastankom edema mozga. Navedeno se izbjegava optimalizacijom dijalize.
Kožni poremećaji. Bolesnici s kroničnom bubrežnom bolesti imaju izražen svrbež kože koji nastaje kao posljedica odlaganja uremijskih toksina te kompleksa kalcija i fosfata u dermis i subkutis. Posljedično koža poprima žućkastu boju i prisutne su brojne ekskorijacije. Kao posljedica anemije bolesnici mogu imati bljeđi aspekt, a zbog poremećene funkcije trombocita ekhimoze i petehije. Učestalost porfirije (porphyria cutanea tarda) i pseudoporfirije češća je kod ovih bolesnika.
NADOMJEŠTANJE BUBREŽNE FUNKCIJE
Nadomještanje bubrežne funkcije, NBF (RRT, od eng. renal replacement therapy) označava terapijske postupke kojima se nastoji nadomjestiti bubrežna funkcija (ekskretorna i/ili endokrina), a obuhvaća dijalizu, koja može biti hemodijaliza ili peritonejska dijaliza, te transplantaciju bubrega.
HEMODIJALIZA
Definicija. Hemodijaliza ili izvantjelesna dijaliza označava postupak kojim se odvodi krv iz organizma, filtrira posebnim filterima te pročišćena vraća natrag u bolesnika. Tim se postupkom vrši uklanjanje toksina, elektrolita u suvišku (natrij, kalij) te vode iz krvi bolesnika uz istodobno nadomještanje tvari koje manjkaju, a prijeko su potrebne organizmu (bikarbonati).
Osnovna načela hemodijalize. Postupak hemodijalize temelji se na četiri osnovna fizikalno-kemijska procesa: difuzija, ultrafiltracija, konvekcija te adsorpcija.
Difuzija podrazumijeva kretanje i uklanjanje malih molekula kroz polupropusnu membranu na osnovi koncentracijskoga gradijenta: tvari s područja veće koncentracije (krv) prelaze u područje s manjom koncentracijom (tekućina za dijalizu). Dakle, proces difuzije uvjetovan je i određen koncentracijskim gradijentom te se na taj način eliminiraju male, topljive molekule kao što su ureja, kreatinin i elektroliti (kalij, natrij, vodik, fosfor). Za provođenje difuzije neophodna je primjena tekućine za dijalizu.
Ultrafiltracija označava kretanje tekućine kroz polupropusnu membranu uvjetovano razlikom tlakova s obje strane membrane. Ona se ostvaruje primjenom pozitivnoga tlaka u odjeljku s krvi ili primjenom negativnoga tlaka u odjeljku s tekućinom za dijalizu. Glavni je cilj ultrafiltracije uklanjanje suvišne tekućine.
Konvekcija omogućuje eliminaciju srednje velikih i velikih molekula kao što su vitamini, mikroglobulini te medijatori upale, a temelji se na načelu velikoga kretanja otopine kroz membranu pri čemu se kroz pore membrane istiskuju srednje velike i velike molekule zajedno s ultrafiltratom. Da bi se ostvario taj veliki protok preko membrane, potrebno je najprije infundirati supstitucijski volumen koji osigurava taj povećan protok kroz membranu, a potom se uklanja procesom ultrafiltracije.
Adsorpcija označava prijanjanje molekula na ili u membranu dijalizatora/hemofiltera te se na taj način uklanjanju velike molekule. Vrsta molekula koje se na taj način uklanjaju najprije ovisi o obilježjima same membrane (npr. membrane za uklanjanje proupalnih citokina).
Tehnička izvedba hemodijalize. Za provođenje postupka hemodijalize potrebni su: uređaj za hemodijalizu, dijalizator ili hemofilter, tekućina za dijalizu te krvne igle i linije.
Uređaj za hemodijalizu omogućuje provođenje postupka hemodijalize, odnosno provodi postupak izvantjelesnoga protoka krvi (crpljenje krvi iz bolesnika, prolazak kroz hemofilter te vraćanje krvi natrag u bolesnika). Uređaji su standardno opremljeni krvnom crpkom koja osigurava protok krvi kroz sustav te različitim senzorima i alarmima koji osiguravaju sigurnost i prilagodljivost protoka krvi: mjerenje i ugađanje brzine protoka krvi i tekućine za dijalizu, mjerenje tlaka u različitim djelovima sustava (prije i poslije krvne crpke), osiguranje temperature krvi i tekućine za dijalizu, detekcija prisutnosti zraka u sustavu, izračunavanje i ugođavanje ultrafiltracije i sl.
Dijalizator ili hemofilter predstavlja mjesto u kojemu se odvija sam proces hemodijalize. Sastoji se od kućišta u kojemu su smještene tzv. kapilare dijalizatora kroz koje protječe krv u jednom smjeru (krvni dio) te prostora u kojemu protječe tekućina za dijalizu u drugom smjeru i izlazi iz dijalizatora kao dijalizat (dijalizatni dio). Kroz membranu kapilara odvijaju se navedeni ključni procesi hemodijalize. Membrane mogu biti različito građene i imati različite biofizikalne značajke, što može utjecati na samu hemodijalizu. Idealna membrana je ona koja omogućuje odstranjenje svih bitnijih uremijskih toksina, tekućine i elektrolita u suvišku te ona koja ne dovodi do značajnijih reakcija između krvi i membrane. Ugrubo se membrane dijele na niskoprotočne i visokoprotočne. Niskoprotočne imaju veću sposobnost difuzije, dok visokoprotočne imaju veću sposobnost ultrafiltracije i konvekcije. Danas se uglavnom koriste visokoprotočne poboljšane membrane koje osiguravaju i dostatni proces difuzije.
Tekućina za dijalizu je otopina koja služi za izmjenu otopljenih tvari s krvi u hemofilteru. Ona protječe unutar hemofiltera u suprotnom smjernu od smjera protoka krvi. U tekućinu za dijalizu iz krvi prelaze uremijski toksini, elektroliti u suvišku i voda te ona na kraju procesa postaje dijalizat i eliminira se. S obzirom na manjak bikarbonata kod ovih bolesnika, koriste se tekućine koje omogućuju njihovu supstituciju, a to su acetatna i bikarbonatna otopina. Kod acetatnih otopina iz tekućine za dijalizu u krv bolesnika prelazi acetat koji se potom u jetri i mišićima metabolizira u bikarbonat (1 mmol acetata daje 1 mmol bikarbonata), a kod bikarbonatnih otopina dolazi do izravnoga prelaska bikarbonata (bikarbonatne otopine sastoje se iz dvije odvojene otopine - otopine elektrolita i otopine bikarbonata, zbog mogućnosti kemijskoga vezivanja bikarbonata u prisutnosti kalcija i magnezija). Danas se uglavnom koriste bikarbonatne otopine jer su sastavom sličnije tjelesnim tekućinama.
Krvne igle i krvne linije osiguravaju protok krvi iz bolesnika u uređaj za hemodijalizu i hemofilter te ponovno vraćanje u bolesnika. Igle i krvne linije koriste se u jednokratne svrhe i moraju imati veće promjere kako bi osigurale prikladan protok krvi (promjer između 1,6 i 2 mm).
Krvožilni pristup. Kako bi se osigurao prikladan protok krvi za hemodijalizu, kod bolesnika se mora osigurati prikladan krvožilni pristup, a postoji nekoliko vrsta: središnji venski kateteri za dijalizu, koji mogu biti netunelirani (privremeni) i tunelirani (trajni), te arterijskovenska fistula.
Netunelirani (privremeni) kateteri za dijalizu koriste se za akutne hemodijalize, a postavljaju se u jednu od velikih vena Seldingerovom tehnikom (v. iugularis interna, v. subclavia, v. femoralis). Za razliku od tzv. terapijskih središnjih venskih katatera, kateteri za dijalizu su dvoluminalni i imaju odvojene otvore na distalnom (unutarnjem) dijelu katetera, tako da osiguravaju odvojen protok krvi koja se crpi i ide u dijalizator i one koja se iz njega vraća i na taj se način sprečava njihovo miješanje. Kada se kateter ne koristi, lumeni katetera se moraju ispuniti heparinom da se izbjegne zgrušavanje krvi i začepljenje. Privremene katatere nije uputno upotrebljavati dulje od dva tjedna zbog opasnosti od infekcije.
Arterijskovenska fistula označava kirurški spoj između arterije i vene koji osigurava prikladan žilni bazen iz kojega se može crpiti krv za hemodijalizu. Razlikuju se nativne arterijskovenske fistule od arterijskovenskoga grafta. Nativna arterijskovenska fistula izvodi se kirurški anastomozom između radijalne ili brahijalne arterije s cefaličnom ili baziličnom venom. Arterijskovenski graft izvodi se kirurškim postavljanjem žilnoga umetka (graft) između navedenih arterija i vena, a izvodi se onda kada je nativna fistula tehnički neizvodiva. Nativne fistule imaju dulji vijek trajanja (nakon tri godine 75 % nativnih fistula još uvijek je u funkciji, dok je nakon istoga vremena u funkciji tek oko 30 % graftova). S obzirom na to da je za punu funkciju fistule potrebno vrijeme da se ona razvije, njezino kreiranje mora se planirati prije planiranoga početka liječenja hemodijalizom. Za uporabu fistule potrebno je da prođe i četiri do osam tjedana od njezinoga kreiranja, a kod nekih bolesnika i više (bolesnici s perifernom žilnom bolesti i šećernom bolesti). Konstrukcija arterijskovenske fistule izvodi se kod bolesnika s kroničnom bubrežnom bolesti kada se serumska koncentracija kreatinina poveća na 350 μmol/l, kada se kreatininski klirens smanji na manje od 25 ml/min ili se očekuje početak liječenja hemodijalizom unutar jedne godine. Najčešće komplikacije arterijskovenskih fistula su lokalne (stenoza, tromboza, aneurizma, infekcije) te srčanožilne (arterijskovenski šant povećava srčani minutni volumen i srčano predopterećenje, što može rezultirati srčanim popuštanjem).
Tunelirani (trajni) kateteri za dijalizu su središnji venski kateteri namijenjeni za hemodijalizu koji ostaju u bolesniku dulje vrijeme. Koriste se kod bolesnika s kroničnom bubrežnom bolesti kada su iscrpljene mogućnosti postavljanja nativne arterijskovenske fistule ili grafta te kod potrebe za hemodijalizom kod bolesnika s kroničnim srčanim popuštanjem (arterijskovenska fistula dovodi do dodatnoga predopterećenja). U ovu svrhu koriste se dvoluminalni kateteri koji se postavljaju u velike vene, kao i privremeni kateteri, ali se njihov položaj stabilizira potkožnom sintetičkom obujmicom (cuff) u koju urasta vezivno tkivo te se tako kateter stabilizira, ali se i sprečava prodor bakterija i infekcije (tzv. tunelirani kateteri). Najpoželjnije mjesto za postavljanje ovih katetera je desna unutarnja jugularna vena, a ostale u obzir dolaze ako nije moguća ta pozicija. Iako je trajni kateter povezan s većom stopom komplikacija u odnosu na arterijskovensku fistulu, ima i svojih prednosti: spreman je za uporabu odmah nakon postavljanja, nisu potrebne dodatne venepunkcije i sl. Najčešće komplikacije vezane su za samu tehniku postavljanja (pneumotoraks, krvarenja) te trombozu i infekcije (tzv. kateter-sepsa). Danas se najčešće postavljaju Hickmanov ili Tesio kateter.
Antikoagulacija i hemodijaliza. S obzirom na to da pri prolasku krvi kroz krvne linije i dijalizator može doći do aktivacije sustava koagulacije i nastanka ugruška, tijekom same dijalize potrebna je primjena antikoagulansa koji to sprečavaju. U određenim situacijama moguća je provedba hemodijalize i bez antikoagulacije, ali je tada potrebno učestalo ispiranje sustava fiziološkom otopinom. Čimbenici koji povećavaju rizik od zgrušavanja krvi tijekom hemodijalize su niski protoci krvi, povišen hematokrit, povećana ultrafiltracija te transfuzija krvi tijekom hemodijalize.
Hemodijaliza bez antikoagulacije primjenjuje se iznimno i to kod bolesnika s velikim rizikom od krvarenja. Pri ovom postupku primjenjuje se ispiranje sustava fiziološkom otopinom te se preporučuju veći protoci krvi i izbjegavanje velike ultrafiltracije. Hemodijaliza bez antikoagulacije nije prikladna i često je zgrušavanje u sustavu.
Sustavna antikoagulacija danas se najčešće primjenjuje, a podrazumijeva bolusnu ili kontinuiranu primjenu klasičnoga ili niskomolekulskog heparina u izvatjelesni optok koji ulazi i u sustavnu cirkulaciju. Najčešći način sustavne antikoagulacije je bolusna primjena dalteparina u dozi od 0,2 - 0,6 mg u arterijsku liniju prije filtera.
Regionalna antikoagulacija podrazumijeva primjenu antikoagulansa koji djeluje samo u izvantjelesnom optoku te se neutralizira njegov učinak prije ulaska natrag u sustavnu cirkulaciju. U tu se svrhu danas najčešće upotrebljava citrat, odnosno citratna otopina koja se infundira prije filtera s ciljem vezanja kalcija na sebe, jer je prijeko potreban za proces koagulacije, a većina nastaloga kompleksa citrat-kalcij se odstrani u dijalizat. Nastali gubitak kalcija kompenziramo reinfuzijom kalcija (kalcijev glukonat, kalcijev karbonat), tako da ne dolazi do značajnije hipokalcijemije. Glavna je opasnost kod citratne antikoagulacije nastanak metaboličke alkaloze, s obzirom na to da se citrat metabolizira u bikarbonate, a kontraindicirana je kod teže bolesti jetre (ili se primjenjuje u manjoj koncentraciji).
Vrste postupaka hemodijalize. S obzirom na vrijeme i način provođenja hemodijalize, razlikujemo tri skupine postupaka hemodijalize: intermitentni, kontinuirani i hibridni.
Intermitentni postupci su oni koje se provode povremeno, obično tijekom nekoliko sati svakih nekoliko dana (obično po četiri sata, tri puta tjedno, a ovisno o kliničkom stanju i indikaciji, dijaliza se može raditi i češće i dulje). Među intermitentnim postupcima, ovisno o načinu izvođenja, razlikujemo hemodijalizu, hemofiltraciju i hemodijafiltraciju.
Hemodijaliza podrazumijeva postupak dijalize koji se temelji prvenstveno na načelu difuzije. Ona je indicirana kod bolesnika koji imaju primarno metaboličke poremećaje (npr. hiperkalijemija, metabolička acidoza), a omogućuje i eliminaciju suviška tekućine.
Hemofiltracija podrazumijeva postupak hemodijalize pri čemu se dominantno provodi proces ultrafiltracije pri čemu se vrši eliminacija tekućine, što je indicirano kod bolesnika s primarnim suviškom tekućine, bez značajnijih metaboličkih poremećaja.
Hemodijafiltracija je postupak intermitentne dijalize koji se zasniva na dodatnom konvektivnom odstranjenju srednje velikih molekula iz krvi u dijalizat. Postiže se volumenima ultrafiltrirane tekućine većima nego što je volumen suviška tekućine u organizmu. Izvodi se infuzijama većih volumena tekućine u sustav koji se potom odstranjuje ultrafiltracijom.
Kontinuirani postupci provode se tijekom duljega vremenskog razdoblja (24 i više sati), s ili bez istodobne primjene supstitucijske tekućine (kao što je opisano i prethodno uz hemodijafiltraciju), pri čemu se izbjegavaju veće hemodinamičke promjene (polaganija je eliminacija tekućine s ciljem izbjegavanja značajnijih hemodinamičkih promjena, što omogućuje istodobna supstitucija tekućine kod bolesnika: ako se u vremenskom razdoblju od jednoga sata iz bolesnika eliminira 1000 ml tekućine, a istodobno primijeni supstitucija od 900 ml tekućine, onda je konačni neto gubitak kod toga bolesnika 100 ml/h, što značajno manje narušava hemodinamiku bolesnika, ali produljuje vrijeme provođenja postupka – za eliminaciju od 1000 ml potrebno nam je deset sati). Supstitucija se može vršiti infundiranjem otopine prije filtera, što se naziva predilucija, ili nakon filtera što se naziva postdilucija. Predilucija razrjeđuje krv prije filtera, što smanjuje mogućnost zgrušavanja, ali smanjuje i klirense, dok postdilucija ima veću stopu zgrušavanja, ali su klirensi bolji. Ovaj postupak rezerviran je za kritično oboljele osobe, osobito one koje su hemodinamički nestabilni (izražena hipotenzija). Ovisno o indikaciji, može se provoditi nekoliko kontinuiranih oblika hemodijalize: spora kontinuirana ultrafiltracija (SCUF, od engl. slow continuous ultrafiltration), kontinuirana veno-venska hemofiltracija (CVVH, od engl. continuous veno-venous ultrafiltration), kontinuirana veno-venska hemodijaliza (CVVHD, od engl. continuous veno-venous hemodialysis) te kontinuirana veno-venska hemodijafiltracija (CVVHDF, od engl. continuous veno-venous hemodiafiltration). Prikaz metoda kontinuirane hemodijalize dan je u Tablici 5.12.
Spora kontinuirana ultrafiltracija proces je ultrafiltracije koji se provodi tijekom duljega vremenskog razdoblja s osnovnim ciljem eliminacije viška tekućine, što je indicirano kod primarno volumno preopterećenih bolesnika (najčešće kardiološki bolesnici), bez značajnije uremije ili elektrolitnoga poremećaja. Preporučuje se eleminacija 100 - 300 ml/h. S obzirom na to da se ne primjenjuje niti tekućina za dijalizu niti nadomjesna tekućina, procesi difuzije i konvekcije su zanemarivi u ovoj vrsti postupka.
Kontinuirana veno-venska hemofiltracija je postupak sličan SCUF-u, ali se koristi nadomjesna otopina (supstitucija), zbog čega se uz ultrafiltraciju provodi i konvekcija. Primarna indikacija za ovaj postupak je volumna preopterećenost, bez značajnijih metaboličkih poremećaja, iako proces konvekcije dovodi i do uklanjanja malih, ali prvenstveno srednje velikih i velikih molekula.
Kontinuirana veno-venska hemodijaliza je postupak čiji se učinak primarno temelji na mehanizmu difuzije pa je vrlo učinkovit i pri uklanjanju malih molekula. Kod ovoga postupka ne koristi se nadomjesna tekućina (supstitucija), zbog čega je mehanizam konvekcije zanemariv. Indicirana je za bolesnike koji imaju primarno metabolički poremećaj, iako se uključivanjem ultrafiltracije omogućuje se i odstranjenje viška tekućine.
Kontinuirana veno-venska hemodijafiltracija je postupak čiji se učinak temelji na svim procesima hemodijalize (difuzija, ultrafiltracija, konvekcija). Primjenom dijalizatne otopine povećava se difuzija kojom se uklanjaju male molekule, dok primjena susptitucije omogućuje konvekciju, pa se jednako dobro uklanjaju i srednje velike i velike molekule. Radi se o postupku koji ima jednako dobar učinak u ispravljanju azotemije, elektrolitnoga disbalansa, kao i u odstranjenju viška tekućine.
|
Tablica 5.12. Metode kontinuirane hemodijalize
|
|
Metoda
|
Transportni mehanizam
|
Dodatne otopine
|
Indikacija
|
|
SCUF
|
Ultrafiltracija
|
Bez otopina
|
Volumno opterećenje
|
|
CVVH
|
Konvekcija ± ultrafiltracija
|
Supstitucijska otopina, nema otopine za dijalizu
|
Primarno: volumno opterećenje
Sekundarno: metabolički disbalans
|
|
CVVHD
|
Difuzija ± ultrafiltracija
|
Otopina za dijalizu, nema supstitucijske otopine
|
Prmarno: metabolički disbalans
Sekundarno: volumno opterećenje
|
|
CVVHDF
|
Difuzija + konvekcija ± ultrafiltracija
|
Supstitucijska i otopina za dijalizu
|
Volumno opterećenje, metabolički poremećaji
|
Hibridni postupci dijalize su oni koji koriste prednosti intermitentnih i kontinuiranih postupaka, a najpopularniji među njima su EDD (od engl. extended daily dialysis) te SLED (od engl. sustained low efficiency dialysis) koja se provodi 5 do 10 sati na dan, sa sporim protokom otopine za dijalizu, čime se postiže dobra hemodinamička tolerancija i učinkovitost. Dodatna prednost je ta što se može provoditi klasičnim hemodijaliznim uređajem.
Akutne komplikacije hemodijalize. Među akutne komplikacije hemodijalize ubrajamo hipotenziju, mišićne grčeve, bol (glavobolja, bol u prsima i leđima), reakcije preosjetljivosti, hemolizu i trombozu, zračnu emboliju, sindrom disekvilibrija te druge, rjeđe komplikacije.
Hipotenzija je najčešća komplikacija koja se javlja za vrijeme hemodijalize. Najčešći uzrok je odstranjenje veće količine volumena u kraćem vremenskom razdoblju (pojačana ultrafiltracija) uz neprikladan kompenzacijski odgovor kakav se obično i nalazi kod ovih bolesnika (izostanak vazokonstrikcije, smanjena srčana pričuva i sl.). Hipotenzija se nastoji izbjeći pravilnim određivanjem "suhe" tjelesne mase bolesnika, kontroliranom ultrafiltracijom, primjenom bikarobantnih otopina za dijalizu (acetatne su povezane s češćim hipotenzijama) te se bolesnicima savjetuje da antihipertenzivne lijekove uzimaju nakon dijalize, a ne prije postupka. Kada nastupi hipotenzija, treba smanjiti protok krvi, smanjiti ili prekinuti ultrafiltraciju, izgubljeni volumen nadoknaditi infuzijama (obično izotoničnim kristaloidnim otopinama) te po potrebi primijeniti Trendelenburgov položaj.
Mišićni grčevi također su česta pojava za vrijeme hemodijalize. Etiologija je nerazjašnjena, a najčešće se povezuje s poremećajem perfuzije skeletnih mišića uvjetovano brzim smanjenjem cirkulirajućega volumena i promjenom koncentracije natrija. Liječenje se sastoji od primjene kristaloidnih otopina (izotonična ili hipertonična), a prevenira se vježbama istezanja i primjenom karnitina, vitamina E ili oksazepama.
Bol. Bolesnici se tijekom hemodijalize najčešće žale na glavobolju te bol u prsima i leđima. Oni su najčešće posljedica hipotenzije i sindroma disekvilibrija. Kod nastupa se savjetuje smanjenje protoka krvi i smanjivanje ultrafiltracije, a po potrebi je moguća i peroralna analgezija (paracetamol). Bol u prsima kod srčanih bolesnika zahtijeva snimanje elektrokardiograma i eventualno određivanje kardioselektivnih enzima.
Reakcije preosjetljivosti za vrijeme hemodijalize obuhvaćaju širok spektar, od urtikarijskoga osipa pa sve do anafilaktičkoga šoka. Reakcija preosjetljivosti može biti izazvana različitim čimbenicima: etilen oksid koji se koristi za sterilizaciju krvnih linija i filtera, endotoksini iz tekućine za dijalizu, sastavnice membrane hemofiltera (osobito adsorbirajuće membrane) i dr. Kod nastanka reakcije potrebno je prekinuti postupak hemodijalize te provesti standardnu terapiju (kortikosteroidi, kloropiramin, kisik, po potrebi adrenalin). Prije nastavka postupka potrebno je isprati dijalizator s 2 litre fiziološke otopine (isto se savjetuje prije svake sljedeće hemodijalize).
Hemoliza. Hemolitička reakcija u izvantjelesnom optoku može biti posljedica mehaničkih opstrukcija (presavijene krvne linije) ili može nastati uslijed pregrijavanja. Bolesnici postaju febrilni, žale se na bol u prsima te razvijaju dispneju. U laboratorijskim nalazima pratimo pad broja eritrocita i hemoglobina uz porast lakat dehidrogenaze i nekonjugiranoga bilirubina, moguće su i hiperkalijemija i hiperuricemija. Potrebno je obustaviti hemodijalizu te po potrebi vršiti nadoknadu krvnim derivatima te liječiti druge probleme (npr. hiperkalijemija).
Tromboza. Tijekom postupka hemodijalize moguća je pojava zgrušavanja u izvantjelesnom optoku što dovodi do otežanoga ili prestanka protoka krvi, a nosi rizik i od tromboembolijskih događaja. Kod pojave zgrušavanja potrebno je obustaviti hemodijalizu te promijeniti krvne linije i/ili filter. Potrebno je provjeriti i prohodnost katetera.
Zračna embolija je rijetka komplikacija koja može nastati prilikom manipulacije sa samim sustavom (ulazak zraka). Većina uređaja danas ima senzor i alarm za prisutnost zraka u sustavu. Kada se razvije zračna embolija, ona se očituje iznenadnom tahidispnejom, padom saturacije krvi kisikom, hipotenzijom te bolovima u prsima. Kada postoji sumnja, bolesnika odmah treba staviti u lijevi lateralni položaj i glavom prema dolje kako bi se zrak zarobio u desnom atriju. Indicirano je odmah postaviti središnji kateter u desni atrij i pokušati aspiraciju zraka. Provodi se i oksigenoterapija ili mehanička ventilacija sa 100 %-tnim kisikom.
Sindrom disekvilibrija rijetka je neurološka komplikacija hemodijalize koja se javlja obično na početku liječenja hemodijalizom kada se naglo uklanja velika količina ureje. Tijekom hemodijalize ureja brzo prelaze iz krvi u dijalizat, dok je pomak ureje iz stanica u izvanstanični prostor sporiji. Zbog toga nastaje razlika u osmolalnosti unutar neurona i izvan njih, što dovodi do pomaka tekućine u stanice, zbog čega dolazi do moždanoga edema. Simptomi su glavobolja, poremećaj svijesti, mučnina, povraćanje, a u najtežim slučajevima epileptički grčevi pa i koma. Liječenje se sastoji od primjene veće koncentracije natrija, manitola te dijazepama. Ovaj sindrom se prevenira skraćivanjem vremena prvih dijaliza, osobito u slučaju velike serumske koncentracije ureje, uz propisivanje hemodijalize na način koji će dovesti do manjega klirensa ureje (manje površine filtera i sporiji protok krvi i tekućine za dijalizu).
Kronične komplikacije hemodijalize. Među kronične komplikacije hemodijalize ubrajamo arterijsku hipertenziju, anemiju kronične bolesti, srčanožilne bolesti, pothranjenost te bolesti i poremećaje ostalih organskih sustava.
Arterijska hipertenzija često se susreće i razvija kod bolesnika koji su na programu kronične hemodijalize, a uvjetovana je različitim čimbenicima koje često susrećemo kod ovih bolesnika: hipervolemija, pojačana aktivnost reninsko-angiotenzinskoga sustava, poremećen odnos vazokonstriktora i vazodilatatora i sl. Arterijska hipertenzija podržava proces ateroskleroze, što posredno pridonosi razvoju srčanožilnih bolesti.
Anemija kronične bolesti redovita je pojava kod ovih bolesnika. Glavni uzrok leži u smanjenom stvaranju eritropoetina, ali je podržavaju i uremijski toksini, smanjeni životni vijek eritrocita, učestalo uzorkovanje krvi, kao i gubitak krvi tijekom same hemodijalize.
Srčanožilne bolesti pojavljuju se s daleko većom učestalošću kod ovih bolesnika nego u općoj populaciji. Hipertrofija lijeve klijetke jedan je od najčešćih nalaza kod ovih bolesnika, a smatra se da ponajprije nastaje uslijed volumnoga opterećenja srca (hipervolemija), ali mu pogoduju i aretrijska hipertenzija, anemija te arterijskovenska fistula. Zbog ubrzane ateroskleroze česta je pojava koronarne bolesti te se smatra da gotovo 70 % bolesnika na kroničnoj hemodijalizi ima 50 %-tno suženje barem jedne koronarne arterije. Pojava hiperkalcijemije udružena je s pojačanom kalcifikacijom srčanih zalistaka i nastanaka valvularnih grešaka. Elektrolitni poremećaji, posbeno hiperkalijemija, povezani su s pojavom srčanih aritmija. Česte manipulacije s venskim kateterima ili aterijskovenskim fistulama rezultiraju većom učestalošću bakterijemije i mogućnošću nastanka septičkoga endokarditisa.
Pothranjenost. Bolesnici na kroničnoj hemodijalizi često imaju smanjen tek i postaju anoreksični, što može rezultirati smanjenjem tjelesne mase. Osim toga, postupcima hemodijalize gube se i neke esencijalne molekule kao što su u vodi topljivi vitamini i oligoelementi, zbog čega je potrebna njihova nadoknada. Bolesnicima na hemodijalizi potrebno je osigurati dnevni unos energije od 35 kcal/kg tjelesne mase, s unosom bjelančevina od namjanje 1,2 g/kg/dan.
Ostale kronične komplikacije. Kod bolesnika na kroničnoj hemodijalizi mogu se naći i druge komplikacije i stanja koja se javljaju s većom učestalošću nego u općoj populaciji, na razini probavnoga sustava (erozivni gastritis, ulkusna bolest, akutni pankreatitis), endokrinoga sustava (inzulinska rezistencija, sekundarni hiperparatireoidizam), imunosnoga sustava (učestale infekcije i sklonost zloćudnim bolestima kao rezultat imunonedostatnosti), koštano-mišićnoga sustava (bubrežna osteodistrofija), živčanoga sustava (periferna polineuropatija, encefalopatija), kože i osjetila (kronični svrbež) te psihijatrijski poremećaji (anksiodepresivni sindrom).
Adekvatnost hemodijalize. Adekvatnost ili primjerenost dijalize je izraz kojim se opisuje uspješnost provedenoga postupka hemodijalize, a kao mjera se uzima količina ureje koja je tijekom pojedinačne hemodijalize odstranjena iz krvi bolesnika. Adekvatnost možemo prikazati na dva načina: kao postotak smanjenja koncentracije ureje u plazmi (URR, od engl. urea reduction rate) i kao količinu plazme koja je u zadanom vremenu očišćena od ureje (Kt/V). URR predstavlja razliku u koncentraciji ureje u plazmi prije i nakon postupka dijalize, odnosno predstavlja postotak smanjenja koncentracije ureje u plazmi i adekvatnom se hemodijalizom smatra kada je URR oko 70 %. Kt/V predstavlja volumen plazme koji se u zadanom vremenu očisti od ureje, a računa se matematički (Kt označava klirens ureje koja je odstranjena u određenom vremenu, a V volumen ukupne tjelesne vode) i trebao bi biti veći ili jednak 1,2. Bolesnici koji imaju malu dozu hemodijalize, odosno imaju malu adekvatnost brže razvijaju kronične komplikacije, češće razvijaju komorbiditete i imaju kraći životni vijek.
PERITONEALNA DIJALIZA
Definicija. Peritonealna dijaliza je oblik nadomještanja bubrežne funkcije koji podrazumijeva intrakorporalnu dijalizu koja se postiže izmjenom tvari i tekućine između otopine koja se instilira u slobodnu trbušnu šupljinu i krvnih žila potrbušnice koje služe kao polupropusna membrana. Danas se smatra da je udio bolesnika koji se liječe peritonealnom dijalizom oko 10 do 15 % od ukupno kronično dijaliziranih bolesnika.
Osnovna načela peritonealne dijalize. Načelo peritonealne dijalize leži u unošenju sterilne otopine određenoga sastava u slobodnu trbušnu šupljinu putem postavljenoga katetera kako bi se omogućila izmjena otopljenih tvari i tekućine preko kapilarne mreže dobro prokrvljene potrbušnice, a koja se potom, nakon određenoga vremena, ponovno evakuira iz trbušne šupljine. Pri tome potrbušnica (tj. njezine krvne žile) ima ulogu polupropusne membrane nalik na membrane koje nalazimo u hemofilterima kod izvođenja hemodijalize. Prijenos uremijskih toksina i elektrolita vrši se na temelju razlike u njihovom koncentracijskom gradijentu pri čemu oni prelazi s područja veće koncentracije (krv) u dijaliznu otopinu u trbušnoj šupljini, dok se eliminacija viška tekućine temelji na primjeni hiperosmolarnih dijaliznih otopina koje navlače vodu iz krvnih žila te tako smanjuju volumen cirkulirajuće tekućine. Prema tome, navedeni procesi ovise ponajprije o sastavu dijaliznih otopina koje se primjenjuju. One sadrže osmotički aktivne tvari (glukoza, ikodekstrin), određenu koncentraciju elektrolita (natrij, kalcij, magnezij) te pufer za korekciju metaboličke acidoze (laktat, bikarbonat).
Tehnička izvedba peritonealne dijalize. Glavni tehnički preduvjet za izvođenje peritonealne dijalize je postavljanje peritonealnoga katetera u slobodnu trbušnu šupljinu. To se provodi kirurškim putem, putem klasične laparotomije, laparoskopije ili rijetko naslijepo putem Seldingerove tehnike. Kateteri su građeni od silikona ili poliuretana, na distalnom kraju imaju mnoštvo otvora, dok se proksimalno nalaze dvije obujmice (peritonealna i potkožna) koje se nakon postavljanja raspiruju te u koje urasta vezivno tkivo kako bi se učvrstio položaj katetera i spriječila komunikacija te prodor bakterija. Mjesto implantacije katetera je individualno, ali načelno se treba nalaziti na strani dominantne ruke te na mjestu koje nije izloženo pritisku i gdje se ne zadržava nečistoća. Nakon postavljanja katetera preporučuje se vremensko razdoblje odgode početka dijalize od nekoliko tjedana kako bi se kateter učvrstio i kako bi rana optimalno zacijelila, što smanjuje moguće komplikacije (infekcijske, mehaničke). Osim katetera, za izvođenje peritonealne dijalize potrebna je dijaliza otopina koja se može instilirati u trbuh ručno (potrebna dobra edukacija bolesnika) ili putem automatiziranih sustava koji to vrše sami (niže detaljnije opisano).
Vrste peritonealne dijalize. Dvije su osnovne vrste peritonealne dijalize: kontinuirana ambulatorna peritonealna dijaliza (CAPD, od engl. continuous ambulatory peritoneal dialysis) te automatizirana peritonealna dijaliza (APD, od engl. automated peritoneal dialysis).
CAPD je oblik peritonealne dijalize kod koje bolesnici sami, ručno, vrše izmjenu dijalizne otopine pomoću sustava vrećica, najčešće četiri puta tijekom dana. Pri tome bolesnici nisu vezani ni za kakve uređaje, ali postupak zahtijeva suradljivost i dobru educiranost bolesnika.
APD je oblik peritonealne dijalize pri kojoj izmjenu dijalizne otopine vrši poseban uređaj (engl. cycler) koji ciklički puni i prazni trbušnu šupljinu, obično tijekom noći prema unaprijed zadanom programu. Bolesnici imaju veću slobodu tijekom dana, ali su noću vezani za uređaj. Dodatna prednost APD-a je manji intraabdominalni tlak, s obzirom na to da se postupak provodi preko noći u ležećem položaju.
Ispitivanje funkcije peritonealne dijalize. S obzirom na individualne razlike u građi i funkciji potrbušnice, potrebno je procijeniti njezinu funkciju, u svrhu određivanja uspješnosti same peritonealne dijalize. Ono se provodi tzv. peritonealnim ekvilibrijskim testom (PET) koji podrazumijeva mjerenje koncentracije glukoze i kreatinina u dijalizatu i krvi u određenim vremenskim intervalima nakon instiliranja otopine te računanje njihova omjera. Na temelju toga testa bolesnike svrstavamo u jednu od četiri kategorije: 1) bolesnici sa sporim tipom transporta, 2) bolesnici s prosječno sporim tipom transporta, 3) bolesnici s prosječno brzim tipom transporta te 4) bolesnici s brzim tipom transporta. Ova kategorizacija bitna je za procjenu volumena i duljine zadržavanja dijalizne otopine u trbušnoj šupljini kako bi se postigao optimalan kreatininski klirens i optimalna ultrafiltracija suvišne tekućine.
Adekvatnost peritonealne dijalize. Kao i kod hemodijalize, adekvatnost peritonealne dijalize izražava Kt/V formulom, pri čemu Kt označava klirens ureje koja je odstranjena u određenom vremenu, a V volumen ukupne tjelesne vode. Preporuča se da ukupni tjedni Kt/V iznosi najmanje 1,7.
Izbor bolesnika za peritonealnu dijalizu. Danas se peritonealna dijaliza koristi u liječenju završnoga stupnja kronične bubrežne bolesti zatajenja. S obzirom na to da se ovaj postupak provodi kod kuće, osnovni uvjet je primjerena suradljivost i zainteresiranost bolesnika te odgovarajući socijalni i higijenski uvjeti. Peritonealna dijaliza omogućuje dulje održavanje ostatne bubrežne funkcije, čime se poboljšava ukupno preživljenje bolesnika. Ovaj oblik dijalize posebno je koristan kod bolesnika koji imaju učestale komplikacije pri liječenju hemodijalizom, koji imaju probleme s krvožilnim pristupom za hemodijalizu te kod kontraindikacija za primjenu antikoagulacije. Apsolutne kontraindikacije su svježe i nedavne opsežne traume trbuha, stanja iza opsežnih operacija u trbuhu i priraslica potrbušnice te infekcije. Relativne kontraindikacije su hernijacije trbušne stijenke, pothranjenost ili pretilost, ugroženost disanja (hipoventilacijski sindromi) te trudnoća.
Komplikacije peritonealne dijalize. Ugrubo, komplikacije peritonealne dijalize možemo grupirati u tri skupine: mehaničke komplikacije, infektivne komplikacije te metaboličke i ostale komplikacije.
Mehaničke komplikacije peritonealne dijalize su malpozicija i začepljenje katetera, propuštanje oko katetera, hidrotoraks i hernijacije trbušne stijenke.
Malpozicija i začepljenje katetera može se javiti uslijed distenzije crijeva, pojave priraslica ili ulaskom fibrina i debrisa u kateter. Očituje se otežanim utokom ili istokom dijalizne tekućine, a potvrđuje se fluoroskopskim praćenjem tekućine. Liječenje može uključivati primjenu klizme i laksativa (smanjenje distenzije crijeva), propiranje katetera fiziološkom otopinom, heparinom ili alteplazom, a u tvrdokornim slučajevima potrebna je kiruruška intervencija i postavljanje novoga katetera.
Propuštanje oko katetera nastaje uslijed formiranja otvora oko katetera, najčešće kao posljedica jakih napinjanja mišićja i/ili infekcije, a klinički se očituje vidljivim propuštanjem i vlaženjem oko katetera. Liječenje podrazumijeva privremeni prestanak dijalize kako bi otvor spontano zacijelio.
Hidrotoraks se može javiti kao posljedica perforacije ošita, a razlikuje se od izljeva druge etiologije nakon pleuralne punkcije i analize punktata (mala koncentracija bjelančevina, a velika glukoze). Liječenje može zahtijevati pleuralnu punkciju, a ako se javlja učestalo, u obzir dolazi i pleurodeza.
Hernijacije trbušne stijenke posljedica su povećanoga intraabdominalnog tlaka koji nastaje nakon unosa dijalizne tekućine. Kod većih hernija preporuča se prelazak na hemodijalizu ili APD (manji intraabdominalni tlak).
Infektivne komplikacije peritonealne dijalize su infekcija izlaznoga mjesta katetera i peritonitis, a smatraju se najčešćim komplikacijama peritonealne dijalize.
Infekcija izlaznoga mjesta katetera obično je uzrokovana kožnim stafilokokima u uvjetima lošije higijene i postupanja s kateterom. Očituje se crvenilom, bolnošću i induriranošću kože uz vlaženje i/ili gnojnu sekreciju. Kod ove pojave potrebno je uzeti obrisak te uvesti najprije empirijski antibiotike (penicilinski antibiotik ili cefalosporin I. generacije), a kasnije terapiju prilagoditi nalazu antibiograma.
Peritonitis je česta pojava kod ovih bolesnika s prosječnim javljanjem jednom u dvije do tri godine. Najčešći put infekcije je širenje bakterija s kože trbuha per continuitatem u trbušnu šupljinu pa su i najčešći uzročnici gram-pozitivne bakterije kožne flore. Infekcija transmuralnim putem iz crijeva ili hematogenim iz krvi je rjeđa. Glavni simptomi su zamućenje dijalizata, febrilno stanje i bol u trbuhu (kriteriji su navedeni u Tablici 5.13.). Kod svake sumnje na peritonitis potrebna je mikrobiološka analiza dijalizata. Blaži oblici mogu se liječiti ambulantno, dok teži zahtijevaju hospitalizaciju. Potrebno je odmah započeti s empirijskom primjenom antibiotika do prispijeća nalaza antibiograma, a koji pokrivaju gram-pozitivne bakterije (cefazolin, vankomicin) i gram-negativne bakterije (cefalosporini III. generacije, aminoglikozid). Kod upornih i refraktornih oblika potrebno je odstraniti kateter iz trbušne šupljine.
|
Tablica 5.13. Kriteriji za dijagnozu peritonitisa
|
|
Kriteriji
|
- Zamućenje dijalizata s više od 0,1 x 109/l leukocita (> 50 % neutrofila)
- Dokaz mikroorganizama bojanjem po Gramu ili kultivacijom dijalizata
- Simptomi i znakovi upale potrbušnice
|
Metaboličke i ostale komplikacije peritonealne dijalize uključuju opstipaciju (zatvor), inkapsulirajuću peritonealnu sklerozu te porast tjelesne mase, hiperlipidemiju i razvoj šećerne bolesti.
Opstipacija je česta kod ovih bolesnika, a smatra se da je posljedica učinka dijalizne otopine na crijevnu peristaltiku (hipomotilitet). Bolesnicima se savjetuje lakša ishrana bogata ostatnim vlaknima (voće, povrće) te po potrebi primjena laksativa.
Inkapsulirajuća peritonealna skleroza je rijetka komplikacija nejasne etiologije, a obilježava ju fibroza potrbušnice koja stvara čahuru (oklop) oko crijeva. Rizični čimbenici za razvoj ove komplikacije su dulje vrijeme provođenja peritonealne dijalize, recidivirajući peritonitisi, primjena beta blokatora i prisutnost autoimunih bolesti. Klinička opasnost leži u mogućnosti razvoja mehaničkoga ileusa i strangulacije crijevnih vijuga. Dijagnoza se postavlja na temelju kompjutorizirane tomografije (nalaz fibroze i kalcifikata potrbušnice nalijepljenih oko crijeva). Liječenje se sastoji od prekida peritonealne dijalize, primjena tamoksifena i kortikosteroida, a često je indicirano i kirurško liječenje (akutni abdomen).
Zbog pojačane resorpcije glukoze iz dijalizata u krv moguća je pojava metaboličkih komplikacija kao što su hiperglikemija, hiperinzulinemija, porast na tjelesnoj masi te pogoršanje postojeće ili razvoj šećerne bolesti.
TRANSPLANTACIJA BUBREGA
Transplantacija bubrega predstavlja najbolji oblik nadomještanja bubrežne funkcije, s obzirom na to da se njome nadoknađuje i ekskrecijska i endokrina (sintetička) bubrežna funkcija. Danas se transplantira bubreg dobiven od bolesnika kojima je proglašena moždana smrt, ili od živih osoba, najčešće krvnih srodnika, ali je moguće i od živih nesrodnih darivatelja.
Indikacije i kontraindikacije. Opći je stav da su svi bolesnici sa završnim stupnjem kronične bubrežne bolesti (stupanj V) kandidati za transplantaciju bubrega ako ne postoje kontraindikacije. Smatra se da je transplantacija opravdana kod svih bolesnika od kojih se očekuje životni vijek dulji od pet godina. Prije stavljanja bolesnika na popis čekanja obično se provodi neki od oblika dijalize, a radi se i bez prethodne dijalize (preemptivna transplantacija).
Apsolutne kontraindikacije su aktivna i/ili proširena zloćudna bolest, teško srčano popuštanje, aktivna infektivna ili imunološka sustavna bolest te bilo koje stanje s očekivanim trajanjem života kraćim od dvije godine.
Relativne kontraindikacije su starija životna dob, signifikantni i korektibilni komorbiditeti (koronarna bolest, cerebrovaskularna bolest i sl.), latentne i indolentne infekcije, nesuradljivost bolesnika, neliječena psihoza te bolesti donjega dijela mokraćnoga sustava.
Donorstvo. Darivatelj (donor) bubrega može biti živa ili umrla osoba. Presadci živih donora brže oporavljaju funkciju nakon transplantacije te dulje traju. Transplantacije od živih osoba čine oko 20 do 25 % od sveukopnoga broja bubrežnih transplantacija.
Živi donor je obično srodna ili, rjeđe, nesrodna osoba. Ovaj postupak podrazumijeva široku dijagnostičku preeksplantacijsku obradu: anamneza, fizikalni pregled, rutinska laboratorijska obrada, serološka virusna dijagostika (EBV, CMV, HIV, HBV, HCV), urinokultura, kreatininski klirens, ultrazvuk bubrega, CT ili MR angiografija aorte i zdjeličnih arterija (s osvrtom na bubrežne). Apsolutne kontraindikacije za eksplantaciju i doniranje bubrega od živoga donora su dob ispod 18 godina, nekontrolirana hipertenzija, šećerna bolest, značajna proteinurija (> 300 mg/24 sata), patološka glomerulska filtracija, značajni komorbiditeti (kronična plućna ili srčana bolest, zloćudna bolest), akutne infekcije, anatomske malformacije bubrega, obostrana nefrolitijaza te osobe pozitivne na HIV. Relativne kontraindikacije su latentne i indolentne infekcije (tuberkuloza, hepatitis B i C), pretilost i psihijatrijske bolesti.
Umrli donor je obično osoba s dokazanom moždanom smrti, ali i osoba s nekucajućim srcem (u Hrvatskoj nije dozvoljeno). Kod svih potenecijalih umrlih donora potrebno je obaviti testiranje na HIV, HBV, HCV, EBV, CMV, urinokulturu, hemokulturu te je potrebno procijeniti funkciju (sediment mokraće, proteinurija, kreatininski klirens) i morfologiju bubrega (ultrazvuk, kompjutorizirana tomografija). Kada je bubrežna funkcija potencijalnoga donora s moždanom smrti granična ili upitna, u obzir dolazi i biopsija bubrega. Kontraindikacije za uzimanje bubrega od kadaveričnoga donora jednake su kao i kod živoga donora. Dob kao kriterij za eksplantaciju bubrega nije kontraindikacija.
Imunologija transplantacije. Osnovni problem u transplantacijskoj medicini je reakcija odbacivanja koja je posljedica odgovora domaćina na strane antigene koji su ini na površini stanica presatka. Geni koji su odgovorni za ovu reakciju nalaze se na 6. kromosomu i nazivaju se HLA geni (engl. human leukocyte antigen), a njihovi proizvodi su antigeni tkivne snošljivosti i nazivaju se antigeni HLA te se izražavaju na površini stanica. Geni HLA su organizirani u tri genska područja: prvo područje koje čine geni koji kodiraju antigene prvoga razreda tkivne snošljivosti HLA-A, HLA-B i HLA-C, drugo područje čine geni koji kodiraju antigene drugoga razreda tkivne snošljivosti - HLA-D (HLA-DR, DQ i DP) te treće područje koje čine non-HLA geni (MICA, MICB), a svi skupa imaju različite uloge u imunolosnim zbivanjima prerade i predočavanja antigena. Antigeni prvoga razreda prisutni su na površinama svih stanica s jezgrama (s izuzetkom endotela rožnice, egzokrine gušterače i neurona), dok su antigeni drugoga razreda prisutni na površinama antigen-prezentirajućih stanica (makrofazi, monociti, limfociti B), premda se u određenim situacijama mogu se pojaviti i na površini nekih drugih stanica (fibroblasti, epitelne stanice). Sustav gena HLA jedan je od najpolimorfnijih sustava gena, stoga nalazimo različit izražaj antigena HLA kod različitih osoba. Prisutnost stranih antigena HLA u presatku (tj. antigena koji domaćin ne posjeduje i na koje nije stekao imunotoleranciju) dovest će do imunosne reakcije usmjerene na uništenje istoga (odbacivanje). Kako bi se spriječila, smanjila ili odgodila ova reakcija, potrebno je provesti imunološku prijetransplantacijsku obradu s ciljem što točnijeg usklađivanja HLA sustava primatelja i darivatelja (pronalazak donora sa što sličnijim HLA-antigenima, uz kompatibilnost krvnih skupina), iako uz današnje mogućnosti farmakološke imunosupresije to postaje manje važno.
Imunološka prijetransplantacijska obrada. Kako bi se u što većoj mjeri spriječila ili smanjila reakcija odbacivanja, potrebno je provesti imunološka ispitivanja s ciljem odabiranja najkompatibilnijega donora, tj. presatka. Obrada uključuje sljedeće pretrage: 1) HLA tipizacija primatelja i darivatelja, 2) određivanje protutijela na antigene HLA u serumu primatelja te 3) test križne reakcije između darivatelja i primatelja neposredno prije zahvata.
HLA tipizacija primatelja i darivatelja. HLA tipizacija označava određivanje prisutnosti pojedinih HLA (gena ili antigena) kod primatelja i darivatelja nakon čega se oni uspoređuju te određuje stupanj nepodudarnosti (engl. mismatch, MM). Ispitivanje se može provoditi serološkim postupcima, pri čemu se određuje polimorfizam antigena HLA ili molekularnim postupcima (PCR) pri čemu se određuje polimorfizam gena HLA. Danas se više preferiraju molekularni postupci zbog preciznijih rezultata. Pri izdavanju nalaza oznaka HLA antigena sastoji se od oznake lokusa iza kojeg slijedi identifikacijski broj antigena (jednoznamenkasti broj koji se piše bez nule), npr. HLA-A2, dok se oznaka HLA gena sastoji od oznake lokusa iza kojeg slijedi identifikacijski broj alela (jednoznamenkasti broj koji se piše s nulom), a koji je od oznake lokusa odvojen zvjezdicom, npr. HLA-A*02. Standardno se ispituje polimorfizam na genskim lokusima HLA-A, HLA-B i HLA-DR, a iznimno i HLA-C te HLA-DP i HLA-DQ. S obzirom na to da svaki lokus ima dva alela, pri standardnom testiranju u nalazu ćemo dobiti šest različitih antigena ili gena HLA (ovisno o postupku - serološki ili molekularni koji se potom uspoređuju te se određuje broj nepodudarnosti kako je prikazano u Tablici 5.14.). HLA tipizacija primatelja vrši se prije prijave na popis čekanja, a darivatelja nakon što se proglasi moždana smrt (ili kod živoga donora nakon davanja pristanka i osnovne medicinske procjene). Što je manji stupanj (broj) nepodudarnosti između primatelja i darivatelja, to će reakcija odbacivanja biti manja i manja će biti potreba za imunosupresijom. Rijetke su iznimke kada se primatelj i darivatelj podudaraju u potpunosti (engl. full house), tj. da je nepodudarnost 0.
|
Tablica 5.14. Primjeri bodovanja nepodudarnosti HLA primatelja i darivatelja
|
|
HLA tipizacija davatelja
|
HLA tipizacija primatelja
|
Nepodudarnost
|
|
A1, A2; B8, B27; DR3, DR4
|
A1, A2; B8, B27; DR3, DR4
|
0
|
|
A1, A2; B8, B27; DR3, DR7
|
A1, A2; B8, B27; DR3, DR4
|
1
|
|
A1, A2; B8, B35; DR3, DR7
|
A1, A2; B8, B27; DR3, DR4
|
2
|
|
A1, A9; B8, B35; DR3, DR7
|
A1, A2; B8, B27; DR3, DR4
|
3
|
|
A1, A9; B8; B35; DR1, DR7
|
A1, A2; B8, B27; DR3, DR4
|
4
|
|
A1, A9; B14, B35; DR1, DR7
|
A1, A2; B8, B27; DR3, DR4
|
5
|
|
A3, A9; B14, B35; DR1, DR7
|
A1, A2; B8, B27; DR3, DR4
|
6
|
Određivanje protutijela na HLA u serumu primatelja. Ova pretraga služi za dokazivanje postojanja protutijela na određene antigene HLA u serumu primatelja. Takva protutijela kod primatelja mogla su nastati prilikom senzibilizacije tijekom prethodnih transfuzija krvi i krvnih pripravaka, tijekom prethodne transplantacije ili kod žena tijekom trudnoće. Ako bi se takvim bolesnicima transplantirao presadak koji sadrži antigen HLA na koji je prethodno stvoreno protutijelo, nastala bi hiperakutna reakcija odbacivanja. Da bi se prevenirao ovakav događaj, bolesnicima se vrši određivanje prisutnosti protutijela na HLA u serumu primatelja i to prvi puta prije uvrštenja na popis čekanja, kao i svaka tri mjeseca dok su na popisu čekanja. Kod ovoga ispitivanja najprije se radi probir (engl. screening) pri čemu se utvrđuje postojanje protutijela na HLA u serumu primatelja (engl. panel reactive antibodies , PRA), a potom će svaki pozitivni nalaz zahtijevati dodatnu obradu pri čemu se identificiraju protutijela specifična za pojedine HLA. PRA podrazumijeva dodavanje limfocita koji su dobiveni od nasumično izabranih darivatelja krvi koji predstavljaju reprezentativni uzorak za određenu populaciju stanovnika u serum potencijalnoga primatelja te (podrazumijeva se da pokrivaju veliku većinu HLA populacije) u serum potencijalnoga primatelja. Ako primatelj ima protutijelo/a na neki od HLA koji se nalazi na limfocitima, nastupit će liza limfocita koja se iskazuje u postocima. Osobe koje imaju PRA 0 – 5 % smatraju se neimuniziranima, koje imaju 5 - 85% imuniziranima, a one koje imaju više od 85 % visokoimuniziranim osobama. Ovom pretragom dobivamo saznanje da osoba ima protutijela na HLA, a kod imuniziraih i visokoimuniziranih osoba potrebno je provesti daljnja testiranja određivanja specifičnosti. U tu svrhu danas su na raspolaganju različiti laboratorijski postupci: ELISA, protočna citometrija ili metoda mikrokuglica obloženih antigenima HLA (Luminex). Svaki imunizirani bolesnik ima smanjenu vjerojatnost dobivanja presatka i to u onolikoj mjeri u kojoj je čest antigen u populaciji na koji je senzibiliziran (npr. učestalost HLA-A2 antigena je u populaciji 50 % pa je za toliko i smanjena vjerojatost dobivanja presatka bolesnika koji ima protutijela na HLA-A2).
Test križne reakcije (engl. cross match) između darivatelja i primatelja završni je test imunološke prijetransplantacijske obrade koji se vrši neposredno prije transplantacije. Test se sastoji od dodavanja limfocita darivatelja (izoliranih iz limfnih čvorova ili slezene) u serum primatelja te promatranja lize limfocita. Cilj ovoga testa još je jednom isključiti moguće postojanje protutijela na HLA, na neki od HLA ili drugih antigena koji ima darivatelj, osobito ako taj antigen nije bio obuhvaćen u probiru PRA. Ako ne dođe do lize limfocita, test križne reakcije je negativan i transplantacija se može provesti. Ako je test pozitivan, transplantacija se neće obaviti (apsolutna kontraindikacija).
Ostala prijetransplantacijska obrada. Osim imunološke obrade i dijagnostike same bubrežne bolesti, bolesnici se prije transplantacije podvrgavaju širokoj dijagostičkoj obradi s ciljem evaluacije zdravstvenoga stanja i pronalaska eventualnih kontraindikacija za transplantaciju. Obrada uključuje anamnezu i fizikalni pregled, laboratorijske te instrumentalne pretrage.
Laboratorijske pretrage uključuju standardne laboratorijske pretrage krvi i mokraće, određivanje protutijela na citomegalovirus, Epstein-Barrov virus, virus herpes simpleks, virus varicella-zoster, biljege hepatitisa B i C te testitanje na HIV i sifilis.
Instrumentalne pretrage uljučuju elektrokardiografiju, ehokardiografiju, prema potrebi ergometriju i koronarografiju, ultrazvučni pregled trbuha te doplersku analizu arterija i vena zdjelice (u obzir dolazi i MR ili CT angiografija), pregledni radiološki snimak prsišta, prema potrebi i trbuha ii urotrakta, ortopan i radiološki snimak paranazalnih sinusa, ezofagogastroduodenoskopiju te prema potrebi kolonoskopiju, ginekološki pregled i PAPA test kod žena, a pregled prostate kod muškaraca (ovisno o dobi) te druge pretrage na indikaciju. Transplantacijska središta mogu imati djelomično različit protokol obveznih pretraga (npr. psihijatrijski pregled, cistoskopija).
Postupak transplantacije. Nakon što se pojavi donor, provede HLA tipizacija donora, pronađe odgovarajući primatelj i provede testiranje križne reakcije, može se krenuti u postupak transplantacije. Radi se o složenom procesu koji se sastoji od eksplantacije bubrega iz donora, vremena tzv. hladne ishemije pri kojoj se bubreg transportira do primatelja te same implantacije u primatelja. Cijeli proces mora biti koordiniran s više razina kako bi se što više skratilo vrijeme hladne ishemije (danas vrijeme hladne ishemije u većine bolesnika traje između 12 i 24 sata) te kako bi se odabrao najpogodiji primatelj. Bubreg se implantira u primatelja u području ilijačne jame (fossa illiaca), dakle heterotopično, u izvanperitonealnom prostoru. Bubrežna vena i arterija presatka se anastomoziraju s vanjskom ilijačnom venom i arterijom primatelja, a ureter presatka se anastomozira s mokraćnim mjehurom primatelja. Pri implantaciji bubrežnoga presatka vlastiti se bubrezi obično ne diraju. Najčešće indikacije za prijetransplantacijsku nativnu nefrektomiju su kronična bubrežna infekcija, inficirani kamenci te policistični bubrezi. Postproceduralno se bolesnici najčešće smještaju u jedinice intenzivnoga liječenja radi nadzora te pravovremenoga uočavanja mogućih komplikacija. Neposredan poslijetransplantacijski oporavak, ako nije došlo do razvoja komplikacija, relativno je brz (oko deset dana).
Poslijetransplantacijska imunosupresija. Kako bi se spriječila reakcija odbacivanja, kod svih se bolesnika primjenjuje imunosupresivna terapija. Lijekove koje koristimo u tu svrhu možemo podijeliti u nekoliko skupina: inhibitori kalcineurina (takrolimus, ciklosporin), inhibitori sinteze purina (mikofenolat, azatioprin), mTOR inhibitori (sirolimus, everolimus), kortikosteroidi (metilprednisolon, prednisolon) te monoklonska i poliklonska protutijela (Tablica 5.15.). Većina lijekova svoj učinak zasniva na inhibiciji aktivacije i/ili proliferacije limfocita, a monokolonska i poliklonska protutijela koja se dobivaju imuniziranjem konja ili zeca s ljudskim limfocitima učinak ostvaruju citotoksičnim učinkom na limfocite ili ometanjem njihove normalne funkcije.
|
Tablica 5.15. Primjeri najčešćih imunosupresivnih lijekova koji se koriste u bubrežnoj transplantaciji
|
|
Imunosupresivni lijek
|
Mehanizam djelovanja
|
Klinička primjena
|
Nuspojave
|
|
Kalcineurinski inhibitori (takrolimus, ciklosporin)
|
Smanjena aktivacija i proliferacija T-limfocita
|
Temelj većine imunosupresivnih protokola
|
Nefrotoksičnost, neurotoksičnost, metaboličke nuspojave
|
|
Inhibitori sinteze purina (mikofenolat, azatioprin)
|
Smanjena proliferacija T-limfocita i B
|
Koriste se u većini imunosupresivnih protokola
|
Leukopenija, probavne nuspojave
|
|
Kortikosteroidi (metil/prednisolon, prednison)
|
Smanjena aktivacija T-limfocita
|
Koriste se u većini imunosupresivnih protokola, liječenje akutnoga odbacivanja
|
Infekcije, osteoporoza, metaboličke nuspojave
|
|
mTOR inhibitori
(sirolimus, everolimus)
|
Smanjena proliferacija T-limfocita
|
Alternativa kalcineurinskim inhibitorima ili inhibitorima sinteze purina
|
Mijelosupresija
|
|
Anti-CD20 protutijela
|
Deplecija limfocita B
|
Indukcijska imunosupresija i liječenje odbacivanja posredovanoga protutijelima
|
Infuzijske reakcije, neutropenija, infekcije
|
|
Anti-CD25 protutijela (baziliksimab)
|
Blokiranje IL-2, smanjena aktivacija limfocita
|
Indukcijska imunosupresija
|
Dobra podnošljivost
|
|
Protulimfocitni globulin
|
Deplecija T-limfocita
|
Indukcijska imunosupresija i liječenje akutnoga odbacivanja
|
Poslijetransplantacijska limfoproliferativna bolest
|
|
Kostimulacijska blokada (belatacept)
|
Blokiranje aktivacije T-limfocita
|
Alternativa inhibitorima kalcijneurina
|
Poslijetransplantacijska limfoproliferativna bolest
|
|
Anti-CD52 protutijela (alemtuzumab)
|
Citoksični učinak na limfocite T i B
|
Indukcijska imunosupresija
|
Infekcije, zloćudne bolesti
|
|
Anti-C5a protutijela (eculizumab)
|
Inhibicija aktivacije komplementa
|
Odbacivanje posredovano protutijelima
|
Infekcije (osobito meningokokna sepsa)
|
U sprečavanju reakcije odbacivanja prestaka koristi se više od jednoga imunosupresivog lijeka prema određenom protokolu. Danas postoji više protokola, ali u načelu svi počivaju na sličnim temeljima. Liječenje započinje indukcijskom imunosupresijom, tj. davanjem imunosupresiva neposredno prije transplantacije, a nastavlja se nakon nje sve dok presadak funkcionira (pa i poslije), s najjačom imunosupresijom u prvim mjesecima nakon transplantacije. Temelj imunosupresije nakon transplantacije (terapija održavanja) čine kalcineurinski inhibitor, inhibitor sinteze purina s ili bez kortikosteroida. Tijekom praćenja bolesnika provodi se određivanje koncentracije kalcineurinskih inhibitora u serumu bolesnika, prema čemu se prilagođava doza. Peritransplantacijski je zbog velikoga rizika od razvoja infekcija indicirana empirijska antibiotička profilaksa te gastroprotekcija zbog povećanoga rizika od nastanka peptičkoga ulkusa.
Komplikacije transplantacije bubrega. Najčešće komplikacije koje prate bubrežnu transplantaciju su kirurške komplikacije, reakcija odbacivanja presatka, infekcije, zloćudne bolesti, srčanožilne bolesti, šećerna bolest, kronična nefropatija presatka i povrat osnovne bubrežne bolesti.
Kirurške komplikacije su krvarenje u operacijskom području, infekcije kirurške rane i formiranje apscesa trbušne stijenke, arterijska i venska tromboza, limfocela te urinarna fistula. Kasnije kirurške komplikacije su stenoza uretera, vezikoureteralni refluks i recidivirajući pijelonefritisi, nefrolitijaza hernije trbušne stijenke i stenoza bubrežne arterije.
Reakcija odbacivanja presatka jedna je od najčešćih komplikacija bubrežne transplantacije. Razlikujemo tri oblika odbacivanja presatka: hiperakutno, akutno i kronično. Danas, uz postojeću imunosupresivnu terapiju, učestalost ovih komplikacija iznosi oko 15 %.
Hiperakutno odbacivanje presatka javlja se za vrijeme same transplantacije, a radi se o odbacivanju koje je posredovano već prisutnim, od ranije, protutijelima na HLA ili protutijelima na antigene krvne skupine u krvi primatelja. Klinički se reakcija očituje već za vrijeme zahvata kada bubreg nakon uspostave perfuzije postaje taman, dolazi do edema te mlohavosti. Liječenje se uglavnom sastoji od odstranjenja presatka, prethodno se može pokušati plazmaferezama. Danas se ova reakcija vrlo rijetko viđa, s obzirom na to da se prije same transplantacije određuje krvna skupina donora te se radi križna proba između limfocita donora i seruma primatelja.
Akutno odbacivanje presatka je ono koje se javlja unutar prvih šest mjeseci od transplantacije, a ovisno o patofiziološkom mehanizmu razlikujemo akutno stanično (posredovano T-limfocitima) i akutno odbacivanje posredovano protutijelima. Klinički možemo naći vrućicu, bolnost presatka, smanjenje diureze te povećanje koncentracije dušičnih metabolita u krvi. Konačna se dijagnoza postavlja biopsijom presatka. Za dijagnozu akutnoga odbacivanja posredovanoga protutijelima korisno je određivanje protutijela specifičnih za donora (DSA, od engl. donor specific antibodies) Liječenje akutnoga odbacivanja uključuje pulsnu kortikoteroidnu terapiju (po 500 - 1000 mg metilprednisolona tijekom tri uzastopna dana), a kod odbacivanja posredovanoga protutijelima rituksimab ili protulimfocitni imunoglobulin i plazmafereza.
Kronično odbacivanje presatka je sporo napredujući proces koji se odvija godinama do kliničke pojave završnoga stupnja kronične bubrežne bolesti. Glavni patofiziološki mehanizam je polagana destrukcija presatka koju prate morfološke promjene u smislu fibroze, arterioloskleroze te kalcifikacije. Dijagnoza se postavlja na temelju biopsije prestaka, a nema specifičnoga liječenja (u završnom stupnju dijaliza ili retransplantacija).
Protokolarne biopsije podrazumijevaju biopsiju presatka prema unaprijed utvrđenom planu, neovisno o bubrežnoj funkciji. Cilj ovih biopsija je što prije uočiti histološke znakove bubrežnoga odbacivanja dok se još nije razvila klinička slika i patološki laboratorijski nalazi te sukladno nalazu prilagođavati imunosupresivnu terapiju (pojačavati ili smanjivati). Učestalost biopsija, tj. protokol, ovisi o transplantacijskom središtu, a s obzirom na to da je odbacivanje najučestalije u prvih šest mjeseci i prvoj godini i učestalost biopsija trebala bi biti najveća u tom razdoblju, npr. 2., , 6. i 12. mjesec nakon transplantacije. Za opis patohistoloških promjena u bioptatu presatka koristi se Banffova međunarodna klasifikacija.
Infekcije. Rizik od infekcije kod transplantiranih bolesnika daleko je veći nego u općoj populaciji. Ona je prvenstveno rezultat imunosupresivne terapije, ali ulogu imaju i drugi čimbenici, kao što je opće zdravstveno stanje, uhranjenost, prisutnost komorbiditeta i sl. Infekcije kod ovih bolesnika prate karakteristični vremenski slijed, a karakteristično za ove bolesnike je i pojava BK virusne nefropatije. Imunosupresivno liječenje akutnoga odbacivanja presatka poseban je rizični čimbenik za nastanak infekcija pa je tijekom takvoga liječenja poželjna antimikrobna profilaksa.
Infekcije koje se javljaju u prvih mjesec dana su uglavnom bakterijske i vezane su uz sam kirurški zahvat i poslijeoperacijski tijek (infekcija rane, uroinfekcije, upale pluća i sl.). Od 2. do 6. mjeseca nakon transplantacije uglavnom se radi o reaktivaciji latentnih virusnih infekcija zbog imunosupresije (CMV, EBV, HCV, HSV, VZV). U ovom razdoblju česte su i gljivične i druge oportunističke infekcije (infekcija Pneumocystis jirovecii). U razdoblju nakon šest mjeseci javljaju se infekcije kao i u općoj populaciji, samo s većom učestalošću. Tijekom prvih šest poslijetransplantacijskih mjeseci u mnogim transplantacijskim središtima primjenjuje se profilaksa citomegalovirusne infekcije valganciklovirom, a tijekom prve poslijetransplantacijske godine profilaksa infekcije Pneumocystis jirovecii sulfametoksazol /trimetoprimom. Infekcija citomegalovirusom se unatoč profilaksi nerijetko razvija, i tijekom prve poslijetransplantacijske godine i poslije. Može biti asimptomatska ili se očitovati vrućicom, citopenijom, pogoršanjem funkcije presatka, proljevom i drugim probavnim simptomima, oštećenjem jetrene funkcije, pneumonitisom i drugim. Liječi se valganciklovirom u terapijskoj dozi ili ganciklovirom parenteralno. Dokazuje se postupkom PCR za CMV DNK ili dokazom virusa u bioptičkom uzorku bubrega ili crijevne sluznice.
BK poliomavirus (BKV, BK su inicijali oboljeloga prema kojemu je nazvan) je ubikvitaran virus koji karakteristično može izazvati infekciju prestaka kao posljedicu imunosupresije. BKV uzrokuje tubulointersticijski nefritis koji može dovesti do poremećaja funkcije do potpunoga prestanka funkcije presatka. Infekcija se obično očituje unutar prve godine od transplantacije pa se na njega treba misliti kod svakoga pogoršanja funkcije presatka. Dijagnoza se postavlja molekulskim postupcima (određivanje DNKBK virusa) te biopsijom presatka (nalaz inkluzijskih tjelešaca, imunohistokemijsko bojanje). Glavna terapijska mjera je smanjenje imunosupresije i intravenski imunoglobulini, a opisano je i da ciprofloksacin te niske doze leflunomida ili cidofovira mogu biti učinkovite.
Zloćudne bolesti. Učestalost zloćudnih tumora kod bolesnika s transplantiranim bubregom je četiri do pet puta veća nego u općoj populaciji. Kao i za infekcije, glavni rizični čimbenik je imunosupresija i gubitak fiziološke uloge imunosnoga sustava u obrani od nastanka zloćudnih klonova. Raspodjela novonastalih tumora prema sijelu kod ovih bolesnika je sljedeća: karcinom kože (40 %), limfoproliferativne bolesti (11 %), karcinom pluća (5 %), karcinom bubrega (5%), Kaposijev sarkom (4 %), karcinom cerviksa (4 %), karcinom vulve i perineuma (3 %) te ostali (28 %). Zbog veće učestalosti ovih bolesti, bolesnike s bubrežnim presatkom mora se aktivno pratiti kako bi se zloćudna bolest prepoznala u što ranijoj fazi i kako bi liječenje bilo uspješnije.
Kronična nefropatija presatka predstavlja morfološke promjene na presatku koje su posljedica imunoloških (reakcija odbacivanja) te neimunoloških zbivanja (ishemija presatka, nefrotoksičnost lijekova, hipertenzija i dr.) uz posljedični napredujući gubitak funkcije. Histološki, kroničnu nefropatiju presatka obilježava tubulointersticijska fibroza i atrofija, proliferacija intime kapilara te glomerulska skleroza. Klinički se razvija slika napredujuće kronične bubrežne bolesti uz porast dušičnih metabolita. Ultrazvučno se bilježi stanjenje bubrežnoga parenhima i hiperehogenost presatka, a konačna dijagnoza postavlja se biopsijom. Specifičnoga liječenja nema, primjenjuju se mjere liječenja kronične bubrežne bolesti, a u završnom stupnju bolesnik se vraća dijaliznom liječenju ili se radi retransplantacija.
Povrat osnovne bolesti. Određene bolesti bubrega imaju tendenciju ponovnoga vraćanja, tj. pojave i u bubrežnom presatku. Primjer takvih bolesti su primarna fokalna segmentalna glomeruloskleroza, C3 glomerulopatije, atipični HUS, paraproteinemije, IgA nefropatija, membranski i membranoproliferativni glomerulonefritis, lupusni nefritis i dr. Ove bolesti ne predstavljaju kontraindikaciju za transplantaciju, ali zbog rizika povrata mogu zahtijevati drukčiji terapijski pristup.
Ostale komplikacije. Kod bolesnika s bubrežnim presatkom prati se ubrzana aterosleroza kojoj pogoduje arterijska hipertenzija, primjena imunosupresivnih lijekova, lošija regulacija glikemije i sl., a to sve vodi povećanom riziku od srčanožilnih bolesti, posebice koronarne i cerebrovaskularne. Također se kod ovih bolesnika prati i pogoršanje otprije postojeće šećerne bolesti, a kod jednoga dijela bolesnika razvija se šećerna bolest de novo (NODAT, od engl. new onset of diabetes after transplantation).
Prognoza. Srednje preživljenje presatka danas iznosi oko 90 % za prvu godinu, 80 % nakon pet godina te 50 % nakon deset godina. Srednje preživljenje bolesnika nakon transplantacije iznosi 95 % nakon prve godine, 85 % nakon 5 godina te 60 % nakon deset godina. Iako su ovi bolesnici skloniji razvoju i pobolijevanju od različitih infekcija u odnosu na opću populaciju, najčešći uzrok smrti kod njih su srčanožilne bolesti, kao i u ostatku populaciji.
PLAZMAFEREZA
Plazmafereza je terapijski postupak pri kojemu se krv iz bolesnika odvodi u posebne uređaje gdje se plazma odstranjuje od ostatka krvi i zamjenjuje tekućinom (svježe smrznuta plazma, otopine albumina) koja se potom vraća natrag u bolesnika. Plazmafereza se primjenjuje s ciljem odstranjenja tvari velike molekulske mase iz krvi koja se ne može odstraniti klasičnom hemodijalizom (protutijela, imunokompleksi, krioglobulini, lipoproteini).
Indikacije. Plazmaferezom se iz krvi odstranjuju molekule velike molekulske mase, molekule koje imaju dug poluživot (spori endogeni putevi odstranjenja) te molekule koje su akutno patogene i otporne na ostale postupke liječenja. U Tablici 5.16. prikazane su molekule koje se odstranjuju terapijskom plazmaferezom s primjerom bolesti u kojima se to radi.
|
Tablica 5.16. Prikaz potencijalnih indikacija za plazmaferezu
|
|
Patološka molekula
|
Bolest/indikacija
|
|
Imunoglobulini
|
Hiperviskozni sindrom, Waldenströmova makroglobulinemija,
Multipli mijelom
|
|
Autoprotutijela
|
Mijastenija gravis, Goodpastureov sindrom, sustavni eritematozni lupus, sustavni vaskulitis, inhibitori ADAMTS13, odbacivanje bubrežnoga presatka posredovanoga protutijelima, priprema za presadbu bubrega darivatelja nepodudarne krvne skupine
|
|
Lipoprotein
|
Hiperkolesterolemija,
Hipertrigliceridemija
|
|
Cirkulirajući imunokompleksi
|
Glomerulonefritis uzrokovan cirkulirajućim imunokompleksima,
Vaskulitisi
|
|
Lijekovi i toksini vezani za bjelančevine
|
Hormoni štitnjače (tireoidna oluja), toksini gljive Amanita phalloides, lijekovi vezani na albumine
|
Temeljno načelo plazmafereze. Plazmafereza podrazumijeva odvajanje plazme od krvnih stanica što se može postići na dva načina: primjenom centrifugalne sile u posebim uređajima za citaferezu te filtracijom kroz visokopropusni filter u uređaju za hemodijalizu. Prema tome, plazmaferaza se može provoditi pomoću uređaja za plazmaferezu ili pomoću uređaja za hemodijalizu koji podržavaju plazmaferezu. Osnovna načela izvantjelesne cirkulacije jednaka su onima za klasičnu hemodijalizu (krvožilni pristup, dijalizni kateter, arterijska i venska linija, antikoagulacija). Uređaji kojima se provodi plazmafereza moraju osigurati brzinu odstranjenja plazme jednaku onoj kojom se infundira supstitucijska otopina, a sami protoci krvi kod provođenja plazmafereze moraju biti sporiji (50 - 150 ml/min. ).
Količina plazmafereze. S obzirom na to da se tvari koje želimo eliminirati postupkom plazmafereze nalaze i u intersticiju i u krvnim žilama, pri izmjeni jednoga volumena plazme odstrani se tek oko 60 % željene tvari, a kod izmjene 1,4 volumena plazme odstrani se oko 75 %. Izračun jednoga volumena plazme matematički je određen formulom: jedan volumen plazme (l) = 0,065 x tjelesna masa (kg) x (1 - hematokrit). Standarno se pri jednom postupku izmjenjuje između jednoga i jednog i pol volumena plazme. Broj postupaka ovisi o indikaciji odnosno molekuli koju želimo odstraniti: npr. molekula IgM se u najvećem dijelu nalazi intravaskularno i potrebno je svega nekoliko postupaka da se odstrani, dok se molekula IgG u velikoj količini nalazi u intersticiju pa se sporo resorbira u krv i za njezino je odstranjenje potrebno više postupaka plazmafereze. Najčešće se provodi po jedan postupak svaki drugi ili treći dan s volumenom izmjene od 1 do 1,5 volumena plazme do ukupno 3 do 5 postupaka. Treba imati na umu da je postupak plazmafereze dopunski postupak i da se treba primjenjivati zajedno s osnovnom terapijom (kortikosteroidi, imunosupresivi).
Nadoknada odstranjene plazme. Volumen plazme koji se odstrani tijekom plazmafereze mora se nadoknaditi, a za to se najčešće koristi ili 5 %-tna otopina albumina ili svježe smrznuta plazma. Glavni nedostatak primjene albumina je u tome što se vrši nadoknada samo albumina, dok ostale bjelančevine kao što su čimbenici zgrušavanja ostaju nenadoknađene, ali ona nosi manji rizik za prijenos virusnih bolesti. S druge strane svježe smrznutom plazmom nadoknađujemo i druge bjelančevine, što čini cijeli postupak fiziološkijim, ali nosi veći rizik od anafilaktičkih reakcija, prijenosa virusnih bolesti te akutnoga plućnoga oštećenja. Apsolutna indikacija za primjenu svježe smrznute plazme je trombotička trombocitopenična purpura (TTP). U Tablici 5.17. su prikazane prednosti i nedostaci otopina koje se koriste za nadoknadu volumena u terapijskoj plazmaferezi.
|
Tablica 5.17. Usporedba komplikacija/nedostataka supstitucijskih otopina za plazmaferezu
|
|
Komplikacija/nedostatci
|
Otopina 5%-tnoga albumina
|
Svježe smrznuta plazma
|
|
Anafilaktička reakcija
|
-/+
|
+
|
|
Prijenos virusnih infekcija
|
-
|
+
|
|
Deplecijska koagulopatija
|
+
|
-
|
|
Gubitak imunoglobulina (infekcije)
|
+
|
-
|
|
Pojava hipokalcijemije
|
+
|
+
|
Komplikacije. Terapijska plazmafereza praćena je komplikacijama jednakim kakve se mogu javiti i kod provođenja hemodijalize (prethodno opisano). Specifične komplikacije najčešće su povezane s vrstom supstitucijske otopine: 1) primjena albuminske otopine očekivano produljuje protrombinsko vrijeme za oko 30 %, dok se aktivirano parcijalno tromboplastinsko vrijeme udvostručuje (oporavak ovih laboratorijskih nalaza očekuje se tijekom 4 do 5 sati od završetka postupka, osim fibrinogena čija je sinteza sporija), 2) teoretski, gubitak imunoglobulina može biti povezan s nastankom imunodeficijencije, iako isto nije dokazano u različitim istraživanjima (ipak, kada se razvija infekcija kod ovih bolesnika indicirana je primjena imunoglobulina), 3) primjena svježe smrznute plazme kao susptitucijske otopine povezana je s većom učestalošću alergijskih reakcija i praćena je povećanim rizikom od prijenosa virusnih bolesti, 4) tijekom plazmafereze se gube i lijekovi koji se vežu na plazmatske bjelančevine, stoga ih treba primjenjivati neposredno nakon postupka.
UVOD U GLOMERULSKE BUBREŽNE BOLESTI
Uvod. Glomerulske bolesti čine treći po učestalosti uzrok završnoga stupnja kronične bubrežne bolesti, nakon dijabetičke i hipertenzivne nefropatije, te se nalaze kod 10 do 15 % tih bolesnika. Nomenklatura glomerulskih bolesti može biti zbunjujuća, ali ugrubo gledano, kada se radi o glomerulskim bolestima s dominantno upalnom komponentnom, govorimo o glomerulonefritisima, a ako su uzrokovane drugim patofiziološkim mehanizmima, govorimo o glomerulopatijama, iako se ova podjela i nazivlje često preklapaju i nemaju jasne granice. U daljnjem tekstu bit će prikazani osnovni koncepti glomerulskih bolesti te najčešće glomerulske bolesti u kliničkoj praksi.
Građa glomerula. Glomerul predstavlja klupko kapilara smješteno između dviju arteriola (aferentna i eferentna arteriola) koje osiguravaju dovod i odvod krvi iz glomerula. Preko stijenke kapilara odvija se temeljni postupak stvaranja mokraće, a to je glomerulska filtracija. Kapilarna stijenka građena je od glomerulske bazalne membrane koja je s unutarnje strane obložena endotelnim stanicama s procjepima, a s vanjske strane visceralnim epitelnim stanicama koje se nazivaju podociti. Između kapilara nalazimo prostor koji se naziva mezangij, a sastoji se od mezangijskih stanica. Cijela struktura glomerula obavijena je Bowmanovom čahurom koja je iznutra obložena parijetalnim epitelnim stanicama, a prostor unutar nje naziva se Bowmanov prostor i u njemu se skuplja filtrirana plazma (primarni urin) koja dalje odlazi u bubrežne tubule.
KLASIFIKACIJA GLOMERULSKIIH BOLESTI
Jedinstvena, općeprihvaćena klasifikacija bolesti glomerula ne postoji, a akademski gledano, one se mogu podijeliti prema više kategorija: etiopatogenetički, kronološki, patološki te klinički. Navedene podjele nisu stroge jer se pojedini klinički oblici glomerulskih bolesti međusobno preklapaju i nemaju jasne granice.
Etiopatogenetička klasifikacija. Primarne glomerulske bolesti su one koje se pojavljuju kao izolirana bubrežna bolest ili je ona dominantna, a sekundarne glomerulske bolesti su one kod kojih je oštećenje glomerula samo jedna od očitovanja sustavne bolesti. S obzirom na mehanizme nastanka često govorimo o imunosnim, metaboličkim, cirkulacijskim i idiopatskim glomerulskim bolestima.
Kronološka klasifikacija. Ovisno o nastupu i duljini trajanja bolesti govorimo o akutnim ili kroničnim glomerulskim bolestima, a posebnu skupinu čine brzoprogresivni glomerulonefritisi, u kojih se akutno bubrežno oštećenje razvija tijekom nekoliko dana od početka prvih simptoma.
Patološka klasifikacija. Ovisno o patohistološkom supstratu govorimo o upalnim i neupalnim glomerulskim bolestima (glomerulonefritis, glomerulopatija), a ovisno o umnažanju pojedinih stanica o neproliferativnim i proliferativnim glomerulskim bolestima. Proliferacija stanica može biti endokapilarna (unutar kapilara) ili ekstrakapilarna (izvan kapilara u Bowmanovom prostoru). Nadalje, prema broju zahvaćenih glomerula razlikujemo difuzne (> 50 % zahvaćenih glomerula) i fokalne bolesti glomerula (< 50 % zahvaćenih glomerula), a prema zahvaćenosti samih glomerula razlikujemo globalne (zahvaćen cijeli glomerul) i segmentalne bolesti glomerula (zahvaćen dio glomerula).
Klinička klasifikacija. Glomerulske bolesti klinički se mogu očitovati kao jedan od navedenih kliničkih sindroma: asimptomatski poremećaji u mokraći (proteinurija i/ili hematurija), nefrotički sindrom, akutni nefritički sindrom/akutni glomerulonefritis, brzoprogresivni glomerulonefritis te kronični glomerulonefritis.
PATOGENEZA GLOMERULSKIH BOLESTI
Klasičan opis patogeneze glomerulskih bolesti uključuje nekoliko ključnih događaja: primarna ozljeda glomerula, odgovor na primarnu ozljedu glomerula te ishodi glomerulske ozljede. Primarna ozljeda glomerula označava noksu kojom započinje patološki proces, a u načelu on može biti imunosne i neimunosne prirode, dok odgovor na primarnu ozljedu označava promjene i događaje u glomerulima koji su posljedica djelovanja primarne ozljede, što sve u konačnici dovodi do određenoga ishoda bolesti (rezolucija, ožiljkavanje). Analize bioptičkih uzoraka ukazuju da je u više od 70 % bolesti glomerula dominantan patofiziološki mehanizam imunosno uvjetovan. Također, u određenome broju glomerulskih bolesti patogenski mehanizam ostaje nepoznat.
primarna ozljeda glomerula → odgovor na primarnu ozljedu → konačni ishod glomerulske ozljede
Predložen patofiziološki slijed glomerulskih bolesti
Primarna imunosna ozljeda glomerula može nastati na nekoliko načina: 1) oštećenje posredovano imunim kompleksima, 2) oštećenje posredovano citotoksičnim protutijelima, 3) stanično posredovano oštećenje, 4) oštećenje uzrokovano prekomjernom aktivacijom alternativnoga puta komplementa.
Oštećenje posredovano imunim kompleksima (antigen - protutijelo) obilježava nakupljanje imunih kompleksa u glomerulima koji dovode do aktivacije komplementa klasičnim putem, čiji je krajnji proizvod litički kompleks C5b-9 koji izaziva strukturna oštećenja glomerula. Imuni kompleksi se mogu stvarati in situ kao odgovor na neke intrinzične antigene, koji su normalna sastavnica glomerula, ili na ekstrinzične antigene, koji su se prethodno implantirali u glomerule (npr. inkorporirani virusni antigeni), a može se raditi i o odlaganju cirkulirajućih, prethodno stvorenih imunih kompleksa (imuni kompleksi s mikrobiološkim antigenima, autoantigenima ili tumorskim antigenima).
Oštećenje posredovano citotoksičnim protutijelima obilježava prisutnost protutijela usmjerenih na antigene glomerula ili endotelnih stanica koji dovode do izravnoga ili posrednoga litičkog učinka, bez prethodnoga formiranja imunih kompleksa i aktivacije komplementa. Glavni primjer ovakvih protutijela su protutijela na citoplazmu neutrofilnih leukocita (ANCA, od engl. antineutrophil cytoplasmatic antibodies: c-ANCA ili PR3-ANCA, na metaloproteinazu-3, p-ANCA ili MPO-ANCA, na mijeloperoksidazu).
Stanično posredovano oštećenje glomerula najslabije je istraženo, a podrazumijeva oštećenje glomerula koje nastaje izravnim staničnim imunosnim reakcijama, a stanice koje se najčešće povezuju s ovim oblicima oštećenja su T-limfociti i makrofazi koji se mogu naći u glomerulima u nekim glomerulskim bolestima, bez prisutnih protutijela i/ili imunih kompleksa.
Oštećenje posredovano prekomjernom aktivacijom komplementa alternativnim putem rjeđi je mehanizam oštećenja glomerula, a posljedica je litičkoga učinka komplementa koji se aktivira alternativnim putem (izravna aktivacija u odsutnosti interakcije antigen - protutijelo). Kao i kod aktivacije komplementa klasičnim putem, krajnji proizvod je litički kompleks C5b-9.
Primarna neimunosna ozljeda označava početno oštećenje glomerula koje nije potaknuto imunosnim zbivanjem, a može nastati na nekoliko načina: 1) genski poremećaj (nasljedne bolesti koje mijenjaju strukturu glomerula), 2) metaboličko oštećenje (nakupljanje patoloških metabolita u glomerulima, učinak hiperglikemije), 3) mehaničko oštećenje (arterijska hipertenzija, trombotička mikroangiopatija), 4) ishemijsko oštećenje (smanjen protok krvi kroz glomerule) i 5) toksično oštećenje (lijekovi, bakterijski toksini).
Odgovor na primarnu ozljedu glomerula predstavlja lokalna zbivanja u glomerulu koja su potaknuta početnom noksom (primarnom ozljedom), a koja dodatno narušavaju strukturu i dovode do funkcijskoga poremećaja te pridonose ukupnoj patogenezi bolesti. Pri tome glavnu ulogu imaju, kako upalne (ekstrinzične) stanice, tako i intrinzične glomerulske stanice.
Upalne (ekstrinzične) stanice bivaju privučene iz cirkulacije, što je potaknuto lučenjem različitih čimbenika kemotaksije, kao odgovor na primarnu ozljedu glomerula. Dolazi do pojačanoga protoka krvi kroz mjesto ozljede kao i pojačane permeabilnosti kapilara te migracije upalnih stanica na mjesto ozljede. Glavne upalne stanice u ovim procesima su neutrofili, makrofazi i T-limfociti. Aktivacija i međusobne interakcije ovih stanica na mjestu primarne ozljede dovest će do daljnjih strukturnih i funkcijskih poremećaja nekim od mehanizama: izravno oštećenje posredovano makrofazima ili citotoksičnim T-limfocitima (CD8+), oštećenje posredovano otpuštanjem slobodnih radikala kisika (ROS, od engl. reactive oxygene species) ili proteinaza, oštećenje posredovano stvaranjem specifičnih protutijela, aktivacija trombocita i stvaranje trombocitnih čepova praćeno ishemijskim promjenama i dr.
Intrinzične glomerulske stanice koje mogu biti uključene u odgovor na primarnu ozljedu glomerula su endotelne stanice, mezangijske stanice, parijetalne te visceralne epitelne stanice (podociti). Aktivacija endotelnih stanica može rezultirati poremećajem funkcije, gubitkom antikoagulantnih i vazoaktivnih svojstava, kao i nekrozom ili proliferacijom. Jedna od glavnih odlika endotelnih stanica je velika sposobnost potpune regeneracije u prisutnosti žilnoga endotelnog čimbenika rasta (VEGF, od engl. vascular endothelial growth factor). Aktivacija mezangijskih stanica može dovesti do nekoliko ishoda: apoptoza, nekroza ili proliferacija i hipertrofija. Također, aktivacija mezangijskih stanica praćena je stvaranjem velikoga broja signalnih molekula (prostaglandini, kemokini i drugi) koji dodatno mogu pojačavati primarnu ozljedu glomerula, a moguća je i transformacija u miofibroblaste. Aktivacija parijetalnih epitelnih stanica očituje se proliferacijom te stvaranjem polumjeseca čiji su sastavni dio. Polumjeseci predstavljaju patološku leziju sastavljenu od proliferiranih parijetalnih epitalnih stanica, makrofaga, T-limfocita te necitokinskih bjelančevina koja se stvara u Bowmanovoj čahuri nakon prekida kontinuiteta glomerulske bazalne membrane i prodora unutaržilnoga sadržaja u Bowmanovu čahuru. Stvaranje polumjeseca uvjetovano je prisutnošću Th-1 citokina (IL-12, INF-γ). Visceralne epitelne stanice (podociti) u odgovoru na primarnu ozljedu mogu otpuštati sastavnice komplemeta, kemokine, čimbenike rasta, te mogu preuzeti lipide. Glavna histološka značajka je gubitak nožica te odvajanje od glomerulske bazalne membrane, što dovodi do nastanka proteinurije. Daljnje napredovanje i gubitak nefrona rezultirat će promjenom citoskeleta podocita i posljedičnom hipertrofijom. Sažeto je uloga intrinzičnih stanica u odgovoru na primarnu ozljedu glomerula prikazana Tablicom 5.18.
|
Tablica 5.18. Uloga intrinzičnih stanica u odgovoru na primarnu ozljedu glomerula
|
|
Stanice
|
Uloga
|
|
Endotelne stanice
|
Poremećaj funkcije, nekroza, proliferacija, regeneracija
|
|
Mezangijske stanice
|
Apoptoza, nekroza, proliferacija, hipertrofija, transformacija
|
|
Parijetalne epitelne stanice
|
Proliferacija i stvaranje polumjeseca
|
|
Visceralne epitelne stanice
|
Aktivacija, gubitak nožica podocita, sekundarna hipertrofija
|
Ishod glomerulske ozljede označava konačan događaj koji nastaje kao posljedica prethodno opisivanih patofizioloških mehanizama. Ishod može uključivati potpunu rezoluciju, tj. potpuni strukturni i funkcijski oporavak glomerula ili zaostaju kronične promjene koje se mogu podijeliti u dvije skupine: promjene na glomerulima (glomeruloskleroza) te promjene na tubulima i intersticiju (tubulointersticijska fibroza i atrofija).
Glomeruloskleroza je naziv za kronične promjene na glomerulu, odnosno za ožiljkavanje glomerula, a one uključuju obliteraciju i nestanak lumena glomerularnih kapilara, ogoljenja glomerularne bazalne membrane te ekspanziju mezangija. Promjene nastaju najprije segmentalno, a kasnije postaju globalne, tj. zahvaćaju cijeli glomerul.
Tubulointersticijska fibroza i atrofija je naziv za kronične promjene koje se javljaju sekundarno na tubulima (atrofija) i intersticiju (fibroza) te prate oštećenje glomerula. Glavni događaj je aktivacija tubulskih stanica koje dovode do razvoja intersticijske upale te kasnije fibroze koja uzrokuje prekid kontinuiteta tubula. Atrofija tubula nastaje kao posljedica glomeruloskleroze i ispadanja nefrona iz funkcije.
KLINIČKE ZNAČAJKE GLOMERULSKIH BOLESTI
Tradicijski, klinička očitovanja glomerulskih bolesti svrstavaju se u jedan od pet kliničkih sindroma: nefrotički sindrom, akutni nefritički sindrom, brzoprogresivni glomerulonefritis, kronični glomerulonefritis te sindrom asimptomatske proteinurije i/ili hematurije. S obzirom na to da se klinička očitovanja mnogih glomerulskih bolesti međusobno preklapaju ili mogu imati više kliničkih očitovanja, teško se držati opisanih podjela. Nefritički i nefrotički spektar glomerulskih bolesti prikazan je u Tablici 5.19.
Nefrotički sindrom je naziv za sindrom kojeg primarno čini proteinurija veća od 3,5 g/24 sata s posljedičnom hipoproteinemijom (hipoalbuminemijom), edemima te hiperlipidemijom/lipidurijom, a obilježava ga sporiji i napredujuć klinički tijek.
Akutni nefritički sindrom (akutni glomerulonefritis) je naziv za sindrom kojega primarno čini hematurija i razvoj kliničke slike akutnoga bubrežnog oštećenja (oligurija/anurija, arterijska hipertenzija), uz edeme i proteinuriju ispod nefrotičkoga ranga.
Brzoprogresivni glomerulonefritis ima ista klinička obilježja kao i akutni nefritički sindrom, ali je praćen naglim i napredujućim gubitkom bubrežne funkcije tijekom nekoliko tjedana ili mjeseci.
Kronični glomerulonefritis ili kronični nefritički sindrom definira se nalazom aktivnoga sedimenta mokraće te trajno smanjenom, stabilnom bubrežnom funkcijom koja traje dulje od 6 mjeseci.
Sindrom asimptomatske proteinurije i/ili hematurije definira se kao stanje u kojemu nalazimo perzistentnu proteinuriju ispod nefrotičkoga ranga i/ili hematuriju, u odsutnosti kliničkih simptoma i znakova i uz očuvanu ekskrecijsku bubrežnu funkciju.
|
Tablica 5.19. Nefritički i nefrotički spektar glomerulskih bolesti
|
|
Nefritički spektar
|
Nefrotički spektar
|
|
Asimptomatska hematurija
|
Akutni nefritički sindrom
|
Brzoprogresivni glomerulonefritis
|
Asimptomatska proteinurija
|
Nefrotički sindrom
|
|
Mikroskopska ili makroskopska hematurija s ili bez proteinurije (< 1 g/dan)
|
Akutno bubrežno oštećenje
Hematurija
Eritrocitni cilindri
Proteinurija (1 - 3 g/dan)
Hipertenzija
Edemi
|
Akutno bubrežno oštećenje
Hematurija
Eritrocitni cilindri
Proteinurija (1 - 3 g/dan)
Sustavni simptomi
Brzo napredovanje
|
Izolirana proteinurija bez simptoma
|
Proteinurija (> 3,5 g/dan)
Hipoalbuminemija
Edemi
Hiperlipidemija
|
PATOHISTOLOŠKA DIJAGNOSTIKA GLOMERULSKIH BOLESTI
Osim standardnih laboratorijskih i slikovnih postupaka, u dijagnostici glomerulskih bolesti jednu od ključnih uloga ima biopsija bubrega i patohistološka dijagnostika. Uzorak bubrežnoga tkiva nakon prikladne pripreme gleda se pod svjetlosnim, imunoflorescentnim i elektronskim mikroskopom.
Svjetlosna mikroskopija ima ulogu u procjeni prikladnosti samoga uzroka (uzorak s najmanje 10 do 20 glomerula), rasprostranjenosti patološkoga procesa (fokalno - difuzno, segmentalno - globalno), vrsti patološkoga procesa (promjene glomerulske bazalne membrane, proliferacija staničnih elemenata i sl.) te procjeni aktivnosti bolesti (prisutnost nekroze, proliferacije, edema, stanične infiltracije).
Imunoflorescentna mikroskopija podrazumijeva bojanje uzoraka imunofluorescentno obilježenim molekulama kao što su protutijela (IgG, IgA, IgM), sastavnice komplementa (C3, C1q), lanci kapa i lambda i sl., te potom analizu florescentnim mikroskopom. Pozitivan nalaz pojedinoga protutijela ili sastavnice komplementa može ukazivati na etiologiju bolesti, a pri tome bitnu ulogu ima i lokalizacija (glomeruli, intersticij, tubuli) te morfologija pozitiviteta (linearni ili granularni uzorak).
Elektronska mikroskopija omogućuje ultrastrukturnu analizu koja uključuje detaljniju analizu pojedinih dijelova glomerula, što ima presudnu ulogu u dijagnostici i/ili određivanju stupnjeva nekih bolesti (npr. bolest minimalnih promjena).
NAJČEŠĆE GLOMERULSKE BOLESTI U KLINIČKOJ PRAKSI
Jedinstvene kliničke podjele glomerulskih bolesti nema, s obzirom na to da se one međusobno isprepliću ovisno o patogenskim mehanizmima i kliničkim očitovanjima. Pokušaj svrstavanja pojedinih glomerulskih bolesti u jednu od pet kliničkih kategorija nije moguć, jer pojedine glomerulske bolesti mogu imati više kliničkih očitovanja, iako načelno gledano mogu vući više prema nefrotičkom ili nefritičkom spektru bolesti. U Tablici 5.20. su prikazane najčešće glomerulske bolesti i klinički sindromi kojima se mogu očitovati.
|
Tablica 5.20. Najčešće glomerulske bolesti u kliničkoj praksi
|
|
Nefrotički sindrom
|
Akutni nefritički sindrom
|
|
Bolest minimalnih promjena
Membranska nefropatija
Fokalna segmentalna glomeruloskleroza.
C3 nefropatija
GN s organiziranim depozitima
C1Q nefropatija
Dijabetička nefropatija
Lupusni nefritis
|
Membranoproliferativni GN
IgA nefropatija
Postinfektivni GN
Lupusni nefritis
|
|
Brzoprogresivni glomerulonefritis
|
Asimptomatski poremećaji u mokraći
|
|
Anti-GBM nefritis
Pauciimuni GN s polumjesecima
Membranoproliferativni glomerulonefritis
C3 nefropatija
IgA nefropatija
Membranska nefropatija (rijetko)
|
IgA nefropatija
Membranoproliferativni glomerulonefritis
C1Q nefropatija
Familijarne nefropatije
|
BOLEST MINIMALNIH LEZIJA
Definicija. Bolest minimalnih lezija označava bolest glomerula koju obilježavaju minimalne strukturne promjene u vidu gubitka nožica podocita, a koje se uočavaju tek elektronskom mikroskopijom. Ona čini oko 80 % uzroka nefrotičkoga sindroma kod djece i oko 10 % kod odraslih osoba. Klinički je obilježava očuvana bubrežna funkcija (glomerulska filtracija), dobar odgovor na liječenje kortikosteroidima te povoljna prognoza.
Etiopatogeneza. Etiopatogenetički razlikujemo dva oblika bolesti: primarni ili idiopatski oblik te sekundarni oblik koji može biti povezan s nekim bolestima i stanjima kao što su hematološke zloćudne bolesti (Hodgkinov limfom), alergijske reakcije te primjena određenih lijekova (nesteroidni protuupalni lijekovi, ampicilin, litij). Iako bolest nije genski uvjetovana, primijećena je veća učestalost kod osoba s određenim antigenima HLA kao što su HLA-DR3, HLA-DR4, HLA-DR6, HLA-B8, HLA-B12. Danas se smatra da bolest nastaje kao posljedica izravnoga imunosnog oštećenja glomerula posredovano citokinima koje stvaraju određeni klonovi T-limfocita. Oslobođeni citokini djeluju toksično na glomerule tako što dovode do smanjenja negativnoga električnog naboja glomerulske bazalne membrane, kao i strukturnih promjena podocita, posljedično čemu dolazi do razvoja proteinurije i nefrotičkoga sindroma. Glomerulska filtracija je očuvana, zbog čega su vrijednosti dušičnih metabolita uredne. Ovu hipotezu potvrđuje činjenica da se supresijom stanične imunosti (kortikosteroidna terapija) postiže dobar klinički odgovor kao i činjenica da se bolest javlja s većom učestalošću kod osoba koje već imaju poremećaj stanične imunosti i T-limfocita (Hodgkinov limfom).
Patologija. Sam naziv bolesti povezuje se s patohistološkim obilježjima, s obzirom na to da se promjene mogu zamijetiti tek pod elektronskim mikroskopom. Na svjetlosnoj mikroskopiji glomeruli ovih bolesnika izgledaju uredno, a imunofluorescentna mikroskopija je negativna (kod manjega broja bolesnika mogu se detektirati manji depoziti protutijela IgM u mezangiju). Osnovna značajka bolesti difuzni je gubitak nožica podocita, što je vidljivo tek pod elektronskim mikroskopom.
Klinička slika. Klasično se bolest prezentira naglim razvojem nefrotičkoga sindroma uz opće simptome kao što su slabost, malaksalost, gubitak teka i apatija. Posebno su izraženi periorbitalni i perigentalni edemi (labija, skrotum). Od ostalih kliničkih očitovanja mogu se naći hipertenzija (u manje od 50 %), hematurija (u manje od 30 %) te atopijska dijateza (u manje od 20 %). Klinička očitovanja često su povezana s bakterijskim i virusnim infekcijama te se često javljaju nakon njih.
Komplikacije. Osnovne komplikacije kod ovih bolesnika su sklonost infekcijama (gubitak imunoglobulina) te tromboembolijskim događajima (gubitak antikoagulantnih čimbenika, pojačana aktivacija trombocita). Akutno bubrežno oštećenje rijetko se razvija, i to obično kod starijih bolesnika, što je obično precipitirano hipovolemijom (proljev, povraćanje) i sepsom.
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza krvi i mokraće te histopatološkom potvrdom bolesti. Laboratorijski nalazi mokraće uključuju masivnu proteinuriju (> 3 g/24 sata), eritrocituriju kod manje od 30 % bolesnika te uredan nalaz mokraćnoga sedimenta (bez patološke cilindrurije). Laboratorijske pretrage krvi uključuju hipoproteinemiju i hipoalbuminemiju (< 20 g/l), uredne vrijednosti dušičnih metabolita (ureja, kreatinin), miješanu hiperlipidemiju te ubrzanu sedimentaciju eritrocita. Elektroforeza serumskih bjelančevina pokazuje smanjene serumske koncentracije albumina i gamaglobulina, uredne koncentracije alfa-1 globulina te povećane alfa-2 te beta-globulina. Konačna dijagnoza se postavlja na temelju biopsije bubrega i patohistološke analize (ključan nalaz je gubitak nožica podocita na elektronskoj mikroskopiji).
Liječenje se sastoji od simptomatskoga i specifičnog liječenja. Simptomatsko liječenje se sastoji od restrikcije unosa soli te parenteralne primjene albumina (0,5 - 1 g/kg) i diuretika Henleove petlje (furosemid 1 mg/kg) za bolesnike s izraženim edemima.
Specifično liječenje podrazumijeva liječenje glukokortikoidima u prvoj liniji te drugim imunosupresivima u drugoj liniji liječenja. Standardno se u početnoj fazi bolesti primjenjuje prednizon u dozi od 1 mg/kg na dan per os (maksimalno 80 mg/dan) do postizanja remisije (povlačenje proteinurije), a potom se tijekom nekoliko mjeseci postupno smanjuje doza glukokortikoida. Vrijeme do povoljnoga kliničkog odgovora (povlačenje proteinurije) kod odraslih je osoba produljeno te se bolesnici smatraju rezistentnima na glukokortikoide ako se ne postigne remisija bolesti nakon 16 tjedana liječenja. Također, određen broj bolesnika postaje ovisan o glukokortikoidima, što se definira kao nemogućnost smanjivanja doze prednizona bez ponovne pojave proteinurije. Unutar pet godina se kod oko 50 % bolesnika prati relaps bolesti, a prvi relaps bolesti se liječi kao i početna epizoda bolesti. Kod bolesnika koji su rezistentni ili ovisni o glukokortikoidima te kod bolesnika s drugim relapsom preporučuje se druga linija liječenja koju čini primjena ciklofosfamida u dozi od 2 mg/kg/dan tijekom dva do tri mjeseca. Ostali alternativni lijekovi druge linije su ciklosporin, takrolimus, mikofenolat ili rituksimab. Pri izboru lijekova treba na umu imati nefrotoksičnost ciklosporina i takrolimusa.
Ostale napomene. Dugotrajna primjena glukokortikoida nosi rizik od razvoja metaboličkih komplikacija, osteoporoze i infekcija, zbog čega se te bolesnike mora posebno nadzirati i pratiti (nadzor tjelesne mase, praćenje glikemije, primjena kalcija i vitamina D, cijepljenje).
Prognoza. Načelno gledano, prognoza bolesti minimalnih lezija je dobra. Većina bolesnika dobro reagira na primjenu glukokortikoida, ali imaju česte recidive. 10 do 20 % bolesnika tijekom liječenja postane ovisno o glukokortikoidima. Razvoj kronične bubrežne bolesti rijetko susrećemo u ove skupine bolesnika, a kod njih se na ponovljenim biopsijama obično postavi dijagnoza fokalne segmentalne glomeruloskleroze.
FOKALNA SEGMENTALNA GLOMERULOSKLEROZA
Definicija. Fokalna segmentala glomeruloskleroza (FSGS) naziv je za glomerulsku bolest definiranu patohistološkim nalazom koji uključuje pojavu skleroze pojedinih glomerula (fokalna glomeruloskleroza) i to njihovih određenih dijelova (segmentalna glomeruloskleroza). Bolest čini 20 do 25 % uzroka nefrotičkoga sindroma kod odraslih osoba, dva puta se češće susreće kod muškaraca, a kod njih ima i teži klinički tijek te lošiju prognozu.
Etiopatogeneza. Etiopatogenetički razlikujemo primarni oblik bolesti (idiopatski), sekundarni oblik te genski uvjetovan oblik bolesti.
Primarni FSGS ima nerazjašnjenu etiopatogenezu, ali se smatra da je nastanak uvjetovan sličnim procesima kao i u bolesti minimalnih promjena. Osnovu patogeneze čini prisutnost cirkulirajućega čimbenika koji je vjerojatno podrijetlom iz posebnoga klona aktiviranih T-limfocita koji dovodi do destrukcije podocita i njihovoga odvajanja od glomerulske bazalne membrane, čime nastaju mjesta propusna za bjelančevine i lipide iz plazme koji potom potiču pojačano stvaranje izvanstaničnoga matriksa i skleroziranje. Nije jasno zašto se opisani procesi odvijaju samo na nekim glomerulima i to na njihovim određenim segmentima. Kao mogući cirkulirajući čimbenici koji dovode do ovih promjena spominju se citokin 1 sličan kardiotrofinu (CLCF1, od engl. cardiotrophin-like cytokine factor 1) te aktivator plazminogenskih receptora sličan urokinazi (SuPAR, od engl. soluble form of the urokinase plasminogen activator receptor).
Sekundarni FSGS označava sekundarni fenomen koji se javlja u preostalim nefronima kod bolesti i stanja obilježenih smanjenjem broja funkcionalnih nefrona. Preostali nefroni kompenzacijski podliježu glomerulskoj hipertrofiji i hiperfiltraciji što dovodi do hemodinamičkih promjena koje uvjetuju nastanak FSGS-a („hiperperfuzijska lezija“). Prema tome, uzrok sekundarnoga oblika ove bolesti mogu biti sva stanja koja dovode do smanjenja funkcionalnih nefrona, a to mogu biti primarne i sekundarne bubrežne bolesti (nefrektomija, refluksna nefropatija, IgA nefropatija, arterijska hipertenzija, anemija srpastih stanica, vaskulitisi i dr.), virusne infekcije (HIV, CMV, EBV) te lijekovi i toksini (heroin, litij, anabolički steroidi, pamidronat, ciklosporin).
Genski uvjetovan FSGS povezan je s genskim mutacijama koje pogađaju strukturne sastavnice podocita. Radi se o mutacijama gena za strukturne bjelančevine podocita kao što su nefrin (mutacija NPHS1), podocin (mutacija NPHS2) i alfa-aktinin (mutacija ACTN4). Kao posljedica navedenih mutacija nastaju strukturne promjene podocita koji se odvajaju od glomerulske bazalne membrane čime nastaju mjesta istjecanja bjelančevina plazme i posljedična proliferacija izvanstaničnoga matriksa i stvaranja sklerozirajućih žarišta.
Patologija. Patohistološki, promjene se početno distribuiraju fokalno (zahvaćeni samo neki glomeruli) te segmentalno (zahvaćeni samo neki dijelovi glomerula). Promjene najprije počinju u jukstamedularnim glomerulima, pa ako biopsijska igla ne zahvati to područje, često se nalaz može protumačiti kao da se radi o bolesti minimalnih lezija. S vremenom proces zahvaća i druge glomerule koji se nalaze kortikalno te u konačnici mogu zahvatiti cijeli glomerul. Svjetlosna mikroskopija otkriva područja skleroze, a ona uključuju potpun kolaps kapilara koje su ispunjene homogenim, hijalinim, PAS-pozitivnim materijalom, dok su ostali dijelovi glomerula, kao i drugi glomeruli, normalnoga izgleda ili su tek blago uvećani. Imunofluorescentna mikroskopija u sklerotičnim područjima može dokazati protutijela IgM i sastavnicu komplementa C3 koji su tamo dospjeli kao rezultat transudacije iz plazme kroz oštećenja glomerulske bazalne membrane. Elektronska mikroskopija na području skleroze otkriva obliteraciju glomerulskih kapilara, dok u ostalim dijelovima glomerula, koji pod svjetlosnim mikroskopom izgledaju normalno. nalazimo difuzni gubitak nožica podocita te mjestimična ogoljenja glomerulske bazalne membrane. Dodatno, prema patohistološkim obilježjima razlikujemo pet podvrsta FSGS-a što je prikazano u Tablici 5.21.
|
Tablica 5.21. Patološka obilježja i prognoza fokalne segmentalne glomeruloskleroze (FGS)
|
|
Podvrsta (tip)
|
Patohistološka obilježja
|
Klinička prognoza
|
|
Klasični FSGS
|
Sklerotični segmenti u bilo kojem dijelu glomerula
Isključene ostale podvrste FSGS-a
|
Dobra prognoza
|
|
Perihilarni FSGS
|
Perihilarna lokalizacija skleroze u > 50 % zahvaćenih glomerula
Isključen celularni i kolapsni FSGS
|
Dobra prognoza
|
|
Celularni FSGS
|
Segmentalna hipercelularnost (proliferacija) u bar jednom glomerulu
Isključen vršni i kolapsni FSGS
|
Loša prognoza
|
|
Vršni FSGS
|
Prisutnost skleroze u tubularnom polu u bar jednom glomerulu
Isključen perihilarni i kolapsni FSGS
|
Dobra prognoza
|
|
Kolapsni FSGS
|
Segmentalni ili globalni kolaps lumena kapilara u bar jednom glomerulu
Hipertrofija podocita u području kolapsa
|
Loša prognoza
|
Klinička slika. Bolest se klinički očituje nefrotičkim sindromom, često započinje kao asimptomatska proteinurija koja se pojačava te na kraju poprima nefrotički rang. Kliničkom slikom dominiraju edemi, dok se arterijska hipertenzija razvija kod 30 do 50 % bolesnika, a kronična bubrežna bolest kod 20 do 30 %.
Dijagnoza se postavlja na temelju anamneze i kliničkoga nalaza, laboratorijskih nalaza krvi i mokraće, a potvrđuje biopsijom i patohistološkom analizom. Laboratorijski nalazi mokraće uključuju neselektivnu proteinuriju nefrotičkoga ranga (rijetko blaži oblik) te patološki sediment (granulirani i masni cilindri, dismorfični eritrociti). U laboratorijskim nalazima u krvi nalazimo hipoproteinemiju, hipoalbuminemiju i hiperlipidemiju, a kod oštećene bubrežne funkcije i porast dušičnih metabolita (ureja, kreatinin). Osnovni biljezi imunopatogenetičkoga zbivanja (sastavnice komplementa – C3, C4) su uredni.
Liječenje može biti simptomatsko i specifično. Simptomatsko liječenje podrazumijeva primjenu diuretika Henleove petelje (furosemid) uz dodatak diuretika distalnih kanalića (tijazidi, amilorid) te prema potrebi infuzije albumina radi korekcije hipoalbuminemije. Specifično liječenje primarnoga oblika FSGS-a opisano je u nastavku, a liječenje sekundarnoga oblika ovisi o osnovnoj bolesti (liječenje osnovne bolesti).
Specifično liječenje primarnoga FSGS-a sastoji se od primjene imunosupresiva (glukokortikoida u prvoj liniji) te ACE inhibitora. Klasično se započinje s primjenom prednisona u dozi od 1 mg/kg/dan (najviše 80 mg/dan) ili 2 mg/kg/svaki drugi dan (maksimalno 120 mg/dan) tijekom 4 do 6 mjeseci uz postupno smanjivanje doze tijekom sljedećih 3 do 6 mjeseci. Uz to se primjenjuju ACE inhibitori ili blokatori angiotenzinskih blokatora s ciljem nefroprotekcije (smanjenje intraglomerulske hipertenzije) te antiproteinuričkoga učinka. Uz navedene mjere liječenja potpuna remisija (proteinurija manja od 300 mg/dan) uz očuvanje bubrežne funkcije dogodi se kod 40 do 60 % bolesnika. Parcijalna remisija je smanjenje proteinurije na 300 do 2000 mg/dan. Kod bolesnika koji su rezistentni na steroide primjenjuje se ciklofosfamid 2 mg/kg dnevno tijekom 2 – 3 mjeseca ili se može smanjiti doza steroida na 0,15 mg/kg dnevno i dodati ciklosporin (3,5 mg/kg/dan podijeljeno u dvije doze uz održavanje koncentracije u serumu između 125 i 300 mcg/l) tijekom 4 - 6 mjeseci. U liječenju se mogu koristiti i mikofenolat, takrolimus i klorambucil.
Prognoza. Mali broj bolesnika s FSGS-om doživi spontanu remisiju, a polovina bolesnika tijekom 5 do 20 godina razvije kroničnu bubrežnu bolest koje će zahtijevati neki od oblika nadomještanja bubrežne funkcije. Bolesnici s genskom osnovom FSGS-a imaju lošiji odgovor na imunosupresivnu terapiju te imaju lošiji klinički tijek bolesti. Nakon bubrežne transplantacije bolest se vrati u 30 % slučajeva.
MEMBRANSKI GLOMERULONEFRITIS
Definicija. Membranski glomerulonefritis (MGN) ili membranska nefropatija naziv je za glomerulsku bolest koju patohistološki obilježavaobilježava zadebljanje glomerulske bazalne membrane uslijed subepitelnoga odlaganja imunih kompleksa, a razlikujemo primarni i sekundarni oblik. Membranski glomerulonefritis odgovoran je za oko 30 % slučajeva nefrotičkoga sindroma kod odraslih bolesnika, s nešto češćom pojavnošću kod muškaraca (omjer muškarci:žena je 2:1), i to najčešće u dobi između 30. i 50. godine.
Etiopatogeneza. Etiopatogenetički gledano, radi se o oštećenju glomerula posredovanom imunim kompleksima, a razlikujemo primarni oblik bolesti, koji označava izoliranu autoimunu bubrežnu bolest koja se javlja u 70 do 80 % slučajeva, te sekundarni oblik bolesti koji se javlja u sklopu sustavnih autoimunih i zloćudnih bolesti.
Primarni ili idiopatski MGN označava izoliranu autoimunu bubrežnu bolest u kojoj se stvaraju specifična protutijela IgG4 na specifične antigene koji se nalaze na membrani ili unutar samih podocita. Tako se stvaraju imuni kompleksi u glomeruluma in situ, uzduž epitelne strane glomerulske bazalne membrane, što dovodi do aktivacije komplementa sa stvaranjem konačnoga produkta (kompleks C5b-9) koji dovodi do lezije podocita. Danas je poznato nekoliko autoantigena na koja se stvaraju specifična protutijela u primarnom MGN-u, a to su glikoproteinski antigen na membrani podocita (M tip receptora za fosfolipazu A2, PLA2R, od engl. phospholipase A2 receptor) te tri unutarstanična antigena: aldoza-reduktaza, superoksid-dismutaza 2 te alfa-enolaza. Do danas se ne zna što je to što potiče (trigerira) imunosni odgovor i nastanak autoprotutijela na navedene antigene.
Sekundarni MGN nastaje u različitim sustavnim autoimunim, zaraznim ili zloćudnim bolestima, a osnovni patofiziološki mehanizam uključuje odlaganje imunih kompleksa uzduž glomerulske bazalne membrane i aktivaciju sustava komplementa. Imuni kompleksi se mogu stvarati in situ kao odgovor na implantirane ekstrinzične antigene (npr. metaboliti lijekova, tumorski antigeni) ili se može raditi o odlaganju cirkulirajućih imunih kompleksa. Sekundarni MGN najčešće susrećemo kod primjene nekih lijekova (penicilinamin, soli zlata, nesteroidni protuupalni lijekovi, kaptopril), u autoimunim bolestima (sustavni eritematozni lupus, reumatoidni artritis, tzv. bolest povezana s IgG4), u zaraznim (hepatitis B, hepatitis C, malarija, lues) te zloćudnim bolestima (karcinom pluća, debeloga crijeva, želuca, dojke i limfoma).
U daljnjem tijeku bolesti oko depozita imunih kompleksa stvara se nova glomerulska bazalna membrana, pri čemu se oni inkorporiraju u nju te bivaju razgrađeni. Sa svakim recidivom bolesti dolazi do istoga ishoda, a krajnji rezultat je sve deblja glomerulska bazalna membrana.
Patologija. Svjetlosna mikroskopija pokazuje povećane glomerule s prohodnim kapilarama, kojima dominira difuzno zadebljana glomerulskna bazalna membrana bez proliferacije (po čemu se razlikuje od membranoproliferativnoga glomerulonefritisa). Imunofluorescentna mikroskopija pokazuje karakterističnu sliku difuznih, gusto zbijenih, zrnatih depozita IgG-a i C3 komponenta komplementa uzduž glomerulske bazalne membrane. Elektronskom mikroskopijom potvrđuje se nalaz depozita s epitelne strane (subepitelno) glomerulske bazalne membrane.
Klinička slika. Bolest počinje postupno razvojem nefrotičkoga sindroma, a bolesnici se najčešće javljaju zbog nastanka edema. MGN se rjeđe očituje kao asimptomatska proteinurija. Hematurija je prisutna kod 30 do 40 % bolesnika i obično se radi o mikrohematuriji, a hipertenzija nije čest nalaz kod ovih bolesnika. U vrijeme postavljanja dijagnoze bubrežna funkcija je uglavnom normalna ili tek blaže snižena. Bolesnici s MGN-om imaju veću učestalost tromboembolijskih događaja (osobito tromboza bubrežne vene) u odnosu na ostale bolesnike s nefrotičkim sindromom, nerijetko prvi znak MGN-a može biti upravo tromboembolijski događaj (npr. duboka venska tromboza ili plućna embolija).
Dijagnoza se postavlja na temelju kliničke slike i kliničkoga nalaza, laboratorijskih nalaza krvi i mokraće te se potvrđuje biopsijom i patohistološkom analizom uzorka. Klasično, u laboratorijskim nalazima nalazimo proteinuriju obično nefrotičkoga ranga, hipoalbuminemiju i hiperlipidemiju. Unatoč aktivaciji komplementa, vrijednosti C3 i C4 su uglavnom uredne. Nakon što se histološki potvrdi dijagnoza potrebna je dodatna obrada bolesnika s ciljem isključivanja ili otkrivanja sekundarnih uzroka MGN-a (probir na autoimune, zloćudne bolesti i najčešće infekcije, kao što su hepatitis B i C). Danas je dostupno i određivanje cirkulirajućih protutijela PLA2R koji imaju 75%-tnu osjetljivost i 100 %-tnu specifičnost za primarni MGN. Protutijela PLA2R se dokazuju i u bubrežnom bioptatu.
Liječenje. U liječenju MGN-a provode se klasične simptomatske mjere liječenja nefrotičkoga sindroma (restrikcija unosa soli, diuretici Henleove petlje, statini, infuzije albumina prema potrebi i sl.) te mjere specifičnoga liječenja. Specifično liječenje MGN-a ovisi o težini bolesti i prognostičkim čimbenicima. Bolesnici koji se prezentiraju sindromom asimptomatske subnefrotičke proteinurije i koji ne pokazuju znakove oštećenja bubrežne funkcije liječe se samo primjenom ACE inhibitora (ili blokatora angiotenzinskih receptora) te se kod njih ne indicira imunosupresivno liječenje. Imunosupresivno liječenje rezervirano je za bolesnike koji se prezentiraju teškom proteinurijom, koji pokazuju znakove pogoršanja bubrežne funkcije ili za one koji ne reagiraju na konzervativno antiproteinurično liječenje (ACE inhibitori, blokatori angiotenzinskih receptora) tijekom šest mjeseci. Danas se u prognostičke čimbenike koji određuju terapijski pristup uključuju i protutijela na PLA2R. Kod visokorizičnih bolesnika sa stabilnom bubrežnom funkcijom rituksimab je prvi izbor. Kod visokorizičnih bolesnika s bubrežnom funkcijom koja se pogoršava rituksimab nema prednosti. Liječenje MGN-a glukokortikoidima u monoterapiji nije pokazalo učinkovitost, nego se liječenje temelji na kombinaciji glukokortikoida i drugih imunosupresiva (ciklofosfamid, klorambucil) prema različitim protokolima (prikazano u Tablici 5.22.). Alternativno, u obzir dolazi i liječenje drugim imunosupresivima (takrolimus, ciklosporin) i imunomodulatorima (mikofenolat). U novije vrijeme kao mogućnost ostaje i potkožna primjena sintetičkoga adrenokortikotropnog hormona (tetrakosaktid) koji djeluje na melanokortinske receptore na površini podocita te dokazano smanjuje proteinuriju. Liječenje imunosupresijom ne preporučuje se za bolesnike s GFR-om manjim od 30 ml/min. Za te je bolesnike liječenje jednako kao i za sve ostale bolesnike s kroničnom bubrežnom bolesti (hemodijaliza, transplantacija).
|
Tablica 5.22. Primjeri protokola za liječenje MGN-a
|
|
Originalni Ponticellijev protokol
|
1., 3. i 5. mjesec: početi s metilprednizolonom u dozi od 1 g IV tijekom tri dana, a zatim nastaviti s prednizonom 0,5 mg/kg/dan per os tijekom 27 dana
2., 4. i 6. mjesec: klorambucil 0,2 mg/kg/dan per os
|
|
Modificirani Ponticellijev protokol
|
1., 3. i 5. mjesec: početi s metilprednizolonom u dozi od 1 g IV tijekom tri dana, a zatim nastaviti s prednizonom 0,5 mg/kg/dan per os tijekom 27 dana
2., 4. i 6. mjesec: ciklofosfamid 2,5 mg/kg/dan per os
|
Prognoza. Načelno gledano, kod 30 % bolesnika s MGN-om dolazi do spontane remisije (potpuna remisija je definirana proteinurijom manjom od 300 mg/dan, a djelomična proteinurijom manjom od 2 g/dan), 30 % ima relapsirajući oblik, ali bez značajnijega oštećenja bubrežne funkcije, a kod ostalih 30 % razvije se završni stupanj kronične bubrežne bolesti koji će zahtijevati neki od oblika nadomještanja bubrežne funkcije.
IMUNOGLOBULIN A NEFROPATIJA (IgA NEFROPATIJA)
Definicija. IgA nefropatija (Bergerova bolest) predstavlja jednu od najčešćih primarnih glomerulopatija, a obilježava ju odlaganje imunoglobulina A u mezangiju s posljedičnom hematurijom i eventualno umjerenom proteinurijom. Bolest se najčešće javlja u drugom i trećem desetljeću života s nešto češćom pojavnošću kod muškaraca.
Etiopatogeneza. Uzrok i mehanizam razvoja IgA nefropatije nisu do kraja razjašnjeni, ali se zna da se radi o imunosno uvjetovanoj etiopatogenezi. U razvoju bolesti postoji nekoliko ključnih događaja: 1) povećano stvaranje protutijela IgA poremećene strukture (galaktoza-deficijentni IgA), 2) stvaranje protutijela na galatoza-deficijentne IgA te stvaranje imunih kompleksa te 3) odlaganja stvorenih imunih kompleksa u mezangij glomerula.
Povećano stvaranje IgA poremećene strukture. Osnovni događaj u ovoj bolesti je pojačana proizvodnja imunoglobulina A razreda IgA1 od strane stanica koje severniraju IgA(limfociti B, plazma stanice) koji pokazuju poremećaj u procesu glikozilacije, pri čemu nastaju aberantni galaktoza-deficijentni IgA1. Uzrok ovoj povećanoj proizvodnji IgA nije poznat (infektivni stimulans?), a kod većine ovih bolesnika može se naći genski poremećaj glikozilacije IgA1 (22q12.2) koji pridonosi samoj bolesti (smanjeno uklanjanje IgA1 iz cirkulacije putem jetre).
Stvaranje protutijela na galaktoza-deficijentne IgA1. Drugi korak u patogenezi IgA nefropatije je stvaranje specifičnih autoprotutijela razreda IgG ili IgA na galaktoza-deficijentne IgA1, pri čemu nastaju specifični imuni kompleksi. Kao i kod ostalih autoimunih reakcija, točan uzrok nastanka ovih autoprotutijela nije poznat, a ulogu mogu imati genska predispozicija, molekulska mimikrija, virusne infekcije i sl.
Odlaganje stvorenih imunih kompleksa u mezangij. Završni događaj u patogenezi bolesti je odlaganje cirkulirajućih imunih kompleksa sastavljenih od autoprotutijela na IgA1 i galaktoza-deficijentnih IgA1 u mezangij pri čemu ulogu imaju veličina imunih kompleksa (imuni kompleksi su manji od pora na kapilarama pa lako prolaze), količina imunih kompleksa u cirkulaciji kao i transferinski receptor (CD71) na mezangijskim stanicama koji veže IgA, a pokazuje veći afinitet za galaktoza-deficijentne IgA1. Imuni kompleksi u mezangiju dovode do aktivacije komplementa te pojačanoga otpuštanja proupalnih citokina, što vodi prema proliferaciji mezangijskih stanica, pojačanoj proizvodnji matriksa i proširenju mezangijskoga prostora te u konačnici prema glomerulosklerozi.
Patologija. Svjetlosna mikroskopija daje nespecifičan nalaz difuzne ili fokalne proliferacije mezangijskih stanica i proširenje mezangijskoga prostora, difuzne ili fokalne glomeruloskleroze te intersticijske fibroze. Glavni nalaz uključuje imunofluorescencijsku mikroskopiju koja otkriva depozite imunoglobulina A u mezangijskom prostoru, a osim dominantnih IgA mogu se detektirati i manje količine IgG i IgM kao i sastavnica komplementa (C3). Elektronskom mikroskopijom potvrđuje se nalaz imunih depozita u mezangiju.
Klinička slika. IgA nefropatija ima širok dijapazon kliničkih očitovanja koja idu od asimptomatske mikro- ili makrohematurije preko akutnoga nefritičkog sindroma do brzoprogresivnoga glomerulonefritisa, a iznimno se može očitovati i kao nefrotički sindrom. Najčešće kliničko očitovanje kod djece i mlađih odraslih uključuje epizodu makrohematurije (s ili bez disuričnih smetnji) koja se obično javlja nekoliko dana iza nespecifične infekcije gornjih dišnih puteva (tzv. sinfaringitički nefritis), a rjeđe nakon gastrointestinalnih ili urogenitalnih infekcija, dok se kod odraslih bolest najčešće očituje kao asimptomatska mikroskopska (ili makroskopska) hematurija, bez ili uz umjerenu proteinuriju. Arterijska hipertenzija prisutna je kod 20 do 50 % ovih bolesnika.
Dijagnoza bolesti postavlja se na temelju kliničke slike, laboratorijskih nalaza krvi i mokraće, a potvrđuje se biopsijom bubrega. Specifični laboratorijski nalazi krvi uključuju povećanu serumsku koncentraciju protutijela IgA1 te povećan titar kompleksa IgA-IgA1 ili IgG-IgA1 (kod oko 30 do 70 % bolesnika), uz uredne koncentracije komplementa (C3 i C4). Smanjena glomerulska filtracija i porast dušičnih metabolita javlja se kasnije u kliničkom tijeku bolesti. U mokraći nalazimo mikro ili makrohematuriju, bez ili uz umjerenu proteinuriju. Konačnu dijagnozu postavljamo na temelju patohistološke analize bioptata bubrega, a ona se temelji na MEST-C oksfordskim kriterijima i njome se procjenjuje aktivnost bolesti.
Liječenje. Bolesnici s niskim rizikom od napredovanja bolesti (bez hipertenzije, s očuvanom glomerulskom filtracijom te bez ili uz umjerenu proteinuriju) ne zahtijevaju specifično liječenje, nego redovito godišnje praćenje. Bolesnici s velikim rizikom od napredovanja bolesti (proteinurija veća od 1 g/dan, smanjena glomerulska filtracija, prisutna arterijska hipertenzija) zahtijevaju primjenu ACE inhibitora ili blokatora angiotenzinskih receptora uz primjenu ribljega ulja (omega-3 masne kiseline), što dokazano smanjuje napredovanje bolesti i smanjuje proteinuriju. Cilj ove terapije je održavati proteinuriju ispod 1 g/dan te krvni tlak između 125/75 i 130/80 mmHg. Specifično liječenje (kortikosteroidna terapija) indicirana je kod svih bolesnika s proteinurijom većom od 1 g/dan, a može i uz manju proteinuriju kod bolesnika u kojih patohistološki nalaz ukazuje na aktivnu bolest. Primjena kortikosteroida odvija se prema nekim od predloženih protokola: Pozzijev ili Mannov protokol, a kod bolesnika koji razviju teže kliničke oblike (brzoprogresivni glomerulonefritis) preporučuje se u terapiju uvesti ciklofosfamid u kombinaciji s kortikosteroidima (Ballardie-Robertsov protokol) što je i prikazano u Tablici 5.23. Kod bolesnika s razvijenom kroničnom bubrežnom bolesti u završnom stupnju preporučuje se transplantacija bubrega, a povrat bolesti nađe se kod oko 30% bolesnika unutar pet do deset godina od transplantacije.
|
Tablica 5.23. Primjeri protokola u liječenju IgA nefropatije
|
|
Pozzijev protokol
|
1., 3. i 5. mjesec: 1000 mg metilprednizolona IV tijekom tri dana;
Ostale dane tijekom 6 mjeseci prednizon oralno 0,5 mg/kg/dan svaki drugi dan, a potom postupno smanjivanje doze do ukidanja
|
|
Mannov protokol
|
Prednizon peroralno u dozi od 0,8 - 1 mg/kg/dan tijekom prva dva mjeseca liječenja, a potom nastaviti s mjesečnim smanjenjem doze za 0,2 mg/kg/dan tijekom sljedeća 4 mjeseca
|
|
Ballardie-Robertsov protokol
|
Prednizon peroralno 1 mg/kg/dan (najviše 60 - 80 mg) tijekom prva 2 - 3 mjeseca, a potom sporo smanjivanje doze do 10 mg/dan tijekom 1 - 2 godine;
Ciklofosfamid 1,5 mg/kg/dan tijekom tri mjeseca, a zatim azatioprin 1,5 mg/kg/dan tijekom 1 - 2 godine
|
Prognoza. Načelno gledano, prognoza IgA nefropatije je dobra. Jedna trećina bolesnika imat će spontanu remisiju, a 20 do 40 % bolesnika razvit će kroničnu bubrežnu bolest koja će zahtijevati jedan od načina nadomještanja bubrežne funkcije. Najznačajniji prognostički čimbenik je veličina proteinurije (bolesnici s proteinurijom većom od 1 g/dan imaju lošiju prognozu). Također, bolesnici s mikrohematurijom i proteinurijom imaju lošiju prognozu od bolesnika s epizodama makrohematurije.
MEMBRANOPROLIFERATIVNI GLOMERULONEFRITIS
Definicija. Membranoproliferativni glomerulonefritis (MPGN) je naziv za bolest glomerula koja se histopatološki očituje zadebljanjem glomerularne bazalne membrane te proliferacijom mezangijskih stanica, a uzrokovana je imunopatološkim reakcijama (odlaganje imunih kompleksa ili aktivacija sustava komplementa). Učestalost MPGN-a danas je u zapadnim zemljama sve niža.
Etiopatogeneza. Danas se prema etiopatogenezi MPGN dijeli u dvije skupine: MPGN tip I (posredovan imunim kompleksima) te MPGN tip II (posredovan komplementom). U najvećem broju slučajeva radi se o sekundarnoj glomerulopatiji koja se javlja u sklopu infekcija, malignih i autoimunih bolesti, a vrlo rijetko se radi o primarnoj ili idiopatskoj glomerulopatiji (najčešće kod djece).
MPGN tip I nastaje kao posljedica aktivacije sustava komplementa klasičnim putem nakon odlaganja imunih kompleksa iz cirkulacije ili uslijed stvaranja imunih kompleksa in situ u glomerulima. To je obično povezano s infekcijama (virusne, bakterijske, gljivične), autoiumunim bolestima (sustavni eritematozni lupus, Sjögrenov sindrom, reumatoidni artritis) te zloćudnim bolestima (stvaranje imunih kompleksa koji se sastoje od protutijela i tumorskih antigena). Imunofluorescencija kod ovih bolesnika otkriva depozite imunoglobulina i komponente C3 u mezangiju i kapilarnim stijenkama (Ig+, C+).
MPGN tip II nastaje kao posljedica aktivacije sustava komplementa alternativnim putem, što je posljedica disregulacije aktivacije alternativnoga puta uslijed mutacija inhibicijskih bjelančevina koje reguliraju aktivaciju toga puta ili uslijed stvaranja protutijela na njih (najpoznatije je protutijelo IgG koje djeluje na C3, a naziva se još i C3-nefritički faktor, C3NeF). Imunofluorescencija kod ovih bolesnika otkriva depozite C3 bez depozita imunoglobulina (Ig-, C+) te se MPGN tip II naziva još i C3 glomerulopatija koja obuhvaća dva histološka entiteta – C3 glomerulonefritis i bolest gustih depozita (DDD, od engl. dense deposit disease).
Patologija. Svjetlosna mikroskopija pokazuje zadebljanu glomerulsku bazalnu membranu te umnažanje mezangijskih stanica, uz pojačano stvaranje matriksa i širenje mezangijskoga prostora. Imunofluorescentna mikroskopija ima glavnu ulogu u razlikovanju tipova MPGN-a, s obzirom na to da njome dokazujemo prisutnost imunoglobulina i komplementa. Elektronskom mikroskopijom određujemo precizniju lokalizaciju imunih depozita u glomerulima. Osnovna patogenetska i patološka obilježja prikazana su u Tablici 5.24.
|
Tablica 5.24. Patogenetska i patološka obilježja MPGN-a
|
|
Tip MPGN-a
|
Patogeneza
|
Imunofluorescencija
|
Elektronska mikroskopija
|
|
MPGN tip I (posredovan imunim kompleksima)
|
Klasični put aktivacije komplementa
|
Pozitivni imunoglobulini
Pozitivni C3
|
Mezangijski i subendotelni depoziti
|
|
MPGN tip II: bolest gustih depozita (DDD)
|
Alternativni put aktivacije komplementa
|
Negativni imunoglobulini
Pozitivni C3
|
Elektronski gusti mezangijski i intramembranski depoziti
|
|
MPGN tip II: C3 glomerulonefritis
|
Alternativni put aktivacije komplementa
|
Negativni imunoglobulini
Pozitivni C3
|
Mezangijski i subendotelni depoziti
|
Nova klasifikacija. S obzirom na moguća preklapanja između pojedinih kliničkih entiteta MPGN-a temeljenoga samo na elektronskoj mikroskopiji, danas se preferira klasifikacija koja se oslanja na nalazu mikroskopske imunofluorescencije. Na temelje ove klasifikacije MPGN dijelimo u tri skupine ovisno o patofiziološkom mehanizmu: MPGN posredovan imunokompleksima, MPGN posredovan aktivacijom sustava komplementa te MPGN posredovan drugim mehanizmima (npr. oštećenje endotela). Nova klasifikacija prikazana je shematski (Slika 5.3.).
Slika 5.3. Shematska klasifikacija MPGN-a na temelju imunofluorescencije
Klinička slika. MPGN može se očitovati kao asimptomatska proteinurija s hematurijom, nefritički sindrom te kao nefrotički sindrom. Arterijska hipertenzija prisutna je kod 30 % bolesnika, a oštećena bubrežna funkcija i razvoj kronične bubrežne bolesti kod oko 25 % bolesnika. Kod sustavnih bolesti prisutni su i drugi simptomi i znakovi ovisno o uzročnoj bolesti. Kod ovih bolesnika pojačana je incidencija tromboembolijskih događaja, osobito tromboze bubrežnih vena.
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza krvi i mokraće te biopsijom bubrega. Specifični laboratorijski nalazi uključuju proteinuriju, eritrocituriju, smanjenu serumsku koncentraciju sastavnica komplementa (C3 je smanjen u oba tipa, a C4 samo u MPGN tip I) te porast dušičnih metabolita kod napredovanja kronične bubrežne bolesti. Konačnu dijagnozu daje patohistološka analiza biopsije bubrega.
Liječenje. U slučaju poznate bolesti, tj. sekundarnoga MPGN-a, potrebno je liječiti uzročnu bolest. Liječenje MPGN-a tipa 1 ponajprije ovisi o težini bolesti, a osnovne preporuke su: 1) bolesnici s nenefrotičkom proteinurijom i oni koji nemaju smanjenju glomerulsku filtraciju liječe se ACE inhibitorima ili blokatorima angiotenzinskih receptora uz redovite kontrole svakih 6 mjeseci; 2) bolesnici koji imaju proteinuriju nefrotičkoga ranga ili smanjenu glomerulsku filtraciju liječe se kombinacijom ciklofosfamida ili mikofenolata i glukokortikoida tijekom 6 mjeseci; 3) kod bolesnika koji razviju brzoprogresivni glomerulonefritis liječenje se sastoji od pulsne kortikosteroidne terapije, primjene ciklofosfamida te terapijske plazmafereze; 4) rutinska primjena antitrombocitne i/ili antikogagulantne terapije zbog sklonosti tromboembolijskim događajima nema jasne preporuke. Liječenje MPGN-a tipa II sastoji se od primjene lijekova koji blokiraju RAAS, primjene glukokortikoida i/ili imunosupresiva, terapijske plazmafereze te primjene ekulizumaba, iako ne postoje jasne smjernice o terapijskom pristupu. Kada se razvije završni stupanj kronične bubrežne bolesti, liječenje se vrši prema standardnim načelima, a bubrežna transplantacija nameće se kao jedno od poželjnijih rješenja.
Prognoza. Proteinurija nefrotičkoga ranga, eritrociturija s više od 50 eritrocita u vidnom polju, arterijska hipertenzija te smanjena glomerulska filtracija loši su prognostički znakovi kod ovih bolesnika i sugeriraju nepovoljniji tijek bolesti. Oko 50 % bolesnika razvije završni stupanj kronične bubrežne bolesti unutar 10 godina od postavljanja dijagnoze, a 90 % unutar 20 godina.
POSTINFEKTIVNI GLOMERULONEFRITIS
Definicija. Postinfektivni glomerulonefritis je imunosno posredovana bolest koja se povezuje s različitim bakterijskim, virusnim ili gljivičnim bolestima, a čije je osnovno obilježje prisutnost specifičnih imunih kompleksa u glomerulima koji dovode do aktivacije sustava komplementa i posljedičnoga tkivnog oštećenja.
Etiopatogeneza. Različite bakterijske, virusne ili gljivične infekcije mogu biti povezane s nastankom postinfektivnoga glomerulonefritisa, a u kliničkoj su praksi najčešći oblici povezani s bakterijama akutni poststreptokokni glomerulonefritis te glomerulonefritis povezan s endokarditisom, a s virusima hepatitis B, hepatitis C te HIV. Bolest je obilježena stvaranjem imunih kompleksa antigen-protutijelo, bilo u cirkulaciji, bilo in situ u glomerulima te aktivacijom sustava komplementa koji dovodi do konačnoga oštećenja glomerulskih struktura.
Patologija. Glavni patohistološki nalaz je difuzni ili fokalni proliferativni glomerulonefritis s depozitima IgG i C3 koji se detektiraju imunofluorescencijom. U najtežim oblicima nalazimo i glomerulonefritis sa stvaranjem polumjeseca.
Klinika. Klinički, postinfektivni glomerulonefritisi se najčešće prezentiraju kao akutni nefritički sindrom, rjeđe kao brzoprogresivni glomerulonefritis. Dijagnoza se temelji na anamnestičkim podacima, laboratorijskim nalazima te rjeđe, biopsiji bubrega. Liječenje ovisi o etiološkom čimbeniku. U nastavku su opisani najčešći oblici postinfektivnoga glomerulonefritisa.
AKUTNI POSTSTREPTOKOKNI GLOMERULONEFRITIS
Definicija. Akutni poststreptokokni glomerulonefritis je naziv za glomerulonefritis koji se javlja nekoliko tjedana nakon infekcije kože ili ždrijela koju uzrokuje beta hemolitički streptokok grupe A. Bolest je karakteristična za pedijatrijsku populaciju (najčešće u dobi između 3. i 12. godine) i češće se razvija kod dječaka, a pojavnost u odrasloj dobi je iznimno rijetka. Iako se radi o bolesti koja je nekada imala visoku stopu učestalosti, zbog unapređenja socioekonomskih prilika, kao i učinkovitijega antimikrobnog liječenja, njezina je pojavnost danas u razvijenim zemljama rijetka i sporadična.
Etiopatogeneza. Radi se o glomerulonefritisu posredovanom imunim kompleksima, a do danas se opisuju tri moguće teorije nastanka: 1) odlaganje cirkulirajućih imunih kompleksa ili stvaranje imunih kompleksa in situ u glomerulima, a čine ih streptokokni antigen te protutijelo IgG; 2) molekulska mimikrija koja podrazumijeva križnu reaktivnost između protutijela i nekih glomerulskih antigena, zbog njihove sličnosti sa streptokoknim antigenima i 3) autoimuna reaktivnost koja podrazumijeva izmjenu normalnih glomerulskih antigena uvjetovana infekcijom pri čemu oni postaju imunogeni i izazivaju autoimuni odgovor. Streptokokni antigeni koji se povezuju s ovom bolesti nazivaju se nefritogenim antigenima, a od posebnoga su interesa streptokokni pirogeni egzotoksin B (SPEB) te nefritis-povezan plazminski receptor (NAPlr). Stvoreni imuni kompleksi dovode do aktivacije sustava komplementa koji dovodi do oštećenja glomerula. Također, primijećena je genska predispozicija koja se povezuje s nastankom akutnoga poststreptokoknog glomerulonefritisa, a radi se o određenim haplotipovima HLA (HLA-DRw4, HLA-B12, HLA-DRB1).
Patologija. Svjetlosna mikroskopija otkriva sliku difuznoga endokapilarnog glomerulonefritisa: uvećani i hipercelularni glomeruli uslijed proliferacije mezangijskih i endotelnih stanica i infiltracije upalnim stanicama. Imunofluorescencijom se dokazuju depoziti IgG i C3 koji su razbacani duž glomerulske bazalne membrane. Elektronska mikroskopija pokazuje tipične subepitelne grbe (ispupčeni depoziti s epitelne strane).
Klinička slika. Bolest se obično razvija 2 - 6 tjedana nakon kožne infekcije i 1 - 3 tjedna nakon infekcije ždrijela. Klasična klinička slika uključuje akutni nefritički sindrom (oligurija, hipertenzija, edemi, hematurija) uz često izražene opće simtome (umor, malaksalost, glavobolja, anoreksija, algični sindrom). Kod manjega broja bolesnika klinička slika može odgovarati nefrotičkom sindromu ili asimptomatskoj hematuriji. U klasičnom tijeku, bolest ima tri faze: latentna faza koja traje od infekcije do pojave nefritičkoga sindroma, faza akutne bolesti, koja traje oko 7 do 14 dana (iznimno do 4 tjedna) te faza oporavka koja može trajati i do 8 tjedana.
Dijagnoza se postavlja na osnovi anamnestičkih podataka (podatak o preboljeloj infekciji), osnovnih laboratorijskih nalaza i seroloških pretraga, a iznimno rijetko se izvodi biopsija bubrega. Osnovni laboratorijski nalazi uključuju: eritrocituriju, nalaz dismorfičnih eritrocita i eritrocitnih i/ili granuliranih cilindara, blagu do umjerenu proteinuriju (rijetko je nefrotičkoga ranga) te smanjenju glomerulsku filtraciju (smanjen kreatininski klirens), uz porast dušičnih metabolita kod oko 60 % oboljelih. Serološke pretrage uključuju porast titra protutijela na streptolizin O (AST-O, antistreptolizin O), antihijaluronidazu (A-H) i anti-DNAazu B te smanjenu serumsku koncentraciju sastavnice komplementa C3. U svrhu potvrđivanja streptokokne infekcije preporučuje se učiniti i obrisak ždrijela (ili kožne promjene) te hemokulturu. Biopsija bubrega indicirana je u atipičnim i nejasnim situacijama: kratko latentno razdoblje bolesti (manje od 7 dana), klinička slika brzoprogresivnoga glomerulonefritisa, normalna koncentracija C3, nedokazana streptokokna infekcija (kultura, serologija) te protrahirano trajanje bolesti.
Liječenje je u pravilu hospitalno i uključuje potporne mjere: mirovanje, smanjen unos soli i tekućine, primjena furosemida kod volumnoga opterećenja (2 x 40 mg IV/dan) te antihipertenziva (preporučuje se primjena blokatora kalcijskih kanala, a izbjegavanje ACE inhibitora i ARB-ova zbog opasnosti od dodatnoga smanjenja glomerulske filtracije). Svima se preporučuje i provođenje antimikrobne terapije penicilinom. Primjena imunosupresivne terapije nije se pokazala klinički opravdanom.
Prognoza. Kod djece je prognoza odlična i većina oboljelih pokazuje potpunu remisiju unutar 3 do 6 tjedana, dok samo oko 3 do 10 % djece imaju perzistentnu mikroskopsku hematuriju, nenefrotičku proteinuriju ili hipertenziju. Prognoza kod odraslih je lošija i oko 50 do 60 % bolesnika razvije završni stupanj kronične bubrežne bolesti.
GLOMERULONEFRITIS POVEZAN S ENDOKARDITISOM
Glomerulonefritis povezan s endokarditisom danas postaje sve češći uzrok kronične bubrežne bolesti. Radi se o komplikaciji subakutnoga bakterijskog endokarditisa koji može biti uzrokovan različitim bakterijama (S. aureus, S. epidermidis, S. viridans, S. pyogenes, E. fecalis, E. coli). S obzirom na to da je klinička slika akutnoga bakterijskog endokarditisa izraženija, on se obično brzo dijagnosticira i liječi te se zbog toga ne stigne razviti ova komplikacija. Kao i kod ostalih postinfektivnih glomerulonefritisa, radi se o oštećenju glomerula posredovanom imunim kompleksima i aktivacijom komplementa. Glavna klinička očitovanja su mikro- ili makrohematurija uz umjerenu proteinuriju i razvoj azotemije kod oko trećine bolesnika. Dijagnoza se postavlja na osnovi kliničke slike, otkrivanja endokarditisa (šum na srcu, hemokulture, transezofagijski ultrazvuk), laboratorijskih nalaza (eritrociturija, proteinurija, praćenje dušičnih metabolita, smanjenje koncentracije sastavnica komplementa – C3 i C4) i nalaza biopsije bubrega koji može uključivati fokuse nekroze okružene proliferativnim procesima uz imune depozite (IgG, IgM, C3). Liječenje je simptomatsko uz eradikaciju uzročnika (antibiotičko liječenje, kardiokirurški zahvat). Ako se izvrši eradikacija uzročnika, prognoza je dobra.
GLOMERULONEFRITIS POVEZAN S HEPATITISOM B
Postinfektivni glomerulonefritis jedna je od najčešćih ekstrahepatičnih komplikacija hepatitisa B. Bolest se može pojaviti u više oblika, a najčešće u obliku membranoproliferativnoga glomerulonefritisa ili IgA-nefropatije, ali i kao membranski glomerulonefritis, fokalna segmentalna glomeruloskleroza te bolest minimalnih lezija. Dijagnoza se postavlja dokazom hepatitisa B (porast transaminaza, biljezi hepatitisa B) te dokazom glomerulske bolesti (patološki nalazi u mokraći, dušični metaboliti te biopsija bubrega). Kod svih bolesnika s glomerulskom bolesti i kliničkom sumnjom na hepatitis B infekciju, potrebno ju je isključiti prije početka liječenja, jer standardno liječenje idiopatskih oblika glomerulonefritisa, koje obično podrazumijevaju imunosupresiju, kod takvih bolesnika je kontraindicirano. Liječenje podrazumijeva klasično liječenje hepatitisa B uz simptomatsku terapiju glomerulskih poremećaja (diuretici, antihipertenzivi). Prognoza kod odraslih je loša te podrazumijeva napredujuć tijek i razvoj završnoga stupnja kronične bubrežne bolesti.
GLOMERULONEFRITIS POVEZAN S HEPATITISOM C
Kao i kod hepatitisa B, postinfektivni glomerulonefritis može se razviti i kod bolesnika s hepatitisom C. Radi se o bolesti posredovanoj imunim kompleksima, a najčešće poprima oblik membrano-proliferativnoga glomerulonefritisa tip I ili rjeđe membranskoga glomerulonefritisa ili IgA nefropatije. Dijagnoza se postavlja na temelju dokaza glomerulske bolesti (klinička slika, laboratorijski nalazi, biopsija bubrega) te potvrdom hepatitisa C. Liječenje se sastoji od primjene antivirotika prema standardnim protokolima za liječenje hepatitisa C te simpomatskoga liječenja glomerulskih poremećaja.
BRZOPROGRESIVNI GLOMERULONEFRITIS
Brzoprogresivni glomerulonefritis (BPGN) je naziv za glomerulonefritis kojega klinički obilježava naglo smanjenje bubrežne funkcije (više od 50 % unutar tri mjeseca) uz tipičnu patohistološku sliku stanične proliferacije u obliku polumjeseca. Radi se o najtežem kliničkom očitovanju glomerulskih bolesti, a može se javiti kao idiopatska bolest nepoznatoga uzroka ili u sklopu drugih glomerulopatija. BPGN je relativno rijedak oblik glomerulonefritisa i čini 10 do 15 % svih glomerulopatija, a obično se javlja u dobi između 20. i 50. godine.
Na temeljem etiopatogeneze i patohistološkoga nalaza (imunofluorescencija) BPGN se dijeli u tri skupine: tip I (anti-GBM glomerulonefritis), tip II (glomerulonefritis posredovan imunokompleksima) te tip III (pauciimuni glomerulonefritis).
BPGN tip I (anti-GBM glomerulonefritis)
Definicija. BPGN tip I ili anti-GBM glomerulonefritis predstavlja autoimuni oblik glomerulonefritisa, pri čemu se stvaraju autoprotutijela na sastavnice kolagena tipa IV (α3-domena) kojega nalazimo u sastavu glomerulske bazalne membrane. Osim nje, i alvelokapilarna stijenka sadrži veće količine ovoga antigena, stoga se u kliničkoj slici često javljaju i hemoptize, pa govorimo o Goodpastureovu sindromu (renopulmonalni sindrom). Ovaj tip glomerulonefritisa čini 1 do 5 % svih glomerulonefritisa i pokazuje bimodalnu pojavnost s obzirom na dob (između 20. i 30. te između 60. i 70. godine života). Također, bolest se češće susreće kod muškaraca u mlađoj životnoj dobi te kod žena u starijoj životnoj dobi.
Etiopatogeneza. Bolest nastaje kao posljedica stvaranja autoprotutijela na α3-domenu kolagena tipa IV (Goodpastureov antigen) koji se u najvećoj koncentraciji nalazi u glomerulskoj bazalnoj membrani te alvelokapilarnoj stijenci. Točan mehanizam nastanka ovih autoprotutijela nije razjašnjen, ali se zna da ulogu ima genska predispozicija (haplotipovi HLA-DR15 i HLA-DR4) te izloženost organskim otapalima (ugljikovodici), metalnoj prašini, nikotinu (pušenje), infekcijama (posebno influenza) te nekim lijekovima (alemtuzumab). Navedeni rizični čimbenici dovode do „otkrivanja“ antigena što omogućuje stvaranje i interakciju s autoprotutijelima pri čemu se stvaraju imuni kompleksi i aktivira sustav komplementa koji dovodi do oštećenja tkiva (reakcija preosjetljivosti tipa II). Stvorena autoprotutijela su pretežno razreda IgG (podrazredi IgG1 i IgG3), rjeđe IgA i IgM.
Patologija. Svjetlosna mikroskopija kod ovih bolesnika pokazuje fokalnu ili segmentalnu fibrinoidnu nekrozu uz staničnu proliferaciju i stvaranje polumjeseca u Bowmanovoj čahuri (karakteristična je za ovaj oblik BPGN-a uniformnost razvojnih faza polumjeseca). Glavno obilježje bolesti su linearni depoziti imunoglobulina (pretežito IgG) te kod oko polovine bolesnika C3 uzduž glomerulske bazalne membrane, što je vidljivo na imunofluorescentnoj mikroskopiji. Elektronska mikroskopija potvrđuje prethodno opisane nalaze.
Klinička slika. Najveći broj bolesnika prezentira se kao renopulmonalni sindrom (60 – 80 %), dok se manji dio prezentira kao samo bubrežna bolest (20 – 40 %) ili kao plućna bolest (5 – 10 %). Kliničku sliku čine opći, plućni i bubrežni simptomi. Opći simptomi uključuju slabost, malaksalost, vrućicu, algične sindrome te anoreksiju. Oni se mogu javiti prije ili usporedo s plućnim i bubrežnim očitovanjima. Plućne simptome čine kašalj, zaduha i hemoptize (masivna plućna hemoragija je rijetko, ali po život opasno očitovanje). Bubrežna očitovanja obilježavaju oligurija, hematurija, arterijska hipertenzija, edemi te razvoj uremijskoga sindroma. Bubrežni simptomi i propadanje bubrežne funkcije odvija se tijekom nekoliko tjedana do nekoliko mjeseci (najčešće u roku od jednoga do dva tjedna).
Dijagnoza se postavlja na temelju kliničke slike, općih i specifičnih laboratorijskih nalaza, radiološkoga nalaza pluća te se konačno potvrđuje biopsijom bubrega. Na ovaj oblik bolesti treba posumnjati kod svih bolesnika s kliničkom slikom BPGN-a, a osobito ako se javlja uz plućne simptome (hemoptize). Opći laboratorijski nalazi uključuju proteinuriju (obično nefrotičkoga ranga), eritrocituriju s eritrocitnim cilindrima, različit stupanj azotemije (porast dušičnih metabolita), leukocitozu, ubrzanu sedimentaciju eritrocita te sideropeničnu anemiju, kao odraz kroničnoga krvarenja. Specifični laboratorijski nalazi podrazumijevaju određivanje prisutnosti anti-GBM protutijela koja imaju visoku osjetljivost (> 95 %) i specifičnost (> 97 %). Kod oko trećine bolesnika mogu se naći pozitivna autoprotutijela ANCA. Klasični radiogram pluća pokazuje simetrične, obostrane, mrljaste mekotkivne infilitrate koji su obično raspoređeni perihilarno i bazalno, a s napredovanjem bolesti slika poprima intersticijski uzorak. Biopsija bubrega i patohistološka analiza uzorka daju nam konačnu dijagnozu koja se temelji na nalazu svjetlosne mikroskopije (polumjeseci) i imunofluorescencije (linearni depoziti IgG).
Liječenje. Osnovu liječenja anti-GBM glomerulonefritisa čini plazmafereza i imunosupresivna terapija. Postupak plazmafereze provodi se svakoga drugog dana tijekom 14 dana, s odstranjenjem 4 litre plazme po postupku i suspstitucijom 5 %-tnim albuminima te primjenom svježe smrznute plazme na kraju svakoga postupka (150 - 300 ml). Paraleleno s plazmaferezom započinje se i imunosupresivno liječenje koje podrazumijeva pulsnu kortikosteroidnu terapiju tijekom tri dana (500 - 1000 mg metilprednizolona), nakon čega slijedi peroralna primjena prednizona per os u dozi od 1 mg/kg/dan tijekom 6 mjeseci uz postupnu redukciju doze. U indukcijskoj terapiji primjenjuje se i ciklofosfamid, 2 mg/kg per os 2 – 3 mjeseca. Transplantacija bubrega kao moguć terapijski izbor kod razvoja završnoga stupnja kronične bubrežne bolesti dolazi u obzir tek po negativizaciji anti-GBM autoaprotutijela u krvi.
Prognoza. Uz navedeno liječenje petogodišnje preživljenje bilježi se u više od 80 % slučajeva, a 30 % bolesnika razvijezavršni stupanj kronične bubrežne bolesti. Relapsi su rijetki, s učestalošću od 5 do 10 %.
BPGN tip II (BPGN uzrokovan imunim kompleksima)
Definicija i etiologija. BPGN tip II ili BPGN uzrokovan imunim kompleksima čini 30 do 40 % svih BPGN-a, a može se javiti idiopatski, bez poznatoga uzroka ili se javlja u sklopu nekih glomerulopatija (postinfektivni glomerulonefritis, IgA-nefropatija, lupusni nefritis, membranoproliferativni glomerulonefritis, membranski glomerulonefritis). Bolest obilježava odlaganje imunokompleksa u glomerule koji aktiviraju sustav komplementa i izazivaju oštećenje glomerula.
Patologija. Svjetlosnom mikroskopijom otkrivaju se klasične promjene koje se viđaju kod BPGN-a (nekroza i stanična proliferacija sa stvaranjem polumjeseca koji zahvaćaju više od 50 % glomerula), a imunfluorescencijska mikroskopija otkriva zrnate (granulirane) imune depozite, čiji nalaz ovisi o uzročnoj bolesti (npr. nakupine IgA u IgA-nefropatiji).
Klinička slika. Klinički se prezentira kao brzoprogresivni gubitak bubrežne funkcije praćen hematurijom, proteinurijom, edemima, arterijskom hipertenzijom te uremijskim sindromom.
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza i biopsije bubrega. Laboratorijska obrada, osim standardnih pretraga (sediment urina, određivanje proteinurije, nalaz metabolita dušika), mora uključivati i širu serološku i imunološku obradu zbog diferenciranja same dijagnoze. Kod donošenja konačne dijagnoze u obzir treba uzeti kliničku sliku, nalaz specifičnih laboratorijskih nalaza (anti-ds-DNA, antistreptolizinski titar, hepatitis markeri, krioglobulini i sl.) te ih usporediti s nalazom biopsije bubrega (osobito je važan nalaz imunofluorescentne i elektronske mikroskopije).
Liječenje idiopatskoga BPGN tpa II provodi se prema protokolima koji se primjenjuju i za liječenje III. i IV. razreda lupusnoga nefritisa, dok se sekundarni oblici BPGN tipa II liječe prema preporukama ovisno ouzročnoj bolesti.
BPGN tip III (pauciimuni BPGN)
BPGN tip III ili pauciimuni BPGN je oblik BPGN koji je udružen s pozitivnim autoprotutijelima ANCA i obično se susreće u ANCA pozitivnim vaskulitisima (staroga naziva Wegenerova granulomatoza i poliarteritis nodosa), a rjeđe se javlja kao izolirana bubrežna bolest (idiopatski oblik). Klinička slika, dijagnoza i liječenje opisani su u dijelu Glomerulonefritisi u sklopu sustavnih vaskulitisa.
C1q NEFROPATIJA
Definicija. C1q nefropatija je rijedak oblik glomerulonefritisa kojeg obilježavaju depoziti sastavnice komplementa C1q u mezangiju u odsustvu sustavnoga eritematoznog lupusa. Bolest se klinički očituje nefrotičkim sindromom s tipičnom pojavnošću kod djece ili mlađih odraslih osoba.
Etiologija bolesti je nepoznata. Smatra se da se radi o bolesti imunih kompleksa na nepoznati antigen ili da se radi o podvrsti fokalne segmentalne glomeruloskleroze (zbog sličnosti histoloških nalaza) i da su navedeni depoziti posljedica izražene proteinurije i nespecifičnoga odlaganja C1q u mezangij.
Klinička slika. Bolest se karakteristično javlja u dječjoj i mlađoj odrasloj dobi. Prezentira se kao nefrotički sindrom, uz postupno napredovanje bubrežnoga oštećenja. Arterijska hipertenzija prisutna je kod oko 40 %, a hematurija kod oko 30 % bolesnika. Bolesnici nemaju kliničkih znakova sustavnoga eritematoznog lupusa.
Dijagnoza se postavlja na temelju histološkoga nalaza depozita C1q uz ostale promjene koje mogu odgovarati fokalnoj segmentalnoj glomerulosklerozi ili bolesti minimalnih lezija (rjeđe se nađe i slika proliferativnih oblika glomerulonefritisa), uz odsutnost kliničko-laboratorijskih parametara sustavnoga eritematoznog lupusa.
Liječenje C1q nefropatije istovjetno je liječenju fokalne segmentalne glomeruloskleroze. Kliničko iskustvo pokazalo je da ovi bolesnici pokazuju slabiji odgovor na terapiju glukokortikoidima te brže napredovanje bubrežnoga oštećenja prema završnom stupnju kronične bubrežne bolesti.
DIJABETIČKA NEFROPATIJA
Definicija. Dijabetička nefropatija ubraja se među najčešće kronične komplikacije šećerne bolesti i među najčešće uzroke kronične bubrežne bolesti, a obilježena je perzistentnom proteinurijom, progresivnim gubitkom bubrežne funkcije (smanjenje glomerulske filtracije) te klasičnim histološkim trijasom koji uključuje zadebljanje glomerulske bazalne membrane, ekspanziju (proširenje) mezangija te difuznu ili segmentalnu glomerulosklerozu. Smatra se da nakon više od 20 godina šećerne bolesti više od 50 % bolesnika ima razvijenu dijabetičku nefropatiju, a ona se javlja i kod bolesnika s tipom I i s tipom II šećerne bolesti.
Etiopatogeneza. Točni mehanizmi nastanka dijabetičke nefropatije nisu do kraja razjašnjeni, ali osnovni pokretač patofizioloških zbivanja je hiperglikemija koja dovodi do specifičnih hemodinamičkih i metaboličkih promjena u glomerulima (Slika 5.4.). Glavne posljedice kronične hiperglikemije su: 1) glomerulska hiperfiltracija i posljedična glomerulska hipertenzija koje vode prema zadebljanju glomerulske bazalne membrane i nastanka glomeruloskleroze; 2) pojačana neenzimatska glikozilacija mezangijskih bjelančevina s nakupljanjem konačnih proizvoda toga procesa (AGEs, od engl. advanced glycosylation end products – konačni proizvodi uznapredovale glikozilacije) koji oslabljuju adheziju endotelnih stanica i potiču proliferaciju (ekspanziju) mezangija te 3) narušena ravnoteža između pro- i protuupalnih citokina te čimbenika rasta, što se očituje povećanom razinom transformirajućega čimbenika rasta β (TGF-β) te dominacijom proupalnih citokina koji potiču infiltraciju mononuklearima, koji svojom aktivacijom doprinose cijelom procesu (proizvodnja slobodnih radika kisika i oksidativni stres). Konačni rezultat navedenih procesa je povećanje količine mezangijskoga matriksa uz pojačanu propusnost glomerulske bazalne membrane s posljedičnom proteinurijom. Ostali čimbenici koji pridonose razvoju dijabetičke nefropatije su arterijska hipertenzija, debljina, pušenje, displipidemija, kao i genska predispozicija. Najznačajniji među njima je arterijska hipertenzija, za koju je jasno dokazana povezanost s pojavom albuminurije kod bolesnika sa šećernom bolesti.

Slika 5.4. Shematski prikaz etiopatogeneze dijabetičke nefropatije
Prirodni tijek dijabetičke nefropatije. Dijabetička nefropatija pokazuje predvidiv tijek što je jasno vidljivo kod bolesnika sa šećernom bolesti tipa I, dok se kod bolesnika sa šećernom bolesti tipa II on slabije prepoznaje, s obzirom na kasno vrijeme postavljanja dijagnoze, jer većina bolesnika u trenutku dijagnosticiranja šećerne bolesti već ima neki oblik dijabetičke nefropatije. U razvoju dijabetičke nefropatije razlikujemo pet stupnjeva: a) prvi stupanj ili stupanj bubrežne hiperfunkcije obilježava povećana glomerulska filtracija i odsutnost albuminurije; b) drugi stupanj ili stupanj latencije, koji može trajati i do 20 godina, obilježen je povišenom ili normalnom glomerulskom filtracijom uz odsutnost albuminurije; c) treći stupanj ili stupanj mikroalbuminurije, u kojemu dominira mikroalbuminurija uz očuvanu glomerulsku filtraciju; d) četvrti stupanj ili stupanj jasne dijabetičke nefropatije, u kojemu nalazimo umjereno smanjenu glomerulsku filtraciju i makroalbuminuriju te e) peti stupanj ili stupanj uznapredovale kronične bubrežne bolesti u kojemu nalazimo značajno smanjenu glomerulsku filtraciju i masivnu proteinuriju.
Patologija. Osnovni patohistološki nalazi kod bolesnika s dijabetičkom nefropatijom su zadebljanje glomerulske bazalne membrane, ekspanzija (proširenje) mezangija te difuzna ili nodularna glomeruloskleroza (Kimmelstiel-Wilsonovi noduli). Osim ovih klasičnih promjena, mogu se naći i neke druge promjene koje se vežu uz šećernu bolest, kao što su hijalina arterioloskleroza te zadebljanje membrane tubula.
Klinička slika. Dijabetička nefropatija je asimptomatska bolest koja se otkriva na redovitim pregledima bolesnika sa šećernom bolesti, pri čemu se radi probir na mikroalbuminuriju. Simptomi se pojavljuju zajedno s napredovanjem bolesti, odnosno u četvrtom i petom stupnju kada dolazi do razvoja nefrotičkoga sindroma i uznapredovale kronične bubrežne bolesti.
Dijagnoza dijabetičke nefropatije kod bolesnika sa šećernom bolesti postavlja se na temelju određivanja proteinurije, procjene (mjerenja) glomerulske filtracije te eventualno biopsijom bubrega.
Određivanje proteinurije. Svi bolesnici sa šećernom bolesti trebaju jednom godišnje raditi probir na mikroalbumnuiruju, što se može postići određivanjem albumina u 24-satnom uzorku mokraće ili mjerenjem omjera albumin/kreatinin u jednokratnom uzorku mokraće (najbolje drugi jutarnji), što je prikazano u Tablici 5.25. Da bi se dijagnoza potvrdila, potrebno je da dva od tri uzorka mokraće, analizirana u vremenskom razdoblju od 3 do 6 mjeseci, budu patološka, a pri interpretaciji nalaza treba imati na umu bolesti i stanja koja mogu dovesti do pojačanoga lučenja albumina i time maskirati dijagnozu: srčano popuštanje, febrilno stanje, teška hiperglikemija i hipertenzija, fizički napor i infekcija mokraćnoga sustava.
Određivanje glomerulske filtracije. Klirens endogenoga kreatinina najčešći je postupak za procjenu i izračunavanje glomerulske filtracije, što je potrebno za određivanje stupnja dijabetičke nefropatije. Glomerulska filtracija može se izračunati i matematički pomoću EPI-CKD ili Salazar. Postupci određivanja glomerulske filtracije, kao i dobivene vrijednosti, opisani su na početku poglavlja.
Biopsija bubrega rijetko je indicirana za postavljanje dijagnoze dijabetičke nefropatije, a obično se primjenjuje kod bolesnika sa šećernom bolesti tipa I koji imaju neuobičajeno brzo napredovanje bolesti, koji imaju dismorfične eritrocite ili patološke cilindre u sedimentu mokraće, koji imaju tešku proteinuriju unatoč dobroj kontroli glikemije i krvnoga tlaka te kod bolesnika sa šećernom bolesti tipa II koji imaju proteinuriju, a nemaju dokazane ostale kronične komplikacije šećerne bolesti (retinopatija, neuropatija). Navedena stanja nadograđuju se međusobno tako da se kod bolesnika možda radi o drugoj bubrežnoj patologiji koja nije povezana sa šećernom bolesti.
|
Tablica 5.25. Definicija mikro- i makroalbuminurije
|
|
Kategorija
|
24-satni uzorak mokraće
(mg/24 sata)
|
Slučajni uzorak mokraće (mcg/mg kreatinina)
|
|
Normalan nalaz
|
< 30
|
< 30
|
|
Mikroalbuminurija
|
30 - 299
|
30 - 299
|
|
Makroalbuminurija
|
> 300
|
> 300
|
Liječenje. Osnovna preporuka u liječenju bolesnika s dijabetičkom nefropatijom je stroga kontrola glikemije i arterijskoga tlaka uz korekciju ostalih rizičnih čimbenika (liječenje dislipidemije, prestanak pušenja i sl.). Održavanje glikemije (prehrana, peroralni antidijabetici, inzulin) pokazalo se kao glavni čimbenik u odgodi nastupa, kao i sprečavanju napredovanja proteinurije kod ovih bolesnika. Preporučuje se održavati vrijednosti glikoziliranoga hemoglobina (HbA1c) manjima od 7 %. Drugi važni rizični čimbenik je arterijska hipertenzija te se preporučuje održavati vrijednosti tlaka kod bolesnika sa šećernom bolesti bez proteinurije na vrijednostima < 130/80 mmHg, a u onih s proteinurijom
Prognoza. Ukupno gledano, prirodni tijek bolesti je relativno dug (više desetaka godina), ali on ponajprije ovisi o kontroli glikemije i arterijskoga tlaka. Bolesnici sa šećernom bolesti i razvijenom dijabetičkom nefropatijom imaju lošije preživljenje i imaju veću učestalost srčanožilnih događaja.
BOLESTI GLOMERULA U AUTOIMUNIM BOLESTIMA I SUSTAVNIM VASKULITISIMA
Bubreg i glomeruli su često sijelo različitih autoimunih sustavnih bolesti kao i vaskulitisa, osobito malih krvnih žila. Zahvaćenost bubrega u tim bolestima opisana je na odgovarajućim mjestima, a ovdje će biti navedene samo najznačajnije bolesti koje se mogu vidjeti u svakodnevnoj kliničkoj praksi, a to su lupusni nefritis, sklerodermijska nefropatija i pauciimuni glomerulonefritis.
LUPUSNI NEFRITIS
Definicija. Lupusni nefritis (LN) je naziv za promjene na glomerulima koje se javljaju u sklopu sustavnoga eritematoznog lupusa (SLE). On je česta pojava kod bolesnika sa sustavnim lupusom te se razvije kod 60 do 80 % bolesnika u nekom trenutku bolesti, a 30 do 50 % bolesnika ima već razvijena bubrežna očitovanja u trenutku postavljanja dijagnoze SLE-a.
Etiopatogeneza. Promjene u LN-u posljedica su odlaganja cirkulirajućih imunih kompleksa sastavljenih od autoantigena i autoprotutijela i/ili stvaranjem istih in situ u glomerulima vezanjem autoprotutijela na nuklearne glomerulske antigene. Imuni kompleksi aktiviraju sustav komplementa koji dovodi do oštećenja glomerula.
Patohistološka klasifikacija. S obzirom na patohistološki nalaz razlikujemo šest razreda LN-a, a osim u histološkom smislu, oni se razlikuju i prema kliničkom očitovanju, terapijskom pristupu i prognozi. Prema klasifikaciji LN-a od strane Svjetskoga nefrološkog društva razlikujemo šest razreda LN-a (Tablica 5.26.).
Razred I LN-a ili minimalni mezangijski LN podrazumijeva uredan nalaz glomerula na svjetlosnoj mikroskopiji, dok se imunofluorescentnom i elektronskom mikroskopijom dokazuju imuni depoziti u mezangiju. Postupkom imunofluorescencije nađu se svi imunoglobulini (IgG, IgA, IgM) te sastavnice komplementa (C3, C1q), što se naziva obrazac pune kuće („full house pattern“). Ovi bolesnici nemaju kliničkih očitovanja bubrežne bolesti.
Razred II LN-a ili mezangioproliferativni LN podrazumijeva proliferaciju mezangija na svjetlosnoj mikroskopiji, dok se postupcima imunofluorescencije i/ili elektronskom mikroskopijom u mezangiju nalaze imuni depoziti kao i u LN razredu I. Klinički se javljaju eritrociturija i proteinurija, a iznimno rijetko arterijska hipertenzija.
Razred III LN-a ili fokalni LN podrazumijeva prisutnost segmentalnih ili globalnih lezija koje zahvaćaju manje od 50 % glomerula na svjetlosnoj mikroskopiji, koje mogu biti aktivne (endokapilarna proliferacija, polumjeseci, nekroza, hijalini trombi), kronične (glomeruloskleroza, fibrozni polumjeseci) ili kombinirane, pa razlikujemo tri podvrste LN-a razreda III: LN-III A (prisutne samo aktivne lezije), LN-III A/C (prisutne i aktivne i kronične lezije) te LN-III C (prisutne samo kronične lezije). Ova podjela je bitna iz razloga što se imunosupresivno liječenje povodi samo kod bolesnika s aktivnim lezijama. Imunofluorescencija i elektronska mikroskopija pokazuje postojanje mezangijskih i subendotelnih imunodepozita („obrazac pune kuće“). Klinički se obično očituje proteinurijom koja je obično nefrotičkoga ranga, arterijskom hipertenzijom, a kod manjega bolesnika i smanjenom bubrežnom funkcijom (smanjenje GFR-a).
Razred IV LN – difuzni LN podrazumijeva prisutnost segmentalnih ili globalnih lezija koje zahvaćaju više od 50 % glomerula na svjetlosnoj mikroskopiji, koje također mogu biti aktivne, kronične i kombinirane. Ako dominiraju segmentalne lezije, govorimo o LN-IV S, a ako dominiraju globalne lezije, o LN-IV G, a oba oblika imaju svoje tri podvrste ovisno o lezijama: aktivne lezije (LN-IV G A i LN-IV S A), aktivne i kronične lezije (LN-IV G A/C i LN-IV S A/C) te kronične lezije (LN-IV G C i LN-IV S C). Kao i u LN-u tipa III, liječenje se provodi samo ako u uzorcima nalazimo aktivne lezije. Nalaz imunofluorescencije i elektronske mikroskopije jednak je kao i kod LN-a razreda III. Klinički se bolest očituje kao nefrotički ili nefritički sindrom, uz smanjenje bubrežne funkcije (smanjena glomerulska filtracija).
Razred V LN-a – membranski LN podrazumijeva nalaz zadebljane glomerulske bazalne membrane na svjetlosnoj mikroskopiji uz nalaze imunih depozita subepitelno uzduž glomerulskih kapilara. Uz ovaj nalaz se obično vide i promjene kao u LN-III ili LN-IV što uvijek potrebno navesti. Klinički se ovaj oblik LN-a očituje kao nefrotički sindrom bez smanjene bubrežne funkcije.
Razred VI LN-a – uznapredovali sklerozirajući LN podrazumijeva nalaz više od 90 % glomerula koji su vezivno izmijenjeni i ne pokazuju znakove aktivne bolesti, a to se klinički očituje kao završni stupanj kronične bubrežne bolesti.
Klinička slika. Kako je navedeno, klinička slika ovisi o patohistološkom tipu LN-a, tako da se može očitovati kao asimptomatska bolest, patološka proteinurija i/ili eritrociturija, nefrotički sindrom, nefritički sindrom te kronična bubrežna bolest. Najčešći oblici LN-a u kliničkoj praksi su razred III i IV.
Dijagnoza se postavlja na temelju kliničke slike i kliničkoga nalaza, općih i specifičnih laboratorijskih pretraga te biopsijom bubrega koja potvrđuje dijagnozu.
Opći laboratorijski nalazi uključuju patološke nalaze u mokraći (proteinurija, eritociturija, cilindrurija) te kod narušene bubrežne funkcije porast dušičnih metabolita (ureja, kreatinin).
Specifični laboratorijski nalazi uključuju visok titar anti-dsDNA protutijela, manjene koncentracije sastavnica komplementa (C3, C4) te pozitivna antinuklearna protutijela (ANA). Biopsija i patohistološka analiza uzorka daje konačnu dijagnozu.
Biopsija bubrega i patohistološki nalaz ključni su u postavljanju konačne dijagnoze lupusnoga nefritisa, a glavni nalazi pojedinih podtipova lupusnoga nefritisa su gore opisani.
|
Tablica 5.26. Osnovna obilježja pojedinih vrsta lupusnoga nefritisa
|
|
Razred
|
Svjetlosna mikroskopija
|
Imunofluorescencija
|
Klinička obilježja
|
|
I
|
Uredan nalaz
|
Mezangijski imuni depoziti
|
Asimptomatska bolest
Minimalno aktivan sediment
Blaga proteinurija
Umjereno aktivni serološki biljezi
|
|
II
|
Proliferacija mezangija
|
Mezangijski imuni depoziti
|
|
III
|
Fokalne lezije glomerula (< 50 % glomerula); aktivne i kronične lezije
|
Mezangijski imuni depoziti
Subendotelni imuni depoziti
|
Srednje aktivan sediment mokraće
Aktivni serološki biljezi
Značajnija proteinurija
Arterijska hipertenzija
|
|
IV
|
Difuzne lezije glomerula (> 50 % glomerula); aktivne i kronične lezije
|
Mezangijski imuni depoziti
Subendotelni imuni depoziti
|
Značajnije bubrežno oštećenje
Aktivan sediment mokraće
Proteinurija obično nefrotičkoga ranga
Jasno izraženi aktivni serološki biljezi
|
|
V
|
Zadebljanje glomerulske bazalne membrane
|
Supepitelni imuni depoziti duž glomerulskih kapilara
|
Proteinurija obično nefrotičkoga ranga
Manje aktivni serološki biljezi
|
|
VI
|
Glomeruloskleroza koja zahvaća više od 90 % glomerula
|
Bez specifičnoga nalaza
|
Kronična bubrežna bolest (završno)
|
Liječenje ponajprije ovisi o tipu LN-a. Razred I i II LN-a ne zahtijevaju specifično (imunosupresivno) liječenje, nego praćenje bolesnika kako ne bi prešli u teži oblik bolesti. Kod bolesnika s LN-om razreda III i IV provodi se imunosupresivno liječenje koje se sastoji od dvije faze: indukcija remisije (glukokortikoid + ciklofosfamid ili glukokortikoid + mikofenolat-mofetil, a iznimno glukokortikoid + azatioprin) te održavanje remisije (mikofenolat-mofetil ili azatioprin u kombinaciji s niskim dozama glukokortikoida). Kod refraktornih oblika bolesti u terapiju se mogu uključiti tzv. biološki lijekovi (rituksimab, kostimulacijska blokada – abatacep per os). Razred V LN zahtijeva liječenje kada se očituje kao nefrotički sindrom ili kao perzistentna proteinurija nenefrotičkoga ranga unatoč optimalnoj terapiji blokatorima renin-angiotenzin-aldosteronskoga sustava (ACE inhibitori, ARB-ovi), a ono se sastoji od peroralne primjene glukokortikoida i citotoksičnih lijekova (ciklosporin ili ciklofosfamid) u prvoj liniji ili mikofenolata, takrolimusa ili rituksimaba u drugoj liniji. Razred VI LN-a ne zahtijeva specifično imunosupresivno liječenje, nego primjenu postupaka nadomještanja bubrežne funkcije. Kod bolesnika s rezistentnim oblicima LN-a moguća je i primjena intravenskih imunoglobulina, a glavne indikacije su slab odgovor na konvencionalno liječenje ili kod bolesnika u kojih se nadzor nad bolesti može postići samo primjenom velikih doza glukokortikoida.
Prognoza ponajprije ovisi o tipu LN-a, s time da na umu treba imati i činjenicu da jedan oblik može prijeći u drugi (obično iz lakšega u teži). Zbog toga sve bolesnike treba redovno kontrolirati i pratiti kliničke, serološke i bubrežne nalaze. Svako njihovo pogoršanje treba popratiti biopsijom bubrega kako bi se dobio uvid u novonastalo stanje i prema tome prikladno terapijski pristupilo.
SKLERODERMIJSKA NEFROPATIJA
Uvod. Sustavna skleroza ili sklerodermija je kronična autoimuna bolest vezivnoga tkiva koju obilježava difuzna fibroza kože, zglobova i unutarnjih organa. Karakteristične promjene u sklerodermiji su zadebljanje arterijske stijenke i posljedično suženje lumena različitih arterija. Kada su ovim procesom zahvaćene unutarbubrežne arterije, govorimo o sklerodermijskoj nefropatiji koja se može očitovati kao kronična bubrežna bolest ili sklerodermijska kriza. Bubrezi su u sklerodermiji zahvaćeni u više od 50 % slučajeva.
Kronična bubrežna bolest razvija se relativno rano u kliničkom tijeku sklerodermije, većinom unutar pet godina od postavljanja dijagnoze. Radi se o sporoprogresivnom propadanju bubrežne funkcije i napredovanju prema završnom stupnju. Kod većine bolesnika prisutna je i umjerena ili teška hipertenzija.
Sklerodermijska kriza obilježena je naglim razvojem akutnoga bubrežnog oštećenja praćenoga znakovima hipertenzivne emergencije (srčana dekompenzacija, hipertenzivna encefalopatija) te mikroangiopatske hemolitičke anemije. Pojava sklerodermijske krize češće se javlja kod bolesnika koji su liječeni visokim dozama glukokortikoida.
Dijagnoza je ponajprije klinička i na nju treba posumnjati kod svih osoba sa sustavnom sklerozom te nastupom akutnoga bubrežnog oštećenja ili kronične bubrežne bolesti uz prisutnost arterijske hipertenzije, što se ne može objasniti drugim uzrocima. Biopsija bubrega daje nespecifične nalaze, no ipak može biti od pomoći u postavljanju dijagnoze i izboru liječenja.
Liječenje se zasniva na agresivnoj kontrolni arterijskoga tlaka, a lijekovi izbora su ACE inhibitori ili blokatori angiotenzinskih receptora. Primjeren nadzor arterijskoga tlaka dokazano ima povoljan učinak na tijek sklerodermijske nefropatije. Osim njih, u obzir dolaze i kalcijski blokatori ili vazodilatator. Ako se razvije završni stupanj kronične bubrežne bolesti, primjenjuju se postupci nadomještanja bubrežne funkcije.
PAUCIIMUNI GLOMERULONEFRITIS
Uvod. Pauciimuni (bez depozita imunih kompleksa) glomerulonefritis je naziv za nekrotizirajući glomerulonefritis koji nalazimo najčešće u sklopu ANCA pozitivnih vaskulitisa (moguć je i ANCA negativan). Radi se o skupini vaskulitisa koji zahvaćaju male krvne žile, a čije je zajedničko svojstvo nalaz protutijela c-ANCA ili p-ANCA u serumu oboljelih, uz odsutnost nalaza imunih depozita u krvožilnim stijenkama. Pauciimuni glomerulonefritis javlja se u sklopu sljedećih ANCA-pozitivnih vaskulitisa: granulomatoza s poliangiitisom, mikroskopski poliangiitis te Churg-Straussov sindrom. Detaljnije o etiologiji i patogenezi ovih poremećaja, kao i kliničkim očitovanjima, dijagnostici i liječenju pisano je u poglavlju vaskulitisa.
Mikroskopski poliangiitis (MP) je sustavni nekrotizirajući vaskulitis koji zahvaća male krvne žile, posebno bubrega i pluća, pa se često prezentira slikom renopulmonalnoga sindroma. Zahvaćenost bubrega pojavljuje se u 80 % slučajeva, a klinički ga obilježava sporonapredujuće propadanje bubrežne funkcije s tendencijom prelaska u brzoprogresivni glomerulonefritis. Dijagnoza se postavlja na temelju histološkoga nalaza koji uključuje nekrotizirajući glomerulonefritis sa stvaranjem polumjeseca na svjetlosnoj mikroskopiji te izostanka ili uz vrlo malo imunih depozita na imunofluorescentnoj i elektronskoj mikroskopiji te uz pozitivan nalaz protutijela ANCA u serumu. Kod oko 50 % oboljelih zahvaćena su i pluća, ali kliničku sliku difuzne alveolarne hemoragije razvije svega 10 % bolesnika. Temelj liječenja čini kombinacija glukokortikoida i ciklofosfamida (indukcijsko liječenje, terapija održavanja). Unatoč primijenjenom liječenju, kod 10 do 50 % bolesnika razvit će se završni stupanj kronične bubrežne bolesti koji će zahtijevati primjenu nekih od postupaka nadomještanja bubrežne funkcije (hemodijaliza).
Granulomatoza s poliangiitisom (napuštenoga naziva Wegenerova granulomatoza) također je jedan od pauciimunih vaskulitisa kojega obilježava pojava granulomatozne upale u gornjim i donjim dišnim putevima i bubrezima, pa kliničku sliku obilježavačini trijas: rinosinustitis, alveolarna krvarenja (hemoptoe) i razvoj akutnoga bubrežnog oštećenja. U početnim fazama bolesti bubreg je zahvaćen kod oko 10 % oboljelih, a poslije se taj udio povećava i čini do 85 % oboljelih osoba. Zahvaćenost bubrega obilježena je sličnom histološkom slikom kao i u mikroskopskom poliangiitisu (nekrotizirajući glomerulonefritis uz stvaranje polumjeseca), uz nalaz granulomatoznih formacija. U serumu je karakterističan nalaz protutijela c-ANCA. Liječenje se temelji na primjeni glukokortikoida i ciklofosfamida, a u fazama aktivne bolesti u obzir dolazi i terapijska plazmafereza. Kronična bubrežna bolest razvija se kod oko 40 % bolesnika, a od toga će njih 15 % zahtijevati nadomještanje bubrežne funkcije.
Churg-Straussov sindrom je naziv za pauciimuni nekrotizirajući vaskulitis s eozinofilijom i stvaranjem izvanžilnih eozinofilnih granuloma, a karakteristična je i velika učestalost atopijskih bolesti, osobito alergijske astme. Bubreg je zahvaćen kod oko 80 % bolesnika, a glavna očitovanja su proteinurija, hematurija te azotemija. Kod većine bolesnika radi se o stabilnoj kroničnoj bubrežnoj bolesti, a u 10 % slučajeva ona progredira do završnoga stupnja. Histološka obilježja uključuju segmentalni nekrotizirajući glomerulonefritis s izvanžilnim eozinofilinim granulomima. U laboratorijskim nalazima kod većine bolesnika nalazimo povećanu serumsku koncentraciju imunoglobulina E, uz pozitivna protutijela p-ANCA. Kao i kod ostalih ANCA vaskulitisa liječenje se provodi kombinacijom gluokokortikoida i ciklofosfamida.
GLOMERULOPATIJE U SKLOPU PARAPROTEINEMIJA I BOLESTI ODLAGANJA
Uvod. Glomerulopatije u sklopu paraproteinemija i bolesti odlaganja odnose se na sekundarne promjene glomerula koje nastaju uslijed prekomjernoga stvaranja i odlaganja patoloških imunoglobulina, njihovih sastavnica ili nekih drugih molekula u glomerule, a primarno se očituju kao nefrotički sindrom i predstavljaju samo jednu od kliničkih očitovanja osnovne bolesti te ukazuju na zahvaćanje bubrega. Paraproteinemija je generaliziran naziv za skupinu bolesti koje su obilježene stvaranjem patoloških imunoglobulina ili njihovih sastavnica u suvišku, a nastaju zbog proliferacije plazma stanica ili B-limfocita. Drugi nazivi koji se još koriste za paraproteinemije su monoklonske gamapatije ili plazmastanične diskrazije. Stvoreni imunoglobulini ili njihovi sastavni dijelovi mogu se odlagati u glomerule i dovesti do nastanka specifičnih promjena. Bolesti odlaganja označavaju različite bolesti i stanja koja su obilježena pojačanim stvaranjem određenih molekula i tvari koje se potom odlažu u različita tkiva i organe te dovode do njihove destrukcije i poremećene funkcije. Najčešći primjeri ovih glomerulopatija su mijelomski bubreg i amiloidna glomerulopatija.
Mijelomski bubreg (mijelomska nefropatija) naziv je za promjene na glomerulima i u tubulointersticiju koje nastaju kao posljedica taloženja lakih lanaca imunoglobulina IgG ili IgA koje stvara plazmacitom (multipli mijelom) u velikoj količini. U kliničkoj slici dominiraju simptomi i znakovi osnovne bolesti, a na zahvaćanje bubrega ukazuje postupan razvoj oštećenja bubrežne funkcije (asimptomatska proteinurija, azotemija). Dijagnoza se potvrđuje na temelju laboratorijskih nalaza poremećene bubrežne funkcije uz poznatu dijagnozu multiploga mijeloma, a ako ona još nije poznata, na nju treba pomišljati kod bolesnika s nalazom hiperkalcijemije, hiperproteinemije te s nalazom patološkoga proteina M u elektroforezi. Biopsija bubrega se izvodi u dvojbenim slučajevima. Liječenje se vrši prema terapijskim protokolima za multipli mijelom.
Amiloidna glomerulopatija je naziv za promjene glomerula koje nastaju u sklopu amiloidoze, bolesti koja je obilježena nakupljanjem amiloida (fibrilarnih bjelančevina) u različitim tkivima i organima. Primarna amiloidoza obilježena je odlaganjem amiloida AL (potječu od lakih lanaca imunoglobulina) i predstavlja monoklonsku bolest plazma stanica, a sekundarna amiloidoza odlaganjem amiloida AA (potječe od serumskoga amiloida A, bjelančevine koja se pojačano stvara u jetri tijekom kroničnih upalnih procesa) te je povezana s kroničnim upalnim i neupalnim bolestima (reumatoidni artritis, Crohnova bolest, tuberkuloza i sl.). Bubrezi mogu biti zahvaćeni i u primarnoj i u sekundarnoj amiloidozi, pri čemu se amiloid nakuplja najprije u mezangiju, a potom se širi i na glomerulsku bazalnu membranu, stijenke krvnih žila te bazalne membrane tubula. Klinički se amiloidna nefropatija prezentira kao nefrotički sindrom s napredujućim pogoršanjem bubrežne funkcije. Dijagnoza se potvrđuje biopsijom i patohistološkom analizom (amiloid se karakteristično boja Kongo crvenilom). Liječenje je etiološko, uz klasične mjere liječenja kronične bolesti bubrega.
NASLJEDNE GLOMERULOPATIJE
Najčešće nasljedne glomerulopatije u kliničkoj praksi su Alportov sindrom (nasljedni nefritis), sindrom tankih bazalnih membrana te nefropatija Fabryjeve bolesti.
ALPORTOV SINDROM
Definicija. Alportov sindrom je nasljedna glomerulopatija koja nastaje kao posljedica genski uvjetovanoga strukturnog poremećaja glomerulske bazalne membrane, s posljedičnim poremećajem bubrežne funkcije. Osim promjena na bubrezima, javljaju se i drugi poremećaji kao što je perceptivna gluhoća te promjene na očima.
Etiopatogeneza. Radi se o genski uvjetovanom poremećaju u građi i strukturi glomerulske bazalne membrane. Do sada su identificirana tri gena koja su uključena u razvoj ovoga sindroma, a sva tri su vezana uz stvaranje kolagena tipa IV koji je sastavni dio glomerulske bazalne membrane (Tablica 5.27.). Posljedično ovim mutacijama dolazi do poremećaja sinteze jednoga od šest α lanaca kolagena tipa IV, što vodi prema specifičnim ultrastrukturalnim promjenama i posljedičnoj disfunkciji glomerula u cjelini.
|
Tablica 5.27. Genska osnova Alportovoga sindroma
|
|
Gen
|
Lokacija gena
|
Genski proizvod
|
Način prijenosa
|
|
COL4A5
|
X kromosom (Xq22.3)
|
α5 lanac kolagena tip IV
|
X-vezano
|
|
COL4A4
|
2. kromosom (2q36.3)
|
α4 lanac kolagena tip IV
|
Autosomno dominantno ili autosomno recesivno
|
|
COL4A3
|
2. kromosom (2q36.3)
|
α3 lanac kolagena tip IV
|
Autosomno dominantno ili autosomno recesivno
|
Patologija. Početne promjene su minimalne, a s odmakom dolazi do specifičnih promjena vidljivih na svjetlosnoj mikroskopiji, a one uključuju fokalnu glomerulsku sklerozu, uz atrofiju tubula i fibrozu intersticija. Nalaz imunofluorescencije je negativan ili nespecifičan. Elektronska mikroskopija pokazuje karakteristične promjene za ovu bolest, a to su segmentalna zadebljana glomerulske bazalne membrane uz cijepanje lamine dense u tanke i paralelne lamele, između kojih nalazimo svijetle prostore. Moguća je i dodatna analiza dokazivanja abnormalnih lanaca kolagena tipa IV, što je ključno za postavljanje patohistološke dijagnoze.
Klinička slika. Klinička očitovanja obično počinju u drugom desetljeću života, a rijetko i prije. S obzirom na to da je najčešći način prijenosa bolesti X-vezan, uglavnom obolijevaju muškarci, dok žene mogu razviti blage oblike bolesti. Bubrežna bolest obilježena je pojavom perzistentne ili intermitentne eritrociturije i proteinurije s povremenim epizodama makrohematurije. Postupno dolazi do napredovanja oštećenja bubrežne funkcije i tijekom sljedećih dvadesetak godina obično se razvije završni stupanj kronične bubrežne bolesti, najčešće u mlađoj odrasloj dobi. Osim bubrežnih očitovanja, karakteristična je za ove bolesnike i pojava perceptivne nagluhosti kod 40 % bolesnika te očnih promjena (mrena, dislokacija leće) kod 30% bolesnika.
Dijagnoza se postavlja na temelju kliničke slike i kliničkoga nalaza, laboratorijskih nalaza te biopsije kože i/ili bubrega. Na bolest treba posumnjati kod svih mlađih bolesnika koji se prezentiraju recidivnim hematurijama uz laboratorijski nalaz oštećene bubrežne funkcije (proteinurija, azotemija), osobito kada to prati nagluhost i/ili očne promjene. Laboratorijski nalazi su nespecifični: eritrociturija, proteinurija, azotemija. Konačna dijagnoza postavlja se biopsijom bubrega i patohistološkom potvrdom bolesti (ključnu ulogu ima nalaz abnormalnih lanaca kolagena tipa IV postupcima imunohistokemijskoga bojanja). Osim biopsije bubrega, u obzir dolazi i biopsija kože. Genska testiranja na navedene mutacije je moguća, ali se ne izvodi u svakodnevnoj praksi.
Liječenje. Specifičnoga liječenja nema. Preporučuje se primjena ACE inhibitora (ili blokatora angiotenzinskih receptora) u svrhu smanjenja proteinurije i nefroprotektivnoga učinka. U završnom stupnju kronične bubrežne bolesti primjenjuje se nadomještanje bubrežne funkcije (dijaliza, transplantacija). Kod oko 5 % transplantiranih bolesnika bolest se ponovo vraća.
BOLEST TANKIH BAZALNIH MEMBRANA
Bolest tankih bazalnih membrana ili benigna familijarna hematurija naziv je za nasljedno uvjetovan poremećaj kojeg obilježava difuzno stanjena glomerulska bazalna membrana što je najbolje vidljivo elektronskom mikroskopijom. Najčešće se radi o mutaciji gena COL4A4 koji je zadužen za sintezu α 4 lanca kolagena tip IV. Bolest je obično asimptomatska i očituje se kao perzistentna ili rekurentna eritrociturija bez proteinurije te bez drugih sustavnih poremećaja, kao što je to slučaj u Alportovom sindromu. Novija istraživanja pokazala su da bolest ipak nije uvijek benigna te da se kod manjega broja bolesnika može razviti i proteinurija te napredovanje bubrežnoga oštećenja. Dijagnoza se temelji na anamnestičkim podacima i nalazu asimptomatske eritrociturije bez drugih simptoma, a potvrđuje biopsijom. Specifičnoga liječenja nema. Preperučuje se redovito praćenje bolesnika zbog mogućega razvoja proteinurije i napredovanja kronične bubrežne bolesti.
NEFROPATIJA FABRYJEVE BOLESTI
Fabryjeva bolest je nasljedna, X-vezana, lizosomska bolest nakupljanja. Bolest nastaje kao posljedica nedostatka ili smanjene aktivnosti enzima alfa-galaktozidaze A zbog mutacije gena koji se nalazi na kromosomu X (xq22), a poznato je više od 600 mutacija. Posljedično smanjenoj aktivnosti alfa-galaktozidaze dolazi do nakupljanja glikosfingolipida (poglavito globotriazilceramida, GL-3) u lizosomima raznih stanica. Učestalost bolesti iznosi između 1:40 000 i 1:117 000 živorođene djece. Klinička očitovanja mogu se javiti već u djetinjstvu i ranoj adolescenciji, a uključuju akroparestezije, kožne angiokeratome, dishidrozu, poremećaje sluha i vida te brzo zamaranje. U starijoj dobi karakteristične su srčane smetnje kao posljedica zahvaćenosti miokarda (hipertrofija klijetke) i srčanih zalistaka (valvularne greške). Bubrežna očitovanja obično se javljaju prije puberteta, a uključuju proteinuriju i gubitak sposobnosti koncentriranja mokraće (poliurija, nikturija). Ako se ne intervenira, razvija se postupno i napredujuće propadanje bubrežne funkcije. Dijagnoza se postavlja na temelju kliničkoga nalaza i pratećih pretraga (laboratorijski nalazi, ehokardiografija, oftamološka obrada i sl.), a potvrđuje dokazivanjem nedostatka aktivnosti enzima alfa-galaktozidaze A te genskom analizom koja otkriva mutaciju za navedeni enzim, što se provodi u specijaliziranim laboratorijima. Specifično liječenje provodi se nadomještanjem rekombinantnoga enzima (agalsidaza-β, agalsidaza-α). Bolesnici s ovom bolesti imaju skraćen životni vijek i obično umiru prije 60. godine života od srčanih komplikacija ili komplikacija kronične bubrežne bolesti.
TUBULOINTERSTICIJSKE BUBREŽNE BOLESTI
Tubulointersticijske bubrežne bolesti su bubrežne bolesti kod kojih patološki proces primarno pogađa tubule i intersticij, dok su glomeruli uglavnom pošteđeni ili sekundarno promijenjeni. Ove bolesti najčešće nastaju kao posljedica izloženosti različitim toksičnim tvarima (uključujući i lijekove), djelovanja infektivnoga agensa ili uslijed različitih autoimunih bolesti, a u određenom broju slučajeva uzrok ostaje nepoznat. Prema kliničkim obilježjima i patomorfološkim promjenama ove bolesti ugrubo možemo podijeliti u dvije skupine: akutni i kronični tubulointersticijski nefritis.
AKUTNI TUBULOINTERSTICIJSKI NEFRITIS
Definicija. Akutni tubulointersticijski nefritis označava akutnu upalu tubula i intersticija koja se razvija naglo, unutar nekoliko dana ili tjedana, najčešće kao posljedica izlaganja različitim lijekovima, mikrobiološkim agensima ili uslijed autoimunoga procesa. Akutni tubulointersticijski nefritis čini 1 % uzroka naglo nastale hematurije i/ili proteinurije kod odraslih osoba.
Etiopatogeneza. Uzroke i razvoj akutnoga tubulointersticijskog nefritisa možemo podijeliti u tri skupine: lijekovi, infekcije i autoimune bolesti.
Lijekovi. Najčešći lijekovi koji dovode do akutnoga tubulointersticijskog nefritisa su antibiotici (penicilini, cefalosoprini, fluorokinoloni, vankomicin), nesteroidni protuupalni lijekovi i diuretici (tijazidi, furosemid, triamteren), a rjeđe mogu i neki drugi (kaptopril, ranitidin, omeprazol, fenitioin, alopurinol). Oni mogu izazvati oštećenje na dva načina: izravnim toksičnim učinkom ili imunosnom reakcijom. Izravni toksični učinak ostvaruju lijekovi koji se luče putem bubrega i koji postižu visoke koncentracije u samim tubulima, dok je imunosno posredovano oštećenje rezultat imunogenoga potencija unesenoga lijeka. Uneseni lijek (ili njegov metabolit) ponaša se kao hapten, odnosno da bi potaknuo imunosni odgovor zbog svoje se male molekulske mase najprije mora vezati za bjelančevine. Vežući se za tubulske bjelančevine oni postaju imunogeni i mogu izazvati imunosni odgovor koji u prvom redu podrazumijeva stanične imunosne reakcije u kojima najveću ulogu imaju pomoćnički i citotoksični T-limfociti.
Infekcije. Različiti mikrobiološki agensi mogu posredovati pojavu akutnoga tubulointersticijskog nefritisa: bakterije (Legionella, Brucella, Streptococcus, Staphylococcus, Salmonella, E. coli, Campylobacter), virusi (Epstein-Barrov virus, Citomegalovirus, Herpes simplex virus, virus hepatitisa B) te ostali (Mycoplasma, Rickettsia, Leptospira, Mycobacterium tuberculosis, Chlamydia). Ovisno o uzročniku, oštećenje može nastati kao rezultat izravnoga oštećenja ili može biti posljedica imunolosnih zbivanja.
Autoimune bolesti. Akutni tubulointersticijski nefritis može se javiti i kao posljedica autoimunih zbivanja, a oštećenje može biti posredovano protutijelima (bolest tubulske bazalne membrane) ili se može raditi o odlaganju imunih kompleksa duž tubulske bazalne membrane (sustavni eritematozni lupus).
Posljedično navedenim zbivanjima dolazi do kemotaksije i infiltracije tubulointersticijskoga prostora upalnim stanicama, kojima dominiraju monociti, T-limfociti te eozinofili (osobito kod oštećenja posredovanoga lijekovima), dok su neutrofili i plazma stanice rjeđe zastupljeni. Razvija se edem intersticija, dolazi do porasta intratubulskoga tlaka, a dolazi i do oštećenja tubulske bazalne membrane, što sve vodi prema tubulskoj disfunkciji. Ako se ne otkloni uzročni čimbenik, bolest može napredovati prema fibrozi i atrofiji tubula te dovesti do završnoga stupnja kronične bubrežne bolesti koja će zahtijevati nadomještanje bubrežne funkcije.
Patofiziologija. Disfunkcija tubula u prvom se redu očituje nemogućnošću koncentriranja mokraće i nastankom poliurije (smanjena reapsopcija natrija), a mogući su i drugi specifični poremećaji koji su prikazani u Tablici 5.28. Porast tlaka u tubulima postupno nadmašuje veličinu glomerulskoga filtracijskog tlaka, što dovodi do smanjenja glomerulske filtracije i nastanka slike akutnoga bubrežnog oštećenja.
|
Tablica 5.28. Poremećaj tubulske funkcije
|
|
Disfunkcija proksimalnoga tubula
|
Disfunkcija distalnoga tubula
|
|
Poremećaj
|
Posljedica
|
Poremećaj
|
Posljedica
|
|
↓ reapsorpcija NaCl
|
Hipostenurija
|
↓ reapsorpcija NaCl
|
Hipostenurija
|
|
↓ reapsorpcija bikarbonata
|
Metabolička acidoza
|
↓ sekrecija vodika
|
Metabolička acidoza
|
|
↓ reapsorpcija glukoze
|
Glukozurija
|
↓ sekrecija kalija
|
Hiperkalijemija
|
|
↓ reapsorpcija cistina
|
Cistinurija
|
↓ reapsorpcija magenzija
|
Hipomagenezijemija
|
|
↓ reapsorpcija fosfata
|
Fosfaturija
|
↓ reapsorpcija kalcija
|
Hiperkalcijurija
|
|
↓ reapsorpcija urata
|
Hiperurikozurija
|
↓ osjetljivost na ADH
|
Dijabetes insipidus
|
Klinička slika akutnoga tubulointersticijskog nefritisa kreće se od asimptomatskih patoloških nalaza u mokraći pa sve do klasične slike akutnoga bubrežnog oštećenja. Kod većine bolesnika razvijaju se opći simptomi kao što su nejasno febrilno stanje, slabost i malaksalost te opći algični sindromi (glavobolje, artralgije), a može se javiti i lokaliziran bol u slabinama kao posljedica edema intersticija. Kod tubulointersticijskoga nefritisa uzrokovanoga lijekovima često se javlja i makulopapulozni osip. Kod manjega broja bolesnika se u sljedećih nekoliko dana ili tjedana razvija klasična slika akutnoga bubrežnog oštećenja.
Dijagnoza se postavlja na temelju anamnestičkih podataka (lijekovi, infekcije), laboratorijskih nalaza te slikovnih postupaka, dok je biopsija bubrega rijetko indicirana. Kliničko-laboratorijska obilježja akutnog tubulointersticijskog nefritisa prikazana su u Tablici 5.29.
Laboratorijski nalazi. Nespecifični nalazi podrazumijevaju umjerenu proteinuriju i hematuriju, nalaz eritrocitnih i leukocitnih cilindara u sedimentu mokraće te porast dušičnih metabolita u krvi (azotemija). Specifičniji nalazi za ovu bolest su hipostenurija i povećana ekskrecijska frakcija natrija u mokraći kao odraz tubulske disfunkcije te eozinofilija i eozinofilurija koje se javljaju kod velikoga broja bolesnika s akutnim tubulointersticijskim nefritisom kao posljedicom uzimanja lijekova.
Slikovni postupci. Na ultrazvučnom pregledu bubrezi su uredne veličine ili nešto uvećani, posljedično edemu intersticija s pojačanom stupnjem ehogenosti. CT ili MRI se rjeđe izvode.
Biopsija bubrega rijetko je indicirana i rezervirana je samo za bolesnike s nejasnom etiologijom tubulskoga bubrežnog oštećenja. Glavni nalaz je žarišna ili difuzna upalna infiltracija te edem tubulointersticija dok su glomeruli i krvne žile uredne morfologije.
|
Tablica 5.29. Kliničko-laboratorijska obilježja akutnoga tubulointersticijskog nefritisa
|
- Anamneza preosjetljivosti na lijekove ili nedavna infekcija i uzimanje antibiotika
- Nagla pojava vrućice posljednjih nekoliko dana ili tjedana
- Pojava hipertenzije različitoga stupnja
- Porast kreatinina u serumu i ekskrecijske frakcije natrija u mokraći
- Umjerena hematurija i/ili proteinurija
- Eozinofilija, eozinofilurija
- Bubrezi normalne veličine ili umjereno uvećani
- Pojava makulopapuloznoga osipa vezano uz uzimanje lijekova
|
Liječenje. Osnovu liječenja čini uklanjanje potencijalnoga etiološkog čimbenika (prekid uzimanja lijeka, liječenje infekcije). Ako se tijekom nekoliko dana ne popravi bubrežna funkcija, opravdana je primjena kortikosteroida, iako oko toga postoje različite prijepori i nema zajedničkoga kliničkog stava. Primjenjuje se prednizon u dozi od 1 mg/kg/dan per os, a trajanje uzimanja lijeka treba biti najmanje dva tjedna. Ako se nakon toga prati oporavak bubrežne funkcije, postupno se smanjuje doza prednizona tijekom sljedećih nekoliko tjedana, a kada i dalje perzistira ili se pogoršava bubrežna funkcija, opravdana je i primjena mikofenolata, ciklosporina te rijetko ciklofosfamida. Ako je uzročni čimbenik nesteroidni protuupalni lijek, kortikosteroidi će uglavnom biti bez učinka. Uz navedene mjere liječenja primjenjuju se i klasični postupci liječenja akutnoga bubrežnog oštećenja.
Prognoza. Načelno gledano, akutni tubulointersticijski nefritis ima povoljnu prognozu i većina bolesnika nakon prekida izlaganja uzročnom čimbeniku oporavi bubrežnu funkciju, a vrlo mali broj njih postaje ovisan o dijalizi. Nepovoljni prognostički čimbenici su starija životna dob, prethodno postojeća bubrežna bolest, perzistiranje patoloških nalaza nakon prekida izlaganju uzročnom čimbeniku te prisutnost fibroze i atrofije tubula i intersticija na biopsijskom uzorku.
KRONIČNI TUBULOINTERSTICIJSKI NEFRITIS
Kronični tubulointersticijski nefritis je naziv za kronične histopatološke promjene tubula i intersticija koje uključuju mononuklearnu infiltraciju te različit stupanj fibroze i atrofije. Ovisno o etiologiji razlikujemo nekoliko kliničkih entiteta kroničnoga tubulointersticijskog nefritisa: analgetička nefropatija, nefropatija aristolohične kiseline (prijašnji naziv endemska nefropatija) te refluksna nefropatija.
ANALGETIČKA NEFROPATIJA
Definicija. Analgetička nefropatija naziv je za kronični tubulointersticijski nefritis koji se razvija kao posljedica dugotrajne uporabe analgetika, prvenstveno nesteroidnih protuupalnih lijekova. Češće se javlja kod žena, pretežno u srednjoj i starijoj životnoj dobi.
Etiopatogeneza. Analgetička nefropatija razvija se uslijed višegodišnjeg uzimanja nesteroidnih protuupalnih lijekova u velikim dozama. Promjene koje izazivaju na bubrezima rezultat su samoga farmakološkog učinka, a to je inhibicija enzima ciklooksigenaze i smanjena sinteza prostaglandina. Prostaglandini imaju veliku ulogu u regulaciji krvnoga protoka kroz bubrežnu srž i posreduju vazodilataciju te se posljedično njihovom nedostatku razvija hipoperfuzija i ishemija, posebice bubrežnih papila. Osim toga, ovi lijekovi pokazuju sposobnost nakupljanja i koncentriranja u bubrežnim papilama gdje mogu uzrokovati izravan citotoksični učinak (aktivacija monooksigenaze ovisne o citokromu P-450 i nastanak aktivnih toksičnih metabolita). Posljedica navedenih događaja prvenstveno je papilarna nekroza, ali ishemijom bivaju zahvaćeni i drugi dijelovi medule što sve vodi u kronične promjene u smislu tubulske atrofije i intersticijske fibroze.
Patologija. Makroskopski, bubrezi su u analgetičkoj nefropatiji smanjeni i nepravilnih vanjskih obrisa, a na presjecima se jasno vide područja papilarne nekroze. Mikroskopski, glavni nalaz čini nekroza i kalcifikacija papila te mononuklearna infiltracija, atrofija i fibroza tubulointersticija, uz početno očuvane glomerule, iako se i kod njih postupno razvijaju promjene u smislu fokalne i segmentalne glomeruloskleroze.
Klinička slika. Iako bolest ima dugogodišnji tijek, ona je obično asimptomatična sve do pojave završnoga stupnja kronične bubrežne bolesti. Prvi simptomi i znakovi bolesti su poliurija i nokturija koji su posljedica tubulske disfunkcije (smanjena sposobnost koncentriranja mokraće). Arterijska hipertenzija javlja se u više od 50 % slučajeva, a česte su i recidivirajuće makrohematurije.
Komplikacije. Papilarna nekroza može biti praćena kliničkom slikom nefrokolike koja nastaje uslijed stvaranja konglomerata sastavljenoga od deskvamiranih papila koji mogu sadržavati kalcij i oponašati nefrolit. Također, papilarna nekroza povezana je s većom učestalošću akutnoga pijelonefritisa. Svi bolesnici s analgetičkom nefropatijom imaju veći rizik za obolijevanje od karcinoma prijelaznoga epitela mokraćnih puteva.
Dijagnoza se postavlja na temelju anamnestičkih podataka, laboratorijskih nalaza, slikovnih postupaka, a u nekim slučajevima i biopsijom bubrega. Osnovni dijagnostički pokazatelj je podatak o višegodišnjem uzimanju nesteroidnih protuupalnih lijekova, osobito paracetamola ili acetilsalicilne kiseline.
Laboratorijski nalazi ukazuju na poremećaj tubulske funkcije: nesposobnost zakiseljavanja mokraće (pH mokraće < 5,5), metabolička acidoza koja je izraženija nego što bi se očekivala u odnosu na bubrežno oštećenje, povećana ekskrecijska frakcija natrija u mokraći uz umjerenu proteinuriju (do 1 g/dan), eritrocituriju i sterilnu leukocituriju. Oštećena bubrežna funkcija očituje se kroz postupni porast dušičnih metabolita (ureja, kreatinin).
Slikovni postupci. Kompjutorizirana tomografija bez kontrasta je glavni slikovni postupak i postupak izbora pri sumnji na analgetičku nefropatiju. Klasični radiološki znakovi analgetičke nefropatije su smanjeni bubrezi s nepravilnim (kvrgavim) obrisima s najmanje tri usjeka u normalnom konveksnom lateralnom rubu uz nalaz kalcifikacija papila. Ekskrecijska (intravenska) urografija danas se rjeđe izvodi u svrhu potvrde ove dijagnoze.
Biopsija bubrega i patohistološka analiza uzorka rezervirana je za bolesnike s nejasnom kliničkom slikom i nejasnim radiološkim znakovima zbog čega se ne mogu isključiti drugi uzroci kronične bubrežne bolesti.
Liječenje i prognoza. Liječenje u prvom redu podrazumijeva prekid uzimanja nesteroidnih protuupalnih lijekova uz obilnu hidraciju (smanjuje koncentraciju metabolita u srži) te nadzor arterijske hipertenzije. Uz navedeno se kod 25 % bolesnika postiže oporavak bubrežne funkcije, kod 50 % ona ostaje stabilna na određenoj razini oštećenja, a u 25 % slučajeva se prati daljnje napredovanje i razvoj završnoga stupnja kronične bubrežne bolesti.
NEFROPATIJA ARISTOLOHIČNE KISELINE
Definicija. Nefropatija aristolohične kiseline - AAN (od engl. aristolochic acid nephropathy, nekad zvana endemska ili balkanska nefropatija) je naziv za kronični tubulointersticijski nefritis nepoznate etiologije koji se endemski pojavljuje isključivo u određenim ruralnim područjima u dolinama velikih pritoka rijeke Dunava na jugoistoku Europe. Bolest obilježava neprimjetan početak, napredujući tijek te razvoj kronične bubrežne bolesti koja će zahtijevati nadomještanje bubrežne funkcije. Karakteristično, ovi bolesnici imaju i veću sklonost razvoju uroepitelnoga karcinoma.
Etiopatogeneza. Uzrok AAN-a leži u molekuli aristolohične kiseline koja se nalazi u sjemenkama biljke Aristolochia clematitis (vučja stopa), koja se može pojaviti u poljima pšenice te zajedno s njom može završiti u preradi i proizvodnji pšeničnoga brašna putem kojega se i unosi u organizam. Metaboliti aristolohične kiseline pokazuju sklonost akumulaciji u proksimalnim dijelovima bubrežnih kanalića gdje izazivaju kroničnu upalu i razvoj fibroze te u stanicama prijelaznoga epitela gornjega dijela mokraćnoga sustava, što se povezuje s povećanom učestalosti uroepitelnih karcinoma.
Klinička slika je nespecifična. Bolest se postupno razvija bez kliničkih očitovanja sve dok ne nastupi simptomatski završni stupanj kronične bubrežne bolesti, odnosno dok se ne razvije uremijski sindrom.
Dijagnoza se postavlja na temelju anamnestičkih i epidemioloških podataka, laboratorijskih nalaza, slikovnih postupaka te nalaza biopsije bubrega. Postoji više dijagnostičkih kriterija za postavljanje dijagnoze AAN, a ovdje su prikazani tzv. brački kriteriji (Svjetska zdravstvena organizacija, Brač, 2008. godina) – Tablica 5.30.
Anamnestički i epidemiološki podaci ključni su za postavljanje dijagnoze i čine prvi dijagnostički kriterij, a uključuju boravak u endemskom području u razdoblju duljem od 20 godina i/ili boravak u kućanstvu u kojemu je bilo oboljelih od AAN-a ili karcinom prijelaznoga epitela gornjeg dijela mokraćnoga sustava u razdoblju duljem od 15 godina.
Laboratorijski nalazi su nespecifični. Početno bolesnici imaju tubulsku proteinuriju (bjelančevine male mokelulske mase), a s razvojem bolesti ona postaje miješanoga tipa – tubuloglomerulska proteinurija (bjelančevine male i velike molekulske mase). Kao biljeg AAN-a spominje se određivanje α1-mikroglobulina u mokraći, s obzirom na to da je pouzdan biljeg oštećenja proksimalnoga tubula i više od 90 % bolesnika s AAN-om ima povećanu koncentraciju u mokraći. Normokromna i normocitna anemija prisutna je već u početku bolesti. S razvojem i napredovanjem bolesti rastu i serumske koncentracije dušičnih metabolita (ureja, kreatinin).
Slikovni postupci. Ultrazvuk bubrega je u početnim fazama uredan, ali s napredovanjem bolesti oni se prikazuju manjih dimenzija, skvrčeni i hiperehogeni. Nema specifičnih radioloških znakova za AAN.
Patohistološki nalaz karakterističan je kao i za ostale kronične tubulointersticijske nefritise: mononuklearna stanična infiltracija, fibroza intersticija te atrofija kanalića, uz očuvane ili minimalno promijenjene glomerule.
|
Tablica 5.30. Brački kriteriji za postavljanje dijagnoze AAN-a
|
|
Kriteriji
|
Tumačenje
|
|
a. Biopsija bubrega indikativna za AAN,
b. Boravak u endemskom području dulji od 20 godina,
c. Tubulska proteinurija,
d. Smanjena glomerulska filtracija (eGFR),
e. Anemija kronične bolesti,
f. Boravak u kućanstvu u kojemu je bilo oboljelih od AAN-a dulje od 15 godina,
g. Karcinom prijelaznoga epitela gornjega mokraćnog sustava,
h. Boravak u kućanstvu s dokazanim tzv. sporadičnim slučajevima bolesti,
i. Biopsija bubrega indikativna na AAN kod bolesnika s karcinomom uroepitela gornjega mokraćnog sustava ili u članova njihovih kućanstava,
j. Boravak u endemskom području dulji od 15 godina.
|
Oboljeli od AAN-a:
a ili b+c+d+e ili c+f ili b+g
Sumnjivi na AAN:
d+e+f ili c+j ili b+g
Visok rizik oboljevanja od AAN-a:
f ili h
Sporadična AAN:
i
|
Liječenje. Specifičnoga liječenja nema, primjenjuju se klasični postupci liječenja kronične bubrežne bolesti, najprije konzervativno, a zatim i nekim od postupaka nadomještanja bubrežne funkcije. Danas je bolesnika oboljelih od AAN-a sve manje i praktično se radi o bolesti u nestajanju.
REFLUKSNA NEFROPATIJA
Refluksna nefropatija naziv je za kronični tubulointersticijski nefritis koji se javlja kao posljedica dugotrajnoga refluksa inficirane mokraće, a što se nalazi u podlozi prirođene anomalije (vezikoureteralni refluks). Neprepoznata anomalija stvara preduvjet za nastanak mokraćne infekcije te refluks inficirane mokraće natrag u bubrege i sabirne kanaliće kroz otvore papila dovodi do kronične upale s posljedičnim stvaranjem fibroze i ožiljaka. Klinička očitovanja se obično javljaju u razdoblju adolescencije u vidu proteinurije, hipertenzije i razvoja kronične bubrežne bolesti. Bolest se dokazuje scintigrafijom i/ili biopsijom bubrega. Osnovu liječenja čini što ranija dijagnostika vezikoureteralnoga refluksa (mikcijska citoureterografija) i kirurško liječenje uz antibiotičku profilaksu mokraćnih infekcija.
VASKULARNE BUBREŽNE BOLESTI
U bolesti krvnih žila bubrega ubrajamo bolesti bubrežnih arterija (akutna okluzija bubrežne arterije, stenoza bubrežne arterije), bolesti unutarbubrežnih krvnih žila (ateroembolijska bubrežna bolest, hipertenzivna nefroangioskleroza, trombotičke mikroangiopatije, sustavne bolesti koji pogađaju unutarbubrežne krvne žile) te bolesti bubrežnih vena (tromboza bubrežne vene).
BOLESTI BUBREŽNIH ARTERIJA
AKUTNA OKLUZIJA BUBREŽNE ARTERIJE
Definicija. Akutna okluzija bubrežne arterije označava stanje nagloga pregida protoka krvi kroz bubrežnu arteriju ili njezinje glavne ogranke s posljedičnim razvojem ishemije i nekroze bubrežnoga parenhima (bubrežni infarkt).
Etiopatogeneza. Akutna okluzija bubrežne arterije ili njezinih glavnih ogranaka može nastati na dva načina: embolizacijom bubrežne arterije ugruškom (ili nekim drugim materijalom) ili intraarterijskim stvaranjem ugruška (tromboza). Posljedično okluziji dolazi do prekida protoka krvi distalno od mjesta začepljenja, što uvjetuje nastanak ishemije, a kasnije i nekroze. Konačni ishod i kliničko očitovanje ovisi o veličini bubrežnoga parenhima koji je ostao bez protoka krvi.
Tromboembolijska embolizacija najčešći je uzrok akutne okluzije bubrežne arterije. Obično se radi o jednostranoj embolizaciji, ali se u 15 do 30 % slučajeva može raditi i o bilateralnoj. U više od 90 % slučajeva tromboembolus je podrijetla iz srca (fibrilacija atrija, valvularna patologija), a ostali izvori su aorta (aneurizmatsko proširenje) ili neki drugi izvor, ako bolesnik ima patološki intrakardijalni šant – paradoksna embolizacija (atrijski septalni poremećaj, foramen ovale).
Intraarterijska tromboza rjeđi je uzrok akutne okluzije bubrežne arterije, a može nastati kao posljedica napredujuće ateroskleroze (plak ruptura i superponirana tromboza) ili traumatične ozljede trbuha (pritisak arterije na kralješnicu i ozljeda intime), a može se javiti i u sklopu sustavnih vaskulitisa (vaskulitis Takayasu, trombangiitis obliterans) i trombofilija (antifosfolipidini sindrom).
Ostali, rjeđi uzroci obuhvaćaju septičke embolizacije (bakterijski endokarditis), tumorske embolizacije (miksom) ili embolizacije zrakom ili masnim tkivom (zračna i masna embolija).
Klinička slika ponajprije ovisi o mjestu okluzije. Okluzije segmentalnih ogranaka dovode do ispada perfuzije manjega dijela bubrežnoga parenhima što može proći i asimptomatski, dok okluzija glavne grane bubrežne arterije dovodi do jasnih kliničkih očitovanja, s obzirom na to da cijeli bubreg postaje ishemičan. U kliničkoj slici možemo naći naglo nastalu bol u slabinama, porast tjelesne temperature, mučninu i povraćanje, a kod velikoga broja bolesnika nalazimo i hematuriju. Kod većine bolesnika razvija se i hipertenzija posljedično otpuštanju renina iz ishemičnoga bubrega. Oligoanurija nastaje u slučaju obostrane okluzije ili okluzije renalne arterije solitarnoga bubrega, a tada nalazimo i jasnu sliku akutnoga bubrežnog oštećenja.
Dijagnoza se postavlja na temelju anamneze i fizikalnoga pregleda, laboratorijskih nalaza te slikovnim prikazom bubrežnih arterija. Podaci o prethodnim bolestima i stanjima mogu biti od pomoći u postavljanju sumnje na ovo stanje (fibrilacija atrija, bolesti zalistaka, trombofilija, nedavna trauma trbuha i sl.). Fizikalni nalaz je nespecifičan (pozitivna lumbalna sukusija).
Laboratorijski nalazi su nespecifični, a mogu uključivati leukocitozu, izolirano povećanje serumske koncentracije enzima aspartat aminotransferaze, alkalne fosfataze i laktat dehidrogenaze, a ovisno o zahvaćenosti i dušičnih metabolita (ureja, kreatinin). U mokraći se najčešće prati eritrociturija, a može i proteinurija i patološka cilindrurija, a od pomoći može biti i određivanje koncentracije laktat dehidrogenaze u mokraći koja je povećana.
Slikovni postupci u dijagostici akutne okluzije bubrežne arterije i njezinih ogranaka u prvom redu podrazumijevaju CT ili MRI angiografiju koji pokazuju poremećaje punjenja glavne ili segmentalnih bubrežnih arterija. Primjena kontrasta trebala bi biti oprezna kod bolesnika s razvijenim akutnim bubrežnim oštećenjem ili otprije poznatom kroničnom bubrežnom bolesti, kod starijih bolesnika te kod bolesnika sa šećernom bolesti. Obojeni dopler, ekskrecijska urografija kao i scintigrafija bubrega više se ne preporučuju u dijagnostici ovoga poremećaja.
Ostale napomene. Ako se navedenim postupcima ne dokaže akutna okluzija bubrežne arterije ili njezinih ogranaka, a i dalje postoji velika sumnja, indicirana je invazivna dijagostička obrada u smislu perkutane angiografije. Svim bolesnicima preporučena je ehokardiografija (transtorakalna, transezofagijska) radi dokaza mogućega izvora embolusa (intrakavitarni tromb, valvularne vegetacije) te svim bolesnicima s trombozom bubrežne arterije, u odsutnosti traume trbuha treba napraviti probir na stečene i nasljedne trombofilije.
Liječenje. S obzirom na to da bubreg može tolerirati samo 60 do 90 minuta tople ishemije, nakon čega razvija ireverzibilne promjene, uspjeh trombolitičke terapije ili invazivnih postupaka s ciljem rekanalizacije bubrežne arterije je ograničen. Glavni terapijski izbor sveden je na antikoagulacijsko liječenje koje započinje primjenom nefrakcioniranoga ili niskomolekulskog heparina, nakon čega se nastavlja dugotrajna peroralna antikoagulacijska terapija varfarinom. Kiruška revaskularizacija ili perkutana intervencija (stentiranje), kao i primjena trombolitičke terapije (sustavne ili lokalne) danas se rjeđe izvode i ostaju kao mogućnost u liječenju obostrane okluzije ili okluzije solitarnoga bubrega, zbog velikoga rizika od mogućih komplikacija, a nije dokazano da učinkovito doprinose spašavanju bubrežne funkcije (najčešće zbog dugoga vremenskog intervala od nastanka okluzije do rekanalizacije).
Prognoza ovisi o više čimbenika: opseg ishemije, dob bolesnika, prethodne bubrežne bolesti i sl. Rizik od gubitka bubrežne funkcije široko varira, od 5 do 50 %. Stopa smrtnosti raste kod bolesnika koji se podvrgavaju kirurškoj revaskularizaciji. Kao najčešća sekvela akutne okluzije bubrežne arterije ili njezinih ogranaka ostaje arterijska hipertenzija koja dobro reagira na lijekove koji blokiraju reninsko angiotenzinski sustav.
STENOZA BUBREŽNE ARTERIJE
Definicija. Stenoza bubrežne arterije označava suženje lumena bubrežne arterije koje dovodi do smanjenoga protoka krvi te hipoperfuzije i ishemije bubrega s posljedičnom aktivacijom reninsko angiotenzinskoaldosteronskoga sustava i razvoja renovaskularne hipertenzije. Suženje bubrežne arterije nalazimo kod oko 5 % osoba s arterijskom hipertenzijom, a hemodinamički značajno suženje je ono veće od 70 % lumena arterije.
Etiopatogeneza. U kliničkoj praksi dva su najčešća uzroka suženja bubrežne arterije: aterosklerotička bolest bubrežnih arterija te fibromuskularna displazija, a rijetko se radi o protisku na bubrežne arterije izvana.
Aterosklerotička bolest bubrežnih arterija javlja se u sklopu generalizirane ateroskleroze i čini najčešći uzrok stenoze bubrežne arterije (više od 90 % slučajeva). Tipično se javlja kod starijih osoba i povezana je s prisutnošću klasičnih rizičnih čimbenika za razvoj ateroskleroze. Kod bolesnika s dokazanom koronarnom ili perifernom arterijskom bolesti i hipertenzijom u 20 do 40 % slučajeva nalazimo neki stupanj stenoze bubrežne arterije. Aterosklerotički plakovi dominantno nastaju u području ishodišta bubrežne arterije i njezinoga proksimalnog dijela.
Fibromuskularna displazija rjeđi je uzrok stenoze bubrežne arterije i čini važan uzrok arterijske hipertenzije kod mlađih osoba bez prisustva srčanožilnih rizika. Bolest se češće javlja kod žena, a smatra se da je genski uvjetovana, iako postoje teorije i o stečenoj etiologiji (hormonske promjene – češća pojavnost kod žena u reproduktivnom razdoblju, mehanički čimbenici, ishemija stijenke i dr.). Bolest obilježavaju histopatološke promjene u smislu hiperplazije, displazije i fibroze koje zahvaćaju mediju i intimu i dovode do suženja bubrežnih arterija. Ta su suženja neravnomjerno raspoređena duž tijeka bubrežne arterije dajući nalaz „poput krunice“.
Patofiziologija. Suženje bubrežne arterije dovodi do posljedične hiperperfuzije i ishemije bubrega što je poticaj pojačanom stvaranju i lučenju renina koji pokreće sustav renin-angiotenzin-aldosteron, dovodeći do nastanka hipertenzije – renovaskularna hipertenzija. Ovisno o stupnju stenoze i jačini ishemije razvija se atrofija bubrega i propadanje njegove funkcije, što može dovesti do razvoja kronične bubrežne bolesti, osobito ako se radi o obostranoj stenozi. Također, jednostrana stenoza bubrežne arterije dovodi i do oštećenja funkcije drugoga bubrega, posredovano hemodinamičkim promjenama uslijed renovaskularne hipertenzije. Zbog pojačanoga stvaranja aldosterona u sklopu aktivacije sustava renin-angiotenzin-aldosteron, moguća je pojava hipokalijemije.
Klinička slika. Kliničkom slikom dominira arterijska hipertenzija koja se teško korigira antihipertenzivnom terapijom. U Tablici 5.31. navedeni su klinički scenariji kod kojih treba pomišljati na stenozu bubrežne arterije. U kasnijem tijeku moguć je i razvoj kronične bubrežne bolesti.
|
Tablica 5.31. Klinička očitovanja stenoze bubrežne arterije
|
- Nagla pojava hipertenzije prije 30. ili poslije 50. godine života
- Negativna obiteljska anamneza na arterijsku hipertenziju
- Kratko trajanje i naglo pogoršanje arterijske hipertenzije
- Otpornost hipertenzije na antihipertenzivnu terapiju*
- Pogoršanje bubrežne funkcije ili razvoj akutnoga bubrežnog oštećenja nakon uvođenja inhibitora RAAS
- Neobjašnjiva hipokalijemija s ili bez metaboličke alkaloze
- Neobjašnjivo napredovanje kronične bubrežne bolesti
|
*Otpornost na antihipertenzivnu terapiju definira se kao loša regulacija krvnoga tlaka unatoč tri antihipertenziva iz različitih skupina u maksimalnim dozama, od kojih je jedan diuretik, ili četriri antihipertenziva iz različitih skupina u maksimalnim dozama, od kojih ni jedan nije diuretik.
Dijagnoza se postavlja na temelju anamnestičkih podataka i fizikalnoga pregleda, laboratorijskih nalaza te slikovnih dijagostičkih postupaka. Anamnestički podaci ključni su u postavljanju sumnje na ovu bolest (Tablica 5.31.), a pri fizikalnom pregledu pažljivom auskultacijom kod nekih se bolesnika može čuti žilni sistoličko-dijastolički šum u području epigastrija.
Laboratorijski nalazi su nespecifični, prate se vrijednosti dušičnih metabolita koje ukazuju na stupanj bubrežnoga oštećenja, a hipokalijemija (s ili bez metaboličke alkaloze) posljedica je hiperaldosteronizma. U plazmi se mogu naći parametri povećane aktivnosti sustava renin-angiotenzin-aldosteron (serumske koncentracije renina i aldosterona).
Slikovni postupci kojima se može dokazati stenoza bubrežne arterije su dopler ultrasonografija te CT i MRI angiografija. Dopler bubrežnih arterija najjednostavniji je i najmanje štetan postupak te se obično primjenjuje kao početni test za dokazivanje stenoze bubrežne arterije. CT i MRI angiografija daju bolji uvid u morfološke promjene bubrežnih arterija, ali nose rizik od razvoja kontrastne nefropatije zbog primjene jodnoga kontrasta kod CT angiografije te nefrogene sustavne fibroze zbog primjene gadolinija kod MRI angiografije. Ipak, uz dovoljnu periproceduralnu hidraciju taj je rizik prihvatljiv. U slučaju nejasne dijagnoze unatoč ovim pretragama izvodi se invazivna digitalna supstrakcijska angiografija. Razlika između aterosklerotičke bolesti i fibromuskularne displazije ponajprije proizlazi iz lokalizacije, tj. rasporeda stenoza (kod ateroskleroze najveća je distribucija oko ishodišta i proksimalnoga dijela, a kod fibromuskularne displazije je slika „poput krunice“).
Liječenje stenoze bubrežne arterije ovisi ponajprije o uzroku te terapijski pristup bolesniku ovisi o tome radi li se o aterosklerotičkoj bolesti bubrežne arterije ili fibromuskularnoj displaziji.
Kod bolesnika s aterosklerotičkom bolesti bubrežne arterije naglasak je na medikamentnom liječenju, dok je postupak revaskularizacije kontroverzan. Istraživanja, naime, nisu pokazala superiornost i terapijsku korist u odnosu na samo medikamentno liječenje. Temelj liječenja je nadzor arterijske hipertenzije, što se postiže kombinacijom antihipertenziva različitih skupina. Nakon uvođenja ACE inhibitora ili blokatora angiotenzinskih receptora u terapiju potrebne su češće kontrole dušičnih metabolita jer mogu dovesti do značajnoga pogoršanja bubrežne funkcije kod ovih bolesnika, djelujući na kompenzacijske autoregulacijske mehanizme kojima se održava glomerulska filtracija. U slučaju obostranih stenoza velik je rizik za pogoršanje bubrežne funkcije, osobito uz hipovolemiju izazvanu diureticima, pa se takvi bolesnici moraju strože kontrolirati. Od ostalih lijekova bitnu ulogu imaju antiagregacijski lijekovi (acetil-salicilna kiselina) i antilipemici (statini). Također, potrebna je i korekcija drugih srčanožilnih rizičnih čimbenika.
Kod bolesnika s fibromuskularnom displazijom dokazana je klinička korist od revaskularizacije te se kod tih bolesnika preporučuje balon-angioplastika bubrežne arterije u kombinaciji s medikametnim liječenjem. S obzirom na to da su u njih česte restenoze, potrebne su redovite kontrole bolesnika.
Prognoza. Aterosklerotička bolest bubrežne arterije predstavlja jedan od nezavisnih prediktora srčanožilne smrtnosti, a ona je veća kada su pridruženi i drugi čimbenici kao što su: povećane serumske koncentracije dušičnih metabolita, starija životna dob, teži stupanj stenoze te prisutnost drugih kroničnih bolesti. Kod bolesnika s fibromuskularnom displazijom nakon intervencijskoga zahvata postiže se izlječenje hipertenzije u oko 45 % slučajeva, a boljem rezultatu pridonose mlađa životna dob, blaža hipertenzija i kraće trajanje hipertenzije.
BOLESTI UNUTARBUBREŽNIH KRVNIH ŽILA
ATEROEMBOLIJSKA BOLEST BUBREGA
Definicija. Ateroembolijska bolest bubrega naziv je za embolizaciju unutarbubrežnih arterija dijelovima ateroma koji su građeni od kolesterolskih kristala, a javlja se kao jedna od komplikacija generalizirane ateroskleroze. S obzirom na nespecifičnost kliničke slike i otežanu dijagnozu, stvarna učestalost bolesti je nepoznata i smatra se da kod većine bolesnika ostaje neprepoznata i nedijagnosticirana.
Etiopatogeneza. Ateroembolijska bubrežna bolest posljedica je otkidanja dijelova aterosklerotičkoga plaka koji nošen strujom može dospjeti u različite arterije i dovesti do njihove okluzije i indukcije upalnoga odgovora. To se najčešće povezuje s instrumentalnim intraarterijskim manipulacijama (kateteri i žice vodilice, postavljanje stentova, transluminalna angioplastika) te antikoagulantnom i trombolitičkom terapijom, rijetko se radi o spontanom otkidanju. Bubreg je jedno od najčešćih mjesta ateroembolizacije, ali mogu biti pogođeni i drugi organi (koža, mozak, oči, slezena, probavni sustav). Najčešće okluzija nastaje na razini arterije arkuate ili interlobularne arterije, ona je obično nepotpuna, a karakteristično izaziva upalni odgovor u kojemu dominantnu ulogu imaju eozinofilni leukociti, zbog čega do razvoja kliničkih simptoma može proći i do nekoliko tjedana.
Klinička slika. Bolest se očituje općim simptomima koji se javljaju kod polovice bolesnika te simptomima zahvaćenosti (ateroembolizacije) pojedinih organa. Opći simptomi nastaju kao posljedica upalnoga odgovora, a uključuju vrućicu, umor i malaksalost, algični sindrom i sl. Bubrežna očitovanja obuhvaćaju razvoj akutnoga bubrežnog oštećenja i/ili izraženu arterijsku hiperteziju. Uz to, česta su kožna očitovanja (livedo reticularis, plavi prsti), a moguća su i druga očitovanja (moždanožilni događaj, akutni pankreatitis, ishemijski kolitis i dr.).
Dijagnoza. S obzirom na nespecifičnost kliničke slike, postavljanje ove dijagnoze je otežano. Ona se temelji na kombinaciji posebnosti u kliničkom te u laboratorijskim nalazima (Tablica 5.32.). Sumnju na ovu bolest treba pobuditi nastanak akutnoga bubrežnog oštećenja uz druge specifične promjene, kao što je livedo reticularis, a javljaju se nakon unutaržilne intervencije ili antikoagulatne ili trombolitičke terapije. U laboratorijskim nalazima vidljiva je ubrzana sedimentacija eritrocita, leukocitoza s eozinofilijom, hipokomplementemija, eozinofilurija, uz porast dušičnih metabolita. Konačnu dijagnozu daje biopsija bubrega (patognomonični kolesterolski kristali u embolusima okludiranih žila), iako se ona ne izvodi ako nam je jasna klinička slika.
|
Tablica 5.32. Ključne sastavnice za postavljanje dijagnoze ateroembolijske bolesti bubrega
|
- Nedavna intravskularna intervencija, antikoagulantna ili trombolitička terapija
- Akutno bubrežno oštećenje i/ili hipertenzija
- Livedo reticularis, plavi prsti
- Eozinofilija, eozinofilurija, ubrzana sedimentacija eritrocita
|
Liječenje je nespecifično i temelji se na potpornim i simptomatskim mjerama. Osnovne mjere u liječenju ovih bolesnika su: 1) agresivna antilipemička terapija statinima, 2) antihipertenzivno liječenje antagonistima angiotenzina II i vazodilatatorima, 3) prikladna peroralna ili parenteralna hidracija te 4) obustava antikoagulantne terapije ako je bolesnik uzima.
Prognoza je općenito loša kod ovih bolesnika zbog osnovne bolesti koja je u podlozi. Oporavak bubrežne funkcije nastupa kod dijela bolesnika, dok kod otprilike trećine napreduje do završnoga stupnja kronične bubrežne bolesti.
HIPERTENZIVNA NEFROANGIOSKLEROZA
Definicija. Hipertenzivna nefroangioskleroza naziv je za promjene na krvnim žilama bubrega koje nastaju kao posljedica dugotrajne hipertenzije, a ponajprije ovise o težini i duljini trajanja arterijske hipertenzije. Smatra se da je arterijska hipertenzija u razvijenim zemljama odgovorna za 20 do 30 % slučajeva kronične bubrežne bolesti.
Etiopatogeneza. Hipertenzivna nefroangioskleroza nastaje kao posljedica dugogodišnje arterijske hipertenzije, a ovisno o patogenezi i kliničkom tijeku, razlikujemo benignu i malignu nefroangiosklerozu.
Benigna hipertenzivna nefroangioskleroza razvija se postupno kod bolesnika s dugogodišnjom hipertezijom, a promjene su utoliko teže ukoliko je stupanj hipertenzije veći i što je ona lošije regulirana. Iako nosi naziv benigna, ima sporonapredujući tijek i može završiti kroničnim propadanjem bubrežne funkcije (kronična bubrežna bolest). Povišen krvni tlak unutar aorte i sustavnih arterija prenosi se i na unutarbubrežne krvne žile i glomerulske kapilare, što izaziva njihov odgovor u vidu povećane propusnosti i odlaganja hijalinoga materijala te hipertofije medije i suženja lumena. Navedene promjene dovode do hipoperfuzije i ishemije bubrežnoga parenhima, što dovodi do promjena na glomerulima (glomeruloskleroze) te tubulima i intersticiju (atrofija, fibroza). U konačnici ove promjene vode propadanju bubrežne funkcije i rezultiraju razvojem kronične bubrežne bolesti.
Maligna hipertenzivna nefroangioskleroza razvija se kod bolesnika s ubrzanom ili malignom hipertenzijom, koju obilježavaju izrazito visoki tlakovi unutar krvnih žila. Izrazito visok tlak unutar unutarbubrežnih arterija i arteriola dovodi do ishemije same stijenke krvne žile koji vodi u nekrozu (nekrotizirajući arteriolitis).
Klinička slika i dijagnoza. Benigna hipertenzivna nefroangioskleroza očituje se kao sporonapredujuća kronična bubrežna bolest koja, ako se ne liječi, završava završnim stupnjem koje će zahtijevati nadomještajne bubrežne funkcije. Maligna hipertenzivna nefroangioskleroza ima akutni tijek kojega obilježava akutno bubrežno oštećenje, a često su prisutni i drugi znaci hipertenzivnoga oštećenja (hipertenzivna retinopatija, edem papile vidnoga živca, encefalopatija). Klinička i dijagnostička obilježja benigne i malgine nefroangioskleroze prikazana su u Tablici 5.33.
|
Tablica 5.33. Osnovna klinička i dijagnostička obilježja hipertenzivne nefroangioskleroze
|
|
Tip
|
Kliniči tijek
|
Laboratorijski nalazi
|
Ultrazvuk bubrega
|
|
Benigna nefroangioskleroza
|
Kronična bubrežna bolest
|
Proteinurija manja 1,5 g/dan
|
Bubrezi obično smanjeni
|
|
Maligna nefroangioskleroza
|
Akutno bubrežno oštećenje
|
Proteinurija, eritrociturija
|
Bubrezi obično povećani
|
Liječenje podrazumijeva prikladan nadzor vrijedosti krvnoga tlaka. Vrijednosti krvnoga tlaka trebaju biti 130/80 mmHg ili niže, a lijekovi izbora su ACE inhibitori i blokatori angiotenzinskih receptora, s obzirom na nefroprotektivni učinak. Liječenje maligne nefroangioskleroze opisano je u dijelu o hipertenzivnim hitnoćama.
TROMBOTIČKE MIKROANGIOPATIJE
Trombotička mikroangiopatija je patohistološki pojam koji opisuje promjene na malim krvnim žilama, posebice arteriolama i kapilarama, koje se javljaju kao posljedica djelovanja različitih štetnih čimbenika (oštećenja). Glavna obilježja trombotičke mikroangiopatije su: 1) zadebljanje žilne stijenke, 2) intraluminalno stvaranje krvnih ugrušaka koji dovode do opstrukcije te 3) fragmentacija eritrocita koja nastaje uslijed oštećenja eritrocita pri prolasku kroz tako patološki promijenjene krvne žile. Posljedično navedenim promjenama glavna klinička obilježja trombotičkih mikroangiopatija su potrošna trombocitopenija, hemolitička anemija te ishemija zahvaćenoga organa. Dva najčešća klinička primjera trombotične mikroangiopatije su trombotička trombocitopenična purpura te hemolitičko uremijski sindrom. Zahvaćenost bubrežne mikrovaskulature u oba slučaja je često te je oštećena bubrežna funkcija jedno od najčešćih i najznačajnijih poremećaja u oba slučaja.
Trombotička trombocitopenična purpura (TTP) je naziv za tešku, životno-ugrožavajuću bolest koja nastaje zbog potpunoga ili djelomičnog manjka proteaze ADAMTS13, enzima koji cijepa ultravelike monomere von Willebrandovoga čimbenika koji se oslobađaju iz oštećenoga endotela i posreduju agregaciju trombocita. U odsustvu ADAMTS13 izostaje primjerena razgradnja von Willebrandovoga čimbenika, što posljedično može dovesti do spontane agregacije trombocita te nastanka mikrovaskularne tromboze. Poremećaj se može javiti kongenitalno (nasljedni nedostatak ADAMTS13) ili stečeno (stvaranje autoprotutijela na ADAMTS13). Unutaržilna tromboza najčešće se odvija u mirkovaskulaturi mozga i bubrega pa u kliničkoj slici dominiraju neurološki simptomi i akutno bubrežno oštećenje, ali se mogu javiti i simptomi s drugih mjestia. Tradicijski, bolest se očituje sljedećom kliničkom pentadom: 1) trombocitopenija, 2) mikroangiopatska hemolitička anemija, 3) fluktuirajući neurološki simptomi, 4) poremećaj bubrežne funkcije i 5) vrućica. Ova puna klinička slika nađe se u tek 35 % slučajeva. Najčešći precipitirajući čimbenici za razvoj TTP-a su febrilna stanja, infekcije, cijepljenje, trudnoća te prekomjeran unos alkohola. Dijagnoza se postavlja na temelju kliničkih i laboratorijskih nalaza te slikovnih postupaka (CT ili MRI mozga), a potvrđuje dokazom izrazito smanjene aktivnosti ADAMTS13 (< 5 %) ili dokazom prisustva inhibitora ili protutijela IgG na ADMTS13. Osnovu liječenja čini postupak plazmafereze uz kortikosteroidnu terapiju, a u rezistentnim i recidivirajućim oblicima u obzir dolazi i liječenje rituksimabom. Više o etiopatogenezi, kliničkoj slici, dijagnozi i liječenju TTP-a navedeno je u poglavlju hematologije.
Hemolitičko uremijski sindrom (HUS) je naziv za trombotičnu mikroangiopatiju koju, slično kao i TTP, obilježava unutaržilna tromboza, potrošna trombocitopenija te mikroangiopatska hemolitička anemija. Za razliku od TTP-a, zahvaćenost mozga kod ovih bolesnika je izuzetno rijeka, a unutaržilna tromboza biva potaknuta raznim bakterijskim toksinima ili lijekovima, uz očuvanu aktivnost ADAMTS13. Klasično razlikujemo dva tipa ovoga sindroma: tipični i atipični HUS. Tipični HUS (90 %) obično nastaje kod djece nakon gastrointestinalne infekcije (E. coli, Shigella dysenteriae) potaknuta bakterijskim toksinima, dok atipični HUS (10 %) obično pogađa odrasle, a najčešće se razvija nakon respiratornih infekcija (Str. pneumoniae) te nakon uzimanja nekih lijekova (oralni kontraceptivi, ciklosporin). U kliničkoj slici dominira akutno bubrežno oštećenje uz trombocitopeniju i hemolitičku anemiju te, ovisno o zahvaćenosti, i simptomi i znakovi drugih organa. Dijagnoza se postavlja na temelju anamnestičkih podataka te kliničkih i laboratorijskih nalaza (koji uključuju i specifične imunološke pretrage). Osnovu liječenja čini plazmafereza. Više o etiopatogenezi, kliničkoj slici, dijagnozi i liječenju HUS-a navedeno je u poglavlju hematologije.
SUSTAVNE BOLESTI KOJE POGAĐAJU BUBREŽNU MIKROVASKULATURU
Nefropatija srpastih stanica nastaje kao posljedica opstrukcije unutarbubrežnih arteriola, obično onih smještenih u srži (vasa recta) srpastih eritrocita koje viđamo u sklopu anemije srpastih stanica. Posljedično se razvija hipostenurija, poremećeno zakiseljavanje mokraće, papilarna nekroza te hematurija. Intrakapilarna fragmentacija srpastih eritrocita i posljedična fagocitoza odgovorni su za razvoj promjena sličnih kao u membranoproliferativnom glomerulonefritisu. Liječenje se temelji na primjeni intravenske infuzije te korekciji elektrolitne i acidobazne neravnoteže uz primjenu diuretika.
Sklerodermija ili progresivna sustavna skleroza zahvaća bubrege u više od 50 % slučajeva, a kod 20 % tih bolesnika razvije se slika bubrežne sklerodermijske krize. Bolest obično zahvaća arkuatne arteriole te se prezentira proliferacijom medije s posljedičnim suženjem lumena i smanjenom perfuzijom. Zahvaćanje bubrega klasično se očituje postupnim razvojem i napredovanjem kronične bubrežne bolesti te se kod većine bolesnika koji razviju azotemiju unutar jedne do dvije godine započne s nadomještanjem bubrežne funkcije. Bubrežna sklerodermijska kriza je po život opasno stanje koje se prezentira naglim pogoršanjem bubrežne funkcije, arterijskom hipertenzijom, proteinurijom nefrotičkoga ranga, hematurijom i plućnom kongestijom i edemom kao posljedicom volumnoga opterećenja. Osnovu liječenja čini nadzor krvnoga tlaka (ACE inhibitori, blokatori angiotenzinskih receptora, blokatori kalcijskih kanala, vazodilatatori). U bubrežnoj sklerodermijskoj krizi lijekovi se daju parenteralno s preporukom snižavanja sistoličkoga tlaka za 20 mmHg i dijastoličkoga za 10 mmHg svakih 24 sata do normalizacije vrijednosti.
Antifosfolipidni sindrom predstavlja trombofiliju koja se očituje kao sklonost razvoju arterijskih i venskih tromboza, a posredovana je antifosfolipidnim protutijelima (antikardiolipinska protutijela, lupus antikoagulans, anti-β-2 glikoproteinsko protutijelo). Navedena protutijela usmjerena su na različite bjelančevine koji se normalno vežu na fosfolipidne sastojke na površini endotela i tako sprečavaju aktivaciju zgrušavanja te njihovom inaktivacijom stvaramo sklonost razvoju tromboze. Bubrezi, odnosno bubrežne arteriole, često su zahvaćene ovim poremećajem, što u konačnici može rezultirati poremećajem bubrežne funkcije koji se može prezentirati kao akutno bubrežno oštećenje ili kronična bubrežna bolest. Dijagnoza i liječenje opisani su u odgovarajućem dijelu.
BOLESTI BUBREŽNIH VENA
TROMBOZA BUBREŽNE VENE
Definicija. Tromboza bubrežne vene podrazumijeva stanje u kojemu dolazi do patološkoga stvaranja ugruška unutar jedne ili obje bubrežne vene i/ili njezinih glavnih segmenata. Spontana tromboza bubrežnih vena izuzetno je rijetka, uglavnom se radi o sekundarnoj pojavi uslijed različitih bolesti i stanja.
Etiopatogeneza. Uzroke možemo podijeliti u tri skupine: 1) endotelno oštećenje (trauma, homocisteniurija, endovaskularne intervencije, kirurški zahvati); 2) venska staza (tumorska kompresija, retroperitonealna fibroza) te 3) hiperkoagulabilna stanja (nefrotički sindrom, antifosfolipidni sindrom, faktor V Leiden, deficit proteina C i S). Kod velikoga dijela bolesnika s nefrotičkim sindromom javlja se tromboza bubrežnih vena kao komplikacija, a osobito kod onih uzrokovanih membranskom nefropatijom i membranoproliferativnim glomerulonefritisom. Posljedično trombozi razvija se venska opstrukcija i poremećena drenaža venske krvi, zbog čega ona zaostaje u krvnim žilama bubrega što dovodi do njegova edema i pritiska na parenhim i postupnoga gubitka bubrežne funkcije.
Klinička slika. Klinička očitovanja ponajprije ovise o opsegu zahvaćenosti i brzini razvoja tromboze i venske opstrukcije. Glavni simptomi i znakovi tromboze bubrežnih vena su nespecifični i često oponašaju nefrokolike ili pijelonefritis. Javlja se bol u slabinama, febrilno stanje, mučnina, povraćanje te hematurija. S napredovanjem se razvija slika akutnoga bubrežnog oštećenja ili kronične bubrežne bolesti.
Dijagnoza tromboze bubrežne vene često se previđa zbog nespecifičnih očitovanja. Na nju se treba misliti kod bolesnika s razvojem bubrežnoga oštećenja u prisutnosti navedenih rizičnih čimbenika i povišenih D-dimera u krvi. U akutnom zbivanju prikazuju se uvećani bubrezi. Konačnu dijagozu omogućuju slikovne pretrage kao što su doplerska ehosonografija te CT ili MRI angiografija.
Liječenje u najvećem broju slučajeva obuhvaća primjenu niskomolekulskoga heparina u terapijskim dozama te postupno prebacivanje na peroralnu antikoagulantnu terapiju varfarinom koja bi se trebala provoditi do godine dana. Fibrinolitička terapija može doći u obzir kod bolesnika kojima se dijagnoza brzo postavi i koji se prezentiraju slikom akutnoga bubrežnog oštećenja.
Cistična bubrežna bolest naziv je za heterogenu skupinu nasljednih ili stečenih bolesti koje obilježava razvoj brojnih cista na jednom ili oba bubrega. U ovome dijelu bit će opisane najčešće nasljedne cistične bolesti (adultna i juvenilna policistična bubrežna bolest, medularna cistična bolest, medularni spužvasti bubreg) te stečene, tzv. jednostavne ciste.
AUTOSOMNO DOMINANTNA (ADULTNA) POLICISTIČNA BUBREŽNA BOLEST
Definicija. Autosomno dominantna policistična bubrežna bolest (ADPBB) je nasljedna bolest koja se nasljeđuje autosomno dominantno, sa značajnom penetrantnošću i genskim izražajem, a obilježava ju razvoj cističnih formacija na različitim organima, s dominantnom zahvaćenošću bubrega. Prevalencija ove bolesti kreće se između 1:400 i 1:1000 i čini oko 5 do 10 % uzroka završnoga stupnja kronične bubrežne bolesti u razvijenim zemljama. Bolest se tipično očituje u mlađoj odrasloj dobi, obično nakon 25. godine života.
Etiopatogeneza. ADPBB nastaje kao posljedica mutacija gena koji kodiraju bjelančevine koje sudjeluju u stvaranju međustaničnih spojeva. Do sada su identificirana dva takva gena, iako slučajevi u kojima nalazimo klasičnu sliku bubrežne policistoze, ali u odsutnosti mutacije ova dva gena, sugeriraju na postojanje još jednog ili više gena koji sudjeluju u ovoj patogenezi. Radi se o genu PKD1, smještenome na 16. kromosomu, i genu PKD2, smještenome na 4. kromosomu, a koji kodiraju policistin 1 i policistin 2, bjelančevine koji sudjeluju u stvaranju međustaničnih spojeva u različitim tkivima i organima. Posljedično abnormalnostima ovih bjelančevina dolazi do poremećaja spoja između tubulskih stanica i bazalne membrane, zbog čega nastaju cistčina proširenja koja se s vremenom povećavaju, vršeći pritisak na preostali bubrežni parenhim, dok ne dovedu do klinički jasnog poremećaja bubrežne funkcije i nastanka završnog stupnja kronične bubrežne bolesti. Slične promjene nastaju i na jetri, gušterači, slezeni i epididimisu, a u 10 do 20 % ovih bolesnika nađu se i prirođene aneurizme moždanih arterija, divertikuloza crijeva i prolaps mitralnog zaliska.
Klinička slika. Bolest obilježavaobilježava dugo asimptomatsko razdoblje te se ona obično očituje u drugom ili trećem desatljeću života, a nekada i poslije. Obilježava ju napredujući tijek te se u većine bolesnika tijekom vremenskog razdoblja od 10 do 20 godina razvije završni stupanj kronične bubrežne bolesti. Bolest se najčešće dijagnosticira u asimptomatskoj fazi tijekom dijagbostičke obrade trbuha (slikovne pretrage) iz nekih drugih razloga. Osnovni simptomi i znakovi policistične bubrežne bolesti su tup bol i napetost u slabinama, što prati jasno pipljiva tumefakcija (uvećan bubreg), poliurija i nokturija, kao posljedica smanjenje sposobosti koncentriranja mokraće, te hematurija. Većina bolesnika razvije arterijsku hipertenziju. S vremenom se razvija klinička slika kronične bubrežne bolesti koja sporo napreduje prema završnom stupnju. Uz ove simptome, bolesnici mogu razviti i simptome posljedično cistama na jetri, gušterači ili slezeni, imaju veću učestalost spontanoga subarahnoidalnog krvarenja zbog moždanih aneurizmi te srčanih smetnji zbog poremećaja na srčanim zaliscima (prolaps mitralne valvule, aortna regurgitacija). Najčešće komplikacije policistične bubrežne bolesti su ponavljane mokraćne infekcije, nefrolitijaza, akutni abdomen zbog rupture cista i krvarenja te divertikulitis.
Dijagnoza se postavlja na temelju anamneze, fizikalnoga pregleda te laboratorijskih i slikovnih pretraga. Jedan od glavnih podataka kod postavljanja ove dijagoze je anamnestički podatak o prisutnosti bolesti u obitelji. Prilikom fizikalnoga pregleda moguća je palpacija povećanih bubrega. Laboratorijski nalazi krvi ovise o stupnju kronične bubrežne bolesti i prisutnosti infekcije, inače su nespecifični. Kreatininski klirens nam daje podatak o veličini glomerulske filtracije, a time i funkcijskoga stanja bubrega. U mokraći se mogu naći eritrociturija i umjerena proteinurija (manje od 1 g/dan). Konačna dijagnoza postavlja se slikovnim pretragama (ultrazvuk, kompjutorizirana tomografija, magnetna rezonancija) te genskim testiranjem, kojim se u više od 90 % slučajeva dokaže mutacija gena PKD1 ili PKD2.
Liječenje. Specifičnoga liječenja nema. Provodi se simptomatsko liječenje s naglaskom na dobroj kontroli infekcija (preporučuje se primjena fluorokinolona i kotrimoksazola zbog dobre penetracije u ciste) i arterijske hipertenzije (naglasak na supresiji sustava renin-angiotenzin-aldosteron). Nedavno je odobrena primjena inhibitora receptora za vazopresin V2 (tolvaptan), što može usporiti stvaranje cista. Simptomatsko olakašanje može se postići i perkutanom drenažom cističnih formacija ili kirurškim zahvatom. Kod nastupa završnoga stupnja kronične bubrežne bolesti primjenjuju se klasični postupci nadomještanja bubrežne funkcije.
Prognoza. ADPBB je napredujućeg tijeka i razvoj završnoga stupnja kronične bubrežne bolesti je neizbježan. Čimbenici koji ukazuju na brže napredovanje bolesti i lošiju prognozu su volumen bubrega, mlađa životna dob u trenutku postavljanja dijagnoze, muški spol, prisutnost mutacije PKD1 gena te prisutnost arterijske hipertenzije.
JUVENILNA POLICISTIČNA BOLEST
Juvenilna policistična bolest je rjeđi oblik nasljedne policistične bubrežne bolesti koji se klinički očituje rano u djetinjstvu, s incidencijom između 1:20 000 i 1:50 000 rođene djece. Ovaj oblik bolesti prenosi se autosomno-recesivno, a zahvaćeni gen nalazi se na 6. kromosomu (PKHD1 gen) i kodira jednu od podjedinica fibrocistina, bjelančevine koja, kao i policistin, sudjeluje u stvaranju međustaničnih spojeva. Klinička slika kojom dominiraju palpabilne tumefakcije uz brz razvoj zvaršnoga stupnja kronične bubrežne bolesti razvijaju se u prvim godinama života. Dijagnoza se temelji na kliničkim pokazateljima, ultrazvučnom nalazu povećanih policističnih bubrega i nalazom genske mutacije PKHD1. Specifično liječenje ne postoji, temelji se na simptomatskom liječenju i nadomještanju bubrežne funkcije. Unatoč poduzetim mjerama, dio ove djece umire u prvim godinama života, a 50 do 80 % doživi adolescenciju.
MEDULARNA CISTIČNA BUBREŽNA BOLEST
Medularna cistična bubrežna bolest rijedak je nasljedni, autosomno-dominantni poremećaj koji nastaje zbog mutacije gena MCKD1 koji se nalazi na 1. kromosomu i kodira bjelančevinu mucin te gena MCKD2 koji se nalazi na 16. kromosomu i kodira bjelančevinu uromodulin. U oba slučaja dolazi do unutarstaničnoga nakupljanja ovih bjelančevina zbog njihova otežanoga izlaska iz stanice, posljedično čemu dolazi do razvoja intersticijske fibroze i razvoja malih cističih formacija ograničeno na srž bubrega. Bolest se očituje u dobi između 20. (mutacija MCKD2) i 70. godine (mutacija MCKD1) razvojem kronične bubrežne bolesti. Kod bolesnika s mutacijom MCKD 2 karakteristično se razvija i hiperuricemija i giht. Dijagoza se postavlja na temelju anamestičkih podataka (obiteljska pojavnost bolesti), laboratorijskih nalaza (azotemija) te slikovnih postupaka, na kojima se često navedene ciste teže i uočavaju, s obzirom na njihov mali promjer. Konačna dijagnoza se postavlja na temelju nalaza genske analize. Liječenje je simptomatsko (nadomještanje bubrežne funkcije).
MEDULARNI SPUŽVASTI BUBREG
Medularni spužvasti bubreg naziv je za benignu nasljednu anomaliju koju obilježava cistična dilatacija završnih dijelova sabirnih kanalića, a koja može biti vidljiva na samo jednom ili na oba bubrega. Genski poremećaj i patogeneza su nepoznati. Zastoj mokraće u dilatiranim prostorima stvara idealne uvjete za stvaranje kamenaca i superponirane infekcije. Bolest se očituje ponavljanim infekcijama i epizodama nefrolitijaze, a dijagnosticira na temelju nalaza kompjutorizirane tomografije, rjeđe ultrazvukom (hiperdenzne papile) ili intravenskom urografijom (nakupljanje kontrasta u papilama). Liječenje nije potrebno, preporučuje se obilnija hidracija.
STEČENE JEDNOSTAVNE CISTE BUBREGA
Nalaz jednostavnih cista na bubregu tijekom ultrazvučnoga pregleda bubrega čest je nalaz i ne predstavlja značajniju patologiju. Obično se radi o sporadičnim cistama manjih dimenzija koje ne stvaraju kliničke smetnje. Točna etiologija nije poznata, smatra se da velik dio njih nastaje tijekom intrauterinoga razvoja, a kasniji čimbenici rizika su kronična bubrežna bolest, starija dob, muški spol te kronična hipokalijemija. Ciste su uglavnom asimptomatske, osim u rijetkih slučajeva kada dosežu velike dimenzije pa stvaraju lokalne kompresivne smetnje te nose rizik od rupture i krvarenja. Posebno liječenje nije potrebno, samo praćenje.
RAZVOJNI I NASLJEDNI POREMEĆAJI BUBREGA
Razvojni i nasljedni poremećaji bubrega obuhvaćaju dvije skupine bolesti: razvojne anomalije bubrega koje se primarno očituju narušenom anatomijom bubrega te nasljedne nefropatije koje se primarno očituju poremećajem specifičnih fizioloških mehanizama.
RAZVOJNE ANOMALIJE BUBREGA
Najčešće razvojne anomalije bubrega su agenezija, hipoplazija i displazija bubrega, ektopija bubrega, potkovast bubreg i putujući (mobilni) bubreg.
AGENEZIJA, HIPOPLAZIJA I DISPLAZIJA BUBREGA
Razvojne anomalije bubrega nastaju kao posljedica poremećene nefrogeneze koja se odvija od 5. do 35. tjedna gestacije. Učestalost ovih anomalija kreće se od 1:5000 do 1:10000 novorođene djece. Najčešće razvojne anomalije su agenezija, hipoplazija i displazija bubrega.
Agenezija označava potpun izostanak razvoja bubrega, dok hipoplazija i displazija označavaju nedovoljno razvijene bubrege. Hipoplaziju obilježava očuvana diferencijacija nefrona, ali je njihov ukupni broj smanjen, dok displaziju obilježava narušena diferencijacija nefrona pri čemu se stvaraju nefroni s anomalnim strukturama. Razvojne anomalije bubrega mogu se javiti kao izolirane anomalije ili mogu biti udružene s pojavom drugih anomalija u različitim genskim sindromima (Turnerov sindrom, Potterov sindrom).
Kliničke posljedice ovih anomalije ponajprije ovise o tome zahvaćaju li jedan ili oba bubrega. Jednostrane anomalije, osobito ako su izolirane, dugo su asimptomatske zbog kompenzacijske kontralateralne hipertofije i obično se prezentiraju u odrasloj dobi, dok se bilateralne anomalije očituju bubrežnim zatajenjem rano u djetinjstvu. Ne postoji specifično liječenje, nego se primjenjuju sve poznate mjere liječenja kronične bubrežne bolesti (i nadomještanje bubrežne funkcije).
BUBREŽNA EKTOPIJA
Bubrežna ektopija nastaje kao posljedica nepravilnoga smještaja jednoga ili oba bubrega. Oni mogu biti normalne građe i funkcije ili mogu biti deformirani i afunkcionalni. Mogu se nalaziti na različitim mjestima u zdjelici. Često se prezentiraju različitim bolovima u trbuhu, a presavijanje mokraćovoda može biti uzrok zastoja mokraće i čestih infekcija. U dijagnostici se ne smiju zamijeniti s tumorskom masom.
POTKOVASTI BUBREG
Potkovast bubreg razvojna je anomalija koja nastaje zbog spajanja embrionalnoga tkiva na donjem polu bubrega. Spojeni dio bubrega obično leži ispred aorte u visini 4. i 5. lumbalnoga kralješka. U kliničkom tijeku česte su infekcije mokraćnoga sustava, nefrolitijaza i hidronefroza. Dijagnosticira se različitim radiološkim pretragama (ultrazvuk, kompjutorizirana tomografija, magnetna rezonancija), a liječenje nije potrebno ako nema komplikacija. Tada se učini disekcija spoja.
MOBILNI BUBREG
Mobilni bubreg je pojava kada se bubreg koji je smješten u lumbalnoj loži spušta prema dolje u zdjelici. Među etiološke čimbenike ubrajamo asteničnu konstituciju, prirođenu slabost fiksacijskoga aparata bubrega, kojega čine fibrozna kapsula, paranefritičko tkivo te žilna petlja bubrega, a pogoduju i višestruke trudnoće.
Kliničke smetnje obično nastaju uslijed hemodinamičkih poremećaja. Simptomi su bol, i to često poput kolika, a pojačavaju se kod kretanja. Karakteristično, bol i smetnje nestaju postavljanjem pacijenta u Trendelenburgov položaj (gornji dio tijela lagano spušten) jer se bubreg vraća u svoju normalnu poziciju i nestaju hemondinamički poremećaji. Česte su i infekcije (pijelonefritis) zbog pijelorenalnoga refluksa, a može se razviti i hipertenzija.
Dijagnoza se postavlja na osnovi fizikalnoga pregleda, intravenske urografije, renalne angiografije te kompjutorizirane tomografije. Liječi se kirurški, i to samo ako su nastupile komplikacije (hipertenzija, hematurija, hidronefroza i sl.). Nefropeksija je zahvat kojime se mobilni bubreg fiksira za sedmo rebro i okolne mišiće.
NASLJEDNE NEFROPATIJE
Nasljedne nefropatije podrazumijevaju širok dijapazon genski uvjetovanih poremećaja koji mogu zahvatiti proksimalni tubul, Henleovu petlju, distalni tubul te sabirne kanaliće. U daljnjem tekstu bit će opisane najznačajnije nasljedne nefropatije.
POREMEĆAJI PROKSIMALNOGA TUBULA
Cistinurija podrazumijeva poremećaj reapsorpcije cistina u proksimalnom tubulu zbog čega dolazi do porasta njegove koncentracije u mokraći (hipersaturacija), što dovodi do stvaranja cistinskih kamenaca. Radi se o autosomno-recesivnoj bolesti koja je uvjetovana mutacijom gena koji sudjeluju u prijenosu cistina u proksimalnom tubulu, a do danas su otkrivena dva takva gena: SLC3A1 i SLC3A9. Osnovno kliničko očitovanje ovoga poremećaja je nefrolitijaza, a karakteristično se javlja već u djetinjstvu, obično do sedme godine života. Na dijagnozu treba posumnjati na temelju nalaza povišenih vrijednosti cistina u mokraći. Osnovu liječenja čini dobra hidracija i zalužnjavanje urina (kalijev citrat) i ona je dovoljna u većini slučajeva. Za bolesnike s rekurentnim epizodama cistinske nefrolitijaze u liječenje treba uključiti lijekove koji smanjuju količinu cistina u mokraći kao što su disulfid-inhibitori (merkaptoproprionglicin).
Cistinoza je autosomno-recesivni poremećaj koji nastaje zbog mutacije gena CTNS koji kodira lizosomski cistinski prijenosnik zadužen za izlazak cistina iz lizosoma, posljedično čemu dolazi do akumulacije cistina unutar lizosoma stvaranjem kristala koji dovode do staničnoga oštećenja. Među najpogođenijim organima nalaze se bubrezi (proksimalni tubul) i oči (kornea). Bolest se javlja u tri oblika: infantilni (nefropatski), adolescentni i adultni tip. Infantilni tip je najčešći oblik bolesti, očituje se već u prvoj godini života, a kliničkom slikom dominira bubrežno oštećenje. Adolescentni oblik javlja se poslije, između desete i dvadesete godine života, a kliničkom slikom dominira bubrežno oštećenje koje je manjeg stupnja, kao i znakovi kornealnoga oštećenja (fotofobija), dok je adultni tip uglavnom asimptomatski, a klinički dominira fotofobija, bez bubrežnoga oštećenja. Dijagnoza se potvrđuje nalazom povećane koncentracije cistina u krvi te genskim testiranjem. Liječenje se sastoji od primjene cisteamina koji pretvara cistin u cistein koji potom biva izbačen iz stanica. Primjena cisteamina treba početi što prije, prije nego nastanu trajna bubrežna oštećenja.
Renalna glukozurija je poremećaj kojega obilježava nalaz glukoze u mokraći u uvjetima normoglikemije i odsutnosti šećerne bolesti. Radi se o poremećaju koji nastaje kao posljedica mutacije gena SLC5A2 koji kodira natrij-glukoza kotransporter (SGLT2) u proksimalnom tubulu, posljedično čemu izostaje reapsorpcija glukoze. Bolest je benignoga karaktera, a dijagnosticira se slučajno, nalazom glukozurije uz normoglikemiju. Specifično liječenje nije potrebno.
Proksimalna renalna tubularna acidoza je poremećaj kojega obilježava oštećena reapsorpcija bikarbonata u proksimalnim tubulima zbog čega se oni pojačano gube putem mokraće, a zbog njihova manjka u krvi bolesnici su skloni razvoju metaboličke acidoze. Ovaj tip renalne tubularne acidoze može se naći u sklopu stečenih tubulopatija, ali i u sklopu nasljednih bolesti koje obilježava intracelularna akumulacija metabolita koja dovodi do oštećenja stanica (Wilsonova bolest, cistinoza, galaktosemija i sl.). Dijagnoza se postavlja laboratorijski, a glavni nalaz je metabolička acidoza (nizak pH krvi uz smanjenu koncentracija bikarbonata) uz povišen pH mokraće. Za razlikovanje od distalne renalne tubularne acidoze može se primijeniti i test frakcijskoga izlučivanja bikarbonata mokraćom koji podrazumijeva intravensku primjenu natrijevoga bikarbonata tijekom čega u proksimalnom poremećaju dolazi do porasta pH mokraće te frakcijskoga izlučivanja bikarbonata. Liječenje se sastoji od nadoknade bikarbonata (natrijev bikarbonat, 5 - 15 mmol/kg/dan) uz dodavanje kalija (kod prevelike primjene bikarbonata nastaje KHCO3 koji se pojačano gubi mokraćom). Ispravak acidoze može se pokušati i primjenom kalijevoga citrata te primjenom hidroklorotijazida koji poboljšava transportnu funkciju proksimalnih tubula.
POREMEĆAJI HENLEOVE PETLJE
Bartterov sindrom nastaje kao rezultat mutacije jednoga od pet gena koji kodiraju ionske prijenosnike u području debeloga segmenta uzlaznoga kraka Henleove petlje, tako da se razlikuje pet tipova ovoga sindroma sa specifičnim kliničkim značajkama (navedeno u Tablici 5.34.). Konačni ishod ovih genskih mutacija pojačan je gubitak elektrolita, a posebno natrija, kalija i klorida, posljedično čemu nastaju hipovolemija i elektrolitna neravnoteža koji potiču aktivaciju sustava renin-angiotenzin-aldosteron (sekundarni hiperaldosteronizam uz uredan ili snižen krvni tlak). Poremećaj se očituje većinom rano u djetinjstvu, rijetko u odrasloj dobi. Dijagnoza se postavlja na temelju isključivanja drugih poremećaja i stanja. U laboratorijskim nalazima nalazimo visoku kocentraciju natrija, kalija i klorida u mokraći, uz povećane koncentracije aldosterona i renina u krvi, uz odsutnost hipertenzije, te metaboličku alkalozu. Dijagnoza se potvrđuje genskim testiranjem. Liječenje se sastoji od primjene lijekova koji štede kalij (nesteroidni protuupalni lijekovi, spironolakton, amilorid) te malih doza ACE inhibitora ili blokatora angiotenzina II. Prema potrebi, dodatno se može vršiti nadoknada kalija, kalcija ili magnezija.
|
Tablica 5.34. Bartterov sindrom: podjela temeljena na genskim poremećajima
|
|
Tip
|
Genski poremećaj, lokus, prijenos
|
Abnormalni genski proizvod
|
|
Tip I
|
gen SLC12A1; (15q15); autosomno-recesivno
|
NKCC2 (kotransporter za natrij-kalij-klorid)
|
|
Tip II
|
gen KCNJ1; (11q24); autosomno-recesivno
|
ROMK (apikalni kalijski kanal ovisan o ATP-u)
|
|
Tip III
|
gen CICNKb; (1p36); autosomno-recesivno
|
ClC-Kb (bazolateralni kloridni kanal)
|
|
Tip IV
|
gen BSND; (1p3); autosomno-recesivno
|
bartin (podjedinica kloridnih kanala)
|
|
Tip V
|
gen CASR; (3q13); autosomno-dominantno
|
CaSR (izvanstanični receptor osjetljiv na kalcij)
|
Gitelmanov sindrom nastaje kao posljedica mutacije gena SLC12A3 koji kodira kotransporter za natrij-klorid osjetljiv na tijazid (NCCT) koji se nalazi na tankom segmentu uzlaznoga kraka Henleove petlje. Radi se o autosomno-recesivnom nasljeđivanju, a bolest se najčešće očituje u adolescenciji. Slično kao i kod Bartterovoga sindroma, dolazi do gubitka natrija i klorida s posljedičnom hipovolemijom i aktivacijom sustava renin-angiotenzin-aldosteron. Također dolazi i do gubitka magnezija, no taj mehanizam ostaje nepoznat. Klinički gledano, kod bolesnika dominiraju hipokloremijska metabolička alkaloza, hipokalijemija te hipomagnezijemija uz hipokalcijuriju. Bolesnici su zbog elektrolitnih poremećaja skloni poremećajima srčanoga ritma, sinkopama i nagloj srčanoj smrti. Dijagnoza se postavlja na temelju specifičnih elektrolitnih otklona u odsutnosti drugih bolesti i stanja, a potvrđuje se genskim testiranjem. Liječenje je istovjetno kao i za Bartterov sindrom. U rijetkim slučajevima u kojima se razvija i kronična bubrežna bolest, u završnom stupnju dolazi u obzir transplantacija bubrega, a poremećaj se ne „vraća“ u presađen bubreg.
POREMEĆAJI DISTALNOGA TUBULA
Obiteljska hipomagnezijemija s hiperkalcijurijom i nefrokalcinozom predstavlja autosomno-recesivni genski poremećaj u kojemu nalazimo mutaciju gena CLDN16 i/ili CLDN19 koji kodiraju klaudin 16 i klaudin 19, bjelančevine koje sudjeluju u prijenosu magnezija i kalcija. Posljedično njihovoj mutaciji dolazi do gubitka magnezija i kalcija (oštećena tubulska reapsorpcija) uslijed čega se razvijaju hipomagnezijemija i hiperkalcijurija koje vode u nefrokalcinozu. Bolest se očituje u djetinjstvu, a obilježavaju je hipomagezijemija refrektorna na nadomjesno liječenje, hiperkalcijurija te ponavljane epizode nefrolitijaze i mokraćnih infekcija. Bolest ima napredujući tijek i završava uremijom, a nema učinkovitoga liječenja.
POREMEĆAJI SABIRNIH KANALIĆA
Liddleov sindrom označava genski poremećaj koji se očituje mutacijom podjedinice epitelnih natrijskih kanala α, β ili γ, što se očituje njihovom prekomjernom aktivnošću, a to rezultira pojačanom reapsorpcijom natrija uz istodobni gubitak kalija. Prema tome, glava klinička obilježja ovoga sindroma su arterijska hipertenzija i hipokalijemijska metabolička alkaloza. Bolest se očituje prije 35. godine života. Na dijagnozu upućuje arterijska hipertenzija u mladosti, povećana koncentracija natrija u mokraći uz suprimirane vrijednosti renina i aldosterona, a potvrđuje se genskim testiranjem. Triamteren ili amilorid su lijekovi koji se koriste u liječenju ovoga sindroma, s obzirom na to da djeluju na natrijske kanale smanjujući njihovu aktivnost.
Distalna renalna tubularna acidoza nastaje kao posljedice oštećene sekrecije vodikovih iona u distalnom tubulu i sabirnim kanalićima, zbog čega se razvija metabolička acidoza uz istodobnu nemogućnost zakiseljavanja mokraće, zbog čega pH mokraće ne prelazi 5,5. Uz ove poremećaje često su prisutne hipokalijemija i hiperkalcijurija. Poremećaj se može javiti sporadično u sklopu oštećenja distalnoga tubula i sabirnih kanalića ili može biti obiteljski uvjetovan kao posljedica mutacije gena koji kodiraju bjelančevine koji sudijeluju u sekreciji vodika (gen SLC4A1, gen CA2). Acidoza je obično umjerenoga tipa pa se ne mora klinički očitovati. Kao posljedica hipokalcijemije i hiperkalciurije javljaju se rahitis i osteomalacija te kalcijska nefrolitijaza. Dijagoza se postavlja na temelju nalaza nejasne metaboličke acidoze (snižen pH krvi uz smanjenu koncentraciju bikarbonata) uz lužnatu mokraću (pH < 5,5). Liječenje se sastoji od primjene natrijevoga bikarbonata ili natrijevoga citrata kojima se nastoji smanjiti metabolička acidoza.
Nefrogeni dijabetes insipidus označava nasljednu nefropatiju koju obilježava djelomična ili potpuna rezistencija bubrežnih tubula na antidiuretički hormon (vazopresin), zbog čega izostaje reapsorpcija vode, prekomjerno stvaranje mokraće i opasnost od razvoja teške dehidracije. Antiduretički hormon ostvaruje svoj učinak vežući se za vazopresinski receptor tipa 2 (V2R) koji se aktivira i pokreće unutrastanične reakcije kojima se stvaraju akvaporinski kanali i omogućavaju prijelaz vode iz lumena u krvne žile. U 90 % nasljednih oblika ove bolesti radi se o X-vezanoj mutaciji gena koji kodira vazopresinski receptor tipa 2 (smanjen broj receptora, afunkcionalni receptori), dok ostale slučajeve čine mutacije akvaporinskih kanala (AVPR2, AQP2). Nasljedni oblik bolesti očituje se odmah po rođenju ili tijekom djetinjstva, a glavni znakovi su poliurija, polidipsija i dehidracija. Dijagnoza se postavlja na temelju kliničke slike i urednih ili povišenih vrijednosti antidiuretičkoga hormona u krvi. Liječenje je teško, a temelji se na smanjenju diureze i očuvanju cirkulirajućega volumena. Primjena tijazidskih diuretika uz smanjen unos tekućine može smanjiti lučenje mokraće, povećavajući proksimalnu reapsorpciju tekućine i smanjujući dolazak vode u sabirne kanaliće, a s obzirom na to da mogu dovesti do hipokalijemije, primjenjuju se zajedno s amiloridom. Također, indometacin pokazuje sposobnost smanjenoga lučenja mokraće, inhibirajući sintezu prostaglandina (smanjenje perfuzije i glomerulske filtracije).
INFEKCIJE MOKRAĆNOGA SUSTAVA
Definicija. Infekcije mokraćnoga sustava (engl. urinary tract infections, UTI) obuhvaćaju nekoliko kliničkih entiteta koji se javljaju kao posljedica djelovanja mikrobioloških uzročnika (bakterije, virusi, gljivice), a to su asimptomatska bakterijurija, cistitis, prostatitis te pijelonefritis.
Epidemiologija. Uroinfekcije su česte u svakodnevnoj kliničkoj praksi. U mlađoj, srednjoj i zreloj životnoj dobi one se češće javljaju kod žena, dok su u starijoj životnoj dobi učestalije kod muškaraca, što se povezuje s visokom prevalencijom hiperplazije prostate i opstruktivnih smetnji. Smatra se da 50 do 80 % žena iz opće populacije ima barem jednu epizodu nekomplicirane infekcije mokraćnoga sustava tijekom života, a 20 do 30 % tih žena imat će ponavljane infekcije. Porast učestalosti infekcija mokraćnoga sustava bilježi se i kod muškaraca u mlađoj životnoj dobi što se povezuje s povećanom učestalosti spolno prenosivih bolesti.
Fiziologija. Organizam posjeduje različite fiziološke mehanizme kojima se mokraćni sustav brani i štiti od naseljavanja patogenim mikroorganizmima i posljedičnih infekcija. Ti su mehanizmi sljedeći: 1) dinamika pražnjenja mjehura, 2) lužnat pH urina, 3) očuvana cjelovitost sluznice, 4) eksfolijacija površinskih stanica, 5) sekrecija imunoglobulina A te 6) prisutnost Tamm-Horsfallove bjelančevine koja dovodi do agregacije bakterija na svoju površinu, pri čemu se oni lakše odstranjuju (izmokre).
Etiologija i mikrobiologija. Infekcije mokraćnoga sustava najčešće su uzrokovane bakterijama i gljivicama, a rijetko se radi o drugim uzročnicima. Razvoju infekcija pogoduju različiti rizični čimbenici koji narušavaju normalne, fiziološke obrambene mehanizme koji priječe razvoju mokraćnih infekcija.
Rizični čimbenici koji pogoduju razvoju infekcija mokraćnih puteva su anatomska obilježja (kratka mokraćna cijev kod žena), genska predispozicija (polimorfizam gena CXCR1 za interleukin 8), kongenitalne anomalije (veziko-ureteralni refluks, fistule i sl.), osobno ponašanje (osobna higijena, promiskuitetno ponašanje), opstruktivne smetnje mokrenja (kamenci, tumori, strikture, trudnoća), prisutnost urinarnoga katetera te imunokompromitirajuća stanja.
Bakterije su najčešći uzročnici infekcija mokraćnoga sustava. Obično se radi o gram-negativnim bakterijama (Escherichia coli, Klebsiella pneumoniae, Enterobacter faecalis, Pseudomonas aeruginosa, Serratia marcescens), rjeđe gram-pozitivnim bakterijama (Staphylococcus saprophyticus, Staphylococcus aureus, Enterococcus species). U posebnu skupinu se ubrajaju i uzročnici spolno prenosivih bolesti (Chlamidia trachomatis, Neisseria gonorrhoeae, Ureaplasma urealyticum, Mycoplasma hominis).
Gljivice su rjeđi uzročnici infekcija mokraćnoga sustava, a glavni rizični čimbenici su šećerna bolest i stečeno imunonedostatno stanje (npr. imunosupresivna terapija). Candida albicans je najčešći izolat, ali mogu se naći i druge gljivice, kao što su Candida glabrata, Candida krusei, Blastomyces i drugi.
Patogeneza. S obzirom na put nastanka, infekcije mokraćnoga sustava dijelimo u dvije skupine: ascendentne i descendentne infekcije.
Ascendentne infekcije nastaju širenjem uzročnika per continuitatem iz okoline (perianalno područje, debelo crijevo, rodnica) kroz mokraćnu cijev prema proksimalnim dijelovima mokraćnoga sustava. Da bi nastale infekcije ovim putem, mora biti zadovoljen barem jedan od dva uvjeta: 1) oslabljeni i neučinkoviti fiziološki obrambeni mehanizmi kojima se mokraćni sustav brani od patogenih mikroorganizama (rizični čimbenici) ili 2) naseljavanje mokraćnoga sustava izuzetno virulentnim sojevima patogenih mikroorganizama koji odolijevaju djelovanju navedenih obrambenih mehanizama.
Descendentne infekcije nastaju širenjem uzročnika putem krvi s mjesta primarne infekcije pa se nazivaju još i hematogene infekcije, a najčešće se očituju kao pijelonefritis. Taj put nastanka infekcije je rijedak i dokumentiran je kod manje od 2 % infekcija mokraćnoga sustava. Pojavljuje se u infekciji uzročnikom tuberkuloze.
Terminologija. Prema kliničkoj slici razlikujemo asimptomatske, simptomatske i recidivirajuće (ponavljajuće) infekcije, a ovisno o pridruženim rizičnim čimbenicima razlikujemo nekomplicirane i komplicirane infekcije mokraćnoga sustava.
Asimptomatske infekcije podrazumijevaju prisutnost patogenih mikroorganizama u odsutnosti kliničkih očitovanja (asimptomatska bakterijurija), dok kod simptomatskih infekcija nalazimo jasna klinička očitovanja (uretritis, cistitis, prostatitis, pijelonefritis). Ponavljajuće infekcije mogu se javiti kao relapsi (recidiv uzrokovan istom bakterijom kao i prethodni put) te kao reinfekcija (recidiv uzrokovan novom bakterijom).
Komplicirane infekcije mokraćnoga sustava (cistitis, pijelonefritis) su sve infekcije mokraćnoga sustava koje ne pripadaju jednoj od sljedećih kategorija: 1) infekcije mokraćnoga sustava kod muškaraca, 2) infekcije mokraćnoga sustava trudnica, 3) prisutnost drugih komplicirajućih čimbenika (navedeno u Tablici 5.35.).
|
Tablica 5.35. Komplicirajući čimbenici infekcija mokraćnoga sustava
|
|
Opstrukcija
|
Nefrolitijaza, tumori, hiperplazija prostate, strikture, kongenitalne anomalije, divertikuli, ciste
|
|
Strana tijela
|
Urinarni kateter, proteze, nefrostomijski kateteri
|
|
Kronične bolesti
|
Šećerna bolest, imunosupresija, kronična bubrežna bolest, spužvasti bubreg
|
|
Ostale bolesti i stanja
|
Muški spol, trudnoća, bolnička infekcija, intervencija na mokraćnom sustavu unutar 15 dana
|
Klinička slika. Klinička očitovanja infekcija mokraćnoga sustava uključuje nekoliko entiteta: akutni uretritis i cistitis, akutni i kronični pijelonferitis, prostatitis te asimptomatska bakteriurija.
Akutni cisitis i uretritis najčešća su klinička očitovanja infekcija mokraćnoga sustava. Primarno, u kliničkoj slici dominiraju lokalni simptomi i znakovi kao što su disurija, polakisurija, mikro- ili makrohematurija, iscjedak iz mokraćne cijevi te bol i osjetljivost suprapubičnoga područja. Sustavna očitovanja, kao što je vrućica ili algični sindrom, kod ovih bolesnika izostaju.
Akutni pijelonefritis obilježen je općim simptomima, muklim i tupim bolovima u slabinama te disuričnim smetnjama. Javljaju se vrućica, tresavica i zimica, algični sindrom, a česti su i mučnina i povraćanje. Klinički pregled obilježava bolna lumbalna sukusija te pozitivan znak psoasa (pojačanje bola pri elevaciji noge). Akutnom pijelonefritisu obično prethodi epizoda akutnoga cistitisa, iako to nije pravilo.
Kronični pijelonefritis razvija se kao posljedica neprepoznatoga (neliječenog) i/ili ponavljanoga akutnog pijelonefritisa, a obilježava ga fibrozno promijenjen bubrežni parenhim i kronično propadanje bubrežne funkcije, odnosno razvoj kronične bubrežne bolesti. U podlozi obično nalazimo anatomsku ili funkcijsku abnormalnost mokraćnoga sustava.
Prostatitis je upala prostate koja se obično očituje akutnim ili kroničnim oblikom. Akutni bakterijski prostatitis obilježava visoka temperatura, jak perianalan bol te disurične smetnje, dok kronični bakterijski prostatitis ima manje izražene simptome, među kojima dominiraju pritisak i perianalan bol uz disurične smetnje koje se ponavljano javljaju tijekom razdoblja duljega od 3 mjeseca. Uz navedene simptome muškarci se mogu žaliti i na različit stupanj erektilne disfunkcije. Prostatitis je dominantno patologija kojom se bave urolozi.
Asimptomatska bakterijurija podrazumijeva klinički sindrom kojega obilježava nalaz bakterija u mokraći bez kliničkih očitovanja. Da bi govorili od signifikantnoj bakterijuriji kod žena, mora se naći više od 105 bakterija u 1 ml mokraće istoga soja u dvije uzastopne urinokulture uzete u razmaku duljem od 24 sata, dok je za muškarce dovoljan nalaz u samo jednoj urinokulturi.
Dijagnoza infekcija mokraćnoga sustava postavlja se na temelju kliničke slike, laboratorijskih i mikrobioloških nalaza te slikovnih i/ili endoskopskih pretraga.
Laboratorijski nalazi u prvom redu podrazumijevaju patološke nalaze u mokraći: pozitivni nitriti i leukocitna esteraza, leukociturija, eritrociturija, bakterijurija te nalaz leukocitnih cilindara (pijelonefritis). Kod infekcija donjih mokraćnih puteva upalni biljezi (leukociti, C-reaktivni protein) su mirni ili blago povišeni, dok su kod pijelonefritisa značajnije povišeni.
Mikrobiološka dijagnostika. Svim se bolesnicima preporuča uzeti uzorak mokraće za mikrobiološku obradu (urinokulturu) prije početka antimikrobne terapije kako bi se identificirao uzročnik te kako bi se odredila njegova osjetljivost na antibiotike (antibiogram). Iznimku od ovoga pravila čine bolesnici s jasnom kliničkom slikom cistitisa ili uretritisa kod kojih urinokultura nije presudna. Kod visokofebrilnih bolesnika i sumnje na pijelonefritis indicirano je uzimanje i hemokulture. Prema potrebi, za mikrobiološku dijagnostiku mogu se uzeti i drugi uzorci (obrisak uretre, obrisak rodnice, iscjedak, eksprimat prostate, ejakulat i dr.).
Ultrazvuk bubrega osnovni je slikovni postupak kod sumnje na akutni ili kronični pijelonefritis. U akutnom pijelonefritisu obično su bubrezi povećani i zadebljani, smanjene ehogenosti, dok su u kroničnom mali, skvrčeni i hiperehogeni.
Slikovne pretrage i endoskopska obrada indicirana je kod bolesnika sa sumnjom na anatomske anomalije ili druge komplicirajuće čimbenike infekcija mokraćnoga sustava, a to su obično bolesnici s ponavljanim infekcijama. U tu se svrhu mogu izvoditi različite pretrage: kompjutorizirana tomografija, magnetna rezonancija, intravenska urografija, cistoureteroskopija i ostale.
Liječenje. Osnovu liječenja čine primjena antimikrobnih lijekova uz preporuku obilne hidracije, obično urološkim čajem ili čajem od brusnice. U danjem tekstu prikazane su hrvatske nacionalne smjernice ISKRA za liječenje infekcija mokraćnoga sustava koje su temeljena na preporukama EUCAST-a (engl. European Society of Clinical Microbiology and Infectious Diseases) – Tablica 5.36.
Većina slučajeva se liječi ambulantno, a indikacija za hospitalizaciju i bolničko liječenje je teška klinička slika koja uključuje visoku vrućicu, visoke upalne biljege, retenciju urina, nemogućnost peroralne terapije kao i potrebu za intravenskom rehidracijom bolesnika.
Ako se započne s parenteralnom terapijom, ona se treba provoditi do kliničkoga poboljšanja (sniženje tjelesne temperature i upalnih biljega), a tada se prelazi na peroralnu. Također, započetu empirijsku terapiju treba prilagoditi antibiogramu po prispijeću nalaza.
|
Tablica 5.36. Antimikrobna terapija infekcija mokraćnih sustava prema nacionalnim smjernicama ISKRA
|
|
Klinička indikacija
|
Prvi izbor
|
Alternativa
|
|
Akutni nekomplicirani uretritis/cistitis kod žena
|
Nitrofurantion 2 x 100 mgper osper os/7 dana; ili
Fosfomicin 1 x 3 g per os jednokratno
|
Koamoksiklav 2 x 1 g per os/7 dana; ili
Cefaleksin 2 x 1 g per os/7 dana; ili
Cefuroksim 2 x 250 mg per os/7 dana; ili
Cefiksim 1 x 400 mg per os/7 dana; ili
Norfloksacin 2 x 400 mg per os/3 dana
|
|
Akutni nekomplicirani pijelonefritis
|
Ambulantno liječenje:
Koamoksiklav 2 x 1 g per os/10 -14 dana
Bolničko liječenje:
Koamoksiklav 3 x 1,2 g IV/10 - 14 dana
|
Ambulantno liječenje:
Cefuroskim 2 x 500 mg per os/10 - 14 dana
Cefiksim 1 x 400 mg per os/10 - 14 dana
Ciprofloksacin 2 x 500 mg per os/7 - 10 dana
Bolničko liječenje:
Genatmicin 1 x 4 mg/kg IV/7 - 10 dana; ili
Cefuroskim 3 x 1,5 g IV/10 - 14 dana; ili
Ceftriakson 1 x 1 - 2 g IV/10 - 14 dana; ili
Ciprofloksacin 2 x 400 mg IV/ 7 - 10 dana
|
|
Komplicirane infekcije (cistitis/pijelonefritis) u žena
|
Ambulantno liječenje:
Koamoksiklav 2 x 1 g per os/10 - 14 dana
Bolničko liječenje:
Koamoksiklav 3 x 1,2 g IV/10 - 14 dana
|
Ambulantno liječenje:
Ciprofloksacin 2 x 500 mg per os/7 - 10 dana
Bolničko liječenje:
Genatmicin 1 x 4 mg/kg IV/7 - 10 dana; ili
Ciprofloksacin 2 x 400 mg IV/7 - 10 dana; ili
Cefuroskim 3 x 1,5 g IV/10 - 14 dana; ili
Ceftriakson 1 x 1 - 2 g IV/10 - 14 dana
|
|
Akutne infekcije mokraćnoga sustava kod muškaraca sa sustavnim znacima (vrućica)
|
Ambulantno liječenje:
Ciprofloksacin 2 x 500 mg per os/14 dana
Bolničko liječenje:
Ciprofloksacin 2 x 400 mg IV/ 7 - 10 dana ±
Gentamicin 1 x 4 mg/kg IV/3 - 10 dana
|
Ambulantno liječenje:
Koamoksiklav 2 x 1 g per osper os/10 - 14 dana
Bolničko liječenje:
Koamoksiklav 3 x 1,2 g IV/10 - 14 dana; ili
Cefuroskim 3 x 1,5 g IV/10 - 14 dana; ili
Ceftriakson 1 x 1 - 2 g IV/10 - 14 dana
|
|
Infekcije mokraćnoga sustava čije smetnje odgovaraju prostatitisu
|
Ciprofloksacin 2 x 500 mg per os/4 tjedna
|
Kotrimoksazol 2 x .960 mg per os/4 tjedna (ako je uzročnik poznat i osjetljiv); ili
Koamoksiklav 2 x 1 g per os/4 tjedna; ili
Ceftibuten 1 x 400 mg per os/4 tjedna
|
|
Akutne infekcije mokraćnoga sustava kod trudnica
|
Ambulantno liječenje:
Ceftibuten 1 x 400 mg per os/7 - 14 dana
Bolničko liječenje:
Cefuroskim 3 x 750 - 1500 mg IV/7 - 14 dana
|
Ambulantno liječenje:
Koamoksiklav 2 x 1 g per os/7 dana; ili
Nitrofurantion 2 x 100 mg per os/7 dana (samo prvih 6 mjeseci trudnoće); ili
Fosfomicin 1 x 3 gper os jednokratno
Bolničko liječenje:
Ceftriakson 1 x 1 - 2 g IV/7 -14 dana; ili
Koamoksiklav 2 x 1 g per os/7 - 14 dana
|
|
Asimptomatska bakteriurija
|
Bez liječenja, osim kod trudnica, prije invazivnih uroloških i ginekoloških zahvata, kod primatelja transplantiranoga bubrega i žena s bakterijurijom koja traje 48 sati nakon odstranjenja trajnoga katetera; liječenje prema antibiogramu 3 - 7 dana. Asimptomatska bakterijurija uz leukocituriju u sedimentu ne predstavlja indikaciju za antimikrobno liječenje.
|
Profilaksa. Bolesnicima s ponavljanim infekcijama mokraćnoga sustava preporučuje se profilaksa jednim od sljedećih načina: 1) samoliječenje antibioticima 3 - 7 dana prema nalazu prethodne urinokulture i uspjehu izlječenja; 2) postkoitalna profilaksa kod žena koje imaju infekcije nakon spolnoga odnosa te 3) kontinuirana profilaksa (svaki dan, svaki treći dan). Ponavljajućim oblikom infekcije mokraćnoga sustava smatramo najmanje tri epizode nekompliciranih infekcija dokazanih urinokulturom u posljednjih 12 mjeseci ili dvije epizode u 6 mjeseci. Odabir lijeka se vrši na temelju nalaza antibiograma, a duljina profilakse trebala bi iznositi 6 mjeseci, a nekada i dulje. Obično se uzima ¼ ili ½ terapijske doze: nitrofurantion per os 50 - 100 mg per os nadan ili kotrimoksazol 480 mg/dan, ciprofloksacin 125 mgper os/dan (fluorokinolone treba davati samo iznimno).
NEFROLITIJAZA I OPSTRUKTIVNA UROPATIJA
NEFROLITIJAZA (UROLITIJAZA)
Definicija. Nefrolitijaza (lat. nephrolithiasis) naziv je za stvaranje kamenaca u mokraćnom sustavu na bilo kojoj razini, od sabirnih tubula do mokraćne cijevi. Iako nekad češće, stvaranje kamenaca u mokraćnom mjehuru danas je rijetko i gotovo su svi slučajevi vezani uz stvaranje i prisutnost kamenaca u gornjem dijelu mokraćnoga sustava.
Epidemiologija. Nefrolitijaza je često stanje u kliničkoj praksi te je broj oboljelih u stalnom porastu, osobito u razvijenim zemljama, što se povezuje sa stečenim životnim navikama, ponajprije vezanim uz ishranu. Procjenjuje se da 10 – 15 % muškaraca i 5 – 10 % žena tijekom života bar jednom razvije sliku nefrolitijaze. Bolest se češće susreće kod muškaraca nego kod žena i to u omjeru 2,5:1, a s obzirom na dob, najveća učestalost nefrolitijaze je između trećega i petog desteljeća života. Bolest je sklona recidiviranju te se procjenjuje da oko 30 – 50 % bolesnika doživi recidiv unutar deset godina od početne prezentacije.
Etiopatogeneza. Glavni etiopatogenetički događaji u procesu nastanka kamenaca u mokraćnom sustavu su sljedeći: 1) prezasićenost mokraće kristalima koji mogu međusobno agregirati i stvarati kamenac, 2) manjkavost inhibitora kristalizacije te 3) retencija kristalnih čestica. Tome pridonose različiti rizični čimbenici: lokalni (zastoj mokraće, anomalije mokraćnih puteva, ponavljane infekcije), sustavni (metabolički i endokrini poremećaji) te ostali (dehidracija i smanjen volumen mokraće, izlučivanje koncentrirane mokraće i sl.).
Prezasićenost mokraće. U nezasićenoj mokraći nema stvaranja kamenaca, ali rastom saturacije u jednom trenutku dolazi do početka nukleacije kristala što označava početak stvaranja kamenca. Nukleaciji pogoduju i organski matriks, bakterije, mukoproteini te celularni debris jer olakšavaju agregaciju kristalnih čestica.
Manjkavost inhbitora kristalizacije. U fiziološkim uvjetima u mokraći nalazimo inhibitore kristalizacije koji sprečavaju razvoj kamenaca i u uvjetima prezasićene mokraće. Takvi inhibitori mogu biti anorganski, kao što su magnezij, citrati i pirofosfat, te organski, a to su bjelančevine koje stvaraju tubulske stanice (glikozaminoglikani, nefrokalcin i dr.). Manjkavost ovih inhibitora kristalizacije stvara veliku predispoziciju za razvoj kamenaca.
Retencija kristalnih čestica. Oštećenja epitela i uklještenje kristala na vršcima papila dovodi do zadržavanja i nakupljanja kristala, što pogoduje njihovom rastu. Ovome stanju najviše pridonose patoanatomski poremećaji normalne bubrežne morfologije.
Ovisno o njihovome sastavu, razlikujemo dvije skupine kamenaca: organski i anorganski. Anorganski kamenci građeni su od kalcijevoga oksalata, kalcijevoga fosfata te magnezij-amonij-fosfata te se jasno mogu prikazati klasičnim radiološkim pretragama, dok su organski kamenci građeni od urične kiseline i cistina te se ne mogu tako lako prikazati tzv. nativnim radiološkim pretragama. U kliničkoj praksi razlikujemo četiri vrste kamenaca koji imaju svoje etiopatogenetička obilježja i rizične čimbenike: kalcijski kamenci (75 %), urični kamenci (10 %), struvitni kamenci (10 %) te cistinski kamenci (5 %).
Kalcijska nefrolitijaza. Oko 75 do 80 % bubrežih kamenaca građeno je od kalcija, najviše u obliku kalcijevog oksalata te u manjoj mjeri kalcijevoga fosfata. Glavni rizični čimbenici koji pogoduju nastaku kalcijskih kamenaca su hiperkalcijemija, hiperkalcijurija, hiperoksalurija te hipocitraturija.
Hiperkalcijemija označava stanje povećane koncentracije serumskoga kalcija, što u slučaju normalne i očuvane glomerulske filtracije rezultira hiperkalcijurijom i sklonošću prema nastanku kalcijskih kamenaca. Najčešći uzroci hiperkalcijemije su primarni hiperparatireoidizam, prekomjeran unos vitamina D i preparata kalcija, kao i drugi, rjeđi, kao što su sarkoidoza, dugotrajna imobilizacija te paraneoplastični sindrom.
Hiperkalcijurija je najčešća metabolička abnormalnost koju susrećemo kod bolesnika s kalcijskom litijazom. Označava povećanu koncentraciju kalcija u mokraći, što dovodi do prezasićenja mokraće, čime se stvara rizik za agregaciju i nastanak kamenca. Hiperkalcijurija ne mora biti posljedica hiperkalcijemije te se može razviti i bez nje. Hiperkalcijuriju u odnosu na nastanak dijelimo u tri skupine: resorptivna (pojačana resorpcija kalcija iz kosti što se može naći kod pojačanoga lučenja paratireoidnoga hormona ili kod dugotrajne imobilizacije), apsorptivna (pojačana apsorpcija kalcija iz probavnoga sustava) te bubrežna (nastaje uslijed poremećaja tubulske reapsorpcije kalcija).
Hiperoksalurija je rjeđa metabolička abnormalnost koju susrećemo kod ovih bolesnika, ali stvara predispoziciju za nastanak kamenaca građenih od kalcijevoga oksalata. Oksalati nastaju kao proizvod metabolizma glicina i askorbinske kiseline (vitamin C), a imaju velik afinitet vezivanja kalcija pri čemu nastaje kalcijev oksalat koji se luči iz organizma putem bubrega. Hiperoksalurija može nastati zbog nekoliko razloga: 1) kao posljedica prirođenoga poremećaja metabolizma glicina što rezultira povećanim stvaranjem oksalata, 2) uslijed pojačanoga unosa tvari koje sadrže oksalate (čaj, čokolada, špinat) ili se metaboliziraju u oksalate (vitamin C) te 3) uslijed probavnih bolesti koje rezultiraju povećanom propusnošću crijeva za male molekule kao što su oksalati. Pojačan unos kalcija i magnezija ima obrnut učinak, s obzirom na to da se vežu za oksalate u crijevnom lumenu i stvaraju teško topljive strukture koje se posljedično slabo apsorbiraju u krvotok.
Hipocitraturija. Citrati u mokraći imaju sposobnost vezivanja kalcija, pri čemu nastaju topljivi kompleksi koji se luče iz organizma, a pri tome se smanjuje koncentracija slobodnoga kalcija koji može stvarati kamence. Prema tome, smanjeno lučenje ili pojačana reapsorpcija citrata koja rezultira ekskrecijom citrata manjom od 320 mg/dan predstavlja rizični čimbenik za razvoj kalcijskih kamenaca. Najčešći uzroci hipocitraturije su renalna tubularna acidoza, metabolička acidoza, hipokalijemija te kronična malapsorpcija.
Urična litijaza. Bubrežni kamenci nastali kristalizacijom urične kiseline rjeđe se susreću u kliničkoj prkasi i čine oko 10 % svih bubrežnih kamenaca. Glavni rizični čimbenik za razvoj uričnih kamenaca je hiperuricemija i hiperurikozurija. Urična kiselina nastaje kao krajnji proizvod metabolizma purina koja se potom luči iz organizma putem mokraće.
Hiperuricemija označava stanje povećane koncentracije urične kiseline u krvi, a može biti primarna (urođeni poremećaj metabolizma urata koji rezultiraju njihovim nakupljanjem) te sekundarna (povećan unos purina hranom životinjskoga podrijetla ili povećano oslobađanje purina iz stanica, npr. zloćudne bolesti). Što je veći stupanj hiperuricemije, to je veći i rizik od nastanka uričnih kamenaca.
Hiperurikozurija označava povećanu koncentraciju urične kiseline u mokraći, što dovodi do hipersaturacije i rizika od kristalizacije. Najčešći uzrok hiperurikozurije je hiperuricemija, ali ona može nastati i bez nje, što se najčešće viđa kod bolesnika s renalnom tubularnom acidozom, gdje nalazimo pojačanu ekskreciju urata.
Struvitna litijaza. Struvitni kamenci građeni su od magnezij-amonij-fosfata, a njihova pojavnost povezuje se s kroničnim mokraćnim infekcijama uzrokovanim bakterijama koje imaju sposobnost lučenja enzima ureaze (Proteus, Klebsiella, Pseudomonas, Serratia, Haemophilus, Corynebacterium). Ureaza dovodi do razgradnje ureje pri čemu nastaje jaka lužina, amonijev hidroksid, koja dovodi do zalužnjavanja mokraće (pH veći od 7,2), što stvara idealne uvjete za nastanak ovih kamenaca. Rizik od nastanka struvitne litijaze imaju bolesnici skloni kroničnim mokraćim infekcijama (bolesnici s tetraplegijom, kateterizirani bolesnici, bolesnici s neurogenim mjehurom i sl.). Jedno od glavnih obilježja ovih kamenaca je njihova veličina i oblik jer su obično veći i poprimaju oblik prostora u kome se nalaze (veliki odljevni kamenci).
Cistinska litijaza. Nastanak cistinskih kamenaca povezan je s povećanom ekskrecijom aminokiseline cistina i posljedičnom hipercistinurijom. Radi se o genskom poremećaju koji se prenosi autosomno recesivno, a obilježava ga poremećaj prijenosa aminokiselina u proksimalnim tubulima (i tankom crijevu) što za posljedicu ima neprimjerenu reapsorpciju cistina iz primarne mokraće. Normalna ekskrecija cistina iznosi oko 20 mg/dan, dok je to heterozigota za ovaj poremećaj oko 100 mg/dan, a kod homozigota i do 1000 mg/dan. Solubilnost cistina održava se pri ekskreciji do 300 mg/dan, a sve više od toga rezultirat će hipersaturacijom i kristalizacijom. Ovi kamenci su obično obostrani, a najveća učestalost je u drugom i trećem desetljeću života.
Klinička slika. U pravilu je nefrolitijaza asimptomastka sve do pojave migracije konkrementa unutar mokraćnih puteva kada nastaje klasična klinička slika koju nazivamo nefrokolike. Bol nastaje kao posljedica mehaničkoga oštećenja epitela mokraćnih puteva te jakih kontrakcija glatke muskulature koje nastoje potisnuti kamenac. Veličina konkrementa ne pokazuje korelaciju s jačinom simptoma.
Nefrokolike su glavno obilježje nefrolitijaze. Očituju se kao naglo nastao i intenzivan bol u lijevoj ili desnoj lumbalnoj loži koji sijeva i širi se prema preponama i genitalima. Rjeđe se očituje kao tup i konstantan bol. Bolesnici su pri tome nemirni, tražeći položaj u kojemu je intenzitet bola najmanji. Pasažom konkrementa u donje dijelove mokraćnoga sustava intenzitet bola također se spušta i bol postaje najintenzivniji u donjem dijelu leđa i preponama, a kod ulaska konkrementa u mokraćni mjehur nastaje simptomatsko olakšanje.
Prateći simptomi i znakovi nefrokolika su disurične smetnje (učestali nagon na mokrenje, mokrenje manjih obroka mokraće), hematurija (mikrohematurija ili makrohematurija), a tijekom napada obično se javlja mučnina i povraćanje te izraženo preznojavanje. U slučaju razvoja infekcije možemo naći i vrućicu.
Komplikacije. Najčešće komplikacije nefrolitijaze su hidronefroza, infekcija te anurija (postrenalno akutno bubrežno oštećenje). Hidronefroza nastaje kao posljedica opstrukcije mokraćovoda i posljedičnoga zastojnoga nakupljanja mokraće, što može dovesti do izražene dilatacije kanalnoga sustava i posljedičnoga bubrežnog oštećenja. Infekcije su također česte jer kamenci predstavljaju dobar medij za rast bakterija, a i zastoj mokraće može uzrokovati pogoduje razmnožavanju bakterija. Anurija može nastati zbog opstrukcije oba mokraćovoda, opstrukcije jednoga mokraćovoda ako nema drugoga bubrega ili je afunkcionalan, ili uslijed opstrukcije vrata mokraćnoga mjehura. Ono se očituje slikom postrenalnoga akutnoga bubrežnog oštećenja.
Dijagnoza se temelji na osnovi anamneze, fizikalnoga nalaza, osnovnih laboratorijskih nalaza te instrumentalnih pretraga (ultrazvučna i radiološka dijagnostika). Pri određenim indikacijama potrebno je detaljna metaboličko-endokrinološka evaluacija.
Laboratorijski nalazi. U krvi se ne nalaze značajnije promjene, najčešće umjerena leukocitoza i/ili povišeni C-reaktivni protein koji nam ukazuju na infekciju mokraćnih puteva. Izolirana leukociturija može biti povezana s upornim povraćanjem koje često nalazimo kod ovih bolesnika. Ureja i kreatinin povišeni su samo u slučajevima komplicirane nefrolitijaze (opstrukcijska uropatija). Također, kod ovih bolesnika korisno je odrediti i serumske koncentracije kalcija, fosfora i urata. Najbitniji nalaz kod sumnje na nefrolitijazu je nalaz sedimenta urinamokraće. Najčešći patološki nalaz u mokraćnom sedimentu je eritrociturija (> 90 %), iako njezin izostanak ne isključuje postojanje kamenca. Ostali patološki nalazi uključuju lekocituriju, kristaluriju, poremećen pH i dr.
Ultrazvučna dijagnostika. Ultrazvuk bubrega jedan je od najčešćih slikovnih dijagnostičkih postupaka koji se provodi kod bolesnika sa sumnjom na nefrolitijazu. Glavna mu je prednost lakoća izvođenja i izbjegavanje većih doza zračenja. Ultrazvučno se mogu prikazati kamenci u bubrezima i mokraćnom mjehuru te eventualna opstrukcija mokraćnih puteva. Kamenci se prikazuju kao jasni, dobro ograničeni hiperehogeni areali s popratnim inferiornim anehogenim odjekom (fenomen sjene), što se vidi kod kamenaca većih od 5 mm, dok kod manjih kamenaca izostaje fenomen sjene te se oni teže uočavaju. Za kamence veće od 5 mm ultrazvučna dijagnostika ima osjetljivost 95 % i specifičnost 100 %. Osim u pronalaženju samih kamenaca, ultrazvuk ima ključno mjesto u otkrivanju opstrukcijskih smetnji, što se očituje proksimalnom dilatacijom mokraćovoda i kanalnoga sustava (hidronefroza). Kod dilatacije kanalnoga sustava nalazimo uvećanje samoga bubrega na račun povećanja pijelona koji je ispunjen velikom količinom mokraće, što se prikazuje kao nepravilno anehogeno područje.
Radiološka dijagnostika. Iako je u većini razvijenih zemalja temelj radiološke dijagnostike nefrolitijaze kompjutorizirana tomografija, u Hrvatskoj se ponajprije oslanjamo na nativnu radiološku snimku urotrakta te intravensku urografiju.
Nativna radiološka snimka urotrakta korisna je u dijagnostici anorganskih kamenaca koji su veći od 5 mm. U odnosu na CT dijagnostiku, pozitivan nalaz kamenaca ovim se postupkom nađe kod polovice do dvije trećine bolesnika. Izgled i gustoća kamenca na nativnoj snimci mogu ukazivati na učinkovitost postupka ESWL (od engl. extracorporeal shock wave lithotripsy, izvantjelesna litotripsija šok-valovima) liječenja (kamenci grublje građe i manje gustoće bolje reagiraju u odnosu na kamence glatke građe i veće gustoće).
Kombinacija nativne snimke urotrakta i ultrazvuka bubrega poboljšava osjetljivost u odnosu na korištenje samo jednoga postupka. Prema nekim istraživanjima, ako se kamenac ne nađe niti jednom od ove dvije pretrage, on će se sponatno eliminirati (sponatna pasaža).
Kompjutorizirana tomografija u većini zemalja predstavlja zlatni standard u dijagnostici nefrolitijaze. Nativni CT trbuha omogućuje prikaz organskih i anorganskih kamenca, njihovih veličina i anatomskih lokalizacija te pri tome ima osjetljivost od 97 % i specifičnost od 96 %. Pretraga ne traje dugo, ne zahtijeva korištenje kontrasta, ali su bolesnici izloženi velikoj dozi zračenja. Osim toga, pretraga ima i bitno mjesto u difrencijalnoj dijagnozi nefrokolika zbog moguće druge intraabdominalne patologije koja se slično klinički očituje.
Intravenska urografija daje podatke o veličini i lokalizaciji kamenca, odnosno stupnju opstrukcije. Pretraga ima svoje mjesto u planiraju daljnjega liječenja koje je u domeni urologa (ESWL, intervencijska endoskopija, operacija i dr.). Pretraga se ne izvodi u akutnoj fazi bolesti (za vrijeme nefrokolika).
Endokrinološko-metabolička evaluacija najčešće je indicirana kod bolesnika s recidivirajućom litijazom (česti recidivi, recidiv unutar jedne godine), djece te kod bolesnika s neuspjehom u liječenju litijaze. Cilj je te obrade utvrditi endokrini ili metabolički poremećaj koji pospješuje stvaranje kamenca i tako odrediti specifično liječenje. Ova evaluacija podrazumijeva određivanje serumskih koncentracija kalcija, fosfata, urata te paratireoidnoga hormona (PTH) te skupljanje 24-satne mokraće iz koje se određuje volumen, pH te koncentracija kalcija, urata, fosfata, oksalata, citrata, magnezija te sulfata. Neki autori preporučuju analizu 24-satne mokraće tri puta. Za vrijeme uzorkovanja bolesnik treba biti na slobodnom režimu prehrane te se, ako je bio na specifičnom postupku liječenja nefrolitijaze, preporučuje odgoda evaluacije za najmanje tri mjeseca.
Diferencijalna dijagnoza nefrokolika je široka i obuhvaća širok dijapazon intraabdominalnih akutnih stanja koja se mogu prezentirati jakim grčevitim bolom: akutni kolecistitis, akutni apendicitis, akutni cistitis, akutni divertikulitis, akutni pijelonefritis, akutne ginekološke bolesti te aneurizma trbušne aorte. Sličnu kliničku sliku mogu imati i neka druga stanja kao što je herpes zoster (osobito u nastajanju, prije izbijanja kožnih promjena) te koštanomišićna bol (lumbosakralni sindrom). Kod nefrokolike obavezno treba misliti na mogućnost rupture aneurizme trbušne aorte jer se u kliničkoj praksi to pokazalo kao najpogubeljniji propust u diferencijalnoj dijagnozi.
Liječenje. Osnovni terapijski pristup temelji se na rješavanju bola i uklanjanju kamenca, bez obzira na njegovu vrstu i podrijetlo, a ono uključuje primjenu lijekova i specifičnih medicinskih postupaka (nespecifično liječenje). Abnormalni nalazi endokrinološko-metaboličke evaluacije mogu zahtijevati posebne oblike liječenja i prevencije nefrolitijaze (specifično liječenje). Iako su u domeni urologa, posebno će biti opisani postupci ekstrakcije kamenaca (interventno liječenje).
Nespecifično liječenje nefrolitijaze. Glavni imperativ kod bolesnika s nefrolitijazom je suzbijanje bola, što se postiže parenteralnom primjenom nesteroidnih protuupalnih lijekova (diklofenak, ketoprofen) te spazmolitika (trospij-klorid) uz ostalu simptomatsku terapiju (npr. antiemetici). Osnovna preporuka kod ovih bolesnika uključuje obilnu hidraciju koja podrazumijeva unos više od 2 l tekućine na dan, najčešće u obliku vode ili čaja (urološki čaj, čaj od brusnice). Također, preporučuje se restrikcija unosa soli i bjelančevina životinjskoga podrijetla, a ne preporučuje se restrikcija unosa kalcija (smanjen unos kalcija dovest će do kompenzacijske reapsorpcije kalcija uz kostiju). Kamenci manji od 5 mm imaju tendenciju spontane pasaže uz navedene postupke pa zahtijevaju samo nadzor i praćenje - bolesnici se puštaju na kućno liječenje uz preporuku da obrate pozornost pri mokrenju kako bi uočili kamenac, npr. mokrenje preko gaze. Ako su kamenci veći od 5 mm ili izostane spontana pasaža ili su prisutne komplikacije (infekcija, opstrukcija) indicirana je aktivna ekstrakcija kamenca, što uključuje lijekovima potpomognutu ekspulziju kamenca, endoskopsku intervenciju, primjenu postupka ESWL, perkutanu nefrolitotomiju ili operativno liječenje. Navedene postupke rješavanja kamenaca opisane su poslije, a u domeni su urologa.
Specifično liječenje nefrolitijaze temelji se na rezultatima endokrinološko-metaboličke evaulacije bolesnika. Određeni abnormalni nalazi zahtijevat će i određene medicinske postupke i liječenje.
Hiperkalcijurija zahtijeva povećan unos tekućine te smanjen unos bjelančevina životinjskoga podrijetla i soli. Danas se ne preporučuje restrikcija unosa kalcija zbog kompenzacijske reapsorpcije kalcija iz kostiju u slučaju smanjenja unosa kalcija u organizam, što su pokazala brojna istraživanja (manja stopa recidiva kalcijske litijaze kod bolesnika koji su bili na dijeti koja je sadržavala unos 1200 mg kalcija na dan u odnosu na bolesnike koji su imali restrikciju unosa kalcija od 400 mg na dan). Kod bolesnika s recidivnom kalcijskom litijazom i dokazanom hiperkalcijurijom opravdana je primjena tijazidskih diuretika koji povećavaju reapsorpciju kalcija u proksimalmom tubulu i tako smanjuju koncentraciju kalcija u urinu.
Hiperoksalurija (> 0,55 mmol ili 50 mg u 24-satnom urinu) je rjeđa abnormalnost koju susrećemo kod ovih bolesnika, a zahtijeva izbjegavanje unosa hrane koja sadrži oksalate (čaj, čokolada, špinat) te tvari koje se metaboliziraju u oksalate (vitamin C). Preporuča se i pojačan unos kalcija i magnezija (stvaraju komplekse s oksalatima u crijevima i smanjuju mogućnost apsorpcije oksalata u krvotok).
Hiperurikozurija (koncentracija urata veća od 4,70 mmol ili 800 mg u 24-satnom urinu) zahtijeva ograničenje unosa mesa i mesnih proizvoda (bogat izvor purina) uz unos hrane koja dovodi do zalužnjavanja mokraće (voće, povrće). Zalužnjavanje urina može se postići i medikamentozno (oralni unos 20 do 30 mEq bikarbonata 2 – 3 x/dan ili 20 do 30 mEq kalijeva citrata 2 – 3 x/dan). U uvjetima hiperuricemije u terapiju se uvodi i alopurinol (100 - 300 mg/dan).
Hipocitraturija definira se kao koncentracija citrata manja od 1,7 mmol (320 mg) u 24-satnoj mokraći. Kod ovih bolesnika preporučuje se smanjenje unosa bjelančevina životinjskoga podrijetla (meso) uz pojačan unos voća i povrća, a na raspolaganju je i primjena kalijevoga citrata (20 do 30 mEq 2 – 3 x/dan).
Hipercistinurija podrazumijeva koncentraciju cistina u 24-satnoj mokraći veću od 400 mmol (60 mg). Kod ovoga poremećaja preporučuje se pojačan unos tekućine (više od 4 l/dan) te u nekim slučajevima primjena lijekova koji smanjuju količinu cistina u mokraći kao što su disulfid-inhibitori (merkaptoproprionglicin).
Interventno liječenje ureteralnih kamenaca. Kamenci koji su u svom promjeru manji od 5 mm imaju tendenciju sponatne pasaže. Veći kamenci zahtijevaju neki od intervencijskih postupaka: medikamentna ekspulzija, ureteroskopska intervencija ili ESWL.
Medikamentna ekspulzija podrazumijeva lijekovima potpomognutu spontanu pasažu kamenaca. Temelji se na primjeni alfa-blokatora (tamsulozin 0,4 mg/dan), nesteroidnih protuupalnih lijekova (ibuprofen 3 x 600 mg/dan) te kortikosteroida (prednizon 10 mg/dan 4 do 5 dana). Navedeni lijekovi djeluju relaksirajuće na mokraćovod te imaju protuupalni i analgetički učinak te tako olakšavaju simptome i potpomažu spontanu pazažu kamenca. Ako se ne postigne željeni učinak tijekom četiri tjedna ili se pojave neke od komplikacija (infekcija, opstrukcija), indicira se neki od interventnih postupaka.
Ureteroskopska intervencija je endoskopski postupak pri kojemu se endoskopskim uređajem ulazi u mokraćovod, vizualizira konkrement te instrumentalno odstrani s ili bez prethodne fragmentacije (obično uz pomoć lasera).
ESWL je postupak koji podrazumijeva primjenu vanjske energije fokusirane na kamenac uz pomoć fluorokospije ili ultrazvuka te tako dovodi do njegove fragmentacije i sponatne pasaže malih fragmentiranih ostataka. Postupak se ne preporučuje ženama u reproduktivnoj dobi zbog nepoznata učinka na ovarije.
Interventno liječenje bubrežnih kamenaca. Bubrežni kamenci koji ne prave simptome i nisu praćeni komplikacijama (infekcija, opstrukcija) ne zahtijevaju promptno interventno liječenje, već se preporučuje praćenje. Ako rastu, postanu simptomatski ili dovedu do razvoja komplikacija preporučuje se interventno liječenje. Kamenci koji su u promjeru manji od 1,5 cm pogodni su za liječenje postupkom ESWL-a, dok oni veći od 1,5 cm zahtijevaju perkutanu nefrolitotomiju. Radi se o invazivnom postupku pri kojemu se igla pod nadzorom rendgena ili ultrazvuka uvodi u željeni bubrežni kaliks uz dilataciju i plasiranje nefroskopa. Nefroskop omogućuje vizualizaciju kamenca, ali i fragmentaciju i ekstrakciju. Periproceduralno se preporučuje primjena antibiotičke terapije. Najčešće komplikacije su infekcije i krvarenje.
OPSTRUKTIVNA UROPATIJA (NEFROPATIJA)
Definicija. Opstruktivna uropatija je naziv za poremećaj koji nastaje uslijed mehaničkih ili funkcionalnih smetnji slobodnom protoku mokraće koji može nastati na bilo kojoj razini mokraćnoga sustava, od bubrežnih nakapnica pa sve do vanjskoga ušća mokraćne cijevi. Kada opstruktivna uropatija rezultira oštećenjem bubrežne funkcije, govorimo o opstruktivnoj nefropatiji. Ovisno o brzini razvoja opstrukcije razlikujemo akutnu i kroničnu opstruktivnu uropatiju. Opstruktivna uropatija predstavlja 2 % uzroka kronične bubrežne bolesti koja zahtijeva neki od oblika nadomještanja bubrežne funkcije.
Etiologija. Opstruktivna uropatija može biti uzrokovana mehaničkim (strukturnim) smetnjama otjecanja mokraće ili funkcijskim poremećajima pa možemo govoriti o mehaničkoj i funkcijskoj opstruktivnoj uropatiji.
Mehanička opstruktivna uropatija može biti uzrokovana različitim patološkim stanjima koje možemo podijeliti u tri skupine: intraluminalni (kamenac, krvni ugrušak, tumorska tvorba, stanični detritus), intramuralni (prirođene ili stečene strikture, kongenitalne valvule) te ekstraluminalni (pritisak tumorom, aneurizmom, retroperitonealna fibroza, hiperplazija i tumori prostate, fimoza).
Funkcijska opstruktivna uropatija nastaje kao rezultat neuromuskularnoga oštećenja i/ili poremećaja centra za mokrenje u sakralnom dijelu kralješnične moždine i ponsu. Neki od najčešćih uzroka su trauma i oštećenja kralješnične moždine, dijabetička neuropatija, neurološke i psihijatrijske bolesti te neki lijekovi (alfa-adrenregički lijekovi, antikolinergički lijekovi, opijati).
Patofiziologija. Opstrukcija mokraćnoga sustava uz čuvano stvaranje mokraće dovodi do postupnoga povišenja intraluminalnoga tlaka proksimalno od mjesta opstrukcije, što dovodi do postupne dilatacije (hidroureter, hidronefroza). Povišenje tlaka i dilatacija kanalnoga sustava unutar bubrega vrši mehanički pritisak na bubrežni parenhim, pri čemu dolazi do oštećenja najprije tubula, a kasnije i glomerula, a mehanizam takvoga oštećenja uključuje ishemiju, brojne vazoaktivne medijatore (angiotenzin II, tromboksan A2), kao i otpuštanje citokina koji dovode do kemotaksije upalnih stanica, pretežno monocita i makrofaga koji svojom aktivacijom i djelovanjem pridonose daljnjem oštećenju. Kada se na vrijeme razriješi opstrukcija, promjene su reverzibilne, no ako opstrukcija traje dulje od 4 do 6 tjedana dolazi do ireverzibilnih promjena (fibroza) i trajnoga oštećenja bubrežne funkcije. Ako se radi o nepotpunoj opstrukciji, porast tlaka je postupan, kao i dilatacija, pri čemu može doći do znatnijega proširenja kanalnoga sustava, a da sam bubrežni parenhim ostane dostatan za vršenje osnovne funkcije. Tada se dominantno javlja tubulska disfunkcija koja se očituje smanjenom sposobnošću koncentriranja mokraće. Da bi se razvilo akutno bubrežno oštećenje (akutna opstrukcija) ili kronična bubrežna bolest (kronična opstrukcija), mjesto opstrukcije mora biti na razini mokraćnoga mjehura ili niže ili se mora raditi o obostranoj opstrukciji mokraćovoda i/ili pijelona ili pak jednostranoj opstrukciji mokraćovoda i/lii pijelona kod bolesnika sa solitarnim bubregom ili afunkcionalnim kontralateralnim bubregom.
Klinička slika. Akutnu opstrukciju obilježavaju jače izraženi simptomi koje, u prvom redu, obilježava bol čija obilježja ovise o uzroku i mjestu opstrukcije. Načelno, opstrukciju gornjih dijelova mokraćnoga sustava (pijelon, ureter) prati jače izražen oštar bol u slabinama koji se širi prema preponama, dok opstrukciju donjih dijelova mokraćnoga sustava prati slabije izražen, tup bol (poslije se kod velike distenzije mokraćnoga mjehura žale na suprapubičnu bol). Bol mogu pratiti smetnje mokrenja (otežano mokrenje, češće mokrenje manjih količina mokraće) ili razvoj oligurije/anurije. Da bi se razvila oligo/anurija, mora se raditi o niskoj opstrukciji, obostranoj visokoj ili jednostranoj visokoj opstrukciju uz afunkcionalan kontralateralni bubreg. Kroničnu opstrukciju prate slabije izraženi simptomi, bolovi su slabijega intenziteta, a dominiraju znaci tubulske disfunkcije (poliurija, nokturija). Kao jedna od najčešćih komplikacija opstrukcije mokraćnih puteva javlja se infekcija koja obično dovodi do razvoja febrilnoga stanja. Ako se opstrukcija ne razriješi na vrijeme, razvija se slika akutnoga bubrežnog oštećenja ili kronične bubrežne bolesti.
Dijagnoza se postavlja na temelju anamnestičkih podataka, fizikalnoga pregleda, laboratorijskih nalaza te slikovnih dijagnostičkih pretraga. Anamnestičkim podacima obuhvaćamo simptome kojima se bolesnik očituje, prethodne epizode simptoma i eventualne uzročne bolesti (nefrolitijaza, hiperplazija prostate). Fizikalni pregled kod nekih bolesnika otkriva uvećan bubreg ili palpatoran mokraćni mjehur. Laboratorijski nalazi ovise o trajanju opstrukcije, najčešće su uredni, dok se poslije može naći povećana serumska koncentracija dušičnih metabolita, hiperkalijemija, metabolička acidoza, anemija kronične bolesti te patološki nalaz u mokraćnom sedimentu (eritrociturija, leukociturija). Ultrazvuk mokraćnoga sustava je postupak izbora u dijagnostici opstruktivne uropatije s obzirom na dostupnost, jednostavnost, neštetnost i ekonomičnost. Na ultrazvučnom pregledu jasno se može prikazati dilatacija kanalnoga sustava, kao i mokraćovoda te izmjeriti količina mokraće u mokraćnom mjehuru, a vrlo često se može naći i uzrok (kamenac, tumor). Na temelju ovih dijagnostičkih pretraga postavlja se radna dijagnoza opstruktivne uropatije, a u procjeni same etiologije na raspolaganju su nam i drugi dijagnostički postupci: kompjutorizirana tomografija, magnetna rezonancija, intravenska urografija te endoskopske pretrage (cistoureteroskopija).
Liječenje opstruktivne uropatije je u domeni urologa, a glavni cilj je razriješiti uzrok i omogućiti normalno otjecanje mokraće te tako spriječiti daljnje oštećenje bubrežne funkcije. Osnovni korak je stabilizacija bolesnika, odnosno ispravak patoloških nalaza (azotemija), bilo konzervativnim liječenjem, bilo primjenom hemodijalize uz privremeno omogućivanje otjecanja mokraće urinarnim kateterom, cistostomom ili nefrostomom. U slučaju postojanja infekcije indicirana je i antibiotska terapija. Definitivno liječenje ovisi o uzroku i u domeni je urologa.
TUMORI MOKRAĆNOGA SUSTAVA
Tumore mokraćnoga sustava dijelimo na tumore bubrega i tumore odvodnih dijelova mokraćnoga sustava (pijelon, mokraćovod, mokraćni mjehur). Prema biološkom ponašanju oni mogu biti dobroćudni i zloćudni. U nastavku teksta bit će opisani osnovni dobroćudni tumori bubrega, karcinom bubrežnih stanica te karcinom mokraćnoga mjehura. Ti su tumori u Hrvatskoj primarno predmet zanimanja urologa i onkologa.
DOBROĆUDNI TUMORI BUBREGA
Dobroćudni tumori bubrega u kliničkoj praksi imaju malo kliničko značenje, a najbitnije ih je razlikovati od zloćudnih tumora. Najčešći dobroćudni tumori bubrega su angiomiolipom, onkocitom te jukstaglomerulski tumor.
Angiomiolipom (hamartom bubrega) je dobroćudni tumor bubrežnoga parenhima građen od različitih vrsta tkiva (krvne žile, glatkomišićne stanice te masno tkivo) koji se može javiti samostalno ili rjeđe u sklopu tuberozne skleroze, rijetke nasljedne bolesti koja se prenosi autosomno dominantno (gena mutacije TSC1 i TSC2), a koju obilježavaju neurološka očitovanja uz pojavu brojnih dobroćudnih tumora po tijelu. Pretežito se radi o solitarnim tumorima, iako mogu biti i multipli te se mogu javiti istodobno na oba bubrega. Obilježava ih polagan neinfiltrativni rast. Obično su asimptomatski i dijagnosticiraju se slučajno tijekom slikovnih dijagnostičkih pretraga trbuha iz nekih drugih razloga. Simptomatski mogu postati tek kod većih dimenzija ili uslijed krvarenja u sam tumor ili retroperiteoneum, a glavni simptomi su bolovi u lumbalnom području. Dijagnoza se postavlja na temelju ultrazvučnoga nalaza ili nalaza kompjutorizirane tomografije (karakteristični nalaz je hiperehogenost na ultrazvuku i smanjena gustoća na CT-u uslijed veće količine masnoga tkiva unutar tumora). Liječenje ovisi o veličini tumora i sumnji na zloćudnost. Kod većih (simptomatskih) tumora i u slučajevima kada se ne može jasno razgraničiti od zloćudnoga tumora na temelju slikovnih nalaza, indicirano je kirurško liječenje.
Onkocitom bubrega je rijedak dobroćudni tumor bubrega građen od tubulskih stanica ispunjenih mitohondrijima koji se pojavljuje rijetko u srednjoj i starijoj životnoj dobi, nešto češće kod muškaraca. Tumor se može pojaviti solitarno, nepoznate etiologije ili multiplo (obično i obostrano), kada se javlja u nekih genskih sindroma kao što su tuberozna skleroza i Brit-Hogg-Duble sindrom. Pojava ovoga tumora povezuje se s mutacijama mitohondrijske DNK. Klinička slika je obično asimptomatska, a rjeđe se očituje kao bol u slabinama, hematurija ili palpabilna masa u trbuhu. Dijagnoza se obično postavlja slučajno tijekom slikovne pretrage trbuha iz nekoga drugog razloga. Slikovnim pretragama (CT, MRI) nekada je teško razlikovati onkocitom bubrega od karcinoma (tipičan je angiografski nalaz poput žbica na kotaču), kada se indicira operativni zahvat i patohistološka dijagnostika u smislu diferenciranja.
Jukstaglomerulski tumor ili reninom je dobroćudni tumor bubrega građen od stanica jukstaglomerularnoga aparata, koji zadržava biološku aktivnost i luči renin. Radi se o iznimno rijetkom tumoru (manje od 100 prikazanih slučajeva) koji se najčešće javlja kod mlađih odraslih s predominacijom kod muškaraca. Tumor može biti asimptomatski, a glavna klinička očitovanja posljedica su hiperreninemije pa se javlja tvrdokorna sekundarna hipertenzija te sekundarni hiperaldosteronizam. Dijagnoza se postavlja na temelju kliničkih obilježja, povećane koncentracije renina u krvi te nalazom tumora na slikovnim pretragama (UZV, CT, MRI). Liječenje je kirurško, a prognoza dobra.
KARCINOM BUBREŽNIH STANICA (HIPERNEFROM)
Definicija. Karcinom bubrežnih stanica (hipernefrom) je najčešći zloćudni tumor bubrega koji nastaje od epitelnih stanica bubrežnih tubula. Čini 2,6 % svih karcinoma u odrasloj populaciji, češće se javlja kod muškaraca (omjer muškarci:žene je 2:1), obično između petoga i sedmog desetljeća života. Češće se pojavljuju u razvijenijim zemljama s porastom incidencije u posljednjih tridesetak godina.
Etiologija. Karcinom bubrežnih stanica može se javiti u dva oblika: sporadični i nasljedni. Najčešće se pojavljuje sporadično, a kao glavni rizični čimbenik navodi se pušenje, a ostali mogući rizični čimbenici su izloženost azbestu, ugljikovodicima (petrolej), pretilost, estrogenska terapija i arterijska hipertenzija. Rjeđe, karcinom bubrega se pojavljuje nasljedno, u sklopu genskih sindroma. Obično se javlja u sklopu von Hippel-Lindauovoga sindroma, autosomno dominantne bolesti koja nastaje zbog mutacije tumor-supresorskoga gena VHL te je udružena s pojavom neuroendokrinih tumora, hemangioblastoma središnjeg živčanoga sustava i retine te cistadenoma gušterače i epididimisa.
Patologija. Ovisno o patomorfološkim obilježjima, staničnom podrijetlu i genskim promjenama, danas se razlikuje tri osnovna tipa karcinoma bubrežnih stanica (svjetlostanični, papilarni i kromofobni), a osnovna obilježja prikazana su u Tablici 5.37. Karakteristično patološko obilježje ovih karcinoma je sklonost unutaržilnom napredovanju tumora duž bubrežnih vena i donje šuplje vene.
|
Tablica 5.37. Vrste karcinoma bubrega
|
|
Vrsta karcinoma
|
Stanično podrijetlo
|
Kliničko-patološka obilježja
|
|
Svjetlostanični karcinom
|
Epitelne satnice proksimalnoga tubula
|
Učestalost: 60 %
Citogenetika: 3p-, 5q+, 14q-
Solitaran, različitih dimenzija, zlatno-žute boje
PHD izgled: acinarni, sarkomatoidni
|
|
Papilarni karcinom
|
Epitelne satnice proksimalnoga tubula
|
Učestalost: 5 – 15 %
Citogenetika: +7, +17, -Y
Obostrani, multifokalni
PHD izgled: papilarni, sarkomatoidni
|
|
Kromofobni karcinom
|
Epitelne stanice distalnoga tubula i sabirnih kanalića
|
Učestalost: 5 – 10 %
Citogenetika: nespecifične promjene
Solitaran, dobro ograničen, bez kapsule, smećkast
PHD izgled: tubularni, sarkomatidni
|
Stupnjevanje (staging). Ovisno oproširenosti bolesti, razlikujemo četiri stupnja bolesti: stupanj I (tumor manji od 7 cm, ograničen na bubreg), stupanj II (tumor veći od 7 cm, ograničen na bubreg), stupanj III (tumor probija bubrežnu kapsulu, ali se nalazi unutar Gerotove fascije i/ili zahvaća jedan hilarni limfni čvor) te stupanj IV (tumor koji probija Gerotovu fasciju, prisutne udaljene metastaze, zahvaćanje više limfnih čvorova).
Klinička slika. Tumori su dugo asimptomatski i obično se slučajno otkriju (incidentalom) prilikom slikovnih dijagnostičkih pretraga koje se rade iz nekih drugih razloga. Simptomi i znakovi koji se mogu javiti su hematurija, mukli lumbalni bol te palpabilna abdominalna tumefakcija, a karakteristični su u kasnijim fazama bolesti. Nekada je prvi znak bolesti bezbolna mikro/makrohematurija. Ostali simptomi i znakovi koji često prate ovaj karcinom su nejasna febrilna stanja, varikocela te gubitak na tjelesnoj masi. Kod 20 % bolesnika pojavljuju se i paraneoplastički sindromi, a nekada su oni i prvi znak bolesti. Nastaju kao posljedica lučenja različitih biološki aktivnih tvari, a najčešći su hiperkalcijemija, arterijska hipertenzija, eritrocitoza i policitemija, ginekomastija, Cushingov sindrom te reverzibilna nemetastatska disfunkcija jetre (Staufferov sindrom).
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza te slikovnih pretraga, dok je biopsija rijetko indicirana. Klinički, svaka hematurija koja se ne može objasniti uroinfektom, a osobito ako se radi o bezbolnoj hematuriji, treba pobuditi sumnju na karcinom bubrega. Laboratorijski nalazi u krvi su nespecifični i mogu uključivati ubrzanu sedimentaciju eritrocita, anemiju kronične bolesti ili eritrocitozu, hiperkalcijemiju i sl. Laboratorijski nalazi u mokraći uključuju eritrocituriju, a citološkim pregledom mogu se naći maligne stanice (iako ne uvijek). Slikovne pretrage uključuju ultrazvuk, kompjutoriziranu tomografiju ili magnetnu rezonanciju trbuha i male zdjelice. Svaka tumefakcija koja se nađe na slikovnim pretragama smatra se karcinomom dok se on ne isključi. Većinom se ta razlika može uočiti na temelju nalaza CT-a ili MRI-a, a u svim nejasnim situacijama indicirana je biopsija ili kirurška resekcija. Ako se sumnja na karcinom bubrežnih stanica treba provesti dodatnu dijagnostiku u smislu procjene proširenosti bolesti: kompjutorizirana tomografija prsišta i trbuha, scintigrafija skeleta te eventualno druge pretrage ovisno o indikaciji.
Liječenje ovisi o proširenosti bolesti. Lokalizirana bolest (stupanj I i II) podrazumijeva kirurško liječenje kao osnovnu liniju liječenja, dok se adjuvantna kemoradioterapija ne provodi. Pri tome se izvodi totalna (radikalna) ili parcijalna nefrektomija. Parcijalna nefrektomija preferira se kod tumora manjih dimenzija, bolesnika sa solitarnim bubregom te bolesnika sa značajnom bolesti kontralateralnoga bubrega, s ciljem očuvanja ostatne bubrežne funkcije. Totalna (radikalna) nefrektomija indicirana je kod bolesnika s tumorima većim od 7 centimetara te kada se parcijalna nefrektomija ne može tehnički izvesti. Proširena (metastatska) bolest (stupanj III i IV) primarno se liječi medikamentno, dok je kirurško liječenje od manjega značaja i obično se provodi u palijativne svrhe (redukcija tumorske mase). Osnovu liječenja donedavno je činila citokinska terapija (interleukin-2, interferon-α), dok danas temelj liječenja čine inhibitori tirozin kinaze (sunitinib, sorafenib) u prvoj liniji i mTOR inhibitori (temsirolimus, everolimus) u drugoj liniji. U slučaju metastaza u kostima i mozgu primjenjuje se palijativna radioterapija.
Prognoza ovih bolesnika ovisi o vrsti tumora, stupnju bolesti te prisustvu nepovoljnih prognostičkih čimbenika. Histološki gledano, najnepovoljniju prognozu ima svjetlostanični karcinom koji slijedi papilarni karcinom, dok najbolju prognozu ima kromofobni karcinom. Glavni nepovoljni prognostički čimbenici su: 1) narušeno opće tjelesno stanje bolesnika, 2) povišene vrijednosti laktat dehidrogenaze, 3) smanjena serumska koncentracija hemoglobina, 4) hiperkalcijemija te 5) izostanak nefrektomije. Bolesnici koji nemaju niti jedan nepovoljni prognostički čimbenik imaju medijan preživljenja od 24 mjeseca, s jednim ili dva čimbenika 12 mjeseci, a s tri i više 5 mjeseci.
KARCINOM MOKRAĆNOGA MJEHURA
Definicija. Karcinom mokraćnoga mjehura je maligni tumor podrijetla epitelnih stanica koji se može javiti u nekoliko oblika: karcinom prijelaznoga epitela (95 %), karcinom pločastih stanica (3 %), adenokarcinom (2 %) te karcinom malih stanica (< 1 %). Češće se javlja kod muškaraca (s omjerom 3:1), obično u šestom i sedmom desetljeću života.
Etiologija. Kao i kod ostalih malignih tumora, točan etiopatogenetički mehanizam nastanka tumora nije poznat, ali su zato definirani rizični čimbenici. Najznačajniji je, kao i kod karcinoma bubrežnih stanica, pušenje, dok se kao ostali spominju izloženost anilinskim bojama, određenim lijekovima (fenacetin, ciklofosfamid), infekcija parazitom Schistosoma haematobium te izloženost zračenju. Nalaze se i kod bolesnika s nefropatijom aristolohične kiseline.
Patologija. S obzirom na patohistološka obilježja, karcinomi mokraćnoga mjehura dijele se različite skupine. Prema histološkoj građi i podrijetlu dijele se na karcinome prijelaznoga epitela (95 %), karcinome pločastih stanica (3 %), adenokarcinome (2 %) i karcinome malih stanica (< 1 %). Prema proširenosti u trenutku dijagnoze dijele se u tri skupine: superficijalni (75 %), mišićno-invazivni (20 %) te metastatski (5 %). S obzirom na stupanj diferenciranosti dijele se u dvije skupine: karcinomi niskoga i visokog stupnja diferenciranosti.
Klinička slika. Karcinom mokraćnoga mjehura dugo ne daje nikakve simptome, a najčešće prvo kliničko očitovanje je bezbolna hematurija. Mogu se javiti i disurične smetnje (disurija, polakisurija), a nekada se može očitovati i opstruktivnom uropatijom. Češća je učestalost infekcija i bubrežnih kamenaca.
Dijagnoza se postavlja na osnovi kliničke slike, citološkoga nalaza mokraćnoga sedimenta, slikovnih pretraga male zdjelice (kompjutorizirana tomografija, magnetna rezonancija) te endoskopske dijagnostike (cistoskopija, ureteroskopija) s biopsijom i patohistološkom analizom uzorka.
Liječenje se temelji na proširenosti karcinoma. Karcinomi koji ne invadiraju mišićni sloj u prvom se redu liječe potpunom endoskopskom resekcijom tumora s ili bez intravezikalne terapije. Intravezikalna terapija podrazumijeva lokalnu primjenu imunoterapeutika ili kemoterapeutika putem urinarnoga katetera. Najčešće se primjenjuju mitomicin, doksorubicin, valrubicin te Bacillus Calmette-Guerin (BCG). Nakon provedene terapije bolesnici se redovno endoskopski kontroliraju svaka tri mjeseca prvih godinu dana zbog visoke stope recidiva. Karcinomi koji invadiraju mišićni sloj liječe se kirurški (totalna ili parcijalna cistektomija) uz sustavnu kemoterapiju (cis-platina) i/ili radioterapiju. U novije vrijeme primjenjuje se i sustavna imunoterapija.
Prognoza ponajprije ovisi o proširenosti i stupnju diferencijacije tumora. Najbolju prognozu imaju bolesnici sa superficijalnim oblikom karcinoma kojima se tumor u cijelosti endoskopski odstrani, dok metastatska bolest ima petogodišnje preživljenje manje od 15 %.
- Appel GB., Radhakrishnan J. Glomerular disorders and nephrotic syndromes. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 783-793.
- Arnaout MA. Cystic kidney diseases. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 816-822.
- Bašić-Jukić N., Kes P. Fabryjeva bolest. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 279-283.
- Batinić D. Bolest minimalnih lezija. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 85-95.
- Becker GJ et al. Advances in urine microscopy. Am J Kidney Dis. 2016 Jun;67(6):954–64.
- Bierzynska A et al. Recent advances in understanding and treating nephrotic syndrome. F1000Res. 2017 Feb 9;6:121.
- Boršo G., Prkačin I. Infekcije mokraćnog sustava. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1118-1122.
- Božić B., Tišljar M., Galešić K. Brzoprogresivni glomerulonefritis. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 187-196.
- Bushinsky DA. Nephrolithiasis. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 811-816.
- Caliskan Y et al. Novel biomarkers in glomerular disease. Adv Chronic Kidney Dis. 2014 Mar;21(2):205–16.
- Cerovac M., Anić B. Specifično liječenje bolesti bubrega. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 67-83.
- Cohen D., Valeri AM. Treatment of irreversible renal failure. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 841-847.
- Correa-Rotter R et al. CKD of unknown origin in Central America: the case for a Mesoamerican nephropathy. Am J Kidney Dis. 2014 Mar;63(3):506–20.
- Couser WG. Primary membranous nephropathy. Clin J Am Soc Nephrol. 2017 Jun 7;12(6):983–97. Erratum in: Clin J Am Soc Nephrol. 2017 Sep 7;12 (9):1528.
- Cramer MT et al. Cystic kidney disease: a primer. Adv Chronic Kidney Dis. 2015 Jul;2 (4):297–305.
- Doshi SM et al. Diagnosis and management of type 2 diabetic kidney disease. Clin J Am Soc Nephrol. 2017 Aug 7;12(8): 1366–73.
- Dubose TD., Santos RM. Vascular disorders of the kidney. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 807-811.
- Farrington K et al. Clinical Practice Guideline on management of older patients with chronic kidney disease stage 3b or higher (eGFR
- Fenoglio R et al. Rituximab therapy for IgA-vasculitis with nephritis: a case series and review of the literature. Immunol Res. 2017 Feb;65(1):186–192.
- Floege J et al. Primary glomerulonephritides. Lancet. 2016 May 14;387(10032):2036–48.
- Galešić K. Fokalna segmentalna glomeruloskleroza. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 99-110.
- Galešić K., Horvatić I., Batinić D., Milošević D., Saraga M., Glavina Durdov M., Galešić Ljubanović D. C1Q nefropatija: prikazi bolesnika i pregled literature. Liječ Vjesn 2015;137:283–287.
- Galešić K., Sabljar-Matovinović M. Kronična insuficijencija bubrega. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1087-1091.
- Galešić K: C1g nefropatija. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 184-185.
- Galešić-Ljubanović D. Osnovna načela patohistološke dijagnostike bubrežnih bolesti. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 40-51.
- Gašparović V., Čala S. Akutna insuficijencija bubrega. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1082-1087.
- Gaudry S et al; AKIKI Study Group. Initiation strategies for renal-replacement therapy in the intensive care unit. N Engl J Med. 2016 Jul 14;375(2):122–33.
- Guay-Woodford LM. Hereditary and developmental abnormalitates of the urinary tract. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 822-827.
- Harris RC. Diabetes and the kidney. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 804-806.
- Henderson SR et al. Diagnostic and management challenges in Goodpasture’s (anti-glomerular basement membrane) disease. Nephrol Dial Transplant. 2018 Feb 1;33(2):196–202.
- Horvatć I. Simptomatsko liječenje glomerularnih bolesti. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 59-64.
- Horvatić I. Biopsija bubrega. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 31-38.
- Horvatić I. Klinička slika glomerularnih bolesti. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 21-29.
- Horvatić I. Membranski glomerulonefritis. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 113-131.
- Horvatić I. Patogeneza glomerularnih bolesti. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 1-17.
- Jeannette JC et al. ANCA glomerulonephritis and vasculitis. Clin J Am Soc Nephrol. 2017 Oct 6;12(10):1680–91.
- Jelaković B., Dik Ž., Karanović S., Vuković Lela I. Endemska nefropatija u Hrvatskoj. Lije~ Vjesn 2015;137:100–108.
- Kes P., Bašić-Jukić N. Liječenje bolesnika s kroničnim zatajenjem bubrega. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1091-1097.
- Kupin WL. Viral-associated GN: hepatitis C and HIV. Clin J Am Soc Nephrol. 2017 Aug 7;12(8):1337–42.
- Kuzmanić D. Toksične nefropatije. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1128-1132.
- Kuzmanić D., Galešić K. IgA-nefropatija. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 138-145.
- Kuzmanić D., Jelaković B. Tubulointersticijske bolesti bubrega. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1123-1128.
- Kuzmanić D., Laganović M. Nefrolitijaza. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1140-1145.
- Kuzmanić D., Škegro D. Dijagnostički postupci u nefrologiji. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1078-1082.
- Laganović M., Grgurević I. Bolesti glomerula povezane s virusnim infekcijama. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 174-178.
- Landry DW., Bazari H. Approach to the patinet with renal disease. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 728-736.
- Meola M et al. Clinical scenarios in chronic kidney disease: cystic renal diseases. Contrib Nephrol. 2016;188:120–30.
- Mitch WE. Chronic kidney disease. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 833-841.
- Molitoris BA. Acute kidney injury. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 778-783.
- Morović-Vergles J. Bubreg u sistmenoj sklerozi. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 236-239.
- Morović-Vergles J., Čulo M.I., Galešić Ljubanović D. Lupusni nefritis. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 224-234.
- Nath KA et al. Sickle cell disease: renal manifestations and mechanisms. Nat Rev Nephrol. 2015 Mar;11(3):161–71.
- Neilson EG. Tubulointerstitial nephritis. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 793-799.
- Okusa MD et al. Reading between the (guide)lines—the KDIGO practice guideline on acute kidney injury in the individual patient. Kidney Int. 2014 Jan;85(1):39–48.
- O'Neill WC. Renal relevant radiology: use of ultrasound in kidney disease and nephrology procedures. Clin J Am Soc Nephrol. 2014 Feb;9(2):373–81.
- Palmer SC et al. Induction and maintenance immunosuppression treatment of proliferative lupus nephritis: a network metaanalysis of randomized trials. Am J Kidney Dis. 2017 Sep; 70(3):324–36.
- Pasini J. Tumori mokraćnog sustava. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1149-1150.
- Patel YA et al. Treatment of HCV in renal disease: subtle management considerations in the era of direct-acting antivirals. Curr Hepatol Rep. 2016 Dec;15(4):285–90.
- Perazella MA. Diagnosing drug-induced AIN in the hospitalized patient: a challenge for the clinician. Clin Nephrol. 2014 Jun;81(6):381–8.
- Ponticelli C et al. Drug management in the elderly adult with chronic kidney disease: a review for the primary care physician. Mayo Clin Proc. 2015 May;90(5):633–45.
- Popović B., Šutić I., Bašić-Marković N. Nefrotoksični lijekovi. Acta Med Croatica, 70 (2016) 309-314.
- Prkačin I. Dijabetička nefropatija. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 258-269.
- Puretić Z., Knotek M. Transplantacija bubrega. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1097-1102.
- Rankin AJ et al. Venous thromboembolism in primary nephrotic syndrome—is the risk high enough to justify prophylactic anticoagulation? Nephron. 2017;135(1):39–45.
- Rauen T et al; STOP-IgAN Investigators. Intensive supportive care plus immunosuppression in IgA nephropathy. N Engl J Med. 2015 Dec 3;373(23):2225–36.
- Ravani P et al. Clinical trials in minimal change disease. Nephrol Dial Transplant. 2017 Jan 1;32(Suppl 1):i7–13.
- Riedl M et al. C3 glomerulopathy. Pediatr Nephrol. 2017 Jan; 32(1):43–57.
- Rodrigues JC et al. IgA nephropathy. Clin J Am Soc Nephrol. 2017 Apr 3;12(4):677–86.
- Rončević T. Nasljedne bolesti bubrega. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1135-1138.
- Ruospo M et al. Glucose targets for preventing diabetic kidney disease and its progression. Cochrane Database Syst Rev. 2017 Jun 8;6:CD010137.
- Sabljar-Matovinović M. Klasifikacija glomerularnih bolesti. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 53-57.
- Sabljar-Matovinović M. Sekundarne bolesti glomerula. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1113-1118.
- Sabljar-Matovinović M., Galešić K. Membranoproliferativni glomerulonefritis. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 149-157.
- Sabljar-Matovinović M., Galešić K. Primarne bolesti glomerula. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1102-1112.
- Saraga M. Hereditrani nefritis. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 271-277.
- Sethi S et al. Mayo Clinic/Renal Pathology Society consensus report on pathologic classification, diagnosis, and reporting of GN. J Am Soc Nephrol. 2016 May;27(5):1278–87.
- Stipić-Marković A., Stipić J., Crnčević-Urek M., Crnek-Kunstelj V. Chrug-Strauss syndrome: a case report. Acta clin Croat 2002; 41:95-98.
- Škegro D. Opstrukcija mokraćnog sustava. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1145-1148.
- Šubat-Dežulović M. Postinfektivni glomerulonefritis. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 160-172.
- Tesar V et al. Bosutinib versus placebo for autosomal dominant polycystic kidney disease. J Am Soc Nephrol. 2017 Nov; 28(11):3404–13.
- Thomas ME et al. The definition of acute kidney injury and its use in practice. Kidney Int. 2015 Jan;87(1):62–73.
- Thurman JM. Many drugs for many targets: novel treatments for complement-mediated glomerular disease. Nephrol Dial Transplant. 2017 Jan 1;32(Suppl 1):i57–64.
- Vassalotti JA et al; National Kidney Foundation Kidney Disease Outcomes Quality Initiative. Practical approach to detection and management of chronic kidney disease for the primary care clinician. Am J Med. 2016 Feb;129(2):153–62.
- Vdović M. Vaskularne bolesti bubrega. U: Vrhovac B., Jakšić B. Reiner Ž., Vucelić B., ur. Interna medicina IV. izdanje. Naklada „Ljevak“, Zagreb, 2008., str. 1132-1134.
- Wang SY et al. Clinical, pathological, and prognostic characteristics of glomerulonephritis related to staphylococcal infection. Medicine (Baltimore). 2016 Apr;95(15):e3386.
- Zaidan M et al; CryoVas Study Group. Spectrum and prognosis of noninfectious renal mixed cryoglobulinemic GN. J Am Soc Nephrol. 2016 Apr;27(4):1213–24.
- Zampeli E et al. A comprehensive evaluation for the treatment of lupus nephritis. J Autoimmun. 2017 Mar;78:1–10.
- Zarbock A et al. Effect of early vs delayed initiation of renal replacement therapy on mortality in critically ill patients with acute kidney injury: the ELAIN randomized clinical trial. JAMA. 2016 May 24–31;315(20):2190–9.
- Zeidel ML. Obstructive uropathy. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Elsevier Saunders, Philadelphia, 2016. p. 799-703.
- Zoccali C et al; European Renal and Cardiovascular Medicine (EURECA-m) Working Group of the European Renal Association— European Dialysis Transplantation Association (ERA-EDTA). The systemic nature of CKD. Nat Rev Nephrol. 2017 Jun;13(6):344–58.
- Živko M., Laganović M. Hemoragijska vrućica s bubrežnim sindromom. U: Galešić K. i sur. Bolesti glomerula – primarne i sekundarne. Medicinska naklada, Zagreb 2014., str. 179-182.