BOLESTI ORGANA PROBAVNOGA SUSTAVA
Vodeće kliničke manifestacije bolesti probavnoga sustava
Dijagnostičke metode i postupci u gastroenterologiji
Krvarenja iz probavnoga sustava
Funkcijske bolesti probavnoga sustava
Poremećaji motorike jednjaka
Gastroezofagealna refluksna bolest
Upalne bolesti jednjaka
Tumori jednjaka
Ostale bolesti jednjaka
Gastritisi i gastropatije
Peptična ulkusna bolest
Komplikacije peptične ulkusne bolesti
Gastrinom (Zollinger Ellisonov sindrom)
Tumori želuca
Infektivni i pseudomembranozni enterokolitis
Upalna bolest crijeva
Malapsorpcijski sindrom
Divertikuloza crijeva
Intestinalna pseudoopstrukcija i megakolon
Tumori tankoga crijeva
Tumori debeloga crijeva
Neuroendokrini tumori probavnoga sustava
Bolesti anorektuma
Kirurška patologija abdomena
Hiperbilirubinemija i žutica (ikterus)
Nealkoholna masna bolest jetre
Alkoholna bolest jetre
Akutni virusni hepatitis
Kronični virusni hepatitisi
Ostale infektivne bolesti jetre
Autoimuni hepatitis
Oštećenja jetre lijekovima i toksinima
Bolesti jetre u trudnoći
Vaskularne bolesti jetre
Ciroza jetre
Komplikacije ciroze jetre
Tumori i ciste jetre
Transplatacija jetre
Bolesti žučnjaka
Bolesti žučnih vodova
Upalne bolesti gušterače - pankreatitisi
Tumori i ciste gušterače
Literatura
VODEĆE KLINIČKE MANIFESTACIJE BOLESTI PROBAVNOGA SUSTAVA
Bolesti probavnoga sustava mogu se očitovati različitim simptomima, znakovima ili sindromima lokalnoga ili proširenog karaktera. Najčešći od njih su: žgaravica i regurgitacija, disfagija i odinofagija, štucanje ili singultus, mučnina i povraćanje, flatulencija, dispepsija, bol u trbuhu, proljev i zatvor.
ŽGARAVICA I REGURGITACIJA
Žgaravica ili piroza predstavlja osnovnu manifestacije refluksne bolesti jednjaka. Prisutan je neugodan osjećaj pečenja (žgara) iza prsne kosti koji se širi gore prema vratu, a može biti praćen i pojavom kiseloga sadržaja u gornjem jednjaku i u ustima što se onda naziva regurgitacijom. Najčešće se javlja uslijed slabosti donjega ezofagealnog sfinktera ili spontanih relaksacija samoga sfinktera koje nisu vezane za gutanje, što predstavlja glavne etiološke čimbenike nastanka refluksne bolesti jednjaka. Ti se simptomi obično javljaju pri ležećem položaju i sagibanju, osobito nakon obroka. Simptomi mogu nalikovati na stenokardiju i nekada ih je teško razlikovati te je potrebno obratiti posebnu pozornost u smislu razvijanja infarkta miokarda (elektokardiogram, srčani enzimi). Uz žgaravicu i regurgitaciju kod GERB-a (gastroezofagusna refluksna bolest) se mogu javiti i drugi povezani simptomi i znakovi, kao što su podrigivanje, zadah iz usta, zubni karijes te kronični kašalj i promuklost.
DISFAGIJA I ODINOFAGIJA
Definicija. Disfagija ili otežano gutanje predstavlja poremećaj kod gutanja pri čemu bolesnik ima osjećaj zapreke kod prolaska hrane kroz jednjak. Odinofagija je termin koji se koristi za pojavu bola gutanja i prolaza zalogaja niz jednjak. Disfagija i odinofagija povezuju se u prvom redu s bolestima jednjaka, ali mogu se javiti i kod drugih bolesti i stanja (bolesti usne šupljine, poremećaji orofarinksa i hipofarinksa, neuromuskularni poremećaji).
Etiologija. Disfagiju i odinofagiju mogu uzrokovati različite bolesti i stanja: 1) bolesti usne šupljine i jezika (upale, tumori); 2) neuromuskularni poremećaji (mijastenija gravis, moždani udar (cerebrovaskularni inzult), bulbarna paraliza); 3) poremećaji motorike jednjaka (ahalazija, difuzni ezofagealni spazam, sklerodermija, dijabetička neuropatija, Chagasova bolest); 4) strukturne bolesti jednjaka (benigne i maligne strikture, upalna zbivanja); 5) ekstraezofagealni patološki procesi koji infiltriraju ili vrše pritisak na jednjak (medijastinalni tumori, guša, uvećan lijevi atrij, aneurizma aorte) te 5) strana tijela.
Klinički pristup. Disfagija i odinofagija spadaju u simptome alarma te je potrebno napraviti žurnu dijagnostičku obradu kako bi se isključilo postojanje prvenstveno karcinoma jednjaka ili gastrezofagealnoga spoja. Inicijalni dijagnostički postupak podrazumijeva svakako endoskopski pregled gornjega dijela probavnoga trakta, a prema potrebi se dijagnostička obrada proširuje na otorinolaringološku, kada se radi o anamnezi vezanoj uz proksimalnu disfagiju, odnosno smetnje gutanja vezane za gornji jednjak i faringoezofagealni spoj. Prema potrebi se dijagnostički postupak proširuje neurološkom obradom, slikovnim metodama prikaza prsnoga koša, funkcijskim dijagnostičkim metodama i sl.
ŠTUCANJE ILI SINGULTUS
Štucanje predstavlja zvučni fenomen koji nastaje uslijed nekontrolirane kontrakcije ošita uz istodobno naglo zatvaranje epiglotisa koji priječi prolazak potisnutoga zraka. Štucanje najčešće nastaje kao posljedica izravnoga nadražaja ošita ili kao posljedica neuroloških poremećaja. Može se javiti u obliku kratkotrajnih epizoda koje nastaju zbog prolaznoga podraživanja ošita. To se može dogoditi uslijed distenzije želuca (prejedanje, aerofagija, gazirana pića) ili nagle promjena temperature (nagli unos vrućih ili hladnih napitaka ili hrane) ili u obliku dugotrajnih epizoda. One mogu biti povezane s različitim bolestima i stanjima kao što su: gastroezofagealna refluksna bolest, pankreatitis, bazalna pneumonija, perikarditis, neurološki poremećaji i sl. Dijagnostička obrada se obično provodi kod dugotrajnoga i upornog štucanja. Tada je obično potrebno napraviti neurološki pregled, osnovne laboratorijske pretrage, radiogram srca i pluća, UZV gornjega abdomena, gastroskopiju te CT ili MR glave, prsa ili abdomena. Iako se u praksi koriste različiti mehanički manevari za suzbijanje singultusa, njihova učinkovitost je upitna. Od lijekova se najčešće primjenjuje klorpromazin (25 - 50 mg peroralno ili parenteralno), metoklopramid (10 mg intravenski ili p.o.), a moguća je i empirijska primjena inhibitora protonske pumpe pri sumnji na GERB kao vodeći etiološki čimbenik.
MUČNINA I POVRAĆANJE
Definicija. Mučnina (nausea) je naziv za osjećaj nelagode u epigastriju i gađenja na hranu uz održan nagon za povraćanjem, dok je povraćanje (vomitus) naziv za sam čin izbacivanja želučanoga sadržaja na usta. Nastaje uslijed kontrakcije mišića trbuha i ošita uz istodobno opuštanje jednjačnih sfinktera. Povraćanje treba razlikovati od regurgitacije pri kojoj dolazi do pasivnoga vraćanja želučanoga sadržaja kroz jednjak u usta bez aktivne mišićne kontrakcije. Mučnina i povraćanje obično se pojavljuju istodobno, iako se mogu javiti i odvojeno.
Etiologija. Mučnina i povraćanje nastaju kao posljedice stimulacije centra za povraćanje koji je smješten u produljenoj moždini. Njegovi eferentni neuroni koordiniraju ritmičke kontrakcije trbušnih mišića i ošita te istodobnu relaksaciju jednjačnih sfinktera, što omogućava pražnjenje želuca. Centar za povraćanje može biti stimuliran primanjem aferentnih niti s nekoliko razina: 1) aferentne niti nervusa vagusa iz sluznice probavnih organa koji obiluju serotininskim 5-HT3 receptorima; 2) aferentne niti iz vestibularnoga aparata koji obiluje histaminskim H1 i muskarinskim kolinergičkim receptorima; 3) aferentne niti iz viših moždanih centara (amigdala) te 4) aferentne niti iz kemoreceptorske okidajuće zone koja se nalazi u produljenoj moždini u području area postrema izvan krvnomoždane barijere, a obiluje opioidnim, serotoninskim 5-HT3, neurokininskim NK1 i dopaminskim D2 receptorima. Različiti čimbenici mogu stimulirati navedene receptore koji putem navedenih aferentnih niti stimuliraju centar za povraćanje i dovode do samoga povraćanja (Tablica 4.1.).
|
Tablica 4.1. Najčešći uzroci mučnine i povraćanja
|
|
Stimulacija iz sluznice probavnih organa
|
Stimulacija iz vestibularnoga aparata
|
Stimulacija iz viših moždanih centara
|
Stimulacija iz kemoreceptorske zone
|
|
Infekcije i ishemija
Mehanička opstrukcija
Peritonealni podražaj
Poremećaji motorike
Bolesti jetre, žuči i gušterače
Nadražajno (lijekovi, alkohol)
Stanje iza operacija
|
Labirintitis
Meniereov sindrom
Bolest kretanja
|
Povišeni intrakranijski tlak
Migrena
Infekcije CNS-a
Psihogeni uzroci
|
Lijekovi: antikonvulzivi, opijati, antiparkinsonici, digoksin, oralni kontraceptivi, inhibitori kolinesteraze)
Sistemski poremećaji: uremija, dijabetička ketoacidoza, adrenokortikalna kriza, trudnoća)
|
Dijagnostički pristup bolesniku s mučninom i povraćanjem ovisi ponajprije o ostalim simptomima i znakovima koji prate to stanje. Na temelju toga planirat će se i dijagostički postupak koji najčešće obuhvaća osnovne laboratorijske nalaze, ultrazvuk abdomena i gastroduodenoskopiju. Daljnji dijagnostički postupak ovisit će o rezultatima dobivenih pretraga, a obično može obuhvaćati MSCT abdomena, radiološke kontrastne pretrage probavne cijevi i sl. Kod svih bolesnika s upornim povraćanjem treba misliti na mogući razvoj komplikacija kao što su dehidracija, hipokalijemija, metabolička alkaloza, ruptura jednjaka (Boerhaaveov sindrom) te laceracije gastroezofagealnoga spoja praćene krvarenjem (Mallory-Weissov sindrom).
Liječenje je utemeljeno na etiološkom faktoru, odnosno bolesti koja je dovela do mučnine i povraćanja. Simptomatsko liječenje sastoji se od lijekova antiemetika koji imaju za cilj suprimirati nadražaj povraćanja. Mehanizam djelovanja antiemetika podrazumijeva blokiranje receptora kojima započinje aferentni put stimulacije centra za povraćanje. U tu se svrhu koriste lijekovi iz različitih skupina: 1) antagonisti serotoninskih 5-HT3 receptora (ondansetron, granisetron, dolasetron, palonosetron); 2) agonisti dopaminskih D2 receptora (metoklopramid, proklorperazin, prometazin, olanzapin); 3) antagonisti neurokininskih receptora (aprepitant, fosaprepitant, rolapitant) te kortikosteroidi.
FLATULENCIJA
Flatulencija (ispuštanje vjetrova) nastaje najčešće kao posljedica povećane količine zraka u crijevima. To može biti uzrokovano pojačanim unosom zraka tijekom gutanja (aerofagija) ili uslijed malapsorpcije ugljikohidrata i proteina zbog pojačane fermentacije ostatnih tvari djelovanjem bakterija iz normalne crijevne flore. Ispušteni plinovi sastoje se od dušika, ugljičnoga dioksida, vodika i metana. Stvaranje i ispuštanje vjetrova u malim količinama normalna je fiziološka pojava, dok veća količina ukazuje na mogući poremećaj apsorpcije ugljikohidrata i proteina ili na aerofagiju.
DISPEPSIJA
Definicija. Dispepsija je sindrom ili skup simptoma. To je naziv za akutnu, kroničnu ili recidivirajuću bol i nelagodu u epigastriju koja može biti povezana s osjećajem punoće i rane sitosti te mučninom i povraćanjem, ali potrebno ju je razlikovati od žgaravice i regurgitacije (žareća bol i nelagoda iza prsne kosti). Taj se poremećaj često susreće u općoj populaciji te se dispepsija javlja u više od 80 % odrasle populacije bar jednom u životu, dok se u oko 10 % ona javlja u kroničnoj ili trajnoj recidivirajućoj formi.
Etiologija. Dispepsiju mogu uzrokovati različite bolesti i stanja: 1) organske bolesti probavnoga sustava (akutni gastritis, ulkusna bolest, kolelitijaza, akutni i kronični pankreatitis, tumori želuca i gušterače, hepatitisi i druge lezije jetre); 2) funkcijske bolesti probavnoga sustava (sindrom iritabilnoga crijeva, funkcijska dispepsija); 3) sistemske i druge bolesti (bubrežno zatajenje, hiperkalcijemija, ishemija miokarda); 4) intolerancija na hranu (prejedanje, brzi unos hrane, obilni masni obroci, prekomjerni unos kofeina) te 5) lijekovi i toksini (nesteroidni protuupalni lijekovi, metronidazol, metformin, preparati željeza i kalija, glukokortikoidi, alkohol i dr.).
Klinički pristup. Dijagnostički i terapijski pristup bolesnicima s dispepsijom ovisi o dobi i prisutnosti tzv. simptoma i znakova alarma. To su: anemija, povraćanje, gubitak na tjelesnoj težini, hematemeza i/ili melena, disfagija, palpatorna rezistencija u trbuhu. Bolesnici koji se prezentiraju dispepsijom i stariji su od 50 godina i/ili imaju neke od simptoma i znakova alarma, zahtijevaju žurnu dijagnostičku, primarno endoskopsku obradu, dok se kod bolesnika mlađih od 50 godina i u odsutnosti simptoma alarma preporuča neinvazivno testiranje na infekciju Helicobacter pylori (antigen H. pylori u stolici, ureja izdisajni test) te provođenje empirijske terapije kroz četiri tjedna. Empirijska terapija podrazumijeva provođenje eradikacijske terapije u bolesnika koji su pozitivni na H. pylori infekciju ili samo primjenu inhibitora protonske pumpe u bolesnika koji su negativni na H. pylori infekciju. Ako se tegobe ne povuku nakon provedene empirijske terapije, indicirana je endoskopska obrada. Kod bolesnika kod kojih se nakon prekida uzimanja inhibitora protonske pumpe ponovno jave simptomi, u odsustvu organske podloge, najčešće se proširuje dijagnostička obrada.
BOL U TRBUHU
Uvod. Bol u trbuhu predstavlja jedan od najvećih kliničkih izazova s obzirom na to da može biti uzrokovan velikim brojem bolesti i stanja, a uz to je i jedan od najčešćih uzroka zbog kojega se bolesnici javljaju liječniku. S obzirom na patofiziologiju, razlikujemo visceralni, parijetalni i preneseni bol. Prema trajanju bol dijelimo na akutni i kronični, s obzirom na proširenost difuzni i lokalizirani te tup i grčevit u odnosu na karakter.
Patofiziologija. Prema osnovnome patofiziološkom konceptu, bol u trbuhu može biti visceralan, parijetalan i prenesen. Visceralni bol proizlazi iz promjena sluznice želučano-crijevnoga trakta, odnosno nastaje aktivacijom aferentnih nocicepcijskih vlakana koja odlaze prema celijačnome spletu, a potom u kralježničnu moždinu. Iz toga razloga bolesnici bol slabo lokaliziraju i navode da je najjači u području sredine trbuha (periumbilikalno, epigastrično). Parijetalni bol nastaje napredovanjem patološkoga procesa prema serozi, pri čemu dolazi do podraživanja potrbušnice (peritoneuma) čija aferentna nocicepcijska vlakna odlaze izravno u odgovarajući segment kralježnične moždine (Th6-L1), zbog čega bolesnici mogu jasno precizirati mjesto najjače bolnosti (npr. desni donji kvadrant kod akutnoga apendicitisa). Kod visceralne boli izraženi su simptomi autonomnoga živčanoga sustava, kao što su preznojavanje, mučnina ili povraćanje, pri čemu su bolesnici nemirni i zauzimaju različite položaje kako bi olakšali bolnost. Kod parijetalne boli bolesnici su mirni (obično u savijenome položaju sa zgrčenim nogama), s obzirom na to da se bol pojačava pri kretnjama i kašljanju. Prenesen bol je bol čiji se uzrok nalazi na mjestu različitome od mjesta samoga uzroka, a nastaje u situacijama kada je određena regija inervirana istim neurosegmentom kao i zahvaćeni organ (npr. bol pod desnom lopaticom kod kolecistitisa (akutne upale žučnjaka) ili bol pod desnim rebrenim lukom kod bazalne pneumonije (upale pluća)).
Akutni bol u trbuhu je bol koji nastaje naglo (kroz nekoliko sati ili dana), brzo se pojačava i visokoga je intenziteta te bolesnika primorava na liječnički pregled u vrlo kratkome razdoblju od svoga nastanka. Taj bol može biti povremen (intermitentan - grč, kolika), kakav se javlja kod opstrukcije šupljih organa i posljedičnih snažnih kontrakcija koje stimuliraju nociceptore, ili kontinuiran bol koji je najčešće posljedica upalnih zbivanja. U diferencijalnoj je dijagnozi osim tih karakteristika bola bitno znati odrediti i mjesto najjače bolnosti, kao što je to prikazano u Tablici 4.2.
|
Tablica 4.2. Diferencijalna dijagnoza akutnih bolova u trbuhu
|
|
Desni gornji kvadrant:
Pluća (efuzija, empijem, pneumonija);
Jetra (hepatitis, kongestija, apsces);
Žuč (kolecistitis, kolangitis, kolelitijaza);
Duodenum (perforirani ulkus);
Želudac (perforirani ulkus).
|
Epigastrij:
Srce (akutna ishemija, tamponada);
Jednjak (ezofagitis, ruptura);
Želudac i duodenum (gastritis, ulkus);
Gušterača (akutni pankreatitis);
Krvne žile (ruptura AAA).
|
Lijevi gornji kvadrant:
Pluća (efuzija, empijem, pneumonija);
Srce (akutna ishemija);
Slezena (apsces, ruptura, splenomegalija);
Želudac (perforirani ulkus);
Gušterača (akutni pankreatitis).
|
|
Desna lumbalna loža:
Bubreg (pijelonefritis, nefrolitijaza);
Ureter (nefrolitijaza, hidronefroza);
Desni kolon (kolitis, rani apendicitis).
|
Periumbilikalna regija:
Tanko crijevo (enteritis, ileus, ishemija);
Desni kolon (kolitis, rani apendicitis);
Krvne žile (ruptura AAA);
Metabolički uzroci (acidoza).
|
Lijeva lumbalna loža:
Bubreg (pijelonefritis, nefrolitijaza);
Ureter (nefrolitijaza, hidronefroza);
Slezena (apsces, ruptura, splenomegalija).
|
|
Desni donji kvadrant:
Crijeva (enterokolitis, ileus, ishemija,
divertikulitis, apendicitis);
Genitalni organi (ektopična trudnoća, salpingitis, endometritis);
Ostalo (mezenterijski limfadenitis, inkarcerirana hernija).
|
Hipogastrij:
Crijeva (enterokolitis, upalna bolest crijeva, sindrom iritabilnoga kolona, ishemija, ileus);
Mokraćni mjehur (akutni cistitis, retencija);
Genitalni organi (ektopična trudnoća, endometritis).
|
Lijevi donji kvadrnat:
Crijeva (enterokolitis, ileus, ishemija,
divertikulitis);
Genitalni organi (ektopična trudnoća, salpingitis, endometritis);
Ostalo (inkarcerirana hernija, limfadenopatija).
|
Kod bolesnika s akutnim bolom u trbuhu potrebno je uzeti temeljitu anamnezu i napraviti klinički pregled s posebnim osvrtom na pregled trbuha. Osnovni dijagnostički postupak podrazumijeva laboratorijsku dijagnostiku, elektrokardiogram (isključenje akutne ishemije kao čestoga uzroka bola u epigastriju), nativne snimke abdomena kod sumnje na ileus ili perforaciju te ultrazvuk abdomena (bol u gornjemu dijelu trbuha) ili kompjuteriziranu tomografiju abdomena (bol u donjemu dijelu trbuha). Nekadašnji stav da se bolesnicima s akutnim bolom u trbuhu ne daje analgezija dok se ne postavi dijagnoza danas je napušten, jer većina bolesnika do trenutka pregleda već samoinicijativno uzme analgetik. Uz to, postavljanje konačne dijagnoze danas se temelji na laboratorijskim i slikovnim metodama, a ne samo na kliničkoj slici i nalazima. Naglo nastao intenzivan bol u trbuhu praćen drugim probavnim simptomima i znacima peritonealnoga nadražaja (napinjanje mišića trbuha pri pregledu ili mišićni defans) primarno je kirurško zbivanje i zahtijeva kiruršku obradu i nadzor.
Bol u trbuhu kroničnoga tipa razvija se postupno, manjega je intenziteta i traje mjesecima, a nekada i godinama. Uzroci mogu biti strukturalni (organska bolest) ili funkcionalni. Najčešći organski uzroci kroničnoga bola u trbuhu su kronična ulkusna bolest, idiopatska crijevna upalna bolest, kronični pankreatitis, bilijarna patologija (kolelitijaza), tumori probavnih organa te endometrioza. Iako se funkcionalni poremećaji probavnoga sustava mogu javiti u bilo kojoj životnoj dobi, obično se javljaju prije četrdesete godine života, što može sugerirati na funkcionalnu podlogu bolova, kao i uredni laboratorijski nalazi. Kod bolesnika s kroničnim bolom u trbuhu potrebno je na vrijeme uočiti tzv. simptome i znake alarma - kao što su pojava anemije, gubitak na tjelesnoj težini, intenziviranje bolova, pojava žutice, razvoj poremećaja pražnjenja crijeva i sl., te ih uputiti na odgovarajuću dijagnostičku obradu, s obzirom na to da oni upozoravaju na razvoj ozbiljne bolesti. Dijagnostička obrada kroničnoga bola u trbuhu široka je, obuhvaća laboratorijsku dijagnostiku, endoskopske pretrage, slikovne metode (ultrazvuk, kompjutorizirana tomografija) te prema potrebi i druge dijagnostičke metode.
PROLJEV (DIARRHOEA)
Definicija. Dijarealni sindrom naziv je za pojavu učestalih, rijetkih stolica čija je težina veća od 200 g/24 sata, a volumen veći od 200 ml/24 sata, prema onome kako ga definiraju gastroenterolozi. Međutim, većina ljudi ima stolicu manje od tri puta dnevno, a više od tri puta na tjedan. Sam naziv proljev ima različito značenje za različite ljude. Međutim, u praksi se najčešće koristimo u definiciji dijareje frekvencijom stolica koje su pritom najčešće tekuće ili kašaste, odnosno redovito neformirane. Prema trajanju dijarealni sindrom dijelimo na akutni - koji traje manje od dva tjedna, i kronični - koji traje dulje od 10 do 14 dana.
AKUTNI PROLJEV
Etiopatogeneza. Akutni proljevi najčešće su uzrokovani infektivnim agensima (bakterije i njihovi toksini, virusi, paraziti), a ovisno o mehanizmu nastanka razlikujemo upalne i neupalne proljeve. Upalni proljevi nastaju kao posljedica invazije uzročnika ili njihovih toksina (citotoksina) u samu sluznicu crijeva pri čemu dolazi do stvaranja patomorfoloških oštećenja, što se očituje nastankom sluzavih, gnojnih i sukrvavih proljevastih stolica u kojima nalazimo obilje fekalnih leukocita i laktoferina. Upalne proljeve najčešće uzrokuju bakterije koje stvaraju citotoksine (enterohemoragična E. coli) ili imaju sposobnost invazije (Shigella spp, Campylobacter jejuni, Salmonella spp, enteroinvazivna E. coli, Yersinia enterocolitica) te određeni virusi (Cytomegalovirus) i protozoe (Entamoeba histolytica). Neupalni proljevi nastaju kao posljedica promjena u funkciji crijevne sluznice, a bez poremećaja morfologije crijeva. Obično su posljedica djelovanja bakterijskih toksina (enterotoksina) koji remete normalnu enzimatsku funkciju enterocita. Takvi su proljevi vodenasti, bez primjesa sluzi, gnoja ili krvi, a negativni su na fekalne leukocite i laktoferin. Neupalni proljevi najčešće su uzrokovani virusima (norovirus, adenovirus, rotavirus) i bakterijama koje stvaraju enterotoksine (Staphylococcus aureus, Clostridium perfringens, Vibrio cholerae, enterotoksična E. coli). Drugi, rjeđi uzroci akutnih proljeva su lijekovi, toksini ili ishemija.
Klinička slika akutnoga dijarealnoga proljeva obilježena je naglom pojavom proljeva čije karakteristike, kao i pridruženi znakovi, ovise o uzroku. Kod upalnih proljeva bolesnici obično imaju povišenu tjelesnu temperaturu, žale se na bolove i grčeve u trbuhu, a proljevaste stolice su zelenkasto-sluzave uz primjese gnoja ili krvi. Kod neupalnih proljeva glavno su obilježje učestale vodenaste stolice bez primjesa i bez općih simptoma. Uporni proljevi mogu dovesti do hipovolemije i dehidracije što je najizraženije kod starijih osoba.
Klinički pristup. Kod bolesnika s akutnim proljevom najprije treba utvrditi radi li se o upalnome proljevu (povišena tjelesna temperatura, primjese krvi, znakovi dehidracije), imunokompromitiranome bolesniku (imunosupresivna terapija, sindrom stečene imunodeficijencije) i starijoj osobi (> 70 godina). Ako se bolesnik ne uklapa niti u jednu od navedenih kategorija, dovoljno je provođenje rehidracije s ili bez primjene antidijarealnih lijekova (npr. loperamid 4 mg početno potom iza svake stolice 2 mg). Ako se bolesnik uklapa u jednu od navedenih kategorija (upalni proljev, imunokompromitiranost, starija životna dob), najprije je potrebno provesti obradu koja uključuje određivanje fekalnih leukocita, uzeti uzorak stolice za rutinsku mikrobiološku obradu te dodatni za testiranje na Clostridium difficile (toksin i antigen), a u određenim slučajevima, kada za to postoji sumnja, radi se i parazitološko ispitivanje stolice (koprokultura). Uvođenje antibiotika indicirano je: 1) ako je pozitivan nalaz na fekalne leukocite, 2) ako bolesnik ima febrilno stanje, bol u trbuhu i primjese krvi u stolici, 3) kod imunokompromitiranih bolesnika te 4) kod bolesnika koji su razvili proljev tijekom hospitalizacije. Fluorokinoloni se danas preporučuju kao lijek izbora u peroralnom empirijskom antimikrobnom liječenju akutnoga proljeva (npr. ciprofloksacin 1 x 500 mg ofloksacin 1 x 400 mg ili levofloksacin 1 x 500 mg kroz tri dana). Kao alternativa navode se kombinacija sulfametoksazol/trimetoprim 160/800 mg dva puta na dan ili doksiciklin 100 mg dva puta na dan. Terapija se kasnije usklađuje prema nalazu antibiograma.
KRONIČNI PROLJEV
Etiopatogeneza. S obzirom na etiopatogenezu, kronični proljev dijelimo u nekoliko skupina: upalni proljev, osmotski proljev, sekretorni proljev te motorički proljev.
Upalni ili inflamatorni proljev nastaje uslijed oštećenja crijevne sluznice što za posljedicu ima gubitak tekućine i krvi, a može biti infektivne i neinfektivne naravi. Infektivni upalni proljev nastaje uslijed sposobnosti patogena da invadira crijevnu sluznicu i izazove njezino oštećenje, dok su neifektivni upalni proljevi najčešće posljedica idiopatske upalne bolesti crijeva (ulcerozni kolitis, Crohnova bolest), radijacijskoga enteritisa, eozinofilnoga gastroenteritisa i sl.
Osmotski proljev nastaje kao posljedica kretanja molekula vode kroz crijevnu sluznicu koja djeluje kao polupropusna membrana, što se događa uslijed stanja pri kojima se u crijevnome lumenu nalaze velike količine osmotskih aktivnih čestica. To se najčešće događa u stanjima malapsorpcije kada se u lumenu crijeva zadržavaju nerazgrađene osmotski aktivne tvari (npr. glukoza) i one dovode do navlačenja vode u lumen crijeva.
Sekretorni proljev nastaje kao posljedica funkcionalnoga poremećaja enterocita koji dovodi do povećanoga aktivnoga ili pasivnog lučenja volumena u tankom ili debelom crijevu. Sekretorni proljev susrećemo uslijed nekih kroničnih infekcija obilježenih stvaranjem enterotoksina, kao posljedicu povećane hormonske aktivnosti (vazoaktivni intestinalni peptid), poremećaja metabolizma žučnih kiselina ili uslijed djelovanja nekih lijekova.
Motorički proljev nastaje kao posljedica pojačane i ubrzane crijevne peristaltike, a može se susresti kod pojačanoga lučenja biološki aktivnih tvari (serotonin, kalcitonin, tireoidni hormoni) ili uslijed poremećaja funkcije autonomnoga živčanoga sustava (prevlast parasimpatikusa). Tu vrstu proljeva susrećemo kod bolesnika sa sindromom iritabilnoga kolona, stanjima nakon vagotomije ili autonomne disfunkcije (šećerna bolest, sklerodermija).
Klinički pristup. Osnovna obrada bolesnika s kroničnim proljevom uključuje: 1) rutinske laboratorijske pretrage (kompletna krvna slika, biokemijski jetreni markeri, proteini, elektroliti, upalni parametri), 2) rutinske pretrage stolice (leukociti, laktoferin, okultno krvarenje, elektroliti, mikrobiološka obrada) te 3) endoskopsku obradu (gastroskopija, kolonoskopija). U slučaju da te pretrage ne dovedu do dijagnoze, ona se proširuje ovisno o kliničkoj sumnji. Često je kod ovih bolesnika potrebno isključiti i celijakiju, zbog čega se uzimaju uzorci sluznice početnoga tankog crijeva za patohistologiju, a rade se i serološki testovi za određivanje glutenske intolerancije. Liječenje kroničnoga dijarealnoga sindroma temelji se na etiologiji, a simptomatski se mogu primjenjivati lijekovi koji smanjuju i ublažavaju proljeve (antidijaroici). U tu se svrhu najčešće primjenjuje loperamid koji smanjuje crijevnu peristaltiku vezujući se za opioidne receptore smještene u crijevnoj stijenci. Loperamid se ne smije rutinski davati kod upalnih proljeva.
ZATVOR ILI KONSTIPACIJA
Definicija. Konstipacija je naziv za stanje pri kojemu bolesnik ima manje od tri defekacije (pražnjenja crijeva) tijekom jednoga tjedna u vremenskome periodu od najmanje nekoliko mjeseci, dok je opstipacija naziv za potpuni izostanak defekacije.
Etiopatogeneza. S obzirom na uzrok i mehanizam nastanka, dijeli se u dvije skupine: primarnu i sekundarnu.
Primarna konstipacija ili zatvor podrazumijeva poremećaj defekacije koji nastaje u odsutnosti strukturnih ili sistemskih bolesti te primarno nastaje kao posljedica poremećaja normalne funkcije crijevne peristaltike i analnih sfinktera. Karakteriziraju ju dva osnovna poremećaja: 1) hipomotilitet crijeva i spor prolaz stolice kroz debelo crijevo (normalno vrijeme prolaza stolice kroz kolon je 35 do 40 sati, a kod ovih bolesnika to može biti i dulje od 72 sata) te 2) inkoordinacija između relaksacije analnih sfinktera i mišića zdjeličnoga dna u prisutnosti povećanoga intraabdominalnog tlaka (normalno, tijekom napinjanja mišića koji proizvode povećan intraabdominalni tlak potreban za izbacivanje stolice mišići zdjeličnoga dna i analni sfinkteri moraju se relaksirati). Različiti su čimbenici koji predisponiraju razvoj primarne konstipacije: prehrambene navike (hrana s malo ostataka), smanjen unos tekućine, smanjena tjelesna aktivnost i sjedilački način života, prirođena slabost i hipomotilitet crijevne muskulature, slabljenje mišićnoga tonusa crijevne muskulature udruženo sa starenjem te psihički uvjetovana konstipacija.
Sekundarna konstipacija ili zatvor može nastati kao rezultat strukturnih bolesti crijeva, sistemskih bolest te kao nuspojava primjene određenih lijekova (Tablica 4.3.).
|
Tablica 4.3. Etiologija sekundarne konstipacije
|
|
Strukturne bolesti crijeva
|
Sistemske bolesti
|
Nuspojave lijekova
|
|
Tumori rektuma i kolona
Upalne i druge strikture
Divertikulitis
Analna fisura i fistule
Rektalni prolaps, rekokela
Hirschprungova bolest
Sindrom iritabilnoga kolona
|
Endokrini poremećaji (hipotireoza, dijabetes melitus, hiperparatireoidizam)
Metabolički poremećaji (hipokalijemija, hiperkalcijemija, uremija, porfirija)
Neurološki poremećaji (multipla skleroza, Parkinsonova bolest, oštećenje sakralnoga živca, autonomna neuropatija)
|
Opioidni analgetici
Blokatori kalcijskih kanala
Antikolinergici
Suplementi kalcija i željeza
Klonidin
Kolestiramin
Diuretici
|
Klinička slika. Bolesnici s konstipacijom i opstipacijom žale se na osjećaj nadutosti i težine u trbuhu, a sama defekacija je otežana, praćena velikim naporom i istiskivanjem tvrde stolice (predugo zadržavanje stolice u kolonu dovodi do apsorpcije vode i formiranja stolice tvrde konzistencije). Zbog napinjanja tijekom defekacije dolazi do porasta tlaka u hemeroidalnim spletovima, zbog čega su česti hemoroidi i posljedično krvarenje.
Klinički pristup. Dobro uzeta anamneza i klinički pregled (uključujući digitorektalni pregled) u većine bolesnika omogućava razlikovanje primarnoga i sekundarnog zatvora. Kod svih bolesnika treba obaviti laboratorijsku obradu koja uključuje određivanje kompletne krvne slike, serumskih elektrolita, uključujući kalcij, glukoze u krvi te hormona štitnjače. Kod rizičnih bolesnika ili onih sa simptomima i znacima alarma (stariji od 50 godina, teška konstipacija, hematohezija, gubitak na težini, stolica pozitivna na okultno krvarenje, pozitivna obiteljska anamneza na tumore debeloga crijeva) potrebno je proširiti obradu endoskopskim pretragama, primarno kolonoskopijom. Liječenje konstipacija uključuje opće i medikamentozne mjere. Opće mjere podrazumijevaju promjenu prehrambenih navika (uzimanje hrane s više ostataka, veće količine tekućine) te životnoga stila (uvođenje hodanja, tjelovježbe). Za liječenje zatvora koriste se laksativi, među kojima razlikujemo nekoliko skupina. Osmotski laksativi dovode do poticanja lučenja tekućine u crijevo što se temelji na prolazu molekula vode u lumen crijeva zbog razlike u koncentracijskom gradijentu koji stvaraju osmotski aktivne čestice u crijevu. Oni se najčešće koriste kao prvi izbor u liječenju konstipacije, a od njih razlikujemo magnezijev hidroksid, laktuloza, 70 %-tni sorbitol te polietilen-glikol. Stimulirajući laksativi djeluju tako da potiču aktivno lučenje tekućine u crijevo djelujući na enterocite, a u među njih ubrajamo bisakodil, senu, lubiproston, linaklotid i plekanatid. Koriste se kod bolesnika koji ne pokazuju odgovor na osmotske laksatve. Antagonisti opioidnih receptora (metilnaltrekson, naloksegol, naldemedin) blokiraju opiodine receptore u probavnom sustavu čija stimulacija dovodi do relaksacije glatke muskulature. Koriste se u liječenju konstipacije povezane s korištenjem opioidnih analgetika. Bolesnike koji ne reagiraju na standardno liječenje potrebno je uputiti na specifičnu obradu koja uključuje funkcijske dijagnostičke pretrage kao što su anorektalna manometrija, defekografija (rendgensko ili MRI snimanje čina defekacije) te mjerenje vremena prolaza stolice kroz debelo crijevo (radiološko praćenje markera).
DIJAGNOSTIČKE METODE I POSTUPCI U GASTROENTEROLOGIJI
Od dijagnostičkih metoda i postupaka u gastroenterološkoj praksi najčešće koristimo sljedeće: različite laboratorijske testove, slikovne radiološke metode, endoskopske pretrage gornjega i donjeg segmenta probavnoga sustava, te tzv. funkcijske testove probavnoga sustava.
LABORATORIJSKE PRETRAGE
Nakon uzimanja dobre anamneze i statusa kod pacijenta, daljnja dijagnostička obrada najčešće se sastoji od različitih osnovnih laboratorijskih testova: sedimentacija eritrocita, kompletna krvna slika, od markera upale CRP (C reaktivni protein), elektroliti, urea, kreatinin, proteinogram.
Biokemijski pokazatelji hepatocelularnoga oštećenja su jetrene transaminaze i laktat dehidrogenaza. Povišenje ovih biokemijskih parametra upućuje na oštećenje jetrenoga parenhima, budući da se oni oslobađaju u cirkulaciju nakon nekroze hepatocita.
Jetrene transaminaze obuhvaćaju određivanje dva enzima koji sudjeluju u prijenosu amino-grupa unutar hepatocita, a to su aspartat-aminotransferaza (AST) i alanin-aminotransferaza (ALT). Najveći značaj povišenje vrijednosti tih enzima ima u dijagnostici akutnih bolesti jetre, dok je njihova specifičnost i osjetljivost kod kroničnih bolesti jetre znatno manja (tada je većina hepatocita već oštećena i zamijenjena fibroznim tkivom). S obzirom na to da se ti enzimi nalaze i u drugim stanicama, oni nisu u potpunosti specifični za bolesti jetre. AST možemo naći, osim u jetri, i u brojnim drugim tkivima i organima - kao što su srce, skeletni mišići, gušterača, bubreg, mozak i pluća, dok se ALT pretežno nalazi u jetri i bubrezima. To ga čini specifičnijim i osjetljivijim za otkrivanje bolesti jetre, stoga se ta dva enzima uvijek skupno određuju i interpretiraju. Vrijednosti AST-a i/ili ALT-a veće od 300 U/L gotovo su uvijek posljedica bolesti jetre, iznimno rijetko mogu biti posljedica drugoga poremećaja (npr. izražena rabdomioliza). Normalne vrijednosti za AST su 8 - 30 U/L, dok su za ALT 10 - 36 U/L. Kod interpretacije nalaza uobičajeno dobivene vrijednosti kategoriziramo u tri stupnja: blago povišene (do 300 U/L), umjereno povišene (300 do 1000 U/L) i visoko povišene (> 1000 U/L). Visoko povišene vrijednosti AST-a i ALT-a ukazuju na velika i akutna jetrena oštećenja, kao što je to u slučaju akutnoga virusnoga hepatitisa, toksičnoga oštećenja jetre (lijekovima, toksinima), ishemijskoga oštećenja jetre, akutne bilijarne opstrukcije te autoimunoga hepatitisa. Kod intrepretacije blago i umjereno povišenih vrijednosti, ključno je uočiti omjer porasta AST-a i ALT-a. Kod većine jetrenih bolesti ALT je veći od AST-a, uz izuzetak alkoholne bolesti jetre i Reyeova sindroma gdje je AST veći od ALT-a. Također, kod interpretacije nalaza treba misliti i na bolesti i stanja koja mogu dovesti do značajnoga porasta ili sniženja tih enzima. Do porasta može doći uslijed tjelovježbe, hemolize ili ozljede mišića, a snižene vrijednosti nalazimo kod bolesnika s uremijom kod kojih gornja granica normalnih vrijednosti iznosi oko 50 % vrijednosti prisutne kod zdravih osoba.
Laktat dehidrogenaza (LDH) kao pokazatelj hepatocelularnoga oštećenja ima ograničeno mjesto u dijagnostici jetrenih bolesti s obzirom na to da se nalazi u gotovo svim stanicama i organima, zbog čega ima izuzetno nisku specifičnost i osjetljivost. Iz tog se razloga ni ne određuje u rutinskoj praksi. Dijagnostička vrijednost određivanja LDH-a u bolestima jetre dolazi do izražaja u dijagnostici ishemijskoga oštećenja jetre kada uz izraženo povišene vrijednosti ALT-a i AST-a nalazimo i izraženo visoke vrijednosti LDH-a, dok kod drugih patologija ne nalazimo toliko brz i značajan porast.
Biokemijski pokazatelji kolestaze ili zastoja u otjecanju žući jesu alkalna fosfataza, gama-glutamil transferaza, bilirubin i 5-nukleotidaza. Povišene vrijednosti tih biokemijskih pokazatelja nalazimo kod bolesnika s opstrukcijom bilijarnoga trakta što se klinički manifestira ikterusom (žuticom).
Alkalna fosfataza (ALP) enzim je koji ubrzava hidrolizu fosfatnih estera, a u najvećoj se mjeri nalazi u organima s izraženim aktivnim metabolizmom kao što su jetra, koštano tkivo, posteljica, crijeva, bubrezi i leukociti. U kliničkoj se praksi porast ALP-a povezuje s hepatobilijarnom ili koštanom patologijom. Povišene vrijednosti ALP-a nalazimo kod intrahepatičke ili ekstrahepatičke bilijarne opstrukcije (obično umjereno povišena), infiltrativnih i parenhimskih bolesti jetre (obično visoko povišena > 1000 U/L), koštane patologije (prijelomi, osteomalacija, primarni koštani tumori i koštane metastaze), a rjeđe se mogu naći kod nekih drugih bolesti i stanja (hipertireoza, akromegalija, mijelofibroza, infarkt bubrega i pluća). Fiziološki, umjereno povišene vrijednosti ALP-a nalazimo u trudnoći te u djetinjstvu i adolescenciji, što je povezano s povećanim metaboličkim potrebama i aktivnošću. Razlučivanje hepatobilijarne od koštane patologije postiže se istodobnim određivanjem drugih pokazatelja kolestaze, kao što je gama-glutamil transferaza (u slučaju koštane patologije ALP je izolirano povišen, dok je vrijednost gama-glutamil transferaze uredna). Pri interpretaciji nalaza ALP-a na umu treba imati i bolesti i stanja koja mogu dovesti do sniženih vrijednosti - kao što su hipotireoza, Wilsonova bolest, perniciozna anemija te neki lijekovi (alendronat, teofilin, estrogeni).
Gama-glutamil transferaza (GGT) mikrosomalni je enzim kojega osim u jetri nalazimo i u mnogim drugim tkivima i organima, kao što su proksimalni bubrežni tubuli, gušterača i crijeva. Činjenica da se on povisi kod gotovo svih bolesti jetre i da povišene vrijednosti mogu biti rezultat indukcije lijekovima čini ga manje osjetljivim i specifičnim. Glavni klinički značaj određivanja GGT-a leži u istodobnom određivanju s ALP-om, zbog diferenciranja porasta ALP-a (koštano ili hepatobilijarno porijeklo).
Bilirubin predstavlja razgradni produkt hemoglobina koji se luči putem žuči, a da bi se izlučio iz hepatocita u žučne kanale mora se konjugirati s glukuronskom kiselinom - što se zbiva u hepatocitima. U praksi se najčešće određuje ukupni bilirubin, ali za preciznije određivanje uzroka hiperbilirubinemije potrebno je odrediti frakciju konjugiranoga i nekonjugiranoga bilirubina. Nekonjugiranu hiperbilirubinemiju obično uzrokuju ekstrahepatalne bolesti i stanja vezana uz pojačanu razgradnju hemoglobina (hemoliza, afunkcionalna eritropoeza, resorpcija velikih hematoma), kao i specifični sindromi poremećene konjugacije bilirubina (Crigler-Najjarov sindrom, Gilbertov sindrom). Konjugirana hiperbilirubinemija gotovo je uvijek posljedica hepatocelularne bolesti ili kolestaze (intrahepatička, ekstrahepatička).
5-nukleotidaza (5-NT) unutarstanični je membranski glikoprotein koji se nalazi u mnogim stanicama i tkivima, ali dominira u hepatocitima. Rijetko se određuje u kliničkoj praksi, najčešće prilikom interpretacije nalaza povišenoga ALP-a, slično kao i GGT. Povišene vrijednosti mogu se naći i uslijed drugih bolesti jetre, osobito u slučaju metastatskih infiltrativnih promjena. Vrlo je osjetljiv marker kolestaze.
Biokemijski pokazatelji sintetske funkcije jetre su određivanje vrijednosti albumina, protrombinskoga vremena te kolinesteraze. Produljeno protrombinsko vrijeme te snižene vrijednosti proteina, albumina i kolinesteraze sugeriraju na smanjenu sintetsku funkciju jetre.
Albumini čine 60 % ukupnih proteina u organizmu. U potpunosti se sintetiziraju u jetri, stoga zauzimaju bitnu ulogu u procjeni sintetske funkcije jetre. Ipak, s obzirom na to da na vrijednosti albuminā utječu različita druga stanja i bolesti, oni nisu niti osjetljivi niti specifični za bolest jetre i nalaz je potrebno interpretirati u skladu s kliničkom slikom i drugim laboratorijskim nalazima. Snižene vrijednosti albumina, osim kod bolesti jetre, nalazimo i kod drugih bolesti, kao što su malapsorpcijski sindrom, nefrotski sindrom, pojačani gubitak putem kože (opekline, eksudativne bolesti), kronične upale i maligna oboljenja. S obzirom na to da je poluvrijeme života albumina tri tjedna, njihovo određivanje u smislu procjene sintetske funkcije jetre ima veće značenje kod kroničnih bolesti nego akutnih bolesti jetre.
Protrombinsko vrijeme (PV) odražava funkciju vanjskoga puta zgrušavanja, a faktori zgrušavanja uključeni u taj put sintetiziraju se u jetri. Produljenje PV-a uslijed bolesti jetre javlja se kada je uništeno (afunkcionalno) više od 80 % jetrenoga parenhima. Osim bolesti jetre, produljeni PV možemo naći i kod primjene varfarina, manjka vitamina K te uređene ili stečene deficijencije faktora VII. U diferencijalnoj dijagnozi tih stanja vodimo se anamnestičkim podacima (uzimanje varfarina) te parenteralnom primjenom vitamina K (kod manjka vitamina K kao uzroka produljenoga PV-a, ubrzo se kroz nekoliko sati prati oporavak vrijednosti PV-a, dok kod bolesti jetre on i dalje ostaje produljen). Poluvrijeme života čimbenika zgrušavanja iznosi nekoliko sati, pa je u odnosu na određivanje albumina, čije poluvrijeme iznosi tri tjedna, procjena PV-a bolji odraz sintetske funkcije kod akutnih bolesti jetre.
Kolinesteraza (CHE) predstavlja specifični enzim koji se sintetizira u jetri i potom otpušta u krvotok pa se njegove snižene vrijednosti povezuju s njezinom smanjenom sintetskom funkcijom, a svoje mjesto ima u procjeni težine jetrene funkcije kod kroničnih bolesti jetre.
Biokemijski pokazatelji metaboličke funkcije jetre. U standardnoj se kliničkoj praksi određivanje vrijednosti amonijaka koristi kao pokazatelj metaboličke funkcije jetre. Amonijak predstavlja završni produkt razgradnje nukleinskih kiselina i aminokiselina, a jetra ga potom pretvara u ureju koja se putem bubrega luči iz organizma. Iako do sada još nije razjašnjena patofiziološka uloga amonijaka u nastanku hepatalne encefalopatije, njegove povišene vrijednosti imaju velik dijagnostički značaj u postavljanju te dijagnoze, osobito kod bolesnika s poremećajem stanja svijesti. Određivanje amonijaka ne provodi se rutinski, nego samo kod onih bolesnika kod kojih se sumnja na hepatalnu encefalopatiju. Također, treba imati na umu da uredne vrijednosti amonijaka ne isključuju tu dijagnozu. Osim kod hepatalne encefalopatije, povišene vrijednosti amonijaka možemo naći i kod nekih drugih bolesti i stanja, među koje ubrajamo: profuzna i jaka krvarenja u probavni trakt, prevelik unos proteina, zatajenje bubrega, akutnu leukemiju, transfuziju krvi i dr.
Biokemijski pokazatelji pankreasnoga oštećenja. Osnovni biokemijski pokazatelji pankreasnoga oštećenja su probavni enzimi amilaze i lipaze, a značajnu ulogu imaju u postavljanju dijagnoze akutnoga pankreatitisa.
Amilaze predstavljaju enzime koji razgrađuju složene šećere, a mogu se naći u različitim tkivima i organima, iako se u najvećoj mjeri nalaze u gušterači i žlijezdama slinovnicama. Povišene vrijednosti amilaza najčešće se povezuju s dijagnozom akutnoga pankreatitisa, osobito kod bolesnika s bolovima u gornjemu dijelu abdomena. Vrijednosti amilaza rastu unutar 2 do 12 sati od početka bolesti (bolova), a povišene ostaju kroz 24 do 72 sata kada počinju lagano opadati, što se može pratiti i određivanjem vrijednosti amilaza u urinu. Normalizacija nalaza obično se dogodi unutar pet dana od početka bolesti. Uredne vrijednosti serumskih amilaza u podlozi akutnoga pankreatitisa mogu se dobiti ako se krv prerano uzorkuje (unutar dva sata od početka bolesti) ili nakon više dana od pojave bolova, kao i u slučaju akutnoga recidiva kroničnoga pankreatitisa, a i kod bolesnika s alkoholnom etiologijom vrijednosti amilaza znaju biti uredne ili blago povišene. Značajna hiperlipidemija također može biti uzrok urednih vrijednosti amilaza kod akutnoga pankreatitisa (da bi se procijenila aktivnost amilaza, uzorak se mora odgovarajuće razrijediti).
Lipaze predstavljaju enzime koji sudjeluju u razgradnji masti, a smatraju se specifičnijim markerom akutnoga pankreatitisa u odnosu na amilaze, osobito ako se krv uzorkuje nakon 24 sata od pojave bolova. Vrijednosti lipaza počinju rasti unutar 4 do 8 sati od pojave bolova, najveće vrijednosti bilježe se nakon 24 sata, a vraćanje na normalu je polaganije i traje 8 do 14 dana. Kao i kod interpretacije nalaza amilaza, treba imati na umu da vrijednosti lipaza kod akutnoga recidiva kroničnoga pankreatitisa ne moraju biti povišene, uz činjenicu da i neke druge bolesti i stanja mogu biti praćena povišenim vrijednostima lipaza u serumu (Tablica 4.4.).
|
Tablica 4.4. Diferencijalna dijagnoza povišeni lipaza i amilaza u serumu
|
|
Bolesti koje mogu oponašati pankreatitis
|
Ostale bolesti i stanja
|
|
Akutna crijevna ishemija
Intestinalna opstrukcija i pseudoopstrukcija
Koledokolitijaza
Kolecistitis
|
Ektopična trudnoća i akutni salpingitis
Akutni parotitis
Karcinom pluća
Trauma glave
|
Tumorski markeri su tvari koje su po svome sastavu najčešće proteini, a u pojačanoj se mjeri stvaraju u određenim tumorskim stanicama, pa se njihove povišene vrijednosti povezuju s pojavom tumora. Ipak, oni nemaju veći značaj u dijagnostičkoj obradi bolesnika, s obzirom na njihovu nisku osjetljivost. Osim za postavljanje dijagnoze, određivanje i praćenje tumorskih markera imaju i druge indikacije: probir zdrave populacije, prognoza bolesti, praćenje učinkovitosti liječenja i pojave recidiva bolesti. U gastroenterologiji se određuju različiti tumorski markeri: alfafetoprotein (AFP), (hepatocelularni karcinom), karcinoembrionalni antigen (kolorektalni karcinom), karbohidratni antigen (CA 19-9), (karcinom gušterače), antigen karcinoma, CA 72-4 (karcinom želuca) i dr. Više o ulozi pojedinih tumorskih markera u dijagnostici malignih bolesti organa probavnoga sustava zasebno je opisano u odgovarajućim dijelovima udžbenika.
SLIKOVNE DIJAGNOSTIČKE METODE
Najznačajnije slikovne metode u gastroenterologiji i hepatologiji su: konvencionalna radiografija, kontrastna radiografija, ultrasonografija, kompjuterizirana tomografija, magnetna rezonanca te radionuklidna scintigrafija.
Konvencionalna radiografija. Nativna radiološka snimka abdomena u stojećemu ili bočnom položaju u prvome se redu koristi u dijagnostici perforacije šupljega organa te mehaničkoga ili paralitičkog ileusa. Za perforaciju šupljega organa karakterističan je srp zraka pod ošitom, što se jasno vidi kod bolesnika slikanih u stojećemu položaju, budući da se zrak koji iz šupljega organa ulazi u trbušnu šupljinu nakuplja ispod ošita. Kod bolesnika s ileusom jasno se vide distendirane vijuge tankoga i/ili debelog crijeva, kao i areolikvidne razine koje predstavljaju presjeke lumena crijeva u čijemu se donjem dijelu nalazi tekući sadržaj, dok se u gornjemu dijelu lumena nakuplja zrak. Osim tih nalaza, na nativnoj snimci abdomena mogu se detektirati i kalcificirani žučni kamenci u području žučnoga mjehura i/ili vodova, pojava zraka u području žučnoga mjehura u slučaju emfimatoznoga kolecistitisa, kalcifikati pankreasa kod kroničnoga pankreatitisa i dr.
Kontrastna radiografija. Radiološki prikaz probavnih organa ispunjenih kontrastnim sredstvom omogućava prikaz lumena i sluzničnih detalja organa probavne cijevi (erozije, ulkusi, polipi, tumori, stenoze), iako u eri široko dostupne endoskopije i drugih naprednih radioloških pretraga ova metoda sve više gube svoj smisao i značaj. Kao kontrastno sredstvo najčešće se koristi barijev sulfat, netopljiv u vodi, ili vodotopljive otopine, kao što je otopina natrijeva amidotrizoata, koje se daju pri sumnji na perforaciju. Te pretrage mogu biti statičke i dinamičke. Statičke omogućavaju prikaz patoloških promjene (sluznički defekti, stenoze, dilatacije, divertikuli), dok dinamičke omogućavaju praćenje prolaza kontrasta u realnom vremenu metodom rendgenske dijaskopije što se najčešće izvodi kod funkcijskih ispitivanja (npr. čin gutanja, dijaskopska defekografija). Najčešće kontrastne radiološke metode u gastroenterologiji su: 1) pasaža jednjaka i gastroduodenuma koja omogućava analizu jednjaka, želuca i dvanaesnika nakon peroralno unešenoga kontrasta; 2) enterokliza koja omogućava prikaz tankoga crijeva nakon unosa kontrasta putem nazoduodenalne sonde i farmakološke relaksacije crijeva te 3) irigografija koja omogućava prikaz debeloga crijeva nakon unosa kontrasta putem klizme. Ipak, zbog svojih se nedostataka svaki radiološki nalaz mora potvrditi endoskopskim pregledom kada god je to moguće.
Ultrasonografija je jedna od najčešće korištenih slikovnih metoda u gastroenterologiji i hepatologiji koja omogućava kvalitetnu analizu solidnih organa i organa ispunjenih tekućim sadržajem. Lako se izvodi (može i uz krevet bolesnika) te ne proizvodi štetna zračenja. Najčešći je pristup transabdominalni, ali danas se sve više koriste i drugi pristupi kod određenih indikacija, kao što je transrektalni ili transvaginalni pristup, a u širokoj je primjeni i endoskopski ultrazvuk kojime se detaljnije može analizirati dubina invazije sluzničke patologije. Najčešće gastroenterološke indikacije za ultrazvučni pregled abdomena jesu sumnja na patološka zbivanja u jetri, žučnoj vrećici i žučnim kanalima, te patološka zbivanja u gušterači (iako je vizualizacija često otežana uslijed meteorizma crijeva). Osim toga, ultrazvuk abdomena omogućava prikaz tekućine u slobodnoj trbušnoj šupljini, zadebljanja crijevne sluznice, a veliku ulogu ima i u diferencijalno-dijagnostičkom smislu (pregled bubrega i mokraćnoga mjehura, pregled genitalnih organa, aorte i sl). Glavni limitirajući čimbenici su meteorizam (ultrazvuk ne prolazi kroz plinoviti sadržaj) te tjelesna konstitucija bolesnika (prekomjerna količina masnoga tkiva). Opcijom obojenoga doplera (engl. Color Doppler) ultrazvukom se mogu analizirati i veće krvne žile (arterije i vene) kao što su mezenterične arterije i vene, kao i portalni sliv te hepatalne vene, što čini okosnicu dijagnostike vaskularnih poremećaja crijeva i jetre. Ultrazvuk ima značajno mjesto i u izvođenju invazivnih dijagnostičkih procedura kao što su biopsija jetre, abdominalna punkcija, transjugularni intrahepatalni portosistemski spoj i sl. Ultrazvučna elastografija (FibroScan) dodatna je ultrasonografska metoda kojom se služimo u procjeni fibroze jetre, a temelji se na principu da je brzina širenja ultrazvučnoga vala kroz jetru izravno proporcionalna tvrdoći tkiva jetre, odnosno udjelu fibroznoga tkiva.
Kompjuterizirana tomografija (CT) predstavlja jednu od najznačajnijih slikovnih dijagnostičkih metoda kod bolesti organa probavnoga sustava i trbuha. CT omogućava detaljniju analizu anatomskih struktura i patomorfoloških promjena, a glavni nedostatak te pretrage čini izlaganje bolesnika visokim dozama zračenja. Indikacije za CT abdomena mogu biti hitne i elektivne. Najčešću indikaciju za hitni CT abdomena čini evaluacija netraumatskoga akutnog abdomena te je danas CT abdomena postao metoda izbora u dijagnostici akutnoga apendicitisa, akutnoga divertikulitisa, uzroka mehaničkoga ileusa, intraabdominalnih apscesa i akutnoga pankreatitisa. U hitnoj proceduri najčešće se izvodi nativni CT abdomena (bez primjene kontrasta). U elektivnoj proceduri CT abdomena najčešće se koristi u dijagnostici i praćenju bolesnika s malignim oboljenjima (dijagnostika primarnih tumora, procjena proširenosti maligne bolesti, praćenje terapijskoga odgovora i sl.), a tada se obično CT izvodi uz primjenu kontrastnoga sredstva (peroralno, intravenski). Uz klasičan CT u kliničkoj praksi, danas se izvode i CT angiografija te CT enterografija i kolonografija (tzv. virtualna endoskopija). CT angiografija koristi se za prikaz krvnih žila, abdominalne aorte i njezinih ogranaka, a najčešće se koristi za otkrivanje krvarenja u probavnome sustavu, osobito ako endoskopski nije pronađen izvor krvarenja ili je on u tankome crijevu. CT enterografija omogućava prikaz tankoga crijeva, njegove unutrašnjosti i promjena na sluznici primjenom peroralnoga i intravenskog kontrasta te računalnom obradom dobivenih CT presjeka. Navedena pretraga ima veliku dijagnostičku ulogu u otkrivanju upalnih procesa te tumorskih promjena, a omogućava i određivanje njihove proširenosti. Dodatnu kliničku težinu toj pretrazi daje činjenica da je tanko crijevo samo po sebi teže dostupno klasičnim endoskopskim pretragama. Na sličan je način moguć i prikaz debeloga crijeva što se naziva CT kolonografija, za koju se bolesnici moraju pripremiti kao i za klasičnu kolonoskopiju, a za bolji prikaz sluznice debeloga crijeva dodatno se prije pretrage u debelo crijevo putem katetera insuflira ugljični monoksid. Uloge ovih pretraga detaljno su opisane u pojedinim dijelovima udžbenika.
Magnetna rezonanca (MRI) rjeđe se koristi u dijagnostici bolesti probavnih organa u odnosu na kompjuteriziranu tomografiju, a glavne su joj prednosti bolja razlučivost mekotkivnih struktura te izostanak štetnoga ionizirajućeg zračenja. Zbog navedene bolje razlučivosti, MRI se najčešće koristi u dodatnoj obradi žarišnih promjena koje su otkrivene nekim drugim pretragama (npr. MRI male zdjelice u procjeni raširenosti karcinoma rektuma ili pregled cirotične jetre u probiru za hepatocelularni karcinom). Kao i kod kompjuterizirane tomografije, dodatna primjena kontrastnih sredstava omogućava bolji prikaz i razlikovanje promjena na promatranim strukturama (npr. intravenska primjena gadolinija pri procjeni žarišnih lezija jetre). MR enterografija uz primjenu peroralnih sredstava koja dovode do distenzije i spazmolitika koji umiruju peristaltiku predstavlja superiorniju metodu pregleda tankoga crijeva u odnosu na CT enterografiju, osobito pri procjeni aktivnosti Crohnove bolesti, s obzirom na to da se izbjegava ionizirajuće zračenje. To posebno dolazi do izražaja u mladih bolesnika kod kojih se pretraga češće izvodi. MR kolangiografija (MRCP) omogućava detaljnu analizu žučnih i pankreasnih vodova te ima značajnu ulogu u dijagnostici opstrukcije žučnih vodova (koledokolitijaza, primarni sklerozirajući kolangitis, Carolijeva bolest). MRCP se danas smatra pretragom izbora u obradi bolesnika sa sumnjom na bolest žučnih kanala, osim kada postoji potreba i za intervencijskom procedurom tada se preferira ERCP.
Nuklearno-medicinska dijagnostika. Radionuklidne slikovne metode danas su slabije zastupljene u dijagnostičkoj obradi gastroenteroloških bolesnika. Dvije najčešće indicirane metode toga tipa su: scintigrafija krvarenja iz probavnoga sustava te primjena pozitron-emisijske kompjuterizirane tomografije za detekciju udaljenih metastaza kod bolesnika s malignim bolestima probavnih organa. Scintigrafija krvarenja iz probavnoga sustava podrazumijeva primjenu radioobilježenih eritrocita (tehnecij) te serijsko snimanje trbuha gama kamerom kako bi se pronašlo mjesto ekstravazacije i nakupljanja eritrocita. Ova dijagnostička metoda je pouzdana, ali daje slabu anatomsku lokalizaciju krvarenja, stoga je CT angiografija superiornija metoda za ovu kliničku indikaciju. PET-CT se primjenjuje kod bolesnika s malignom bolesti probavnih organa s ciljem otkrivanja udaljenih metastaza, što se obavlja tijekom procesa otkrivanja proširenosti bolesti. Pretraga se temelji na intravenskoj primjeni 5-fluorodeoksiglukoze koja ima tendenciju pojačanoga nakupljanja u tumorskim stanicama.
ENDOSKOPIJA
Endoskopske pretrage danas zauzimaju vodeće mjesto u gastroenterologiji, ne samo u dijagnostičkom, nego i u terapijskom smislu. One omogućavaju izravnu vizualizaciju sluznice organa probavne cijevi, uočavanje patoloških promjena te uzimanje uzoraka za patohistološku dijagnozu. Osim toga, danas se uz pomoć endoskopije mogu izvesti i brojni terapijski zahvati koji su u znatnoj mjeri smanjili potrebu za operativnim liječenjem (npr. liječenje komplikacija ulkusne bolesti, uklanjanje površinskih tumora i sl.). Najznačajnije endoskopske metode su endoskopija gornjega probavnog trakta (ezofagogastroduodenoskopija), endoskopija donjega dijela probavnoga trakta (kolonoskopija, rektosigmoidoskopija, rektoskopija), endoskopska retrogradna kolangiopankreatografija, balon-enteroskopija te endoskopija videokapsulom. U endoskopske pretrage ubrajamo i endoskopski ultrazvuk koji danas ima sve veću ulogu u procjeni proširenosti maligne bolesti organa probavne cijevi. Danas se pri izvođenju endoskopskih pretraga koristi fleksibilni videoendoskop. On na svojemu vrhu ima kameru s izvorom svjetlosti i priključen je na endoskopski stup s monitorom na kojemu se prikazuje slika. Vrh endoskopa je pomičan te ga se može usmjeravati u svim smjerovima, a kroz cijeli endoskop prolazi radni kanal koji omogućava upuhivanje (insuflacija) zraka i ispiranje tekućinom, kao i uvođenje specifičnih instrumenata potrebnih za izvođenje određenih dijagnostičkih ili terapijskih procedura. Osim toga, na raspolaganju su i endoskopi s povećalima koji omogućavaju promatranje sitnih detalja, kao i endoskopi s različitim modalitetima prikazivanja (npr. konfokalna endomikroskopija, autofluorescencija).
Dijagnostička endoskopija podrazumijeva izravnu vizualizaciju površina sluznice organa probavne cijevi i uočavanje patoloških promjena, a u najvećoj mjeri ovisi o iskustvu endoskopičara i provedenoj pripremi probavne cijevi za pretragu. Svaka sumnjiva promjena može se bioptirati, odnosno moguće je uzeti komadić tkiva koji se potom šalje na patohistološku analizu. Uzimanje tkiva provodi se specifičnim instrumentima kao što su biopsijska kliješta ili četkica koji se uvode kroz radni kanal endoskopa.
Terapijska endoskopija podrazumijeva izvođenje terapijskih procedura kao što su zaustavljanje krvarenja (injekcijska skleroterapija, dijatermija, ligacija, laserska terapija, postavljanje klipsi), uklanjanje tumorskih procesa (laserska terapija, polipektomija, radiofrekventna ablacija, endoskopska mukozna i submukozna resekcija), liječenje striktura i stenoza (postavljanje stentova, balonska dilatacija, bužiranje) i sl. Ove endoskopske procedure u velikoj su mjeri zamijenile invazivnije kirurške procedure koje nose veći rizik od razvoja komplikacija te dugotrajniji oporavak.
Endoskopija gornjega probavnoga trakta podrazumijeva pregled jednjaka, želudaca i početnoga dijela dvanaesnika (ezofagogastroduodenoskopija), a indikacije su brojne: bolesnici sa simptomima i znacima alarma poput anemije, disfagija i odinofagija, hematemeze i melene, pozitivnoga hemokult testa, gubitka na tjelesnoj težini, palpabilne tumorske tvorbe u gornjem abdomenu, dijagnostika varikoziteta jednjaka kod bolesnika s cirozom jetre, uporno povraćanje, biopsije dvanaesnika pri sumnji na celijakiju i dr. Glavne kontraindikacije (relativne) su teški šok, teški respiratorni distres, nedavni akutni infarkt miokarda, nestabilna angina ili hemodinamski značajan poremećaj srčanoga ritma, atlantookcipitalna subluksacija. Bolesnik prije pretrage ne bi trebao jesti ni piti barem četiri sata, a kod hitnih se procedura u svrhu poticanja pražnjenja želuca primjenjuje eritromicin koji ima prokinetičko djelovanje. Sama pretraga traje 5 do 15 minuta, ovisno o nalazu i postupku, a tijekom pretrage se bolesnik nalazi u lijevom bočnom položaju. Pretraga se može izvesti i uz laganu analgosedaciju pri čemu treba pratiti bolesnika, osobito njegovu respiratornu funkciju. Najčešće komplikacije koje prate ovu pretragu su aspiracija i aspiracijska pneumonija, perforacija te kardiorespiratorna depresija kod analgosediranih bolesnika.
Endoskopija donjega probavnog trakta podrazumijeva pregled rektuma, kolona te početnoga dijela terminalnoga ileuma (kolonoskopija, rektosigmoidoskopija, rektoskopija). Najčešće indikacije su: suspektna upalna bolest crijeva, kronični proljev, poremećaji u navikama pražnjenja crijeva, rektalno krvarenje, kronična sideropenična anemija, probir za kolorektalni karcinom, praćenje bolesnika nakon polipektomije ili kirurškoga liječenja neoplazme i dr. Kontraindikacije su jednake kao i za gastroskopiju, uz dodatak akutnoga teškoga ulceroznog kolitisa i toksičnoga megakolona. Bolesnici se prije pretrage moraju pripremiti, a sama priprema uključuje pridržavanje uputa o prehrani (ograničiti unos hrane s malo ostataka 48 sati prije, a potpuno obustaviti unos hrane 24 sata prije same procedure) i čišćenju crijeva (gorka sol, polietilen-glikol). Pretraga traje 15 do 30 minuta, a može se izvoditi s ili bez analgosedacije. Najčešće komplikacije vezane su uz analgosedaciju (kardiorespiratorna depresija), a mogu se javiti i perforacija te krvarenje iz mjesta intervencije i zahvata (uzimanje biopsije, polipektomija).
Endoskopska retrogradna kolangiopankreatografija (ERCP) je endoskopska pretraga koja se nadopunjava rendgenskom dijaskopijom u svrhu vizualizacije pankreatobilijarnoga stabla, s dijagnostičkom ili terapijskom svrhom. Pretraga se izvodi posebnim endoskopom koji se uvodi u dvanaesnik kako bi se prikazala papila Vateri kroz koju se uvodi poseban kateter te vrši ubrizgavanje kontrastnoga sredstva da bi se prikazali žučni i pankreasni vodovi (dijaskopija). Dijagnostička uloga ERCP-a danas ima manji značaj u pogledu dijagnostike bolesti pankreatobilijarnoga sustava i ampularne regije s obzirom na dobro razvijene slikovne metode kakva je MRCP, iako i danas ostaje jedina metoda koja omogućava biopsiju i uzimanje uzoraka za citološku analizu pri sumnji na malignu patologiju ampularne regije. Terapijski ERCP može biti usmjeren na liječenje bilijarne ili pankreasne patologije što uključuje odgovarajuću bilijarnu drenažu i uklanjanje kamenaca (sfinkterotomija, ekstrakcija kamenca košaricom, implantacija stenta), kao i drenažu pseudocista gušterače. Zahvat se izvodi pod općom anestezijom, a glavne su kontraindikacije teško kardiopulmonalno oboljenje te koagulopatija. Komplikacije koje prate ovaj zahvat prisutne su kod 5 do 10 % bolesnika, a mogu biti opće, kao i kod endoskopije gornjega probavnog trakta, te specifične (krvarenje, kolangitis, pankreatitis, zračna embolija).
Balon-enteroskopija omogućava pregled cijeloga tankog crijeva, a izvodi se u dubokoj sedaciji ili pod općom anestezijom. Tehnika koja se najčešće koristi je enteroskopija dvostrukim balonom (engl. push-and-pull enteroscopy) pri kojoj se pomoću dva balona koja se mogu napuhivati i ispuhivati vrši povlačenje (nabiranje) tankoga crijeva te se na taj način može analizirati segment po segment tankoga crijeva. Kao i pri klasičnoj endoskopiji, osim vizualizacije, moguće je izvesti i specifične terapijske procedure. Indikacije, kontraindikacije te komplikacije postupka jednake su kao i kod endoskopije gornjega probavnog trakta.
Endoskopija videokapsulom podrazumijeva pregled organa probavne cijevi putem videokapsule koja sadrži kameru i radio odašiljač, a kroz probavnu cijev kreće se pasivno, tj. oslanja se na crijevnu peristaltiku. Iako je ona u prvome redu bila namijenjena za potpuni pregled tankoga crijeva, ubrzo je zbog svoje neinvazivnosti postala šire prihvatljiva, najprije za pregled jednjaka (izuzetno pogodno kod sumnje na varikozitete jednjaka), a danas se koristi i za pregled debeloga crijeva. Današnje videokamere sadrže po dvije kamere s vlastitim izvorom energije, a omogućeno je snimanje različitoga broja fotografija (oko četiri fotografije u sekundi). Sve se fotografije bežično prenose na površinu tijela gdje se nalaze elektrode koje ih registriraju i potom prenose do uređaja za snimanje koji bolesnik nosi oko pojasa, a koje se potom prenose na računalo. Kapsula se izlučuje iz organizma zajedno sa stolicom. Najčešća indikacija za ovu pretragu je endoskopski pregled tankoga crijeva (krvarenje, tumori, celijakija, Crohnova bolest), no izvodi se i za pregled jednjaka pri sumnji na varikozitete te za pregled debeloga crijeva u svrhu probira za kolorektalni karcinom. Glavna je kontraindikacija sumnja na strikturu probavne cijevi na bilo kojoj razini (opasnost od retencije videokapsule), a s oprezom se primjenjuje i kod osoba s ugrađenim elektrostimulatorom ili kardioverterom. Retencija videokapsule bilježi se kod manje od 1 % osoba.
Endoskopski ultrazvuk (EUS) izvodi se pomoću posebnih endoskopa koji na svojemu vrhu imaju ultrazvučnu sondu ili uz pomoć samostalnih ultrazvučnih sondi koje se uvode preko radnoga kanala. EUS omogućava analizu patomorfoloških lezija same stijenke organa probavne cijevi, ali i susjednih struktura - kao što su limfni čvorovi, krvne žile i drugi priležeći organi. EUS se najčešće koristi prilikom procjene dubine invazije tumorskoga procesa, ali i kod brojnih drugih stanja (dijagnostika tumora gušterače, kroničnoga pankreatitisa, tumora žučnih vodova, koledokolitijaze i dr.). Osim toga, uz pomoć EUS-a je moguća ciljana biopsija patološke promjene ili uzimanje materijala za citološku analizu.
UZIMANJE BIOPTIČKOGA MATERIJALA
Dijagnostičke invazivne procedure u gastroenterologiji podrazumijevaju uzimanje tkiva suspektnih patoloških tvorbi ili promjena, bilo transkutano, bilo tijekom endoskopskih procedura, pri čemu se koristi posebna oprema (tanke biopsijske igle, četke), a cijeli se postupak oslanja na korištenje slikovnih metoda koje omogućavaju preciznost same procedure (ultrazvuk, dijaskopija, kompjuterizirana tomografija). Svi dobiveni uzorci mogu se histološki ili citološki analizirati, a to kod većine bolesti predstavlja i omogućava konačnu dijagnozu bolesti. Najčešći su primjeri transkutana biopsija jetre i gušterače.
TESTOVI ZA ISPITIVANJE FUNKCIJE PROBAVNOGA SUSTAVA
Funkcijski testovi u gastroenterologiji predstavljaju testove kojima se utvrđuje sekretorna i/ili apsorptivna funkcija probavnoga sustava, a moguća su i mjerenja motiliteta pojedinih organa probavne cijevi. U tu se svrhu primjenjuju specifični testovi koji su opisani u pojedinim poglavljima udžbenika.
Od funkcijskih testova za ispitivanje motiliteta probavne cijevi najčešće se koriste manometrija jednjaka te manometrija anorektuma. Radi se o dijagnostičkim metodama koje precizno registriraju postojanje ili odsutnost peristaltične aktivnosti probavne cijevi, odnosno postojanje različitih poremećaja motoričke ili pak senzoričke funkcije probavne cijevi. Rjeđe se koriste druge manometrijske metode poput antroduodenojejunalne manometrije, manometrije bilijarnoga stabla ili manometrije kolona.
Za procjenu refluksne bolesti jednjaka koristi se pH-metrija koja predstavlja zlatni dijagnostički standard za ovu bolest. Danas se koristi kombinacija pH-metrije s impendancom kako bi se detektirao proces gutanja krute ili tekuće hrane, zraka ili pak retrogradne aktivnosti i refluksa želučanoga sadržaja.
KRVARENJA IZ PROBAVNOGA SUSTAVA
Krvarenja iz probavnoga sustava pripadaju u najčešću patologiju gastroenterološke prakse te zahtijevaju promptnu dijagnostičku i/ili terapijsku intervenciju. Razlikujemo krvarenja iz gornjega i donjeg dijela probavnoga sustava.
KRVARENJA IZ GORNJEGA DIJELA PROBAVNOGA SUSTAVA
Definicija. Krvarenje iz gornjega dijela probavnoga sustava podrazumijeva krvarenje unutar probavne cijevi čiji je izvor lokaliziran iznad Treitzova ligamenta (jednjak, želudac i dvanaesnik).
Etiologija. Najčešći uzroci krvarenja iz gornjega dijela probavnoga sustava su: 1) krvareći ulkus želuca i/ili dvanaesnika (40 % svih krvarenja), 2) komplikacije portalne hipertenzije (varikoziteti jednjaka, varikoziteti želuca i/ili dvanaesnika, portalna gastropatija), 3) erozivni ezofagitis i/ili gastritis, 4) vaskularne malformacije (angiodisplazije, teleangiektazije, Dieulafoy lezija), 5) Mallory-Weissov sindrom, 6) neoplazme jednjaka i želuca te 7) ostala rjeđa stanja (aortoenteralna fistula, hemobilija, infiltracija okolnim neoplazmama).
Klinička slika. Glavne kliničke manifestacije krvarenja iz gornjega dijela probavnoga sustava su hematemaza, melena ili rjeđe, hematohezija. Hematemeza podrazumijeva povraćanje svježe krvi i krvnih ugrušaka ili povraćanje stare, dijelom razgrađene krvi koja nalikuje talogu crne kave. Melena je naziv za crnu, katranastu stolicu intenzivnoga mirisa koja nastaje uslijed oksidacije željeza iz eritrocita, a može nastati već i kod manjih gubitaka krvi u probavni sustav (50 - 100 ml). Hematohezija (pojava svježe krvi i/ili krvnih ugrušaka na anusu) rijetka je manifestacija krvarenja iz gornjih dijelova probavnoga sustava, a nastaje kod profuznih krvarenja (gubitak krvi veći od 1000 ml u kratkome vremenskom periodu) pri čemu krv samo prolazi kroz tanko i debelo crijevo. Kod otprilike 50 % bolesnika s krvarenjem iz gornjih dijelova probavnoga sustava istodobno nalazimo hematemezu i melenu, dok 30 % bolesnika ima samo hematemezu, a 20 % samo melenu. Ovisno o jačini krvarenja, bolesnici mogu imati različito izražene simptome hemoragijskoga šoka, kao što su bljedoća, hipotenzija, tahikardija, oligurija te poremećaj svijesti.
Dijagnostički pristup i inicijalni postupci. Osnovni pristup bolesniku s krvarenjem iz gornjih dijelova probavnoga sustava uključuje uzimanje anamneze, fizikalni pregled, osiguravanje krvožilnoga pristupa i uzorkovanje krvi za pretrage i određivanje krvne grupe i interreakcije te izvođenje dijagnostičke i (najčešće) terapijske endoskopije gornjega segmenta probavnoga trakta ili gastroduodenoskopije.
Anamnestički podaci su značajni i mogu ukazivati na sam uzrok krvarenja: uzimanje nesteroidnih protuupalnih lijekova može ukazivati na krvarenje iz erozija ili ulkusa, bolesti jetre na kvarenje uslijed portalne hipertenzije ili pojačan unos alkohola i povraćanje na Mallory-Weissov sindrom i sl.
Fizikalni pregled usmjeren je na otkrivanje znakova hipovolemije i hemoragijskoga šoka kao što su izražena bljedoća kože i sluznica, hipotenzija (sistolički krvni tlak < 100 mmHg), tahikardija (puls > 100/min) uz slabo punjeni, fuliformni puls te poremećaj stanja svijesti. Prisutnost petehija i ekhimoza upućuje na prisutnost koagulopatije (hemoragijska dijateza), a treba obratiti pozornost i na prisutnost znakova jetrene bolesti (ascites, ikterus, palmarni eritem, spider nevusi i dr.).
Osiguravanje krvožilnoga pristupa i uzorkovanje krvi. Svim bolesnicima potrebno je osigurati intravenski pristup, (ponekad i dvije braunile) te uzeti krv za krvne pretrage (osnovne hematološke poput kompletne krvne slike (KKS) biokemijski i testovi koagulacije), Svakako je potrebno inicijalno odrediti krvnu grupu i interreakciju. U crvenoj krvnoj slici nalazimo smanjen broj eritrocita te snižene vrijednosti hemoglobina i hematokrita. Hematokrit nije pouzdan pokazatelj krvarenja tijekom prva 24 sata s obzirom na činjenicu da se na početku gubi puna krv, tj. isti omjer tekućega i staničnog dijela. Do razrjeđenja i pada hematokrita dolazi tek kasnije, nakon povlačenja tekućine iz intersticija ili nakon infuzijske resuscitacije. Broj trombocita i koagulogram (protrombinsko vrijeme, aktivirano parcijalno tromboplastinsko vrijeme, fibrinogen) pružaju uvid u moguće poremećaje zgrušavanja krvi koji mogu pridonijeti krvarenju (npr. produljeno protrombinsko vrijeme kod bolesnika koji su predozirani varfarinom). Kod takvih bolesnika mogu se naći i karakteristično povišene vrijednosti ureje u odnosu na vrijednosti kreatinina, što je posljedica pojačane reapsorpcije nakon razgradnje krvnih proteina unutar probavne cijevi.
Postavljanje nazogastrične sonde i aspiracija želučanoga sadržaja mogu biti od koristi u dijagnostici krvarenja iz gornjega dijela probavne cijevi (pojava hematiziranoga sadržaja), a sama lavaža želučanoga sadržaja omogućava i bolju vizualizaciju sluznica tijekom endoskopskoga pregleda te smanjuje rizik od nastanka aspiracije. Treba imati na umu da to može biti potencijalno opasno kod bolesnika s portalnom hipertenzijom (varikoziteti jednjaka, portalna gastropatija) te je stoga kontraindicirana kod svih bolesnika s poznatom bolesti jetre ili kod bolesnika s jasno izraženim kliničkim znakovima koji ukazuju na nju.
Inicijalni terapijski postupak usmjeren je na hemodinamsku stabilizaciju bolesnika koja uključuje infuzijsku resuscitaciju, primjenu krvi i krvnih pripravaka te prema potrebi vazoaktivnih lijekova.
Volumna resuscitacija podrazumijeva primjenu infuzijskih otopina, što mora biti utemeljeno na kliničkome stanju bolesnika. Kod svih hemodinamski ugroženih bolesnika potrebna je energičnija nadoknada kristaloidnim otopinama, dok je primjena koloidnih otopina, kao što je hidroksietil škrob (HES), opravdana jedino kod bolesnika s jasnim krvarenjem, izraženom hipotenzijom i nemogućnošću brze primjene krvnih pripravaka.
Transfuzijsko liječenje podrazumijeva primjenu krvnih pripravaka i specifičnih lijekova s ciljem korekcije crvene krvne slike te ispravka koagulacijskih poremećaja. Koncentrati eritrocita primjenjuju se s ciljem održavanja hemoglobina između 70 i 90 g/L (jedna doza koncentriranih eritrocita obično podiže vrijednost hemoglobina za oko 10 g/L ako je krvarenje stalo). Transfuzija trombocita primjenjuje se samo kod bolesnika čije su vrijednosti trombocita ispod 50 x 109/L ili se sumnja na njihovu disfunkciju (uremija, primjena acetilsalicilne kiseline ili klopidogrela). Primjena svježe smrznute plazme indicirana je kod svih bolesnika s produljenim protrombinskim vremenom (INR > 1,8). Ostale mjere transfuzijskoga liječenja uključuju primjenu vitamina K kod bolesnika s predoziranjem varfarinom; primjenu idarucizumaba u slučaju terapije dabigatranom (ako je prošlo manje od 12 sati od zadnje doze lijeka); primjenu faktora protrombinskoga kompleksa u slučaju potrebe za brzom korekcijom koagulograma te primjenu tri doze dezmopresina (0,3 mcg/kg) u razmaku od 12 sati u uremičnih bolesnika (poboljšanje funkcije trombocita).
Vazoaktivno liječenje indicirano je samo kod bolesnika kod kojih se ne može postići odgovarajuća hemodinamska stabilizacija (vrijednosti sistoličkoga krvnog tlaka > 90 mmHg) nakon provedene volumne resuscitacije i transfuzijskoga liječenja. Vazopresor izbora je noradrenalin.
Ezofagogastroduodenoskopija kao specifični dijagnostički i često terapijski postupak od prvorazrednoga je značenja kod ovih bolesnika i treba je inicijalno učiniti. Endoskopska intervencija indicirana je u svih bolesnika s krvarenjem iz gornjih dijelova probavnoga sustava te ju se preporuča obaviti unutar prvih 24 sata od prijema u bolnicu, odnosno dolaska u hitnu službu, a kod bolesnika kod kojih se ne može postići odgovarajuća hemodinamska stabilizacija konzervativnim metodama unutar dva sata. Endoskopska obrada u takvih bolesnika od trostruke je koristi jer pruža: 1) identifikaciju izvora krvarenja (uzrok), 2) mogućnost interventne hemostaze (kauterizacija, sklerozacija, endoklipse) te 3) utvrđivanje rizika od ponovnoga krvarenja. Kako bi se osigurala bolja vizualizacija želuca i početnoga dijela dvanaesnika, preporuča se primjena prokinetika 30 do 60 minuta prije intervencije (250 mg eritromicina iv ili 10 mg metoklopramida iv). Ako se endoskopskom intervencijom ne uspije uspostaviti odgovarajuća hemostaza, indicirano je kirurško liječenje, ali to se u današnje vrijeme rijetko susreće.
Farmakološko liječenje. Glavni lijekovi za liječenje krvarenja iz gornjih dijelova probavnoga sustava su inhibitori protonske pumpe. Za tu se svrhu preporuča inicijalna bolusna primjena pantoprazola ili esomeprazola u dozi od 80 mg nakon čega slijedi kontinuirana intravenska infuzija u dozi od 8 mg/h kroz 72 sata. Takva shema dokazano smanjuje rizik od ponovnoga krvarenja, osobito kod visokorizičnih bolesnika. Kod bolesnika s niskim rizikom od ponovnoga krvarenja (erozivni ezofagitis i gastritis, Mallory-Weissov sindrom, ulkus čistoga dna) dovoljna je i peroralna primjena inhibitora protonske pumpe u dvostrukoj dnevnoj dozi. Kod bolesnika s krvaranjem kao posljedicom komplikacija portalne hipertenzije (varikoziteti jednjaka, portalna gastropatija) indicirana je kontinuirana intravenska primjena oktreotida (100 mcg bolus nakon čega slijedi 50-100 mcg/h) s ciljem smanjenja splanhične perfuzije. U današnje se vrijeme sve više umjesto oktreotida primjenjuje terlipresin. Primjena ovih lijekova dokazano smanjuje smrtnost i učestalost ponovnoga krvarenja te se preporuča svim bolesnicima koji imaju kliničke znakove jetrene bolesti ili imaju već potvrđenu portalnu hipertenziju.
Prognoza. Kod otprilike 80 % bolesnika krvarenje iz gornjih dijelova probavnoga sustava spontano prestaje, dok se kod ostalih bolesnika to postiže endoskopskom intervencijom, vrlo rijetko kirurškim zbrinjavanjem. Uz današnje metode liječenja smrtnost je manja od 2,1 %, a rizični čimbenici uključuju dob iznad 60 godina, prisutnost drugih komorbiditeta te krvarenje koje nastaje za vrijeme hospitalizacije.
KRVARENJA IZ DONJEGA DIJELA PROBAVNOGA SUSTAVA
Definicija. Krvarenje iz donjih dijelova probavnoga sustava odnosi se na krvarenje kojemu je izvor distalno od Treitzova ligamenta, što uključuje krvarenja iz jejunuma, ileuma i kolona. U više od 95 % slučajeva radi se o krvarenju iz kolona.
Etiologija. Najčešći uzroci krvarenja iz donjega dijela probavnoga sustava su: divertikuloza, vaskularne anomalije (angiodsiplazija, teleangiektazije), neoplazme (polipi, adenokarcinom), upalna bolest crijeva (ulcerozni kolitis, Crohnova bolest), anorektalni poremećaji (hemoroidi, fisure), ishemijski kolitis te ostali, rjeđi uzroci, poput radijacijskoga kolitisa, ulceracija. Gledano prema dobi, najčešći su uzroci krvarenja iz donjega dijela probavnoga sustava kod bolesnika mlađih od 50 godina infektivni kolitis, anorektalne bolesti te upalna bolest crijeva, dok se kod starijih bolesnika najčešće radi o divertikulozi, vaskularnim anomalijama, neoplazmama i ishemiji.
Klinička slika. Kliničke manifestacije krvarenja iz donjega dijela probavnoga sustava ovise ponajprije o izvoru krvarenja: smeđa stolica prošarana ili pomiješana sa svježom krvlju sugerira na krvarenje iz anusa ili rektosigmoida, obilne količine svježe crvene krvi obično sugeriraju na krvarenje iz kolona, dok tamna i crna stolica sugeriraju na krvarenja iz tankoga crijeva. Kod 10 % bolesnika s hematohezijom izvor krvarenja je u gornjemu dijelu probavnoga sustava (opsežna krvarenja praćena hemodinamskom nestabilnosti). Spontani prestanak krvarenja pojavljuje se kod više od 70 % bolesnika.
Dijagnoza se postavlja na temelju anamnestičkih podataka i fizikalnoga pregleda (obavezan digitorektalni pregled), isključenja krvarenja iz gornjih dijelova probavnoga sustava, endoskopskoga pregleda rektuma i kolona te CT angiografije ili scintigrafije krvnih žila trbuha.
Isključenje krvarenja iz gornjega dijela probavnoga sustava. Svim bolesnicima koji se prezentiraju hematohezijom i hemodinamskom nestabilnosti u prvome je redu potrebno učiniti hitnu endoskopiju gornjega dijela probavnoga sustava (gastroduodenoskopija).
Endoskopski pregled rektuma i kolona. Ako se radi o mlađim bolesnicima (mlađi od 45 godina) bez prisustva anemije, pretraga izbora je anoskopija i rektosigmoidoskopija, s obzirom na to da su kod takvih bolesnika najčešći razlog krvarenja anorektalne bolesti i poremećaji. Ako se ovom pretragom pronađe patomorfološki supstrat koji bi mogao biti uzrokom krvarenja, daljnje pretrage nisu indicirane, osim u slučaju ponovljenoga krvarenja. Kod bolesnika starijih od 45 godina, kao i kod bolesnika s anemijom, indicirana je endoskopska pretraga cijeloga debeloga crijeva (kolonoskopija), kao i kod svih bolesnika s obilnim krvarenjem iz donjega dijela probavnoga sustava (hematohezija, rektoragija) kod kojih je isključeno krvarenje iz gornjega dijela. Neposredno prije pregleda potrebno je provesti brzo čišćenje crijeva. Kod hemodinamski stabilnih bolesnika kolonoskopija može biti učinjena i do 24 sata od prijema bolesnika, dok se kod hemodinamski nestabilnih bolesnika i bolesnika koji aktivno krvare preporuča što ranije učiniti kolonoskopiju, obično unutar 1 do 2 sata od završetka čišćenja debeloga crijeva (tada je najmanje ugrušaka, što omogućava dobru vizualizaciju). Endoskopskim se pregledom u 75 – 85 % slučajeva otkrije izvor krvarenja.
CT angiografija i scintigrafija krvnih žila trbuha. Kod bolesnika kod kojih se navedenim metodama ne otkrije izvor krvarenja ili su one kontraindicirane moguća je radiološka i/ili nuklearno-medicinska dijagnostika. Scintigrafija obilježenim eritrocitima ili CT angiografija mogu odrediti mjesto krvarenja, ali ne i točan uzrok. Da bi scintigrafija mogla pokazati krvarenje, ono mora biti veće od 0,1 ml/min, dok za CT angiografiju ono mora biti veće od 0,5 ml/min. Nedostatak scintigrafije u odnosu na CT angiografiju leži u vremenskome intervalu izvođenja pretrage (potrebno je znatno više vremena u odnosu na CT angiografiju, što može biti presudno kod bolesnika s obilnim krvarenjem i hemodinamskom nestabilnosti).
Dijagnoza krvarenja iz distalnoga dijela tankoga crijeva otežana je zbog nemogućnosti pregleda tijekom klasične kolonoskopije i ileoskopije. Na nju može ukazivati naviranje krvi u cekum kroz valvulu Bauchini, a konačnu potvrdu mogu dati CT angiografija ili scintigrafija. Za konačnu potvrdu i otkrivanje uzroka nekada se indicira i intraoperativna enteroskopija i/ili kirurška eksploracija. Kod bolesnika sa sumnjom na krvarenje iz tankoga crijeva, koji su hemodinamski stabilni, može se primijeniti i endoskopija kapsulom.
Liječenje. Inicijalni pristup i liječenje (hemodinamska stabilizacija) jednako je kao i kod krvarenja iz gornjega dijela probavnoga sustava. Specifični oblici liječenja podrazumijevaju endoskopsku intervenciju, intraarterijsku embolizaciju te kirurško liječenje.
Endoskopska intervencija danas omogućava odgovarajuću hemostazu kod gotovo svih bolesnika kod kojih se tijekom pregleda nađe izvor krvarenja. Na raspolaganju stoje različite metode, kao što su primjena otopine adrenalina, elektrokoagulacija ili postavljanje endoklipsi.
Intraarterijska embolizacija zahtijeva točnu identifikaciju izvora krvarenja (CT angiografija), a dovodi do odgovarajuće hemostaze u više od 95 % slučajeva. Obično se provodi kada se endoskopskim načinom ne postiže kontrola krvarenja ili se radi o krvarenju u distalnome dijelu tankoga crijeva. Najčešće su komplikacije koje prate ovu proceduru ponovno krvarenje (25 %) te razvoj ishemijskoga kolitisa (5 %).
Kirurško liječenje. Uz današnje mogućnosti endoskopskoga i interventnoga radiološkog liječenja, kirurško liječenje krvarenja iz donjega dijela probavnoga sustava indicirano je kod manje od 5 % bolesnika. Najčešće se radi o starijim bolesnicima s dokazanim ishemijskim kolitisom (gangrena crijeva) ili o bolesnicima kod kojih se ne može postići odgovarajuća kontrola krvarenja prethodno navedenim metodama (divertikuli, angiodisplazije). Kirurško liječenje obično podrazumijeva podvezivanje krvareće žile i resekciju pripadajućega dijela crijeva.
Prognoza takvih bolesnika ovisi ponajprije o uzroku krvarenja, dobi bolesnika i pratećim komorbiditetima. Kod više od 70 % bolesnika krvarenje iz donjega dijela probavnoga sustava spontano prestaje, dok se kod ostalih postiže dobra kontrola uz endoskopsko ili radiološko interventno liječenje. Manji broj oboljelih (manje od 5 %) zahtijeva kiruršku intervenciju.
KRVARENJA IZ DONJEGA DIJELA TANKOGA CRIJEVA
Definicija. Kod 5 do 10 % bolesnika koji se klinički očituju krvarenjem iz probavnoga sustava ne može se gastroskopski niti kolonoskopski naći izvor krvarenja te se kod njih sumnja na krvarenje iz tankoga crijeva (jejunum, ileum).
Etiologija. Kod mlađih su bolesnika najčešći uzroci krvarenja iz tankoga crijeva neoplazme (GIST tumori, limfomi, karcinoid, adenokarcinom), Crohnova bolest, celijakija i Meckleov divertikulum, dok su kod starijih bolesnika krvarenja najčešće posljedica angiodisplazija i djelovanja nesteroidnih protuupalnih lijekova.
Klinička slika. Krvarenja iz tankoga crijeva mogu biti okultna i manifestna. Okultna krvarenja obilježena su pozitivnim hemokult-testom i sideropeničnom anemijom bez kliničkih simptoma i znakova (eventualno bljedoća), dok se manifestna krvarenja prezentiraju melenom, stolicom boje kestena ili hematohezijom i/ili rektoragijom kod jače izraženoga krvarenja.
Dijagnoza. Kod sumnje na krvarenje iz tankoga crijeva prije daljnje specifične obrade potrebno je ponoviti gastroskopiju (obično dužim aparatom) i kolonoskopiju, kako bi se definitivno isključio uzrok krvarenja u tim dijelovima probavne cijevi. Ako se radi o hemodinamski stabilnim bolesnicima, preporuča se endoskopija kapsulom te daljnja dijagnostika ovisno o njezinom nalazu. Kod hemodinamski nestabilnih bolesnika preporuča se CT angiografija koja, ako pokaže krvarenje u tankom crijevu, nalaže interventno liječenje (intraarterijska embolizacija) ili provedbu intraoperativne enteroskopije.
Liječenje ponajprije ovisi o uzroku. Hitna hemostaza postiže se intraarterijskom embolizacijom ili endoskopskom intervencijom tijekom intraoperativne enteroskopije. Ako se endoskopskim putem ne može postići odgovarajuća hemostaza, indicirana je kirurška intervencija.
OKULTNO KRVARENJE
Definicija. Okultno ili skriveno krvarenje iz probavnoga sustava označava polagano krvarenje u probavnu cijev (manje od 100 ml/dan) koje neće dovesti do kliničkih znakova (promjene boje i oblika stolice), ali u konačnici dovodi do razvoja sideropenične anemije i pozitivnoga testa na okultno krvarenje (hemokult-test).
Epidemiologija. Smatra se da 2 % muškaraca i 5 % žena u općoj populaciji ima sideropeničnu anemiju. Njezin je najčešći uzrok kod muškaraca okultno krvarenje u probavnom sustavu, dok je kod žena u premenopauzalnom periodu ono najčešće povezano s ginekološkim uzrocima, a u postmenopauzalnom periodu najčešće se povezuje, kao i kod muškaraca, s kroničnim krvarenjem u probavni sustav.
Etiologija. Najčešći su uzroci okultnoga gastrointestinalnog krvarenja tumori, vaskularne anomalije, peptičke lezije (ezofagitis, gastritis, ulkusna bolest), infekcije, lijekovi (nesteroidni protuupalni lijekovi) te drugi specifični uzroci (npr. idiopatska crijevna upalna bolest).
Klinička slika. Kod bolesnika s okultnim krvarenjem ono je obično asimptomatsko ili ima simptome i znakove povezane s anemijom, kao što su umor, malaksalost, palpitacije te bljedoća kože i sluznica. Većina bolesnika slučajno otkrije sideropeničnu anemiju ili ima pozitivan hemokult-test, što se utvrdi tijekom sistematskoga pregleda ili pregleda zbog neke druge tegobe.
Dijagnoza. Svim bolesnicima s pozitivnim hemokult-testom i sideropeničnom anemijom preporuča se endoskopska obrada probavnoga sustava (gastroskopija, kolonoskopija) s obzirom na to da se izvor gubitka krvi nađe kod otprilike 70 % bolesnika. Kod ostalih bolesnika sumnja se na krvarenje iz distalnih dijelova tankoga crijeva (opisano ranije). Mlađim se bolesnicima preporuča inicijalna laboratorijska i serološka dijagnostika celijakije i idiopatske crijevne upalne bolesti.
Liječenje se temelji na uzroku krvarenja uz nadomjesno liječenje željezom s ciljem ispravka nastale anemije.
FUNKCIJSKE BOLESTI PROBAVNOGA SUSTAVA
Funkcijske bolesti probavnoga sustava uključuju široki spektar poremećaja bez organskoga uzroka koji se manifestiraju određenim kroničnim simptomima i znakovima probavnoga sustava, uz odsutnost jasnoga patomorfološkog supstrata. Iako se u osnovi radi o benignim poremećajima, njihova prisutnost može značajno narušavati kvalitetu života. Dugo godina dijagnostički pristup ovoj patologiji temeljio se na načelu isključivanja organskih bolesti. U zadnjih nekoliko desetljeća koriste se tzv. pozitivni kriteriji definirani Rimskim konsenzusom (Rimska fundacija za funkcijske poremećaje probavnoga sustava, sada aktualni Rim IV kriteriji). Najznačajniji i najčešći poremećaji iz ove skupine su: funkcijska dispepsija, sindrom iritabilnoga crijeva i funkcijska konstipacija.
FUNKCIJSKA DISPEPSIJA
Definicija. Funkcijska dispepsija označava poremećaj probavnoga sustava koji se manifestira kroničnim dispeptičkim tegobama, uz odsutnost organske patologije gornjega probavnog sustava kojima bi se one mogle pripisati. Radi se o relativno učestalome poremećaju za koji se procjenjuje da se može naći u 5 do 10 % opće populacije. Velik dio bolesnika s funkcijskom dispepsijom tijekom života razvije simptome sindroma iritabilnoga crijeva različitoga oblika što govori u prilog zajedničkoga patofiziološkog mehanizma u nastanku ovih patoloških entiteta.
Etiopatogeneza. Točan uzrok i mehanizam nastanka funkcijske dispepsije je nepoznat. Vjeruje se da se radi o simptomima koji nastaju kao posljedica visceralne preosjetljivosti pri čemu normalni, fiziološki stimulansi, kao što su kontrakcija, distenzija, prisutnost probavnih enzima i sokova, mogu rezultirati pojavom nelagode i bolova. U razvoju i nastanku ovoga poremećaja određenu ulogu mogu imati i psihosocijalni čimbenici, s obzirom na to da različiti stresovi mogu rezultirati pojačavanjem i pogoršanjem ovih simptoma. Kod oko 20 % bolesnika simptomi funkcijske dispepsije nastaju nakon akutnih infekcija želuca i dvanaesnika, što može implicitno ukazivati i na njihovu potecijalnu ulogu u nastanku ovoga poremećaja.
Klinička slika. Funkcijsku dispepsiju karakterizira povremen ili stalan osjet bola i/ili pečenja u epigastriju, obično praćen osjećajem punoće, nadutosti i rane sitosti, a kod manjega broja bolesnika mogu se javiti i mučnina i povraćanje. Simptomi su intermitetnoga karaktera te obično spontano prestaju. Pojava simptoma može biti potaknuta nekim čimbenicima kao što su unos alkohola, nekih lijekova (osobito NSAID) ili određene hrane. Osobe koje razviju sliku funkcionalne dispepsije sklonije su i razvoju anksio-depresivnoga sindroma.
Dijagnoza. S obzirom na to da dispepsija može biti uzrokovana različitim bolestima i stanjima gornjega dijela probavnoga sustava, svi se bolesnici trebaju prikladno obraditi - osobito ako se radi o osobama kod kojih se takvi simptomi javljaju prvi puta u dobi iznad 50. godine života. Dijagnoza funkcijske dispepsije obično se donosi metodom isključivanja ostalih bolesti i stanja. U tu se svrhu preporuča osnovna dijagnostička obrada koja uključuje laboratorijsku dijagnostiku (transaminaze, alkalna fosfataza, bilirubin, amilaza, lipaza, elektroliti), testiranje na H. pylori infekciju, test na okultno krvarenje, ultrazvuk gornjega abdomena s osvrtom na jetru, žučne puteve i gušteraču te endoskopski pregled, osobito kada se radi o bolesnicima kod kojih se simptomi javljaju u dobi iznad 50. godine života. Ovisno o nalazima, ponekad je potrebno proširiti navedenu obradu drugim, specifičnim metodama. Prisutnost navedenih kliničkih simptoma uz uredan nalaz laboratorijskih pretraga i slikovnih dijagnostičkih pretraga sugerira dijagnozu funkcionalne dispepsije. Za postavljanje dijagnoze funkcijske dispepsije, kao i ostalih funkcijskih poremećaja, koriste se tzv. Rimski kriteriji (trenutno aktualan Rim IV).
Diferencijalna dijagnoza obuhvaća širok dijapazon bolesti i poremećaja gornjega abdomena: gastroezofagealna refluksna bolest, kronični gastroduodenitis, ulkusna bolest, dijabetička i idiopatska gastropareza, maligna oboljenja jednjaka i želuca te bolesti jetre, žučnih puteva i gušterače.
Liječenje. Osnovu liječenja funkcionalne dispepsije čini promjena životnih i prehrambenih navika, što uključuje kontrolu stresa, prestanak pušenja te izbjegavanje nadražajne i teške hrane. Kod većine se bolesnika poboljšanje simptoma postiže kratkotrajnom primjenom (nekoliko tjedana) inhibitora protonske pumpe (npr. omeprazol 1 x 20 mg/dan). Kod bolesnika koji ne reagiraju na navedene mjere liječenja u obzir dolazi psihoterapija i/ili primjena tricikličkih antidepresiva u nižim, večernjim dozama (npr. aimitriptilin 10 do 50 mg pred spavanje).
Prognoza. Kod većine se bolesnika s funkcijskom dispepsijom uz navedene mjere liječenja postiže odgovarajuća kontrola simptoma i remisija bolesti. Manji broj bolesnika može imati opetovane recidive bolesti.
SINDROM IRITABILNOGA CRIJEVA
Definicija. Sindrom iritabilnoga crijeva definira se kao funkcijski poremećaj probavnoga sustava obilježen kroničnom, recidivirajućom nelagodom ili bolom u trbuhu povezanim s poremećajima pražnjenja crijeva, uz odsutnost patomorfološkoga supstrata koji bi mogao biti uzrok navedenih tegoba.
Epidemiologija. Smatra se da više od 10 % odrasle populacije u jednome trenu života razvije simptome koji odgovaraju sindromu iritabilnoga crijeva. Poremećaj se češće susreće kod žena u odnosu na muškarce, i to obično u mlađoj (srednjoj) životnoj dobi.
Etiopatogeneza. Kao i kod funkcijske dispepsije, točan uzrok i mehanizam nastanka ovoga poremećaja nisu poznati. Smatra se da on nastaje kao posljedica poremećenoga crijevnog motiliteta i visceralne preosjetljivosti, što može biti posljedica genetske predispozicije, okolišnih čimbenika te psihosocijalnoga utjecaja (Slika 4.1.). Kod većine bolesnika sa sindromom iritabilnoga crijeva nalazi se određeni stupanj poremećaja crijevne pokretljivosti (motiliteta), bilo da se radi o ubrzanom, bilo o usporenome motilitetu, što ima utjecaj na samu kliničku sliku (bolne kontrakcije, opstipacija, dijareja), kao i na razvijenu visceralnu preosjetljivost.
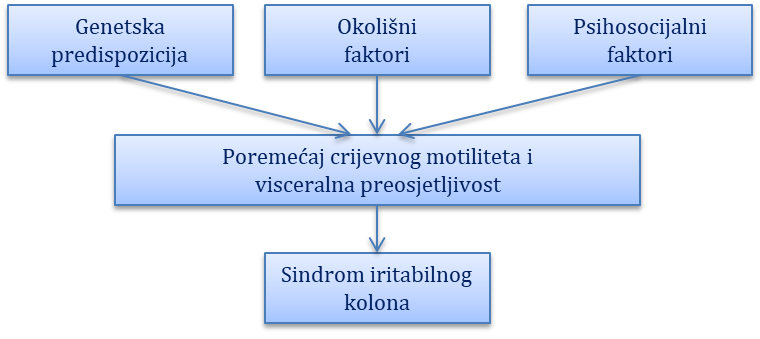
Slika. 4.1. Shematski prikaz etiopatogeneze sindroma iritabilnoga kolona
Genetska predispozicija. Činjenica da je sindrom iritabilnoga crijeva češći u nekim obiteljima ukazuje na mogući genetski utjecaj na pojavnost toga poremećaja. Za sada nije otkriven gen koji bi bio odgovoran za nastanak sindroma iritabilnoga kolona, ali smatra se da određeni utjecaj mogu imati polimorfizmi gena odgovorni za stvaranje neuroendokrinih peptida koji sudjeluju u crijevnoj fiziologiji.
Okolišni čimbenici. Pretpostavlja se da određeni intraluminalni antigeni (lijekovi, bakterije, hrana) mogu dovesti do povećane propustljivosti crijevne sluznice i razvoja upale niskoga intenziteta s posljedičnom aktivacijom upalnih stanica čije interakcije mogu dovesti do poremećaja crijevnoga motiliteta (povećana osjetljivosti crijevnih neurona), što može biti povezano s pojavom visceralne hiperreaktivnosti. Tome u prilog ide i činjenica da se kod više od 10 % bolesnika nakon epizode akutnoga gastroenteritisa razvije sindrom iritabilnoga kolona tijekom jedne godine (u usporedbi s 2 % u kontrolnoj skupini). Kod određenoga broja ovih bolesnika može se dokazati i kemijska (ne alergijska) intolerancija na sastavnice mlijeka i pšenice.
Psihosocijalni čimbenici. Kod više od 50 % bolesnika sa sindromom iritabilnoga crijeva nalazimo i različito izražene psihijatrijske poremećaje, kao što su depresija, anksioznost i sklonost psihosomatizaciji. Psihološki čimbenici mogu utjecati na bolesnikov doživljaj bola i visceralnu osjetljivost.
Klinička slika. Glavne kliničke manifestacije sindroma uključuju bol u trbuhu i poremećaje pražnjenja debeloga crijeva. Simptomi mogu biti prisutni kontinuirano ili se javljati periodično, ali su kroničnoga karaktera (moraju biti prisutni dulje od 6 mjeseci). Kod ovih je bolesnika potrebno poznavati i prepoznati tzv. simptome alarma koji ukazuju na mogući drugi, potencijalno opasniji uzrok tegoba i koji nalažu trenutnu dijagnostičku obradu.
Bol u trbuhu. Bol je kod većine bolesnika lokaliziran u donjim dijelovima trbuha te se opisuje kao grčevit, oštar i probadajuć. Obično je povezan s činom defekacije te se nakon toga može smiriti ili pogoršati. Kod manjega broja bolesnika bol može biti lokaliziran u gornjemu dijelu trbuha ili ga mogu opisivati kao tup.
Poremećaji pražnjenja crijeva. Ovisno o vrsti poremećaja pražnjenja crijeva, bolesnike sa sindromom iritabilnoga kolona svrstavamo u tri kategorije: 1) sindrom iritabilnoga kolona udružen s opstipacijom (bolesnici imaju manje od tri stolice na tjedan, žale se na otežanu defekaciju, a stolica je tvrda), 2) sindrom iritabilnoga kolona udružen s dijarejom (bolesnici imaju više od tri stolice na dan, stolice su neformirane, pretežno vodenaste) te 3) sindrom iritabilnoga kolona udružen s opstipacijom i dijarejom (miješani poremećaj).
Ostali simptomi. Bolesnici sa sindromom iritabilnoga crijeva mogu imati i druge pridružene simptome, kao što su nadutost i flatulencija, osjećaj punine i težine u trbuhu te dispeptičke tegobe.
Simptomi alarma ukazuju na moguću organsku osnovnu bolesti zbog čega ih se mora ozbiljno shvatiti. Među alarmantne simptome ubrajamo: prvu pojavu simptoma bolesti kod osoba starijih od 45 godina, pojavu noćne dijareje, učestale smjene dijareje i opstipacije, pojavu hematohezije, gubitak na tjelesnoj težini te pojavu febrilnoga stanja. Posebno je to bitno kod bolesnika koji od ranije imaju sindrom iritabilnoga crijeva koji sada mijenja karakter ili učestalost simptoma te kod bolesnika koji imaju obiteljsku anamnezu opterećenu malignomom probavnoga sustava, idiopatskom crijevnom upalnom bolesti ili celijakijom.
Dijagnoza sindroma iritabilnoga crijeva temelji se na postojanju prethodno navedenih simptoma uz odsutnost organske podloge bolesti, što se dokazuje dijagnostičkom obradom (metoda isključivanja). U dijagnostičkoj je obradi kod sumnje na sindrom iritabilnoga kolona potrebna laboratorijska obrada (uključujući određivanje markera celijakije i fekalnoga kalprotektina), testiranje stolice na okultno krvarenje, mikrobiološka analiza stolice te endoskopska obrada. Rutinska sigmoidoskopija ili kolonoskopija nije preporučena kod mlađih bolesnika sa simptomima iritabilnoga kolona kada nemaju alarmantnih simptoma, ali treba ju uzeti u obzir ako oni potraju i/ili ne reagiraju na liječenje. Kod bolesnika starijih od 45 godina i onih koji imaju alarmantne simptome potrebno je učiniti kolonoskopiju kako bi se isključio maligni ili upalni proces.
Diferencijalna dijagnoza je široka i obuhvaća različite bolesti i stanja: maligna bolest kolona, idiopatska crijevna upalna bolest (ulcerozni kolitis, Crohnova bolest, mikroskopski kolitis), malapsorpcijski sindrom, hipo- i hipertireoza, ginekološki poremećaji (endometrioza) i dr.
Liječenje se sastoji u prvome redu od općih mjera i dijetoterapije, a ako se njima ne postignu zadovoljavajući rezultati, u liječenje se uključuju medikamenti. U farmakološkome liječenju sindroma iritabilnoga kolona koriste se različiti lijekovi koji se temelje na simptomima koje bolesnik ima: spazmolitici, antidijarojici, laksativi, psihotropni lijekovi te probiotici.
Opće mjere i dijetoterapija. Bolesnike je potrebno upoznati s prirodom bolesti te im ukazati na važnost pridržavanja preporučene dijetoterapije i izbjegavanja stresora i drugih čimbenika koji izazivaju ili pogoršavaju simptome iritabilnoga crijeva. Savjetuje se izbjegavanje pretjerano masne hrane, alkohola, kofeina te prekomjerno začinjene hrane. Također, preporuča se i prekomjerno uzimanje mlijeka, mliječnih proizvoda, kao i žitarica. Pridržavanje preporučene prehrane kod više od 50 % bolesnika rezultira smanjenjem simptoma tijekom dva do četiri tjedna.
Spazmolitici. Kod bolesnika s izraženim grčevitim bolovima primjenjuju se antikolinergički lijekovi, kao što su hiosciamin (0,125 mg tbl/dan), diciklomin (10 - 20 mg tbl/dan) ili metskopolamin (2,5 - 5 mg tbl prije obroka i spavanja). Uz primjenu antikolinergika bolesnici se mogu žaliti na konstipaciju, tahikardiju, suhoću usta te mogu razviti retenciju urina. Ulje od peperminta također se pokazalo korisnim u smanjenju grčevitih bolova u trbuhu (relaksira glatku muskulaturu).
Antidijarojici. Kod bolesnika s izraženom dijarejom primjenjuju se antidijarojici. U tom se smislu najčešće primjenjuje loperamid (3 x 2 mg tbl/dan) koji se može primjenjivati i profilaktički (npr. u stresnim situacijama). Osim loperamida, za tu se indikaciju mogu primjenjivati i kolestiramin (sekvestrant žučnih kiselina), eluksadolin (opioidni antagonist) te alosteron (antagonist serotoninskih receptora).
Laksativi. Kod bolesnika s izraženom konstipacijom primjenjuju se klasični laksativi kao što je polietilen-glikol (17 - 34 g/dan) ili noviji lijekovi kao što su lubiproston (2 x 8 mg tbl/dan) ili linaklotid (1 x 290 mg tbl/dan). Oba lijeka dovode do stimulacije lučenja klorida i tekućine u crijevo što rezutira povećanim volumenom stolice čime se potiče defekacija.
Psihotropni lijekovi. Kod nekih se bolesnika odgovarajuća kontrola simptoma može postići tek po uključivanju tricikličkih antidepresiva ili selektivnih inhibitora ponovne pohrane serotonina. Najčešće se primjenjuju nortriptilin, dezipramin ili imipramin počevši od nižih doza (10 mg) pred spavanje uz postupno povećanje doze do 50 - 150 mg. Za postizanje zadovoljavajućih rezultata nekada je lijekove potrebno uzimati i dulje od mjesec dana.
Probiotici. Meta-analize sastavljene od manjih kontroliranih studija pokazale su korist od primjene probiotika na bazi bakterije Bifidobacterium infantis te VSL#3 probiotika za smanjenje simptoma sindroma iritabilnoga kolona. Učinak se objašnjava obnavljanjem crijevne mikrobiote i supresijom upalnoga procesa.
Prognoza. Izlječenje sindroma iritabilnoga crijeva rijetko se postiže, ali većina ga bolesnika nauči kontrolirati prehrambenim navikama i primjenom lijekova. Kod tih bolesnika potrebno je na vrijeme uočiti promjenu kvalitete ili intenziteta simptoma što može ukazivati na pojavu organskoga oboljenja.
POREMEĆAJI MOTORIKE JEDNJAKA
Uvodne napomene. Poremećaji motorike jednjaka predstavljaju poremećaje osnovnoga mišićnog tonusa jednjaka i/ili poremećaje jednjačne peristaltike koji mogu zahvatiti samo pojedine dijelove jednjaka ili jednjak u cjelini. Ti poremećaji mogu nastati primarno - uslijed bolesti i poremećaja samoga jednjaka, ili sekundarno - uslijed drugih bolesti i stanja, najčešće živčanoga sustava. Poremećaji motorike jednjaka očituju se karakterističnim simptomima (bol, otežano i bolno gutanje, regurgitacija) te patološkim nalazima manometrijskoga nalaza tijela jednjaka i sfinktera. Najčešći su poremećaji motiliteta jednjaka orofaringealna disfagija, ahalazija te difuzni jednjačni spazam.
OROFARINGEALNA DISFAGIJA
Orofaringealna disfagija podrazumijeva poremećaje poprečnoprugaste muskulature ždrijela i proksimalnoga dijela jednjaka koji dovode do poremećaja gutanja, a mogu nastati zbog poremećaja samih mišića, živaca koji ih inerviraju ili viših moždanih centara. Najčešći uzroci orofaringealne disfagije u kliničkoj praksi su moždani udar, mijastenija gravis, moždani tumori, amiotrofična lateralna skleroza, Parkinsonova bolest, Guillain-Barreov sindrom, paraneoplastični sindromi i dermatomiozitis. Kliničkom slikom dominiraju disfagija, bol u prsištu, rjeđe odinofagija. Najčešći je simptom ipak disfagija bez bolnosti koja može biti proksimalna, vezana uz nemogućnost relaksacije gornjega jednjačnog sfinktera kod gutanja ili distalna, kada je patološki supstrat vezan uz distalni dio jednjaka i donji jednjačni sfinkter. Zbog poremećaja gutanja česte su i aspiracije. Dijagnostika je usmjerena na osnovnu bolest. Endoskopskom i radiološkom obradom potrebno je isključiti patomorfološki supstrat u poremećaju gutanja. Liječenje je usmjereno na osnovnu bolest, a bolesnicima se savjetuje oprez pri gutanju i uzimanje manjih zalogaja s dosta tekućine.
AHALAZIJA
Definicija. Ahalazija označava poremećaj motorike distalnoga dijela jednjaka kojeg karakterizira parcijalni ili potpuni gubitak peristaltike te nedovoljna relaksacija donjega ezofagealnog sfinktera. To dovodi do retencije sadržaja u jednjaku, povećanja tlaka te posljedičnoga proširenja jednjaka. Ahalazija se može javiti u bilo kojoj životnoj dobi, ali najčešće je to u dobi između 30. i 60. godine života, podjednako kod oba spola.
Etiopatogeneza. Ahalazija primarno nastaje kao posljedica bolesti i poremećaja mijenteričnoga živčanog spleta glatke muskulature distalnoga dijela jednjaka. Ovisno o etiologiji, razlikujemo primarnu i sekundarnu ahalaziju ili pseudoahalaziju.
Primarna ahalazija bolest je još uvijek nejasne etiologije. Patoanatomske značajke su redukcija ili potpun nestanak ganglijskih stanica u mijenteričnom pleksusu, degenerativne promjene u ograncima nervusa vagusa te degeneracija stanica centralne jezgre nervusa vagusa. Sve se više govori o primarnoj ahalaziji kao autoimuno posredovanoj bolesti, iako su mehanizmi nedovoljno razjašnjeni.
Sekundarna ahalazija ili pseudoahalazija nastaje uslijed izravnoga oštećenja pleksusa mijenterikusa što se može dogoditi pri različitim bolestima: Chagasova bolest (infekcija Tripanosoma crusi), poliomijelitis, dijabetička neuropatija infiltrativne bolesti (amiolidoza, sarkoidoza) te uslijed infiltracije tumorskim stanicama (sekundarizmi). Neki tumori (npr. karcinom malih stanica pluća) imaju sposobnost stvaranja antineurinskih antitijela (anti-Hu) koja mogu biti odgovorna za destrukciju neurona mijenteričnoga spleta i nastanak ahalazije.
Klinička slika. Najkarakterističniji simptom ahalazije je disfagija, prvenstveno za krutu hranu, a kod manjega broja bolesnika i za tekuću hranu. Kako bi olakšali pražnjenje jednjaka, bolesnici se služe različitim manevrima poput zalijevanja krutoga zalogaja vodom, zauzimanje uspravnoga položaja kod hranjenja, podizanje ruku iznad glave i ispravljanje leđa, izbjegavanje jedenja tijekom stresa i sl. Od ostalih simptoma i znakova mogu se javiti retrosternalna bol, žgaravica te značajan gubitak na tjelesnoj težini.
Komplikacije nastaju kao rezultat retencije i staze hrane u jednjaku. Uslijed nadražaja sluznice javljaju se ezofagitis, krvarenje i strikture. Kod bolesnika koji nisu liječeni veća je učestalost karcinoma jednjaka. Može se javiti i aspiracija regurgitiranoga sadržaja i pojava rekurentnih pneumonija.
Diferencijalna dijagnoza uključuje karcinom fundusa želuca, karcinom jednjaka, limfome, karcinom gušterače, amiloidozu, Chagasovu bolest, oštećenje ganglijskih stanica toksinima Trypanosoma crusi, postvagotomične smetnje, Sjögrenov sindrom i dr.
Dijagnoza se postavlja na osnovi anamneze, pregledne radiološke snimke prsnoga koša, pasaže jednjaka, endoskopske pretrage te manometrije. Manometrija jednjaka zlatni je standard u dijagnostici ahalazije. Pregledna radiološka snimka prsnoga koša pokazuje prošireni medijastinum sa smanjenom količinom zraka u želucu (ili bez njega). Pasaža jednjaka barijevom kašom daje karakterističan nalaz nakupljanja kontrasta u proširenome dijelu jednjaka uz suženje u području donjega ezofagealnoga sfinktera („ptičji kljun“). Endoskopija u dijagnostici ahalazije ima dvojaku ulogu: isključivanje ostalih bolesti koje oponašaju simptome ahalazije te evaluaciju sluznice prije početka liječenja. Endoskopski se mogu vidjeti dilatacija i atonija srednjega dijela jednjaka, naborana sluznica i zatvoren donji ezofagealni sfinkter, a u želudac se ulazi uz lagan otpor ili se uopće ne može proći kod težih oblika bolesti. Manometrija jednjaka pokazuje postojanje hipertoničnoga donjega ezofagealnog sfinktera uz nepotpunu relaksaciju pri gutanju (patognomonični znak) te aperistaltičnu aktivnost distalne dvije trećine jednjaka ili postojanje samo fragmenata peristaltične aktivnosti.
Liječenje ahalazije u prvome je redu simptomatsko te obuhvaća nekoliko mogućnosti: primjenu botulinum toksina, pneumatsku dilataciju donjega ezofagealnog sfinktera, kirurško liječenje te u novije vrijeme peroralnu endoskopsku miotomiju. Primjena nitrata ili blokatora kalcijskih kanala prije obroka može rezultirati simptomatskim olakšanjem kod nekih bolesnika (relaksacija sfinktera).
Primjena botulinum toksina. Ova terapijska opcija podrazumijeva injiciranje botulinum toksina na četiri mjesta u područje donjega ezofagealnog sfinktera, što je omogućeno endoskopskom intervencijom. Botulinom toksin koči oslobađanje acetilkolina te dovodi do relaksacije sfinktera. Postupak dovodi do trenutnoga poboljšanja simptoma kod 65 do 85 % bolesnika. Kod 50 % bolesnika relaps simptoma dogodi se unutar 6 do 9 mjeseci, dok se kod ostalih 50 % bolesnika dogodi unutar 24 mjeseca. Ovaj se postupak provodi kod bolesnika koji nisu kandidati niti za pneumatsku dilataciju jednjaka niti za operativni postupak.
Pneumatska dilatacija. Postupak endoskopske pneumatske dilatacije donjega ezofagealnog sfinktera rezultira poboljšanjem simptoma kod više od 90 % bolesnika. Rezultati su lošiji kada se radi o bolesnicima mlađim od 45 godina i bolesnicima koji imaju izraženo proširen jednjak. Prati se i manji postotak recidiva simptoma koji se bilježi kod oko 35 % bolesnika unutar deset godina od postupka. Kod manje od 3 % bolesnika tijekom postupka dođe do perforacije jednjaka koja će zahtijevati kirurško zbrinjavanje.
Kirurško liječenje. Operativna disrupcija donjega ezofagealnog sfinktera (Hellerova miotomija) poboljšava simptome u više od 90 % slučajeva. Zahvat prati visoka učestalost gastroezofagealnoga refluksa zbog čega se preporuča i neka od antirefluksnih operacija u istom postupku. Postotak recidiva simptoma sličan je kao i kod bolesnika nakon pneumatske dilatacije donjega ezofagealnog sfinktera. Masivno proširenje jednjaka kod nekih bolesnika može biti indikacija za ezofagektomiju i/ili perkutanu gastrostomiju.
Peroralna endoskopska miotomija (POEM) predstavlja noviju proceduru u liječenju ovih bolesnika. Radi se o endoskopskoj disekciji donjega ezofagealnog sfinktera, a rezultati su slični onima koji se dobivaju klasičnim kirurškim liječenjem. S obzirom na to da ovaj postupak ne uključuje prevenciju gastroezofagealnoga refluksa, bolesnici moraju uzimati inhibitore protonske pumpe te pate od težih oblika refluksne bolesti jednjaka.
Prognoza. Sve prethodno navedene mjere liječenja ne dovode do trajnoga rješavanja problema i većina bolesnika u jednom ili više navrata imaju relaps simptoma koji će zahtijevati ponovnu intervenciju. Treba imati na umu da ovi bolesnici imaju sklonost razvoju karcinoma jednjaka zbog čega ih se mora redovno pratiti i kontrolirati.
DIFUZNI EZOFAGEALNI SPAZAM
Definicija i etiologija. Difuzni ezofagealni spazam označava pojavu snažnih, kratkotrajnih kontrakcija glatkih mišića jednjaka. Javlja se u svim dobnim skupinama, a češće kod žena u četvrtom i petom desetljeću. Manometrijski nalaz za vrijeme napadaja odaje simultane kontrakcije jednjaka visokih amplituda, a histološki nalaz pokazuje hipertrofiju mišićnoga sloja te degenerativne promjene u završecima vagusa. Točan mehanizam nastanka ovih kontrakcija nije poznat, ali je povezan s poremećajem stvaranja dušičnoga oksida u glatko-mišićnim stanicama jednjaka. Napad mogu provocirati vrući napici, stres i gastroezofagealni refluks.
Klinička slika i dijagnoza. Simptomi su disfagija, bol prsima i odinofagija, a mogući su i regurgitacija te žgaravica. Dijagnoza se postavlja na temelju kliničke slike i tipičnoga nalaza manometrije jednjaka.
Liječenje je simptomatsko i sastoji se u primjeni lijekova koji opuštaju glatke mišiće ili povećavaju sadržaj dušičnoga oksida: hiosciamin (0,125 mg sublingvalno), nifedipin (10 mg sublingvalno), nitroglicerin (0,3 mg sublingvalno) ili sildenafil (50 mg peroralno). Rezultati se poboljšavaju paralelnom primjenom tricikličkih antidepresiva. Ako se lijekovima ne postigne zadovoljavajuća kontrola bolesti, primjenjuje se pneumatska dilatacija i/ili injiciranje botulinum toksina, iako rezultati nisu zadovoljavajući. Kirurško liječenje nije indicirano ako nema elemenata ahalazije.
GASTROEZOFAGEALNA REFLUKSNA BOLEST
Definicija i epidemiologija. Gastroezofagealna refluksna bolest (GERB) stanje je uvjetovano neučinkovitom antirefluksnom barijerom što za posljedicu ima vraćanje želučanoga i/ili duodenalnog sadržaja u jednjak. To je jedna od najčešćih bolesti u zapadnim zemljama čija se prevalencija procjenjuje na između 10 i 30 % opće populacije. Pojavnost bolesti, kao i njezinih komplikacija, raste s dobi. Učestalost GERB-a češća je kod muškaraca nego kod žena i to u omjeru od 2:1 do 3:1.
Antirefluksna barijera predstavlja fiziološku barijeru koja sprečava povrat želučanoga i/ili duodenalnog sadržaja u jednjak i tako sprečava nadražaj sluznice jednjaka. Antirefluksnu barijeru čini: 1) donji ezofagealni sfinkter koji proizvodi tlak od 10 do 35 mmHg što onemogućava povrat sadržaja u jednjak, 2) intraabdominalni položaj jednjaka i donjega ezofagealnog sfinktera što osigurava oštar Hisov kut (kut između intrabdominalnoga dijela jednjaka i fundusa želuca) koji je potreban za normalnu funkciju donjega ezofagealnog sfinktera, 3) vanjska kompresija sfinktera dijafragmalnim nitima te 4) frenoezofagealni ligament koji stabilizira položaj donjega ezofagealnog sfinktera nakon gutanja.
Etiologija. Osnovni poremećaj prisutan kod GERB-a inkompentencija je antirefluksne barijere što dovodi do regurgitacije (vraćanja) kiseloga sadržaja želuca i/ili dvanaesnika nazad u jednjak s posljedičnom iritacijom i oštećenjem. Uzroci koji dovode do inkompentencije antirefluksne barijere su različiti, a djeluju izravno na donji ezofagealni sfinkter i/ili dovode do promjene anatomskih odnosa struktura antirefluksne barijere: 1) prirođena slabost donjega ezofagealnog sfinktera i/ili ošita (tlak donjega jednjačnog sfinktera manji od 5 mmHg omogućava nesmetano vraćanje sadržaja iz želuca u jednjak); 2) kronično slabljenje antirefluksne barijere povezano sa starenjem (zato se učestalost GERB povećava sa životnom dobi); 3) pojava hijatalne hernije (prolaps intraabdominalnoga dijela jednjaka u prsište dovodi do izravnavanja Hisova kuta što slabi funkciju donjega ezofagealnog sfinktera); 4) akutna trauma abdomena ili prsišta te 5) prisutnost čimbenika koji pogoduju sniženju tlaka donjega ezofagealnog sfinktera (distenzija želuca, pretilost, lijekovi koji relaksiraju glatke mišiće, alkohol, pušenje, masna hrana, kofein te čokolada).
Patogeneza. Vraćanje želučanoga i/ili duodenalnog sadržaja dovodi do nadražaja i oštećenja sluznice jednjaka. Nastanak promjena na jednjaku ovisi o vremenu eliminacije kiseline što predstavlja vrijeme u kojem jednjak ostaje izložen sadržaju čiji je pH manji od 4. Na vrijeme eliminacije kiseline utječe brzina peristaltike jednjaka, kao i pristizanje sline s bikarbonatima koja neutralizira pH jednjaka iz usne šupljine. Što je vrijeme eliminacije kiseline dulje, to je i veći rizik od nastanka promjena na jednjaku, a produljenje vremena eliminacije kiseline javlja se kod usporene peristaltike i hiposalivacije. Promjene na sluznici jednjaka javljaju se kada kiseli želučani sadržaj nadvlada zaštitne mehanizme. Njih dijelimo na: preepitelne (sluz, bikarbonati, prostaglandini, epidermalni čimbenik rasta), epitelne (višeslojni pločasti epitel) te postepitelne (odgovarajuća perfuzija). Regurgitacija kiseloga sadržaja najprije uzrokuje upalu (refluksni ezofagitis) koja nastaje zbog difuzije vodikovih iona u samu sluznicu te uzrokuje acidifikaciju s posljedičnim oštećenjima. Samoj upali pridonose i drugi čimbenici, kao što su prisutnost enzima (pepsin, tripsin), žučne kiseline (gastroduodenalni refluks) te hiperosmolarna hrana. Kod bolesnika koji su kronično izloženi ovim uvjetima može doći i do metaplazije (zamjene) višeslojnoga pločastog epitela s cilindričnim epitelom i vrčastim stanicama, što nazivamo Barettovom metaplazijom i Barettovim jednjakom (kasnije detaljnije opisano). Na patogenezu GERB-a utječe i prisutnost Helicobacter pylori infekcije. Kod bolesnika koji su Helicobacter pylori pozitivni nalazimo blaže oblike GERB-a, a to se tumači nekim učincima ove bakterije, kao što je smanjena sekrecija želučane kiseline (H. pylori uzrokuje korpusni gastritis ili pangastritis) te lokalna neutralizacija (H. pylori luči tvari poput amonijaka koje dovode do neutralizacije kiseloga sadržaja). Kasnije, kolonizacija u području kardije može imati suprotan učinak jer otpuštanje proupalnih citokina i dušičnoga oksida dovodi do relaksacije donjega ezofagealnog sfinktera.
Klinička slika. U kliničkoj slici GERB-a razlikujemo ezofagealne, ekstraezofagealne i simptome alarma. Ezofagealni simptomi su žgaravica, mučnina, podrigivanje, regurgitacija sadržaja u jednjak i usta. Žgaravica predstavlja osnovni i najkonzistentniji simptom GERB-a. Tipično se pojačava iza obroka i kod određenih položaja tijela (npr. nakon lijeganja ili pri sagibanju). Također, jače je izražena na početku bolesti, a s napredovanjem i razvojem metaplazije njezin intenzitet slabi. Odinofagija, mučnina i podrigivanje manje su česti simptomi. Ekstraezofagealni simptomi posljedica su djelovanja kiseloga želučanog sadržaja na druge anatomske strukture, a najčešći su kronični kašalj i promuklost, pojava simptoma nalik astmi, hipersalivacija, erozije na zubima te štucanje. Simptomi alarma kod GERB-a su progresivna disfagija, gubitak tjelesne težine te krvarenje i anemija, a mogu biti povezani s razvojem Barettova jednjaka i adenokarcinoma (zato se i nazivaju simptomima alarma).
Komplikacije. Najznačajnije komplikacije GERB-a su Barettov jednjak koji povećava rizik od nastanka adenokarcinoma jednjaka te striktura jednjaka koja može dovesti do poremećaja pasaže. Komplikacije GERB-a zasebno su opisane.
Dijagnoza GERB-a postavlja se na temelju anamnestičkih podataka, testa inhibitorima protonske pumpe te endoskopske dijagnostike. Kod nekih je bolesnika zbog preciznije dijagnostike refluksne bolesti jednjaka potrebna manometrija jednjaka i 24 satna pH-metrija.
Anamneza je ključ dijagnostike GERB-a. Žgaravica je vodeći simptom koji se javlja kod ovih bolesnika te je potrebno dobro ispitati njezine karakteristike (kada se javlja, kako se širi, povezanost s položajem tijela, prisutnost otežanoga gutanja, gorčine u ustima i sl.). Pozornost treba usmjeriti i na ekstraezofagealne (atipične) simptome te simptome alarma. Danas su na raspolaganju i upitnici kojima se evaluiraju bolesnikovi simptomi i pomažu u otkrivanju ove bolesti.
Test inhibitorima protonske pumpe. Kod bolesnika s tipičnim ezofagealnim simptomima (žgaravica kao dominantan simptom), ako nema alarmantnih simptoma i bolesnici su mlađi od 50 godina, može se provesti test inhibitorima protonske pumpe (Slika 4.2.). Test se sastoji od primjene inhibitora protonske pumpe u dvostrukoj dozi (2 x standardna doza) kroz deset dana. Ako se nakon deset dana kod bolesnika povuku simptomi za više od 75 %, test se smatra pozitivnim i s velikom se vjerojatnošću može ustvrditi da bolesnik ima GERB (senzitivnost testa je 85 %). Kod bolesnika kod kojih je test negativan (nije doveo do značajnoga poboljšanja simptoma) preporuča se endoskopska obrada.
Slika 4.2. Postupak s bolesnikom koji ima tipične ezofagealne simptome
Endoskopska dijagnostika ima vrlo značajno mjesto u dijagnostici GERB-a, a indicirana je za sve bolesnike u dobi iznad 50 godina koji su opterećeni simptomima GERB-a, kod bolesnika sa simptomima alarma te kod onih s negativnim testom na inhibitor protonske pumpe. Kod više od polovine bolesnika ne nalazimo nikakve promjene na sluznici jednjaka (osobito ako su prije toga bili na antisekretornoj terapiji) pa govorimo o neerozivnom ili endoskopski negativnom GERB-u. Kod ostalih 50 % bolesnika govorimo o endoskopski pozitivnom GERB-u, a nalazi mogu uključivati erozije i ulceracije (refluksni ezofagitis), strikture ili Barettov jednjak. Starije osobe obično imaju jače izražene endoskopske promjene. Endoskopski urednu sluznicu nije potrebno bioptirati, ali kada se primijete suspektne promjene, one zahtijevaju uzimanje biopsije. Standardno se uzimaju četiri bioptička uzorka: na svaka 2 cm u četiri kvadranta u području gastroezofagealnoga prijelaza, u području vidljivoga cilindričnog epitela. Promjene koje se endoskopski uočavaju kod refluksnoga ezofagitisa danas se najčešće klasificiraju u četiri stupnja prema Los Angeles klasifikaciji (Tablica 4.5.).
|
Tablica 4.5. Los Angeles klasifikacija endoskopskih promjena refluksnoga ezofagitisa
|
|
Stupanj
|
Opis (karakteristike)
|
|
Stupanj A
|
Jedna (ili više) erozija maksimalne dužine do 5 mm koja ne doseže do vrhova susjednih mukoznih nabora
|
|
Stupanj B
|
Jedna (ili više) erozija dužine preko 5 mm koja ne doseže do vrhova susjednih mukoznih nabora
|
|
Stupanj C
|
Jedna (ili više) erozija koja se širi između vrhova dva ili više mukozna nabora, ali ne zahvaća više od 75 % cirkumferencije jednjaka
|
|
Stupanj D
|
Jedna (ili više) erozija koja se širi između vrhova dva ili više mukozna nabora te zahvaća više od 75 % cirkumferencije jednjaka
|
Radiološka dijagnostika nema veće mjesto u dijagnostici GERB-a, a pasaža jednjaka s barijevom kašom izvodi se samo kada je endoskopija kontraindicirana ili kod postojanja opsežnijih striktura, s obzirom na superiornost te pretrage u procjeni duljine stenoziranoga segmenta jednjaka.
pH-metrija jednjaka. Mjerenje pH jednjaka kroz 24 sata najbolja je metoda za dokazivanje prisutnosti kiseloga želučanog sadržaja u jednjaku. Glavni je cilj te analize procijeniti vrijeme u kojemu je jednjak izložen kiselom želučanom sadržaju te pojavu simptoma ovisno o toj izloženosti. Postupak se provodi pomoću posebnih katetera koji imaju pH osjetljivu sondu koja se plasira u distalni dio jednjaka, a može biti povezana s uređajem koji analizira dobivene podatke preko katetera fiksiranoga u nosu ili, ako se radi o novijim, radiotelemetrijskim sondama, kateter se izvlači, a sonda ostaje fiksirana u jednjaku. Ta se pretraga ne izvodi rutinski, nego je rezervirana za bolesnike s tipičnim simptomima koji ne reagiraju na klasično liječenje, bolesnike s atipičnim (ekstraezofagealnim) simptomima te za bolesnike koji su u obradi za kirurško liječenje. U prilog GERB-u ide nalaz izloženosti jednjaka želučanom sadržaju čiji je pH < 4 u vremenu duljem od 5 % od ukupnoga ispitivanoga vremena uz više od 50 refluksnih epizoda od kojih tri ili više traju dulje od 5 minuta.
Liječenje. Glavni ciljevi liječenja GERB-a uključuju postizanje simptomatskoga olakšanja, oporavak sluznice, odnosno cijeljenje refluksnoga ezofagitisa (ako postoji) te prevenciju dugoročnih komplikacija. Liječenje ove bolesti sastoji se od općih mjera, medikamentozne terapije te kirurškoga liječenja.
Opće mjere liječenja GERB-a uključuju promjene životnoga stila i prehrambenih navika. Ove mjere uključuju: 1) smanjenje tjelesne težine; 2) prestanak konzumacije alkohola, gaziranih pića, kave i pušenje cigareta; 3) izbjegavanje nošenja uske odjeće; 4) izbjegavanje obroka 2 do 3 sata prije spavanja; 5) spavanje s podignutim uzglavljem; 6) umjerena tjelovježba, izbjegavati pojačane fizičke napore; 7) ograničiti ili smanjiti uzimanje lijekova koji opuštaju donji ezofagealni sfinkter (blokatori kalcijskih kanala, nitrati, benzodiazepini); 8) uzimanje hrane s manje masti te prakticiranje uzimanja manjih obroka te 9) izbjegavanje namirnica koje izazivaju žgaravicu (vino, kisela hrana, čokolada, citrusi, rajčice, luk, krastavci).
Medikamentno liječenje. Za liječenje GERB-a na raspolaganju je nekoliko skupina lijekova: antacidi, prokinetici, blokatori H2 receptora te inhibitori protonske pumpe. Više je o mehanizmu njihova djelovanja pisano u dijelu o ulkusnoj bolesti, dok je ovdje opisana njihova uloga u liječenju GERB-a.
Antacidi (alumnijev hidroksid, magnezijev hidroksid) dovode do neutralizacije kiseloga želučanog sadržaja i brzoga olakšanja simtoma (kroz nekoliko minuta) te imaju djelovanje od jednoga do dva sata. Primjena antacida olakšava simptome, ali ne utječe na cijeljenje i oporavak sluznice jednjaka. Ovi se lijekovi u prvom redu uzimaju kao automedikacija od strane samih bolesnika s obzirom na to da se radi o bezreceptnim lijekovima. Glavna opasnost pri uzimanju ovih lijekova je prikrivanje simptoma, što može dovesti do razvoja komplikacija. Svi bolesnici koji učestalo uzimaju antacide zahtijevaju dijagnostičku evaluaciju.
Prokinetici (metoklopramid, domperidon) su lijekovi koji potiču motalitet probavne cijevi, pa time i jednjaka, što bi trebalo poboljšati eliminaciju kiseloga sadržaja iz jednjaka i smanjiti vrijeme izloženosti kiselom sadržaju. Ipak, taj se učinak nije pokazao korisnim u liječenju ovih bolesnika stoga se ni rutinska primjena ovih lijekova pri GERB-u ne preporuča.
Blokatori histaminskih (H2) receptora smanjuju sekreciju želučane kiseline, ali u puno manjem intenzitetu u odnosu na inhibitore protonske pumpe. Zbog štetnih nuspojava povučeni su iz upotrebe u peroralnoj formi.
Inhibitori protonske pumpe danas predstavljaju osnovne lijekove za liječenje GERB-a. Radi se o snažnim inhibitorima sekrecije želučane kiseline koji, osim što dovode do smanjenja simptoma bolesti, imaju pozitivan učinak i na cijeljenje promjena na sluznici jednjaka. S obzirom na malo nuspojava, opravdana je i njihova dugotrajna primjena. Najčešće su nuspojave koje se mogu javiti nakon početka uzimanja ovih lijekova glavobolja, proljevi i kožni osipi, dok se pri dugoročnom uzimanju ovih lijekova opisuje veći rizik od razvoja gastrointestinalnih infekcija, pneumonija, pogoršanja kronične bubrežne bolesti, kao i oštećenje apsorpcije vitamina B, željeza i kalcija, s čime se povezuje i veća učestalost prijeloma kuka. Lijekovi se standardno uzimaju u jednoj dnevnoj dozi (sat prije doručka), a u težim slučajevima i u dvostrukoj dnevnoj dozi.
Kirurško liječenje danas je manje zastupljeno u liječenju GERB-a s obzirom na to da se u većine bolesnika postiže dobra kontrola bolesti i simptoma konzervativnim liječenjem. Operativno liječenje indicirano je kod bolesnika kod kojih se unatoč konzervativnim metodama liječenja ne postiže zadovoljavajuća kontrola bolesti. Na raspolaganju su različite kirurške tehnike, a danas se najčešće izvodi laparoskopska fundoplikacija (Nissen). Na raspolaganju je i magnetski umjetni sfinkter koji se može ugraditi laparoskopskim putem izvana u području intraabdominalnoga dijela jednjaka. Odobren je za liječenje od 2012. godine, a studije koje su provedene do danas pokazuju dobre rezultate ovoga postupka, iako ova metoda nije još u širokoj primjeni.
Klinički pristup bolesniku s GERB-om. Kod liječenja bolesnika s GERB-om postoji nekoliko osnovnih načela koja obuhvaćaju inicijalno liječenje, dugoročno liječenje te liječenje ekstraezofagealnih manifestacija. U Tablici 4.6. su prikazane standardne, dvostruke i polovične doze inhibitora protonske pumpe koje koristimo u liječenju.
|
Tablica 4.6. Doziranje inhibitora protonske pumpe (IPP)
|
|
IPP
|
Polovična doza
|
Standardna doza
|
Dvostruka doza
|
|
Pantoprazol
|
1 x 20 mg
|
1 x 40 mg
|
2 x 40 mg
|
|
Omeprazol
|
1 x 20 mg
|
1 x 40 mg
|
2 x 40 mg
|
|
Esomeprazol
|
1 x 20 mg
|
1 x 40 mg
|
2 x 40 mg
|
|
Rabeprazol
|
1 x 10 mg
|
1 x 20 mg
|
2 x 20 mg
|
|
Lanzoprazol
|
1 x 15 mg
|
1 x 30 mg
|
2 x 30 mg
|
|
Dekslanzoprazol
|
1 x 30 mg
|
1 x 60 mg
|
2 x 60 mg
|
Inicijalno liječenje podrazumijeva primjenu inhibitora protonske pumpe kroz četiri do osam tjedana. Obično se počinje dvostrukom dnevnom dozom (jutarnja i večernja doza), a ako su bolesnici bili podvrgnuti endoskopiji te imaju endoskopski negativni GERB ili endoskopski pozitivan GERB koji uključuje stadij A i B prema Los Angeles klasifikaciji, inhibitori protonske pumpe mogu se primjenjivati tijekom ovoga perioda i u standardnoj dozi (jedna jutarnja doza). Nakon perioda inicijalnoga liječenja potrebno je provesti procjenu simptoma iznova i odlučiti kako nastaviti daljnje, dugoročno liječenje.
Dugoročno liječenje. Ako se kod bolesnika nakon provedene inicijalne terapije postigne zadovoljavajuća kontrola bolesti, može se provesti liječenje nastavkom kontinuiranoga dnevnog uzimanja inhibitora protonske pumpe u standardnoj dozi do ukupno osam do dvanaest tjedana, a nakon toga se lijekovi mogu uzimati prema potrebi. U slučaju kliničkoga recidiva ponovno se provodi terapija dvostrukom dozom kroz četiri do osam tjedana kao na početku liječenja. Ako se recidivi vraćaju i nakon druge primjene inhibitora protonske pumpe u dvostrukoj dozi, preporuča se dugoročna primjena inhibitora protonske pumpe kroz šest i više mjeseci u najnižoj dozi koja osigurava kontrolu simptoma (kod dugoročne terapije teži se primjeni polovične doze inhibitora protonske pumpe). Kod bolesnika koji slabo reagiraju na terapiju inhibitorima protonske pumpe u terapiju se mogu dodati triciklički antidepresivi (npr. 25 mg imipiramina ili nortriptilina prije spavanja) što se pokazalo korisno kod ovih bolesnika. Studije i stavovi o dugotrajnoj primjeni inhibitora protonske pumpe su različiti, ali načelno, ako je indicirana, dugotrajna primjena ovih lijekova je sigurna.
Liječenje ekstraezofagealnih manifestacija. Ekstraezofagealne kliničke manifestacije često zahtijevaju primjenu dvostrukih, a nekada i trostrukih doza inhibitora protonske pumpe. Nakon povlačenja ekstraezofagealnih simptoma dozu inhibitora protonske pumpe treba postupno smanjivati zbog velikoga rizika od recidiva. Ako se ne postiže zadovoljavajuća kontrola uz dvostruke doze inihibitora protonske pumpe, preporuča se učiniti pH-metriju te iznova procijeniti dijagnozu, a u terapiju se mogu uvesti i blokatori H2 receptora.
Prognoza. Kod bolesnika koji se redovno kontroliraju i pridržavaju terapijskoga režima, GERB ima dobru prognozu. Također, kod bolesnika kod kojih se ne može postići zadovoljavajuća kontrola simptoma konzervativnim terapijskim pristupom, kirurško liječenje daje odlične rezultate. Bolesnici koji se ne pridržavaju liječenja imaju veliki rizik od razvoja komplikacija kao što je Barettov jednjak, adenokarcinom jednjaka i striktura jednjaka.
KOMPLIKACIJE REFLKUSNE BOLESTI JEDNJAKA
Najznačajnije komplikacije refluksne bolesti jednjaka su razvoj striktura jednjaka te Barrettov jednjak.
STRIKTURA JEDNJAKA
Striktura (suženje) distalnoga dijela jednjaka česta je nuspojava dugotrajne gastroezofagealne refluksne bolesti. Rizik je viši kod starijih osoba i osoba s anamnezom dugogodišnjih simptoma refluksa. S obzirom na raširenu primjenu inhibitora protonske pumpe, učestalost ove komplikacije pokazuje silazan trend. Striktura nastaje kao posljedica cijepljenja (ožiljkavanja) opsežnih ulceracija sluznice jednjaka koje nastaju uslijed djelovanja kiseloga želučanog sadržaja. Osim suženja lumena koji dovodi do poremećaja pasaže, javlja se i regionalni ispad motiliteta jednjaka što dodatno pogoršava pasažu. Klinička slika obuhvaća razvoj progresivne disfagije što nalaže hitru dijagnostičku obradu (diferencijalno dijagnostički u obzir dolazi i razvoj malignoga procesa). Dijagnoza se postavlja na temelju endoskopske obrade i kontrastne radiološke dijagnostike (pasaža barijevom kašom). Liječenje se sastoji u prvom redu od endoskopske dilatacije, a preporuča se i injiciranje triamkinolona u području strikture. Česti su recidivi koji zahtijevaju reintervenciju.
BARRETTOV JEDNJAK
Definicija. Barrettov jednjak predstavlja komplikaciju gastroezofagealne refluksne bolesti koju karakterizira metaplazija (zamjena) višeslojnoga pločastog epitela cilindričnim epitelom s vrčastim stanicama kao mehanizam adaptacije jer je novi epitel otporniji na kiseli sadržaj. Barettov jednjak nađe se kod oko 5 do 15 % bolesnika s GERB-om, a obično se razvija kod muškaraca mlađih od 50 godina.
Etiopatogeneza. Dugotrajni refluks kod bolesnika s GERB-om uzrokuje opsežna oštećenja sluznice jednjaka što potiče aktivaciju multipotentnih matičnih stanica u bazalnom sloju. One se mogu diferencirati u cilindrične i vrčaste stanice. Barettova metaplazija pokazuje sklonost malignoj transformaciji i pogoduje nastanku adenokarcinoma, a osobito je izražena kod «Barettovoga ezofagusa dugoga segmenta» što označava segment metaplazije dulji od 3 cm. Bolesnici s Barettovim jednjakom imaju deset puta veći rizik od razvoja adenokarcinoma jednjaka nego osobe koje nemaju Barettov jednjak. Glavni rizični čimbenici za razvoj Barettova jednjaka su duljina trajanja simptoma (dugotrajni refluks), pušenje, muški spol, starija dob, infekcija H. pylori te centralni oblik pretilosti.
Patologija. Razlikujemo tri tipa metaplastične cilindrične sluznice koja zamjenjuje normalan pločasti epitel jednjaka: 1) intestinalni tip u kojemu dominiraju tzv. goblet cells, 2) kardijalni tip koji sadrži žlijezde nalik žlijezdama koje normalno nalazimo u području želučane kardije te 3) oksintokardijalni tip sluznice koji sadrži kombinaciju žlijezda oksintičke i sluznice kardije. Metaplazija je povezana s nastankom adenokarcinoma, a taj se proces odvija kroz nekoliko stupnjeva: najprije nastaje displazija niskoga stupnja, potom displazija visokoga stupnja, a zatim intramukozni i naposljetku invazivni adenokarcinom (Slika 4.3.). Neki autori navode da samo intestinalni tip metaplazije ima sklonost progresiji u adenokarcinom, ali to nije potvrđeno.

Slika 4.3. Shematski prikaz patomorfoloških promjena u Barettovom jednjaku
Klinička slika. Pojava Barettova jednjaka često je praćena smanjenjem i olakšanjem simptoma bolesti s obzirom na to da se razvija otporniji epitel, što može dovesti do krivih kliničkih zaključaka. Zbog toga na razvoj Barettova jednjaka treba ukazivati smanjenje simptoma nakon dugotrajnih epizoda refluksne bolesti.
Dijagnoza se postavlja na temelju endoskopskoga nalaza sluznice distalnoga dijela jednjaka. Makroskopski se očituje pomakom skvamokolumnarne granice proksimalno, ispod čega nalazimo ružičasta baršunasta područja između područja blijedo ružičaste boje (normalna boja sluznice jednjaka). Svaki suspektan nalaz nalaže uzimanje biospije i patohistološku analizu uzoraka, a uzroci se standardno uzimaju s četiri kvadranta ezofagogastričnoga spoja te dodatno sa svake suspektne lezije sluznice. Patohistološki nalaz može uključivati metaplaziju bez displazije (intestinalni, kardijalni i oksintokardijalni tip), displaziju niskoga stupnja, displaziju visokoga stupnja te intramukozni i invazivni karcinom. Kod nejasnih i slabo uočljivih nalaza na sluznici distalnoga jednjaka preporuča se kromoskopija i endoskopija s povećanjem. Primjenom 2,5 %-tne lugolove otopine mogu se bolje uočiti žarišta displazije što služi i kao marker za mjesto biopsije. U slučaju patohistološkoga nalaza adenokarcinoma preporučen je endoskopski ultrazvuk kako bi se procijenila tumorska invazija u stijenci jednjaka. Za endoskopsko praćenje bolesnika s Barettovim jednjakom koriste se Praški kriteriji.
Praški kriteriji predstavljaju standard u mjerenju duljine Barrettovoga jednjaka, a vrše se dva mjerenja: duljina jednjaka koja je zahvaćena metaplazijom u cijeloj cirkumferenciji (C mjera) i duljina jednjaka koja je zahvaćena maksimalnom ekstenzijom metaplazije (M mjera) – Slika 4.5. Kao ishodišna distalna točka od koje se vrši mjerenje uzima se proksimalna margina nabora kardije. Mjere se izražavaju u centimetrima (npr. C3M5 označava da je jednjak u punoj cirkumferenci zahvaćen metaplazijom 3 cm, a da maksimalna ekstenzija metaplazije prema proksimalno iznosi 5 cm).
Slika 4.5. Određivanje duljine Barrettova jednjaka prema Praškim kriterijima
Liječenje. S obzirom na to da se Barettov jednjak očituje simptomima GERB-a i da proizlazi iz njega, terapija slijedi osnovne principe liječenja GERB-a: pridržavanje općih mjera (promjene životnih navika i prehrane) te primjena inhibitora protonske pumpe uz endoskopsko ili kirurško liječenje displastičkih promjena. Postupanje s ovim bolesnicima ponajprije ovisi o patohistološkom nalazu (Tablica 4.7.).
Metaplazija bez displazije. Kod ove skupine bolesnika primjenjuju se klasične mjere liječenja GERB-a kako je to prethodno opisano. Praćenje ovih bolesnika ovisi o duljini zahvaćenoga segmenta: ako je zahvaćeni segment kraći od 3 cm, endoskopije se ponavljaju svakih tri do pet godina, a ako je dulji od 3 cm ponavljaju se svake dvije do tri godine.
Niski stupanj displazije. Kod ovih bolesnika provodi se terapija dvostrukom dozom inhibitora protonske pumpe kroz dvanaest tjedana i tada se obavi kontrolni endoskopski nalaz. U slučaju negativnoga nalaza bolesnici se dalje endoskopski prate svakih tri do šest mjeseci dok se ne dobiju uzastopno dva negativna nalaza, a onda se endoskopije ponavljaju jednom godišnje. U slučaju pozitivnoga nalaza nastavlja se terapija dvostrukom dozom inhibitora protonske pumpe uz endoskopsko praćenje svakih tri do šest mjeseci. Ako niski stupanj displazije potraje dulje od jedne godine, preporuča se endoskopsko liječenje.
Visoki stupanj displazije. I kod ove skupine bolesnika provodi se terapija dvostrukom dozom inhibitora protonske pumpe kroz dvanaest tjedana, tada se obavi kontrolni endoskopski nalaz te se u slučaju nastavljanja promjena preporuča kirurško ili endoskopsko liječenje.
|
Tablica 4.7. Postupanje s bolesnicima prema Britanskim kliničkim smjernicama iz 2016. g.
|
|
PHD nalaz
|
Zahvaćeni segment < 3 cm
|
Zahvaćeni segment > 3 cm
|
|
Bez displazije
|
Ponavljanje endoskopije svakih 3 do 5 godina
|
Ponavljanje endoskopije svake 2 do 3 godine
|
|
Nizak stupanj displazije
|
Dvije ponovljene endoskopije unutar jedne godine uz terapiju IPP-om, ako displazija perzistira, preporuča se endoskopsko liječenje
|
|
Visok stupanj displazije
|
Najprije 8 - 12 tjedana intenzivnoga liječenja IPP-om, kontrolna endoskopija, ako je ponovljena displazija visokoga stupnja, preporuča se kirurško liječenje
|
Endoskopsko liječenje podrazumijeva primjenu endoskopske mukozektomije ili endoskopskih ablativnih tehnika (fotodinamička terapija, argon plazma koagulacija, radiofrekventna ablacija, krioterapija), dok klasično kirurško liječenje podrazumijeva resekciju jednjaka ili totalnu ezofagektomiju. S obzirom na ograničenje endoskopskih metoda i mogućnost zaostajanja metaplastičkoga epitela ispod epitela normalnoga izgleda, u slučaju displazije visokoga stupnja preporuča se kirurško liječenje.
Prognoza. Iako bolesnici s Barettovim jednjakom imaju povećani rizik od razvoja adenokarcinoma, većina ga ipak ne razvije. Opservacijske studije pokazale su da primjena aspirina, nesteroidnih protuupalnih lijekova te statina smanjuje rizik od razvoja adenokarcinoma kod ovih bolesnika, no to nije potvrđeno relevantnim kliničkim studijama. Uz redovno praćenje i pridržavanje liječenja, bolesnici s Barettovim jednjakom imaju dobru prognozu.
U upalne bolesti jednjaka ubrajamo upalu jednjaka uzrokovanu mikrobiološkim agensima (infekcijski ezofagitis), upalu jednjaka uzrokovanu lijekovima (medikamentozni ezofagitis) te eozinofilni ezofagitis.
INFEKCIJSKI EZOFAGITIS
Uvod. Infektivni ezofagitis rijetka je pojava kod inače zdravih osoba te se obično javlja kod imunokompromitiranih bolesnika (urođene ili stečene imunodeficijencije) ili kod osoba s poremećajima samoga jednjaka (ahalazija, divertikuli, strikture). Većinom se radi o virusnim infekcijama koje se javljaju sekundarno uz osnovno imunodeficitarno stanje (ezofagitisi su česta pojava kod bolesnika s HIV-infekcijom te bolesnika koji su na visokim dozama imunosupresivnih lijekova). Klinička je slika kod većine bolesnika slična, s dominacijom lokalnih simptoma (disfagija, odinofagija) uz manje ili više izražene opće, sistemske simptome. Dijagnostički postupak temelji se na endoskopskom pregledom jednjaka uz uzimanje bioptičkih materijala te serološkim pretragama na najčešće viruse koji mogu uzrokovati ovu bolest. Liječenje je specifično i ovisi o uzročniku. U daljnjemu će tekstu biti opisani najčešći oblici (entiteti) virusnih ezofagitisa.
Bakterijski ezofagitis rijetka je pojava kod imunokompetentnih osoba, a obično se viđa kod bolesnika s neutropenijom i malignim oboljenjem. U kliničkoj slici dominira visoka temperatura, opće loše stanje kao i poteškoće s gutanjem (difagija, odinofagija). Moguć je i razvoj perforacije i akutnoga medijastinitisa. Endoskopski nalaz uključuje hiperemiju, edem te pojavu erozija. Preporuča se uzorkovanje tkiva te patohistološka i mikorbiološka analiza. Specifično liječenje ovisi o vrsti uzročnika, a započinje se antibioticima koji pokrivaju širok spektra bakterija (gram-pozitivne, gram-negativne te anaerobne bakterije).
Kandida ezofagitis. Gljivična infekcija jednjaka koju uzrokuje Candida spp. rijetko se susreće kod inače zdravih osoba, a rizični čimbenici su imunosupresija (imunosupresivno liječenje, HIV infekcija), kronične bolesti (šećerna bolest) te lokalni poremećaji jednjaka (ahalazija, sklerodermija). Endoskopski nalaz uključuje pojavu žućkasto-bijelih naslaga ili plakova duž sluznice jednjaka, a preporučeno je uzimanje uzorka (četkanje) te mikrobiološka dijagnostika. Početno liječenje podrazumijeva peroralnu primjenu flukonazola u dozi od 400 mg prvi dan, a zatim 200 - 400 mg na dan kroz sljedećih 14 - 21 dan. Ako se ne postigne kliničko poboljšanje, može se primijeniti itrakonazol suspenzija (200 mg/dan) ili vorkonazol (2 x 200 mg tbl), a u najtežim oblicima primjenjuje se kaspofungin parenteralno u dozi od 50 mg/dan.
Citomegalovirusni ezofagitis također se javlja isključivo kod imunokompromitiranih bolesnika i to dominantno kod oštećenja stanične imunosti. Glavna klinička tegoba kod ovih bolesnika je odinofagija, a endoskopski se uočavaju brojne erozije i ulceracije sluznice. Liječenje se sastoji od parenteralne primjene ganciklovira (5 mg/kg 1 – 2 x na dan kroz 10 do 14 dana). Druga opcija je primjena foskarneta u dozi od 90 mg/kg svakih osam do dvanaest sati do oporavka stanja bolesnika.
Herpetični ezofagitis najčešće je uzrokovan herpes simpleks virusom tipa 1, a osim kod imunokompromitiranih bolesnika, može se javiti i kod imunokompetentnih osoba. Kliničkom slikom dominira odinofagija, a endoskopski se uočavaju brojne vezikule i ulceracije te fragilna sluznica jednjaka s dominacijom promjena u distalnome dijelu. U bioptičkim uzorcima nalaze se tipične intracelularne inkluzije. Ovisno o kliničkoj slici u liječenju se primjenjuje peroralni aciklovir (400 - 800 mg 5 x/dan kroz sedam dana) ili parenteralni aciklovir (5 mg/kg svakih osam sati kroz sedam dana). Kod bolesnika koji ne reagiraju na takvo liječenje primjenjuje se foskarnet u dozi od 40 mg/kg intravenski svakih osam sati kroz 21 dan.
MEDIKAMENTOZNI EZOFAGITIS
Definicija. Medikamentozni ezofagitis naziv je za oštećenja sluznice jednjaka koja nastaju kao posljedica djelovanja različitih lijekova.
Etiopatogeneza. Osnovni uzrok tih promjena produljeno je vrijeme izloženosti sluznice jednjaka djelovanju lijeka. To se može dogoditi zbog nekoliko razloga: uzimanje lijeka s malo tekućine, oslabljena peristaltika jednjaka, fiziološka suženja jednjaka (mjesto impresije aorte) te patološka suženja jednjaka (benigne i maligne strukture). U tim se situacijama lijek zadržava u području jednjaka gdje počinje dolaziti do njegove resorpcije i stvaranja lokalnih promjena. Oštećenja sluznice mogu nastati direktnim toksičnim učinkom na sluznicu i epitel ili stvaranjem nepovoljnoga okruženja (kiseli medij, lužnati medij, hiperosmolarni medij). Najčešći lijekovi koji uzrokuju takva oštećenja su tetraciklini, nesteroidni protuupalni lijekovi, bisfosfonati i kalijev klorid (Tablica 4.8.).
Patologija. Promjene na sluznici uključuju širok spektar, od hiperemije i edema pa sve do erozija, ulceracija i krvarenja, dok u fazi cijeljenja mogu nastati strikture i suženja jednjaka.
Klinička slika. Klinički se prezentira nastupom bola u prsima, odinofagijom i disfagijom koja obično nastupa pola sata do sat od uzimanja lijeka, a kada se lijek uzima prije spavanja, bol i nelagoda bolesnike obično bude iz sna.
Dijagnoza se postavlja na osnovi anamnestičkih podataka (pogoršanje simptoma nakon uzimanja lijeka) uz endoskopsku i radiološku potvrdu.
Liječenje se provodi simptomatskim mjerama kao što su izbjegavanje uzimanje potencijalnoga lijeka, uzimanje lijekova s puno tekućine te izbjegavanje uzimanja lijekova neposredno pred spavanje. Primjena inhibitora protonske pumpe ne pomaže cijeljenju ovih promjena, ali smanjuje mogući dodatni negativni utjecaj refluksa želučanoga sadržaja ako postoji.
EOZINOFILNI EZOFAGITIS
Definicija. Eozinofilni ezofagitis naziv je za kroničnu upalu jednjaka koju karakterizira histološki nalaz eozinofilne infiltracije. Smatra se da prevalencija ovoga poremećaja u općoj populaciji iznosi oko 40 do 50 slučajeva na 100 000 osoba. Bolest se češće javlja kod muškaraca i to pretežno u srednjoj životnoj dobi. Kod više od polovine bolesnika nalazimo pozitivnu anamnezu na različita atopijska oboljenja (astma, dermatitis).
Etiopatogeneza. Eozinofilni ezofagitis nastaje uslijed poremećaja imunološkoga sustava koji se očituje imunološkom reakcijom posredovanom Th2 stanicama kao odgovorom na zasada nepoznati alergen iz hrane. Pri toj se reakciji oslobađaju interleukini (IL-4, IL-5, IL-13) koji dovode do kemotaksije eozinofila u sluznicu jednjaka. Aktivirani eozinofili dovode do produkcije proupalnih i profibrotičkih medijatora koji dovode do upalnih promjena i nastanka fibroze, što rezultira poremećajem funkcije jednjaka (Slika 4.6.). Često se zajedno s eozinfilnim ezofagitisom nađe i gastroezofagealna refluksna bolest, a s obzirom na to da neki slučajevi eozinofilnoga ezofagitisa dobro reagiraju na liječenje inhibitorima protonske pumpe, razlikujemo i termin IPP-osjetljiv eozinofilni ezofagitis.
Patologija. Makroskopski nalaz kod ovih bolesnika može biti neupadljiv i poremećaj se može verificirati jedino histološkim pregledom uzorka, a mogući makroskopski nalazi uključuju linearno nabiranje sluznice, pojavu koncentričnih prstenova ili bjelkastih nabora nalik kandidijaznom ezofagitisu. Osnovni dijagnostički nalaz je pojava više od 15 eozinofila na velikom vidnom polju u uzorku sluznice jednjaka. Dodatni nalazi uključuju ekstracelularne depozite proteina iz eozinofilnih granula, eozinofilne apscese te hiperplaziju bazalne membrane i lamine proprije. U kasnijim fazama nalazimo i fibrotske promjene (remodelacija stijenke jednjaka).
Slika 4.6. Shematski prikaz patogeneze eozinofilnoga ezofagitisa
Klinička slika. Iako jedan dio bolesnika može biti u potpunosti bez simptoma, najčešće bolesnici kao simptome navode disfagiju na krutu hranu kroz dulji vremenski period, kao i povremene epizode akutne impakcije hrane. Bol u epigastriju i žgaravica također se mogu naći kod ovih bolesnika. Ako je eozinofini ezofagitis udružen s gastroezofagealnom refluksnom bolesti, žgaravica može biti dominantni simptom.
Dijagnoza se postavlja na temelju anamnestičkih podataka kojima se indicira endoskopska obrada, a potvrđuje se patohistološkim nalazom. Pri sumnji na eozinofilni ezofagitis potrebno je uzeti više uzoraka sluznice jednjaka i to iz distalnoga i proksimalnog dijela (distalna infiltracija eozinofilima može se naći i kod bolesnika s GERB-om). Ovu dijagnozu potvrđuje nalaz eozinofilije u perifernoj krvi, kao i povišeni imunoglobulini E (IgE) kod većine ovih bolesnika. Preporuča se provesti i alergološka testiranja na nutritivne alergene.
Diferencijalna dijagnoza uključuje i druge bolesti i stanja koja mogu biti povezana s infiltracijom eozinofilima i disfunkcijom jednjaka: eozinofilni gastroenteritis, infestacije, ahalazija, preosjetljivost na lijekove, Crohnova bolest, hipereozinofilni sindrom, kolagenoze i sl.
Liječenje. Nakon što se postavi sumnja na eozinofilni ezofagitis i nakon što ga se potvrdi patohistološkim nalazom, svim se bolesnicima propisuje empirijska terapija inhibitorima protonske pumpe u dvostrukoj dnevnoj dozi kroz osam tjedana te se tada provodi kontrolna endoskopija s biopsijama. Ako se nakon kontrolne biopsije u patohistološkim nalazima primijeti oporavak (manje od 15 eozinofila u velikom vidnom polju), radi se o IPP-osjetljivom eozinofilnom ezofagitisu ili GERB-u, te se nastavlja liječenje inhibitorima protonske pumpe u standardnoj dozi kao što je to opisano kod GERB-a. Ako se i nakon osam tjedana primjene inhibitora protonske pumpe nađe više od 15 eozinofila u velikom vidnom polju u uzrocima sluznice jednjaka, radi se o eozinofilnom ezofagitisu i tada se započinje s topičkom (lokalnom) primjenom steroida: flutikazon 800 - 1760 mcg/dan ili budezonid 1 - 2 mg/d (preprati koji se koriste i kod astme, samo se ne inhaliraju, nego se progutaju). Nakon nekoliko mjeseci potrebno je iznova napraviti endoskopiju kako bi se evaluirao histološki nalaz. Ako se postigao zadovoljavajuć odgovor, nastavlja se kliničko praćenje, a ako eozinofilija i dalje ustraje, u obzir dolazi sistemska primjena kortikosteroida. Tijekom cijeloga vremena liječenja bolesnici se moraju pridržavati režima prehrane koji uljučuje eliminaciju osnovnih alergogenih namirnica (jaja, mlijeko, žitarice, soja, orašasto voće i morski plodovi). Kod bolesnika s razvijenim strikturama jednjaka preporuča se endoskopska dilatacija.
Tumori jednjaka mogu biti benigni (rijetko) i maligni, među kojima se posebno ističu planocelularni karcinom te adenokarcinom.
BENIGNI TUMORI JEDNJAKA
Benigni tumori jednjaka su rijetki, a najčešće su smješteni intramuralno. Više od tri četvrtine čine leiomiomi. Javljaju se češće kod muškaraca, pretežno u donjoj trećini jednjaka. Najčešći simptom je disfagija, a dijagnoza se postavlja endoskopski. Metoda liječenja je submukozna enukleacija tumora, ali je kod većih tumora potrebna resekcija zahvaćenoga dijela jednjaka. Ostali rijetki tumori mezodermalnoga podrijetla su fibromi, lipomi, fibromiomi, lipomiomi i fibrovaskularni polipi. Benigni tumori epitelnoga podrijetla su planocelularni papilomi.
MALIGNI TUMORI JEDNJAKA
Definicija. Maligni tumori jednjaka čine više od 90 % tumora jednjaka i gotovo su redovno epitelnoga porijekla. Dva najčešća oblika su planocelularni karcinom i adenokarcinom. Ostali, rjeđi tipovi karcinoma jednjaka su verukozni pločasti karcinom, vretenasti pločasti karcinom, adenoskvamozni karcinom, mukoepidermoidni karcinom, adenoid cistični karcinom, karcinom sitnih stanica te nediferencirani karcinom.
Epidemiologija. Rak jednjaka jedan je od najzloćudnijih tumora uopće. Najčešće se javlja u dobi između 50. i 70. godine života s nešto većom učestalošću kod muškaraca nego kod žena (omjer 3:1). Iako se planocelularni karcinom javlja češće nego adenokarcinom, danas se bilježi trend pada učestalosti planocelularnoga karcinoma uz istodobni porast oboljelih od adenokarcinoma. Također, uočena je i obiteljska pojavnost karcinoma jednjaka u područjima s njegovom inače visokom incidencijom (Kina, Iran, Afganistan, Sirija), iako točan genetski poremećaj nije identificiran. Godišnje se u Republici Hrvatskoj dijagnosticira između 100 i 150 novih slučajeva karcinoma jednjaka.
Planocelularni karcinom predstavlja najčešći oblik karcinoma jednjaka, a nastaje iz pločastih epitelnih stanica. Iako se ne zna točan uzrok nastanka ovoga karcinoma, postoje jasni čimbenici rizika koji se s njime povezuju, a dva najznačajnija su: prekomjerni unos alkohola i pušenje. Ostali čimbenici uključuju peroralni unos kancerogena (nitrati, gljivični toksini), oštećenje sluznice fizikalnim agensima (vrući čaj, lužine, radijacijske ozljede), kao i druge bolesti i stanja (kronična ahalazija, Plummer-Vinsonov sindrom, kongenitane hiperkeratoze, infekcije humanim papiloma virusom). Planocelularni karcinom razvija se iz normalnoga epitela, preko displazije pa sve do nastanka invazivnoga karcinoma s progresijom i razvojem metastaza. Na tome putu nastaju različite genetske promjene koje uključuju prekomjernu ekspresiju određenih protoonkogena (EGFR, CCND1) uz inaktivaciju tumor supresorskih gena (p53, p16, p120). Istraživanja su pokazala da u ranim fazama displazije dominiraju genetske promjene u kojima dolazi do prekomjerne ekspresije različitih protoonkogena, dok u kasnijim fazama bolesti dominiraju promjene koje uključuju inaktivaciju tumor-supresorskih gena. Planocelularni karcinom obično se javlja u gornjoj i srednjoj trećini jednjaka.
Adenokarcinom je drugi po učestalosti karcinom jednjaka koji pokazuje sve veću učestalost u razvijenim zemljama što se povezuje s porastom incidencije refluksne bolesti jednjaka. Ovaj se tumor razvija u distalnome dijelu jednjaka i etiološki je povezan s kroničnim želučanim refluksom i gotovo se uvijek pojavljuje na podlozi Barettova jednjaka. Glavni rizični čimbenici za pojavu ovoga malignoma su kronični gastroezofagealni refluks, Barettov jednjak, centralni tip debljine, muški spol i pušenje cigareta. Utjecaj inhibitora protonske pumpe na smanjenje pojavnosti ovoga karcinoma nije posve istražen. Kod više od 15 % bolesnika oboljelih od adenokarcinoma jednjaka nalazimo pojačanu ekspresiju HER2/neu gena što upućuje na njegov utjecaj u nastanku ovoga tumora.
Klinička slika. Bolest se kod većine bolesnika otkrije u poodmakloj fazi. Najčešći je razlog javljanja liječniku progresivna disfagija (najprije na krutu hranu, a kasnije i na tekuću) praćena naglim gubitkom tjelesne težine te odinofagija. Osim toga, bolesnici mogu imati manifestacije lokalnoga širenja bolesti (kašalj, promuklost, dispneja, Hornerov sindrom), kao i udaljenih metastaza (hepatomegalija, ikterus, patološki prijelomi kostiju i dr.). Bolest je praćena brzim propadanjem bolesnika te se vrlo brzo razvija tumorska kaheksija i nemoć.
Dijagnoza se postavlja na temelju anamneze i kliničkoga nalaza, laboratorijskih nalaza krvi, endoskopskoga pregleda, radiološkoga kontrastnog snimanja jednjaka te CT-a prsišta i abdomena. Nakon što se potvrdi dijagnoza karcinoma jednjaka potrebno je provesti dijagnostičku obradu s ciljem procjene proširenosti bolesti.
Laboratorijski nalazi kod ovih bolesnika nisu karakteristični. Najčešće se susreće sideropenična anemija kao posljedica kroničnoga gubitka krvi putem tumorske mase. Ovisno o pojavi metastaza, mogu se naći i drugi patološki nalazi (povišene jetrene transaminaze, povišena alkalna fosfataza i sl.) te hipoalbuminemija kao odraz malnutricije. Iako karcinom jednjaka nema svoj specifični tumorski marker, kod većine bolesnika nalazimo povišene vrijednosti karcinoembrionalnoga antigena (CEA).
Endoskopski pregled jednjaka predstavlja najznačajniju metodu u obradi ovih bolesnika s obzirom na to da omogućava vizualizaciju tumorske mase te uzimanje uzoraka za patohistološku dijagnostiku. Makroskopski tumori mogu imati različite forme: endofitični (ulceracija), egzofitični (poput cvjetače) te difuzno infiltrativni (zahvaćaju cijelu cirkumferenciju jednjaka). Najčešće se radi o egzofitičnim masama koje u različitom stupnju smanjuju lumen jednjaka. Kod uzimanja uzoraka preporuča se uzorkovanje obaviti na više različitih mjesta tumora (6 do 8 uzoraka) kako bi se dobio najoptimalniji uzorak. Patohistološki nalaz mora sadržavati sljedeće informacije: histološki tip karcinoma, stupanj diferenciranosti te dubinu invazije kao i postojanje limfovaskularne invazije. Kod nalaza adenokarcinoma preporuča se i citogenetska dijagnostika i dokazivanje HER2/neu mutacije.
Radiološki kontrastni pregled jednjaka danas se rjeđe izvodi, a pokazuje korist samo u procjeni duljine stenoziranoga segmenta jednjaka, ako se kroz njega ne može proći endoskopskim aparatom. Pretraga se izvodi peroralnim unosom barijeve kaše (pasaža jednjaka).
Procjena proširenosti tumora. Nakon postavljenje dijagnoze karcinoma jednjaka potrebno je provesti obradu s ciljem otkrivanja proširenosti bolesti, kako bi se mogao donijeti ispravni terapijski plan za bolesnika. Za procjenu dubine invazije tumora i zahvaćenosti paraezofagealnih limfnih čvorova danas se preporuča endoskopski ultrazvuk (EUS) te aspiracijska biopsija tankom iglom (FNA). Osim toga, treba učiniti CT prsnoga koša i abdomena. Preporuča se obaviti i PET-CT snimanje s ciljem otkrivanja mogućih metastaza na drugim dijelovima tijela.
Liječenje bolesnika s karcinomom jednjaka ovisi o nekoliko čimbenika: stupanj proširenosti tumora, lokalizacija tumora te bolesnikovo funkcionalno stanje u trenu postavljanja dijagnoze. Bolesnike na temelju tih karakteristika svrstavamo u dvije kategorije: bolesnici s ranim stadijem bolesti (izlječiva bolest) te bolesnici s uznapredovalim stadijem (neizlječiva bolest).
Izlječiva (kurabilna) bolest (ili potencijalno izlječiva bolest) podrazumijeva karcinom jednjaka u stadijima I (Ia, Ib), II (IIa, IIb) te III (IIIa, IIIb). Kod takvih bolesnika osnovu liječenja čini kirurško liječenje s ili bez neoadjuvantne kemoradioterapije. Prijeoperativna (neoadjuvantna) kemoradioterapija nije indicirana kod bolesnika sa stadijem I bolesti, dok se preporuča svim bolesnicima u stadijima II (IIa, IIb) te stadijima IIIa i IIIb, s obzirom na to da su studije pokazale bolje dvogodišnje preživljenje u odnosu na bolesnike koji su liječeni samo operativno bez neoadjuvantne terapije. Preferirana kombinacija neoadjuvantne kemoterapije predstavlja kombinaciju karboplatina plus paklitaksel, kao alternativa navodi se cisplatina plus 5-fluorouracil. Kemoradioterapija bez kirurškoga zahvata kao opcija liječenja ovih bolesnika prihvatljiva je samo kada se radi o bolesnicima kod kojih je operativni zahvat iz bilo kojega razloga kontraindiciran. Kod bolesnika u najranijim fazama bolesti (Ia i Ib) u obzir dolazi i endoskopsko liječenje (endoskopska mukozna resekcija ili endoskopska submukozna disekcija) koje zahtijeva češće endoskopske kontrole kasnije (početno svaka tri mjeseca kroz prvu godinu, a dalje ovisno o nalazu). Tijekom provođenja liječenja svim bolesnicima treba osigurati odgovarajuću prehrambenu podršku.
Neizlječiva (nekurabilna) bolest podrazumijeva karcinom jednjaka u stadijima IIIc i IV. Kod bolesnika u ovim fazama bolesti kirurško liječenje nije indicirano, a sva terapijska nastojanja usmjerena su na poboljšanje simptoma i osiguranje što bolje kvalitete života. Primjenom palijativne kemoradioterapije može se postići kratkoročno poboljšanje simptoma i olakšanje disfagije u dvije trećine bolesnika, osobito onih u stadiju IIIc. Ona se primjenjuje samo kod bolesnika koji imaju očuvani funkcionalni status i imaju očekivano preživljenje od najmanje nekoliko mjeseci. Najčešće se primjenjuje kombinacija triju kemoterapeutika: fluoropirimidin (5-fluorouracil ili kapecitabin), platina (cisplatina ili oksaplatina) te epirubicin ili paklitaksel. Kod bolesnika s metastatskim adenokarcinomom koji je pozitivan na HER2/neu mutaciju može se primijeniti i monoklonalno protutijelo trastuzumab. Kako bi se osigurala odgovarajuća nutritivna potpora bolesniku, preporuča se endoskopsko postavljanje potpornice (stenta) u jednjak ili, u najtežim oblicima, postavljanje perkutane endoskopske gastrostome.
Prognoza bolesnika s karcinomom jednjaka je loša. Petogodišnje preživljenje prisutno je samo kod oko 10 % bolesnika. Kirurško liječenje primjenjivo je u oko 45 % slučajeva, a prati ga relativno visoka stopa mortaliteta (oko 5 %).
U ostale bolesti jednjaka ubrajamo prirođene bolesti i strukturne abnormalnosti jednjaka, varikozitete jednjaka, Mallory-Weissov sindrom, perforaciju jednjaka, hijatalnu herniju te strano tijelo.
PRIROĐENE BOLESTI I STRUKTURNE ABNORMALNOSTI JEDNJAKA
Najčešće bolesti i poremećaji iz ove skupine bolesti su: atrezija jednjaka i traheoezofagealna fistula, opne i prstenovi jednjaka, divertikuli jednjaka, vaskularne kompresije jednjaka te heterotopična želučana sluznica.
ATREZIJA JEDNJAKA I TRAHEOEZOFAGEALNA FISTULA
Atrezija jednjaka označava nepotpun razvoj lumena jednjaka, dok traheoezofagealna fistula označava patološki spoj, odnosno komunikaciju između jednjaka i dušnika. Oba poremećaja nastaju uslijed poremećaja razvoja organa srednjega crijeva: atrezija nastaje kao posljedica izostanka stvaranja lumena jednjaka, a traheoezofagealna fistula nastaje zbog nepotpunoga zatvaranja traheoezofagealnoga septuma u embrionalnom razvoju. Postoji pet različitih tipova ove malformacije, a najčešći oblik uključuje proksimalnu atreziju jednjaka s distalnom traheoezofagealnom fistulom. Ove se malformacije klinički očituju u dječjoj dobi kada se vrlo brzo po rođenju pojavljuje regurgitacija uz respiratorni distres uslijed aspiracije, povezano uz hranjenje. Dijagnoza se potvrđuje kontrastnim radiološkim pretragama (klasična radiografija, kompjuterizirana tomografija), a liječenje je kirurško (zatvaranje fistule i rekonstrukcija jednjaka). Većina takve djece danas preživljava operaciju i ulazi u odraslu dob, a najčešći poremećaji koje kod njih susrećemo su razvoj gastroezofagealne refluksne bolesti koja se dobro drži pod kontrolom primjenom inhibitora protonske pumpe te poslijeoperativne strikture koje se često moraju rješavati endoskopskim intervencijama (dilatacija).
OPNE I PRSTENOVI JEDNJAKA
Opne jednjaka predstavljaju strukturni poremećaj obilježen postojanjem tanke, membranske opne koja sužava lumen jednjaka, a može se javiti na bilo kojemu dijelu - s najčešćom lokalizacijom u proksimalnom jednjaku. Opne jednjaka građene su od sloja vezivnoga tkiva različite debljine koji je s obiju strana obložen višeslojnim pločastim epitelom, a često je prisutna i upalna infiltracija. Točan uzrok i mehanizam nastanka opni jednjaka nije poznat. Povezuje se s poremećajem u razvoju jednjaka, a primijećena je i veća učestalost kod bolesnika koji imaju i neke druge bolesti kao što eozinofilni ezofagitis, bulozne kožne promjene (pemfigoid, bulozna epidermoliza) i sideropenična anemija.
Prstenovi jednjaka predstavljaju područja koncentričnoga suženja jednjaka koja se javljaju u njegovome distalnom dijelu. Prema građi prstena razlikujemo dva oblika: mišićni (tip A) i sluznični (tip B). Mišićni prsten predstavlja difuzno zadebljanje mišićnoga sloja što se mikroskopski vidi kao hipertrofija mišićnih vlakana cirkulatornoga sloja, a javlja se nekoliko centimetara iznad nazubljene linije (skvamokolumnarne granice). Sluznični prsten (Schatzkijev prsten) češće se susreće, a predstavlja zadebljali nabor sluznice koji zahvaća punu cirkumferenciju i sužava lumen jednjaka. Prstenovi u prvome redu nastaju kao poremećaj u razvoju jednjaka, no mogu biti povezani i s gastroezofagealnom refluksnom bolesti i nastati kasnije u životu, osobito sluznični.
Klinička slika. Simptomi i znakovi posljedica su suženja lumena jednjaka što se očituje otežanim (disfagija) i bolnim gutanjem (odinofagija) te regurgitacijom hrane, a ako se radi o poremećaju u proksimalnom dijelu, moguća je i aspiracija hrane u dišne puteve. Simptomi se javljaju intermitentno i ne pokazuju progresivni karakter. Također, ovi su bolesnici skloniji nastanku stranoga tijela u jednjaku što se događa kod uzimanja većih zalogaja hrane. Navedeni simptomi javljaju se kada se lumen jednjaka suzi na manje od 13 mm u promjeru. Opne i prstenovi koji ne dovode do ovoga kritičkog suženja lumena jednjaka ostaju asimptomatski. Plummer-Vinsonov ili Paterson-Brown-Kellyjev sindrom je klinički sindrom obilježen disfagijom uzrokovanom opnom na jednjaku, glostitisom te sideropeničnom anemijom.
Dijagnoza se postavlja na temelju endoskopske obrade (obično kao slučajni nalaz) ili radiološkoga kontrastnoga snimanja (pasaža jednjaka barijevom kašom). Radiološki prikaz pokazao se superiornijim u odnosu na endoskopsku dijagnostiku s obzirom na to da se manje izraženi prstenovi teže uočavaju za vrijeme endoskopije.
Liječenje je indicirano samo kod simptomatskih bolesnika. Osnovu liječenja čini endoskopska dilatacija na mjestu suženja lumena jednjaka, iako su česti recidivi i postupak se mora ponavljati. Dugotrajna primjena inhibitora protonske pumpe smanjuje učestalost recidiva. Također, u liječenju mišićnoga prstena u obzir dolazi i primjena botulinum toksina ili antikolinergika u područje suženja.
DIVERTIKULI JEDNJAKA
Uvodne napomene. Divertikuli jednjaka predstavljaju vrećasta, lokalizirana proširenja jednjaka koja se rjeđe susreću u kliničkoj praksi. Oni su odgovorni za manje od 5 % uzroka disfagije u odrasloj dobi, a najčešće se javljaju kod muškaraca starije životne dobi. Divertikuli prema mehanizmu nastanka mogu biti pulzijski - nastaju zbog povećanoga intraezofagealnoga tlaka, te trakcijski - nastali povlačenjem stijenke jednjaka od strane okolnoga upalnog tkiva (adhezije). Prema lokalizaciji razlikujemo hipofaringealne, torakalne i epifrenične divertikule.
Hipofaringealni (Zenkerov) divertikul predstavlja hernijaciju (protruziju) sluznice stražnjeg zida hipofarinksa iznad gornjega ezofagealnog sfinktera između dva mišića (m. constrictor pharyngealis i m. cricopharyngeus). Nastaje uslijed povišenja tlaka u hipofarinksu tijekom gutanja zbog nedovoljne relaksacije gornjega ezofagealnog sfinktera. Klinički su obično asimptomatski, a kod nekih bolesnika možemo naći hipersalivaciju, nelagodu i oteklinu na vratu (prazni se nakon pritiska na nju i nestaje) te neugodan zadah. Najčešće komplikacije koje susrećemo kod ovih bolesnika su aspiracija i nastanak opetovanih pneumonija te perforacija divertikula koja nastaje prilikom endoskopije. Dijagnoza se postavlja na temelju anamneze, lokalnoga nalaza (palpabilna tumefakcija na vratu koja nastaje nakon gutanja) te se potvrđuje kontrastnim radiološkim pregledom jednjaka ili endoskopijom (samo ako je nužna, uz oprez da ne dođe do probijanja). Liječenje je uglavnom konzervativno i podrazumijeva uzimanje manje količine hrane uz dobro žvakanje i dosta tekućine. Divertikulektomija je indicirana samo kod težih simptoma i pojave učestalih komplikacija.
Torakalni divertikuli pojavljuju se u srednjem dijelu jednjaka, najčešće zbog poremećaja motiliteta jednjaka (npr. ahalazija) ili uslijed povlačenja stijenke jednjaka kroničnim upalnim procesom u medijastinumu (trakcijski divertikul). Torakalni divertikuli obično su asimptomatski zbog velikoga otvora koji omogućava pražnjenje, pa ne dolazi do zadržavanja hrane u njemu. Dijagnoza se postavlja slučajno, za vrijeme endoskopije ili radiološkoga pregleda jednjaka i želuca zbog nekoga drugog poremećaja. Liječenje nije potrebno osim kod pojave komplikacija, a sastoji se od kirurškoga postupka resekcije divertikula.
Epifrenični divertikuli pojavljuju se u donjemu dijelu jednjaka, a najčešće su uzrokovani pojačanim motilitetom jednjaka uz poremećenu relaksaciju donjega ezofagealnog sfinktera što rezultira porastom intraluminalnoga tlaka i nastankom proširenja (pulzijski divertikuli). Rjeđi uzrok može biti i mehanička opstrukcija (benigne i maligne strikture) koja također dovodi do povišenja intraluminalnoga tlaka. Bolesnici su obično asimptomatski, rjeđe se mogu žaliti na retrosternalnu bol, difagiju, odinofagiju ili regurgitaciju. Dijagnoza se postavlja radiološkim kontrastnim pregledom jednjaka ili endoskopski. Endoskopska dijagnostika omogućava i uzimanje bioptičkih materijala što ima veliki diferencijalno-dijagnostički značaj (tumorska stenoza i sl.). Liječenje se provodi samo kod bolesnika s izraženim simptomima (divertikulektomija).
VASKULARNE KOMPRESIJE JEDNJAKA
Dysphagia lusoria simptomatska je kompresija jednjaka uzrokovana aberantnom desnom arterijom subklavijom. Klinički se može očitovati u djetinjstvu ili tek u kasnijoj životnoj dobi kao posljedica razvijene ateroskleroze. Pri fizikalnom pregledu nalazimo oslabljen puls desne radijalne arterije, a dijagnoza se potvrđuje radiološkim pregledom barijevom kašom koji pokaže defekt punjenja iznad luka aorte u razini trećega torakalnog kralješka te CT angiografijom luka aorte i njezinih ogranaka. Liječenje je kirurško, a kod starijih osoba kod kojih je operacija kontraindicirana preporuča se konzervativno liječenje koje uključuje uzimanje manjih obroka s dosta tekućine te izbjegavanje krute hrane. Anomalije drugih žila koje mogu vršiti kompresiju na jednjak su desni ili dvostruki aortalni luk te aberantna lijeva plućna arterija.
HETEROTOPIČNA ŽELUČANA SLUZNICA
Heterotopična želučana sluznica predstavlja razvojnu anomaliju pri kojoj se u području jednjaka pojavljuju ograničeni areali želučane sluznice. To se može slučajno naći kod oko 5 % osoba koje se podvrgavaju endoskopiji probavnoga sustava. Promjene se obično nalaze u proksimalnom dijelu jednjaka, crvenkaste su boje te variraju u veličini od nekoliko milimetara do nekoliko centimetara. Sluznica zadržava sve druge karakteristike kao što je lučenje želučane kiseline što može dovesti do iritacije sluznice jednjaka te nastanka ezofagitisa i ulceracija. Bolesnici se mogu žaliti na osjećaj pečenja u gornjem dijelu prsišta iza prsne kosti ili vratu, a često su i promukli zbog nadražaja glasnica. Dijagnoza se postavlja endoskopski, a liječenje podrazumijeva primjenu inhibitora protonske pumpe ili endoskopsku ablaciju.
VARIKOZITETI JEDNJAKA
Definicija. Varikoziteti jednjaka predstavljaju proširenja submukoznih vena koja su nastala kao posljedica portalne hipertenzije, a mogu dovesti do rupture i po život opasnoga krvarenja. Portalna hipertenzija nastaje kao posljedica ciroze jetre. Smatra se da oko 50 % oboljelih od ciroze jetre ima varikozitete jednjaka, a od njih će 30 % razviti njihovo krvarenje.
Etiopatogeneza. Najčešći uzrok portalne hipertenzije koja dovodi do razvoja varikoziteta jednjaka je ciroza jetre, osobito ciroza jetre alkoholne etiologije. Varikoziteti jednjaka nastaju uslijed stvaranja portosistemskih kolaterala kojima se nastoji drenirati krv iz portalne vene zaobilaznim putem preko želučanih koronarnih vena u jednjačne vene, a potom u venu azigos i gornju šuplju venu. Razvoj ovih kolaterala započinje kada razlika tlaka između vene porte i donje šuplje vene (tzv. transhepatalni venski gradijent) prijeđe vrijednost od 10 do 12 mmHg, dok je normalno taj gradijent između 2 i 6 mmHg. Povećan protok krvi kroz jednjačne vene (hiperdinamička cirkulacija) dovodi do slabljenja stijenke vena te njihova vrećastoga proširenja. Ruptura i krvarenje iz varikoziteta ovise o hidrostatskom tlaku u samom variksu (eruptivna terorija) te o upalnim i drugim patološkim promjenama stijenke jednjaka (erozivna teorija). Čimbenici koji nose rizik od nastanka krvarenja iz varikoziteta uključuju: 1) veličinu variksa (veći variksi nose veći rizik), 2) prisutnost nepovoljnih endoskopskih znakova (engl. cherry red spots), 3) težina jetrene bolesti (uznapredovala bolest nosi veći rizik) te 4) uzimanje alkohola (bolesnici s cirozom koji su nastavili uživati alkohol imaju veći rizik).
Klinička slika. Varikoziteti jednjaka ne dovode do kliničkih manifestacije sve dok ne nastupi ruptura i krvarenje. Svako krvarenje iz gornjega dijela probavnoga sustava (hematemeza, melena) u prisutnosti kliničkih znakova jetrene bolesti treba pobuditi sumnju na varikozitete jednjaka. Krvarenja su obično teška i kada se ne liječe dovode do razvoja hemoragijskoga šoka.
Dijagnoza se postavlja na temelju anamnestičkih podataka i fizikalnoga pregleda (stigme jetrene bolesti), a potvrđuje se endoskopskim pregledom. Na temelju endoskopije razlikujemo nekoliko stupnjeva varikoziteta jednjaka: I. stupanj (mali variksi bez prolapsa u lumen jednjaka), II. stupanj (srednje veliki variksi koji prolabiraju u lumen, ali ga ne sužavaju, a gastroezofagealni spoj je vidljiv), III. stupanj (veliki variksi koji prolabiraju i sužavaju lumen, a gastroezofagealni spoj je teško vidljiv) i IV. stupanj (variksi opstruiraju lumen jednjaka, a spoj se ne vidi). Treba obratiti pozornost na prisutnost tzv. prijetećih znakova «crvenih točki» koje se opisuju kao točkice nalik trešnji (engl. cherry red spots), a označavaju povećanu napetost stijenke variksa te se smatraju stigmama rupture variksa. Kod takvih se bolesnika endoskopija mora izvoditi pažljivo i oprezno kako bi se izbjegla moguća traumatska lezija variksa i jatrogeno krvarenje.
Liječenje varikoziteta jednjaka možemo podijeliti u nekoliko točaka: primarna prevencija krvarenja, liječenje krvarenja te sekundarna prevencija krvarenja.
Primarna prevencija krvarenja odnosi se na bolesnike koji imaju verificirane varikozitete jednjaka, a nisu još imali krvarenje iz njih te je usmjerena na njegovu prevenciju. Primarna prevencija provodi se kod svih bolesnika s visokim rizikom od nastanka krvarenja, a to su bolesnici s variksima većim od 5 mm i prisutnim cherry red spots stigmama te bolesnici s cirozom jetre u B ili C kategoriji prema Child-Pugh klasifikaciji. Bolesnici koji se nalaze u kategoriji A ciroze jetre te imaju varikse manje od 5 mm bez cherry red spots stigmi ne zahtijevaju primarnu prevenciju, nego kontrolni endoskopski pregled i reevaluaciju bolesti kroz jednu godinu. Primarna prevencija uključuje primjenu neselektivnih beta-adrenergičkih blokatora (propranolol), dok je endoskopska ligacija variksa indicirana samo kod bolesnika s vrlo visokim rizikom od krvarenja ili bolesnika kod kojih je kontraindicirana primjena propranolola.
Liječenje krvarenja iz varikoziteta jednjaka podrazumijeva hemodinamsku stabilizaciju bolesnika (opisano u dijelu o krvarenju iz gornjega dijela probavnoga sustava), ispravak koagulacijskoga poremećaja udruženoga s jetrenom bolesti, primjenu vazoaktivnih lijekova, antibiotsku profilaksu te specifične postupke kao što su hitna endoskopska intervencija, balonska tamponada te portalne dekompresivne procedure.
Ispravak koagulacijskoga poremećaja potreban je kod gotovo svih bolesnika s obzirom na poremećenu jetrenu funkciju i sintezu faktora zgrušavanja. Pri akutnom krvarenju preporuča se primjena svježe smrznute plazme (20 ml/kg početno te 10 mg/kg svakih šest sati) i vitamina K sve dok se ne postigne normalizacija protrombinskoga vremena (INR između 1,8 i 2). Bolesnicima s trombocitima nižima od 50 x 109 potrebna je transfuzija trombocita. Primjena rekombinantnoga faktora VIIa nije pokazala veću učinkovitost, a upitna je i učinkovitost primjene faktora protrombinskoga kompleksa.
Svim bolesnicima s aktivnim krvarenjem iz varikoziteta jednjaka preporuča se primjena somatostatina (250 mcg/h) ili njegovih analoga kao što su oktreotid (50 mcg iv bolus, a zatim nastavak 50 mcg/h) i terlipresin (1 - 2 mg iv svaka 4 sata). Ovi lijekovi smanjuju perfuziju splanhičnih krvnih žila i tlak u portalnoj veni čime smanjuju u konačnici i protok i tlak u venama jednjaka. Dokazano poboljšavaju kontrolu krvarenja iz varikoziteta (osobito u kombinaciji s endoskopskom intervencijom), ali nije dokazano i da smanjuju smrtnost. Primjena ovih lijekova provodi se kroz tri do pet dana.
S obzirom na to da kod ovih bolesnika postoji visok rizik od razvoja teških infekcija, kao što su bakterijski peritonitis, pneumonija ili infekcija mokraćnih puteva, kod svih je opravdana i preporučena antibiotska profilaksa koja bi u prvome redu trebala pokriti gram-negativne uzročnike, s obzirom na to da se oni najčešće izoliraju. U ovu se svrhu primjenjuju fluorokinoloni (npr. ciprofloksacin 2 x 200 - 400 mg iv) ili cefalosporini treće generacije (ceftriakson 1 x 1 g iv) koji su danas prihvatljiviji izbor zbog sve veće učestalosti rezistencije na fluorokinolone te sve češće pojave gram-pozitivnih uzročnika.
Endoskopsku intervenciju preporuča se napraviti što ranije, odmah nakon hemodinamske stabilizacije (unutar 2 do 12 sati). Kontrola krvarenja postiže se sklerozacijom ili primjenom ligatura (podvezivanje). Ovim se tehnikama postiže odgovarajuća hemostaza kod više od 80 % bolesnika. Ako se hemostaza postigne primjenom ligatura, procedura se ponavlja svakih 2 do 4 tjedna dok se ne podvežu svi vidljivi varikoziteti.
Mehanička balonska tamponada danas se rijetko koristi kao prijelazna metoda za kontrolu krvarenja do definitivne terapije (endoskopska intervencija). Hemostaza se postiže postavljanjem posebnih sondi (Minnesota sonda, Sengstaken-Blakemoreova sonda) koje omogućavaju napuhavanje balona zrakom ili fiziološkom otopinom unutar jednjaka, a oni potom mehanički vrše kompresiju na varikse i zaustavljaju krvarenje. Taj se način liječenja može primjenjivati najviše do 24 sata.
Portalne dekompresivne metode rezervirane su za bolesnike kod kojih se ne postiže odgovarajuća kontrola krvarenja primjenom vazoaktivnih lijekova i endoskopskom intervencijom. U tu se svrhu najčešće izvodi transjugularni intrahepatalni portosistemski shunt (TIPS) koji podrazumijeva stvaranje spoja između portalne i hepatalne vene postavljanjem metalnoga stenta koji se uvodi posebnim kateterom kroz unutarnju jugularnu venu. TIPS je povezan s povećanom učestalosti razvoja hepatalne encefalopatije. Hitno kirurško liječenje (kirurški portosistemski šant) rijetko se provodi, a prati ga visoka stopa smrtnosti (preko 60 %).
Sekundarna prevencija krvarenja podrazumijeva primjenu terapijskih postupaka čiji je cilj smanjiti rizik od ponovne pojave krvarenja iz varikoziteta jednjaka. Kao najbolja opcijom u sekundarnoj prevenciji pokazala se kombinacija endoskopske ligature variksa uz istodobnu primjenu neselektivnih beta-adrenergičkih blokatora (propranolol), ali određen stupanj uspjeha pokazuju i transjugularni portosistemski šant, kirurški portosistemski šant te transplantacija jetre.
Prognoza. Smrtnost je kod ovih bolesnika visoka i iznosi 30 do 50 %. Kod oko 60 do 70 % bolesnika krvarenje se javi iznova unutar jedne godine i to u polovice unutar prvih šest tjedana.
MALLORY-WEISSOV SINDROM
Definicija. Mallory-Weissov sindrom je naziv za akutno krvarenje iz gornjega probavnog sustava koje nastaje zbog površinskih (rjeđe transmuralnih) linearnih laceracija sluznice jednjaka i/ili želuca u blizini ezofagogastrične spojnice.
Etiopatogeneza. Uzrok ovoga stanja učestalo je povraćanje čija je posljedica mehaničko oštećenje sluznice uslijed naprezanja koje dovodi do prekida sluznice i oštećenja krvnih žila. To stanje najčešće susrećemo uslijed povraćanja nakon pijanstva, a rjeđe se vidi i kod sindroma hiperemeze u trudnoći ili opetovanoga povraćanja koje vidimo kod bolesnika s nefrokolikama ili bilijarnim kolikama. Kod većine bolesnika dolazi do spontanoga cijeljenja promjena na sluznici unutar 48 sati.
Klinička slika, dijagnoza i liječenje. Dominantna klinička manifestacija je hematemeza koja se javlja uslijed i nakon profuznoga povraćanja, a bolesnici se često tuže i na bol u epigastriju. Dijagnoza se potvrđuje endoskopskim nalazom. U većini slučajeva tijekom endoskopskoga pregleda krvarenje je već prestalo, a ako je i dalje prisutno, potrebna je endoskopska hemostaza. Kod ovih bolesnika standardno se parenteralno primjenjuje inhibitor protonske pumpe u punoj dozi.
PERFORACIJA JEDNJAKA
Etiologija. Perforacija jednjaka najčešće nastaje uslijed instrumentalne ozljede tijekom endoskopije, dok su rjeđi uzroci strana tijela, spontana barogena ruptura – Boerhaaveov sindrom (rađanje, defekacija, dizanje teškoga predmeta) ili lokalno uznapredovala bolest jednjaka (tumor, upala, divertikul).
Klinička slika. Perforaciju jednjaka obično prati pojava nagloga bola u vratu, prsnom košu ili gornjem abdomenu (ovisno o mjestu rupture), a pojačava se prilikom gutanja tekućine ili hrane. Uslijed prodora zraka u medijastinum (pneumomedijastinum) razvija se supkutani emfizem suprasternalno i supraklavikularno. Zbog otvorene komunikacije s medijastinalnim strukturama dolazi do prodora bakterija i razvoja akutnoga medijastinitisa praćenoga prostracijom te razvojem septičkoga šoka.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, fizikalnoga nalaza (supkutani emfizem) te radiološke dijagnostičke obrade. Na preglednom radiogramu prsnoga koša mogu se naći znakovi pneumomedijastinuma, a za konačnu dijagnozu preporuča se obaviti CT prsnoga koša ili kontrastni radiološki pregled jednjaka uz primjenu vodotopljivih kontrastnih sredstava (gastrografin).
Liječenje perforacije uglavnom podrazumijeva kirurško zbrinjavanje, osim ako se radi o perforaciji vratnoga dijela koji se može tretirati i konzervativno. Konzervativno liječenje sastoji se od simptomatskih terapijskih mjera i primjene antibiotika širokoga spektra. Ako se radi o perforaciji kao posljedici tumorske invazije, može se pokušati i s endoskopskim postavljanjem stenta u područje tumora, odnosno rupture.
HIJATALNA HERNIJA
Definicija. Hijatalna hernija označava anatomski defekt kod kojega dolazi do prolabiranja gornjega dijela želuca u prsnu šupljinu kroz otvor ošita kroz koji normalno prolazi jednjak (hiatus oesophagi). Iako se točan uzrok ovoga poremećaju ne zna, vjeruje se da se radi o prirođenoj ili stečenoj slabosti ošita, a dodatni rizični čimbenici uključuju traumu abdomena i/ili prsišta, debljinu, trudnoću i teški fizički rad. Razlikujemo dva oblika hijatalne hernije: klizna (95 %) i paraezofagealna (5 %).
Klizna hijatalna hernija označava protruziju intraabdominalnoga dijela jednjaka i kardije u prsište pri čemu nastaje zvonkoliko proširenje probavne cijevi iznad ošita. S obzirom na to da pri ovome stanju dolazi do izravnavanja Hisova kuta (kut između jednjaka i želuca), dolazi do poremećaja funkcije donjega ezofagealnog sfinktera zbog čega se pospješuje stvaranje refluksne bolesti jednjaka.
Paraezofagealna hijatalna hernija označava stanje kod kojega su intraabdominalni dio jednjaka i kardija u normalnoj poziciji, a kroz hijatus pored jednjaka prolazi dio fundusa želuca. U ovom slučaju ne dolazi do poremećaja Hisova kuta, pa je funkcija donjega ezofagealnog sfinktera očuvana, ali je moguća inkarceracija fundusa želuca u hijatusu.
Klinička slika i dijagnoza. Hijatalna hernija je asimptomatska bolest dok se ne razviju komplikacije, kao što je GERB kod klizne hernije ili uklještenje kod paraezofagealne hernije. Dijagnoza se postavlja na temelju endoskopskoga pregleda jednjaka i želuca, rjeđe kontrastnim radiološkim metodama.
Liječenje nije potrebno ako je bolest asimptomatska. Kirurško liječenje indicirano je kada se ne može postići medikamentozna kontrola simptoma bolesnika s GERB-om ili kada se razvije uklještenje.
STRANO TIJELO U JEDNJAKU
Strana tijela u jednjaku obično susrećemo kod starijih osoba (problemi sa zubalom, otežano gutanje), djece te psihijatrijskih bolesnika i zatvorenika. Najčešći predmeti koji završe u jednjaku su novčići, sitne igračke, kosti, neprožvakana hrana, žlice, vilice, žice i sl. Predmeti se najčešće zaustavljaju u proksimalnom dijelu jednjaka i to obično na mjestu impresije od strane aortalnoga luka. Simptomi nastaju naglo, a prezentiraju se kao disfagija (najčešći simptom), odinofagija, osjećaj gušenja, kašalj, dispneja i hroptanje. Dijagnoza se postavlja anamnestički, a potvrđuje se endoskopski. Danas je endoskopija terapijska metoda za vađenje stranih tijela metoda izbora. S obzirom na to da procedura zna potrajati duže i bude neugodna i bolna po pacijenta, indicirano je izvođenje u dubokoj analgosedaciji pod anesteziološkim nadzorom. U slučaju neuspjeha endoskopske metode, indiciran je kirurški zahvat. Komplikacije koje mogu nastati kod endoskopskoga terapijskog izbora su perforacija te stvaranje apscesa i fistula, što zahtijeva posebnu opreznost kod izvođenja endoskopskoga zahvata.
GASTRITISI I GASTROPATIJE
Gastritis je naziv za sve upalne promjene želuca, a načelno ga dijelimo u tri skupine: akutni gastritis, kronični gastritis te oblik specifičnoga gastritisa. Duodenitis se obično susreće zajedno s gastritisom te se rijetko pojavljuje kao poseban klinički entitet. Gastropatija je naziv za promjene na želučanoj sluznici bez upalne komponente ili je ona vrlo slabo izražena.
AKUTNI GASTRITIS
Definicija. Akutni gastritis naziv je za akutnu upalu želučane sluznice koju karakterizira nastanak višestrukih erozija i krvarenja, pa se naziva još i erozivni ili hemoragijski gastritis. Danas je akutni gastritis najčešće povezan s hipoperfuzijom sluznice (stresni gastritis), prekomjernom konzumacijom nesteroidnih protuupalnih lijekova te prekomjernim unosom alkohola.
Etiopatogeneza. Akutni gastritis može biti infektivne i neinfektivne prirode. Infektivni akutni gastritis najčešće uzrokuje H. pylori, a rjeđe se može raditi i o drugim bakterijama kao što su Streptococcus spp, Staphylococcus spp, Escherichia coli i Haemophilus spp (obično kod imunokompromitiranih osoba nakon instrumentalnih zahvata kao što je polipektomija i sl.). Neinfektivni akutni gastritis javlja se znatno češće, a može biti posljedica kemijskih (lijekovi, alkohol, toksini) ili fizikalnih oštećenja (nazogastrična sonda, strana tijela). Nastanku upale pridonose i drugi čimbenici, kao što su refluks duodenalnoga sadržaja (žuč), pušenje, začinjena hrana i sl. Poseban klinički entitet čini akutni stresni gastritis koji se često viđa kod kritično oboljelih osoba.
Akutni stresni gastritis javlja se u kliničkim stanjima koje obilježava nastanak hipotenzije i centralizacije krvotoka pri čemu posljedično dolazi do hipoperfuzije sluznice želuca. Slabo prokrvljena sluznica želuca postaje vulnerabilna i osjetljiva na djelovanje želučane kiseline zbog čega nastaju višestruke erozije i/ili ulceracije. Glavni rizični čimbenici razvoja ovoga oblika akutnoga gastritisa su krvotočni urušaj (šok), mehanička ventilacija, koagulopatija, sepsa, oštećenja središnjega živčanog sustava te višeorgansko zatajenje. Carlingov ulkus naziv je za razvoj akutnoga stresnog gastritisa uslijed opsežnih opeklina, a Cushingov ulkus uslijed posljedica oštećenja središnjega živčanog sustava.
Patologija. Morfološki, promjene mogu biti različitoga stupnja i težine, od hiperemije i edema sluznice pa do pojave erozija i ulkusa praćenih krvarenjem. Histološki nalaz pokazuje obilan upalni infiltrat sastavljen od različitih upalnih stanica, a omogućava i jasnu razliku između erozija i ulkusa (ulkus je defekt sluznice koji prolazi muskularis mukoze).
Klinička slika. Bolest je praćena nespecifičnim bolovima u abdomenu te nelagodom u epigastriju. Obično su prisutni mučnina i povraćanje, a kod krvarenja se može pojaviti i hematemeza. S obzirom na to da se radi o krvarenju iz površinskih lezija, ona ne dovode do hemodinamske nestabilnosti i dramatične kliničke slike. Kod akutnih gastritisa infektivne naravi dolazi i do povišenja temperature i pojave općih infektivnih simptoma što se ipak rjeđe viđa u kliničkoj praksi. Nije dokazana povezanost između težine kliničke slike i endoskopskoga nalaza.
Dijagnoza se postavlja na temelju anamnestičkih podataka i kliničkoga nalaza, laboratorijskih nalaza i nalaza endoskopije. Anamnestički podaci otkrivaju mogući uzrok (prekomjerni unos lijekova, alkohola i sl.), dok klinički nalaz ne mora biti pretjerano upečatljiv (osjetljivost i palpatorna bolnost epigastrija). Laboratorijski nalazi su nespecifični, eventualno se mogu uočiti nešto niže vrijednosti hemoglobina i hematokrita ako je posrijedi izraženije krvarenje. Konačna dijagnoza postavlja se endoskopski uz uzimanje bioptičkih uzoraka, a sam endoskopski nalaz također može biti upečatljiv i sugerirati dijagnozu.
Liječenje. Blaži oblici akutnoga gastritisa zahtijevaju mirovanje, dijetalnu ishranu te peroralnu ili parenteralnu primjenu inhibitora protonske pumpe u standardnoj dnevnoj dozi ili dvostrukoj dnevnoj dozi (Tablica 4.6.). U slučaju krvarenja najčešće je indicirana hospitalizacija, a bolesnicima se ordinira neki od inhibitora protonske pumpe parenteralno u punoj dozi. U težim slučajevima indicirana je i endoskopska hemostaza. Ova se terapija primjenjuje do prestanaka krvarenja i simptomatskoga olakšanja kada se može započeti s laganom ishranom uz nastavak liječenja inhibitorima protonske pumpe per os. Specifični oblici akutnoga gastritisa zahtijevaju i specifično liječenje (eradikacija H. pylori i sl.).
Prognoza bolesnika s akutnim gastritisom načelno je dobra. Svim bolesnicima koji se nalaze u jedinicama intenzivnoga liječenja, kao i svim drugima s prethodno navedenim rizičnim čimbenicima razvoja akutnoga stresnog gastritisa, preporuča se profilaktička primjena inhibitora protonske pumpe, najčešće u parenteralnom obliku, no dokazana je i jednako dobra učinkovitost peroralnih preparata kad nastupi kliničko poboljšanje.
KRONIČNI GASTRITIS
Definicija i podjela. Kronični gastritis naziv je za kroničnu upalu sluznice želuca koju histološki karakterizira upalni infiltrat sastavljen primarno od limfocita i plazma stanica. Ovisno o uzroku i anatomskoj raspodjeli promjena na želucu razlikuju se dva oblika kroničnoga gastritisa: tip A (autoimuni gastritis) i tip B (kronični gastritis uzrokovan infekcijom H. pylori).
Kronični gastritis tip A (autoimuni gastritis) oblik je kroničnoga gastritisa, a nastaje uslijed autoimuno posredovanoga oštećenja sluznice fundusa želuca. Kod više od 90 % takvih bolesnika možemo dokazati postojanje autoantitijela usmjerenih na parijetalne stanice i unutarnji faktor, zbog čega je klasično ovaj oblik gastritisa udružen i s pernicioznom anemijom. Točan uzrok nastanka ove bolesti nije poznat, a veću učestalost nalazimo kod osoba koje imaju HLA-B8 i HLA-DR3 haplotip. Također, ove osobe obično imaju razvijene i druge autoimuno posredovane bolesti (imunotireopatija, vitiligo, šećerna bolest tip I). Histološke promjene u ovome obliku kroničnoga gastritisa ograničene su na područje fundusa želuca, a uključuju atrofiju i intestinalnu metaplaziju uz upalni infiltrat kojeg pretežno čine limfociti i plazma stanice. S obzirom na to da se želučana kiselina najvećim dijelom stvara u fundusu želuca, razvija se hipoklorhidrija uz kompenzatornu hipergastrinemiju koja pak može dovesti do hiperplazije enterokromafinih stanica s mogućnošću nastanka malih, multicentričnih karcinoidnih tumora. Bolesnici s kroničnim autoimunim gastritisom imaju trostruko veći rizik od razvoja adenokarcinoma želuca u odnosu na opću populaciju.
Kronični gastritis tip B (H. pylori gastritis). Kronični gastritis tip B uzrokovan je infekcijom Helicobacter pylori, a tipično zahvaća antralni dio želuca (antralni gastritis), iako u težim oblicima može zahvatiti sve dijelove želuca, pa govorimo o pangastritisu. H. pylori je gram-negativna, ubikvitarna štapićasta bakterija koja invadira i naseljava površinski dio sluznice želuca. Učestalost infekcije ovim mikroorganizmom povećana je u nerazvijenim zemljama, odnosno povezana je s nepovoljnim socioekonomskim prilikama. Patogenetski mehanizmi nastanka upale i oštećenja sluznice definirani su genima vacA i cagA koji osiguravaju lučenje ureaze. Ona optimizira pH sluznice potreban za opstanak bakterije te lučenje toksina koji uzrokuju direktan citotoksičan učinak. Akutna infekcija ovom bakterijom karakterizirana je superficijalnim gastritisom kojega histološki karakterizira obilan upalni infiltrat sastavljen dominantno od polimorfonukleara, dok u daljnjemu tijeku upala poprima kronični karakter obilježen pojavom limfocita. Rezultat te kronične upale uključuje tri moguća ishoda: 1) većina ljudi razvije blagi, difuzni gastritis koji ne remeti lučenje želučane kiseline te nije povezan s klinički značajnim ishodima, 2) oko 15 % oboljelih razvije dominantni antralni gastritis obilježen povećanim lučenjem gastrina i želučane kiseline, zbog čega se povećava rizik od nastanka želučanoga i duodenalnog ulkusa te 3) manje od 5 % oboljelih razvije difuzni pangastritis kojega obilježavaju atrofija i intestinalna metaplazija epitela te povećan rizik od nastanka želučanoga adenokarcinoma (detaljnije opisano u dijelu o karcinomu želuca). Osim toga, kronični gastritis uzrokovan H. pyori povezan je i s povećanim rizikom od razvoja MALT limfoma (kronična stimulacija T-stanica dovodi do proizvodnje citokina koji mogu djelovati kao promotori nastanka limfoma).
Patohistološki nalaz. Klasično, kronični gastritis prolazi kroz tri razvojne faze. Početno nalazimo površinski ili superficijalni gastritis koji je obilježen upalnim infiltratom sastavljenim od polimorfonukleara i limfocita i ograničen je na mukozu i laminu propriju. Sljedeća razvojna faza podrazumijeva širenje upale u dublje dijelove želučane sluznice uz propadanje želučanih žlijezda - kronični atrofični gastritis. U ovoj formi gastritisa dominira upalni infiltrat kojeg dominantno čine limfociti i plazma stanice. Završna faza kroničnoga gastritisa je atrofija želuca kod koje nalazimo stanjenu sluznicu želuca, gubitak žljezdanih struktura te redukciju upalnoga infiltrata. Endoskopski gledano, sluznica je izraženo stanjena te se ispod nje prosijavaju krvne žile. Kao odgovor na kronični upalni podražaj, javlja se i intestinalna metaplazija koja predstavlja zamjenu želučanoga epitela s epitelom koji sadržava stanice nalik na stanice sluznice crijeva (sadržavaju vrčaste stanice). Intestinalna metaplazija označava premalignu leziju i povezana je s razvojem adenokarcinoma želuca.
Klinička slika. Kliničke manifestacije kroničnoga gastritisa su slabe i većina oboljelih nema simptome. Kod manjega broja oboljelih mogu se javiti jače ili slabije izražene dispeptičke tegobe i osjećaj nelagode nakon većih obroka. U slučaju razvijene perniciozne anemije bolesnici mogu biti blijedi, slabi i umorni. Kod bolesnika s kroničnim gastritisom tipa A mogu se naći simptomi i znaci drugih autoimunih oboljenja.
Dijagnoza kroničnoga gastritisa postavlja se isključivo na temelju endoskopskoga pregleda te patohistološke analize uzetih bioptičkih uzoraka. U svrhu diferenciranja oblika kroničnoga gastritisa preporuča se provesti neinvazivno ili invazivno testiranje na infekciju H. pylori te laboratorijsku dijagnostiku usmjerenu na otkrivanje perniciozne anemije i mogućih autoantitijela.
Laboratorijski nalazi. Kod autoimunoga gastritisa u laboratorijskim nalazima obično nalazimo megaloblastičnu anemiju (MCV > 1oo f/L). Također, u serumu se nađe snižena razina vitamina B 12, dok su folati uredni. Kod većine bolesnika mogu se naći pozitivna antiparijetalna antitijela.
Neinvazivna dijagnostika H. pylori infekcije obuhvaća tri metode: serološka dijagnostika, ureja izdisajni test i određivanje antigena u stolici. Serološka dijagnostika H. pylori infekcije (određivanje specifičnih IgM i IgG protutijela) danas se ne preporuča u rutinskoj dijagnostici s obzirom na manju osjetljivost i specifičnost u odnosu na druge neinvazivne metode. Ureja izdisajnim testom određuje se ukupna aktivnost enzima ureaze koju stvara živa bakterija. Princip testa zasniva se na primjeni obroka koji sadržava ureju u kojoj je atom ugljika 12C zamijenjen izotopima 13C ili 14C koji se mogu detektirati u izdahnutome zraku. Obilježenu ureju koja se unese u želudac enzim ureaza razgrađuje na bikarbonat i amonijev ion. Razgradnjom bikarbonata oslobađa se 13/14CO2 koji se može detektirati u izdahnutom zraku. Nakon pola sata ponovi se isti postupak, samo se ne primjenjuje obilježena ureja te se potom kvantitativno mjeri omjer 12C i 13/14C iz CO2 u prvom i drugom uzorku izdahnutoga zraka. Rezultat ove pretrage označava se kao pozitivan ili negativan, a pozitivan test označava prisutnost žive bakterije u sluznici želuca. Određivanje antigena H. pylori u stolici jednostavnija je i jeftinija dijagnostička metoda, a dostupna su dva testa: ELISA test i brzi imunokromatografski test (UIT). Oba se testa temelje na monoklonalnim antitijela koja se vežu za antigen H. pylori ako on postoji u uzorku stolice. Ovaj test bitan je u praćenju odgovora na eradikacijsku terapiju, s obzirom na to da bi antigen trebao nestati nakon provedenoga liječenja. Kod tumačenja rezultata ovih dijagnostičkih metoda treba imati na umu da primjena inhibitora protonske pumpe i antibiotika mogu značajno smanjiti osjetljivost ureja izdisajnoga testa, kao i određivanja antigena u stolici, stoga se preporuča prekinuti uzimanje inhibitora protonske pumpe 7 do 14 dana prije testiranja, a antibiotika 30 dana prije testiranja.
Invazivna dijagnostika H. pylori infekcije podrazumijeva dokazivanje H. pylori iz uzoraka želučane sluznice uzete tijekom endoskopije. Endoskopsko uzimanje uzoraka sluznice želuca samo zbog dokaza infekcije H. pylori danas nije opravdano, ali ako se endoskopski pregled izvodi zbog neke druge indikacije, uputno je učiniti i histološku dijagnostiku H. pylori infekcije. Ona se izvodi specifičnim bojanjem preparata (npr. bojanje po Giemsi) na temelju kojih se bojaju i prepoznaju bakterije. Ova dijagnostička metoda u dokazivanju H. pylori infekcije ima visoku osjetljivost (90 %) i specifičnost (95 %).
Liječenje. Kronični gastritis ne zahtijeva posebne mjere liječenja. Svim bolesnicima kojima se dokaže H. pylori infekcija preporuča se provesti eradikacijsku terapiju (opisano u dijelu o ulkusnoj bolesti). Bolesnici s kroničnim gastritisom tipa A (autoimuni gastritis) i pernicioznom anemijom zahtijevat će doživotnu primjenu vitamina B12 u parenteralnom obliku. Svim bolesnicima s histološkim nalazom atrofičnoga gastritisa, kojima je dokazana intestinalna metaplazija (bez displazije), potrebno je redovno provoditi endoskopske pretrage, svake tri godine.
SPECIFIČNI OBLICI GASTRITISA
Infektivni gastritisi. Ako isključimo infekciju H. pylori, ostale infekcije želuca su rijetke. Mogu se javiti nespecifične upale, ali i one u sklopu specifičnih procesa kao što su tuberkuloza ili sifilis. Flegmonozni gastritis je oblik koji je uzrokovan stafilokokima i streptokokima kod imunokoprimitiranih osoba, a karakteriziran je jakom polimorfonuklearnom infiltracijom s pojavom gnojenja (supurativni gastritis). Emfizematozni gastritis uzrokuju bakterije koje stvaraju plin, kao što su klostridiji. Klinički, javljaju se opći infektivni simptomi te simptomi od strane želuca (bol u epigastriju, mučnina, povraćanje). Teški oblici prezentiraju se akutnim abdomenom. Dijagnoza se postavlja na temelju anamneze, fizikalnoga pregleda, laboratorijskih nalaza i endoskopije. Liječi se energičnom primjenom antibiotika uz eventualnu kiruršku intervenciju. Virusne infekcije želuca su rijetke, a obično se radi o citomegalovirusnoj infekciji kod imunokompromitiranih osoba te je obično udružen s ezofagitisom.
Limfocitni gastritis rijedak je oblik kroničnoga gastritisa kojega karakterizira obilna limfocitna infiltracija površinskoga sloja sluznice želuca s pretežnom raspodjelom u području korpusa želuca. Upalni infiltrat sastavljen je od zrelih T-stanica i plazma stanica. Točan uzrok i mehanizam nastanka ove bolesti nije poznat, ali često se susreće kod bolesnika s glutenskom enteropatijom. Kod većine ovih bolesnika nađu se zadebljani nabori sluznice koji imaju brojne nodularne lezije na čijim vrhovima nalazimo centralnu depresiju ili eroziju (tzv. varioliformini gastritis). Bolest je obično asimptomatska ili se prezentira nespecifičnim dispeptičkim tegobama. Dijagnoza se postavlja na osnovi endoskopskoga nalaza i patohistološke analize uzoraka promijenjene sluznice. Liječenje se provodi glukokortikoidima ili natrijevim kromoglikatom.
Eozinofilni gastritis podrazumijeva infiltraciju želučane stijenke upalnim infiltratom kojeg poglavito čine eozinofili, a može zahvatiti cijelu stijenku ili biti ograničen na neki od slojeva (mukoza, mišićni sloj, seroza). Bolest se može javiti u izoliranoj formi ili u sklopu eozinofilnoga gastroenteritisa, a kod većine bolesnika nalazi se i periferna eozinofilija. Klinička slika je nespecifična (bolovi u trbuhu, dispepsija). Rijetko upala može dovesti do izraženoga edema stijenke želuca koji može dovesti do potpune opstrukcije i prekida pasaže sadržaja kroz želudac. Dijagnoza se postavlja endoskopskim pregledom i patohistološkom analizom bioptata, a liječenje se provodi glukokortikoidima.
Korozivni gastritis nastaje kao posljedica ingestije koroziva (jake kiseline i lužine) koji dovode do izravnoga oštećenja sluznice želuca i jednjaka. Ovisno o jačini koroziva, promjene mogu uključivati edem i hiperemiju sluznice, pa sve do nekroze i perforacije stijenke želuca. Klinička slika uključuje bolove u trbuhu, mučninu i povraćanje te razvoj akutnoga abdomena i šoka. Dijagnoza se postavlja na temelju anamnestičkih podataka te endoskopskoga nalaza uz maksimalan oprez pri manipulaciji endoskopskim aparatom. Liječenje se zasniva na razrjeđenju koroziva primjenom vode, primjenom anatacida te inhibitora protonske pumpe. Ingestija koroziva ima izrazito lošu prognozu, a bolesnici koji ju prežive često razvijaju strikture koje ometaju normalnu pasažu sadržaja kroz jednjak i želudac.
GASTROPATIJE
Definicija i podjela. Gastropatija je naziv za promjene na želučanoj sluznici bez upalne komponente ili je ona jako malo izražena, a u osnovi razlikujemo dva temeljna oblika: hiperplastične i reaktivne gastropatije.
HIPERPLASTIČNE GASTROPATIJE
Hiperplastične gastropatije predstavljaju skupinu rijetkih bolesti koje su karakterizirane zadebljanjem nabora želučane sluznice uz odsutnost histoloških znakova upalnoga procesa. Najčešće hiperplastične gastropatije u kliničkoj praksi su Menetrierova bolest, hipertrofično-hipersekretorna gastropatija te Zollinger-Ellinsonov sindrom. Ova skupina bolesti ima posebni diferencijalno-dijagnostički značaj s obzirom na neke sličnosti s malignim oboljenjima želučane sluznice.
MENETRIEROVA BOLEST
Definicija. Menetrierova bolest predstavlja rijetki oblik hiperplastične gastropatije nepoznate etiologije koju karakteriziraju difuzno zadebljali nabori želučane sluznice uz odsutnost upalne ili tumorske komponente. Bolest se češće javlja kod muškaraca i to u dobi između 40. i 60. godine života.
Etiopatogeneza. Točan uzrok i mehanizam nastanaka Menetrierove bolesti nije poznat, ali se neki slučajevi povezuju s citomegalovirusnim infekcijama. Kod većine ovih bolesnika dokazana je prekomjerna aktivnost EGFR signalizacijskoga puta (engl. epidermal growth factor receptor) koja potiče proliferaciju epitelnih stanica dovodeći do nastanka foveolarne hiperplazije. Iako se Menetrierova bolest smatra prekanceroznom lezijom, rizik od progresije u karcinom nije jasno dokazan.
Patohistološki nalaz. Promjene su najizraženije u području korpusa i fundusa želuca, dok je antrum u većini slučajeva pošteđen. Želučani nabori postaju uvećani i izvijugani, nalik na vijuge velikoga mozga. Histološki nalaz uključuje izraženu foveolarnu hiperplaziju (hiperplazija mukoznih stanica) uz atrofiju parijetalnih i glavnih stanica, zbog čega se razvija hipoklorhidrija. Također, u lamini propriji može se naći umjereni upalni infiltrat sastavljen od eozinofila i plazma stanica. Rijetko se na naborima mogu naći i ulceracije koje mogu dovesti do okultnoga krvarenja.
Patofiziologija. Navedene patohistološke promjene dovode do izražene malnutricije koja je posljedica smanjenoga lučenja želučane kiseline uslijed atrofije parijetalnih i glavnih stanica te hipoalbuminemije uslijed hipersekrecije sluzi uvjetovane foveolarnom hiperplazijom.
Klinička slika. Iako se bolest uglavnom javlja sporadično, u nekim slučajevima zabilježena je i obiteljska pojavnost. Bolest karakterizira progresivan klinički tijek. Početak bolesti obilježen je nespecifičnim simptomima kao što su bol i nelagoda u epigastriju, mučnina i povraćanje, a kasnije se razvija anoreksija, gubitak na tjelesnoj težini (malnutricija) te periferni edemi kao posljedica hipoalbuminemije. U slučaju okultnoga krvarenja iz sluzničkih erozija razvija se sideropenična anemija.
Dijagnoza se postavlja na osnovi endoskopskoga nalaza i patohistološke analize uzorka zadebljane sluznice. Endoskopski se prikazuju uvećani, izvijugani nabori želučane sluznice koji nalažu duboku biopsiju kako bi se dobio što dublji uzorak za patohistološku analizu. Radiološko kontrastno snimanje (barijeva kaša) može prikazati vijugavost želučane sluznice, ali ima nizak diferencijalno-dijagnostički značaj. Dodatne dijagnostičke metode koje mogu poslužiti za diferenciranje Menterierove bolesti spram drugih bolesti su endoskopski ultrazvuk i određivanje pH želučanoga sadržaja dobivenoga endoskopskim putem (nalaz hipoklorhidrije). U laboratorijskim nalazima možemo naći sideropeničnu anemiju i hipoalbuminemiju, a preporuča se učiniti i testiranje na H. pylori i CMV infekciju.
Terapija. Dosadašnje liječenje Menetrierove bolesti antikolinergicima, inhibitorima protonske pumpe, antagonistima H2 receptora te analozima somatostatina (oktreotid) nije polučilo zadovoljavajuće kliničke ishode, pa se terapija u najvećem broju slučajeva svodila na simptomatsko liječenje (nadoknada proteina) uz redovno endoskopsko praćenje, a u najtežim oblicima izvodila se i resekcija želuca. Uvođenjem specifične terapije, odnosno specifičnih EGFR antitijela (cetuksimab) koja inhibiraju EGFR signalizacijski put uključen u razvoj ove bolesti, kod većine bolesnika postiže se gotovo potpuna histološka rezolucija i poboljšanje simptoma, stoga ona predstavljaju prvu liniju liječenja kod ovih bolesnika.
HIPERTROFIČNO-HIPERSEKRETORNA GASTROPATIJA
U hipertrofično-hipersekretornoj gastropatiji nalazimo hiperplaziju glavnih i parijetalnih stanica sluznice želuca što dovodi do hipersekrecije želučane kiseline i sklonosti nastanku želučanoga i/ili duodenalnog ulkusa. Uzrok ove bolesti nije poznat. Klinički se prezentira izraženim dispeptičkim tegobama te razvojem ulkusne bolesti. Dijagnoza se postavlja na temelju endoskopskoga nalaza i patohistološke analize dobivenih uzoraka sluznice želuca (hipertrofija glavnih i parijetalnih stanica uz očuvane mukozne stanice i odsutnost upalnoga infiltrata). Liječenje je simptomatsko (profilaktička primjena inhibitora protonske pumpe, liječenje ulkusne bolesti).
GASTROPATIJA KOD BOLESNIKA S ZOLLINGER-ELLINSONOVIM SINDROMOM
Zbog pojačane produkcije gastrina kod bolesnika sa Zolliger-Ellinsonovim sindromom razvija se hiperplazija glavnih i parijetalnih stanica (glandularni tip hiperplazije), a kao posljedica se javlja hipersekrecija želučane kiseline koja dovodi do pojave ulkusne bolesti. Zollinger-Ellinsonov sindrom i njegove posljedice opisane su zasebno.
REAKTIVNE GASTROPATIJE
Reaktivna gastropatija naziv je za histološke promjene želučane sluznice koje nalazimo u okolini različitih lezija (erozije, ulkusi, anastomoze) ili se javljaju kao odgovor na neki dugotrajni stimulans (primjena lijekova i sl.). Glavne su histološke značajke umjerena foveolarna hiperplazija uz minimalne upalne promjene ili bez njih. One ne dovode do kliničkih manifestacija i uglavnom se otkriju kao dodatni nalaz prilikom endoskopskoga pregleda zbog neke druge indikacije. Specifičnoga liječenja nema.
Fiziologija želučane sekrecije. Želučana kiselina nastaje spajanjem iona vodika i klora u želučanom lumenu, što omogućavaju parijetalne stanice zajedno sa svojim aktivnim prijenosnicima iona. Vodik-kalij protonska puma osigurava izlučivanje iona vodika u želučani lumen u zamjenu za ion kalija, dok klor-bikarbonat izmjenjivač omogućava izlučivanje iona klora u zamjenu za bikarbonat. Spajanjem vodika i klora nastaje klorovodična ili želučana kiselina. Proces nastajanja želučane kiseline nadziran je brojnim stimulacijskim i inhibitornim mehanizmima. Parijetalne stanice, osim što luče želučanu kiselinu, luče i pepsinogen, neaktivnu proteazu koja se pod utjecajem niskoga pH aktivira u pepsin i sudjeluje u razgradnji proteina te unutarnji faktor koji sudjeluje u resorpciji vitamina B12.
Stimulacijski mehanizmi lučenja želučane kiseline. Stimulaciju stvaranja želučane kiseline posreduju nervus vagus, hormon gastrin te histamin. Nervus vagus potiče lučenje želučane kiseline putem acetilkolina koji se otpušta na njegovim živčanim završecima i potom veže na muskarinske receptore na površini parijetalnih stanica. Ova je stimulacija uvjetovana aktivacijom parasimpatikusa. Gastrin je hormon kojeg luče G-stanice želučanoga antruma, a svoj učinak na lučenje želučane kiseline ostvaruje vezanjem za gastrinske receptore na parijetalnim stanicama. Poticaj za stvaranje gastrina daje pojačan tonus parasimpatikusa, distenzija želuca te obrok u kojemu se nalazi obilje proteina. Nasuprot tome, smanjeno stvaranje gastrina nalazimo kada dolazi do smanjenja pH vrijednosti u antrumu želuca (antralna acidifikacija) i pri unosu obroka bogatoga mastima. Histamin je biogeni amin kojega luče mastociti i enterokromafilne stanice, a svoj učinak ostvaruje vežući se na histaminske (H2) receptore na površini parijetalnih stanica. Lučenje histamina potaknuto je djelovanjem gastrina s obzirom na to da se gastrinski receptori nalaze na površini mastocita, kao i enterokromafinih stanica.
Inhibicijski mehanizmi lučenja želučane kiseline. Glavni inhibitorni učinak na lučenje želučane kiseline ostvaruju prostaglandini vežući se za prostaglandinske receptore te somatostatin vežući se za somatostatinske receptore na površini parijetalnih stanica.
Protekcija želučane sluznice. Želučana sluznica posjeduje razne mehanizme kojima svoj integritet štiti od djelovanja želučane kiseline i ostalih agresivnih čimbenika. Slabljenje tih fizioloških mehanizama može rezultirati gubitkom integriteta, tj. nastankom defekata sluznice, što i predstavlja jedan od osnovnih patofizioloških mehanizama u razvoju ulkusne bolesti. Najznačajniji mehanizmi protekcije želučane sluznice su: stvaranje mukoznoga sloja, lučenje bikarbonata i prostaglandina, utjecaj faktora rasta te odgovarajuća perfuzija želučane stijenke. Mukozne stanice želučane sluznice stvaraju sluz koja predstavlja mukoznu barijeru oblažući želučanu unutrašnjost poput gela i štiteći epitelne stanice od izravnoga djelovanja želučane kiseline. Površinske epitelne stanice imaju sposobnost lučenja bikarbonata u opisani mukozni sloj pri čemu smanjuju njegovu kiselost, tako da je pH sluzi uz same epitelne stanice oko 7, dok je pH u želučanom lumenu oko 2. Osim toga, epitelne stanice posjeduju i enzim COX-2 (ciklooksigenaza 2) koji iz arahidonske kiseline stvara prostaglandine koji svoj protektivan učinak ostvaruju snažnom stimulacijom lučenja sluzi i bikarbonata. Da bi se osigurali svi ti procesi, sluznica želuca mora biti dovoljno prokrvljena (perfundirana), s obzirom na to da je ona neotporna na anaerobni metabolizam jer nema odgovarajuće enzime glikolitičkoga puta. Osim ovih mehanizama, na otpornost želučane sluznice utječi i drugi čimbenici kao što su razvijeni međustanični spojevi, utjecaj epidermalnoga faktora rasta koji potiče sazrijevanje i proliferaciju epitelnih stanica i drugi.
Definicija. Ulkus (čir, vrijed, grizlica) predstavlja defekt sluznice probavne cijevi koji prolazi kroz muskularis mukoze i obično je veći od 5 mm u promjeru. Ulkusna bolest zajednički je naziv za pojavu ulkusa na sluznici želuca i/ili dvanaesnika, iako se može razviti na bilo kojemu dijelu probavne cijevi gdje postoji aktivnost želučane kiseline i pepsina (distalni jednjak, Meckelov divertikul i sl.). Ulkus dvanaesnika četiri puta je češći od ulkusa želuca.
Epidemiologija. Učestalost ulkusne bolesti posljednjih dvadesetak godina pokazuje značajno opadanje, što se pripisuje spoznajama o važnosti eradikacije bakterije H. pylori te učincima nesteroidnih protuupalnih lijekova na želučanu sluznicu. Iako se ulkusna bolest može pojaviti u bilo kojoj životnoj dobi, dodenalni ulkusi obično se javljaju u dobi između 30 i 50 godina, a želučani ulkusi između 50 i 70 godina. Ulkusna se bolest češće javlja kod muškaraca u odnosu na žene i to u omjeru 5:1 za duodenalni ulkus i 2:1 za želučani ulkus.
Etiopatogeneza. Načelno gledano, do razvoja ulkusa dolazi kada dođe do narušavanja ravnoteže između agresivnih čimbenika koji djeluju na sluznicu i protektivnih mehanizama kojima se sluznica štiti od njih (Tablica 4.9.). Defekt sluznice nastat će kada agresivni čimbenici nadvladaju zaštitne mehanizme što se može dogoditi u uvjetima prisutnosti iznimno jakoga agresivnog čimbenika ili u uvjetima smanjene i narušene želučane protekcije. Za više od 95 % slučajeva ulkusa želuca i dvanaesnika odgovorni su H. pylori infekcija i nesteroidni protuupalni lijekovi, a u svega manje od 5 % slučajeva ulkus se razvija uslijed drugih okolnosti.
|
Tablica 4.9. Etiopatogenetski čimbenici u razvoju ulkusne bolesti
|
|
Agresivni čimbenici
|
Protektivni čimbenici
|
|
H. pylori infekcija
Pušenje, alkohol
Duodenalni refluks
Hipergastrinemija
|
Ishemija (hipoperfuzija)
Krvotočni urušaj (šok)
Nesteroidni protuupalni lijekovi
|
H. pylori infekcija. Visoka učestalost infekcije H. pyori kod bolesnika s duodenalnim i želučanim ulkusom (70 - 90 %) ukazuje na izraženu povezanost i ulogu ove bakterije u nastanku ulkusne bolesti. H. pylori je gram-negativna štapićasta bakterija koja na jednome kraju ima više flagela koje ju čine pokretnom i omogućavaju snažan prodor kroz mukozni sloj do epitelnih stanica za čiju se površinu veže uz pomoć posebne adhezivne molekule (BabA). S obzirom na to da rastu i razvoju H. pylori ne odgovara kiseli medij kakav nalazimo unutar lumena želuca, položaj uz epitelne stanice gdje vlada značajno viši pH (oko 7) pogodan je za njihov rast i razvoj, a osim toga, bakterija ima sposobnost lučenja enzima ureaze koji razgrađuje ureju pri čemu nastaju bikarbonati koji djeluju kao puferi i dodatno osiguravaju alkalizaciju okolišnoga medija. Dodatni patogeni učinak osiguravaju geni cagA i vacA čiji proteinski produkti ulaze u citoplazmu epitelnih stanica te dovode do različitih učinaka (povećana propusnost membrane, poremećaj signalnih puteva, apoptoza stanice). Navedene promjene dovode do slabljenja obrambenih mehanizama želučane sluznice što je stvara osjetljivom na djelovanje agresivnih čimbenika, a kod jednoga dijela bolesnika, kod kojih infekcija ovom bakterijom zahvaća dominantno antrum želuca, nalazimo i pojačano lučenje gastrina i želučane kiseline - što dodatno pogoduje razvoju ulkusa (vidi kronični gastritis uzrokovan H. pylori). O povezanosti između infekcije ovom bakterijom i ulkusne bolesti govori i činjenica da će se recidiv ulkusa dvanaesnika razviti kod više od 85 % bolesnika kada se ne provede eradikacijska terapija, u usporedbi s 5 do 20 % bolesnika kada je provedena eradikacijska terapija. Povezanost između infekcije H. pylori i ulkusa izraženija je u patogenezi duodenalnoga ulkusa.
Nesteroidni protuupalni lijekovi (NSAID, od engl. non steroidal anti inflammatory drugs). NSAID su lijekovi korišteni u liječenju različitih upalnih oboljenja s obzirom na to da inhibiraju aktivnost ciklooksigenaze čime se smanjuje produkcija proupalnih medijatora. Razlikujemo dva oblika toga enzima: ciklooksigenaza 1 koju nalazimo u različitim stanicama (pretežno upalnim) te ciklooksigenaza 2 koja se nalazi u epitelnim stanicama želučane sluznice. Prevalencija ulkusa želuca kod bolesnika koji su na dugotrajnoj terapiji NSAID-om iznosi 10 do 20 %, dok je prevalencija duodenalnoga ulkusa manja i iznosi 2 do 5 %. Rizik od nastanka ulkusa najveći je unutar prva tri mjeseca od uključivanja ovih lijekova u terapiju, a veći je i kod bolesnika starijih od 60 godina, bolesnika koji imaju pozitivnu anamnezu na ulkusnu bolesti ili dispeptičke tegobe, te kada zajedno s NSAID-om uzimaju i antikoagulantne lijekove ili kortikosteroide. Patogenetski mehanizam koji razjašnjava ovu povezanost uključuje inhibiciju enzima ciklooksigenaze 2 čime se onemogućava nastanak prostaglandina iz arahidonske kiseline u epitelnim stanicama, zbog čega se smanjuje stvaranje sluzi i bikarbonata te se značajno narušava otpornost želučane sluznice na djelovanje agresivnih čimbenika. Primjena selektivnih NSAID-a koji selektivno inhibiraju ciklooksigenazu 1 (koksibi) pokazala se opravdanom u pogledu smanjenja učestalosti ulkusne bolesti (s obzirom na to da nemaju učinak na želučanu ciklooksigenazu 2), ali su određeni lijekovi iz te skupine, kao što su rofekoksib i valdekoksib, povezivani s povećanim rizikom od pojave neželjenih kardiovaskularnih ishoda zbog čega su povučeni s tržišta. Danas nam od koksiba na raspolaganju ostaje celekoksib za koji meta-analize nisu pokazale povezanost sa spomenutim neželjenim ishodom, ali svejedno nije ušao u široku uporabu i primjenjuje se uz stroge indikacije. Povezanost između primjene NSAID-a i ulkusa izraženija je u patogenezi želučanoga ulkusa.
Ostali uzroci ulkusne bolesti. Pojavu ulkusne bolesti možemo naći i kod drugih bolesti i stanja koja mogu rezultirati poremećajem ravnoteže između agresivnih čimbenika i obrambenih mehanizama želučane sluznice, a danas se za takve ulkusne bolesti sve češće koristi termin Non-HP Non-NSAID ulkusna bolest (Tablica 4.10.).
|
Tablica 4.10. Najčešći uzroci Non HP Non NSAID ulkusne bolesti
|
|
Infekcije
|
Lijekovi i toksini
|
Ostalo
|
|
Citomegalovirus
Herpes simplex virus
Varicella zoster virus
Epstein-Barr virus
Helicobacter heilmannii
|
Bisfosfonati
Glukokortikoidi
Mikofenolat mofetil
Klopidogrel
Kalijev klorid
|
Alkoholizam, pušenje
Ishemija (stres ulkus)
Hipergastrinemija (Zollinger-Ellison)
Sistemske upalne i maligne bolesti
Kronične nezarazne bolesti
|
Patologija. U više od 98 % slučajeva ulkusi su smješteni u području bulbusa dvanaesnika ili na maloj krivini želučanoga antruma. Obično se radi o solitarnim lezijama, a kod otprilike 15 % bolesnika mogu se naći i višestruke ulceracije. Ulkusi su najčešće manji od 2 cm u promjeru, okrugle i ovalne konture, te čvrsta dna prekrivenoga sivo-ružičastim naslagama ili crne boje uslijed krvarenja i stvaranja ugruška. Želučani nabori zrakasto se šire oko samoga ulkusa. Histološki se razlikuju dvije zone: zona nekroze i fibroze te zona nespecifične upalne infiltracije koju prvenstveno čine polimorfonukleari. Glavni nalaz koji razgraničava eroziju od ulkusa je proboj defekta kroz muskularis mukoze.
Klinička slika. Osnovno kliničko obilježje ulkusne bolesti je bol i on se javlja u 80 do 90 % bolesnika. Nespecifičan je i teško ga je razlikovati od bolova u epigastriju uzrokovanih nekom drugom patologijom želuca. Bol može imati različite karaktere, od osjećaja pritiska i nelagode u epigastriju do osjećaja žarenja i probadanja. Bolesnici mogu navoditi smanjenje intenziteta bolova nakon obroka ili uzimanja antacida, ali se on ponovno vraća kroz nekoliko sati. Dvije trećine bolesnika s duodenalnim ulkusom i jedna trećina bolesnika s želučanim ulkusom imaju noćne epigastrične bolove koji ih bude tijekom sna. Također, karakteristična je za ove bolesnike smjena perioda obilježenih bolovima i perioda bez bolova, pri čemu su bolovi prisutni kroz nekoliko tjedana nakon čega slijedi period od nekoliko mjeseci do godinu dana bez bolova. Mučnina i povraćanje mogu biti prisutni, ali nisu karakteristični za ulkusnu bolest. Kod oko 15 do 20 % bolesnika ulkusna bolest prolazi bez simptoma, a to je posebno karakteristično za starije bolesnike koji razviju ulkus uslijed primjene NSAID-a, s obzirom na to da navedeni lijekovi imaju analgetski učinak.
Dijagnoza se postavlja na osnovi anamnestičkih podataka i endoskopskoga nalaza kao metode izbora kod kliničke sumnje na ulkusnu bolest. Osim postavljanja same dijagnoze ulkusa, potrebno je provesti i dijagnostičke metode s ciljem otkrivanja uzroka ulkusne bolesti.
Anatomska dijagnoza. Dijagnostička metoda izbora pri sumnji na ulkusnu bolest je endoskopski pregled jednjaka, želuca i dvanaesnika (ezofagogastroduodenoskopija). Endoskopski pregled omogućava vizualizaciju defekta sluznice i određivanje njihove točne lokalizacije. S obzirom na to da su duodenalni ulkusi gotovo redovno benigni, biopsija nije standardno indicirana (samo pri sumnji na malignitet), dok svaki ulkus želuca zahtijeva biopsiju jer se u 3 do 5 % slučajeva radi o malignoj leziji. Ako se dokaže ulkusna bolest, kontrolnu endoskopiju potrebno je obaviti 12 tjedana nakon početka liječenja, a ako ulkus nije zacijelio, treba ga shvatiti kao maligni proces sve do njegovoga konačnoga rješavanja. Radiološka kontrastna dijagnostika (barijeva kaša) danas se iznimno provodi s obzirom na sve prednosti i široku dostupnost endoskopskih metoda.
Etiološka dijagnoza. Kako su dva najčešća uzroka ulkusne bolesti infekcija H. pylori i uzimanje NSAID-a, kod svih bolesnika treba provesti testiranje na H. pylori infekciju te anamnestičkim podacima dobiti uvid u povijest uzimanja navedenih lijekova (koliko dugo, u kojoj dozi). Testovi na H. pylori mogu biti neinvazivni i invazivni (vidi kronični gastritis), no kako se kod ovih bolesnika endoskopija provodi redovito - preporuča se učiniti histološki pregled bioptata na H. pylori kod svih bolesnika. Anamnestičkim podacima obuhvaćaju se i podaci o drugim potencijalno štetnim čimbenicima koji mogu dovesti do ulkusne bolesti (alkoholizam, pušenje, lijekovi), a kod sumnje na gastrinom (Zollinger-Ellinsonov sindrom) potrebno je odrediti i bazalne vrijednosti gastrina u serumu.
Diferencijalna dijagnoza obuhvaća širok spektar bolesti kao što su hijatalna hernija, funkcionalna dispepsija (simptomi ulkusne bolesti koji se ne mogu prikazati ni endoskopijom niti radiološki), gastritis, bolesti bilijarnoga trakta i gušterače te maligna obljenja.
Liječenje. Glavni su ciljevi liječenja ulkusne bolesti simptomatsko olakšanje, cijeljenje defekta sluznice te prevencija recidiva i komplikacija. Liječenje je prvenstveno farmakološko, dok se kirurško liječenje iznimno rijetko primjenjuje, i to uglavnom kod razvoja komplikacija. Osnovu farmakološkoga liječenja ulkusne bolesti čini primjena inhibitora protonske pumpe te eradikacijska terapija H. pylori infekcije. Ostali lijekovi koji se mogu primjenjivati su blokatori histaminskih (H2) receptora, antacidi te citoprotektivi. U ovome će dijelu biti opisane osnovne karakteristike ovih lijekova, dok će u nastavku biti opisan terapijski pristup zasnovan na uzroku ulkusne bolesti.
Inhibitori protonske pumpe (IPP) danas predstavljaju glavne i osnovne antisekretorne lijekove koji se koriste u liječenju ulkusne bolesti. Svoj antisekretorni učinak ostvaruju ireverzibilnim vezanjem za vodik-kalij ATP-azu (protonsku pumpu) uslijed čega izostaje sekrecija vodika, neophodnoga za nastanak želučane kiseline, u lumen želuca. S obzirom na to da se radi o ireverzibilnoj inaktivaciji protonske pumpe, ponovna obnova lučenja želučane kiseline zahtijeva sintezu novih protonskih pumpi - za što je potrebno oko 18 do 24 sata. Zbog tih karakteristika ovi se lijekovi, iako imaju poluvijek života u plazmi od samo 60 minuta, mogu koristiti u jednoj dnevnoj dozi (odnosno u dvostrukoj dnevnoj dozi ako se radi o težim oblicima), a da im se učinak vidi kroz 18 do 24 sata. Primjena inhibitora protonske pumpe rezultira cijeljenjem ulkusa dvanaesnika u više od 90 % slučajeva tijekom četiri tjedna primjene i preko 90 % ulkusa želuca tijekom osam tjedana primjene u jednoj dnevnoj (standardnoj dozi). Preporučene doze inhibitora protonske pumpe u liječenju ulkusne bolesti su: omeprazol 20 - 40 mg, esomeprazol 40 mg, rabeprazol 20 mg, lansoprazol 30 mg, dekslansoprazol 30 - 60 mg te pantoprazol 40 mg. Lijek se preporuča uzeti ujutro, sat vremena prije obroka. Ovi su lijekovi izuzetno sigurni pri kratkoročnom uzimanju, a najčešće su nuspojave glavobolja i alergijski osipi. Dugotrajna primjena povezana je s malapsorpcijom vitamina B skupine, željeza, magnezija i kalcija, s povećanim rizikom od nastanka gastrointestinalnih infekcija (osobito klostridijskih) te pneumonija, s pogoršanjem bubrežne funkcije (intersticijski nefritis), nastankom prijeloma kuka (malapsorpcija kalcija) te razvojem demencije, što nije jasno dokazano.
Eradikacija H. pylori uz inhibitore protonske pumpe čini osnovu liječenja ulkusne bolesti. Postoji više eradikacijskih shema koje se koriste, a uključuju primjenu dva ili tri antibiotika zajedno s inhibitorom protonske pumpe ili preparatima bizmuta kroz 10 do 14 dana. Vrsta eradikacijske sheme ponajprije ovisi o epidemiološkim prilikama, s obzirom na razvoj rezistencije H. pylori na primjenjivane antibiotike. Osnovna trojna eradikacijska terapija koju čine inhibitor protonske pumpe, klaritromicin te amoksicilin (ili metrondiazol kod preosjetljivosti na penicilin), danas se napušta zbog razvoja rezistencije na klaritromicin te se ona primjenjuje samo na područjima s niskom rezistencijom na klaritromicin (manje od 15 %). Danas se većinom preporuča četverostruka terapija temeljena na bizmutu ili bez njega kroz 14 dana. Najčešći terapijski režimi prikazani su u Tablici 4.11.
|
Tablica 4.11. Eradikacijska terapija H. pylori infekcije
|
|
Standardna trojna terapija temeljena na IPP-u
|
v IPP u dvostrukoj dnevnoj dozi
v Klaritromicin 2 x 500 mg/dan
v Amoksicilin 2 x 1 g/dan (ili metrondidazol 2 x 500 mg/dan kod preosjetljivosti na penicilin).
|
|
Četverostruka terapija temeljena na bizmutu
|
v IPP u dvostrukoj dnevnoj dozi
v Bizmut subsalicilat 262 mg 4 x 2 tbl ili bismut subcitrat 120-400 mg 1 x 4 tbl/dan
v Tetraciklin 4 x 500 mg/dan
v Metrondidazol 3 x 500 mg tbl/dan
|
|
Četverostruka terapija temeljena na IPP-u bez bizmuta
|
v IPP u dovstrukoj dnevnoj dozi
v Amoksicilin 2 x 1 g/dan
v Metronidazol 2 x 500 mg/dan
v Klaritromicin 2 x 500 mg/dan
|
Blokatori histaminskih (H2) receptora pokazuju značajno slabiji antisekretorni učinak u odnosu na inhibitore protonske pumpe. Svoj učinak ostvaruju vezanjem na H2 receptore na površini parijetalnih stanica čime smanjuju stimulacijski učinak histamina na lučenje želučane kiseline. Ti se lijekovi mogu koristiti u liječenju nekompliciranih oblika ulkusne bolesti i to u sljedećim dnevnim dozama: ranitidin i nizatidin 300 mg, famotidin 40 mg te cimetidin 800 mg. Uzimaju se kao jedna dnevna doza, i to navečer pred spavanje. S tom se indikacijom postiže cijeljenje duodenalnoga i želučanog ulkusa kod 80 do 90 % bolesnika kroz šest do osam tjedana liječenja. Cimetidin je najstariji lijek iz ove skupine i ima izražen antandrogeni učinak, dok noviji lijekovi nemaju. Kod maloga broja bolesnika može se razviti pancitopenija.
Ostali lijekovi. Antacidi su pripravci koji olakšavaju simptome dovodeći do kemijske reakcije neutralizacije, ali nemaju antisekretorni učinak. Ako ih bolesnici uzimaju nekritično i na svoju ruku, mogu maskirati simptome ulkusne bolesti. U praksi se primjenjuju aluminijev i magnezijev hidroksid. Citoprotektivni lijekovi su pripravci koji fizički oblažu sluznicu želuca i pojačavaju njezinu otpornost. S tom se svrhom najčešće primjenjuju sukralfat i preparati bizmuta.
Kirurško liječenje danas je napuštena metoda liječenja ulkusne bolesti, osim u slučaju razvoja komplikacija. Indikacije za kirurško liječenje ulkusne bolesti mogu biti hitne (perforacija, hemoragija) i elektivne (opstrukcija, perzistencija ulkusa unatoč optimalnoj terapiji lijekovima). Kirurške metode liječenja uključuju resekcije želuca (Bilroth I, Bilorth II) te vagotomiju.
Terapijski pristup bolesniku s ulkusnom bolesti uslijed H. pylori infekcije. Osnovu liječenja takvih bolesnika čini eradikacija H. pylori primjenom inhibitora protonske pumpe uz dva ili više antibiotika (opisano dolje u tekstu) kroz 14 dana. Bolesnici koji su imali ulkus manji od 1 cm u promjeru i kojima su simptomi u potpunosti nestali nakon eradikacijske terapije ne zahtijevaju daljnju primjenu inhibitora protonske pumpe. Bolesnici koji su imali ulkus veći od 1 cm u promjeru i bolesnici kojima se simptomi nisu u potpunosti povukli zahtijevaju dodatnu primjenu inhibitora protonske pumpe u standardnoj dozi kroz još dva do četiri tjedna ako se radi o duodenalnom ulkusu, odnosno četiri do šest tjedana ako se radi o želučanom ulkusu. Provjera uspješnosti eradikacijske terapije provodi se četiri tjedna nakon provedene eradikacijske terapije ili dva tjedna nakon prekida uzimanja inhibitora protonske pumpe nekim od neinvazivnih testova ili kontrolnim endoskopskim pregledom. Uspješna eradikacijska terapija smanjuje mogućnost recidiva ulkusa na manje od 20 % tijekom jedne do dvije godine (u odnosu na 80 do 90 % ako se ne provede). Ako je postignuta potpuna eradikacija H. pylori, stopa reinfekcije je niska i iznosi 0,5 % po godini. Dugotrajna primjena inhibitora protonske pumpe s ciljem prevencije recidiva ulkusne bolesti opravdana je isključivo kod bolesnika kod kojih se ne može postići zadovoljavajuća eradikacija H. pylori.
Terapijski pristup bolesniku s ulkusnom bolesti uslijed primjene NSAID-a. Osnovna preporuka za liječenje ovih bolesnika obustava je primjene NSAID-a uz primjenu inhibitora protonske pumpe ili blokatora histaminskih (H2) receptora. Lijek izbora predstavljaju inhibitori protonske pumpe u standardnoj dnevnoj dozi koje bi trebalo primjenjivati kroz četiri tjedna kada se radi o duodenalnom ulkusu, odnosno osam tjedana ako se radi o želučanom ulkusu. Blokatori histaminskih (H2) receptora mogu se koristiti kao alternativa u slučaju manjih i nekompliciranih ulkusa kroz šest tjedana ako se radi o duodenalnom ulkusu, odnosno osam tjedana ako se radi o želučanom ulkusu. Preporučene doze u liječenju duodenalnoga ulkusa su cimetidin 1 x 800 mg, ranitidin ili nizatidin 1 x 300 mg te famotidin 1 x 40 mg, a u liječenju želučanoga ulkusa primjenjuju se polovične doze (cimetidin 1 x 400 mg, ranitidin ili nizatidin 1 x 150 mg te famotidin 1 x 20 mg). Svi se bolesnicima moraju testirati na infekciju H. pylori, te je ako se ona i dokaže potrebno provesti prethodno opisanu eradikacijsku terapiju. U nastavku liječenja potrebno je odvagnuti kliničku opravdanost ponovnoga uvođenja NSAID-a u terapiju, osobito kod bolesnika s višestrukim rizičnim čimbenicima (dob iznad 60 godina, ranija anamneza ulkusne bolesti, istodobna primjena antitrombocitne, antikoagulantne i kortikosteroidne terapije) razmotriti uvođenje neselektivnih NSAID-a (koksibi). Terapija NSAID-om trebala bi se provoditi u što kraćem vremenu u što manjoj dozi.
Prevencija ulkusne bolesti i njezinih komplikacija usmjerena je na otkrivanje H. pylori infekcije te prevenciju ulkusa kod bolesnika koji uzimaju NSAID-e ili antitrombocitne i/ili antikogualntne lijekove.
Otkrivanje H. pylori infekcije. Zbog izražene etiopatogenetske povezanosti infekcije H. pylori s nastankom ulkusne bolesti, prevencija je u prvom redu usmjerena na njezino otkrivanje, zbog čega se preporuča provesti invazivno ili neinvazivno testiranje svih bolesnika s opetovanim gastričnim smetanja (dispepsija) te u slučaju pozitivnih nalaza provesti eradikacijsku terapiju kako je opisano.
Nesteroidni protuupalni lijekovi. Svim bolesnicima kojima se uvode NSAID-i u terapiju, a pripadaju rizičnoj skupini za razvoj ulkusne bolesti preporuča se istodobna primjena inhibitora protonske pumpe s ciljem gastroprotekcije i sprečavanja razvoja ulkusne bolesti (rabeprazol 20 mg, omeprazol 20 - 40 mg, lanzoprazol 30 mg, dekslanzoprazol 30 - 60 mg, pantoprazol ili omeprazol 40 mg).
Antitrombocitna i antikoagulantna terapija. U prevenciji ulkusne bolesti posebnu skupinu čine bolesnici koji uzimaju antiagregacijsku i/ili antikoagulantnu terapiju s obzirom na povećani rizik od nastanka krvarenja iz erozija ili ulceracija. Rizik od pojave klinički značajnoga krvarenja uz primjenu acetilsalicilne kiseline u niskim dozama iznosi oko 0,5 % po godini, dok dvojna antiagregacijska terapija ili istodobna primjena i antikoagulanasa značajno povećava taj rizik. Ako se primjenjuje navedena terapija, a bolesnici pripadaju rizičnoj skupini, potrebna je gastroprotekcija inhibitorima protonske pumpe. Treba istaknuti da klopidogrel ne izaziva gastrične ulceracije ili erozije, ali njegova aktivnost može pridonijeti razvoju krvarenja kod bolesnika koji zajedno s njime uzimaju acetilsalicilnu kiselinu ili imaju infekciju H. pylori. Stoga, samostalna primjena klopidogrela kod bolesnika koji su H. pylori negativni može biti sigurna alternativa primjeni acetilsalicilne kiseline u profilaktičkoj dozi (ako to indikacije dozvoljavaju). Treba imati na umu i da istodobna kombinacija nekih inhibitora protonske pumpe (u najvećoj mjeri omeprazol i esomeprazol) može dovesti do slabljenja antitrombocitnoga učinka klopidogrela, s obzirom na to da inhibitori protonske pumpe inhibiraju enzim CYP2C19 potreban za aktivaciju klopidrogela. Zbog toga je FDA izdala preporuke o potrebi izbjegavanja kombinacije klopidogrela i omeparzola/esomeprazola, a kao alternative predlažu se ili zamjena klopidogrela nekim drugim antitrombocitnim lijekom (npr. tikagrelor) ili primjena drugoga inhibitora protonske pumpe (pantoprazol 1 x 40 mg, rabeorazol 1 x 20 mg) ili primjena blokatora histaminskih (H2) receptora (famotidin 2 x 20 mg, ranitidin 2 x 150 mg, nizatidin 2 x 15 mg; cimetidin se ne preporučuje jer inhibira učinak navedenoga enzima).
Refraktorna ulkusna bolest. Uz današnje lijekove i terapijske protokole kod manje od 5 % bolesnika izostaje cijeljenje ulkusa i povlačenje simptoma nakon 6 do 8 tjedana provođenja terapije. Najčešći uzrok toga neuspjeha leži u lošoj suradljivosti bolesnika (engl. noncompliance) u pogledu uzimanja lijekova i pridržavanja uputa. Ostali uzroci mogu podrazumijevati hipersekreciju želučane kiseline (Zollinger-Ellisonov sindrom), neprepoznato maligno oboljenje (adenokarcinom, limfom), primjenu drugih lijekova koji pogoduju razvoju ulkusa (bisfosfonati), neuobičajenu manifestaciju Crohnove bolesti ili nesvakidašnje infekcije. U svim se slučajevima preporuča kontrolna endoskopija s ponovnim uzorkovanjem tkiva te određivanje vrijednosti gastrina. Kod upornih ulkusa koji ne cijele medikamentoznom terapijom indicirano je operativno liječenje.
KOMPLIKACIJE PEPTIČNE ULKUSNE BOLESTI
Klasične komplikacije ulkusne bolesti uključuju gastrointestinalno krvarenje, perforaciju ulkusa, penetraciju ulkusa, opstrukciju izlaznoga dijela želuca te malignu alteraciju.
KRVAREĆI ULKUS
Definicija i etiologija. Krvarenje je najčešća komplikacija ulkusne bolesti, prisutna je kod jednoga od šest bolesnika s ulkusnom bolesti. Češće se razvija uslijed ulkusa uzrokovanih učinkom nesteroidnih protuupalnih lijekova nego ulkusa povezanih s infekcijom H. pylori. Krvarenje nastaje uslijed erozivnoga učinka želučane kiseline i pepsina na stijenke krvnih žila, a opseg krvarenja ovisi o vrsti, zahvaćenosti i veličini krvne žile (arterijsko, vensko ili kapilarno krvarenje), tako da ona mogu biti oskudna i intermitentna dovodeći do razvoja sideropenične anemije, ali mogu biti i jaka i profuzna, praćena razvojem hemoragijskoga šoka. U više od 80 % slučajeva krvarenja iz želučanoga ili duodenalnog ulkusa spontano prestaju.
Klinička slika ponajprije ovisi o intenzitetu krvarenja. Polagana krvarenja mogu biti potpuno asimptomatska ili mogu biti praćena neodređenom nelagodom i bolom u epigastriju uz kliničke znakove krvarenja iz gornjega dijela probavnoga sustava kao što su melena (stolica crna poput katrana) ili hematemeza (povraćani sadržaj nalik je talogu crne kave) te uz izražene simptome anemije kao što su bljedoća, umor i sl. Jače izražena krvarenja imaju akutniju prezentaciju, bolesnici povraćaju svježu ili koaguliranu krv, a kod profuznih krvarenja češće se susreće hematohezija (pojava svježe krvi s ugrušcima iz anusa) od melene (obilna hematohezija uvijek mora najprije probuditi sumnju na krvarenje iz gornjega probavnog sustava, prije nego iz donjega). Bolesnici mogu imati bolove u trbuhu te pokazivati znakove hemoragijskoga šoka (hipotenzija, tahikardija, poremećaj svijesti, bljedoća).
Dijagnoza se postavlja na temelju anamnestičkih podataka i kliničkoga pregleda, laboratorijskih nalaza te hitne endoskopske obrade. Anamnezom se moraju obuhvatiti podaci o ranijim gastričnim smetnjama, ostalim bolestima te lijekovima koje je bolesnik uzimao. Klinički pregled usmjeren je na uočavanje znakova hemoragijskoga šoka (bljedoća, preznojenost, tahikardija, hipotenzija) te je obvezan digitorektalni pregled (melena, hematohezija). Ako se bolesnik javi unutar nekoliko sati od pojave krvarenja, digitorektalni pregled može biti uredan. U laboratorijskim nalazima prati se pad u crvenoj krvnoj slici (pad broja eritrocita, hemoglobina i hematokrita), a obvezno je učiniti i koagulogram kako bi se uočila eventualna koagulopatija. Hematokrit u početku krvarenja može biti uredan ili čak povišen zbog hemokoncentracije, no s vremenom, uslijed povlačenja tekućine iz intersticija i prijema infuzijskih otopina, dolazi do hemodilucije i pada njegovih vrijednosti. Kod bolesnika s kroničnim intermitentnim krvarenjem iz ulkusa nalazimo sideropeničnu anemiju. Također, kod ovih bolesnika nalazimo i karakteristično povišene vrijednosti ureje (uz uredan kreatinin) kao posljedicu asporpcije dušika iz krvi u tankom crijevu. Endoskopski pregled predstavlja metodu izbora za dokazivanje krvarenja iz ulkusa želuca ili dvanaesnika, a trebalo bi ga izvesti unutar 24 sata od nastupa krvarenja, odnosno odmah ako se radi o neposrednoj životnoj ugroženosti uslijed krvarenja. Postavljanje nazogastrične sonde i lavaža želuca s ciljem dobivanja krvavoga sadržaja kao potvrde krvarenja u želucu ili dvanaesniku danas se rijetko izvodi, a nalaz ne mora biti uvijek pozitivan, osobito kada se radi o krvarenju u dvanaesniku. Također, postavljanje sonde izričito je zabranjeno kada postoji sumnja da bolesnik ima varikozitet jednjaka i krvari iz njega.
Liječenje bolesnika s krvarećim ulkusom odvija se kroz tri faze: inicijalna (stabilizacijska) terapija, interventno liječenje te prevencija ponovnoga krvarenja. Najteži oblici liječe se kirurškim putem. Većina bolesnika zahtijeva hospitalizaciju te bolničko liječenje i praćenje. Unatoč svim mjerama liječenja, smrtnost od akutnoga krvarenja iz ulkusa iznosi i do 7 %.
Inicijalna stabilizacija. Ova faza liječenja započinje nakon prvoga kontakta bolesnika i provodi se prije i tijekom endoskopske obrade. Cilj je postići hemodinamsku stabilizaciju i kondicionirati bolesnika za interventno liječenje. Kod bolesnika s kliničkom sumnjom potrebno je obustaviti uzimanje bilo kakve hrane, tekućine i lijekova na usta, potrebno je osigurati venski pristup (obično dvije do tri šire intravenske kanile), uzorkovati krv za standardne krvne pretrage (hematologija, biokemija, koagulacije) i za interreakciju te odmah započeti volumnu resuscitaciju. Kod bolesnika u boljem kliničkom stanju dovoljna je primjena kristaloidnih otopina, ali za bolesnike s izraženom hipotenzijom inicijalno je opravdana i promjena koloidnih otopina (hidroksietil-škrob). Potrebno je što prije započeti transfuzijsko liječenje (opći principi transfuzijskoga liječenja opisani su u poglavlju hematologije). Bolesniku se mora što prije dati i inicijalni intravenski bolus pantoprazola ili omeprazola u dozi od 80 mg te nastaviti kontinuiranu intravensku primjenu u dozi od 8 mg/h (standardno se priprema 200 mg pantoprazola/omeprazola u 500 ml fiziološke otopine na 24 sata). U slučaju bolova primjenjuju se analgetici, a u slučaju hipoksemije oksigenoterapija. Preporuča se praćenje vitalnih znakova uz postavljanje urinarnoga katetera zbog mjerenja satne diureze. U slučajevima životne ugroženosti i refrakterne hipotenzije u terapiju se mogu uključiti vazoaktivni lijekovi kao što su noradrenalnin (vazokonstriktor) i sandostatin (vazokonstriktor) te traneksamična kiselina (antifibrinolitik). Po prispijeću nalaza, ako je potrebno, mora se provesti i korekcija koagulacijskih poremećaja (vitamin K, svježe smrznuta plazma, krioprecipitat i dr.). Više o liječenju masivne hemoragije i hemoragijskoga šoka nalazi se u poglavlju o intenzivnoj medicini. Glavni je cilj ovih postupaka postići i držati sistolički krvni tlak iznad 100 mmHg.
Endoskopska intervencija. Iako je preporučeno vrijeme izvođenja endoskopske intervencije kod ovih bolesnika unutar 24 sata, ono mora biti ponajprije bazirano na kliničkom stanju bolesnika. U fazi pripreme bolesnicima se preporuča primjena eritromicina koji ima prokinetički učinak te smanjuje sadržaj u želucu i omogućava bolji pregled želučane i dudenalne sluznice. Bolesnici s jakim arterijskim krvarenjima ne mogu se stabilizirati bez endoskopske intervencije i/ili kirurškoga zahvata i kod njih je potrebno izvesti pregled što ranije, paralelno s primjenom postupaka opisanih u inicijalnoj fazi liječenja. Endoskopski pregled omogućava vizualizaciju ulkusa, procjenu aktivnosti krvarenja, a ako je ono prestalo, procjenjivanje rizika od ponovnoga krvarenja. Za morfološke karakteristike krvarećega ulkusa koristi se Forestova klasifikacija (Tablica 4.12.). Osim toga, endoskopija omogućava i postizanje egzaktne hemostaze, tako da, osim dijagnostičke, ima i terapijske implikacije. Daljnje postupanje s bolesnikom ovisi o endoskopskom nalazu. Ulkusi manji od 2 cm u promjeru, koji ne krvare i imaju čisto dno ili je ono prekriveno slojem crnoga ili crvenoga sadržaja, imaju rizik manji od 10 % od ponovnoga krvarenja i ne zahtijevaju nikakvu endoskopsku intervenciju, nego nastavak konzervativne terapije. Ulkusi većih dimenzija koji aktivno krvare ili imaju vidljivu krvnu žilu koja trenutno ne krvari, zahtijevaju endoskopsku intervenciju. Različite su mogućnosti endoskopske hemostaze kao što su sklerozacijska terapija (danas gotovo napuštena metoda), termokoagulacija, postavljanje metalnih kopči i sl. Ako se iznad ulkusa nalazi ugrušak, on se ispire fiziološkom otopinom da bi se prikazao sam ulkus i njegove karakteristike. Njegovo uklanjanje ispiranjem ako je on izrazito adherirao za površinu (teško se ispire) ostaje kontroverzno jer se često tako potakne ponovno krvarenje, dok njegovo ostavljanje na ulkusu bez vizualizacije samoga ulkusa i zbrinjavanja onoga ispod njega ne predstavlja zadovoljavajuću hemostazu. Današnjim endoskopskim tehnikama hemostaze uspije se zaustaviti krvarenje u više od 90 % bolesnika.
Prevencija ponovnoga krvarenja. Bolesnici s ulkusima manjima od 2 cm u promjeru i čistim dnom imaju rizik manji od 5 % da ponovno prokrvare, dok bolesnici koji imaju ulkuse manje od 2 cm u promjeru i dno prekrivenom tamno crvenim ili crnim slojem imaju rizik manji od 10 % od ponovnoga krvarenja. Ako se radi o mlađim bolesnicima (mlađi od 60 godina) bez značajnijih komorbiditeta, s opisanim ih se endoskopskim nalazom može promatrati kroz 24 do 72 sata uz započinjanje preoralnoga uzimanja hrane i klasične terapije ulkusne bolesti, nakon čega ih se može otpustiti na kućno liječenje. Bolesnike koji su bili podvrgnuti endoskopskoj hemostatskoj intervenciji treba zadržati u bolnici najmanje 72 sata jer je nakon toga vremena rizik od ponovnoga krvarenja manji od 3 %. Kontinuirana infuzija pantoprazola ili omeprazola u dozi od 8 mg/h primjenjuje se kroz 72 sata, a nakon toga se može prijeći na peroralnu terapiju. Trećega dana trebalo bi nastaviti terapijski režim, kao i kod nekomplicirane ulkusne bolesti (ranije opisano).
Kirurško liječenje danas se rijetko izvodi i rezervirano je za bolesnike kod kojih se ne može postići zadovoljavajuća endoskopska hemostaza uz klasične mjere konzervativnoga liječenja.
Krvareći ulkus i antitrombocitna i antikoagulantna terapija. Pri liječenju takvih bolesnika preporuča se isključiti svu antikoagulantnu i antitrombocitnu terapiju (osobito prva tri dana). Ovisno o kardiovaskularnome riziku treba ih ponovno vratiti na terapiju što je prije moguće uz odgovarajuću gastroprotekciju (inhibitor protonske pumpe u dozi ekvivalentnoj esomeprazolu 20 mg dva puta na dan), osobito ako kardiovaskularni rizik premašuje rizik od ponovnoga krvarenja. Također, studije su pokazale manji rizik od ponovnoga krvarenja kod bolesnika kojima je uvedena antritrombocitna terapija acetilsalicilnom kiselinom (aspirin) u niskim dozama uz navedenu gastroprotekciju u odnosu na primjenu samoga klopidogrela.
|
Tablica 4.12. Forrestova klasifikacija krvarećih ulkusa
|
|
Lezija sa znacima aktivnoga krvarenja
|
|
Ia
|
Arterijsko krvarenje u mlazu
|
|
Ib
|
Krvarenje u obliku slijevanja ili kapanja
|
|
Lezija sa znacima nedavnoga krvarenja
|
|
IIa
|
Vidljiva ogoljena krvna žila koja ne krvari
|
|
IIb
|
Adherirani koagulum
|
|
IIc
|
Hematinom prekrivena lezija (crno dno)
|
|
Lezija bez znakova krvarenja
|
|
III
|
Čista baza ulkusa
|
Prognoza bolesti ovisi o jačini krvarenja i pridruženim koomorbiditetima. Klinički značajno krvarenje koje nosi veći rizik od fatalnoga ishoda prisutno je kod 10 % bolesnika. Ukupna smrtnost od krvarećega ulkusa iznosi oko 7 %. Nepovoljni prognostički čimbenici su životna dob iznad 60 godina, masivna transfuzija te prisutnost drugih bolesti (kronično srčano popuštanje, kronična bubrežna bolest, šećerna bolest i dr.).
PERFORACIJA ULKUSA
Perforacija ulkusa javlja se kod manje od 5 % bolesnika s ulkusnom bolesti, a najčešće nastaje kod ulkusa na prednjoj strani želuca ili dvanaesnika. Nastaje uslijed širenja defekta sluznice koji zahvaća cijelu stijenku želuca ili dvanaesnika te rezultira njezinim progrizanjem. Perforacija može biti slobodna, pri čemu sadržaj iz probavne cijevi dospijeva u slobodnu trbušnu šupljinu te dovodi najprije do kemijskoga, a kasnije i bakterijskoga peritonitisa, ili može biti ograničena - kada se na mjesto perforacije nalijepi omentum i zatvori komunikacija te lokalizira bolest. Bolest se klinički prezentira razvojem akutnoga abdomena: naglo nastao bol u trbuhu, mučnina i povraćanje, nadražaj peritoneuma praćen zatezanjem mišićnoga zida (defans) uz postupni razvoj peritonitisa te hipovolemijskoga i/ili septičkog šoka. Treba imati na umu da kod starijih osoba, dijabetičara i bolesnika koji uzimaju analgetike i kortikosteroide klinička slika može biti znatno manje izražena. Dijagnoza se postavlja na temelju anamneze i kliničkoga nalaza, a potvrđuje se nativnom snimkom abdomena u stojećem položaju (srp zraka pod ošitima uslijed izlaska zraka iz želuca i nakupljanja pod ošitima). U laboratorijskim se nalazima prate povišeni upalni parametri, a uslijed nadražaja pankreasa moguća je i hiperamilazemija. Konačna dijagnoza potvrđuje se pomoću CT-a abdomena. Liječenje je kirurško, a metodu izbora predstavlja laparoskopsko prešivanje perforacije. Po stabilizaciji bolesnika potrebno je nastaviti klasično liječenje ulkusne bolesti.
OPSTRUKCIJA (STENOZA)
Opstrukcija izlaznoga dijela želuca ili dvanaesnika danas se rijetko susreće i javi se kod manje od 3 % bolesnika s ulkusnom bolesti. Opstrukcija se može javiti u fazi akutne upale uslijed izraženoga edema ili u kroničnoj fazi kada dođe do cijeljenja i stvaranja ožiljaka (cikatrizacija). Opstrukcija dovodi do otežane pasaže želučanoga sadržaja, zbog čega se razvija dilatacija želuca. Dominantni su simptomi mučnina, povraćanje, osjećaj sitosti i punoće u želucu. Postavljanjem nazogastrične sonde dobije se obilni ustajali sadržaj neugodna mirisa. Ako takvo stanje potraje, javljaju se i elektrolitni i metabolički poremećaji (metabolička alkaloza, hipokalijemija). Dijagnoza se potvrđuje endoskopski. Liječenje se sastoji od želučane dekompresije nazogastričnom sondom te ispravkom elektrolitnoga i metaboličkog disbalansa. Također, odmah po postavljanju sumnje na ovaj poremećaj, primjenjuje se intravenski bolus pantoprazola ili omeprazola u dozi od 80 mg nakon čega slijedi kontinuirana primjena 8 mg/h kroz sljedeća 72 sata, nakon čega slijedi klasično liječenje ulkusne bolesti. Ako se na kontrolnoj endoskopiji za 3 do 5 dana ne postigne poboljšanje, može se pokušati s endoskopskom dilatacijom, a kod najtežih oblika indicirana je i kirurška resekcija.
GASTRINOM (ZOLLINGER ELLISONOV SINDROM)
Definicija. Zollinger-Ellisonov sindrom naziv je za kliničko stanje koje karakterizira hipersekrecija želučane kiseline udružena s ulkusnom dijatezom uslijed hipersekrecije gastrina iz gastrinoma, jednoga od najčešćih neuroendokrinih tumora. Gastrinom je odgovoran za pojavu manje od 1 % ulkusne bolesti. Učestalost ovoga sindroma podjednaka je kod oba spola, a iako se može javiti u svakoj životnoj dobi, najčešće se javlja između 30. i 50. godine života.
Etiopatogeneza. Gastrinom je jedan od najčešćih neuroendokrinih tumora s najčešćom lokalizacijom u dvanaesniku (45 %) ili gušterači (25 %), a mogu se naći i u limfnim čvorovima gornjega abdomena te drugim, rjeđim lokalizacijama. U više od 80 % slučajeva gastrinomi se javljaju u tzv. gastrinomskom trokutu koji je omeđen portom hepatis, vratom gušterače te dvanaesnikom. Tumori se uglavnom javljaju sporadično iz nepoznatoga razloga, a u 20 % slučajeva javljaju se u sastavu MEN-1 sindroma. Tumori pokazuju različitost u svojoj brojnosti (solitarni, višestruki), veličini (od 1 mm do 20 cm) te biološkom ponašanju (benigni, maligni). Razlika između benignih i malignih oblika gastrinoma dokazuje se samo nalazom udaljenih metastaza, s obzirom na to da ne pokazuju nikakve histopatološke različitosti. Osnovna je značajka gastrinoma biološka aktivnost u pogledu stvaranja hormona gastrina koji djeluje na parijetalne želučane stanice i potiče hipersekreciju želučane kiseline. To dovodi do pojave tvrdokornih ulkusa želuca i dvanaesnika, ali i pojave malapsorpcijskoga sindroma koji je posljedica stalnoga pritoka kiseloga sadržaja iz želuca u tanko crijevo, što dovodi do oštećenja sluznice crijeva, ali i inaktivacije pankreasnih enzima i precipitacije žučnih kiselina. To rezultira poremećenom probavom masti i proteina. Rijetko gastrinomi mogu stvarati i druge hormone kao što je to adrenokortikotropni hormon ili njemu sličan peptid što može rezultirati nastankom Cushingova sindroma.
Klinička slika. Kliničke manifestacije proizlaze iz same patofiziologije bolesti. Kliničkom slikom dominiraju simptomi i znakovi ulkusne bolesti, a kod više od jedne trećine bolesnika nalazimo i dijareju, steatoreju te gubitak na tjelesnoj težini kao posljedicu nastale malapsorpcije. Jedna od glavnih kliničkih karakteristika bolesnika slab je odgovor na klasičnu antiulkusnu terapiju. Dijareja može biti prvi simptom ove bolesti kod oko 10 % bolesnika. Ako se gastrinom javlja u sklopu MEN-1 sindroma, u kliničkoj slici možemo naći i znakove hiperparatireoidizma (hiperkalcijemija, nefrolitijaza) te mikroadenoma hipofize (hiperprolaktinemija). U trenu postavljanja dijagnoze kod oko 20 % bolesnika nalazimo metastaze, najčešće u jetri.
Dijagnoza Zollinger-Ellisonova sindroma prolazi kroz tri faze: 1) postavljanje sumnje na gastrinom; 2) biokemijsko dokazivanje bolesti te 3) određivanje anatomske lokalizacije tumora.
Sumnja na Zollinger-Ellisonov sindrom osnovni je korak u procesu dijagnoze ovoga poremećaja. Na njega nam trebaju upućivati sljedeći klinički scenariji: ulkusna bolest refrakterna na standardnu antiulkusnu terapiju, ulkusi veći od 2 cm u promjeru, pojava višestrukih ulkusa, pojava ulkusa kod bolesnika koji su H. pylori negativni i koji ne uzimaju NSAID-e, učestali recidivi ulkusne bolesti, udruženost ulkusne bolesti s malapsorpcijskim simptomima te neobične lokalizacije ulkusa (ulkusi distalno od bulbusa dvanaesnika).
Biokemijska dijagnoza postavlja se na temelju određivanja bazalnih vrijednosti gastrina, kiselosti želučanoga sadržaja te prema potrebi stimulacijskim sekretinskim testom. Inicijalni korak podrazumijeva određivanje bazalnih vrijednosti gastrina (natašte) i kiselosti želučanoga sadržaja. Normalne bazalne vrijednosti gastrina manje su od 150 pg/mL, a za pouzdane vrijednosti potrebno je iz terapije izostaviti blokatore histaminskih receptora kroz 24 sata te inhibitore protonske pumpe šest dana prije uzorkovanja krvi. Bazalne vrijednosti gastrina iznad 1000 pg/mL i pH želučanoga sadržaja ispod 3 sigurni su biokemijski pokazatelji Zolliner-Ellisonova sindroma. Vrijednosti gastrina između 150 i 1000 pg/mL zahtijevaju provođenje stimulacijskoga testa sekretinom. On se sastoji od intravenske primjene sekretina u dozi od dvije jedinice po kilogramu tjelesne mase uz određivanje vrijednosti gastrina 30 minuta nakon njegove primjene. U normalnim slučajevima primjena sekretina neće dovesti do znatnoga povišenja vrijednosti gastrina, dok se kod bolesnika s gastrinomom bilježi povećanje vrijednosti gastrina u odnosu na bazalne vrijednosti bar za 200 pg/mL. Povišene vrijednosti gastrina u krvi uz pH želučanoga sadržaja iznad 3 nisu indikativne za postavljanje ove dijagnoze. Kod svih bolesnika s dokazanim Zollinger-Ellisonovim sindromom potrebno je obaviti proširenu endokrinološku obradu kako bi se isključio ili ustanovio MEN-1 sindrom (paratireoidni hormon, prolaktin, luteinizacijski hormon, folikul stimulirajući hormon, hormon rasta).
Anatomska dijagnoza. S obzirom na to da gastrinomi na svojoj površini posjeduju somatostatinske receptore, slikovna metoda izbora za sve bolesnike s biokemijski dokazanim Zollinger-Ellisonovim sindromom je scintigrafija somatostatinskih receptora pri čemu se koristi posebni radiofarmak (111indium-octreotid) koji se veže za navedene receptore i potom detektira SPECT metodom (engl. single-photon emission CT). Navedeni radiofarmak daje se intravenski nakon čega se provede skeniranje cijeloga tijela te se na taj način osim dokaza primarnoga sijela tumora mogu detektirati i metastaze. U otkrivanju točne lokalizacije tumora od pomoći može biti i endoskopski ultrazvuk (EUS).
Liječenje Zollinger-Ellisonovoga sindroma može biti medikamentozno i kirurško. Terapijski pristup ovisi o prisutnosti udaljenih metastaza. Ako se inicijalnom obradom ne dokažu udaljene metastaze, govorimo o lokaliziranoj bolesti te se liječenje provodi u prvom redu kirurški, no ako se one dokažu, govorimo o proširenoj bolesti - kada je kirurško liječenje manje vjerojatno, a liječenje počiva na primjeni kemoterapeutika.
Kirurško liječenje čini osnovu liječenja ovoga poremećaja. Uklanjanjem tumora smanjuje se gastrinomom potaknuta hipersekrecija želučane kiseline što dovodi do simptomatskoga olakšanja. Operativno liječenje moguće je samo kod jednoga dijela bolesnika (dobro lokalizirani i anatomski dostupni tumori), dok se kod bolesnika s višestrukim tumorima često ne može postići odgovarajuća kirurška ekstirpacija, a operativno se liječenje ne izvodi ni u prisustvu jetrenih metastaza koje se ne mogu resecirati (metastazektomija).
Medikamentno liječenje. Osnovu medikamentnoga liječenja čini primjena inhibitora protonske pumpe. Kod većine bolesnika može se postići zadovoljavajuća kontrola sekrecije želučane kiseline primjenom standardne ili dvostruke dnevne doze inhibitora protonske pumpe. Antisekretorna terapija provodi se sve dok se ne postigne kirurško izlječenje, a za bolesnike koji nisu kandidati za kirurško liječenje provodi se doživotna antisekretorna terapija uz suplementaciju vitaminom B12 (manjak vitamina B12 javlja se kod svih bolesnika na dugotrajnoj terapiji inhibitorima protonske pumpe).
Liječenje uznapredovale bolesti. Kirurško liječenje te skupine bolesnika malo je vjerojatno i izvodi se samo kada se zajedno s primarnim sijelom tumora mogu ukloniti i metastaze. Za bolesnike koji nisu kandidati za kirurško liječenje u obzir dolazi primjena oktreotida samoga ili u kombinaciji s interefronom-α, s obzirom na to da je dokazano da ova terapijska opcija dovodi do usporavanja rasta tumora kod 50 do 60 % bolesnika. Ako ova terapijska opcija ne poluči zadovoljavajuće rezultate ili se dokaže da tumor ubrzano raste, preporuča se liječenje klasičnim kemoterapeuticima (5-fluorouracil, dokorubicil. everolimus, sunitinib). Također, kod ovih bolesnika može se pokušati i s interventnim liječenjem metastaza (kemoembolizacija, radioembolizacija), a kod manjega broja bolesnika može se pokušati i s transplantacijom jetre kada su metastaze ograničene samo na jetru i radi se o mlađim bolesnicima.
Prognoza. Bolesnici koji imaju ograničenu bolest imaju dobru prognozu. Kod oko 25 % bolesnika bilježi se agresivni rast tumora i pojava jetrenih metastaza koje i predstavljaju loši prognostički pretkazatelj. Desetogodišnje preživljenje bolesnika s jetrenim metastazama iznosi oko 30 %.
Tumori želuca prvenstveno su maligni, a najčešći među njima je adenokarcinom želuca koji čini ukupno 90 do 95 % svih tumora želuca. Ostali maligni tumori želuca su limfomi i sarkomi (leiomiosarkom). Benigni tumori želuca rijetko se susreću u kliničkoj praksi, a najčešće se radi o leiomiomima i lipomima.
ADENOKARCINOM ŽELUCA
Definicija i epidemiologija. Adenokarcinom želuca je maligni epitelni tumor koji čini 95 % svih malignih tumora želuca. Iako njegova učestalost značajno opada posljednjih desetaka godina, i danas zauzima značajno mjesto u onkologiji. Prema podacima Hrvatskoga registra za rak iz 2015. godine, adenokarcinom želuca drži 6. mjesto po učestalosti karcinoma kod muškaraca i 9. mjesto kod žena. Učestalost pojave toga tumora pokazuje značajnu zemljopisnu uvjetovanost, a područja s najvećom incidencijom su Japan, Kina i Koreja (50 - 70/100,000). Zemljopisna uvjetovanost pojavnosti tumači se utjecajem životnoga stila i prehrambenih navika (vrlo začinjena, usoljena i dimljena hrana) s obzirom na to da osobe koje migriraju poprimaju epidemiološka obilježja područja u koje su migrirali. Učestalost adenokarcinoma značajno raste nakon 50. godine života, a češće se javlja kod muškaraca i to u omjeru 2:1 u odnosu na žene. Petogodišnje preživljenje bolesnika s tim karcinomom iznosi manje od 20 % što ga svrstava među najzloćudnije karcinome uopće.
Etiopatogeneza. S obzirom na anatomsku lokalizaciju, epidemiološke karakteristike, histološku sliku i povezanost s određenim rizičnim čimbenicima (okolišni čimbenici ili genetika), razlikujemo dva oblika adenokarcinoma želuca: intestinalni i difuzni (klasifikacija po Laurenu).
Intestinalni adenokarcinom želuca je dobro, srednje ili slabo diferenciran karcinom želuca pretežno građen od žljezdanih elemenata čije stanice pokazuju jasne znakove malignoga preobražaja (hiperkromazija i polimorfija jezgara), a tipično se razvija u distalnome dijelu želuca. Iako učestalost ovoga tipa karcinoma značajno pada, još je uvijek to najčešći oblik karcinoma želuca (70 - 80 %), dva puta češće se javlja kod muškaraca, a prosječna dob pri postavljanju dijagnoze je između 60 i 65 godina. Njegova pojavnost snažno je povezana s okolišnim čimbenicima, a smatra se da se razvija stupnjevito iz kronične upale (atrofični gastritis) preko intestinalne metaplazije, displazije do karcinoma (Slika 4.7.). Najznačajniji rizični čimbenik razvoja ovoga karcinoma je kronična H. pylori infekcija, dokaziva kod 60 do 90 % oboljelih od toga karcinoma. Drugi značajniji čimbenici rizika su: kronični autoimuni gastritis povezan s pernicioznom anemijom, kronični alkoholizam i pušenje, povećan unos nitrata i soli putem hrane uz smanjen unos antioksidanasa (voće, povrće) te resekcija želuca (karcinom na mjestu anastomoze).
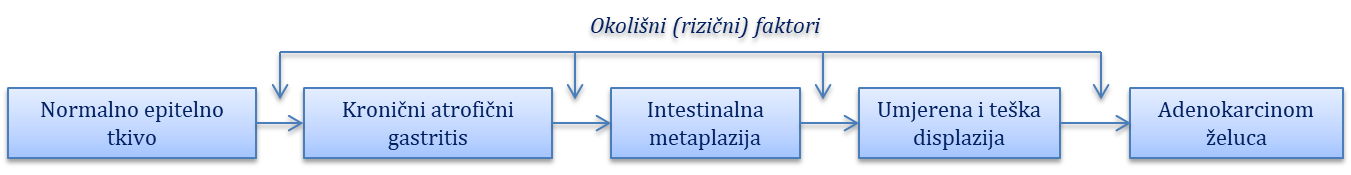
Slika 4.7. Shematski prikaz razvoja adenokarcinoma želuca
Difuzni adenokarcinom želuca nediferencirani je karcinom želuca građen od nakupina i tračaka stanica koje imaju svijetlu citoplazmu uz periferno potisnutne jezgre zbog čega poprimaju karakteristični oblik "stanica prstena pečatnjaka". Tipično se javlja u proksimalnim dijelovima želuca (osobito u području kardije) i čini 20 - 30 % karcinoma želuca s tendencijom porasta učestalosti. Za razliku od intestinalnoga adenokarcinoma, podjednako se javlja i kod muškaraca i kod žena i to u mlađoj životnoj dobi. Pojavnost ove vrste karcinoma želuca više se povezuje s genetskim promjenama u odnosu na okolišne čimbenike i prehranu, a kod većine ovih bolesnika mogu se dokazati stečene ili naslijeđene mutacije gena za adhezijski protein katherin-E i katherin-α. Posebnu skupinu ovoga karcinoma čini tzv. hereditarni difuzni adenokarcinom želuca koji nastaje uslijed mutacije CDH1 gena za protein katherin E koja se prenosi autosomno-dominantnim putem. Bolesnici s tom naslijeđenom mutacijom imaju značajno veći rizik od razvoja difuznoga adenokarcinoma u mlađoj životnoj dobi, zbog čega su kandidati za profilaktičku gastrektomiju. Ostali genetski sindromi koji mogu biti praćeni povećanim rizikom od razvoja ovoga karcinoma su: Lynchov sindrom, Peutz-Jeghersov sindrom te sindrom familijarne adenomatozne polipoze.
Patologija. Karcinomi želuca najčešće su lokalizirani u području tijela i antruma. Makromorfološki, karcinom želuca može poprimiti jednu od klasičnih slika (Borrmannova klasifikacija): I polipoidni tumor (tumor oštro ograničen od okoline, često leži na širokoj bazi), II uzdignuti tumor (tumori nalik krateru vulkana, imaju oštro ograničene i uzdignute rubove), III ulcerirani tumor (tumori naglašenih rubova koji infiltriraju okolnu stijenku) te IV difuzno-infiltrativni tumori (linitis plastica, tumori koji pokazuju široku, nejasnu infiltraciju). Mikromorfološki nalaz karcinoma želuca mora uključivati stupanj diferencijacije, dubinu invazije u stijenku želuca, zahvaćenost limfnih čvorova te prisutnost ili odsutnost stanica prstena pečatnjaka. Na temelju histološke slike razlikuju se dva osnovna tipa: intestinalni i difuzni, kako je to ranije opisano. Posebnu skupinu čini tzv. rani karcinom želuca (engl. early gastric cancer) koji podrazumijeva invazivni karcinom želuca ograničen na mukozu ili submukozu bez obzira na zahvaćenost limfnih čvorova. Koncept ranoga karcinoma želuca potječe iz Japana gdje je uočeno da takav oblik karcinoma ima znatno bolju prognozu (petogodišnje preživljenje je preko 90 %). Molekularnim se metodama mogu ispitati prisutnost HER2 ekspresije, PD-L1 mutacije, prisutnost mikrosatelitske nestabilnosti (MSI), kao i drugih molekularnih (genetskih) abnormalnosti koje mogu imati utjecaj na terapijski protokol.
Klinička slika. Karcinom želuca ima dug asimptomatski period. U ranoj fazi bolesti javljaju se nespecifični simptomi kao što je neodređen bol i nelagoda u epigastriju, osjećaj punoće ili težine nakon obroka uz laganu mučninu, gubitak apetita te osjećaj gađenja na neke vrste hrane. Kasniju fazu bolesti obilježava povraćanje (karcinomi distalnoga dijela želuca) ili disfagija (karcinomi proksimalnoga dijela želuca) uz značajan gubitak na tjelesnoj težini. U uznapredovaloj fazi česta su krvarenja iz tumorske mase što može biti praćeno pojavom hematemeze, melene ili sideropenične anemije te se mogu javiti znakovi metastatske bolesti kao što su ascites, hepatomegalija, žutica, bolovi u kostima i dr. Pri fizikalnom pregledu kod manje od 20 % bolesnika može se naći palpatorna masa u gornjem abdomenu ili neki od tipičnih znakova metastatske proširenosti u lijeve supraklavikularne limfne čvorove (Virchowljev čvor) ili umbilikalne limfne čvorove. Ovarijske metastaze karcinoma želuca rezultiraju pojavom velike tumorske mase u maloj zdjelici (Krukenbergov tumor). Moguć je i razvoj paraneoplastičnih sindroma kao što su migrirajući tromboflebtis (Trousseauov sindrom), acantosis nigricans te neuromiopatija.
Dijagnoza se postavlja na osnovi anamestičkih podataka, laboratorijskih nalaza, endoskopske pretrage te slikovnih metoda kojima se procjenjuje proširenost bolesti.
Laboratorijske pretrage kod bolesnika s karcinomom želuca su nespecifične. Često se nalazi sideropenična anemija kao posljedica kroničnoga krvarenja iz tumorske mase, a ovisno o prisustvu metastaza mogu se naći i povišeni jetreni enzimi, bilirubin, alkalna fosfataza i dr. Hipoalbuminemija nastaje kao posljedica malnutricije. Tumorski markeri CEA i CA72.4 nemaju veći značaj u postavljanju dijagnoze, ali se mogu koristiti kao biokemijski parametri praćenja terapijskoga odgovora.
Endoskopska dijagnostika (ezofagogastroduodenoskopija) osnovna je dijagnostička metoda pri sumnji na karcinom želuca. Indicirana je kod svih bolesnika iznad 60 godina koji se javljaju zbog gastričnih smetnji te kod mlađih bolesnika koji uz gastrične smetnje imaju i tzv. alarmantne simptome (disfagija, gubitak na tjelesnoj težini, učestalo povraćanje i sl.). Endoskopska pretraga omogućava vizualizaciju sluznice želuca i uočavanje suspektnih lezija (Borrmannova klasifikacija), a svaku suspektnu leziju koja se pronađe tijekom pretrage potrebno je višestruko bioptirati kako bi se dobio uzorak prikladan za patohistološku interpretaciju.
Endoskopski ultrazvuk (EUS) ima sve značajnije mjesto u dijagnostičkoj obradi bolesnika s karcinomom želuca, s obzirom na to da pruža najegzaktniji uvid u dubinu lezije, tj. stupanj invazije želučane stijenke te zahvaćenost regionalnih limfnih čvorova što je posebno bitno pri odabiru kandidata za endoskopsko liječenje.
Slikovne dijagnostičke metode ponajprije služe za procjenu proširenosti bolesti. Kod svih je bolesnika potrebno obaviti CT prsnoga koša, abdomena i male zdjelice, što nam daje uvid u lokalnu proširenost bolesti (zahvaćenost, pluća, jetre, peritoneuma, limfnih čvorova, nadbubrežnih žlijezda, jajnika i sl.) te PET-CT uz korištenje fluorodeoksiglukoze koji ima veliku ulogu u dijagnostici udaljenih metastaza (kosti, mozak).
Određivanje stadija karcinoma. Na temelju obavljenih pretraga definira se stadij karcinoma prema TNM klasifikaciji, pri čemu se T odnosi na veličinu tumora, N na zahvaćenost limfnih čvorova, a M na prisutnost udaljenih metastaza (Tablica 4.13.). Ponekad je točno određivanje stadija moguće tek nakon operativnoga uklanjanja tumorske mase s pripadajućim limfnim čvorovima.
|
Tablica 4.13. TNM klasifikacija i klinički stadiji karcinoma želuca
|
|
T – veličina tumora
|
Klinički stadij
|
|
T1a
|
Tumor koji zahvaća mukozu
|
Stadij 0
|
TIS, T0, M0
|
|
T1b
|
Tumor koji zahvaća submukozu
|
Stadij IA
|
T1, N0, M0
|
|
T2
|
Tumor koji zahvaća mišićni sloj
|
Stadij IB
|
T2, N0, M0; T1, N1, M0
|
|
T3
|
Tumor koji zahvaća serozu
|
Stadij IIA
|
T3, N0, M0; T2,N1, M0; T1, N2, M0
|
|
T4
|
Tumor koji zahvaća okolne strukture
|
Stadij IIB
|
T4a, N0, M0; T3,N1, M0; T2, N2, M0
|
|
N – zahvaćenost limfnih čvorova
|
Stadij IIIA
|
T4a, N1, M0, T3, N2, M0, T2, N3, M0
|
|
N0
|
Bez zahvaćanja regionalnih limfnih čvorova
|
Stadij IIIB
|
T4b, N0-1, M0, T4a, N2, M0, T3, N3, M0
|
|
N1
|
Zahvaćenost 1 - 2 regionalna limfna čvora
|
Stadij IIIC
|
T4b, N2-3, M0, T4a, N3, M0
|
|
N2
|
Zahvaćenost 3 - 6 regionalnih limfnih čvorova
|
Stadij IV
|
Bilo koji T, bilo koji N, M1
|
|
N3
|
Zahvaćenost 7 ili više regionalnih limfnih čvorova
|
|
|
|
M – prisutnost udaljenih metastaza
|
|
|
|
M0
|
Bez prisutnosti udaljenih metastaza
|
|
|
|
M1
|
Prisutne udaljene metastaze
|
|
|
Liječenje. Osnovu liječenja adenokarcinoma želuca čini operativno liječenje uz perioperativnu kemoterapiju s ili bez radioterapije. Za bolesnike u uznapredovaloj fazi bolesti na raspolaganju su različite palijativne metode liječenja.
Kirurško liječenje jedina je potencijalno kurabilna metoda liječenja adenokarcinoma želuca, a dolazi u obzir kod bolesnika sa stadijem I-III. Ako se radi o tumoru smještenome u distalnom dijelu želuca, preferira se subtotalna gastrektomija s resekcijom limfnih čvorova u području porte hepatis i glave gušterače. Tumori koji su smješteni u proksimalnome dijelu obično zahtijevaju totalnu gastrektomiju s resekcijom pridruženih limfnih čvorova, a često se u istom postupku primjenjuju i distalna pankreatektomija te splenektomija, iako to značajno povećava postoperativne komplikacije i smrtnost. Opseg disekcije limfnih čvorova tijekom operativnoga zahvata i danas je predmet mnogih radova i rasprava (proširena disekcija limfnih čvorova povezana je sa znatno većim rizikom od nastanka perioperativnih komplikacija s ne tako jasnim dokazom o produljenju preživljenja).
Onkološko liječenje podrazumijeva primjenu kemoterapije same ili kemoterapije kombinirane s radioterapijom. Danas se sve više pribjegava konceptu perioperativne kemoradioterapije što podrazumijeva primjenu kemoterapeutika prije, kao i poslije operativnoga zahvata što je pokazalo veći terapijski učinak (dulje preživljenje, smanjenje recidiva), u odnosu na kemoterapiju koja se primjenjuje samo nakon operativnoga zahvata (adjuvantna kemoterapija). Kod primjene kemoterapeutika obično se kombiniraju dva ili tri kemoterapeutika, dok je liječenje samo jednim kemoterapeutikom rezervirano za bolesnike s lošim općim (kondicijskim) stanjem. U liječenju takvih bolesnika mogu se koristiti različiti kemoterapijski protokoli: CF (5-fluorouracil, cisplatina), ECF (epirubicin, cisplatina, 5-fluorouracil), TCF (docetaksel, cisplatina, 5-fluorouracil) i drugi. S obzirom na to da je adenokarcinom želuca izuzetno radiosenzitivan tumor, sama radioterapija (bez kemoterapije) ne utječe na produljenje preživljenja i ne primjenjuje se kao samostalan oblik onkološkoga liječenja.
Liječenje metastatske bolesti. Kod bolesnika s dokazanim udaljenim metastazama radikalan kirurški zahvat nije indiciran, no u obzir dolaze palijativne kirurške metode (npr. gastrojejunostomija). Ako to opće stanje bolesnika dopušta, može se provesti kemoterapija, a najčešće se koriste 5-fluorouracil ili taksani u kombinaciji s cisplatinom. Dodatne pozitivne ishode osigurava i primjena trastuzumaba kod bolesnika koji su HER-2 pozitivni ili pembrolizumaba kod bolesnika koji su PD-L1 pozitivni. U drugoj liniji koristimo ramucirumab, irinotekan ili paklitaksel.
Endoskopsko liječenje. Kod maloga broja bolesnika koji se dijagnosticiraju u ranoj fazi bolesti (T1a) endoskopsko liječenje predstavlja terapiju izbora. Ono je sigurno za dobro diferencirane tumore manje od 2 cm u promjeru, koji zahvaćaju samo mukozu i nemaju ulcerozni izgled.
Prognoza ponajprije ovisi o kliničkome stadiju bolesti. Petogodišnje preživljenje kreće se od 70 % za stadij bolesti IA do svega 5 % u stadiju IV. Glavni su prognostički čimbenici anatomska lokalizacija tumora (distalni tumori imaju bolju prognozu) te zahvaćenost limfnih čvorova i njihov broj (petogodišnje preživljenje bolesnika s negativnim limfnim čvorovima nakon operativnoga zahvata veće je za 50 % od onih s pozitivnim čvorovima).
Praćenje bolesnika s adenokarcinomom uključuje redovne kliničke preglede i laboratorijske nalaze (u prvi dvije godine svaka tri do četiri mjeseca, a kasnije dva puta godišnje), endoskopski pregled (dva puta godišnje), CT abdomena (dva puta godišnje) te rendgenogram srca i pluća (jednom godišnje).
LIMFOM ŽELUCA
Definicija. Limfomi želuca predstavljaju zloćudne tumore limfatičkoga porijekla koji se mogu javiti kao primarna bolest (nastaju iz želučane sluznice, tzv. ekstranodalni limfom) ili sekundarna bolest koja nastaje diseminacijom nodalnoga limfoma. Razlikovanje ta dva oblika ima ključnu ulogu u terapijskome pristupu i načinu liječenja. Primarni želučani limfomi drugi su po učestalosti maligni tumori želuca (odmah iza adenokarcinoma) te čine 3 do 5 % želučanih malignih tumora. Ove tumore obično susrećemo kod mlađih osoba, nešto češće kod muškaraca u odnosu na žene.
Etiopatogeneza. U više od 95 % slučajeva radi se o non-Hodgkinovom limfomu B staničnoga porijekla (MALT limfom, difuzni B-velikostanični limfom), a u manje od 5 % slučajeva radi se o T-staničnom limfomu. Nastanak primarnih B-staničnih limfoma povezan je s kroničnom H. pylori infekcijom koja je povezana s izraženim limfocitnim odgovorom i formiranjem limfodinih folikula, zbog čega se ona smatra glavnim rizičnim čimbenikom za razvoj ovih tumora. Ta je povezanost posebno istaknuta u razvoju MALT limfoma (engl. mucosa-associated lymphoid tissue), s obzirom na to da se infekcija H. pylori može dokazati kod više od 90 % bolesnika s tim tumorom. Nastanak primarnih T-staničnih limfoma povezan je s infekcijom humanim T-leukemijskim virusom tipa 1 (HTLV-1), ali se ona u praksi rijetko susreće. Također, kod ovih bolesnika češće se susreću i određene kromosomske abnormalnosti kao što su t (1;14), t (11,18) i t (14,18). Biološki gledano, MALT limfomi ubrajaju se u limfome niskoga stupnja malignosti, dok difuzni B-velikostanični limfom kao i T-stanični limfomi pripadaju skupini limfoma visokoga stupnja malignosti.
Klinička slika. Kliničke manifestacije želučanih limfoma su nespecifične i mogu odgovarati onima koje susrećemo kod bolesnika s ulkusnom bolesti ili ranije opisanim karcinomom želuca. Difuzni B-velikostanični limfom može se manifestirati i izraženim općim, sistemskim manifestacijama (slabost, umor, noćno preznojavanje, febrilno stanje).
Dijagnoza se postavlja na temelju endoskopskoga pregleda želuca i uzimanja bioptičkoga materijala. Makroskopski ovi tumori najčešće poprimaju ulcerirani izgled (iako se mogu prezentirati i kao egzofitička ili infiltrativna masa) te ih je lako zamijeniti za benigni želučani ulkus, zbog čega je potrebno uzeti uzorke s više mjesta. Patohistološka analiza dobivenoga materijala najpreciznija je metoda dokazivanja ove bolesti. Ako se histološki dokaže da se radi o limfomu, potrebno je obaviti dodatna testiranja navedenih kromosomskih abnormalnosti. U daljnjoj obradi potrebno je učiniti endoskopski ultrazvuk (procjena invazije tumora i zahvaćenosti limfnih čvorova) te CT prsnoga koša, abdomena i zdjelice. U cilju razlikovanja primarnih i sekundarnih limfoma preporuča se citološka analiza sumnjivih perifernih limfnih čvorova, kao i analiza koštane srži.
Liječenje. Limfomi niskoga stupnja malignosti ograničeni na površinski sloj (mukoza, submukoza) imaju izvrsnu prognozu. U prvome se redu liječe eradikacijom H. pylori infekcije, s obzirom na to da se kod njih u većini slučajeva postiže spontana remisija tumora nakon provedene eradikacije, što se provjerava i kontrolira redovnim endoskopskim pregledima. Kod bolesnika s nekom od opisanih kromosomskih abnormalnosti eradikacijska terapija obično nije dovoljna nego se zajedno s njom primjenjuje radioterapija ili kemoradioterapija. Kod bolesnika s proširenim limfomom niskoga stupnja te kod bolesnika s limfomom visokoga stupnja malignosti preporuča se kombinirano kirurško i onkološko liječenje (COHP protokol, rituksimab, zračenje).
Prognoza želučanih limfoma ovisi o vrsti i stupnju proširenosti bolest, ali je u načelu bolja nego kod bolesnika s adenokarcinomom. Bolesnici kod kojih se oni otkriju u ranim fazama bolesti (stadij I i II), i koji imaju male, resektibilne tumore te tumore niskoga stupnja malignosti imaju dobru prognozu te je njihovo petogodišnje preživljenje veće od 90 %.
LEIOMIOSARKOM ŽELUCA
Leiomiosarkomi želuca čine manje od 1 % malignih tumora želuca. Radi se o zloćudnim tumorima koji potječu od glatke muskulature stijenke želuca, a biološki ih karakterizira spor, indolentan rast. Često ulceriraju i dovode do krvarenja, a rijetko zahvaćaju susjedne organe i u pravilu metastaziraju u regionalne i udaljene limfne čvorove i pluća. Klinička slika je nespecifična i odgovara onoj koju nalazimo kod bolesnika s ulkusnom bolesti ili adenokarcinomom želuca. Dijagnoza se potvrđuje endoskopskim pregledom i patohistološkom analizom dobivenih uzoraka nakon čega treba provesti dodatnu obradu za utvrđivanje proširenosti bolesti (endoskopski ultrazvuk, CT prsnoga koša i abdomena, PET-CT). Liječenje u prvom redu podrazumijeva kombinaciju kirurškoga liječenja i zračenja, dok se kemoterapija provodi kod dokazane metastatske bolesti.
BENIGNI TUMORI ŽELUCA
Polipi želuca rijetki su benigni tumori koji se mogu naći kod osoba srednje i starije životne dobi. Prema izgledu mogu biti sesilni (imaju široku bazu) ili pedunkularni (nalaze se na peteljci), a ovisno o patohistološkoj slici razlikujemo dva temeljna oblika: adenomatozni i hiperplastični. Hiperplastične polipe obilježava histološka struktura koju čine normalne, hiperplastične žlijezde, dok su adenomatozni polipi prave neoplastične tvorbe s malignim potencijalom. Ostale vrste polipa su polipi žlijezda fundusa, inflamatorni i juvenilni polipi. Polipi su obično asimptomatski, rijetko se prezentiraju mučninom i povraćanjem. Dijagnoza se postavlja na osnovi endoskopskoga pregleda i patohistološke analize. Liječenje se provodi endoskopskom polipektomijom.
Leiomiomi su najčešći benigni tumori želuca, građeni su od glatkomišićnih stanica i potječu od mišićnoga sloja želučane stijenke. Najčešće rastu prema lumenu i unutrašnjosti želuca stvarajući ulceracije koje krvare, a u manjem broju slučajeva rastu prema vanjskoj strani i serozi. Leiomiomi su najčešće lokalizirani u središnjem i distalnom dijelu želuca. Obično su asimptomatski, rjeđe se manifestiraju okultnim krvarenjem i mikrocitnom anemijom. Dijagnoza se postavlja na temelju endoskopskoga pregleda i patohistološkoga nalaza. Kirurško liječenje indicirano je kod simptomatskih leiomioma te kod dvojbenih patohistoloških nalaza (ako se teže diferenciraju od svoje maligne forme).
INFEKTIVNI I PSEUDOMEMBRANOZNI ENTEROKOLITIS
U ovome će poglavlju predstavljeni biti osnovni bakterijski, virusni, gljivični i parazitarni oblici enterokolitisa te pseudomembranozni ili klostridijski enterokolitis koji se često susreće u kliničkoj praksi s obzirom na široku primjenu antibiotika i njegovu povezanost s antibiotskim liječenjem. Radi se o infektivnim upalama tankoga i debeloga crijeva različite etiologije.
INFEKTIVNI ENTEROKOLITISI
Bakterijski enterokolitisi predstavljaju infektivne bolesti crijeva nastale djelovanjem bakterija ili njihovih toksina. Obično se radi o samoograničavajućim bolestima, ali u rjeđim okolnostima one mogu poprimiti i sistemski karakter. Najčešći su uzročnici bakterijskih enterokolitisa Salmonella spp, Shigella spp, Yersinia spp, Campylobacter spp te enteroinvazivna i enterotoksična Escherichia coli. Osim bakterijskih enterokolitisa, prikazani će biti i najznačajniji virusni, gljivični i parazitarni oblici enterokolitisa.
Salmoneloze predstavljaju crijevne infektivne bolesti koje nastaju kao posljedica infekcije gram-negativnim bakterijama Salmonella spp kojih ima više od 4000 vrsta, a kod nas su najčešće S. enteritidis, S. typhi murium te S. hadar. Salmoneloze predstavljaju klasične zoonoze s obzirom na to da su salmonele primarno paraziti na domaćim životinjama, a ljudi se njima zaraze konzumirajući meso, jaja, mlijeko i mliječne proizvode zaraženih životinja, ako ti proizvodi nisu prethodno odgovarajuće termički obrađeni. Također, osoba oboljela od salmoneloze izlučuje salmonelu stolicom, te je moguć i interpersonalni fekalno-oralni put prijenosa. Bolest nastaje kao posljedica invazije uzročnika u crijevnu sluznicu (akutni gastroenteritis), a rjeđe dovodi do bakterijemije (salmonela vrućica) ili sistemskoga upalnoga odgovora i nastanka sekundarnih žarišta (salmonela sepsa). Inkubacija traje jedan do dva dana, bolest počinje naglo općim simptomima (vrućica, umor, algični sindrom) koji se postupno smiruju te dolazi do razvoja lokalnih simptoma i znakova (proljev, povraćanje, bolovi u trbuhu). Stolice su najčešće zelenkaste i smrdljive, a kasnije mogu biti i vodenaste. Bolest je obično samoograničavajuća te se simptomi povlače kroz tri do pet dana, a kod manjega broja oboljelih napreduje prema težim kliničkim očitovanjima (salmonela vrućica, salmonela sepsa). Dijagnoza se postavlja na temelju anamnestičkih i epidemioloških podataka te dokazom salmonele u stolici ili hemokulturi. Osnova liječenja je simptomatska (rehidracija, dijeta), a u težim slučajevima indicirano je i antimikrobno liječenje (empirijski lijekovi izbora su kinoloni, makrolidi i cefalosporini treće generacije).
Šigeloza (bacilarna dizenterija) je crijevna zarazna bolest koju uzrokuju šigele, gram-negativne štapićaste bakterije razvrstane u četiri skupine, a u Hrvatskoj je najčešća Shigella sonnei. Izvor zaraze su bolesne osobe ili kliconoše, a put prijenosa je fekalno-oralni. Šigele naseljavaju i invadiraju sluznicu debeloga crijeva što dovodi do različitoga stupnja upale (od kataralne do ulceromembranozne), a osim toga šigele imaju i sposobnost stvaranja enterotoksina koji dovode do hipersekrecije i obilnih proljeva. Šigele rijetko prodiru u krv i dovode do bakterijemije. Inkubacija traje od jednoga do pet dana, počinje naglo općim infektivnim sindromom krakteriziranim visokom vrućicom te dolazi do razvoja lokalnih simptoma među kojima dominiraju uporni sluzavo-krvavi proljevi. Bolest je uglavnom samoograničavajuća te se klinička slika postupno smiruje kroz tri do pet dana. Dijagnoza se postavlja na temelju kliničke slike, epidemioloških podataka te izolacijom uzročnika iz stolice. Liječenje se temelji na rehidraciji, dijeti i primjeni antibiotika, a kao i kod salmonela, preferiraju se kinoloni (ciproflokacin), makrolidi (azitromicin) ili cefalosporini treće generacije (ceftriakson).
Yersinia enterokolitis predstavlja crijevnu zaraznu bolest koju uzrokuje aerobna gram-negativna štapićasta bakterija Yersinia enterocolitica koja primarno inficira domaće životinje (zoonoza) te se na ljude prenosi unosom termički nedovoljno obrađenoga mesa, mlijeka i mliječnih proizvoda ili pak fekalno-oralnim putem od oboljele osobe ili kliconoše. Bolest nastaje invazijom uzročnika u sluznicu crijeva izazivanjem njezinoga oštećenja. Inkubacija može trajati i do tjedan dana, a klinički se očituje povišenom tjelesnom temperaturom i lokalnim simptomima (proljev, povraćanje, bolovi u trbuhu). Kod oboljelih može biti izražena bolnost desnoga donjeg kvadranata abdomena te bolest može nalikovati na akutni apendicitis. Dijagnoza se potvrđuje izolacijom uzročnika iz stolice. Liječenje se temelji na simptomatskim mjerama (dijeta, rehidracija), a antibiotici su rezervirani za teže slučajeve (trimetoprim-sulfametoksazol, kinoloni, cefalosporini treće generacije).
Campylobacter enterokolitis je crijevna zarazna bolest koju u Hrvatskoj najčešće uzrokuje Campylobacter jejuni koji se nalazi u crijevnoj flori mnogih domaćih životinja, peradi i divljih životinja. Čovjek se najčešće zarazi konzumirajući mlijeko ili vodu kontaminiranu životinjskim izmetom, rjeđi je interpersonalni prijenos. Kao i kod ostalih crijevnih zaraznih bolesti, inkubacija može trajati do tjedan dana, a u kliničkoj slici nalazimo povišenu tjelesnu temperaturu, bolove u trbuhu, povraćanje i proljev. Dijagnoza se potvrđuje izolacijom uzročnika iz stolice. Liječenje se sastoji od dijete, rehidracije i u težim slučajevima primjene antibiotika (ciprofloksacin ili azitromicin).
Escherichia coli enterokolitis naziv je za crijevne zarazne bolesti koje mogu uzrokovati enterotoksična i enteroinvazivna E. coli, oba se soja prenose interpersonalno fekalno-oralnim putem. Enterotoksična E. coli uzrokuje sekretornu dijareju bez izraženih sistemskih očitovanja (proljev bez povišene tjelesne temperature), dok enteroinvazivna E. coli stvara kliničke manifestacije kao kod ostalih invazivnih crijevnih zaraznih infekcija (temperatura, algični sindrom, proljev, povraćanje). Dijagnoza se postavlja izolacijom uzročnika iz stolice. Liječenje se sastoji od rehidracije, dijete i primjene antibiotika samo kod težih oblika praćenih visokom tjelesnom temperaturom. Antibiotici izbora su kinoloni (ciprofloksacin), doksiciklin ili sulfametoksazol/trimetoprim.
Alimentarne intoksikacije ili trovanja hranom označavaju crijevne zarazne bolesti nastale unosom hrane s već stvorenim egzotoksinom koji će djelovati na enterocite uzrokujući hipersekreciju i obilno povraćanje ili proljev, ali uz odsutnost općih (sistemskih) simptoma. Najčešće se radi o stafilokoknom i klostridijskom trovanju hrane. Staphylococcus aureus može kolonizirati kožu te sluznicu nosa i ždrijela odakle lako može dospjeti u hranu (osobito kolače i sladoled) gdje se razmnožava i stvara obilje toksina, a bolest nastaje unosom hrane u kojoj se enterotoksini nalaze. Clostridium perfringens široko je rasprostranjen u prirodi i naseljava 2 do 5 % probavnoga sustava ljudi i životinja odakle može kontaminirati hranu u kojoj stvara enterotoksin (trovanje najčešće nastaje kao posljedica konzumacije mesnih obroka koji su bili kuhani nekoliko dana ili sati prije uporabe). Kliničkom slikom trovanja hrane dominiraju lokalni simptomi (kod stafilokoknoga trovanja dominira povraćanje, a kod klostridijskoga proljev). Simptomi nastaju nekoliko sati nakon unosa hrane, traju 12 do 24 sata, a potom prestaju. Dijagnoza se postavlja na osnovi kliničke slike i epidemioloških podataka. Liječenje je isključivo simptomatsko.
Virusni enterokolitis. Virusi su najčešći uzročnici infektivnoga enterokolitisa, a najčešće se radi o rotavirusima, kalicivirusima, adenovirusima te astrovirusima. Radi se o vrlo zaraznim virusima koji se lako prenose interpersonalno, a glavni put prijenosa je fekalno-oralni ili putem inficirane vode ili hrane (rjeđe). Inkubacija prosječno iznosi od jednoga do tri dana. Virusi invadiraju enterocite te dovode do funkcionalnih poremećaja što za posljedicu ima hipersekreciju tekućine i proljev kao dominantan znak bolesti, dok se povišena tjelesna temperatura i opći simptomi rijetko javljaju. Ukupno gledano, rotavirusi su najčešći uzročnici infektivnih enterokolitisa, osobito kod djece i mlađih odraslih osoba. Glavni su simptomi bolovi u trbuhu te proljev kojega se ne može razlikovati od onoga izazvanoga drugim crijevnim zaraznim bolestima (obično sluzav bez primjesa krvi). Prisutnost rotavirusa u stolici dokazuje se brzom metodom imunoelektroosmoforeze (IEOF). Liječenje je simptomatsko.
Kandidijaza donjih dijelova probavne cijevi izuzetno se rijetko susreće, a obično se radi o bolesnicima s izraženom imunosupresijom. Kandidijaza crijeva najčešće nastaje širenjem gljivične infekcije iz gornjih dijelova probavne cijevi (usta, jednjak), rijetko hematogenom diseminacijom u sklopu generalizirane infekcije. Simptomi uključuju bolove u trbuhu te vodenaste proljevaste stolice uz normalnu ili tek blago povišenu tjelesnu temperaturu. Dijagnoza se postavlja na temelju kliničkoga nalaza, anamnestičkih podataka (imunosupresija) te dokazom gljivice u kulturi stolice. Liječenje uključuje primjenu antimikotika (flukonazol, ketokonazol, liposomalni amfotericin B).
Intestinalna histoplazmoza rijetko se susreće u kliničkoj praksi, a najčešće nastaje progresijom plućne bolesti. Klinički se očituje kroničnim tijekom karakteriziranim mučninom, povraćanjem, proljevom, gubitkom teka te gubitkom na tjelesnoj težini. Obično su prisutni hepatosplenomegalija i periferna limfadenopatija. Dijagnoza se postavlja biopsijom tankoga crijeva ili kolona te dokazom uzročnika u sluznici i lamini propriji. Liječenje se sastoji od primjene antimikotika (itrakonazol, liposomalni amfotericin B).
Amebijaza je crijevna zarazna bolest koju uzrokuje protozoa Entamoeba hystolitica. Uzročnik se u obliku ciste održava u vanjskoj sredini (hrana, voda) u koju dospije stolicom kroničnih bolesnika ili zdravih kliconoša. Čovjek se zarazi unosom kontaminirane hrane ili vode, a u crijevu se iz ciste oslobađa vegetativni oblik koji može samo kolonizirati sluznicu ili je invadirati stvarajući ulceracije. Amebe rjeđe mogu dospjeti i u krvne žile te krvnom strujom dospjeti u jetreno tkivo. Kliničku sliku čine neodređeni bolovi u trbuhu, meteorizam te proljevi koji se često smjenjuju s opstipacijama. Bolest je lokalnoga karaktera i bolesnici nemaju sistemskih simptoma, osim ako prodru u krv. Dijagnozu potvrđuje nalaz spora i vegetativnih oblika u stolici. Osnovu liječenja čini peroralna primjena metronidazola.
Lamblijaza je crijevna zarazna bolest uzrokovana protozoom Lamblia intestinalis. Kao amebijaza, lamblija dolazi u dvije forme: cistična (odgovorna za preživljavanje u vanjskim uvjetima) i vegetativna (nastaje iz cistične nakon unosa u crijevo). Izvor zaraze je čovjek koji stolicom izlučuje ciste u okoliš, a put prijenosa je fekalno-oralni. Lamblije poglavito dovode do kronične upale tankoga crijeva, a rijetko mogu dospjeti i u žučne puteve uzrokovajući kolestazu. Bolest je asimptomatska ili prisutni mogu biti umjereni bolovi u trbuhu, mučnina, podrigivanje ili proljev. Bolesnici nemaju izražene opće infektivne simptome. Dijagnoza se postavlja na temelju parazitološkoga pregleda stolice, a liječenje se temelji na primjeni metronidazola.
Enterobioza je crijevna parazitarna zarazna bolest koju uzrokuje glista Enterobius vermicularis. Infekcija nastaje unosom jajašaca enterobijusa koji u vanjski okoliš dospijevaju iz anusa zaražene osobe (ličinke ženke noću izlaze iz crijeva te polažu jajašca u perianalnom području) te se zadržavaju na donjemu rublju, posteljini, igračkama i sl. U crijevima se iz unešenih jajašaca razvija konačni oblik gliste. Karakterističan je simptom analni svrbež koji često dovodi do ekskorijacija kao posljedice češanja. Dijagnoza se potvrđuje nalazom jajašaca na otisku anusa, a liječenje se provodi primjenom mebendazola ili albendazola.
PSEUDOMEMBRANOZNI ENTEROKOLITIS
Definicija. Klostridijski enterokolitis najčešći je oblik enterokolitisa povezanoga uz primjenu antibiotika, najčešći je uzrok proljeva kod bolesnika hospitaliziranih dulje od tri dana te značajno povećava duljinu hospitalizacije, mortalitet, kao i troškove liječenja.
Etiologija. Clostridium difficile anaerobna je bakterija koja u obliku spora kolonizira debelo crijevo oko 3 % zdrave populacije te 8 % hospitaliziranih bolesnika i u takvom obliku ne izaziva oboljenje. Normalna crijevna bakterijska flora sprečava prelazak spora klostridija u vegetativni oblik (germinacija) koji može izazvati bolest. Međutim, ona može biti uništena širokom primjenom antibiotika. Antibiotici koji se najčešće povezuju s ovom infekcijom su ampicilin, klindamicin, cefalosporini treće generacije te fluorokinoloni, iako je mogu izazvati gotovo svi antibiotici. Istodobna primjena probiotika značajno smanjuje mogućnost razvoja ove infekcije kako se navodi u nekim radovima. Dodatni rizični čimbenici za razvoj ove infekcije su starija životna dob, imunokompromitiranost, primjena više vrsta antibiotika, produljeno vrijeme primjene antibiotika, primjena inhibitora protonske pumpe, enteralni unos hrane putem nazogastrične sonde te ranije bolesti crijeva (npr. upalna bolest crijeva).
Epidemiologija. Spore C. difficile prenose se interpersonalno fekalno-oralnim putem, bilo direktnim kontaktom, bilo indirektno preko treće osobe (bolničko osoblje). Osim toga, spore klostridija nađu se u i bolničkim sobama i kupaonicama. Pojačana higijena (učestalo pranje ruku, osobito od strane medicinskoga osoblja) i korištenje jednokratnih rukavica značajno smanjuje mogućnost prijenosa ovih spora među bolesnicima.
Patofiziologija. Narušavanjem normalne crijevne mikroflore omogućuje se germinacija spora klostridija, a kada klostridiji dođu u vegetativnu fazu, počinju proizvoditi toksine odgovorne za nastanak bolesti. Patofiziološki su značajni toksin A (TcdA), koji se naziva još i enterotoksin, te toksin B (TcdB), koji se naziva još i citotoksin. Toksin A odgovoran je za povećanu permeabilnost crijevne stijenke i pojačanu transudaciju, dok je toksin B odgovoran za direktan citotoksični učinak i izazivanje upalnoga procesa. Kod polovice bolesnika na površini crijevne sluznice nastaju žućkasti uzdignuti plakovi, tj. pseudomembrane, zbog čega se nekada i koristio naziv pseudomembranozni kolitis koji je danas napušten jer navedeni plakovi ne moraju uvijek biti prisutni.
Klinička slika. Bolest se razvija uglavnom unutar osam dana od uvođenja antibiotske terapije. Tipično ju obilježava pojava proljeva i grčeva u donjemu dijelu trbuha. Bolesnici mogu imati i do 15 i više vodenastih, zelenkastih, smrdljivih stolica, često pomiješanih sa sluzi, rijetko s krvi. Teški i fulminantni oblik bolesti razvija se kod 10 do 15 % oboljelih, a karakterizira ga progresivni razvoj septičkoga šoka, paralitičkoga ileusa ili toksičnoga megakolona uz visoku stopu smrtnosti.
Dijagnoza se postavlja na osnovi kliničke slike, laboratorijskih nalaza, mikrobiološke dijagnostike te endoskopskih i slikovnih metoda.
Laboratorijski nalazi obično podrazumijevaju pojavu leukocitoze s neutrofilijom, povišene vrijednosti laktat dehidrogenaze, snižene vrijednosti albumina te različiti stupanj elektrolitnoga disbalansa i otklona acidobazne ravnoteže (hipokalijemija, hiponatrijemija, metabolička acidoza).
Mikrobiološka dijagnostika podrazumijeva određivanje antigena i toksina C. difficile u uzorku stolice. Aktivnu bolest karakteriziraju pozitivni antigen i toksini, dok samo pozitivan antigen može označavati kolonizaciju. Kultura stolice na C. difficile klinički nije prihvatljiva s obzirom na to da se na rezultate čeka i do sedam dana.
Ostale dijagnostičke metode. Endoskopski pregled nije rutinski dio dijagnostičke obrade, ali ako se izvodi, omogućuje prikazivanje pseudomembrana kod oko 50 % bolesnika. Klasična radiološka snimka i/ili CT abdomena izvode se samo kod bolesnika s teškim i fulminantnim oblikom bolesti.
Liječenje klostridijskoga enterokolitisa temelji se na primjeni jednoga od tri antibiotika: metronidazol, vankomicin ili fidaksomicin (slabo apsorbirajući makrolid). Odabir i način primjene antibiotika ovisi o kliničkoj težini bolesti, kao i o drugim karakteristikama bolesnika.
Uvodna terapija. Za bolesnike s umjereno izraženom kliničkom slikom lijek izbora je peroralni metronidazol u dozi od 3 x 500 mg/dan, dok je za bolesnike koji teže podnose metronidazol, kao i za trudnice i djecu te bolesnike s upalnom bolesti crijeva, lijek izbora peroralni vankomicin u dozi od 4 x 125 mg/dan. Kliničko poboljšanje bilježi se već nakon 48 do 72 sata, a liječenje treba provoditi 10 do 14 dana. Za bolesnike s teškim kliničkim očitovanjem (septički šok, ileus, megakolon, hemodinamska nestabilnost) preporučena je istodobna primjena intravenskoga metronidazola u dozi od 3 x 500 mg/dan uz peroralni unos (per sondam) vankomicina u dozi od 4 x 500 mg/dan (intravenski vankomicin slabo prodire u crijevnu stijenku). Dodatna primjena fidaksomicina u dozi od 2 x 200 mg per os moguća je opcija, iako još nema studija koje ukazuju na učinkovitost ove terapije. U najtežim oblicima bolesti indicirano je kirurško liječenje.
Prevencija recidiva. Kod oko 25 % bolesnika nakon prekida liječenja u periodu od dva tjedna nastupa relaps bolesti koji može biti posljedica reinfekcije ili neuspjeha u potpunom iskorijenjivanju bakterije tijekom prethodnoga antibiotskoga liječenja. Kod pojave prvoga relapsa bolesti liječenje se provodi istim terapijskim režimom (istim antibiotikom) kao i u slučaju prethodne infekcije, što u većini slučajeva dovodi do izlječenja. Ako se razvije treći relaps bolesti, preporuča se produljena primjena peroralnoga vankomicina uz postupno snižavanje doze prema sljedećoj shemi: prvih 14 dana primjenjuje se u punoj dozi od 4 x 125 mg/dan, sljedećih sedam dana u dozi od 2 x 125 mg/dan, zatim sljedećih sedam dana 1 x 125 mg/dan, zatim sedam dana 1 x 125 mg/svaki drugi dan, a potom nastaviti 1 x 125 mg/svaki treći dan kroz dva do osam tjedana. Kod bolesnika s tri i više relapsa klostridijskoga enterokolitisa moguća je i primjena postupka fekalne transplantacije tj. primjena suspenzije fekalnih bakterija iz zdravoga donora u terminalni ileum ili proksimalni kolon oboljele osobe, bilo putem nazoenterične sonde, bilo putem kolonoskopa - što je pokazalo veći klinički uspjeh od ponovne primjene vankomicina. Danas za tu svrhu postoje posebno izrađene kapsule koje sadrže fekalnu formulaciju, a u primjeni su od 2017. godine.
Nove terapijske mogućnosti. Kao dodatna opcija liječenja kolostridijskoga enterokolitisa kod bolesnika s rizičnim čimbenicima (imunokompromitiranost, upalna bolest crijeva, dugotrajna primjena antibiotika) nameće se primjena bezlotoksumaba, monoklonalnoga antitijela na toksin B C. difficile. Iako ova terapijska opcija nije u svakodnevnoj praksi, neke su studije pokazale značajno nižu stopu relapsa bolesti nakon jednokratne infuzije ovoga lijeka u rizičnih bolesnika tijekom dvanaest tjedana u odnosu na bolesnike koji su dobili placebo.
Definicija. Upalna bolest crijeva (IBD, engl. inflammatory bowel disease) naziv je za kroničnu, idiopatsku upalnu bolest koja obuhvaća dva klinička entiteta: Crohnovu bolest ili terminalni ileitis i ulcerozni kolitis. Oni dijele neke zajedničke karakteristike u pogledu etiopatogeneze, ali se razlikuju prema svojim kliničko-patološkim manifestacijama. Kod oko 10 % oboljelih ne može se točno razgraničiti o kojemu se kliničkom entitetu radi pa se govori o tzv. intermedijarnom obliku bolesti.
Epidemiologija. Učestalost upalne bolesti crijeva u posljednjih nekoliko desetaka godina bilježila je rast diljem svijeta, ponajprije u razvijenim zemljama. Područja s najvećom učestalosti su Sjeverna Amerika, Velika Britanija te sjeverna Europa. Incidencija ulceroznoga kolitisa u zapadnim zemljama danas pokazuje stagnaciju te iznosi 10 do 20 novooboljelih osoba na 100 000 stanovnika, dok se prevalencija kreće između 100 i 200 bolesnika na 100 000 stanovnika. Incidencija Crohnove bolesti pokazuje negativan trend te iznosi 5 do 10 novooboljelih osoba na 100 000 stanovnika, dok je prevalencija između 50 i 100 bolesnika na 100 000 stanovnika. Iako se upalna bolest crijeva može javiti u svakoj životnoj dobi, s najvećom se učestalošću javlja u dobi između drugoga i četvrtog desetljeća života te u sedmom desetljeću života. Bolest se javlja podjednako učestalo kod oba spola (Crohnova bolest pokazuje neznatno veću učestalost kod žena).
Etiopatogeneza. S obzirom na to da Crohnova bolest i ulcerozni kolitis dijele zajednički obrazac etiopatogeneze, u ovome će dijelu biti opisan osnovni koncept razvoja bolesti. Iako točan uzrok i mehanizam bolesti nisu poznati, smatra se da ona nastaje međudjelovanjem više čimbenika među koje se ubrajaju genetski, okolišni i poremećaj imunosnoga odgovora. Temeljna etiopatogenetska pretpostavka podrazumijeva da se radi o kroničnoj upali koja nastaje kao posljedica abnormalnoga imunološkog odgovora na neki okolišni (egzogeni) čimbenik kod genetski predisponirane osobe.
Genetski čimbenici. Na genetsku osnovu bolesti ukazuje činjenica da se upalna bolest crijeva javlja učestalije unutar nekih obitelji. Najbliži srodnici oboljelih osoba imaju deset do petnaest puta veći rizik od obolijevanja u odnosu na opću populaciju. Do danas je poznato više od 150 genskih lokusa koji mogu biti povezani s pojavom upalne bolesti crijeva od kojih je najmanje 30 specifično za pojavu Crohnove bolesti, a 20 za pojavu ulceroznoga kolitisa. Najčešće genetske promjene koje se povezuju s upalnom bolesti crijeva uključuju mutacije specifičnih gena koji uglavnom sudjeluju u imunoregulacijskim mehanizmima i očuvanju epitelne barijere crijevne sluznice (NOD2/CARD15, ATG16L1, IRGM, OCTN1, DLG5), polimorfizme gena za receptore interleukina IL-10 i IL-23 te prisutnost određenih HLA haplotipova (HLA-DR*103).
Okolišni čimbenici. Bakterije se danas smatraju najvjerojatnijim induktorima (trigerima, okidačima) abnormalnoga imunološkog odgovora koji dovodi do razvija kronične upale kod genetski predisponiranih osoba. Tome u prilog govori nekoliko činjenica: 1) istraživanja na životinjskim modelima pokazala su da se upalna bolest crijeva neće razviti u sterilnim uvjetima, no može se inducirati uvođenjem komenzalnih bakterija; 2) upalna bolest crijeva dominantno zahvaća dijelove probavne cijevi s najvećom koncentracijom bakterija (terminalni ileum, kolon); 3) preusmjeravanje fekalnoga toka dalje od upaljene sluznice crijeva (npr. ileostomija) dovodi do smanjenja intenziteta upale te 4) primjena antibiotika (osobito onih s utjecajem na anaerobne bakterije) dovodi do poboljšanja simptoma kod bolesnika s upalnom bolesti crijeva. Iako su provođena brojna istraživanja, do danas nije poznato koja bi točno bakterija mogla biti odgovorna za razvoj ovoga patološkog procesa. Ostali okolišni čimbenici koji bi mogli imati utjecaj na razvoj upalne bolesti crijeva su: 1) pušenje (ulcerozni kolitis češće se javlja kod nepušača i bivših pušača, dok se Crohnova bolest češće javlja kod pušača), 2) prehrana (ishrana koja uključuje smanjeni unos namirnica s niskom razinom ostataka te visokom razinom šećera povećava rizik od razvoja Crohnove bolesti) te 3) apendektomija (apendektomirani bolesnici imaju značajno nižu učestalost pojavnosti ulceroznoga kolitisa).
Abnormalni imunološki odgovor. Patološki proces započinje ulaskom bakterijskoga antigena u područje lamine proprije što se odvija preko specijaliziranih M-stanica umetnutih između epitelnih stanica, ili kroz mehanička oštećenja epitelne barijere. Antigen-prezentirajuće stanice (APC, engl. antigen presenting cells) prerađuju antigene te ih prezentiraju na svojoj površini što prepoznaju pomoćnički limfociti tipa 1 (Th1). Aktivirani limfociti potom luče medijatore među kojima je najznačajniji interferon-γ, uvjetujući nastanak Th1 obrasca imunološkoga odgovora. Na ovaj način aktiviraju se i druge imunološke i neimunološke stanice s posljedičnim lučenjem različitih citokina (IL-12, IL-23, IL-1, IL-6, TNF-α) koji uvjetuju razvoj upalnoga procesa i posljedičnih patoloških promjena. Ovaj proces prisutan je i kod zdravih pojedinaca, ali je on samoograničavajući i ne rezultira razvojem bolesti. Različiti genetski poremećaji mogu biti odgovori za gubitak ove regulacije i napredovanje navedenoga procesa do bolesti. Do danas nije poznato zašto kod nekih bolesnika ovaj proces rezultira razvojem Crohnove bolesti, kod nekih ulceroznoga kolitisa, odnosno različitim histopatološkim obilježjima.
S obzirom na različitosti u pogledu histopatoloških i kliničkih obilježja, kao i u pristupu dijagnostici i liječenju, Crohnova bolest i ulcerozni kolitis bit će opisani zasebno. Također, prije razmatranja svake bolesti zasebno će biti opisane osnovne karakteristike lijekova korištenih u liječenju tih bolesti.
FARMAKOTERAPIJA UPALNE BOLESTI CRIJEVA
S obzirom na to da se u liječenju Crohnove bolesti i ulceroznoga kolitisa koriste lijekovi iz istih skupina, ovdje će biti opisane njihove osnovne zajedničke karakteristike. Radi se o aminosalicilatima, antibioticima, kortikosteroidima, imunomodulatorima te biološkim lijekovima.
Aminosalicilati su lijekovi čija je glavna farmakološka djelatna (aktivna) tvar 5-aminosalicilna kiselina (5-ASA) koja svoj protuupalni učinak ostvaruje lokalnim (topičkim) djelovanjem na sluznicu crijeva. Dovodi do smanjenja upalnoga odgovora smanjujući lokalnu produkciju proupalnih citokina i medijatora upale, a dovodi i do pojačane ekspresije PPAR nuklearnih receptora (engl. peroxisome proliferate-activated receptor-gamma) koji kontroliraju staničnu proliferaciju i apoptozu u epitelnim stanicama crijeva. Prvi i najpoznatiji predstavnik ove skupine je mesalazin. Glavna je karakteristika peroralne primjene aminosalicilata njihova brza apsorpcija u proksimalni dio tankoga crijeva zbog čega oni ne dostižu u njegove distalnije dijelove. Iz toga su razloga razvijene različite formulacije lijekova koje omogućavaju dospijeće aktivne tvari i u te dijelove crijeva, a to su vezanje 5-ASA s azo-konjugatima, kao i primjena otpornih polimernih ovojnica. 5-ASA vezana za azo-konjugate ne može se apsorbirati u tankom crijevu te tako dospijeva u debelo crijevo gdje se pod utjecajem bakterija koje luče azo-konjuktazu cijepa ta veza i oslobađa se 5-ASA koja potom djeluje na sluznicu crijeva. Primjer tih lijekova su sulfasalazin, balsalazid i olsalazin. Drugi način koji osigurava dospijeće lijeka u distalnije dijelove crijeva je oblaganje mesalazina posebnim ovojnicama koje se otapaju pri pH većim od 7, kakav je u distalnom dijelu tankoga crijeva, ili ovojnicama s posebnim mikrogranulama koje postupno oslobađaju aktivnu tvar (lijekovi s produljenim oslobađanjem). Mesalazin se može primjenjivati i lokalno u obliku supozitorija i mikroklizme. Sulfasalazin se teže podnosi od mesalazina, što potonjemu daje značajnu kliničku prednost. Nuspojave mesalazina su rijetke, a uključuju proljev, glavobolju, mučninu i alergijski osip, dok primjena sulfasalazina može dovesti do oligospermije, malapsorpcije folata, kao i ozbiljnijih nuspojava kao što su pankreatitis, agranulocitoza te Stevens-Johnsonov sindrom.
Antibiotici se često primjenjuju u liječenju upalnih bolesti crijeva, iako provedene meta-analize nisu pokazale njihov značajniji doprinos u izazivanju ili održavanju remisije. Pretpostavlja se da antibiotici mogu dovesti do smanjenja intenziteta upale mijenjanjem bakterijske flore i/ili smanjenjem nastanka sindroma bakterijskoga prerastanja. U ovu svrhu najčešće se primjenjuju metronidazol (10 mg/kg/dan per os) ili ciprofloksacin (2 x 500 mg per os) kroz više tjedana (6 - 12 tjedana).
Kortikosteroidi imaju jednu od ključnih uloga u izazivanju remisije kod bolesnika s upalnom bolesti crijeva, dok ih se treba izbjegavati u terapiji održavanja remisije. Najčešće se koriste u peroralnom obliku (prednizon), ali u težim slučajevima opravdana je i parenteralna primjena (metilprednizolon, hidrokortizon). U liječenju ulceroznoga kolitisa mogu se primjenjivati i topički preparati kao što su hidrokortizonske pjene, mikroklizme ili supozitoriji. Nuspojave koje se mogu javiti tijekom kratkoročne primjene kortikosteroida uključuju dispeptičke tegobe, nesanicu, porast tjelesne težine, hiperglikemiju, pojavu akni te perifernih edema, dok se uz dugotrajnu primjenu kortikosteroida povezuju kušingoidni fenotip (lat. facies lunata, centralni tip debljine), osteoporoza, miopatija, katarakta te imunosupresija. Zbog izražene sklonosti razvoju osteoporoze, svi bolesnici za vrijeme uzimanja kortikosteroidne treapije trebaju uzimati vitamin D te preparate kalcija. U liječenju Crohnove bolesti na raspolaganju nam stoji i budezonid, peroralni kortikosteroid s topičkom (lokalnom) protuupalnom aktivnosti koji ima nisku sistemsku aktivnost zbog izraženoga metabolizma prvoga prolaska kroz jetru (što mu je i glavna prednost pred ostalim preparatima). Budezonid obložen posebno formuliranim ovojnicama koje se otapaju pri pH većem od 7 koristi se u liječenju Crohnove bolesti koja zahvaća distalni ileum i proksimalni kolon.
Imunomodulatori su lijekovi koji se u upalnim bolestima crijeva najčešće koriste kao lijekovi za održavanje remisije, dok samostalno primjenjivani sa svrhom indukcije remisije ne pokazuju značajniji učinak te se obično daju zajedno s biološkim lijekovima kao što TNF-α inhibitori zbog potencijalnoga sinergističnog učinka, ali i smanjenja stvaranja protutijela na biološke lijekove koji dovode do slabljenja njihova učinka. U ovu se svrhu primjenjuju tiopurini (azatioprin, merkaptopurin) te metotreksat.
Tiopurini. Klasični tiopurinski lijekovi koriste se kao lijekovi koji omogućavaju smanjivanje i ukidanje doze kortikosteroida (engl. steroid spraing agents) te održavanje stabilne remisije bolesti. U kliničkoj praksi koriste se azatioprin i merkaptopurin čiji se aktivni metaboliti ugrađuju u stanične nukleinske kiseline i inhibiraju sintezu DNA, RNA i proteina te time u konačnici inhibiraju proliferaciju limfoidnih stanica nakon antigenske stimulacije u lamini propriji. Glavne alergijske nuspojave ovih lijekova su temperatura, osip i artralgije, dok se od nealergijskih reakcija mogu javiti mučnina, povraćanje, hepatotoksičnost, pankreatitis, supresija koštane srži te infekcije. Dugotrajna primjena ovih lijekova povezana je s većom učestalošću razvoja non-Hodgkinovoga limfoma, osobito kod osoba mlađih od 30 godina i starijih od 50 godina. Mutacija gena za tiopurin-metiltrasferazu, enzima koji sudjeluje u metaboliziranju ovih lijekova, može dovesti do razvoja duboke imunosupresije, a s obzirom na to da ima relativno visoku učestalost (homozigoti 1:300, heterozigoti 1:9), preporuča se prije početka terapije odrediti aktivnost navedenoga enzima te sukladno tome prilagoditi dozu lijeka. Kod svih je bolesnika potrebno pratiti vrijednosti krvne slike, kao i jetrenih enzima, za početak na tjednoj bazi, a kasnije na mjesečnoj i tromjesečnoj - ako su vrijednosti stabilne.
Metotreksat je analog dihirofolne kiseline koji u niskim dozama ima protuupalno djelovanje s naglaskom na inhibiciji lučenja TNF-a iz monocita i makrofaga. Primjenjuje se peroralno ili supkutano. Najčešće su mu nuspojave mučnina, povraćanje, stomatitis, pancitopenija, sklonost infekcijama te fibroza plućnoga intersticija i jetre. Uz primjenu metotreksata inicirana je suplementacija vitaminima B skupine. Zbog svoga teratogenog učinka s posebnom se pozornošću treba primjenjivati kod bolesnika u reproduktivnoj dobi te se u slučaju planiranja začeća mora iz terapije isključiti u vremenskom periodu od najmanje šest mjeseci i kod muškaraca i kod žena.
Biološki lijekovi danas čine osnovu liječenja upalnih bolesti crijeva kod bolesnika s umjerenim do teškim oblicima bolesti koji ne reagiraju na druge lijekove (aminosalicilati, kortikosteroidi, imunomodulatori). Na raspolaganju je nekoliko lijekova iz te skupine: TNF-α inhibitori, antiintegrini te anti-IL12/23 protutijela.
TNF-α inhibitori predstavljaju prvu liniju biološkoga liječenja upalne bolesti crijeva. To je skupina monoklonalnih antitijela koja se vežu uz TNF faktor, glavni proupalni citokin u TH1 imunološkom odgovoru kakvoga nalazimo u ovim bolestima, i neutraliziraju njegov učinak. Na raspolaganju je nekoliko TNF-α inhibitor-lijekova: infliksimab, adalimumab, golimumab te certolizumab (Tablica 4.14.). Ozbiljnije nuspojave ovih lijekova relativno su rijetke i jave se kod 2 do 5 % bolesnika, a uključuju septično stanje, razvoj oportunističkih infekcija (tuberkuloza, kandidijaza, histoplazmoza, reaktivacija virusnih infekcija), akutnu jetrenu leziju, optički neuritis, demijelinizacijske poremećaje, pogoršanje srčanoga popuštanja te povećani rizik od nastanka nekih tumora (non-Hodgkinov limfom, karcinom kože). Kod svih bolesnika prije uključenja biološke terapije treba provesti probir za tuberkulozu (PPD test, radiografija pluća) te hepatitis B i C. Tijekom terapije je potrebno pratiti vrijednosti pojedinih lijekova u plazmi, kao i pojavu specifičnih antititijela te sukladno tome prilagođavati terapiju (povišenje doze, skraćenje vremenskoga intervala primjene lijeka, promjena lijeka). Za vrijeme primjene bioloških lijekova bolesnici ne smiju primati živa cjepiva.
|
Tablica 4.14. TNF-α inhibitori
|
|
Lijek
|
Doziranje
|
Napomena
|
|
Infliksimab
|
Početno 5 mg/kg iv u 3 doze (0., 2. i 6. tjedan); nastaviti 5 mg/kg iv svakih 8 tjedana
|
Kod 40 % bolesnika se razviju antitijela na primijenjeni lijek; preporučeno ih je prvih godinu dana koristiti zajedno s imunomodulatorom da se smanji mogućnost za to
|
|
Adalimumab
|
Početno 160 mg sc te 80 mg sc za dva tjedna; nastaviti 40 mg sc svaki drugi tjedan
|
|
Certolizumab
|
Početno 400 mg u tri doze (0., 2. i 4. tjedan); nastaviti 400 mg svaka 4 tjedna
|
Antiintegrini predstavljaju skupinu lijekova koji smanjuju migraciju cirkulirajućih leukocita iz kapilarne mreže u intersticij (laminu propriju). Glavni je predstavnik vedolizumab (anti-α4β7 antitijelo), a indiciran je kada bolesnici ne toleriraju TNF-a ili on postane neučinkovit. Početna doza iznosi 300 mg iv u tri doze (0., 2. i 6. tjedan) nakon čega slijedi održavanje (300 mg iv svakih četiri do osam tjedana). Do sada nije uočena povezanost primjene ovoga lijeka s većom učestalosti infekcija ili tumora. Kod 5 % bolesnika razvijaju se specifična neutralizirajuća antitijela koja dovode do slabljenja učinka. Natalizumab je drugi lijek iz ove skupine (anti-α4 antitijelo) kojega se povezuje s većom učestalosti multifokalne leukoencefalopatije, pa se njegova primjena izbjegava u kliničkoj praksi.
Anti-IL12/23 antitijela predstavljaju novije biološke lijekove koji se koriste u liječenju ovih bolesti. Oni blokiraju učinak interleukina IL12 i IL23 koji imaju proupalno djelovanje. Predstavnik ove skupine lijekova je ustekinumab koji se danas koristi samo za liječenje Crohnove bolesti bez reakcije na ostale terapijske postupke. Početna doza iznosi 5 - 7 mg/kg iv, a potom se primjenjuje u dozi od 90 mg sc svakih osam tjedana. Do sada nije zabilježena veća učestalost pojave oportunističkih infekcija i tumora.
CROHNOVA BOLEST
Definicija i histopatološka obilježja. Crohnova bolest je oblik crijevne upalne bolesti koja može zahvatiti bilo koji dio probavne cijevi s najčešćom ileocekalnom lokalizacijom. Karakteriziraju je upala koja zahvaća cijelu stijenku (transmuralna upala) te preskačuće lezije (izmjena bolesnih i zdravih dijelova crijevne stijenke). U ranim fazama bolesti histološkom slikom dominira akutni upalni infiltrat (polimorfonukleari) koji prožima laminu propriju s razvojem kriptitisa i kriptalnih apscesa. S napredovanjem bolesti dolazi do limfocitne infiltracije i promjene kriptalne arhitekture (kripte postaju skraćene i iskrivljene). Karakteristična je i pojava nekazeoznih granuloma koji se mogu naći u više od 15 % endoskopskih uzetih uzoraka te u više od 70 % kirurških preparata reseciranoga crijeva. Transmuralna zahvaćenost može rezultirati fibroziranjem i razvojem striktura zahvaćenoga crijevnog segmenta (ožiljkavanje), a veća je i učestalost nastanka fistula i apscesa. Crohnova bolest pokazuje karakterističnu anatomsku distribuciju: u 40 do 60 % slučajeva bolest je ograničena na terminalni ileum i cekum; izolirana bolest tankoga crijeva nađe se u oko 30 % slučajeva; izolirana bolest debeloga crijeva u oko 20 % slučajeva, dok perianalnu bolest i zahvaćanje gornjih dijelova probavne cijevi (jednjak, želudac) nalazimo u manje od 10 % slučajeva.
Klinička slika. Kliničke manifestacije Crohnove bolesti posljedica su kroničnoga upalnog procesa (opći simptomi), anatomske lokalizacije bolesti (lokalni simptomi) te prisustva komplikacija ili ekstraintestinalnih manifestacija bolesti. Bolest karakterizira intermitentni tijek, odnosno smjene aktivnih faza bolesti i faza remisije.
Opći simptomi posljedica su naravi same bolesti te uključuju umor i malaksalost, povremena febrilna stanja, smanjeni tek te gubitak na tjelesnoj težini (što može biti i posljedica malapsorpcije, osobito ako je bolest zahvatila veći dio tankoga crijeva).
Lokalni simptomi ovise o anatomskoj lokalizaciji bolesti. Najčešći lokalni simptomi uključuju bol u desnom donjem kvadrantu abdomena (ileocekalna zahvaćenost) praćen pojavom proljevastih stolica. Bol je obično grčevita karaktera i najjači je pred defekaciju, dok nakon defekcije bolesnici navode olakšanje. Bol u epigastriju, mučnina i povraćanje javljaju se kod zahvaćenosti gornjih dijelova probavne cijevi, dok se bol u donjem dijelu trbuha povezan s poremećajima pražnjenja crijeva (dijareja, konstipacija) javlja kod zahvaćenosti donjih dijelova probavne cijevi. Periumbilikalni bol s izraženim znacima malapsorpcijskoga sindroma ukazuje na dominantnu zahvaćenost tankoga crijeva. Zahvaćenost analne regije prezentira se pojavom perianalnih fistula i fisura.
Komplikacije. Prvo očitovanje bolesti nekada može biti lokalna komplikacija ili se ona nadovezuje na postojeće simptome. Glavne lokalne komplikacije su intestinalna opstrukcija, fistulacija te intraabdominalni apscesi. Kao i kod ulceroznoga kolitisa, veći je rizik od razvoja karcinoma kolona (kasnije opisano).
Intestinalna opstrukcija u akutnoj fazi posljedica je edema crijevne stijenke, dok u kroničnoj fazi nastaje uslijed ožiljkavanja i stvaranja striktura. Klinički dominiraju simptomi i znakovi otežane pasaže crijeva (povraćanje, izostanak stolice, meteorizam).
Fistule nastaju širenjem upalnoga procesa prema okolnim strukturama pri čemu nastaju patološki spojevi između crijeva i okolnih organa. Enteroenteralne fistule uglavnom su asimptomatske i ostaju neprepoznate. Enterokolične fistule mogu dovesti do razvoja malapsorpcijskoga sindroma uslijed razvoja sindroma bakterijskoga prerastanja (migracija bakterija iz kolona u tanko crijevo) te brzim odlaskom hrane iz tankoga crijeva u kolon kada su fistule većeg opsega. Kologastrične i koloduodenalne fistule mogu uzrokovati miserere. Enterovezikalne fistule praćene su dizurijom, učestalim infekcijama mokraćnih puteva, fekalourijom te pneumaturijom. Enterovaginalne i rektovaginalne fistule očituju se dispareunijom i fekalnim vaginalnim iscjetkom. Enterokutane fistule su rijetke i nalaze se u području kirurških ožiljaka.
Intraabdominalni apscesi praćeni su pojavom abdominalnoga bola, septičkim temperaturama i palpatornom bolnom rezistencijom. Apscesi u području ileuma mogu penetrirati u retroperitoneum i uzrokovati opstrukciju uretera s posljedičnom hidronefrozom, a mogu prodrijeti i u muskulus psoas uzrokujući psoasni apsces praćen bolovima u kuku, koljenu i bedru.
Ekstraintestinalne manifestacije. Više od 50 % bolesnika s Crohnovom bolesti ima i neku ekstraintestinalnu manifestaciju, od kojih se neke tipično javljaju u vrijeme aktivne faze bolesti, dok se neke javljaju i u fazi remisije (prikazano u Tablici 4.15.).
|
Tablica 4.15. Ekstraintestinalne manifestacije upalne bolesti crijeva
|
|
Manifestacije koje se javljaju u fazi aktivne bolesti
|
Manifestacije koje se javljaju u fazi remisije bolesti
|
|
Konjuktivitis, iritis, episkleritis
Aftozni stomatitis
Artritis i artalgije
Erythema nodosum
Pyoderma gangrenosum
Masna promjena jetre
Tromboembolijski incidenti
|
Autoimuni hepatitis
Primarni sklerozirajući kolangitis
Kolelitijaza i kolecistitis
Sakroileitis/ankilozirajući spondilitis
Osteoporoza, osteomalacija
Amiloidoza
Oksalatna nefrolitijaza
|
Diferencijalna dijagnoza uključuje široki spektar bolesti i stanja sa sličnim kliničkim očitovanjima. To su infekcijski gastroenteritis (Campylobacter jejuni, Clostridium difficile, Salmonella, Shigella, Yersinia spp., Histoplasma capsulatum, Entamoeba hystolitica), specifični upalni procesi (apendicitis, divertikulitis, mezenterijalni limfadenitis, eozinofilni enteritis), lijekovi i toksini (nesteroidini protuupalni lijekovi, pankreatični enzimi), sistemski vaskulitisi (Behcetova bolest, Churg-Straussov sindrom, poliarteritis nodoza, sistemski eritematozni lupus), postradijacijski enteritis, neoplazme probavne cijevi, ginekološka patologija (endometrioza, tuboovarijski apsces) i sl.
Dijagnoza Crohnove bolesti postavlja se na temelju anamneze, fizikalnoga nalaza, laboratorijske dijagnostike i specifičnih dijagnostičkih postupaka (endoskopska i radiološka dijagnostika).
Standardni laboratorijski nalazi imaju ulogu u otkrivanju i procjeni težine malapsorpcijskoga stanja te aktivnosti upalnoga procesa. Na malapsorpciju nam ukazuju nalaz anemije, snižene serumske vrijednosti željeza, folne kiseline i vitamina B12 te hipoalbuminemija. U aktivnoj fazi bolesti obično nalazimo leukocitozu (iako ona može biti i posljedica primjene kortikosteroida), povišene vrijednosti C-reaktivnoga proteina (iako kod jedne trećine bolesnika on može biti i uredan) te ubrzana sedimentacija eritrocita.
Specifični laboratorijski nalazi podrazumijevaju određivanje seroloških markera bolesti te mjerenje fekalnoga kalprotektina. Kod 40 do 70 % bolesnika s Crohnovom bolesti nalazimo pozitivna ASCA antitijela (anti-Saccharomyces cerevisiae protutijela), a kod 20 % bolesnika nalazimo pozitivna pANCA antitijela (perinuklearna antineutrofilna citoplazmatska antitijela). U novije vrijeme određuju se i specifična antimikrobna antitijela kao što su anti-I2, anti-Cbir1 te anti-OmpC. Fekalni kalprotektin protein je koji se oslobađa iz polimorfonukleara te njegove povišene vrijednosti u stolici sugeriraju na aktivnost upalne bolesti crijeva. Osim u postavljanju dijagnoze, bitnu ulogu ima i u praćenju terapijskoga odgovora. Kod zdravih osoba vrijednosti kalprotektina manje su od 30 µg/g, dok su kod bolesnika s upalnom bolesti crijeva one obično veće od 200 µg/g. Povišene vrijednosti mogu se naći i i uslijed drugih poremećaja, kao što su divertikulitis, polipi, karcinom, infektivni enterokolitis i sl., dok su uredni kod funkcionalnih bolesti (npr. sindrom iritabilnoga kolona).
Mikrobiološka obrada stolice. Zbog isključivanja infektivne etiologije kod svih bolesnika potreban je pregled stolice na bakterije, parazite te toksin i antigen Cl. difficile.
Endoskopska dijagnostika ključna je u postavljanju dijagnoze Crohnove bolesti. Ovisno o dominaciji simptoma izvodi se gastroskopija ili kolonoskopija ili obje. Inicijalne vizualne promjene u Crohnovoj bolesti podrazumijevaju male i plitke ulceracije sluznice (tzv. aftozne ulceracije) koje s progresijom bolesti postaju dublje, a mogu poprimiti nekoliko oblika (okrugle, linearne, valovite). Presijecanjem longitudinalnih i transverzalnih linearnih ulceracija nastaje kaldrmasti (engl. cobblestone) izgled sluznice zahvaćenoga dijela. Karakteristična je smjena zdravih i patološki promijenjenih dijelova sluznice što nazivamo preskačuće lezije. Svaku sumnjivu leziju potrebno je bioptirati, a ključnu ulogu u donošenju dijagnoze ima patohistološki nalaz. Kod neuvjerljivih lezija trebaju se uzeti barem po dvije biopsije s pet lokacija duž kolona, uključujući rektum.
Radiološka dijagnostika služi kao nadopuna endoskopskom pregledu i može imati ključnu ulogu u dijagnostici intestinalnih komplikacija bolesti, kao i kod zahvaćenosti dijelova tankoga crijeva koji nisu dostupni endoskopskom pregledu. Danas se najčešće primjenjuje CT ili MR enterografija koja može ukazati na prisutnost ulceracija, striktura i fistula, što su karakteristike ove bolesti. Osim toga, može se procijeniti i debljina i prokrvljenost crijevne stijenke te zadebljanje sluznice. Pretraga probavne cijevi klasičnom radiografijom uz primjenu barijeve kaše danas se rijetko izvodi (ako navedene pretrage nisu dostupne).
Procjena aktivnosti Crohnove bolesti. CDAI bodovni sistem (engl. The Crohn's disease activity indeks) predstavlja zlatni standard za određivanje aktivnosti Crohnove bolesti unatoč svojim manjkavostima (nije primjenjiv kod djece, ni kod bolesnika s perianalnom bolesti). Aktivnost bolesti temelji se na procjeni osam varijabli kojima se definira ukupni CDAI zbroj (engl. score). Na osnovi broja bodova razlikujemo tri kategorije bolesti: blaga bolest (150 do 220 bodova), umjerena bolest (220 do 450 bodova) te teška bolest (više od 450 bodova) – Tablica 4.16.
|
Tablica 4.16. CDAI bodovni sistem za procjenu aktivnosti (težine) Chronove bolesti
|
|
Kliničko-laboratorijska varijabla
|
Faktor težine
|
|
Broj tekućih ili mekanih stolica svaki dan tijekom 7 dana
|
x 2
|
|
Bol u trbuhu (graduirano po jačini od 0 do 3) svaki dan tijekom 7 dana
|
x 5
|
|
Subjektivna procjena stanja od 0 (dobro stanje) do 4 (izuzetno loše stanje) svaki dan tijekom 7 dana
|
x 7
|
|
Postojanje komplikacija i ekstraintestinalnih manifestacija
|
x 20
|
|
Uzimanje antidijarejalnih preparata
|
x 30
|
|
Nalaz patorezistencije u trbuhu (0 ako nema, 2 pri sumnji, 5 siguran nalaz)
|
x 10
|
|
Odstupanje vrijednosti hematokrita 47 % za muškarce i 42 % za žene
|
x 6
|
|
Postotak odstupanja od standardne težine
|
x 1
|
Liječenje Crohnove bolesti uključuje opće mjere (prehrana i simptomatsko liječenje), medikamentno i kirurško liječenje. Glavni terapijski cilj je postizanje kliničke remisije bolesti kod ovih bolesnika, smanjenje njezine progresije te sprečavanje ili odgađanje pojave komplikacija.
Prehrana i simptomatsko liječenje. Bolesnici s Crohnovom bolesti morali bi imati dobro uravnoteženu prehranu s ustaljenim načinom prehrane (izbjegavati veće obroke, uzimati manje, ali češće obroke). Masna i pržena hrana, kao i obroci bogati laktozom, često pogoršavaju lokalne simptome uslijed sekundarne maldigestije. Za sve bolesnike kojima se ne može osigurati odgovarajuća opskrba nutrijentima i kalorijama klasičnim obrocima indicirana je dodatna, suplementalna enteralna prehrana ili parenteralna prehrana (parcijalna, totalna). Simptomatska terapija temelji se na odgovarajućoj rehidraciji, primjeni antidijarealnih lijekova (loperamid, kolestiramin), analgospazmolitika i dr.
Medikamentozno liječenje temelji se na primjeni lijekova iz nekoliko skupina: aminosalicilati, antibiotici, kortikosteroidi, imunomodulatori (azatioprin, merkaptopurin, metotreksat) te biološki lijekovi (anti-TNF lijekovi, antiintegrini, anti-IL12/IL-23 antitijela). Izbor lijekova ovisi o težini i anatomskoj distribuciji bolesti. U daljnjemu tekstu bit će opisana osnovna načela primjene pojedinih lijekova u liječenju Crohnove bolesti. Liječenje se provodi u dva dijela, a to su indukcija remisije te kasnije održavanje remisije.
Indukcija remisije. Primjena aminosalicilata i antibiotika u indukciji remisije kod bolesnika s Crohnovom bolesti danas više nije opravdana te se ona temelji na primjeni kortikosteroida ili primjeni bioloških lijekova.
Kortikosteroidi su danas najčešće korišteni lijekovi za indukciju remisije bolesnika s Crohnovom bolesti. Oni se primjenjuju peroralno ili parenteralno, ovisno o kliničkom stanju bolesnika. Od peroralnih pripravaka koristimo budezonid i prednizon. Budezonid je opravdan samo za liječenje blage do umjerene bolesti koja zahvaća terminalni ileum i ascedentni kolon i to po shemi 9 mg/dan kroz osam tjedana nakon čega se postupno doza snižava za 3 mg svaki drugi tjedan. Za blagu do umjerenu Crohnovu bolest ostalih lokalizacija (distalni kolon ili proksimalno tanko crijevo), kao i za sve umjereno do teške oblike bolesti, primjenjuje se potentniji prednizon u dozi od 40 mg/dan kroz dva tjedana nakon čega se postupno smanjuje za 5 mg svaki tjedan. Navedenim režimom primjene kortikosteroidne terapije remisija se postiže kod više od 80 % bolesnika kroz osam do šesnaest tjedana liječenja, no oko 50 % tih bolesnika imat će relaps bolesti unutar godine dana. Kod bolesnika kod kojih se nakon snižavanja doze kortikosteroida pogoršava klinička slika i koji zahtijevaju njihovu dugotrajniju primjenu indiciran je nastavak liječenja imunomodulatorima i/ili biološkim lijekovima (održavanje remisije). Za bolesnike kod kojih se ne može postići remisija primjenom kortikosteroida inicirana je indukcija temeljena na biološkim lijekovima (u kombinaciji s imunomodulatorima). Kod bolesnika s klinički izraženim simptomima u početnom liječenju mogu se primjenjivati i parenteralni kortikosteroidi. Prije početka takvoga oblika liječenja potrebno je učiniti CT abdomena kako bi se isključilo postojanje intraabdominalnoga apscesa koji ima sličnu kliničku prezentaciju, a zahtijeva kirurški tretman.
Biološki lijekovi danas imaju sve veći značaj u indukciji remisije Crohnove bolesti. Prijašnji stav da se oni koriste kao druga linija u indukciji remisije danas se napušta i sve je više preporuka koje sugeriraju da bi se ove lijekove trebalo primijeniti već u prvoj liniji liječenja kod bolesnika s umjerenim do teškim oblikom bolesti, fistulirajućim oblikom bolesti te kod postojanja ekstraintestinalnih manifestacija. U ovu se svrhu u prvom redu koriste TNF-α inhibitori: infliksimab, adalimumab te certolizumab. Oni se obično kombiniraju s imunomodulatorima (azatioprin ili metotreksat) što povećava uspješnost postizanja remisije i smanjuje utjecaj neutralizirajućih antitijela na biološke lijekove koji bi doveli do slabljenja odgovora biološke terapije, ali se tu kombinaciju ne preporuča koristiti dulje od godine dana zbog povećanoga rizika od razvoja limfoproliferativnih bolesti i oportunističkih infekcija (osobito kod bolesnika mlađih od 30 i starijih od 60 godina). Doze lijekova navedene su prethodno u opisu općih karakteristika lijekova korištenih u liječenju upalnih bolesti crijeva.
Održavanje remisije. Nakon postizanja remisije potrebno je odlučiti kod kojih se bolesnika treba nastaviti s terapijom održavanja remisije, a kod kojih se to i ne mora. Načelno gledano, velik dio bolesnika nakon postizanja remisije i prekida uzimanja lijekova razvije relaps bolesti. Bolesnici s dobrom prognozom (starija dob kod postavljanja dijagnoze, odsutnost perianalnih manifestacija, promjene ograničene na ileum i cekum, nepušači) u pravilu ne moraju nužno zahtijevati terapiju održavanja remisije, nego se samo redovno kontroliraju, dok bolesnici s lošijom prognozom (mlađa dob kod postavljanja dijagnoze, ekstenzivno zahvaćanje tankoga i debelog crijeva, perianalne manifestacije, pušači), kao i oni koji za postizanje remisije zahtijevaju prolongiranu primjenu kortikosteroida, zahtijevaju nastavak terapije održavanja remisije. Cilj ove terapije je smanjiti progresiju bolesti i potrebu za kortikosteroidima. U ovu svrhu danas koristimo imunomodulatore te biološke lijekove (anti-TNF lijekovi, antiintegrini, anti-IL12/IL-23 antitijela).
Imunomodulatori (azatioprin, merkaptopurin, metotreksat) među najčešće su korištenim lijekovima u održavanju remisije kod ovih bolesnika. Liječenje imunomodulatorima je dugotrajno s obzirom na to da je stopa relapsa bolesti nakon prekida njihova uzimanja visoka. Azatioprin se primjenjuje u dozi od 2,5 mg/kg/dan per os, merkaptopurin u dozi od 1,5 mg/kg/dan per os, a metotreksat u dozi od 25 mg supkutano jednom tjedno kroz dvanaest tjedana nakon čega se doza smanjuje na 12,5 mg 1 x tjedno. Za vrijeme primjene tih lijekova potrebno je provoditi redovne kontrole kako bi se na vrijeme uočile moguće nuspojave (npr. pancitopenija kod primjene azatioprina ili merkaptopurina uslijed manjka enzima tiopurin-metil-transferaze).
TNF-α inhibitori predstavljaju temelj biološkoga liječenja Crohnove bolesti. Osim opisane primjene u cilju postizanja remisije, koriste se i kao terapija za održavanje remisije. U većini se slučajeva primjenjuju kada se ciljevi indukcije i/ili održavanja remisije ne mogu postići primjenom kortikosteroida i imunomodulatora, iako se sve više zastupa njihova rana upotreba u liječenju ovih bolesnika, osobito onih s težim oblicima i čimbenicima loše prognoze. U tu se svrhu može primjenjivati infliksimab (5 mg/kg iv svakih osam tjedana), adalimumab (40 mg sc svaka dva tjedna) ili certolizumab (400 mg sc svaka četiri tjedna). Primjena ovih lijekova dokazano pomaže u smanjenju progresije bolesti, oporavku sluznice te smanjenjem broja hospitalizacija, kao i potrebe za kirurškim liječenjem. Slabljenje učinka ovih lijekova može se očekivati nakon dužega vremena njihove primjene, a najčešći je razlog razvoj neutralizirajućih antitijela. Zbog toga se u ovim situacijama određuje koncentracija lijeka u serumu te prisutnost antitijela na ove lijekove. Ako se dokaže prisutnost tih antitijela, indicirana je promjena TNF-α inhibitora, a ako se nađe smanjena koncentracija lijeka bez dokaza antitijela, može se povećati doza lijeka ili se može smanjiti vremenski interval između davanja lijeka.
Novi biološki lijekovi za liječenje Crohnove bolesti su antiintegrini (vedolizumab) te anti-IL12/IL23 antitijela (ustekinumab). Ti se lijekovi koriste kao druga linija u biološkome liječenju Crohnove bolesti kada se dokaže smanjena učinkovitost TNF-α inhibitora, njihova kontraindiciranost ili ih bolesnici ne podnose. Vedolizumab (anti-α4β7 antitijelo) smanjuje regrutaciju leukocita u područje upaljenoga crijeva, dok ustekinumab ometa funkciju IL12 i IL13. Oba se lijeka mogu koristiti i u indukciji remisije bolesti.
Kirurško liječenje. Prije uvođenja biološke terapije u liječenje Crohnove bolesti više od 80 % bolesnika zahtijevalo je u svome kliničkom tijeku kiruršku intervenciju, no uvođenjem ovih lijekova taj se postotak značajno smanjio. Glavne indikacije za kirurško liječenje su neuspjeh medikamentoznoga liječenja i razvoj intestinalnih komplikacija (intestinalna opstrukcija, krvarenje, fistule, intraabdominalni apsces). U kirurškom liječenju najčešće se primjenjuje strikturoplastika, rjeđe resekcija zahvaćenoga crijeva (učestale resekcije crijeva dovele bi do značajnoga smanjenja duljine crijeva). Nakon operacije se preporuča kod svih bolesnika nastaviti terapiju održavanja koja uključuje primjenu metronidazola u dozi od 3 x 250 mg kroz tri mjeseca u kombinaciji s dugotrajnom primjenom imunomodulatora, s ciljem ponovnoga recidiva bolesti.
Prognoza. Neliječena bolest progresivnoga je karaktera te će dovesti do razvija intestinalnih komplikacija koje će zahtijevati operativno liječenje. Čak do 50 % oboljelih osoba zahtijevat će neki od kirurških postupaka unutar prvih pet godina bolesti. Loši prognostički čimbenici uključuju mlađu životnu dob kod postavljanja dijagnoze (< 20 godina), ekstenzivno zahvaćanje tankoga crijeva, perianalne manifestacije bolesti i verificirane ulceracije na endoskopskom pregledu. Uz pridržavanje liječenja i redovne kontrole većina bolesnika se suživi s bolesti i vodi normalan život.
ULCEROZNI KOLITIS
Definicija i histopatološka obilježja. Ulcerozni kolitis je oblik crijevne upalne bolesti koju karakterizira zahvaćenost kolona u kontinuitetu počevši od rektuma prema proksimalnim dijelovima te patološke promjene ograničene samo na mukozu i submukozu (superficijalna upala). Početnu fazu bolesti karakterizira edematozna i hiperemična sluznica granuliranoga izgleda, a kako bolest napreduje tako se pojavljuju ulceracije sluznice koje i predstavljaju osnovnu karakteristiku bolesti. Bolest započinje u rektumu i kontinuirano se širi proksimalno zahvaćajući lijevi i desni hemikolon. Kod polovine bolesnika bolest zahvaća cijeli lijevi hemikolon (rektum, sigmoideum, kolon descendens), dok je kod ostalih bolest ograničena samo na rektosigmoid ili se radi o zahvaćenosti cijeloga kolona (ekstenzivni kolitis). Histopatološki nalaz u akutnoj fazi podrazumijeva nekrozu epitela te upalni infiltrat sačinjen od polimorfonukleara (neutrofila) koji prožimaju laminu propriju i formiraju kriptalne apscese. U kroničnoj fazi upalni infiltrat čine limfociti, nalazimo poremećenu arhitekturu kripti uz gubitak vrčastih stanica te karakteristične postinflamatorne pseudopolipe koji predstavljaju područja ostatne normalne ili hipertrofirane sluznice okružene atrofičnim arealima.
Klinička slika. Kliničke manifestacije ulceroznoga kolitisa uključuju pojavu općih i lokalnih simptoma čiji intenzitet ovisi o težini i proširenosti bolesti, pojavu komplikacija bolesti te ekstraintestinalnih manifestacija koje su jednake kao i kod Crohnove bolesti. Kao i kod Crohnove bolesti, klinički tijek obilježen je smjenama faza pogoršanja simptoma (egzacerbacija) i faza smirenja simptoma (remisija).
Opći simptomi nisu tako izraženi kao kod Crohnove bolesti, ali bolesnici se mogu žaliti na umor i malaksalost, febrilno stanje i gubitak na tjelesnoj težini. Opće loše stanje bolesnika proizlazi iz dehidracije i anemije uslijed gubitka tekućine i krvi učestalim proljevastim stolicama prije nego zbog malapsorpcije.
Lokalni simptomi dominiraju kod bolesnika s ulceroznim kolitisom, a obuhvaćaju učestale sluzavo-krvave stolice i/ili rektalno krvarenje, grčevite bolove poglavito u donjemu abdomenu te bolni nagon za defekcijom (tenezmi). Neki bolesnici mogu imati i konstipaciju uslijed izraženoga edema sluznice izlaznoga dijela rektuma.
Komplikacije. S obzirom na to da je upalni proces kod ulceroznoga kolitisa ograničen na površinski sloj stijenke crijeva, komplikacije kao što su fistulacije koje nalazimo kod bolesnika s Crohnovom bolesti nisu karakteristične i ovdje. Najznačajnije komplikacije ulceroznoga kolitisa su toksični megakolon, perforacija kolona te nastanak karcinoma kolona (posebno opisano).
Toksični megakolon teška je komplikacija koja se razvija uslijed širenja upalnoga procesa na mišićni sloj stijenke crijeva zbog čega ona postaje paralitična i hipotonična što uvjetuje njezino širenje (megakolon), a dolazi i do prodora bakterija i toksina kroz kapilare proširene uslijed upale pri čemu nastaje septikemija i toksemija. Klinički se manifestira teškim općim stanjem koje uključuje povišenu tjelesnu temperaturu, prostraciju, znakove hemodinamske nestabilnosti (hipotenzija, tahikardija, oligurija) uz izraženu bolnost i napetost trbušne stijenke. Nativna snimka abdomena pokazuje izrazito distendirane vijuge kolona (preko 8 cm). Toksični megakolon predstavlja hitno stanje koje se mora kirurški zbrinjavati.
Perforacija kolona javlja se najčešće kao komplikacija toksičnoga megakolona. Očituje se naglim pogoršanjem općega stanja, abdominalnim bolom, distenzijom i bolnom osjetljivošću abdomena te tahikardijom i povišenom temperaturom. Dijagnosticira se radiološki (srp zraka pod ošitom), a liječenje je kirurško.
Diferencijalna dijagnoza. Sličnu kliničku prezentaciju mogu imati i neke druge bolesti i stanja: infekcijski kolitis (bakterije, virusi, paraziti), proktitis u sklopu spolno prenosivih bolesti (gnoreja, klamidijska infekcija, herpesna infekcija), ishemijski kolitis (osobito kod starijih bolesnika s kardiovaskularnom patologijom), postradijacijski kolitis te Crohnova bolest (perianalna bolest).
Dijagnoza ulceroznoga kolitisa temelji se na anamnezi, fizikalnom pregledu (obvezan digitorektalni pregled), laboratorijskim nalazima, endoskopskim i radiološkim pretragama.
Laboratorijski nalazi bolesnika s ulceroznim kolitisom su nespecifični. Na aktivnost i težnu bolesti ukazuju vrijednosti hematokrita (anemija); sedimentacije eritrocita, vrijednosti leukocita i C-reaktivnoga proteina (aktivnost bolesti) te serumskih proteina i albumina (težina bolesti). Serološki markeri imaju manji dijagnostički značaj nego što je to slučaj kod Crohnove bolesti. Pozitivna antitijela na Saccharomyces cerevisiae (ASCA) nalazimo kod manje od 15 % bolesnika s ulceroznim kolitisom. Kao i kod Crohnove bolesti, na upalnu aktivnost bolesti ukazuju povišene vrijednosti fekalnoga kalprotektina.
Mikrobiološka obrada stolice indicirana je za sve bolesnike sa sumnjom na ulcerozni kolitis, s ciljem isključenja drugih mogućih uzroka (diferencijalna dijagnoza).
Endoskopska dijagnostika ima ključno mjesto u postavljanju konačne dijagnoze ulceroznoga kolitisa. Za sve je bolesnike indicirana kolonoskopija, dok se rektosigmoidoskopija primjenjuje samo u iznimnim slučajevima (bolesnikovo stanje, toksični megakolon i sl.). Endoskopijom se omogućava vizualizacija unutrašnjosti stijenke kolona te uočavanje karakterističnih promjena i njihovoga rasporeda (kontinuirana zahvaćenost od rektuma proksimalno). U akutnoj fazi sluznica je edematozna, hiperemična, granulirana s pojavom ulceracija te kontaktnoga krvarenja. U kroničnoj fazi crijevni lumen je sužen, sluznica atrofična s ožiljcima zacijeljenih ulkusa te se mogu naći pseudopolipi. Sve suspektne promjene se bioptiraju te patohistološki analiziraju, a tipični mikroskopski nalaz opisan je gore u tekstu. Kod bolesnika s teškom kliničkom slikom kod kojih postoji sumnja na razvoj toksičnoga megakolona endoskopska dijagnostika je kontraindicirana zbog mogućnosti nastanka perforacije kolona.
Radiološka dijagnostika ima ograničen značaj kod ovih bolesnika. Kod bolesnika s akutnom kliničkom slikom kojom dominira osjetljivost trbušne stijenke zahtijeva nativni radiološki snimak abdomena zbog uočavanja distenzije kolona (toksični megakolon). Irigografija, odnosno naprednije metode kao što su CT ili MR kolonografija, mogu imati dijagnostički značaj kod bolesnika koji imaju strikturu kolona jer se na taj način najbolje može odrediti duljina suženoga dijela, kao i dobiti uvid u karakteristike same stijenke (zadebljanje i sl.).
Procjena težine ulceroznoga kolitisa. Na temelju kliničkih i laboratorijskih pokazatelja te endoskopskoga nalaza razlikujemo tri stupnja aktivnosti bolesti: blaga bolest, umjerena bolest i teška bolest (Tablica 4.17.).
|
Tablica 4.17. Procjena težine ulceroznoga kolitisa
|
|
Karakteristika
|
Blaga bolest
|
Umjerena bolest
|
Teška bolest
|
|
Učestalost stolice/dan
|
< 4
|
4 - 6
|
> 6
|
|
Krv u stolici
|
Malo
|
Umjereno
|
Dosta
|
|
Frekvencija pulsa/min
|
< 90
|
90 - 100
|
> 100
|
|
Hematokrit ( %)
|
Uredan
|
30 - 40
|
< 30
|
|
Gubitak na težini ( %)
|
Bez gubitka
|
1 - 10
|
> 10
|
|
Temperatura (℃)
|
Normalna
|
< 37,5
|
> 37,5
|
|
Sedimentacija eritrocita (mm/h)
|
< 20
|
20 - 30
|
> 30
|
|
Albumini (g/dL)
|
Uredni
|
3 - 3,5
|
< 3
|
|
Endoskopski nalaz
|
Hiperemija, edem, fina granuliranost
|
Gruba granuliranost, kontaktno krvarenje
|
Ulceracije, spontano krvarenje
|
Liječenje. Kao i kod Crohnove bolesti, dva osnovna cilja liječenja su postizanje remisije te sprečavanje ponovnoga relapsa bolesti. Temelj liječenja kod većine bolesnika čine aminosalicilati koji su se pokazali učinkovitima u indukciji remisije kod gotovo svih bolesnika s blagom do umjerenom bolesti, kao i za njezino održavanje u svih oblika bolesti (blaga, umjerena, teška). Terapijski pristup u prvome redu ovisi o težini bolesti te o stupnju zahvaćenosti crijeva što je zasebno opisano.
Blagi do umjereni distalni kolitis. Lokalna primjena aminosalicilata (supozitoriji) predstavlja prvu liniju liječenja ovih bolesnika, a ima visoku stopu učinkovitosti. U tu se svrhu najčešće koristi mesalazin u obliku supozitorija (1000 mg/dan) ili mikroklizme (4 g/dan) kroz četiri do osam tjedana. Uz ovaj način liječenja u više od 75 % bolesnika postiže se povlačenje simptoma (remisija bolesti). Lokalna primjena kortikosteroida (mikroklizma hidrokortizona u dozi od 80 - 100 mg/dan) manje je učinkovita od liječenja mesalazinom. Kod bolesnika koji ne reagiraju na lokalnu primjenu mesalazina u monoterapiji može se primijeniti neka od drugih terapijskih opcija: 1) dodatak peroralnoga aminosilacilata, 2) kombinacija lokalne primjene mesalazina (navečer) i kortikosteroida (ujutro) ili 3) kombinacija lokalne primjene mesalazina i kortikosteroida uz peroralnu primjenu aminosalicilata. Ako bolesnici ne reagiraju na navedene terapijske opcije za izazivanje remisije, opravdana je i primjena peroralnih kortikosteroida (prednizon) ili biološke terapije. Nakon postizanja remisije preporuča se nastavak lokalne primjene aminosalicilata (meslazina) u svrhu njezinoga održavanja. Lokalna primjena kortikosteroida nije opravdana kao terapija za održavanje remisije kod ovih bolesnika.
Blagi do umjereni pankolitis. Terapijski pristup ovim bolesnicima je stupnjevit te počinje od peroralne primjene aminosalicilata preko kortikosteroida i imunomodulatora do biološke terapije. Prvu liniju liječenja čini peroralna primjena aminosalicilata kroz četiri do osam tjedana, a koja dovodi do remisije u 50 do 70 % slučajeva. Najčešće se primjenjuje mesalazin u dozi od 2,4 do 4,8 g/dan, dok se sulfazalazin (2 x 1,5 g/dan) drži kao alternativa zbog veće učestalosti nuspojava. Kod bolesnika koji ne reagiraju na opisanu terapiju indicirana je peroralna kortikosteroidna terapija, najčešće prednizonom u početnoj dozi od 40 do 60 mg/dan kroz prva dva tjedna nakon čega se postupno snižava za 5 - 10 mg/tjedan. Kod oko 30 % bolesnika koji nisu reagirali na primjenu aminosalicilata neće se postići poboljšanje niti uz kortikosteroide, ili će se bolest vratiti odmah po snižavanju početne doze. Kod takvih je bolesnika opravdana primjena imunomodulatora kao što su azatioprin 2,5 mg/kg/dan ili merkaptopurin 1,5 mg/kg/dan (metotreksat se nije pokazao učinkovitim kod bolesnika s ulceroznim kolitisom). Za bolesnike kod kojih se ne može postići remisija konvencionalnim načinom liječenja prethodno navedenim lijekovima (aminosalicilati, kortikosteroidi, imunomodulatori), inidicirana je primjena TNF-α inhibitora, najčešće infliksimaba u početnoj dozi od 5 mg/kg iv kroz tri navrata (0., 2. i 6. tjedan) uz nastavak primjene iste doze svakih osam tjedana. Tijekom prve godine preporuča se kombinirana primjena TNF-α inhibitora zajedno s nekim imunomodulatornim lijekom (azatioprin ili merkaptopurin). Za bolesnike koji ne reagiraju niti na TNF-α inhibitore danas je opravdana primjena vedolizumaba (antiintegrin) u početnoj dozi od 300 mg iv u tri navrata (0., 2. i 6. tjedan) uz nastavak primjene 300 mg iv svakih osam tjedana. Nakon postizanja remisije kod svih je bolesnika potrebno provoditi terapiju održavanja koja se temelji na primjeni aminsalicilata u prvoj liniji ili primjeni imunomodulatora ili bioloških lijekova u drugoj liniji (ovisno o tome kojim se lijekom postigla remisija). Primjena kortikosteroida u terapiji održavanja remisije nije opravdana.
Teški i fulminantni oblik bolesti. Kod oko 15 % bolesnika klinički tijek bolesti komplicira se razvojem teškoga oblika ulceroznoga kolitisa koji je obilježen teškom prostracijom, febrilnim stanjem, hipovolemijskim šokom te izraženom crijevnom distenzijom i osjetljivošću trbušne stijenke. Kod svih je takvih bolesnika indicirana hospitalizacija te mjere intenzivnoga liječenja. One uključuju odgovarajuću volumnu resuscitaciju, transfuzijsko liječenje, primjenu antibiotika širokoga spektra koji pokrivaju i aerobne i anaerobne bakterije, tromboprofilaksu te gastroprotekciju. Bolesnici moraju biti na strogoj karenciji, a parenteralna prehrana indicirana je samo kod bolesnika s lošim nutritivnim statusom i kod onih kod kojih se ne očekuje da će početi s oralnim unosom hrane kroz sljedećih pet do sedam dana. Posebnu pozornost treba usmjeriti na prepoznavanje razvoja toksičnoga megakolona koji zahtijeva kiruršku intervenciju. Inicijalno specifično liječenje podrazumijeva intravensku primjenu kortikosteroida (metilprednizolon 40 - 80 mg/dan ili hidrokortizon 300 mg/dan), bilo na način da je podijeljeno u nekoliko dnevnih doza, bilo u obliku kontinuirane intravenske infuzije. Veće ili pulsne doze kortikosteroida nisu pokazale veću korist, a nose veći rizik od razvoja nuspojava. Kod većine se bolesnika uz ovu terapiju postiže kliničko poboljšanje kroz sedam do deset dana. Čim se kliničko stanje poboljša te bolesnici opet mogu uzimati peroralnu tekućinu, intravenske kortikosteroide treba zamijeniti peroralnim. Ako se uz intravenske kortikosteroide ne postigne kliničko poboljšanje kroz tri do pet dana, u obzir dolazi primjena imunomodulatora i/ili biološke terapije (TNF-α inhibitori) u prethodno navedenim dozama (iako novije studije ukazuju na manju potrebu za kolektomijom kod bolesnika koji su dobivali veće doze infliksimaba (10 mg/kg intravenski u tri doze u vremenskom periodu od dva do tri tjedna). Kao moguća terapijska opcija kod bolesnika koji ne reagiraju na intravenske kortikostroide, navodi se i primjena ciklosporina (2 - 4 mg/kg/dan kao kontinuirana infuzija), ali ona je praćena visokom stopom nuspojava (nefrotoskičnost, infekcije, hipertenzija). Ako se ranije opisanim metodama medikamentoznoga liječenja ne postigne remisija, indicirano je operativno liječenje (kolektomija). Nakon stabilizacije kliničke slike indicirano je nastaviti terapiju održavanja remisije (imunomodulatori, biološki lijekovi).
Kirurško liječenje indicirano je kod oko 25 % bolesnika. Glavne su indikacije fulminantni kolitis i/ili toksični megakolon koji ne reagira na medikamentnozno liječenje unutar 48 do 72 sata ili razvoj akutnoga abdomena (krvarenje, perforacija). Također, kirurško liječenje indicirano je i u slučaju razvoja karcinoma ili prekanceroznih lezija koje nisu pogodne za endoskopsko liječenje (vidi kasnije). Obično se izvodi totalna kolektomija s formiranjem eksterne ili interne ileostome (engl. ileal pouch, ilealni rezervoar) koja osigurava crijevni kontinuitet prema analnome otvoru. Kod više od 40 % bolesnika s ilealnim rezervoarom mogu se naći endoskopski i histološki znaci upale nazvan pouchitis, a dobro reagira na liječenje metronidazolom ili ciprofloksacinom.
Prognoza. Ulcerozni kolitis bolest je karakterizirana smjenama egzacerbacija i remisija. Kod većine bolesnika može se postići odgovarajuća kontrola nad bolešću tako da ne narušava kvalitetu života i da nema potrebe za kirurškim liječenje. Trećina će bolesnika u nekom trenutku u životu zahijevati kirurško liječenje, što može rezultirati narušavanjem kvalitete života.
INTERMEDIJARNI (NEODREĐENI) OBLIK UPALNE BOLESTI CRIJEVA
Nedeterminirani kolitis naziv je za oblik crijevne upalne bolesti kod koje dolazi do preklapanja kliničkih, seroloških, endoskopskih i patohistoloških karakteristika ulceroznoga kolitisa i Crohnove bolesti te se ne može sa sigurnošću postaviti dijagnoza niti jednoga od ta dva entiteta. Nedeterminirani kolitis smatra se privremenom dijagnozom sve dok kasniji klinički tijek i dijagnostička obrada ne pokažu o kojemu se kliničkom entitetu upalne bolesti crijeva radi. Nedeterminirani kolitis susreće se kod 5 do 20 % bolesnika s upalnom bolesti crijeva, a ima jednaku učestalost kod oba spola. Klinička slika više nalikuje na onu koju nalazimo kod bolesnika s ulceroznim kolitisom, ali je znatno teža. Dijagnoza počiva na klasičnim dijagnostičkim metodama kako je to ranije opisano, a ključnu ulogu ima patohistološki nalaz koji ne govori jasno u prilog niti jednom od klasičnih oblika upalne bolesti crijeva. Pri tome treba imati na umu da se biopsije moraju uzeti s više različitih mjesta te u dva odvojena pregleda. Početno liječenje jednako je kao i kod ulceroznoga kolitisa, a dalje se prilagođava ovisno o tome prema kojemu se kliničkom entitetu kolitis i razvija. Kod više od 80 % bolesnika tijekom kliničkoga praćenja razvije se neki od klasičnih oblika upalne bolesti crijeva (33 - 72 % ulcerozni kolitis i 17 - 37 % Crohnova bolest).
MIKROSKOPSKI KOLITIS
Definicija. Mikroskopski kolitis je upalna bolest crijeva nepoznate etiologije karakterizirana učestalom vodenastom stolicom, uz makroskopski potpuno uredan izgled sluznice s patološkim promjenama uočljivim tek na mikroskopskoj razini. Ovisno o patohistološkom nalazu, razlikujemo dva oblika mikroskopskoga kolitisa: limfocitni i kolageni kolitis.
Podjela. Limfocitni kolitis karakteriziraju površinska epitelna oštećenja pri kojima dominira obilan limfocitni infiltrat u području epitela i lamine proprije. Kolageni kolitis također pokazuje površinska oštećenja epitela uz karakteristični nalaz subepitelnoga sloja kolagena koji leži duž bazalne membrane uz upalni infiltrat sastavljen od limfocita i plazma stanica.
Etiologija. Uzrok i mehanizam razvoja mikroskopskoga kolitisa nisu poznati. Njegova se pojavnost najčešće povezuje s primjenom određenih lijekova, kao što su nesteroidni protuupalni lijekovi, inhibitori protonske pumpe, niske doze acetilsalicilne kiseline, selektivni inhibtori ponovne pohrane serotonina te ACE inhibitori i beta blokatori. Bolest je češća i kod osoba koji imaju glutensku enteropatiju (celijakiju).
Klinička slika i dijagnoza. Bolest se najčešće javlja kod žena srednje životne dobi i to pretežno kod onih koje već imaju neko autoimuno oboljenje, na primjer reumatoidni artritis ili šećernu bolest tip I. Glavno kliničko obilježje bolesti kontinuirana je ili intermitentna pojava vodenih, proljevastih stolica. Dijagnoza se potvrđuje endoskopskim pregledom debeloga crijeva čija sluznica makroskopski djeluje uredno, no za konačnu potvrdu bolesti potreban je pozitivan patohistološki nalaz.
Liječenje takvih bolesnika je stupnjevito. Njegovu osnovu čine antidijarojici (loperamid, bismut-subslicilat) koji u više od 70 % slučajeva dovode do kliničkoga poboljšanja. Bolesnici koji ne reagiraju na ove lijekove zahtijevaju primjenu budezonida, a kao krajnje rješenje nameće se biološka terapija s ili bez imunomodulatora.
Definicija. Malapsorpcijski sindrom naziv je za kliničko stanje koje nastaje kao posljedica nedostatne opskrbe tijela osnovnim, elementarnim nutrijentima. U svojoj osnovi malapsorpcijski sindrom može nastati na tri razine: 1) smanjeni unos hrane u organizam (malnutricija, pothranjenost), 2) poremećaj razgradnje hrane na sastavne dijelove unutar probavne cijevi ili prebrz prolazak sadržaja kroz crijevo (maldigestija) te 3) poremećaj apsorpcije razgrađenih tvari iz probavne cijevi u krvotok (malapsorpcija u užem smislu).
Etiologija. Brojne bolesti i stanja mogu dovesti do razvoja malapsorpcijskoga sindroma različitim mehanizmima. U ovome dijelu teksta opisane će biti specifične bolesti i stanja koja mogu rezultirati pojavom toga sindroma, a nisu opisani u drugim dijelovima udžbenika. To su glutenska enteropatija (celijakija), sindrom kratkoga crijeva, sindrom bakterijskoga prerastanja, Whippleova bolest, tropska spru te još neki rijetki poremećaji.
Klinička slika malapsorpcijskoga sindroma sastoji se od dvije skupine kliničkih manifestacija: lokalnih i sistemskih. Lokalne manifestacije nastaju kao posljedica poremećene probave (digestije) i apsorpcije hrane, što rezultira različitim gastroenterološkim tegobama, dok sistemske manifestacije nastaju kao posljedica manjka pojedinih nutrijenata u organizmu, što dovodi do izostanka njihovih specifičnih uloga.
Lokalne manifestacije uključuju pojavu nelagode i bola u trbuhu (obično grčevita karaktera), osjećaj nadutosti, flatulenciju, mučninu i povraćanje te pojavu vodenastih i/ili masnih stolica. Pojava tih simptoma obično je uvjetovana obrokom jer se oni pojavljuju ili pojačavaju nakon jela.
Sistemske manifestacije mogu biti različite, a ovise o specifičnom deficitu: mikrocitna anemija (deficit željeza), makrocitna anemija (deficit vitamina B12 ili folne kiseline), parestezije i tetanija (deficit kalcija, magenzija), bol u kostima i sklonost prijelomima (deficit vitamina D i kalcija), hemoragijska dijateza (deficit vitamina K), periferni edemi (deficit albumina), hiperkeratoza i kseroftalmija (deficit vitamina A), dermatitis i nespecifilni osipi (deficit esencijalnih masnih kiselina) i dr.
Dijagnoza malapsorpcijskoga sindroma postavlja se na osnovi anamnestičkih podataka, fizikalnoga pregleda i laboratorijskih nalaza (anemija, hipoalbuminemija, elektrolitni disbalans i dr.). Daljnja diferencijalno-dijagnostička obrada ovisi o pretpostavljenoj kliničkoj sumnji na određenu bolest ili stanje, a uključuje specifične funkcionalne testove, endoskopsku obradu te različite slikovne dijagnostičke metode.
Liječenje. Osnovu liječenja čini specifično etiološko liječenje bolesti ili stanja koje je dovelo do razvoja malapsorpcijskoga sindroma, a paralelno s njime provodi se simptomatsko liječenje koje se temelji na primjeni nutrijenata za koje se na temelju kliničke i laboratorijske obrade uspostavi da su u značajnome manjku.
CELIJAKIJA
Definicija. Celijakija ili glutenska enteropatija jedan je od najčešćih uzroka malapsorpcijskoga sindroma u zapadnim zemljama. Nastaje uslijed imunološki posredovanoga oštećenja sluznice proksimalnoga dijela tankoga crijeva kao odgovora na unos glutena, jednoga od glavnih proteina pšenice, raži, zoba i ječma.
Epidemiologija. Celijakiju karakterizira široka rasprostranjenost diljem svijeta s najvećom incidenicijom na području sjeverne Europe, gdje su istraživanja temeljena na serološkim markerima pokazala njezinu pojavnost od visokih 1:100. Ipak, klinički manifestna bolest razvija se kod samo 10 % bolesnika s pozitivnim serološkim markerima, dok su ostali bolesnici asimptomatski ili imaju oskudna klinička očitovanja, tako da bolest prolazi nedijagnosticirana. Bolest se obično dijagnosticira tijekom prve godine života kada se u prehranu počnu uvoditi brašno i druge namirnice koje sadrže gluten. Manji broj bolesnika (obično onih s klinički atipičnim i slabo izraženim simptomima) ostaje neprepoznat do odrasle dobi. Učestalost celijakije nešto je češća kod žena.
Etiopatogeneza. Celijakija nastaje kao posljedica imunološki posredovanoga oštećenja sluznice proksimalnoga dijela tankoga crijeva uslijed ingestije namirnica koje sadrže gluten. Na razvoj bolesti snažan utjecaj ima genetika, s obzirom na to da se celijakija razvija isključivo kod osoba koje imaju HLA-DQ2 (95 %) i HLA-DQ8 (5 %) haplotip.Međutim, valja imati na umu da se celijakija ne mora nužno razviti u svih bolesnika s navedenim haplotipovima. Naime, oni su prisutni u čak oko 40 % opće populacije. Glutenski peptidi, od kojih je najznačajniji glijadin, apsorbiraju se iz crijevnoga lumena kroz epitelne stanice i dospijevaju u subepitelni prostor gdje ih preuzimaju antigen-prezentirajuće stanice nakon što se deaminiraju posredovanjem enzima transglutaminaze. Nakon ovakve transformacije ti se antigeni izlažu CD4+ limfocitima, ovi se aktiviraju te posreduju razvoj Th1 odgovora u kojemu dolazi do stvaranja specifičnih proupalnih citokina (IL-1, IFN-γ, TNF-α). Citokini dovode do limfocitne infiltraciju i oštećenja sluznice te u konačnici razvitka malapsorpcije. U serumu bolesnika s celijakijom mogu se dokazati i određena specifična autoantitijela (antiglijadinska, antiendomizijska, antitransglutaminazna), ali ona nemaju dokazani utjecaj na razvoj oštećenja sluznice te se danas koriste samo kao dijagnostički marker.
Patologija. Najznačajnije promjene u celijakiji nalazimo u proksimalnom dijelu tankoga crijeva. Bioptički uzorak crijevne sluznice pokazuje subtotalnu atrofiju resica uz izduživanje kripti, a s vremenom dolazi do potpunoga izravnavanja sluznice i gubitka sluzničkoga reljefa. U kriptama nalazimo povećan broj mitoza što govori o naglašenoj proliferativnoj aktivnosti. Mukoza sadržava brojne intraepitelne limfocite, a u lamini propriji nalaze se brojne plazma-stanice i eozinofili.
Klinička slika. U pogledu kliničkoga očitovanja, celijakija se može predstaviti tipičnom (klasičnom) kliničkom slikom koja se javlja u dječjoj dobi, te atipičnom kliničkom slikom koja se javlja u odrasloj dobi i često se lako ne prepoznaje u kliničkoj praksi. Kod više od 40 % bolesnika s pozitivnim serološkim markerima bolesti ne nalazimo nikakvih kliničkih manifestacija. To nazivamo tihom ili asimptomatskom celijakijom. Manje od 10 % bolesnika s celijakijom ima karakteristične kožne promjene (dermatitis herpetiformis).
Tipična klinička slika razvija se u dojenačkoj ili mlađoj dječjoj dobi (obično do druge godine života) kada se u prehranu uvedu brašno i drugi proizvodi koji sadrže gluten. Kliničkom slikom dominiraju tegobe vezane uz probavni trakt. To su različiti, nespecifični simptomi i znakovi bolesti: bolovi u abdomenu, distenzija trbušne stijenke, dijareja i/ili steatoreja, a ako se ti simptomi zanemare dolazi i do zastoja u psihomotornom rastu i razvoju djeteta (slabo napredovanje na težini ili gubitak na težini, mišićna slabost, generalizirana hipotonija i sl.).
Atipična klinička slika razvija se u kasnijoj dječjoj i odrasloj dobi, a karakteriziraju je slabije izraženi lokalni simptomi: kronični proljev ili dispepsija te drugi nespecifični simptomi i znaci od strane probavnoga trakta. Nadalje, pojavljuje se i čitav niz drugih simptoma ekstraintestinalnoga i općeg karaktera kao što su umor, malaksalost, depresivno raspoloženje, simptomi vezani za sideropeničnu anemiju, bolovi u kostima i povećana učestalost prijeloma uslijed osteoporoze, te druge sistemske manifestacije malapsorpcije. Takvi su bolesnici obično niži rastom te razvijaju različite endokrinopatije kao što su zakašnjeli pubertet, primarna ili sekundarna amenoreja te smanjenja plodnost.
Dijagnoza celijakije postavlja se na temelju anamnestičkih podataka, fizikalnoga pregleda, općih i specifičnih laboratorijskih nalaza te se potvrđuje endoskopskim pregledom dvanaesnika i patohistološkom analizom dobivenih uzoraka sluznice. Bitno je posumnjati na ovu bolest čim ranije i izbaciti gluten iz prehrane kako bi se sačuvala crijevna sluznica u normalnoj funkciji.
Opći laboratorijski nalazi mogu uključivati različit stupanj sideropenične ili megaloblastične anemije, hipokalcijemiju i povišene vrijednosti alkalne fosfataze (osteoporoza), hipoproteinemiju i hipoalbuminemiju, a kod više od trećine bolesnika mogu se naći i umjereno povišene vrijednosti jetrenih transaminaza.
Specifični laboratorijski nalazi podrazumijevaju serološku dijagnostiku celijakije. Kod svih bolesnika sa sumnjom na celijakiju preporuča se odrediti IgA antitijela na tkivnu transglutaminazu (IgA-tTG). Ta antitijela imaju visoku osjetljivost (98 %) i specifičnost (98 %). Ako su IgA-tTG antitijela negativna, a postoji visoka klinička sumnja na celijakiju, preporuča se odrediti ukupnu razinu IgA antitijela s obzirom na to da se kod 3 do 5 % ovih bolesnika otkrije IgA deficijencija te je nalaz lažno negativan. Kod tih bolesnika za serološku potvrdu bolesti koristimo određivanje IgG protutijela (IgG-tTG) ili deaminiranih antiglijadinskih protutijela (anti-DGP). Nakon uvođenja bezglutenske prehrane navedeni serološki markeri postaju nedetektibilni kroz 3 do 24 mjeseca te se kao takvi mogu koristiti u kliničkom praćenju bolesnika (pridržavanje bezglutenske prehrane). Ranije određivana antiglijadinska i antiendomizijska protutijela danas se ne preporučuju u standardnoj dijagnostičkoj obradi.
Endoskopski pregled dudenuma i tankoga crijeva, odnosno duboka duodenoskopija i uzimanje bioptičkoga materijala sluznice crijeva je zlatni dijagnostički standard za celijakiju. Uzorci se uzimaju s dva mjesta i to s područja proksimalnoga i distalnoga dvanaesnika. Pretraga se preporuča za sve bolesnike s pozitivnim serološkim biljezima celijakije, kao i za one s negativnim nalazima, a koji imaju visoku kliničko-laboratorijsku sumnju na ovu bolest. Uredan patohistološki nalaz ne isključuje bolest, pa se kod nekih bolesnika nalaže ponavljanje pretrage. Kao i kod seroloških biljega, nakon uvođenja bezglutenske prehrane prati se postupni oporavak sluznice dvanaesnika kroz šest mjeseci do godinu dana.
Diferencijalna dijagnoza uključuje razne bolesti i stanja: intestinalna limfangiektazija, abetalipoproteinemija, eozinofilna gastroenteropatija, agamaglobulinemija, cistična fibroza, insuficijencija egzokrine funkcije gušterače i sl. Za razlikovanje tih stanja od celijakije potrebno je učiniti biopsiju sluznice.
Liječenje. Osnovu liječenja celijakije čini doživotna bezglutenska dijeta. Prakticiranje takve prehrane danas je olakšano zbog široke dostupnosti bezglutenskih proizvoda te jasnim obilježavanjem proizvoda ovisno o tome sadrži li gluten ili ne. Nakon uvođenja bezglutenske prehrane olakšanje simptoma nastupa već kroz nekoliko tjedana. U početku liječenja preporuča se i suplementacija mikronutrijenata (željezo, folati, kalcij, vitamin D), ali ono nije nužno kasnije, kada dođe do kliničkoga poboljšanja. Kod manjega broja bolesnika mogu se naći izraženi klinički simptomi koji ne reagiraju na bezglutensku prehranu te se kod njih mogu primijeniti krotikosteroidi (prednison 40 mg tbl/dan ili budezonid 9 mg tbl/dan) kroz dva ili više tjedana.
Komplikacije. Najčešće komplikacije celijakije su osteoporoza, povećan rizik od nastanka malignih tumora te razvoj ulceroznoga jejunoileitisa. Osteoporaza je česta kod ovih bolesnika, osobito starijih. Stoga se preporučaju češće denzitometrijske kontrole. Bolesnici s celijakijom imaju dvostruko veći rizik od nastanka malignih tumora tankoga crijeva (osobito T-staničnoga limfoma), a veća je učestalost i nastanka planocelularnoga karcinoma jednjaka. Manji broj bolesnika može razviti ulcerozni jejunoileitis, upalnu bolest koju prati teška klinička slika (febrilno stanje, bolovi, opstrukcija, perforacija), koja često nalaže hitan operativan zahvat i intraoperacijsku biopsiju. Liječenje je teško i zahtijeva visoke doze kortikosteroida.
Dermatitis herpetiformis danas se smatra kožnom varijantom celijakije. Takve kožne promjene nalazimo u manje od 10 % bolesnika s jasno izraženim simptomima celijakije, dok se kod gotovo svih bolesnika s ovom dermatopatijom na biopsijama duodenalne sluznice nađu promjene koje odgovaraju celijakiji, čak i u odsutnosti probavnih tegoba. Kožne promjene uključuju pojavu papulovezikularnoga osipa raspodijeljenoga po ekstenzornim stranama ekstemiteta te po trupu i vlasištu. Promjene se uglavnom povlače po uvođenju bezglutenske prehrane te je samo kod manjega broja bolesnika potrebno uvesti specifičnu terapiju.
Prognoza. Kod većine bolesnika koji se pridržavaju bezglutenske prehrane prognoza je odlična. U manje od 5 % slučajeva nalazimo teže kliničke oblike koji ne reagiraju na bezglutensku prehranu. Takvi su bolesnici skloniji razvoju drugih autoimunih bolesti kao što su Addisonova bolest, Gravesova bolest, šećerna bolest tip I, skleroderma i druge.
SINDROM KRATKOGA CRIJEVA
Definicija. Sindrom kratkoga crijeva (engl. short bowel syndrome) predstavlja oblik malapsorpcijskoga sindroma koji nastaje uslijed odstranjenja i/ili disfunkcije određenoga segmenta tankoga crijeva, što za posljedicu ima smanjenju crijevnu apsorpciju. Klinički značajna bolest nastaje kada je više od 40 - 50 % tankoga crijeva u disfunkciji.
Etiopatogeneza. Najčešći uzrok sindroma kratkoga crijeva je kirurška resekcija tankoga crijeva, dok su Crohnova bolest i radijacijski enteritis danas znatno rjeđi uzroci. Mehanizmi koji uvjetuju nastanak malapsorpcije kod ovih bolesnika uključuju smanjenu apsorptivnu površinu, kraće zadržavanje i brži prolazak hrane kroz ostatno tanko crijevo, poremećeno enterohepatično kruženje žučnih soli te bakterijsko prerastanje. Težina malapsorpcije ovisi o mjestu i opsegu resekcije tankoga crijeva (jejunum ili ileum) te o rezidualnoj bolesti i sposobnosti adaptivne hiperplazije ostatnoga crijeva. Resekcija jejunuma načelno se bolje podnosi od resekcije ileuma, s obzirom na to da se veći dio nutrijenata apsorbira u ileumu, a ileum uz to ima i izraženiju sposobnost adaptivne hiperplazije. Adaptivna hiperplazija predstavlja kompenzacijski odgovor ostatnoga crijeva u vidu povećanja resica crijevne sluznice kako bi se održala odgovarajuća apsorptivna funkcija, a kao glavni stimulans adaptivne hiperplazije navodi se glukagonu-sličan peptid 2 (GLP2, engl. glucagon-like peptid) koji nastaje u L-stanicama terminalnoga ileuma i kolona. Ove adaptivne promjene razvijaju se kroz 6 do 12 mjeseci od resekcije, a glavni je poticaj unos hrane s posljedičnom sekrecijom probavnih sokova i enzima. Stoga je svim bolesnicima već u ranome poslijeoperativnom periodu potrebno uvesti enteralne pripravke. U slučajevima opsežnih resekcija tankoga crijeva kolon može preuzeti znatnu ulogu u održavanju apsorptivne funkcije.
Klinička slika. Kliničke posljedice sindroma kratkoga tankoga crijeva ovise ponajprije o opsegu resekcije i/ili disfunkcije tankoga crijeva, a značajne postaju kada je zahvaćeno više od 40 do 50 % tankoga crijeva. Klasično kod ovih bolesnika nalazimo: 1) gubitak na tjelesnoj masi kao posljedicu smanjene apsorpcije nutrijenata; 2) megaloblastičnu anemiju kao posljedicu manjka folata; 3) proljev i/ili steatoreju kao posljedicu poremećenoga enterohepatičnoga kruženja žučnih soli; 4) hiperoksaluriju i povećanu učestalost razvoja bubrežnih kamenaca kao posljedicu stimulirane apsorpcije oksalata u debelome crijevu od strane žučnih soli te 5) povećanu učestalost žučnih kamenaca uslijed nakupljanja žuči u žučnjaku.
Dijagnoza se temelji na anamnezi, kliničkim nalazima i laboratorijskim pretragama. Kod svih bolesnika kod kojih je rađena resekcija tankoga crijeva, kao i kod onih koji imaju bolest koja zahvaća tanko crijevo, treba razmatrati mogući razvoj ovoga sindroma. U laboratorijskim nalazima tih bolesnika može se naći makrocitna (megaloblastična) anemija, hipoproteinemija (hipoalbuminemija), smanjene razine vitamina B skupine te vitamina topljivih u mastima, a česti su i hipokacijemija, hipofosfatemija i hipomagenzijemija.
Liječenje. Liječenje sindroma kratkoga crijeva u prvome je redu usmjereno na olakšanje lokalnih simptoma te nadoknadu deficitarnih nutrijenata, a u današnje su nam doba na raspolaganju i specifični oblici liječenja, kao što su stimulacija adaptivne hiperplazije te transplantacija tankoga crijeva.
Simptomatsko olakšanje kod bolesnika postiže se pravilnom prehranom koja uključuje smanjen unos masti i povećan unos ugljikohidrata, s obzirom na to da se tako smanjuje učestalost steatoreje i dijareje. Obroci trebaju biti količinski manji, ali se trebaju uzimati češće. U slučaju upornih proljevastih stolica moguća je primjena klasičnih antidijarealnih lijekova (npr. loperamid 2 - 4 mg do 3 x/dan) i/ili helata žučnih kiselina (npr. kolestipol ili kolestiramin 2 - 4 g do 3 x/dan).
Nutritivna nadoknada. Svim bolesnicima sa sniženim serumskim vrijednostima vitamina B12, kao i onima s resekcijom ileuma većom od 50 cm, potrebno je nadoknađivati vitamin B12 u obliku intramuskularnih ili supkutanih injekcija (500 - 1000 µg 1x mjesečno). Ostali vitamini i oligoelemtni nadoknađuju se peroralnim putem, ali se primjenjuju u znatno većim dnevnim dozama nego što je to preporučeno za ostalu populaciju. Ako se klasičnom prehranom ne može osigurati dostatan kalorijski unos, preporuča se primjena posebnih enteralnih pripravaka čiji sastav i formulacija osiguravaju zadovoljavajući iznos kalorija i mikronutrijenata. Ako se ni uz te mjere ne mogu zadovoljiti dostatne kalorijske potrebe, indicirana je primjena parenteralne prehrane.
Specifični oblici liječenja podrazumijevaju primjenu teduglutida i transplantaciju tankoga crijeva. Teduglutid je GLP-2 analog koji stimulira adaptivnu hiperplaziju tankoga crijeva i odobren je od strane FDA u liječenju sindroma kratkoga crijeva. Primjenjuje se u dozi od 0,05 mg/kg/dan supkutano te dokazano smanjuje potrebu za parenteralnim oblicima prehrane. Transplantacija tankoga crijeva rijetko se izvodi, a preporuča se kod bolesnika kod kojih je indicirana trajna parenteralna prehrana, a kod kojih se razviju ozbiljne komplikacije (progresivna jetrena bolest) ili imaju problema s vaskularnim pristupom. Petogodišnje preživljenje crijevnoga presatka je ispod 50 %.
Prognoza. Kod većine ovih bolesnika razvijaju se dugoročne komplikacije koje uključuju osteopeniju, tj. osteomalaciju, bubrežne kamence, žučne kamence, sindrome manjkavosti vitamina topljivih u mastima te sindrom bakterijskoga prerastanja.
SINDROM BAKTERIJSKOGA PRERASTANJA U TANKOM CRIJEVU (SIBO)
Definicija. Sindrom bakterijskoga prerastanja u tankom crijevu naziv je malapsorpcijskoga sindroma koji nastaje kao posljedica pretjeranoga rasta i razmnožavanja bakterija unutar tankoga crijeva koje je u fiziološkim uvjetima sterilno ili sadržava male količine bakterija. Bakterije su obično porijeklom iz debeloga crijeva, a razvoju sindroma pogoduje funkcijska ili anatomski uvjetovana hipoperistaltika tankoga crijeva. Radi se o relativno učestalom sindromu kod starijih osoba, iako on često prolazi neopaženo i neprepoznato.
Etiopatogeneza. Bakterijsko prerastanje unutar tankoga crijeva obilježava umnažanje bakterija kao što su E. coli i Bacteroides spp., koje su inače sastavni dio crijevne mikroflore kolona. Nastanku ovoga sindroma pridonose hiposekrecija želučane kiseline (hipoklorhidrija), hipomotilitet tankoga crijeva (vagotomija, sklerodermija, dijabetička neuropatija), anatomske abnormalnosti koje uvjetuju nastanak slijepe vijuge (postoperativno, divertikuli) te prisutnost gastrokolične ili enterokolične fistule (Crohnova bolest, tumori i sl.). Do sindroma malapsorpcije dolazi iz više razloga: 1) bakterije pogoduju direktnome oštećenju sluznice i resica tankoga crijeva smanjujući apsorptivnu površinu; 2) ubrzana je dekonjugacija žučnih kiselina zbog čega se one brzo reapsorbiraju iz crijeva - što dovodi do poremećaja apsorpcije masti i vitamina topljivih u mastima, 3) bakterije za svoje metaboličke procese koriste vitamin B12 i ugljikohidrate zbog čega se oni ubrzano troše i slabije apsorbiraju (razvoj megaloblastične anemije). Također, bakterije imaju sposobnost stvaranja vitamina B9 (folna kiselina) zbog čega se on pojačano apsorbira u krvotok.
Klinička slika. Kod većine bolesnika je sindrom bakterijskoga prerastanja asimptomatski ili oligosimptomatski. Najčešći su simptomi nelagoda i neodređen bol u trbuhu, osjećaj nadutosti i pojačana flatulencija, učestale proljevaste i/ili masne stolice, te postupan gubitak na tjelesnoj težini. Ovisno o izraženosti, mogu se javiti i simptomi deficijencije vitamina topljivih u mastima.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, laboratorijskih nalaza i specifičnih pretraga. Na sindrom bakterijskoga prerastanja treba pomišljati kod svih bolesnika kod kojih se pojavljuju probavne smetnje, gubitak na tjelesnoj težini te prisutnost makrocitne anemije, uz prisutnost rizičnih čimbenika (operacijski zahvati, šećerna bolest i sl.). U laboratorijskim nalazima nalazimo karakteristično snižene vrijednosti vitamina B12 (kobalamin) uz povišene vrijednosti folne kiseline (vitamin B9), s obzirom na to da bakterije u tankome crijevu troše vitamin B12, a produciraju folnu kiselinu koja se potom apsorbira. Konačna se dijagnoza postavlja aspiracijom i mikrobiološkom kultivacijom sadržaja iz proksimalnoga jejunuma u kojemu se nalazi više od 105 mikroorganizama/mL. S obzirom na to da se radi o invazivnoj metodi, danas se češće izvode neinvazivni izdisajni testovi (npr. 14C-ksiloza izdisajni test, SIBO test).
Valja napomenuti da o ovom sindromu treba razmišljati kod velikoga broja bolesnika s funkcijskim poremećajima probavnoga trakta, poput sindroma iritabilnoga crijeva, dispepsije i funkcijske konstipacije. Radi se o poremećajima koji su sve učestaliji, posebice kod ljudi mlađe ili srednje životne dobi, prečestoga i predugog korištenja inhibitora protonske pumpe i sličnim stanjima. U takvim slučajevima moramo pomišljati i na SIBO posebice kada se radi o rezistentni probavnim tegobama tipa nadutosti.
Liječenje. Osnovu liječenja čini rješavanje uzročnoga stanja, ako je to moguće. Svim se bolesnicima preporuča peroralna primjena antibiotika širokoga spektra kroz 7 do 14 dana. Najčešće se primjenjuju cirpofloksacin (2 x 500 mg), norfloksacin (1 x 400 mg) ili amoksicilin/klavulonska kiselina (2 x 1 g). Kod bolesnika s rekurentnim simptomima preporuča se ciklička primjena antibiotika (primjena antibiotika kroz tjedan dana, potom pauza od tri tjedna). Najčešće se primjenjuju cirpofloksacin (2 x 500 mg), norfloksacin (1 x 400 mg) ili amoksicilin/klavulonska kiselina (2 x 1 g) s ili bez metronidazola (3 x 500 mg).
Prognoza. Bolest je obično kroničnoga i rekurentnog karaktera te zahtijeva česte primjene antibiotika, što može rezultirati nastankom rezistencije. Osnovu svega čini liječenje uzročnoga stanja koje je dovelo do sindroma bakterijskoga prerastanja.
WHIPPLEOVA BOLEST
Definicija. Whippleova je bolest rijetko uzrok malapsorpcijskoga sindroma, a predstavlja multisistemsku bolest koju uzrokuje Tropheryma whippelii, gram pozitivna bakterija iz roda Actinomyces. Whippleovu bolest karakterizira zahvaćenost probavnoga sustava, zglobova, središnjega živčanog sustava te srca.
Etiopatogeneza. T. whipplei je mala, gram-pozitivna bakterija štapićastoga oblika koja pripada rodu Actinomyces, a karakterizira ju nizak stupanj virulentnosti. Točan izvor zaraze je nepoznat (vjeruje se da se nalazi u tlu, s obzirom na to da se bolest najčešće razvija kod poljoprivrednika), a nije dokazan niti interpersonalni prijenos. Kao jedan od rizičnih čimbenika za razvoj ove infekcije navodi se haplotip HLA-B27, s obzirom na to da se on nalazi kod oko 40 % oboljelih osoba. Infestacija ovom bakterijom prezentira se histološkim nalazom PAS-pozitivnih makrofaga krcatih bacilima koji se mogu naći u različitim tkivima i organima, kao što su sluznica tankoga crijeva, sinovijalne membrane, središnji živčani sustav, jetra, limfni čvorovi, koža i srce. Sličnu histološku sliku daje i infekcija uzrokovana Mycobacterium avium intracelullare koju obično nalazimo kod bolesnika sa sindromom stečene imunodeficijencije (AIDS).
Klinička slika. Najranija klinička očitovanja bolesti obuhvaćaju opće simptome (umor, febrilno stanje) te pojavu migratornoga poliartritisa koji zahvaća velike zglobove. Crijevni simptomi javljaju se kasnije, a uključuju pojavu proljeva, steatoreje, nespecifičnih bolova u trbuhu te gubitak na tjelesnoj težini (malapsorpcijski sindrom). U kasnijoj fazi bolesti (godinama kasnije) javljaju se simptomi i znakovi zahvaćenosti drugih organskih sustava (anemija, limfadenopatija, hepatomegalija, demencija, poremećaji vida, hiperpigmentacija kože i dr.).
Dijagnoza Whippleove bolesti postavlja se na temelju anamnestičkih podataka, patohistološkoga nalaza biopsije sluznice tankoga crijeva te molekularnim metodama dokaza infekcije T. whipplei (PCR). Na Whippleovu bolest treba posumnjati kod osoba s prisutnim nespecifičnim probavnim simptomima, uz anamnestičke podatke o općim simptomima, artralgijama ili znacima zahvaćenosti nekoga drugog organskog sustava. Kod takvih bolesnika indicirana je endoskopska obrada s biopsijom crijevne sluznice (najbolje iz proksimalnoga dijela tankoga crijeva) te karakterističnim nalazom PAS-pozitivnih makrofaga. Konačna dijagnoza postavlja se PCR-metodom kojom se dokazuje prisutnost T. whippelii iz bioptičkih uzoraka (sluznica crijeva, limfni čvor, koža) ili ekstracelularnih tekućina (cerebrospinalni likvor, sinovijalna tekućina).
Liječenje se provodi primjenom antibiotske terapije u trajanju od jedne godine. Ono započinje primjenom ceftriaksona (2 x 1 gr iv) ili meropenema (3 x 1 gr iv) kroz dva tjedna nakon čega slijedi peroralna primjena kombinacije trimetoprim/sulfametoksazol u dozi od 160/800 mg dva puta na dan kroz 12 mjeseci. Uspješnost liječenja potvrđuje se biopsijom sluznice tankoga crijeva (nestanak PAS-pozitivnih makrofaga) i/ili PCR metodom po provedenoj terapiji.
Prognoza. Kod neprepoznatih i neliječenih bolesnika dolazi do fatalnoga završetka. Uz pridržavanje antibiotskoga liječenja remisija se postiže u 100 % slučajeva. Zahvaćanje središnjega živčanog sustava loš je prognostički znak.
MANJAK DISAHARIDAZA
Uvod. Disaharidaze su enzimi četkaste prevlake crijevne sluznice koji cijepaju disaharide u monosaharide (laktaza, maltaza, izomaltaza, sukraza) te predstavljaju završni korak u procesu probave ugljikohidrata. Manjak disaharidaza dovodi do poremećaja cijepanja disaharida, a time i do poremećaja probave ugljikohidrata što se očituje kliničkim smetnjama nakon njihova unosa zbog čega se ovo stanje naziva još i intolerancija na ugljikohidrate. Najčešće se radi o deficitu laktaze, enzima koji cijepa laktozu (mliječni šećer) na glukozu i galaktozu.
Etiopatogeneza. Manjak disaharidaza može se javiti kao urođeni (kongenitalni) deficit što se očituje u ranom djetinjstvu i predmet je pedijatrije ili se može raditi o stečenom (sekundarnom) deficitu kod bolesti koje dovode do oštećenja četkaste prevlake (celijakija, tropska spru, akutne crijevne infekcije, Crohnova bolest i sl.). Izostankom razgradnje disaharida na monosaharide, oni se nakupljaju u lumenu tankoga crijeva što dovodi do osmotskoga navlačenja vode u lumen tankoga crijeva (disaharidi su osmotski aktivne tvari), zbog čega nastaju obilne vodenaste stolice. Također, kada disaharidi dospiju u kolon podložni su bakterijskoj razgradnji pri čemu nastaju razni plinovi (vodik, ugljični dioksid, metan) što dovodi do meteorizma, flatulencije, nadimanja i bolova u trbuhu. Sama težina bolesti ovisi o stupnju sluzničkoga oštećenja, tj. o stupnju deficita enzima.
Klinička slika. Intolerancija na laktozu u odraslih osoba dijelom se krije pod kliničkom slikom osnovne bolesti, a karakteristična je za nju pojava vodenastih proljeva, nadimanja, flatulencije, mučnine te grčeva u trbuhu koji se intenziviraju nakon unosa laktoze (mlijeko, mliječni proizvodi). Bolesnici sami uočavaju povezanost unosa laktoze i simptoma. Simptomi nastaju obično nakon unosa ekvivalenta 2 do 4 dL mlijeka. Posljedično, kod pacijenta dolazi do gubitka na tjelesnoj težini, kroničnoga umora i sl.
Dijagnoza. Pri postavljanju dijagnoze deficita disaharidaza bitna je dobro uzeta anamneza (pojava crijevnih simptoma vezana uz konzumaciju mlijeka i mliječnih proizvoda) te fizikalni pregled. Provodi se klasični dijagnostički postupak kao i kod ostalih malapsorpcijskih sindroma (laboratorijska obrada krvi, urina, pretrage stolice, endoskopski pregled). Specifičniji dijagnostički nalazi za manjak disaharidaza (posebice laktoze) su vodikov izdisajni test te test tolerancije laktoze.
Vodikov izdisajni test provodi se tako da se bolesniku da preoralno 50 grama laktoze te se određuje koncentracija vodika u izdisaju nakon 90 minuta. Porast koncentracije vodikovih iona u izdahnutom zraku iznad 20 ppm nakon 90 minuta od ingestije određuje ovaj test pozitivnim i ukazuje na smanjenu aktivnost laktaze. Osjetljivost i specifičnost ovoga testa je oko 95 %.
Test tolerancije laktoze provodi se tako da se bolesniku da peroralno 1 g/kg laktoze te se mjeri vrijednost glukoze u krvi krvi prije ingestije te nakon 60 i 120 minuta od ingestije uz promatranje simptomatologije. Kod intolerancije na laktozu simptomi se pojavljuju već 20 do 30 minuta od početka testa uz odsutnost značajnijega porasta vrijednosti glukoze u krvi. Test je manje specifičan od vodikovoga izdisajnog testa.
Liječenje. Osnova je liječenja uklanjanje laktoze iz prehrane. Izbjegavanje konzumiranja laktoze ne treba biti strogo, nego utemeljena na iskustvima bolesnika. Neki bolesnici mogu tolerirati konzumiranje manjih količina laktoze te kod njih ne treba zabraniti njezinu potpunu konzumaciju. Fermentirana mlijeka sadrže manje količine laktoze, pa se i bolje podnose. Kod bolesnika kod kojih se značajno ograniči unos ovih proizvoda potrebno je provoditi dodatnu suplementaciju kalcija (kalcij karbonat 2 - 3 x 500 mg/dan), s obzirom na to da su mliječni proizvodi među glavnim izvorima unosa kalcija u organizam. Nakon uklanjanja osnovnoga etiološkog čimbenika bolesnici mogu ponovno uzimati mlijeko i šećere.
DRUGI UZROCI MALAPSORPCIJSKOGA SINDROMA
Tropska spru je bolest nepoznatoga uzroka koja se javlja endemično i epidemično u tropskim krajevima. Najvjerojatnije se radi o infektivnoj podlozi, iako točan uzročnik i patofiziološki mehanizam nisu dokazani. Često se javi kod osoba koje su boravile u tropima, a kod njih obično nalazimo i pozitivnu anamnezu na akutni gastroenterkolitis u tome periodu. Patološke promjene slične su onima kod celijakije, ali za razliku od celijakije gdje su te promjene najizraženije u proksimalnome dijelu tankoga crijeva, tropska spru podjednako zahvaća cijelo tanko crijevo. Klinički, bolest počinje kao akutni gastroenteritis nakon čega slijedi trajnije ili trajno crijevno oštećenje. Prisutna je kronična malapsorpcija praćena sekundarnim nutritivnim deficitima, posebno folne kiseline i željeza, zbog čega nastaju nastaju sideropenična ili megaloblastična anemija. Kao posljedica malapsorpcije ugljikohidrata i masti javljaju se proljev i steatoreja. Razlikovanje tropske spru od celijakije omogućava i bezglutenska dijeta, s obzirom na to da se kod ovih bolesnika ne postiže kliničko poboljšanje nakon isključivanja glutena iz prehrane. U liječenju koristimo antibiotike (tetraciklini) te se nadoknađuje folna kiselina i željezo, ovisno o laboratorijskim nalazima.
Abetalipoproteinemija je nasljedna autosomno-recesivna bolest koja nastaje zbog poremećaja u transportu masti kroz crijevnu sluznicu s posljedičnim nakupljanjem masti u enterocitima. Klinički dominiraju loklani simptomi (nadutost, stetoreja), kao i zaostajanje u rastu i razvoju djece te pojava specifičnih poremećaja koji nastaju uslijed malapsoprcije vitamina topljivih u mastima, posebice vitamina E (retinopatija, spinocerebelarna degeneracija). Dijagnoza se postavlja na temelju sniženih vrijednosti apoproteina B, triglicerida i kolesterola u plazmi, a potvrđuje se patohistološkim nalazom bioptata crijevne sluznice (nakupine masnih kapljica unutar enterocita). Liječenje se sastoji od prehrane utemeljene na smanjenomu unosu masti, a osiguranje kalorijskih potreba utemeljeno je na unosu ugljikohidrata. Također se preporuča i pojačan unos vitamina E.
Gastroenteropatije s gubitkom proteina obilježene su značajnim gubitkom serumskih proteina u probavni sustav na što upućuje nalaz kombinirane hipoalbuminemije i hipogamaglobulinemije uz odsutnost kronične jetrene ili bubrežne bolesti. Tri su osnovna mehanizma koja mogu dovesti do toga stanja: 1) povećana propusnost sluznice gastrointestinalnoga trakta zbog oštećenja ili gubitka stanica sluznice, 2) erozije ili ulceracije sluznice te 3) opstrukcija limfatičnih kanala. U kliničkoj slici ponajprije dominiraju simptomi hipoproteinemije (periferni edemi, izljev u tjelesne šupljine), a ovisno o uzročnoj bolesti javljaju se i druga klinička očitovanja (malapsorpcija masti i ugljikohidrata). Povećane vrijednosti α1-antitripsina u uzorku stolice potvrđuju dijagnozu poremećaja. S obzirom na to da se radi o sekundarnome poremećaju, kod svih je bolesnika s tom dijagnozom potrebna detaljna dijagnostička obrada s ciljem otkrivanja uzroka te provedbe odgovarajućeg liječenja.
Uvod. Divertikuli predstavljaju vrećasta izbočenja stijenke probavne cijevi. Mogu biti pravi (sastoje se od jednakih slojeva kao i normalna stijenka probavne cijevi) i lažni (mukoza i submukoza prodiru kroz muskularni sloj), prirođeni i stečeni te pojedinačni i višestruki. Mogu se javiti u svim dijelovima probavnoga sustava, a najčešće su lokalizirani u debelome crijevu. Divertikuloza podrazumijeva prisutnost nekompliciranih i neinflamiranih divertikula u većem broju, a divertikulitis je naziv za upalu divertikula, najčešću komplikaciju divertikuloze.
DIVERTIKULI TANKOGA CRIJEVA
Divertikuli tankoga crijeva rijetka su patologija tankoga crijeva, a pojavljuju se obično u starijoj životnoj dobi i to češće kod muškaraca. Pojavi divertikula tankoga crijeva pogoduju povećani intraluminalni tlak, visceralna miopatija te neuropatija (npr. dijabetička neuropatija). Klinički su najčešće asimptomatski ili se mogu manifestirati nekom od akutnih komplikacija, kao što su akutna mehanička intestinalna opstrukcija (ileus), divertikulitis, perforacija i krvarenje kada se očituju slikom akutnoga abdomena ili krvarenja iz probavnoga sustava. Dijagnoza se postavlja na temelju nativne rendgenske snimke abdomena (mjehurići zraka ili brojne razine zrak/tekućina) te radiološkim kontrastnim pregledom. Liječenje asimptomatskih divertikula nije potrebno, a komplikacije se tretiraju kirurškim putem.
Meckelov divertikul je prirođeni divertikul tankoga crijeva koji predstavlja najčešću anomaliju probavnoga sustava uopće, a nađe se u 2 do 3 % opće populacije. Nastaje kao posljedica nepotpune obliteracije duktusa omfalomezenterikusa, a smješten je na antimezenteričnoj strani crijeva, unutar 100 cm oralno od ileocekalne valvule. Veličina Meckelovoga divertikula je različita, od 1 do 10 cm u promjeru, a u više od 50 % slučajeva unutar divertikula se nalazi heterotopično želučano ili pankreasno tkivo. Klinički gledano, Meckelov divertikul je asimptomatska bolest do pojave neke od komplikacija kao što su divertikulitis, krvarenje, mehanički ileus ili perforacija. Zbog anatomskoga položaja klinička slika ovih komplikacija često nalikuje na akutni apendicitis i često se dijagnoza postavi tek intraoperativno, nakon što je započeo zahvat sa sumnjom na akutni apendicitis. Postavljanje dijagnoze je otežano, a s obzirom na to da se gotovo uvijek radi u uvjetima akutnoga abdomena, ne daje puno mogućnosti zbog čega se često poseže za eksploracijskom laparoskopijom. Meckelov divertikul može se prikazati na kompjuteriziranoj tomografiji, a prilikom dijagnostike krvarenja iz njega korisna je scintigrafija natrijevim pertehnetatom (99mTn) koji pokazuje sklonost nakupljanju i u normalnoj i u heterotopičnoj sluznici unutar divertikula, iako lažno pozitivne rezultate kod odraslih osoba možemo naći i kod prisutnosti drugih, upalnih bolesti tankoga crijeva. Liječenje komplikacija Meckelova divertikula je operativno (kirurška resekcija).
DIVERTIKULI DEBELOGA CRIJEVA
Definicija. Debelo crijevo je najčešće sijelo divertikula u probavnome sustavu, osobito descendentni kolon i sigma. Učestalost divertikula debeloga crijeva raste sa životnom dobi, tako da se oni nalaze kod manje od 5 % bolesnika mlađih od 40 godina, 30 % mlađih od 60 godina te u više od 50 % kod osoba starijih od 80 godina. Komplikacije se razvijaju kod manje od 5 % bolesnika s tom bolesti.
Etiopatogeneza. Smatra se da pojavi divertikula pogoduje rafinirana i vlaknima siromašna hrana koja je uzrok smanjene mase fekalnoga sadržaja i otežanoga prolaska kroz crijevo. To često dovodi do pretjeranih spastičkih kontrakcija koje dovode do znatnoga povišenja intraluminalnoga tlaka, a on slabi mišićni sloj i stvara preduvjete za razvoj divertikula. Prema tome, prehrana, povišenje intraluminalnoga tlaka i slabost mišićnoga sloja glavni su čimbenici pojave divertikula. Predilekcijska mjesta su mjesta na kojima krvne žile ulaze u crijevnu stijenku. Razvoju divertikuloze pogoduju i drugi poremećaji crijevne peristaltike, kao i nasljedne i stečene bolesti vezivnoga tkiva, na primjer Ehlers-Danlosov sindrom, Marfanov sindrom te skleroderma.
Ovisno o kliničkoj prezentaciji, dijagnostičkim i terapijskim postupcima, divertikule debeloga crijeva možemo klasificirati u tri skupine: nekomplicirana divertikuloza kolona, akutni divertikulitis te krvarenje iz divertikula.
NEKOMPLICIRANA DIVERTIKULOZA KOLONA
Definicija. Nekomplicirana divertikuloza kolona predstavlja najčešću kliničku manifestaciju koju nalazimo u više od 90 % bolesnika s divertikulima kolona. Podrazumijeva postojanje jednoga ili više divertikula duž debeloga crijeva s najčešćom lokalizacijom u području sigmoidnoga i descendentnoga kolona. Divertikuli mogu pokazivati veliku različitost u svojoj veličini (1 - 10 cm).
Klinička slika. Kod većine bolesnika radi se o asimptomatskoj bolesti koja se otkrije slučajno, tijekom endoskopske ili radiološke pretrage debeloga crijeva iz nekoga drugog razloga. Manji broj oboljelih može imati kronični zatvor ili nespecifične bolove u trbuhu. Fizikalni pregled većine bolesnika je uredan, kod većih i brojnijih divertikula nekada se u lijevome donjem kvadrantu može palpirati nejasna tumefakcija.
Dijagnoza. Kako je navedeno, dijagnoza nekomplicirane divertikuloze kolona obično se postavlja slučajno prilikom pretraga debeloga crijeva iz drugih razloga. Najbolje metode dokazivanja ove bolesti su kolonoskopija, pri kojoj se mogu verificirati ulazna mjesta u divertikule, iako se ne može s preciznošću reći kolika je njihova veličina, te kontrastne radiološke pretrage (irigografija, kompjuterizirana tomografija) kojima se jasno može prikazati broj, raspored i veličina divertikula.
Liječenje. Bolesnici ne zahtijevaju posebno liječenje, a savjetuje im se uzimanje hrane s dosta ostataka i biljnih vlakana (voće, povrće). Vlakna se dodatno mogu unositi i u obliku praha od mekinja, psilijuma ili metilceluloze. Preporuča se i odgovarajuća fizička aktivnost. Cilj je tih preporuka povećati sadržaj fekalne mase u crijevima te regulirati i olakšati defekaciju.
AKUTNI DIVERTIKULITIS KOLONA
Definicija. Akutni divertikulitis najčešća je komplikacija divertikuloze kolona. Smatra se da nastaje uslijed nadražujućega djelovanja fekalne mase unutar lumena divertikula i/ili kompresijom na krvne žile u području ulaza u divertikul, što obično uzrokuje inklavirani fekolit. Upala može zahvatiti cijelu stijenku divertikula i dovesti do perforacije praćene početnim lokalnim peridivertikulitisom i lokaliziranim apscesom, od čega se u konačnici može razviti i difuzni peritonitis.
Klinička slika. Početno bolesnici imaju umjereno izražene simptome zbog čega se često javljaju na pregled nakon nekoliko dana od početka bolesti. Temeljni simptom je bol u lijevom donjem kvadrantu abdomena, praćen otežanom defekacijom, umjereno povišenom tjelesnom temperaturom, mučninom i povraćanjem. Hematohezija je rijetka pojava, ali je u gotovo svih prisutno okultno krvarenje. U slučaju progresije lokalnoga nalaza u smislu pojave peridivertikulitisa i apcesa ili peritonitisa dolazi do pogoršanja općega stanja (febrilno stanje, prostracija), kao i bolova u trbuhu praćenih izraženom palpatornom osjetljivošću i defansom muskulature. Difuzni peritonitis manifestira se slikom hipovolemije i septičkoga šoka.
Dijagnoza. Postavljanje sumnje na akutni divertikulitis kolona temelji se na kliničkoj slici, kliničkome pregledu i laboratorijskim nalazima (umjereno povišeni leukociti i upalni parametri), a potvrđuje se endoskopskim ili radiološkim kontrastnim metodama pri čemu se treba ravnati sljedećim preporukama: 1) kod bolesnika dobroga općeg stanja s visoko suspektnim akutnim divertikulitisom nije potrebno odmah provoditi endoskopsku ili radiološku obradu, nego se ona preporučuje nakon provedene terapije i smirivanja stanja; 2) kod bolesnika s inicijalno teškom kliničkom slikom ili onih kojima se stanje pogoršava unatoč medikamentnome liječenju, indicrana je kontrastna radiološka dijagnostika (CT kolonografija) te 3) endoskopska pretraga debeloga crijeva kontraindicirana je u početnim fazama bolesti, a osobito kod bolesnika koji imaju teže kliničko očitovanje zbog mogućnosti jatrogene ozljede. Radiološki nalazi koji ukazuju na akutni divertikulitis su zadebljanje stijenke, zamućenost parakoličnoga masnog tkiva (peridivertikulitis), formiranje apsecsa te ekstraluminalna prisutnost zraka (znak perforacije).
Diferencijalna dijagnoza je široka i uključuje različite bolesti i stanja, kao što su neoplazme kolona, Crohnova bolest, apendicitis, ishemijski kolitis, infektivni kolitis, adneksitis, izvanmaterična trudnoća i druge.
Liječenje ponajprije ovisi o težini bolesti. Blaži oblici mogu se liječiti ambulantno, dok se bolesnici s težom kliničkom slikom i lošijim laboratorijskim nalazima hospitaliziraju. Liječenje može biti konzervativno i kirurško.
Konzervativno liječenje. Bolesnici s umjerenom kliničkom slikom liječe se ambulantno, a temelj liječenja uključuje uzimanje tekuće hrane uz peroralnu primjenu antibiotika. U liječenju se najčešće preporučuje amoksicilin/klavulonska kiselina (2 x 875/125 mg/dan) ili metronidazol (3 x 500 mg/dan) uz ciprofloksacin (2 x 500 mg/dan) ili sulfametoksazol/trimetoprim (2 x 800/160 mg/dan) kroz sedam do deset dana ili dok bolesnik ne bude dobroga stanja kroz tri do pet dana. Bolesnici s težom kliničkom slikom i lošijim laboratorijskim nalazima primaju se na bolničko liječenje te je indicirana obustava unosa hrane na usta i intravenska rehidracija. Antibiotici se primjenjuju parenteralno, a najčešće se koriste oni koji pokrivaju i gram-negativne i anaerobne bakterije (piperacilin-tazobaktam samostalno ili kombinacija metrondizola s aminoglikozidima ili cefalosporinima treće generacije). Poboljšanje obično nastupa kroz dva do tri dana antibiotske terapije, a prelazak na peroralne antibiotike indiciran je nakon pet do sedam dana. Po smirivanju stanja preporuča se uzimanje hrane s dosta ostataka te suplementacija vlakana (psilijum, mekinje) s ciljem regulacije stolice.
Kirurško liječenje može biti hitno i elektivno. Hitan kirurški zahvat indiciran je u slučaju nemogućnosti kontrole bolesti konzervativnim liječenjem (pogoršanje stanja nakon 72 sata unatoč optimalnoj terapiji) ili razvoja lokalnih komplikacija kao što su apsces ili peritonitis (akutni abdomen). Elektivno liječenje divetikula primjenjuje se kod bolesnika s čestim recidivima divertikulitisa koji zahtijevaju hospitalno liječenje. Kirurško liječenje sastoji se od resekcije i uspostave kontinuiteta kolona termino-terminalnom anastomozom.
Prognoza. Učestalost relapsa divertikulitisa tijekom perioda od deset do dvadeset godina iznosi 15 do 30 %. Kod manje od 5 % bolesnika javljaju se učestali recidivi koji će zahtijevati kiruršku intervenciju. Divertikuloza kolona i divertikulitis nisu povezani s povećanom učestalosti razvoja karcinoma debeloga crijeva, ali se zbog slične kliničke prezentacije ovi bolesnici moraju češće kolonoskopski kontrolirati nakon 50. godine života.
KRVARENJE IZ DIVERTIKULA
Krvarenje iz divertikula kolona jedno je od najčešćih uzroka krvarenja iz donjega dijela probavnoga sustava. Kliničke manifestacije, dijagnostički i terapijski postupak opisani su u poglavlju „Krvarenja iz probavnoga sustava“.
INTESTINALNA PSEDUOOPSTRUKCIJA I MEGAKOLON
U ovome dijelu bit će opisana intestinalna pseudoopstrukcija koja označava prekid pasaže kroz crijeva uz odsutnost organske podloge (paralitički ileus) te megakolon - prekomjerna distenzija kolona s prijetećom rupturom kao najtežom komplikacijom, često povezana s intestinalnom pseudoopstrukcijom.
INTESTINALNA PSEDUOOPSTRUKCIJA
Definicija. Intestinalna pseudoopstrukcija ili paralitički (funkcionalni) ileus predstavlja stanje koje obilježava izostanak crijevne peristaltike i prekid pasaže kroz crijeva, ali u odsutnosti mehaničkoga uzroka.
Etiologija. Paralitički ileus relativno se često susreće kod hospitaliziranih i starijih osoba, a može biti uzrokovan različitim bolestima i stanjima (Tablica 4.18.). Iako točan mehanizam razvoja ovoga poremećaja nije jasan, vjeruje se da navedne bolesti i stanja izravno utječu na autonomnu inervaciju crijeva pri čemu dolazi do prevlasti simpatikusa u odnosu na parasimpatikus što rezultira hipoperistaltikom i crijevnom atonijom. Osim toga, kod nekih bolesnika dokazane su i neke patohistološke promjene, kao što su nedostatak stanica mijenteričnoga pleksusa te stanica koje sintetiziraju dušični oksid. Patofiziološki procesi jednaki su kao i kod mehaničkoga ileusa: dolazi do zastoja crijevnoga sadržaja i distenzije crijevnih vijuga, što je praćeno elektrolitnim disbalansima i poremećajem acidobaznoga statusa.
|
Tablica 4.18. Uzroci paralitičkoga ileusa
|
|
Intraabdominalni uzroci
|
Ekstraabdominalni uzroci
|
Lijekovi i toksini
|
|
Difuzni perionitis
Teške upale (pankreatitis, adneksitis)
Perforacija šupljega organa
Trauma, intraabdominalno krvarenje
Postoperativno
|
Septički šok, teške infekcije
Uremijski sindrom
Dijabetička ketoacidoza
Elektrolitni disbalans
Hipotireoza
Polineuropatije
|
Narkotici
Triciklički antidepresivi
Antiparkinsonici
Anestetici
Fenotiazidi
|
Klinička slika. Kliničke manifestacije paralitičkoga ileusa uključuju bol u trbuhu, mučninu i povraćanje te izostanak stolice i vjetrova. Prilikom kliničkoga pregleda otkriva se meteorizam, osjetljivost trbušne stijenke, auskultacijski odsutnu peristaltiku ili pretakanje, a digitorektalni pregled ukazuje na praznu ampulu.
Dijagnoza se postavlja na temelju anamneze, kliničkoga pregleda, laboratorijskih nalaza te slikovnih radioloških metoda. U laboratorijskim nalazima obično nalazimo leukocitozu, poremećaj elektrolita te otklone od acidobazne ravnoteže (metabolička acidoza). Kod tumačenja nalaza treba imati na umu da hiponatrijemija i hipokalijemija najčešće nastaju kao posljedica ileusa, a rjeđe su uzrok nastanka paralitičkoga ileusa. Nativna snimka abdomena u stojećem položaju ili na lijevom boku pokazuje dilatirane crijevne vijuge i aerolikvidne nivoe. Kolon se smatra dilatiranim ako je njegov promjer veći od 8 do 9 cm. S obzirom na to da je na temelju ovih nalaza teško razlučiti radi li se o mehaničkom ileusu, kod svih je pacijenata potrebno obaviti nativni ili kontrastni CT abdomena kako bi se eventualno uočio mehanički uzrok ileusa.
Liječenje. Osnovno liječenje podrazumijeva zbrinjavanje i terapiju uzročnoga stanja, odnosno bolesti u podlozi. Svim bolesnicima indicirano je postaviti nazogastričnu sondu te moraju biti na karenciji. Potrebno je provesti odgovarajuću intravensku rehidraciju i ispraviti elektrolitni disbalans. Također, potrebno je isključiti iz terapije sve lijekove koji podržavaju ovo stanje. Ako je ampula rektuma puna, potrebna je manualna evakuacija sadržaja te se može postaviti rektalni kateter (Darmor). Ako se navedenim mjerama liječenja ne postigne kliničko poboljšanje, indicirana je primjena neostigmina (reverzibilni antagonist acetilkolinesteraze). On se daje intravenski u bolusu od 2 mg, a kod većine bolesnika (više od 80 %) rezultirat će ponovnom uspostavom peristaltike. Ako izostane klinički učinak, lijek se može ponovno dati nakon četiri do šest sati. Kod primjene lijeka bolesnik bi trebao biti pod nadzorom, s obzirom na to da može doći do razvoja bradikardije koja dobro reagira na primjenu atropina. Primjena klizme može biti opravdana ako se u kolonu nalazi obilje crijevnoga sadržaja. Ako u potpunosti izostane učinak neostigmina, u obzir dolazi i kolonoskopska dekompresija, iako je ona tehnički teško izvodljiva i nosi rizik od nastanka perforacije. U slučajevima daljnje distenzije crijeva i pogoršanja kliničkoga stanja indicirana je operativna dekompresija.
Prognoza ponajprije ovisi o bolesti u podlozi. Rizik od nastanka perforacije ili ishemije crijeva povećan je kod bolesnika s promjerom cekuma većim od 12 cm i trajanjem bolesti dužim od šest dana.
OGILVIJEV SINDROM
Ogilvijev sindrom ili akutna količna pseudoopstrukcija izdvaja se kao poseban klinički entitet paralitičkoga ileusa koji podrazumijeva akutno nastalu dilataciju proksimalnoga kolona u odsutnosti distalne mehaničke opstrukcije, a povezan je s povećanim rizikom od perforacije. Rizični čimbenici isti su kao i za opisani paralitički ileus, iako je ovo stanje uglavnom povezano s kritično oboljelim osobama koje se nalaze u jedinici intenzivnoga liječenja i zahtijevaju strojnu ventilacijsku potporu. Klinički se kod bolesnika prati distenzija i osjetljivost trbušne stijenke uz odsutnost stolice. Dijagnoza se potvrđuje nativnom snimkom abdomena na lijevom boku koja pokazuje distenziju cekuma veću od 10 cm. Za sve je bolesnike indiciran i CT abdomena kako bi se isključio mehanički uzrok ileusa. Liječenje je istovjetno prethodno opisanome.
MEGAKOLON
Definicija. Megakolon je deskriptivni pojam koji se odnosi na promjere crijeva vidljive na nativnom radiološkom nalazu. O megakolonu govorimo kada je promjer rektosigmoidnoga dijela i descendentnoga kolona veći od 6,5 cm, ascendentalnoga kolona veći od 8 cm, a cekuma od 12 cm. Megakolon se može definirati i kao sklonost debeloga crijeva da se dilatira zbog različitih mehaničkih, nemehaničkih i upalnih uzroka. Posebni oblik čini kongenitalni megakolon i Hirschprungova bolest.
Etiopatogeneza. Prema etiologiji razlikujemo kongenitalni megakolon (Hirschprungova bolest), prethodno opisan, te stečeni megakolon. Stečeni megakolon može biti uzrokovan bilo kojim uzrokom koji dovodi do suženja lumena crijeva, a najčešće se radi o neoplazmama i upalnim suženjima. Sličnu sliku može uzrokovati i infekcija parazitom Trypanosoma cruzi (Chagasova bolest) koja invadira stijenku i razara pleksuse. Toksični megakolon javlja se kod osoba s idiopatskom crijevnom upalnom bolesti (ulcerozni kolitis), a posljedica je širenja upalnoga procesa i atonije mišićnoga sloja.
Klinička slika. Pacijenti se tuže na osjećaj nadutosti i nespecifične bolove u trbuhu. Često opisuju osjećaj nepotpunoga pražnjenja debeloga crijeva nakon defekacije te povremeno febriraju. Ovisno o uzročnoj bolesti mogu se javiti i drugi, specifični simptomi i znakovi.
Dijagnoza se postavlja na temelju radiološkoga nalaza koji ukazuje na distenziju crijevnih vijuga. Daljnja dijagnostička obrada ovisi o sumnji na osnovni proces, a najčešće uključuje nativni ili kontrastni CT abdomena te endoskopsku obradu.
Liječenje se sastoji od rješavanja i liječenja uzročne bolesti. Specifičnoga liječenja nema, mogu se provoditi simptomatske mjere (karencija, intravenska rehidracija i sl.).
HIRSCHPRUNGOVA BOLEST
Definicija. Hirschprungova bolest (kongenitalni megakolon) nastaje uslijed prirođenoga manjka intramuralnih živčanih spletova u ograničenom dijelu stijenke debeloga crijeva (obično rektumu ili sigmi), zbog čega zahvaćeni segment postaje atoničan, bez peristaltike i sužen, što dovodi do otežane pasaže crijevnoga sadržaja i posljedičnoga zadržavanja i dilatacije proksimalnih, zdravih dijelova crijeva.
Patogeneza. Bolest nastaje kao posljedica izostanka migracije neuroblasta iz neuralnoga grebena u distalni dio debeloga crijeva gdje normalno formiraju mijenterične i submukozne živčane spletove. Tako nastaje aganglionarni segment iznad unutarnjeg analnoga sfinktera u kome je odsutna peristaltika i sužen je, dok se proksimalno crijevno dilatira.
Klinička slika. Bolest se manifestira ubrzo nakon rođenja, a prva i glavna manifestacija je izostanak mekonija (prva stolica novorođenčeta), a kasnije se razvija zatvor (koji može potrajati i tjednima), meteorizam, distenzija i atrofija abdominalne stijenke kroz koju se može uočiti peristaltika.
Dijagnoza se postavlja na temelju anamneze, fizikalnoga i digitorektalnog pregleda, endoskopski te radiološki. Nativna rendgenska snimka abdomena prikazuje distendirani kolon, a za bolji prikaz koristi se kontrastni radiološki prikaz kolona. Analna manometrija je dopunska metoda koja pokaže izostanak relaksacije unutarnjega sfinktera nakon distenzije rektuma. Konačna dijagnoza i histološka obrada postižu se biopsijom cijele debljine stijenke (pod općom anestezijom).
Liječenje je operativno.
Definicija i epidemiologija. Tumori tankoga crijeva rijetka su oboljenja koja čine manje od 5 % svih tumora crijeva, a mogu biti dobroćudni (benigni) i zloćudni (maligni). Mogu se pojaviti u svakoj životnoj dobi, ali znatno su češći kod starijih osoba i nešto češći kod muškaraca u odnosu na žene.
Etiologija. Točan uzrok i mehanizam nastanka ovih tumora je nepoznat, ali se zna da povećanu sklonost tim tumorima imaju bolesnici s upalnom bolesti tankoga crijeva ili Crohnovom bolesti, određenim oblicima nasljednih polipoznih sindroma (obiteljska adenomatozna polipoza, Peutz-Jeghersov sindrom, Lynchov sindrom), a utjecaj mogu imati i neki vanjski čimbenici kao što su kroničan unos alkohola, pušenje i prekomjeran unos soli. Niža stopa pojavnosti tumora tankoga crijeva u odnosu na ostali dio probavne cijevi tumači se brzim prolaskom hrane kroz tanko crijevo (smanjeno vrijeme izlaganja potencijalnim kancerogenima), razrijeđenom sadržaju (smanjena koncentracija kancerogena), kao i alkalnosti sadržaja koja inhibira rast bakterija.
Benigni tumori češće se javljaju u mlađoj životnoj dobi, najčešće u trećem i četvrtom desetljeću života. Najčešće se radi o adenomima, leiomiomima i lipomima, dok su dezmoidni tumori, hemangiomi i hamartomi rjeđi. Benigni tumori tankoga crijeva obično nastaju u distalnom dijelu (distalni jejunum, ileum).
Maligni tumori češće se javljaju u kasnijoj životnoj dobi, obično nakon petoga desetljeća života. Najčešće se radi o adenokarcinomima, karcinoidima, limfomima te malignim tumorima vezivnoga tkiva.
Adenokarcinomi su najčešći maligni tumori tankoga crijeva. Nastaju od žljezdanoga epitela sluznice tankoga crijeva s najčešćom lokalizacijom u dvanaesniku, a kao i ostali adenokarcinomi, prema histološkoj slici mogu biti dobro i slabo diferencirani.
Karcinoidi tankoga crijeva nastaju iz enterokromafinih stanica tankoga crijeva i imaju sve veću incidenciju kod osoba srednje i starije životne dobi. Češće se pojavljuju u ileumu, a karakterizira ih biološka aktivnost i lučenje biološki aktivnih supstanci (detaljno opisano u dijelu o neuroendokrinim tumorima probavnoga sustava).
Primarni limfomi tankoga crijeva drugi su po učestalosti pojavnosti primarnih ekstranodalnih limfoma u probavnome sustavu (na prvome su mjestu želučani). S obzirom na to da su limfoidne strukture u njemu najbrojnije, primarni limfomi tankoga crijeva najčešće nastaju u ileumu.
Maligni tumori vezivnoga tkiva rjeđe se susreću, a najčešće se radi o gastrointestinalnim stromalnim tumorima (GIST) koji nastaju od intersticijskih Cajalovih stanica s najčešćom lokalizacijom u dvanaesniku, a nešto rjeđe mogu se naći i leiomiosarkomi.
Sekundarizmi (metastaze). Osim primarnih tumora, tanko crijevo može biti i sijelo metastaza koje nastaju izravnim širenjem tumora iz okolnih organa i hematogenim širenjem. Najčešće se radi o metastazama karcinoma jajnika, dojke, pluća i drugih organa probavne cijevi.
Klinička slika. Tumori tankoga crijeva obično su asimptomatski, a najčešće kliničko očitovanje je kronična sideropenična anemija koja nastaje kao posljedica dugotrajnoga krvarenja iz tumorske mase te nejasni periumbilikalni bolovi praćeni osjećajem nelagode u trbuhu. Ovisno o veličini, mogu uzrokovati djelomičnu ili potpunu opstrukciju što se može manifestirati kliničkom slikom mehaničkoga ileusa. Kod malignih tumora pojavljuju se mučnina i povraćanje uz gubitak na tjelesnoj težini i razvoj tumorske kaheksije. Kod velikih je tumora u području proksimalnoga dvanaesnika zbog pritiska na papilu Vateri moguća i slika opstruktivnoga ikterusa. Klinička slika karcinoidnih tumora praćena je pojavom simptoma i znakova koji nastaju kao posljedica otpuštanja biogenih amina (napadi crvenila, znojenja, tahikardije, proljeva i sl.). Kod većih tumora moguće je tijekom fizikalnoga pregleda trbuha napalpirati abdominalnu patorezistenciju.
Dijagnoza tumora tankoga crijeva otežana je zbog nemogućnosti lake endoskopske dostupnosti pregleda tankoga crijeva. Laboratorijske pretrage nemaju veće značenje, a najčešći nalazi uključuju sideropeničnu anemiju, patološke jetrene nalaze kod prisutnih metastaza, a uputno je i odrediti CEA tumorski marker koji može biti povišen i kod bolesnika s adenokarcinomom tankoga crijeva. Kod sumnje na karcinoid određuju se vrijednosti pojedinih biogenih amina kako je to opisano u poglavlju o neuroendokrinim tumorima probavnoga sustava. Endoskopske metode kao što su ezofagogastroduodenoskopija ili duboka enteroskopija zauzimaju važno mjesto u dijagnostici s obzirom na to da se više od 70 % malignih tumora tankoga crijeva nalazi u prvih 100 cm, a danas je na raspolaganju i endoskopija kapsulom. Slikovne metode danas su najdostupnije u dijagnostici tumora tankoga crijeva, a najčešće se izvodi kompjuterizirana tomografija.
Liječenje. Benigni tumori zahtijevaju lokalno uklanjanje, bilo endoskopski - ako je dostupno, bilo kirurškim putem - kada nije dostupno endoskopskim putem. Maligni se tumori u prvome redu liječe kirurški (radikalno uklanjanje tumorskoga tkiva s regionalnim limfnim čvorovima) nakon čega slijedi onkološko liječenje kakvo se koristi i u liječenju karcinoma debeloga crijeva (isti kemoterapijski pristup i protokoli). Liječenje primarnih limfoma i karcinoida opisano je u odgovarajućim dijelovima udžebika.
Prognoza. Petogodišnje preživljenje bolesnika s malignim tumorima tankoga crijeva ponajprije ovisi o vrsti tumora, tako da se kod adenokarcinoma kreće između 20 i 30 %, a kod gastrointestinalnih stromalnih tumora i limfoma 50 do 60 %.
U ovome dijelu bit će opisani najčešći dobroćudni i zloćudni tumori debeloga crijeva, a to su polipi kolona i polipozni sindromi te adenokarcinom debeloga crijeva.
POLIPI KOLONA
Uvod. Polip je naziv za svaku novotvorinu koja proizlazi iz sluznice crijeva te stvara makroskopski vidljivu tumorsku masu. Prema makroskopskome izgledu razlikujemo nekoliko vrsta polipa: 1) pedunkularni polip koji je sa sluznicom povezan tankom peteljkom, 2) sesilni polip koji je za sluznicu crijeva vezan širokom bazom te 3) ravni (flat) polip koji se nalazi unutar sluznice i tek se diskretno izbočuje u lumen zbog čega ga je i teže uočiti. Prema histološkim karakteristikama polipi mogu biti neoplastični (adenomatozni) koji imaju maligni potencijal te neneoplastični koji ne nose rizik od nastanka karcinoma.
NEOPLASTIČNI (ADENOMATOZNI) POLIPI – ADENOMI
Definicija i epidemiologija. Neoplastični (adenomatozni) polipi ili adenomi predstavljaju dobroćudne tumore koji nastaju uslijed neoplastične proliferacije epitelnih stanica sluznice debeloga crijeva. Mogu se javiti sporadično ili u sklopu obiteljskih polipoznih sindroma (opisano kasnije). Adenomi debeloga crijeva predstavljaju značajnu patologiju debeloga crijeva zbog svoga malignog potencijala (nastanak adenokarcinoma) te visoke učestalosti u općoj populaciji. Njihova učestalost raste sa životnom dobi te se smatra da je ona nakon 50. godine života veća od 15 % kod žena i 25 % kod muškaraca.
Etiopatogeneza. Adenomi debeloga crijeva nastaju kao rezultat poremećaja gena koji nadziru proces proliferacije i smrti epitelnih stanica sluznice crijeva. Naime, epitelni sloj crijevne sluznice podliježe kontinuiranome samoobnavljanju, dinamičkome procesu koji započinje diferenciranjem matičnih stanica smještenih u kriptama crijevne sluznice u epitelne stanice koje otpočinju svoj put prema lumenu. Naposljetku te stanice bivaju uklonjene procesom apoptoze, ekstruzije ili bivaju fagocitirane. Tijekom perioda od tri do osam dana dolazi do izmjene svih epitelnih stanica crijevne sluznice (tzv. period obrtanja). Kao rezultat navedenih genetskih abnormalnosti, na luminalnoj se površini nakupljaju epitelne stanice koje bi u normalnim okolnostima propale, što rezultira nastankom polipoidne tumorske mase. Daljnjim nakupljanjem specifičnih mutacija može nastupiti maligna transformacija adenoma u adenokarcinom što se naziva adenom-karcinom sekvenca. Geni uključeni u ove procese prikazani su u shemi u nastavku. Točan uzrok nastanka ovih genetskih promjena nije poznat, ali u taj su proces uključeni različiti rizični čimbenici kao što su genetska predispozicija, povećan unos masti i alkohola, debljina, pušenje te smanjena tjelesna aktivnost. Povećan unos voća i povrća, izvora antioksidanasa, ima zaštitnu ulogu i dokazano smanjuje rizik od nastanka polipa.
Patologija. Makroskopski, polipi debeloga crijeva mogu biti pedunkularni, sesilni i ravni, kako je prethodno opisano, dok mikroskopski razlikujemo tri glavna oblika polipa debeloga crijeva: tubularni, vilozni i tubulovilozni adenom. Rizik od maligne transformacije adenoma u adenokarcinom uvjetovan je veličinom, histološkim karakteristikama, kao i brojem samih polipa (prikazano u Tablici 4.19.).
Tubularni adenomi uglavnom su pedunkularnoga izgleda (poput maline na peteljci), a veličinom su manji od 2 cm. Najčešće se pojavljuju u rektumu i sigmoidnom kolonu, bilo sporadično, bilo kao multipli. Peteljka je uglavnom građena od vezivno-mišićnih komponenata, dok se sam adenom sastoji od razgranatih i umnoženih žlijezda obloženih psudostratificiranim epitelom u različitim stupnjevima displazije.
Vilozni adenomi uglavnom su sesilni (imaju široku osnovu) te su dimenzijama daleko veći od tubularnih, promjer im može biti i do 10 cm. Javljaju se u starijoj životnoj dobi, a također se obično nalaze u distalnim dijelovima kolona (rektosigmoid). Mikroskopski ih karakteriziraju brojne resice obložene cilindričnim epitelom i u pravilu pokazuju teži stupanj displazije nego u tubularnim adenomima.
Tubulovilozni adenomi pokazuju šaroliku patohistološku sliku te sadrže elemente i tubularnoga i viloznog adenoma. Maligna transformacija veća je što je veći udio vilozne strukture unutar samoga polipa.
|
Tablica 4.19. Rizik od maligne transformacije adenoma
|
|
Obilježje polipa
|
Visok rizik
|
Nizak rizik
|
|
Makromorfologija polipa
|
> 1,5 cm
Sesilni polipi, ravni polipi
|
< 1 cm
Pedunkularni polipi
|
|
Mikromorfologija polipa
|
Teški stupanj displazije
Vilozna struktura
|
Blagi stupanj displazije
Tubularna struktura
|
|
Broj polipa
|
Multipli polipi
|
Solitarni polipi
|
Klinička slika. Polipi debeloga crijeva u većini su slučajeva asimptomatski te se otkriju slučajno. Najčešće kliničko obilježje oboljelih je sideropenična anemija kao posljedica kroničnoga, polaganoga i okultnog krvarenja. Polipi većih dimenzija mogu uzrokovati smetnje pasaže (opstipacije), a kod većih viloznih adenoma mogu se javiti i proljevi te hipokalijemija kao posljedica pojačane mukozne sekrecije.
Dijagnoza. Zlatni standard u dijagnostici polipa debeloga crijeva je endoskopski pregled – kolonoskopija, koja osim dijagnostičkoga značaja ima i terapijsku ulogu, s obzirom na mogućnost uklanjanja polipa. Indicirana je kod asimptomatskoga oblika, kao i kod svih oboljelih sa simptomima, s nejasnom sideropeničnom anemijom i pozitivnim testom na skriveno (okultno) krvarenje. Primjenom kromoskopije (prskanje bojom) tijekom endoskopskoga pregleda debeloga crijeva postiže se bolje uočavanje manjih i ravnih polipa u odnosu na nativnu kolonoskopiju. Kontrastni radiološki pregled debeloga crijeva (irigografija) i CT kolografija također mogu imati značaj u dijagnostičkoj obradi ovih bolesnika, ali se zbog svojih nedostataka (teže ili nemoguće uočavanje ravnih polipa, nemogućnost biopsije, izlaganje radioaktivnom zračenju) rijetko izvode kod ove indikacije.
Liječenje. Osnovu liječenja polipa debeloga crijeva čini njihovo uklanjanje (polipektomija) koje se u najvećem broju slučajeva izvodi endoskopskim putem, a tek je kod manjega broja oboljelih potrebna kirurška intervencija.
Endoskopska polipektomija metoda je izbora u liječenju polipa debeloga crijeva, a pri tome se koriste različite tehnike. Pedunkularni se polipi najčešće odstranjuju tehnikom polipektomije omčom, dok se sesilni i ravni polipi odstranjuju tehnikama endoskopske mukozne ili submukozne resekcije (mukozektomija), pri čemu se u submukozu injicira tekućina čime se sluznica i patološka promjena odižu od podloge te se potom različitim tehnikama odstranjuje polip, bilo u komadu ("en bloc"), bilo komad po komad ("piecemeal fashion"). Kirurška polipektomija indicirana je kod velikih polipa i polipa koji se iz tehničkih razloga ne mogu odstraniti endoskopskim putem.
Daljnje praćenje i nadzor. Svaki se odstranjeni polip mora histološki pregledati kako bi se analizirala moguća prisutnost maligne komponente. Ako se u polipu otkrije maligna komponentna, bitno je odrediti i druge karakteristike kao što su stupanj diferenciranosti, zahvaćenost vaskularnih i limfnih struktura te udaljenost od ruba resekcije. Nepovoljni su čimbenici slaba diferenciranost, vaskularna i/ili limfna invazija te zahvaćenost resekcijskoga ruba (maligne stanice unutar 2 mm od resekcijskoga ruba). Pedunkularni polipi koji sadrže malignu komponentnu bez prisutnosti nepovoljnih čimbenika ne zahtijevaju dodatne intervencije i za njih je endoskopska polipektomija dovoljna, dok je ovakav pristup liječenju sesilnih polipa još uvijek kontroverzan. Prisutnost nepovoljnih čimbenika nalaže dodatno kirurško i/ili onkološko liječenje (kolorektalni karcinom).
Prognoza. Ako se polipi odstrane u potpunosti, izlječenje je 100 %-tno. Nakon provedenoga liječenja potrebno je daljnje redovno endoskopsko praćenje, svakih tri do pet godina, ovisno o patološkom nalazu. Kolonoskopija svakih pet godina potrebna je ako su pronađena jedan ili dva adenoma manja od jednoga centimetra. Kolonoskopija svake tri godine potrebna je ako se pronađu tri do četiri adenoma ili najmanje jedan adenom veći od jednoga centimetra. Ponavljanje kolonoskopije svake godine potrebno je ako se otkrije pet ili više malih adenoma ili ako se pronađu tri ili više adenoma od kojih je najmanje jedan veličine iznad jednoga centimetra.
NENEOPLASTIČNI POLIPI
Više od polovice polipa otkrivenih tijekom kolonoskopije čine tzv. neneoplastični polipi, odnosno izrasline crijevne sluznice koje nemaju maligni potencijal. Među najčešćim su neneoplastičnim polipima hiperplastični polipi, upalni polipi, mukozni i submukozni polipi, limfoidni polipi te juvenilni polipi.
Hiperplastični polipi najčešći su neneoplastični polipi koji nastaju uslijed prebrzoga sazrijevanja i nakupljanja epitelnih stanica. Takvi su polipi obično manjih dimenzija i smješteni su u području rektosigmoida. Ponekad hiperplastični polipi mogu sadržavati adenomatozna žarišta iz kojih je moguć razvoj adenokarcinoma.
Inflamatorni polipi javljaju se u fazi cijeljenja upalnoga procesa. Uglavnom su asimptomatski i ne stvaraju veće probleme. Potrebna je biopsija da bi se isključili neoplastični polipi.
Mukozni polipi predstavljaju nabore sluznice, dok submukozni polipi nastaju kao posljedica formiranja podsluzničkih lezija (nakupine limfnoga tkiva, lipomi, leiomiomi, fibromi).
NASLJEDNI POLIPOZNI SINDROMI
Polipoze probavnoga sustava stanja su karakterizirana pojavom multiplih polipoidnih lezija duž probavne cijevi s dominantnim zahvaćanjem tankoga i debelog crijeva. Većina polipoza probavnoga sustava genetski su uvjetovana stanja koja se nasljeđuju autosomno dominantnim ili recesivnim putem (tzv. obiteljski polipozni sindromi), no mogu se javiti i u sporadičnom, stečenom obliku (neobiteljski polipozni sindromi). Najznačajniji su obiteljski polipozni sindromi obiteljska adenomatozna polipoza, obiteljska hamartomatozna polipoza te Lynchov sindrom, dok je najznačajniji neobiteljski polipozni sindrom Cronkhite-Canada sindrom.
OBITELJSKA ADENOMATOZNA POLIPOZA
Definicija. Obiteljska adenomatozna polipoza (FAP) karakterizirana je pojavom velikoga broja adenomatoznih polipa koji nose visoki rizik od ranoga razvoja adenokarcinoma duž probavne cijevi, što se obično susreće u četvrtom desetljeću života. Učestalost ovoga sindroma u općoj populaciji iznosi 1:10 000 osoba, a u 0,5 do 1 % slučajeva odgovoran je za nastanak kolorektalnoga karcinoma.
Genetska osnova bolesti. Obiteljska adenomatozna polipoza nasljedni je genetski poremećaj koji se u više od 90 % slučajeva razvija kao posljedica mutacije APC gena, dok je u ostalih posljedica mutacije MUTYH gena.
APC gen (engl. adenomatous polyposis coli gene) smješten je na 5. kromosomu (5q21) i predstavlja tumor-supresorski gen koji je ključni regulator rasta epitelnih stanica crijevne sluznice. Pri mutaciji ovoga gena dolazi do nekontrolirane proliferacije epitelnih stanica crijevne sluznice, pri čemu nastaju brojni polipoidni adenomi koji daljnjim genetskim promjenama mogu progredirati u adenokarcinom (adenom-karcinom sekvenca). Mutacija APC gena prenosi se autosomno-dominantnim načinom nasljeđivanja. Ovisno o lokalizaciji ove mutacije, prisutnosti modificirajućih gena i/ili okolišnih čimbenika, razlikujemo četiri klinička oblika ovoga sindroma: klasični oblik, atenuirani oblik te Gardnerov i Turcotov sindrom.
MUTYH gen smješten je na 1. kromosomu (1p34.1), a njegov produkt, MYH glikozilaza, važan je enzim koji sudjeluje u procesu popravka (reparacije) molekule DNA nakon izlaganja oksidativnome stresu. Posljedično navedenoj mutaciji i manjku ovoga enzima dolazi do nakupljanja mutacija na molekuli DNA, što može rezultirati gubitkom kontrole regulacije staničnoga umnažanja i pojavom tumora. Navedena mutacija prenosi se autosomno-recesivnim načinom nasljeđivanja.
Klasični oblik adenomatozne polipoze obilježen je pojavom velikoga broja adenomatoznih polipa (više desetaka tisuća) duž kolona s najvećom koncentracijom u području distalnoga dijela. Polipi se mogu razviti i u području tankoga crijeva i želuca, ali znatno rjeđe, te ih obilježava niži maligni potencijal. Bolest se razvija u prva dva desetljeća života kada se i počinje klinički manifestirati kroz nespecifičan bol u trbuhu, proljevaste stolice i hematoheziju. Ekstraintestinalne manifestacije su rijetke (tumori mekih i koštanoga tkiva, dezmoidni tumori). Većina takvih bolesnika u dobi od četrdesete do pedesete godine razvije adenokarcinom.
Atenuirani oblik adenomatozne polipoze obilježen je nastankom manjega broja adenomatoznih polipa (oko 100) pretežno lokaliziranih u desnome kolonu, a pojava maligne alteracije javlja se nešto kasnije u odnosu na klasični oblik, obično u dobi između pedesete i šezdesete godine života.
Gardnerov sindrom oblik je adenomatozne polipoze kod koje je uz klasično intestinalno očitovanje bolesti naznačena prisutnost ekstraintestinalnih manifestacija kao što su tumori koštanoga tkiva (osteomi), tumori mekih tkiva (lipomi, fibrosarkomi), dezmoidni tumori (difuzna mezenterična fibromatoza), prekobrojni zubi te hipertrofija pigmentnoga epitela mrežnice.
Turcotov sindrom također je podtip adenomatozne polipoze koju uz intestinalno očitovanje karakterizira i pojava malignih bolesti središnjega živčanog sustava kao što su meduloblastom, glioblastom ili ependimom.
Polipoza uzrokovana mutacijom MUTYH gena (engl. MUTYH associated polyposis) fenotipski se manifestira jednako kao i atenuirani oblik adenomatozne polipoze s nešto kasnijim kliničkim očitovanjem. Ovaj oblik polipoze udružen je s povećanim rizikom od karcinoma dojke i jajnika kod žena te od tumora kože, kostiju i mokraćnoga mjehura.
Dijagnostički postupak. Dijagnoza navedenih sindroma temelji se na kliničkoj slici i kliničkom nalazu te endoskopskoj i genetskoj dijagnostici. Na obiteljski adenomatozni polipozni sindrom potrebno je pomisliti u svih bolesnika s nalazom višestrukih adenomatoznih polipa tijekom endoskopske pretrage. Kod svih bolesnika kod kojih se otkrije više od deset polipa potrebno je provesti genetsko testiranje na postojanje mutacije APC i MUTYH gena. Ako se potvrde, preporuča se endoskopski pregled i genetsko testiranje svih srodnika u prvom koljenu. Također, kod ovih je bolesnika potrebno obaviti temeljit klinički pregled i dijagnostičku obradu s ciljem isključenja gastroduodenalne manifestacije bolesti, kao i mogućih ekstraintestinalnih manifestacija (Gardnerov sindrom, Turcotov sindrom).
Liječenje. Osnovu liječenja kod ovih bolesnika čini proktokolektomija s ileoanalanom anastomozom ili totalna kolektomija s ileorektalnom anastomozom koju bi trebalo obaviti prije dvadesete godine života. Nastavak praćenja bolesnika uključuje redovne rektoskopije (u slučaju očuvanoga rektuma) i gastroskopije u vremenskim razmacima od jedne do tri godine, ako se otkriju polipi - indicirana je polipektomija. Također, kod bolesnika s adenomima gastroduodenuma ili ostatnoga rektuma u obzir dolazi i primjena sulindaka ili celekoksiba (inhibitori ciklooksigenaze 2).
OBITELJSKA HAMARTOMATOZNA POLIPOZA
Definicija. Obiteljska hamartomatozna polipoza skupina je polipoza karakterizirana prisutnošću višestrukih hamartomatoznih polipa u različitim dijelovima probavne cijevi. Hamartom predstavlja razvojnu tkivnu anomaliju građenu od stanica ili tkiva kakva se normalno nalaze u organu u kojemu je hamartom nastao. Najčešći su oblici ovoga sindroma Peutz-Jaghersov sindrom, juvenilna polipoza te Cowdenov sindrom.
Peutz-Jeghersonov sindrom označava autosomno-dominantni nasljedni poremećaj koji nastaje uslijed mutacije STK11 gena, a očituje se pojavom hamartomatoznih polipa udruženih s karakterističnim mukokutanim hiperpigmentacijama duž cijele probavne cijevi. STK11 gen (engl. serine-threonin kinase gene) nalazi se na 19. kromosomu i proizvodi protein uključen u regulaciju stanične diobe i programirane stanične smrti (apoptoze). U nedostatku toga proteina dolazi do razvoja brojnih hamartomatozih polipa u probavnoj cijevi, kao i do blokade migracije melanina prema keratinocitima, zbog čega nastaju karakteristični hiperpigmentirani areali kože i sluznica. Pojava hamartoma najizraženija je u području tankoga crijeva gdje oni mogu doseći veće dimenzije te uzrokovati mehanički ileus ili krvarenje. Iako hamartomatozni adenomi nisu maligne lezije, kod oboljelih nalazimo povećan rizik od nastanka malignih bolesti probavnih organa (želudac, tanko i debelo crijevo), kao i nekih drugih lokalizacija (gonade, gušterača). Dijagnoza se postavlja na osnovi patohistološke analize polipa te genetskoga testiranja (koje nije svugdje dostupno). Osnovu liječenja čini uklanjanje polipa (polipektomija), bilo endoskopskim putem, bilo klasičnim (operativnim) putem. Kasniji nadzor bolesnika podrazumijeva endoskopski pregled gornjega i donjeg dijela probavne cijevi s endoskopskim ultrazvukom gušterače svake dvije godine, kao i redovite kliničke preglede muških i ženskih spolnih organa.
Juvenilna polipoza označava autosomno-dominantni nasljedni poremećaj koji nastaje uslijed mutacija MADH4 (18q21.1) i BMPR1A gena (10q23.2), a očituje se pojavom multiplih (> 10) hamartomatoznih polipa duž probavne cijevi s najvećom koncentracijom u području kolona. Rizik od nastanka adenokarcinoma kod takvih bolesnika iznosi 20 %. Simptomi se većinom razvijaju u adolescenciji te uključuju pojavu rektalnoga krvarenja, anemije, nespecifičnih bolova u trbuhu, a nekada i intestinalnu opstrukciju. Kod tih se bolesnika bilježi i veća pojavnost arteriovenskih malformacija. Dijagnoza se postavlja na osnovi endoskopskoga i histološkog nalaza, kao i genetske potvrde kada je ona dostupna. Svim se bolesnicima preporuča izvođenje kolonoskopije u razmacima od jedne do tri godine s izvođenjem polipektomije, a kada se radi o ekstenzivnoj bolesti preporuča se totalna kolektomija s ileorektalnom ili ileoanalnom anastomozom.
Cowdenov sindrom (engl. PTEN hamartoma syndrome) naziv je za autosomno-dominantni nasljedni poremećaj koji nastaje kao posljedica mutacije PTEN tumor-supresorskoga gena (10q23.31), a očituje se povećanom učestalošću razvoja hamartomatoznih polipa kože, sluznice, probavne cijevi, kao i povećanom učestalošću nastanka malignih oboljenja štitne žlijezde, dojke te reproduktivnih organa. Rizik od nastanka kolorektalnoga karcinoma deset je puta veći nego u općoj populaciji. Dijagnoza se postavlja na temelju patohistološke analize polipa i genetskoga testiranja ako je dostupno. Liječenje uključuje polipektomiju i praćenje bolesnika.
LYNCHOV SINDROM (HEREDITARNI NEPOLIPOZNI KOLOREKTALNI KARCINOM, HNPCC)
Definicija. Lynchov sindrom naziv je za autosomno-dominantan nasljedni poremećaj karakteriziran razvojem ravnih (flat) adenoma (polipa) koji su povezani s nastankom kolorektalnoga karcinoma (hereditarni nepolipozni kolorektalni karcinom, HNPCC). Smatra se da je oko 3 % kolorektalnih karcinoma uzrokovano ovim sindromom. Osim uz razvoj ovoga malignoma, ovaj se sindrom povezuje i s razvojem nekih drugih malignih oboljenja (želudac, tanko crijevo, jetra i žučni kanali, bubrezi i mokraćni mjehur te endometrij i ovariji).
Etiopatogeneza. Genetski defekti koji dovode do ovoga sindroma podrazumijevaju mutacije nekih od sljedećih gena, koji sudjeluju u procesu otkrivanja i popravljanja oštećenje molekule DNA: MLH1, MSH2, MSH6 te PMS2 gen. U više od 90 % slučajeva radi se o mutacijama MLH1 i MSH2 gena. Razvoj karcinoma iz ovih adenoma (adenom-karcinom sekvenca) ubrzana je i događa se u samo nekoliko godina, dok je za razvoj karcinoma iz ostalih adenoma potrebno i više od deset godina.
Klinička slika i dijagnoza. Lynchov sindrom asimptomatska je bolest sve do pojave nekoga od mogućih malignih oboljenja koje daje odgovarajuću simptomatologiju. Kako bi se na vrijeme prepoznala mogućnost postojanja ovoga sindroma, postavljeni su Bethesda kriteriji koji sugeriraju mogućnost prisutnosti ovoga sindroma. Kod svih je bolesnika s opravdanom sumnjom na ovaj sindrom potrebno provesti genetsko ispitivanje.
Liječenje. Specifičnoga liječenja nema. Ako se razvije maligna bolest određene lokalizacije, ona se liječi prema ustaljenim načelima. Osnovni je interes prevencija nastanka ovih oboljenja kod bolesnika, a ona podrazumijeva provođenje redovnih kolonoskopskih pregleda (jednom godišnje počevši od 25. godine života), gastroskopskih pregleda (svake dvije do tri godine počevši od 30. godine života) te ginekoloških kontrola. Ženama s potvrđenim Lynchovim sindromom preporuča se histerektomija s adnekstektomijom nakon četrdesete godine ili nakon završetka reproduktivne funkcije.
CRONKHITE-CANADA SINDROM
Cronkhite-Canada sindrom rijetki je primjer polipoze probavnoga sustava koja se javlja sporadično, nevezano uz obiteljsko nasljeđivanje. Sindrom čini pojava multiplih hamartomatoznih polipa probavnoga sustava uduženih s dermatološkim poremećajima kao što su alopecija, kožna hiperpigmentacija te atrofija noktiju. Klinički tijek ovoga sindroma obilježen je povećanim rizikom od nastanka kolorektalnoga i želučanog karcinoma, kao i općenito lošom prognozom (petogodišnja stopa smrtnosti veća je od 55 %).
ADENOKARCINOM KOLONA
Definicija i epidemiologija. Adenokarcinom debeloga crijeva maligni je epitelni tumor kojega se smatra jednim od najčešćih malignoma kako kod muškaraca, tako i kod žena. Incidencija toga tumora veća je u razvijenim zemljama u odnosu na zemlje u razvoju (40/100 000 do 60/100 000), podjednako se javlja kod oba spola, obično nakon 50. godine života s vršnom incidencijom u šestome desetljeću života.
Etiopatogeneza. U razvoju adenokarcinoma debeloga crijeva ključnu ulogu imaju genetske promjene (genetska nestabilnost), kao i brojni osobni i okolišni rizični čimbenici od kojih se ponajviše ističu prehrambene navike.
Genetska osnova. Danas je jasno utvrđena povezanost između genetskih promjena epitelnih stanica debeloga crijeva i pojave adenokarcinoma (Tablica 4.20.). Navedene genetske promjene mogu biti posljedica kompleksnih zbivanja kao što su kromosomska nestabilnost, mikrosatelitna nestabilnost ili hipermetilacija nukleotida (tzv. hipermetilacijski fenotip) što može rezultirati inaktivacijom tumor-supresorskih gena (gena koji sprečavaju nastanak tumora) ili aktivacijom protoonkogena (gena koji potiču nastanak tumora), a to u konačnici i dovodi do maligne transformacije epitelnih stanica. Nastanak adenokarcinoma debeloga crijeva nije uvjetovan jednom mutacijom, nego nastaje tijekom duljega vremenskog perioda u kojemu se mutacije postupno nakupljaju i dovode do promjene normalne epitelne stanice u malignu stanicu. Mutacije koje dovode do maligne transformacije stanica u prvome redu pogađaju gene koji sudjeluju u procesima stanične diferencijacije, dijeljenja i rasta (APC, K-ras, DCC, SMAD4, p53 i sl.), zbog čega se gubi kontrola nad tim procesima i započinje umnažanje i rast.
|
Tablica 4.20. Razvoj adenokarcinoma debeloga crijeva
|
|
Normalna stanica
|
Rani adenom
|
Srednji adenom
|
Kasni adenom
|
Adenokacinom
|
|
Gen
|
APC
|
K-ras
|
DCC, SMAD4
|
p53
|
|
Lokacija
|
5q
|
12p
|
18q
|
17p
|
Osobni rizični čimbenici. Povećan rizik od nastanka adenokarcinoma debeloga crijeva imaju osobe sa sporadičnim adenomima debeloga crijeva ili nasljednim polipoznim sindromima kao što je obiteljska adenomatozna polipoza ili hereditarni nepolipozni kolorektalni karcinom, zatim osobe s idiopatskom crijevnom upalnom bolesti (Crohnova bolest i ulcerozni kolitis, osobito ako su udruženi s primarnim sklerozirajućim kolangitisom) i osobe podvrgavane zračenju abdominalnoga i/ili zdjeličnoga područja, koje imaju ureterosigmoidostomiju i bolesnici koji boluju od akromegalije.
Prehrambeni čimbenici. Masna hrana povećava rizik od nastanka adenokarcinoma debeloga crijeva uslijed pojačane stimulacije lučenja žuči, a određeni metaboliti žučnih kiselina imaju kancerogeno djelovanje. Hrana bogata biljnim vlaknima (voće, povrće) uzrokuje povećanje fekalne mase što dovodi do razrjeđenja karcinogena u lumenu debeloga crijeva te ubrzava peristaltiku, čime se skraćuje vrijeme izlaganja karcinogenima. Osim toga, voće i povrće osiguravaju dostatan unos antioksidanasa (vitamin B, C, D i E) koji imaju protektivnu ulogu.
Ostali rizični čimbenici. Od ostalih rizičnih čimbenika koji pogoduju razviju adenokarcinoma debeloga crijeva spominju se debljina, pušenje i kronični unos alkohola, dok primjena nesteroidnih protuupalnih lijekova (NSAID) i vjerojatno hipolipemika (statina) smanjuju taj rizik.
Patologija. Makroskopski tumor može poprimiti jedan od sljedećih izgleda: endofitični (ulceracija), egzofitični (poput cvjetače ili polipoidni izgled) te difuzno infiltrativni, koji zahvaća punu cirkumferenciju lumena. Tumor se može naći na bilo kojemu dijelu debeloga crijeva: cekum i ascendentni kolon (38 %), transverzni kolon (18 %), descendentni kolon (18 %) te rektum i kolon sigmoideum (35 %). Mikroskopski tumorska masa ima sve odlike adenokarcinoma. Ako histološkom slikom vlada obilje mucina, govorimo o mucinoznom adenokarcinomu, a može se naći i rjeđi oblik tumora karakteriziran izraženom fibroznom komponentom kojega nazivamo sciroznim karcinomom. Svi se kolorektalni karcinomi šire izravno kroz crijevnu stijenku infiltrirajući okolne strukture te metastatski (limfogeno, hematogeno) u limfne čvorove, jetra i pluća. Moguće je i transperitonealno širenje koje uzrokuje karcinomatozu peritoneuma praćenu stvaranjem obilnoga ascitesa. U procjeni proširenosti karcinoma debeloga crijeva koriste se Dukesova i Astler-Collerova klasifikacija.
Dukesova klasifikacija podrazumijeva četiri stadija bolesti: stadij A (karcinom unutar stijenke crijeva), stadij B (karcinom prožima cijelu stijenku), stadij C (zahvaćeni parakolični i perirektalni limfni čvorovi) i stadij D (postoje udaljene metastaze).
Astler-Collerova klasifikacija predstavlja modificiranu i proširenu Dukesovu klasifikaciju i razlikuje sedam stadija bolesti: stadij A (tumor ograničen na submukozu), stadij B1 (tumor ulazi u muskularis propriju, ali je ne zahvaća u potpunosti, limfni čvorovi nisu zahvaćeni), stadij B2 (tumor zahvaća cijelu muskularis propriju, limfni čvorovi nisu zahvaćeni), stadij B3 (tumor izravno invadira u druge organe), stadij C1 (zahvaćeni regionalni limfni čvorovi), stadij C2 (metastaze postoje u limfnim čvorovima kod arterije mezenterike) i stadij D (tumor je distalno proširen).
Klinička slika. Adenokarcinom debeloga crijeva karakterizira dug asimptomatski period, a prvo kliničko očitovanje pojava je skrivenoga (okultnog) krvarenja u stolici i razvoj kronične sideropenične anemije, zbog čega ona kod svih bolesnika iznad petoga desetljeća života mora ukazivati i na ovu bolest. Kliničke manifestacije ponajprije ovise o veličini i lokalizaciji tumora.
Tumori desnoga hemokolona daju nespecifične simptome kao što su umor, malaksalost te gubitak na tjelesnoj težini, a posljedica su sideropenične anemije uslijed kroničnoga krvarenja, obično okultnoga, rijetko manifestnoga (melena). Bolesnici se mogu žaliti na nelagodu i povremene bolove u desnome dijelu trbuha. Pojava opstrukcije (mehanički ileus) je rijetka i to zbog širokoga lumena kolona te prisutnosti neformirane, kašaste stolice u ovome dijelu kolona.
Tumori lijevoga hemikolona tipično se očituju promjenama u navikama pražnjenja crijeva. S obzirom na to da je kolon u tome dijelu užega promjera, a tumori su skloniji cirkumferentnom rastu, kao i prisutnošću formirane, tvrde stolice, stvaraju se svi preduvjeti za nastanak opstipacije praćene povremenim, grčevitim bolovima. Bolesnici često navode smjene opstipacije s pojavom učestalih, rijetkih stolica. U slučaju jačega krvarenja bolesnici mogu razviti hematoheziju (stolica pomiješana s krvlju), iako je kod većine bolesnike prisutno kronično, okultno krvarenje.
Tumori rektuma i kolona sigmoideuma najčešće su praćeni pojavom svježe krvi u stolici, bolnim nagonom na stolicu (tenezmi), kao i promjenama u promjeru stolice, dok je dubok rektalni bol kasni znak bolesti. Bolesnici često navode jutarnje proljeve koji su zapravo lažni, s obzirom na to da ih ne čini fekalna masa, nego sluz pomiješana s krvlju koja se pojačano stvara distalno od tumora. Kod nisko postavljenih tumora moguća je njihova palpacija tijekom digitorektalnoga pregleda (obično se palpiraju kao tvrde, kvrgave i bezbolne patorezistencije koje mogu kontaktno krvariti - pojava krvi na rukavici).
Ostale kliničke manifestacije. Mehanički ileus kao prva manifestacija adenokarcinoma debeloga crijeva moguća je, ali ne tako česta pojava, a svojstvena je prvenstveno tumorima lijevoga hemikolona. Kod bolesti koja duže traje razvija se tumorska kaheksija, a moguća je i pojava znakova regionalnih i udaljenih metastaza: ascites, ikterus, hepatomegalija, patološki prijelomi kostiju, kronični kašalj i dr.
Dijagnoza se postavlja na temelju anamnestičkih podataka, laboratorijskih nalaza i endoskopske obrade, a dopunjava se slikovnim metodama s ciljem određivanja proširenosti bolesti.
Laboratorijski nalazi. Najčešći laboratorijski nalaz kod bolesnika s karcinomom debeloga crijeva je sideropenična anemija koja nastaje uslijed kroničnoga (obično okultnog) krvarenja te svaka nejasna sideropenična anemija u kasnijoj životnoj dobi zahtijeva endoskopsku gastroenterološku obradu. U slučaju proširene bolesti mogu se naći i drugi patološki nalazi, kao što su povišene vrijednosti jetrenih transaminaza ili pokazatelja kolestaze (metastaze na jetri, kostima i sl.). Od tumorskih markera u dijagnostici adenokarcinoma debeloga crijeva koristi se CEA (karcinoembrionalni antigen), iako ima relativno nisku specifičnost i osjetljivost. Prijeoperativne vrijednosti CEA više od 5 ng/mL predstavljaju loš prognostički čimbenik. Praćenje vrijednosti CEA korisno je u praćenju odgovora tijekom provođenja liječenja.
Test na okultno krvarenje (hemokult-test) predstavlja test za otkrivanje krvi u stolici utemeljen na principu reagiranja kemijskih supstanci na testnoj traci s hemoglobinom iz stolice, pri čemu testna traka mijenja boju. Danas postoji više komercijalnih testova kojima se provodi hemokult-test. Osjetljivost testa na karcinom je oko 50 %, a specifičnost oko 30 %. Test može biti pozitivan i kod drugih bolesti probavne cijevi praćenih kroničnim krvarenjem, kao i kod uzimanja crvenoga mesa, željeza ili acetilsalicilne kiseline, zbog čega ih je potrebno izostaviti iz prehrane bar tri dana pred testiranje. Test u prisutnosti karcinoma može biti negativan ako se radi o intermitentnom krvarenju. Testiranje se provodi na tri uzorka stolice kroz tri dana (jedan dan - jedan uzorak). Detaljnije o testovima stolice na okultno krvarenje piše i u dijelu o probiru za karcinom debeloga crijeva.
Endoskopska dijagnostika. Kolonoskopija je metoda izbora u dijagnostici karcinoma debeloga crijeva. Ona omogućava vizualizaciju tumorske mase te uzimanje bioptičkoga materijala nužnoga za potvrdu patohistološke dijagnoze. Indicirana je kod svih bolesnika s nejasnom sideropeničnom anemijom, pozitivnim testom na okultno krvarenje te simptomima i znakovima koji mogu ukazivati na ovu bolest. Kod bolesnika kod kojih je kolonoskopija kontraindicirana ili se ne može izvesti, preporuča se CT kolonografija (tzv. virtualna kolonoskopija), ili ako ona nije dostupna - irigografija (kontrasno radiološko snimanje debeloga crijeva), iako su te metode manje pouzdane u postavljanju dijagnoze te onemogućavaju njezinu patohistološku potvrdu.
Slikovne metode služe za procjenu proširenosti bolesti. Svim je bolesnicima u prijeoperativnoj obradi potrebno napraviti kompjuteriziranu tomografiju prsnoga koša, trbuha i zdjelice, uz primjenu kontrasta, s ciljem utvrđivanja prisutnosti udaljenih metastaza i lokalne proširenosti bolesti. Magnetna rezonanca (MRI) trbuha nije dio standardne obrade, a preporuča se za sve bolesnike s karcinomom u području rektuma s obzirom na mogućnost preciznije procjene lokalne proširenosti tumora prema okolnim strukturama u odnosu na CT. Za procjenu lokalne invazije i proširenosti tumora može se koristiti i endoskopski ultrazvuk (EUS), osobito kod karcinoma rektuma. PET-CT se ne koristi rutinski u dijagnostici i praćenju bolesnika oboljelih od karcinoma debeloga crijeva, ali može biti od koristi kod odabranih bolesnika.
Karcinom debeloga crijeva mora se isključiti kod svih bolesnika u dobi iznad 40 godina, kod kojih se pojavljuju promjene u navikama pražnjenja crijeva, bolesnika s nejasnom sideropeničnom anemijom i bolesnika s pozitivnim testom na okultno krvarenje.
Diferencijalna dijagnoza. Slične kliničko-laboratorijske nalaze mogu davati i druga patološka stanja kao što su sindrom iritabilnoga kolona, divertikuloza kolona, ishemijski kolitis, idiopatska crijevna upalna bolest, infektivni kolitis, hemoroidalna bolest i sl.
Proširenost bolesti. Na temelju provedene dijagnostičke obrade određuje se proširenost, tj. stadij bolesti, a pri tome se koristi TNM klasifikacija: Tis (tumor in situ); T1 (submukoza); T2 (muskularis proprija); T3 (subseroza, perikolorektalno tkivo); T4a (visceralni peritoneum); T4b (ostale strukture); N1a (1 regionalni limfni čvor); N2b (2 - 3 regionalna limfna čvora); N1c (satelitni limfni čvor bez regionalnih limfnih čvorova); N2a (4 - 6 regionalnih limfnih čvorova); N2b (7 i više regionalnih limfnih čvorova); M0 (nema udaljenih metastaza); M1a (metastaze u jednom udaljenom organu); M2b (metastaze u više od jednoga udaljenog organa, i/ili peritoneumu) – Tablica 4.21.
|
Tablica 4.21. Klinički stadiji karcinoma debeloga crijeva
|
|
Klinički stadij
|
T (tumor)
|
N (limfni čvor)
|
M (metastaze)
|
|
0
|
Tis
|
N0
|
M0
|
|
I
|
T1, T2
|
N0
|
M0
|
|
IIa
|
T3
|
N0
|
M0
|
|
IIb
|
T4a
|
N0
|
M0
|
|
IIc
|
T4b
|
N0
|
M0
|
|
IIIa
|
T1, T2
T1
|
N1
N2a
|
M0
M0
|
|
IIIb
|
T3, T4a
T2, T3
T1, T2
|
N1
N2a
N2b
|
M0
M0
M0
|
|
IIIc
|
T4a
T3, T4a
T4b
|
N2a
N2b
N1, N2
|
M0
M0
M0
|
|
IVa
|
Bilo koji T
|
Bilo koji N
|
M1a
|
|
IVb
|
Bilo koji T
|
Bilo koji N
|
M1b
|
Liječenje. Osnovu liječenja čini kirurška resekcija tumorske mase i pripadajućih limfnih čvorova, nakon čega slijedi kemoterapija ovisno o stadiju bolesti. U liječenju karcinoma rektuma u obzir dolazi i prijeoperativna (neoadjuvantna) kemoradioterapija, kako je u nastavku opisano.
Kirurško liječenje bolesnika s karcinomom debeloga crijeva može biti kurativno i palijativno. Kurativno kirurško liječenje podrazumijeva resekciju tumorske mase zajedno s pripadajućim okolnim tkivom uz postizanje čistih reznih rubova (rubovi bez tumora) te odgovarajuću limfadenektomiju (uklanjanje više od dvanaest limfnih čvorova). Vrsta kirurškoga zahvata ovisi ponajprije o lokalizaciji tumora: desna hemikolektomija (karcinom cekuma i kolona ascendensa), resekcija kolona transverzuma (karcinom hepatalne i lijenalne fleksure, karcinom transverzuma), lijeva hemikolektomija (karcinom kolona descendensa), proširena resekcija sigme (karcinom kolona sigmoideuma), abdominalna mezorektalna resekcija (karcinom gornjega rektuma) te abdominoperinealna ekstirpacija rektosigmoida i anusa (karcinom donjega rektuma). Pri operativnim zahvatima nastoji se osigurati kontinuitet probavne cijevi anastomozom između resekcijskih rubova, a ako je to nemoguće, kod bolesnika se izvodi kolonostomija (anus preter) koja omogućava pražnjenje debeloga crijeva putem izvoda kolona na prednjoj trbušnoj stijenci. Navedeni zahvati mogu se izvoditi klasičnim putem (laparotomija) ili laparoskopski, što ovisi o karakteristikama samoga tumora i iskustvu operatera. Kod bolesnika s niskim sijelom karcinoma rektuma (na manje od 8 cm od anokutane granice), čija veličina nije veća od 4 cm i mobilni su te su dobro diferencirani u stadiju T1 ili T2, u obzir dolazi i transanalna ekscizija što predstavlja značajno poštedniji kirurški pristup u odnosu na ostale zahvate. Palijativni kirurški zahvati izvode se kod bolesnika koji imaju u osnovi inoperabilnu, proširenu bolest s ciljem osiguravanja kontinuiteta probavne cijevi, kako bolesnici ne bi razvili mehanički ileus (bipolarni anus preter, ileotransverzostomija i sl.). Posebnu skupinu bolesnika čine bolesnici s metastazama u jetri ili plućima koje su resektabilne i kod kojih je dokazana klinička dobit od izvođenja metastazektomija (kasnije opisano).
Adjuvantna kemoterapija dokazano poboljšava kliničke ishode (povećava stopu preživljenja i tzv. vrijeme bez tumora) kod određenih bolesnika, što se ponajprije temelji na stadiju bolesti kako je to u nastavku opisano. Adjuvantna radioterapija nema veće značenje kod bolesnika s karcinomom debeloga crijeva i ne indicira se u rutinskom liječenju.
U prvome stadiju bolesti prati se izvrsno petogodišnje preživljenje kod bolesnika koji su prikladno kirurški liječeni (karcinom kolona 92 %, karcinom rektuma 87 %) te se kod njih adjuvantna kemoterapija ne preporučuje.
U drugome stadiju bolesti (stadij bez zahvaćanja limfnih čvorova) također se prati značajan postotak petogodišnjega preživljenja (65 - 85 %) uz samo kirurško liječenje, a ni provedene studije nisu pokazale značajan klinički doprinos adjuvantne kemoterapije u pogledu produljenja preživljenja te se ona u rutinskom liječenju ne primjenjuje. Ipak, kod bolesnika s povećanim rizikom od recidiva bolesti (slabo diferencirana histologija; limfna, vaskularna ili perineuralna invazija; T4 tumori; nejasni resekcijski rubovi; ekstirpacija manje od dvanaest limfnih čvorova) preporuča se provođenje adjuvantne kemoterapije kako je opisano u trećem stadiju bolesti.
U trećem stadiju bolesti (stadij sa zahvaćanjem limfnih čvorova) adjuvantna kemoterapija dokazano i jasno pokazuje pozitivan učinak na petogodišnje preživljenje i indicirana je kod svih bolesnika. Najčešće se primjenjuje FOLFOX protokol koji se sastoji od kombinacije oksiplatine, 5-fluorouracila i leukovorina, a dobre rezultate daje i CAPOX protokol u kojemu su 5-fluorouracil i leukovorin zamijenjeni kapecitabinom. Liječenje se obično provodi kroz šest mjeseci nakon kirurškoga zahvata, a kod bolesnika s T1-3 i N1 može trajati i tri mjeseca, s obzirom na to da pokazuje jednaku učinkovitost uz znatno nižu stopu komplikacija kao što je neuropatija.
Četvrti stadij bolesti (metastatska bolest) otkrije se kod oko 20 % bolesnika u trenu postavljanja dijagnoze i planiranja liječenja. Dio bolesnika s izoliranim metastazama u jetri ili plućima može se podvrgnuti metastazektomiji što zajedno s uklanjanjem primarnoga tumora i kemoterapijom rezultira značajnim produljenjem preživljenja. Uklanjanje metastaza moguće je obaviti unutar istoga postupka kao i uklanjanje primarnoga tumora, ili odvojeno - nakon resekcije primarnoga tumora i provedene adjuvantne kemoterapije. Kemoterapija kod bolesnika s metastatskom bolesti (bilo da se radi o operabilnoj ili inoperabilnoj bolesti) temelji se na kombinaciji oksiplatine, 5-fluorouracila, irinotekana i leukovorina (FOLFOX protokol, FOLFIRI protokol), a danas se u sve većoj mjeri kod ovih bolesnika zajedno s klasičnim kemoterapeuticima koriste i biološki lijekovi i to već u prvoj liniji liječenja. Takvi su lijekovi anti-VEGF protutijelo (bevacizumab), usmjeren na vaskularni endotelni čimbenik rasta, a primjenjuje se kod bolesnika neovisno o RAS statusu tumora, te anti-EGFR protutijela (cetuximab, panitumumab), usmjerena na receptore za epidermalni čimbenik rasta, a primjenjuju se kod bolesnika s RAS-nemutiranim tumorima (tzv. divlji tipovi). Dodavanjem tih lijekova klasičnim kemoterapeuticima postiže se produljenje preživljenja u prosjeku za tri do šest mjeseci. Ako se unatoč navedenim protokolima liječenja kod ovih bolesnika primjećuje daljnja progresija bolesti, na raspolaganju stoje alternativni protokoli i lijekovi (druga linija liječenja). U drugoj liniji liječenja mogu se kombinirati novi inhibitori angiogeneze (aflibercept, mucirumab) zajedno s kemoterapijskim protokolima utemeljenim na irinotekanu ili se može pokušati s kombinacijom trifuridina (inhibitor sinteze DNAO-a) i tipiracila (inhibitor lučenja angiogenih faktora i inhibitor rasta epitelnih stanica).
Neoadjuvantna kemoradioterapija karcinoma rektuma. Pristupi liječenju karcinoma kolona i rektuma razlikuju se u nekim koracima, a odnose se na II i III stadij bolesti (I i IV stadij bolesti jednako se liječe, kako je prethodno opisano). S obzirom na teže postizanje zadovoljavajućega kirurškog uklanjanja primarnoga tumora, kod bolesnika s karcinomom rektuma u II i III stadiju bolesti, potvrđeno na temelju nalaza endoskopskoga ultrazvuka i/ili MRI male zdjelice, primarno se izvodi neoadjuvantna kemoradioterapija nakon čega se pristupa kirurškome liječenju šest do osam tjedana kasnije. Cilj je takvoga pristupa smanjiti i ograničiti primarni tumor (engl. downstaging) kako bi ga se učinilo pogodnijim za kirurško uklanjanje. Bez obzira na provođenje neoadjuvantne kemoterapije, nakon kirurškoga zahvata kod bolesnika s karcinomom rektuma u trećem stadiju indiciran je nastavak liječenja kemoterapijom istim protokolima kao i za karcinom kolona (ranije opisano). Ukupno trajanje specifičnoga onkološkog liječenja trebalo bi biti oko šest mjeseci.
Praćenje bolesnika. Redovne kontrole bolesnika oboljelih od adenokarcinoma debeloga crijeva uključuju praćenje tumorskoga markera CEA, MSCT prsnoga koša, abdomena i male zdjelice, kao i kolonoskopske preglede. Klinički pregledi s određivanjem CEA tumorskoga markera provode se svaka četiri mjeseca tijekom prve dvije godine bolesti, potom svakih šest mjeseci od druge do pete godine, a nakon toga jednom godišnje. MSCT prsnoga koša, abdomena i male zdjelice provodi se jednom godišnje u prvih pet godina za bolesnike dijagnosticirane u drugom i trećem stadiju bolesti. Prva kontrolna kolonoskopija provodi se godinu dana od operativnoga liječenja ako je prije operacije obavljena kompletna kolonoskopija, a ako ona nije bila kompletna, prvu kontrolnu kolonoskopiju potrebno je napraviti tri do šest mjeseci od operativnoga zahvata. Ako je kontrolna kolonoskopija uredna, dalje se provodi svakih tri do pet godina. Ako se tijekom praćenja bolesnika bilježi porast CEA ili bolesnici navode simptome recidiva, potrebno je napraviti MSCT prsnoga koša, abdomena i male zdjelice te kolonoskopiju, kako bi se utvrdio lokalni recidiv ili pojava udaljenih metastaza. Ako se to ovim pretragama ne dokaže, uputno je učiniti PET-CT.
Prognoza bolesnika s karcinomom debeloga crijeva ponajprije ovisi o stadiju bolesti u vremenu postavljanja dijagnoze. Načelno gledano, karcinomi kolona imaju nešto povoljniju prognozu od karcinoma rektuma. Ukupno petogodišnje preživljenje bolesnika s prvim stadijem bolesti iznosi preko 90 %, s drugim stadijem bolesti 70 - 80 %, s trećim stadijem bolesti 40 - 60 %, a s četvrtim stadijem bolesti 20 - 40 % kada je bolest operabilna, a kada je inoperabilna, prosječno preživljenje iznosi oko 24 mjeseci.
Probir bolesnika za karcinom debeloga crijeva. S obzirom na činjenicu da je karcinom debeloga crijeva izlječiva bolest kada se pravodobno otkrije, metode probira imaju izuzetno velik javnozdravstveni značaj. U tom pogledu razlikujemo osobe s niskim, srednjim i visokim rizikom od razvoja karcinoma debeloga crijeva (prikazano u Tablici 4.22.) te se kod njih nalažu određene mjere probira. Kod osoba srednjega rizika metode probira treba započeti nakon pedesete godine života, dok se kod osoba s visokim rizikom trebaju početi provoditi i ranije, prije četrdesete godine. U metode probira za karcinom debeloga crijeva ubrajamo testiranje stolice na okultno krvarenje i DNA te endoskopske i radiološke metode.
|
Tablica 4.22. Procjena rizika od nastanka karcinoma debeloga crijeva
|
|
Nizak rizik
|
Srednji rizik
|
Visok rizik
|
|
Starosna dob ≥ 50 godina;
Negativna osobna anamneza na adenome debeloga crijeva;
Negativna osobna anamneza za uplane bolesti crijeva;
Negativna obiteljska anamneza za malignome debeloga crijeva.
|
Pozitivna osobna anamneza na adenome debeloga crijeva;
Ranije dijagnosticirana maligna bolest endometrija i/ili jajnika;
Pozitivna osobna anamneza na upalne bolesti crijeva;
Pozitivna obiteljska anamneza.
|
Maligna bolest crijeva u mlađoj životnoj dobi (prije pedesete godine);
Pozitivna osobna ili obiteljska anamneza na nasljedne polipozne sindrome;
Pozitivna osobna ili obiteljska anamneza na HNPCC.
|
Testiranje stolice. Među metodama probira za karcinom debeloga crijeva velik značaj ima testiranje stolice. Danas su na raspolaganju dvije metode probira stolice: testiranje stolice na okultno krvarenje i DNA testiranje stolice. Testovi stolice na okultno krvarenje danas se najčešće provode u svakodnevnoj praksi. Klinički značaj ovoga testiranja leži u činjenici da karcinomi i veliki adenomi dovode do kroničnoga, polaganog krvarenja koje nije makroskopski vidljivo, a može se detektirati ovim testiranjem. Na raspolaganju su dvije metode: testovi koji detektiraju pseudoperoksidaznu aktivnost hema, kao i fekalni imunokemijski testovi koji detektiraju prisutnost humanoga globina u uzorku stolice. Imunokemijski testovi pokazuju veću osjetljivost i specifičnost s obzirom na to da nisu pod utjecajem prehrane ili lijekova. DNA testiranje stolice provodi se u novije vrijeme, a podrazumijeva detekciju DNA (genskih biljega) koji potječu od raspadnutih tumorskih stanica.
Endoskopske metode. Kolonoskopija i fleksibilna kolonoskopija predstavljaju metode izbora u probiru za karcinom debeloga crijeva. Indicirane su kod svih bolesnika sa simptomima koji mogu upućivati na ovaj karcinom, s nejasnom sideropeničnom anemijom te u svih bolesnika koji imaju pozitivan test stolice na okultno krvarenje ili tumorsku DNA. One omogućavaju vizualizaciju stijenke debeloga crijeva, uočavanje promjena te njihovu biopsiju ili potpuno uklanjanje. Kolonoskopija kapsulom u praksi se rijetko provodi.
Radiološke metode imaju manji značaj u probiru ovakih bolesnika, a u tu se svrhu najčešće primjenjuju CT kolonografija (virtualna kolonoskopija) i irigografija (kontrastni prikaz debeloga crijeva). CT kolonografija ima osjetljivost veću od 95 % za otkrivanje karcinoma i veću od 85 % za otkrivanje polipa veličine 1 cm i više, dok je za otkrivanje polipa manjih od 1 cm te ravnih i nazubljenih polipa manje osjetljiva od kolonoskopije.
Strategija provođenja metoda probira za karcinom debeloga crijeva stvara se u javnozdravstvenim ustanovama. U Hrvatskoj se provodi „Nacionalni program ranog otkrivanja raka debelog crijeva“ kojime su obuhvaćene sve osobe u dobi između 50. i 74. godine, a probir se temelji na slanju testova za okultno krvarenje na kućnu adresu.
NEUROENDOKRINI TUMORI PROBAVNOGA SUSTAVA
Uvod. Neuroendokrini tumori rijetka su skupina tumora porijeklom od endokrinih stanica koje karakterizira biološka aktivnost, odnosno mogućnost stvaranja i lučenja različitih tvari, poput biogenih amina i polipeptidnih hormona. Ovi tumori potječu od najmanje petnaest različitih pluripotentnih enteroendokrinih stanica difuznoga endokrinog sustava koje su rasprostranjene duž otočića gušterače i stijenki probavnih organa, pa su i najčešće lokalizacije ovih tumora organi probavne cijevi (želudac, dvanaesnik, tanko crijevo, apendiks, kolon i rektum) te gušterača. Stanice neuroendokrinih tumora sadrže granule u kojima su pohranjene različite kemijske tvari poput biogenih amina (serotonin, dopamin, histamin), kromogranina A te polipeptidnih hormona, a njihovo lučenje dovodi do karakterističnih kliničkih sindroma (tzv. hipersekrecijski sindromi). Također, stanice neuroendokrinih tumora imaju mogućnost stvaranja i lučenja različitih čimbenika rasta i citokina koji djeluju na sam tumor (preko receptora na svojoj površini) potičući rast tumorskoga tkiva, ali djeluju i na okolno, zdravo tkivo (autokrino i parakrino djelovanje tumora). Neuroendokrini tumori najčešće se javljaju sporadično, ali mogu se javiti i u sklopu genetski uvjetovanih sindroma kao što su sindrom multiple endokrine neoplazije, neurofibromatoza tip I te Von Hippel-Lindau sindrom. Kliničke manifestacije posljedica su samoga rasta tumora te njegove biološke aktivnosti (hipersekrecijski sindrom). Neuroendokrini tumori najčešće rastu sporo i kasno metastaziraju, pa je i život bolesnika više ugrožen nekontroliranim lučenjem hormona nego invazivnim rastom tumora.
Klasifikacija. Postoje brojne klasifikacije i podjele neuroendokrinih tumora. Jedna od najpoznatijih je klasifikacija Williamsa i Sandlera iz 1963. godine, zasnovana na podjeli prema embriogenom porijeklu tumora, dok je danas najčešće korištena klasifikacija Svjetske zdravstvene organizacije iz 2000. godine kod koje je podjela stvorena na osnovi karakteristika samoga tumora (veličina, patohistološka obilježja te invazivnost tumora).
Williamsova i Sandlerova klasifikacija neuroendokrinih tumora zasnovana na embriogenom porijeklu razlikuje neuroendokrine tumore prednjega crijeva (bronhi, pluća, timus, želudac, gušterača, žučni mjehur, dvanaesnik), neuroendokrine tumore srednjega crijeva (jejunum, ileum, apendiks, uzlazni kolon) te neuroendokrine tumore stražnjega crijeva (poprečni kolon, silazni kolon, sigmoidni kolon i rektum). Prema zastupljenosti, 40 do 60 % neuroendokrinih tumora porijeklom je iz srednjega crijeva, 25 % iz prednjega, a ostatak pripada neuroendokrinim tumorima stražnjega crijeva.
Klasifikacija Svjetske zdravstvene organizacije iz 2000. godine tumore dijeli prema primarnome sijelu (želudac, gušterača, tanko crijevo, apendiks, kolon i rektum), patološkim karakteristikama (veličina tumora, broj mitoza, angioinvazivnost, metastaze) te kliničkim karakteristikama (asimptomatski ili klinički prepoznatljiv sindrom). Svrstavaju se u jednu od tri skupine: dobro diferencirani neuroendokrini tumori, dobro diferencirani neuroendokrini karcinomi te slabo diferencirani neuroendokrini karcinomi (Tablica 4.23.).
|
Tablica 4.23. Klasifikacija neuroendokrinih tumora, Svjetska zdravstvena organizacija, 2000. g
|
|
Dobro diferencirani neuroendokrini tumori
|
Dobro diferencirani neuroendokrini karcinomi
|
Slabo diferencirani neuroendokrini karcinomi
|
|
Benigni
|
Maligni niskoga stupnja
|
|
Ograničen od okoline
Manji od 2 cm
Nema angioinvazije
Manje od 2 mitoze
Manje od 2 % Ki67 stanica
Funkcionalno aktivan ili inaktivan
|
Ograničen od okoline
Veći od 2 cm
Više od 2 % Ki67 stanica
Moguća angioinvazija
Funkcionalno aktivan ili inaktivan
|
Malignost niskoga stupnja
Invazija okolnih organa i/ili metastaze
Funkcionalno aktivan ili inaktivan
|
Malignost visokoga stupnja
Metastaze, lokalna invazija, angioinvazija
Više od 30 % Ki67 stanica
Bez prepoznatljivoga hormonskog sindroma
|
Klinička klasifikacija. Prema kliničkoj slici razlikujemo asimptomatske (nijeme) i funkcionalne neuroendokrine tumore, ovisno o sposobnosti lučenja biološki aktivnih tvari koje dovode do određenih kliničkih manifestacija. Kod funkcionalnih (aktivnih) tumora, klinička slika hipersekrecijskoga sindroma često se javlja znatno ranije prije nego se i otkrije sijelo (lokacija) tumora. I nijemi neuroendokrini tumori luče biološki aktivne tvari, samo je to povremeno ili ispod razine koja je potrebna da bi izazvala poremećaj homeostaze organizma i rezultirala kliničkim manifestacijama.
Epidemiologija. Neuroendokrini tumori rijetka su skupina tumora. Pojavnost ovih tumora procjenjuje se na dva do četiri oboljela na 100 000 osoba godišnje, no ako uključimo i one otkrivene na obdukcijama, incidencija raste na šest do osam oboljelih na 100 000. Povećana incidencija ovih tumora smatra se posljedicom bolje dijagnostike (napredne imunohistokemijske i molekularno-genetičke metode, kao i bolje slikovne metode), a ne stvarnoga povećanja oboljelih od tih tumora. Tumori se nešto češće javljaju kod žena nego kod muškaraca, ali bez većih razlika. Također, pojavnost neuroendokrinih tumora veća je kod osoba s obiteljskom anamnezom pozitivnom na neuroendokrine tumore, tako da osoba ima četiri puta veći rizik od oboljenja ako od neuroendokrinoga tumora boluje jedan član uže obitelji, a dvanaest puta veći rizik ako od njega boluju dva člana uže obitelji. Pokazalo se da osobe koje imaju dijagnosticirani neuroendokrini tumor imaju veći rizik od razvoja druge maligne bolesti, poglavito malignoma probavnoga sustava.
Etiopatogeneza. Kao i kod ostalih tumora, točan uzrok i mehanizam nastanka neuroendokrinih tumora nije poznat. Ipak, značajna povezanost učestalosti neuroendokrinih tumora s pozitivnom obiteljskom anamnezom ukazuje na moguću genetsku osnovu bolesti. Također, pojavnost ovih tumora povezuje se i s kroničnim upalama s obzirom na to da se često razvijaju na njihovoj podlozi (kronični gastritis, upalna bolest crijeva).
Genetska podloga nastanka neuroendokrinih tumora objašnjena je slijedom genetskih događanja koja dovode do nastanka tumora. Ona podrazumijevaju inaktivaciju tumor-supresorskih gena te aktivaciju protoonkogena (Kundsova hipoteza dvostrukoga udarca). Velik napredak u razumijevanju genetske podloge ovih tumora dalo je istraživanje sindroma multiple endokrine neoplazije koju karakterizira mutacija MEN-1 gena, tumor-supresorskoga gena smještenoga na jedanaestome kromosomu čiji produkt, protein menin, sudjeluje u procesima transkripcije i replikacije molekule DNA. Gubitak MEN-1 gena karakterističan je za neuroendokrine tumore prednjega crijeva gdje je gubitak dokazan u 41 % sporadičnih i 75 % nasljednih oblika tumora. Neuroendokrini tumori srednjega crijeva rijetko pokazuju gubitak MEN-1 gena, a za njih je karakterističniji gubitak distalnoga dijela 11q na kojemu je smješten tumor-supresorski gen SDHD (sukcinat-ubikvinon oksidoreduktaza podjedinica D). Najslabije je poznata genska podloga neuroendokrinih tumora stražnjega crijeva. Kod njih se otkriva povećana ekspresija receptora za epidermalni faktor rasta (EGF) te transformirajući čimbenik rasta alfa (TGF-α).
Kronična upala. Neuroendokrini tumori su spororastući tumori, a kao i kod ostalih tumora, na njihov rast utječu brojni citokini i faktori rasta. Da citokini i faktori rasta uistinu utječu na rast i promociju neuroendokrinih tumora, govori i činjenica da sami tumori nastaju na podlogama kroničnih upala (u želucu na podlozi kroničnoga gastritisa, a u kolonu na podlozi upalne bolesti crijeva), uz to i same stanice tumora luče citokine i faktore rasta. Kronična upala u tumorogenezi ima dvojnu ulogu, s jedne strane protuupalni citokini sudjeluju u eliminaciji tumorskih stanica, a aktivacija proupalnih citokina i faktora rasta dovodi do poticanja tumorskoga rasta i metastaziranja. Citokini i čimbenici rizika potiču rast tumora, invazivnost i metastaziranje na razini molekule DNA te autokrinim i parakrinim djelovanjem na zloćudno izmijenjene stanice.
Ostali čimbenici tumorogeneze. Danas se sve više istražuje povezanost polimorfizama gena za citokine i čimbenike rasta koji su povezani s nastankom i napredovanjem tumora. U ovome se kontekstu najčešće spominju citokini i faktori rasta koje nalazimo u upali (TNF-alfa, IL-1beta, IL-2, IL-6), imunosupresiji (IL-10) i angiogenezi (VEGF, IL-8, IL-10).
Klinička slika neuroendokrinih tumora je različita. Sami tumori dugo mogu biti asimptomatski te se otkriju slučajno, a načelno razlikujemo dvije vrste simptoma: simptome koji su posljedica same lokalizacije i rasta tumora (lokalni simptomi) te simptome koji su posljedica biološke aktivnosti (hipersekrecijski sindrom).
Lokalni simptomi posljedica su samoga smještaja i rasta tumora. S obzirom na to da neuroendokrini tumori sporo rastu, često se u kliničkom tijeku najprije javljaju hipersekrecijski sindromi, a tek potom sindromi lokalne kompresije, kao što su dispeptičke tegobe kod želučane lokalizacije ili slika mehaničkoga ileusa kod crijevne lokalizacije, čemu pridonosi dezmoplastična reakcija mezenterija kao posljedica lučenja faktora rasta iz tumora.
Hipersekrecijski sindrom nastaje kao posljedica sposobnosti tumora da luče veći broj bioloških amina i polipeptida. Hipersekrecijski sindrom ovisi o samoj vrsti neuroendokrinoga tumora, odnosno dominantnoj tvari koju luče. Tako primjerice gastrinomi uslijed pojačane sekrecije gastrina dovode do ulceracija i krvarenja iz želuca i dvanaesnika (Zollinger-Ellisonov sindrom), dok se vipom koji dovodi do hipersekrecije vazoaktivnoga intestinalnog peptida manifestira vodenastim proljevima i hipokalijemijom (Verner-Morrisonov sindrom). Ipak, velika većina neuroendokrinih tumora, osim dominantne tvari, luči i ostale tvari kao što su serotonin, različite vazoaktivne tvari i citokine, što uvjetuje nastanak tzv. karcinodinoga sindroma. Karcinoidni sindrom obilježen je iznenadnim pojavama proljeva, brohnospazama, crvenila u licu, tremorom i sličnim simptomima te uglavnom ukazuje na postojanje jetrenih metastaza neuroendokrinih tumora. Sekrecija hormona iz tumora može biti stalna ili pulsatilna, pa o tome i ovisi hoće li klinička slika biti kontinuirana ili pulsatilna.
Hipersekretorna kriza. Najopasnije kliničke manifestacije neuroendokrinih tumora su tzv. hipersekretorne krize koje obilježavaju lučenje biogenih amina i polipeptidnih hormona u velikim količinama, a mogu dovesti do značajnoga narušavanja homeostatskih mehanizama, a nekada mogu završiti i fatalnim ishodom (ekstremne hipertenzije ili hipotenzije, protrahirani bronhospazam, pojava malignih aritmija i sl.). To se često dogodi prilikom manipulacije samim tumorom (npr. endoskopski ili kirurški zahvati).
Dijagnoza neuroendokrinih tumora temelji se na kliničkoj slici, specifičnim laboratorijskim pretragama, slikovnim metodama te konačno, patohistološkoj verifikaciji tumora. S obzirom na široku varijabilnost kliničke slike i rijetkost ovih tumora, sumnja na ove tumore na temelju kliničke slike je rijetka, a često se događa da bolesnike prije konačne dijagnoze obrađuju različiti specijalisti.
Laboratorijska dijagnostika. Specifični serumski i urinarni biljezi neuroenokrinih tumore su kromogranin A (CgA) te 5-hidroksiindol octena kiselina (5-HIAA). Njihovo određivanje ima ulogu u samoj dijagnostici, ali i praćenju razvoja bolesti te uspješnosti terapije.
Kromogranin A (CgA) se u značajnim količinama luči iz stanica neuroendokrinih tumora. Glavna mu je karakteristika ta što se luči i kod sekrecijski aktivnih i sekrecijski inaktivnih tumora, pa je bitan i u dijagnostici nefunkcionalnih neuroendokrinih tumora (onih koji ne luče specifične amine i hormone). Njegova serumska vrijednost korelira s veličinom tumora, a pad inicijalne vrijednosti za 50 % nakon početka terapije dobar je prognostički znak. Vrijednosti CgA iznad 75 nmol/L povezani su s lošijom prognozom, a petogodišnje preživljenje osoba s visokim vrijednostima CgA značajno je niže (22 %) u odnosu na osobe s nižim vrijednostima CgA (63 %). Osobe tretirane s analozima somatostatina imaju niže vrijednosti CgA što treba uzeti u obzir prilikom interpretacije nalaza u takvih bolesnika.
5-hidroksiindol octena kiselina (5-HIAA) predstavlja metabolit serotonina čije povišene vrijednosti sugeriraju na metastatsku, proširenu bolest (jetrene metastaze). U tim slučajevima vrijednost 5-HIAA dobro korelira s veličinom i/ili brojem jetrenih metastaza te kliničkom slikom karcionoidnoga sindroma.
Kod jasno izraženih hipersekretornih sindroma određuju se i vrijednosti pojedinih hormona, npr. gastrina kod sumnje na gastrinom, glukagona kod sumnje na glukagonom i sl. Također, kod sumnje na sindrom multiple endokrine neoplazije (MEN sindrom) potrebno je odrediti i vrijednosti parathormona, kalcitonina, prolaktina, katekolamine, vanil-mandeličnu kiselinu, kortizol te adenokortikotropni hormon.
Klasične radiološke metode kao što su radiogram gastroduodenuma s pasažom, irigografija ili ultrazvuk manje su pouzdane i vrijedne kod sumnje na neuroendokrine tumore. Nešto bolje rezultate u otkrivanju neuroendokrinih tumora, posebice primarnoga sijela, daju kompjuterizirana tomografija i magnetna rezonanca (osjetljivost se kreće oko 64 % za CT, a 56 % za MR). Također, sve veću ulogu u detekciji neuroendokrinih tumora ima i pozitron emisijska tomografija koja može detektirati leziju manju od 5 mm, ali ipak još nije postala standard u dijagnostici.
Endoskopske metode. Veliku ulogu u dijagnostici neuroendokrinih tumora organa probavne cijevi imaju endoskopske pretrage uz korištenje endoskopskoga ultrazvuka. One omogućavaju vizualizaciju same lezije, uzimanje uzoraka za patohistološku obradu, ali i ultrazvučno određivanje dubine tumorske invazije.
Oktreoscan. Današnji zlatni standard u dijagnostici neuroendokrinih tumora predstavlja scintigrafija somatostatinskih receptora oktreotidom (oktreoscan). Pretraga se temelji na činjenici da tumorske stanice neuroendokrinih tumora obiluju receptorima za somatostatin, pa se primjenom njegova radioobilježenog analoga oktreotida mogu prikazati tumori uz pomoć gama kamere. Senzitivnost metode kreće se oko 90 % za otkrivanje neuroendokrinih tumora prednjega, srednjeg i stražnjeg crijeva, dok je relativno mala za otkrivanje inzulinoma jer njegove stanice imaju malu ekspresiju receptora za somatostatin.
Patohistološka verifikacija tumora daje konačnu dijagnozu na temelju čega se onda mogu provoditi i specifične metode liječenja pojedinih neuroendokrinih tumora. Brojne su metode patohistološkoga dokazivanja vrste neuroendokrinoga tumora: imunohistokemijski prikaz specifičnoga neuroendokrinog tumorskog tipa, in situ hibridizacija i dokaz mRNA za specifični peptid u tumorskome tkivu i sl.
Liječenje neuroendokrinih tumora ide u dva smjera, jedan je usmjeren na eliminaciju i uništenje samoga tumora (kirurški postupci, kemoterapija), a drugi je usmjeren na ublažavanje simptoma nastalih hipersekrecijom (simptomatska terapija).
Kirurško liječenje (resekcija tumora) glavna je metoda liječenja, poglavito ako je tumor ograničen i nije metastazirao. Tada je uspjeh liječenja 100 %-tan. Ipak, u trenutku postavljanja dijagnoze i pronalaska samoga primarnog tumora, većina je neuroendokrinih tumora metastazirala, pa je uspjeh kirurškoga liječenja lošiji i mora ga se nadopunjavati drugim metodama.
Kemoterapija nije pokazala veći uspjeh u liječenju neuroendokrinih tumora. Karakteristično, kemoterapija pokazuje uspjeh obrnuto proporcionalan nalazu oktreoscana. Tek kod 10 % bolesnika s pozitivnim nalazom oktreoscana može se očekivati dobar odgovor na kemoterapiju. Najbolji odgovor na kemoterapiju pokazuju slabo diferencirani i anaplastični neuroendokrini tumori. Liječenje neuroendokrinih tumora radiofarmacima podrazumijeva nekoliko pretpostavki: da se izotop dobro nakuplja u tumoru, da u njemu ostane dovoljno dugo te da se nevezani dio što prije izluči iz tijela. Najčešće se u tu svrhu koristi oktreotid obilježen 111-indijem koji ulazi u tumorske stanice te u njima dovodi do ionizacije stvarajući lokalnu radijaciju tumora.
Liječenje metastaza. Najčešće sijelo metastaza neuroendokrinih tumora su jetra, pa su usavršene brojne metode liječenja jetrenih metastaza: resekcija metastaza ako je moguća, ligacija i embolizacija hepatalne arterije, infiltracija etanolom ili viskokofrekventna ablacija. Rezultat ovih metoda temelji se na ishemiji i odumiranju tumorskih stanica. Također, navedene se metode moraju često ponavljati, a svaka manipulacija dovodi do opasnosti od razvoja hipersekretorne krize. Kod bolesnika s multiplim jetrenim metastazama navodi se i transplantacija jetre kao moguća terapijska opcija.
Simptomatsko liječenje je raznoliko i ponajprije ovisi o vrsti neuroendokrinoga tumora, tj. hipersekrecijskoga sindroma koji potencira. Kontrola hipersekrecije može se postići na dva načina: inhibicijom lučenja hormona iz tumorskih stanica ili blokiranjem učinka izlučenih hormona na ciljna tkiva (npr. blokada želučane sekrecije kod gastrinoma). Najčešći blokator sekrecije hormona iz neuroendokrinih tumora je oktreotid. Oktreotid je sintetski analog somatostatina koji učinkovito smanjuje lučenje hormona iz neuroendokrinih tumora prednjega, srednjeg i stražnjeg crijeva, a danas se spominje i njegov antiproliferacijski učinak jer inhibira i lučenje čimbenika rasta. Na raspolaganju su nam oblici za supkutanu primjenu koji se daju dva puta na dan te intramuskularni pripravci koji se daju svaka dva do četiri tjedna. Nuspojave oktreotida su intolerancija glukoze, kolelitijaza te hipokalcijemija.
NEUROENDOKRINI TUMORI ŽELUCA
Definicija i epidemiologija. Neuroendokrini tumori želuca čine oko 8 % neuroendokrinih tumora probavnoga sustava. Iako su najčešće asimptomatski i benignoga tijeka, pojedini sporadični neuroendokrini želučani tumori mogu imati agresivan tijek. Češće se javljaju kod osoba s kroničnom hipergastrinemijom (perniciozna anemija, kronični atrofični gastritis, Zollinger-Ellisonov sindrom). Najčešća dobna pojavnost je između petoga i sedmog desetljeća života s češćom pojavnošću kod žena.
Klasifikacija. Razlikujemo tri oblika neuroendokrinih tumora želuca (tip I, tip II, tip III) koja imaju različite etiološke čimbenike i različitu prognozu.
Tip I želučanoga neuroendokrinog tumora najčešći je oblik (75 - 80 %). Etiopatogenetski je povezan s kroničnim atrofičnim gastritisom i pernicioznom anemijom (stanja povezana s hipergastrinemijom). Nastaje iz enterokromafilnih stanica uslijed dugotrajne stimulacije gastrinom. Tumori su obično mali i multipli, najčešće lokalizirani u tijelu želuca. Imaju povoljno biološko ponašanje, najčešće su asimptomatski i rijetko metastaziraju, stoga se smatraju indolentnim i benignim tumorima.
Tip II želučanoga neuroendokrinog tumora najrjeđi je oblik (manje od 5 %). Etiopatogenetski je povezan s hipergastrinemijom koja je posljedica pojačanoga lučenja gastrina iz gastrinoma (Zollinger-Ellisonov sindrom). Patološke i biološke karakteristike slične su kao i kod tipa I: asimptomatski, multipli, spororastući, niskoga malignog potencijala.
Tip III želučanoga neuroendokrinog tumora javlja se sporadično i nije povezan s hipergastrinemijom, a čini oko 20 % želučanih neuroendokrinih tumora. Za razliku od prva dva, ovaj je tip povezan s agresivnim ponašanjem. Preko 65 % bolesnika u trenutku postavljanja dijagnoze ima jetrene metastaze. S obzirom na to da stvara i luči 5-hidroksitriptofan, to je jedini želučani neuroendokrini tumor koji stvara simptome karcinodinoga sindroma.
Klinička slika i dijagnoza. Klinički, želučani neuroendokrini tumori su asimptomatski i slučajno se dijagnosticiraju prilikom endoskopskoga pregleda želuca. Tip III je agresivan i može se manifestirati slikom karcinoidnoga sindroma. Glavna dijagnostička metoda je gastroskopija kojom se vizualiziraju lezije uz biopsiju za patohistološku potvrdu uz primjenu endoskopskoga ultrazvuka zbog ocjene invazije tumora. CT i MR manje su bitni u dijagnostičkoj obradi tumora tipa I i II, ali bitni su kod tipa III zbog otkrivanja jetrenih metastaza. Za procjenu udaljenih metastaza kod većih i agresivnijih tumora u kostima, jetri i limfnim čvorovima, koristi se scintigrafija somatostatinskih receptora. U laboratoriju su od većega značaja određivanje koncentracije kromogranina A te gastrina.
Liječenje. Terapijski pristup tumorima tipa I i II manjima od 1 cm je ekspektativan i uključuje endoskopsku kontrolu jednom godišnje. Ako su veći od 1 cm, indicirana je endoskopska polipektomija, a ako je invadirana mukoza (vidljivo endoskopskim ultrazvukom), radi se mukozektomija. Ako su rubovi nakon mukozektomije pozitivni, indicirana je antrektomija i lokalna resekcija tumora. Učinak antrektomije temelji se na smanjenom lučenju gastrina s obzirom na to da su gastrin-producirajuće stanice u najvećoj mjeri smještene u antrumu želuca. Kod tumora tipa III indicirana je totalna gastrektomija s regionalnom limfadenektomijom uz naknadno onkološko liječenje koje uključuje terapiju oktreotidom, klasičnim kemoterapeuticima (5-fluorouracil, kapecitabin) te mTOR inhibitorima (everolimus) i/ili inhibitorima tirozin-kinaze (suntitinib, sorafenib).
NEUROENDOKRINI TUMORI TANKOGA CRIJEVA
Uvod. Neuroendokrini tumori tankoga crijeva se za razliku od želučanih neuroendokrinih tumora nešto se češće manifestiraju hipersekrecijskim sindromima, ali većinom su asimptomatski i dijagnosticiraju se slučajno ili pri obradi nekih nejasnih simptoma.
Neuroendokrini tumori dvanaesnika čine 1 do 3 % svih primarnih duodenalnih tumora. Najčešće se radi o malim, solitarnim tumorskim lezijama ograničenim na mukozu i submukozu. Ako se radi o multiplim lezijama, najčešće dolaze u obliku sindroma multiple endokrine neoplazije. Iako su ograničeni na mukozu i submukozu, 40 do 60 % tumora dvanaesnika ima metastaze u regionalnim limfnim čvorovima, a 10 % i u jetri. Klinički gledano, 90 % duodenalnih neuroendokrinih tumora je nefunkcionalno, a svega 10 % ih je funkcionalno i manifestira se nekim od hipersekrecijskih sindroma (najčešće Zollinger-Ellisonov sindrom i karcinoidni sindrom). Tumori su najčešće lokalizirani u proksimalnom dijelu dvanaesnika, ali mogu se javiti i periampularno kada mogu uzrokovati opstruktivni ikterus. Glavna dijagnostička metoda je endoskopska pretraga s biopsijom i endoskopskim ultrazvukom. CT, MR i scintigrafija somatostatinskih receptora služe za procjenu proširenosti bolesti. Od laboratorijskih markera najznačajniji su kromogranin A, gastrin, somatostatin te 5-hidroksiindol octena kiselina. Tumori manji od 1 cm bez metastaza u regionalnim limfonodusima mogu se endoskopski odstraniti, dok sva ostala stanja zahtijevaju kiruršku resekciju tumora s odstranjenjem regionalnih limfnih čvorova. Kod funkcionalnih tumora primjenjuje se i simptomatska terapija, kod Zollinger-Ellisonova sindroma inhibitori protonske pumpe, a kod karcinoidnoga sindroma analozi somatostatina. U uznapredovaloj bolesti pristupa se i kemoterapiji. Prognoza je povezana sa stupnjem raširenosti bolesti.
Neuroendokrini tumori jejunuma i ileuma čine oko 25 % svih neuroendokrinih tumora probavnoga sustava. Najčešće se javljaju u šestome i sedmom desetljeću života, podjednako u oba spola. 15 - 30 % ovih tumora povezano je s drugim malignim bolestima, obično iz probavnoga sustava. Klinički, mogu biti funkcionalni i nefunkcionalni. Nefunkcionalni se najčešće dijagnosticiraju nakon pronalaska metastaza u jetri ili slučajno tijekom endoskopije crijeva. Lokalni su simptomi nespecifični, poput intermitetnih nelagoda u trbuhu, ali mogu se javiti i opstrukcija (peritumorska fibroza) ili intestinalna ishemija (dezmoplastična reakcija mezenterija koja komprimira mezenterijsku vaskulaturu). Kod funkcionalnih tumora javljaju se proljevi, napadaji crvenila kože, intermitentne bronhoopstrukcije te karcionidna bolest srca. Posebno su opasne karcionoidne krize koje mogu biti isprovocirane anestezijom ili drugim invazivnim postupcima. Standardne dijagnostičke procedure uključuju ultrazvuk trbuha, CT i/ili MR, scintigrafiju somatostatinskih receptora, endoskopiju, ehosonografiju (sumnja na karcionoidnu bolest srca) te određivanje kromogranina A i 5-HIAA. Kirurška resekcija tumora s limfadenektomijom u pravilu je osnovna metoda liječenja jer u trenu postavljanja dijagnoze uglavnom se radi o tumoru koji je invadirao u lokalne limfonoduse i/ili jetru. U liječenju funkcionalnih tumora primjenjuju se analozi somatostatina i interferon. Kemoterapija ima smisla kod slabo diferenciranih tumora. Prognoza ovih tumora lošija je od istih tumora drugih lokalizacija s obzirom na tendenciju širenja u limfne čvorove i jetru. Petogodišnje preživljenje kod neuznapredovale bolesti je 65 %, a kod bolesnika s udaljenim metastazama 36 %. Prevalencija karcionidne bolesti srca kod ovih bolesnika je 30 - 65 %, a uzrok smrti 30 do 50 % oboljelih je popuštanje desne strane srca u sklopu karcionoidne bolesti srca.
NEUROENDOKRINI TUMORI APENDIKSA
Polovina intestinalnih neuroendokrinih tumora smještena je u apendiksu, a oni predstavljaju i najčešće tumore apendiksa. Uglavnom su asimptomatski i slučajno se nađu prilikom apendektomije. Obično su manji od 1 cm, solitarni i benigni. Iako pokazuju sklonost lokalnoj invaziji, udaljene metastaze su rijetke. Najčešća lokalizacija je baza apendiksa gdje svojim rastom tumor može uzrokovati opstrukciju i akutni apendicitis. Pojava karcionidnoga sindroma ukazuje na pojavu jetrenih metastaza. Pojava lokalnih simptoma poput bolova u donjemu desnom kutu abdomena javlja se kod velikih tumora ili peritumorske fibroze. Prognoza je uvjetovana veličinom tumora. Tumori manji od 2 cm teže se dijagnosticiraju (obično slučajno kod apendektomije iz drugih razloga) i rijetko stvaraju metastaze. Kod tumora većih od 2 cm u trenutku dijagnoze, oko 30 % ih pokazuje metastatsku proširenu bolest. Ako se radi o tumorima manjima od 2 cm, radi se samo apendektomija, ali za veće je potrebna desna hemikolektomija uz liječenje metastaza, ako su prisutne, i kemoterapiju. Petogodišnje preživljenje je 70 - 100 %, a kod metastatske bolesti 10 - 30 %.
NEUROENDOKRINI TUMORI KOLONA I REKTUMA
Neuroendokrini tumori kolona su rijetki te čine oko 8 % neuroendokrinih tumora probavnoga sustava. Najčešća lokalizacija, više od polovine, smještena je u cekumu i uzlaznom kolonu. Klinički ih karakteriziraju dug asimptomatski period i nespecifični simptomi poput laganih bolova u trbuhu, proljeva i gubitka na tjelesnoj težini pa se u trenutku postavljanja dijagnoze obično radi o uznapredovaloj bolesti s metastazama u regionalnim limfnim čvorovima i jetri. Češća je učestalost kod bolesnika koji boluju od idiopatskih crijevnih upalnih bolesti (ulcerozni kolitis, Crohnova bolest).
Neuroendokrini tumori rektuma češći su u odnosu na kolon, a najčešće se slučajno otkriju. Obično se radi o malim, polipoidnim lezijama smještenim unutar 20 cm od lineje dentate na prednjoj ili lateralnim stijenkama rektuma. Kako umjesto serotonina sadrže glukagon, rijetko se prezentiraju karcinoidnim sindromom.
Dijagnoza. Najznačajnija pretraga u dijagnostici je kolonoskopija s biopsijom te endoskopski ultrazvuk, dok irigografija i CT kolonografija mogu biti dopunske metode. CT, MR i scintigrafija somatostatinskih receptora služe za procjeni raširenosti bolesti. U laboratorijskoj obradi korisno je određivanje kromogranina A, kisele fosfataze te enteroglukagona.
Liječenje. Tumore manje od 1 cm moguće je liječiti endoskopskom resekcijom, dok veće tumore treba kirurški odstraniti. Kod metastatske bolesti lokalno agresivno kirurško liječenje nije jamstvo duljega preživljenja, a može značajno narušiti kvalitetu života. Dopunski se može indicirati kemoterapija i radionuklidna terapija.
Hemoroidi i hemoroidalna bolest među najčešćim su patološkim stanjima anorektuma u kliničkoj praksi, a susreću se i druge bolesti i stanja: analni svrbež, analne infekcije, anorektalni apsces, analna fistula, analna fisura, tumori anorektuma te inkontinencija stolice.
HEMOROIDI
Definicija. Hemoroidi predstavljaju jednu od najčešćih patologija anorektalne regije, a pretpostavlja se da se nalaze kod više od 5 % odrasle populacije. Radi se o vaskularnim promjenama analnoga kanala odgovornima za pojavu neugodnih simptoma i opetovanoga krvarenja. Razlikujemo vanjske i unutarnje hemoroide koji se ne razlikuju samo prema svojoj poziciji, nego i prema nastanku, tj. građi.
Unutarnji hemoroidi predstavljaju hipertrofirana kavernozna tijela rektuma (lat. corpora cavernosa recti) koja se normalno nalaze u analnome kanalu iznad nazubljene linije i sudjeluju u održavanju analne kontinencije. Sastoje se od rahloga vezivnog tkiva koje se tijekom defekacije ispunja krvlju preko hemoroidalnih arterija te tako štiti sluznicu od mehaničkih oštećenja.
Vanjski hemoroidi predstavljaju proširenja venskoga pleksusa analnoga kanala koji se drenira u sustav donje šuplje vene. Anatomski su i funkcionalno manje važni od unutarnjih hemoroida, iako se daleko češće susreću u kliničkoj praksi.
Etiologija. Pojavi hemoroida pogoduju konstitucionalna uvjetovanost, zastoj krvi u portalnome sustavu (ciroza, portalna hipertenzija), pritisak na vene u maloj zdjelici (trudnoća, tumori), dugotrajna opstipacija, kao i jako napinjanje prilikom defekacije (način prehrane) te zanimanja pri kojima se neprekidno sjedi ili stoji. Sva ta stanja rezultiraju povećanim hidrostatskim tlakom u krvnim žilama male zdjelice što može biti povezano sa slabljenjem stijenke kavernoznih tijela i nastankom hemoroida.
Klinička slika. Osnovni simptomi hemoroidalne bolesti su bol i nelagoda povezani s aktom defekacije te pojava svježe krvi na stolici ili toaletnom papiru nakon brisanja. Hemoroidi su, ukupno gledano, najčešći uzrok krvarenja iz donjega dijela probavnoga sustava. Najčešće komplikacije koje se mogu razviti su tromboza i prolaps. Tromboza uglavnom završava spontanom resorpcijom tromba, a nekada se mogu razviti gangrena, nekroza, apsces ili ulceracija.
Dijagnoza se postavlja na temelju kliničke slike i kliničkoga nalaza koji se temelji na inspekciji analne regije, digitorektalnom pregledu te anoskopiji/rektoskopiji. Hemoroidi se jasno uočavaju kao grozdaste nakupine različite veličine koje mogu kontaktno krvariti ili poprimiti tamnoljubičastu boju u slučaju tromboziranosti. Unutarnji hemoroidi imaju četiri stupnja: 1. stupanj - čvorovi ostaju u analnom kanalu pri defekaciji; 2. stupanj - čvorovi prolabiraju tijekom defekacije izvan sfinktera i spontano se vraćaju nakon defekacije; 3. stupanj - hemoroidi prolabiraju, spontano se ne vraćaju, ali se mogu manualno reponirati, a 4. stupanj označava stalno prolabirane čvorove koji se ne mogu reponirati.
Liječenje može biti opće, nekirurško i kirurško. Opće mjere liječenja uključuju regulaciju stolice (rješavanje opstipacije) te uklanjanje upalne komponente (adstringentni i protuupalni lijekovi u obliku masti, krema i čepića, eventualno uz dodatak antikoagulantnoga sredstva). U liječenju ovih poremećaja značajno mjesto danas zauzimaju i pripravci koji stabiliziraju kapilare (biflavonoidi) i povećavaju kapilarnu otpornost. Nekirurško liječenje obuhvaća injekcijsku sklerozaciju, podvezivanje hemoroida gumenim prstenom i krioterapiju, dok je kirurško liječenje (hemoroidektomija) indicirano kod neuspješnoga konzervativnog liječenja, kod istodobnoga postojanja hemoroida i neke druge benigne anorektalne bolesti te kod hemoroida trećega i četvrtog stupnja s izraženim simptomima. Liječenje hemoroidalne bolesti u domeni je abominalnoga kirurga (proktologa).
Prognoza. Osobe koje boluju od hemoroidalne bolesti rijetko se izliječe, pa i unatoč operativnom zahvatu, jer su hemoroidi skloni recidiviranju.
PERIANALNI SVRBEŽ
Definicija. Perianalni svrbež (lat. pruritus ani) predstavlja jak i neugodan svrbež perianalne regije i analnoga kanala koji se može naći kod 1 do 5 % opće populacije. Češće se javlja kod muškaraca (4:1), najčešće između četvrtoga i šestog desetljeća života.
Etiologija. Prema etiologiji, razlikujemo primarni i sekundarni oblik. Primarni oblik javlja se u odsutnosti bilo kakvoga poznatoga i objašnjivog uzroka, a često se povezuje s neodgovarajućom higijenom analne regije te psihosomatskim poremećajem. Sekundarni oblik povezan je različitim lokalnim i sistemskim bolestima (analna fisura, analna fistula, analne infekcije, hemoroidi, psorijaza, dijabetes, ikterus i sl.).
Klinička slika. Svrbež u analnoj regiji vodeći je simptom, a osobito je jak u mirovanju i noću. Klinička je slika intenzivnija tijekom ljeta zbog pojačanoga znojenja. Uslijed učestaloga češanja analna je regija obično crvena i macerirana (vidljive ogrebotine).
Dijagnoza se postavlja na temelju kliničke slike i kliničkoga pregleda. Dopunska dijagnostička obrada indicirana je kada postoji sumnja na određeni uzrok (rektoskopija, biopsija kože i sl.).
Liječenje. Osnovne mjere liječenja uključuju pojačanu higijenu analne regije, održavanje njezine suhoće te izbjegavanje nadražujućih kemijskih sredstava (upotreba neutralnoga sapuna). Kod težih oblika bolesti preporuča se kratkotrajna primjena kortikosteroidnih krema (npr. 1 %-tni hidrokortizon), što kod većine bolesnika rezultira povlačenjem simptoma.
INFEKCIJE ANALNE REGIJE
Definicija i etiologija. Analne infekcije bolesti su analne regije uzrokovane živim uzročnicima. Ako je osim kože analne regije upalom zahvaćen i analni kanal, govorimo o proktitisu. Najčešće se radi o infekcijama uzrokovanim bakterijama s površine kože (stafilokoki, streptokoki) ili enteropatogenim bakterijama čemu pogoduje gubitak integriteta kože i sluznice (npr. oštećenje kože uslijed češanja i sl.).
Klinička slika. Simptomi i znakovi bolesti prvenstveno su lokalne prirode: bolnost i svrbež perianalne regije i analnoga kanala koji se pojačavaju prilikom defekacije te pojava krvave ili gnojne izlučevine. Povišenje tjelesne temperature sugerira širenje infekcije.
Dijagnoza se postavlja na temelju kliničke slike i kliničkoga nalaza (hiperemija, edem, gnojne kolekcije, maceracije i sl.). Rektoskopija omogućava vizualizaciju analnoga kanala i rektuma zbog procjene proširenosti infekcije. Preporuča se provesti mikrobiološku dijagnostiku (bris perineuma, anusa, koprokultura).
Liječenje uključuje simptomatske mjere (pojačana higijena, kupke) uz lokalnu primjenu antibiotskih ili antimikotičkih krema ili masti. Kod izraženih lokalnih simptoma može se primijeniti i kortikosteroidna mast. Sistemska antibiotska terapija indicirana je kod pojave febrilnoga stanja.
Analni kondilomi (anorektalne bradavice) pripadaju skupini spolno prenosivih bolesti koje uzrokuje humani papiloma virus (HPV), a predstavljaju egzofitične mase praćene osjećajem svrbeža, a nekada mogu biti prisutni i iscjedak i krvarenje. Bradavice mogu biti različite boje (bjelkaste, ružičaste ili sivkaste). Liječi se lokalnom primjenom 25 %-tnoga podofilina, bikolor-octenom kiselinom ili 5-fluorouracilom, ili ekskohleacijom.
ANOREKTALNI APSCES
Definicija. Anorektalni apsces predstavlja ograničenu kolekciju gnojnoga sadržaja u anorektalnome području. Ovisno o lokalizaciji razlikujemo nekoliko skupina anorektalnih apscesa: perianalni, ishiorektalni, intersfinkterični te supralevatorni apscesi.
Etiopatogeneza. Anorektalni apscesi nastaju kao posljedica nespecifičnih bakterijskih infekcija analnih žlijezda i njihovih izvodnih kanala. Najprije dolazi do začepljenja izvodnih kanala žlijezda fecesom ili stranim tijelom, što uzrokuje zastoj i sekundarnu infekciju. Najčešći su uzročnici stafilokoki i streptokoki. Infekcija uvijek započinje u intersfinkteralnome prostoru (intersfinkterični apsces), a može se širiti prema gore (supralevatorni apsces), horizontalno (ishiorektalni apsces) ili prema dolje (perianalni apsces).
Klinička slika. Osnovni simptom perianalnoga apscesa je bol u analnoj regiji koji se pojačava u sjedećem položaju i za vrijeme defekacije, a bolesnici se žale i na nastanak otekline u blizini analnoga otvora. Rijetko susrećemo povišenu tjelesnu temperaturu. Klinički pregled ukazuje na crvenu, bolnu i fluktuirajuću oteklinu, dok je digitorektalni pregled uredan.
Dijagnoza se postavlja na temelju kliničke slike i kliničkoga pregleda. Dodatni pregled analnoga kanala omogućava anoskopija. Laboratorijske pretrage krvi indicirane su samo kod bolesnika s povišenom tjelesnom temperaturom.
Liječenje uključuje kiruršku inciziju i drenažu apscesa uz primjenu antibiotika širokoga spektra koji pokrivaju anaerobne i gram-negativne bakterije (najčešće kombinacija amoksicilin/klavulonska kiselina i metronidazol). Simptomatsko olakašnje postiže se i primjenom analgetika te mlakih kupki.
ANALNA FISTULA
Definicija. Analna fistula označava patološku komunikaciju između analnoga kanala i kože u perianalnoj regiji. Radi se o kanalu obloženom granulacijskim tkivom koji ima dva otvora (jedan u analnom kanalu, drugi na površini kože). Incidencija analne fistule iznosi 5 - 10 oboljelih osoba na 100 000 stanovnika, a češće se susreće kod muške populacije.
Etiologija. U 90 % slučajeva analna fistula razvija se iz perianalnoga apscesa i predstavlja njegov kronični oblik. U ostalim slučajevima fistule nastaju kao posljedice specifičnih procesa (Crohnova bolest, tuberkuloza, postradijacijski).
Klasifikacija. Ovisno o lokalizaciji, razlikujemo nekoliko oblika analnih fistula: intersfinkterična fistula (nalazi se između vanjskoga i unutarnjega analnog sfinktera, a vanjski otvor obično je uz analni rub), transsfinkterična fistula (prolazi kroz vanjski analni sfinkter, a vanjski je otvor u ishioanalnoj jami), suprasfinkterična fistula (prolazi iznad vanjskoga analnog sfinktera preko puborektalnoga mišića, a vanjski je otvor u ishioanalnoj jami) te ekstrasfinkterična fistula (prolazi izvan vanjskoga analnog sfinktera).
Klinička slika. Bolesnici se dominantno žale na bol i nelagodu u perianalnoj regiji, osobito za vrijeme defekacije i pri sjedenju. Često je prisutna gnojna sekrecija iz fistuloznoga otvora, a nekada je moguća i pojava stolice. Većina bolesnika navodi da su imali simptome koji odgovaraju perianalnome apscesu.
Dijagnoza se postavlja na temelju kliničke slike i kliničkoga nalaza, a potvrđuje se anoskopijom i sondiranjem fistulnoga kanala. Inspekcijom se može uočiti vanjski otvor fistule u perianalnome području iz kojega se može dobiti gnojni ili sukrvavi sadržaj. Digitorektalni pregled uglavnom je uredan. Sondiranjem metalnom cijevi možemo dobiti podatak o smjeru fistuloznoga kanala. Rektoskopijom se nekada može uočiti unutarnji otvor fistuloznoga kanala, a ako se on ne prikazuje, može se kroz vanjski otvor aplicirati kontrast koji će biti uočljiv prilikom rektoskopije. Fistulografija se rijetko izvodi.
Liječenje je kirurško (fistulotomija), a u slučaju gnojne sekrecije i prisutnosti drugih znakova upale ordiniraju se i antibiotici širokoga spektra.
ANALNA FISURA
Definicija. Analna fisura predstavlja uzdužnu laceraciju analnoga kanala koja se proteže od nazubljene linije do analnoga ruba. Češće se javlja u mlađoj i srednjoj životnoj dobi, podjednako kod oba spola. Razlikujemo akutnu i kroničnu analnu fisuru.
Etiologija. Danas se smatra da je spazam unutarnjega analnog sfinktera i s njime povezana otežana defekacija jedan od glavnih uzroka pojave analne fisure. Tome pridonosi i prolazak tvrde i obline stolice te ishemija sluznice analnoga kanala.
Patologija. Analna fisura najčešće je smještena na sredini stražnje stijenke analnoga kanala (rijetko u prednjem dijelu). Akutna analna fisura je površinska plitka laceracija u kojoj je oštećen samo epidermis, dok je kronična analna fisura duboka ograničena laceracija, a vremenom nastaje iz akutne. Na donjem kraju kronične fisure nalazi se oteklina koju nazivamo hemoroid čuvar, a na gornjem kraju možemo naći hipertrofičnu analnu papilu.
Klinička slika. Dominantni je simptom bol za vrijeme i neposredno nakon defekacije koji može trajati od nekoliko minuta do nekoliko sati (nije povezano s veličinom fisure). Krvarenje je minimalno i obično pacijenti navode male količine krvi na površini stolice i toaletnom papiru nakon brisanja. Mogući su i pojačani analni iscjedak te svrbež.
Dijagnoza se postavlja na temelju kliničke slike, digitorektalnoga pregleda i anoskopije. Digitorektalnim pregledom kod akutne analne fisure nalazimo spastični analni sfinkter, a kod kronične induraciju i fibrozu analnoga kanala. Anoskopijom potvrđujemo dijagnozu. Ako se sumnja da je fisura u sklopu neke crijevne bolesti (npr. Crohnove bolesti), treba napraviti kolonoskopiju.
Liječenje. Kod manjih je fisura konzervativno (hrana sa što više ostataka, blaga laksacija, lokalno anestetske masti i blage kupke), a kod većih i bolnijih indiciran je kirurški zahvat. Danas je sve popularnija primjena relaksatora unutarnjega analnog sfinktera, kao što su nitroglicerinska mast ili diltiazemski gel koji se lokalno nanose nekoliko puta na dan. Navedena terapija smanjila je potrebu za operativnim liječenjem za više od 50 %.
TUMORI ANOREKTUMA
Definicija. Tumori anorektuma su rijetki i čine 1,5 % svih tumora probavnoga sustava. Tumore anorektuma dijelimo u dvije skupine: tumori analnoga ruba (perianalna koža udaljena do 5 cm od analnoga kraja) te tumori analnoga kanala.
Tumori analnoga ruba mogu biti benigni i maligni. Najčešći benigni tumori su kondilomi i leukoplakija, a maligni planocelularni karcinom (najčešći), bazocelularni karcinom, Bowenova bolest (intraepidermalni oblik planocelularnoga karcinoma) te Pagetova bolest. Karcinomi mogu metastazirati u regionalne limfne čvorove. Bolesnici se žale na izraslinu, krvarenje i svrbež, a kasnije i na bol te tenezme. Dijagnoza se postavlja kliničkim pregledom (očituju se kao ulceracije ili izrasline) te biopsijom i histološkom analizom suspektne lezije. Potrebna je i rektosigmoidoskopija. Liječenje je kirurško uz dopunu kemoradioterapijom prema odluci onkologa.
Tumori analnoga kanala uglavnom su maligni i to su planocelularni karcinom, adenokarcinom i melanom. Najčešći su simptomi krvarenje iz rektuma, bolovi, tumorska tvorba, sluzavi iscjedak te promjene kalibra stolice (poput olovke). Dijagnostička obrada pored kliničkoga pregleda obuhvaća anoskopiju, kolonoskopiju (uz obveznu biopsiju i histološki nalaz) te kompjuteriziranu tomografiju radi procjene lokalne raširenosti tumora. Liječi se kirurški, kemoterapijom i radioterapijom.
INKONTINENCIJA STOLICE
Definicija. Inkontinencija stolice označava različite oblike poremećaja funkcije analnoga sfinktera te se može očitovati nemogućnošću zadržavanja – od vjetrova do krute stolice, od potpunoga prolaska kroz anus. Razlikujemo potpunu i djelomičnu inkontinenciju. Potpuna označava nemogućnost kontrole tvrde stolice, a djelomična se odnosi samo na nemogućnost zadržavanja vjetrova i tekuće stolice.
Etiologija. Inkontinenciju stolice mogu uzrokovati brojni čimbenici: 1) mehaničke lezije mišića anorektuma (postoperativno, postpartalno, postraumatski); 2) teži oblici anorektalnih bolesti (hemeroidi, tumori); 3) poremećaj inervacije (bolesti središnjega živčanog sustava i produljene moždine, periferne neuropatije).
Klinička slika i dijagnostički postupak. Bolesnici se žale na nemogućnost zadržavanja vjetrova, tekuće ili krute stolice. Dijagnoza se postavlja na osnovi anamnestičkih podataka, fizikalnoga pregleda, analne manometrije, endoanalnoga ultrazvuka te drugih metoda (kolonoskopija, elektromioneurografija).
Liječenje je konzervativno i kirurško. Ako je uzrok poznat, treba djelovati na njega. Konzervativno obuhvaća pridržavanje propisane dijete, uzimanje blagih laksativa, masažu trbuha, a preporučuju se i perianalne vježbe i vježbe mišića dna zdjelice. Može se pokušati i s elektrostimulativnom terapijom sfinktera. Kod bolesnika kod kojih nema poboljšanja treba razmišljati o operativnome liječenju.
KIRURŠKA PATOLOGIJA ABDOMENA
AKUTNI ABDOMEN
Definicija. Akutni abdomen naziv je za kliničko stanje koje nastaje uslijed naglo nastale bolesti ili ozljede intraperitonealnih organa, a klinički se manifestira naglo nastalim bolom u trbuhu koji u pravilu zahtijeva hitno liječenje, najčešće kirurški zahvat.
Etiologija. Uzrok akutnoga abdomena mogu biti različite bolesti i ozljede trbušnih organa. Sliku akutnoga abdomena mogu uzrokovati i neke druge bolesti koje ne zahtijevaju kirurško liječenje.
Ozljede trbuha. Akutni abdomen može nastati i kod zatvorenih i otvorenih ozljeda trbuha (penetrantne, nepentrantne). Kod trauma abdomena često nalazimo rupturu slezene i jetre te ozljede velikih krvnih žila. Obično se nađe peritonitis, intraabdominalna hemoragija te ileus.
Bolesti trbušnih organa. Akutni abdomen mogu uzrokovati bolesti probavne cijevi (akutni apendicitis, ileus, inkarcerirana hernija, perforacija ulkusa, divertikulitis i sl.), jetre i žučnih vodova (kolecistitis, kolangitis, apsces jetre), gušterače (akutni pankreatitis), slezene (ruptura, infarkt), ginekološke bolesti (izvanmaterična trudnoća, adneksitis, endometrioza), urološke bolesti (pijelonefritis, infarkt bubrega), vaskularni poremećaji (ruptura aneurizme abdominalne aorte, okluzija visceralnih arterija) te bolesti peritoneuma i retroperitoneuma (peritonitis, retroperitonealno krvarenje i apsces).
Bolesti s kliničkom prezentacijom akutnoga abdomena koje ne zahtijevaju kirurško liječenje mogu biti metaboličke i endokrine (dijabetička ketoacidoza, adisonska kriza, uremija, akutna porfirija), hematološke (akutna leukoza, kriza srpaste anemije, hepatosplenomegalija), intoksikacije (trovanje olovom, apstinencijska kriza), upalne bolesti (vaskulitisi) te se može raditi o bolu prenesenom iz drugih organa i regija (infarkt miokarda, akutni perikarditis, bazalna pneumonija, infarkt pluća, pneumotoraks, interkostalna neuralgija i sl.).
Klinička slika. Temeljni simptom akutnoga abdomena je bol u trbuhu, a uz njega se mogu javiti i simptomi od strane probavnoga i genitourinarnog sustava, ovisno o etiologiji. Pri kliničkom pregledu treba obratiti pozornost na abdominalne i ekstraabdomnalne znakove bolesti.
Bol u trbuhu glavni je simptom akutnoga abdomena. Prema karakteru može biti intermitentan (kolike) ili konstantan. U razvoju upalnih intraabdominalnih bolesti razlikujemo tri razvojne faze bolova: 1) prva faza ili inicijalni signal boli organa (bol nastaje podraživanjem nociceptora iz sluznice povezanih s medulom spinalis preko celijačnoga spleta pa se bol lokalizira periumbilikalno); 2) druga faza ili inicijalni signal peritoneuma (nastaje napredovanjem upale do seroze i peritoneuma čija vlakna idu izravno prema meduli spinalis zbog čega se bol preciznije lokalizira, npr. bol u desnom donjem kvadrantu kod apendicitisa) te 3) treća faza ili razvijeni signali peritonitisa (nastaje uslijed širenja upale cijelim peritoneumom zbog čega bolesnik osjeti jak bol koji zahvaća cijeli trbuh). Iz tih se razloga pri uzimanju anamnestičkih podataka treba dobro obratiti pozornost na kvalitetu i intenzitet bolova te promjene lokalizacije bola (početak, širenje, intenzitet, karakter…).
Ostali simptomi. Ovisno o etiologiji, mogu se naći različiti simptomi: gastroduodenalni (mučnina, povraćanje, regurgitacija), simptomi tankoga crijeva (kruljenje, učestale stolice, osjećaj nadutosti), simptomi debeloga crijeva (bol u donjem dijelu trbuha, tenezmi, izostanak stolice), simptomi urogenitalnoga sustava (nefrokolike, dizurične tegobe, bol u lumbalnim ložama, bol u skrotumu) i dr.
Ekstraabdominalni znakovi. Od njih su najvažniji znaci šoka (suh i obložen jezik, oslabljen turgor kože, hipotenzija, tahikardija, smetenost). Opće stanje bolesnika se pogoršava i nastaje slika koju nazivamo facies abdominalis Hippocratica: upali obrazi, ušiljen nos, halonirane oči i patnički izraz lica. Temperatura je uglavnom povišena, iako normotermija ne isključuje akutni abdomen. Korisno je odrediti razliku aksilarne i rektalne temperature.
Abdominalni znakovi. Prilikom kliničkoga pregleda trbuha moguće je uočiti različite kliničke znakove: inspekcija (štednja trbuha pri disanju, povećan opseg trbuha, prisutnost hernija), palpacija (palpatorna bolnost, defans muskulature), auskultacija (hiperperistaltika, hipoperistaltika, muklina), perkusija (muklina kod prisutnosti tekućega sadržaja, timpanizam kod prisutnosti zraka). Obvezno je kod svih bolesnicima izvršiti digitorektalni pregled i antriranje kilnih otvora.
Klinički pristup bolesniku. Svim bolesnicima s kliničkom slikom akutnoga abdomena indicirano je mirovanje te praćenje razvitka kliničke slike kada se odmah ne indicira operativni zahvat. Kod svih bolesnika s težom kliničkom slikom, bolovima i povraćanjem, potrebno je staviti nazogastričnu sondu. Potrebno je osigurati odgovarajuće intravenske puteve te pristupiti odgovarajućoj volumnoj resuscitaciji. Potreban je oprez kod davanja analgetske i spazmolitske terapije jer to može kod nekih bolesnika zasjeniti i zakomplicirati postavljanje točne dijagnoze. Uzimaju se uzorci krvi i urina za laboratorijske pretrage te je potrebno obaviti nativnu snimku abdomena u stojećemu položaju ili na boku (isključiti pneumoperitoneum kao znak perforacije šupljega organa i prisutnost aerolikvidnih nivoa kao znak ileusa). Ostali dijagnostički i terapijski pristup ovisi o kliničkom stanju bolesnika te o diferencijalno-dijagnostičkoj sumnji. Danas se kod ovakvih stanja u prvoj liniji radi i ultrazvuk abdomena, a u slučaju dodatnih nejasnoća kod postavljanja dijagnoze i MSCT abdomena.
U daljnjemu će tekstu biti opisani najčešći uzroci akutnoga abdomena: akutni apendicitis, mehanički ileus te vaskularni ileus (gangrena crijeva ili akutna crijevna ishemija).
AKUTNI APENDICITIS
Definicija. Akutni apendicitis označava akutnu upalu crvuljka koja predstavlja jednu od najčešćih kirurških bolesti i jedan od najčešći uzroka akutnoga abdomena, iako se primjećuje smanjenje učestalosti te bolesti u dječjoj i odrasloj populaciji.
Etiopatogeneza. Uzrok nastanka apendicitisa sve do danas nije potpuno razjašnjen, a najprihvaćenija je teorija da akutni apendicitis nastaje kao posljedica opstrukcije lumena apendiksa koju mogu izazvati povećani limfni folikuli (djeca), feces, koprolit, paraziti, strano tijelo ili tumor. Nakon opstrukcije dolazi do nastavka lučenja sekreta iz sluznice apendiksa što dovodi do povišenja intraluminalnoga tlaka i kompresije na vaskularne strukture, a to pogoduje ishemiji sluznice i ulasku bakterija. Upalni proces polagano napreduje prema serozi i preko nje se širi na peritoneum. Opće gledano, ishod apendicitisa uključuje 1) potpuno spontano smirivanje upale, 2) stvaranje peritiflitičkoga apscesa (lokalizirani peritonitis) te 3) difuzni peritonitis.
Klinička slika. Glavni i osnovni simptom kliničke slike je bol u trbuhu. Početno se radi o visceralnom bolu neodređene lokalizacije (obično periumbilikalno). Nakon 6 do 12 sati bol se postupno seli u desni donji kvadrant abdomena (somatska bol) i najjači je u području McBurneyeve točke (3 cm od vrška ilijačne kosti prema pupku). Pojačava se kod kihanja, kašljanja ili dubokoga udaha. Ubrzo se razvijaju i mučnina i povraćanje te dolazi do porasta tjelesne temperature. Bolesnik obično leži s desnom nogom savijenom u koljenu (ili su savijene obje noge) kako bi se smanjila napetost trbušne stijenke i smanjili bolovi. Palpatorno, trbuh je najosjetljiviji u području desnoga donjeg kvadranta, a kod razvoja peritonitisa javlja se i defans muskulature.
Diferencijalna dijagnoza uključuje širok spektar bolesti i stanja: akutni gastroenteritis, mezenterijalni limfadenitis, Meckleov divertikulitis, nefrokolike, perforirani duodenalni ulkus, akutni kolecititis, terminalni ileitis (Crohnova bolest), akutni adneksitis, izvanmaterična trudnoća, torzija ovarijske ciste, akutni skrotum i sl.
Dijagnoza se postavlja na osnovi kliničke slike, fizikalnoga pregleda, laboratorijskih nalaza (povišeni upalni parametri) te slikovnih dijagnostičkih metoda (ultrazvuk, kompjuterizirana tomografija). Ultrazvučni nalaz kod akutnoga apendicitisa uključuje nekompresibilan crvuljak, apendikolit, povećanje promjera crvuljka više od 6 cm, znak mete na poprečnom presjeku te tubularna struktura na uzdužnom presjeku. Danas se u većini centara konačna dijagnoza postavlja na temelju nalaza kompjuterizirane tomografije abdomena koji se posebno preferira u slučaju bolova u donjem dijelu trbuha.
Liječenje akutnoga apendicitisa je kirurško. Većinom se primjenjuje laparoskopska tehnika, iako se kod kompliciranih oblika primjenjuje i klasična apendektomija (laparotomija).
MEHANIČKI ILEUS
Definicija i etiologija. Mehanički ili opstruktivni ileus označava prekid pasaže kroz crijeva uvjetovan mehaničkom opstrukcijom crijeva. Ovisno o mjestu opstrukcije, uzroke dijelimo u tri skupine: ekstraluminalni (adhezije, inkarcerirana hernija, tumori), intramuralni (tumori, upale) te intraluminalni (žučni konkrament, strana tijela, bezoari, crijevni paraziti).
Posebni oblici mehaničkoga ileusa su volvulus, invaginacija i strangulacijski ileus. Volvulus označava rotaciju pomičnih dijelova probavne cijevi oko vlastite osi što za posljedicu ima opstrukciju i kompromitiranost cirkulacije te može rezultirati ishemijom i gangrenom. Invaginacija (intususcepcija) označava uvlačenje proksimalnoga crijevnog segmenta u distalni, a najčešće se javlja kod djece (uvlačenje ileuma u cekum). Strangulacijski ileus je poseban oblik mehaničkoga ileusa kod kojega se uz opstrukciju razvija i kompromitiranost cirkulacije, pa dolazi do ishemije i gangrene crijeva. Najčešće se razvija kao posljedica volvulusa, invaginacije te inkarceracije hernije.
Klinička slika. Osnovni simptomi i znakovi mehaničkoga ileusa su bolovi u trbuhu, povraćanje te izostanak stolice i vjetrova.
Bol u trbuhu. Bolovi kod ileusa grčevita su karaktera. Kod visokih se opstrukcija grčevi ponavljaju u intervalu od 1 do 3 minute, dok je kod niskih opstrukcija bezbolni period duži (oko deset minuta). Bolovi nastaju zbog distenzije crijeva, a ne podražaja peritoneuma, pa bolesnici ne mogu naći položaj kod kojega je bol manji (nemirni su za razliku od bolesnika s peritonitisom koji zbog bola leže mirno i nepokretno).
Povraćanje. Kod oralnijih opstrukcija u kliničkome se tijeku povraćanje brzo razvija, a zbog dilatacije želuca i nadražaja ošita javlja se i štucanje. Kod distalnijih opstrukcija povraćanje se javlja nešto kasnije, a povraćani sadržaj je crijevni. Povraćanje fekalne mase (miserere) kasni je znak niske opstrukcije.
Izostanak stolice i vjetrova rani je znak niske opstrukcije, dok kod visoke opstrukcije pacijenti mogu imati stolicu i vjetrove još neko vrijeme zbog peristaltike i sadržaja zaostaloga distalno od opstrukcije.
Dijagnoza mehaničkoga ileusa postavlja se na temelju anamnestičkih podataka, fizikalnoga pregleda, osnovnih laboratorijskih nalaza te radiološke dijagnostike (nativna snimka abdomena, ultrazvuk abdomena ili kompjuterizirana tomografija abdomena).
Laboratorijski nalazi mogu uključivati povišene upalne parametre (leukocitoza, neutrofilija, povišeni C-reaktivni protein), a često se nađu i elektrolitni disbalans i povišene vrijednosti laktat dehidrogenaze.
Nativna snimka abdomena kod ovih bolesnika ukazuje na patološku distenziju crijevnih vijuga i karakterizirana je pojavom aerolikvidnih nivoa. Snimku je potrebno učiniti u stojećem položaju, a ako stanje to ne dozvoljava - u položaju na boku.
Ultrazvuk abdomena u dijagnostici mehaničkoga ileusa ima manji značaj, ali mogu se detektirati distendirane crijevne vijuge ispunjene tekućim sadržajem. Nekada se ultrazvučno mogu prikazati zadebljala stijenka crijeva (upala), tumorski proces ili intususcepcija.
Kompjuterizirana tomografija danas je postala jedna od glavnih dijagnostičkih metoda kod bolesnika sa sumnjom na mehanički ileus. Osim što može pokazati da se radi o mehaničkome ileusu, ona može ukazivati na sam uzrok što ima bitnu ulogu u zauzimanju terapijske strategije (operativno ili konzervativno liječenje).
Liječenje mehaničkoga ileusa u pravilu je operativno, a zasniva se na procjeni kirurga. Svim je bolesnicima indicirano je mirovanje i obustavljanje unosa hrane ili tekućine, postavljanje nazogastrične sonde, uključivanje antibiotika širokoga spektra koji pokrivaju gram-negativne i anaerobne bakterije (npr. ciprofloksacin, metronidazol, meropenem) te ostala simptomatska terapija (intravenska rehidracija, analgezija, ispravljanje elektrolitnoga disbalansa i sl.).
ISHEMIJA CRIJEVA (VASKULARNI ILEUS)
Definicija. Vaskularni ileus ili ishemija crijeva uopćeni je naziv za promjene na crijevima koje nastaju kao posljedica neodgovarajuće perfuzije, bilo da se radi o poremećenoj arterijskoj opskrbi, bilo poremećenoj venskoj drenaži. Radi se o relativno čestome uzroku akutnoga abdomena kod starijih osoba, osobito onih koji imaju brojne dodatne komorbiditete.
Etiopatogeneza. Prema njihovu uzroku i nastanku, razlikujemo dva oblika ishemije crijeva: primarni - uslijed poremećaja samih mezenterijalnih krvnih žila te sekundarni koji nastaje u stanjima generalizirane hipoperfuzije i centralizacije krvotoka.
Primarna ishemija crijeva nastaje uslijed arterijske okluzivne bolesti i venske tromboze. Najčešći uzroci okluzije mezenteralnih arterija su uznapredovala ateroskleroza (ruptura plaka i superponirana tromboza), embolijski incidenti (intrakardijalni embolusi, septički endokarditis, embolusi porijeklom iz aneurizmatskoga proširenja aorte) te upala same stijenke arterije što se može naći pri nekim oblicima sistemskih vaskulitisa. S obzirom na to da je arterijska opskrba crijeva osigurana dvjema arterijama (a. mesenterica superior et inferior) koje su međusobno povezane brojnim arkadama, začepljenje jedne od tih arterija ili njezinih ogranaka ne mora nužno uzrokovati ishemiju crijeva zbog moguće kolateralne cirkulacije iz druge arterije. Venska tromboza obično se susreće kao posljedica tupe traume abdomena (masivna ozljeda endotela), hiperkoagulabilnih stanja i hiperviskoznih sindroma (stečene i nasljedne trombofilije, akutna leukoza), portalne hipertenzije i izvanjske kompresije (tumori i sl.).
Sekundarna ishemija crijeva nastaje kao posljedica smanjenoga protoka krvi (hipoperfuzije) kroz crijeva, uz očuvan kontinuitet arterija i vena. Najčešće se događa u stanjima praćenim protrahiranom hipotenzijom i centralizacijom krvotoka (septički šok, hipovolemijski šok, visoke doze vazonkstriktora, smanjen srčani izbačaj – kardiogeni šok).
Patologija. Crijeva imaju relativno dug kompenzacijski period u kojemu mogu tolerirati smanjenje protoka krvi (i do 12 sati), nakon čega dolazi do pojave prvih znakova oštećenja. Akutna ishemija crijeva patološki se može očitovati kao transmuralni infarkt (crijevna gangrena) kod koje nalazimo nekrozu koja zahvaća cijelu crijevnu stijenku ili se u blažim oblicima razvija tzv. akutna hemoragijska enteropatija gdje je ishemijsko oštećenje ograničeno samo na mukozu i submukozu. Nekroza (gangrena) dovodi do perforacije crijeva, krvarenja i izlijevanja crijevnoga sadržaja u trbušnu šupljinu što dovodi do difuznoga peritonitisa.
Klinička slika. Bolest obično počinje naglom pojavom bola u trbuhu najprije u obliku grčeva, a kasnije postaje konstantan. Bol je jak i slabo reagira na analgetike. Često se jave i mučnina i povraćanje, a vodeći je znak pojava krvavih proljeva. Kod bolesnika koji nemaju dominantnu kliničku sliku praćenu bolovima u trbuhu na ovaj poremećaj treba pomišljati u stanjima meteorizma, paralitičkoga ileusa i pojave krvavih stolica, osobito kod starijih osoba i osoba s raznim komorbiditetima. S razvojem peritonitisa dolazi do pogoršanja općega stanja praćenoga znakovima hipovolemijskoga i septičkoga šoka. Ako se ne pristupi hitnom liječenju, pacijent umire unutar jednoga do dva dana. Pri kliničkom se pregledu može bilježiti febrilno stanje, hipotenzija, tahikardija, suhe i obložene sluznice, oligurija, palpatorna osjetljivost trbuha s kasnijim razvojem defansa, a digitorektalnim pregledom na rukavici se uglavnom dobije stolica pomiješana sa svježom krvi.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, kliničke slike, laboratorijskih nalaza i slikovnih metoda. U laboratorijskim nalazima obično nalazimo leukocitozu, neutrofiliju, povišene upalne markere (C-reaktivni protein, prokalcitonin), hemokoncentraciju, kao i povišenje brojnih biokemijskih biljega (laktat dehidrogenaza, kreatin kinaza, amilaza, aminotrasferaze), iako navedeni nalazi nemaju veću specifičnost niti osjetljivost. Na vaskularni ileus može upućivati i nalaz povišenih D-dimera. Nativna snimka abdomena treba se obaviti kod svih bolesnika zbog isključenja mogućih drugih uzroka akutnoga abdomena, a nalaz koji se može susresti kod ovih bolesnika je intersticijska pneumatoza, odnosno nakupljanje zraka u crijevnoj stijenci. S tim se ciljem može izvršiti i nativna kompjuterizirana tomografija. Verifikaciju poremećaja protoka kroz mezenterijalne krvne žile daju nam ultrazvučni doplerski pregled, često onemogućen zbog izrazitoga meteorizma, te CT ili MR angiografija. U velikoj kliničkoj suspekciji i teškoj kliničkoj slici dijagnoza se može postaviti intraoperativno.
Liječenje. Zajedno s dijagnostičkom obradom treba započeti volumnu resuscitaciju i ispravak elektrolitnoga i eventualnoga koagulacijskog poremećaja, kako bi se bolesnici kondicionirali za eventualni kirurški zahvat. Indicirana je i primjena antibiotika širokoga spektra koji pokrivaju i gram-negativne i anaerobne bakterije (meropenem, imipenem, ciprofloksacin, metronidazol). Kirurško je liječenje terapijska metoda koja može pružiti preživljenje i indicirana je u svih bolesnika kao vitalna indikacija.
HIPERBILIRUBINEMIJA I ŽUTICA (IKTERUS)
Definicija. Hiperbilirubinemija predstavlja patološku vrijednost bilirubina povišenoga u serumu i to u vrijednosti iznad 20 µmol/L, dok ikterus ili žutica predstavlja kliničko stanje karakterizirano žutom bojom kože i vidljivih sluznica, što je posljedica hiperbilirubinemije veće od 40 µmol/L.
Metabolizam bilirubina. Bilirubin nastaje kao posljedica razgradnje hemoproteina, posebne skupine proteina koji sudjeluju u transportu i metabolizmu kisika. Razgradnjom ovih proteina oslobađa se hem, prostetička skupina koju čini heterociklički organski prsten porfirina u čijemu se središtu nalazi atom željeza koji služi kao izvor ili primatelj elektrona u kemijskim reakcijama, a koji se slijedom enzimatskih reakcija pretvara u bilirubin. U odrasloj osobi tijekom 24 sata nastaje oko 4 mg bilirubina po kilogramu tjelesne težine, a više od 80 % stvorenoga bilirubina nastaje razgradnjom hemoglobina koji se oslobađa sekvestracijom starih eritrocita u stanicama retikuloendotelnoga sustava slezene, jetre i koštane srži. Ostali bilirubin nastaje razgradnjom nehemoglobinskih hemoproteina, kao što je mioglobin, te različitih enzima (peroksidaza, katalaza, citokrom) ili uslijed neučinkovite hematopoeze u koštanoj srži. Nastanak bilirubina iz hema odvija se kroz dva koraka, u prvome se koraku hem uz pomoć hem-oksigenaze pretvara u biliverdin, a potom se u drugom koraku on pretvara u bilirubin uz pomoć biliverdin-reduktaze. Nastali bilirubin naziva se nekonjugirani bilirubin i on se vezan za albumine prenosi do jetre. Jetra je ključni organ u procesu metabolizma bilirubina s obzirom na to da omogućava njegovo izlučivanje iz organizma putem žuči. Taj proces započinje ulaskom nekonjugiranoga bilirubina u hepatocite mehanizmom olakšane difuzije. U hepatocitima dolazi do konjugacije bilirubina s glukuronskom kiselinom što omogućava enzim UDP-glukuronil transferaza, pri čemu nastaju blirubin-monoglukuronid i bilirubin-diglukuronid. Takav se bilirubin naziva konjugirani bilirubin i u tom se obliku može izlučiti iz hepatocita u žuč, što omogućavaju specifični membranski transporteri (MRP2/cMOAT). Konjugirani bilirubin u sastavu žuči dospijeva u tanko crijevo gdje uslijed djelovanja bakterija prelazi u urobilinogen koji se potom oksidira u sterkobilin, smeđi pigment koji stolici daje karakterističnu smeđu boju. U tom se procesu dio urobilinogena apsorbira iz crijeva u cirkulaciju i nazad u jetru i žuč, što se naziva enterohepatičko kruženje bilirubina. Ipak, jedan dio toga urobilinogena dospijeva i do bubrega preko kojega se urinom izlučuje iz organizma. Navedenim mehanizmima uspijeva se održati sklad između stvaranja i izlučivanja bilirubina iz organizma, pri čemu se on u plazmi održava unutar vrlo niskih koncentracija, što je vrlo bitno zbog njegova općega toksičnog učinka na organizam.
Vrste hiperbilirubinemija. S obzirom na vrstu frakcije bilirubina koja je povišena, razlikujemo nekonjugiranu, konjugiranu i miješanu hiperbilirubinemiju. U laboratorijskoj praksi mjere se ukupni i konjugirani bilirubin te se na osnovi njih određuje vrsta hiperbilirubinemije: 1) nekonjugirana hiperbilirubinemija ona je kod koje je udio konjugiranoga bilirubina manji od 20 % ukupnoga bilirubina; 2) konjugirana hiperbilirubinemija ona je kod koje je udio konjugiranoga bilirubina veći od 50 % ukupnoga bilirubina; 3) miješana hiperbilirubinemija ona je kod koje je udio konjugiranoga bilirubina između 20 i 50 % ukupnoga bilirubina. Razlikovanje podvrstā hiperbilirubinemija ima važno diferencijalno dijagnostičko značenje s obzirom na to da svaka od njih ima drugu etiologiju. Također, ovisno o načinu nastanka, razlikujemo nasljedne i stečene hiperbilirubinemije.
Nasljedne hiperbilirubinemije nastaju kao posljedica mutacija gena čiji genski produkti sudjeluju u metabolizmu bilirubina. Ovisno o razini na kojoj se poremećaj razvija, razlikujemo nekonjugirane hiperbilirubinemije kao što su Gilbertov i Crigler-Najjarov sindrom, te konjugirane hiperbilirubinemije, kao što su Dubin-Johnsonov i Rotorov sindrom, benigna rekurirajuća intrahepatična kolestaza te sindrom progresivne obiteljske intrahepatične kolestaze.
Gilbertov sindrom predstavlja najčešći oblik nasljedne hiperbilirubinemije koji se može naći kod 3 do 6 % osoba unutar opće populacije. Gilbertov sindrom nastaje kao posljedica smanjene aktivnosti UDP-glukuronil transferaze, enzima koji sudjeluje u procesu konjugacije bilirubina s glukuronskom kiselinom. Radi se o skupini enzima i izoenzima koje kodiraju različiti geni, a za nastanak ovoga sindroma zaslužna je mutacija UGT1A1 gena koja se prenosi autosomno-dominantnim putem. Posljedica ove mutacije je snižena razina i aktivnost navedenoga enzima (10 do 35 % aktivnosti enzima), zbog čega dolazi do smanjenja konjugacije bilirubina unutar hepatocita, a to dovodi do umjerene nekonjugirane hiperbilirubinemije. Bolest je asimptomatske naravi, a glavno kliničko očitovanje je nalaz umjereno povišenih vrijednosti bilirubina uz ostale uredne nalaze jetrene funkcije. Ponekad se i stanjima stresa (teški fizički rad, gladovanje, infekcija i sl.) može razviti blaga žutica koja spontano prolazi za nekoliko dana. Dijagnoza se postavlja na osnovi kliničke slike i laboratorijskih nalaza, a potvrđuje se molekularnim tehnikama (dokaz mutacije). Specifično liječenje nije potrebno, bolesnicima se savjetuje da izbjegavaju provocirajuće čimbenike i lijekove.
Crigler-Najjarov sindrom rjeđi je oblik nasljedne nekonjugirane hiperbilirubinemije koji se javlja u dva oblika: tip I i tip II. Oba oblika nastaju kao posljedica mutacije UGT1A1 gena, kao i Gilbertov sindrom, a razlikuju se po izraženosti gubitka aktivnosti enzima UDP-glukuronil transferaze. Crigler-Najjarov sindrom tip I obilježava potpuni izostanak aktivnosti enzima UDP-glukuronil transferaze, a prenosi se autosomno-recesivnim putem. Bolest se manifestira vrlo brzo po rođenju razvojem izraženoga ikterusa zbog čega novorođenčad brzo umire uslijed toksičnoga učinka bilirubina na mozak (kernikterus). Crigler-Najjarov sindrom tip II karakterizira snižena aktivnost enzima UDP-glukuronil transferaze koja se kreće u rasponu od 5 do 10 % (za razliku od Gilbertova sindroma gdje se aktivnost kreće između 10 i 35 %), a bolest se prenosi autosomno-dominantnim putem. Klinička slika nešto je izraženija nego kod Gilbertova sindroma te se može razviti već u djetinjstvu. Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza (hiperbilirubinemija uz uredne ostale nalaze jetrene funkcije) te molekularne potvrde mutacije UGT1A1 gena. Liječenje nije potrebno, no u slučaju jače izražene hiperbilirubinemije može se primijeniti fenobarbital koji značajno smanjuje vrijednosti bilirubina.
Dubin-Johnsonov sindrom predstavlja nasljedni oblik hiperbilirubinemije koji se nasljeđuje autosomno-dominantnim putem, a nastaje uslijed mutacije gena za MRP2/cMOAT membranski transporter koji sudjeluje u prijenosu konjugiranoga bilirubina iz hepatocita u žučne kanaliće. Posljedično manjkavosti toga transportera izostaje odgovarajuća sekrecija konjugiranoga bilirubina u žuč, zbog čega se on nakuplja u hepatocitima (što jetri daje karakterističnu crnu boju) te u krvi. Bolest se očituje blagom žuticom, a dijagnosticira se na temelju laboratorijskih nalaza (konjugirana hiperbilirubinemija uz uredne ostale nalaze jetrene funkcije) te molekularnom potvrdom bolesti. U dijagnostičkoj obradi ulogu mogu imati i pojačana urinarna eksekrecija koproporfirina te depoziti melaninu sličnoga pigmenta u hepatocitima u uzorcima bioptata jetre. Specifično liječenje nije potrebno, ženama se preporuča izbjegavanje uzimanja estrogenskih preparata.
Rotorov sindrom rijedak je oblik nasljedne konjugirane hiperbilirubinemije koji se nasljeđuje autosomno-recesivno, a nastaje kao posljedica SLCO1B1 i SLCO1B3 gena čiji su genski produkti proteini koji djeluju kao transporteri bilirubina u membranama hepatocita. Posljedično tim mutacijama izostaje odgovarajuća sekrecija konjugiranoga bilirubina u žuč pa nastaje konjugirana hiperbilirubinemija. Klinički se bolest očituje intermitentnim blagim žuticama uz odsutnost drugih simtoma i znakova. Kao i kod ostalih nasljednih bilirubinemija, dijagnoza se postavlja na temelju laboratorijskih nalaza i molekularnih metoda, a specifično liječenje ovoga poremećaja nije potrebno.
Stečene hiperbilirubinemije pojavljuju se pri različitim jetrenim i drugim bolestima, a prema frakcijski povišenom bilirubinu razlikujemo nekonjugirane i konjugirane hiperbilirubinemije.
Stečena nekonjugirana hiperbilirubinemija može biti posljedica pojačanoga stvaranja bilirubina ili poremećene apsorpcije bilirubina u jetri. Pojačano stvaranje bilirubina nalazimo u stanjima hemolize, neučinkovite eritropoeze te uslijed resorpcije velikoga hematoma. Poremećena apsorpcija bilirubina u jetri obično je posljedica uzimanja lijekova koji remete unos ili konjugaciju bilirubina u hepatocitima (rimfampicin, probenicid, radiokontrasti). Hemoliza je najčešći uzrok stečene nekonjugirane hiperbilirubinemije, a na nju ukazuju i drugi laboratorijski nalazi: anemija, retikulocitoza, povišene vrijednosti laktat dehidrogenaze, snižene vrijednosti haptoglobina te pojava hemosiderina u mokraći.
Stečena konjugirana hiperbilirubinemija može nastati uslijed hepatocelularnoga oštećenja te kolestaze (intrahepatične ili ekstrahepatične). Razlikovanju ove dvije skupine uzroka konjugirane hiperbilirubinemije omogućuju laboratorijski nalazi i ultrazvučni pregled. Laboratorijski nalazi kod hepatocelularnoga oštećenja ukazuju na značajnije povišene vrijednosti jetrenih transaminaza (> 300 I/U) uz umjereniji porast alkalne fosfataze (normalna ili < 3x od normalnih vrijednosti), dok kod kolestaze nalazimo umjereniji porast transaminaza (< 300 I/U), a značajniji porast alkalne fosfataze (> 4x od normale). Ultrazvučni nalaz kod kolestaze ukazuje na intrahepatalnu ili ekstrahepatalnu dilataciju žučnih vodova. Najčešći uzroci stečene konjugirane hiperbilirubinemije prikazani su u Tablici 4.24.
|
Tablica 4.24. Uzroci stečene konjugirane hiperbilirubinemije
|
|
Hepatocelularno oštećenje
|
Intrahepatična kolestaza
|
Ekstrahepatična kolestaza
|
|
Alkoholni steatohepatitis
Autoimuni hepatitis
Fibroza/ciroza jetre
Hemokromatoza
Nealkoholni steatohepatitia
|
Primarna bilijarna ciroza
Kolestaza u trudnoći
Postoperativna hiperbilirubinemija
Koledokolitijaza
Infekcije, lijekovi
|
Koledokolitijaza
Neoplazme žučnih vodova
Neoplazme gušterače
Primarni sklerozirajući kolangitis
Strikture koledokusa
|
Pristup bolesniku s hiperbilirubinemijom. Osnovni je korak kod bolesnika s hiperbilirubinemijom određivanje radi li se o pretežno konjugiranoj ili nekonjugiranoj hiperbilirubinemiji, kako je navedeno u Tablici 4.25.
|
Tablica 4.25. Razlikovanje nekonjugirane i konjugirane hiperbilirubinemije
|
|
Laboratorijski parametar
|
Nekonjugirana hiperbilirubenimija
|
Konjugirana hiperbilirubinemija
|
|
Abnormalni nalazi jetrene funkcije
|
Uglavnom uredni
|
Većinom patološki
|
|
Bilirubin u urinu
|
Negativan
|
Pozitivan
|
|
Konjugirani bilirubin u serumu
|
< 20 % ukupnoga bilirubina
|
> 30 % ukupnoga bilirubina
|
|
Test mokraćne pjene (protresanje urina)
|
Bijela pjena
|
Žuta pjena
|
Nekonjugirana hiperbilirubinemija. Kod bolesnika kod kojih laboratorijski nalazi ukazuju na nekonjugiranu hiperbilirubinemiju treba razmotriti sljedeće uzroke: hemoliza, neučinkovita hematopoeza, smanjen unos bilirubina u jetru (učinak lijekova), mogućnost resorpcije hematoma, Gilbertov sindrom te Crigler-Najjarov sindrom, kako je prethodno opisano.
Konjugirana hiperbilirubinemija. Kod bolesnika s konjugiranom hiperbilirubinemijom treba razlučiti radi li se o hepatocelularnom oštećenju ili kolestazi, što je moguće učiniti na temelju laboratorijskih nalaza: na hepatocelularno oštećenje ukazuju dominantno povišene vrijednosti transaminaza uz normalno ili blago povišenje alkalne fosfataze, dok na kolestazu ukazuju dominantno povišene vrijednosti alkalne fosfataze i umjereno povišene vrijednosti transaminaza.
U slučaju nalaza koji ukazuju na hepatocelularno oštećenje treba razmotriti sljedeće uzroke: alkoholni hepatitis, autoimuni hepatitis, ciroza jetre, toksično ili medikamentozno oštećenje jetre, tromboza hepatične vene, ishemijski hepatitis, virusni hepatitis, Wilsonova bolest, manjak α1-antitripsina, hemokromatoza.
U slučaju nalaza koji ukazuju na kolestazu treba razlučiti radi li se o intrahepatičnoj ili ekstrahepatičnoj kolestazi, što je moguće napraviti na temelju slikovnih dijagnostičkih metoda (ultrazvuk, kompjuterizirana tomografija), a prema potrebi u obzir dolaze i MR-kolangiopankreatografija (MRCP) ili endoskopska retrogradna kolangio-pankreatografija (ERCP). Mogući uzroci intra- i ekstrahepatične kolestaze prikazani su ranije u tablici.
NEALKOHOLNA MASNA BOLEST JETRE
Definicija. Nealkoholna masna bolest jetre (engl. nonalcoholic fatty liver disease, NAFLD) predstavlja spektar patohistoloških promjena koje klasično nalazimo u alkoholnoj bolesti jetre (masna promjena, steatohepatitis, fibroza/ciroza), ali u odsutnosti kronične, prekomjerne konzumacije alkohola, odnosno dnevnoga unosa alkohola manjega od 20 g za žene i 30 g za muškarce.
Epidemiologija. NAFLD predstavlja jednu od najčešćih metaboličkih bolesti jetre te se procjenjuje da ju se može naći u 20 do 45 % odrasle populacije razvijenih zemalja, a bilježi se i sve veća pojavnost u pedijatrijskoj populaciji. Bolest se javlja kod oba spola, ali nešto češće kod žena srednje i starije životne dobi. Glavni čimbenici rizika za razvoj NAFLD-a su pretilost, šećerna bolest tipa II te hiperlipidemija (metabolički sindrom). Kod bolesnika s navedenim rizičnim čimbenicima bolest ima daleko veću učestalost, tako da se može naći kod više od 90 % iznimno pretilih osoba te kod više od 80 % bolesnika koji boluju od šećerne bolesti tipa II. Ukupno gledano, NAFLD je vodeći uzrok jetrene disfunkcije, ako se isključe bolesnici s alkoholnom bolesti jetre i virusnim hepatitisom, a s obzirom na rastuću epidemiologiju pretilosti, NAFLD postaje sve češći razlog za transplantaciju jetre.
Etiopatogeneza. Glavni etiološki čimbenici koji pogoduju razvoju NAFLD-a su pretilost, šećerna bolest tipa II te hiperlipidemija, no može biti povezana i s nekim drugim bolestima i stanjima, kao što su sindrom policističnih jajnika, različite endokrinopatije (hipopituitarizam, hipokorticizam, hipotireoidizam, hipogonadizam) te prehrambene navike (pojačana konzumacija fruktoze, gladovanje i refeeding sindrom, parenteralna prehrana). U podlozi navedenih etioloških čimbenika nalazimo inzulinsku rezistenciju i kompenzacijsku hiperinzulinemiju koje se smatraju ishodišnom točkom cijeloga poremećaja. Posljedično inzulinskoj rezistenciji dolazi do povećane lipolize u perifernim masnim tkivima pri čemu nastaju slobodne masne kiseline koje dolaze u hepatocite gdje ih se jedan dio usmjerava u proces β-oksidacije (pretvorba masnih kiselina u molekulu acetil-CoA koja ulazi u Krebsov ciklus), a drugi se dio ponovno pretvara u trigliceride i u tom obliku skladišti, što rezultira razvojem masne promjene jetre (steatoza). Trigliceridi sami po sebi nisu hepatotoksični, ali u procesu njihove sinteze nastaju intermedijarni produkti, kao što je diacil-glicerol, koji mogu djelovati toksično (lipotoksičnost) što može biti uzrok oštećenja i nastanka upale (steatohepatitis). Do sada još nije jasno zašto neki bolesnici sa steatozom razviju steatohepatitis, dok ga drugi ne razviju, što sugerira na kompleksniju patofiziologiju i utjecaj genetskih čimbenika (polimorfizam PNPLA3 gena). Upala i oštećenje hepatocita vodi u staničnu smrt, što daje poticaj aktivaciji zvjezdolikih ili Itovih stanica koje imaju bitnu ulogu u regeneraciji i imunosnom odgovoru jetre, ali imaju i ključnu ulogu u razvoju fibroze te kasnije ciroze jetre (fibroza se definira kao međustadij između kroničnoga hepatitisa i ciroze) koji predstavljaju najteži oblik NAFLD-a.
Patologija. Ovisno o stupnju bolesti, histološki nalaz nealkoholne masne promjene jetre može uključivati steatozu (difuzna, makrovezikularna), steatohepatitis (balonska degeneracija hepatocita, neutrofilna infiltracija, Malloryjeva tjelešca) te različit stupanj fibroze koja može progredirati u cirozu.
Klinička slika. Kod većine ovih bolesnika manifestira se samo masna promjena jetre (steatoza) koja je kod najvećega broja bolesnika asimptomatska, dok se manji broj bolesnika žali na nespecifične simptome kao što su umor i malaksalost te bol i osjećaj težine pod desnim rebrenim lukom. Pažljivim pregledom može se napalpirati uvećana jetra kod oko 75 % bolesnika, dok su druge stigme kronične jetrene bolesti rijetke. Kod ovih bolesnika dijagnoza se najčešće postavlja uslijed obrade slučajno otkrivenih povišenih vrijednosti jetrenih transaminaza ili usputno, prilikom slikovne dijagnostičke obrade gornjega abdomena (ultrazvuk, kompjuterizirana tomografija) iz nekoga drugog razloga. Kod manjega broja bolesnika bolest progredira prema steatohepatitisu, fibrozi i cirozi. Čimbenici rizika za ovu progresiju su životna dob > 45 godina, indeks tjelesne mase > 30 kg/m2, loše regulirana šećerna bolest te arterijska hipertenzija. Kod ovih se bolesnika postupno razvijaju klasični klinički znaci jetrenoga oštećenja (ikterus, ascites, palmarni eritem, znakovi venskih kolaterala i dr.).
Dijagnoza se postavlja na osnovi anamnestičkih podataka i kliničkoga nalaza, laboratorijskih i slikovnih pretraga, a u konačnici se potvrđuje biopsijom i patohistološkom analizom dobivenoga uzorka.
Laboratorijski nalazi. Najčešći laboratorijski nalazi uključuju umjereno povišene vrijednosti jetrenih transaminaza (omjer AST:ALT manji je od 1) te gamaglutamil-transferaze i alkalne fosfataze, iako kod određenoga broja bolesnika s masnom promjenom jetre one mogu biti i uredne. Kod ovih se bolesnika često mogu otkriti hiperferitinemija te pozitivna autoantitijela kao što su antinuklearna antitijela (ANA) te antitijela na glatku muskulatru (anti-SM) što može djelovati zbunjujuće u diferencijalnoj dijagnozi (hemokromatoza, autoimuni hepatitis).
Slikovne metode. Ultrazvuk je najčešće korištena metoda u slikovnoj dijagnostici NAFLD-a. Steatoza se kao početni stadij bolesti ultrazvučno može uočiti kada je infiltrirano više od 33 % hepatocita, tj. kada je sadržaj ukupne masti veći od 5 % od ukupne mase jetre. Masna jetra je uvećana (mjerena u medioklavikularnoj liniji) te pokazuje difuzno grub izgled uz naglašenu hiperehogenost (tzv. svijetla jetra). Iako se radi o difuznoj leziji, ponekad je moguća slika tzv. fokalne steatoze pri kojoj opisane promjene nalazimo kao izolirani areal unutar zdravoga jetrenog parenhima, najčešće u IV. i V. segmentu jetre), a moguće je ponekad naći i areale nepromijenjenoga, zdravoga jetrenog parenhima unutar masno izmijenjenoga parenhima. Kod pojave steatohepatitisa smanjuje se intenzitet ehogenosti, no nema izražene difuzne hipoehogenosti kao u drugim oblicima akutnoga hepatitisa. Fibrozu i početni stadij ciroze karakterizira uvećana jetra hiperehogene i inhomogene strukture parenhima uz prisutnost pseudolobulacije te otežane vizualizacije stijenki krvnih žila. U uznapredovalome stadiju ciroze jetra je smanjena, skvrčena, naglašenoga i inhomogenog izgleda („jetra izjedena od moljaca“), neravnih kontura i s četkastim izgledom kapsule. Uz to nalazimo i druge znakove nastale portalne hipertenzije kao što su ascites, dilatirana i tortuozna portalna vena i sl.
Biopsija jetre. S obzirom na to da se steatohepatitis i fibroza jetre slikovnim metodama teško otkrivaju i razlikuju u svojim početnim stadijima, biopsija jetre i patohistološka analiza uzorka ostaje glavna metoda procjene i diferencijacije tih entiteta. Glavne indikacije za biopsiju jetre kod bolesnika su trajno povišene vrijednosti jetrenih transaminaza, visoka klinička suspekcija na steatohepatitis i/ili uznapredovalu fibrozu te kod nejasne etiologije u svrhu diferenciranja dijagnoze (sumnja na druge uzroke masne promjene jetre).
Zaključno, za definitivnu dijagnozu NAFLD-a potrebni su nam sljedeći kriteriji: 1) radiološki ili histološki nalaz masne promjene jetre; 2) negativna anamneza na konzumaciju alkohola; 3) isključeni drugi uzroci masne promjene jetre te 4) odsutnost drugih, koegzistirajućih kroničnih bolesti jetre.
Diferencijalna dijagnoza NAFLD-a je široka i obuhvaća razne bolesti i stanja: alkoholna bolest jetre, kronični virusni hepatitis, Wilsonova bolest, lipodistrofija, hemokromatoza, medikamentno oštećenje jetre, Reyeov sindrom, HELLP sindrom i dr.
Liječenje u prvome redu podrazumijeva modifikaciju životnoga stila i navika te primjenu lijekova, sve s ciljem smanjenja tjelesne težine i inzulinske rezistencije. Također, liječenje podrazumijeva i dobru regulaciju bolesti povezanih s nastankom i progresijom NAFLD-a (šećerna bolest, hiperlipidemija, arterijska hipertenzija). U uznapredovalim fazama steatohepatitisa i ciroze provode se klasične metode liječenja opisane u odgovarajućim dijelovima udžbenika.
Modifikacija životnoga stila i navika osnovna je terapijska opcija kod ovih bolesnika. Preporuča se dijetna ishrana, redovita tjelovježba i redukcija tjelesne težine. Za kliničko poboljšanje steatoze potreban je minimalni gubitak od 3 do 5 % na tjelesnoj težini, dok se kod steatohepatitisa poboljšanje očekuje nakon gubitka od minimalno 10 %.
Medikamentno liječenje čini drugu liniju liječenja NAFLD-a. Primjenom metformina i taizolinidenida kao lijekova koji smanjuju inzulinsku rezistenciju, dokazano se poboljšavaju vrijednosti jetrenih laboratorijskih nalaza, ali metformin ne utječe na rezoluciju histološkoga nalaza, dok tiazolinidenidi utječu i na rezoluciju histološkoga nalaza, ali izbjegava ih se zbog nuspojava koje uključuju dobivanje na tjelesnoj težini. Primjena antioksidanasa (vitamin E, vitamin C) može biti opravdana u liječenju i prevenciji steatohepatitisa. U slučaju hiperlipidemije potrebna je primjena antilipemika (statini).
Prognoza. Stetatoza sama za sebe predstavlja benignu promjenu jetre ireverzibilne prirode ako se ukloni inicijalni etiološki čimbenik (debljina, hiperlipidemija, kronična hiperglikemija). Razvoj steatohepatitisa je nepredvidiv te osim prethodno navedenih rizičnih čimbenika, u ovoj progresiji veliku ulogu vjerojatno ima i genetska predispozicija. Bolesnici sa steatohepatitisom posjeduju rizik od razvoja fibroze, odnosno ciroze, i pojave jetrenoga zatajenja. Kod najmanje jedne trećine bolesnika kod kojih se dokaže steatohepatitis na inicijalnoj biopsiji jetre razvije se progresivna fibroza u vremenskome periodu od pet do sedam godina. Bolest je reverzibilna sve do razvoja težih stupnjeva ciroze što ima velik terapijski značaj (pravodobno i pravilno liječenje može smanjiti ili spriječiti daljnju progresiju bolesti). S obzirom na veliku učestalost metaboličkoga sindroma u općoj populaciji, NASH ciroza postaje sve češći uzrok transplantacije jetre u zemljama u razvoju.
Definicija. Alkoholna bolest jetre naziv je za patološke promjene na jetri koje nastaju kao posljedica dugotrajnoga unosa veće količine alkohola u organizam, a uključuju spektar promjena od masne promjene jetre, preko steatohepatitisa pa sve do fibroze i ciroze jetre.
Epidemologija. Radi se o jednoj od najčešćih bolesti jetre u razvijenim zemljama i čini drugi po učestalosti uzrok transplantacije jetre. Smatra se da će se masna promjena jetre uzrokovana alkoholom javiti kod više od 90 % osoba koje konzumiraju više od 50 g alkohola na dan kroz vremenski period dulji od deset godina, dok će se alkoholna ciroza razviti kod 10 do 25 % takvih osoba.
Metabolizam alkohola. Nakon unosa alkohola u organizam nastupa njegova brza apsorpcija preko sluznice gornjega dijela probavnoga sustava tako da se on već nakon nekoliko minuta može detektirati u krvi, osobito ako se unosi na prazan želudac (prisutnost masne hrane u želucu i dvanaesniku usporava apsorpciju alkohola). Zbog svoje izražene topljivosti u mastima (liposolubilnost), alkohol se ravnomjerno raspoređuje u tijelu, posebno u masnome tkivu, a više od 90 % unesenoga alkohola biva metabolizirano u jetri, dok se tek manji dio, svega oko 10 %, izlučuje iz organizma u nerazgrađenome obliku i to dijelom putem bubrega (urinom), a dijelom putem pluća (disanje). Metabolizam alkohola u jetri odvija se kroz dva koraka. U prvom se koraku alkohol oksidira u acetaldehid što u najvećoj mjeri (> 80 %) omogućava alkoholna dehidrogenaza, a u manjoj mjeri (< 15 %) mikrosomalni enzimi citokrom P-450 (CYP2E1) i peroksimalna katalaza. Osim u jetri, alkoholnu dehidrogenazu nalazimo i u drugim tkivima i organima, a najznačajnija je ona u sluznici želuca koja aktivno sudjeluje u metaboliziranju alkohola u acetaldehid. Acetaldehid predstavlja toksičan spoj koji se dalje metabolizira putem enzima aldehid dehidrogenaze u acetat koji se potom luči u krv i biva oksidiran u perifernim tkivima stvarajući ugljični dioksid i vodu.
Patofiziologija. Oštećenje hepatocita nastaje dvama temeljnim mehanizmima: 1) direktnim učinkom alkohola na hepatocite te 2) indirektnim učinkom preko aktiviranih Kupfferovih stanica.
Direktno oštećenje hepatocita posredovano alkoholom nastaje kroz nekoliko temeljnih mehanizama. (1) Osnovni događaj uključuje nakupljanje acetata u hepatocitima, on služi kao izvor vodikovih iona koji dovode do pojačane pretvorbe NAD-a (nikotinamid-adenin dinukletoid) u njegov reducirani oblik NADH. Nakupljanje NADH-a dovodi do smanjenja redoks-potencijala hepatocita, što za posljedicu ima smanjenu oksidaciju masnih kiselina te nakupljanje triglicerida i drugih lipida (masna promjena jetre) uz inhibiciju glukoneogeneze (sklonost hipoglikemijama u uvjetima malnutricije). Osim toga, povećana oksidacija NADH-a dovodi do pojačane potrošnje kisika, što može rezultirati hipoksijskom lezijom hepatocita. (2) Također, pojačanom aktivnošću enzima citokroma C450 dolazi do stvaranja slobodnih radikala kisika koji dovode do oksidativnoga stresa i lipidne peroksidacije (oštećenja lipidnih struktura) što pridonosi oštećenju hepatocita. (3) Nastali acetaldehid ima i sposobnost vezanja za različite proteine, kao i molekule DNA, što dovodi do njihovih strukturnih izmjena čime postaju strani za imunološki sustav te kao takvi mogu izazvati dodatno imunološki posredovano oštećenje.
Indirektni učinak alkohola na hepatocite. Kronična konzumacija alkohola dovodi do povećane crijevne permeabilnosti što rezultira razvojem kronične endotoksemije portalne cirkulacije. Navedeni toksini podražuju Kupfferove stanice jetre te one počinju stvarati i lučiti različite proupalne citokine kao što u TNF-α, TGF-β, IL-1, IL-6, IL-8 i dr. Kao rezultat djelovanja ovih medijatora dolazi do infiltracije jetre različitim upalnim stanicama koje svojom aktivacijom dovode do oštećenja hepatocita. Također, navedene molekule imaju i mogućnost aktivacije stelatnih stanica (Itove stanice) koje imaju sposobnost stvaranja kolagenskih vlakana što vodi prema fibrozi i cirozi jetre.
Rizični čimbenici. S obzirom na činjenicu da se alkoholna bolest jetre ne razvija kod svih osoba koje konzumiraju alkohol, kao i na činjenicu da uz konzumiranje jednake količine alkohola osobe mogu razviti različite histopatološke promjene i oblike alkoholne bolesti jetre, jasno je da na njezin razvoj utječu i drugi čimbenici, kao što su oblik pijenja i vrsta alkohola, spol, nutritivni status te nasljeđe i ranije bolesti jetre.
Oblik pijenja i vrsta alkohola. Kronični, svakodnevni unos alkohola češće se povezuje s pojavom alkoholne bolesti jetre u odnosu na povremeni unos alkohola, a to se opravdava činjenicom velike regeneratorne sposobnost jetre te njezinim oporavkom između perioda pojačanoga unosa alkohola. Iako to nije u potpunosti dokazano i postoje različita mišljenja, pijenje žestokih pića i piva češće se povezuje s nastankom alkoholne bolesti jetre u odnosu na pijenje vina.
Spol. Žene imaju veći rizik od razvoja alkoholne bolesti jetre u odnosu na muškarce, što se tumači manjim volumenom distribucije alkohola, kao i smanjenom aktivnošću gastrične alkoholne dehidrogenaze. Iz navedenih se razloga alkoholna ciroza jetre kod žena može razviti pri konzumiranju znatno manjih količina alkohola u odnosu na muškarce (npr. ciroza jetre kod muškaraca obično se razvija nakon unosa više od 60 do 80 grama alkohola na dan kroz deset godina, dok se kod žena može javiti i kod unosa 20 grama alkohola na dan).
Nutritivni status. Pothranjenost, kao i pretilost, smatraju se važnim rizičnim čimbenicima za razvoj alkoholne bolesti jetre. Kod pothranjenosti do izražaja dolazi manjak mikronutrijenata i antikosidanasa koji djeluju protektivno u vidu smanjenja i ublažavanja oksidacijskoga stresa nastaloga pojačanim unosom alkohola, dok se kod pretilosti tumači pojačanim unosom alkohola s obzirom na to da se zbog velikoga volumena raspodjele pretile osobe teže opijaju i za to su im potrebne veće količine alkohola.
Nasljeđe. Polimorfizam gena povezanih s metabolizmom alkohola (geni za alkoholnu dehidrogenazu, aldehid dehidrogenazu ili citokrom C-450 enzime) i/ili gena povezanih s produkcijom proupalnih citokina može imati određen učinak na razvoj alkoholne bolesti jetre. Jedan od najistraživanijih gena povezanih s razvojem alkoholne bolesti jetre je gen PNPLA3 čiji genski produkt, enzim adiponutrin, posreduje hidrolizu triglicerida. Prisutnost mutacije ovoga gena povezuje se s uznapredovalim stadijima alkoholne bolesti jetre, kao i s nastankom hepatocelularnoga karcinoma.
Ranije bolesti jetre. Bolesnici koji već imaju neki oblik kronične bolesti jetre (kronični virusni hepatitis, autoimune bolesti jetre i sl.) imaju veći rizik i ranije razvijaju alkoholnu bolest jetre od osoba sa zdravom jetrom.
ALKOHOLNA MASNA PROMJENE JETRE
Definicija i patogeneza. Alkoholna masna promjena jetre predstavlja najblaži i najraniji kliničko-patološki oblik alkoholne bolesti jetre koju karakterizira pojačano nakupljanje lipida, posebice triglicerida i fosfolipida, unutar hepatocita i nalazimo ju u gotovo svih alkoholičara. Temeljni mehanizam nastanka masne promjene jetre je smanjen redukcijsko-oksidacijski potencijal hepatocita (objašnjeno ranije) koji rezultira smanjenom beta oksidacijom masnih kiselina, a alkohol također može djelovati i na pojačanu lipogenezu (sintezu masnih kiselina) preko transkripcijskoga faktora SREBP-1c složenim unutarstaničnim mehanizmima. Kao rezultat tih događaja javlja se pojačana intracitoplazmatska akumulacija lipida unutar hepatocita. U konačnici, radi se o reverzibilnoj promjeni koja nestaje i povlači se ako se prekine konzumacija alkohola i jetri omogući period regeneracije, dok nastavkom konzumacije alkohola masna promjena jetre prelazi u drugi stadij - alkoholni steatohepatitis.
Patologija. Osnovna makromorfološka promjena masne jetre je hepatomegalija uz glatke, sjajne i zaobljene rubove, a najznačajnije promjene su na histološkoj razini. Prvi znaci masne promjene jetre su akumulacije lipida unutar citoplazme hepatocita koje se vide kao brojne manje vakuole (mikrovezikularna steatoza), napredovanjem bolesti spajaju se u jednu veliku vakuolu koja potiskuje jezgru hepatocita prema periferiji (marovezikularna steatoza), što se naziva baloniranje stanice. U ovome stadiju alkoholne bolesti jetre ne nalazimo upalni infiltrat, niti pojačanu produkciju fibrinskih vlakana.
Klinička slika. Alkoholna masna promjena jetre obično je asimptomatske prirode te se najčešće manifestira tek lagano uvećanom jetrom s ili bez umjereno povišenih vrijednosti jetrenih transaminaza. Tup bol pod desnim rebrenim lukom, mučnina i umor rijetka su klinička očitovanja ovoga stadija alkoholne bolesti jetre.
Dijagnoza se postavlja na temelju anamnestičkih podataka o uživanju alkohola, laboratorijskih nalaza i ultrazvuka jetre. Laboratorijski nalazi mogu biti uredni, no najčešće uključuju umjereno povišene vrijednosti gamaglutamil transferaze (GGT) te jetrenih transaminaza s karakteristično višim vrijednostima aspartat-aminotrasferaze (AST) u odnosu na alanin-aminotransferazu (ALT). Često se mogu naći i druge laboratorijske stigme kroničnoga alkoholizma kao što su makrocitoza (MCV > 100) i umjerena trombocitopenija. Ultrazvuk jetre najčešća je slikovna metoda korištena u dijagnostičkoj evaluaciji ovih bolesnika, a masna promjena jetre može se detektirati kada je ukupan sadržaj masti u jetri veći od 5 % ukupne mase jetre. Jetra je obično uvećana, gruboga i hiperehogenog odjeka („svijetla jetra“), promjene su obično difuzno raspoređene (rjeđe se javljaju fokalno), a često su vidljivi i očuvani areali zdravoga jetrenog parenhima unutar masne promjene.
Liječenje i prognoza. Liječenje se sastoji od stroge apstinencije od alkohola i ne zahtijeva druge, specifične oblike liječenja. U blažim oblicima masne promjene jetre potpuni oporavak moguć je već nakon četiri do šest tjedana od prestanka konzumacije alkohola, dok se kod težih slučajeva očekuje kroz nešto dulji vremenski period. Također, ovim je bolesnicima potrebno osigurati prikladnu nutritivnu potporu 35 - 40 kcal/kg/dan) koja uključuje i suplementaciju vitamina B i drugih mikronutrijenata i antikosidanasa. Prema potrebi u liječenje treba uključiti i psihijatra i psihoterapeuta, sve s ciljem održavanja dugotrajnoga ustezanja od uzimanja alkohola.
ALKOHOLNI STEATOHEPATITIS
Definicija i patogeneza. Alkoholni steatohepatitis označava stadij alkoholne bolesti jetre obilježen difuznom parenhimatoznom upalom jetre koju karakterizira hepatocelularno oštećenje i infiltracija upalnim stanicama, a obično se superponira na postojeću masnu promjenu jetre. Nastanak alkoholnoga steatohepatitisa tumači se kroz nekoliko mehanizama. (1) Tijekom metabolizma alkohola u hepatocitima se oslobađaju slobodni radikali kisika odgovorni za lipidnu peroksidaciju i oštećenje lipidnih struktura hepatocita, a i sam acetaldehid ima direktan citotoksični učinak. Oštećeni hepatociti luče endogene supstance (DAMP suspstance) koje upalnim stanicama signaliziraju mjesto oštećenja zbog čega se one tamo nakupljaju, aktiviraju i dovode do daljnjega oštećenja. (2) Acetaldehid kao vrlo reaktivan spoj lako ulazi u veze s drugim proteinima hepatocita, kao i s molekulom DNA, pri čemu nastaju autoantigeni koji aktiviraju imunološki sustav i dovode do humoralnoga i stanično posredovanog oštećenja hepatocita. (3) U konačnici i povećana crijevna permeabilnost omogućava translokaciju bakterijskih lipopolisaharida (endotoksina) koji portalnom venom dospijevaju u jetru i aktiviraju Kupfferove stanice i time produkciju proupalnih citokina (TNF-α, TGF-β, IL-1, IL-6, IL-8) koji dalje dovode do kemotaksije i aktivacije upalnih stanica.
Patologija. Glavna histopatološka karakteristika alkoholnoga steatohepatitisa je masna pretvorba jetrenih stanica uz infiltraciju jetrenoga parenhima polimorfonuklearnim leukocitima i prisutnost mjestimične hepatocelularne nekroze. Imunohistokemijskim metodama mogu se dokazati i tipična Mallory-Denkova tjelešca koja predstavljaju tzv. alkoholni hijalin koji nastaje kondenzacijom citoskeletnih intermedijarnih filamenata, a čija prisutnost korelira s težinom bolesti. Već je u ovim fazama bolesti moguće otkriti odlaganje kolagena oko središnjih vena što dovodi do zadebljanja njihove stijenke. Navedene promjene nisu patognomonične za alkoholni steatohepatitis i mogu se naći i kod drugih bolesti jetre.
Klinička slika alkoholnoga steatohepatitisa ovisi o aktivnosti same bolesti. Umjerena upala dovest će do blaže kliničke slike koju karakteriziraju bol i nelagoda pod desnim rebrenim lukom, mučnina i povraćanje te različito izražena žutica. Kod manjega broja oboljelih bolest može progredirati u akutno, fulminantno jetreno zatajenje praćeno razvojem vrućice, hepatalne encefalopatije i višeorganskoga zatajenja. Također, kod ovih bolesnika često su prisutne i druge stigme kroničnoga alkoholizma, kao što su plamarni eritemi, spider-nevusi, ginekomastija, testikularna atrofija te Dupuytrenova kontraktura. Kako bolesnici u tome stanju obično ne mogu dalje unositi alkohol u organizam, kod dobroga se dijela razvije i apstinencijski sindrom (lat. delirium tremens).
Dijagnoza se postavlja na osnovi laboratorijskih nalaza, slikovnih metoda i eventualno biopsije jetre, uz anamnestički podatak o kroničnome uživanju alkohola. Laboratorijski nalazi uključuju leukocitozu s neutrofilijom, megaloblastičnu anemiju, umjerenu trombocitopeniju, povišene vrijednosti jetrenih transaminaza (obično preko 300 I/U s karakterističnim omjerom AST > ALT) i pokazatelja kolestaze (GGT, ALP, bilirubin) te povišene vrijednosti amonijaka i produljeno protrombinsko vrijeme. U procjeni težine bolesti na temelju laboratorijskih vrijednosti koristi se tzv. Maddreyjev skor (4.6 x [bolesnikovo protrombinsko vrijeme - kontrolno protrombinsko vrijeme] + ukupni bilirubin). Vrijednosti Maddreyjeva skora iznad 32 ukazuju na tešku bolest jetre te lošu prognozu. Ostali laboratorijski nalazi uključuju manjak vitamina B skupine, hipoalbuminemiju, hipogamaglobulinemiju te povećanu saturaciju transferina.
Ultrazvuk jetre daje sliku sličnu onoj kod masne promjene jetre, ali je slabije izražena hiperehogenost jetrenoga parenhima („tamnija jetra“). U jetrenome parenhimu može se vidjeti i znak „perivaskularnih manžeta“ koji predstavlja hiperehogenu stijenku krvnih žila koje se prosijavaju na slici („slika zvjezdanog neba“). Doplersko mjerenje protoka kroz hepatalnu arteriju pokazuje povišenu vršnu brzinu sistoličkoga protoka, kao i povećanje promjena cijele arterije. Biopsija jetre rijetko je indicirana kod ovih bolesnika jer se na temelju prikazanih kriterija i pozitivne anamneze na alkoholizam s velikom pouzdanošću može postaviti dijagnoza alkoholnoga steatohepatitisa. Kod nejasnih je slučajeva potrebno analizirati markere za virusne i autoimune oblike akutnoga hepatitisa.
Liječenje. Kao i kod drugih oblika alkoholne bolesti jetre, osnovna terapijska intervencija je stroga apstinencija od alkohola uz odgovarajuću nutritivnu podršku. Kod bolesnika s alkoholnim steatohepatitisom i Maddreyjevim skorom većim od 32 indicirana je i specifična medikamentozna terapija koju čine predinzolon, N-acetilcistein ili pentoksifilin. Transplantacija jetre rezervirana je za manji broj bolesnika koji ne reagiraju na medikamentozno liječenje.
Metilprednizolon je lijek izbora u liječenju alkoholnoga steatohepatitisa koji dokazano smanjuje ukupnu smrtnost bolesnika, a smije se davati kada je isključena mogućnost postojanja virusnoga hepatitisa te u odsutnosti sistemske infekcije i krvarenja iz probavnoga sustava. Najčešće se daje u dozi od 32 mg/dan tijekom četiri tjedna i nije potrebna istodobna profilaktična primjena antibiotika. Alternativa metilprednizolonu je predinzolon koji se primjenjuje u dnevnoj dozi od 40 mg kroz četiri tjedna.
N-acetilcistein može se primjenjivati u kombinaciji s metilprednizolonom s obzirom na to da su neke studije pokazale bolje kratkoročno preživljenje u odnosu na bolesnike liječene isključivo metilprednizolonom. Primjena N-acetilcisteina smanjuje rizik od razvoja hepatorenalnoga sindroma i sistemskih infekcija, a primjenjuje se intravenski kroz pet dana u dozi od 100 mg/kg/dan otopljenoj u 1000 ml 5 % glukoze.
Pentoksifilin je inhibitor produkata citokina koji primijenjen u dozi od 3 x 400 mg na dan kroz četiri tjedna dokazano smanjuje rizik od razvoja hepatorenalnoga sindroma kod bolesnika s alkoholnim steatohepatitisom. U odnosu na metilprednizolon ima lošije rezultate u pogledu smanjenja ukupne smrtnosti te se stoga primjenjuje samo kod bolesnika kod kojih je primjena metilprednizolona kontraindicirana. Također se niti kombinacija metilprednizolona i pentoksifilina nije pokazala učinkovitijom, stoga se ne preporuča.
Transplantacija jetre. Ako se nakon tjedan dana terapije ne postiže zadovoljavajuć klinički odgovor, a on se procjenjuje na temelju Lille skora (≥ 0.45), u obzir dolazi transplantacija jetre kao mogući terapijski izbor te takvoga bolesnika treba prebaciti u odgovarajući medicinski centar. S obzirom na kliničko stanje i rezultate dosadašnjih studija, uvjet šestomjesečne apstinencije od alkohola prije transplantacije jetre kod ove skupine bolesnika nije primjenjiva. Lille skor dobiva se unosom određenih čimbenika kao što su dob, vrijednost albumina, inicijalna vrijednost bilirubina, vrijednost bilirubina nakon sedam dana te vrijednosti kreatinina i protrombinskoga vremena.
Prognoza. Iako je alkoholni steatohepatitis potencijalno reverzibilno stanje, ono je praćeno znatno lošijim kliničkim ishodima, za razliku od alkoholne masne promjene jetre, te ukupna smrtnost kod ovih bolesnika u prvih šest mjeseci iznosi i do 40 %. Što su veći Maddreyjev i Lilleov skor, to je prognoza lošija.
ALKOHOLNA CIROZA I FIBROZA JETRE
Definicija i patogeneza. Alkoholna fibroza jetre predstavlja međustadij između alkoholnoga steatohepatitisa i ciroze jetre koju karakterizira fibrozno cijeljenje i akumulacija vezivnoga tkiva u području hepatocelularne nekroze, dok se s progresijom bolesti fibroza difuzno širi i prožima ostatak jetrenoga parenhima formiranjem regeneratornih čvorića što predstavlja cirozu jetre, ireverzibilni stadij alkoholne bolesti jetre. Početne lezije hepatocita jetra uspijeva sanirati zahvaljujući svojoj regeneratornoj sposobnosti, no u slučajevima produljenoga djelovanja nokse (u ovom slučaju alkohola) dolazi do insuficijencije regeneratorne sposobnosti te nastala hepatocelularna oštećenja bivaju zamijenjena vezivnim tkivom. U tom procesu glavnu ulogu imaju stelatne (Itove) stanice, specifične mezenhimalne stanice koje se u normalnim okolnostima nalaze u Disseovim prostorima u neaktivnom obliku. Aktivacijom se Itove stanice diferenciraju u miofibroblaste koji imaju sposobnost stvaranja vezivnoga tkiva koje najprije nadomješta oštećene hepatocite, no u stanju pojačane stimulacije može doći do prekomjerne produkcije veziva koje prožima normalni jetreni parenhim. Aktivaciju Itovih stanica u alkoholnoj bolesti jetre mogu uzrokovati različiti čimbenici kao što su stanični debris i molekula DNA oslobođena iz oštećenih hepatocita, slobodni kisikovi radikali koji nastaju u oštećenim hepatocitima, upalnim ili Kupfferovim stanicama te endotoksini iz portalne cirkulacije. U procesu fibroze stvaraju se različiti fibrogeni medijatori koji koordiniraju cijelim procesom, a najznačajniji su TGF-β, PDGF i angiotenzin II. Osim iz Itovih stanica, miofibroblasti mogu nastati i iz drugih stanica, kao što su portalni fibroblasti, fibrociti i mezenhimalne stanice porijeklom iz koštane srži. Konačni je ishod navedenih procesa stvaranje veziva koje najprije ispunjava hepatocelularna oštećenja (fibroza jetre), a kasnije prožima i ostatak jetrenoga parenhima narušavajući normalnu strukturu i funkciju jetre (ciroza). Fibroza se smatra još potencijalno reverzibilnim stadijem, dok je ciroza apsolutno ireverzibilna promjena.
Patologija. Makroskopski je jetra obično normalne veličine ili je smanjena s karakterističnom grubo-zrnatom površinom, tamnosmeđe boje. Mikroskopski, promjene najprije započinju odlaganjem kolagena oko središnjih vena, sinusoida te pojedinih stanica (perivenularna, perisinusoidna i pericelularna fibroza) s dominacijom promjena u području hepatocelularnoga oštećenja. Kako postupno napreduje, fibroza se širi i u ostali jetreni parenhim stvarajući vezivne tračke koji dovode do potpune pregradnje jetrenoga parenhima, pri čemu vezivne pregrade okružuju preostale hepatocite. Navedene nakupine hepatocita između vezivnih pregrada nazivamo regeneratornim čvorićima, a u alkoholnoj cirozi jetre ti su čvorići obično promjera do 1 cm, zbog čega govorimo o tzv. mikronodularnoj cirozi. Hepatociti unutar čvorića često pokazuju različiti stupanj polimorfije uz pojavu hiperkromazije jezgara i displazije, što sve može dovoditi do razvoja hepatocelularnoga karcinoma. Unutar vezivnih tračaka nalazimo novonastale krvne žile, umnožene žučne kanale te izraženu upalnu infiltraciju.
Klinička slika alkoholne ciroze jetre ne razlikuje se od kliničke slike ciroze jetre druge etiologije te je ona zajedno s komplikacijama detaljno opisana u poglavlju o fibrozi i cirozi jetre.
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza, slikovnih metoda, biopsije jetre te sigurnih anamnestičkih podataka o uživanju alkohola (duljina alkoholičarskoga staža, način pijenja, vrsta alkohola i sl.). Laboratorijski nalazi bolesnika s alkoholnom cirozom jetre obično uključuju disproporcionalno povećane vrijednosti AST-a u odnosu na ALT, hipoalbuminemiju, hiperbilirubinemiju, anemiju (obično makrocitnu), leukopeniju, trombocitopeniju, produljeno protrombinsko vrijeme (ili povišen INR) te povišene vrijednosti amonijaka. Ultrazvuk jetre kod bolesnika s fibrozom jetre pokazuje lagano uvećanu jetru, grubu i inhomogenu hiperehogenu strukturu s distalnom atenuacijom ultrazvučnoga vala i otežanim prikazom krvnih žila. Kod bolesnika s razvijenom cirozom ultrazvučno se mogu dokazati pseudolobulizacija (regeneratorni čvorići), grub i naglašeno inhomogeni jetreni parenhim ("kao od moljca izjeden"), a mogu se naći i indirektni znaci, kao što je dilatirana i vijugava portalna vena, ascites te splenomegalija. Osim ultrazvuka, slične nalaze daju i kompjuterizirana tomografija i magnetna rezonanca abdomena s posebnim osvrtom na jetru. U kliničkoj praksi primjenjuje se ultrazvučna elastografija (FibroScan, ARFI) kojom se može detektirati i kvantificirati jetrena fibroza i ciroza. Biopsija jetre uglavnom je indicirana kod bolesnika s nejasnom dijagnozom jetrene lezije, kao i za procjenu težine same bolesti. Ovisno o kliničkom stanju bolesnika i potencijalnom riziku od krvarenja, biopsija se može izvesti perkutanim ili transjugularnim putem. Sam dijagnostički postupak kod bolesnika s cirozom jetre opisan je u poglavlju o fibrozi i cirozi jetre.
Liječenje se sastoji od stroge apstinencije od alkohola te od drugih specifičnih mjera liječenja ciroze jetre što je opisano u poglavlju o fibrozi i cirozi jetre. Konačno liječenje bolesnika s alkoholnom cirozom jetre podrazumijeva transplantaciju jetre. Osnovni preduvjet za izvođenje transplantacije jetre tim bolesnicima je apstinencija od alkohola u minimalnom trajanju od šest mjeseci prije postupka. Ova skupina bolesnika ima značajno viši rizik od razvoja malignih oboljenja (osobito gornjega dijela probavnoga i dišnog sustava) te kardiovaskularnih bolesti, zbog čega ih se mora temeljito pregledati u pretransplantacijskoj obradi.
Prognoza. Ako se radi o disciplinarnim bolesnicima koji se pridržavaju apsolutne apstinencije od uživanja alkohola, petogodišnje preživljenje bolesnika s dijagnosticiranom alkoholnom cirozom jetre doseže i 90 %, no s nastavkom uživanja alkohola ono pada na 50 do 60 %. Ako se bolest dijagnosticira u fazi razvijene bolesti (žutica, ascites, hematemeza), petogodišnje preživljenje pada ispod 30 %, a većina smrtnih ishoda dogodi se unutar prve godine. Ako se bolesnicima transplantira jetra, ukupna se prognoza poboljšava te je, kada se bolesnici pridržavaju apstinencije, recidiv bolesti izuzetno rijedak.
Akutni virusni hepatitis naziv je za akutnu upalu jetre koja može biti uzrokovana raznim virusima među kojima su najznačajniji virus hepatitisa A (HAV), virus hepatitisa B (HBV), virus hepatitisa C (HCV), virus hepatitisa D (HDV) te virus hepatitisa E (HEV). Osim tih klasičnih hepatotropnih virusa, akutni virusni hepatitis mogu uzrokovati i drugi virusi kao što su citomegalovirus (CMV), Epstein-Barrov virus (EBV) te herpes simpleks virus (HSV). Akutni virusni hepatitis može završiti potpunom rezolucijom ili može progredirati u kroničnu formu. Učestalost akutnih virusnih hepatitisa danas je u značajnom padu diljem svijeta, a osobito u razvijenim zemljama, što se može pripisati boljim mjerama prevencije i učinkovitosti cjepiva za određene viruse.
Akutni virusni hepatitis karakteriziran je upalnim procesom kojega obilježava nekroza hepatocita, što je posljedica inkorporacije genetskoga materijala virusa u hepatocite te posljedične ekspresije virusnih antigena na površini hepatocita koje imunološki sustav prepoznaje kao strane te otpočinje imunološku reakciju s ciljem njihova uništenja i eliminacije. Ključnu ulogu u tim reakcijama imaju citotoksični T-limfociti, ali određenu ulogu imaju i proupalni citokini, prirodne stanice ubojice (NK-stanice) te stanična citotoksičnost posredovana protutijelima. Kod nekih se bolesnika ovom reakcijom uništavaju zaražene stanice čime se postiže potpuna rezolucija bolesti, dok kod drugih to ne uspijeva i dolazi do razvoja kronične infekcije.
U klasičnoj kliničkoj slici razlikujemo nekoliko faza bolesti: asimptomatska faza inkunbacije, preikterična faza bolesti u kojoj dominiraju nespecifični simptomi i znakovi bolesti te ikterična faza ili faza razvijene bolesti na koju se nadovezuje ili faza oporavka ili prijelaz u kronični oblik bolesti. Razvijenost kliničke slike i izraženost pojedinih simptoma i znakova značajno variraju te najvećim dijelom ovise o vrsti virusa, ali i o samom domaćinu. U najtežim oblicima razvija se slika akutnoga jetrenog zatajenja (fulminantni hepatitis) koje zahtijeva brz odgovor i liječenje, u pravilu transplantaciju jetre.
Dijagnoza se u pravilu postavlja na osnovi kliničke slike, laboratorijskih nalaza te seroloških i/ili molekularnih biljega akutne virusne infekcije. Slikovne metode (ultrazvuk) i biopsija jetre nemaju veći dijagnostički značaj kod ovih bolesnika. Opća načela liječenja akutnih virusnih hepatitisa uključuju konzervativne mjere (mirovanje, dijeta, izbjegavanje unosa alkohola, lijekova i toksina) uz specifične mjere koje ovise o vrsti virusa koji je uzrokovao bolest, a danas u prvi plan dolaze mjere prevencije, kao što je cijepljenje.
U daljnjemu će tekstu biti prikazani najznačajniji akutni virusni hepatitisi: akutni hepatitis A, akutni hepatitis B, akutni hepatitis C, akutni hepatitis D te akutni hepatitis E.
AKUTNI VIRUSNI HEPATITIS A
Etiologija. Akutni virusni hepatitis A uzrokuje virus hepatitisa A (HAV), RNA virus iz skupine Picornaviridae. Radi se o maloj čestici veličine 27 nm građenoj od kapside koja sadrži specifičan antigen (antigen virusa hepatitisa A) te nukleinsku kiselinu (RNA). Do sada su opisana četiri različita genotipa virusa hepatitisa A (genotip I, II, III i VII), a u cijelome svijetu prevladava genotip I.
Epidemiologija. Izvor zaraze je bolesnik ili kliconoša u čijoj se jetri vrši replikacija virusa, koji se potom putem žuči i fecesa izlučuje u okolinu te se dalje prenosi fekalno-oralnim putem (izravni kontakt, kontaminirana hrana ili voda). Zbog toga se akutni hepatitis A svrstava u tzv. bolesti prljavih ruku te je njegova pojavnost povezana s lošijim higijenskim i socioekonomskim prilikama. Virus se u najvećoj mjeri luči putem stolice tjedan do dva prije nastupa kliničkih simptoma i vrlo se brzo nakon razvoja ikterusa gubi iz nje, tako da osobe prestaju biti zarazne tjedan dana nakon javljanja ikterusa. Kronično kliconoštvo se ne javlja. Prijavljeni su i slučajevi prijenosa virusa hepatitisa A putem krvi te vertikalni prijenos s majke na dijete, iako oni nisu uobičajeni za ovaj virus. Hepatitis A javlja se širom svijeta, a visokoendemska područja su zemlje jugoistočne Azije u kojima i do 90 % odrasle populacije ima serološki biljeg infekcije ovim virusom. U tim se područjima osobe inficiraju uglavnom u djetinjstvu kada bolest ima asimptomatski tijek tako da serološki biljezi ostaju jedini dokaz preboljene infekcije. Za razliku od ovih zemalja, u razvijenim zemljama (niskoendemska područja) serološke biljege preboljene infekcije ima 20 do 30 % odrasloga stanovništva, a bolest se uglavnom javlja sporadično ili u manjim epidemijama (obiteljske epidemije).
Patogeneza. Nakon ingestije hepatitis A virus prolazi kroz želudac (acidorezistentan je), dolazi do crijeva te ulazi u krv pri čemu nastaje viremija. Krvlju virus dolazi do jetre gdje se veže na specifične receptore na površini hepatocita te tako prodire u njihovu citoplazmu gdje se dalje razmnožava i u najvećoj mjeri luči u žuč, a u manjoj mjeri natrag u krv. Hepatitis A ima minimalan ili nikakav direktan citotoksičan učinak na hepatocite tako da je nastalo oštećenje hepatocita posljedica aktiviranoga imunološkog odgovora domaćina koji prepoznaje inficirane hepatocite te ih nastoji uništiti.
Patologija. Osnovni patološki supstrat je difuzna upala jetre. Histološki, nalazimo tipične znakove akutnoga hepatitisa koje uključuju baloniranje i degeneraciju hepatocita, pojavu acidofilnih tjelešaca te u konačnici nekrozu, a promjene su najizraženije u portalnim i periportalnim prostorima. Kolestaza je u ovoga virusnog hepatitisa naglašenija nego u drugim tipovima. Regeneratorna aktivnost hepatocita može se vidjeti već 48 sati od oštećenja i ona kroz neko vrijeme dovodi do potpune rezolucije bolesti, bez trajnih posljedica.
Klinička slika. Vrijeme inkubacije bolesti iznosi od 15 do 50 dana, najčešće oko 25 dana. Iako se hepatitis A može očitovati kao asimptomatskoga pa sve do fulminantnoga oblika, najčešće prolazi uz blažu kliničku sliku. Klinička slika ponajprije ovisi o dobi tako da je u djece bolest najčešće asimptomatska ili je tek blago izražena, dok starije osobe imaju teže kliničke oblike. Tipičan klinički tijek bolesti ima dva razdoblja: prodromalnu i ikteričnu fazu, ali se može očitovati i atipičnim oblicima, ekstrahepatičkim manifestacijama ili, rijetko, u obliku fulminantnoga hepatitisa.
Prodromalna faza je karakterizirana općim (sistemskim) simptomima kao što su umor, slabost i malaksalost, gubitak apetita, mučnina i povraćanje. Rjeđe se javljaju bolovi u trbuhu, vrućica, glavobolja, bolovi u mišićima i zglobovima te proljev. Ti simptomi nestaju pojavom žutice.
Ikterična faza ili faza žutice javlja se uglavnom u odraslih, najčešće tjedan do dva od početka prodromalne faze. Praćena je pojavom tamne mokraće, svijetle stolice te pruritusom. Traje do dva tjedna. Pregledom se otkriva bolna i blago povećana jetra te ponekad povećana slezena i vratni limfni čvorovi.
Atipični oblici javljaju se u obliku kolestatskoga i relapsirajućega hepatitisa. Kolestatski hepatitis obilježava ikterična faza koja traje duže od tri mjeseca, a praćena je pruritusom, umorom, proljevima i gubitkom težine, dok relapsirajući oblik bolesti karakterizira prvi relaps nakon četiri do petnaest tjedana trajanja remisije, dok se daljnji relapsi mogu javiti do godinu dana od početka remisije.
Ekstrahepatične manifestacije hepatitisa A imunološki su posredovane, a najčešće se manifestiraju kao kratkotrajni kožni osipi i artralgije, dok se rjeđe vidi leukocitoklastični vaskulitis, glomerulonefritis ili artritis donjih udova.
Fulminantni hepatitis kao posljedica infekcije hepatitis A virusom rijetko se susreće (1:1000 ikteričnih bolesnika), praćen je razvojem akutnoga zatajenja jetre s višeorganskim zatajenjem, a i visokom stopom smrtnosti, u pravilu zahtijeva hitnu transplantaciju.
Dijagnoza se postavlja na osnovi kliničke slike, epidemioloških podataka, laboratorijskih nalaza te serološke i molekularne dijagnostike. Ultrazvuk jetre nema veći dijagnostički značaj, kao ni biopsija jetre.
Laboratorijska dijagnostika. U krvnoj slici nalazimo normalne vrijednosti leukocita ili leukopeniju uz relativnu limfocitozu. Prvi znaci oštećenja jetre su nagao i izražen porast jetrenih transaminaza (AST, ALT), nakon čega slijedi i porast pokazatelja kolestaze (alkalna fostaza, bilirubin) čije se vrijednosti normaliziraju nakon pada vrijednosti transaminaza. Produljeno protrombinsko vrijeme prisutno je samo pri teškim oblicima bolesti.
Serološka i molekularna dijagnostika predstavljaju zlatni standard u dijagnostici i potvrdi hepatitisa A. U serumu se određuju specifična IgM i IgG protutijela na hepatitis A virus (IgM-antiHAV, IgG-antiHAV), dok se molekularnim metodama (PCR) iz stolice, rjeđe i iz krvi, određuje prisutnost RNA hepatitis A virusa (RNA-HAV). IgM-antiHAV detektira se u serumu već u prvom tjednu bolesti, a ostaje povišen kroz tri do šest mjeseci i predstavlja najosjetljiviji biljeg u dijagnostici akutnoga virusnog hepatitisa A. IgG-antiHAV može se detektirati krajem prvoga mjeseca bolesti i ostaje povišen godinama, pa i do kraja života, te ostaje kao biljeg preboljene infekcije. RNA-HAV se može detektirati tri do deset dana prije početka bolesti i jedan do dva tjedna nakon nje (ikterična faza) te predstavlja najraniji biljeg infekcije hepatitisom A, iako se rjeđe koristi u svakodnevnoj praksi (kada se postavi klinička sumnja na hepatitis A, IgM-antiHAV antitijela već su prisutna u serumu i dovoljna su za postavljanje dijagnoze).
Diferencijalna dijagnoza je široka i uključuje razne bolesti i stanja: drugi virusni hepatitisi (osobito hepatitis B i C), infektivna mononukleoza, citomegalovirusna infekcija, ishemijski i toksični hepatitis, leptospiroza, Q-groznica, autoimuni hepatitis i sl.
Liječenje. Hepatitis A je u većini slučajeva samoograničavajuća bolest i nema specifičnoga liječenja. Bolesnicima se savjetuje mirovanje, hepatoprotektivna ishrana uz izbjegavanje unosa alkohola, lijekova i toksina. U težim slučajevima bolesnike treba hospitalizirati i simptomatski liječiti (hidracija, antiemetici, antihistaminici i sl.). Kortikosteroidi nemaju učinka u liječenju ove bolesti, čak niti kod fulminantnih oblika. Fulminantni hepatitis A liječi se hitnom transplantacijom jetre u slučaju zatajivanja drugih terapijskih metoda.
Praćenje pacijenta. U tijeku bolesti prate se rezultati standardnih pretraga jetrenih bolesti, a najtočnije se stanje očitava iz nalaza transaminaza i bilirubina. Padanje njihovih vrijednosti znači i kliničko poboljšanje, a njihov porast pogoršanje ili recidiv bolesti. Pojava IgG anti-HAV-a i pad titra IgM anti-HAV-a dobri su pokazatelji izlječenja.
Prevencija se sastoji od općih mjera (poboljšanje higijenskih navika, pranje ruku, pravilno zbrinjavanje fekalija, osiguranje kvalitete vode i sl.) te primjene cjepiva ili gotovoga imunoglobulina. Cjepljenje se provodi kod zdrave djece i odraslih u dobi između jedne i četrdeset godina, dok se gotovi imunoglobulini daju bolesnim osobama te djeci mlađoj od jedne godine i odraslim osobama starijim od četrdeset godina. Ta se kemoprofilaksa preporuča svim osobama koje žive ili putuju u visokoendemske krajeve ili pripadaju rizičnim skupinama (npr. kronična bolest jetre) te postekspozicijski (osobe koje su u užem kontaktu s oboljelom osobom).
Prognoza. U pravilu je akutni hepatitis A bolest s povoljnom prognozom koju prati potpuna rezolucija kroz tri do četiri tjedna. Kod manjega broja bolesnika produljeno je vrijeme prisutnosti povišenih vrijednosti jetrenih transaminaza (djeca, imunokompromitirane osobe) ili razvoj fulminantnoga hepatitisa (< 0,1 %). Stopa smrtnosti od akutnoga hepatitisa A u odrasloj populaciji iznosi 1,8 %.
AKUTNI VIRUSNI HEPATITIS B
Etiologija. Akutni virusni hepatitis B uzrokovan je virusom hepatitisa B, DNA virusom iz skupine Hepadnaviridae. Radi se virusu sferična oblika, veličine 42 nm, građenome od nukleokapsidne jezgrice koja sadržava djelomično dvostruku molekulu DNA zajedno s enzimom DNA-polimerazom te lipopolisaharidnu ovojnicu koja okružuje jezgricu. Cijela virusna čestica naziva se Daneova čestica prema istraživaču koji ju je prvi opisao. HBV virus sadržava i tri značajna antigena, dva smještena u jezgri (HBcAg i HBeAg) i jedan smješten na površini (HBsAg). Do sada je poznato osam različitih genotipova HBV-a (A-H), a oni pokazuju jasnu povezanost s pojavnosti unutar određenih zemljopisnih područja, a također pokazuju i različit odgovor na liječenje interferonom.
Epidemiologija. Smatra se da je diljem svijeta više od dvije milijarde ljudi imalo kontakt s HBV-om, a od toga više od 350 milijuna ima kroničnu infekciju. Akutnu infekciju karakterizira umnažanje virusa unutar hepatocita te njegovo lučenje u krv, pri čemu nastaje značajna viremija te se virus u znatnim količinama može naći u krvi, spermi, vaginalnome sekretu, slini, fecesu, urinu, majčinom mlijeku te suzama. Sukladno tome, najčešći putevi prijenosa su spolni kontakt (nezaštićeni odnos sa zaraženom osobom) i parenteralni put prijenosa (transfuzijsko liječenje, korištenje zajedničkih intravenskih kanila i igala, tetoviranje), a mogući je i vertikalni put prijenosa sa zaražene majke na dijete te, daleko rjeđe, neparenteralnim putem uslijed uskih kućnih kontakata. Zemljopisna područja s najvećom prevalencijom hepatitisa B su nerazvijene zemlje Azije, Afrike i južne Amerike, dok se razvijene zemlje zapadne Europe, sjeverne Amerike, Kanade i Australije smatraju područjima s niskom prevalencijom hepatitisa B. Rizične skupine za obolijevanje od hepatitisa B čine osobe koje su u uskom kontaktu s osobom oboljelom od hepatitisa B, promiskuitetne homoseksualne i heteroseksualne osobe, intravenski ovisnici, zdravstveni radnici (kontakt s oboljelim osobama), osobe koje su primale transfuzijske pripravke prije uvođenja obveznoga testiranja na HBV, osobe na hemodijalizi i dr. Kod oko 30 % oboljelih osoba nije moguće utvrditi i ustanoviti način zaraze.
Patogeneza. Infekcija započinje ulaskom virusa u krv i nastankom viremije. Pomoću specifičnih receptora na površini hepatocita (engl. natrium taurocholate co-transporting polypeptide, NTCP) virus ulazi u same hepatocite gdje dolazi do otapanja njegove kapsule te sadržaj virusne jezgre biva unesen u jezgru hepatocita gdje formira tzv. kovalentno zbijenu prstenastu DNA (cccDNA, engl. covalently closed circle DNA) koja omogućava daljnju replikaciju virusa s obzirom na to da služi kao predložak po kojemu nastaju molekule RNA. One se u endoplazmatskoj mrežici prevode u specifične virusne proteine koji služe za nastanak novoga virusa ili se eksprimiraju na površini inficiranoga hepatocita. Samo oštećenje jetre nije posljedica izravnoga citopatogenog učinka virusa, nego je posljedica imunološkoga odgovora domaćina. Pri tome najveću ulogu imaju citotoksični T-limfociti (CD8+) koji napadaju i uništavaju antigenski izmijenjene hepatocite (one koji virusne antigene sadržavaju u unutrašnjosti ili ih eksprimiraju na svojoj površini), a ulogu imaju i specifična protutijela koja mogu obložiti inficirane hepatocite i dovesti do njihove lize (protutijelima posredovana stanična citotoksičnost). Ekstrahepatalne manifestacije koje se mogu javiti tijekom infekcije HBV-om, kao što su poliartritis, vaskulitis ili glomerulonefritis, nastaju kao posljedica odlaganja imunokompleksa u kojima se nalaze virusni antigeni i na njih usmjerena specifična protutijela.
Patologija. Patohistološki nalaz kod akutnoga hepatitisa B uključuje pojavu brojnih fokalnih nekroza hepatocita praćenih upalnom infiltracijom koju u najvećem postotku čine mononukleari, a mogu se naći i reverzibilno promijenjeni hepatociti velikoga i svijetlog izgleda (hidropska degeneracija). Osim toga, prisutna je i reaktivna hiperplazija Kupfferovih stanica. U najtežim se oblicima mogu naći piecemeal i premošćujuće nekroze koje kod fulminantnoga hepatitisa mogu dominirati stvarajući sliku submasivne ili masivne nekroze jetre.
Klinička slika. Inkubacija hepatitisa B može biti različito duga, od šest tjedana do šest mjeseci, ali u prosjeku iznosi dvanaest do četrnaest tjedana. Sama klinička slika akutnoga hepatitisa B može biti varijabilna, od asimptomatske infekcije do slike fulminantnoga hepatitisa i akutnoga jetrenog zatajenja uz česte ekstrahepatalne manifestacije. Kronični oblik bolesti razvija se kod 5 do 10 % oboljelih osoba (zasebno opisano).
Asimptomatska infekcija javlja se kod oko 50 % oboljelih osoba. Može proći potpuno nezapaženo ili uz blage simptome nalik gripi kojima bolesnici ne pridaju značajniju pažnju. Asimptomatske infekcije češće se javljaju u djece i mlađih odraslih osoba.
Klasični tijek bolesti. Kod većine je bolesnika tijek bolesti obilježen prodromalnim stadijem i stadijem razvijene bolesti, a cijeli klinički tijek traje do nekoliko tjedana. Početak bolesti obično je postupan i njime dominiraju opći infektivni simptomi (vrućica, slabost i malaksalost, algični sindromi). Na prodromalni stadij nadovezuje se stadij razvijene bolesti kojim dominira bol pod desnim rebrenim lukom, mučnina i povraćanje te različiti stupanj žutice (žuto obojenje kože i sluznice, svijetla stolica, tamni urin). Pri fizikalnome pregledu može se otkriti umjerena hepatomegalija, a rjeđe može se otkriti i splenomegalija i cervikalna limfadenopatija. Simptomi obično traju do dva tjedna, iako kod manjega broja bolesnika (5 do 10 %) mogu trajati i duže (i do dvanaest tjedana).
Fulminantni hepatitis nastaje kod manje od 1 % oboljelih, a manifestira se teškim, akutnim jetrenim zatajenjem pri kojemu gotovo polovina bolesnika umre unutar deset dana od nastupa simptoma. Fulminantni hepatitis karakterizira visoka temperatura, izraženi ikterus, ascites, poremećaj stanja svijesti koji progredira sve do kome, hemoragijska dijateza te razvoj hepatorenalnoga i hepatopulmonalnog sindroma.
Ekstrahepatalne manifestacije mogu se javiti u bilo kojem dijelu infekcije. Najčešće se javljaju nespecifični poliartritis koji obično zahvaća male zglobove te osip koji može nalikovati urtikarijskom ili se može manifestirati makulopapuloznim promjenama. Ostale manifestacije uključuju vaskulitis, glomerulonefritis i sl.
Dijagnoza se u prvome redu postavlja na temelju kliničke slike, epidemioloških podataka, laboratorijskih nalaza te seroloških markera i molekularnih tehnika, a slikovne metode (ultrazvuk) i biopsija jetre koriste se kao dopunske metode.
Laboratorijski nalazi. Kao i kod drugih oblika akutnih virusnih hepatitisa, povišene vrijednosti jetrenih transaminaza (ALT > AST) ukazuju na hepatocelularno oštećenje i nekrozu hepatocita kao osnovne značajke bolesti. Vrijednosti jetrenih transaminaza više su nego kod akutnoga hepatitsa A, ali su zato markeri kolestaze (ALP, GGT) manje izraženi. Vrijednosti protrombinskoga vremena (PV, INR) i ukupnoga bilirubina dobri su pokazatelji težine bolesti.
Serološka dijagnostika čini osnovu dijagnoze akutnoga hepatitisa B. Serološka dijagnostika čini osnovu dijagnoze akutnoga hepatitisa B. U tu se svrhu određuje nekoliko specifičnih antigena (HBsAg, HBeAg) i njihovih specifičnih protutijela (Anti-HBs, Anti-HBe, Anti-HBc) – Tablica 4.26.
|
Tablica 4.26. Interpretacija seroloških markera kod infekcije virusom hepatitisa B
|
|
Interpretacija nalaza
|
Serološki markeri
|
|
HBsAg
|
Anti-HBs
|
IgM Anti-HBc
|
IgG Anti-HBc
|
HBeAg
|
Anti-HBe
|
|
Akutna infekcija
|
+
|
-
|
+
|
-/+
|
-/+
|
-/+
|
|
Kronična infekcija
|
+
|
-
|
-
|
+
|
-/+
|
-/+
|
|
Prošla infekcija
|
-
|
+
|
-
|
+
|
-
|
-/+
|
|
Cijepljenje
|
-
|
+
|
-
|
-
|
-
|
-
|
Pojava HBsAg antigena prvi je znak infekcije virusom hepatitisa B. On se pojavljuje kasno u inkubacijskoj fazi, ali prije pojave kliničko-laboratorijskih znakova bolesti. Ostaje povišen tijekom akutne faze bolesti, najčešće kroz tri do četiri tjedna, a vrlo rijetko ostaje pozitivan i do pet mjeseci. Ako je HBsAg pozitivan dulje od šest mjeseci, ukazuje na razvoj kronične infekcije.
Anti-HBs predstavljaju specifična protutijela na HBsAg i pojavljuju se nakon negativizacije HBsAg (obično tri do šest mjeseci od početka bolesti) i ostaju pozitivna kroz veći broj godina, kod većine ljudi i doživotno. Prema tome, pozitivan Anti-HBs označava stigmu preboljene akutne infekcije virusom hepatitisa B (tada je pozitivan i Anti-HBc) ili označava stigmu procjepljivanja protiv ovoga virusa (tada je Anti-HBc negativan).
HBeAg pojavljuje se tijekom perioda inkubacije i to kratko nakon pojave HBsAg-a. HBeAg je pokazatelj replikacije virusa i nestaje relativno brzo (unutar tri mjeseca), a tada se pojavljuje njegovo specifično protutijelo Anti-HBe. Perzistiranje HBeAg-a dulje od tri mjeseca ukazuje na povećanu vjerojatnost od razvoja kronične infekcije.
Anti-HBe predstavlja specifično protutijelo na HBeAg i pojavljuje se s nestankom HBeAg-a, što se obično dogodi unutar tri mjeseca i ostaje, slično kao i Anti-HBs, stigma preboljene akutne infekcije hepatitis B virusom (uz pozitivan nalaz Anti-HBs-a i Anti-HBc-a).
HBcAg antigen ne detektira se u krvi nego se određuju njegova specifična IgM i IgG protutijela (Anti-HBc). IgM anti-HBc javlja se kratko nakon pojave HBsAg-a te ukazuje na akutnu infekciju hepatitis B virusom. Obično perzistira kroz tri do šest mjeseci, a potom nestaje. IgG Anti-HBc također se pojavljuje tijekom akutne faze hepatitis B infekcije, ali ostaje trajno pozitivan i ne iščezava.
Molekularna dijagnostika. PCR metoda omogućava određivanje i praćenje replikacije DNA virusa (HBV-DNA), kao i određivanje specifičnoga genotipa hepatitis B virusa (genotip A-H). HBV-DNA ukazuje na aktivnu replikaciju virusa i aktivnu fazu bolesti (kao i HBeAg), a signifikantan broj kopija je veći od 105/mL seruma. Kod jednoga dijela bolesnika HBV-DNA može biti prisutna u serumu bez pozitivnoga HBeAg što se događa uslijed razvoja mutacija koje onemogućavaju sintezu HBeAg-a u inficiranim hepatocitima (zbog toga je praćenje HBV-DNA puno osjetljivije od određivanje HBeAg-a u pogledu procjene replikacije virusa i aktivnosti bolesti).
Ultrazvuk jetre kod bolesnika s akutnim hepatitisom pokazuje difuzan, homogen, hipoehogen jetreni parenhim („tamna jetra“) uz prisutan znak perivaskularnih manžeta (prosijavanje hiperehogenih stijenki krvnih žila). Cijela jetra blago je uvećana.
Biopsija jetre i patohistološka analiza kod akutnoga B hepatitisa nema veći značaj, s obzirom na pouzdanost seroloških pokazatelja te se izvodi samo u atipičnim situacijama u diferencijalno-dijagnostičke svrhe.
Diferencijalna dijagnoza slična je kao i kod akutnoga virusnog hepatitisa A: drugi virusni hepatitisi, infektivna mononukleoza, citomegalovirusna infekcija, ishemijski i toksični hepatitis, leptospiroza, Q-groznica, autoimuni hepatitis i sl.
Liječenje akutnoga B hepatitisa uglavnom je simptomatsko i kod većine bolesnika dolazi do spontane eradikacije virusa. Preporuke o primjeni antivirusne terapije kod ovih bolesnika nisu jednoznačne, osobito kod bolesnika s nefulminantnim oblikom hepatitisa. Kod tih bolesnika primjena antivirotika dovodi do značajnoga pada vrijednosti HBV-DNA kopija (što upućuje na smanjenje aktivnosti bolesti i replikacije virusa), ali nisu dokazani bolji klinički ishodi u odnosu na bolesnike koji nisu dobivali antivirusnu terapiju. Antivirusna terapija apsolutno je indicirana kod bolesnika kod kojih se razvije fulminantni oblik akutnoga hepatitisa, s obzirom na to da značajno smanjuje potrebu za transplantacijom jetre. U tu se svrhu od antivirotika primjenjuju lamivudin (100 mg/dan), tenofovir (300 mg/dan) ili entekavir (0,5 mg/dan). Antivirusna terapija indicirana je i kod HBV inficiranih majki tijekom trudnoće, koje imaju broj kopija HBV-DNA iznad 5 x 107 IU/mL, a najčešće se primjenjuje tenofovir s obzirom na najmanji teratogeni rizik.
Prognoza. Do potpunoga oporavka dolazi kod 90 do 95 % bolesnika s akutnim hepatitisom A i to u vremenskome periodu od šest mjeseci, a u svega 5 do 10 % slučajeva progredira u kroničnu infekciju. Kod manje od 1 % bolesnika s akutnim hepatitisom razvit će se fulminantni oblik koji će zahtijevati transplantaciju jetre.
Prevencija infekcije virusom hepatitisa B temelji se na općim mjerama, aktivnoj (cijepljenje) te pasivnoj imunoprofilaksi (primjena imunoglobulina).
Opće mjere uključuju nošenje rukavica, maski i naočala kod zdravstvenih radnika, testiranje trudnica na HBV, testiranje krvi i krvnih pripravaka na HBV, promjene ponašanja u seksualnom životu te opskrba narkomana čistim iglama.
Aktivna imunoprofilaksa podrazumijeva cijepljenje koje je danas u većini zemalja uvedeno u kalendar cijepljenja djece, a svakako je indicirano i kod odraslih neprocijepljenih osoba koje se ubrajaju u neku od rizičnih skupina (zdravstveni radnici, bolesnici na hemodijalizi, članovi obitelji i spolni partneri oboljelih osoba ili vironoša, homoseksualne osobe i sl.). Navedenu rizičnu populaciju potrebno je testirati na HBV infekciju (HBsAg i anti-HBs) te provesti cijepljenje ako su osobe seronegativne. Cijepljenje se sastoji od primjene rekombinantnoga HBsAg-a u tri doze (0., 1. i 6. mjesec), a kod bolesnika koji su na hemodijalizi u četiri doze (0., 1., 2. i 6. mjesec). Primjena cjepiva dovest će do imunološkoga odgovora u obliku stvaranja Anti-HBs antitijela, a titar veći od 10 U/L smatra se protektivnim i dostatnim. Cjepivo se načelno dobro podnosi, a mogu se registrirati lokalne reakcije na mjestu uboda koje nestaju kroz nekoliko dana. Standardna procjena serokonverzije (određivanje titra Anti-HBs) ne preporuča se rutinski, osim kod osoba s povećanim rizikom kako bi se utvrdio odgovor na cijepljenje. Izostanak serokonverzije bilježi se kod 3 do 10 % cijepljenih osoba, a obično se radi o pušačima, pretilim osobama i osobama starije životne dobi. Kod njih se primjenjuje ponovno cijepljenje po istome principu uz veću dozu cjepiva. Kod jedne trećine osoba zaštitna Anti-HBs antitijela gube se nakon deset do petnaest godina, a još se ne zna jesu li te osobe i dalje zaštićene te se stoga preporuča u rizičnoj populaciji provjeravati titar Anti-HBs antitijela svakih deset do petnaest godina te prema potrebi provesti ponovno cijepljenje.
Pasivna imunoprofilaksa podrazumijeva primjenu gotovih specifičnih imunoglobulina (antihepatitis B imunoglobulin), a preporuča se kod svih osoba koje su neprocijepljene ili imaju titar Anti-HBs antitijela manji od 10 U/L, a imale su rizični kontakt s HBV inficiranim osobama (npr. nezaštićeni spolni odnos) ili HBV-kontaminiranim materijalima (npr. ubod na iglu). Ova vrsta profilakse preporuča se unutar 48 sati od rizičnoga događaja, a kombinira se s klasičnim cijepljenjem. Također, sva novorođenčad HBsAg pozitivnih majki mora primiti imunoglobulin te se mora cijepiti unutar dvanaest sati od rođenja.
AKUTNI VIRUSNI HEPATITIS C
Etiologija. Akutni virusni hepatitis C uzrokovan je virusom hepatitisa C, RNA virusom iz skupine Flaviviridae. Radi se o virusu čiji genom čini jednolančana molekula RNA koja kodira poliproteinski produkt sastavljen od različitih strukturnih i funkcionalnih virusnih proteina, što je prikazano na Slici 4.8. Ovisno o razlikama u pojedinim regijama genoma (E1, NS4, NS5), razlikuje se sedam glavnih genotipa hepatitis C virusa (1 - 7) koji se dodatno dijele u podtipove, tako da se razlikuje više od pedeset podtipova virusa. Genotipovi 1a i 1b odgovorni su za više od 70 % hepatitis C infekcija u Europi. Kliničke manifestacije, progresija i težina same bolesti jednaki su bez obzira na genotip virusa, ali njegovo točno poznavanje ima ulogu u predviđanju odgovora na liječenje interferonom s obzirom na to da različiti virusni podtipovi pokazuju značajne razlike u tom pogledu.

Slika 4.8. Shematski prikaz virus hepatitisa C – organizacija genoma
Epidemiologija. Smatra se da je virusom hepatitisa C inficirano više od 200 milijuna ljudi diljem svijeta sa značajnim razlikama u prevalenciji ovisno o zemljopisnom području, tako da prevalencija u Europi iznosi između 1 i 3 %, dok u nekim dijelovima Afrike (Egipat) iznosi 15 do 20 %. Postotak hepatitis C pozitivnih osoba u Republici Hrvatskoj iznosi 1,3 % u općoj populaciji. Izvor zaraze čine bolesnici s aktivnom bolesti i vironoše, a glavni putevi prijenosa jednaki su kao i kod hepatitisa B: parenteralni (transfuzijsko liječenje, korištenje zajedničkih intravenskih kanila i igala, tetoviranje), spolni (nezaštićen spolni odnos s oboljelom osobom) i vertikalni put prijenosa (s majke na čedo), s time da novije epidemiološke studije ukazuju na parenteralni put prijenosa kao vodeći. Prijenos virusa bliskim kontaktom (zajedničko domaćinstvo) izuzetno je rijedak. Kod otprilike 20 % oboljelih ne može se ustanoviti način zaraze.
Patogeneza. Hepatitis C virus ulazi u hepatocite procesom fuzije. Nakon ulaska u citoplazmu hepatocita dolazi do oslobađanja molekule RNA na temelju koje se sintetizira poliproteinski produkt kojeg čini najmanje deset proteina (strukturnih i funkcionalnih) koji će poslužiti u nastanku novih virusnih čestica u tzv. replikacijskom kompleksu koji povezuje virusne proteine, stanične komponente te novonastalu RNA. Po završetku replikacije novonastale virusne čestice sekretornim putevima napuštaju inficirane hepatocite i otpuštaju se u krv. Za razliku od hepatitisa A i B u kojima oštećenje hepatocita nastaje poglavito djelovanjem imunološkoga sustava protiv inficiranih hepatocita koji eksprimiraju virusne antigene na svojoj površini, oštećenje hepatocita pri hepatitisu C posljedica je kombinacije izravnoga citopatskog učinka virusa, kao i do sada opisivanoga imunološki posredovanoga oštećenja. Izravni citopatski učinak ostvaruje se djelovanjem određenih virusnih proteina (npr. protein jezgre) na unutarstanične puteve kojima se inducira apoptoza ili se remete normalni metabolički putevi koji dovode do oštećenja hepatocita. U prilog imunološki posredovanome oštećenju hepatocita govori prisutnost citotoksičnih (CD8+) i pomoćničkih (CD4+) T-limfocita u svim dijelovima jetrenoga režnjića. Kao i kod hepatitisa B, moguće je odlaganje imunokompleksa koje čine virusni antigeni i specifična protutijela u različita tkiva i organe što uvjetuje razvoj ekstrahepatalnih manifestacija (poliartritis, vaskulitis, glomerulonefritis i sl.).
Patologija. Patomorfološke promjene koje nalazimo kod akutne infekcije jetre hepatitis C virusom nisu specifične, jednake su kao i kod drugih akutnih hepatitisa. Hepatociti postaju uvećani pri čemu vrše kompresiju na sinusoide koje se gotovo i ne uočavaju (vakuolarna pretvorba hepatocita) uz razvoj jasnih zona nekroza. Jetreni režnjići infiltrirani su mononuklearima, a nalazimo i hiperplaziju Kupfferovih stanica.
Klinička slika. Inkubacija akutnoga virusnog hepatitisa C iznosi šest do sedam tjedana, a kod velikoga broja oboljelih prolazi neprepoznato, s obzirom na to da se klinički najčešće očituje nespecifičnim simptomima kao što su umor, malaksalost, subfebrilnost, osjetljivost pod desnim rebrenim lukom ili ima izražene opće infektivne simptome nalik na gripu ili neku drugu akutnu virusnu infekciju. Hiperbilirubinemija i ikterus javljaju se kod 20 do 30 % bolesnika. Razvoj akutnoga fulminantnog hepatitisa izuzetno je rijedak događaj (obično se razvija kod osoba koje već od ranije imaju neku bolest jetre). Nakon akutne infekcije hepatitis C virusom samo 15 do 25 % osoba uspijeva eliminirati virus u potpunosti (obično se radi o mlađoj populaciji), dok se kod ostalih 75 do 85 % osoba razvija kronična infekcija hepatitis C virusom.
Dijagnoza akutne infekcije hepatitis C virusom temelji se u prvome redu na biokemijskim laboratorijskim nalazima, serološkim i molekularnim pretragama, a slikovne metode i biopsija jetre služe samo kao dodatne dijagnostičke metode. Osnovna laboratorijska obrada uključuje određivanje vrijednosti pokazatelja hepatocelularne nekroze i njihovoga omjera (ALT > AST), pokazatelja kolestaze (alkalna fosfataza, bilirubin), pokazatelja sintetske funkcije jetre (protrombinsko vrijeme, albumini) te pokazatelja metaboličke funkcije jetre (amonijak). Vrijednosti navedenih pretraga ponajprije ovise o težini bolesti, a najčešće se nalazi izolirano višestruko povišenje jetrenih transaminaza.
Serološka i molekularna dijagnostika akutnoga virusnog hepatitisa C podrazumijeva određivanje dva temeljna markera: antitijelo na HCV (Anti-HCV) te određivanje genetskoga materijala (HCV-RNA) – Tablica 4.27. Određivanje antigena hepatitis C virusa (HCV Ag) nema veće kliničko značenje s obzirom na to da se on u serumu nalazi u vrlo niskim koncentracijama. Anti-HCV antitijela pojavljuju se šest do dvanaest tjedana od nastupa akutne infekcije, a ostaju trajno povišena, čak i nakon potpune eliminacije virusa. HCV-RNA može se ranije detektirati i to već dva do četiri tjedna od nastupa akutne infekcije, a ukazuje na aktivnu bolest i replikaciju virusa. Također, molekularne metode omogućavaju i procjenu genotipa virusa što može imati značaj u predviđanju terapijskoga odgovora.
|
Tablica 4.27. Interpretacija nalaza serološke i molekularne dijagnostike hepatitis C infekcije
|
|
Anti-HCV
|
HCV-RNA
|
Interpretacija nalaza
|
|
-
|
-
|
Nema infekcije
|
|
-
|
+
|
Akutna infekcija
|
|
+
|
-
|
Kronična infekcija ili preboljena bolest
|
|
+
|
+
|
Akutna infekcija ili egzacerbacija kronične infekcije
|
Ultrazvuk i biopsija jetre imaju manji i ograničeni značaj u dijagnostici akutne infekcije jetre hepatitis C virusom. Ultrazvučno se mogu naći isti znakovi kao i kod ostalih akutnih hepatitisa (opisano u dijagnostici akutnoga hepatitisa A), a ima ulogu i u diferencijalnoj dijagnostici i isključenju drugih uzroka porasta vrijednosti jetrenih transaminaza. Biopsija se provodi samo u klinički nejasnim slučajevima.
Diferencijalna dijagnoza jednaka je kao i za druge akutne virusne hepatitise, iako je postavljanje dijagnoze akutnoga hepatitisa C otežano s obzirom na oskudnu simptomatologiju zbog koje se bolesnici uglavnom niti ne javljaju liječniku, pa se dijagnoza obično postavlja u kroničnoj fazi bolesti (obrada povišenih vrijednosti jetrenih transaminaza).
Liječenje. Ako se bolest dijagnosticira u akutnoj fazi infekcije, apsolutno je indicirana antivirusna terapija koja, osim što omogućava eliminaciju virusa i prevenciju razvoja kroničnoga hepatitisa C, kod većine bolesnika smanjuje rizik i od prijenosa virusa na druge osobe.
Prva linija liječenja. Klasični terapijski pristup podrazumijeva supkutanu primjenu pegiliranoga interferona (α2a ili α2b) u dozi od 180 µg/tjedan za α2a, odnosno 1.5 µg/kg/tjedan za α2b kroz 24 tjedna, što se pokazalo dostatnim za eliminaciju virusa kod većine bolesnika. Kliničko-laboratorijski parametri koji predviđaju dobar odgovor na ovaj terapijski pristup su simptomatska bolest, visoke vrijednosti alanin-aminotransferaze (ALT) te niska razina HCV-RNA. Kod bolesnika koji nemaju ove parametre u terapijski se režim preporuča dodati i ribavirin per os (0.8 mg/dan), osobito kod bolesnika koji su inficirani hepatitis C virusom genotipa 1. Navedenim preporukama za liječenje akutne infekcije hepatitis C virusom postiže se potpuna eliminacija virusa u 70 do 90 % bolesnika.
Druga linija liječenja. Ako se prethodno navedenom terapijom ne postigne eliminacija virusa (perzistiranje HCV-RNA), nastavlja se liječenje kombinacijom pegeliranoga interferona i ribavirina u prethodno navedenim dozama, ali kroz vremenski period od 48 tjedana. Iako još nema randomiziranih studija koje bi pokazale prednost primjene novih anti-HCV lijekova, sve više se u drugoj liniji liječenja koristi peroralna kombinacija sofosbuvira (400 mg/dan) i ribavirina (1 g/dan) kroz period od 24 tjedna.
Prognoza. Kod većine bolesnika s akutnom infekcijom jetre hepatitis C virusom dolazi do kliničkoga oporavka kroz tri do šest mjeseci s nešto dužom perzistencijom patoloških nalaza jetrenih transaminaza. Ukupna smrtnost od akutnoga hepatitisa C manja je od 1 % (fulminantni hepatitis izuzetno se rijetko razvija). U više od 80 % slučajeva iz akutne infekcije razvija se kronična infekcija hepatitis C virusom, osobito kod bolesnika bez dijagnoze i onih kod kojih nije provedena antivirusna terapija.
Prevencija se na prvome mjestu provodi općim mjerama kakve vrijede i za prevenciju hepatitis A infekcije. Do sada nije pronađeno cjepivo za hepatitis C virus. Nakon dokumentiranoga rizičnog ponašanja (ubod kontaminiranom iglom, nezaštićeni spolni odnos sa zaraženom osobom i sl.), bolesnike je potrebno pratiti mjerenjem HCV-RNA i praćenjem vrijednosti jetrenih transaminaza (na početku, u drugom tjednu, nakon četiri i nakon šest mjeseci), a kada se dokumentira akutna infekcija, potrebno je provesti opisano liječenje.
AKUTNI VIRUSNI HEPATITIS D
Etiologija. Akutni virusni hepatitis D virusna je upala jetre uzrokovana virusom hepatitisa D (HDV) koji pripada virusima iz skupine Deltaviridae. Radi se o inkompletnome RNA virusu koji za svoj ulaz u hepatocite treba nosača, a za to koristi hepatitis B virus (smješten unutar HBs antigena). HDV se sastoji od genetskoga materijala koji čini molekula RNA i ima delta antigene (HDVAg): mali delta antigen (SHDVAg) i veliki delta antigen (LHDVAg). Ovisno o genetskim razlikama, razlikujemo tri virusna genotipa.
Epidemiologija. S obzirom na navedenu povezanost virusa hepatitisa D i B, jasno je da oni dijele i iste epidemiološke značajke (put prijenosa, rizične skupine). Ovisno o vremenskoj pojavi infekcije virusom hepatitisa D, možemo govoriti o koinfekciji (istodobna infekcija virusom hepatitisa B i D) ili o superinfekciji (naknadna infekcija virusom hepatitisa D kod osoba prethodno zaraženih virusom hepatitisa B). Procjenjuje se da je 5 % osoba zaraženih virusom hepatitisa B istodobno zaraženo i virusom hepatitisa D. Područja s višom stopom pojavnosti ove infekcije su Rusija, istočna Europa, Japan i Indija.
Patogeneza. Mehanizam ulaska virusa hepatitisa D u hepatocite nije u potpunosti razjašnjen, ali zna se da hepatitis D virus ne može sam ući u hepatocite i da za to koristi hepatitis B virus (smješten unutar njegova površinskoga antigena). Nakon ulaska u hepatocite dolazi do oslobađanja virusne RNA koja se prenosi u jezgru gdje se vrši replikacija uz pomoć polimeraze I i II domaćina. Tako nastaju specifične mRNA koje se prevode u specifične virusne proteine (delta antigen). Prema tome, virus hepatitisa B potreban je hepatitis D virusu samo za ulaz i izlaz iz hepatocita, ali ne i za replikaciju. Oštećenje hepatocita povezano s hepatitis D virusom dijelom proizlazi iz njegova izravnoga citopatskog učinka, a dijelom iz imunološki posredovanoga odgovora na eksprimirane antigene na površini inficiranih hepatocita.
Klinička slika. Koinfekcija HDV-a i HBV-a ne može se klinički razlikovati od akutne, ikterične hepatitis B infekcije, ali prisutan je karakterističan dvofazni porast jetrenih transaminaza tijekom akutne infekcije. Superinfekcija je karakterizirana kliničkim pogoršanjem i akutizacijom ranije stečene kronične hepatitis B infekcije. Bolesnici zaraženi s oba virusa pokazuju veću sklonost razvoju fulminantnoga oblika bolesti. Rizik od razvoja kronične infekcije hepatitis B virusom nije povećan kada se radi o koinfekciji s hepatitis D virusom.
Dijagnoza hepatitis D infekcije temelji se na serološkim i molekularnim metodama koje uključuju određivanje HDV antigena (HDAg), ukupnih antitijela na HDV (Anti-HD), IgM antitijela na HDV (IgM Anti-HD) te genetskoga materijala HDV (HDV-RNA). Gotovo se svi HBsAg pozitivni bolesnici moraju testirati na hepatitis D, a osobito oni kod kojih se u akutnoj fazi bolesti bilježi dvofazni porast jetrenih transaminaza. Interpretacija nalaza, zajedno s markerima hepatitis B infekcije, prikazana je u Tablici u 4.28.
|
Tablica 4.28. Laboratorijska interpretacija HBV i HDV markera
|
|
Serološki/molekularni marker
|
Akutna HBV/HDV koinfekicja
|
Akutna HDV superinfekcija
|
Kronična HDV infekcija
|
|
HBsAg
|
Pozitivan
|
Pozitivan
|
Pozitivan
|
|
IgM Anti-HBc
|
Pozitivan
|
Negativan
|
Negativan
|
|
HDAg
|
Rano i kratko pozitivan
|
Rano i kratko pozitivan
|
Negativan
|
|
HDV-RNA
|
Rano i prolazno pozitivan
|
Rano i trajno pozitivan
|
Obično pozitivan
|
|
Ukupni Anti-HDV
|
Kasno pozitivan, nisak titar
|
Brzo rastući titar
|
Visoki titar
|
|
IgM Anti-HDV
|
Prolazni pozitivan
|
Trajno povišeni titar
|
Obično povišeni titar
|
Liječenje, prevencija i prognoza. Nema specifičnoga oblika liječenja, liječi se prema načelima opisanim kod akutne infekcije hepatitis B virusom. Mjere prevencije su opće i odnose se jednako kao i na hepatitis B. Cijepljenje protiv hepatitisa B dovelo je i do pada učestalosti hepatitisa D, iako ne postoji specifično cjepivo za hepatitis D. U slučaju koinfekcije, kronično vironoštvo virusa hepatitisa D bilježi se kod samo 2 % bolesnika, a kod superinfekcija taj postotak iznosi 90 %.
AKUTNI VIRUSNI HEPATITIS E
Etiologija. Akutni virusni hepatitis E uzrokovan je virusom hepatitisa E (HEV) koji pripada skupini virusa Hepeviridiae. Radi se o malom RNA virusu koji nema ovojnicu, a genetski materijal sadržan je u jednoj jednolančanoj molekuli RNA. Do sada je opisano pet različitih genotipova od kojih su genotip 1 i 2 nađeni samo u ljudi, dok ostali mogu inficirati i neke životinje (svinje, psi, štakori).
Epidemiologija. Bolest se prenosi slično kao i hepatitis A, fekalno-oralnim putem, i to najčešće putem vode ili hrane kontaminirane fekalijama koje sadržavaju virusne čestice. Također, infekcija se može prenositi i parenteralnim i vertikalnim putem, iako je to manje zastupljeno. Bolest se uglavnom javlja endemski u krajevima s lošim higijenskim i socioekonomskim uvjetima (Afrika, Bliski Istok, Indija).
Patogeneza infekcije hepatitis E virusima slabo je poznata, kao i način na koji virus uz probavnoga sustava dospijeva u hepatocite, ali se zna da se on osim u hepatocitima može replicirati i na drugim mjestima, kao što su crijevna sluznica i limfni čvorovi. Nakon replikacije u hepatocitima novonastale virusne čestice izlučuju se dijelom u krv, a dijelom u žuč kojom iznova dospijevaju u crijeva, odakle fecesom dospijevaju u prirodu. Smatra se da je dominantno oštećenje hepatocita posredovano imunološkim odgovorom domaćina na inficirane hepatocite i u tome glavnu ulogu imaju citotoksične T-satnice i prirodno ubilačke NK-stanice.
Klinička slika. Inkubacija traje tri do osam tjedana, a bolest počinje postupno, nespecifičnim simptomima i znakovima kao što su umor, malaksalost te vrućica nejasnoga porijekla. Obično se nakon ovih prodromalnih simptoma razvija ikterična faza, a bolesnici se mogu žaliti na bolnost pod desnim rebrenim lukom, mučninu i povraćanje. Kod imunokompetentnih osoba gotovo bez iznimke dolazi do spontane potpune eliminacije virusa i ozdravljenja. Težu kliničku sliku obično nalazimo kod trudnica koje su od ranije imale neku kroničnu bolest jetre te se kod njih može razviti i akutni fulminantni hepatitis. U nekoliko radova prikazana je i povećana povezanost Guillain-Barreova sindroma s ovom infekcijom.
Dijagnoza se postavlja na osnovi kliničke slike, epidemioloških podataka (u Hrvatskoj je bitan podatak o putovanju u endemska područja) te laboratorijskih nalaza. Kao i kod ostalih akutnih hepatitisa, primjećuju se povišene jetrene transaminaze te hiperbilirubinemija, a mogu perzistirati i do dva mjeseca od rezolucije simptoma. Konačna se dijagnoza postavlja određivanjem seroloških biljega i molekularnim tehnikama. Kod akutne infekcije nalazimo povišeni titar IgM antitijela na hepatitis E virus (IgM Anti-HEV), dok povišeni titar IgG antitijela na hepatitis E virus (IgG Anti-HEV) ostaje trajno povišen. Na aktivnu bolest ukazuje nam i nalaz genetskoga materijala u serumu (HEV-RNA). Ultrazvuk i biopsija imaju jednaku ulogu kao i u drugim akutnim virusnim hepatitisima.
Liječenje i prognoza. Liječenje je uglavnom simptomatsko, kao i kod akutne infekcije hepatitisom A, a primjena ribavirina indicirana je samo kod bolesnika s teškom kliničkom slikom (fulminantni hepatitis), a nekada je indicirana i transplantacija jetre. Ukupno gledano, prognoza akutnoga hepatitisa E je dobra i kod većine bolesnika dolazi do spontane eliminacije virusa i rezolucije simptoma. Stopa smrtnosti od akutnoga virusnog hepatitisa E kreće se od 1 do 10 %, a teže kliničke oblike susrećemo kod trudnica i starijih osoba. Razvoj kronične infekcije ovim virusom i zuzetno je rijetka pojava, a bilježi se kod HIV pozitivnih osoba i imunokompromitiranih bolesnika.
Prevencija se za sada temelji na općim mjerama kao što su podizanje svijesti o higijeni (pranje ruku), boljim nadzorom nad vodom za piće u endemičnim krajevima, upoznavanje osoba koje putuju u te krajeve s mogućim načinom zaraze i sl. Cjepivo protiv virusa hepatitisa E (rekombinantni HEV protein) pokazalo se uspješnim u posljednjim kliničkim fazama te je već odobreno u nekim zemljama (Kina).
KRONIČNI VIRUSNI HEPATITISI
Uvod. Kronični virusni hepatitis naziv je za kronični upalni (nekroinflamatorni) proces jetrenoga parenhima uzrokovan hepatotropnim virusima, koji traje dulje od tri do šest mjeseci. Najčešće se radi o infekciji virusima hepatitisa B i C te se danas procjenjuje da u svijetu od kroničnoga hepatitisa uzrokovanoga tim virusima boluje više od 500 milijuna ljudi. Virus hepatitisa A uzrokuje isključivo akutnu infekciju i ne pokazuje tendenciju prelaska u kroničnu fazu. Kod manjega broja bolesnika s kroničnim hepatitisom B može se naći i kronična infekcija hepatitis D virusom (koinfekcija, superinfekcija) koja može pogoršati klinički tijek kod ovih bolesnika. Virus hepatitis E u pravilu uzrokuje akutnu infekciju, no kod manjega broja bolesnika s izraženom imunosupresijom može prijeći u kroničnu fazu. Klinički značaj kroničnih virusnih hepatitisa leži u njihovoj izraženoj povezanosti s razvojem ciroze jetre i hepatocelularnoga karcinoma, njihovim najozbiljnijim i najtežim komplikacijama. Osim hepatotropnih virusa, sličnu patohistološku sliku i kliničke manifestacije kroničnoga hepatitisa mogu uzrokovati i drugi uzroci kao što su kronična konzumacija alkohola (alkoholni steatohepatitis), metabolički poremećaji (nealkoholni steatohepatitis, hemokromatoza, Wilsonova bolest) te autoimuni proces (autoimuni hepatitis). U daljnjemu tekstu bit će prikazani najznačajniji oblici kroničnih virusnih hepatitisa.
KRONIČNI VIRUSNI HEPATITIS B
Definicija i epidemiologija. Kronični virusni hepatitis B nastaje iz akutne infekcije uzrokovane hepatitis B virusom, a definira se kao perzistencija HBs antigena (HBs Ag) u serumu kroz vremenski period dulji od šest mjeseci. Stopa razvoja kronične infekcije virusom hepatitisa B u najvećoj mjeri ovisi o dobi bolesnika pri nastanku infekcije, tako da je stopa kronifikacije kod novorođenčadi i male djece preko 90 %, s porastom godina se smanjuje te u konačnici u odrasloj dobi iznosi između 5 i 10 %. Procjenjuje se da se diljem svijeta nalazi više od 240 milijuna kroničnih nositelja hepatitis B virusa (4 % svjetske populacije), a Republika Hrvatska ubraja se u zemlje s niskom prevalencijom kroničnoga kliconoštva (< 2 %) zajedno sa zemljama srednje i zapadne Europe, Amerike i Australije.
Prirodni tijek infekcije hepatitis B virusom sastoji se od nekoliko faza: faza imunotolerancije, faza virusne eliminacije, faza imunološkoga nadzora te faza gubitka imunološkoga nadzora (Slika 4.9.).
Faza imunotolerancije kratka je faza koja se javlja na početku same infekcije (iako može dulje trajati kod novorođenčadi i male djece), a obilježena je stanjem mirovanja imunološkoga sustava u uvjetima prisutnosti eksprimiranih virusnih antigena na površini hepatocita. S obzirom na to da nema oštećenja hepatocita, vrijednosti aminotrasferaza su uredne, biopsija jetre pokazuje minimalnu upalnu aktivnost (infiltracija mononuklearima), a u serumu se mogu detektirati visoke razine HBeAg i HBV-DNA kao odraz snažne replikacije virusa.
Faza virusne eliminacije druga je faza u prirodnome tijeku hepatitis B infekcije karakterizirana aktivnim imunološkim odgovorom koji uzrokuje nekroinflamatorni proces te aktivira proces fibroze. U serumu se primjećuje porast jetrenih transaminaza posljedično destrukciji hepatocita, dok je razina HBV-DNA niža nego u fazi imunotolerancije (destrukcijom hepatocita dolazi i do destrukcije virusa i posljedičnoga pada replikacije virusa), a patohistološki nalaz pokazuje aktivnu bolest. Ova faza može biti različito duga te završiti trajnom i potpunom eliminacijom virusa (ozdravljenje) ili može ući u kroničnu fazu (kronični hepatitis B) koja je praćena perzistiranjem virusne replikacije, ali je ona manje izražena te, ovisno o detekciji HBe antigena (HBeAg), govorimo o HBeAg pozitivnom ili HBeAg negativnom kroničnom hepatitisu B.
Faza imunološkoga nadzora podrazumijeva stanje tzv. imunološke kontrole bolesti u kojemu imunološki sustav uspijeva suprimirati virusnu replikaciju, što se očituje niskom razinom HBV-DNA (< 2000 IU/mL) te odsutnošću HBeAg (tzv. neaktivni nositelj, inactive carrier). Nalazi jetrenih transaminaza uglavnom su uredni, a patohistološki nalaz ukazuje na minimalnu upalnu aktivnost. Kod nekih bolesnika ova faza također može završiti potpunom eliminacijom virusa (ozdravljenje).
Faza gubitka imunološkoga nadzora javlja se kod manjega broja osoba u stanju imunološke kontrole bolesti, a podrazumijeva reaktivaciju virusa i akutizaciju bolesti (kronični aktivni hepatitis B), što je obilježeno ponovnim porastom vrijednosti jetrenih transaminaza i razine HBV-DNA, a i patohistološki nalaz ukazuje na ponovnu aktivaciju bolesti (upalna infiltracija, nekroza, fibroza).
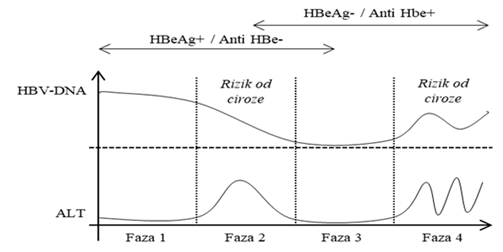
Slika 4.9. Prirodni tijek infekcije hepatitis B virusom
Patogeneza. Oštećenje jetre uslijed kroničnoga hepatitisa B nije posljedica direktnoga citopatskog učinka virusa, nego nastaje kao posljedica lokalnoga imunološkog odgovora koji je u prvome redu posredovan citotoksičnim T-limfocitima koji prepoznaju i uništavaju inficirane hepatocite, odnosno hepatocite koji na svojoj površini eksprimiraju virusne antigene. Lokalna upalna reakcija praćena je stvaranjem različitih proupalnih citokina od kojih neki uzrokuju aktivaciju Itovih stanica što dovodi do pojačanoga stvaranja vezivnoga tkiva (fibroza). Osim toga, i neki virusni proteini (protein X) mogu direktno stimulirati Itove stanice i proces fibroze. Prekomjerno stvaranje vezivnoga tkiva u konačnici dovodi do progresivne fibroze i razvoja ciroze jetre.
Klinička slika. Kronični hepatitis B uglavnom je asimptomatska bolest ili se manifestira slabo izraženim i nespecifičnim simptomima i znakovima tako da se najčešće dijagnosticira obradom slučajno otkrivenih povišenih vrijednosti jetrenih transaminaza ili pri traženju uzroka razvijene ciroze jetre. Najčešći simptomi i znakovi koji prate kronični hepatitis B su umor, malaksalost te nelagoda i bol u desnom gornjem kvadrantu abdomena i/ili epigastriju. Svi takvi bolesnici imaju rizik od nastanka ciroze jetre koja se u vremenskom periodu od jedne do pet godina razvije kod 20 % bolesnika. Manji dio bolesnika razvije i neke od ekstrahepatalnih manifestacija kao što su poliarteritis i glomerulonefritis. Načelno gledano, bolesnici s HBeAg negativnim kroničnim hepatitisom imaju teži i nepovoljniji klinički tijek od bolesnika s HBeAg pozitivnim kroničnim hepatitisom.
Dijagnoza kronične infekcije hepatitis B virusom temelji se na patološkim biokemijskim nalazima jetrene funkcije, serološkim i molekularnim markerima te biopsiji i patohistološkoj analizi. Slikovne su metode od manjega značaja.
Laboratorijski nalazi. Kod kroničnoga hepatitisa B dominiraju povišene vrijednosti pokazatelja hepatocelularne nekroze i to dominantno alanin-aminotransferaze, dok su pokazatelji kolestaze, kao što su alkalna fosfataza i bilirubin, mirni ili tek blaže povišeni sve do faze razvijene ciroze jetre kada su vrijednosti svih pokazatelja jetrene funkcije patološke (amonijak, protrombinsko vrijeme, albumini). Interpretacija seroloških i molekularnih markera kod kroničnoga hepatitisa B prikazana je u Tablici 4.29.
|
Tablica 4.29. Interpretacija seroloških i molekularnih markera kronične infekcije hepatitis B virusom
|
|
Interpretacija
|
HBsAg
|
Anti-HBs
|
HBeAg
|
Anti HBe
|
Anti HBc
IgM
|
Anti HBc ukupni
|
HBV-DNA
|
|
HBeAg pozitivan KH
|
+
|
-
|
+
|
-
|
-
|
+
|
> 2 x 104
|
|
HBeAg negativan KH
|
+
|
-
|
-
|
+
|
-
|
+
|
> 2 x 103
|
|
Inaktivni nositelj
|
+
|
-
|
-
|
+
|
-
|
+
|
< 2 x 103
|
|
Reaktivacija KH
|
+
|
-
|
+/-
|
+/-
|
+/-
|
+
|
> 2 x 103
|
Slikovne metode, kao što je ultrazvuk, imaju ograničenu ulogu u dijagnostici kroničnoga hepatitisa i nalaz može varirati od naizgled uredne ehogenosti do promjena karakterističnih za cirozu jetre. Neizravni znakovi koji upućuju na kronični hepatitis su grub, iregularan i hiperehogeni parenhim uz nepravilnost i zaobljenost jetrenih kontura, početno dilatiranu portalnu venu, hilarnu limfadenopatiju i splenomegaliju.
Biopsija jetre i patohistološka analiza indicirana je kod svih bolesnika sa serološki dokazanom kroničnom hepatitis B infekcijom. Za kronični hepatitis C karakteristični su hepatociti sa sitno-zrnatom citoplazmom poput mliječnoga stakla (engl. groundglass hepatocytes), a imunohistokemijski se može dokazati prisutnost specifičnih antigena (HBsAg i HBcAg). Pri patohistološkoj analizi dobivenih uzoraka potrebno je procijeniti stupanj nekroinflamatornih promjena te stupanj razvijenosti fibroze, za što služe posebni bodovni sustavi kao što su Metavir sustav (F0 - F4) ili Ishakov sustav (Ishak 0 - 6).
Diferencijalna dijagnoza uključuje širok spektar bolesti i stanja, kao što su alkoholne i druge toksične lezije jetre (alkoholni steatohepatitis, medikamentozni hepatitis), metaboličke bolesti jetre (nealkoholni steatohepatitis, Wilsonova bolest, hemokromatoza, manjak α-1 antitropsina), autoimune bolesti jetre i dr.
Liječenje. Osnovni cilj liječenja kronične infekcije virusom hepatitisa B je postizanje trajne supresije replikacije virusa, rezolucije patohistoloških promjena te na taj način spriječiti napredovanje bolesti prema fibrozi/cirozi te hepatocelularnome karcinomu. U liječenju ovih bolesnika koriste se interferon te analozi nukleozida i nukleotida. U daljnjemu će tekstu biti opisana osnovna načela liječenja kroničnoga hepatitisa B, ali u kliničkoj praksi ono treba biti prilagođeno lokalnim smjernicama i preporukama odgovarajućih društava.
Indikacije za liječenje kroničnoga hepatitisa B načelno su jednake i za HBeAg pozitivne i za HBeAg negativne bolesnike, a temelje se na tri osnovna kriterija: vrijednostima HBV-DNA, vrijednostima alanin-aminotransferaze (ALT) te patohistološkim karakteristikama (nekroinflamacija, fibroza, ciroza). Načelno bolesnike kod kojih je indicirano antivirusno liječenje možemo svrstati u dvije kategorije: 1) bolesnici s umjereno do teško aktivnom bolesti (nekroinflamacija, fibroza), kod kojih su vrijednosti HBV-DNA iznad 2000 IU/mL i/ili povišene vrijednosti ALT-a te 2) bolesnici s razvijenom cirozom jetre, bez obzira na vrijednosti HBV-DNA i ALT-a te bez obzira na klinički stadij ciroze (liječenje je indicirano i u kompenziranoj i u dekompenziranoj cirozi). U Tablici 4.30. su navedene indikacije za liječenje kroničnoga B hepatitisa prema preporukama Hrvatske konsenzus konferencije o virusnim hepatitisima iz 2013. godine.
|
Tablica 4.30. Indikacije za liječenje kroničnoga hepatitisa B
|
|
1) bolesnici s kroničnim HBeAg pozitivnim i HBeAg negativnim hepatitisom koji imaju HBV-DNA > 2000 IU/mL);
2) bolesnici s razvijenom cirozom jetre (kompenzirana, dekompenzirana);
3) bolesnici s transplantiranom jetrom, u svrhu prevencije reinfekcije;
4) bolesnici s dokazanom reinfekcijom nakon transplantacije jetre;
5) bolesnici s HIV, HCV ili HDV koinfekcijom;
6) bolesnici s ekstrahepatalnim kliničkim manifestacijama;
7) zdravstveni radnici s blagim oblikom kronične hepatitis B infekcije
8) osobe s blagim oblikom kronične hepatitis B infekcije koje borave u zatvorenim ustanovama;
9) bolesnici na hemodijalizi i oni s transplantiranim bubregom;
10) bolesnici na imunosupresivnoj terapiji ili kemoterapiji
11) djeca i trudnice.
|
Interferoni su proteini koji djeluju kao imunostimulatori koji potpomažu imunološki sustav u pogledu eliminacije virusnih čestica. U liječenju kroničnoga hepatitisa B primjenjuje se pegelirani interferon-α2a, a može se koristiti i u liječenju HBeAg pozitivnih i HBeAg negativnih bolesnika. Lijek se primjenjuje supkutano i to u jednoj tjednoj dozi od 180 µg. Najbolji odgovor postiže se kod mlađih bolesnika, bolesnika s visokim vrijednostima aminotransferaza te vrijednostima HBV-DNA manjim od 107 IU/mL. Uspješnost terapije provjerava se tri mjeseca nakon početka liječenja praćenjem serumske razine HBsAg-a: ako je došlo do pada vrijednosti, očekuje se povoljan terapijski odgovor, no ako taj pad izostane, preporuča se prekid liječenja interferonom i nastavak analozima nukleozida. Obično se kod svih bolesnika unutar šest do osam sati od primjene lijeka registriraju nuspojave u vidu simptoma nalik na gripu koji postaju slabije izraženi opetovanim primjenama lijeka. Od ostalih nuspojava bilježe se glavobolja, mialgije, mučnina, alopecija, poremećaji raspoloženja te depresija koštane srži (neutropenija, trombocitopenija).
Analozi nukleozida i nukleotida čine okosnicu peroralne antivirusne terapije u liječenju kroničnoga hepatitisa B. To su lijekovi koji se primjenjuju u neaktivnome obliku, a da bi postali aktivni moraju proći dvostruku (analozi nukleotida: adefovir, tenofovir) ili trostruku fosforilaciju (analozi nukleozida: lamivudin, entekavir). Ti se lijekovi mogu koristiti u liječenju i HBeAg pozitivnih i HBeAg negativnih bolesnika, a osim što su vrlo učinkoviti u inhibiciji replikacije virusa, kod dugoročne primjene imaju i povoljne učinke glede smanjenja fibroze. Entekavir i tenofovir danas su lijekovi izbora u liječenju ovih bolesnika, a primjenjuju se u jednoj dnevnoj dozi (0,5 mg entekavir; 300 mg tenofovir). Načelno gledano, ovi se lijekovi dobro podnose i imaju malo nuspojava. Dosadašnja iskustva nisu dala prednosti kombiniranom liječenju te se preporuča koristiti samo jedan lijek.
Terapijska strategija. U liječenju kroničnoga hepatitisa B postoje dvije osnovne strategije liječenja: 48-tjedno liječenje s pegeliranim interferonom ili dugoročno liječenje analozima nukleotida/nukleozida. Do sada nije potvrđena prednost istodobne primjene ove dvije skupine lijekova.
48-tjedna primjena pegeliranoga interferona α2a danas se preporuča za HBeAg pozitivne bolesnike koji imaju visoke vrijednosti ALT-a (više od tri puta u odnosu na gornju granicu) te imaju HBV-DNA ispod 2000 IU/mL. Kod većine se tih bolesnika ovim terapijskim pristupom postiže pozitivan terapijski odgovor definiran postizanjem serokonverzije (gubitak HBeAg i pojava Anti HBe) i održavanjem vrijednosti HBV-DNA ispod 2000 IU/mL. Također, bolesnici inficirani virusom hepatitisa B genotipa A i B pokazuju bolji odgovor na liječenje interferonom. Primjena pegeliranoga interferona kontraindicirana je kod bolesnika s uznapredovalom cirozom jetre te imunokompromitiranih bolesnika. Bolesnici koji nisu pokazali odgovor na liječenje interferonom prevode se na peroralnu terapiju analozima nukleotida/nukleozida.
Kod većine bolesnika s kroničnim hepatitisom B indicirano je dugoročno liječenje analozima nukleotida/nukleozida. Kao lijekovi prvoga izbora koriste se tenofovir ili entekavir. Cilj je liječenja suprimirati replikaciju virusa tako da vrijednosti HBV-DNA postaju nedetektabilne (< 10 IU/mL). Ako se monoterapijom ne postigne taj cilj, moguće je dodati drugi lijek, iako dugoročna sigurnost i uspješnost ove kombinacije nije ispitana. Liječenje se kod HBeAg pozitivnih bolesnika provodi još šest do dvanaest mjeseci od postizanja serokonverzije (gubitak HBeAg, pojava Anti HBe), a kod HBeAg negativnih bolesnika još šest do dvanaest mjeseci od gubitka HBsAg. Ako se ne ostvare ti uvjeti, liječenje se provodi doživotno. Glavna opasnost u liječenju ovih bolesnika leži u razvoju rezistencije na primjenjivani lijek, a ona je najmanje izražena u liječenju entekavirom i tenofovirom. Kod razvoja rezistencije, što se očituje ponovnim porastom HBV-DNA, preporuča se dodavanje dodatnoga lijeka iz ove skupine ili prelazak na monoterapiju tenofovirom. Također, na raspolaganju za liječenje rezistentnih bolesnika je i fiksna antivirusna kombinacija tenofovir/emtricitabin.
Bolesnici s dekompenziranom cirozom jetre zahtijevaju žurno antivirusno liječenje koje se temelji na primjeni analoga nukleotida/nukleozida, a neki stručnjaci preporučuju da se liječenje tih bolesnika odmah započne s dva potentna lijeka iz ove skupine. Pravovremeno uključivanje antivirotika kod takvih bolesnika može smanjiti potrebu za transplantacijom jetre ili je odgoditi. Ako se ne postiže kontrola bolesti, indicirana je transplantacija jetre, a odmah nakon nje potrebno je nastaviti liječenje primjenom HBV imunoglobulina i analoga nukleotida/nukleozida (tenofovir, entekavir).
Praćenje bolesnika u preterapijskom periodu (bolesnici s viremijom manjom od 2000 IU/mL) obuhvaća šestomjesečne kontrole koje podrazumijevaju biokemijsko i molekularno praćenje uz jednogodišnju evaluaciju fibroze neinvazivnim metodama (Fibroscan). Terapijsko praćenje podrazumijeva kontrolu biokemijskih (ALT) i molekularnih parametara (HBV-DNA), kao i kliničkoga stanja. Bolesnici koji su na terapiji interferonom kontroliraju se u šestomjesečnim intervalima, a kontrole obuhvaćaju određivanje HBeAg, Anti HBe, HBsAg te HBV-DNA. Kod bolesnika koji su na terapiji analozima nukleotida/nukleozida serološki parametri prate se u šestomjesečnim intervalima, dok se HBV-DNA kontrolira u tromjesečnim intervalima (zbog uočavanja porasta koji sugerira nastanak rezistencije). Kod bolesnika s razvijenom cirozom jetre potrebne su šestomjesečne ultrazvučne kontrole te praćenje vrijednosti tumorskoga markera α-fetoproteina, s ciljem ranoga otkrivanja hepatocelularnoga karcinoma.
Prognoza. Klinički je tijek kod ovih bolesnika varijabilan. Kod dobroga dijela bolesnika se uz opisano antivirusno liječenje i praćenje postiže dugoročno preživljenje uz smanjenje stope progresije bolesti u cirozu. Rizik od nastanka ciroze i hepatocelularnoga karcinoma pozitivno korelira s vrijednostima HBV-DNA. Također, infekcija virusom hepatitisa B genotipa C povezana je s većim rizikom od razvoja ciroze jetre. Ukupni petogodišnji mortalitet ovih bolesnika iznosi 0 - 2 % kada nije razvijena ciroza, 14 - 20 % za bolesnike s kompenziranom cirozom te 70 - 86 % za bolesnike s dekompenziranom cirozom.
KRONIČNI HEPATITIS C
Definicija i epidemiologija. Kronični hepatitis C definira se kao perzistencija genetskoga materijala virusa hepatitisa C u serumu (HCV-RNA) kroz vremenski period duži od šest mjeseci, a razvija se kod oko 85 % oboljelih od akutne infekcije virusom hepatitisa C. Klinički se teško razlikuje od drugih etioloških oblika kroničnoga hepatitisa, te kao i drugi oblici pokazuje sklonost razvoju ciroze i hepatocelularnoga karcinoma. Kod više od 20 % bolesnika s kroničnom infekcijom hepatitisom C razvit će se ciroza jetre, a ta je stopa veća kod muškaraca, kod osoba koje konzumiraju više od 50 g alkohola na dan, kod pretilih bolesnika te kod bolesnika koji su oboljeli od akutnoga C hepatitisa u dobi nakon 40. godine. Razvoj ciroze jetre nosi i rizik od razvoja njezinih komplikacija, uključujući i hepatocelularni karcinom, što značajno smanjuje preživljenje. Prevalencija kronične infekcije hepatitis C virusom varira ovisno o zemljopisnim područjima, a u Europi se ona procjenjuje na oko 1,8 %.
Patogeneza. Kronična infekcija jetre hepatitis C virusom dovodi do nekroinflamatorne lezije praćene različitim stupnjem fibroze koja može progredirati sve do ciroze. Opisano oštećenje jetre nastaje kao posljedica aktivacije imunološkoga sustava koji prepoznaje i uništava inficirane hepatocite koji na svojoj površini eksprimiraju virusne antigene, dok je direktan citopatski učinak koji ima ulogu u akutnoj infekciji ovdje manje značajan. Proupalni citokini koje luče aktivirani limfociti djeluju i na Itove stanice koje se transformiraju u miofibroblaste koji stvaraju vezivno tkivo i dovode do fibroze, a kasnije i ciroze. Stvaranje vezivnoga tkiva i napredovanje bolesti prema cirozi jače je izraženo kod starijih bolesnika, bolesnika koji pojačano konzumiraju alkohol, pretilih osoba, kao i u slučaju jače izražene imunosupresije. Težina kroničnoga hepatitisa nije povezana s razinom HCV-RNA niti genotipom virusa.
Patologija. Kronični hepatitis C obilježen je različito izraženim obilježjima nekroinflamatornoga procesa i fibroze, što ukazuje na težinu bolesti. Početno je upalni infiltrat ograničen na portalne prostore, a kasnije se širi i u jetrene režnjiće. Specifičnije histološko obilježje kroničnoga hepatitisa C su obilni limfocitni agregati u portalnim prostorima koji mjestimice mogu stvarati folikule s germinativnim centrima, a preostali hepatociti često pokazuju znakove masne promjene. Za razliku od hepatitis B virusa, virus hepatitisa C ne može se imunohistološki dokazati u bioptičkim uzorcima.
Klinička slika i podjela. Kronični hepatitis C uglavnom je asimptomatska bolest i najčešće ostaje neprepoznata sve do razvoja ciroze jetre. Bolesnici mogu ispoljavati nespecifične simptome kao što su umor i malaksalost, mučnina, gubitak na tjelesnoj težini te bol i osjećaj nelagode pod desnim rebrenim lukom, a manje od 1 % bolesnika može razviti ekstrahepatalne manifestacije (vaskulitis, artralgije, glomerulonefritis, krioglobulinemija, porfirija kutanea tarda i sl.). Bolesnici s kroničnim C hepatitisom imaju i veći rizik od nastanka šećerne bolesti i non-Hodgkinova limfoma.
S obzirom na kliničku sliku, vrijednosti jetrenih transaminaza i patohistološki nalaz, kronični hepatitis C može se podijeliti u tri skupine: kronični hepatitis s normalnim nalazom transaminaza (25 %), blagi kronični hepatitis (50 %) te umjereni i teški kronični hepatitis (25 %).
Kronični hepatitis s normalnim nalazom transaminaza u potpunosti je asimptomatski, a patohistološki nalaz uključuje blaže izražene nekroinflamatorne promjene. Obično se dijagnosticira slučajno tijekom sistematskih pregleda u kojima se određuju markeri hepatitisa C (npr. obrada davatelja krvi).
Blagi kronični hepatitis obilježen je umjerenim povišenjem jetrenih transaminaza, a klinički su bolesnici ili asimptomatski ili imaju slabo izražene nespecifične simptome i znakove. Patohistološki nalaz ukazuje na blaže izraženu nekroinflamaciju i fibrozu. Ova skupina bolesnika obilježena je sporom progresijom prema cirozi jetre.
Umjereni i teški kronični hepatitis karakteriziran je značajnije povišenim vrijednostima jetrenih transaminaza uz patohistološki nalaz nekroinflamatorne lezije i fibroze težega stupnja. Bolesnici mogu imati različito izražene simptome, iako oni ne koreliraju s histološkim nalazom (teža klinička slika ne znači odmah i težu histološku sliku). Ova skupina bolesnika razvija cirozu ranije u odnosu na ostale.
Dijagnoza kroničnoga hepatitisa C temelji se na kliničkom nalazu, laboratorijskim pokazateljima hepatocelularne nekroze (povišene vrijednosti jetrenih transaminaza) te serološkim i molekularnim metodama (istodobna prisutnost Anti-HCV i HCV-RNA). Razina HCV-RNA ne korelira s težinom bolesti, a određivanje genotipa hepatitis C virusa ima ulogu u provođenju terapije (opisano kasnije). Osim tih nalaza, kod 50 % bolesnika detektiraju se i pozitivna IgM Anti-HCV antitijela, ali ona nemaju veći dijagnostički značaj. Također, ovi bolesnici često pokazuju i povišene vrijednosti krioglobulina i reumatoidnoga faktora. Ultrazvuk jetre pokazuje nespecifična obilježja kroničnoga hepatitisa kako je to opisano u kroničnoj infekciji virusom hepatitisa B, a biopsija jetre i patohistološka analiza imaju ulogu u procjeni stupnja nekroinflamatorne lezije i fibroze. Za procjenu fibroze koriste se i neinvazivne metode (Fibroscan). Diferencijalna dijagnoza jednaka je kao i kod kronične infekcije virusom hepatitisa B.
Liječenje. Cilj liječenja kronične infekcije virusom hepatitisa C je spriječiti progresiju bolesti te nastanak ciroze i hepatocelularnoga karcinoma, što se postiže supresijom virusne replikacije definirane nestankom HCV-RNA iz seruma 12 do 24 tjedna nakon završetka terapije.
Indikacije. Liječenje je indicirano kod svih neliječenih i ranije liječenih bolesnika kod kojih nalazimo znakove aktivne, kompenzirane ili dekompenzirane bolesti jetre. Prednost u liječenju imaju sljedeće skupine bolesnika: 1) bolesnici sa značajnom fibrozom (F3 po Metaviru) ili cirozom (F4 po Metaviru); 2) bolesnici s HBV ili HIV koinfekcijom; 3) bolesnici s indikacijom za transplantaciju jetre; 4) bolesnici s povratom HCV infekcije nakon transplantacije jetre; 5) bolesnici s HCV infekcijom prije i nakon transplantacije solidnih organa (bubreg, srce) i 6) bolesnici sa značajnim ekstrahepatalnim manifestacijama. Liječenje može biti opravdano i kod bolesnika s umjerenom fibrozom (F1 ili F2 po Metaviru) koji imaju dugo trajanje bolesti (> 20 godina) ili nose visoki rizik od daljnjega prenošenja infekcije (žene reproduktivne dobi koje žele trudnoću, bolesnici na hemodijalizi i sl.). Liječenje se može odgoditi kod bolesnika bez ili s blagom bolesti (F0 i F1 po Metaviru) te bez ekstrahepatalnih komplikacija. Liječenje se ne preporučuje bolesnicima s očekivanim ograničenim životnim vijekom zbog nekoga drugog komorbiditeta.
Antivirusna terapija. Nekadašnji terapijski protokoli utemeljeni na primjeni pegeliranoga interferona danas su gotovo u potpunosti zamijenjeni novim, direktnim antivirusnim lijekovima koji djeluju na različita ciljna mjesta ometajući replikaciju virusa hepatitisa C (inhibitori NS3 proteaze, inhibitori NS5B polimeraze). Standardno liječenje kroničnoga hepatitisa C temeljilo se na kombiniranoj terapiji pegeliranim interferonom α2a (180 µg sc/tjedno) ili α2b (1,5 µg/kg sc/tjedno) uz peroralnu primjenu ribavirina (0,8 - 1,4 g/dan), što je dovodilo do terapijskoga odgovora kod 50 % bolesnika inficiranih hepatitis C virusom genotipa 1 i kod 75 do 80 % bolesnika inficiranih hepatitis C virusom genotipa 2 ili 3. Ta klasična terapija postupno je zamijenjena novim, direktnim antivirusnim lijekovima, a terapijski protokoli ovise o genotipu virusa. Ipak, u zemljama sa slabijim ekonomskim prilikama i danas su zadržani stari temelji liječenja s obzirom na skupoću novih lijekova. Novi, direktni antivirusni lijekovi u liječenju kronične infekcije hepatitisa C imaju 90 do 95 %-tnu terapijsku učinkovitost, što je uvelike promijenilo prognozu ovih bolesnika. Općenito gledano, to su lijekovi koji se uzimaju peroralno i imaju nisku stopu nuspojava što omogućava dobru suradljivost bolesnika. Uspješnost terapije provjerava se određivanjem HCV-RNA dvanaest tjedana nakon početka liječenja. Pregled novih, direktnih antivirotika u liječenju hepatitis C infekcije prikazan je u Tablici 4.31.
|
Tablica 4.31. Novi, direktni antivirusni lijekovi u liječenju hepatitis C infekcije
|
|
Terapijska skupina
|
Ciljna molekula
|
Primjer lijekova
|
|
Inhibitori serinske proteaze
|
NS34A serinska proteaza
|
Simeprevir, Grazoprevir, Glekaprevir
|
|
Nukleozidni inhibitori polimeraze
|
NS5B RNA-ovinsa RNA polimeraza
|
Sofosbuvir
|
|
Nenukleozidni inhibitori polimeraze
|
NS5B RNA-ovinsa RNA polimeraza
|
Dasabuvir
|
|
Inhibitori NS5A replikacijskoga kompleksa
|
NS5A replikacijski kompleks
|
Velpatasvir, Ledipasvir, Elbasvir
|
|
Inhibitor ciklofilina
|
Cikloflin
|
Alisporivir
|
Terapijska strategija. Liječenje kronične infekcije hepatitis C virusom u prvome redu ovisi o genotipu virusa, zbog čega je njegovo određivanje nužno prije početka liječenja. Preporuke se donose na razini odgovarajućih društava, na temelju brojnih studija i ispitivanja te su podložne stalnim izmjenama i dopunama. U Tablici 4.32. su prikazane preporuke za liječenje hepatitis C infekcije iz 2019. godine.
Liječenje hepatitisa i transplantacija jetre. Transplantacija jetre kod bolesnika s kroničnom infekcijom hepatitis C virusom indicirana je ako kod bolesnika ne postoji kontraindikacija za navedeni postupak, i kada im je MELD skor ≥ 15 i/ili imaju prisutan hepatocelularni karcinom po Milanskim ili San-Francisco kriterijima.
Kod donošenja odluke o transplantaciji jetre kod ovih bolesnika temeljno je pitanje treba li prvo transplantirati, a potom provoditi antivirusno liječenje ili najprije provesti antivirusno liječenje, a zatim transplantirati. Smjernice Europske hepatološke asocijacije (EASL) iz 2018. godine preporučuju sljedeće: 1) prvo transplantirati, a potom antivirusno liječiti treba: a) bolesnike s dekompenziranom cirozom jetre (Child Pugh B/C) i MELD skorom ≥ 18 - 20 te b) bolesnike s hepatocelularnim karcinomom i očekivanim vremenom čekanja na transplantacijskoj listi < 3 - 6 mjeseci; 2) prvo antivirusno liječiti, a potom procijeniti potrebu za transplantacijom treba kod: a) bolesnika s dekompenziranom cirozom jetre (Child Pugh B/C) i MELD skorom < 18 - 20; b) bolesnika s dekompenziranom cirozom jetre (Child Pugh B/C) i očekivanim vremenom čekanja na transplantacijskoj listi > 6 mjeseci te c) bolesnika s hepatocelularnim karcinomom i očekivanim vremenom čekanja na transplantacijskoj listi > 6 mjeseci.
Liječenje bolesnika koji su kandidati za transplantaciju jetre ovisi o nekoliko čimbenika: radi li se o bolesniku s dekompenziranom cirozom jetre i radi li se o bolesniku s hepatocelularnim karcinomom, što opet ovisi o tome ima li bolesnik u podlozi dekompenziranu (Child Pugh B/C) ili kompenziranu cirozu jetre (Child Pugh A) ili uopće nema cirozu u podlozi. U Tablici 4.33. navedene su osnovne kombinacije lijekova u pojedinih skupina bolesnika, iako su one proširene i mogu se naći u važećim smjernicama.
|
Tablica 4.33. Terapijska strategija liječenja bolesnika s kroničnim hepatitisom C koji su kandidati za transplantaciju
|
|
Bolesnici s dekompenziranom cirozom jetre, bez HCC-a
|
Genotip 1, 4, 5, 6: sofosbuvir + ledipasvir + ribavirin kroz 12 tjedana ili bez ribavirina kroz 24 tjedna
Svi genotipovi: sofosbuvir + velpatasvir + ribavirin kroz 12 tjedana ili bez ribavirina kroz 24 tjedna
|
|
Bolesnici s HCC-om i dekompenziranom cirozom jetre
|
Isti protokol kao i za bolesnike s dekompenziranom cirozom jetre bez HCC-a
|
|
Bolesnici s HCC-om i kompenziranom cirozom jetre
|
Genotip 1a, 4: sofosbuvir + ledipasvir kroz 12 tjedana za ranije neliječene ili grazopervir + elbasvir kroz 12 tjedana za HCV-RNA
Genotip 1b, 2, 5, 6: sofosbuvir + ledipasvir kroz 12 tjedana
Genotip 3: glecaprevir + pibrentasvir kroz 12 tjedana
|
|
Bolesnici s HCC-om bez ciroze jetre
|
Genotip 1a, 1b, 4, 5, 6 : sofosbuvir + ledipasvir kroz 8 do 12 tjedana
Genotip 2, 3: sofosbuvir + velpatasvir kroz 12 tjedana
|
Liječenje bolesnika s transplantiranom jetrom indicirano je kod svih bolesnika koji nisu izliječeni od HCV infekcije prije transplantacije te bolesnika koji imaju recidiv infekcije na transplantiranoj jetri. Liječenje započinje nakon prva tri mjeseca od transplantacije kada je bolesnik u stabilnoj fazi imunosupresivnoga liječenja. Preporuke za liječenje ove skupine bolesnika nalaze se u Tablici 4.34.
|
Tablica 4.34. Terapijska strategija liječenja bolesnika s kroničnim hepatitisom C i transplantiranom jetrom
|
|
Bolesnici s HCV infekcijom genotipa 1, 4, 5, 6
|
Stadij fibroze 0-3 ili kompenzirana ciroza jetre (Chid Pugh A): sofosbuvir + ledipasvir kroz 12 tjedana
Dekompenzirana ciroza jetre (Child Pugh B/C): sofosbuvir + ledipasvir + ribavirin kroz 12 tjedana ili bez ribavirina kroz 24 tjedna
|
|
Bolesnici s HCV infekcijom genotipa 2, 3
|
Stadij fibroze 0-3 ili kompenzirana ciroza jetre (Chid Pugh A): sofosbuvir + velpatasvir kroz 12 tjedana
Dekompenzirana ciroza jetre (Child Pugh B/C): sofosbuvir + velpatasvir + ribavirin kroz 12 tjedana ili bez ribavirina kroz 24 tjedna
|
|
Svi genotipovi uz klirens kreatinina < 30 ml/min
|
Stadij fibroze 0-3 ili kompenzirana ciroza jetre (Chid Pugh A): glecaprevir + pibrentasvir kroz 12 tjedana
|
Prognoza. U prosjeku 20 % bolesnika s kroničnom infekcijom hepatitis C virusom razvije cirozu jetre u periodu od dvadeset godina. Ciroza jetre ostaje u kompenziranoj fazi dugi niz godina s godišnjom stopom od 2 do 5 % progresije u dekompenziranu fazu. Nakon dekompenzacije stopa smrtnosti kod ovih bolesnika znatno raste i petogodišnje preživljenje kod njih iznosi 50 %. Kod bolesnika s razvijenom cirozom jetre godišnja stopa razvoja hepatocelularnoga karcinoma iznosi 2 do 4 %. Primjena novih lijekova značajno je povećala postotak uspješnosti liječenja (i do 95 %), što je značajno poboljšalo ukupno preživljenje i smanjenje stope progresije u cirozu i hepatocelularni karcinom.
KRONIČNI VIRUSNI HEPATITIS D
Kronična infekcija hepatitis D virusom moguća je samo u HBsAg pozitivnih bolesnika. Postotak razvoja kroničnoga hepatitisa D kod bolesnika s akutnom koinfekcijom HBV-om i HDV-om malen je i iznosi oko 2 %, dok je u slučaju superinfekcije taj postotak daleko veći i iznosi i do 90 %. Kod bolesnika s kroničnom infekcijom hepatitis D virusom ciroza jetre razvije se u više od 80 % slučajeva, a imaju i tri puta veći rizik od razvoja hepatocelularnoga karcinoma u odnosu na bolesnike koji imaju samo hepatitis B. Dijagnoza se potvrđuje serološkim i molekularnim metodama: visoka razina ukupnih i IgM Anti-HD protutijela kao i prisutna HDV-RNA. Osnovna terapija bazira se na primjeni klasičnoga ili pegeliranog interferona u visokim dozama.
KRONIČNI VIRUSNI HEPATITIS E
Hepatitis E infekcija gotovo je isključivo akutna bolest i prijelaz u kronični oblik bilježi se samo kod bolesnika s izraženom imunodeficijencijom, obično nakon transplantacije. Dijagnoza se temelji na detekciji IgM Anti-HEV antitijela te prisutnosti HEV-DNA u krvi ili stolici. Liječenje se temelji na primjeni pegeliranoga interferona ili ribavirina ili njihovoj kombinaciji.
OSTALE INFEKTIVNE BOLESTI JETRE
Osim virusnih hepatitisa koji predstavljaju glavne infektivne bolesti jetre, u kliničkoj se praksi mogu susresti i druge infektivne bolesti kao što su gnojna infekcija jetre te parazitarne bolesti.
GNOJNA INFEKCIJA (APSCES) JETRE
Definicija. Gnojna infekcija jetre predstavlja infektivnu bolest jetre koju uzrokuju piogene bakterije, a karakterizirana je formiranjem jednoga ili višestrukih apscesa (lokalizirana kolekcija gnoja i nekrotizirajućega materijala). Radi se o rijetkoj bolesti koja se prvenstveno javlja kod starijih i imunokompromitiranih osoba kod kojih je praćena visokom stopom smrtnosti (20 - 40 %).
Etiopatogeneza. Gnojna infekcija jetre može nastati na jedan od sljedećih načina: 1) hematogeno širenje putem hepatalne arterije za vrijeme septikemije (najčešći uzročnici su gram-pozitivne bakterije kao što su Streptococcus spp i Staphylococcus spp); 2) hematogeno putem portalne vene kod bolesnika s gnojnom upalom crijeva (najčešći uzročnici su gram-negativne bakterije kao što su E. coli i Klebsiella spp); 3) ascendentnim širenjem putem žučnih kanala kod bolesnika s gnojnim infekcijama bilijarnoga sustava (najčešće uslijed kolangitisa i kolecistitisa) te 4) izravnim širenjem uzročnika iz ostalih dijelova trbušne šupljine ili unosom s površine tijela (trauma, biopsija jetre). Infekcija navedenim patogenima dovodi do lokaliziranih oštećenja jetrenoga parenhima uz posljedičnu supuraciju (gnojenje), pri čemu organizam nastoji lokalizirati proces stvaranjem vezivne čahure – apscesa. Apscesi se najčešće formiraju u desnome jetrenom režnju.
Klinička slika. Bolest se obično manifestira akutnim simptomima kao što su vrućica, tresavica i zimica uz naglašenu bol i palpatornu napetost pod desnim rebrenim lukom. Kod dijela bolesnika može se razviti hepatomegalija te ikterus (u slučaju opstrukcije žučnih puteva samim apscesom). Kod jednoga dijela bolesnika simptomi mogu biti kronične naravi te se bolesnici primarno žale na umor, malaksalost, subfebrilne temperature, gubitak na tjelesnoj težini i sl.
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza te slikovnih metoda. U laboratorijskim nalazima obično su prisutni povišeni upalni parametri (leukocitoza, neutrofilija, povišeni C-reaktivni protein, povišeni fibrinogen) uz umjereno povišenje jetrenih transaminaza ili pokazatelja kolestaze. Ultrazvuk jetre osnovna je dijagnostička metoda pri sumnji na apsces jetre, a ultrazvučni nalaz mijenja se kroz vremenski tijek slijedeći rast i sazrijevanje apscesa. Prvi znak podrazumijeva nejasno ograničenu inhomogenu leziju s anehogenim arealima koji se postupno šire i zamjenjuju hipoehogene promjene, a s razvojem vezivne čahure lezija postaje jasno ograničena od ostaloga jetrenog parenhima s jasno uočljivom aerolikvidnom granicom. Nejasni ultrazvučni nalazi zahtijevaju izvođenje kompjuterizirane tomografije. Perkutana iglena punkcija daje konačnu dijagnozu s obzirom na to da nam omogućava dobivanje sadržaja same ciste koji se potom mikrobiološki analizira (mikrobiološka kultura apscesa).
Liječenje se sastoji od mirovanja, simptomatskih mjera (rehidracija, analgoantipireza) te primjene antiobiotika i eventualno perkutane drenaže apscesa. Kirurško liječenje rijetko je indicirano. U liječenju jetrenoga gnojnog apscesa najčešće se primjenjuje kombinacijska antimikrobna terapija koju čine ampicilin, gentamicin i metronidazol.
HEPATALNA AMEBIJAZA
Definicija i etiologija. Hepatalna amebijaza predstavlja parazitarnu bolest jestre koju uzrokuje ameba soja Entamoeba hystolitica koja u jetru dolazi putem portalne vene iz debeloga crijeva gdje se i nalazi primarno sijelo bolesti (intestinalna amebijaza).
Epidemiologija. Amebijaza se najčešće susreće u tropskim i subtropskim karajevima. Uzročnik se prenosi u obliku ciste, najčešće fekalno-oralnim putem prijenosa, a može i putem zagađenih ruku, hrane, vode ili predmeta. Velik epidemiološki problem čine parazitonoše, tj. osobe koje u lumenu debeloga crijeva nose amebu, a nemaju nikakvih kliničkih znakova.
Patogeneza. Entamoeba hystolitica hranom dospijeva u probavni trakt gdje naseljava proksimalni dio kolona. Trofoziti, pokretni oblici parazita, dovode do lokalnoga oštećenja crijevne sluznice putem histolitičkih enzima koje luče, pri čemu nastaju ulceracije kroz koje trofoziti dospijevaju u portalnu venu te krvnom strujom budu naneseni u jetru. Nastavljajući lučenje histolitičkih enzima, trofoziti u jetri stvaraju brojne mikroapscese koji se šire i fuzioniraju u jedan veći, makroskopski vidljiv apsces. Amebni hepatalni apscesi ispunjeni su crvenkasto-smeđim gustim sadržajem koji se sastoji od nekrotičkoga tkiva jetre, krvi, upalnih stanica i trofozita. Iz jetre trofoziti dalje mogu dospjeti u pluća i pleuralnu šupljinu (krvlju ili direktno), a iz pluća u druge dijelove tijela (mozak, koža, slezena).
Klinička slika. Simptomi i znakovi hepatalne amebijaze su nespecifični. Bolesnici se mogu žaliti na opće infektivne simptome (vrućica, umor, malaksalost, artralgije, mialgije) uz bol i palpatornu osjetljivost pod desnim rebrenim lukom. Bolesnici često imaju znakove intestinalne amebijaze (tenezmi, proljevaste stolice s primjesama krvi). Žutica se rijetko razvije.
Dijagnoza se postavlja na temelju anamnestičkih podataka (bitan je podatak o putovanju u tropske krajeve), kliničke slike, laboratorijskih nalaza, slikovnih metoda te serološke dijagnostike uz perkutanu aspiraciju apscesa. Laboratorijski nalazi nisu specifični, otkriva se umjerena leukocitoza, eozinofilija te povišeni C-reaktivni protein uz različito izražene patološke jetrene nalaze. Slikovne metode (ultrazvuk, kompjuterizirana tomografija) mogu pokazati na prisutnost apscesa unutar jetrenoga parenhima. Točnu etiološku dijagnostiku omogućavaju serološke pretrage (određivanje titra antitijela na E. histolytica) te mikrobiološka obrada sadržaja dobivenoga iz apscesa putem perkutane iglene punkcije.
Liječenje se sastoji od primjene metronidazola u dozi od 3 x 800 mg kroz deset dana. U slučaju perzistiranja simptoma unatoč antimikrobnoj terapiji u obzir dolazi perkutana drenaža ili kirurška intervencija.
EHINOKOKOZA
Definicija i etiologija. Hepatalna ehinokokoza je parazitarna bolest jetre koja nastaje kao posljedica infestacije ehinkokokima (Echinococcus granulosus, Echinococcus mutilocularis), a karakterizira ju stvaranje jedne ili više hidatidnih cista. Infekcija u ljudi nastaje unosom jajašaca uzročnika u probavni sustav iz prirode kamo dospijevaju iz probavnoga sustava životinja (ovce, psi).
Patogeneza. Nakon unosa jajašaca uzročnika u probavni sustav iz njih se razvijaju onkosfere koje portalnom cirkulacijom dospijevaju u jetru gdje se zbog promjera većeg od promjera jetrenih kapilara zadržavaju te se iz njih razvijaju ličinke koje se formiraju u hidatidne ciste. U svome konačnom obliku hidatidna cista ima tri sloja: vanjski sloj kojeg čini debela, acelularna, eozinofilna membrana koja nastaje kao odgovor domaćina na prisutnost i rast ciste, srednji slojeviti sloj i unutarnji, germinalni sloj. Samu šupljinu ciste ispunjava granulirani sadržaj u kojemu se nalaze skoleksi ehinokoka (dijelovi trakavice pomoću kojih se one hvataju za druga tkiva i organe). Patogeni učinak ostvaruje se rastom i mehaničkim pritiskom na okolni parenhim jetre u značajnijoj mjeri nego antigenim ili toksičnim učinkom. Hidatidna cista raste i po nekoliko desetaka godina i može narasti do veličine jabuke, a u nekim slučajevima i dječje glave.
Klinička slika. Ciste su uglavnom asimptomatske, a simptomatične postanu kada zbog pritiska na žučne vodove izazovu ikterus ili dođe do razvoja infekcije unutar ciste. Simptomi infekcije su povišenje temperature, bol pod desnim rebrenim lukom, podražaj frenikusa i opće loše stanje. Cista se nekada prvi puta može očitovati nastupom neke od komplikacija.
Komplikacije. Hidatidna cista može ruptuirati u trbušnu šupljinu, može se sekundarno inficirati te izazvati opstrukciju bilijarnoga sustava. Kod rupture ciste u slobodnu trbušnu šupljinu može se razviti anafilaksija i nadražaj peritoneuma. Ruptura u žučne vodove dovest će do ikterusa i kolangitisa, a prodor u prsište izaziva anafilaktičke simptome i akutni pleuritis.
Dijagnoza se obično postavlja slučajnim nalazom cistične formacije jetre tijekom izvođenja slikovnih pretraga trbuha zbog neke druge indikacije. Laboratorijski nalazi nisu specifični, ali kod oko 30 do 50 % bolesnika može se otkriti periferna eozinofilija. Konačnu etiološku dijagnozu omogućavaju serološke pretrage te analiza sadržaja ciste. Instrumentalne manipulacije cistom nose rizik od rupture i rasapa uzročnika po slobodnoj trbušnoj šupljini. Karakteristike hidatidnih cista prikazanih slikovnim metodama su nalaz hidatidnoga pijeska i nalaz kćeri cista u okolnome jetrenom parenhimu.
Liječenje. Osnovu liječenja čini primjena antihelmintika (albendazol 2 x 400 mg kroz nekoliko mjeseci). Ako se radi o velikim simptomatskim cistama, u obzir dolazi i perkutana drenaža ili kirurška resekcija uz obveznu prijeproceduralnu kemoprofilaksu (albendazol) zbog visokoga rizika od rupture tijekom instrumentalizacije.
Definicija. Autoimuni hepatitis predstavlja autoimuno oboljenje jetre karakterizirano kroničnom, rekurirajućom upalom obilježenom nekrozom hepatocita, fibrozom i cirozom, uz prisutnosti specifičnih autoantitijela u serumu te hipergamaglobulinemije.
Epidemiologija. Bolest se može javiti u bilo kojoj životnoj dobi, ali najčešće se javlja između 15. i 25. godine te između 45. i 60. godine života. Također, bolest se znatno češće javlja kod žena i smatra se da preko 70 % oboljelih čine žene. Procijenjena incidencija autoimunoga hepatitisa iznosi 1,7 na 100 000 stanovnika. Bolest je često udružena s drugima autoimunim bolestima, tako da više od 40 % bolesnika ima pozitivnu obiteljsku anamnezu na autoimuna oboljenja, a više od 20 % bolesnika ima dodatno autoimuno oboljenje (reumatoidni artritis, tireoiditis, Sjögrenov sindrom, perniciozna anemija i dr.).
Etiopatogeneza. Točan uzrok i mehanizam razvoja autoimunoga hepatitisa nije poznat. Kao i kod ostalih autoimunih oboljenja, glavnu ulogu imaju genetska predispozicija te izlaganje nekom, za sada nepoznatom, okidaču koji potiče cijelu reakciju. Genetsku predispoziciju za razvoj autoimunoga hepatitisa imaju osobe s HLA-B8, HLA-B14, HLA-DR3, HLA-DR4 te HLA-Dw3 haplotipom. Iako nije jasno potvrđeno, kao mogući okidači najčešće se spominju virusi (Epstein-Barrov virus, virus hepatitisa A, B i C) te neki lijekovi (nitrofurantion, hidralazin, metildopa, infliksimab). Sadašnje spoznaje sugeriraju da je oštećenje jetre u autoimunom hepatitisu dijelom posljedica stanično posredovane imunosti (citotoksični učinak CD4+ limfocita T), a dijelom posljedica humoralne imunosti (rezultat interakcije autoantitijela sa specifičnim antigenima eksprimiranima na površini hepatocita). Početno oštećenje rezultira razvojem nekroze hepatocita, što u kasnijim fazama zamjenjuje fibrozni proces koji uvjetuje razvoj ciroze.
Patologija. Autoimuni hepatitis nema specifično ili patognomonično patohistološko obilježje i teško ga je razlikovati od drugih kroničnih oblika hepatitisa. Glavna značajka autoimunoga hepatitisa visoka je aktivnost upale, a upalni infiltrat dominantno čine limfociti i plazma stanice. Upala je najizraženija u portalnim prostorima, a širi se i na lobule uz mnoštvo rubnih i premošćujućih nekroza. Kasnije, tijekom vremena, u područjima nekroze dolazi do vezivne pregradnje i razvoja ciroze jetre.
Klinička slika. S obzirom na kliničke i laboratorijske (serološke) karakteristike, kao i odgovor na terapiju, razlikuju se tri oblika autoimunoga hepatitisa: tip I, tip II i tip III.
Osnovna klinička obilježja. Autoimuni hepatitis karakterizira dug asimptomatski period, a bolesnici se najčešće dijagnosticiraju obradom slučajno nađenih patoloških vrijednosti jetrenih transaminaza. Simptomatsku bolest karakteriziraju prodromalni, nespecifični simptomi koji traju mjesecima ili godinama, a uključuju slabost, mučninu, povraćanje, žuticu, nelagodu u gornjem abdomenu te anoreksiju i gubitak na tjelesnoj težini. Mogu se naći i artralgije, mialgije te kožni osipi. Kasnije, u kliničkom tijeku bolesti razvija se klasična klinička slika ciroze jetre.
Specifična klinička obilježja ovise o tipu autoimunoga hepatitisa (tip I, II ili III) i prikazana su u Tablici 4.35.
Dijagnoza autoimunoga hepatitisa postavlja se na temelju kliničkoga nalaza, općih i specifičnih laboratorijskih nalaza te slikovnih dijagnostičkih metoda i biopsije jetre. Dijagnoza se u kliničkoj praksi najčešće postavlja na temelju obrade slučajno otkrivenih povišenih vrijednosti jetrenih transaminaza.
Opći laboratorijski nalazi. Kod ovih bolesnika dominantno nalazimo povišene vrijednosti jetrenih transaminaza (AST i ALT) koje se kreću između 100 i 1000 U/L uz umjereno povišene markere kolestaze (alkalna fosfataza, bilirubin). Često se otkriju i normokromna, normocitna anemija uz umjerenu trombocitopeniju i leukopeniju. Protombinsko vrijeme može biti produženo.
Specifični laboratorijski nalazi uključuju hipergamaglobulinemiju te nalaz specifičnih autoantijela: antinuklearna antitijela (ANA), antitijela na glatku muskulaturu (AGLM), antitijela na mikrosome jetre i bubrega (anti-LKM1), antitijela na topljive jetrene antigene (anti-SLA), antitijela na antigene jetre i gušterače (anti-LP), perinuklearna antineutrofilna citoplazmatska antitijela (pANCA), antitijela na asijaloglikoproteinski receptor (anti-ASGP-R, antiaktinska antitijela (AAA), antitijela na jetreni citosolni antigen tip 1 (anti-LC1) te antimitohondrijska antitijela (AMHA). Pojavnost specifičnih antitijela prema tipu bolesti prikazana je u Tablici 4.35.
Slikovne dijagnostičke metode i biopsija bubrega služe kao nadopuna laboratorijskim nalazima. Ultrazvuk jetre može prikazivati umjereno do naglašeno grubi, iregularni i hiperehogeni jetreni parenhim uz nepravilne i zaobljene jetrene konture. Kasnije se mogu registrirati i dilatacija portalne vene, splenomegalija te hilarna limfadenopatija. Biopsija jetre potvrđuje dijagnozu, a služi i za procjenu same težine bolesti. Histopatološki nalaz opisan je prethodno u tekstu, a kako nije patognomoničan za autoimuni hepatitis i može se naći i u drugih kroničnih hepatitisa, konačnu dijagnozu postavlja se uzimanjem u obzir svih dijagnostičkih kriterija.
|
Tablica 4.35. Karakteristike i dijagnostički kriteriji za autoimuni hepatitis
|
|
Kliničko-laboratorijski pokazatelj
|
Autoimuni hepatitis tip I
|
Autoimuni hepatitis tip II
|
Autoimuni hepatitis tip III
|
|
Učestalost
|
75 - 80 %
|
15 - 20 %
|
10 %
|
|
Dobna pojavnost
|
15 do 30 god
|
oko 10 god
|
20 do 40 god
|
|
Spolna pojavnost (žene)
|
78 %
|
89 %
|
90 %
|
|
Klinički tijek
|
Indolentan
|
Akutni/fulminantni
|
Indolentan
|
|
Progresija u cirozu
|
45 %
|
82 %
|
75 %
|
|
Pridružene bolesti
|
tireoiditis, ulcerozni kolitis
|
vitiligo, šećerna bolest tip I
|
tireoiditis, ulcerozni kolitis
|
|
Specifična autoantitijela
|
ANA, AGLM
|
Anti-LKM1
|
Anti-SLA, Anti-LP
|
|
Pridružena autoantitijela
|
pANCA, Anti-ASGP-R
|
Anti-LC1, Anti-ASGP-R
|
ABA, AGLM, AMHA
|
|
Hipergamaglobulinemija
|
+++
|
+
|
++
|
|
Odgovor na kortikosteroide
|
+++
|
++
|
+++
|
|
Dijagnostički kriteriji za autoimuni hepatitis: 1) autoantitijela (1 bod za titar > 1:40, 2 boda za titar > 1:80); 2) hipergamaglobulinemija (1 bod za razinu < 30 g/L; 2 boda za razinu > 30 g/L); 3) histološki nalaz (1 ili boda ovisno o izraženosti promjena); 4) negativni serološki nalazi za kronični virusni hepatitis (2 boda). Zbroj bodova veći od 7 ukazuje na autoimuni hepatitis.
|
Diferencijalna dijagnoza autoimunoga hepatitisa je široka, ali u prvom redu u obzir dolaze kronične forme virusnih hepatitisa (hepatitis B, C) te medikamentozni hepatitis.
Liječenje. Osnovu liječenja čine kortikosteroidna i imunomodulatorna terapija, a rjeđe se primjenjuje sama kortikosteroidna terapija. U nastavku teksta prikazane su indikacije za početak liječenja te osnove inicijalnoga liječenja, liječenja relapsa bolesti te liječenje bolesnika koji ne pokazuju zadovoljavajući odgovor na standardne oblike liječenja.
Indikacije za specifično liječenje. Glavne indikacije za početak specifičnoga liječenja su: 1) izrazit porast jetrenih transaminaza (deset ili više puta od gornje granice referentnih vrijednosti), 2) umjeren porast jetrenih transaminaza (pet ili više puta od gornje granice referentnih vrijednosti) uz vrijednosti imunoglobulina dvostruko veće od normale te 3) histološki nalaz koji uključuje multilobularne ili premošćujuće nekroze.
Inicijalno liječenje. Liječenje započinje kombinacijom prednizona i azatioprina ili, rjeđe, primjenom samoga prednizona. Početne se doze tijekom nekoliko tjedana smanjuju do vrijednosti korištenih u dozi održavanja (Tablica 4.36.). Kod većine bolesnika kliničko poboljšanje postiže se gotovo trenutno, dok se normalizacija nalaza postiže kroz jednu do dvije godine, a normalizacija histološkoga nalaza kasni tri do šest mjeseci za biokemijskom rezolucijom bolesti. Zbog moguće depresije koštane srži uslijed navedene terapije, bolesnicima je potrebno u prvih tri do šest mjeseci terapije češće kontrolirati krvnu sliku. Navedenim se načinom liječenja remisija (normalizacija biokemijskih i histološkoga nalaza) postiže kod više od 80 % oboljelih, a nakon postizanja remisije terapiju treba provoditi još tri godine.
|
Tablica 4.36. Shematski prikaz liječenja autoimunoga hepatitisa
|
|
Shema liječenja
|
1. tjedan
|
2. tjedan
|
3. tjedan
|
4. tjedan
|
Održavanje
|
|
Monoterapija
|
Prednizon (mg/d)
|
60
|
40
|
30
|
30
|
20
|
|
Kombinacijska terapija
|
Prednizon (mg/d)
|
30
|
20
|
15
|
15
|
10
|
|
Azatioprin (mg/d)
|
50
|
50
|
50
|
50
|
50
|
Liječenje relapsa bolesti. Relaps bolesti liječi se iznova inicijalnim liječenjem (kombinacija prednizona i azatioprina) čime se postiže jednaka stopa remisije (> 80 %).
Liječenje bolesnika koji ne reagiraju na klasično liječenje. Kod bolesnika kod kojih se ne postiže kliničko poboljšanje, definirano izostankom pada vrijednosti jetrenih transferaza za više od 50 % nakon šest mjeseci liječenja, u obzir dolazi liječenje ciklosporinom, takrolimusom, sirolimusom, everolimusom, metotreksatom ili rituksimabom ili infliksimabom. U najtežim oblicima i kod bolesnika koji ne reagiraju na navedene načine liječenja, indicirana je transplantacija jetre, a bolest se vrati kod više od 70 % transplantiranih bolesnika tijekom pet godina nakon transplantacije.
Prognoza u prvome redu ovisi o histološkom nalazu koji upućuje na težinu i opseg promjena. Ciroza će se razviti kod oko 20 % bolesnika s histološkim nalazom portalnoga hepatitisa i kod oko 80 % bolesnika s nalazom premošćujuće ili multilobularne nekroze u vremenskom periodu od pet godina od postavljanja dijagnoze. Ukupno gledano, u većine bolesnika (> 80 %) postiže se remisija bolesti primjenom prednizona i azatioprina, ali za trajnu remisiju obično je potrebno doživotno liječenje.
OŠTEĆENJA JETRE UZROKOVANA LIJEKOVIMA I TOKSINIMA
Definicija i epidemiologija. Oštećenje jetre uzrokovano lijekovima i drugim toksinima definira se kao oštećenje jetre praćeno određenim stupnjem poremećene jetrene funkcije, a povezuje se s uzimanjem lijekova ili izlaganjem određenim toksinima. U zapadnim je zemljama oštećenje jetre lijekovima i drugim toksinima odgovorno za više od 50 % slučajeva akutnoga jetrenog zatajenja i hepatalne encefalopatije. Stvarnu učestalost ovih poremećaja teško je utvrditi s obzirom na to da se veliki dio njih i ne prijavi, a procjenjuje se da se učestalost medikamentozne lezije jetre u europskim zemljama kreće oko 20 slučajeva na milijun stanovnika na godinu. U daljnjem dijelu teksta razmotrit će se patofiziološka i patohistološka osnova toksične lezije jetre.
Patofiziološka osnova toksične lezije jetre. S obzirom na patofiziološki mehanizam nastanka toksične lezije jetre, razlikujemo predvidivo (direktno) i nepredvidivo (idiosinkrazija) oštećenje jetre (Slika 4.10.).
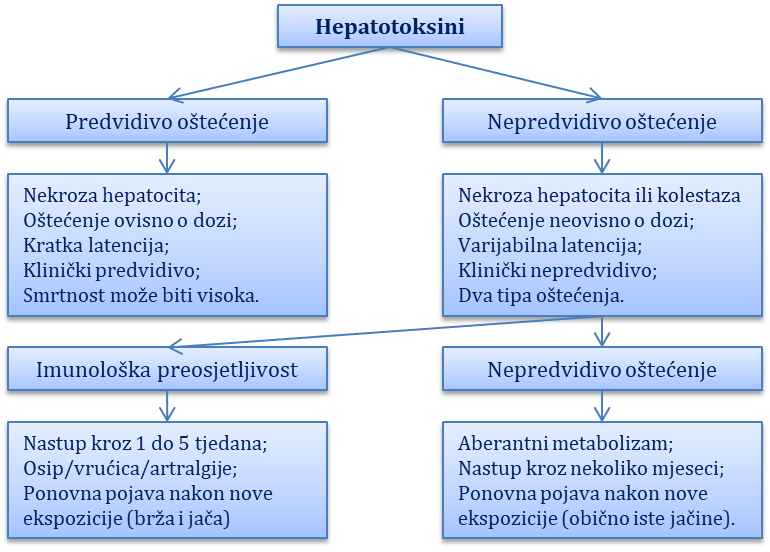
Slika 4.10. Patofiziološka osnovna nastanka toksične lezije jetre.
Predvidivo oštećenje jetre predstavlja rjeđi oblik toksične lezije jetre koje nastaje kao posljedica direktnoga učinka toksina na jetru. Oštećenje je posredovano toksičnim produktima koji nastaju kao posljedica metabolizma u jetri, a oni različitim mehanizmima mogu dovesti do poremećaja strukture i funkcije hepatocita i drugih stanica. Ovaj mehanizam nastanka toksične lezije jetre nazivamo predvidivim jer ima sličan, gotovo identičan obrazac razvoja kod svih osoba (klinički se može predvidjeti), težina oštećenja ovisna je o dozi (što je veća doza toksina, to je i oštećenje teže) te ima jasan vremenski interval u kojemu se oštećenje jetre javlja (oštećenje nastaje kratko nakon unosa toksina u organizam pa ih je lako uzročno-posljedično povezati). Neki od klasičnih primjera toksina koji dovode do oštećenja jetre tim mehanizmom su paracetamol (acetaminofen), otrov nekih gljiva (Amanita phalloides, Amanita virosa – zelena i smrdljiva pupavka), tetraklor-ugljik (organsko otpalo), fosfor i dr.
Nepredvidivo oštećenje jetre znatno je češći oblik nastanka toksične lezije jetre, a radi se o idiosinkratičnoj reakciji, odnosno sklonosti određene osobe da pokrene hipersenzitivnu imunološku reakciju na određeni agens ili da ima drugačiji put metabolizma agensa u odnosu na ostatak populacije. Prema tome, oštećenje može biti posljedica hipersenzitivnosti limfocita na novonastale epitope na površini hepatocita ili kao i kod predvidivoga oštećenja nastane reaktivni metabolički spoj koji izravno dovede do oštećenja. Ovaj se mehanizam nastanka toksične lezije jetre naziva nepredvidivim zbog nekoliko činjenica: veličina oštećenja ne korelira s dozom (ne može se predvidjeti), vremenski intervali između unosa toksina i razvoja oštećenja različiti su i nestalni (obično više od nekoliko dana i tjedana), a stupanj oštećenja jetre različit je kod različitih pojedinaca. Jedan od glavnih razloga tih različitosti je i individualna genetska raznolikost (polimorfizmi CYP izoenzima, hepatobilijarnih transportera te HLA polimorfizmi). Također, karakteristična je za ovaj mehanizam i činjenica da pri ponovnom unosu istoga toksina nastupa oštećenje jače nego prethodno i da se razvija znatno brže nego prvi puta, što je uvjetovano ranijom senzibilizacijom. Većina lijekova do oštećenja jetra dovodi tim mehanizmom oštećenja (amiodaron, halotan, klorpromazin, iznoiazid, sulfonamidi, diklofenak, aspirin, fluorokinoloni i dr.). Ove se reakcije javljaju rijetko, manifestacija je obično akutna, a do oporavka dolazi vrlo brzo nakon ukidanja ekspozicije.
Patohistološka osnova toksične lezije jetre. S obzirom na patohistološke promjene koje nastaju uslijed djelovanja toksina, razlikujemo nekoliko oblika toksične lezije jetre od kojih su najznačajnije hepatocelularna i kolestatska toksična lezija jetre (Tablica 4.37.).
Hepatocelularna toksična lezija jetre najčešći je oblik oštećenja jetre uzrokovan lijekovima i drugim toksinima te se javlja u više od 90 % slučajeva. Histološki nalaz uključuje nekrozu hepatocita s popratnom infiltracijom upalnim stanicama među kojima su najznačajniji limfociti i eozinofili. Opseg nekroze je različit te se kreće od zonalnih do masivne nekroze koja dovodi do teške jetrene insuficijencije, hepatalne encefalopatije i smrti bolesnika. Kod ovoga oblika toksične lezije jetre u laboratorijskim se nalazima primjećuje nagao porast vrijednosti jetrenih transaminaza.
Kolestatska toksična lezija jetre rjeđi je patohistološki oblik toksične lezije jetre čije je glavno obilježje nastanak kolestaze, ikterusa i pruritusa. Može nastati na dva načina: neinflamatornim i inflamatornim mehanizmom. Neinflamatorni mehanizmi podrazumijevaju interferiranje toksičnih metabolita s hepatobilijarnim transportnim sustavom, pri čemu dolazi do funkcionalnoga poremećaja u intrahepatičnom dijelu metabolizma bilirubina i posljedične hiperbilirubinemije, a može se naći poglavito kod primjene oralnih kontraceptiva (estrogeni), anabolnih steroida te antagonista spolnih hormona (npr. tamoksifen). Inflamatorni mehanizam (kolestatski hepatitis) podrazumijeva razvoj upale i oštećenja stanica bilijarnoga kanalnog sustava uz slabije izraženo hepatocelularno oštećenje, a može se javiti kod uzimanja različitih lijekova (amoksilicilin, azitromicin, penicilinamin, azatioprin, celekoksib, merkaptopurin i dr.).
Ostali patohistološki oblici toksične lezije jetre uključuju masnu promjenu jetre, nastanak granulomatozne reakcije (alopurinol, fenitoin, pirazinamid), fibrozu i cirozu jetre (metotreksat, vitamin A), venookluzivnu bolest jetre (busulfan, gemtuzumab ozogamicin, oksaliplatina) te peliozu jetre (anabolni steroidi, anabolni steroidi).
|
Tablica 4.37. Oblici toksične lezije jetre
|
|
Tip oštećenja
|
Biokemijski profil
|
Prognoza
|
|
Hepatocelularna toksična lezija
|
ALT dva puta viša od gornje granice
Omjer ALT/ALP >5
|
Akutna prezentacija, teža prognoza
|
|
Kolestatska toksična lezija
|
ALP dva puta viša od gornje granice
Omjer ALT/ALP
|
Sklonost razvoju kroničnoga oštećenja
|
|
Mješovita toksična lezija
|
ALT dva puta viša od gornje granice
Omjer ALT/ALP između 2 i 5
|
Sklonost razvoju kroničnoga oštećenja
|
Rizični čimbenici koji pogoduju nastanku toksične lezije jetre su: starija životna dob (dob > 60 godina) i dječja dob, ženski spol, genetska predispozicija (CYP polimorfizam i dr.), prisutnost prethodnih reakcija na lijekove, polipragmazija, narušen nutritivni status (pothranjenost i pretilost), jetrena bolest u podlozi te druge kronične bolesti kao što su šećerna bolest, kronična bolest bubrega i sl.
Klinička slika toksične lezije jetre je nespecifična i može znatno varirati u svojoj težini. Kod nekih se bolesnika može manifestirati asimptomatskim porastom jetrenih transaminaza, kod nekih srednje izraženim simptomima i znakovima koje možemo naći i kod drugih akutnih hepatitisa (umor, mučnina, povraćanje, bol i napetost pod desnim rebrenim lukom, ikterus), a u najtežim oblicima može dovesti do akutnoga jetrenog zatajenja koje može biti i smrtonosno. Kod jednoga dijela bolesnika može se kao posljedica dugotrajnoga izlaganja hepatotoksinu razviti i kronični hepatitis, koji je obično asimptomatske prirode i prezentira se samo patološkim laboratorijskim nalazima.
Dijagnoza toksične lezije jetre postavlja se na osnovi kliničke indicije te pomno uzetih anamnestičkih podataka. Laboratorijski nalazi koji ukazuju na toksičnu leziju jetre (povišene jetrene transaminaze, povišeni kolestatski markeri, produljeno protrombinsko vrijeme i sl.) ne razlikuju se od akutnih oboljenja jetre druge etiologije. Glavne su dijagnostičke preporuke za postavljanje dijagnoze toksične lezije jetre: 1) kod svake lezije jetre treba promišljati o mogućem učinku lijekova ili drugih hepatotoksina; 2) uzeti što detaljniju anamnezu koja mora sadržavati podatke o lijekovima koje je bolesnik uzimao, kao i mogućem unosu drugih hepatotoksina (npr. gljive); 3) potrebno je procijeniti vrijeme latencije, tj. vremenski period od izlaganja do kliničke manifestacije (kod toksične lezije jetre uglavnom je to period od nekoliko dana do osam tjedana); 4) potrebno je proučiti literaturu o mogućim reakcijama i nuspojavama lijekova i toksina kojima je bolesnik bio izložen; 5) potrebno je provesti klasičnu dijagnostičku obradu sa svrhom isključenja drugih uzroka jetrenoga oštećenja (virusni hepatitis, bilijarna bolest i sl.); 6) potrebno je isključiti potencijalni lijek i procijeniti učinak prekida izlaganja lijeku ili potencijalnom hepatotoksinu (kod toksične lezije jetre prati se normalizacija laboratorijskih pokazatelja hepatocelularne nekroze unutar dva mjeseca te pokazatelja kolestaze unutar šest mjeseci) te 7) u nejasnim slučajevima treba razmotriti biopsiju jetre i histopatološku analizu. U neizravnoj procjeni povezanosti lezije jetre s toksičnim učinkom lijeka usavršene su različite skale i skorovi od kojih su najčešće korištene: RUCAM skor (engl. Roussel Uclaf Causality Assessment Method), M&V skor (engl. Maria & Victorino score) te DDW-J metoda (engl. Digestive Disease Week-Japan). Svi ti sustavi i skorovi dostupni su na internetu, koji omogućava brz unos podataka i interpretaciju nalaza.
Diferencijalna dijagnoza uključuje druge oblike hepatitisa i lezije jetre (virusni hepatitis, alkoholna bolest jetre, nealkoholna masna jetra, autoimuni hepatitis i dr.), kolestaza (primarni sklerozirajući kolangitis, primarna bilijarna ciroza, kolestaza u trudnoći), masna promjena jetre, granulomatozni hepatitis (sarkoidoza, tuberkuloza), pelioza jetre i sl.
Liječenje toksične lezije jetre podrazumijeva prekid izlaganja suspektnom lijeku ili hepatotoksinu, opće potporne mjere liječenja i nadzora (volumna resuscitacija, liječenje jetrenoga zatajenja) te primjenu specifičnih antidota (npr. N-acetilcistein kod oštećenja uzrokovanoga paracetamolom ili penicilin G i tioktična kiselina kod trovanja gljivama) što je opisano u odgovarajućim dijelovima. U najtežim oblicima jetrenoga oštećenja može biti indicirana i transplantacija jetre (indikacije prema King's College kriterijima – Tablica 4.38.).
|
Tablica 4.38. Indikacije za transplantaciju jetre u akutnoj toksičnoj leziji jetre (King's College Criteria).
|
|
Toksična lezija jetre uzrokovana acetaminofenom
|
Toksična lezija jetre uzrokovana drugim lijekovima i toksinima
|
|
pH < 7.3
|
INR > 6.5 ili bilo koja tri sljedeća kriterija:
|
|
Laktati > 3.5 nM nakon 8 sati
|
|
|
Laktati > 3.0 nM nakon 12 sati
|
|
|
Kreatinin > 300 mmol/L
|
|
|
INR > 6.5
|
- Dob između 10 i 40 godina
|
|
Encefaloptaija 3. - 4. stupanj
|
- Etiologija: reakcija na lijek ili nepoznato
|
Prognoza. Ukupno gledano, ako se na vrijeme prepozna i prekine izlaganje potencijalnom hepatotoksinu, većina se bolesnika u potpunosti oporavi. Prognoza je i bolja kod bolesnika koji su imali pretežno kolestatsko oštećenje u odnosu na one koji su imali dominantno hepatocelularno oštećenje. Loš prognostički znak imaju bolesnici čije su vrijednosti AST-a i ALT-a veće od tri puta od gornje referentne vrijednosti ili alkalne fosfataze veće od 1.5 puta od gornje referentne vrijednosti (tzv. Hyjevo pravilo, prema autoru Hymanu Zimmermanu). Kod bolesnika s razvijenom koagulopatijom ili hepatalnom encefalopatijom smrtnost se penje na 60 do 80 %. Kroničnu jetrenu bolest nakon akutne toksične lezije razvije 6 % bolesnika.
HEPATOTOKSIČNOST NAJČEŠĆIH LIJEKOVA
Acetaminofen. Toksična lezija jetre uzrokovana acetaminofenom (paracetamol) klasičan je i najčešći primjer akutne toksične lezije jetre uzrokovane lijekovima. Radi se o predvidivom oštećenju koje nastaje uslijed metabolizma lijeka preko CYP2E1, CYP1A2 i CYP3A4 enzima pri čemu nastaje intermedijarni toksični metabolit N-acetil-p-benzo-kvinon imin (NAPQI) koji može stupiti u različite interakcije s intracelularnim proteinima i uzrokovati smrt hepatocita. Toksični učinak NAPQI na hepatocite neutralizira glutation te hepatotoksičnost nastaje kada se zalihe glutationa iscrpe ili proizvodnja NAPQI premaši kapacitet vezanja na glutation. Smanjenu razinu glutationa nalazimo u kroničnih alkoholičara tako da kod njih i manje doze acetaminofena (2 - 4 g/dan) mogu uzrokovati tešku leziju jetre. Klinička manifestacija toksične lezije jetre uzrokovane acetaminofenom odvija se kroz dvije faze. Prvi se simptomi javljaju 24 sata nakon uzimanja acetaminofena, a uključuju mučninu, povraćanje i slabost te se povlače kroz sljedeća 24 sata. Znaci hepatocelularnoga oštećenja javljaju se između 72 i 96 sati od uzimanja acetaminofena, a uključuju naglo nastale bolove u trbuhu, žuticu, mučninu i povraćanje te, ovisno o težini i opsegu oštećenja, i druge znakove akutnoga jetrenog zatajenja (encefalopatija, koagulopatija). Dijagnoza se postavlja na osnovi anamnestičkih podataka, vremenskoga slijeda kliničkih manifestacija te patoloških laboratorijskih nalaza (povišenje jetrenih transaminaza, hiperbilirubinemija, produljeno protrombinsko vrijeme, metabolička acidoza, hiperlaktatemija). Ultrazvuk jetre u kombinaciji s obojenim doplerom služi za isključenje drugih mogućih uzroka akutnoga jetrenog zatajenja (npr. vaskularni poremećaji). Biopsija jetre rijetko je indicirana. Liječenje se sastoji od prekida izlaganja lijeku (prekid uzimanja, lavaža želuca ima smisla samo ako je prošlo do četiri sata od posljednjoga uzimanja lijeka) te intravenskoj ili peroralnoj primjeni antidota - N-acetilcistein (peroralna primjena kroz 72 sata: 140 mg/kg jednokratno, a zatim 70 mg/kg svaka četiri sata). Većina se bolesnika uz potporne mjere liječenja i primjenu antidota u potpunosti oporavi, a manji dio razvije masivnu nekrozu jetre koja će zahtijevati transplantaciju.
Amiodaron je jedan od najčešće primjenjivanih antiaritmika koji se danas koristi u liječenju različitih kako ventrikulskih tako i supraventrikulskih tahiaritmija. Primjena amiodarona povezana je s različitim neželjenim pojavama koje su obično posljedica dugotrajnoga peroralnoga unosa i akumulacije lijeka u stanicama. Asimptomatsko povišenje serumskih transaminaza kao posljedica dugotrajne peroralne primjene amiodarona susreće se kod oko 25 % bolesnika, dok će se kod manje od 3 % razviti simptomatska lezija jetre. Akutna lezija jetre nakon intravenske primjene amiodarona znatno je rjeđa nuspojava te se javlja kod manje od 1 % bolesnika. Točan mehanizam nastanka akutne lezije jetre nakon intravenskoga unosa lijeka nije do kraja razjašnjen, a spominje se nekoliko mogućih hipoteza: direktan toksičan učinak amiodarona na hepatocite, toksičan učinak otapala polisorbit-80 koji se nalazi u sastavu pripravka amiodarona za intravensku primjenu te amiodaronom inducirana hipotenzija koja dovodi do smanjenoga perfuzijskog tlaka jetre i posljedične ishemije. Ovo akutno oštećenje jetre nakon intravenske primjene amiodarona predstavlja zaseban klinički entitet u odnosu na leziju jetre uslijed dugotrajnoga peroralnog unosa lijeka i međusobno nisu povezani. Povišenje serumskih transaminaza u akutnoj leziji jetre nakon intravenske primjene amiodarona bilježi se već unutar 24 sata od primjene lijeka, a vrijednosti budu povišene i više desetaka puta u odnosu na gornje referentne vrijednosti te se bilježi brzi pad i normalizacija vrijednosti ubrzo nakon prekida primjene lijeka. Povišenje serumskih transaminaza uslijed dugotrajne peroralne primjene javlja se nakon dužega perioda od početka primjene lijeka te su vrijednosti obično naznačeno povišene. Peroralna primjena amiodarona nije kontraindicirana kod bolesnika koji su prethodno razvili akutnu leziju jetre uslijed intravenske primjene, no zahtijeva češću kontrolu serumskih transaminaza te pokazatelja bubrežne funkcije. Osim akutne lezije jetre zabilježene su i druge, rjeđe nuspojave intravenske primjene amiodarona kao što su akutna ozljeda bubrega, akutni respiratorni distres sindrom te srčani zastoj (kardijalni arest). Općenito gledano, akutna lezija jetre nakon parenteralnoga unosa amiodarona reverzibilna je kada se na vrijeme prepozna i kada se prekine s primjenom lijeka te nije praćena s visokom stopom smrtnosti.
Nesteroidni protuupalni lijekovi relativno su čest uzrok toksične lezije jetre, što proizlazi iz njihove široke primjene. Oštećenje je primarno posredovano reaktivnim metabolitima, a ulogu mogu imati i imunološki mehanizmi, kao i smanjena sinteza prostaglandina uslijed inhibicije ciklooksigenaze (COX). Diklofenak je najčešći lijek iz ove skupine koji se povezuje s hepatotoksičnim učinkom. Dugotrajna primjena diklofenaka obično je povezana s asimptomatskim povišenjem jetrenih transaminaza što se primjećuje u prvih šest mjeseci terapije, dok su teže toksične lezije znatno rjeđe. Osim diklofenaka, izraženiji hepatotoksičan učinak imaju i bromfenak, nimesulidin, sulindak te ibuprofen. Ibuprofen i sulindak povezani su s razvojem kolestatske toksične lezije jetre koja je obično reverzibilna i nestaje s prestankom uzimanja lijeka.
Antituberkulotici. Toksična lezija jetre razvija se kod oko 35 % bolesnika koji uzimaju antituberkulotike zbog čega je kod njih potrebno posebno pratiti jetrenu funkciju tijekom liječenja. Glavni antituberkulotici koji dovode do toksične lezije jetre su izoniazid, rimfampicin i pirazinamid. Izoniazid uzrokuje oštećenje jetre putem reaktivnih metabolita koji nastaju u procesu metaboliziranja lijeka, a ono je u najvećoj mjeri povezano s genetskim varijacijama u samome metabolizmu (spori metabolizatori imaju znatno veći rizik od razvoja toksične lezije). Također, istovremena primjena lijekova koji povećavaju aktivnost enzima citokrom p450 također mogu pojačati toksičan učinak izoniazida. Klinički se ova toksična lezija očituje asimptomatskim porastom jetrenih transaminaza, što se u potpunosti povlači nakon prekida uzimanja lijeka. Ipak, ako se nastavi s primjenom izoniazida, razvit će se teško hepatocelularno oštećenje jetre. Pirazinamid i rimfampicin sami po sebi nisu toksični, no kada se daju u kombinaciji s drugim lijekovima (ili u međusobnoj kombinaciji) ili se primijene kod bolesnika s ranije oštećenom jetrenom funkcijom, može doći do razvoja klinički značajne toksične lezije jetre.
Ostali antimikrobni lijekovi. Ukupno gledano, antimikrobni lijekovi (uključujući antituberkulotike i antifungike) odgovorni su za 25 do 45 % toksičnih lezija jetre uzrokovanih lijekovima. Od antibiotika s toksičnom lezijom jetre najčešće se povezuju beta-laktamski antibiotici (penicilini, cefalosporini), osobito u kombinaciji s klavulonskom kiselinom. Kod bolesnika se najčešće razvija kolestatska ili miješana toksična lezija jetre, što se klinički manifestira prolaznom hiperbilirubinemijom i žuticom. Također, kolestatsku toksičnu leziju jetre mogu uzrokovati i makrolidi, posebno eritromicin te sulfonamidi. Kod antifungika se hepatotoksičnost najčešće povezuje s primjenom ketokonazola i drugih azola. Obično se radi o miješanoj toksičnoj leziji koja je reverzibilna ako se obustavi primjena lijeka kod uočavanja značajnijega porasta jetrenih transaminaza.
Ostali lijekovi. Statini mogu dovesti do reverzibilnoga oštećenja jetre što se manifestira prolaznim povišenjem razine jetrenih transaminaza, ali vrlo rijetko dovode do klinički značajnoga zatajenja jetrene funkcije. Zbog toga se svim bolesnicima kod kojih se započinje liječenje statinima preporuča kontrola jetrenih enzima. Kod bolesnika s HLA-DR3, DR4 ili DR5 haplotipovima primjena statina može rezultirati nastankom hepatitisa sličnoga autoimunom hepatitisu (engl. autoimmune-like hepatitis). Primjena ezetimiba također može biti povezana s razvojem toga oblika hepatitisa i kolestatske toksične lezije jetre. Ipak, ukupno gledano, primjena statina nije kontraindicirana kod bolesnika s ranijim bolestima jetre, ali nalaže češće kontrole transaminaza. Od peroralnih antidijabetika, glitazoni se najčešće dovode u vezu s nastankom toksične lezije jetre (roziglitazon, pioglitazon), iako je to rijetko. Glimepirid također može biti povezan s nastankom kolestatske toksične lezije jetre.
Trudnoća kao fiziološki proces ne utječe značajnije na funkciju jetre, iako se u drugoj polovici trudnoće mogu naći otkloni u nekim laboratorijskim nalazima. Smatra se da je oko 3 % trudnoća komplicirano bolestima jetre, bilo da se radi o ranije poznatoj, kroničnoj bolesti jetre koja nije povezana s trudnoćom ili o poremećaju koji se karakteristično javlja i povezan je s trudnoćom (prekomjerno povraćanje u trudnoći, intrahepatična kolestaza u trudnoći, akutna masna jetra u trudnoći, HELLP sindrom).
PREKOMJERNO POVRAĆANJE U TRUDNOĆI (HYPEREMESIS GRAVIDARUM)
Definicija. Hyperemesis gravidarum definira se kao mučnina i učestalo povraćanje kod trudnica koje rezultira razvojem dehidracije, ketoze i gubitka na tjelesnoj težini (više od 5 % početne tjelesne težine). Taj se poremećaj javlja na samome početku trudnoće, u prvome tromjesečju, a prisutan je kod 0,3 do 2 % trudnica.
Etiopatogeneza poremećaja nije poznata, ali povezuje se s hormonskim promjenama koje nastupaju u trudnoći. Glavni rizični čimbenici za razvoj hiperemeze su multiparitet, povećan indeks tjelesne mase, postojeća šećerna bolest, psihijatrijsko oboljenje te prisutnost hiperemeze u ranijim trudnoćama. Iako nije dokazano oštećenje same jetre ovim poremećajem, većina bolesnica ima povišene vrijednosti jetrenih nalaza.
Klinička slika. Simptomi se obično pojavljuju prije 9. tjedna trudnoće i nestaju do 20. tjedna. Glavno kliničko obilježje je mučnina i uporno povraćanje što vodi prema dehidraciji i iscrpljivanju organizma zbog čega se trudnice osjećaju slabo i malaksalo.
Dijagnoza se postavlja na osnovi kliničkoga nalaza, laboratorijskih nalaza i ultrazvuka abdomena. Laboratorijski nalazi uključuju u prvome redu povišene vrijednosti jetrenih transaminaza (oko 200 U/L), a često su povišeni i kolestatski markeri (alkalna fosfataza, bilirubin) te pankreasni biljezi (amilaze, lipaze). Ultrazvuk abdomena ima diferencijalno dijagnostički značaj u pogledu isključenja drugih mogućih uzroka ovakve kliničke slike (bilijarna patologija, pankreatitis).
Liječenje je simptomatsko i sastoji se od rehidracije (intravenska, peroralna) i nadoknade elektrolita, a u težim oblicima moguća je i primjena antiemetika (metoklopramid), iako ih treba izbjegavati zbog neispitanoga učinka na plod (teratogenost).
INTRAHEPATIČNA KOLESTAZA U TRUDNOĆI
Definicija. Intrahepatička kolestaza u trudnoći označava reverzibilnu kolestazu koja se javlja u drugoj polovici trudnoće (krajem drugoga i tijekom trećega tromjesečja) te nestaje ubrzo nakon poroda. Učestalost ovoga poremećaja različita je u različitim zemljopisnim regijama, a kod nas se procjenjuje na 0,5 do 2 % trudnoća.
Etiopatogeneza nije do kraja razjašnjena, ali se zna da se radi o funkcionalnome poremećaju membranskoga ekskrecijskog mehanizma žuči iz hepatocita, na što utječu genetski (mutacija gena za MDR3 transportni protein), humoralni (estrogen) i okolišni čimbenici (češća pojavnost poremećaja tijekom zimskih mjeseci). Čimbenici koji povećavaju rizik od razvoja intrahepatičke kolestaze u trudnoći su: starosna dob majke (> 35 godina), multiparitet, ranije uzimanje oralnih hormonskih kontraceptiva, liječenje neplodnosti te intrahepatička kolestaza u ranijim trudnoćama.
Klinička slika. Iako se dominantno radi o kolestazi, pojava žutice nije karakteristična za ove bolesnice i javlja se u 15 do 25 % slučajeva. Kliničkom slikom dominiraju neizravni znakovi kolestaze kao što su svrbež, steatoreja te posljedice malapsorpcije vitamina topljivih u mastima. Najistaknutiji je simptom svrbež koji se obično pojavljuje između 25. i 30. tjedna trudnoće, najizraženiji je na području tabana i dlanova te se pogoršava tijekom noći.
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza i ultrazvuka jetre. Osnovno laboratorijsko obilježje intrahepatičke kolestaze u trudnoći su povišene vrijednosti ukupnih žučnih kiselina, a njihova vrijednost ima i prognostički značaj (vrijednosti veće od 40 µmol/L povezane su s nepovoljnim ishodima trudnoće). Povišene su i razine jetrenih transaminaza, bilirubina i alkalne fosfataze. Protrombinsko vrijeme može biti produljeno, ali ne kao posljedica jetrene insuficijencije, nego malapsorpcije vitamina K. Nalaz ultrazvuka jetre je uredan i ima diferencijalno dijagnostički značaj (isključenje drugih uzroka). Biopsija jetre izvodi se iznimno rijetko, a histološki se otkriva intrahepatička kolestaza bez upalne komponente.
Liječenje je simptomatsko. Lijek izbora za ublažavanje svrbeža u trudnica je ursodeoksikolna kiselina u dozi od 2 x 500 mg/dan koja se pokazala sigurnom za plod prilikom primjene u trećem tromjesečju trudnoće. Primjena kolestiramina nije pokazala zadovoljavajuće rezultate. Kod simptoma upornih unatoč primjeni ursodeoksikolne kiseline, u terapiju se može dodati i rifampicin.
Prognoza. Intrahepatička kolestaza u trudnoći predstavlja benigno stanje za majku i u potpunosti nestaje nakon poroda. Povećane vrijednosti ukupnih žučnih kiselina u serumu mogu biti povezane s lošijim ishodom trudnoće (raniji porod, intrauterini zastoj u rastu i sl.). Ako se prate trajno povišeni patološki nalazi jetrene funkcije i tri mjeseca od poroda, potrebna je detaljna dijagnostička obrada kako se ne bi previdjelo drugu bolest jetre u podlozi.
AKUTNA MASNA JETRA U TRUDNOĆI
Definicija. Akutna masna jetra u trudnoći predstavlja ozbiljno opstetričko stanje obilježeno mikrovezikularnom masnom infiltracijom jetrenoga parenhima, a može progredirati sve do jetrenoga zatajenja i smrtnoga ishoda. Radi se o rijetkom poremećaju s učestalosti od oko 1:7000 - 16000 trudnoća, a obično se pojavljuje u trećem tromjesečju trudnoće (rijetko prije 30. tjedna trudnoće ili nedugo nakon poroda).
Etiopatogeneza ovoga poremećaja nije u potpunosti razjašnjena, ali smatra se da se radi o poremećaju oksidacije masnih kiselina u mitohondrijima koje se javlja i kod majke i kod ploda, što je posljedica mutacija gena za specifične enzime uključene u ovaj proces (npr. mutacija LCHAD gena). Posljedično poremećaju dolazi do akumulacije lipida unutar hepatocita, što može dovesti do njihove disfunkcije i nekroze.
Klinička slika. Početni simptomi i znakovi su nespecifični i uključuju slabost, malaksalost, mučninu i povraćanje, bol i nelagodu pod desnim rebrenim lukom, no bolest može brzo progredirati prema težim oblicima i razvoju jetrenoga zatajenja (ikterus, encefalopatija, koagulopatija) i/ili multiorganskoga zatajenja.
Dijagnoza se postavlja na osnovi kliničke slike, laboratorijskih nalaza, slikovnih metoda i eventualno biopsije jetre. Laboratorijski nalazi uključuju leukocitozu, anemiju, trombocitopeniju, značajno povišene vrijednosti jetrenih transaminaza i pokazatelja kolestaze (bilirubin, alkalna fosfataza). U kasnijim fazama nalazimo i znakove poremećene sintetske i metaboličke funkcije jetre (produljeno protrombinsko vrijeme, hipoalbuminemija, hiperamonijemija). Kod razvoja hepatorenalnoga sindroma dolazi i do razvoja azotemije. Slikovne metode (ultrazvuk, magnetna rezonanca) korisne su u prikazu masne infiltracije te isključenju drugih uzroka jetrenoga zatajenja. Biopsija se rijetko izvodi i treba je izbjegavati zbog koagulopatije i rizika od krvarenja.
Liječenje se sastoji od što hitnijega dovršenja trudnoće, bez obzira na gestacijsku dob, te intenzivnoga liječenja akutnoga jetrenog zatajenja (konzervativni pristup, terapijska plazmafereza, kontinuirane metode hemodijalize i albuminske dijalize i sl.). U najtežim je slučajevima indicirana transplantacije jetre.
Prognoza. Kod trudnica kod kojih je na vrijeme postavljena dijagnoza i dovršena trudnoća, uglavnom se dogodi oporavak nekoliko mjeseci nakon poroda. Sve žene koje su imale ovaj poremećaj treba testirati na LCHAD mutaciju, kao i djecu, ako su preživjela. Ukupni mortalitet za majku iznosi oko 15 %, a za plod 25 %.
PREEKLAMPSIJA, EKLAMPSIJA I HELLP SINDROM
Definicija. Preeklampsija se definira kao višeorganski poremećaj u trudnoći karakteriziran novonastalom arterijskom hipertenzijom prije 20. tjedna trudnoće uz vrijednosti krvnoga tlaka veće od 140/90 mmHg i proteinuriju veću od 300 mg/dan, uz prisutnost kliničkih znakova disfunkcije drugih organa i organskih sustava, uključujući i uteroplacentarnu disfunkciju. O eklampsiji govorimo kada se uz preeklampsiju razviju epileptički napadaji i poremećaj stanja svijesti (koma). HELLP sindrom je varijanta teške preeklampsije karakterizirana hemolizom, trombocitopenijom i povišenim vrijednostima jetrenih transaminaza (HELLP – engl. hemolytic anemia, elevated liver enzyme, low platelets). HELLP sindrom razvija se kod oko 10 % trudnica s preeklampsijom i to najčešće između 27. i 30. tjedna trudnoće, ili unutar prvih 48 sati nakon poroda.
Etiopatogeneza. Pretpostavlja se da je ovaj poremećaj rezultat generalizirane endotelne disfunkcije i pojačane agregacije trombocita, što je potaknuto različitim tvarima koje se oslobađaju iz tkiva posteljice (npr. dušični oksid, prostaglandini, endotelin). Endotelna ozljeda i taloženje fibrina dovode do mikroangiopatske hemolitičke anemije uz aktivaciju i potrošnju trombocita. Navedeni proces zahvaća i jetrene sinusoide što dovodi do sinusoidalne opstrukcije, vazospazma i ishemije s posljedičnim poremećajem jetrene funkcije.
Klinička slika. Kod razvoja HELLP sindroma dolazi do pojave bolova i nelagode u gornjemu dijelu trbuha uz mučninu, povraćanje i slabost. Bolesnice uz to imaju razvijenu arterijsku hipertenziju, smetnje vida i znakove volumnoga suviška (edemi, povećanje tjelesne težine). Najteža i najozbiljnija komplikacija je ruptura jetre i nastanak intraabdominalne hemoragije.
Dijagnoza se postavlja na osnovi kliničke slike, laboratorijskih nalaza i ultrazvuka jetre. U krvnoj slici nalazimo anemiju uz retikulocitozu i nalaz shistocita u razmazu periferne krvi te trombocitopeniju. Posljedično hemolitičkoj anemiji nalazimo i nekonjugiranu hiperbilirubinemiju, povišene vrijednosti laktat dehidrogenaze te niski haptoglobin. Jetrene transaminaze obično su umjereno povišene. Ovisno o težini laboratorijskih nalaza, HELLP sindrom se dijeli u tri skupine (Mississippi klasifikacija – Tablica 4.39.). Ultrazvuk služi u diferencijalno dijagnostičke svrhe kako bi se isključile druge bolesti jetre.
|
Tablica 4.39. Mississippi klasifikacija HELLP sindroma.
|
|
Klinička skupina
|
Laboratorijski kriteriji
|
|
Skupina I
|
Trombociti < 50 x 109/L
AST ili ALT > 70 IU/L
LDH > 600 IU/L
|
|
Skupina II
|
Trombociti 50 – 100 x 109/L
AST ili ALT > 70 IU/L
LDH > 600 IU/L
|
|
Skupina III
|
Trombociti 100 – 150 x 109/L
AST ili ALT > 40 IU/L
LDH > 600 IU/L
|
Liječenje HELLP sindroma sastoji se od dovršenja trudnoće ako se radi o trudnoći dužoj od 34 tjedna, a ako se radi o kraćoj trudnoći, može se pokušati s primjenom kortikosteroida. Uz to, treba provoditi i druge potporne metode liječenja (transfuzije trombocita, eritrocita). Ruptura jetre zbrinjava se kirurški. Normalizacija laboratorijskih nalaza očekuje se unutar mjesec dana od poroda.
Najznačajnije vaskularne bolesti jetre su Budd-Chiarijev sindrom, sindrom sinusoidalne opstrukcije ili veno-okluzivna bolest te kongestivna hepatopatija (zastojna jetra).
BUDD-CHIARIJEV SINDROM
Definicija i epidemiologija. Budd-Chiarijev sindrom predstavlja trombotičku ili netrombotičku okluziju hepatalnih vena s posljedičnim razvojem venske kongestije jetre, hepatomegalije, ascitesa i bolova u trbuhu. Ovisno o vremenu nastanka razlikujemo akutni i kronični Budd-Chiarijev sindrom. Radi se o rijetkom poremećaju s prosječnom incidencijom od oko 1:1000 000 stanovnika, a iako nema čvrstih podataka utemeljenih na kliničkim studijama, čini se da je učestalost nešto viša kod žena nego kod muškaraca te da se obično javlja kod osoba s nekim od oblika trombofilije.
Etiologija. Budd-Chiarijev sindrom mogu uzrokovati brojne bolesti, poremećaji i stanja koja stvaraju sklonost nastanku ugruška unutar jedne ili više hepatalnih vena i/ili mogu dovesti do njihove vanjske kompresije ili unutarnje opstrukcije. Najčešće bolesti i stanja koja se povezuju s Budd-Chiarijevim sindromom su: 1) hematološki poremećaji (policitemija rubra vera, paroksizmalna noćna hemoglobinurija, mijeloproliferativne bolesti, esencijalna trombocitoza), 2) nasljedne trombofilije (deficijencija proteina C, proteina S, antitrombina III ili faktor V Leiden), 3) kronične infekcije (aspergiloza, hidatidna cista, amebijaza), 4) kronične upalne bolesti (Behcetova bolest, idiopatska upalna bolest crijeva, sarkoidoza, sistemski lupus, Sjögrenov sindrom), 5) tumori (hepatocelularni karcinom, karcinom bubrega, karcinom nadbubrežnih žlijezda, miksom desnoga atrija, leiomiosarkom retroperitoneuma) te 6) ostali (trudnoća i puerperij, primjena oralnih kontraceptiva, kongenitalna membranska opstrukcija, kongenitalna hipoplazija suprahepatičnih vena, posttraumatski, postoperativno).
Patogeneza. Klinički i patofiziološki značajan Budd-Chiarijev sindrom uzrokuje opstrukciju dvaju ili više hepatalnih vena, dok opstrukcija samo jedne vene prolazi uglavnom asimptomatski. Opstrukcija dovodi do venske kongestije jetre s posljedičnom hepatomegalijom te povišenim tlakom u sinusoidama koji rezultira hipoksijom i okolnom hepatocelularnom nekrozom. Hepatomegalija dovodi do rastezanja hepatalne kapsule koja sadržava nociceptore, zbog čega bolesnici osjete bol. Uslijed otežanoga protoka krvi iz jetre prema donjoj šupljoj veni i desnom srcu, dolazi do porasta tlaka u portalnome sustavu, zbog čega se razvija portalna hipertenzija sa svojim klasičnim posljedicama (ascites, hipersplenizam, kolateralna cirkulacija). Brzina razvoja opstrukcije hepatalnih vena uvjetuje kliničku narav bolest: nagao razvoj opstrukcije dovodi do akutne ili fulminantne kliničke slike, dok postupni razvoj omogućava razvoj kolaterala i dekompresiju jetre, zbog čega je klinička slika asimptomatska ili se očituje blagim simptomima i znacima.
Klinička slika. Budd-Chiarijev sindrom može se očitovati kao kronična, akutna i fulminantna bolest.
Kronični oblik je najčešća klinička prezentacija, a karakterizira je razvoj progresivnoga ascitesa, bolesnici se žale na umor i malaksalost, a više od 50 % bolesnika ima razvijen hepatorenalni sindrom i neku od manifestacija portalne hipertenzije (varikoziteti jednjaka, proširene i izvijugane površinske abdominalne vene). U konačnoj fazi razvija se i ciroza jetre.
Akutni oblik razvija se kroz nekoliko dana, a karakterizira ga bol pod desnim rebrenim lukom i u području epigastrija, hepatomegalija, nagli razvoj ascitesa, blagi ikterus, a u velike većine bolesnika razvije se i akutno bubrežno oštećenje (hepatorenalni sindrom). Kroz nekoliko se dana na trbušnoj stijenci mogu zamijetiti tortuozne i proširene površinske vene (razvoj kolaterala).
Fulminantni oblik rijetka je i neouobičajena klinička manifestacija Budd-Chiarijeva sindroma, a karakteriziran je naglim i progresivnim razvojem akutnoga jetrenog zatajenja, na što se nadovezuje i akutno bubrežno oštećenje te u konačnici višeorganska disfunkcija. Takav je oblik bolesti praćen visokom stopom smrtnosti.
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza i slikovnih metoda. Laboratorijski nalazi kod Budd-Chiarijeva sindroma nisu karakteristični, obično su umjereno povišene vrijednosti jetrenih transferaza i alkalne fosfataze. Kod bolesnika s ascitesom analizom sadržaja dobivenoga punkcijom mogu se naći visoke koncentracije proteina (> 2 g/dL), vrijednosti leukocita obično su niže od 500/µL te je omjer albumina u serumu i ascitesu manji od 1.1. Ultrazvučni pregled nadopunjen doplerskom analizom predstavlja metodu izbora u postavljanju dijagnoze ovoga sindroma. Indirektni znakovi ukazuju na uvećanu, kongestivnu jetru s proširenim venama unutar kojih se mogu vizualizirati trombotske mase. Pulsni dopler može ukazivati na abnormalnosti protoka kroz portalnu venu s karakterističnim kolateralama unutar jetrenoga parenhima kojima se krv skreće iz okludiranih u prohodne hepatične vene. Također, ultrazvukom se mogu detektirati tumorske mase koje vrše kompresiju na hepatalne vene. Karakteristično je da lobus quadratus jetre ostaje pošteđen od ovih promjena, s obzirom na odvojenu arterijsku i vensku cirkulaciju od ostatka jetre. CT ili MR angiografija koriste se kod bolesnika s visokom razinom sumnje na Budd-Chiarijev sindrom, kod kojih je ultrazvučni nalaz nejasan. Kod svih bolesnika s dokazanim Budd-Chiarijevim sindromom potrebno je učiniti probir za stečene i nasljedne trombofilije, kao i probir za tumorsku etiologiju (tumorski markeri).
Diferencijalna dijagnoza je široka i može obuhvaćati različita klinička stanja kao što su desnostrano ili globalno srčano popuštanje, metastatska bolest jetre, cirozu jetre različite etiologije, infekcijske i tumorske bolesti, nefrotski sindrom i dr.
Liječenje. U mjere i metode liječenja Budd-Chiarijeva sindroma ubraja se sljedeće: trombolitička terapija, antikoagulantno liječenje, radiološke intervencije te ostale potporne metode. Ako je poznat uzrok, liječenje se treba temeljiti na njegovu rješavanju i zbrinjavanju.
Trombolitička terapija dolazi u obzir kao metoda liječenja kojom se otapa stvoreni ugrušak unutar hepatalnih vena, ali zbog maloga broja bolesnika i nedostatka iskustva, ona nije u široj kliničkoj primjeni.
Antikoagulantna terapija najčešći je oblik liječenja Budd-Chiarijeva sindroma, budući da se najčešće radi o opstrukciji trombotskim masama. Klasično se započinje niskomolekularnim heparinom, a nastavlja s oralnim antikoagulansima uz održavanje INR-a u terapijskim vrijednostima (2 - 3). Duljina provođenja antikoagulantne terapije obično ovisi o bolesti koja se nalazi u podlozi (nasljedna ili stečena trombofilija).
Radiološke intervencije u liječenju ovoga sindroma podrazumijevaju lokalnu trombolizu, balonsku angioplastiku (s ili bez postavljanja stenta) te transjugularni intrahepatični portokavalni šant (TIPS). Ove su metode rezervirane za sve bolesnike kod kojih se ne može uspostaviti zadovoljavajući protok kroz hepatalne vene, a kao najčešće izvođena metoda navodi se TIPS.
Transplantacija jetre kao metoda liječenja Budd-Chiarijeva sindroma indicirana je u slučaju razvoja ciroze jetre, kao i u slučaju fulminantnoga oblika bolesti. Svi bolesnici nakon transplantacije jetre zahtijevaju doživotnu antikoagulantnu terapiju.
Ostala terapija uključuje mjere standardnoga liječenja portalne hipertenzije: primjena neselektivnih beta blokatora (propranolol, nadolol) u slučaju postojanja varikoziteta jednjaka, sa svrhom prevencije krvarenja; dijeta s niskim udjelom soli; primjena spirinolaktona te po potrebi diuretika Henleove petlje u svrhu kontrole stvaranja ascitesa, a prema potrebi se indicira i paracenteza (hipertenzivni ascites).
Prognoza. Priroda same bolesti nije do kraja jasno poznata. Čimbenici koji se povezuju s povoljnim ishodima su mlađa životna dob u trenu dijagnoze, sniženi Child-Pugh score, snižene vrijednosti serumskoga kreatinina te odsutnost ili laka terapijska kontrola ascitesa. Petogodišnje preživljenje nakon radiološke intervencije široko se kreće između 38 i 87 %, a desteogodišnje oko 55 %.
VENOOKLUZIVNA BOLEST
Definicija. Veno-okluzivna bolest ili sindrom sinudoidalne opstrukcije predstavlja rijetku vaskularnu bolest jetre karakteriziranu okluzijom sinusoidalnih i centralnih vena jetre. Radi se o malim venskim prostorima koje nalazimo unutar temeljnih funkcionalnih jedinica (jetreni režnjići ili lobuli), čijim spajanjem nastaju hepatalne vene koje se dreniraju prema donjoj šupljoj veni.
Etiopatogeneza. Najčešći uzroci veno-okluzivne bolesti su pirolizidinski alkaloidi koje nalazimo u nekim biljkama korištenim za pripravu čajeva (Crotalaria, Senecio), zračenje regije trbuha, zatim u sklopu reakcije presatka protiv domaćina nakon transplantacije koštane srži te uslijed djelovanja nekih lijekova (azatioprin, dimetilnitrozamin). Okluzija nastaje kao posljedica inducirane fibroze i obliteracije navedenih venskih prostora, a ne uslijed tromboze. Unutar opstruiranih prostora mogu se naći nakupine crvenih krvnih stanica i makrofaga bogatih hemosiderinom. Nastala opstrukcija uvjetuje razvoj portalne hipertenzije, ishemične hepatocelularne nekroze i u konačnici, ciroze jetre.
Klinička slika. Glavne kliničke manifestacije veno-okluzivne bolesti su iznenadna žutica, hepatomegalija te razvoj ascitesa. Karakteristično je da se, ako se radi o reakciji presatka protiv domaćina, bolest razvija unutar prva dva tjedna od transplantacije te se na nju treba pomisliti kod svih bolesnika s razvojem žutice nakon transplantacije koštane srži.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, laboratorijskih nalaza, ultrazvuka jetre te u nekim slučajevima - biopsije. U laboratorijskim nalazima bilježimo konjugiranu hiperbilirubinemiju te povišene vrijednosti alkalne fosfataze i jetrenih transaminaza uz patološke vrijednosti pokazatelja sintetske funkcije jetre ako se radi o težem poremećaju (produljeno protrombinsko vrijeme, snižena kolinesteraza). Ultrazvučni nalaz uključuje dilataciju portalne vene uz hepatofugalan smjer krvi (retrogradni smjer krvi) uz uredan i očuvan protok krvi kroz velike hepatalne vene. Ponekad je za potvrdu dijagnoze potrebno izvesti i transjugularnu biopsiju jetre.
Liječenje je suportivno. U svrhu smanjenja portalne hipertenzije u obzir dolazi postavljanje transjugularnoga intrahepatičkog stenta, a u krajnjim oblicima u obzir dolazi i transplantacija jetre (najteži klinički oblici koji ne reagiraju na konzervativno liječenje). Profilaktička primjena defibrotida koji ima zaštitan učinak na vaskularni endotel preporuča se kod bolesnika kod kojih se planira transplantacija koštane srži s postojećom jetrenom bolesti ili kod bolesnika koji su primali gemtuzumab.
Prognoza je varijabilna. Kod dijela bolesnika dolazi do spontanoga povlačenja simptoma i regeneracije jetre, dok se kod drugoga dijela razvija kronično oštećenje i ciroza. Kod najmanjega dijela bolesnika ubrzo nakon početka bolesti dolazi do razvoja akutnoga, fulminantnoga jetrenog zatajenja koje zahtijeva hitnu transplantaciju jetre.
ZASTOJNA JETRA
Kongestivna hepatopatija ili zastojna jetra predstavlja vensku kongestiju hepatalnih vena koja nastaje kao posljedica desnostranoga srčanog popuštanja, bilo da se radi o izoliranoj disfunkciji desne strane srca, bilo o globalnoj kardiomiopatiji. Najčešća klinička manifestacija predstavlja bezbolnu hepatomegaliju uz uredne jetrene laboratorijske nalaze, no kod težih oblika uslijed porasta tlaka u hepatalnim venama koje se prenose u centralne i sinusoidne vene dolazi do hepatocelularne nekroze i posljedičnoga porasta jetrenih transaminaza. Uslijed retrogradnoga prijenosa tlaka moguć je i razvoj portalne hipertenzije (ascites, splenomegalija). U slučajevima zastojne jetre aminotransferaze su umjereno povišene (obično dva do tri puta iznad normalnih vrijednosti), a na ultrazvuku se bilježe najprije promjene na hepatalnim venama (dilatacija veća od 10 mm), a u težim slučajevima uočavaju se i promjene na jetrenom parenhimu te portalnoj veni. Kronična kongestivna hepatopatija može rezultirati razvojem kardijalne ciroze. Liječenje je simptomatsko i odnosi se na zbrinjavanje srčanoga popuštanja i eliminacije viška tekućine.
Definicija. Ciroza jetre predstavlja posljednji, ireverzibilni stadij jetrene bolesti koju histološki karakterizira difuzno umnažanje vezivnoga tkiva koje narušava normalnu tkivnu arhitekturu jetre i dovodi do patološke nodularne organizacije jetrenoga parenhima uz postupan gubitak i narušavanje jetrene funkcije. Ciroza jetre javlja se kao posljedica fibroze, specifičnoga odgovora na razna oštećenja jetre, karakteriziranoga pojačanom produkcijom i odlaganjem komponenti izvanstaničnoga matriksa u jetri (kolagen, glikoproteini, proteoglikani). Prema tome, ciroza predstavlja konačni i završni, ireverzibilni stadij različitih kroničnih bolesti jetre i ne predstavlja samostalan klinički entitet s jedinstvenom etiopatogenezom.
Epidemiologija. Ciroza jetre važan je uzrok morbiditeta i mortaliteta diljem svijeta. S obzirom na velik broj asimptomatskih bolesnika, stvarnu prevalenciju ciroze jetre u općoj populaciji teško je procijeniti. Prema Svjetskoj zdravstvenoj organizaciji, od ciroze jetre i njezinih posljedica godišnje u svijetu umre oko 800 000 osoba i ona se nalazi među prvih deset uzroka ukupne godišnje smrtnosti. Zbog činjenice da se ciroza jetre najčešće razvija kod radno sposobnih osoba (najčešće u životnoj dobi između 45. i 64. godine), ona predstavlja i velik socioekonomski problem.
Etiologija. Gotovo sve kronične bolesti jetre u svojim krajnjim fazama mogu rezultirati fibrozom i razvojem ciroze jetre. Četiri najčešća uzroka ciroze jetre su: kronični hepatitis C, alkoholna bolest jetre, nealkoholna masna bolest jetre te kronični hepatitis B. Osim toga, cirozu mogu uzrokovati i brojne druge bolesti i stanja: autoimune bolesti jetre (primarna bilijarna ciroza, primarni sklerozirajući kolangitis, autoimuni hepatitis), intrahepatična ili ekstrahepatična bilijarna opstrukcija (mehanička opstrukcija, bilijarna atrezija, cistična fibroza), metaboličke bolesti jetre (hemokromatoza, Wilsonova bolest, deficit α-1 antitripsina, abetalipoproteinemija, porfirija, bolesti odlaganja), vaskularne bolesti jetre (Budd-Chiarijev sindrom, veno-okluzivna bolest, desnostrano srčano popuštanje) te kronična lezija jetre lijekovima i toksinima. Kod određenoga broja oboljelih točan uzrok razvoja ciroze jetre ne može se otkriti, pa govorimo o kriptogenoj cirozi jetre.
Patogeneza. Osnovni i ključni korak u nastanku fibroze i ciroze jetre je aktivacija jetrenih, presinusoidalnih zvjezdolikih stanica (stelatne stanice, Itove stanice). To su stanice koje se u fiziološkim uvjetima nalaze u Disseovom prostru (prostor između hepatocita i endotelnih stanica sinusoida), neaktivne su i služe kao mjesto skladištenja retinoida (vitamin A). Njihov glavni potencijal leži u činjenici da se mogu aktivirati kao odgovor na hepatocelularno oštećenje, a aktivirane stanice proliferiraju i luče sastavnice ekstracelularnoga matriksa (kolagen tip I, kolagen tip III, proteoglikani, glikoproteini) koje dovode do fibroznoga ožiljkavanja mjesta hepatocelularnoga oštećenja. Smještaj i odnosi pojedinih struktura jetrenoga režnjića prikazani su na Slici 4.11.
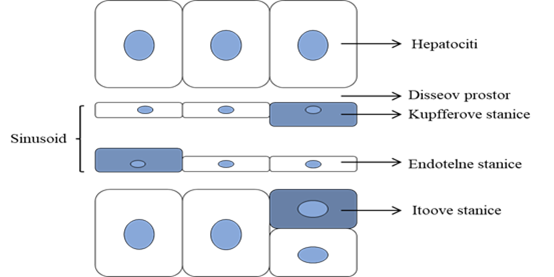
Slika 4.11.Prikaz osnovne jetrene funkcionalne jedinice, jetrenoga režnjića
Kronični podražaj Itovih stanica, kakav se nalazi kod kroničnih jetrenih bolesti, dovodi do prekomjernoga stvaranja vezivnoga tkiva koje postupno prožima jetreni parenhim, pri čemu se normalan jetreni parenhim pregrađuje vezivnim septama u tzv. regeneratorne čvoriće, a sve to dovodi do poremećaja protoka krvi kroz jetru i posljedičnoga razvoja portalne hipertenzije te postupnoga propadanja jetrene funkcije (hepatalna insuficijencija). To se događa uslijed fenomena „kapilarizacije jetrenih sinusoida“, koji podrazumijeva odlaganje vezivnoga tkiva u Disseov prostor, što onemogućava normalnu komunikaciju između hepatocita i krvne plazme (u normalnim uvjetima jetrene sinusoide nemaju bazalnu membranu i imaju velike fenestre kroz koje se omogućava velika izmjena tvari i molekula s hepatocitima). Aktivacija Itovih stanica posredovana je različitim proupalnim medijatorima, citokinima i interleukinima koji se stvaraju u uvjetima kronične upale i kroničnoga jetrenoga oštećenja. Na to ukazuju i brojna istraživanja koja su pokazala dominaciju proupalnih citokina kao što s IL-6, IL-7, IL-8, IL-10, TNF-α i sl. u krvi bolesnika s uznapredovalom fibrozom i cirozom jetre.
Patofiziologija. Glavne su patofiziološke posljedice ciroze jetre portalna hipertenzija, poremećaj izlučivanja žuči, poremećaj sintetske i detoksikacijske funkcije jetre te hepatorenalni i hepatopulmonalni sindrom. Ovdje su ovi poremećaji navedeni samo okvirno, a detaljnije će biti opisani kasnije u tekstu.
Portalna hipertenzija definira se porastom tlaka u portalnoj veni iznad 12 mmHg, a nastaje kao posljedica otežanoga protoka krvi kroz jetru, zbog čega se ona zadržava u portalnoj veni povećavajući hidrostatski tlak. Glavna klinička očitovanja portalne hipertenzije su ascites, splenomegalija i hipersplenizam te stvaranje portosistemskih venskih anastomoza kojima se nastoji uspostaviti odgovarajuća drenaža krvi iz portalne vene (varikoziteti jednjaka, caput meduse, proširene površinske trbušne vene, hemoroidi).
Poremećaj izlučivanja žuči nastaje najprije uslijed nemogućnosti prijenosa konjugiranoga bilirubina iz hepatocita u žuč, a kasnije i zbog same narušene konjugacije bilirubina, što se očituje miješanom hiperbilirubinemijom i žuticom. Manjak žuči u tankome crijevu dovodi do nedogovarajuće apsorpcije masti što dovodi do steatoreje, ali i deficita vitamina topljivih u mastima.
Poremećaj sintetske funkcije jetre javlja se u kasnijim fazama ciroze jetre, a posljedica je smanjenja broja hepatocita. Posljedično tome dolazi do smanjenja produkcije proteina, osobito albumina, zbog čega se razvija hipoalbuminemija uz posljedični pad koloidno-osmotskoga tlaka plazme, zbog čega bolesnici razvijaju periferne edeme. Također je smanjena i produkcija globulina, zbog čega su bolesnici skloniji infekcijama. S obzirom na to da je jetra glavno mjesto stvaranja većine faktora zgrušavanja, smanjena sintetska funkcija rezultirat će sklonošću prema krvarenju (hemoragijska dijateza), na što ukazuju i laboratorijski koagulacijski testovi (produljeno protrombinsko vrijeme).
Poremećaj detoksikacijske funkcije jetre rezultira smanjenom razgradnjom i uklanjanjem različitih endogenih i egzogenih štetnih tvari, lijekova i toksina. Najteži poremećaj predstavlja razvoj hepatalne encefalopatije koja nastaje uslijed neurotoksičnoga učinka amonijaka i drugih metabolita koji se normalno razgrađuju u jetri i bivaju odstranjeni iz organizma. Smanjena razgradnja estrogena kod muškaraca može rezultirati razvojem hiperesterizma (ginekomastija, testikularna atrofija, spider nevusi, palmarni eritem).
Hepatorenalni sindrom i hepatopulmonalni sindrom označavaju funkcionalne poremećaje bubrega i pluća, nastaju u odsutnosti morfoloških promjena navedenih organa te se poboljšavaju nakon transplantacije jetre. Vjeruje se da oba poremećaja nastaju uslijed poremećaja odnosa vazokonstriktora i vazodilatatora (poremećaj sinteze, inaktivacija) s posljedicama za bubrege i pluća i njihovu funkciju. Nastanak i kliničke manifestacije navedenih poremećaja detaljnije su opisani kasnije u tekstu.
Patologija. Makoroskopski je jetra normalne veličine ili je smanjena, a zbog velike količine vezivnoga tkiva tvrde je i čvrste konzistencije. Površina je zrnata, a na presjeku nalazimo regeneratorne čvoriće. Prema veličini tih čvorića razlikujemo makronodularnu cirozu (čvorići imaju promjer veći od 1 cm) i mikronodularnu cirozu (čvorići imaju promjer manji od 1 cm). Mikroskopski nalaz pokazuje obilno vezivno tkivo koje pregrađuje jetreni parenhim i okružuje regeneratorne čvoriće. Na osnovi histološkoga nalaza ne može se razlikovati uzrok ciroze, ali neki histološki nalazi mogu na njega upućivati (npr. Malloryjev hijalin u alkoholnoj cirozi, slika oštećenja ili nestanka žučnih vodova u primarnoj bilijarnoj cirozi i sl.).
Klinička slika ciroze jetre široko varira - od asimptomatske slike do teške, životno ugrožavajuće slike zatajenja jetrene funkcije. U svome prirodnom tijeku razlikujemo dva klinička oblika ciroze jetre: kompenzirana i dekompenzirana ciroza jetre. Kompenziranu fazu karakteriziraju nespecifični simptomi, očuvana sintetska i detoksikacijska funkcija jetre uz povećani tlak u portalnoj veni, ali ne u tolikoj mjeri da bi se razvio značajan ascites ili krvarenje iz varikoziteta jednjaka (samo postojanje varikoziteta jednjaka ne znači dekompenziranu fazu). S progresijom bolesti dolazi do pogoršanja portalne hipertenzije i razvoja zatajenja jetrene funkcije u svim svojim segmentima, što se označava kao dekompenzacijska faza ciroze jetre. Srednje vrijeme u kojemu klinička slika iz kompenzirane prelazi u dekompenziranu iznosi oko šest godina od trena postavljanja dijagnoze, iako razvoj hepatocelularnoga karcinoma značajno ubrzava taj proces. Prirodni tijek prikazan je u shemi na Slici 4.12.
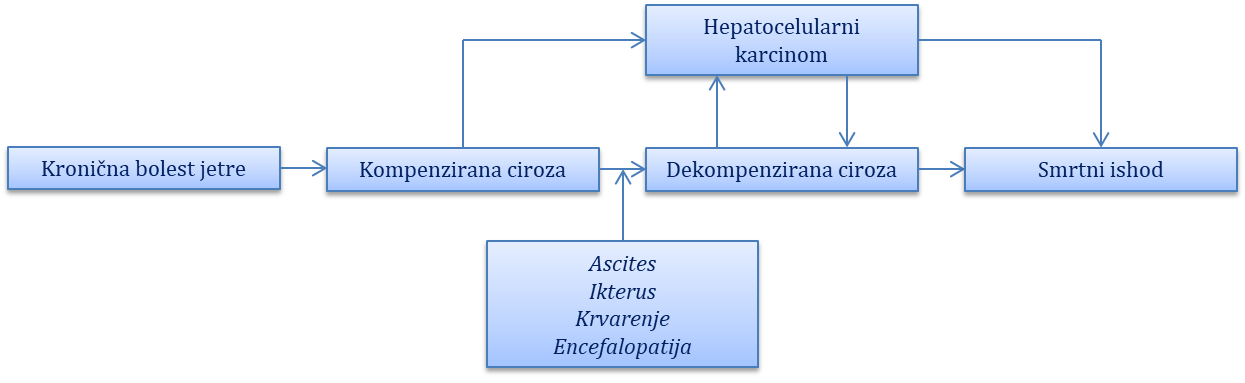
Slika 4.12. Klinički tijek ciroze jetre
Kompenzirana ciroza jetre podrazumijeva rani stadij ciroze jetre u kojoj su bolesnici asimptomatski ili ispoljavaju nespecifične simptome kao što su umor, malaksalost, gubitak teka, propadanje mišićne mase i gubitak na tjelesnoj težini, kognitivni poremećaji, poremećaji spavanja, gubitak libida i sl. Klinička slika kompenzirane ciroze jetre često ovisi i o kroničnoj bolesti jetre koju nalazimo u podlozi (nalaz kliničkih stigmi kroničnoga alkoholizma i sl.). Oko 40 % bolesnika u kompenziranoj fazi ima razvijene varikozitete jednjaka.
Dekompenzirana ciroza jetre podrazumijeva kasniji stadij ciroze jetre, a obilježena je specifičnim kliničkim manifestacijama koje podrazumijevaju razvijenu portalnu hipertenziju (ascites, splenomegalija i hipersplenizam, krvarenje iz varikoziteta jednjaka i dr.) i jetrenu insuficijenciju (žutica, periferni edemi, hemoragijska dijateza, hepatalna encefalopatija, hepatopulmonalni sindrom, hepatorenalni sindrom). Zbog svojih karakterističnih očitovanja, ovi se bolesnici jasno raspoznaju već pri samome kliničkom pregledu bez dodatnih dijagnostičkih pretraga.
Fizikalni pregled. Prilikom fizikalnoga pregleda, osim prethodno opisanih ascitesa, ikterusa, perifernih edema i hemoragijske dijateze (petehije, ekhimoze, hematomi), postoje i drugi, specifični znakovi koji ukazuju na kroničnu bolest jetre/cirozu jetre: foetor hepaticus (zadah na plijesan i vlažnu zemlju koji potiče od spoja merkaptana), caput medusae (proširenje vena periumbilikalne regije, portosistemski šant između umbilikalne vene i površinske epigastrične vene), spider nervusi i plamarni eritem (kožne teleangiektazije i hiperemija dlanova, posljedica hiperesterizma), ginekomastija i testikularna atrofija kod muškaraca (hiperesterizam), znakovi plućne hipoksije (centralna cijanoza, batićasti prsti) i dr.
Dijagnoza. Dijagnostički se postupak može podijeliti u dva dijela, prvi se dio odnosi na postavljanje same dijagnoze ciroze jetre, a drugi na postavljanje dijagnoze uzročne bolesti koja je dovela do razvoja ciroze jetre, ako ona nije od ranije poznata (etiološka dijagnostika). Osnovu dijagnoze ciroze jetre čine anamneza i klinički pregled bolesnika, laboratorijski nalazi, slikovne metode, gastroenterološka endoskopska obrada te biopsija jetre i patohistološka dijagnostika.
Laboratorijski nalazi ovise o fazi bolesti, kao i o uzročnoj bolesti. U načelu pratimo pokazatelje hepatocelularne nekroze (AST i ALT i njihov omjer), pokazatelje kolestaze (bilirubin, alkalna fosfataza), pokazatelje sintetske funkcije jetre (albumini, protrombinsko vrijeme) te amonijak kao pokazatelj detoksikacijske funkcije jetre. Praćenjem vrijednosti ovih pokazatelja brzo se i učinkovito može dobiti uvid u funkcionalno stanje jetre i procijeniti težinu bolesti. Kod ovih bolesnika posebno je korisno redovno praćenje vrijednosti α-fetoproteina, budući da su njegove vrijednosti iznad 400 ng/mL visoko suspektne za razvoj hepatocelularnoga karcinoma (kod bolesnika s kroničnim hepatitisom uobičajeno nalazimo vrijednosti α-fetoproteina povišene do 100 ng/mL kao odraz regeneracije jetrenoga parenhima).
Slikovne metode. Ultrazvuk je klasično osnovna i temeljna slikovna dijagnostička metoda u obradi bolesnika sa sumnjom na cirozu jetre. U ranoj i srednjoj fazi ciroze (Child A i B) jetra je diskretno uvećana s umjereno valovitim vanjskim konturama, dok je struktura parenhima difuzno hiperehogena i inhomogena uz jasno vidljivu pseudolobulaciju (regeneratorni čvorići). U uznapredovaloj fazi (Child C) jetra je smanjena i skvrčena (mjerena u medioklavikularnoj liniji obično manja od 10 cm) s grubim i naglašenim parenhimom uz nervne i grbovite konture te uz pucanje i četkasti izgled jetrene čahure. Prisutni su i indirektni znaci kao što su dilatacija portalne vene (promjer > 13 mm u području hepatoduodenalnoga ligamenta i > 11 mm intrahepatično) uz hepatofugalni venski tok koji se bilježi obojenim doplerom te prisutnost ascitesa i kolaterala (rekanalizirana umbilikalna vena). Primjena kontrastne kompjuterizirane tomografije ili magnetne rezonance ima smisla kod dvojbenih ultrazvučnih nalaza i kod analize sumnjivih čvorova (suspektni hepatocelularni karcinom).
Tranzijentna elastografija danas je sve češća dijagnostička metoda koju se koristi kod bolesnika sa sumnjom na fibrozu/cirozu jetre. Metoda se temelji na odašiljanju smičnoga vala ili mehaničkoga impulsa kojeg proizvodi vibrator povezan s ultrazvučnom sondom uz istodobno korištenje ultrazvučnoga vala i doplerskoga efekta koji mjere brzinu širenja smičnoga vala kroz jetreni parenhim i na taj način neizravno daju podatak o tvrdoći jetre (što je veći stupanj fibroze, to se smični val teže probija kroz jetreni parenhim). Kod izvođenja pretrage, sonda se postavlja u VII. ili VIII. interkostalni prostor u srednjoj aksilarnoj liniji desno. Dobiveni rezultat izražava se u kilopaskalima (kPa), a normalne vrijednosti iznose 2,5 do 7,5 kPa. Vrijednosti veće od 14 kPa govore u prilog cirozi jetre.
Endoskopska dijagnostika. Kod svih je bolesnika s potvrđenom cirozom jetre potrebno obaviti endoskopski pregled gornjega probavnog trakta s ciljem utvrđivanja postojanja varikoziteta jednjaka ili portalne gastropatije kao mogućih izvora fatalnih krvarenja. Kod bolesnika kod kojih se takve promjene ne potvrde preporuča se kontrolni pregled za dvije godine, dok je kod onih s potvrđenom bolesti potrebno jednogodišnje praćenje. Kolonoskopija se ovim bolesnicima ne radi rutinski.
Biopsija jetre i patohistološka dijagnostika predstavljaju zlatni standard u potvrđivanju dijagnoze fibroze i ciroze jetre. Napretkom neinvazivnih metoda dijagnostike, biopsija jetre danas je uglavnom rezervirana za bolesnike s nejasnom etiologijom ciroze (imunocitokemijska identifikacija prisutnosti virusa, žučnih vodova ili onkogenih markera, kemijsko mjerenje željeza i bakra i sl.) ili u slučaju postojanja nejasnih čvorova koji bi potencijalno mogli biti maligni, a osobito kod bolesnika s povišenim vrijednostima α-fetoproteina. Može se izvoditi perkutanim putem ili transjugularnim pristupom. S obzirom na sklonost krvarenju, kod ovih je bolesnika prije samoga zahvata potrebno provjeriti koagulacijske parametre i broj trombocita.
Etiološka dijagnostika ciroze jetre, osim prethodno navedene biopsije, uključuje i određivanje drugih biokemijskih i seroloških markera: markeri na virusne hepatitise, određivanje specifičnih autoantitijela, α-1 antitripsin, bakar i ceruloplazmin, željezo i feritin te specifični genetski markeri.
Liječenje ciroze jetre u prvome se redu odnosi na liječenje i zbrinjavanje uzročne bolesti koju nalazimo u podlozi ciroze. Paralelno s liječenjem osnovne bolesti primjenjuju se opće i specifične terapijske metode te transplantacija jetre kao jedno od rješenja uznapredovale bolesti jetre.
Opće terapijske metode odnose se na sve bolesnike s cirozom jetre, a uključuju izbjegavanje teških fizičkih napora, ograničenje unosa soli u organizam (≤ 2 g/dan), izbjegavanje korištenja nesteroidinih protuupalnih lijekova (mogućnost krvarenja u probavni sustav, pogoršanje renalne funkcije) te redovno procjepljivanje (protiv virusa hepatitisa A i B, pneumokokno cjepivo svakih pet godina, cjepivo protiv gripe svake godine). Također se bolesnicima preporuča prestanak pušenja, unosa alkohola i drugih hepatotoksina, uz održavanje odgovarajućega nutritivnog statusa (osiguranje kalorijskih potreba, suplementacija vitamina i minerala, a posebno vitamina topljivih u mastima). Bolesnici s kompenziranom cirozom jetre trebali bi voditi normalan život uz pridržavanje navedenih uputa i liječenje osnovne bolesti. Svi bi takvi bolesnici trebali svakih šest do dvanaest mjeseci ići na ultrazvuk jetre i određivanje vrijednosti α-fetoproteina (probir za hepatocelularni karcinom).
Specifične terapijske metode usmjerene su na prevenciju i liječenje komplikacija vezanih uz cirozu jetre (ascites, varikoziteti jednjaka, hepatalna encefalopatija, hepatorenalni sindrom i sl.), a opisane su zasebno u poglavlju o komplikacijama ciroze jetre.
Transplantacija jetre predstavlja jedinu terapijsku opciju koja značajnije produljava životni vijek i poboljšava kvalitetu života kod bolesnika s uznapredovalom bolesti jetre. Indikacije i ostale specifičnosti vezane uz transplantaciju jetre posebno su opisane (poglavlje „Transplantacija jetre“).
Procjena težine bolesti. U kliničkoj se praksi za procjenu težine bolesti najčešće koristi Childova klasifikacija s Turcotte-Pughovom modifikacijom (tzv. Child-Pugh skor) te MELD skor (engl. model for end-stage liver disease).
Child-Pugh bodovni sustav temelji se na kliničkim i laboratorijskim parametrima prema kojima se bolesnici svrstavaju u jednu od tri skupine (Child A, B ili C). Procjena težine navedenim bodovnim sustavom važna je u procjeni prognoze bolesnika, ali i u određenim terapijskim smjernicama (Tablica 4.40.).
|
Tablica 4.40. Child-Pugh klasifikacija (skor)
|
|
Parametar/Bod
|
1
|
2
|
3
|
Interpretacija
|
|
Ascites
|
Nema
|
Minimalno
|
Značajno
|
Child A: zbroj bodova manji od 7
Child B: zbroj bodova 7 - 9
Child C: zbroj bodova veći od 9
|
|
Encefalopatija
|
Nema
|
I - II stupanj
|
III - IV stupanj
|
|
Bilirubin (µmol/L)
|
< 35
|
35 - 50
|
> 50
|
|
Albumin g/L
|
> 35
|
28 - 35
|
< 28
|
|
PV (broj sekundi produženja)
|
1 - 3
|
4 - 6
|
> 6
|
MELD bodovni sustav dobiva se matematičkim izračunom utemeljenim na vrijednostima serumskoga bilirubina, kreatinina i INR-a, a koristi se prediktor mortaliteta kod bolesnika koji čekaju transplantaciju jetre (Tablica 4.41.).
|
Tablica 4.41. Jednogodišnje preživljenje bolesnika koji čekaju transplantaciju jetre temeljeno na MELD skoru
|
|
MELD skor
|
Jednogodišnje preživljenje
|
|
Bolesnici bez komplikacija
|
Bolesnici s komplikacijama
|
|
< 9
|
97 %
|
90 %
|
|
10 - 19
|
90 %
|
85 %
|
|
20 - 29
|
70 %
|
65 %
|
|
30 - 39
|
70 %
|
50 %
|
Prognoza ovih bolesnika je varijabilna. U prosjeku ukupno petogodišnje preživljenje od postavljanja dijagnoze ciroze jetre iznosi oko 50 %, ali uvelike ovisi o kliničkom stadiju bolesti (Child A, B ili C). Loši klinički prognostički indikatori su perzistentna žutica, ascites refrakteran na terapiju, recidivno krvarenje iz varikoziteta jednjaka, mala i skvrčena jetra te perzistentna hipotenzija, dok su loši prognostički laboratorijski znakovi niske vrijednosti albumina (< 28 g/L) i natrij (< 125 mmol/L) uz produljeno protrombinsko vrijeme (više od šest puta u odnosu na normalno) te porast kreatinina (> 130 µmol/L). Prosječno preživljenje temeljeno na Child bodovnom sustavu prikazano je u Tablici 4.42.
|
Tablica 4.42. Child-Pugh bodovni sustav i preživljenje bolesnika sa cirozom jetre
|
|
Preživljenje/Stadij
|
Child A
|
Child B
|
Child C
|
|
Jednogodišnje preživljenje
|
82 %
|
62 %
|
42 %
|
|
Petogodišnje preživljenje
|
45 %
|
20 %
|
20 %
|
|
Desetogodišnje preživljenje
|
25 %
|
7 %
|
0 %
|
KOMPLIKACIJE CIROZE JETRE
Komplikacije i posljedice ciroze jetre su portalna hipertenzija i varikoziteti jednjaka, ascites, spontani bakterijski peritonitis, hepatalna encefalopatija, hepatorenalni sindrom, hepatopulmonalni sindrom i plućna hipertenzija, koagulopatija i hemoragijska dijateza te hepatocelularni karcinom.
PORTALNA HIPERTENZIJA I VARIKOZITETI JEDNJAKA
Definicija i etiopatogeneza. Poremećena arhitektura jetre i depoziti fibroznoga tkiva u Disseovim prostorima dovode do porasta vaskularnoga otpora u jetrenim sinusoidama što otežava ili onemogućava drenažu venske krvi iz portalne prema hepatalnim venama, zbog čega se ona zadržava te dovodi do porasta hidrostatskoga tlaka. Taj porast tlaka u portalnoj veni uzrokuje povećanu sintezu dušičnoga oksida kao kompenzatorni odgovor jer se vazodilatacijom nastoji smanjiti periferni otpor (a time i sam tlak), no širenje portalne vene samo dovodi do još većega dotoka krvi u nju iz splanhikusa (hiperdinamičko stanje) što dodatno povećava tlak u portalnoj veni. Osim toga, pojačano stvaranje dušičnoga oksida djeluje i na druge krvne žile zbog čega, osim splanhične, nastaje i sustavna vazodilatacija što uvjetuje aktivaciju humoralnih mehanizama među kojima je najznačajniji renin-angiotenzin-aldosteron sustav koji dodatno dovodi do zadržavanja natrija i tekućine (povećanje volumena plazme), čime se podržava hiperdinamično stanje koje pogoršava portalnu hipertenziju. Porastom tlaka u portalnoj veni dolazi do otvaranja kolateralnih vena kojima se nastoji krv iz portalne vene „skrenuti“ u sistemsku vensku cirkulaciju (tzv. portosistemske anastomoze) zaobilazeći jetru i hepatalne vene. Tri su najvažnije portosistemske anastomoze kojima se to postiže: 1) anastomoza preko želučanih i jednjačnih vena prema veni azigos i hemiazigos koje se dreniraju u gornju šuplju venu, 2) anastomoza preko paraumbilikalne i umbilikalne vene koje se dreniraju preko površinske epigastrične vene u femoralnu venu te 3) anastomoza preko gorenje hemoroidalne vene koja se drenira izravno u donju šuplju venu. To ima velik klinički značaj s obzirom na to da se posljedično razvoju ovih anastomoza razvijaju i karakteristična klinička stanja: portalna gastropatija i varikoziteti jednjaka, caput medusae te hemoroidalna bolest (kasnije opisano).
Ostali uzroci portalne hipertenzije. Osim ciroze jetre, portalnu hipertenziju mogu uzrokovati i druge bolesti i stanja, iako se to u kliničkoj praksi javlja znatno rjeđe. Uzroci se mogu grupirati u tri skupine ovisno o mjestu patološkoga zbivanja: 1) prehepatični uzroci (tromboza vene porte, kongenitalno suženje vene porte), 2) intrahepatični uzorci koji mogu biti presinusoidalni (schistosomijaza, sarkoidoza, primarni bilijarni kolangitis), sinusoidalni (ciroza, kongenitalna hepatična fibroza, parcijalna nodularna transformacija) i postsinusoidalni (veno-okluzivna bolest, Budd-Chiarijev sindrom) te 3) posthepatični uzorci (opstrukcija donje šuplje vene, desnostrano srčano popuštanje, kronični konstriktivni perikarditis). Slijed patofizioloških zbivanja jednak je bez obzira na uzrok inicijalnoga porasta tlaka u portalnoj veni.
Klinička slika. Kako je ranije navedeno, tri su najznačajnija klinička očitovanja portalne hipertenzije: portalna gastropatija i varikoziteti jednjaka, caput medusae te hemoroidalna bolest.
Portalna gastropatija i varikoziteti jednjaka predstavljaju proširenje površinskih vena želuca i jednjaka koje prolabiraju u lumen želuca i jednjaka i nose rizik od rupture i nastanka po život opasnoga krvarenja. Kritični tlak u portalnoj veni potreban za nastanak varikoziteta je tlak veći od 12 mmHg. Smatra se da više od 50 % oboljelih od ciroze jetre ima tu komplikaciju, a ona je posebno česta kod bolesnika s cirozom jetre alkoholne etiologije. Prevalencija ovisi i o težini bolesti, tako da ona iznosi oko 40 % kod bolesnika u stadiju Child A i 85 % kod bolesnika sa stadijem Child C. Klinički, portalna gastropatija i varikoziteti jednjaka nemaju simptoma do pojave krvarenja koje se manifestira pojavom hematemeze (povraćanje svježe krvi) i melene te određenim stupnjem hemodinamskoga urušaja. Krvarenje se može dogoditi spontano, a često je povezano i s naglim, kratkotrajnim povišenjem tlaka u portalnome sustavu (fizički rad, napinjanje muskulature trbuha i sl.). Teškom krvarenju pridonosi i pridružena trombocitopenija i nedostatak faktora zgrušavanja, što je često kod ovih bolesnika.
Caput medusae predstavlja proširene i izvijugane površinske epigastrične vene koje se radijalno šire od umbilikulusa prema periferiji što uz umbilikalnu herniju (koja je obično prisutna uslijed ascitesa) daje karakterističnu sliku glave meduze. Ovaj klinički znak nema veći patofiziološki značaj, osim što predstavlja jasan klinički znak portalne hipertenzije.
Hemoroidalna bolest uvjetovana je anastomozom vene porte i donje šuplje vene preko gornje hemoroidalne vene i otkriva se u gotovo svih bolesnika s cirozom jetre. Javljaju se klasične hemoroidalne smetnje s čestim krvarenjima koja se teže kontroliraju i pridonose anemiji kronične bolesti.
Dijagnoza portalne hipertenzije postavlja se na osnovi kliničke slike, slikovnih metoda te, rijetko, invazivnim metodama mjerenja tlaka u portalnoj veni. Kod svih bolesnika s dokazanom ili suspektnom portalnom hipertenzijom potrebno je obaviti endoskopski pregled gornjega probavnog trakta.
Slikovne metode. Ultrazvuk i obojeni dopler predstavljaju osnovne metode u dijagnostici portalne hipertenzije. Omogućavaju uvid u morfološke i funkcionalne promjene jetre i portalne vene. Kod ovih se bolesnika klasično nalaze uobičajeni ultrazvučni znakovi ciroze jetre uz proširenu portalnu venu (> 13 mm) i dilataciju jetrene arterije (> 3 mm). Doplerskom se analizom bilježi smanjenje pulsatilnosti u hepatalnim venama, smanjenje brzine protoka u portalnoj veni (< 13 cm/s) uz undulirajući oblik zapisa te gubitak respiratorne modulacije protoka krvi kroz portalnu venu. U uznapredovaloj fazi bolesti primjećuje se i hepatofugalni smjer kretanja krvi kroz portalnu venu (smjer obrnut od jetre). Kod nekih je bolesnika moguća i ultrazvučna detekcija portosistemskih spojeva, kao što su rekanalizirana paraumbilikalna vena i dilatirana lijeva gastrična vena. U dijagnostičku se obradu u nejasnim situacijama mogu uključiti i CT ili MR angiografija.
Invazivno mjerenje tlaka u portalnoj veni rijetko se primjenjuje zbog otežane kateterizacije portalne vene i mogućnosti teških komplikacija te se u tu svrhu izvodi mjerenje gradijenta jetrenoga venskog tlaka (HVPG) pomoću transjugularne kateterizacije jetrenih vena u kojima se mjeri razlika između slobodnoga i ukliještenog tlaka. Ovo se ne izvodi u rutinskoj obradi, nego samo kod nejasne etiologije portalne hipertenzije s obzirom na to da se na osnovi dobivene razlike tlaka može pobliže ukazati na mogući uzrok. Normalna razlika između navedenih tlakova (3 - 5 mmHg) ukazuje na prehepatični uzrok portalne hipertenzije, dok veća razlika ukazuje na intrahepatalne i posthepatalne uzroke.
Endoskopska dijagnostika. Ezofagogastroduodenoskopija metoda je izbora u dijagnostici varikoziteta jednjaka i portalne gastropatije. Varikoziteti jednjaka se ovisno o veličini dijele u nekoliko stupnjeva: I. stupanj (mali variksi bez prolapsa u lumen jednjaka), II. stupanj (srednje veliki variksi koji prolabiraju u lumen, ali ga ne sužavaju, a gastroezofagealni spoj je vidljiv), III. stupanj (veliki variksi koji prolabiraju i sužavaju lumen, a gastroezofagealni spoj teško je vidljiv) i IV. stupanj (variksi opstruiraju lumen jednjaka, a spoj se ne vidi). Tijekom endoskopije je bitno uočiti rizične znakove koji ukazuju na mogućnu rupturu: crveni točkasti znakovi (engl. cherry-red spots), hemocistične točke (engl. hemocystic spots) i linearne točke (engl. red weals). Portalnu gastropatiju karakteriziraju proširene i izvijugane površinske vene želuca koje daju mozaični izgled poput zmijske kože (engl. snake skin). Kod bolesnika s potvrđenim varikozitetima i portalnom gastroskopijom indicira se kontrolna endoskopija jednom godišnje (nekada i češće) zbog praćenja dinamike i eventualne potrebe za interventnim liječenjem.
Liječenje. Osim klasičnih metoda liječenja ciroze jetre i bolesti u podlozi ciroze jetre, kod bolesnika s portalnom hipertenzijom usmjeravamo se na primarnu i sekundarnu prevenciju krvarenja iz varikoziteta jednjaka, bilo da se radi o medikamentnim, bilo o interventnim postupcima. Liječenje akutnoga krvarenja iz varikoziteta jednjaka opisano je u poglavlju o bolestima jednjaka i krvarenju iz probavnoga sustava.
Medikamentna prevencija krvarenja iz varikoziteta indicirana je kod svih bolesnika s endoskopski dokazanim varikozitetima, a u tu se svrhu primjenjuju neselektivni blokatori beta adrenergičkih receptora kakvi su propranolol i nadolol. Inicijalna doza propranolola iznosi 2 x 20 mg/dan s postupnim povećanjem doze do ciljne dnevne doze od 80 mg (2 x 40 mg). Titracija se provodi do postizanja ciljne doze ili do pojave nuspojava (srčana frekvencija < 55/min, sistolički krvni tlak < 90 mmHg). Uz ovu terapiju postiže se gotovo 50 %-tno sniženje rizika od nastanka krvarenja. Kao alternativa se može primjenjivati nadolol u inicijalnoj dozi od 1 x 20 mg/dan. U novije se vrijeme i primjena nebivolola (selektivnoga blokatora beta adrenergičkih receptora) spominje kao moguće rješenje za bolesnike koji loše toleriraju propranolol ili nadolol. On se primjenjuje u dozi od 1 x 12,5 mg/dan i to samo kod bolesnika koji nemaju ascites (koji su u kompenziranoj fazi ciroze jetre) s obzirom na njegov vazodilatacijski efekt koji može pogoršavati hiperdinamičko stanje, a time i portalnu hipertenziju. Primjena beta blokatora u prevenciji nastanka samih varikoziteta (kod bolesnika koji nemaju endoskopski dokazane varikozitete) nema učinka i nije opravdana.
Interventna prevencija krvarenja iz varikoziteta odnosi se na endoskopske metode liječenja varikoziteta jednjaka (sklerozacija, podvezivanje), što je opravdano samo kod bolesnika kod kojih se ne može provesti medikamentozna prevencija jer se ovim postupkom ne utječe na samu portalnu hipertenziju koja je i dalje prisutna, a može dovesti i do krvarenja iz ligaturom izazvanih ulceracija. Endoskopska intervencija odvija se u više navrata s razmakom od nekoliko tjedana, a obično se po postupku uspije riješiti oko pet varikoziteta (ligacija ili sklerozacija). Transjugularni intrahepatalni portokavalni šant (TIPS) nije indiciran u prevenciji krvarenja iz varikoziteta.
Općeprihvaćen stav o prevenciji krvarenja iz varikoziteta jednjaka podrazumijeva primjenu propranolola ili nadolola kao osnovne mjere prevencije, dok se endoskopska intervencija preporuča za bolesnike koji imaju kontraindikacije ili ne podnose beta blokatore. Također, kod kompenziranih bolesnika koji ne toleriraju propranolol i nadolol može se primijeniti nebivolol.
Prognoza. Uz racionalni pristup i mjere prevencije kod više od 50 % bolesnika može se spriječiti krvarenje iz varikoziteta. Samo krvarenje praćeno je visokom stopom smrtnosti (30 - 40 %). Nakon endoskopske intervencije kod 30 - 40 % bolesnika dolazi do njihovoga povrata unutar godine dana, zbog čega su potrebne stalne endoskopske kontrole (mjesec do tri mjeseca nakon intervencije, a potom svakih šest do dvanaest mjeseci).
ASCITES
Definicija i etiopatogeneza. Ascites je naziv za patološko nakupljanje većih količina tekućine u slobodnoj trbušnoj šupljini. Pojava ascitesa kod bolesnika s cirozom jetre označava prijelaz iz kompenzirane u dekompenziranu kliničku fazu, a nastaje kada se tlak u portalnoj veni povisi iznad razine od 12 mmHg. Osnovni patofiziološki mehanizam nastanka ascitesa u cirozi jetre uključuje porast hidrostatskoga tlaka u portalnoj veni (portalna hipertenzija) koji dovodi do pojačane transudacije tekućine u trbušnu šupljinu. Tome pridonosi i aktivacija sustava renin-angiotenzin-aldosteron koja se javlja kao posljedica sustavne vazodilatacije izazvane pojačanom produkcijom dušičnoga oksida kao odgovor na porast tlaka u portalnoj veni (prethodno opisano). Aktivacija ovoga sustava dovodi do zadržavanja natrija i tekućine u organizmu, što osigurava stalnu obnovu intravskularnoga volumena i kontinuirano stvaranje ascitesa. U kasnijim fazama stvaranju ascitesa pogoduje i nastanak hepatorenalnoga sindroma uslijed smanjenje glomerularne filtracije (opisano u nastavku). Manjim dijelom stvaranju ascitesa pogoduje i pad koloidno-osmotskoga tlaka plazme uvjetovan smanjenom sintetskom funkcijom jetre (hipoalbuminemija).
Klinička slika i fizikalni pregled. Klinički se ascites jasno očituje kod prisutnosti veće količine tekućine što dovodi do povećanja opsega trbuha koji u kasnijim fazama biva izrazito uvećan, tvrd i napet (hipertenzivni ascites). Manje količine slobodne tekućine teže je klinički uočiti. Bolesnici se žale na tupu bolnost i napetost u trbuhu, osjećaj rane sitosti, a zbog pritiska na ošit često imaju i dispnoične tegobe i ulažu dodatan napor pri disanju. Pri fizikalnom se pregledu veća količina ascitesa (iznad 1500 ml) može dokazati perkusijom u ležećem položaju te pomakom mukline pri premještanju na bočni položaj. Manja količina ascitesa dokazuje se u geno-kubitalnom položaju pri čemu se tekućina skuplja u prednjem dijelu trbuha oko pupka, što se može dokazati perkusijom (muklina).
Dijagnoza se postavlja na osnovi kliničkoga pregleda i ultrazvuka abdomena, a dijagnostički postupak može se dopuniti dijagnostičkom paracentezom koja najviše smisla ima kod nejasne etiologije ascitesa i pri sumnji na spontani bakterijski peritonitis (niže opisan). Ultrazvuk se izvodi na bolesniku u ležećem položaju, a najraniji znak ascitesa je nalaz tekućine (anehogena zona) u području oko mokraćnoga mjehura (Douglasov prostor) te između jetre/slezene i ošita. Ultrazvukom se mogu detektirati i manje količine ascitesa (> 100 ml). U kasnijim se fazama jasno uočava prisutnost tekućine i u desnom hepatorenalnom i lijevom splenorenalnom prostoru, kao i u ostatku trbušne šupljine u kojemu se identificiraju crijevne vijuge koje plutaju unutar tekućine. Punkcija acitesa samo u dijagnostičke svrhe (dijagnostička paracenteza) rijetko se izvodi, a dobiveni sadržaj analizira se biokemijski, citološki i mikrobiološki. Biokemijska analiza uključuje određivanje broja leukocita, albumina, amilaza, glukoze i laktat dehidrogenaze. Povećani broj leukocita te povišene vrijednosti glukoze i laktat dehidrogenaze sugeriraju na infekcijski proces, a povišene vrijednosti amilaza na pankreasnu patologiju. Određivanje gradijenta između vrijednosti serumskih albumina i albumina iz ascitesa (SAAG, engl. serum-ascites albumin gradient) pomaže u diferencijaciji uzroka acitesa (Tablica 4.43.). Citološka analiza i nalaz malignih stanica može upućivati na hepatocelularni karcinom kod bolesnika s cirozom jetre ili na karcinomatozu peritoneuma. Mikrobiološka obrada (kultura ascitesa) ima ulogu u identifikaciji uzročnika intraabdominalne infekcije.
|
Tablica 4.43. Diferencijalno-dijagnostički značaj određivanja albumina u ascitesu i SAAG-a
|
|
Kliničko stanje
|
SAAG*
|
Albumini u ascitesu**
|
|
Ciroza jetre
|
Visoki
|
Niski
|
|
Maligni ascites
|
Niski
|
Visoki
|
|
Kardijalni ascites
|
Niski
|
Visoki
|
|
*Tumačenje vrijednosti: visoki označava vrijednost veću od 1.1 g/dL, a niski manju od 1.1 g/dL
**Tumačenje vrijednosti: visoki označava vrijednost veću od 2.5 g/dL, a niski manju od 2.5 g/dL
|
Liječenje ascitesa u sklopu ciroze jetre podrazumijeva pridržavanje općih napomena, primjenu diuretika, izvođenje terapijske paracenteze te eventualno TIPS-a.
Opće napomene. Svi bolesnici s ascitesom trebaju smanjiti unos soli (natrija) u organizam i to na dozu manju od 2 g/dan, a kod izražene hiponatrijemije (radi se o dilucijskoj hiponatrijemiji) indicirana je i restrikcija unosa tekućine na manje od 1000 ml/dan. Bolesnici bi trebali izbjegavati uzimanje nesteroidnih protuupalnih lijekova, kao i ACE inhibitora ili antagonista angiotenzinskih receptora.
Diuretska terapija. Diuretici se u liječenju ascitesa uzrokovanoga cirozom jetre uvode kada se njegova kontrola ne može postići ograničenjem unosa soli. Diuretik izbora je spirinolakton, aldosteronski antagonist koji oponira učinak aldosterona (retencija natrija i tekućine) te tako smanjuje negativni učinak renin-angiotenzin sustava. Inicijalna doza je 100 mg/dan, a postupno se podiže svakih tri do pet dana za 100 mg do ciljne doze od 400 mg/dan (nekada se koriste i više doze). Tijekom titriranja doze potrebno je pomno pratiti bolesnika (diureza, kalijemija, ginekomastija). Kod nepodnošenja ili kontraindikacije za liječenje sprinolaktonom, može se koristiti amilorid s početnom dozom od 5 - 10 mg/dan. Ako se ne postiže zadovoljavajuća diureza uz ove diuretike, u terapiju se uvodi i furosemid u dnevnoj dozi od 40 do 160 mg/dan. Doze diuretika treba prilagoditi kliničkome stanju bolesnika (diureza, praćenje težine bolesnika, elektrolitni status, krvni tlak, podnošenje lijeka i sl.). Diuretska terapija uspješna je kada bolesnici izgube do 1 kg tjelesne težine u prvom tjednu liječenja, i 2 kg svakoga narednog tjedna. Dozu diuretika treba smanjiti kod bolesnika koji izgube više od 0,5 kg/dan ako nemaju perifernih edema ili više od 1 kg/dan ako imaju periferne edeme.
Terapijska paracenteza. Mehanička evakuacija ascitesa (terapijska paracenteza) indicirana je kod bolesnika s hipertenzivnim ascitesom koji je refrakteran na standardnu diuretsku terapiju i dovodi do jasnih kliničkih manifestacija (npr. dispneja), kao i kod bolesnika koji iz nekoga razloga ne mogu uzimati diuretike. Postupak dovodi do simptomatskoga olakšanja za bolesnika, a kao prevenciju brzoga recidiva i naglih cirkulatornih promjena bolesnicima se za svaku litru odstranjenoga ascitesa intravenski nadoknadi 6 - 8 g albumina, a osobito kod odstranjenja više od 5 litara tekućine (engl. large-volume paracentesis, LVP). Punkcije se ponavljaju sve dok se ascites ne ukloni u potpunosti ili do prihvatljivoga simptomatskog olakšanja uz nastavak prethodno opisanoga liječenja diureticima koji bi trebali smanjiti nastajanje ascitesa.
Transjugularni intrahepatični portokavalni šant (TIPS) koristi se u liječenju refrakternoga ascitesa kod oblika otpornih na klasičnu, prethodno opisanu terapiju, i to kod bolesnika kod kojih se planira transplantacija jetre. Radi se o radiološkoj proceduri pri kojoj se transjugularnim pristupom umeće metalni stent između ogranka hepatalne vene i portalne vene koji osigurava drenažu venske krvi u sustav donje šuplje vene. Poboljšanje nakon navedenoga postupka bilježi se kod oko 75 % bolesnika. Najčešće komplikacije koje prate ovu proceduru su razvoj hepatalne encefalopatije, infekcija te stenoza ili okluzija stenta. Stentovi koji se danas koriste izgrađeni su od posebnih materijala koji smanjuju mogućnost tromboze i okluzije, a u slučaju njihovoga razvoja može se pokušati rekanalizacija balonskom dilatacijom, lokalnom trombolizom ili postavljanjem novoga stenta.
Prognoza. Pojava ascitesa kod bolesnika s cirozom jetre predstavlja loš prognostički znak koji povećava smrtnost (vjerojatnost dvogodišnjega i petogodišnjeg preživljenja nakon prve pojave ascitesa iznosi 50 odnosno 20 %).
SPONTANI BAKTERIJSKI PERITONITIS
Definicija i etiopatogeneza. Spontani bakterijski peritonitis označava infekciju ascitesa u odsutnosti intraabdominalnoga izvora infekcije (kolecistitis, kolangitis, ruptura šupljega organa i sl.), a razvija se kod oko 20 % bolesnika s ascitesom u sklopu ciroze jetre. Nekoliko je mehanizama kojima se nastoji opisati nastanak spontanoga bakterijskog peritonitisa. Osnovni događaj u patogenezi ove komplikacije je translokacija ili migracija bakterija kroz stijenku crijeva u mezenterijalne limfne žile i čvorove čemu pogoduje poremećaj lokalnih i sistemskih imunoloških mehanizama, kao i sindrom bakterijskoga prerastanja koji nastaje uslijed smanjenoga crijevnog motiliteta što se često susreće kod bolesnika s cirozom jetre. Pretpostavlja se da kontaminacija ascitesa nastaje uslijed oštećenja (rupture) limfnih vodova koji sadrže crijevne bakterije, što je posljedica povećanoga protoka i tlaka povišenoga uslijed portalne hipertenzije. Nastanku i razvoju infekcije ascitesa pridonosi i njegova smanjena baktericidna aktivnost. Najčešći uzročnici spontanoga bakterijskog peritonitisa su Escherichia coli, Klebsiella pneumoniae i Streptococcus pneumoniae.
Klinička slika spontanoga bakterijskog peritonitisa je nespecifična. Najčešće manifestacije su vrućica, bolovi u trbuhu, pogoršanje mentalnoga statusa (hepatalna encefalopatija) te osjetljivost trbušne stijenke, a često se razvija i paralitički ileus. Spontani bakterijski peritonitis javlja se samo kod bolesnika sa značajnom količinom ascitesa. Kod jedne trećine bolesnika bolest je u potpunosti asimptomatska i dokazuje se punkcijom ascitesa zbog nekoga drugog razloga.
Dijagnoza se postavlja na osnovi kliničke slike i dijagnostičke punkcije ascitesa (paracenteza). Paracentezu treba izvesti što ranije pri sumnji na ovo stanje, prije uvođenja antimikrobne terapije. Dobiveni uzorak ascitesa potrebno je proslijediti na biokemijsku i mikrobiološku analizu (u preporukama stoji da se najprije provede uzorkovanje za biokemijsku analizu, potom se igla kojom je punkcija izvršena zamijeni novom, sterilnom iglom te se provede uzorkovanje, tj. inokulacija ascitesa u bočicu za hemokulturu s podlogom). Ključni nalazi za postavljanje ove dijagnoze su povećan broj polimorfonukleara (> 250/mm3 ascitesa) i/ili pozitivan nalaz kulture ascitesa na isključivo jedan bakterijski soj.
Zbog ozbiljnosti i čestoga previda ove dijagnoze, potrebno je obaviti abdominalnu punkciju kod svih bolesnika s cirozom jetre koji imaju neki od navedenih čimbenika: značajno pogoršanje u vidu povećanja ascitesa, novonastali ascites, značajno pogoršanje općega stanja bolesnika, vrućica (> 37,8℃), bolovi u trbuhu, povećana osjetljivost trbušne stijenke, promjene u mentalnome statusu, ileus, hipotenzija, laboratorijski pokazatelji infekcije, acidoza, pogoršanje renalne funkcije te gastrointestinalno krvarenje.
Diferencijalna dijagnoza. Kliničko stanje u kojemu je broj polimorfunkuleara veći od 250/mm3 ascitesa, a kultura ascitesa negativna, nazivamo neutrofilni ascites, a postupanje i liječenje jednako je kao i za spontani bakterijski peritonitis. Suprotna situacija koja uključuje pozitivnu kulturu ascitesa na jedan bakterijski soj uz broj polimorfonukleara manji od 250/mm3 ascitesa naziva se monomikrobni neneutrofilni ascites i liječi se jednako kao i spontani bakterijski peritonitis kada su prisutni i drugi znaci infekcije, a ako nisu prisutni, zahtijeva ponovnu abdominalnu punkciju za 48 sati. Mikrobiološki nalaz izolacije više bakterijskih sojeva iz ascitesa uz broj polimorfonuklearnih leukocita manji od 250/mm3 najčešće je posljedica traumatske punkcije crijeva i naziva se polimikrobni bakterijski ascites.
Liječenje treba započeti odmah kod svih bolesnika s brojem polimorfonukleara većim od 250/mm3 ascitesa, bez obzira na nalaz mikrobiologije. Terapiju izbora predstavljaju cefalosporini treće generacije, najčešće cefotaksim koji se daje intravenski u dozi od 3 x 2 g ili ceftriakson u dozi od 1 x 2 g. Liječenje se treba provoditi sve dok broj polimorfonukleara ne padne ispod 250/mm3 ascitesa. Ponovna, kontrolna abdominalna punkcija preporuča se 48 sati od početka antimikrobnoga liječenja te se na osnovi novoga nalaza dalje korigira i usmjerava liječenje: 1) ako je broj polimorfonukleara manji od 250/mm3 ascitesa, terapija se može prevesti na peroralni oblik (obično fluorokinoloni), a antimikrobno liječenje trebalo bi trajati najmanje pet dana; 2) ako je broj polimorfonukleara veći od onog prije početka terapije, treba tražiti moguće uzroke sekundarnoga peritonitisa; 3) ako je broj polimorfonukleara manji od početnoga, ali i dalje povišen, nastavlja se započeto liječenje uz ponovnu reevaluaciju za 48 sati. Primjenu antibiotika treba prilagoditi nalazu antibiograma ako se izolira određeni bakterijski soj. Ako se radi o spontanom bakterijskom peritonitisu koji je nastao 48 sati od primitka u bolnicu, postiže se puno slabiji odgovor na klasični empirijski izbor antimikrobne terapije te se kod njih liječenje može započeti i s rezervnim antibioticima, osobito ako su bolesnici u lošijem kliničkom stanju (imipenem, ertapenem, vankomicin). U svrhu prevencije pogoršanja renalne funkcije kod bolesnika s ranije narušenom bubrežnom funkcijom preporuča se intravenska primjena albumina i to po shemi 1.5 g/kg u trenu postavljanja dijagnoze te 1 g/kg treći dan od prve doze (doza albumina ne bi trebala prelaziti 100 g po primjeni).
Profilaksa. Primarna profilaksa spontanoga bakterijskog peritonitisa provodi se u određenoj skupini bolesnika s dekompenziranom cirozom jetre, najčešće kod onih koji su hospitalizirani zbog krvarenja iz probavnoga sustava, a lijek izbora predstavlja ceftriakson (1 x 2 gr intravenski), sve dok se ne prekine karencija i bolesnik može uzimati peroralnu terapiju - kada se nastavlja s norfloksacinom u dozi od 400 mg/dan. Sekundarna profilaksa rezervirana je za bolesnike koji su preboljeli jednu ili više epizoda spontanoga bakterijskog peritonitisa, a više je lijekova kojima se ona provodi: norfloksacin 1 x 400 mg/dan, sulfometoksazol-trimetoprim 1 x 960 mg ili ciprofloksacin 1 x 500 mg.
Prognoza. Kao i razvoj drugih komplikacija, pojava spontanoga bakterijskog peritnoitisa predstavlja loš prognostički znak kod bolesnika s cirozom jetre. Smrtnost bolesnika sa spontanim bakterijskim peritonitisom za vrijeme hospitalizacije vrlo je visoka i iznosi 30 do 40 %. Dvije trećine bolesnika razvit će recidiv infekcije unutar jedne godine. Stopa smrtnosti kod ovih bolesnika unutar prve godine ide i do 50 %.
HEPATALNA ENCEFALOPATIJA
Definicija i etiopatogeneza. Hepatalna encefalopatija naziv je za moždanu disfunkciju koja se javlja u uznapredovaloj fazi jetrene bolesti, a povezana je sa smanjenom detoksikacijskom funkcijom jetre i razvojem kolateralne cirkulacije, zbog čega različite neurotoksične tvari dospijevaju u sistemsku cirkulaciji zaobilazeći jetru te u konačnici prolaze krvno-moždanu barijeru i dospijevaju u središnji živčani sustav. Da se radi o neurotoksinima kao patofiziološkoj osnovi bolesti govore dvije činjenice: hepatalna encefalopatija razvija se i kod bolesnika s relativno očuvanom funkcijom jetre, a u prisutnosti razvijenih kolaterala, kao i bolesnika sa značajno narušenom funkcijom jetre, bez prisustva kolateralne cirkulacije, jer u obje situacije neurotoksini dospijevaju u sistemsku cirkulaciju bez da su prošli odgovarajući metabolički put u jetri. Najbolje proučen i opisan neurotoksin koji pogoduje razvoju hepatalne encefalopatije je amonijak, iako su opisane uloge i drugih neurotoksina.
Amonijak nastaje u crijevima razgradnjom proteina, aminokiselina, ureje te dušičnih baza (purini, pirimidini), a u tome veliku ulogu imaju crijevne bakterije. Amonijak koji se apsorbira iz crijeva normalno dolazi u jetru gdje biva razgrađen na ureju i glutamin te se tako eliminira njegov potencijalni toksični učinak. Povećana količina amonijaka u sistemskoj cirkulaciji dovodi do njegove difuzije u središnji živčani sustav gdje ostvaruje različite neurotoksične učinke (mijenja promet aminokiselina, vode i elektrolita kroz membranu neurona te inhibira stvaranje postsinaptičkih potencijala) koji rezultiraju moždanom disfunkcijom te razvojem različitih psihijatrijskih i neuroloških manifestacija.
Ostali neurotoksini. Osim amonijaka, i druge molekule mogu djelovati kao neurotoksini i pridonijeti razvoju hepatalne encefalopatije. U tom se pogledu spominju aromatične aminokiseline kao što su fenilalamin, tirozin i triptofan koje u središnjem živčanom sustavu mogu djelovati kao lažni neurotransmiteri koji mogu inteferirati s neurotransmisijom posredovanom dopaminom ili noradrenalinom. Također, bitnu ulogu ima i smanjena razgradnja gama-aminomaslačne kiseline (GABA) u jetri, glavnoga inhibitornog neurotrasmitera u središnjem živčanom sustavu koji se stvara u probavnom sustavu. I druge tvari mogu imati utjecaj na razvoj hepatalne encefalopatije, na primjer merkaptani, magenzij, monoamini i endogeni opijati.
Rizični čimbenici koji pridonose razvoju hepatalne encefalopatije uključuju sva stanja i bolesti koje mogu pridonijeti povećanoj produkciji navedenih neurotoksina, koja premašuje sposobnost jetre da ih metabolizira i neutralizira. To su: prekomjeran unos proteina putem hrane, gastrointestinalno krvarenje, konstipacija, infekcije (uključujući spontani bakterijski peritonitis), lijekovi (depresori središnjega živčanog sustava), portosistemski spojevi (TIPS), progresivno jetreno oštećenje te razvoj hepatocelularnoga karcinoma.
Klinička slika. Hepatalna encefalopatija u pravilu se postupno razvija i obuhvaća širok spektar neuropsihijatrijskih simptoma i znakova. Poremećaj se najprije prezentira slabljenjem kognitivnih funkcija (zaboravljivost, letargija, depresija) i promjenom bioritma sna (spavaju tijekom dana, a noću bivaju budni). Postupno dolazi do progresije poremećaja stanja svijesti pri čemu postaju najprije somnolentni, a potom i soporozni i na kraju komatozni. Također, bolesnici mogu ispoljavati bizarne oblike ponašanja i dezorijentaciju. U fizikalnom pregledu dominira distalni tremor i foetor haepaticus.
Dijagnoza se u kliničkoj praksi postavlja već na osnovi anamnestičkih podataka, kliničke slike i laboratorijskoga određivanja vrijednosti amonijaka, iako ne postoji jasna korelacija između vrijednosti amonijaka i težine kliničke slike. Ipak, kod bolesnika s novonastalim neuropsihijatrijskim poremećajem preporuča se konzultacija neurologa, kompjuterizirana tomografija mozga i elektroencefalografija kako bi se isključio drugi intrakranijski proces koji se može isto ili slično klinički očitovati.
Liječenje započinje identifikacijom potencijalnoga rizičnog čimbenika koji je kod bolesnika doveo do razvoja hepatalne encefalopatije svojim utjecajem i njegovim uklanjanjem. Simptomatsko poboljšanje nastoji se postići smanjenim unosom proteina, primjenom laksativa i antibiotika, što se temelji na činjenici da u nastanku amonijaka iz proteina u crijevima posreduju crijevne bakterije.
Opće preporuke. Bolesnicima se treba ograničiti unos proteina na najviše 60 - 80 mg/dan, a potrebe za proteinima trebaju se osigurati iz biljnih izvora, s obzirom na to da ih se tolerira bolje nego one iz mesnih izvora. Kod bolesnika s krvarenjem u probavni sustav preporuča se što ranija eliminacija sadržaja krvi iz probavne cijevi kako bi se smanjila produkcija amonijaka, a to se postiže primjenom magnezijeva citrata (120 ml per os ili per sondam svaka tri do četiri sata dok se ne postigne stolica bez primjesa krvi). Također, kod ovih bolesnika treba izbjegavati primjenu opioida i sedativa koja se metaboliziraju putem jetre te se u slučaju potrebe za sedacijom kod agitiranih bolesnika koristi oksazepam u dozi od 10 do 30 mg.
Laktuloza je sintetički disharad koji predstavlja osnovu liječenja hepatalne encefalopatije. Ona se u crijevima razgrađuje do kratkolančanih masnih kiselina koji dovode do acidifikacije kolona što pogoduje stvaranju amonijevoga iona iz amonijaka (NH3 + H+ ↔ NH4+) koji se ne može apsorbirati. Također, laktuloza dovodi i do promjene crijevne flore što smanjuje i samu produkciju amonijaka. Inicijalna peroralna doza iznosi 3 – 4 x 30 ml/dan (optimalna doza je ona uz koju bolesnik ima dvije do tri meke stolice na dan). Kod bolesnika koji ne mogu laktulozu uzeti peroralnim putem primjenjuje se u obliku mikroklizme u obliku otopine 200 g/300 mL fiziološke otopine ili 5 %-tne glukoze, koja se primjenjuje svakih četiri do šest sati.
Peroralna primjena antibiotika također može biti od koristi u smanjenju produkcije amonijaka uništavanjem normalne crijevne flore. Kao lijek izbora preporuča se neapsorbirajući rifaksimin u dozi od 2 x 550 mg/dan, metronidazol 3 x 250 mg/dan ili neomicin 3 x 500 - 1000 mg/dan. Navedena primjena antibiotika indicirana je kod bolesnika koji ne pokazuju klinički odgovor na primjenu isključivo laktuloze.
Prognoza. Hepatalna encefalopatija smatra se reverzibilnim stanjem te liječenjem i uklanjanjem predisponirajućega čimbenika dolazi i do oporavka kliničkoga stanja. Kod svih bolesnika koji su imali epizodu hepatalne encefalopatije preporuča se nastaviti primjenu laktuloze s ili bez antibiotika (neomicin, metronidazol) u svrhu prevencije recidiva.
HEPATORENALNI SINDROM
Definicija i etiopatogeneza. Hepatorenalni sindrom predstavlja funkcionalni poremećaj bubrežne funkcije koji se razvija kod bolesnika s uznapredovalom bolešću jetre (kronična ili akutna hepatalna insuficijencija), u odsutnosti patomorfoloških promjena na bubrezima. Vjerojatnost nastanka hepatorenalnoga sindroma kod bolesnika s cirozom jetre iznosi 18 % unutar prve godine od postavljanja dijagnoze i 39 % unutar pet godina. Pretpostavljeni mehanizam razvoja poremećaja bubrežne funkcije sličan je onome u razvoju ascitesa, a uključuje specifične hemodinamske promjene. Razvoj portalne hipertenzije uvjetuje povećanu sintezu dušičnoga oksida i drugih vazodilatatora s ciljem smanjenja otpora i pada tlaka unutar portalne vene, no navedeni vazodilatatori djeluju i na druge krvne žile dovodeći do sistemske vazodilatacije i pada krvnoga tlaka. Uslijed pada krvnoga tlaka dolazi do smanjenja perfuzije bubrega što opet uzrokuje smanjenje glomerularne filtracije. Kao odgovor na nastalu hipoperfuziju, bubreg pojačano stvara renin i aktivira sustav renin-angiotenzin-aldosteron koji zajedno s drugim kompenzacijskim sistemskim vazokonstriktorima dovodi do izražene bubrežne (većinom kortikalne) vazokonstrikcije koja dodatno pogoršava bubrežnu perfuziju i glomerularnu filtraciju. Posljedično nastalim prilikama dolazi do smanjenoga stvaranja urina (oligurija) i porasta vrijednosti dušičnih metabolita (azotemija).
Klinička slika. Ovisno o brzini razvoja ovoga sindroma, razlikujemo dva tipa hepatorenalnoga sindroma. Tip I razvija se brzo, obično unutar dva tjedna, i povezan je s drugim akutnim komplikacijama ciroze jetre (spontani bakterijski peritonitis, krvarenje iz probavnoga sustava), dok se tip II razvija postupno tijekom više tjedana i mjeseci i nađe se kod bolesnika s uznapredovalom, ali stabilnom cirozom jetre. U kliničkoj slici hepatorenalnoga sindroma dominiraju simptomi i znakovi jetrenoga zatajenja uz postupni razvoj oligoanurije i drugih pokazatelja poremećaja bubrežne funkcije.
Dijagnoza hepatorenalnoga sindroma kod bolesnika s kroničnom bolesti jetre (ciroza) postavlja se na osnovi kliničkih pokazatelja i laboratorijskih nalaza. Dijagnostički kriteriji za hepatorenalni sindrom uključuju: 1) akutno ili kronično zatajenje jetre s portalnom hipertenzijom, 2) serumski kreatinin veći od 132 µmol/L ili klirens kreatinina manji od 40 ml/min, 3) odsutnost šoka, infekcije, nefrotoksičnih lijekova i hipovolemije, 4) odsutnost poboljšanja bubrežne funkcije nakon ukidanja diuretika i volumne nadoknade te 5) proteinurija manja od 5 g/L, bez ultrazvučnoga dokaza opstruktivne uropatije ili znakova bolesti bubrežnoga parenhima. Da bi se postavila dijagnoza hepatorenalnoga sindroma, moraju biti zadovoljeni svi navedeni kriteriji.
Liječenje. Glavni ciljevi liječenja su korekcija precipitirajućih čimbenika (infekcije, hipovolemija, primjena nefrotoskičnih lijekova) te popravljanje hemodinamskih poremećaja. Liječenje obuhvaća farmakološke i nefarmakološke mjere.
Farmakološke mjere liječenja mogu biti nespecifične (optimalna hidracija, primjena antibiotika, isključivanje diuretika koji štede kalij) te specifične, kojima se nastoji poboljšati splanhična hemodinamika. U tu se svrhu primjenjuju lijekovi koji dovode do vazonkonstrikcije splanhičkih krvnih žila čime se poboljšava perfuzija bubrega. Od svih vazokonstriktora najčešće se upotrebljava terlipresin, analog vazopresina koji se primjenjuje kroz 14 dana intravenskom infuzijom u dozi od 0,5 do 2 mg tijekom četiri do šest sati. Ostali analozi vazopresina (ornipresin), analozi somatostatina (oktreotid) te adrenergički agonisti (noraderenalin) imaju slabije rezultate pa se rijetko primjenjuju u tu svrhu.
Nefarmakološke mjere liječenja obuhvaćaju različite postupke. Transjugularni intrahepatični portosistemski šant (TIPS) smanjuje portalnu hipertenziju te poboljšava perfuziju bubrega što može imati pozitivan učinak na oporavak bubrežne funkcije. Metode nadomjesnoga liječenja bubrežne funkcije primjenjuju se u strogim indikacijama (hipervolemija, hiperkalijemija, metabolička acidoza), a kontinuirane metode imaju prednost u odnosu na intermitentne zbog lošega stanja bolesnika i pridružene hemodinamske nestabilnosti. Potpora funkcije jetre može se postići primjenom ekstrakorporalnih albuminskih dijaliza (Prometheus, MARS) kojima se pomoću membrana i adsorbensa odstranjuju toksini vezani za proteine plazme, a obično se koriste kao premosnica do transplantacije jetre koja predstavlja jedino učinkovito liječenje kod ovih bolesnika.
Prognoza. Navedenim postupcima liječenja postižu se skromni rezultati, osobito kod bolesnika s hepatorenalnim sindromom tip I od kojega većina oboljelih umre unutar mjesec dana od razvoja komplikacije. Kod bolesnika s hepatorenalnim sindromom tip II, koji su kandidati za transplantaciju jetre, hemodijaliza se nameće kao prijelazno rješenje.
HEPATOPULMONALNI SINDROM
Definicija i etiopatogeneza. Hepatopulmonalni sindrom označava funkcionalni poremećaj respiratorne funkcije koji se očituje razvojem klinički značajne hipoksemije, a povezuje se s uznapredovalom bolesti jetre. Ovaj poremećaj razvija se kod 5 do 30 % bolesnika u terminalnoj fazi ciroze jetre. Pretpostavljeni patofiziološki mehanizam uključuje nastanak funkcionalnoga desno-lijevog šanta, što je posljedica djelovanja vazodilatatora, osobito dušičnoga oksida, koji se u pojačanoj mjeri sintetiziraju kao odgovor na razvoj portalne hipertenzije. Vazodilatatori dovode do izražene dilatacije plućnih kapilara pri čemu omogućavaju brži protok krvi kroz njih, što nosi i manji stupanj oksigenacije, a pogoduju i otvaranju intrapulmonalnih šanteva između plućne arterije i vene zbog čega deoksigenirana krv iz plućne arterije dospijeva u plućne vene zaobilazeći prolaz kroz alvelokapilarnu membranu. Navedene prilike dovode do razvoja značajne hipoksemije koja je odgovorna za kliničke manifestacije ovoga sindroma. Poremećaju funkcije disanja često pridonosi i mehanički pritisak ascitesa na pluća, kao i pleuralni izljevi koji mogu nastati zbog patološke komunikacije preko ošita, kao i značajne hipoalbuminemije. Nasuprot ovome, plućna hipertenzija povezana s cirozom jetre daleko se rjeđe susreće (kod oko 0,5 % bolesnika s cirozom jetre), i to češće kod žena, osobito onih s autoimunom podlogom, a uključuje porast tlaka unutar plućne vaskularne mreže što se povezuje s hiperdinamičnom cirkulacijom kroz pluća i prekomjernom osjetljivošću na vazokonstriktore koji se sintetiziraju kao odgovor na sistemsku vazodilataciju. Početne promjene su reverzibilne, no s razvojem bolesti dolazi do proliferacije endotelnih stanica i mikrotromboza što uvjetuje nastanak ireverzibilne plućne hipertenzije.
Klinička slika. Dominantna tegoba koja se javlja kod ovih bolesnika je dispneja. Ona je progresivne naravi te se najprije javlja samo pri naporu, a kasnije je prisutna i u mirovanju. Karakteristično je dispneja izraženija pri uspravnom položaju (platipneja). U najtežim se oblicima razvija i centralni tip cijanoze, a ako poremećaj traje dulje vrijeme, razvijaju se i batićasti prsti.
Dijagnoza. Na hepatopulmonalni sindrom treba pomišljati kod bolesnika koji imaju sljedeći trijas: kronična jetrena bolest, značajna hipoksemija i odsutnost bolesti srca i/ili pluća. Za konačnu i sigurnu potvrdu dijagnoze koriste se slikovne metode kojima je moguće prikazati dilataciju plućnoga krvožilja i intrapulmonalne šanteve, a to su kontrastna ehokardiografija (primjena kontrasta u perifernu venu te praćenje dinamike pojave u desnom i lijevom srcu), scintigrafija makroagregatima albumina obilježenih tehnecijem te HRCT angiografija. Bitno je provesti i druge dijagnostičke metode kojima se isključuju potencijalne bolest srca i pluća koje mogu dovesti do sličnih manifestacija. Kateterizacija desnoga srca i mjerenje plućnih tlakova ima diferencijalno dijagnostički značaj u pogledu potvrde ili isključenja plućne hipertenzije.
Liječenje hepatopulmonalnoga sindroma ne daje značajne rezultate. Jedina terapijska opcija koja može značajno poboljšati respiratornu funkciju je transplantacija jetre. Prije odluke o transplantaciji kod ovih je bolesnika potrebna kateterizacija desnoga srca jer srednji arterijski tlak plućne arterije viši od 45 mmHg predstavlja apsolutnu kontraindikaciju za transplantaciju. Inhalacijska primjena inhibitora dušičnoga oksida i faktora angiogeneze do sada nije pokazala veću kliničku učinkovitost. U simptomatskom liječenju uglavnom se primjenjuje oksigenoterapija, ali i ona ima ograničen uspjeh. Bolesnicima s plućnom hipertenzijom koji nisu kandidati za transplantaciju mogu se davati selektivni plućni vazodilatatori (epoprostenol, bosentan, ambrisentan, sildenafil, tadalafil).
Prognoza. Razvoj hepatopulmonalnoga sindroma loš je prognostički znak i većina oboljelih umire unutar tri godine od postavljanja dijagnoze, dijelom od plućnih, dijelom od drugih komplikacija. Ako se provede transplantacija jetre prije razvoja plućne hipretenzije, dolazi do oporavka plućne funkcije u većine bolesnika, kao i kod hepatorenalnoga sindroma.
KOAGULOPATIJA I HEMORAGIJSKA DIJATEZA
Koagulopatija i hemoragijska dijateza česte su komplikacije ciroze jetre, a mogu se javiti zbog nekoliko razloga: 1) smanjenjem sintetske funkcije jetre dolazi i do smanjene sinteze većine faktora koagulacije; 2) splenomegalija je odgovorna za povećanu sekvestraciju trombocita zbog čega se razvija klinički značajna trombocitopenija (hiperslenizam) te 3) toksemija koja prati uznapredovalu fazu jetrene bolesti može djelovati kao depresor normalne funkcije koštane srži. Klinički, bolesnici su skloni spontanim krvarenjima (ekhimoze, petehije, epistaksa), krvarenju iz probavnoga sustava te na mjestima invazivnih procedura (središnji venski katater, biopsije, punkcije i sl.). Dijagnoza se postavlja određivanjem klasičnoga koagulograma i određivanjem broja trombocita: trombocitopenija, produljeno protrombinsko vrijeme i aktivirano parcijalno tromboplastinsko vrijeme (PV i APTV) uz snižen fibrinogen i antitrombin III. Primjena vitamina K kod ovih bolesnika ima ograničen učinak s obzirom na to da je oštećena sintetska funkcija jetre bez obzira na malapsorpciju vitamina topljivih u mastima, pa tako i vitamina K. Osnovu liječenja čini primjena svježe smrznute plazme kojom se vrši supstitucija faktora zgrušavanja, iako je njezin vremenski učinak ograničen, pa se i ne primjenjuje rutinski, nego samo u slučaju krvarenja ili prije neophodnih invazivnih procedura. Transfuzija trombocita indicirana je kod bolesnika s aktivnim krvarenjem ili kod kritično niskih vrijednosti trombocita (< 5 x 109/L). Primjena eltrombopaga (trombopoetin) može reducirati potrebu za transfuzijom trombocita kod bolesnika s cirozom jetre i vrijednostima trombocita manjim od 50 x 109/L, ali primjena ovoga lijeka nosi rizik od razvoja tromboze portalne vene i arterijskih tromboembolijskih incidenata. U liječenju aktivnoga krvarenja kod ovih bolesnika može biti indicirana i primjena aktiviranoga faktora VII kao i protrombinskoga kompleksa.
Tumori jetre mogu biti benigni i maligni. Najčešći benigni tumori jetre su adenomi, hemangiomi te fokalna nodularna hiperplazija, dok su najčešći maligni tumori hepatocelularni karcinom, fibrolamelarni karcinom, angiosarkom te metastatski tumori (sekundarizmi).
HEPATOCELULARNI ADENOM
Definicija i epidemiologija. Hepatocelularni adenom predstavlja rijedak dobroćudni tumor jetre koji nastaje iz hepatocita. Znatno se češće javlja kod žena (više od 90 % slučajeva), i to najčešće u reproduktivnoj dobi (15 - 45 godina), zbog čega se pojavnost ovoga tumora najviše povezuje s učinkom ženskih spolnih hormona (estrogen).
Etiopatogeneza. Iako točan uzrok i mehanizam nastanka hepatocelularnoga adenoma nije razjašnjen, vjeruje se da se oni razvijaju kao posljedica specifičnih genetskih mutacija koje mogu biti uzrokovane različitim vanjskim podražajima. Pri tome se najčešće pojavnost tumora povezuje s učinkom estrogena što i potkrepljuje činjenica da se tumor najčešće razvija kod žena koje uzimaju oralnu hormonsku kontracepciju te se učestalost tumora povećava nakon uvođenja oralnih kontraceptiva u kliničku praksu. Ipak, pojavnost tumora kod muškaraca sugerira i na druge mehanizme i rizične čimbenike kao što su utjecaj androgena i anabolnih gukokortikoida, kao i poremećen odnos inzulina i glukagona (češća pojavnost tumora kod bolesnika sa šećernom bolesti i poremećajima skladištenja glikogena). Geni koji se najčešće povezuju s hepatocelularnim adenomom su TCF1 (gen za transkripcijski faktor 1), CTNNB1 (gen za β-katenin 1) te IL6ST (gen za signalni prijenosnik interleukina 6). Hepatocelularni adenomi koji se povezuju s mutacijama gena za β-katenin imaju veći rizik progresije u malignu formu (hepatocelularni karcinom).
Patologija. Hepatocelularni adenomi najčešće se pojavljuju solitarno, no kod jedne četvrtine bolesnika mogu se javiti i u multiploj formi. Tumori mogu biti različite veličine (1 - 30 cm), dobro su ograničeni od okolnoga jetrenog parenhima, iako ne moraju imati vezivnu čahuru. Histološki, tumor je građen od gredica hepatocita bez portalnih prostora i žučnih struktura. Kupferove stanice su rijetke i nefunkcionalne. Tumor obiluje dobro razvijenim spletom krvnih žila što nosi rizik od rupture i nastanka intraabdominalnoga krvarenja, osobito u tumorima bez vezivne čahure.
Klinička slika ponajprije ovisi o veličini tumorske mase. Mali tumori su asimptomatski i obično se slučajno otkriju prilikom dijagnostičke obrade trbuha zbog nekoga drugog razloga. Veći tumori mogu se prezentirati tupim bolom pod desnim rebrenim lukom ili u epigastriju s ili bez palpatorne tumorske mase. Žutica je rijetka, a može nastati uslijed kompresije tumora na žučne kanale što remeti normalnu drenažu žuči prema crijevima. Kod manjega broja bolesnika može nastati spontana ruptura tumora i hematoperiteonum što se prezentira slikom hemoragijskoga šoka i akutnoga abdomena. To se obično događa kod bolesnika s velikom tumorskom masom periferne lokalizacije.
Dijagnoza se postavlja na temelju anamnestičkih podataka, laboratorijskih nalaza i slikovnih dijagnostičkih metoda. Anamnestički podaci o uzimanju oralnih kontraceptiva ili anabolnih hormona mogu imati ključnu ulogu u postavljanju dijagnoze. Laboratorijski nalazi su nespecifični, a kod polovine bolesnika možemo naći povišene vrijednosti jetrenih transaminaza kao posljedica tumorskoga rasta i destrukcije okolnih hepatocita. U smislu diferencijalne dijagnoze preporuča se i određivanje α-fetoproteina (uredne vrijednosti ne isključuju postojanje hepatocelularnoga karcinoma), karcinoembrionalnoga antigena (metastaze kolorektalnoga karcinoma) te seroloških markera (amebijaza, ehinokokoza). Slikovne dijagnostičke metode uključuju ultrazvuk, kompjuteriziranu tomografiju (CT) ili magnetnu rezonacu (MRI). Ultrazvučni nalaz koji upućuje na hepatoceularni adenom uključuje okruglu, inhomogenu, hiperehogenu fokalnu leziju s hipoehogenim rubom ili prstenom s najčešćom lokalizacijom u desnom režnju jetre. Kod većih se tumora u sredini mogu naći znaci krvarenja i nekroze u vidu hipoehogene nepravilne zone. Doplerska metoda pokazuje naglašenu vaskularizaciju. Zbog nespecifičnih ultrazvučnih znakova i teže diferencijacije prema malignim formama, indiciran je kontrastni CT ili MRI jetre što omogućava detaljniju analizu i razagraničenje prema malignim tumorima. Biopsija i patohistološka analiza indicira se u nejasnim slučajevima, a nosi rizik od mogućnosti postproceduralnoga krvarenja.
Diferencijalna dijagnoza je široka i obuhvaća različite fokalne lezije jetre: apscese i ciste, fokalnu nodularnu hiperplaziju te druge dobroćudne i zloćudne jetrene tumore.
Liječenje. Kod svih je bolesnika potrebno prekinuti unos oralnih kontraceptiva ili anabolnih hormona. To često dovodi do regresije tumorske mase, iako rizik od maligne transformacije ostaje prisutan i dalje. Asimptomatske bolesnike potrebno je redovito pratiti, a kirurško liječenje indicirano je kod svih simptomatskih bolesnika, kao i kod bolesnika s nejasnom i upitnom dijagnozom. Kod bolesnica s većim tumorskim masama ne preporuča se trudnoća (dodatni rast tumora) ili se preporuča kirurška resekcija u prekoncepcijskoj skrbi. Ruptura i krvarenje iz tumora zbrinjavaju se kirurški ili interventnim radiološkim postupkom (transarterijska embolizacija tumora).
Prognoza. Kompletna spontana rezolucija hepatocelularnoga adenoma moguća je, ali izuzetno rijetka pojava. Rizik od maligne transformacije iznosi 4,2 %, stoga se svi bolesnici koji nisu kandidati za kirurško liječenje redovno prate (jednogodišnji ultrazvučni pregled te praćenje vrijednosti α-fetoproteina).
HEMANGIOM JETRE
Definicija i epidemiologija. Hemangiomi jetre najčešći su benigni tumori jetre mezenhimalnoga porijekla, građeni su od spleta krvnih žila i smatraju se kongenitalnim hamartomima. Učestalost hemangioma jetre u općoj populaciji iznosi i do 5 %. Tumori se češće javljaju kod žena nego kod muškaraca i to u omjeru od 4 - 6:1. Mogu se javiti u bilo kojoj životnoj dobi, ali se najčešće javljaju u trećem, četvrtom i petom desetljeću. Multiparitet predstavlja značajan čimbenik u razvoju hemangioma kod žena.
Etiopatogeneza. Kao i kod hepatocelularnoga adenoma, točan uzrok i mehanizam nastanka hemangioma jetre nije poznat. Do sada nije nađena poveznica između specifičnih genetskih mutacija i pojavnosti ovoga tumora. Smatra se da primjena glukokortikoida i estrogena, kao i sama trudnoća mogu potencirati nastanak i rast ovoga tumora.
Patologija. Makroskopski, radi se o dobro ograničenim tumorima bez vezivne čahure promjera obično do 5 centimetara. Obično su solitarni, ali mogu se naći i kao multiple lezije. Većinom su smješteni intrahepatalno, ali mogu se naći i u pedunkularnom obliku (na površini jetre s kojom su povezani strukturom nalik na peteljku). U rjeđim oblicima veličina hemangioma može prelaziti 10 centimetara (tzv. orijaški hemangiomi). Mikroskopski, hemangiomi su građeni od krvnih žila različitih veličina, a mjestimično mogu tvoriti veće šupljine ispunjene krvlju. Unutrašnjost vaskularnih prostora ispunjena je pravilnim endotelnim stanicama.
Klinička slika. Kao i kod hepatocelularnih adenoma, klinička slika ponajprije ovisi o veličini tumora, tako da ona može biti asimptomatska (manji tumori) ili se prezentirati nespecifičnim bolovima i nelagodom u gornjem trbuhu kod većih tumora. Opasnost od rupture i krvarenja veća je nego kod adenoma, a klinički se manifestira naglo nastalim bolom u trbuhu i razvojem hemoragijskoga šoka. Hemangiomi jetre mogu se naći i kao dio kliničke slike dobro diferenciranih nasljednih sindroma kao što su Klippel-Trenaunay-Weberov sindrom, Kasabach-Merrittov sindrom, Osler-Rendu-Weberova te Von Hippel-Lindauova bolest.
Dijagnoza se postavlja na osnovi kliničke slike, laboratorijskih nalaza te slikovnih metoda. Laboratorijski nalazi su nespecifični, a kod manjega broja bolesnika može se naći trombocitopenija kao rezultat destrukcije unutar krvožilnoga spleta tumora ili hipofibrinogenemija kao posljedica intratumorske fibrinolize. Tumorski markeri (a-fetoprotein, CA 19-9, CEA) su uredni. Ultrazvuk jetre predstavlja glavnu i ishodišnu dijagnostičku metodu u obradi bolesnika sa sumnjom na hemangiom jetre. Na ultrazvuku se tumor prikazuje kao solitarna, dobro ograničena, hiperehogena okrugla do ovalna tvorba glatkih kontura s dorzalnom akustičnom sjenom. Manje tumore kod kojih su promjeri krvnih žila manji te imaju sporije protoke teže je prikazati doplerskom metodom, što se može poboljšati primjenom ultrazvučnih kontrastnih sredstava. Ultrazvučni nalaz treba usporediti s nalazom CT-a ili MRI-a koji su značajno osjetljiviji u postavljanju ove dijagnoze (kontrastni CT ima osjetljivost od oko 66 %, a MRI od 96 %). Biopsija lezija za koje se sumnja da se radi o hemangiomima izbjegava se zbog mogućnosti izazivanja krvarenja.
Diferencijalna dijagnoza je široka i uključuje različite fokalne lezije jetre: sekundarizme, hepatocelularne karcinome, hepatocelularne adenome, fokalnu nodularnu hiperplaziju, kalcificirane ciste i apscese i sl.
Liječenje. Asimptomatske i male tumore koji ne nose rizik od rupture i krvarenja nije potrebno liječiti, nego se bolesnici trebaju redovno radiološki pratiti (ultrazvučni pregled svakih šest do dvanaest mjeseci). Kirurško liječenje indicirano je kod simptomatskih bolesnika, kao i kod bolesnika s velikim tumorima (> 10 cm) koji nose opasnost od rupture i krvarenja. U slučaju akutnoga krvarenja u obzir dolazi i transhepatična embolizacija tumorske mase. U novije se vrijeme sve više govori o mogućoj primjeni inhibitora faktora rasta te kinaznih inhibitora u svrhu smanjenja tumorske mase, što se temelji na nekolicini prikaza slučajeva kod kojih je zabilježeno smanjenje jetrenih hemangioma za vrijeme liječenja karcinoma kolona bevacizumabom (monoklonalno antitijelo koje inhibira aktivnost VEGF, vaskularnoga endotelnog faktora rasta).
Prognoza. Bolesnici s hemangiomima jetre u načelu imaju dobru prognozu. Maligna transformacija do sada nije dokazana. Glavna opasnost leži u rastu tumora i mogućnosti intraabdominalnoga krvarenja.
FOKALNA NODULARNA HIPERPLAZIJA
Definicija i epidemiologija. Fokalna nodularna hiperplazija predstavlja benignu proliferaciju hepatocita koja stvara formacije u jetri slične tumorima i predstavlja diferencijalno-dijagnostički problem prema drugim benignim tumorima jetre, osobito hepatocelularnom adenomu. Radi se o drugoj po učestalosti benignoj leziji jetre, odmah iza hemangioma. Fokalna nodularna hiperplazija najčešće se susreće kod žena u dobi između 20. i 50. godine života.
Etiopatogeneza ovoga poremećaja nije razjašnjena u potpunosti, ali se načelno smatra da se radi o proliferacijskom odgovoru na lokalizirane poremećaje cirkulacije. Hipoksija i posljedična nekroza hepatocita nakon vaskularnoga inzulta može složenim intraceularnim mehanizmima potaknuti kompenzatornu hiperplaziju okolnih hepatocita, što u konačnici rezultira nastankom hiperplastičnih nodusa koji nalikuju na cirozu jetre, no budući da su ograničeni na samo jedan dio jetre, često se govori i o „lokaliziranoj cirozi“.
Patologija. Makroskopski se fokalna nodularna hiperplazija očituje pojavom vidljivih čvorova koji nalikuju na tumore, a ograničeni su i gusto raspoređeni na jednom dijelu jetrenoga parenhima. Promjene su smještene subkapsularno i izbočene su na površini jetre. Presjekom nodula nalazimo karakteristični vezivni ožiljak iz kojeg se radijalno šire vezivni tračci prema površini tvorbe. Mikroskopski, hiperplastično nodusi građeni su od hepatocita posloženih u debele gredice između kojih nalazimo tračke vezivnoga tkiva s vaskularnim prostorima.
Klinička slika. Radi se o asimptomatskoj promjeni jetre koja se otkrije slučajno tijekom dijagnostičke obrade jetre iz nekoga drugog razloga ili tijekom operativne eksploracije abdomena te stvara diferencijalno dijagnostički problem naspram drugih fokalnih lezija jetre (pravi tumori).
Dijagnoza se postavlja na temelju slikovnih dijagnostičkih metoda. Ultrazvučno se fokalna nodularna hiperplazija prikazuje kao solitarna nodularna lezija glatkih kontura sa specifičnim nalazom hiperehogenoga centralnoga zvjezdastog uzorka krvnih žila (zvjezdasti ožiljak) uz prikaz protoka krvi poput žbica na kotaču. Za konačnu potvrdu dijagnoze potrebno je napraviti CT ili MRI jetre. Biopsija je rijetko indicirana.
Liječenje i prognoza. Liječenje ovih promjena nije potrebno, nego se primjenjuje ekspektativni stav (češće radiološko praćenje). U slučaju dvojbenih nalaza spram malignih tumora ili pri uočavanju brzoga rasta tvorbe, indicirano je kirurško liječenje. Do sada nema jasnih dokaza o riziku od maligne transformacije ovoga tumora.
HEPATOCELULARNI KARCINOM
Definicija i epidemiologija. Hepatocelularni karcinom predstavlja najčešći primarni maligni tumor jetre koji nastaje malignom transformacijom hepatocita. Učestalost ovoga malignoma različita je u različitim dijelovima svijeta i povezana je s učestalošću infekcije virusom hepatitisa B i C te s učestalošću alkoholne bolesti jetre koji predstavljaju najznačajnije rizične čimbenike za razvoj ovoga tumora. Visoka incidencija ovoga tumora bilježi se u nerazvijenim zemljama Azije i Afrike te u Kini gdje ona iznosi i do 100 novooboljelih na 100 000 stanovnika, dok je u razvijenim zemljama (sjeverna Europa, Amerika) ona značajno niža i iznosi 2 - 5 novooboljelih osoba na 100 000 stanovnika (u Republici Hrvatskoj ona iznosi 3,5 na 100 000 stanovnika). Hepatocelularni karcinom nešto se češće javlja kod muškaraca u odnosu na žene i to najčešće u dobi između 45. i 60. godine života. Osobe crne rase pokazuju veći rizik od obolijevanja od hepatocelularnoga karcinoma od osoba bijele rase.
Etiopatogeneza. Smatra se da hepatocelularni karcinom nastaje u uvjetima kronične jetrene lezije (u više od 90 % slučajeva povezan je s cirozom jetre) koju karakterizira upala i nekroza te posljedična regeneracija i proliferacija što u konačnici rezultira akumulacijom genetskih oštećenja (aktivacija onkogena, inaktivacija tumor supresorskih gena) koja uvjetuju malignu transformaciju hepatocita i nastanak hepatocelularnoga karcinoma. Glavni geni koji se povezuju s nastankom hepatocelularnoga karcinoma su tumorski supresorski gen P53 čija se inaktivacija otkrije u više od 50 % slučajeva te mutacije CTNNB1 gena (gen za β-katenin 1) koje se otkriju u više od 30 % slučajeva. Glavni rizični čimbenici koji se povezuju s nastankom hepatocelularnoga karcinoma su: 1) kronični virusni hepatitisi B i C (inkorporacija virusnoga genoma u genom domaćina može rezultirati nastankom genskih promjena koje uvjetuju malignu transformaciju inficiranoga hepatocita); 2) alkoholna ciroza jetre (ponavljajući ciklusi nekroze i regeneracije hepatocita povećavaju rizik od nastanka genetskih mutacija i maligne alteracije); 3) izloženost aflatoksinu (toksin plijesni Aspergillus flaus koja kolonizira uskladištene žitarice, a ima sposobnost izazivanja mutacija gena P53) te 4) ostali čimbenici (autoimuni hepatitis, primarna bilijarna ciroza, hemokromatoza, deficiti α1-antitripsina, nealkoholni steatohepatitis, nikotizam).
Patologija. Makroskopski, hepatocelularni karcinom može imati tri oblika: 1) masivni oblik koji se prezentira kao jedan veliki tumor, 2) multinodularni oblik koji se očituje s više čvorova u jetri te 3) difuzno infiltrirajući tumor koji prožima cijelu jetru. Histološki je hepatocelularni karcinom građen od atipičnih stanica koje nalikuju na hepatocite, a mogu stvarati tri slike: trabekularna slika (stanice tvore široke trabekule između kojih se nalaze sinusoidni prostori), pseudoglandularna slika (tumorske stanice okružuju lumene ispunjene žuči) i solidna slika (velike plohe slabo diferenciranih stanica). Nalaz žuči u tumoru je patognomoničan s obzirom na to da se ona ne nalazi niti u jednom drugom tumoru. Posebni tip hepatocelularnoga karcinoma je fibrolamelarni karcinom kojeg čine tračci i manje nakupine velikih atipičnih hepatocita s jako eozinofilnom i granuliranom citoplazmom. On se javlja kod mlađih osoba, češće kod muškaraca, i ima bolju prognozu od ostalih histoloških tipova ovoga karcinoma.
Širenje tumora. Hepatocelularni karcinom pokazuje sklonost ranoj invaziji krvnih žila te često dovodi do opstrukcije hepatalnih vena (Budd-Chiarijev sindrom) te portalne vene (portalna hipertenzija). Tumor također metastazira u regionalne (hilus jetre, oko gušterače i paraaortalni) te udaljene limfne čvorove. Udaljene se metastaze najčešće vide u plućima, koštanoj srži i nadbubrežnim žlijezdama, a nastaju hematogenim rasapom malignih stanica.
Klinička slika hepatocelularnoga karcinoma je nespecifična i često je prekrivena simptomima i znakovima bolesti u podlozi (ciroza jetre). Na razvoj hepatocelularoga karcinoma kod tih bolesnika treba pomišljati u slučaju pogoršanja jetrene funkcije i postojećih simptoma: nastanak ili pogoršanje postojećega ascitesa, razvoj hepatalne encefalopatije, pogoršanje žutice, pojava gastrointestinalnoga krvarenja, razvoj Budd-Chiarijeva sindroma i sl. Prisutni su i klasični tumorski konstitucijski simptomi i znakovi: gubitak teka, progresivno mršavljenje te razvoj tumorske kaheksije. Bol je prisutan zbog povećanja jetre i rastezanja kapsule. U kasnijoj fazi javljaju se i klinička očitovanja metastaza (patološki prijelomi kostiju, pleuralni izljev i sl.) te paraneoplastični sindromi (učestale hipoglikemije, sekundarna policitemija, hiperkalcijemija).
Dijagnoza se postavlja na osnovi kliničke slike, anamnestičkih podataka (povijest bolesti), laboratorijskih nalaza, slikovnih metoda te biopsijom i patohistološkom potvrdom bolesti. Dijagnostički algoritam fokalne lezije na jetri suspektne na hepatocelularni karcinom prikazana je u algoritmu na Slici 4.13.
Laboratorijski nalazi ovise o stanju i naravi bolesti koju nalazimo u podlozi. Specifičniji nalazi koji mogu ukazivati na razvoj hepatocelularnoga karcinoma su umjerena leukocitoza (kod bolesnika s cirozom obično nalazimo leukopeniju), anemija s normalnim ili povišenim hematokritom te kontinuiran porast vrijednosti alkalne fosfataze koja je ranije bila stabilna. Tumorski marker α-fetoprotein povišen je kod više od 70 % bolesnika (> 400 ng/mL) s hepatocelularnim karcinomom. Kod interpretacije nalaza treba imati na umu da umjereno povišene vrijednosti mogu imati i bolesnici s kroničnim aktivnim virusnim hepatitisom, dok vrlo visoke vrijednosti možemo naći kod bolesnika s akutnom hepatalnom nekrozom (npr. kod toksične lezije jetre paracetamolom). Kod manje od jedne trećine bolesnika vrijednosti α-fetoproteina mogu biti uredne unatoč postojanju ovoga karcinoma. Kod bolesnika s ascitesom indicirana je punkcija i citološka analiza (probir za maligne stanice).
Slikovne metode. Ultrazvuk jetre uključuje nalaz solitarne ili multiplih fokalnih inhomogenih, hipo-, izo- ili hiperehogenih lezija okruženih anehogenim i nepravilnim oštrim rubom. Obojenim doplerom mogu se prikazati značajke nepravilne arterijske hipervaskularizacije unutar tumorske mase. Okolni jetreni parenhim također je patološki promijenjen (kronični hepatitis, ciroza). Na temelju samoga ultrazvuka teško se može postići razlikovanje hepatoceulularnoga karcinoma od drugih fokalnih lezija, i obično se interpretira zajedno s nalazom vrijednosti α-fetoproteina te nadopunjava nalazom CT-a ili MRI-a. Kontrastna kompjuterizirana tomografija i magnetna rezonanca najbolje su slikovne metode u dijagnostici hepatocelularnoga karcinoma, a karakteristični nalaz uključuje pojačanje prikaza lezije u arterijskoj fazi uz kasnije ispiranje i smanjenje denziteta. Navedene slikovne metode dobro prikazuju lezije koje su veće od 2 cm, dok su nesigurne za one između 1 i 2 cm, a gotovo beskorisne za tumore manje od 1 cm.
Biopsija i patohistološka dijagnostika. Hepatocelularni karcinom jedan je od rijetkih karcinoma za koji se dijagnoza može postaviti na temelju radiološke dijagnostike bez uzorkovanja i histološkoga nalaza. Ako se radi o bolesnicima s definiranim rizikom od razvoja ovoga karcinoma i ako se na kontrastnim pretragama jasno dokaže arterijsko pojačanje prikaza i vensko ispiranje, nije potrebna biopsija. Dakle, biopsija i histološka potvrda bolesti ostaju rezervirane samo za bolesnike kod kojih se ne može sa sigurnošću na temelju navedenih pretraga utvrditi da se radi o hepatocelularnom karcinomu.
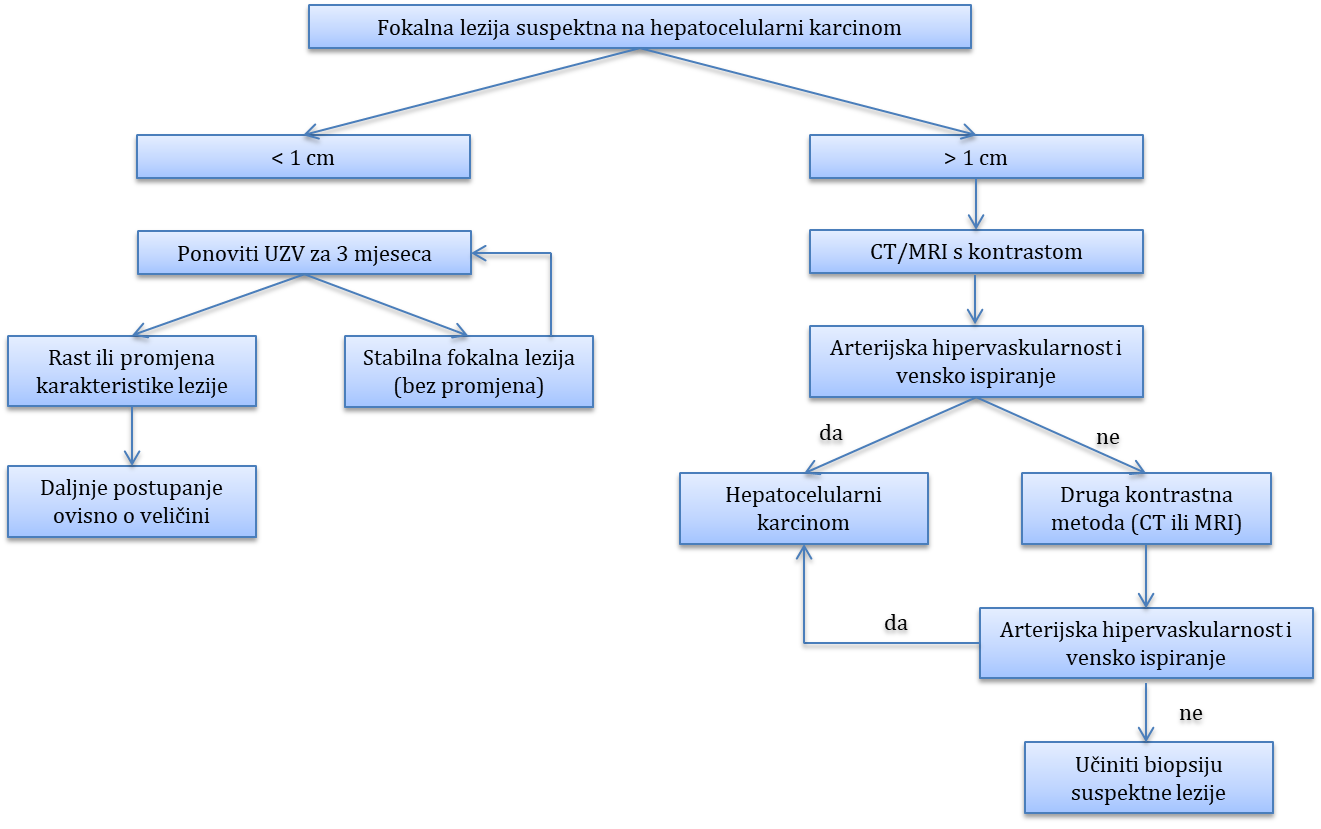
Slika 4.13. Dijagnostička obrada bolesnika s fokalnom lezijom suspektnom na hepatocelularni karcinom (prema smjernicama Američke udruge za jetrena oboljenja)
Utvrđivanje proširenosti bolesti. U svrhu utvrđivanja proširenosti bolesti, što je preduvjet za početak liječenja, preporuča se kompjuterizirana tomografija toraksa, abdomena i male zdjelice te scintigrafija skeleta uz eventualnu dodatnu obradu prema kliničkim pokazateljima. Za daljnju evaluaciju bolesti i bolesnika koriste se različiti skorovi i klasifikacije: TNM klasifikacija (patološka proširenost bolesti), F skor (fibroza skor), Child-Pugh skor (procjena jetrene funkcije) te BCLC podjela (od engl. Barcelona clinic liver cancer) koja u obzir uzima kliničko stanje bolesnika, karakteristike tumora te Child-Pugh skor te se najčešće koristi u procjeni izbora terapijske opcije.
TNM klasifikacija uključuje sljedeće definicije: T0 (nema dokaza primarnoga tumora); T1a (solitarni tumor manji ili jednak 2 cm); T1b (solitarni tumor veći od 2 cm bez vaskularne invazije); T2 (solitarni tumor veći od 2 cm s vaskularnom invazijom ili do pet multiplih tumora); T3 (pet ili više multiplih tumora); T4 (solitarni ili multipli tumori koji invadiraju glavne grane portatne ili hepatalnih vena ili invadiraju okolne anatomske strukture kao što su žučnjak ili peritoneum); N0 (bez metastaza u limfne čvorove), N1 (prisutne metastaze u limfne čvorove); M0 (bez udaljenih metasaza); M1 (prisutne udaljene metastaze).
Fibroza skor (F-skor) definira se po Ishaku i ima prognostičku vrijednost za ukupno preživljenje, a stupanj fibroze označava se od 0 do 6. Prema tim vrijednostima bolesnike grupiramo u dvije skupine: F0 (stupanj 0 do 4 – bez fibroze ili umjerena fibroza) i F1 (stupanj 5 i 6 – jako izražena fibroza i ciroza).
Child-Pugh skor koristi se u procjeni jetrene funkcije, a temelji se na laboratorijskim i kliničkim parametrima. Ovaj skor prikazan je u poglavlju o fibrozi i cirozi jetre.
Diferencijalna dijagnoza hepatocelularnoga karcinoma je široka i uključuje razlikovanje od drugih fokalnih lezija jetre kao što su fokalna nodularna hiperplazija, hepatocelularni adenom, intrahepatični kolangiokarcinom, hemangiom, sekundarizmi i sl.
Liječenje. Modaliteti liječenja hepatocelularnoga karcinoma uključuju kirurške metode liječenja (resekcija jetre, transplantacija jetre), ablativne metode liječenja (transarterijska kemoembolizacija, radiofrekventna ablacija) te sistemsku kemoterapiju. Liječenju hepatocelularnoga karcinoma najčešće se pristupa na temelju BCLC algoritma (Slika 4.14.).
Kirurške metode liječenja uključuju resekciju jetre i transplantaciju jetre. Resekcija jetre predstavlja terapiju izbora kod bolesnika s lokaliziranim resektabilnim tumorom na necirotičnoj jetri ili za izabrane bolesnike koji imaju cirozu jetre u stadiju Child-Pugh A i nemaju razvijenu portalnu hipertenziju. Petogodišnje preživljenje ove skupine bolesnike je oko 50 %, dok 50 % bolesnika razvije recidiv bolesti unutar istoga razdoblja. Transplantacija jetre indicirana je kod bolesnika s hepatocelularnim karcinomom na cirotičnoj jetri, koji zadovoljavaju Milanske kriterije ili proširene UCSF kriterije (kriteriji University of California San Francisco) – Tablica 4.44. Kod dobro odabranih kandidata petogodišnje preživljenje nakon transplantacije iznosi i do 75 %.
|
Tablica 4.44. Kriteriji za transplantaciju jetre kod bolesnika s hepatocelularnim karcinomom
|
|
Milanski kriteriji
|
UCSF kriteriji
|
|
Jedan tumor ≤ 5 cm, ili
Dva ili tri tumora, nijedan > 3 cm +
Odsutnost vaskularne invazije.
|
Jedan tumor ≤ 6,5 cm, ili
Dva ili tri tumora, nijedan > 4,5 cm, ili
Totalni tumorski dijametar ≤ 8 cm +
Odsutnost vaskularne invazije
|
Ablativne metode liječenja uključuju transarterijsku kemoembolizaciju, radiofrekventnu ablaciju te perkutanu injekciju etanola.
Transarterijska kemoembolizacija (TACE) predstavlja način liječenja koji se koristi kod bolesnika s hepatocelularnim karcinom i cirozom jetre, bilo kao dio palijativnoga liječenja, bilo kao premošćujuća opcija do transplantacije jetre. Ono podrazumijeva intraarterijsko ubrizgavanje citostatika (doksorubicin, cisplatina, mitomicin) izravno u hepatičnu arteriju ili njezine ogranke (kompletna, selektivna ili superselektivna TACE) s ciljem smanjenja tumorske mase, bilo da bi se veličina tumora dovela na razinu koja je prihvatljiva prema navedenim kriterijima za transplantaciju ili da bi se postigla bolja simptomatska kontrola bolesti (palijativna uloga). Kontraindikacije za TACE su dekompenzirana ciroza jetre i multifokalni hepatocelualrni karcinom.
Radiofrekventna ablacija tumora (RFA) predstavlja terapijsku opciju kod koje se smanjenje tumorske mase postiže ciljanom primjenom radiofrekventnoga zračenja putem elektrode koja se perkutano uvodi u tumorsku masu. RFA ima više ograničenja od TACE-a i može se primjenjivati samo kod bolesnika koji imaju do tri tumorske mase s maksimalnim promjerom do 5 cm. Kao i kod TACE-a, RFA se može koristiti u svrhu palijacije (olakšanje simptoma smanjenjem tumorske mase) ili kao premošćujuća opcija do definitivnoga tretmana (transplantacija).
Perkutana injekcija etanola (PEI) također predstavlja ablativnu metodu kojom se u središte tumora posebnom iglom ubrizgava etanol koji će dovesti do nekroze i smanjenja tumorske mase. Metoda je učinkovita za tumore koji su manji od 3 cm u promjeru. Za tumore između 3 i 5 cm RFA je učinkovitija metoda liječenja.
Sistemska kemoterapija ima ograničenu ulogu u liječenju bolesnika s hepatocelularnim karcinomom budući da se radi o relativnom kemorezistentnom tumoru. Većina klasičnih kemoterapeutika ne pokazuje učinak na produljenje preživljenja. Danas se u ovu svrhu primjenjuje sorafenib, multikinazni inhibitor koji dokazano reducira staničnu proliferaciju, povećava apoptozu tumorskih stanica te inhibira angiogenezu. Sorafenib se primjenjuje kod bolesnika u uznapredovalom stadiju hepatocelularnoga karcinoma. U kasnijim fazama liječenja uznapredovaloga hepatocelularnog karcinoma primjenjuju se i regorafenib i nivolumavb.
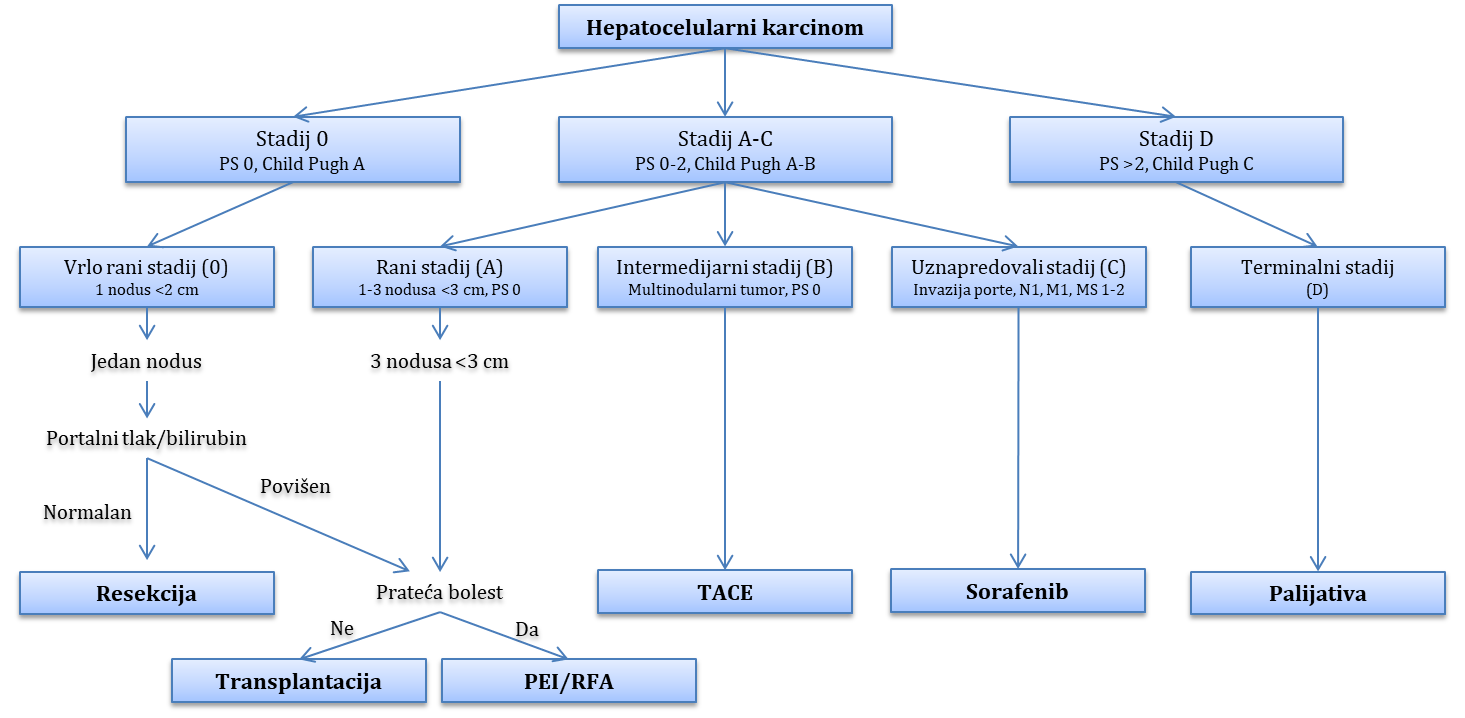
Slika 4.14. BCLC algoritam liječenja hepatocelularnoga karcinoma (od engl. Barcelona clinic liver cancer)
Iako radioterapija za sada nije standardni način liječenja hepatocelularnoga karcinoma, u novije se vrijeme sve više primjenjuje 3D konformalna radioterapija (3DCRT) i radioterapija modulatornoga intenziteta (IMRT) koji omogućavaju aplikaciju učinkovitih doza zračenja na tumor uz poštedu okolnoga, zdravog tkiva jetre. Kao i druge metode, najčešće se koristi s ciljem smanjenja tumorske mase kako bi bolesnici postali kandidati za neki od oblika kirurškoga liječenja.
Prognoza. Ukupno gledano, prognoza ovih bolesnika je loša, prosječno preživljenje od postavljanja dijagnoze za bolesnike s cirozom jetre iznosi 3 do 6 mjeseci, a za bolesnike bez ciroze jetre do 18 mjeseci. Ukupno petogodišnje preživljenje iznosi 2 do 6 %, odnosno 30 do 40 % kod bolesnika koji su podvrgnuti resekciji tumora. Vrijednosti serumskoga α-fetoproteina veće od 200 ng/mL ili kontinurani porast za više od 15 ng/mL na mjesec, prediktori su loših kliničkih ishoda, osobito kod bolesnika koji čekaju transplantaciju jetre.
Praćenje rizičnih bolesnika. Rizičnim bolesnicima za obolijevanje od hepatocelularnoga karcinoma smatraju se bolesnici s kroničnim hepatitisom B i C te bolesnici s alkoholnom bolesti jetre, osobito ako je došlo do razvoja ciroze. Kod njih se preporuča svakih 6 do 12 mjeseci ultrazvuk jetre i određivanje vrijednosti α-fetoproteina. Ovim se načinom hepatocelularni karcinom može otkriti u ranijim fazama kada su mogućnosti liječenja veće, što utječe na ukupno preživljenje bolesnika.
FIBROLAMELARNI KARCINOM
Definicija i epidemiologija. Fibrolamelarni karcinom je primarni maligni tumor jetre koji se javlja kod adolescenata i mlađih odraslih u odsutnosti kronične lezije jetre, koji se dugo vremena opisivao u sklopu hepatocelularnoga karcinoma, a danas se sve više izdvaja kao samostalan entitet. Radi se o vrlo rijetkom tumoru s godišnjom incidencijom od 0,02 na 100 000 stanovnika koji se nešto češće javlja kod muškaraca u odnosu na žene. Prosječna dob obolijevanja je 25 godina.
Etiopatogeneza fibrolamelarnoga karcinoma je nepoznata i nejasna, ne povezuje se s klasičnim rizičnim čimbenicima kao što su kronična upala, fibroza i ciroza ili izloženost hepatotoksinima, a nije niti identificirana eventualna histološka prekursorna lezija. Jedino s čime se ovaj tumor danas povezuje je fuzijski gen DNAJB1-PRKACA koji je nađen u većini tumorskih stanica, iako njegova uloga i nastanak nisu do kraja razjašnjeni.
Patologija. Makroskopski se obično radi o velikim, solitarnim tumorskim masama (10 - 20 cm) blijedo-smeđe boje koje se jasno raspoznaju od ostaloga jetrenoga parenhima. Na presjeku tumora uočava se tipična centralna fibroza sa širenjem u obliku tračaka prema periferiji, što podsjeća na fokalnu nodularnu hiperplaziju. Mikroskopski, tumorske stanice su grupirane u gredicama koje su međusobno odvojene kolagenim vlaknima što daje lamelarni izgled. Tumorske stanice su velike i poligonalne s eozinofilnom citoplazmom i velikim jezgrama.
Klinička slika fibrolamelarnoga karcinoma je nespecifična, a početni simptomi i znakovi uključuju neodređen bol u trbuhu, osobito pod desnim rebrenim lukom i epigastriju, gubitak na tjelesnoj težini te umor i malaksalost. S razvojem bolesti javljaju se i specifičnija klinička očitovanja kao što su opstruktivni ikterus i druge stigme kronične jetrene bolesti. Najčešći znak pri fizikalnom pregledu je hepatomegalija.
Dijagnoza se postavlja na osnovi kliničke slike, laboratorijskih nalaza, slikovnih metoda te patohistološkoga nalaza. Laboratorijski nalazi uključuju umjereno povišene jetrene transaminaze, dok su a-fetoprotein i karcinoembrionalni antigen rijetko povišeni. Slikovne metode (UZV, CT ili MRI) pokazuju obično solitarnu fokalnu leziju uz normalan ostatni parenhim jetre, a najveći diferencijalno-dijagnostički izazov predstavlja razlikovanje ovoga tumora od fokalne nodularne hiperplazije, s obzirom na to da dijele slična morfološka i epidemiološka obilježja. U nejasnim slučajevima indicirana je biopsija i patohistološka analiza uzorka.
Liječenje i prognoza. Liječenje fibrolamelarnoga karcinoma vodi se istim načelima kakvi su opisani i za hepatocelularni karcinom (kirurško liječenje, ablativne metode, sistemska kemoterapija). Ukupno jednogodišnje preživljenje kod ovih bolesnika je 70 %, dok je petogodišnje 30 %, što je značajno bolje nego kod bolesnika s hepatocelularnim karcinomom. Bolesnici s neresektabilnom bolesti imaju srednje preživljenje od 14 mjeseci.
ANGIOSARKOM JETRE
Definicija i epidemiologija. Angiosarkom jetre predstavlja rijetki mezenhimalni primarni tumor jetre koji nastaje od stanica koje oblažu jetrene sinusoide. Tumor se nešto češće javlja kod muškaraca, najčešće u šestom i sedmom desetljeću života.
Etiopatogeneza angiosarkoma jetre nije u potpunosti razjašnjena, a dva najčešće spominjana rizična čimbenika su vinilklorid (spoj koji se koristi u proizvodnji gume i plastike) i torotrast (kontrastno sredstvo koje se u prošlosti široko primjenjivalo, a osobito u kontrastnim pretragama bilijarnoga sustava). Oba spoja imaju tendenciju nakupljanja u mezenhimalnim stanicama jetre gdje mogu dovesti do genetskih promjena koje uvjetuju malignu transformaciju stanica, a karakterizira ih i dugi period latencije prije pojave tumora. Također, u vezu s ovim tumorom dovode se i drugi rizični čimbenici kao što su izloženost arsenu i bakru, anabolni hormoni te infekcija hepatitis C virusom.
Patologija. Makroskopski, angiosarkom se prezentira višestrukim čvorovima ispunjenima krvožilnim spletovima koji međusobno konfluiraju u veće strukture. Mikroskopski, tumor je građen od izduljenih i atipičnih endotelnih stanica koje okružuju vaskularne prostore. Unutar krvnih prostora često se nalaze tromboze.
Klinička slika. Tumor isprva daje nespecifične simptome, zbog čega se i dijagnosticira relativno kasno, u fazi proširene bolesti. Najčešći simptomi i znakovi su slabost, malaksalost, gubitak na težini, hepatomegalija, bol u trbuhu te ascites i opstruktivni ikterus. Kod oko 15 % bolesnika prva manifestacija bolesti je intraabdominalno krvarenje uslijed rupture tumora. U vrijeme postavljanja dijagnoze često su prisutni i klinički znakovi metastaza, najčešće u kostima i plućima.
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza te slikovnih metoda. U laboratorijskim nalazima česte su mikroangipatska hemolitička anemija i trombocitopenija (mehaničko oštećenje stanica unutar tumora) uz umjereno povišene jetrene transaminaze i pokazatelje kolestaze. Ultrazvučno se angiosarkom pokazuje kao solitarna (rijetko) ili multipla hiperehogena masa slabo definiranih rubova koja pokazuje hipervaskularizaciju primjenom obojenoga doplera. Konačna diferencijacija tumora postiže se primjenom kompjuterizirane tomografije ili magnetne rezonance. Biopsija se izbjegava zbog mogućnosti rupture i krvarenja.
Liječenje i prognoza. Osnovu liječenja čini kirurška resekcija tumorske mase kada je ona moguća. Transplantacija kao metoda liječenja ovih bolesnika nije opravdana. Primjena klasičnih kemoterapeutika kao ni kod angiosarkoma drugih regija (doksorubicin, paklitaksel, ifosfamid) nije pokazala veći klinički uspjeh. Prognoza je loša i većina bolesnika ne preživi dulje od 12 mjeseci od postavljanja dijagnoze.
METASTATSKI TUMORI JETRE
Definicija i etiologija. Metastatski tumori jetre (sekundarizmi) najčešći su maligni tumori jetre, a jetra predstavlja jedno od najčešćih sijela primarnih karcinoma drugih lokalizacija (dojka, pluća, trbuh i zdjelica) i to prvenstveno zbog svoje velike prokrvljenosti. Prema učestalosti, najčešće se radi o metastazama karcinoma debeloga crijeva i gušterače (60 - 80 %), dojke (50 %), želuca i pluća (40 - 45 %) te jednjaka, bubrega, mokraćnoga mjehura i maternice (30 - 35 %).
Patologija. Metastaze se obično pojavljuju u obliku difuznih čvorića (rjeđe solitarnih) koji su nepravilno raspoređeni po jetrenom parenhimu, a na presjeku se obično uočavaju zone centralne nekroze.
Klinička slika. Simptomi i znakovi jetrenih metastaza mogu biti prikriveni osnovnom bolesti, a u nekim slučajevima mogu biti i prva klinička manifestacija primarnoga tumora. Bolesnici imaju izražene opće simptome kao što umor i malaksalost, gubitak na tjelesnoj težini uz bolove u trbuhu, a jetra je povećana i bolna na palpaciju. U kasnijim fazama dolazi do razvija ikterusa, ascitesa te hepatalne encefalopatije.
Dijagnoza se postavlja na temelju anamnestičkih podataka, laboratorijskih nalaza te slikovnih metoda. Laboratorijski nalazi nisu specifični, ali bilježi se porast jetrenih transaminaza i pokazatelja kolestaze, a u težim slučajevima i porast amonijaka te produljenje protrombinskoga vremena (narušena sintetska funkcija jetre). Određivanjem specifičnih tumorskih markera bilježi se i njihov značajan porast (ovisno o vrsti primarnoga karcinoma). Na ultrazvuku se vizualiziraju solitarne ili multiple žarišne lezije koje su kod brzo rastućih tumora (pluća, dojka, gušterača) hipoehogene teksture, dok su kod spororastućih tumora (karcinom, želudac) hiperehogene teksture. Većina metastaza ima karakteristični hipo- do anehogeni rub što se opisuje kao znak pečata ili mete. Pojava centralne nekroze (centralni anehogeni areal, „bikovo oko“) znak je regresije (npr. nakon kemoterapije) ili sekundarne infekcije sa razvojem apscesa. Dodatno, kompjuterizirana tomografija (CT) i magnetna rezonanca (MRI) mogu poslužiti za bolju diferencijaciju žarišnih lezija u slučaju dvojbenih ultrazvučnih nalaza. U slučaju solitarne žarišne promjene indicirana je i biopsija i patohistološka analiza.
Liječenje jetrenih metastaza ovisi o primarnom tumoru i opisano je u odgovarajućim poglavljima. Osnovu liječenja čini resekcija metastaza (metastazektomija) ako se ispunjavaju kriteriji (ograničena intrahepatična bolest – manje od četiri metastaze koje ne invadiraju glavne anatomske strukture, odsutnost drugih, ekstrahepatalnih sekundarizama). Primjenom R0 resekcije jetre značajno se produžuje preživljenje ovih bolesnika, ali ona je moguća kod samo 5 - 10 % bolesnika. Moguća je i primjena lokalnih ablativnih metoda liječenja. Transplantacija jetre kao metoda liječenja jetrenih metastaza u obzir dolazi samo kod bolesnika s metastatskim karcinoidom uz preduvjet uspješne radikalne resekcije primarnoga žarišta. Najbolje rezultate liječenja jetrenih metastaza imaju bolesnici s kolorektalnim karcinomom.
CISTE JETRE
Ciste jetre predstavljaju ograničene šupljine unutar jetrenoga parenhima ispunjene tekućim sadržajem i okružene vezivnom opnom, a dolaze solitarno ili multiplo. Iako nije točno utvrđeno, smatra se da je učestalost cisti na jetri u općoj populaciji oko 5 %. Prema etiologiji, one mogu biti parazitarne (posebno opisane u dijelu o infektivnim bolestima jetre) i neparazitarne - jednostavne neparazitarne ciste i policistoza jetre. Kada se radi o cističnim formacijama, uvijek treba diferencijalno dijagnostički misliti i na cistične tumore (cistadenom, cistadenokarcinom) te apscese, zbog čega je u svim dvojbenim ultrazvučnim nalazima indicirana i kompjuterizirana tomografija ili magnetna rezonanca te citološka punkcija.
Jednostavne neparazitarne ciste jetre najčešće su cistične formacije jetre koje se mogu javiti kongenitalno ili stečeno (izolirani defekt parenhima jetre, dilatacija žučnih vodova bez komunikacije s bilijarnim sustavom), a nađu se u oko 3 % ultrazvučnih pregleda abdomena s nešto češćom prevalencijom kod žena. Ciste su obložene bilijarnim epitelom, a sadržavaju tekućinu koja sastavom oponaša plazmu, a nastaje kao posljedica sekrecije iz epitelnih stanica i benigne je prirode. Jednostavne ciste obično su klinički asimptomatske i otkriju se slučajno tijekom ultrazvučnoga pregleda abdomena. Velike ciste mogu izazvati bol i palpatornu masu pod desnim rebrenim lukom. Na ultrazvuku se jednostavne ciste prikazuju kao okrugle ili ovalne anehogene strukture, glatkih i jasnih rubova s dorzalnim akustičnim pojačanjem. Povremeno, a osobito kod većih cista, prate se unutarcistične vezivne septe. Liječenje asimptomatskih bolesnika nije potrebno, dok se kod bolesnika s kliničkom simptomatologijom indicira citološka punkcija i aspiracija tekućine iz ciste što se često kombinira s istodobnom aplikacijom sklerozirajućega sredstva kako bi se postigla obliteracija cistične šupljine s obzirom na to da se ona ponovno može napuniti tekućim sadržajem. Kirurška resekcija krajnja je opcija u liječenju ovih bolesnika.
Policistoza jetre predstavlja kongenitalnu anomaliju koju karakteriziraju brojne parenhimatozne ciste jetre različite veličine i oblika, koje u konačnici mogu dovesti do hepatomegalije i narušene funkcije jetre. Bolest je obično povezana s policističnom bolesti bubrega te se javlja uslijed mutacija PKD1 i PKD2 gena. Kod bolesnika koji nemaju policističnu bolest bubrega identificiran je treći gen koji se povezuje s ovim stanjem - PRKCSH gen. Osim moguće narušene funkcije jetre, česte su i komplikacije kao što su ruptura, krvarenje i infekcije. Iako su ciste prisutne od rođenja, klinički se najčešće manifestiraju u mlađoj odrasloj dobi, a inicijalni simptomi su bol po desnim rebrenim lukom, hepatomegalija i ikterus. Kasnije se, s vremenom, razvijaju i ostali simptomi i znakovi bolesti jetre. Ultrazvučno se prate mnogobrojne anehogene strukture s dorzalnim akustičnim pojačanjem koje pokazuju znatne varijacije u veličini i obliku. Liječenje se provodi kod simptomatskih bolesnika, a uključuje pokušaj resekcije, no u slučaju difuznih promjena indicirana je transplantacija jetre.
Pelioza jetre predstavlja ektaziju portalne vene koja je obilježena prisutnošću brojnih malih cističnih šupljina ispunjenih krvlju. Etiologija ovoga poremećaja nije jasna, a dovodi se u vezu s oštećenjem jetrenih sinusoida, opstrukcijom protoka krvi kroz jetru i sl. Obično se susreće kod bolesnika s kroničnim bolestima i imunodeficijentnim stanjima (AIDS, tuberkuloza, stanje nakon transplantacije). Jedan od najpovezivanijih uzročnika s ovim stanjem je bakterija Bartonella henselae. Bolest je najčešće asimptomatska, no kod nekih bolesnika bilježi se bol pod desnim rebrenim lukom, hepatomegalija, opstruktivni ikterus te razvoj portalne hipertenzije i rijetko, hepatalne encefalopatije. Pelioza jetre nosi rizik od moguće rupture i nastanka krvarenja. Osim na jetri, slične se promjene mogu naći i na drugim organima (slezena, bubrezi, limfni čvorovi). Dijagnoza se obično postavlja na temelju anamnestičkih podatka i slikovnih metoda (ultrazvuk, magnetna rezonanca). Liječenje obično nije potrebno, no u slučaju krvarenja ili značajno narušene funkcije jetre, indicirano je kirurško zbrinjavanje.
Transplantacija jetre predstavlja oblik liječenja uznapredovale bolesti jetre koji se primjenjuje kada se mjerama konzervativnoga liječenja više ne može postići odgovarajući klinički odgovor. U kirurškom se pogledu radi o jednome od najsloženijih operativnih zahvata uopće, a podrazumijeva hepatektomiju bolesne jetre kod primatelja, hepatektomiju zdrave jetre kod donora te implantaciju zdrave jetre na mjesto bolesne u primatelja (tzv. ortotopna transplantacija jetre). Transplantacija jetre druga je po učestalosti transplantacija solidnih organa, odmah iza bubrega. U daljnjem će tekstu biti predstavljeni osnovni koncepti transplantacije jetre.
Indikacije za transplantaciju jetre mogu biti različite: 1) ciroza jetre nekolestatske etiologije (kronični virusni hepatitisi, autoimuni hepatitis, alkoholna bolest jetre, nealkoholna masna bolest jetre); 2) ciroza jetre kolestatske etiologije (primarni sklerozirajući kolangitis, primarna bilijarna ciroza, sekundarna bilijarna ciroza); 3) maligne neoplazme (hepatocelularni karcinom, kolangiokarcinom, hepatoblastom); 4) kronične metaboličke bolesti jetre (hemokromatoza, Wilsonova bolest, deficit α1-antitripsina, tirozemija); akutno zatajenje jetre različite etiologije te 5) ostale bolesti i stanja (Budd-Chiarijev sindrom, trauma, graft versus host disease i dr.).
Kontraindikacije za transplantaciju jetre mogu biti apsolutne i relativne. Apsolutne kontraindikacije su: 1) neliječeni spontani bakterijski peritonitis ili druga teška aktivna infekcija (septično stanje); 2) teška i uznapredovala kardiovaskularna bolest (simptomatska koronarna bolest koja nije podložna revaskularizaciji, teška plućna hipertenzija koja se ne može kontrolirati medikamentima); 3) ekstrahepatalna maligna bolest koja ne zadovoljava kriterije potencijalne izlječivosti; 4) aktivna zlouporaba alkohola ili drugih tvari (za razmatranje transplantacije potreban je period apstinencije od minimalno šest mjeseci); 5) psihosocijalna disfunkcija (za pridržavanje poslijetransplantacijskih protokola potrebna je apsolutna suradljivost bolesnika) te 6) teške anatomske anomalije koje onemogućavaju kirurški postupak. Postoje i tzv. relativne kontraindikacije kao što su kronična bolest bubrega (mogućnost kombinirane transplantacije bubrega i jetre u jednome navratu), uznapredovala kaheksija, tromboza portalne i mezenteričnih vena, srednje izražena aktivna infekcija i sl., koje onemogućavaju trenutnu transplantaciju, ali nakon njihova saniranja bolesnici se mogu podvrgnuti postupku transplantacije.
Prijetransplantacijska obrada. Kada se kod bolesnika postavi indikacija za liječenje transplantacijom jetre potrebno je provesti specifičnu obradu kojom se procjenjuje bolesnikovo ukupno zdravstveno stanje i spremnost na postupak transplantacije, kao i utvrđivanje apsolutnih i/ili relativnih kontraindikacija. Laboratorijska prijetransplantacijska obrada osim klasične obrade uključuje i obvezno određivanje krvne grupe i Rh faktora, serologije na najčešće viruse (CMV, EBV, HIV, HAV, HBV, HCV, VZV) te određivanje tumorskih markera. Kardiopulmonalna evaluacija podrazumijeva klasičan rendgenogram srca i pluća, elektrokardiografiju, ehokardiografiju, ergometriju te prema potrebi koronarografiju, pulsnu oksimetriju, spirometriju te test difuzije, a ovisno o indikaciji i nalazima, i kompjuteriziranu tomografiju prsnoga koša. Probir za najčešća maligna oboljenja podrazumijeva CT ili MRI gornjeg abdomena (probir za hepatocelularni karcinom i kolangiokarcinom), pregled kože uz dermatoskopiju, kolonoskopiju i gastroskopiju (kod bolesnika iznad 50 godina) te ginekološki i urološki pregled (neoplazme urogenitalnoga sustava). U svrhu evaluacije infektoloških bolesti, osim seroloških pretraga na najčešće viruse, treba napraviti i kvanitiferonski test (tuberkuloza), kao i ortopan i stomatološki pregled. Svim bolesnicima s cirozom jetre i portalnom hipertenzijom potrebna je endoskopija gornjega dijela probavne cijevi. Također, izvode se i slikovne metode (CT ili MRI angiografija) kojima se prikazuju glavne krvne žile jetre što je potrebno za planiranje samoga kirurškog zahvata.
Određivanje prioriteta. Nakon postavljene indikacije i provedene prijetransplantacijske obrade kojom nisu otkrivene kontraindikacije, bolesnici se stavljaju na listu čekanja za transplantaciju jetre, a zbog ograničenosti dostupnih organa velik broj tih bolesnika umre prije nego dočeka transplantaciju. Da bi se to svelo na što manji postotak, razvijeni su posebni bodovni sustavi kojima se ocjenjuje težina bolesnikova stanja na temelju kliničko-laboratorijskih parametara pa bolesnici s višim bodovnim zbirom predstavljaju bolesnike s većim rizikom od smrtnoga ishoda i imaju prednost kod dodjeljivanja organa. U tu se svrhu u odrasle populacije najčešće koristi MELD skor (engl. model for end-stage liver disease) koji se dobiva matematičkim izračunom temeljenim na vrijednostima serumskoga bilirubina, kreatinina i INR-a. Prioritet za transplanaciju jetre imaju bolesnici čiji je MELD skor veći od 15 ili imaju neku od navedenih komplikacija: ascites, sponatni bakterijski peritonitis, encefalopatiju te recidivirajuće krvarenje iz jednjačnih varikoziteta. Također, bolesnici s akutnim jetrenim zatajenjem i bolesnici s poremećajem funkcije presatka nakon transplantacije, zbog tromboze hepatalne arterije imaju MELD skor 40 i dobivaju status prioritetnoga primatelja.
Donorstvo. Donor jetre može biti živa ili umrla osoba (kadaver) koja je AB0 kompatibilna s primateljem te nema isključne kriterije kao što su anamneza na ranije bolesti jetre, aktivna infekcija, maligno oboljenje ili prisutna HIV, HBV ili HCV infekcija. Većina transplantacija jetre odvija se s umrlih osoba, odnosno osoba kod kojih je dokazana moždana smrt, a čiji se organi održavaju na životu. Pri uzimanju jetre iz umrle osobe obično se presađuje cijela jetra, iako su moguće i tzv. split operacije kada se jetra donora dijeli i to tako da se desni, veći režanj transplantira u odraslu osobu, a lijevi, manji režanj u dijete. Ako se jetra uzima od živoga donora, uzima se desni režanj za odraslu osobu, odnosno lateralni segment lijevoga režanja ako se transplantira u dijete. Kod 10 do 20 % živih donora bilježi se razvoj nekih poslijeoperacijskih komplikacija (krvarenje, infekcija, oštećenje žučnih vodova), a stopa smrtnosti vezana uz proceduru iznosi 0,2 %. Potpuni oporavak funkcije jetre u živih donora očekuje se unutar jedne godine od transplantacije.
Postupak transplantacije. Sam kirurški postupak sastoji se od nekoliko faza i koraka. Najprije je potrebno obaviti hepatektomiju donora, a dobivena jetra se polaže na led i tako može ostati sačuvana kroz 20 sati (tzv. period hladne ishemije). Za što bolju kasniju funkciju transplantirane jetre potrebno je osigurati što kraći period hladne ishemije. Drugi korak (koji se često provodi paralelno s prvim korakom) podrazumijeva hepatektomiju primatelja, što može biti otežano i komplicirano samom osnovnom patologijom jetre, sklonosti krvarenju, pretjeranom debljinom i sl. Treći korak podrazumijeva implantaciju jetre (ili režnja odnosno segmenta) i osiguravanje odgovarajućih vaskularnih i bilijarnih anastomoza koje će osigurati zadovoljavajuću prokrvljenost jetre i drenažu žuči u tanko crijevo. Obično cijeli operativni proces vezan uz primatelja traje oko 8 sati i zahtijeva različito opsežnu nadoknadu krvi i krvnih pripravaka, što ponajprije ovisi o bolesnikovoj sklonosti krvarenju prije postupka transplantacije.
Komplikacije transplantacije jetre mogu se podijeliti u nekoliko skupina: primarna disfunkcija presatka, kirurške (tehničke) komplikacije, infekcije te reakcije odbacivanja. Karakteristično se one javljaju u određenom periodu nakon transplantacije kako je prikazano u Tablici 4.45.
|
Tablica 4.45. Vremenska pojavnost najčešćih poslijetransplantacijskih komplikacija
|
|
1. - 3. dan
|
3. - 14. dan
|
14. dan – 3. mjesec
|
|
Primarna difunkcija grafta
Tromboza hepatalne arterije
Tromboza portalne vene
Hiperakutno odbacivanje
|
Akutno odbacivanje
Bilijarne komplikacije
Bakterijske infekcije
|
Kronično odbacivanje
Virusne infekcije (HCV, CMV)
|
Primarna disfunkcija presatka definira se kao izostanak povrata normalne funkcije jetre odmah nakon implantacije u bolesnika. Ona je u prvom redu posljedica hladne ishemije (duža ishemija nosi veći rizik od nastanka ove komplikacije), ali i drugi čimbenici imaju određenu ulogu (dob donora, prisutna masna promjena jetre i sl.). Zbog povezanosti s duljinom hladne ishemije, ova se komplikacija znatno rjeđe susreće kod bolesnika kada se izvodi transplantacija sa živoga donora (1 %) u odnosu na transplantaciju s kadavera (7 - 8,5 %), s obzirom na vrijeme putovanja organa. Primarna disfunkcija presatka klinički se manifestira slikom akutnoga zatajenja jetre (encefalopatija, ascites, koagulopatija) uz izraženo povišene jetrene transaminaze, a moguć je i razvoj višeorganskoga zatajenja. U većini slučajeva dolazi do spontanoga oporavka funkcije presatka kroz neko vrijeme, a do tada se provode potporne mjere liječenja. No, ako izostane oporavak presatka, indicirana je retransplantacija.
Tehničke komplikacije često se nazivaju još i kirurškim komplikacijama s obzirom na to da su najčešće povezane s kirurškom tehnikom te u pravilu i zahtijevaju liječenje kirurškim putem. U ove komplikacije ubrajamo krvarenje koje će kod 5 do 15 % bolesnika zahtijevati operativnu reviziju, trombozu hepatalne arterije i portalne vene te komplikacije vezane uz žuč i žučne vodove (atrezije i strikture, fistule, otjecanje žuči i sl.). Tromboza hepatalne arterije može se naći kod 3 do 10 % transplantiranih bolesnika, a predstavlja opasnu komplikaciju koja vrlo brzo dovodi do razvoja akutne ishemije presatka i gubitka njegove funkcije. Dijagnoza se postavlja uz pomoć obojenoga doplera ili CT/MR angiografije, a liječi se kirurški (pokušaj revaskularizacije ili retransplantacija). Tromboza portalne vene rjeđe se susreće, a rezultira razvojem portalne hipertenzije i jetrenoga zatajenja. Liječenje interventnom trombektomijom ili fibrinolitičkom terapijom obično daje skromne rezultate pa je i ovdje često indicirana kirurška revizija te u najtežim slučajevima retransplantacija. Bilijarne komplikacije razvijaju se nešto kasnije, ali obično unutar prva tri mjeseca. U dijagnostičkoj obradi pri sumnji na ove komplikacije koristimo se MR kolangiografijom ili endoskopskim metodama (ERCP). Strikture se mogu pokušati riješiti postavljanjem stenta, dok fistule i otjecanje žuči zahtijevaju kiruršku reviziju.
Infekcije su česte komplikacije koje se mogu naći kod bolesnika u poslijetransplantacijskom periodu. Većina infekcija se događa u prva tri mjeseca nakon transplantacije, a obično se radi o infekcijama uzrokovanim bakterijama i gljivicama (infekcija rane, pneumonija). Virusne infekcije obično se razvijaju nešto kasnije, a najznačajnija je infekcija citomegalovirusom. Bolesnici koji su ranije imali serološki biljeg infekcije ovim virusom ili su dobili jetru od bolesnika sa serološkim biljegom preboljele CMV infekcije u riziku su od njegove reaktivacije te se kod njih preporuča profilaksa valganciklovirom (900 mg/dan) kroz 90 dana nakon transplantacije. Kod sumnje na infekciju citomegalovirusom indicirana je biopsija jetre kojom se dokazuju CMV inkluzije te molekularna dijagnostika (određivanje CMV-DNA). Liječenje se provodi specifičnim imunoglobulinom i/ili ganciklovirom.
Akutno odbacivanje transplantata definira se kao gubitak funkcije presatka uslijed imunološke reakcije, a zbiva se unutar prvih trideset dana od transplantacije. Kod većine se bolesnika akutno odbacivanje manifestira kao asimptomatski porast jetrenih nalaza, iako dio bolesnika može imati vrućicu te bol pod desnim rebrenim lukom uz postupni razvoj simptoma i znakova jetrene insuficijencije. Dijagnoza se postavlja na osnovi biopsije presatka, a klasični patohistološki nalaz uključuje mješoviti upalni infiltrat sastavljen od limfocita, plazma stanica, eozinofila i neutrofila uz nesupurativni, destruktivni kolangitis i vaskulitis. U prvoj se liniji liječenje sastoji od pulsne kortikosteroidne terapije (metilprednizolon 1g/dan kroz jedan do tri dana), a bolesnici koji ne pokažu odgovor mogu biti tretirani specifičnom anti-T limfocitnom terapijom (timoglobulin). Kod sumnje na odbacivanje posredovano B-stanicama može se pokušati i s terapijskom plazmaferozom i nekim od anti-B limfocitinih lijekova (rituksimab). Gubitak presatka uslijed akutnoga odbacivanja je rijetka pojava.
Kronično odbacivanje transplantata definira se kao gubitak funkcije presatka uslijed imunološke reakcije, a zbiva se u vremenskom periodu nakon 30 dana od transplantacije. Obično se radi o postupnom i progresivnom gubitku jetrene funkcije koje je asimptomatsko, a najčešće se prepoznaje po pogoršanju nalaza jetrene funkcije na kontrolnim pregledima (transaminaze, alkalna fosfataza, bilirubin). Dijagnoza se postavlja na osnovi biopsije, a u patohistološkom nalazu obično nalazimo gubitak žučnih vodova uz limfocitni vaskulitis i znakove ishemije. Kronično odbacivanje slabo reagira na imunosupresivnu terapiju i predstavlja indikaciju za retransplantaciju.
Poslijetransplantacijska imunosupresija. Kao i kod transplantacije drugih solidnih organa, kod ovih je bolesnika potrebna doživotna imunosupresija kako bi se spriječilo imunološki posredovano odbacivanje doniranoga organa. Karakteristika ovih bolesnika znatno je niža stopa nastanka reakcije odbacivanja i znatna tolerancija imunološkoga sustava na transplantiranu jetru zbog čega ovi bolesnici uzimaju znatno niže doze imunosupresije, a opisani su i slučajevi razvijene potpune imunotolerancije koja omogućava potpuni prekid uzimanja imunosupresivnih lijekova. U ovu se svrhu najčešće koriste inhibitori kalcineurina (ciklosporin, takrolimus), mTOR inhibitori (sirolimus, everolimus), mikofenolat-mofetil te kortikosteroidi prema određenim terapijskim protokolima koji se razlikuju u različitim transplantacijskim centrima. Tijekom provođenja imunosupresije bolesnici moraju kontrolirati vrijednosti pojedinih imunosupresiva te ih državati unutar preporučenih vrijednosti (npr. takrolimus 5 - 10 ng/mL, ciklosporin 100 - 150 ng/L, sirolimus 5 ng/mL). Bolesnici koji su na imunsupresivnoj terapiji nalaze se u rizičnoj skupini za razvoj infekcija, malignih oboljenja, ali i specifičnih nuspojava (nefrotoksičnost, neurotoksičnost). Najčešći imunosupresivi koji se koriste nakon transplantacije jetre prikazani su u Tablici 4.46.
|
Tablica 4.46. Najznačajniji imunosupresivi u prevenciji odbacivanja transplantirane jetre
|
|
Lijek
|
Doza
|
Praćenje (monitoring)
|
Nuspojave
|
|
Ciklosporin
|
2 x 100 - 200 mg/dan
|
Razina lijeka u serumu
|
Nefrotoksičnost Neurotoksičnost Hipertenzija
|
|
Takrolimus
|
2 x 1 - 2 g/dan
|
Razina lijeka u serumu
|
Nefrotoksičnost
Neurotoksičnost
Šećerna bolest
|
|
Prednizon
|
1 x 5 - 20 mg/dan
|
Kliničko praćenje
|
Hipertenzija
Šećerna bolest
Retencija tekućine
|
|
Mikofenolat mofetil
|
2 x 500 - 1500 mg/dan
|
Krvna slika
|
Neutropenija
Rizik od CMV-a i HSV-a
Probavne smetnje
|
|
Sirolimus
|
1 x 1 - 3 g/dan
|
Razina lijeka u serumu
|
Trombocitopenija
Hiperlipidemija
Trombofilija
|
|
Everolimus
|
2 x 1 - 2 g/dan
|
Razina lijeka u serumu
|
Neutopenija
Trombocitopenija
Hiperlipidemija
|
Najznačajnije bolesti žučnoga mjehura su anomalije žučnoga mjehura, kolelitijaza, akutni i kronični kolecistitis, benigne i maligne neoplazme te postkolecistektomični sindrom.
KONGENITALNE ANOMALIJE
Žučni mjehur može biti anomalan s obzirom na veličinu, oblik i broj. Najčešće su malformacije ageneza žučnoga mjehura, duplikacije žučnoga mjehura, rudimentarni žučni mjehur, divovski žučni mjehur te divertikuli žučnoga mjehura. Frigijska kapa označava stanje u kojemu nalazimo djelomično ili potpuno odvajanje fundusa od korpusa žučnoga mjehura septumom. Anomalni položaj žučnoga mjehura obuhvaća lijevostrani položaj, intrahepatalni položaj te flotirajući položaj (sklon torziji i volvulusu). Anomalije žučnoga mjehura uglavnom su bez većega kliničkoga značenja i mogu stvarati probleme jedino kirurzima kod operacija u tom području.
ŽUČNI KAMENCI (KOLELITIJAZA)
Definicija i epidemiologija. Kolelitijaza je naziv za prisutnost kamenaca u žučnom mjehuru. Ukupno gledano, jedna je od najčešćih bolesti hepatobilijarnoga sustava s ukupnom prevalencijom u zapadnim zemljama između 5 do 10 % za muškarce i 10 do 15 % za žene. Bolest se dva do tri puta češće javlja kod žena, a učestalost se povećava i sa životnom dobi (najveća je u petom i šestom desetljeću života).
Etiopatogeneza. Tri su osnovna etiopatogenetska čimbenika u razvoju žučnih kamenaca: poremećaj sastava žuči, zastoj žuči (kolestaza) te infekcija žučnih puteva. Kada se govori o poremećaju sastava žuči, u prvome se redu misli na prezasićenje žuči kolesterolom i/ili bilirubinom te poremećaj odnosa pronukleacijskih i antinukleacijskih čimbenika, odnosno čimbenika koji potiču i inhibiraju proces kristalizacije i nastanka kamenca. Zastoj žuči (kolestaza) može biti posljedica poremećaja motiliteta žučnoga mjehura (smanjena ili odsutna kontrakcija) ili može nastati uslijed patoanatomskih zapreka (benigne strikture, neoplazme). Infekcije žučnih puteva koje pogoduju razvoju kamenaca obično nastaju ascedentnim putem, širenjem bakterija iz dvanaesnika. U samome nastanku kamenaca razlikujemo tri procesa: hipersaturacija (stvaranje nenormalne, prezasićene žuči), nukleacija (formiranje jezgre oko koje će nastati kamenac) te agregacija (taloženje krute tvari oko jezgre i rast kamenca). Ovisno o sastavu te načinu nastanka, razlikujemo dvije osnovne vrste žučnih kamenaca: kolesterolski i pigmentni kamenci.
Kolesterolski kamenci dominantno su građeni od kristala kolesterola i čine više od 80 % svih žučnih kamenaca. U normalnoj je žuči kolesterol otopljen zajedno s fosfolipidima i žučnim kiselinama u micelarnom ili vezikularnom obliku, i kao takav se luči u tanko crijevo, dok se u stanjima prezasićenosti kristalizira u tzv. kolesterolske monohidratne kristale koji se međusobno spajaju i formiraju kamence (nukleacija). Glavni etiopatogenetski čimbenici koji pridonose razvoju ovih kamenaca su: 1) prezasićenost žuči kolesterolom (visokokalorična prehrana, prehrana bogata kolesterolom i drugim životinjskim mastima, pretilost i naglo mršavljenje, metabolički sindrom); 2) poremećaj odnosa pronukleacijskih (mucin, glikoproteini, imunoglobulini) i antinukleacijskih čimbenika (apolipoprotein A-I i A-II) te 3) smanjen motilitet žučnoga mjehura (šećerna bolest, trudnoća, produljeno gladovanje, hipertrigliceridemija).
Pigmentni kamenci dominantno su građeni od kristala kalcijeva bilirubinata koji čini najveći dio kamenca, a čine manje od 20 % svih žučnih kamenaca. Razlikujemo dva glavna podtipa pigmentnih kamenaca, a to su crni i smeđi. Crni pigmentni kamenci građeni su od kristala kalcijeva bilirubinata i anorganskih kalcijevih soli, kao što su kalcijev-karbonat ili kalcijev-fosfat, a susrećemo ih u stanjima povezanim s kroničnom hiperbilirubinemijom (kronične hemolitičke anemije, Gilbertov sindrom) ili povećanom enterohepatičkom cirkulacijom bilirubina (bolest ili resekcija ileuma). Smeđi pigmentni kamenci građeni su od kalcijeva bilirubinata i masnih kiselina (kalcijev palmitat ili stearat), a nastaju kao posljedica pojačanoga djelovanja β-glukuronidaze koja dovodi do hidrolize micelarnih struktura pri čemu se oslobađaju slobodne masne kiseline i kolesterol te dekonjugacije bilirubina. Nastanak ovih kamenaca povezuje se s infekcijama žučnih puteva, s obzirom na to da neke bakterije imaju sposobnost stvaranja i otpuštanja β-glukuronidaze.
Rizični čimbenici. Prema prethodno iznesenim činjenicama, rizične čimbenike koji pogoduju razvoju žučnih kamenaca možemo podijeliti u dvije osnovne skupine: nepromjenjivi i promjenjivi. Među nepromjenjive čimbenike rizika ubrajamo stariju životnu dob, ženski spol, genetsku predispoziciju te etničku pripadnost, dok u promjenjive čimbenike rizika ubrajamo visokokalorijsku prehranu, prehranu bogatu kolesterolom i životinjskim mastima, pretilost i nagli gubitak na tjelesnoj težini, metabolički sindrom, hipertrigliceridemiju, trudnoću te tjelesnu neaktivnost. Također, učestalost žučnih kamenaca češća je kod bolesnika s cirozom jetre, Crohnovom bolesti te šećernom bolesti, a može se javiti i uz uzimanje nekih lijekova kao što su klofibrat, estrogeni (oralna hormonska kontracepcija, hormonsko nadomjesno liječenje), ceftriakson i oktreotid.
Genetska podloga. Činjenica da se kamenci ne razvijaju kod svih osoba koje imaju neki od navedenih rizičnih čimbenika ukazuje na to da za razvoj kamenca osoba mora imati i genetsku (endogenu) podlogu. Mutacije gena uključenih u proces stvaranja i izlučivanja žuči mogu biti povezane s povećanim rizikom od razvoja žučnih kamenaca. Danas se u tom kontekstu najviše spominju geni čiji produkti djeluju kao transmembranski transporteri kolesterola, žučnih soli i fosfolipida (ABC transporteri, engl. adenosine triphosphate-binding cassette).
Klinička slika. U najvećem broju slučajeva žučni kamenci su asimptomatska bolest te se dijagnoza postavi slučajno tijekom slikovnih pretraga iz nekih drugih razloga. Tek će 20 % bolesnika koji imaju žučne kamence kroz vremenski period od deset do petnaest godina razviti simptomatsku bolest, dok će njih 10 % razviti teže komplikacije (akutni kolecistitis, koledokolitijaza). Bilijarne kolike predstavljaju klasično kliničko očitovanje žučnih kamenaca, a nastaju kada kamenac dovede do opstrukcije u području vrata žučnoga mjehura ili duktusa cistikusa. Iako se bol naziva kolikama, nema klasična obilježja grčevitoga bola. Tipično se javlja u desnom gornjem kvadrantu trbuha i ima sklonost širenju straga prema leđima i desnoj lopatici. U više od 50 % slučajeva bol se javlja unutar jednoga sata od konzumacije masnoga obroka. Nakon nastupa, bol obično u kontinuitetu traje od jednoga do pet sati, a nekada može trajati i do 24 sata. Učestalost pojave tih simptoma je različita (obično jednom na tjedan ili rjeđe). Od ostalih se simptoma mogu javiti mučnina i povraćanje (60 % slučajeva) te nadutost i podrigivanje (50 % slučajeva). Pojava bola koji traje dulje od 24 sata, vrućice ili žutice sugerira na razvoj nekih od komplikacija kolelitijaze.
Komplikacije. Najčešće komplikacije koje mogu pratiti kolelitijazu su akutni kolecistitis, koledokolitijaza i akutni kolangitis, bilijarni pankreatitis te intestinalna opstrukcija nastala pasažom većega konkramenta u lumen tankoga crijeva (sva su navedena klinička stanja zasebno opisana u odgovarajućim dijelovima udžbenika).
Dijagnoza. Osnovna dijagnostička metoda za otkrivanje žučnih kamenaca je ultrazvuk. Laboratorijski nalazi kod bolesnika su nespecifični i nemaju veće dijagnostičko značenje (npr. nalaz hiperlipidemije). Ostale metode uključuju kompjuteriziranu tomografiju, magnetnu rezonancu i klasični radiogram, ali rijetko se koriste za ovu indikaciju.
Ultrazvuk gornjega abdomena indiciran je kod svih bolesnika s opisanom simptomatologijom gornjega abdomena i s visokom osjetljivošću (85 %) i specifičnošću (95 %) može otkriti prisutnost žučnih kamenaca. Oni se klasično prikazuju kao hiperehogena intraluminalna žarišta s distalnom akustičnom sjenom koja nastaje zbog nemogućnosti prodora ultrazvučnih valova kroz sam kamenac, a karakteristično su pomični pri promjeni položaja tijela (engl. rolling stone phenomenon). Analiza može biti limitirana meteorizmom i izraženom adipoznosti bolesnika, a manji konkramenti ne moraju davati distalnu akustičnu sjenu, što može dovesti do previda kamenaca, osobito ako je žučnjak kontrahiran. Kod impaktiranih kamenaca, kao i u slučaju kontrahiranosti žučnjaka, izostaje i mobilnost kamenca. Rijetko, cijeli žučnjak može biti ispunjen konkramentima (kalkulozni žučni mjehur) pri čemu oni daju skupnu, gustu akustičnu sjenu i onemogućavaju vizualizaciju ostatka žučnoga mjehura.
Kompjuterizirana tomografija (CT) i magnetna rezonanca (MRI) manje su osjetljive metode za dijagnosticiranje žučnih kamenaca od ultrazvuka i primarno su indicirane u dijagnostici komplikacija žučnih kamenaca ili kod nejasnih bolova u trbuhu s urednim nalazom ultrazvuka.
Klasični radiogram abdomena pokazat će prisutnost žučnoga kamenca u manje od 15 % slučajeva, s obzirom na to da oni ne sadrže dovoljno kalcija da bi se mogli prikazati na ovaj način, ali pretraga sama po sebi može biti korisna kod ovih bolesnika zbog diferenciranja drugih mogućih uzroka bolova u gornjem trbuhu.
Diferencijalna dijagnoza bilijarnih kolika uključuje sindrom iritabilnoga kolona (spazam u području hepatalne fleksure), atipičnu ulkusnu bolest, renalne kolike, pankreatitis, tumor desnoga hemikolona i sl.
Liječenje. Osnovno liječenje kolelitijaze je operativno (kolecistektomija). Indicirano je kod svih bolesnika sa simptomatskom i kod odabranih bolesnika s asimptomatskom kolelitijazom. Medikamentozno liječenje i litotripsija danas imaju znatno manji značaj u liječenju ovih bolesnika.
Simptomatsko liječenje. Liječenje bilijarnih kolika temelji se na primjeni nesteroidnih protuupalnih lijekova (diklofenak, ketoprofen, ibuprofen) koji se u težim slučajeva mogu primjenjivati parenteralno. Kod ordiniranja lijekova za kućno liječenje potrebno je upozoriti bolesnike da bol koji se ne može kupirati standardnom dozom lijeka zahtijeva bolnički pregled kako se komplikacija ne bi maskirala većom dozom analgetika. Uz te se mjere preporuča smanjiti unos visokokalorične i masne hrane (dijetni režim).
Kirurško liječenje. Laparoskopska kolecistektomija danas je postala zlatni standard u liječenju simptomatske kolelitijaze i predstavlja jedan od najčešće izvođenih zahvata u abdominalnoj kirurgiji. Navedenim se zahvatom u gotovo svih bolesnika postiže simptomatsko olakšavanje, bez većih reperkusija na kvalitetu života. Bolesnici se nakon zahvata otpuštaju na kućno liječenje kroz jedan do dva dana (danas se sve češće zahvat radi i kroz jednodnevnu kirurgiju) uz vraćanje u svakodnevnu životnu rutinu kroz jedan do dva tjedna. Najčešća komplikacija koja prati ovaj zahvat je intraoperativna lezija duktusa koledokusa, a ona se javlja kod 0,1 % operiranih bolesnika. Kolecistektomija može povećati rizik od razvoja adenokarcinoma jednjaka, proksimalnoga tankog crijeva i kolona, što je posljedica direktnoga, kontinuiranog lučenja žuči u crijevo i produljene izloženosti sluznice djelovanju žuči. Kolescistektomija se kod asimptomatskih bolesnika ne izvodi rutinski i rezervirana je za određene skupine bolesnika kao što su bolesnici s kamencem većim od 3 cm, bolesnici s povećanim rizikom od razvoja karcinoma žučnjaka (bolesnici s porculanskim žučnim mjehurom, bolesnici s adenomom žučnjaka te s anomalnim utokom pankreatičnoga voda u koledokus) te kod bolesnika kod kojih se planira transplantacija (zbog naknadne imunosupresije). Nekadašnje preporuke da se profilaktička kolecistektomija izvodi i kod bolesnika sa šećernom bolesti te prije barijatrijske kirurgije danas ne stoji.
Konzervativno liječenje danas ima ograničen značaj u liječenju ovih bolesnika. Primjena ursodeoksikolne kiseline u dozi od 15 mg/kg/dan u svrhu otapanja kolesterolskih kamenaca može dolaziti u obzir kod bolesnika sa simptomatskom kolesterolskom kolelitijazom, kod kojih se ne planira operativno liječenje. Terapijski uspjeh je ograničen (izlječenje se postiže kod oko 40 % bolesnika), a praćen je visokom stopom recidiva bolesti (kod više od 50 % bolesnika u vremenu od pet godina nakon prekida terapije ponovno se pojave kamenci). Primjena ekstrakorporalne litotripsije u liječenju kolelitijaze također ima ograničen uspjeh te se iznimno rijetko primjenjuje (bolesnici kod kojih se ne pristupa kirurškom liječenju, bilo kao samostalno liječenje, bilo u kombinaciji s primjenom ursodeoksikolne kiseline).
AKUTNI KOLECISTITIS
Definicija. Akutni kolecistitis akutna je upala žučnjaka u 90 % slučajeva povezana sa žučnim kamencima (akutni kalkulozni kolecistitis), a malo kad se javi bez njih (akutni akalkulozni kolecistitis).
AKUTNI KALKULOZNI KOLECISTITIS
Etiopatogeneza. Akutni kalkulozni kolecistitis najčešća je komplikacija simptomatske kolelitijaze koja se razvije kod 15 do 20 % takvih bolesnika. Nastaje uslijed impakcije kamenca u području vrata žučnoga mjehura ili duktusa cistikusa pri čemu dolazi do opstrukcije i onemogućavanja drenaže sadržaja iz žučnoga mjehura. Posljedični upalni odgovor nastaje zbog dva osnovna razloga: mehanički podražaj (opstrukcija dovodi do intraluminalnoga zadržavanja sadržaja, porasta tlaka i distenzije s posljedičnom ishemijom sluznice) te kemijski podražaj (unutar žuči dolazi do aktivacije leticina u lizoleticin koji toksično djeluje na sluznicu). Kod 50 % bolesnika možemo naći i sekundarnu infekciju najčešće uzrokovanu bakterijama E. coli, Klebsiella spp., i Streptococcus spp.
Klinička slika. Bolest karakterizira nastup jakih bolova u području desnoga gornjeg kvadranta abdomena koji za razliku od bilijarnih kolika traju dulje (obično dulje od 24 sata) te su češće povezani s mučninom i povraćanjem, febrilnim stanjem i izraženom anoreksijom. Tjelesna temperatura obično je umjereno povišena, a visoko febrilno stanje ukazuje na sekundarnu bakterijsku infekciju ili širenje upale na koledokus (kolangitis). U kliničkom pregledu dominira izražena bolnost i osjetljivost gornjega desnog kvadranta abdomena s različito izraženim znacima nadražaja peritoneuma (ograničeni defans) te pozitivan Murphyev znak (pojačanje bolnosti tijekom palpacije žučnjaka u dubokom inspiriju). Rjeđe se kod bolesnika može zamijetiti ikterus ili se može napalpirati bolna patorezistencija u desnom gornjem kvadrantu (zadebljali omentum oko žučnjaka kao odgovor na upalni proces kojim se nastoji lokalizirati upala).
Dijagnoza se postavlja na temelju kliničke slike i fizikalnoga nalaza, laboratorijskih nalaza te slikovnih metoda od kojih najznačajniju ulogu ima ultrazvuk.
Laboratorijski nalazi. U laboratorijskim se nalazima pojavljuju umjereno povišeni markeri upale (leukociti, C-reaktivni protein) te umjereno povišene vrijednosti jetrenih transaminaza, alkalne fosfataze, bilirubina te amilaza i lipaza. Značajno povišeni navedeni nalazi ukazuju na razvoj komplikacija akutnoga kolecistitisa.
Ultrazvuk žučnoga mjehura i žučnih puteva pokazuje manju osjetljivost (67 %) i specifičnost (82 %) u dijagnostici akutnoga kolecistitisa u odnosnu na kolelitijazu. Glavni ultrazvučni nalazi koji ukazuju na akutni kolecistitis su zadebljana (> 4 mm), hipoehogena i raslojena stijenka žučnoga mjehura te prisutnost tekućine oko žučnoga mjehura (perikolecistična kolekcija), kao i pozitivan sonografski Murphyev znak (bolnost prilikom prelaska ultrazvučne sonde u području žučnoga mjehura). Obojeni dopler može prikazati pojačanu vaskularizaciju zadebljane stijenke žučnjaka.
Kolescintigrafija danas se rijetko izvodi, a zasniva se na intravenskoj primjeni hepatalne iminodiacetatne kiseline obilježene tehnecijom (HIDA) koja se u normalnim uvjetima izlučuje u žuč i nakuplja u žučnom mjehuru. Pozitivan nalaz uključuje izostanak prikaza žučnoga mjehura uslijed opstrukcije duktusa cistikusa, bilo kamencem, bilo edemom sluznice što nalazimo u akutnom kolecistitisu.
Ostale slikovne metode. Kompjuterizirana tomografija (CT) i magnetna rezonanca (MRI) rjeđe se koriste u dijagnostici akutnoga kolecistitisa, a svoje mjesto imaju pri sumnji na razvoj komplikacija (gangrena žučnjaka, perforacija žučnjaka).
Diferencijalna dijagnoza je široka i uključuje različite bolesti i stanja: akutni pankreatitis, perforirani duodenalni ili želučani ulkus, intrahepatalni apsces, akutni apendicitis, bazalna pneumonija, akutni infarkt miokarda i sl.
Liječenje akutnoga kolecistitisa uključuje kombinaciju konzervativnoga (antibiotsko i simptomatsko) i kirurškoga ili interventnog liječenja. Kod svih je bolesnika indicirana hospitalizacija, mirovanje i karencija uz odgovarajući nadzor kliničkoga stanja te, prema potrebi, vitalnih funkcija.
Konzervativno liječenje uključuje odgovarajuću volumnu resuscitaciju (infuzijsko liječenje), analgeziju (nesteroidni protuupalni lijekovi), ostalu simptomatsku terapiju (korekcija elektrolita) te primjenu antibiotika. Izbor antibiotika u akutnom kolecistitisu prikazan je u Tablici 4.47., a ovisi o mjestu nastanka bolesti (izvanbolnička ili bolnička) i kliničkoj težini same bolesti.
Kirurško i interventno liječenje. Kolecistektomija (laparoskopska, klasična) predstavlja temelj liječenja akutnoga kalkuloznog kolecistitisa. Ovisno o vremenu izvođenja, razlikujemo hitnu, ranu i odgođenu kolecistektomiju. Interventno liječenje podrazumijeva perkutanu ili endoskopsku drenažu sadržaja iz žučnoga mjehura, a primjenjuje se samo u teških bolesnika kada operativno liječenje nije primarna opcija (kasnije objašnjeno). Indikaciju za hitnu kolecistektomiju (unutar 24 sata) predstavlja akutni kalkulozni kolecistitis s razvijenim komplikacijama (gangrena, perforacija, emfizem) te progresija bolesti unatoč odgovarajućem konzervativnom liječenju. Na prisutnost komplikacija ukazuje samo kliničko stanje bolesnika (izrazita prostracija, hemodinamska nestabilnost), kao i laboratorijski nalazi (izražena leukocitoza, visoki CRP) te radiološki znakovi (kod dvojbenih nalaza indicirana je kompjuterizirana tomografija).
Bolesnici koji nisu kandidati za hitnu kolecistektomiju razvrstavaju se temeljem ASA klasifikacije (od engl. American Society of Anesthesiologists) u dvije skupine: bolesnici niskoga rizika (ASA I - II) te bolesnici visokoga rizika (ASA III - V) te se dalje ovisno o njihovom kliničkom stanju i odgovoru na konzervativno liječenje donosi odluka hoće li biti podvrgnuti ranoj (unutar nekoliko dana u istoj hospitalizaciji) ili odgođenoj, tj. elektivnoj kolecistektomiji (po smirivanju kliničkoga stanja kroz nekoliko tjedana do nekoliko mjeseci).
Bolesnici s niskim rizikom (ASA I i II), ako pokažu kliničko poboljšanje kroz sljedeća dva do tri dana, kandidati su za ranu kolecistektomiju tijekom iste hospitalizacije, no ako izostane zadovoljavajući klinički odgovor ili se klinički pokazatelji pogoršaju u bilo kojem trenutku, postaju kandidati za hitnu kolecistektomiju.
Kod bolesnika s visokim rizikom (ASA III do V), koji ne pokazuju znakove sepse i nisu vitalno ugroženi, inicijalno liječenje je konzervativno te se nakon jednoga do tri dana radi ponovna klinička procjena. Ako se kod bolesnika pojavi kliničko poboljšanje, nastavlja se s konzervativnim liječenjem te oni postaju kandidati za elektivnu (odgođenu) kolecistektomiju. Ako se kod bolesnika nakon inicijalno započetoga konzervativnog liječenja ne postiže kliničko poboljšanje ili dođe do daljnjega pogoršanja, indicirana je perkutana ili endoskopska intervencija (drenaža žučnoga mjehura) s daljnjim praćenjem stanja. Ako se bolest nakon interventnoga postupka smiri, nastavlja se konzervativno liječenje te oni također postaju kandidati za odgođenu kolecistektomiju, no ako bolest dalje progredira, indicirana je hitna kolecistektomija (vitalna indikacija).
Kod bolesnika s visokim rizikom (ASA III do V), koji pokazuju znakove sepse i vitalne ugroženosti, indicirana je hitna endoskopska ili perkutana intervencija (drenaža) te se prati klinički odgovor. Ako se postigne kliničko poboljšanje, nastavlja se konzervativno liječenje te bolesnici postaju kandidati za odgođenu (elektivnu) kolecistektomiju, no kada se dalje prati pogoršanje ili izostane odgovarajući terapijski odgovor i ti bolesnici postaju kandidati za hitnu kolecistektomiju (vitalna indikacija).
Komplikacije. Najznačajnije komplikacije akutnoga kolecistitsa su gangrena i perforacija žučnoga mjehura, empijem žučnoga mjehura, emfizematozni kolecistitis, kolecistoenterička fistula te razvoj kroničnoga kolecistitisa.
Gangrena žučnoga mjehura nastaje kao rezultat protrahirane ishemije stijenke koja dovodi do ireverzibilnih strukturnih promjena, koje mogu rezultirati nastankom perforacije. Rizični čimbenici za razvoj gangrene uključuju stariju životnu dob, izraženu distenziju žučnjaka te kronične komorbiditete (šećerna bolest, imunosupresija i sl.). Klinički dominira jaka bolnost, razvoj visoko febrilnoga stanja te izražena osjetljivost i palpatorna bolnost u području gornjega desnog kvadranta abdomena. Gangrena se najbolje uočava na temelju nalaza kompjuterizirane tomografije. Liječenje se sastoji od hitne kolecistektomije.
Perforacija žučnoga mjehura najčešće nastaje kao posljedica gangrene stijenke žučnoga mjehura, a razlikujemo slobdnu i ograničenu perforaciju. Kod slobodne perforacije dolazi do pražnjenja sadržaja žučnoga mjehura u trbušnu šupljinu što dovodi do privremenoga kliničkog poboljšanja nakon čega slijedi razvoj znakova generaliziranoga peritonitisa i sepse. Ograničena perforacija nastaje kada na mjesto peroforacije nasjedne omentum koji spriječi razlijevanje sadržaja iz žučnoga mjehura u trbušnu šupljinu čime se proces ograniči i spriječi nastanak peritonitisa. Klinička slika slična je kao i kod gangrene žučnjaka, a kompjuterizirana tomografija također je petraga izbora u dokazivanju ovoga stanja. Liječenje uključuje hitnu kolecistektomiju.
Empijem žučnoga mjehura nastaje kao posljedica bakterijske superinfekcije sadržaja koji se nalazi u žučnom mjehuru pri čemu dolazi do pojave izražene supuracije. U kliničkoj slici osim bolova u trbuhu, mučnine i povraćanja dominiraju i izraženi opći infektivni znaci. Nekada se proširen, gnojem ispunjen žučnjak može palpirati preko trbušne stijenke. Empijem žučnoga mjehura nosi visoki rizik od nastanka perforacije i gram-negativne sepse. Dijagnoza se postavlja na temelju laboratorijskih nalaza (izražena leukocitoza i značajan porast C-reaktivnoga proteina) uz potvrdu slikovnim metodama. Ultrazvučni nalaz ukazuje na ispunjenost lumena žučnjaka ehogenijim sadržajem, obično uz prisutnost kamenca, a cijeli žučnjak je uvećan te djeluje okrugao i napet. Liječenje se sastoji od hitne kolecistektomije uz odgovarajuću antimikrobnu terapiju.
Emfizematozni kolecistitis razvija se kao posljedica superinfekcije stijenke žučnoga mjehura bakterijama koje imaju sposobnost stvaranja plinova (Clostridium perfringens, Clostridium welchii, E. coli). To se stanje najčešće susreće kod starijih osoba s dugogodišnjom anamnezom šećerne bolesti. Klinička slika uključuje lokalno izražene simptome i znakove (bol u trbuhu, palpatorna osjetljivost gornjega desnog kvadranta abdomena) uz opće infektivne simptome (vrućica, algični sindrom). Dijagnoza se potvrđuje nalazom plinovitoga sadržaja u području stijenke žučnoga mjehura na klasičnoj radiološkoj snimci abdomena, a još bolja vizualizacija postiže se kompjuteriziranom tomografijom. Ultrazvučno se unutar stijenke žučnjaka uočavaju odjeci visoke amplitude uzrokovani mjehurićima zraka. Liječenje se sastoji od hitne kolecistektomije.
Kolecistoenterička fistula nastaje progresijom upale koja zahvaća cijelu stijenku žučnoga mjehura te se nastavlja na organ koji s kojim je u tijesnom kontaktu pri čemu dolazi do stvaranja patološkoga spoja (fistule). Najčešće su fistule između žučnoga mjehura i dvanaesnika, iako možemo naći i fistule s drugim djelovima tankoga crijeva i kolonom. Nakon razvoja fistule dolazi do spontane drenaže sadržaja iz žučnoga mjehura, zbog čega dolazi do olakšanja simptoma bolesti (pogrešno se tumači da se radi o smirivanju bolesti). Dijagnoza se potvrđuje endoskopskim prikazom patološke komunikacije ili kontrastnom radiološkom pretragom probavne cijevi. Liječenje je kirurško.
Prognoza je načelno dobra i uz odgovarajuće konzervativno liječenje i kirurški pristup postiže se izlječenje većine bolesnika. Lošiji ishodi povezani su uglavnom sa starijom životnom dobi te brojnim kroničnim komorbiditetima.
AKUTNI AKALKULOZNI KOLECISTITIS
Etiopatogeneza. Akutni akalkulozni kolecistitis značajno je rjeđa pojava od akutnoga kalkuloznog kolecistitisa i čini svega 5 do 10 % slučajeva akutnoga kolecistitisa. Obično se susreće kod kritično oboljelih osoba nakon teških trauma, opeklina, operacija ili nakon prolongirane totalne parenteralne prehrane. Točan mehanizam nastanka upale nije jasan, ali se tumači poremećenim motilitetom žučnjaka koji dovodi do kolestaze i sekundarne bakterijske kolonizacije (ascedentno širenje bakterija iz dvanaesnika putem žučnih vodova).
Klinička slika. Simptomi i znakovi slični su kao i kod kalkuloznoga kolecistitsa te uključuju lokalne simptome i znakove (bol u trbuhu, mučnina, povraćanje, palpatorna osjetljivst, nadražaj peritoneuma) uz pojavu visoke tjelesne teperature, tresavice i zimice. Bolest pokazuje brži i progresivniji tijek nego kalkulozni kolecistitis te se brže i češće razvijaju komplikacije kao što su empijem, gangrena, emfizem i perforacija.
Dijagnoza se postavlja na temelju anamnestičkih podataka, kliničke slike i kliničkoga nalaza, laboratorijskih pretraga (leukocitoza, povišeni C-reaktivni protein) te slikovnih metoda. Ultrazvuk ili CT nalaz ukazuju na prisutnost dilatiranoga žučnog mjehura, zadebljane i raslojene stijenke, bez prisutnosti žučnih kamenaca.
Liječenje se sastoji od hitnoga kirurškog liječenja, s obzirom na mogućnost brzoga razvoja komplikacija. Ako je operativni zahvat kontraindiciran, preporučljivo je obaviti interventnu drenažu žučnoga mjehura, bilo postavljanjem perkutanoga drena, bilo endoskopskim putem. Uz ove, provode se i druge mjere konzervativnoga liječenja kako je to opisano kod akutnoga kalkuloznog kolecistitisa.
KRONIČNI KOLECISTITIS
Kronični kolecistitis naziv je za kroničnu upalu stijenke žučnoga mjehura koja nastaje kao posljedica prisutnosti žučnih kamenaca i stalnoga mehaničkog podražaja i/ili učestalih epizoda akutnoga kolecistitisa. Bolest je obično asimptomatskoga tijeka, a dijagnoza se postavlja slikovnim metodama (ultrazvuk, kompjuterizirana tomografija). Ultrazvučni nalaz kod kroničnoga kolecistitisa uključuje difuzno ili ograničeno zadebljanje stijenke koja je hiperehogena, a može biti i raslojena uslijed brojnih akutizacija upale. Jedna od najznačajnijih posljedica kroničnoga kolecistitisa je nastanak tzv. porculanskoga žučnog mjehura. Porculanski žučni mjehur nastaje kao posljedica odlaganja kalcijevih soli u kronično upaljenu stijenku žučnoga mjehura, a dobro je poznata veza između njegove pojavnosti i pojavnosti karcinoma žučnoga mjehura, zbog čega se on smatra prekanceroznom lezijom. U slučaju porculanskoga žučnog mjehura, ultrazvukom se prikazuje hiperehogena stijenka uz kompletnu ili djelomičnu distalnu akustičnu sjenu, a nekada ga je teško razlikovati od žučnjaka koji je u potpunosti ispunjen konkramentima. Liječenje je operativno (kolecistektomija).
KARCINOM ŽUČNJAKA
Definicija. Karcinom žučnoga mjehura maligni je epitelni tumor koji predstavlja najčešće maligno oboljenje žučnoga sustava, a na petom je mjestu po učestalosti u odnosu na cijeli probavni sustav. Obično se javlja u šestom i sedmom desetljeću života s nešto većom učestalosti kod žena u odnosu na muškarce (3:1).
Etiopatogeneza. Točan uzrok i mehanizam razvoja karcinoma žučnoga mjehura je nepoznat. Etiološki čimbenici koji pogoduju razvoju ovoga karcinoma su: genetska predispozicija (mutacije K-ras i p53 gena), kolelitijaza (solitarni kamenci veći od 3 cm), kronični kolecistitis i porculanski žučni mjehur, polipi žučnoga mjehura veći od 1 cm, izlaganje aflatoksinu te neka konegenitalna stanja (cistične anomalije žučnih puteva te anomalni utok duktusa pankreatikusa u koledokus).
Patologija. U više od 90 % slučajeva radi se o adenokarcinomu (scirozni, papilarni, koloidni), dok se u ostalih 10 % radi o planocelularnom ili anaplastičnom karcinomu. Karcinom žučnoga mjehura može se širiti lokalno invazivno infiltrirajući okolne strukture (koledokus, dvanaesnik, kolon) ili limfogeno (lokalni i udaljeni limfni čvorovi) te hematogeno (udaljene metastaze).
Klinička slika je nespecifična. Više od 80 % bolesnika ima bol pod desnim rebrenim lukom koji traje dulje od mjesec dana i sliči na bol pri kolelitijazi, kod 50 % bolesnika dominira mučnina i povraćanje s gubitkom na tjelesnoj masi, a kod oko 30 % bolesnika razvija se žutica koja i predstavlja loš prognostički znak.
Dijagnoza se postavlja na temelju laboratorijskih nalaza te slikovnih dijagnostičkih metoda. Laboratorijski nalazi ovih bolesnika su nespecifični i ovise o proširenosti bolesti, a nema razvijenih specifičnih tumorskih markera. U kasnijim fazama bolesti prate se anemija, hipoproteinemija te patološki nalazi jetrenih transaminaza i pokazatelja kolestaze. Ultrazvuk žučnoga mjehura i žučnih vodova ima 80 %-tnu osjetljivost u otkrivanju karcinoma žučnoga mjehura, a prikazuje se kao hipoehogena, inhomogena, polipoidna ili nepravilna masa koja se izbočuje iz stijenke žučnjaka te ovisno o veličini zauzima manji ili veći prostor unutar samoga žučnjaka. Obojeni dopler pokazuje rijetku i raspršenu vaskularizaciju unutar tumorske mase. CT i MRI, osim što mogu bolje prikazati morfološke karakteristike tumorske mase, imaju važno mjesto i u procjeni lokalne, ali i udaljene raširenosti bolesti. Endoskopski ultrazvuk i ERCP rijetko se koriste u prijeoperativnom dijagnostičkom postupku.
Proširenost bolesti. Iako su na raspolaganju različite dijagnostičke metode, proširenost bolesti najčešće se procjenjuje tijekom samoga operativnog zahvata. U svrhu utvrđivanja proširenosti bolesti koristi se TNM klasifikacija: Tis (karcinom in situ), T1a (tumor zahvaća laminu propriju), T1b (tumor zahvaća mišićni sloj), T2 (tumor zahvaća perimuskularno vezivno tkivo, ali ne zahvaća serozu), T3 (tumor zahvaća serozu te jetru ili druge okolne organe), T4 (tumor zahvaća portalnu venu ili hepatalnu arteriju ili zahvaća dvije ili više ekstrahepatične okolne strukture), N0 (nema metastaza u limfne čvorove), N1 (metastaze u jedan do tri regionalna limfna čvora), N2 (metastaze u četiri ili više regionalna limfna čvora), M0 (nema udaljenih metastaza) te M1 (prisutne udaljenje metastaze). Na temelju TNM klasifikacija određuju se stadiji bolesti: stadij 0 (Tis, No, M0), stadij Ia (T1, N0, M0), stadij Ib (T2, N0, M0), stadij IIa (T3, N0, M0), stadij IIb (T1-3, N1, M0), stadij IIIa (T3, N0, M0), stadij IIIb (T1-3, N1, M0), stadij IVa (T4, N0-1, M0) te stadij IVb (T1-3, N0-2, M1 ili T1-3, N2, M0). Resektabilni stadiji su stadij 0, Ia i Ib, dok su ostali neresektabilni.
Liječenje. Kirurško liječenje, ako je moguće, čini osnovu liječenja ove bolesti. Ako je tumor ograničen samo na stijenku žučnjaka bez prodora seroze, indicirana je kolecistektomija i limfedenektomija, no kada nalazimo i proboj seroze, resekcija mora uključivati i samo ležište žučnjaka u jetri. Kod radikalno operiranih bolesnika preporuča se adjuvantna kemoterapija (kombinacija gemcitabina i kapecitabina). Učinak adjuvante radioterapije je kontroverzan, no ipak se preporučuje bolesnicima s pozitivnim limfnim čvorovima. Kod neresektabilne bolesti obično je indicirano kirurško palijativno liječenje (bilioenteralna anastomoza) uz palijativnu kemoradioterapiju (gemcitabin, cisplatina). Odgovor ovih tumora na onkološku terapiju općenito je slab i kratkotrajan.
Prognoza ponajprije ovisi o proširenosti bolesti. U slučaju proširene metastatske bolesti srednje preživljenje ovih bolesnika iznosi devet do dvanaest mjeseci.
BENIGNI TUMORI ŽUČNJAKA
Kolesteroloza žučnoga mjehura podrazumijeva abnormalno prekomjerno nakupljane lipida, posebno kolesterola, unutar makrofaga koji su smješteni u području lamine proprije stijenke žučnoga mjehura. Razlikujemo dvije osnovne forme bolesti: difuzna forma pri kojoj cijela sluznica postaje zadebljana i grubo granulirana te lokalizirana forma pri kojoj nalazimo jedan ili više tzv. kolesterolskih polipa unutar lumena žučnoga mjehura. Najčešće je kolesteroloza udružena s kolesterolskom kolelitijazom, ali može se javiti i bez nje. Klinički, bolest može biti asimptomatska ili može imati nespecifične simptome nalik onima kod kolelitijaze. Dijagnoza se postavlja na temelju slikovnih metoda (okruglasta intraluminalna masa pričvršćena uz stijenku žučnjaka, a ne daje akustičnu sjenu), a liječenje je operativno (kolecistektomija).
Adenomiomatoza žučnoga mjehura označava stanje karakterizirano hiperplazijom sluznice i mišićnoga sloja stijenke žučnoga mjehura pri čemu se formiraju višestruki intramuralni divertikuli, tzv. Rokitansky-Aschoffovi sinusi. Smatra se da adenomiomatoza nastaje kao posljedica povećanoga intraluminalnog tlaka uslijed otežanoga pražnjenja žučnoga mjehura, iako to nije dokazano. Kod većine bolesnika stanje je povezano s kolelitijazom. Bolest je obično asimptomatska, a dijagnoza se postavlja na temelju slikovnih metoda (ultrazvuk, kompjuterizirana tomografija). Liječenje je operativno, a provodi se samo kod simptomatskih bolesnika i kod nejasne etiologije. Adenomiomatoza žučnoga mjehura ne smatra se premalignom lezijom.
Adenomatozni polipi (adenomi) žučnoga mjehura predstavljaju benigne epitelne tumore koji imaju maligni potencijal. Obično dolaze solitarno i manji su od 1 cm. Većina polipa je asimptomatska, vrlo rijetko mogu imati nespecifične simptome nalik onima kod kolelitijaze i to većinom kod bolesnika s polipima većih dimenzija. Dijagnoza se postavlja na temelju slikovnih pretraga, posebice ultrazvučnoga pregleda na kojemu se prikazuje kao hiperehogena intraluminalna masa bez akustične sjene koja ne pokazuje znakove mobilnosti prilikom promjene položaja tijela. Liječenje je indicirano kod polipa većih od 1 cm (s obzirom na to da oni mogu sadržavati karcinom in situ) te kod simptomatskih bolesnika. Polipi manji od 1 cm prate se serijskim ultrazvučnim pregledima te je indicirana operacija kada se primijeti njihov konstantan rast.
POSTKOLECISTEKTOMIČNI SINDROM
Postkolecistektomični sindrom naziv je za prisutnost abdominalnih simptoma u obliku dispeptičkih tegoba, bolova i nelagode u gornjem desnom kvadrantu abdomena uz flatulenciju i intoleranciju masne harne, koja se javlja kod bolesnika nakon kolecistektomije. Prema različitim studijama, ovaj sindrom javlja se kod 10 do 30 % bolesnika, većinom kod žena. Bolest je funkcionalne prirode i nema potpuno razjašnjenu etiopatogenezu, ali se povezuje s poremećenim protokom žuči i enterehepatičnim kruženjem. Kod svih bolesnika treba isključiti druge moguće uzroke ovih simptoma, kao što su koledoholitijaza, benigna postoperativna striktura koledokusa, disfunkcija Oddijeva sfinktera, kronični pankreatitis i sl. Zbog toga se kod svih ovih bolesnika preporučaju laboratorijska obrada, ultrazvuk abdomena, endoskopski ultrazvuk te MRCP ili ERCP ako postoji sumnja na bilijarnu strikturu ili koledokolitijazu uz manometriju Oddijeva sfinktera. Liječenje postkolecistektoničnoga sindroma je konzervativno i sastoji se od primjene gastroprotektiva, spazmonalagetika, a u nekim slučajevima i tricikličkih antidepresiva.
Najznačajnije bolesti žučnih vodova su anomalije žučnih vodova, kamenci (koledokolitijaza), upale (akutni kolangitis, rekurirajući gnojni kolangitis), autoimune bolesti (primarni sklerozirajući kolangitis, primarna bilijarna ciroza) te benigni i maligni tumori (kolangiokarcinom).
KONGENITALNE ANOMALIJE
Anomalije žučnih puteva. Najčešća i najznačajnija anomalija žučnih vodova su bilijarna atrezija i hipoplazija. One podrazumijevaju nepotpun ili potpun izostanak razvoja manjega ili većeg segmenta žučnih puteva. Klinički se očituju kao novorođenačka žutica koja traje i poslije šest do osam tjedana, premda su isključeni drugi mogući uzroci neonatalnoga ikterusa. Stolica je akolična, mokraća tamna, a jetra umjereno povećana. Dijagnoza se postavlja putem perkutane ili intraoperativne kolangiografije. Liječenje je u većini slučajeva transplantacija jetre (zbog razvoja kroničnoga kolangitisa, hepatalne fibroze i portalne hipertenzije).
Cistične malformacije. Ciste žučnih vodova su kongenitalne abnormalnosti bilijarnoga sustava koje se očituju cističnom dilatacijom ekstrahepatičnih i/ili intrahepatičnih žučnih vodova. Češće obolijevaju žene. Klinički nalazimo bol u desnom gornjem kvadrantu abdomena, ikterus i palpabilnu masu. Komplikacije uključuju kolangitis, hepatalni apsces te povećan rizik od razvoja karcinoma i bilijarni peritonitis nakon rupture ciste. Dijagnoza se postavlja na temelju kliničkoga nalaza, ultrazvuka, CT-a, te prikazivanjem bilijarnoga trakta nekom od klasičnih pretraga (MRCP, ERCP). Liječenje je kirurško.
Carolijeva bolest predstavlja rijetku kongenitalnu anomaliju obilježenu segmentalnim, vrećastim cističnim proširenjima velikih intrahepatalnih žučnih vodova. Cistična proširenja stvaraju preduvjete za povećan rizik od razvoja koledokolitijaze, kolangitisa i kolangiokarcinoma. Kliničkom slikom dominiraju povremeni napadi akutnoga kolangitisa. Dijagnoza se postavlja na osnovi slikovnih metoda prikaza žučnih vodova (MRCP, ERCP). Ako se radi o lokaliziranoj bolesti, terapija izbora je resekcija jetre, dok se kod difuzne izvodi transplantacija.
KOLEDOKOLITIJAZA
Definicija. Koledokolitijaza je naziv za prisutnost kamenaca u žučnim vodovima, posebice glavnom žučovodu (lat. ductus choledocus). Učestalost koledokolitijaze raste s dobi te se ona smatra bitnim rizičnom čimbenikom u razvoju ove bolesti. Smatra se da 25 do 50 % starijih bolesnika s kolelitijazom istodobno ima i koledokolitijazu.
Etiopatogeneza. S obzirom na etiopatogenezu, razlikujemo primarnu i sekundarnu koledokolitijazu. Primarna koledokolitijaza podrazumijeva nastanak kamenaca de novo u žučnim vodovima, a povezana je s bilijarnom stazom i superponiranom infekcijom pri čemu bakterije posreduju dekonjugaciju bilirubina i razgradnju micelarnih struktura građenih od kolesterola i drugih lipida, što za posljedicu ima nastanak smeđih pigmentnih kamenaca (građeni od kalcijeva bilirubinata i masnih kiselina). Sekundarna koledokolitijaza nastaje kao posljedica kolelitijaze, odnosno nastaje spontanom pasažom kamenca iz žučnoga mjehura u žučne vodove. Sekundarna koledokolitijaza znatno je češća od primarne i čini oko 80 % svih slučajeva koledokolitijaze.
Klinička slika. Velik broj bolesnika s koledokolitijazom nema značajne kliničke tegobe i ona se otkriva slučajno. Osnovne kliničke manifestacije su bol i žutica. Bol se javlja u području epigastrija ili gornjega desnog kvadranta trbuha te ima karakteristike slične onima kod bolesnika s kolelitijazom, a nastaje kada dođe do impakcije kamenca koji dovede do djelomične ili potpune opstrukcije i bilijarne staze. Bol može biti praćen pojavom mučnine i povraćanja. Žutica je obično povezana s bolom (rijetke su bezbolne) te je obično intermitentnoga karaktera. Očituje se pojavom žutoga obojenja kože i sluznica (svijetlo žuta boja) uz istodobnu pojavu tamne mokraće (urobilnogen) i svijetle (akolične) stolice uslijed manjka sterkobilina koji nastaje razgradnjom bilirubina u stolici. U slučaju razvoja akutnoga kolangitisa dolazi do povišenja tjelesne temperature, tresavice i zimice, kao i intenziviranja prethodno navedenih tegoba.
Komplikacije. Glavne komplikacije koledokolitijaze povezane su s impakcijom kamenaca unutar glavnoga žučovoda što može dovesti do bilijarne staze i žutice, sekundarnih bakterijskih infekcija (akutni kolangitis, apsces jetre, sepsa), akutnoga pankreatitisa te kronične bilijarne strikture.
Dijagnoza koledokolitijaze ponajprije se postavlja na temelju slikovnih radioloških metoda među kojima glavnu ulogu imaju ultrazvuk te magnetna kolangiopankreatografija (MRCP). Laboratorijski nalazi ovih bolesnika mogu biti uredni, no u slučaju djelomične ili potpune opstrukcije žučnih puteva mogu se naći povišene vrijednosti kolestatskih biljega (bilirubin, alkalna fosfataza, gama-glutamiltransferaza) uz umjereno povišene biljege hepatocelularnoga oštećenja (aspartat-aminotransferaza, alanin-aminotransferaza).
Ultrazvuk obično predstavlja ishodišnu dijagnostičku metodu kod bolesnika s bolovima i žuticom te sumnjom na kamence unutar bilijarnoga sustava. Kamenci unutar žučnih vodova teško se detektiraju pa je nekada jedini znak nalaz proširenje žučnih puteva. Kamenci se unutar žučnih puteva prikazuju kao pojedinačne ili višestruke hiperehogene tvorbe s distalnom akustičnom sjenom. Prikaz kamenaca i akustične sjene često je limitiran zrakom iz crijeva. Proširenje žučnih puteva uključuje dilataciju intrahepatičnih ili ekstrahepatičnih žučnih vodova. Dilatirani intrahepatalni vodovi prikazuju se kao anehogene tračnice, a razlikovanje od vaskularnih struktura omogućava pregled obojenim doplerom. O dilataciji duktusa koledokusa govorimo kada je njegov unutarnji promjer veći od 6 mm. Ultrazvučni nalaz treba proširiti i na ostale strukture gornjega abdomena zbog pronalaženja drugih mogućih uzroka bilijarne opstrukcije i dilatacije žučnih vodova.
Magnetna kolangiopankreatografija (MRCP) predstavlja slikovnu dijagnostičku metodu koja uz visok stupanj specifičnosti i osjetljivosti može dokazati prisutnost kamenaca unutar žučnih puteva. Danas je praktički indicirana kod svih bolesnika s kliničkom sumnjom na koledokolitijazu, kojima ta dijagnoza nije postavljena na temelju ultrazvučnoga pregleda žučnih vodova. Glavna je prednost te pretrage izbjegavanje štetnoga ionizirajućeg zračenja.
Ostale dijagnostičke metode. Endoskopski ultrazvuk (EUS) predstavlja invazivnu metodu kojom se putem endoskopske ultrazvučne sonde iz dvanaesnika može vizualizirati duktus koledokus i analizirati prisutnost kamenaca u njemu. Kompjuterizirana tomografija (CT) također može biti korisna u otkrivanju koledokolitijaze, ali uz MRCP i EUS nema toliko velik klinički značaj. Endoskopska retrogradna kolangiopankreatografija (ERCP) danas se ne izvodi u dijagnostičke svrhe, nego je rezervirana za bolesnike s potvrđenom koledokolitijazom ili visokom kliničkom sumnjom na koledokolitijazu, kod kojih se planira istodobna endoskopska intervencija. Perkutana transhepatična kolangografija (PTC) danas se rijetko izvodi s obzirom na niže stope specifičnosti i osjetljivosti u potvrđivanju koledokolitijaze.
Diferencijalna dijagnoza. Bilijarnu opstrukciju i kliničku sliku koledokolitijaze mogu uzrokovati i različiti drugi intraluminalni ili ekstralumninalni uzroci (Tablica 4.48.).
|
Tablica 4.48. Diferencijalna dijagnoza bilijarne opstrukcije
|
|
Intraluminalni uzroci
|
Ekstraluminalni uzroci
|
|
Kolangiokarcinom
Benigne strikture i stenoze
Sklerozirajući kolangitis
Parazitarna infestacija
|
Karcinom glave gušterače
Karcinom u području ampularne regije
Akutni pankreatitis
Limfadenopatija
|
Liječenje. Osnovu liječenja koledokolitijaze čini endoskopsko ili kirurško uklanjanje kamenaca iz žučnih vodova, što dovodi do simptomatskoga olakšavanja, kao i sprečavanja razvoja navedenih komplikacija. Ekstrakcija kamenaca iz žučnih puteva indicirana je u svih bolesnika bez obzira na simptomatologiju.
Endoskopsko liječenje. Endoskopska intervencija tijekom ERCP-a danas je postala glavna terapijska opcija u liječenju ovih bolesnika. Podrazumijeva endoskopsku sfinkterotomiju, balonsku dilataciju te ekstrakciju kamenca košaricom (engl. basket extraction). Na taj se način može riješiti i do 90 % kamenaca, a glavne su komplikacije te procedure pankreatitis, krvarenje, kolangitis te perforacija, a javljaju se u manje od 5 - 10 % bolesnika. Kamenci veći od 1,5 cm ili oni smješteni iznad bilijarne strikture teško se mogu ekstrahirati navedenom metodom te je za njihovu ekstrakciju potrebno korištenje alternativnih postupaka, kao što je dilatacija balonima velikoga promjera te mehanička ili elektrohidraulička fragmentacija. U slučaju nemogućnosti potpune ekstrakcije žučnih kamenaca, preporuča se postavljanje endoluminalnih stentova koji će osigurati odgovarajuću drenažu žuči i spriječiti nastanak ponovne opstrukcije.
Kirurško liječenje. U slučaju nemogućnosti ekstrakcije kamenaca endoskopskim putem indicirano je operativno liječenje koje uključuje laparoskopsku ili otvorenu eksploraciju duktusa koledokusa s uklanjanjem kamenaca. Eksploracija koledokusa potpomaže se intraoperativnom kolangiografijom. Danas se ona vrlo rijetko koristi s obzirom na razvijene metode endoskopskoga liječenja. U slučaju postojanja istodobne kolelitijaze i koledokolitijaze preporuča se laparoskopska kolecistektomija nakon čega se u istom navratu obavi endoskopska intervencija (ERCP).
Prognoza. Koledokolitijaza je obilježena visokom stopom recidiva, tako da se ponovno javi kod 25 % bolesnika, bez obzira na kolecistektomiju. Glavni prediktori ponovne pojave kamenaca nakon liječenja su dilatacija koledokusa veća od 13 mm te prisutnost periampularnih divertikula. Komplikacije koje prate koledokolitijazu češće su kod bolesnika starije životne dobi.
AKUTNI KOLANGITIS
Definicija. Akutni kolangitis naziv je za akutnu bakterijsku infekciju ekstrahepatalnih i/ili intrahepatalnih žučnih puteva koja se obično sekundarno javlja - kao posljedica bilijarne opstrukcije.
Etiopatogeneza. U fiziološkim uvjetima žuč i žučni putevi ostaju sterilni što omogućava nekoliko mehanizama: 1) Oddijev sfinkter kao mehanička barijera prolazu bakterija iz dvanaesnika, 2) odgovarajući protok žuči kroz žučne puteve, 3) bakteriostatska aktivnost žučnih soli te 4) odgovarajuća produkcija zaštitnoga imunoglobulina A (IgA). Bilo koji čimbenik koji narušava skladnost ovih mehanizama može postati uzrok nastanka akutnoga kolangitisa. Bakterijska infekcija žučnih puteva može nastati na dva načina: ulazom bakterija iz dvanaesnika (gotovo uvijek) ili hematogenom diseminacijom u tijeku sepse ili bakterijemije (izuzetno rijetko). Sama bakterijska invazija žučnih puteva ne može dovesti do bakterijske infekcije ako su navedeni zaštitni mehanizmi suficijentni, odnosno bez postojeće patologije žučnih puteva. Prema tome, akutni kolangitis obično je povezan s benignom ili malignom bilijarnom opstrukcijom (koledokolitijaza, kolangiokarcinom, primarni sklerozirajući kolangitis, parazitarne infestacije) ili instrumentalnim intervencijama (endoskopska ili kirurška intervencija). Najčešće bakterije izolirane iz inficirane žuči su gram-negativne bakterije (E.coli, Klebsiella spp, Pseudomonas spp, Proteus spp, Enterococcus spp) te Streptococcus spp. Porast intraluminalnoga tlaka i vazodilatacija posredovana upalnim odgovorom pogoduje nastanku bakterijemije i sepse što kod starijih bolesnika prati visoka stopa smrtnosti.
Klinička slika. Glavne kliničke manifestacije akutnoga kolangitisa su vrućica, žutica i bol u trbuhu, predstavljaju tzv. Charcotov trijas koji se može naći kod 50 do 70 % ovih bolesnika. Bol je intenzivan, a javlja se u epigastriju ili pod desnim rebrenim lukom te je obično praćen mučninom i povraćanjem. Tjelesna temperatura umjereno je do visoko povišena, praćena tresavicama i zimicama. Žutica se manifestira žutim obojenjem kože i sluznica, tamnom mokraćom i akoličnom stolicom. U slučaju progresije bolesti dolazi do prostracije, bolesnici postaju adinamični, poremećenoga stanja svijesti uz razvoj znakova septičkoga šoka (tahikardija, hipotenzija, oligurija). Pri pregledu abdomena dominira bolna osjetljivost i napetost u području gornjega desnog kvadranta, a u rjeđim situacijama moguća je i palpacija uvećanoga žučnog mjehura (kod opstrukcija koledokusa distalno od utoka duktusa cistikusa).
Dijagnoza akutnoga kolangitisa postavlja se na temelju kliničke slike, laboratorijskih nalaza i slikovnih dijagnostičkih metoda (prvenstveno ultrazvuka). Prema smjernicama iz Tokyja od 2006. godine dijagnoza akutnoga kolangitisa postavlja se na temelju prisutnosti sva tri elementa Charcotova trijasa ili dva elementa Charcotova trijasa uz jedan ili više sljedećih elemenata: povišeni upalni parametri, povišeni jetreni enzimi te ultrazvučni nalaz dilatacije žučnih vodova.
Laboratorijski nalazi. U laboratorijskim nalazima kod ovih bolesnika nalazimo povišene pokazatelje upale (leukocitoza, neutrofilija, povišeni C-reaktivni protein i proklacitonin), povišene kolestatske pokazatelje (bilirubin, alkalna fosfatza, GGT) te pokazatelje hepatocelularnoga oštećenja (AST, ALT). Kod bilijarne opstrukcije koja traje kroz nekoliko dana mogu se naći i povišene amilaze i lipaze te produljeno protrombinsko vrijeme (PV) kao odraz malapsorpcije vitamina K.
Ultrazvuk. Ultrazvučni nalaz uključuje sve karakteristike bilijarne opstrukcije opisane u dijagnostici koledokolitijaze uz zadebljanje stijenke žučnih vodova te nalaz staničnoga detritusa u većim vodovima koji se prikazuje kao intraluminalno ehogeniji sadržaj.
Ostale dijagnostičke metode. Kod svih bolesnika s akutnim kolangitisom i dokazanim bilijarnim kamencima ili visokom suspekcijom na njih indicirana je endoskopska retrogradna kolangiopankreatografija (ERCP) s obzirom na njezine terapijske reperkusije. Kod nejasnih se bolesnika dijagnostička obrada može proširiti magnetnom kolangiografijom, kompjuteriziranom tomografijom ili endoskopskim ultrazvukom.
Liječenje akutnoga kolangitisa sastoji se od konzervativnih i interventnih metoda. Osnovu liječenja čini primjena antibiotika te endoskopska bilijarna drenaža koja se mora učiniti u prvih 24 do 48 sati od prijema u bolnicu.
Konzervativno liječenje uključuje simptomatske mjere te parenteralno antibiotsko liječenje. Simptomatske mjere podrazumijevaju odgovarajuću volumnu nadoknadu te primjenu spazmoanalgetika uz izbjegavanje morfija zbog mogućega spazma Oddijeva sfinktera. Za blago do umjereno teški akutni kolangitis preporuča se intravenska primjena ciprofloksacina u dozi od 2 x 400 mg/dan uz metronidazol u dozi od 3 x 500 mg/dan ili se kao alternativa preporuča primjena ampiclin-sulbactam u dozi od 4 x 3 gr/dan. Kod bolesnika s teškim oblikom akutnoga kolangitisa preporuča se primjena meropenema (1 gram svakih osam sati) ili piperacilin-tazobaktama (4,5 grama svakih šest do osam sati). Aminoglikozidi se mogu dodati u liječenje kada se radi o septičkom šoku, ali samo u periodu od nekoliko dana, zbog izražene nefrotoksičnosti (npr. gentamicin 5 mg/kg svaka 24 sata kroz tri do četiri dana). Parenteralna primjena lijeka preporuča se kroz najmanje deset do četrnaest dana, a po stabilizaciji stanja i padu upalnih parametara oni se mogu zamijeniti peroralnim preparatima.
Interventno liječenje. Endoskopska dekompresija žučnih vodova (sfinkterotomija ili balonska dilatacija Oddijeva sfinktera uz evakuaciju sadržaja iz žučnih puteva) indicirana je kod svih bolesnika sa znacima septičkoga šoka unutar 12 sati od prijema u bolnicu, ili ako ne dođe do kliničkoga poboljšanja, nakon 24 sata od započetoga konzervativnog liječenja. U slučaju nemogućnosti izvođenja ERCP-a ili njegovoga neuspjeha, indicirana je perkutana bilijarna drenaža. Po smirivanju upale i kliničkoga stanja preporuča se svim bolesnicima napraviti elektivnu kolecistektomiju.
Prognoza. Mortalitet od akutnoga kolangitisa izravno je povezan sa starijom životnom dobi bolesnika i postojećim komorbiditetima, izraženom hiperbilirubinemijom i produljenim protrombinskim vremenom, kao i neuspjelim interventnim zahvatom.
REKURENTNI PIOGENI KOLANGITIS
Rekurentni piogeni kolangitis (ili orijentalni kolangiohepatitis) bolest je koja se tipično javlja u istočnoj i jugoistočnoj Aziji, a obilježena je učestalim epizodama akutnoga kolangitisa koji nastaje kao posljedica parazitarne opstrukcije žučnih vodova s posljedičnom bilijarnom stazom i superponiranom infekcijom. Bolest započinje infestacijom žučnih vodova parazitima Ascaris lumbricoides ili Clonorchis sinensis koji dovode do bilijarne opstrukcije. Posljedično opstrukciji dolazi do bilijarne staze i dilatacije žučnih vodova što stvara predispoziciju za naseljavanje gram-negativnih bakterija iz crijeva što dovodi do nastanka akutnoga kolangitisa. Posljedično učestalim bakterijskim infekcijama dolazi do stvaranja smeđih pigmentnih kamenaca što dodatno pogoršava opstrukciju i drenažu žuči. Kliničkom slikom dominiraju recidivi akutnoga kolangitisa koji se mogu komplicirati sepsom, kao i lokalnim komplikacijama (perforacija, fistulizacija) ili razvojem jetrenih apscesa. Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza i slikovnih metoda kako je to opisano uz epidemiološki podatak o boravku u navedenom zemljopisnom području i serološku dijagnostiku na navedene parazite. Liječenje se sastoji od primjene antibiotika, bilijarne drenaže te eventualno kirurškoga liječenja ako su razvijene lokalne komplikacije (perforacija, fistule, jetreni apsecs).
PRIMARNI SKLEROZIRAJUĆI KOLANGITIS
Definicija. Primarni sklerozirajući kolangitis predstavlja kroničnu autoimunu bolest karakteriziranu razvojem sklerozirajuće upale koja segmentalno zahvaća intra- i ekstrahepatalne žučne vodove dovodeći do razvoja striktura i posljedične bilijarne opstrukcije (kolestaze).
Epidemiologija. Prevalencija primarnoga sklerozirajućeg kolangitisa u zapadnim zemljama procjenjuje se na oko 0,5 do 8,5 oboljelih na 100 000 stanovnika. Češće se javlja kod muškaraca s omjerom od 2:1 u odnosu na žene i to najčešće između drugoga i petog desetljeća života, iako je pojavnost zabilježena i kod djece i staraca. Kod dvije trećine bolesnika zajedno s primarnim sklerozirajućim kolangitisom nalazimo i idiopatsku crijevnu upalnu bolest (obično ulcerozni kolitis, rjeđe Crohnovu bolest), što sugerira na njihovu etiopatogenetsku povezanost.
Etiopatogeneza. Iako se točan uzrok i mehanizam razvoja bolesti nisu poznati, smatra se da primarni sklerozirajući kolangitis nastaje kao rezultat autoimunoga oštećenja žučnih puteva u genetski predisponiranih osoba kao odgovor na neki, za sada nepoznat, antigen. Na genetsku podlogu bolesti ukazuje uska povezanost s određenim HLA haplotipovima (HLA-B8, HLA-DR3, HLA-DR4), kao i češća pojavnost bolesti među bližim srodnicima, dok na autoimunu podlogu bolesti ukazuje prisutnost određenih autoantijela kao što su antineutrofilna citoplazmatska protutijela (pANCA) koja se nađu kod oko 80 do 90 % oboljelih, hipergamaglobulinemija (obično su povišeni IgG, rjeđe IgM imunoglobulini), kao i češća pojavnost drugih autoimunih oboljenja. Upalni proces segmentalno zahvaća intra- i ekstrahepatične žučne vodove, a karakterizira ga zadebljanje stijenke, infiltracija mononuklearima (limfociti, monociti) te razvoj fibroze koja u konačnici dovodi do suženja lumena žučnih vodova i razvoj striktura. Posljedično strikturama dolazi do otežane drenaže žuči i razvoja kolestaze koja stvara sklonost nastanku kamenaca i infekcija kao i razvoju hepatalnoga oštećenja - bilijarna ciroza (svaka kolestaza koja traje dulje od 30 dana dovodi do značajnoga oštećenja hepatocita i može u konačnici rezultirati razvojem ciroze jetre). Osim toga, kronična upala i oštećenje nose i povećan rizik od razvoja kolangiokarcinoma.
Klinička slika. Bolest karakterizira dugi asimptomatski tijek te postupni razvoj općih simptoma kao što su umor, malaksalost te gubitak na tjelesnoj težini. Prvi jasniji znak bolesti je pojava žutice koja je najprije intermitetnoga karaktera, dok kasnije u tijeku bolesti postaje permanentna i progresivna. Žuticu prate klasični znakovi kao što su pojačan svrbež kože (pruritus), tamna mokraća i akolična stolica. Velik dio bolesnika može navoditi nelagodu i bol pod desnim rebrenim lukom. Uslijed kolestaze razvija se i malapsorpcija masti i vitamina topljivih u mastima zbog čega bolesnici imaju steatoreje, razvijaju osteoporozu (manjak vitamina D), sklonost krvarenju (manjak vitamina K) i sl. U kliničkom tijeku moguć je i razvoj kolelitijaze i kolecisitisa, kao i koledokolitijaze i kolangitisa, što prati odgovarajuća klinička slika. U konačnici dolazi do razvoja bilijarne ciroze praćene klasičnim kliničkim znacima (opisano u dijelu ciroze jetre).
Dijagnoza primarnoga sklerozirajućeg kolangitisa temelji se na kliničkoj slici, laboratorijskim nalazima te slikovnim metodama koje danas predstavljaju zlatni standard za potvrdu dijagnoze. Inicijalna dijagnostička obrada istovjetna je kao i kod drugih bolesti žučnih puteva, a kasnije se proširuje kako bi se bolest u konačnici mogla i potvrditi.
Inicijalna dijagnostička obrada podrazumijeva osnovnu laboratorijsku obradu i ultrazvuk jetre i bilijarnoga sustava. Laboratorijski nalazi ovise o stadiju bolesti, a klasično se bilježe povišene vrijednosti kolestatskih markera i pokazatelja hepatocelularnoga oštećenja, a kod superponirane upale nalazimo i povišene vrijednosti leukocita i C-reaktivnoga proteina. Kod većine bolesnika može se naći i produljeno protrombinsko vrijeme, najprije kao rezultat malapsorpcije vitamina K, a kasnije uslijed oštećenja sintetske funkcije jetre. Ultrazvučni nalaz ukazuje na varijacije u promjeru žučnih vodova s nepravilnim dilatacijama i stenozama, dok je jetreni parenhim grube i hiperehogene teksture s proširenim i fragmentiranim portalnim prostorima. Navedeni ultrazvučni nalaz, osobito kod bolesnika koji imaju anamnestički podatak o idiopatskoj crijevnoj upalnoj bolesti ili nekoj drugoj autoimunoj bolesti, ukazuje na primarni sklerozirajući kolangitis.
Dijagnostička potvrda bolesti. Kod bolesnika sa sumnjom na ovu bolest dijagnostička obrada mora se proširiti specifičnim laboratorijskim pretragama i magnetnom kolangiografijom (MRCP). Iako nisu specifični za primarni sklerozirajući kolangitis, nalaz autoantitijela kao što su pANCA, ANA i anti-SMA, kao i nalaz povišenih vrijednosti IgG ili IgM imunoglobulina, podupiru dijagnozu ove bolesti. MRCP danas predstavlja zlatni standard u postavljanju dijagnoze primarnoga sklerozirajućeg kolangitsa, a omogućava detaljan prikaz intrahepatalnih i ekstrahepatalnih žučnih vodova koji imaju karakterističnu sliku „poput krunice“ koju daju naizmjenična segmentalna suženja i proširenja. ERCP i biopsija jetre rjeđe se koriste kako bi se potvrdila dijagnoza primarnoga sklerozirajućeg kolangitisa i rezervirana je samo kod nejasnih nalaza MRCP-a. U 10 do 15 % slučajeva bolest je ograničena na male intrahepatalne žučne vodove te je kod njih nalaz MRCP-a i ERCP-a uredan, a dijagnoza je moguća samo na temelju patohistološkoga nalaza. Ova skupina bolesnika ima načelno gledano bolju prognozu od onih kod kojih bolest zahvaća i ekstrahepatalne žučne vodove.
Diferencijalna dijagnoza. Diferencijalno dijagnostički primarni sklerozirajući kolangitis treba razgraničiti od drugih uzroka koji se mogu slično kliničko-patološki manifestirati: koledokolitijaza, akutni kolangitis, kirurške lezije žučnih vodova, tumori žučnih vodova, vaskularna oštećenja, cistične promjene žučnih vodova i sl.
Liječenje primarnoga sklerozirajućeg kolangitisa je ograničeno. Iako su istraživani mnogi lijekovi, do sada nije identificiran niti jedan koji utječe na sam tijek bolesti, odnosno smanjuje njezinu progresiju. Liječenje se sastoji od simptomatskoga liječenja do stadija bolesti kada se indicira transplantacija jetre.
Simptomatsko liječenje ponajprije se odnosi na liječenje kronične kolestaze i njezinih posljedica što se postiže primjenom ursodeoksikolne kiseline i endoskopskim intervencijama (dilatacija, stentovi). Ursodeoksikolna kiselina primjenjuje se u standardnoj dnevnoj dozi od 10 - 15 mg/kg, a dokazano smanjuje simptome kolestaze i poboljšava laboratorijske nalaze jetrene funkcije, ali ne utječe na prirodni tijek bolesti. Osim toga, primjenjuju se i druge simptomatske mjere liječenja, u prvom redu komplikacija vezanih uz malapsorpciju vitamina topljivih u mastima (prevencija i liječenje osteoporoze, primjena vitamina K i dr.).
Transplantacija jetre trenutno predstavlja jedinu potencijalnu kurabilnu opciju za ove bolesnike, a glavne su indikacije progresivna žutica, dekompenzirana faza ciroze jetre sa svojim komplikacijama, recidivirajući kolangitisi i kolangiokarcinom. Petogodišnje preživljenje nakon transplantacije jetre iznosi 80 do 90 %, ali kod 15 do 20 % bolesnika bolest se vraća i zahvaća transplantirani organ, a tada ima bržu kliničku progresiju.
Prognoza. Primarni sklerozirajući kolangitis progresivna je bolest koja u konačnici dovodi do razvoja ciroze jetre i njezinih komplikacija. Klinički tijek bolesti često je kompliciran nastakom učestalih kolangitisa i kolangiokarcinoma koji se razvijaju kod 15 % ovih bolesnika. Trenutno je jedina terapijska opcija kojom se može produljiti životni vijek ovih bolesnika transplantacija jetre. Srednje preživljenje bolesnika od postavljanja dijagnoze do smrti ili transplantacije jetre iznosi deset do petnaest godina.
PRIMARNI BILIJARNI KOLANGITIS (PRIMARNA BILIJARNA CIROZA)
Definicija. Primarni bilijarni kolangitis naziv je za bolest karakteriziranu kroničnom autoimunom destrukcijom malih i srednje velikih intrahepatalnih žučnih vodova što dovodi do njihove obliteracije, kolestaze te razvoja fibroze i ciroze jetre. Nekadašnji naziv - primarna bilijarna ciroza, danas je napušten s obzirom na činjenicu da ne razviju svi bolesnici u konačnici i cirozu jetre.
Epidemiologija. Prevalencija primarnoga bilijarnog kolangitisa različita je u različitim zemljopisnim područjima te bilježi veću učestalost na području sjeverne Europe i sjeverne Amerike, dok je rijetko susrećemo u zemljama Azije i Afrike. Bolest se znatno učestalije javlja kod žena u odnosnu na muškarce i to u omjeru 9:1, najčešće u srednjoj životnoj dobi (od drugoga do šestog desetljeća života).
Etiopatogeneza. Primarni bilijarni kolangitis predstavlja kroničnu autoimunu bolest nepoznate etiologije, a tome u prilog govori nekoliko činjenica: 1) ovi bolesnici pokazuju povećanu sklonost razvoju drugih autoimunih bolesti kao što su reumatidni artritis, Sjögrenov sindrom, kronični tireoiditis, sklerodermija, celijakija i sl.; 2) kod većine bolesnika nalazimo genetske promjene koje imaju reperkusije na funkciju imunološkoga sustava (polimorfizam gena za interleukin 2 i njegov receptor, prisutnost HLA-DR8 haplotipa) te 3) kod više od 90 % bolesnika otkriju se pozitivna antimitohondrijska antitijela (AMA) i to podvrsta AMA-M2 usmjerena na jednu komponentu enzima piruvat dehidrogenaze koju nalazimo s unutrašnje strane membrane mitohondrija. Kao mogući pokretači ovoga autoimunog procesa najčešće se spominju infektivni agensi kao što su Chlamyidia pnumoniae, Escherichia coli te Novosphingobium aromaticivorans, a kao dodatni rizični čimbenici navode se pušenje i hormonska nadomjesna terapija. Aktivirani autoimuni proces posreduje razvoj upale i destrukcije malih i srednje velikih intrahepatalnih žučnih vodova koji vode do njihove fibroze i obilteracije te posljedične kolestaze koja posreduje razvoj bilijarne ciroze. Ovaj se proces odvija polagano, kroz više godina, a kod mnogih bolesnika i ne dođe do razvoja ciroze (zbog čega je naziv primarna bilijarna ciroza 2015. godine zamijenjen nazivom primarni bilijarni kolangitis).
Patologija. Patohistološki gledano, bolest prolazi kroz nekoliko stadija. Inicijalnu patohistološku leziju čini kronični nekrotizirajući upalni proces pri čemu dominira infiltracija malih i srednje velikih intrahepatalnih žučnih vodova citotoksičnim T-limfocitima koji dovode do destrukcije žučnih vodova, a osim limfocita u ovom se stadiju mogu naći i epiteloidni granulomi te orijaške stanice. S napredovanjem procesa dolazi do dolazi ožiljkavanja, dovodeći do opstrukcije i zastoja žuči (kolestaze) koja potencira oštećenje i nekrozu hepatocita. U histološkoj slici dolazi do smanjenja dominacije upalnoga infiltrata, a u prvi plan dolazi razvoj periportalne fibroze koja se potom širi na ostali dio jetrenoga parenhima te reaktivna proliferacija malih žučnih vodova.
Klinička slika. Bolesnici s primarnim bilijarnim kolangitisom imaju dug asimptomatski period i obično se dijagnosticiraju obradom slučajno nađenoga patološkoga laboratorijskog nalaza, obično povišenih vrijednosti alkalne fosfataze. Prvi klinički znakovi su nespecifični, a uključuju umor i malaksalost, letargično raspoloženje te dnevnu pospanost. S razvojem bolesti bolesnici se mogu tužiti na nelagodu pod desnim rebrenim lukom, a potom se razvija i progresivna žutica sa svim svojim očitovanjima (žuto obojenje kože i sluznica, akolična stolica, tamni urin) i komplikacijama (malapsorpcija masti i vitamina topljivih u mastima). S vremenom se razvija ciroza jetre te se javljaju njezine kliničke manifestacije i posljedice (portalna hipertenzija, hepatosplenomegalija).
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza, slikovnih metoda te patohistološkom analizom uzorka biopata jetre. U laboratorijskim nalazima nalazimo povišene vrijednosti markera kolestaze (poglavito alkalne fosfataze i gama-glutamiltransferaze, dok je bilirubin povišen tek u kasnijim fazama bolesti) te hiperkolesterolemiju. U više od 95 % slučajeva nalazimo pozitivna antimitohondrijska antitijela (anti-AMA), a kod oko 15 % bolesnika nalazimo i pozitivna antitijela na glatku muskulaturu (anti-SMA) te antinuklearni faktor (ANA). Ukupni imunoglobulini obično nisu povišeni, ali se nađe povećana frakcija imunoglobulina M (IgM). Slikovne metode kao što su ultrazvuk trbuha, kompjuterizirana tomografija i MRCP nemaju veći dijagnostički značaj, ali bitni su u isključivanju patologije ekstrahepatalnih žučnih vodova, u kasnijim fazama omogućavaju dijagnozu ciroze jetre. Konačnu dijagnozu osiguravamo biopsijom jetre i histološkom analizom dobivenoga uzorka. Patohistološki nalaz može uključivati jedan od četiri stadija: stadij I (portalna nekrotizirajuća upala sa stvaranjem granuloma), stadij II (reaktivna proliferacija malih žučnih vodova, periportalna upala); stadij III (nestanak žučnih vodova, pojava interlobularnih fibroznih septi) te stadij IV (ciroza).
Diferencijalna dijagnoza obuhvaća široki spektar bolesti i stanja: opstrukcija bilijarnoga trakta drugim uzrocima (kamenac, striktura), kolangiokarcinom, primarni sklerozirajući kolangitis, autoimuni hepatitis, kronični hepatitis, sarkoidoza te učinak lijekova (klorpromazin).
Liječenje primarnoga bilijarnog kolangitisa sastoji se od farmakoterapijskih mjera i transplantacije jetre. Glavni lijekovi koji se primjenjuju su ursodeoksikolna i obetikolna kiselina.
Ursodeoksikolna kiselina (UDCA) čini osnovu liječenja primarnoga bilijarnog kolangitisa. Poboljšava transmembranski prijenos žučnih kiselina iz hepatocita u žučne vodove te tako djeluje citoprotektivno, a daje se u dozi od 13 do 15 mg/kg/dan u jednoj ili podijeljeno u dvije dnevne doze. Primjena ursodeoksikolne kiseline dokazano smanjuje progresiju bolesti i odgađa vrijeme transplantacije jetre. Jedna od najčešćih nuspojava je dobitak na tjelesnoj težini, a lijek se može davati i za vrijeme trudnoće.
Obetikolna kiselina. Kod bolesnika kod kojih se ne postigne zadovoljavajući odgovor na ursodeoksikolnu kiselinu, indicirana je primjena obetikolne kiseline (OCA) koja djeluje kao inhibitor sinteze žučnih kiselina u hepatocitima. Početna doza iznosi 5 mg/dan i povećava se do 10 mg/dan ako je potrebno, a učinak se prati mjerenjem vrijednosti alkalne fosfataze. Glavna nuspojava je izražen svrbež kože (pruritus).
Ostali lijekovi. Od ostalih lijekova koji se mogu uključiti u liječenje ovih bolesnika navodi se kolhicin (2x0,6 mg/dan) te metotreksat (15 mg/tjedno), iako imaju skromne terapijske rezultate te se primjenjuju kao druga linija liječenja ako se prethodno navedenim lijekovima ne postiže kliničko poboljšanje. Glukokortikoidi nisu pokazali značajan učinak na poboljšanje kliničkoga stanja, pa ni nisu uvršteni u lijekove terapijskoga izbora. Kod bolesnika s izraženim pruritusom kao posljedicom kolestaze može se primijeniti kolestiramin (3 x 4 g/dan), rifampicin (2 x 150 mg/dan) ili antagonisti serotonina kao što je ondanserton (3 x 4 mg/dan). Kod bolesnika koji ne reagiraju na medikamentoznu terapiju ponekada je indicirana plazmafereza ili ekstrakorporalna albuminska dijaliza (Prometheus, Mars).
Transplantacija jetre ostaje posljednja opcija u liječenju ovih bolesnika, a indicirana je kada se razvije ciroza jetre s komplikacijama te kada se pruritus više ne može kupirati navedenim metodama liječenja. Petogodišnje preživljenje transplantiranih bolesnika veće je od 80 %, ali se kod oko jedne trećine bolesnika prati povrat bolesti u vremenskom periodu od deset godina.
Prognoza. Primarni bilijarni kolangitis kronična je i progresivna bolest. Značajno zatajenje jetrene funkcije razvije se kod oko 25 % bolesnika u vremenskom periodu od deset godina nakon postavljanja dijagnoze. Bez transplantacije jetre prosječno preživljenje iznosi sedam do deset godina od pojave prvih simptoma bolesti.
KOLANGIOKARCINOM
Definicija. Kolangiokarcinom predstavlja maligni epitelni tumor intra- i/ili ekstrahepatalnih žučnih vodova koji čini 10 do 20 % svih hepatobilijarnih malignoma. Nešto se češće javlja kod muškaraca, obično između petoga i sedmog desetljeća života. Također, nešto češća pojavnost bilježi se u području Azije, što se pripisuje infekciji parazitom Clonorchis sinensis koja predstavlja jedan od rizičnih čimbenika za razvoj ovoga tumora.
Etiopatogeneza. Točan uzrok i mehanizam razvoja kolangiokarcinoma ostaje nepoznat, ali su poznati rizični čimbenici koji se povezuju s pojavom toga malignoma: primarni sklerozirajući kolangitis, koledokolitijaza i kronični kolangitis, bilijarni adenomi, idiopatska crijevna uplana bolest, kronični virusni hepatitisi, kongenitalne ciste koledokusa, Carolijeva bolest, kronični pankreatitis, pretilost, šećerna bolest te kronični alkoholizam i pušenje. U endemskim područjima važan etiološki čimbenik u razvoju kolangiokarcinoma čini infestacija parazitima Clonorchis sinensis i Opisthorchis viverrini.
Patologija. Kolangiokarcinom može se razviti u bilo kojem dijelu bilijarnoga stabla, a prema učestalosti, najčešće se razvija u području spoja lijevoga i desnoga hepatičnog voda u zajednički vod u području hilusa jetre (tzv. Klatskinov tumor, 50 %), dok ostatak čine tumori intrahepatalnih žučnih vodova (30 %) te distalnih ekstrahepatalnih vodova (20 %). Patohistološki gledano, najčešće se radi o adenokarcinomima. Tumor lokalno zahvaća okolne strukture, limfne i krvne žile (metastaze u regionalne i udaljenje limfne čvorove te udaljene organe), a pokazuje sklonost invadiranju i širenju putem perineuralnih ovojnica.
Klinička slika. Bolest karakterizira relativno dug asimptomatski period, a glavno kliničko očitovanje je opstruktivni ikterus. On se brže razvija kod kolangiokarcinoma ekstrahepatičnih žučnih vodova, dok se kod kolangiokarcinoma intrahepatalnih žučnih vodova javlja kada tumorski proces postane ekstenzivan i zahvati velik dio površine jetre. Bolesnici se tuže na bolnost i osjećaj težine pod desnim rebrenim lukom, imaju mučninu i povraćanje uz gubitak teka što dovodi do gubitka na tjelesnoj masi. Uz žuto obojenje kože i sluznica (tamno žuta boja) bolesnici imaju svijetlu stolicu i tamni urin, a javlja se i izraženi pruritus. Prilikom palpacije trbuha kod tumora većih dimenzija moguć je nalaz tumefakcije u području gornjega desnog kvadranta. U uznapredovaloj fazi bolesti izražena je tumorska kaheksija.
Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza te slikovnih metoda uz patohistološku/citološku potvrdu bolesti. U laboratorijskim nalazima, ovisno o uznapredovalosti bolesti možemo naći anemiju kronične bolesti, hiperbilirubinemiju te povišene vrijednosti drugih markera kolestaze i hepatocelularnoga oštećenja. Kod više od 85 % bolesnika nađu se i povišene vrijednosti CA 19-9 i CEA tumorskih markera, iako on nije niti specifičan niti osjetljiv za dijagnozu kolangiokarcinoma, a vrijednosti mogu biti povišene i kod bilijarne opstrukcije i kolestaze drugih uzroka.
Slikovne metode. Kod svih bolesnika s opstruktivnim ikterusom indicirani su ultrazvuk, kompjuterizirana tomografija (CT) ili magnetna kolagiopankreatografija (MRCP). Tipični nalaz na slikovnim metodama uključuje nalaz strikture žučnoga kanala s proksimalnom dilatacijom s ili bez vidljive tumorske mase. CT je koristan i u procjeni lokalne proširenosti tumorske mase te zahvaćanja okolnih limfnih čvorova. PET-CT služi u procjeni proširenosti bolesti i traženja udaljenih metastaza.
Endoskopske metode. Endoskopska retrogradna kolangiopankreatografija (ERCP) i endoskopskim ultrazvukom vođenja tankoiglena aspiracijska punkcija (EUS-FNA) predstavljaju osnovne dijagnostičke metode kojima se potvrđuje maligna bolest s obzirom na mogućnost uzimanja materijala za citološku obradu i dokaz prisutnosti malignih stanica, iako je ona dosta otežana s obzirom na to da su maligne stanice malobrojne i da se nalaze unutar guste vezivne strome.
Procjena proširenosti bolesti. Na temelju provedenoga dijagnostičkog postupka moguće je provesti stupnjevanje bolesti prema TNM klasifikaciji.
Kolangiokarcinom ekstrahepatalnih žučnih vodova: Tis (karcinom in situ); T1 (tumor ograničen na žučni vod); T2 (tumor probija žučni vod i zahvaća okolno masno tkivo (T2a) ili jetru (T2b)); T3 (tumor zahvaća unilateralne ogranke portalne vene ili hepatalne arterije); T4 (tumor zahvaća portalnu venu ili njezine ogranke bilateralno, zajedničku hepatalnu arteriju ili njezine ogranke bilateralno ili kontralateralne ograne portalne vene ili jetrene arterije); N1 (metastaze u jednome do tri regionalna limfna čvora); N2 (metastaze u četiri ili više regionalna limfna čvora); M1 (prisutne udaljene metastaze).
Kolangiokarcinom intrahepatalnih žučnih vodova: T1a (solitarni tumor < 5 cm bez vaskularne invazije); T1b (solitarni tumor > 5 cm bez vaskularne invazije); T2 (solitarni tumor s vaskularnom invazijom ili multipli tumori veličine do 5 cm s ili bez vaskularne invazije); T3 (tumor koji zahvaća visceralni peritoneum); T4 (tumor zahvaća okolne anatomske strukture s iznimkom žučnoga mjehura); N1 (prisutne metastaze u regionalne limfne čvorove); M1 (prisutne udaljene metastaze).
Liječenje. Kirurška resekcija tumora s bilioenteralnom anastomozom predstavlja osnovu liječenja, a moguća je tek kod oko 10 do 20 % bolesnika. Liječenje kolangiokarcimoma distalnoga koledokusa zahtijeva radikalan kirurški zahvat - Whippleovu operaciju. U nekim se centrima kao opcija liječenja kolangiokarcinoma u području hilusa jetre nameće transplantacija jetre nakon provedene neoadjuvantne kemoterapije ili kemoradioterapije. Nakon kirurškoga liječenja provodi se adjuvantna kemoterapija (kapecitabin s ili bez gemcitabina) ili kombinirana kemoradioterapija. Kod bolesnika s uznapredovalom bolesti liječenje se sastoji od palijativnih drenažnih procedura kojima se nastoji smanjiti opstruktivni ikterus (postavljanje stenta, perkutana transhepatalna bilijarna drenaža i sl.) te od primjene palijativne kemoterapije (gemcitabin pus cisplatina) s ili bez zračenja.
Prognoza bolesnika s kolangiokarcinom ukupno gledano je loša i izravno je povezana sa stupnjem proširenosti bolesti. Operabilni bolesnici koji imaju negativne kirurške margine imaju stupu petogodišnjega preživljenja od 47 % kada se radi o intrahepatalnom kolangiokarcinomu, 41 % ako se radi o kolangiokarcinomu u području hilusa jetre te 37 % ako se radi o kolangiokarcinomu distalnih ekstrahepatalnih vodova. Bolesnici s uznapredovalom bolesti unatoč provedenom liječenju rijetko prežive duže od 24 mjeseca.
BENIGNI TUMORI ŽUČNIH PUTEVA
Benigni tumori žučnih vodova izuzetno su rijeki u kliničkoj praksi. Mogu biti solitarni ili mutilpi, a najčešće se radi o adenomina i cistadenomima. Klinički su najčešće asimptomatski te se slučajno otkriju ili mogu dovesti do bilijarne opstrukcije, kolestaze i ikterusa. Dijagnoza se postavlja na osnovi slikovnih dijagnostičkih metoda. S obzirom na dosta teško razlikovanje od malignih tumora, ali i zbog svoje potencijalne maligne transformacije, preporuča se kirurški ih liječiti.
UPALNE BOLESTI GUŠTERAČE – PANKREATITISI
Pankreatitis je naziv za skup bolesti karakteriziranih upalom gušterače. Postoje dva osnovna oblika pankreatitisa, a to su akutni i kronični pankreatitis.
AKUTNI PANKREATITIS
Definicija. Akutni pankreatitis predstavlja akutnu upalu tkiva gušterače koja nastaje kao posljedica prerane aktivacije pankreasnih enzima u samoj žlijezdi (autodigestija) s visokom sklonosti nastanku kako lokalnih (nekroza, apsces, pseudociste), tako i sistemskih komplikacija (višeorgansko zatajenje). Ovisno o težini, razlikujemo dva oblika akutnoga pankreatitisa: intersticijski (80 %) i nekrotizirajući (20 %).
Epidemiologija. Akutni je pankreatitis relativno česta bolest u općoj populaciji s godišnjom incidencijom između 10 i 50 oboljelih na 100 000 stanovnika, čini 3 do 5 % uzroka hospitalizacija bolesnika s bolovima u trbuhu. Također, učestalost akutnoga pankreatitisa bilježi svoj kontinuirani rast unazad više desetaka godina, što se pripisuje ne samoj boljoj dijagnostici nego i porastu učestalosti žučnih kamenaca kod pretilih osoba što predstavlja jedan od osnovnih etioloških čimbenika u razvoju ove bolesti. Bolest se podjednako javlja kod oba spola s najvećom učestalošću u srednjoj životnoj dobi (između 25 i 75 godina).
Etiopatogeneza. Akutni pankreatitis u svojoj osnovi karakterizira prerana aktivacija pankreasnih enzima unutar same gušterače što za posljedicu ima oštećenje tkiva gušterače, kao i stvaranje različitih upalnih medijatora koji, osim što imaju lokalne učinke na tijek upalnoga procesa, ulaze i u cirkulaciju te dovode do nastanka različitih sistemskih komplikacija (SIRS, engl. systemic inflammatory response syndrome). U više od 80 % slučajeva akutni pankreatitis uzrokovan je žučnim kamencima i alkoholizmom, ali može nastati i uslijed djelovanja različitih drugih čimbenika kao što su lijekovi, toksini, metabolički i genetski čimbenici, trauma i infekcije. U 15 do 20 % slučajeva akutnoga pankreatitisa ne može se pronaći točan uzrok, pa govorimo o idiopatskome pankreatitisu. U daljnjemu tekstu raspravit ćemo osnove pojedinih etiopatogenetskih mehanizama.
Žučni kamenci. Osnovni patogenetski mehanizam kojim žučni kamenci dovode do akutnoga pankreatitisa je permanentna ili prolazna opstrukcija glavnoga pankreatičnog voda koja nastaje uslijed inklaviranja kamenca u području papile Vateri i posljedičnoga edema sluznice, što onemogućava fiziološku drenažu pankreatičnih enzima u dvanaesnik. Ta se komplikacija razvija kod oko 5 % bolesnika sa žučnim kamencima (kolelitijaza, koledokolitijaza) i to obično kod onih koji imaju kamence manje od 5 mm u promjeru ili se radi o mikrolitijazi, s obzirom na to da takvi kamenci mogu proći kroz duktus cistikus i završiti u koledokusu. Sličnim patogenetskim mehanizmom do akutnoga pankreatitisa mogu dovesti i drugi uzroci opstrukcije distalnoga koledokusa i papile Vateri, kao što su neoplazme, benigne strikture, disfunkcija Oddijeva sfinktera i sl.
Alkoholizam. Pojava akutnoga pankreatitisa najčešće je povezana s višegodišnjim konzumiranjem alkohola (dulje od pet godina), iako je rizik kod takvih pojedinaca relativno nizak i čini 2 do 5 % što ukazuje na važnost utjecaja dodatnih rizičnih čimbenika kao što su genetska sklonost, dijeta s visokim udjelom masti te pušenje. Većina bolesnika razvija pankreatitis nekoliko dana nakon prestanka uzimanja alkohola. Točan patogenetski mehanizam koji povezuje alkohol i razvoj akutnoga pankreatitisa nije u potpunosti jasan, ali se navodi direktan toksični učinak alkohola na tkivo gušterače, utjecaj alkohola na normalno lučenje pankreatičnih enzima (hiperstimulacija), oksidativni stres te edem sluznice dvanaesnika uslijed alkoholnoga duodenitisa koji pogoduje opstrukciji papile Vateri i poremećenom izlučivanju pankreatičnih enzima.
Metabolički čimbenici. S pojavom akutnoga pankreatitisa često se povezuju metabolički poremećaji, kao što su hipertrigliceridemija i hiperkalcijemija. Serumske vrijednosti triglicerida više od 5 do 10 mmol/L mogu biti povezane s pojavom akutnoga pankreatitisa te se smatra da je hipertriglicedemija treći po učestalosti uzrok akutnoga pankreatitisa. Ovaj patogenetski mehanizam nije do kraja razjašnjen, ali se objašnjava povećanom količinom hilomikrona (transportni oblik triglicerida) koji mogu dovesti do opstrukcije kapilara unutar pankreasa što rezultira ishemijom te lokalnim oštećenjem pri čemu se trigliceridi izlažu pankreasnim lipazama koje se potom aktiviraju te vode u daljnje oštećenje. Hiperkalcijemija je također jasno utvrđen rizični čimbenik razvoja akutnoga pankreatitisa, što se tumači nastankom kalcijskih depozita koji mogu posredovati aktivaciji pankreatičnih enzima i razvoju staničnoga oštećenja u pankreatičnim vodovima.
Lijekovi i toksini. Akutni pankreatitis uzrokovan lijekovima ili toksinima rijetko se susreće u kliničkoj praksi. Najčešći lijekovi koji se povezuju s nastankom akutnoga pankreatitisa su 6-merkaptopurin i azatioprin, ali i neki drugi (pentamidin, valproična kiselina, furosemid, aminosalicilati, sulfonamidi, tetraciklini, estrogeni, kortikosteroidi, metronidazol te ACE inhibitori). Od toksina koji se povezuju s nastankom akutnoga pankreatitisa, osim etilnoga alkohola, navode se i metilni alkohol, organofosfatni insekticidi te životinjski otrovi (škorpion).
Trauma. Pojava akutnoga pankreatitisa može biti povezana i s različitim traumatskim zbivanjima, bilo da se radi o tupim mehaničkim ozljedama trbuha (nagnječenje gušterače), bilo o medicinskim zahvatima kao što su endoskopska retrogradna kolangiopankreatografija ili ekstenzivne intraabdominalne operacije. Rizik od razvoja akutnoga pankreatitisa nakon ERCP-a iznosi 5 do 20 % ovisno o težini procedure i kondicijskom stanju bolesnika prije same procedure. Nastanak akutnoga pankreatitisa kod ovih bolesnika uvjetovan je složenim patogenetskim mehanizmima koji uključuju kombinaciju kemijskih, hidrostatskih, enzimskih, mehaničkih i toplinskih uvjeta.
Infekcije. Akutni pankreatitis može se pojaviti i u sklopu nekih virusnih infekcija uzrokovanih virusom mumpsa, citomegalovirusa, ehovirusa i Coxackie virusa. Parazit Ascaris lumbricoides može naseliti pankreatične vodovode i dovesti do njihove opstrukcije koja remeti normalno lučenje pankreasnih enzima. Bakterijske i gljivične infekcije gušterače izuzetno su rijetke, ako se javljaju, uglavnom su povezane sa značajnom imunokompromitiranosti.
Genetika. Neka su istraživanja pokazala da određene genetske promjene mogu biti povezane s povećanim rizikom od nastanka akutnoga (ali i kroničnog) pankreatitisa, osobito uz prisutnost drugih prethodno opisanih etioloških čimbenika. Najčešće se radi o mutacijama PRSS1, SPINK1, CFTR, CTRC i CASR gena.
Patofiziologija. Patofiziološko zbivanje zbiva se kroz tri faze u akutnome pankreatitisu. Prvu, inicijalnu fazu karakterizira aktivacija pankreatičnih enzima i inicijalno oštećenje acinarnih stanica. Osnovni je događaj u ovoj fazi pretvorba proenzima tripsinogena u aktivni enzim tripsin, nakon čega se kaskadno aktiviraju i drugi pankreasni enzimi koji dovode do staničnoga oštećenja (autodigestija). Taj ključni korak aktivacije tripsina posredovan je lizosomalnim hidrolazama, kao što je katepsin B. Druga faza razvija se kao odgovor na acinarno oštećenje, a uključuje sekvestraciju, kemotaksiju te aktivaciju leukocita (neutrofili) i makrofaga unutar oštećenoga tkiva gušterače. Aktivirani neutrofili, osim što su izvor brojnih medijatora upale (proupalni citokini), uključeni su i u aktivaciju tripsina što dovodi do progresije samoga procesa autodigestije. Također, uslijed pojačane transudacije tekućine iz dilatiranih kapilara, dolazi do pojačanoga gubitka tekućine i nastanka ascitesa („gubitak tekućine u treći prostor“), što u nekim slučajevima može rezultirati razvojem hipovolemičnoga šoka. Treća faza bolesti podrazumijeva utjecaj aktiviranih enzima (elastaza, fosfolipaza A2) i proupalnih citokina (npr. IL-17) na udaljene organe i tkiva, s obzirom na to da oni dospijevaju u cirkulaciju te tako mogu imati sistemski učinak (razvoj SIRS-a, engl. systemic inflammatory response syndrome). Posljedično SIRS-u dolazi do sistemske vazodilatacije, hipoksije i tkivne acidoze, vaskularnoga oštećenja i sl., što uvjetuje nastanak višeorganskoga zatajenja.
Kliničko-patološki oblici bolesti. Ovisno o jačini i duljini izloženosti etiološkom čimbeniku, kao i brzini prepoznavanja i početku liječenja, akutni se pankreatitis može manifestirati u dvije osnovne forme: intersticijski i nekrotizirajući pankreatitis, što se klinički temelji na radiološkom nalazu (kompjuterizirana tomografija).
Intersticijski pankreatitis otkriva se kod oko 80 % bolesnika i predstavlja klinički lakši oblik bolesti. Gušterača zadržava svoj oblik, ali se vide edem i točkasta krvarenja. Histološki se verificira intersticijski edem, manja nekrotična područja te upalna infiltracija.
Nekrotizirajući pankreatitis javlja se kod manjega broja oboljelih (20 %) i predstavlja teži klinički oblik bolesti s potencijalnim smrtnim ishodom. Tkivo gušterače je nekrotično i prožeto krvlju, a osim gušterače mogu zahvaćene i okolne strukture. U peritoneumu se nakuplja blago zamućena ili sukrvava tekućina u kojoj plivaju masne kapljice i bjelkaste mase (kalcijevi sapuni). Histološki nalazimo velika, difuzna područja steatonekroze, područja krvarenja te oblinu infiltraciju neutrofilnim leukocitima.
Klinička slika ponajprije ovisni o težini bolesti, a osnovni simptomi i znakovi akutnoga pankreatitisa su bol u trbuhu, mučnina i povraćanje. Bol je dominantno izražen u području epigastrija, nastaje naglo i pogoršava se kroz nekoliko sati te perzistira kroz nekoliko dana. Često se pojasno širi u obje strane i sijeva prema leđima te se često pogoršava prilikom ustajanja, hodanja i ležanja na leđima, zbog čega bolesnici zauzimaju prisilni sjedeći položaj nagnuti prema naprijed (tada im je osjet bola najmanji). Mučnina i povraćanje gotovo su redovni kod ovih bolesnika, a navode i gubitak teka, slabost i malaksalost. Pri fizikalnom nalazu obično se nađe palpatorna bolnost i osjetljivost u području epigastrija i lijevoga hipohondrija, a može biti izražen i lokaliziran peritonealni nadražaj (defans muskulature). S pogoršanjem bolesti dolazi i do pogoršanja općega stanja (prostracija), bol se intenzivira, bolesnici postaju febrilni, a često dolazi i do poremećaja stanja svijesti. U slučaju razvoja šoka, bolesnici postaju hipotenzivni, tahikardični i oligurični. U sklopu višeorganskoga zatajenja pri najtežim oblicima bolesti, osim značajne hemodinamske nestabilnosti, razvija se i respiratorna insuficijencija. Poremećaju respiratorne funkcije često pridonosi razvoj lijevostranoga pleuralnoga izljeva uslijed spontane drenaže abdominalne tekućine kroz ošit. Kod manjega broja oboljelih prilikom kliničkoga pregleda mogu se naći karakteristični znakovi koji upućuju na akutni pankreatitis: modrikaste pjege u lumbalnom području (Grey-Turnerov znak) i donjim udovima (Davisov znak) te periumbilikalne diskoloracije nalik hematomima i sufuzijama (Cullenov znak).
Komplikacije. Akutni pankreatitis, osobito kada se radi o teškom obliku, prati visoka stopa razvoja komplikacija koje ugrubo dijelimo u tri skupine: lokalne komplikacije, gastrointestinalne te sistemske komplikacije.
Lokalne komplikacije. Na razvoj lokalnih komplikacija ukazuje kliničko pogoršavanje stanja bolesnika unatoč prikladnom konzervativnom liječenju, a one mogu uključivati razvoj nekroze (s ili bez sekundarne infekcije), formiranje pseudocisti, disrupcije pankreatičnoga voda te paripankreatične vaskularne komplikacije.
Gastrointestinalne komplikacije koje mogu pratiti akutni pankreatitis su gastrointestinalno krvarenje (najčešće iz duodenalnih erozija), opstruktivni ikterus uslijed edema pankreasa ili same bilijarne etiologije te paralitički ili mehanički ileus (edem pankreasa može dovesti do opstrukcije dvanaesnika).
Sistemske komplikacije u akutnom pankreatitisu pogoršavaju tijek i ishod bolesti. Uključuju respiratorne komplikacije (akutni respiratorni distres sindrom, superponirana pneumonija), akutno bubrežno oštećenje, metaboličke komplikacije (hiper-/hipoglikemija, hipokalcijemija, metabolička acidoza) te hematološke komplikacije (diseminirana intravskularna koagulopatija).
Dijagnoza akutnoga pankreatitisa temelji se na anamnezi i detaljnom kliničkom pregledu, laboratorijskim nalazima te slikovnim metodama. Anamnestički podaci mogu biti ključni u identificiranju uzroka akutnoga pankreatitisa (alkoholizam, uzimanje prekomjerno masnih obroka, od ranije poznati žučni kamenci), dok fizikalni nalaz može ukazivati na težinu bolesti (palpatorna bolnost, peritonealni nadražaj, meteorizam, ascites).
Laboratorijski nalazi. Osnovni biokemijski markeri akutnoga pankreatitisa su serumske amilaze i lipaze. Kod više od 90 % bolesnika one porastu unutar 24 sata za više od tri puta iznad gornjih granica, a pad njihovih vrijednosti ovisi o težini bolesti (lipaza pokazuje polaganiji trend opadanja u odnosu na amilaze). Izuzetno se rijetko kod ovih bolesnika mogu naći uredne vrijednosti amilaza i lipaza, a obično se tada radi o blagom pankreatitisu kod kojega je uzorkovanje provedeno više dana od nastupa bolesti. Također, kod nekih bolesnika se u akutnom pankreatitisu može naći izolirano povišene amilaze ili lipaze. S obzirom na to da se oba markera izlučuju putem bubrega, oštećena funkcija bubrega može rezultirati značajno višim vrijednostima amilaza i lipaza nego što se to očekuje u odnosu na težinu bolesti, kao i lažno povišene vrijednosti kod bolesnika koji nemaju akutni pankreatitis (tada su vrijednosti umjereno povišene). Serumske lipaze i amilaze mogu biti povišene i u nekim drugim stanjima što može imati diferencijalno-dijagnostičko značenje. S obzirom na specifičnost i osjetljivost u dijagnostičkom smislu, određivanje vrijednosti lipaze smatra se superiornijim od određivanja vrijednosti amilaza. Također, učestalo praćenje njihovih vrijednosti tijekom bolesti nema značajnije reperkusije na kliničko prosuđivanje, pa se ono i ne preporučuje. Ostali laboratorijski nalazi uključuju leukocitozu i povišene vrijednosti C-reaktivnoga proteina, a ovisno o težini bolesti i razvoju komplikacija mogu se otkriti i hiperglikemija, hipokalcijemija, azotemija, hiperlaktatemija i metabolička acidoza, hipoksemija i sl. Kod bilijarnoga pankreatitisa obično su povišeni i kolestatski markeri (alkalna fosfataza, bilirubin) te jetrene transaminaze (povišenje alanin-aminotransferaze tri puta iznad gornjih vrijednosti visoko je sugestibilno za bilijarnu etiologiju akutnoga pankreatitisa), a potrebno je odrediti i vrijednosti serumskih triglicerida.
Slikovne metode. Osnovne slikovne metode u dijagnostici akutnoga pankreatitisa su ultrazvuk, kompjuterizirana tomografija i magnetna rezonanca. One imaju ključnu ulogu u procjeni morfologije gušterače i presudne su za utvrđivanje postojanja nekroze. Ultrazvuk gušterače u dijagnostici akutnoga pankreatitisa značajno je ograničen, s obzirom na to da je pretraga često limitirana konstitucijom bolesnika (pretilost) ili izraženim meteorizmom. Osnovni ultrazvučni znakovi akutnoga pankreatitisa opisani su u Tablici 4.49. Osim toga, ultrazvučni pregled bitan je i u procjeni bilijarnoga stabala i dijagnostike bilijarnih kamenaca (prikaz konkramenta, dilatacija žučnih vodova). Kompjuterizirana tomografija omogućava jasniji i točniji prikaz morfologije gušterače, osobito ako se koristi uz primjenu kontrasta (nekrotično tkivo se ne boji kontrastnim sredstvom), iako ima manju specifičnost i osjetljivost za dijagnostiku bilijarnih kamenaca. Jasna markacija nekroze najbolje se prikazuje nakon tri ili više dana od početka bolesti. Osim toga, ova pretraga ima i bitno mjesto u diferencijalnoj dijagnozi i uočavanju druge patologije koja se kliničko-laboratorijski može prezentirati slično kao i akutni pankreatitis. U slučaju detekcije lokalnih komplikacija (nekroza, pseudocista), uz kliničko-laboratorijsku sumnju na superponiranu infekciju, preporučena je CT-vođena iglena aspiracija te mikrobiološka obrada dobivenoga materijala. Magnetna rezonanca ekvivalentna je kompjuteriziranoj tomografiji u pogledu dijagnostike akutnoga pankreatitisa, no izbjegava se izlaganje zračenju (trudnice), ali samo izvođenje pretrage tehnički je kompliciranije i duže traje. Osim toga, magnetna rezonanca omogućava i izvođenje kolangiopankreatografije (MRCP) koja zauzima važno mjesto kod bolesnika kod kojih uzrok pankreatitisa nije dokazan klasičnim metodama, s obzirom na mogućnost dobroga prikazivanja bilijarne patologije (npr. mikrolitijaza), kao i abnormalnosti pankreatičnih vodova. Endoskopski ultrazvuk (EUS) izvodi se kod sumnje na prisutnost maligne lezije u području papile Vateri koji dovodi do opstrukcije i otežane drenaže pankreatičnih enzima.
|
Tablica 4.49. Ultrazvučni nalaz u akutnom pankreatitisu
|
|
Intersticijski pankreatitis
|
Nekrotizirajući pankreatitis
|
|
Difuzno ili žarišno uvećana gušterača
Pravilne konture gušterače
Homogena, hipoehogena ehostruktura
Manje peripankreatične kolekcije tekućine
|
Nejasan prikaz gušterače, nepravilne konture
Inhomogena hipo- i anehogena ehostruktura
Retro- i intraperitonealne kolekcije tekućine
Ljevostrani pleuralni izljev, paralitički ileus
|
Procjena težine bolesti. S obzirom na težinu bolesti, prema Atlanta kriterijima iz 2013. godine razlikujemo tri oblika akutnoga pankreatitisa: blagi, umjereno teški i teški. Blagi akutni pankreatitis karakterizira umjereno izražena klinička slika uz povišene serumske amilaze i lipaze, ali uz odsutnost lokalnih i sistemskih komplikacija. Umjereno teški akutni pankreatitis karakteriziraju lokalne komplikacije i/ili pojava prolazne (do 48 sati) sistemske organske disfunkcije (jedan ili više organa). Osnovna karakteristika teškoga akutnog pankreatitisa je prisutnost sistemskih komplikacija u vidu disfunkcije jednoga ili više organa koja traje više od 48 sati. Danas postoje različiti bodovni sistemi koji se koriste u procjeni i identifikaciji bolesnika kod kojih će bolest napredovati do teških oblika, a najčešće se koriste Glasgow i Ransonovi kriteriji (Tablica 4.50.).
|
Tablica 4.50. Bodovni sistemi u procjeni težine akutnoga pankreatitisa
|
|
Glasgow kriteriji
|
Ranson kriteriji
|
|
Dob > 55 godina
PaO2 < 8 kPa
Leukociti > 15 x 109/L
Albumini < 32 g/L
Serumski Ca < 2 mmol/L
Glukoza > 10 mmol/L
Urea > 16 mmol/L (nakon rehidracije)
ALT > 200 U/L
LDH > 600 U/L
|
Kriteriji kod dolaska
Dob > 55 godina
Leukociti > 16 x 109/L
Glukoza > 11 mmol/L
LDH > 600 U/L
ALT > 250 U/L
Kriteriji unutar 48 sati
Pad hematokrita > 10 %
ALT > 200 U/L
Serumski Ca < 2 mmol/L
Porast ureje > 1,8 mmol/L
Deficit baza > 4 mEq/L
PaO2 < 8 kPa
|
|
Prisutnost tri i više kriterija sugerira teži klinički tijek bolesti i razvoj teškoga pankreatititsa.
|
Osim ovih bodovnih sistema, na raspolaganju nam je i Baltazar bodovni sustav koji predstavlja indeks težine akutnoga pankreatitisa utemeljen na nalazu kompjuterizirane tomografije (Tablica 4.51.). Zbroj bodova 0 - 3 označava blagi pankreatitis, 4 - 6 srednje teški, a 7 - 10 teški pankreatitis.
|
Tablica 4.51. Baltazar bodovni sustav
|
|
Stupanj akutnoga pankreatitisa
|
Bodovi
|
Stupanj nekroze gušterače
|
Bodovi
|
|
Normalna gušterača
Fokalno ili difuzno uvećana gušterača
Upala gušterače i okolnoga tkiva
Izolirana kolekcija tekućine
Dvije ili više kolekcija tekućine, prisutnost plina
|
0
1
2
3
4
|
Nema nekroze
Nekroza jedne trećine gušterače (< 30 %)
Nekroza polovine gušterače (30 - 50 %)
Nekroza više od pola gušterače (> 50 %)
|
0
2
4
6
|
Liječenje akutnoga pankreatitisa u prvom se redu temelji na težini bolesti (blaga, umjereno teška ili teška bolest), kao i na etiologiji. Blagi i umjereno teški oblici pankreatitisa mogu se liječiti na konzervativnim odjelima, dok se teški pankreatitisi zbrinjavaju u jedinici intenzivnoga liječenja. U daljnjem su tekstu prikazani osnovni postulati liječenja akutnoga pankreatitisa.
Karencija i prehrana. Kod svih bolesnika s dijagnosticiranim akutnim pankreatitisom indicirana je karencija i bolesnici ne smiju uzimati ništa na usta. U slučaju meterozima i/ili paralitičkoga ileusa može se postaviti i nazogastrična sonda s povremenim sukciranjem gastričnoga sadržaja. Ponovno uvođenje prehrane ovisi o kliničkom stanju bolesnika. Kod bolesnika s blažim oblicima pankreatitisa karencija se prekida kada dođe do simptomatskoga olakšavanja, odnosno po smirivanju bolova, prestanku mučnine i povraćanja te uspostave normalne crijevne peristaltike (auskultacijski nalaz). Najprije se započinje s uzimanjem tekućine, a potom se postupno uvodi i prehrana utemeljena na niskom unosu masti. Kod bolesnika s težim oblicima pankreatitisa, kod kojih se ne očekuje da će početi uzimati hranu na usta unutar sedam do deset dana, preporuča se postavljanje nazojejunalne sonde i početak enteralnoga unosa hrane (hrana posebne formulacije) unutar 48 sati uz pretpostavku očuvane crijevne peristaltike. Ako se radi o bolesnicima s teškim pankreatitisom i paralitičkim ileusom, preporučeno je uvesti parenteralnu prehranu uz dodatak oligoelemenata, vitamina i glutamina.
Volumna resuscitacija. U početnoj fazi bolesti zbog gubitka tekućine u „treći prostor“ volumna nadoknada čini osnovni terapijski postupak koji osigurava hemodinamsku stabilizaciju bolesnika. U prvim satima bolesti kod blažih oblika primjenjuje se volumen od 250 do 500 ml/h, a u težim oblicima 500 do 1000 ml/h, dok se kasnije on prilagođava kliničkom stanju bolesnika (održati satnu diurezu većom od 5 ml/kg te osigurati pad hematokrita u prvih 12 do 24 sata). U volumnoj nadoknadi primjenjuju se kristaloidne otopine pri čemu se prednost daje Ringerovom laktatu u odnosu na 0,9 %-tni NaCl, s obzirom na to da su studije pokazale manju pojavnost SIRS-a kod bolesnika kojima je volumna nadoknada bila utemeljena na primjeni Ringerovoga laktata.
Simptomatska terapija. Svim je bolesnicima potrebno osigurati prikladnu analgeziju pri čemu se koriste različiti analgetici (paracetamol, tramadol, fentanil) ovisno o jačini bolova. Teoretski rizik od nastanka spazma Oddijeva sfinktera uslijed primjene morfija nije klinički potvrđen, ali većina kliničara izbjegava njegovu primjenu pri akutnom pankreatitisu. Mučninu i povraćanje kupiramo metoklopramidom ili tietilperazinom, a opravdana je i primjena spazmolitika (trospij klorid).
Antibiotska profilaksa. Današnje preporuke i smjernice ne preporučavaju profilaktičku primjenu antibiotika, osobito ne kod bolesnika s intersticijskim pankreatitisom, s obzirom na to da provedene studije nisu pokazale njihovu kliničku korist. U slučaju nekrotizirajućega pankreatitisa može se primijeniti imipenem u dozi od 4 x 500 mg intravenski ili cefuroksim u dozi od 3 x 1,5 g intravenski tijekom deset do četrnaest dana u smislu prevencije sekundarnoga inficiranja nekrotične mase. Primjena ciprofloksacina i metronidazola nije opravdana kod ovih bolesnika.
Ostala potporna terapija. Kao i kod svih bolesnika koji su dulje imobilizirani, preporuča se provođenje tromboprofilakse niskomolekularnim heparinom (npr. enoksaparin 1 x 1mg/kg s.c.) te gastroprotekcija inhibitorima protonske pumpe (npr. pantoprazol 1 x 40 mg i.v.). Hiperglikemija se korigira brzodjelujućim inzulinskim preparatima, a hipokalcijemija kalcijevim glukonatom, ali samo u slučaju prisustva tetanije. Neki bolesnici mogu imati uporne hipoglikemije koje zahtijevaju primjenu otopina glukoze. Ako se nakon odgovarajuće volumne resuscitacije ne postigne hemodinamska stabilizacija, indicirano je uključiti vazoaktivnu terapiju (noradrenalin). Hipoksemija i respiratorna insuficijencija zbrinjavaju se prema ustaljenim načelima (oksigenoterapija, mehanička ventilacija). U slučaju razvoja akutnoga bubrežnog oštećenja indicirana je i kontinuirana dijaliza (CVVHDF), a sve više se zagovara i rana primjena kontinuirane dijalize s naglaskom na konvekciju i primjenu adsorbirajućih filtera s ciljem eliminacije prupalnih citokina i aktiviranih enzima kako bi se preveniralo i ublažilo SIRS i posljedično multiorgansko zatajenje.
Specifično (etiološko) liječenje. Kod većine bolesnika s bilijarnim pankreatitisom dolazi do spontane propulzije konkramenta te se liječenje temelji na opisanim mjerama. Kod bolesnika s prisutnom koledokolitijazom, a osobito kod onih kojima rastu broj leukocita i vrijednosti transaminaza, indicirano je napraviti hitni ERCP unutar 24 do 48 sati od prijema u bolnicu. Terapijski se ERCP sastoji od sfinkterotomije i ekstrakcije konkramenata te ostaloga detritusa kako bi se osigurala odgovarajuća drenaža pankreatičnih enzima i žuči. Bolesnicima koji nemaju dokumentiranu koledokolitijazu, ali imaju kolelitijazu, osobito s kamencima manjim od 5 mm, preporuča se elektivna kolecistektomija zbog visokoga rizika od ponovne epizode pankreatitisa. Preporuča se obaviti ju tijekom iste hospitalizacije nakon smirivanja simptoma, a najkasnije četiri do šest tjedana od otpusta iz bolnice. Ako je kolecistektomija kontraindicirana kod ovih bolesnika, preporuča se endoskopska sfinkterotomija. Kod alkoholne etiologije akutnoga pankreatitisa nema specifičnoga liječenja, a glavna terapijska mjera je apstinencija od alkohola uz provođenje mjera sprečavanja razvoja alkoholnoga delirija (diazepam, vitamini B skupine). Kod bolesnika s akutnim pankreatitisom uzrokovanim teškom hipertrigliceridemijom, uz prethodno navedene mjere, liječenje se provodi primjenom antilipemika (gemfibrozil, fenofibrat, niacin), a za najteže je oblike indicirano provesti i plazmaferezu. U prevenciji i liječenju akutnoga pankreatitisa nakon ERCP-a, korisnom se pokazala rektalna primjena nesteroidnih protuupalnih lijekova (indometacin 100 mg supp. ili diklofenak 100 mg supp.) neposredno prije ili nakon samoga zahvata. Kirurško liječenje nije prvi izbor liječenja akutnoga pankreatitisa i ono je rezervirano za pojavu lokalnih komplikacija (opisano u nastavku).
Liječenje lokalnih komplikacija. Liječenje neinficirane nekroze gušterače temelji se na konzervativnom liječenju s dvojbenim preporukama o primjeni antibiotika (s jedne strane se vrši prevencija superponirane bakterijske infekcije, a s druge se povećava rizik od nastanka gljivičnih infekcija), iako se većina kliničara odlučuje za profilaktičku primjenu antibiotika. U slučaju pogoršanja kliničkoga stanja koje ukazuje na infekciju nekroze, a koja ne reagira na mjere konzervativnoga i antibiotskog liječenja, indiciran je neki od invazivnih postupaka (endoskopska drenaža, transkutana drenaža ili operativno liječenje), ovisno o centru i iskustvima kliničara. Većina pseudocista spontano se resorbira kroz šest tjedana, a samo perzistentne i simptomatske pseudociste indikacija su za liječenje (interventna ili kirurška drenaža). Ako se na MRCP-u dokaže disrupcija pankreatičnoga voda, indicirano je endoskopsko postavljanje stenta kada je izvodivo, ili se pristupa kirurškom liječenju.
Prognoza u prvome redu ovisi o težini i uzroku bolesti. Blagi i umjereno teški oblici pankreatitisa načelno imaju bolju prognozu, dok bolesnici s teškim pankreatitisom imaju smrtnost i do 20 %. Smrt od akutnoga pankreatitisa najčešće je posljedica razvoja SIRS-a i višeorganskoga zatajenja. Alkoholni pankreatitis ima sklonost recidiviranju, osobito ako se radi o bolesnicima koji istodobno uz konzumiranje alkohola i puše. U Tablici 4.52. navedene su stope smrtnosti bolesnika s akutnim pankreatitisom na temelju zbroja Ransonovih kriterija.
|
Tablica 4. 52. Smrtnost u akutnom pankreatitisu
|
|
Broj Ransonovih kriterija
|
Stopa smrtnosti
|
|
0 – 2
|
1 %
|
|
3 – 4
|
16 %
|
|
5 – 6
|
40 %
|
|
7 – 8
|
100 %
|
KRONIČNI PANKREATITIS
Definicija. Kronični pankreatitis predstavlja kroničnu upalu tkiva gušterače karakteriziranu lokaliziranom ili difuznom fibrozom koja zamjenjuje normalno tkivo gušterače i dovodi do postupnoga razvoja egzokrine i endokrine pankreasne insuficijencije. Prevalencija kroničnoga pankreatitisa u zapadnim zemljama procjenjuje se na oko 50 oboljelih na 100 000 stanovnika, iako je njegova stvarna učestalost vjerojatno i veća, s obzirom na to da je bolest kod velike većine bolesnika asimptomatska ili ima tek blage simptome, pa se ni ne dijagnosticira.
Etiopatogenza. Kronični alkoholizam glavni je uzročnik kroničnoga pankreatitisa u razvijenim zemljama (i do 80 %), iako ga mogu uzrokovati i drugi uzročnici. Generalno razlikujemo tri najznačajnija oblika bolesti: kronični alkoholni pankreatitis, kronični genetski pankreatitis te kronični autoimuni pankreatitis. U svim oblicima središnji događaj označava kronični upalni infiltrat koji dovodi do aktivacije posebnih stanica (stealtne stanice) koje produciraju kolagen čime otpočinje proces fibroze kojime se nadomješta oštećeno tkivo gušterače, pri čemu dolazi do gubitka kako endokrine tako i egzokrine funkcije. Navedeni procesi dovode i do striktura pankreatičnih vodova pri čemu se oni dilatiraju, što je jedna od glavnih patoloških značajki bolesti.
Kronični alkoholni pankreatitis. Kronična konzumacija alkohola danas je najznačajniji etiološki čimbenik razvoja kroničnoga pankreatitisa. Etilni alkohol dokazano potiče intrapankreatičnu aktivaciju tripsinogena u tripsin koji dovodi do permanentnoga oštećenja acinarnih stanica (direktan toksični učinak) praćen kasnijim razvojem fibroze i kalcifikacije. Kod ovih bolesnika česte su akutizacije bolesti, osobito nakon epizoda povećanoga unosa alkohola. Ipak, ne razvije se kod svih kroničnih alkoholičara ova bolest, što ukazuje na kompleksniji patogenetski mehanizam i uključenost drugih čimbenika, kao što je pušenje. Kombinacija kroničnoga alkoholizma i pušenja djeluje singeristično u pogledu razvoja kroničnoga pankreatitisa.
Kronični genetski pankreatitis. Kronični pankreatitis može se razviti i kao posljedica permanentne aktivacije pankreasnih enzima unutar tkiva gušterače uslijed genetskih promjena koje obuhvaćaju gene koji reguliraju njihovu aktivaciju i inaktivaciju kao što su PRSS1, SPINK-1 ili CFTR gen. Ovaj oblik kroničnoga pankreatitisa karakterizira rana pojavnost, obično prije 40. godine života.
Kronični autoimuni pankreatitis rijedak je oblik kroničnoga pankreatitisa koji se može javiti u dva oblika: tip 1 i tip 2. Tip 1 javlja se u sklopu multisistemske IgG4 bolesti, rijetkoga stanja karakteriziranoga limfoplazmocitnom infiltracijom i sklerozom različitih organa i tkiva u tijelu (žučni vodovi, peritoneum, ekstraperitonealno vezivno tkivo, bubrezi, štitna žlijezda, žlijezde slinovnice), pa se često naziva limfoplazmocitski sklerozirajući kronični pankreatitis. Bolest se obično javlja nakon petoga desetljeća života i karakteriziraju je izrazito povišene vrijednosti IgG4 u serumu. Tip 2 kroničnoga autoimunog pankreatitisa javlja se kao samostalna, izolirana bolest koju karakterizira kronična upala, destrukcija i fibroza pankreatičnih vodova (granulocitne epitelne lezije), bez povišenih vrijednosti IgG4 u serumu. Ovaj se oblik javlja u ranijoj životnoj dobi i kod oko 30 % bolesnika povezan je s pojavom upalne bolesti crijeva.
Klinička slika. Osnovno kliničko očitovanje kroničnoga pankreatitisa predstavlja periodična pojavnost bolova u gornjem abdomenu uz postupni razvoj malapsorpcijskoga sindroma, a kasnije i šećerne bolesti kao posljedice uznapredovale fibroze tkiva gušterače. Bol je najčešće epizodičan, a rjeđe može biti i konstantan, lokaliziran je pretežno u epigastriju te se može širiti u leđa. Obično je praćen osjećajem mučnine i povraćanja. Često bolesnici navode pogoršanje simptoma nakon uzimanja veće količine alkohola ili masnoga obroka. S vremenom se razvija malapsorpcijski sindrom karakteriziran steatorejom, napuhanošću, flatulencijom te gubitkom na tjelesnoj težini, a kod više od 80 % bolesnika se tijekom više desetaka godina razvije i šećerna bolest.
Komplikacije. Osim opisane endokrine (oštećena tolerancija glukoze, šećerna bolest) i egzokrine insuficijencije gušterače (malapsorpcijski sindrom), kod ovih je bolesnika česta i pojava cista i pseudocista koje svojom veličinom mogu vršiti kompresiju na okolne strukture te dovesti do opstrukcijskoga ikterusa ili rjeđe, mehaničkoga ileusa, a sklone su i sekundarnom inficiranju. Osim toga, ovi bolesnici imaju i povećan rizik od nastanka adenokarcinoma gušterače u odnosu na opću populaciju.
Dijagnoza. Postavljanje dijagnoze kroničnoga pankreatisa obično je otežano uslijed nespecifičnih kliničkih manifestacija i sporoga progresivnog tijeka bolesti, a temelji se na laboratorijskoj i radiološkoj obradi bolesnika. Ključni korak u postavljanju ove dijagnoze je postavljanje kliničke sumnje na tu bolest zbog dugotrajne anamneze epigastričnoga bola uz pojavu malapsorpcijskih znakova i/ili šećerne bolesti.
Laboratorijski nalazi. Nema specifičnih laboratorijskih nalaza koji bi ukazivali na kronični pankreatitis. Povišene vrijednosti amilaza i lipaza mogu se bilježiti u početnim fazama i fazama akutizacije bolesti, dok se s progresijom fibroze njihove vrijednosti smanjuju. Na egzokrinu insuficijenciju gušterače ukazuje smanjena razina fekalne elastaze (< 100 mcg/g stolice), smanjena razina serumskoga tripsinogena (< 20 ng/mL) te patološki sekretinski test (analiza bikarobonata u duodenalnom aspiratu nakon intravenske primjene sekretina), dok na endokrinu insuficijenciju ukazuju hiperglikemija i glikozurija.
Slikovne metode uz anamnestičke podatke i patološke laboratorijske nalaze predstavljaju osnovu za postavljanje dijagnoze kroničnoga pankreatitisa. Klasični rendgenogram abdomena može pokazati kalcifikate u području gušterače i nema veći dijagnostički značaj. Ultrazvučni nalazi koji upućuju na kronični pankreatitis uključuju različit stupanj atrofije tkiva gušterače uz nejasne i nepravilne konture, hiperehogenu ehostrukturu uz područja hipoehogenosti koja ukazuju na fibrozne areale te proširen i cistično promijenjen duktus pankreatikus, a česte su i pseudociste. Kompjuterizirana tomografija omogućava najjasniji prikaz morfoloških karakteristika kroničnoga pankreatitisa (atrofija, fibroza, kalcifikati) te se smatra metodom izbora u dijagnostičkom postupku. Iste karakteristike ima i magnetna rezonaca s proširenom mogućnošću izvođenja kolangiopankreatografije (MRCP) kojom se još jasnije može procijeniti sam duktus pankreatikus.
Etiološka dijagnostika. Svim se bolesnicima s dokazanim kroničnim pankreatitisom preporuča odrediti vrijednost IgG4 u serumu, antinuklearna antitijela te antitijela na laktoferin i ugljičnu anhidrazu II. Ako je moguće, potrebno je provesti i genetsko testiranje na PRSS1, SPINK-1 i CFTR mutacije, osobito kod mlađih bolesnika.
Liječenje kroničnoga pankreatitisa, osim djelovanja na osnovni uzrok (etiološko liječenje), usmjereno je na kupiranje bola i simptomatsko olakšanje te liječenje endokrine i egzokrine insuficijencije gušterače.
Etiološko liječenje. Svim je bolesnicima potrebno ukazati na važnost apstinencije od konzumacije alkohola i prestanka pušenja, kao i izbjegavanja masnih obroka. Kontrola bolesti bez pridržavanja ovih preporuka nije moguća. U slučaju dokazanoga autoimunoga kroničnog pankreatitisa indicirana je primjena kortikosteroida i to po shemi prednizon 40 mg/dan kroz jedan do dva mjeseca nakon čega se doza postupno smanjuje za 5 mg svaka dva do četiri tjedna i prilagođava terapijskom odgovoru. Kod bolesnika koji ne reagiraju na navedenu terapijsku shemu može se pokušati indukcija remisije primjenom rituksimaba s ili bez imunomodulatora (azatioprin) uz nastavak terapije održavanja.
Kupiranje bola i simptomatsko olakšanje kod ovih bolesnika može se postići konzervativnim ili interventnim postupcima. Medikamentno liječenje podrazumijeva primjenu klasičnih analgetika (paracetamol, tramadol) s ili bez lijekova koji potenciraju njihov analgetski učinak (triciklički antidepresivi, inhibitori ponovne pohrane serotonina). Bolesnici s dilatacijom pankreatičnoga voda većom od 5 mm dokazano imaju korist od endoskopske ili kirurške dekompresije i drenaže s ciljem ublažavanja bolova i kliničkoga poboljšanja. U pažljivo odabranih bolesnika endoskopskom je intervencijom (ERCP) moguće dilatirati strikturu pankreatičnoga voda s ili bez postavljanja stenta, što će omogućiti odgovarajuću drenažu i smirivanje bolova. Dodatno, intervencijom se mogu ukloniti i manji kamenci i kalcifikati, dok se kod većih kamenaca može provesti prijeproceduralna ekstrakorporalna litotripsija. Kod bolesnika koji nisu pogodni za endoskopsko liječenje, indicirana je kirurška intervencija kojoj je cilj uspostaviti odgovarajuću drenažu najčešće izvođenu kreiranjem anastomoze između duktusa pankreatikusa, koji se otvara longitudinalnim rezom, i izolirane vijuge jejunuma (pankreatojejunoanastomoza). U rjeđim je slučajevima indicirana parcijalna ili totalna resekcija pankreasa. Za bolesnike koji nisu pogodni niti za endoskopsko niti za kirurško liječenje, može se pokušati kupirati bol blokadom celijačnoga pleksusa EUS-om vođenom aplikacijom anestetika ili čistoga alkohola.
Liječenje egzokrine i endokrine insuficijencije gušterače postiže se primjenom pankreatičnih enzima koji dolaze u različitim kombinacijama. S obzirom na to da su pankreasni enzimi u svoj osnovi proteini, i stoga podložni razgradnji u želucu, danas se najčešće koriste u obliku obloženih acidorezistentnih mikrosfera unutar kapsula koje se otapaju u želucu, a potom se oslobođene mikrosfere ravnomjerno miješaju sa sadržajem želuca i bivaju potisnute u dvanaesnik gdje se ovojnica otapa uz pH > 5,5, čime se osigurava djelovanje enzima. Enzimi se dobivaju preradom svinjske gušterače. Početna doza iznosi 30 000 jedinica lipaze po obroku, a uzima se uz glavne obroke (doručak, ručak, večera). Prema potrebi se doza može povećavati do 90 000 jedinica lipaze. Osim primjene pankreatičnih enzima, preporuča se i suplementacija vitamina D zbog prevencije osteoporoze. Kod razvoja šećerne bolesti primjenjuju se standardna načela liječenja šećerne bolesti (opisano u poglavlju o dijabetologiji).
Prognoza ponajprije ovisi o uzroku kroničnoga pankreatitisa i vremenu njegova prepoznavanja. Kod većine bolesnika uglavnom se radi o kroničnoj, progresivnoj bolesti u kojoj se kroz deset do dvadeset godina razviju znakovi egzokrine i endokrine insuficijencije koji značajno smanjuju kvalitetu života.
ADENOKARCINOM GUŠTERAČE
Definicija i epidemiologija. Adenokarcinom je najčešći maligni tumor gušterače koji nastaje iz duktalnih ili acinarnih epitelnih stanica te čini više od 90 % svih tumora gušterače. Incidencija ovoga tumora u razvijenim zemljama zadnjih dvadesetak godina je konstantna i čini oko 10 do 15 oboljelih na 100 000 stanovnika. Tumor se rijetko javlja prije 40. godine života, a najčešća dobna pojavnost je u šestom i sedmom desetljeću života s nešto češćom pojavnošću kod muškaraca u odnosu na žene. Jedna od osnovnih epidemioloških karakteristika ovoga tumora je kasna dijagnostika kada je on već uznapredovao i proširen, što značajno smanjuje mogućnosti liječenja i pogoršava prognozu, zbog čega ga prati visoka stopa smrtnosti.
Etiopatogeneza. U više od 90 % slučajeva adenokarcinom se javlja kao sporadična bolest u čijem nastanku ulogu mogu imati različiti okolišni čimbenici, prehrambene navike te neke bolesti i stanja, dok se u oko 10 % slučajeva radi o nasljedno uvjetovanoj bolesti.
Okolišni čimbenici. Glavni okolišni čimbenici koji se povezuju s nastankom ovoga tumora su pušenje i kronični alkoholizam te u manjoj mjeri izloženost radijaciji (radioterapija abdominalne regije), teškim metalima (aresn, kadmij) i kloriranim ugljikovodicima. Danas se smatra da su pušenje i kronični alkoholizam odgovorni za nastanak više od 30 % adenokarcinoma gušterače. Kada se govori o alkoholu kao etiološkom čimbeniku, onda se podrazumijeva uzimanje veće količine alkoholnih pića kroz dulje vrijeme s obzirom na to da umjeren i povremen unos alkohola nisu povezani s povećanim rizikom od nastanka ovoga tumora.
Prehrambene navike. Određene prehrambene navike također su povezane s pojavnošću ovoga tumora. Prehrana karakterizirana visokim unosom masti i mesa povezana je s povećanim rizikom od razvoja adenokarcinoma gušterače, dok pojačani unos voća i povrća ima suprotan učinak (unos antioksidanasa).
Bolesti i druga stanja. S povećanim se rizikom od nastanka ovoga tumora također povezuju različite bolesti i stanja, a to su kronični pankreatitis, šećerna bolest te pretilost. Kronični pankreatitis dokazano višestruko povećava rizik od razvoja adenokarcinoma gušterače u odnosu na opću populaciju. Povezanost šećerne bolesti i pretilosti dovodi se u vezu s pojavom ovoga tumora, iako ta veza nije još u potpunosti razjašnjena. Primjena metformina u liječenju šećerne bolesti smanjuje rizik od pojavnosti ovoga tumora, dok primjena inzulina i GLP-1 agonista mogu povećavati taj rizik.
Nasljedni oblik bolesti. U 5 do 10 % slučajeva adenokarcinom gušterče javlja se kao dio nasljednoga poremećaja što se može vidjeti u nekim sindromima: nasljedni karcinom dojke (BRCA-2 mutacija), hereditarni pankreatitis (PRSS-1 mutacija), Peutz-Jeghersov sindrom (STK11/LKB1 mutacija), nasljedni atipični multipli melanom (p16/CDKN2A mutacija), sindrom ataksija-teleangiektazija (ATM mutacija) te Lynchov sindrom (MLH1, MSH2, MSH6 mutacije).
Molekularna karcinogeneza. Današnje shvaćanje razvoja i nastanka adenokarcinoma gušterače temelji se na slijedu i nakupljanju genetskih mutacija koje obuhvaćaju specifične onkogene i tumor-supresorske gene i dovode do slijeda intraepitelnih promjena koje uključuju spektar od premalignih lezija do invazivnoga karcinoma. Taj spektar započinje premalignom lezijom nazvanom pankreatična intraepitelna neoplazija (PanIN) koja ima tri stupnja (PanIN-1A i B, PanIN-2, PanIN-3), a ona potom prelazi u invazivni karcinom. Smatra se da je mutacija KRAS onkogena inicijalni događaj u tumorskoj preobrazbi normalne epitelne stanice, s obzirom na to da se ona može dokazati kod više od 90 % bolesnika s pankreatičnom intraepitelnom neoplazijom (PanIN), dok se s razvojem bolesti, tj. prelaskom u teže stupnjeve intraepitelnih promjena može detektirati sve veći broj mutacija određenih tumor-supresorskih gena kao što su CDKN2A/TP16, TP53, SMAD4, RB1 i STK11 (shema).
Patologija. Najčešća lokalizacija adenokarcinoma gušterače je u području glave (60 %), dok se rjeđe nađe u trupu (15 %) ili repu (5 %). Makromorfološki se prezentira kao siva, tvrda i scirozna masa različite veličine koja je slabo ograničena od ostatka tkiva. Ovisno o porijeklu, razlikujemo dva tipa: duktalni tip porijeklom iz epitelnih stanica duktusa te acinarni tip porijeklom iz acinarnih epitelnih stanica. Ovisno o histološkim karakteristikama (produkcija mucina, broj mitoza, atipija jezgara) razlikujemo dobro, umjereno i slabo diferencirane adenokarcinome gušterače. Invazivni karcinom karakterizira lokalno, limfogeno te hematogeno metastaziranje.
Klinička slika. Većina bolesnika ima dug asimptomatski period te je kod pojave simptoma bolest već u uznapredovalom stadiju. Glavni simptomi i znakovi karcinoma gušterače su bol, gubitak na tjelesnoj težini i opstruktivni ikterus. Bol nastaje kao posljedica tumorske infiltracije celijačnoga pleksusa i pretežno je lokalizirana u epigastriju s tendencijom širenja prema leđima. Gubitak na tjelesnoj težini i razvoj tumorske kaheksije dijelom su posljedica hipermetaboličkoga stanja uslijed rasta samoga tumora, a dijelom su posljedica malapsorpcijskoga sindroma koji se razvija zajedno s razaranjem i propadanjem tkiva gušterače. S obzirom na to da je karcinom gušterače najčešće lokaliziran u području glave, svojim rastom dovodi do bilijarne opstrukcije zbog čega bolesnici razviju ikterus praćen snažnim pruritusom. Za razliku od netumorske etiologije opstruktivnoga ikterusa, pri kojemu su koža i sluznice svijetložute boje, ove bolesnike karakterizira pojava tamne žutice (sivkasto-zelenkasta nijansa). Uz ove kliničke manifestacije bolesnici često navode i druga, nespecifična očitovanja probavnoga sustava kao što su mučnina i povraćanje, osjećaj nadutosti i rane sitosti i sl. Kod razvoja malapsorpcijskoga sindroma bolesnici se mogu žaliti na masne i proljevaste stolice. U trenu postavljanja dijagnoze više od 50 % bolesnika ima razvijenu šećernu bolest. U uznapredovalim fazama bolesti mogu se otkriti i drugi karakteristični znakovi, kao što su Trousseauov znak (migratorni tromboflebitis), Courvoisierov znak (distendirani bezbolni žučni mjehur) te hepatosplenomegalija.
Dijagnoza se postavlja na temelju anamnestičkih podataka i kliničkoga pregleda, laboratorijskih nalaza, slikovnih i endoskopskih metoda te se konačno potvrđuje histološkim nalazom.
Laboratorijski nalazi. Kod bolesnika s uznapredovalom bolesti mogu se otkriti normocitna ili mikrocitna anemija, umjereno povišene serumske amilaze i lipaze, a u slučaju opstruktivnoga ikterusa i povišeni kolestatski markeri te jetrene transaminaze (mogu biti i znak metastaza). Hiperglikemiju i glikozuriju nalazimo kod oko 10 do 20 % bolesnika. Hipoalbuminemija može biti odraz tumorske kaheksije. CA 19-9 i CEA koriste se kao tumorski biljezi za adenokarcinom gušterače, ali imaju manji dijagnostički značaj, a više se koriste u praćenju odgovora bolesnika na liječenje.
Slikovne metode imaju ključnu ulogu u postavljanju dijagnoze ovoga tumora, a njima se procjenjuje i resektabilnost tumora (Tablica 4.53.). Ultrazvuk abdomena osnovna je i ishodišna slikovna metoda kojom se, osim prikaza tumorske mase, može dobiti uvid i u stanje jetre (metastaze), žučnih kanala (opstruktivni ikterus) te regionalnih limfnih čvorova i krvnih žila. Karcinom gušterače na ultrazvuku se prikazuje kao nepravilna, pretežno hipoehogena, nejasno ograničena tvorba koja mijenja obrise gušterače. Dodatno se može prikazati prošireni duktus pankreatikus i koledokus, kompresija ili infiltracija okolnih anatomskih struktura, a kod većih umora nalazimo i inhomogene areale koji upućuju na područja nekroze ili krvarenja unutar tumora. Uredan ultrazvučni nalaz ne isključuje postojanje tumora. Kompjuterizirana tomografija (kontrastni CT) predstavlja metodu izbora u dijagnostici, ali i procjeni proširenosti karcinoma gušterače (infiltracija okolnih struktura, zahvaćenost limfnih čvorova, udaljene metastaze) te je u tome daleko superiornija od ultrazvuka. Tumorske tvorbe manje od 1 - 2 cm mogu ostati neprepoznate ovom dijagnostičkom metodom. Endoskopski ultrazvuk (EUS) komplementarna je metoda CT-u u dijagnostici karcinoma gušterače, ali poglavito ovisi o iskustvu endoskopičara. Omogućava detekciju lezija manjih od 1 - 2 cm koje mogu promaknuti na CT-u te bolju procjenu zahvaćenosti regionalnih limfnih čvorova i okolnih vaskularnih struktura, čime se poboljšava prijeoperacijska procjena resektibilnosti tumora. Negativan nalaz EUS-a s gotovo 100 %-tnom sigurnosti isključuje postojanje karcinoma gušterače. Magnentna rezonanca (MRI) nema veće prednosti pred CT-om te se koristi kao njegova alternativa, a to ponajprije ovisi o tehničkoj opremljenosti samoga centra i iskustvu radiologa. Dodatno se za procjenu morfologije duktusa pankreatikusa i koledokusa može izvesti MR kolangio-pankreatografija (MRCP). PET-CT 18-fluorodeoksiglukozom (FDG) koristi se za procjenu postojanja udaljenih metastaza, što također igra veliku ulogu u procjeni proširenosti bolesti.
Endoskopske metode. Gastroskopija i kolonoskopija indicirane su svim bolesnicima s karcinomom gušterače, ponajprije zbog procjene moguće invazije tumorske mase u želudac, dvanaesnik ili kolon. Endoskopska retrogradna kolangiopankretografija (ERCP) uz sve ostale precizne, manje neinvazivne metode danas ima ograničeno mjestu u dijagnostici karcinoma gušterače.
Histološki nalaz ključan je za potvrdu dijagnoze adenokarcinoma gušterače. Uzorak se može dobiti iglenom biopsijom transabdominalnim putem uz kontrolu ultrazvuka ili CT-a ili iglenom biopsijom transgastričnim ili trasndudenalnim pristupom uz kontrolu EUS-a (EUS-FNA). Transabdominalna iglena biopsija teoretski nosi rizik od mogućega intraperitonealnog rasapa tumorskih stanica, iako to nije jasno dokazano. Izvođenje ovih invazivnih postupaka dvojbeno je kod bolesnika kod kojih se s velikom sigurnošću može ustvrditi da se radi o karcinomu gušterače u resektibilnoj fazi na temelju slikovnih metoda i koji su svakako kandidati za operativno liječenje. Glavne indikacije za transabdominalnu iglenu biopsiju ili EUS-FNA su male lezije za koje se ne može sa sigurnošću reći da se radi o malignim promjenama te kod bolesnika s proširenom bolesti koji nisu kandidati za operativno liječenje, a potrebno je histološki verificirati bolest.
|
Tablica 4.53. Kriteriji neresektabilnosti karcinoma gušterače
|
- Lokalno proširena i metastatska bolest (zahvaćenost peripankreatičnoga tkiva i limfnih čvorova, sekundarizmi)
- Zahvaćenost više od 50 % cirkumferencije gornje mezenterične vene
- Zahvaćenost gornje mezenterične arterije, donje šuplje vene, aorte ili celijačnoga trunkusa
- Kod tumora repa zahvaćenost slezene ne znači inoperabilnost
|
Određivanje stadija bolesti. Stupnjevanje (engl. staging) karcinoma gušterače temelji se na TNM klasifikaciji: Tis (karcinom in situ); T1a (tumor ograničen na gušteraču, manji od 0,5 cm); T1b (tumor ograničen na gušteraču, 0,5 - 1 cm); T1c (tumor ograničen na gušteraču, 1 - 2 cm); T2 (tumor ograničen na gušteraču, 2 - 4 cm); T3 (tumor ograničen na gušteraču, ali veći od 4 cm; ili tumor koji se širi izvan gušterače bez obzira na veličinu, ali ne zahvaća okolne vaskularne strukture); T4 (tumor bez obzira na veličinu koji se širi izvan gušterače i zahvaća okolne vaskularne strukture; N0 (bez zahvaćenosti regionalnih limfnih čvorova); N1 (zahvaćenost do tri regionalna limfna čvora); N2 (zahvaćenost četiri ili više regionalnih limfnih čvorova); M0 (bez udaljenih metastaza); M1 (prisutne udaljene metastaze).
Liječenje ponajprije ovisi o proširenosti bolesti, odnosno mogućnosti kirurškoga liječenja (resektabilnosti) koje čini osnovu liječenja. Resektabilnost bolesti procjenjuje se opisanom dijagnostičkom obradom, a ključnu ulogu ima i intraoperativni nalaz. Ako se pri samom operativnom zahvatu utvrdi inoperabilnost tumora, preporuča se učiniti biliointestinalna drenaža kako bi se preveniralo nastanak opstruktivnoga ikterusa u kasnijim fazama bolesti.
Resektabilnu bolest u trenutku postavljanja dijagnoze ima oko 10 do 20 % bolesnika te se kod njih pristupa radikalnom kirurškom liječenju (Whippleova operacija) te se preporuča provođenje adjuvantne kemoterapije nakon perioda od jednoga do dva mjeseca kada se postigne odgovarajuće kondicijsko stanje bolesnika. Adjuvantna kemoterapija temelji se na primjeni 5-fluorouracila ili gemcitabina s ili bez kapecitabina. Istodobna kemoradioterapija kod ovih bolesnika nije se pokazala učinkovitijom od same primjene kemoterapije po pitanju produljenja preživljenja, pa se ona izbjegava zbog većega rizika od nastanka komplikacija, a također se kod ovih bolesnika ne preporuča niti gubitak vremena na neoadjuvantnu kemoterapiju, nego što ranije pristupanje kirurškom zahvatu.
Granično resektabilnu bolest u trenutku postavljanja dijagnoze ima oko 20 do 40 % bolesnika i oni su kandidati za neoadjuvantnu (prijeoperacijsku) kemoterapiju koja za cilj ima smanjenje tumorske mase kako bi bolest postala resektabilna i kako bi se mogao provesti radikalni kirurški zahvat. Kod 15 do 35 % tih bolesnika se unatoč primjeni prijeoperativne kemoterapije ne postigne željeno smanjenje tumorske mase, a kod nekih se može registrirati i daljnja progresija te oni nisu kandidati za kirurško liječenje. U neoadjuvantnoj kemoterapiji karcinoma gušterače koriste se uz prethodno navedene režime i režimi temeljeni na primjeni 5-fluorouracila ili gemcitabina s ili bez kapecitabina.
Lokalno uznapredovala i metastatska bolest (neresektabilna bolest) u trenu postavljanja dijagnoze otkrije se kod preko 60 % bolesnika i predstavlja kontraindikaciju za radikalan kirurški zahvat. Liječenju takvih bolesnika predstavlja kemoterapija utemeljena na FOLFIRINOX protokolu (folna kiselina, 5-fluorouracil, irinotekan, oksaliplatina) u kombinaciji s lokalnom radioterapijom (antidolorozan učinak kod invazije retroperiteonuma) i/ili drugim palijativnim endoskopskim ili kirurškim zahvatima kojima se nastoji osigurati odgovarajuća drenaža žuči u tanko crijevo.
Prognoza. Ukupno gledano, prognoza ovih bolesnika iznimno je loša i petogodišnje preživljenje bilježi se kod manje od 5 % bolesnika i nakon radikalnoga kirurškog zahvata. Srednje preživljenje bolesnika s resektabilnom bolesti iznosi 18 do 23 mjeseca, a u onih s lokalno uznapredovalom ili metastatskom bolesti 6 do 12 mjeseci.
CISTIČNE NEOPLAZME GUŠTERAČE
Definicija. Ciste gušterače su šupljine unutar tkiva gušterače, a razlikujemo prave i lažne ciste pankreasa. Lažne ciste (pseudociste) čine više od 80 % cista, a predstavljaju tekuću kolekciju unutar tkiva gušterače koja nema prave stijenke, a nastaje kao posljedica upale i traume gušterače. Prave ciste imaju stijenku koju čine epitelne stanice i predstavljaju prave neoplazme. Najčešće cistične neoplazme gušterače su serozni cistadenom, mucinozni cistadenom, intraduktalna papilarna mucinozna neoplazma te cistadenokarcinom.
Serozni cistadenomi sastoje se od multiplih cističnih šupljina obloženih kubičnim, glikogenom bogatim epitelnim stanicama. Obično se pojavljuju u starijoj životnoj dobi i imaju asimptomatski klinički tijek. Mogu biti različiih dimenzija, od 4 do 20 cm u promjeru. Maligna transformacija je rijetka, zbog čega je rijetko potrebna kirurška resekcija, osim u slučajevima kompresivnih simptoma koji nastaju kod većih tumora.
Mucinozni cistadenomi su cistični tumori s malignim potencijalom. Obično se radi o unilokluralnim cističnim tvorbama oblaženim kubičnim epitelnim stanicama bogatima mucinom, a pregrađene su septama. Razvijaju se gotovo isključivo kod žena i to u petom i šestom desetljeću, a tipično su lokalizirane u tijelu i repu gušterače. Ti tumori pokazuju tendenciju maligne transformacije zbog čega se preporuča kirurška resekcija.
Intraduktalna papilarna mucinozna neoplazma predstavlja cistični tumor pankreasa koji se razvija unutar glavnoga dijela ili njegovih bočnih ogranaka, a obično se pojavljuje kod muškaraca u šestom ili sedmom desteljeću života. Karakteriziraju ga cistične formacije obložene epitelnim stanicama bogatima mucinom. Klinički, tumor je spororastući, ali ima visoki maligni potencijal zbog čega se preporuča kirurška resekcija.
Cistadenokarcinom predstavlja maligni epitelni tumor koji nastaje iz cističnih formacija, a klinički se ponaša kao i ranije opisan adenokarcinom gušterače.
Klinička slika. Ciste gušterače obično su asimptomatske, osobito kada su manjih dimenzija. Veće ciste, kao i one manje smještene u glavi gušterače, mogu vršiti pritisak na duktus koledokus i izazvati opstruktivni ikterus. Velike ciste su rijetke, a prezentiraju se nespecifičnom nelagodom i bolovima u epigastriju, ranom sitosti te osjećajem punoće u gornjem trbuhu, a rijetko se mogu i plapirati tijekom kliničkoga pregleda.
Dijagnostički pristup. Osnovni izazov kod bolesnika kod kojih se nekom od slikovnih metoda (najčešće ultrazvukom) dokaže cistična formacija gušterače je diferencirati radi li se o pseudocisti, benignoj ili malignoj cističnoj formaciji. Pseudociste najčešće nastaju kao posljedica akutnoga ili kroničnoga pankreatitisa, pa negativna anamneza za te bolesti ukazuje na tumorsku podlogu. Razlikovanje pojedinih cističnih formacija moguće je na temelju slikovnih metoda (CT, MRI, EUS), kao i analize sadržaja ciste dobivene metodom EUS-FNA (povišene vrijednosti amilaza i karcinoembrionalnoga antigena ukazuju na tumorsku etiologiju, kao i citološki nalaz promijenjenih stanica).
Terapijski pristup. Uopćeni koncenzus govori da asimptomatske cistične formacije manje od 2 cm u promjeru ne treba kirurški liječiti, nego ih se dalje prati nekom od slikovnih metoda jednom godišnje tijekom pet godina. Sve simptomatske cistične formacije, kao i one veće od 2 cm, za koje se ne može sa sigurnošću reći da su benigne, potrebno je kirurški odstraniti. Opisani postupnik nije čvrsto određen kliničkim smjernicama i liječenje bolesnika temelji se na samoj kliničkoj multidisciplinarnoj procjeni (radiolog, gastroenterolog, kirurg). Cistadenokarcinomi načelno imaju nešto povoljniju prognozu od ostalih (solidnih) adenokarcinoma gušterače.
NEUROENDOKRINI TUMORI GUŠTERAČE
U neuroendokrine tumore gušterače ubrajamo sljedeće tumore: gastrinom, inzulinom, vipom, glukagonom i somatostatinom.
GASTRINOM
Gastrinom je neuroendokrini tumor koji luči hormon gastrin, najčešće je smješten u gušterači i dvanaesniku te je povezan s nastankom Zolinger-Ellisovoga sindroma čije su glavne manifestacije ulkusna bolest i dijareja. Gastrinom nalazimo kod oko 1 % bolesnika s teškim oblicima ulkusne bolesti. Početno se mislilo da gastrinomi nastaju samo u gušterači, ali napretkom dijagnostike došlo se do spoznaje da je učestalost gastrinoma nešto viša u dodenumu nego u gušterači, ali se i danas uglavnom opisuje u sklopu tumora gušterače. 90 % gastrinoma lokalizirano je u tzv. području gastrinomskoga trokuta. Tumore karakterizira spori rast, a pojava metastaza znak je malignosti tumora. Maligno je oko dvije trećine gastrinoma. Najčešća mjesta metastaziranja su regionalni limfni čvorovi i jetra. Ulkusna bolest je najčešća klinička manifestacija gastrinoma. Karakteristični nalaz uključuje višestruke ulceracije dvanaesnika s teškim ezofagitisom refrakternim na antisekretornu terapiju. Hipersekrecija želučane kiseline uzrokovana hipergastrinemijom dovodi i do proljeva uslijed učinka kiseline na crijevnu sluznicu. Također, želučana kiselina izaziva upalne promjene na sluznici tankoga crijeva, zbog čega se može razviti i malapsorpcija (nizak pH u tankome crijevu može deaktivirati pankreasne enzime zbog čega se javi masna stolica). Kod bolesnika sa sumnjom na gastrinom prvi korak u dijagnostici je određivanje serumske vrijednosti gastrina. Višestruko veće koncentracije nedvojbeno sugeriraju postojanje gastrinoma (više od 1000 pg/mL), dok se blaže povećane koncentracije (između 100 i 1000 pg/mL) nađu i u drugim stanjima koja mogu dovesti do pojačanoga lučenja gastrina (aklorhidrija, kronični atrofični gastritis, stanje iza vagotomije, terapija inhibitorima protonske pumpe). Kod sumnje na gastrinom indicirano je i određivanje vrijednosti pH želučanoga sadržaja, ali prije toga potrebno je ukinuti liječenje inhibitorima protonske pumpe na tjedan dana. Visoke vrijednosti gastrina natašte (deset puta više od normale) uz hiperklorhidriju (pH manji od 2) upućuje na Zolinger-Ellisonov sindrom. Zbog povezanosti s MEN sindromom potrebno je odrediti i kalcij, parathormon i prokalcitonin. Slikovne metode za dijagnostiku lokalizacije gastrinoma su razne: CT, MR, scintigrafija somatostatih receptora, endoskopija i endoskopski ultrazvuk. Navedenim se metodama obično mogu otkriti tumori veći od 1 cm, dok manji često ostaju neprepoznate lokalizacije. Zbog čestoga metastaziranja u kralježnicu, indiciran je i MR kralježnice u svih bolesnika. Osnovno liječenje je kirurško, a sam operacijski postupak ovisi o lokalizaciji tumorske lezije i proširenosti bolesti. Svakako se kod svih bolesnika mora provoditi terapija inhibitorima protonske pumpe. Može se primjenjivati i kemoterapija te liječenje analozima somatostatina i interferonom. Transplantacija jetre u sklopu liječenja jetrenih metastaza dolazi u obzir kao opcija, ako nema drugih ekstrahepatičkih sekundarizama. Desetogodišnje preživljenje nakon operacije ako nema jetrenih metastaza je više od 90 %, a kod prisustva jetrenih metastaza oko 16 %.
INZULINOM
Inzulinom je neuroendokrini tumor koji producira inzulin te dovodi do teških i opetovanih hipoglikemija. To su najčešći funkcionalni tumori pankreasa s incidencijom od 1 - 2 na milijun stanovnika. Obično se javljaju u petom i šestom desteljeću života, češće kod žena nego kod muškaraca. U 10 % radi se o multipilm lezijama, u oko 10 % radi se o malignim tumorima, a njih 5 do 10 % udruženi su sa sindromom multiple endokrine neoplazije (MEN-1). Glavne kliničke manifestacije inzulinoma su uporne hipoglikemije. Hipoglikemija se očituje simptomima neuroglikopenije (gubitak koncentracije, smetnje vida, poremećaj govora, koma) te simptomima adrenergičke aktivacije (tremor, palpitacije, znojenje, glavobolja). Simptomi se pogoršavaju gladovanjem ili prilikom tjelesne aktivnosti. Da bi izbjegli te simptome, oboljeli često jedu što većinom dovede do povećanja tjelesne mase. Karakteristično, kod ovih bolesnika nalazimo snižene vrijednosti glikemije (obično ispod 2,2 mmol/L) uz povišene vrijednosti inzulina (više od 6 ug/U). U pravilu se provodi 72-satni test gladovanja kada se bilježe vrijednosti inzulina i glukoze u određenim vremenskim intervalima te se očekuje pojava hipoglikemičnih simptoma. Kod 75 % bolesnika simptomi se razvijaju unutar 24 sata, u 95 % bolesnika u prvih 48 sati, a kod 100 % bolesnika unutar 72 sata. Slikovni prikaz često je težak zbog malih dimenzija tumora koji ne remete značajnije konture gušterače. Najbolje rezultate daje kombinacija CT-a i endoskopskoga ultrazvuka. Ostale su metode transabdominalni ultrazvuk, MR te intraoperativna eksploracija i intraoperativni ultrazvuk. Scintigrafija somatostatinskih receptora nema veću ulogu jer inzulinomi imaju značajno slabiju ekspresiju tih receptora u odnosu na druge neuroendokrine tumore. PET dijagnostika nije pokazala bolje rezultate u dijagnostici u odnosu na CT ili MR. Glavna metoda liječenja je kirurško odstranjenje tumora (enukelacija, resekcija gušterače). Glavni lijek za suzbijanje sekrecije inzulina je diazoksid koji djelujući na beta stanice smanjuje izlučivanje inzulina i poboljšava glikogenolizu. Glavne su nuspojave dobivanje na tjelesnoj masi, edemi, oštećenje bubrega i dlakavost. Kod refrakternih hipoglikemija mogu se primjenjivati i glukokortikoidi. S obzirom na smanjenu ekspresiju somatostatinskih receptora, analozi somatostatina imaju manji značaj u liječenju. Kod malignih inzulinoma indicirana je i sistemska kemoterapija.
VIPOM
Vipom je neuroendokrini tumor koji producira vazoaktivni intestinalni polipeptid koji dovodi do pojačane intestinalne sekrecije vode i klorida te suprimira sekreciju želučane kiseline. 90 % vipoma smješteno je u gušterači, pojavljuje se solitarno i to najčešće u tijelu ili repu. Karakterizira ih visoka stopa malignosti: 75 % vipoma je maligno, a u trenutku dijagnoze više od 50 % je metastaziralo. Hipereskrecijski sindrom uzrokovan ovim tumorom naziva se Werner-Morissonov sindrom. Glavne su mu karakteristike obilne vodenaste, proljevaste stolice, hipokalijemija te aklorhidrija. Ukupna količina vodenastih stolica biva i preko 3 L/dan, pa se nekada ovo stanje naziva i pankreasnom kolerom. Neki bolesnici imaju izražene napadaje crvenila lica i trupa. Na vipom treba pomišljati kod bolesnika s obilnim vodenastim stolicama koje ne prestaju unatoč karenciji, a praćene su dehidracijom i hipokalijemijom. Laboratorijski se potvrđuje povišena razina vazoaktivnoga intestinalnog polipeptida. S obzirom na to da su vipomi dosta veliki, CT predstavlja najbolju metodu za otkrivanje lokalizacije tumora. Liječenje kao prvu mjeru uključuje nadoknadu tekućine i kalija s obzirom na njihov veliki gubitak. Dugodjelujući oktreotid zaustavlja proljeve u većine bolesnika, a u onih kod kojih izostane uspjeh, mogu se dodati glukokortikoidi jer se njihova zajednička primjena pokazala uspješnijom. Nakon lokalizacije tumora i metaboličke stabilizacije bolesnika indicira se kirurško uklanjanje tumora. Kod metastatski uznapredovale bolesti primjenjuje se kemoterapija.
GLUKAGONOM
Glukagonom je rijedak neuroendokrini tumor koji luči glukagon. Radi se o solitarnim tumorima gušterače koji u trenutku dijagnoze budu veliki i do 6 cm. Većina tumora smještena je u glavi gušterače te ih većina u trenutku dijagnoze ima udaljene metastaze. Javljaju se obično između četvrtoga i šestog desteljeća života. Glavne manifestacije glukagonoma su dermatitis, hiperglikemija te anemija. Prvi znak je pojava nekrolitičnoga migratornog eritema, kožne lezije koja se javlja intertriginozno, najprije kao ograničeni eritem koji se širi lateralno, dok se u sredini pojavljuju bule koje pucaju stvarajući kruste koje otpadaju i tada počinje cijeljenje nakon kojeg ostaju kronične hiperpigmentacije. Te se kožne lezije javljaju nekoliko godina prije drugih simptoma. Glukagon stimulira glikeogenolizu, glukoneogenezu te inhibira sekreciju inzulina, zbog čega se javlja hiperglikemija i intolerancija glukoze. Dijagnoza se postavlja na temelju povišenih razina glukagona u krvi, a kako je tumor većih dimenzija, dobro se lokalizira CT ili MR pregledom abdomena. Primjenom oktreotida smanjuje se sekrecija iz tumora, pa se postiže simptomatska kontrola. Tumor je potrebno kirurški odstraniti. Kod metastatske bolesti primjenjuju se kemoterapeutici.
SOMATOSTATINOM
Somatostatinom je neuroendokrini tumor koji producira somatostatin, a osim u gušterači, može se naći i u tankom crijevu. Somatostatinomi smješteni u gušterači produciraju veću količinu somatostatina od intestinalnih. Klinički se bolest prezentira šećernom bolesti, bolestima žučnoga mjehura (kolelitijaza, akalkulozni kolecisitis, opstruktivni ikterus) te steatorejom. Često se ovi tumori otkriju slučajno za vrijeme operacije zbog bolesti žučnoga mjehura. Dijagnoza se potvrđuje nalazom povišenih vrijednosti somatostatina u plazmi te slikovnim prikazom tumora (CT, MR, ultrazvuk). Osnova liječenja je kirurška, a primjena oktreotida nije uvijek uspješna.
- Abbas Z., Afzal R. Life cycle and pathogenesis of hepatitis D virus: A review. World J Hepatol 2013 December 27; 5(12): 666-75.
- Aisenberg J. The specific direct oral anticoagulant reversal agents: their current status and future place in gastroenterology practice. Am J Gastroenterol Suppl. 2016 Jul;3:36–44.
- Albillos A, Zamora J, Martínez J, Arroyo D, Ahmad I, De-la-Peña J et al; Baveno Cooperation. Stratifying risk in the prevention of recurrent variceal hemorrhage: results of an individual patient meta-analysis. Hepatology. 2017 Oct;66(4): 1219–31.
- Andeweg CS, Groenewoud J, van der Wilt GJ, van Goor H, Bleichrodt RP. A Markov. A Markov decision model to guide treatment of recurrent colonic diverticulitis. Clin Gastroenterol Hepatol. 2016 Jan;14(1):87–95.
- ASGE Standards of Practice Committee, Shaukat A, Wang A, Acosta RD, Bruining DH, Chandrasekhara V, Chathadi KV et al; ASGE Standards of Practice Committee. The role of endoscopy in dyspepsia. Gastrointest Endosc. 2015 Aug; 82(2):227–32.
- Bagdasarian N, Rao K, Malani PN. Diagnosis and treatment of Clostridium difficile in adults: a systematic review. JAMA. 2015 Jan 27; 313(4):398–408.
- Banić M. Karcinoid. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 819-22.
- Banić M., Opačić M. Dijagnostičke metode u gastroenterologiji i hepatologiji. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008., str. 721-35.
- Bardou M, Quenot JP, Barkun A.. Stress-related mucosal disease in the critically ill patient. Nat Rev Gastroenterol Hepatol. 2015 Feb;12(2): 98–107.
- Bašiž Marković N, Marković R, Diminić-Lisica I, Radošević N. Gastroezofagealna bolest - bolest s mnogo lica. Acta Med Croatica. 2015;69:279-85.
- Beales I. Recent advances in the management of peptic ulcer bleeding. F1000Res. 2017 Sep 27;6:1763.
- Becq A, Rahmi G, Perrod G, Cellier C. Hemorrhagic angiodysplasia of the digestive tract: pathogenesis, diagnosis, and management. Gastrointest Endosc. 2017 Nov 86(5):792–806.
- Benedeto-Stojanov D., Nagorni A., Bjelaković G. Clasiffication and scoring systems used in diagnostics, prognosis and the treatment of proximal digestive tract bleeding. Vojnosanit Pregl 2011; 68(10): 872–77.
- Berk P. D., Korenbalt K. M. Approach to the patient with jaundice or abnormal liver test. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 983-92.
- Bilić A., Jurčić D. Sindrom iritabilnog crijeva. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 759-61.
- Bišof V, Juretić A, Stančić-Rokotov D, Rustemović N, Miletić D, Boban M i sur. Kliničke preporuke za dijagnozu, liječenje i praćenje bolesnika oboljelih od raka jednjaka i ezofagogastričnog prijelaza. Liječ Vjesn 2016;138:233–9.
- Bitton A, Buie D, Enns R, Feagan BG, Jones JL, Marshall JK et al; Canadian Association of Gastroenterology Severe Ulcerative Colitis Consensus Group. Treatment of hospitalized adult patients with severe ulcerative colitis: Toronto consensus statements. Am J Gastroenterol. 2012 Feb;107(2):179–94.
- Blanke C. D., Faigel D. O. Neoplasms of the small and large intestine. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1320-31.
- Boak A., Katalinić M., Kovarik Z. Kolinesteraze: struktura, uloga, inhibicija. Arh Hig Rada Toksikol 2011;62:175-90.
- Bonavina L, Aiolfi A, Scolari F, Bona D, Lovece A, Asti E.. Long-term outcome and quality of life after transoral stapling for Zenker diverticulum. World J Gastroenterol. 2015 Jan 28;21(4):1167–72.
- Bonkovsky HL, Kleiner DE, Gu J, Odin JA, Russo MW, Navarro VM et al ; U.S. Drug Induced Liver Injury Network Investigators. Clinical presentations and outcomes of bile duct loss caused by drugs and herbal and dietary supplements. Hepatology. 2017 Apr;65(4):1267–77.
- Bradarić N.+, Vucelić B. Hepatitis B. Medicus. 2006;15(1):121-30.
- Bralić Lang V. Hepatocelularni karcinom - novosti u dijagnostici, praćenju i liječenju te uloga liječnika obiteljske medicine. Acta Med Croatica. 2015;69:327-32.
- Bredenoord AJ. Management of belching, hiccups, and aerophagia. Clin Gastroenterol Hepatol. 2013 Jan;11(1):6–12.
- Brkić T, Grgić M. Tumori tankog i debelog crijeva. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 828-33.
- Buecher B. Colorectal adenomatous polyposis syndromes: genetic determinism, clinical presentation and recommendations for care. Bull Cancer. 2016 Feb;103(2):199–209.
- Bukmir L, Smokrović H, Diminić-Lisica I, Ljubotina, A. Nelakoholna masna bolest jetre. Acta Med Croatica. 2015;69:305-10.
- Camilleri M. Disorders of gastrointestinaln motility. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 884-9.
- Camilleri M. Novel diet, drugs, and gastric interventions for gastroparesis. Clin Gastroenterol Hepatol. 2016 Aug;14(6):1072–80.
- Carbonnel F, Colombel JF, Filippi J, Katsanos KH, Peyrin-Biroulet L, Allez M et al. Methotrexate is not superior to placebo for inducing steroid-free remission, but induces steroid-free clinical remission in a larger proportion of patients with ulcerative colitis. Gastroenterology. 2016 Feb;150(2):380–8.
- Carlson DA, Ravi K, Kahrilas PJ, Gyawali CP, Bredenoord AJ, Castell DO et al. Diagnosis of esophageal motility disorders: esophageal pressure topography vs. conventional line tracing. Am J Gastroenterol. 2015 Jul;110(7):967–77.
- Carr RM, Oranu A. Non-alcoholic fatty liver disease: Pathophysiology and management. Gastroenterol Clin North Am. 2016 Dec;45(4):639–52.
- Chalasani N. P. Alcoholic and nonalcocholic steatohepatitis. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1019-22.
- Chey WD, Leontiadis GI, Howden CW, Moss SF et al. ACG Clinical Guideline: treatment of Helicobacter pylori. Am J Gastroenterol. 2017 Feb;112(2):212–39.
- Čolić-Crljić V. Jetra u trudnoći. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 851-4.
- Čolić-Cvrlje V. Toksična i medikamentozna oštećenja jetre. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 847-50.
- Čuković-Čavka S., Brkić T. Polipi probavnog sustava. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 823-8.
- De Angelis C, Cortegoso Valdivia P, Venezia L, Bruno M, Pellicano R. Diagnosis and management of Zollinger- Ellison syndrome in 2017. Minerva Endocrinol. 2018 Jun;43(2):212-20.
- Deng Y, Misselwitz B, Dai N, Fox M. Lactose intolerance in adults: biological mechanism and dietary management. Nutrients. 2015 Sep;7(9):8020–35.
- Deterding K, Spinner CD, Schott E, Welzel TM, Gerken G, Klinker H et al. Ledipasvir plus sofosbuvir fixed-dose combination for 6 weeks in patients with acute hepatitis C virus genotype 1 monoinfection (HepNet Acute HCV IV): an openlabel, single-arm, phase 2 study. Lancet Infect Dis. 2017Feb;17 (2):215–22.
- Doorly MG, Senagore AJ. Pathogenesis and clinical and economic consequences of paralytic ileus. Surg Clin North Am. 2012 Apr; 92(2):259–72.
- Dougherty M, Runge TM, Eluri S, Dellon ES. Esophageal dilation with either bougie or balloon technique as treatment for eosinophilic esophagitis: a systematic review. Gastrointest Endosc. 2017 Oct;86(4):581–91.
- Duits LC, van der Wel MJ, Cotton CC, Phoa KN, Ten Kate FJW, Seldenrijk CA et al. Patients with Barrett’s esophagus and confirmed persistent low-grade dysplasia are at increased risk for progression to neoplasia. Gastroenterology. 2017 Apr;152(5):993–1001.
- Dulai PS, Singh S, Jiang X, Peerani F, Narula N, Chaudrey et al. The real-world effectiveness and safety of vedolizumab for moderate-severe Cro n’s disease: results from the US VICTORY consortium. Am J Gastroenterol. 2016 Aug;111(8):1147–55.
- Duvnjak M. Tumori gušterače. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 896-9.
- Duvnjak M., Rustemović N. Tumori jetre. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 874-9.
- Elmunzer BJ, Noureldin M, Morgan KA, Adams DB, Coté GA et al. The impact of cholecystectomy after endoscopic sphincterotomy for complicated gallstone disease. Am J Gastroenterol. 2017 Oct;112(10):1596–602.
- Eswaran S, Chey WD, Jackson K, Pillai S, Chey SW, Han-Markey T.. A diet low in fermentable oligo-, di-, and monosaccharides and polyols improves quality of life and reduces activity impairment in patients with irritable bowel syndrome and diarrhea. Clin Gastroenterol Hepatol. 2017 Dec;15(12):1890–9.
- European Association for the Study of the Liver (EASL). EASL clinical practice guidelines on the prevention, diagnosis and treatment of gallstones. J Hepatol. 2016 Jul;65(1):146–81.
- European Association for the Study of the Liver et al. EASL Clinical Practical Guidelines on the management of acute (fulminant) liver failure. J Hepatol. 2017 May;66(5):1047–81.
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017 Aug;67(2):370–98.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: the diagnosis and management of patients with primary biliary cholangitis. J Hepatol. 2017 Jul;67(1):145–72.
- European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2016. J Hepatol. 2017 Jan;66(1):153–94.
- European Society of Gastrointestinal Endoscopy; European Association for the Study of the Liver. Role of endoscopy in primary sclerosing cholangitis: European Society of Gastrointestinal Endoscopy (ESGE) and European Association for the Study of the Liver (EASL) clinical guideline. J Hepatol. 2017 Jun;66(6):1265–81.
- Everson G. T. hepatic failure and liver transplantation. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1031-7.
- Falk G. W., Katzka D. A. Disease of the esophagus. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 896-907.
- Filaković P. Hepatička encefalopatija. Med Vjesn 2010; 42(1-2):57-64.
- Fiore M, Maraolo AE, Gentile I, Borgia G, Leone S, Sansone P et al. Current concepts and future strategies in the antimicrobial therapy of emerging Gram-positive spontaneous bacterial peritonitis. World J Hepatol. 2017 Oct 28;9(30):1166–75.
- Fogel E. L., Sherman S. Disease of the gallbladder and bile ducts. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia; Elsevier Saunders: 2016. p. 1038-50.
- Forsmark C. E. Pancreatitis. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. , Philadelphia: Elsevier Saunders; 2016. p. 959-66.
- Garcia-Tsao G. Cirrhosis and its sequelae. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. , Philadelphia: Elsevier Saunders; 2016. p. 1023-30.
- Gerson LB, Fidler JL, Cave DR, Leighton JA. ACG clinical guideline: diagnosis and management of small bowel bleeding. Am J Gastroenterol. 2015 Sep; 110(9):1265–87.
- Gifford FJ, Morling JR, Fallowfield JA. Systematic review with meta-analysis: vasoactive drugs for the treatment of hepatorenal syndrome type 1. Aliment Pharmacol Ther. 2017 Mar;45(5):593–603.
- Grgurević I, Hrstić I, Vucelić B. Procjena težine oštećenja jetre u bolesnika s kroničnim virusnim hepatitisom. Acta Med Croatica. 2013;67:291-301.
- Guindi M., Riddell R. H. Indeterminate colitis. J Clin Pathol 2004;57:1233–44.
- Haito-Chavez Y, Inoue H, Beard KW, Draganov PV, Ujiki M, Rahden BHA et al. Comprehensive analysis of adverse events associated with per oral endoscopic myotomy in 1826 patients: an international multicenter study. Am J Gastroenterol. 2017 Aug;112(8):1267–76.
- Hauser S. C. Vascular disease of the gastointestinal tract. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 951-8.
- Herrine SK, Moayyedi P, Brown RS Jr, Falck-Ytter YT.. American Gastroenterological Association Institute technical review on initial testing and management of acute liver disease. Gastroenterology. 2017 Feb;152(3): 648–64.
- Hrstić I. Autoimune bolesti jetre. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 854-62.
- Hrstić I., Brinar M., Ostojić R. Autoimune bolesti jetre. Medicus. 2006;15(1):131-6.
- Hrstić I., Ostojić R. Transplantacija u gastroenterologiji. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 904-9.
- Inamdar S, Han D, Passi M, Sejpal DV, Trindade AJ. Rectal indomethacin is protective against post-ERCP pancreatitis in high-risk patients but not average-risk patients: a systematic review and meta-analysis. Gastrointest Endosc. 2017 Jan;85(1):67-75.
- Inamdar S, Han D, Passi M, Sejpal DV, Trindade AJ. Rectal indomethacin is protective against post-ERCP pancreatitis in high-risk patients but not average-risk patients: a systematic review and meta-analysis. Gastrointest Endosc. 2017 Jan;85(1):67-75.
- Islam RS, Patel NC, Lam-Himlin D, Nguyen CC. Gastric polyps: a review of clinical, endoscopic, and histopathologic features and management decisions. Gastroenterol Hepatol (N Y). 2013 Oct;9(10):640-51.
- Iveković H., Markoš P., Grubelić Ravlić K. Mjesto i uloga endoskopske resekcije u liječenju novotvorina probavne cijevi. Medicus .2012;21(2):197-201.
- Jairath V, Kahan BC, Gray A, Doré CJ, Mora A, James MW et al. Restrictive versus liberal blood transfusion for acute upper gastrointestinal bleeding (TRIGGER): a pragmatic, open-label, cluster randomized feasibility trial. Lancet. 2015 Jul 11;386(9989):137–44.
- Jakić-Razumović J, Rustemović N. Detekcija Helicobactera pylori u histološkim uzorcima. Medicus. 2012;21(2):231-5.
- Jay Pasricha P. Gastrointestinaln endoscopy. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 872-8.
- Jensen R. T. Pancreatic neuroendocrine tumors. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1334-8.
- Jeppesen PB, Gabe SM, Seidner DL, Lee HM, Olivier C. Factors associated with response to teduglutide in patients with short-bowel syndrome and intestinal failure. Gastroenterology. 2018 Mar;154(4):874–85.
- Jurčić D., Bilić A. Poremećaji motorike jednjaka. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 761-4.
- Kaić B, Vilibić-Čavlek T, Kurečić filipović S, Nemeth-Blažić T, Pem-Novosel I, Višekurina Vučina V i sur.. Epidemiologija virusnih hepatitisa. Acta Med Croatica. 2013;67:273-9.
- Kalauz M., Hrstić I. Metaboličke i infiltrativne bolesti jetre. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 833-40.
- Kalauz M., Škrlec I. Eozinofilne gastrointestinalne bolesti. Medicus. 2012;21(2):215-21.
- Katačić M. Indeksi aktivnosti uplanih bolesti crijeva. Acta Med Croatica. 2013;67:93-110.
- Katičić M. Ulkusna bolest. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 781-90.
- Katičić M., Filipec T., Maričić V. Ureja izdisajni test. Medicus. 2002;11(2);277-89.
- Katićić M. Gastritis i gastropatije. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 776-81.
- Kelley R. K., Venook A. P. Liver and biliary tract cancers. U: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1339-44.
- Kelly CP, Bai JC, Liu E, Leffler DA.. Advances in diagnosis and management of celiac disease. Gastroenterology. 2015 May;148(6):1175–86.
- Kelly CR, Kahn S, Kashyap P, Laine L, Rubin D, Atreja A, et al. Update on fecal microbiota transplantation 2015: indications, methodologies, mechanisms, and outlook. Gastroenterology. 2015 Jul;149(1):223–37.
- Kim H. D., Pickhardt P. Diagnostic imaging procedures in gastroenterology. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 866-71.
- Klebanoff MJ, Corey KE, Chhatwal J, Kaplan LM, Chung RT, Hur C. Bariatric surgery for nonalcoholic steatohepatitis: a clinical and cost-effectiveness analysis. Hepatology. 2017 Apr;65(4):1156–64.
- Kocman B, Jemendžić D, Jadrijević S, Filipec-Kanižaj T, Mikulić D, Poljak M. Kirurški aspekti transplntacije jetre. Medix. 2011;17(92/93):172-5.
- Kolaček S. Nasljedne bolesti gušterače. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 885-9.
- Kovacs T. O, Jensen D.M. Gastrointestinaln hemorrhage. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 879-83.
- Krajicek EJ, Hansel SL. Small intestinal bacterial overgrowth: a primary care review. Mayo Clin Proc. 2016 Dec;91(12):1828–33.
- Krznarić Ž, Kolaček S. Sindrom malapsorpcije. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 735-48.
- Kuemmerle J. F. Inflammatory and anatomic disease of the intestine, peritoneum, mesentery and omentum. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 943-51.
- Kuipers E. J., Blaser M. J. Acid peptic disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. , Philadelphia: Elsevier Saunders; 2016. p. 908-17.
- Kujundžić M. Akutni abdomen. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 817-9.
- Kujundžić M. Poremećaji crijevne cirkulacije. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 804-6.
- Kujundžić M., Babić Ž. Ostale bolesti probavnog sustava. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 806-16.
- Kwo PY, Cohen SM, Lim JK. ACG Clinical Guideline: evaluation of abnormal liver chemistries. Am J Gastroenterol. 2017 Jan;112(1):18–35.
- Laheru D. Pancreatic cancer. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1332-3.
- Lee W. M. Toxin and drug induced liver diaease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1006-10.
- Lembo AJ, Lacy BE, Zuckerman MJ, Schey R, Dove LS, Andrae DAet al. Eluxadoline for irritable bowel syndrome with diarrhea. N Engl J Med. 2016 (Jan);374(3):242–53.
- Liberal R, de Boer YS, Andrade RJ, Bouma G, Dalekos GN, Floreani A et al. Expert clinical management of autoimmune hepatitis in the real world. Aliment Pharmacol Ther. 2017 Mar;45(5): 723–32.
- Lichteinstein G. R. Inflammatory bowel disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 935-42.
- Lichtenstein G. R. ACG Clinical Guideline: Management of Crohn’s Disease in Adults. Am J Gastroenterol 2018;113:481–517.
- Lin M, Zhang F, Wang Y, Zhang B, Zhang W, Zou X et al. Liver cirrhosis caused by chronic Budd-Chiari syndrome. Medicine (Baltimore). 2017Aug;96(34):e7425.
- Lindsay J., Langmead L., Preston S. L. Gastrointestinal disease. In: Kumar P, Clark M. Kumar & Clark`s Medicine. Ninth edition. London: Elsevier; 2017. p. 357-436.
- Loffredo L, Pastori D, Farcomeni A, Violi F. Effects of anticoagulants in patients with cirrhosis and portal vein thrombosis: a systematic review and meta-analysis. Gastroenterology. 2017 Aug;153(2):480–7.
- Lv T, Li X, Zhang W, Zhao X, Ou X, Huang J. Recent advance in the molecular genetics of Wilson disease and hereditary hemochromatosis. Eur J Med Genet. 2016 Oct;59(10):532–9.
- Machicado JD, Amann ST, Anderson MA, Abberbock J, Sherman S, Conwell DL et al. Quality of life in chronic pancreatitis is determined by constant pain, disability/unemployment, current smoking, and associated co-morbidities. Am J Gastroenterol. 2017 Apr;112(4):633–42.
- Madoff R. D. Diseases of rectum and anus. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 967-75.
- Malagelada JR, Accarino A, Azpiroz F. Bloating and abdominal distension: old misconceptions and current knowledge. Am J Gastroenterol. 2017Aug;112(8):1221–31.
- Martin P. Approach to the patinet with liver disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 976-82.
- Masclee GM, Coloma PM, Kuipers EJ, Sturkenboom MC. Increased risk of microscopic colitis with use of proton pump inhibitors and non-steroidal anti-inflammatory drugs. Am J Gastroenterol. 2015 May;110(5):749–59.
- Mayer E. A. Functionaln gastrointestinal disorders. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 890-5.
- McQuaid K. R. Approach to the patinet with gastrointestinal disease. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 850-65.
- Mikolasevic I, Filipec-Kanizaj T, Jakopcic I, Majurec I, Brncic-Fischer A, Sobocan N i sur. Liver Disease During Pregnancy: A Challenging Clinical Issue. Med Sci Monit, 2018;24:4080-90.
- Mikolašević I, Bagić Ž, Milić, S, Kurpis, M, Matana A, Kukuljan M i sur. Hepatopulmonalni sindrom – često neprepoznata komplikacija u jetrenoj cirozi. Medicina fluminensis. 2010;46(2): 202-7.
- Milć S, Mikolašević I. Hepatitis C - klinička slika i komplikacije. Medicina 2007;43:118-22.
- Milivojević V, Ranković I, Stojanović M, Oluić B, Tomić D. Hepatorenalni sindrom - kompleksan entitet zahteva intebzivno lečenje. NČ urgent medic HALO 194, 2016;22(1):39-46.
- Minalyan A, Benhammou JN, Artashesyan A, Lewis MS, Pisegna JR. Autoimmune atrophic gastritis: current perspectives. Clin Exp Gastroenterol. 2017Feb;10:19–27.
- Mitchell MC, Friedman LS, McClain CJ. Medical management of severe alcoholic hepatitis: expert review from the Clinical Practice Updates Committee of the AGA Institute. Clin Gastroenterol Hepatol. 2017 Jan;15(1):5–12.
- Mohsen W, Levy MT. Hepatitis A to E: what’s new? Intern Med J. 2017 Apr;47(4):380–9.
- Mušterić G, Vrdoljak DV, Lesar M, Penavić I, Kirac I, Tometić G.. Current Surgical treatment for colorectal liver metastases. Libri Oncol. 2013;41(1-3):41 – 58.
- Nagata N, Niikura R, Sakurai T, Shimbo T, Aoki T, Moriyasu S et al. Safety and effectiveness of early colonoscopy in management of acute lower gastrointestinal bleeding on the basis of propensity score matching analysis. Clin Gastroenterol Hepatol. 2016 Apr;14(4):558–64.
- Nault JC, Couchy G, Balabaud C, Morcrette G, Caruso S, Blanc JF et al. Molecular classification of hepatocellular adenoma in clinical practice. J Hepatol. 2017 Nov;67(5):1074–83.
- Navari RM, Aapro M. Antiemetic prophylaxis for chemotherapyinduced nausea and vomiting. N Engl J Med. 2016 Apr 7;374(14):1356–67.
- O’Rourke A. Infective oesophagitis: epidemiology, cause, diagnosis and treatment options. Curr Opin Otolaryngol Head Neck Surg. 2015 Dec;23(6):459–63.
- Opačić M, Rustemović N. Bolesti bilijarnog sustava. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 879-85.
- Ostojić R, Hrstić I. Virusni hepatitisi. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 840-7.
- Ostojić R. Ciroza jetre i njene komplikacije. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 866-74.
- Ostojić R. Hepatitis C. Medicus. 2006;15(1):113-20.
- Papa B. Upalne bolesti gušterače. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 889-96.
- Patel YA, Muir AJ. Evaluation of new-onset ascites. JAMA. 2016 Jul 19; 316(3):340–1.
- Paulanić R. Gastroezofagealna refluksna bolest. Medicus. 2006;15(1):25-37.
- Paulanić R. Portalna hipertenzija. Medix. 2009;15(84/85):146-56.
- Pawlotsky J. M. Acute viral hepatitis. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 993-9.
- Pawlotsky J. M. Chronic viral and autoimmune hepatitis. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1000-5.
- Peery AF, Keku TO, Martin CF, Eluri S, Runge T, Galanko JA et al. Distribution and characteristics of colonic diverticula in a United States screening population. Clin Gastroenterol Hepatol. 2016 Jul;14(7):980–5.
- Pericleous M, Sarnowski A, Moore A, Fijten R, Zaman M. The clinical management of abdominal ascites, spontaneous bacterial peritonitis and hepatorenal syndrome: a review of current guidelines and recommendations. Eur J Gastroenterol Hepatol. 2016 Mar;28(3):e10–8.
- Pribić S., Gmajnić R., Ebling B., Ćosić V. Funkcionalni poremećaji anorektalne regije. Med Fam Croat. 2017;25(1-2):2017.
- Pulanić R. Gastroezofagealna refluksna bolest i ostale bolesti jednjaka. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 765-73.
- Pulanić R. Gastrointestinalno krvarenje. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 749-59.
- Qumseya BJ, Wani S, Desai M, Qumseya A, Bain P, Sharma P et al. Adverse events after radiofrequency ablation in patients with Barrett’s esophagus: a systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2016 Aug;14(8): 1086–95.
- Redy K. R. Bacterial, parasitic, fungal and granulomatous liver diseases. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1011-1018.
- Riddle MS, DuPont HL, Connor BA. ACG Clinical Guideline: diagnosis, treatment, and prevention of acute diarrheal infections in adults. Am J Gastroenterol. 2016 May;111(5):602–22.
- Roman S, Huot L, Zerbib F, Bruley des Varannes S, Gourcerol G, Coffin B et al. High-resolution manometry improves the diagnosis of esophageal motility disorders in patients with dysphagia: a randomized multicenter study. Am J Gastroenterol. 2016 Mar;111(3):372–80.
- Rustgi A. K. Neoplasms of the esophagus and stomach. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 1313-9.
- Schiller LR, Pardi DS, Sellin JH. Chronic diarrhea: diagnosis and management. Clin Gastroenterol Hepatol. 2017 Feb;15(2):182–93.
- Schmitd B, Yoon SS. D1 Versus D2 Lymphadenectomy for Gastric Cancer. J Surg Oncol. 2013 Mar;107(3): 259–264.
- Semard C. E. Approach to the patient with diarrhea and malabsorption. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 918-34.
- Shih DQ, Kwan LY. All Roads Lead to Rome: Update on Rome III Criteria and New Treatment Options. Gastroenterol Rep. 2007;1(2): 56–65.
- Shimomura A, Nagata N, Shimbo T, Sakurai T, Moriyasu S, Okubo H et al. New predictive model for acute gastrointestinal bleeding in patients taking oral anticoagulants: a cohort study. J Gastroenterol Hepatol. 2018 Jan;33(1):164–71.
- Stefan D, Hamilton JP. Drug-induced Liver Injury. US Gastroenterol Hepatol Rev. 2010 Jan:6;73–80.
- Subhani T. F. and all. 5’-nukleotidaza, oksidacijski stres i antioksidacijski status kod konzumenata alkohola i bolesnika s cirozom jetre. Biochemia Medica. 2009;19(3):277–86.
- Syngal S, Brand RE, Church JM, Giardiello FM, Hampel HL, Burt RW; American College of Gastroenterology. American College of Gastroenterology. ACG clinical guideline: genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015 Feb;110(2):223–62.
- Štefan L, Tepšić T, Zavidić T, Urukalo M, Tota D, Domitrović R. Lipidna peroksiadacija. Medicina 2007;43:84-93.
- Tandon P, Abraldes JG, Keough A, Bastiampillai R, Jayakumar S, Carbonneau M et al. Risk of bacterial infection in patients with cirrhosis and acute variceal hemorrhage, based on Child-Pugh class and effects of antibiotics. Clin Gastroenterol Hepatol. 2015 Jun;13(6):1189–96.
- Terrault NA, Bzowej NH, Chang KM, Hwang JP, Jonas MM, Murad MH; American Association for the Study of Liver Diseases. AASLD guidelines for treatment of chronic hepatitis B. Hepatology. 2016 Jan;63(1):261–83.
- Tremaine WJ. Diagnosis and treatment of indeterminate colitis. Gastroenterol Hepatol (N Y). 2011 Dec;7(12):826-8.
- Troskot B., Gamulin M. Tumori jednjaka. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 773-6.
- Troskot B., Gamulin M. Tumori želuca. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 794.
- Vanclooster A, van Deursen C, Jaspers R, Cassiman D, Koek G.. Proton pump inhibitors decrease phlebotomy need in HFE hemochromatosis: double-blind randomized placebo-controlled trial. Gastroenterology. 2017Sep;153(3):678–80.
- Vande Casteele N, Ferrante M, Van Assche G, Ballet V, Compernolle G, Van Steen K. Trough concentrations of infliximab guide dosing for patients with inflammatory bowel disease. Gastroenterology. 2015 Jun;148(7):1320–9.
- Vince A. i ostali. Virusni hepatitis hrvastka kosenzus konferencija 2013. Acta Med Croatica.2013;67:263-272.
- Vrca Botica M, Zelić I, Borovečki Žuti I, Botica I, Gačina A, Haralović D. Suživot s bakterijom Helicobacter pylori u obiteljskoj medicini. Acta Med Croatica, 69 (2015) 389-94.
- Vrdoljak D. Gastroezofagealna refluksna bolest (GE RB) – dijagnostika i liječenje u obiteljskoj medicini. Medix. 2012;272-6.
- Vucelić B. Alkoholna bolest jetre. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 863-6.
- Vucelić B., Čuković-Čavka S. Upalne bolesti crijeva. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 794-804.
- Wells CI, O'Grady G, Bissett IP. Acute colonic pseudo-obstruction: a systematic review of aetiology and mechanisms. World J Gastroenterol.2017 Aug 14;23(30):5634–44.
- Wilcox MH, Gerding DN, Poxton IR, Kelly C, Nathan R, Birch T et al; MODIFY I and MODIFY II Investigators. Bezlotoxumab for prevention of recurrent Clostridium difficile infection. N Engl J Med. 2017 Jan 26;376(4):305–17.
- Williet N, Boschetti G, Fovet M, Di Bernado T, Claudez P, Del Tedesco E et al. Association between low trough levels of vedolizumab during induction therapy for inflammatory bowel diseases and need for additional doses within 6 months. Clin Gastroenterol Hepatol. 2017 Nov;15(11):1750–57.
- Zajčić-Rotković V. Neuroendokrini tumori gušterače. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. str. 899-903.
- Zavidić T, Lovrinić Đ. Tranzijenta elastografija - budućnost dijagnostike oštećenja jetre ili samo pokušaj? Acta Med Croatica. 2015;69:381-8.